XENOTRANSPLANTASI SEL TESTIKULAR
IKAN GURAMI KEPADA LARVA IKAN NILA
IRMA ANDRIANI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
i
Dengan ini saya menyatakan dengan sebenar-benarnya bahwa semua pernyataan dalam disertasi saya yang berjudul :
Xenotransplantasi Sel Testikular Ikan Gurami kepada Larva Ikan Nila merupakan hasil penelitian disertasi saya sendiri dengan pembimbingan oleh komisi pembimbing terkecuali yang jelas ditunjukkan rujukannya. Disertasi ini belum pernah diajukan untuk memperoleh gelar pada program sejenis di perguruan tinggi lain. Semua data dan informasi yang digunakan telah dinyatakan secara jelas dan dapat diperiksa kebenarannya.
Bogor, Januari 2012
iii
IRMA ANDRIANI. Xenotransplantation of Giant Gourami Testicular Germ Cells into Larvae of Nile Tilapia. Under direction of ALIMUDDIN, KOMAR tilapia larvae as recipient for xenotransplantation of giant gouramy TGC into larvae of Nile tilapia. We developed TGC xenotransplantation system by some steps as follow : 1) The characterization of spermatogonia to identify optimal donor of giant gourami based on body weight using histological approach, 2) The determination of dissociation method for giant gourami testicular tissue by comparing two different composition of dissociation medium with 5 hours incubation time, 3) Optimizing the timing of intraperitoneal TGC transplantation into peritoneal cavity of 1, 3, 5 and 7 days post hatching (dph) recipient by investigating the colonization efficiency of donor cell labelled PKH 26 fluorescent membrane dye under fluorescent microscope and of molecular technique using growth hormone of giant gourami specific primer, 4 ) Analyzing the proliferation of spermatogonia colonized in recipient gonad using molecular approach, and 5) The evaluation of TGC isolated from testis of giant gourami which preserved at 4 oC using NaCl 0.7% for 6, 12, 24 and 48 hours and then transplanted into peritoneal cavity of recipient. The result showed that the donor with abundant spermatogonia stem cell and A type spermatogonia (cell diameter = 14.43–20.53 µm) were found in giant gourami with body weight ranged from 500–1000 g. The dissociation method produced high number of spermatogonia with high viability was one used medium PBS containing trypsin, DNase, CaCl2, HEPES, FBS and incubated for 3 hours. The highest colonization efficiency was observed at 3 dph recipient (61.1±34.71%) suggesting that 3 dph Nile tilapia larvae was the optimum recipient for transplantation. Intraperitoneally transplanted xenogenic spermatogonia efficiently colonized the ovary as well with sex ratio male out of female was 1:1, and possibly proliferated indicated by cell cluster forming and the increase of DNA concentration of donor in recipient testis during time interval 1 month to 2 or 3 month pt. The successful colonization of spermatogonia isolated from preserved testis were also observed with colonization efficiency not differed significantly as from non preserved testis. In conclusion : the testis of giant gouramy was composed of cells that had competency as donor for xenotransplantation using Nile tilapia larvae as recipient.
v
Ikan Nila. Dibimbing oleh ALIMUDDIN, KOMAR SUMANTADINATA, dan ITA DJUWITA.
Lambatnya pertumbuhan ikan gurami (Osphronemus goramy) tidak hanya berdampak pada lamanya ikan gurami mencapai ukuran konsumsi tetapi juga pada lamanya ikan gurami mencapai ukuran induk (matang kelamin) sehingga ketersediaan induk untuk menghasilkan benih ikan gurami menjadi terbatas. Keterbatasan induk dan benih tentu saja menjadi kendala bagi kegiatan peningkatan produksi ikan gurami.
Saat ini berkembang satu sistem pembenihan untuk produksi ikan yang lama matang kelamin yaitu benih diproduksi oleh induk lain atau induk pengganti (surrogate broodstock). Untuk aplikasi sistem pembenihan ini dibutuhkan suatu teknologi yang disebut xenotransplantasi sel testikular yaitu transplantasi sel testikular yang berasal dari jenis ikan (donor) yang ingin diproduksi ke jenis ikan (resipien) berbeda yang memiliki pertumbuhan cepat. Jika teknologi ini diterapkan pada budidaya ikan gurami diharapkan sel spermatogonia dari suspensi sel testikular ikan gurami yang ditransplantasikan akan tumbuh dan berkembang bersama-sama dengan sel testikular resipien hingga dikeluarkan sebagai sel gamet ikan gurami dalam waktu yang lebih cepat. Pada penelitian ini resipien yang digunakan adalah ikan nila karena cepat matang kelamin, masa rematurasi 2 bulan, viabilitas larva tinggi dan mudah beradaptasi.
vi
dilakukan untuk mengatasi masalah sinkronisasi ketersediaan sel donor dan resipien. Parameter yang diamati adalah viabilitas sel spermatogonia, kerusakan histologis dan efisiensi kolonisasi sel donor pada resipien.
Hasil penelitian menunjukkan bahwa sel spermatogonia ikan gurami yang memiliki peluang terkolonisasi adalah sel spermatogonia tidak terdiferensiasi yaitu sel punca spermatogonia (SSC) dan spermatogonia A (SpA) dengan diameter sel berukuran 14,43–20,53 µm. Kelompok bobot tubuh ikan gurami yang memiliki kelimpahan SSC dan SpA tertinggi adalah kelompok 500–1000 g dengan frekuensi relatif rata-rata SSC dan SpA masing-masing 2,96±1,20% dan 23,23±3,75%.
Larutan disosiasi yang mengandung tripsin dan DNase (larutan B) memberikan hasil disosiasi dengan jumlah sel spermatogonia yang lebih tinggi dibandingkan larutan disosiasi yang mengandung tripsin saja (larutan A). Waktu inkubasi yang optimum untuk disosiasi adalah 3 jam. Dengan demikian untuk metode disosiasi jaringan testikular yang optimum untuk ikan gurami adalah menggunakan larutan B yang terdiri atas tripsin dan DNase yang dilengkapi CaCl2, HEPES dan FBS dalam larutan PBS dengan lama masa inkubasi jaringan 3 jam.
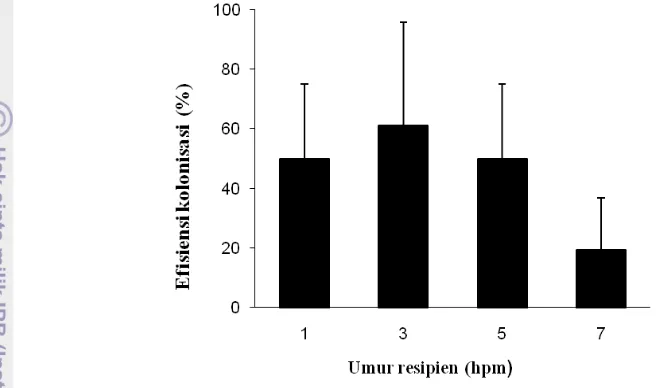
Teknik transplantasi menggunakan mikroinjeksi secara i.p menghasilkan sintasan larva 24 jam pt berbeda nyata (P<0,05) dengan kontrol untuk kelompok larva umur 1 hpm yaitu 82,74±6,76%. Hasil transplantasi sel pada berbagai umur larva ikan nila menunjukkan efisiensi kolonisasi yang cenderung menurun dengan semakin bertambahnya umur resipien. Efisiensi kolonisasi tertinggi terdapat pada resipien umur 3 hpm (61,10±34,71%) dan yang terendah pada umur 7 hpm (19,33±17,33 %). Dengan demikian umur larva ikan nila yang optimum dijadikan sebagai resipien adalah 3 hpm. Sel donor spermatogonia juga mampu terkolonisasi pada ikan betina dengan perbandingan jantan dan betina yang membawa sel donor adalah 1:1. Hasil kuantifikasi DNA genom gonad resipien ikan nila pada 1, 2 dan 3 bulan pt juga menunjukkan bahwa terjadi peningkatan konsentrasi DNA dan jumlah sel donor sebesar 3,42 kali dari umur 1 bulan pt ke 2 bulan pt atau ke 3 bulan pt. Hal ini mengindikasikan sel spermatogonia ikan gurami yang terkolonisasi pada gonad ikan nila mampu berproliferasi.
Lama preservasi testis dalam NaCl 0,7% (4 oC) mulai berpengaruh nyata terhadap viabilitas sel spermatogonia (P<0,05) pada 12 jam preservasi dan menurun tajam pada lama preservasi 48 jam. Jenis kerusakan sel secara histologis berupa disintegrasi jaringan interstitial dan inti piknotik. Efisiensi kolonisasi sel spermatogonia ikan gurami yang diisolasi dari testis pascapreservasi 0, 24 dan 48 jam pada resipien ikan nila tidak berbeda nyata (P>0,05) dengan efisiensi kolonisasi masing-masing adalah 61,11±19,25%, 55,56±9,62% dan 55,56±9,62%. Dari penelitian ini dapat disimpulkan bahwa testis ikan gurami mengandung sel yang kompeten sebagai donor dalam xenotransplantasi menggunakan larva ikan nila sebagai resipien.
vii
© Hak Cipta milik IPB, tahun 2012 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah: dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
ix
IKAN GURAMI KEPADA LARVA IKAN NILA
IRMA ANDRIANI
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
x
Penguji pada Ujian Prakualifikasi Doktor : Prof.Dr.Ir.Enang Harris M.S. Dr.Ir.Agus Oman Sudrajat M.Sc. Penguji pada Ujian Tertutup : Prof.Dr.Ir.M.Zairin Junior M.Sc.
Prof.drh.Arief Boediono Ph.D, PAvet. Penguji pada Ujian Terbuka : Dr.Ir.Rudhy Gustiano M.Sc.
xi Nama : Irma Andriani
NIM : C161060081
Disetujui Komisi Pembimbing
Dr. Alimuddin S.Pi. M.Sc. Ketua
Prof.Dr.Ir.Komar Sumantadinata M.Sc Dr.drh.Ita Djuwita M.Phil.
Anggota Anggota
Mengetahui
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Perairan
Prof.Dr.Ir.Enang Harris M.S. Dr.Ir.Dahrul Syah M.Sc Agr
xiii
Alhamdulillahirabbil‟alamin, puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia dan rahmatNya sehingga karya ini berhasil dilakukan. Tema penelitian ini adalah Xenotransplantasi Sel Testikular Ikan Gurami kepada Larva Ikan Nila. Penelitian dilaksanakan dari bulan April 2008 hingga bulan Juli 2011 dengan uraian tahap penelitian, waktu, tempat penelitian sebagai berikut : 1) karakterisasi morfologi sel spermatogonia ikan gurami dan penentuan sumber donor berlangsung dari bulan Agustus 2008 hingga Januari 2009 di Laboratorium Kesehatan Ikan, Fakultas Perikanan dan Kelautan (FPIK), Institut Pertanian Bogor (IPB), di Laboratorium Histologi Fakultas Kedokteran Hewan (FKH), IPB dan di Tokyo University of Marine Science and Technology di Jepang, 2) metode disosiasi jaringan testikular ikan gurami berlangsung dari bulan Februari hingga Mei 2009 di Laboratorium Embriologi, FKH, IPB , 3) xenotransplantasi sel testikular ikan gurami pada berbagai umur larva ikan nila berlangsung dari bulan Juni hingga Desember 2009 di Balai Besar Pengembangan Budidaya Ikan Air Tawar (BBPBAT) di Sukabumi, 4) analisis proliferasi sel spermatogonia yang terkolonisasi pada gonad resipien dan 5) viabilitas dan efisiensi kolonisasi spermatogonia dari testis ikan gurami pascapreservasi dingin berlangsung dari bulan April 2010 hingga Juli 2011 di Laboratorium Reproduksi dan Genetika Organisme Akuatik, FPIK, IPB dan Laboratorium Embriologi, FKH, IPB.
Sebagian dari disertasi ini khususnya bab II dan bab III telah dipublikasikan dalam Indonesian Aquaculture Journal 5 (2) :165-172 dengan judul “Morphological characteristic of spermatogonia and testis dissociation : A preliminary study for the germ cell transplantation in giant gourami (Osphronemus goramy) dan sebagian dari bab VI telah dipresentasikan pada Kongres Perhimpunan Biologi Indonesia (PBI) pada tahun 2009 di Malang.
xiv
menyelesaikan penelitian ini dengan semaksimum mungkin. Penghargaan yang setinggi-tingginya juga kami sampaikan kepada Prof. Dr. Goro Yoshizaki dan koleganya di Tokyo University of Marine Science and Technology atas kesempatan dan pelatihan teknik transplantasi pada ikan selama penulis mengikuti Program SANDWICH–DIKTI pada tahun 2008-2009. Terima kasih yang sebesar-besarnya penulis ucapkan kepada Ir. Maskur M.Si selaku Kepala BBPBAT Sukabumi saat itu, Adi Sucipto S.Pi, M.Si. dan tim, Dian Hardianto S.Pi, M.Si. dan tim serta Ade Sunarma S.Pi., M.Si. dan tim atas bantuan fasilitas dan berbagi ilmu selama penulis melakukan penelitian di BBPBAT.
Terima kasih kami ucapkan kepada Keluarga Besar Jurusan Biologi dan FMIPA, Universitas Hasanuddin (UNHAS) atas doa dan dorongan morilnya. Terima kasih juga kepada semua rekan-rekan akuakultur angkatan 2006 dan rekan-rekan di Laboratorium Reproduksi dan Genetika Organisme Akuatik, BDP-FPIK IPB, di Laboratorium Embriologi, FKH-IPB, dan sahabat-sahabat seperjuangan penulis atas dukungan semangatnya selama studi dan penelitian penulis. Terima kasih kepada guru-guru kelima anak-anak saya atas perhatiannya yang ekstra dan bantuannya mendidik serta upaya menjaga akhlak kelima anak-anak kami selama penulis menjalankan studi di IPB. Akhirnya penulis menghaturkan terima kasih tak terhingga kepada ayahanda M.Idrus Abdullah (alm) dan Ibunda Fatimah, suami Syamsari Syamsuddin, tante Puang Puji, serta kelima anak-anak saya atas doa dan dukungan moril serta semangat yang diberikan kepada penulis selama menjalankan studi.
Semoga disertasi ini dapat memberikan manfaat yang sebesar-besarnya bagi perkembangan ilmu pengetahuan pada umumnya dan perkembangan penelitian khususnya di bidang Budidaya Perairan. Kepada semua yang penulis sebutkan di atas, penulis senantiasa berdoa “Jazakumullahu khairan katsiira” : Semoga Allah SWT membalas semua kebaikan yang diberikan kepada penulis dengan sebaik-baik balasan dari Allah SWT. Amiin ya Rabbal „Alamiin.
xv
Penulis dilahirkan di Makassar pada tanggal 9 Agustus 1971 dari pasangan ayah Drs. M. Idrus Abdullah (Alm) dan ibu Ir. Fatimah Husain M.Si. Penulis merupakan anak pertama dari lima bersaudara. Pendidikan sarjana di tempuh pada Program Studi Budidaya Perairan, Fakultas Perikanan, Institut Pertanian Bogor, lulus tahun 1996. Pada tahun 2000 menyelesaikan pendidikan master di Sekolah Pascasarjana Institut Pertanian Bogor Program Studi Biologi dengan beasiswa Karya Siswa, Direktorat Jenderal Pendidikan Tinggi (DIKTI), Kementerian Pendidikan Nasional dan oleh DIKTI penulis ditempatkan sebagai staf pengajar di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Hasanuddin sejak tahun 1999 hingga sekarang. Kesempatan melanjutkan ke pendidikan Program Doktor pada Program Studi Ilmu Perairan Sekolah Pascasarjana, Institut Pertanian Bogor diperoleh pada tahun 2006 dengan Beasiswa BPPS DIKTI.
Selama penulis menjalani pendidikan di Program Doktor IPB penulis mendapatkan beasiswa Program Sandwich oleh DIKTI ke Tokyo University of Marine Science and Technology (TUMSAT) di Jepang dan telah mengikuti pelatihan transplantasi sel germinal spermatogonia ikan rainbow trout selama 1 bulan di Ooizumi Training Station, TUMSAT, Jepang. Pada akhir penelitian, penulis berkesempatan mendapatkan beasiswa Hibah Disertasi tahun 2011. Penulis telah mempresentasikan makalah berjudul : “Isolasi Sel Spermatogonia dan Karakteristik Morfologis Jaringan Testikular Ikan Gurami Pascapreservasi” di konggres Perhimpunan Biologi Indonesia , Malang pada tahun 2009. Satu buah karya ilmiah bagian dari penelitian disertasi telah dibuat dengan judul : Morphological characteristic of spermatogonia and testis dissociation: a preliminary study for the germ cell transplantation in giant gourami (Osphronemus goramy) dan telah diterbitkan pada Indonesian Aquaculture Journal 5(2):163-171 tahun 2010.
xvii
Tujuan dan Ruang Lingkup Penelitian ... 7
Kebaruan Penelitian ... 8
Manfaat Penelitian ... 8
II KARAKTERISASI MORFOLOGI SEL SPERMATOGONIA IKAN GURAMI DAN PENENTUAN SUMBER DONOR ... 9
Abstrak ... 9
III METODE DISOSIASI JARINGAN TESTIKULAR IKAN GURAMI ... 25
IV XENOTRANSPLANTASI SEL TESTIKULAR IKAN GURAMI PADA BERBAGAI UMUR LARVA IKAN NILA ... 37
V ANALISIS PROLIFERASI SEL SPERMATOGONIA IKAN GURAMI YANG TERKOLONISASI PADA IKAN NILA ... 59
Abstrak ... 59
xviii
Pendahuluan... 60
Bahan dan Metode... 62
Hasil dan Pembahasan... 66
Kesimpulan ... 73
VI VIABILITAS DAN EFISIENSI KOLONISASI SPERMATO- GONIA DARI TESTIS IKAN GURAMI PASCAPRESERVASI DINGIN PADA LARVA IKAN NILA ... 75
Abstrak... ... 75
Abstract ... 76
Pendahuluan ... 76
Bahan dan Metode... 79
Hasil dan Pembahasan... 81
Kesimpulan ... 89
VII PEMBAHASAN UMUM ... 91
VIII KESIMPULAN UMUM DAN SARAN ... 101
DAFTAR PUSTAKA ... 103
LAMPIRAN ... 111
xix
Halaman 1 Deskripsi morfologi tipe spermatogonia pada ikan gurami ... 18 2 Frekuensi relatif rata-rata (%) spermatogonia dari jaringan testis
ikan gurami pada berbagai bobot tubuh (g) ... 20 3 Jumlah dan viabilitas rata-rata sel spermatogonia hasil disosiasi
jaringan testikular ikan gurami dalam larutan A dan B ... 35 4 Konsentrasi DNA (ng/µ L) dan jumlah sel hasil kuantifikasi DNA
produk PCR sel donor ikan gurami dalam gonad resipien umur
1, 2 dan 3 bulan pascatransplantasi (pt) ... 72 5 Jumlah dan viabilitas rata-rata sel spermatogonia hasil disosiasi
jaringan testis ikan gurami pascapreservasi pada lama inkubasi
berbeda ... 82 6 Jumlah dan viabilitas rata-rata sel spermatogonia dalam 20.000 sel
xxi
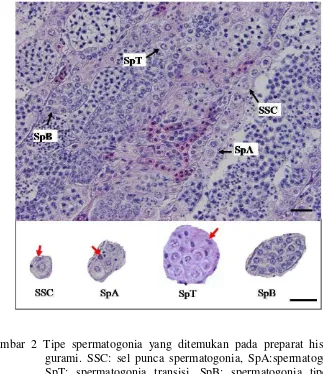
2 Tipe spermatogonia yang ditemukan pada preparat histologis ikan gurami. SSC: sel punca spermatogonia, SpA:spermatogonia tipe A, SpT: spermatogonia transisi, SpB: spermatogonia tipe B. Panah merah menunjukkan sel sertoli. Skala : 20 µm………... 3 Penampang melintang testis ikan gurami. A. Kelompok ikan bobot
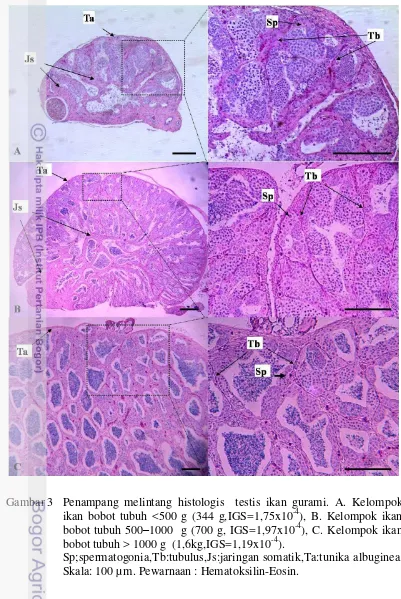
tubuh <500 g (344 g,IGS=1,75x10-4), B. Kelompok ikan bobot tubuh 500-1000 g (700 g, IGS=1,97x10-4), C. Kelompok ikan bobot tubuh > 1000 g (1,6kg,IGS=1,19x10-4)………. 4 Suspensi sel testikular ikan gurami pascadisosiasi. A. Tipe-tipe sel
spermatogonia. B. Sel punca spermatogonia dengan membran sel yang tipis (kepala panah adalah membran sel). C. Sel yang mati berwarna biru setelah pewarnaan dengan trypan blue……… 5 Jumlah dan viabilitas sel spermatogonia ikan gurami pada larutan
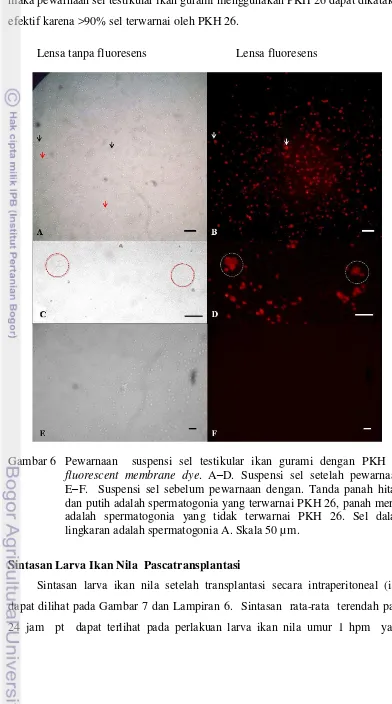
disosiasi dan lama inkubasi berbeda. A. Jumlah sel spermatogonia yang dihasilkan pada lama waktu inkubasi 1 hingga 5 jam dalam larutan A dan larutan B. B. Viabilitas sel spermatogonia pada lama inkubasi 1 hingga 5 jam dalam larutan A dan larutan B……… 6. Pewarnaan suspensi sel testikular ikan gurami dengan PKH 26
fluorescent membrane dye. A–D. Suspensi sel setelah pewarnaan. E–F.Suspensi sel sebelum pewarnaan ………... 7. Sintasan resipien ikan nila perlakuan umur 1, 3, 5, 7 hari
pascamenetas dan tanpa transplantasi (kontrol) pada 24 jam dan 2 bulan pascatransplantasi. ………. 8 Efisiensi kolonisasi sel spermatogonia ikan gurami pada resipien
ikan nila perlakuan umur transplantasi 1, 3, 5 ,7 hari pascamenetas
xxii
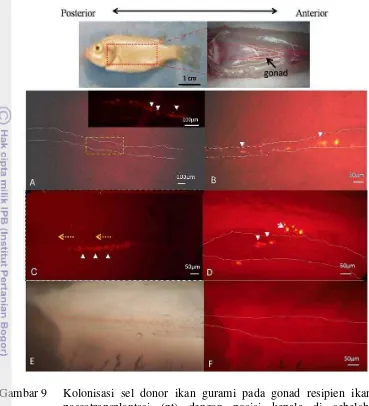
pascatransplantasi (pt) dengan posisi kepala di sebelah kiri (posterior) dan ekor di sebelah kanan (anterior)………. 10 Elektroforegram DNA produk PCR dari gonad resipien ikan nila 2
bulan pascatransplantasi menggunakan marka molekuler spesifik GH ikan gurami dan primer β-aktin ikan nila sebagai kontrol
internal………
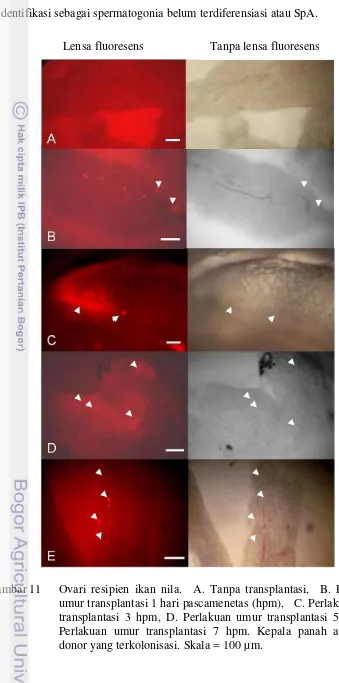
11 Ovari resipien ikan nila. A. Tanpa transplantasi, B. Perlakuan umur transplantasi 1 hari pascamenetas (hpm), C. Perlakuan umur transplantasi 3 hpm, D. Perlakuan umur transplantasi 5 hpm, E. Perlakuan umur transplantasi 7 hpm. ……… 12 Kumpulan sel donor ikan gurami yang terkolonisasi (kepala panah)
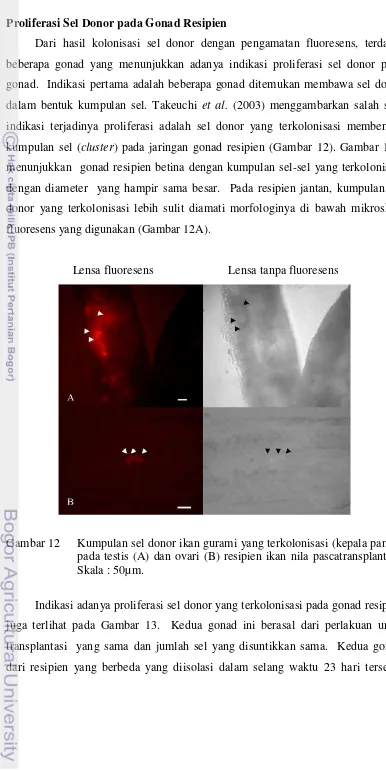
pada testis (A) dan ovari (B) resipien ikan nila pascatransplantasi……….…….……….
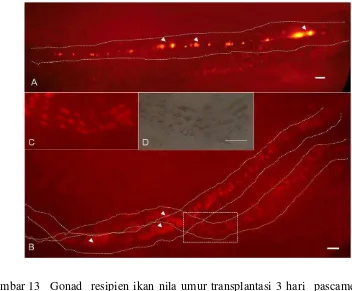
13 Gonad resipien ikan nila umur transplantasi 3 hari pascamenetas. A. Resipien betina 72 hari pascatransplantasi (pt). B. Resipien betina 95 hari pt. C,D (insersi). Pembesaran dari kotak…………... 14 Elektroforegram DNA produk PCR dari sel testikular ikan gurami
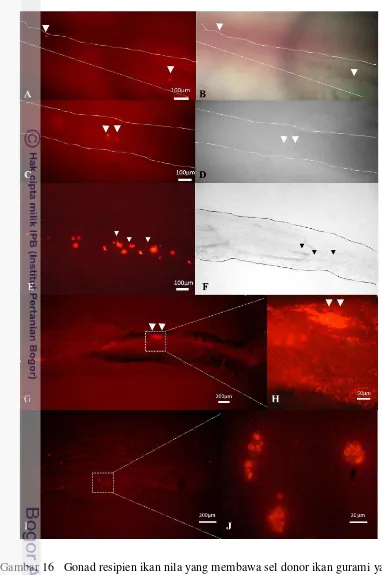
dan ikan nila yang diamplifikasi menggunakan marker spesifik GH gurami (340 bp) dan β aktin (150 bp) sebagai kontrol internal.………... 15 Kurva standar konsentrasi produk PCR dari DNA genom ikan gurami dalam suspensi sel testikular ikan nila………... 16 Gonad resipien ikan nila yang membawa sel donor ikan gurami
yang terlabel oleh PKH 26 (kepala panah). Garis putus-putus menunjukkan batas gonad. A,C,E,I,J: pengamatan dengan mikroskop fluoresens, B,D,F: pengamatan tanpa fluoresens. A,D: resipien umur 1 bulan pascatransplantasi (pt), E,F: resipien jantan umur 2 bulan pt, G,H(insersi): kumpulan sel donor pada resipien jantan umur 3 bulan pt, I,J(insersi): kumpulan sel donor pada resipien jantan umur 2 bulan pt………. 17 Elektroforegram DNA produk PCR dari gonad resipien ikan nila 1,
2 dan 3 bulan pascatransplantasi (pt) menggunakan marka molekuler spesifik GH ikan gurami (340 bp) dan primer β-aktin ikan nila (150 bp) sebagai kontrol internal………...
xxiii
nila berdasarkan konsentrasi DNA hasil kuantifikasi pita DNA produk PCR menggunakan program unscan IT Gel 6.1………. 19 Hasil disosiasi jaringan testikular ikan gurami. A.Tanpa preservasi,
B. Pascapreservasi 24 jam, C. Pascapreservasi 48 jam. Kepala panah merah menunjukkan sel spermatogonia yang mati terwarnai oleh trypan blue, sedangkan kepala panah hitam menunjukkan sel spermatogonia hidup………. ………. 20 Penampang melintang preparat histologis jaringan testis ikan
gurami. A,B: testis tanpa preservasi, C,D: testis pascapreservasi 6 jam, E,F: testis pascapreservasi 12 jam, G,H:testis pascapreservasi 24 jam, I,J: testis pascapreservasi 48 jam………...
21 Sintasan resipien ikan nila pada 24 jam dan 1 bulan pasca-transplantasi……… 22 Efisiensi kolonisasi sel spermatogonia ikan gurami yang diisolasi dari gonad pascapreservasi 0, 24 dan 48 jam pada resipien ikan
nila………...………...
23 Gonad resipien ikan nila yang membawa sel donor ikan gurami dari testis pascapreservasi dan tanpa preservasi. A–C: testis, D–F: ovari, A,D: tanpa preservasi, B,E: preservasi 24 jam, C,F: preservasi 48
jam.………. ………...
24 Mekanisme pewarnaan oleh PKH 26 (Wallace et al. 2008)………...
71
83
84
86
87
xxv
Halaman 1. Analisis karakteristik morfologi tipe spermatogonia ikan
gurami……….
2 Analisis data kelimpahan sel testikular (frekuensi relatif) ikan gurami pada bobot tubuh ikan <500 g (1), 500–1000 g (2), >1000 g (3)………. 3 Analisis faktorial pengaruh larutan disosiasi dan lama masa
(waktu) inkubasi terhadap jumlah dan viabilitas sel spermatogonia ikan gurami... 4 Profil resipien larva ikan nila pada berbagai umur hari
pascamenetas ……….
5 Persentase sel testikular dan sel spermatogonia ikan gurami yang terlabel oleh PKH 26 (Sigma)………... 6 Sintasan ikan nila pascatransplantasi………. 7 Efisiensi kolonisasi sel spermatogonia ikan gurami pada ikan
nila resipien………
8 Hasil pengukuran ekstraksi DNA gonad ikan gurami menggunakan gene quant...……….. 9. Hasil kuantifikasi DNA produk PCR DNA genom gonad ikan nila menggunakan program unscan IT Gel 6.1………..
10 Hasil analisis ragam estimasi konsentrasi dan jumlah sel resipien ikan nila 1 bulan, 2 bulan dan 3 bulan pascatransplantasi………..
11 Jumlah dan viabilitas spermatogonia ikan gurami dari testis pascapreservasi serta analisis ragam terhadap viabilitas
spermatogonia………
LATAR BELAKANG
Beberapa tahun terakhir ini, para peneliti mencoba mengatasi masalah-masalah reproduksi pada hewan melalui teknologi transplantasi sel germinal jantan atau disebut juga transplantasi sel testikular. Transplantasi merupakan teknik pemindahan organ, jaringan atau sel tertentu dari donor ke resipien. Jika hewan donor dan resipien merupakan individu yang sama disebut autotransplantasi (transplantasi autogenik), sedangkan jika hewan donor dan resipien merupakan individu yang berbeda namun dari spesies yang sama disebut allotransplantasi (transplantasi singenik). Transplantasi sel atau jaringan dari hewan donor ke resipien yang berasal dari individu dan spesies yang berbeda disebut xenotransplantasi (transplantasi xenogenik) (Johnston et al. 2000).
Transplantasi sel testikular memiliki banyak aplikasi dalam bidang biologi, peternakan dan perikanan di antaranya untuk 1) menjajaki proses-proses perkembangan dan diferensiasi sel germinal (gametogenesis), 2) terapi regeneratif penyakit organ reproduksi, 3) memproduksi hewan transgenik melalui sistem transfer gen yang dimediasi sel, dan 4) menciptakan sistem pembenihan dimana spesies target dapat diproduksi dari induk yang lain atau dikenal dengan istilah induk pengganti atau surrogate broodstock (Brinster & Zimmermann 1994, Okutsu et al. 2006a).
Penelitian transplantasi sel germinal telah banyak dilakukan pada vertebrata tingkat tinggi. Transplantasi sel germinal pertama kali diperkenalkan pada ayam oleh Tajima et al. (1993), kemudian pada tikus dengan menggunakan sel punca spermatogonia (Brinster & Zimmerman 1994) dan selanjutnya pada hewan-hewan lain seperti kambing, babi dan primata (Schatt 2002, Dobrinski 2005).
tersebut menghasilkan sel donor yang mampu bermigrasi, mampu bergabung (terkolonisasi) dengan sel-sel somatik saluran bakal gonad larva, dan mampu berdiferensiasi hingga menjadi sel gamet yang fungsional. Penelitian ini telah membuktikan bahwa sel donor yang berasal dari individu berbeda tidak mengalami penolakan oleh sistem imun resipien.
Keberhasilan transplantasi tersebut menjadi inspirasi bagi Takeuchi dan koleganya untuk menerapkan sistem transplantasi menggunakan sel donor PGC ikan rainbow trout (Oncorhynchus mykiss) ke resipien yang berbeda spesies ikan salmon masu (Oncorhynchus masou) yang dikenal dengan istilah xenotransplantasi. Meskipun ikan rainbow trout memiliki masa matang gonad yang lebih lama (sekitar 2 tahun) dari ikan salmon (sekitar 1 tahun) namun PGC ikan rainbow trout yang ditransplantasikan pada ikan salmon ternyata dapat melakukan gametogenesis secara normal pada gonad ikan salmon masu bahkan diperoleh sel spermatozoa ikan rainbow yang fungsional dari induk ikan salmon yang berumur 1 tahun pascatransplantasi (Takeuchi et al. 2004). Ikan salmon hasil xenotransplantasi tersebut merupakan model surrogate broodstock atau induk pengganti pertama pada ikan.
Disebabkan oleh jumlah PGC yang sedikit dan sulit ditemukan, penelitian transplantasi sel germinal pada ikan ini kemudian dikembangkan dengan menggunakan sel testikular sebagai sel donor seperti yang telah dilakukan oleh Okutsu et al. (2006a), Lacerda et al. (2008), Takeuchi et al. (2009). Penggunaan sel testikular sebagai sel donor ini didasari atas kesamaan sifat tipe sel testikular spermatogonia dengan PGC (Okutsu et al. 2006a). Spermatogonia pada allotransplantasi sel testikular ikan rainbow trout ternyata tidak hanya mampu berdiferensiasi menjadi sel gamet jantan yang fungsional tetapi juga mampu berdiferensiasi menjadi sel gamet betina yang fungsional (Okutsu et al. 2006b). Kemampuan sel spermatogonia berdiferensiasi menjadi spermatosit dan derivatnya serta menjadi oosit dan derivatnya disebut sebagai development plasticity atau sexual plasticity (Okutsu et al. 2006a, Yoshizaki et al. 2010).
jauh (Hill & Dobrinsky 2006). Xenotransplantasi sel testikular manusia ke tubuli seminiferi mencit mampu menghasilkan kolonisasi dan produksi spermatozoa manusia pada 25% resipien (Sofikitis et al. 1999). Sebaliknya, xenotransplantasi hamster ke tikus (Ogawa et al. 1999) dan primata ke tikus (Nagano et al. 2001) mengalami proses spermatogenesis tidak sempurna yang diduga karena perbedaan morfologis sel donor dan gonad resipien serta hubungan filogeni yang jauh. Perbedaan hasil xenotransplantasi tersebut menunjukkan bahwa faktor yang menentukan terjadinya inkompatibilitas antara hewan donor dan resipien bersifat spesifik atau dapat berbeda pada spesies tertentu.
Pada dekade terakhir xenotransplantasi sel testikular juga telah dilakukan pada beberapa jenis ikan yang berbeda spesies hingga berbeda famili dan menghasilkan sel donor yang mampu bermigrasi ke saluran bakal gonad, terkolonisasi dan berproliferasi pada gonad resipien (Yazawa et al. 2010) bahkan ada pula yang dapat menghasilkan sel gamet jantan yang fungsional (Majhi et al. 2009). Namun belum terdapat informasi apakah kemampuan development plasticity spermatogonia pada resipien yang berbeda jenis juga masih dapat terjadi.
Keberhasilan xenoransplantasi sel testikular pada beberapa jenis ikan telah memberikan peluang dan harapan bagi aplikasi xenotransplantasi ini untuk dijadikan sebagai alternatif metode pembenihan dengan cara pembuatan induk pengganti untuk ikan yang memiliki nilai ekonomis tinggi dan untuk ikan-ikan langka namun sulit penanganan produksinya. Oleh karena itu aplikasi teknologi transplantasi sel germinal ini perlu diupayakan di Indonesia.
memiliki masa matang gonad cepat serta dapat berproliferasi dan berdiferensiasi menjadi sel gamet fungsional pada gonad resipien, melalui teknik pemijahan buatan, benih ikan gurami dapat diperoleh dengan cepat.
Ikan nila dijadikan sebagai model resipien untuk aplikasi teknologi xenotransplantasi sel testikular ikan gurami karena matang gonad pertamanya lebih cepat (4–5 bulan) dan masa rematurasi juga lebih cepat. Selain itu, ikan nila mudah beradaptasi dengan perubahan lingkungan dan viabilitas larvanya yang tinggi (Stickney 2000). Di masa yang akan datang, teknologi xenotransplantasi sel testikular ikan gurami menggunakan ikan nila sebagai induk pengganti ini diharapkan dapat menciptakan model sistem pembenihan baru dalam budidaya ikan gurami khususnya dan ikan air tawar pada umumnya.
Ikan gurami dan ikan nila telah terpisah pada tingkatan taksonomi ordo, yaitu ikan gurami berasal dari ordo Labyrintichii dan ikan nila dari ordo Percomorphii (Saanin 1984). Biologi reproduksi kedua ikan ini juga memiliki beberapa perbedaan. Salah satu perbedaan yang menyolok adalah pada tipe telurnya. Ikan gurami memiliki tipe telur mengapung, sedangkan telur ikan nila tenggelam ke dasar. Melalui teknologi xenotransplantasi sel germinal jantan antar ikan gurami dan ikan nila ini, maka kita dapat mengkaji sejauh mana kemampuan sel donor ikan gurami terkolonisasi dan berproliferasi pada resipien yang jauh hubungan filogeninya dan memiliki perbedaan morfologis pada sel gametnya.
membuka peluang untuk menjadikan ikan air tawar sebagai induk pengganti jenis ikan air laut.
Beberapa fenomena transplantasi sel germinal pada ikan seperti yang telah dijelaskan sebelumnya perlu dikaji untuk keberhasilan aplikasi teknologi xenotransplantasi sel testikular ikan gurami kepada ikan nila. Sebagai tahap awal dibutuhkan beberapa informasi dasar dan tahapan teknis transplantasi di antaranya adalah preparasi sel donor yang terdiri atas karakterisasi sel spermatogonia ikan gurami, penentuan sumber donor ikan gurami dan penentuan metode disosiasi jaringan gonad ikan gurami. Ketiga tahapan teknis ini merupakan upaya untuk menyiapkan suspensi sel donor yang kaya akan sel donor yang memiliki kemampuan kolonisasi.
Menurut Grisswold et al. (2001), karakterisasi sel spermatogonia yang tidak jelas sering menjadi faktor pembatas dalam pelaksanaan transplantasi sel germinal. Kemampuan mengidentifikasi spermatogonia dari sel testikular lainnya penting karena hanya spermatogonia yang tidak terdiferensiasi, yaitu spermatogonia A, yang memiliki kemampuan terkolonisasi pada resipien (Okutsu et al. 2006a). Oleh karena itu karakterisasi sel spermatogonia ikan gurami merupakan informasi dasar yang harus diketahui sebelum melakukan kegiatan transplantasi sel germinal ikan gurami.
Selanjutnya dilakukan penentuan tahap perkembangan gonad ikan gurami yang dapat dijadikan sebagai sumber donor. Menurut Zapata (2009) kelimpahan spermatogonia berkaitan dengan perkembangan gonad. Hingga saat ini belum terdapat informasi yang jelas mengenai tahap perkembangan gonad pada ikan gurami. Dengan metode disosiasi yang tepat, jaringan gonad dari ukuran ikan gurami yang optimum dapat menghasilkan suspensi sel testikular yang mengandung banyak spermatogonia.
gonad resipien atau dengan semakin bertambahnya umur resipien (Okutsu et al. 2006a). Pengaruh interval umur resipien yang mempengaruhi efisiensi kolonisasi berkaitan dengan sistem imunodefisiensi yang belum sempurna pada larva (Manning & Nakanishi 1996). Faktor-faktor tersebut dilaporkan berbeda-beda di antara spesies (Dobrinski et al. 1999, Johnston et al. 2000). Hingga saat ini larva ikan nila belum pernah digunakan sebagai resipien dalam kegiatan transplantasi. Pada penelitian ini dilakukan uji kompetensi terhadap larva ikan nila sebagai resipien dengan menganalisis kemampuan kolonisasi sel testikular ikan gurami pada gonad berbagai umur awal larva ikan nila untuk mengetahui umur larva ikan nila yang optimum untuk kegiatan transplantasi. Selanjutnya dilakukan pula analisis kemampuan proliferasi sel donor yang telah terkolonisasi pada resipien tersebut.
Pada aplikasi teknik transplantasi, faktor ketersediaan sel juga sering menjadi faktor pembatas (Griswold et al. 2001). Sinkronisasi ketersediaan sel donor dengan resipien dan terbatasnya jumlah sel donor spermatogonia adalah dua hal yang berkaitan dengan ketersediaan sel. Terkadang sel atau jaringan donor sudah tersedia tetapi resipien belum siap ditransplantasi. Sementara itu, jaringan gonad yang dikeluarkan dari tubuh ikan akan beresiko mengalami kerusakan jika tidak segera diproses. Oleh karena itu untuk mengatasi kendala ini dibutuhkan teknik penyimpanan atau teknik preservasi jangka pendek untuk menghindari kerusakan sel-sel gamet pada gonad sebelum transplantasi dilakukan dan sekaligus menambah daya tahan hidup.
sel donor dan resipien, preservasi jangka pendek ini juga merupakan upaya bagi proses penyelamatan plasma nutfah gonad atau testis yang langka dan bernilai ekonomis karena dapat digunakan sebagai sumber donor dalam kegiatan transplantasi sel germinal. Sel spermatogonia hidup yang dihasilkan dari gonad preservasi akan menjadi sesuatu yang berharga jika digunakan pada aplikasi teknologi transplantasi sel testikular sebagai sumber donor. Oleh karena itu pada tahap akhir penelitian ini dilakukan pula transplantasi sel donor dari testis ikan gurami pascapreservasi dingin ke larva ikan nila.
Beberapa tahapan dan kendala teknis yang mempengaruhi keberhasilan xenotransplantasi khususnya pada ikan gurami belum pernah dilaporkan. Oleh karena itu penelitian xenotransplantasi sel germinal jantan ikan gurami ke ikan nila ini diharapkan dapat menambah informasi dasar tentang teknologi transplantasi sel spermatogonia pada ikan.
TUJUAN DAN RUANG LINGKUP PENELITIAN
Penelitian ini bertujuan untuk mengkaji kompetensi sel testikular ikan gurami sebagai donor dan ikan nila sebagai resipien pada teknologi xenotransplantasi sel testikular ikan gurami kepada ikan nila. Secara khusus penelitian ini bertujuan untuk:
1. Melakukan karakterisasi sel spermatogonia ikan gurami dan menganalisis kelimpahan sel spermatogonia pada beberapa kelompok bobot tubuh ikan gurami untuk penentuan sumber donor.
2. Menentukan metode disosiasi jaringan testikular ikan gurami yang optimum. 3. Menganalisis pengaruh umur resipien terhadap efisiensi kolonisasi sel
spermatogonia pada gonad ikan nila.
4. Menganalisis kemampuan proliferasi sel spermatogonia yang telah terkolonisasi pada resipien.
Ruang lingkup penelitian ini terdiri atas :
1. Karakterisasi morfologi sel spermatogonia ikan gurami dan penentuan sumber donor .
2. Metode disosiasi jaringan testikular ikan gurami.
3. Xenotransplantasi sel testikular ikan gurami pada berbagai umur larva ikan nila.
4. Analisis proliferasi sel spermatogonia yang terkolonisasi pada gonad resipien. 5. Viabilitas dan efisiensi kolonisasi spermatogonia dari testis ikan gurami
pascapreservasi dingin pada larva ikan nila.
KEBARUAN PENELITIAN
Kebaruan (novelty) dalam penelitian ini adalah :
1. Tersedianya data karakteristik morfologi beberapa tipe sel spermatogonia ikan gurami.
2. Pembuktian bahwa sel spermatogonia ikan gurami mampu terkolonisasi dan berproliferasi pada gonad ikan nila.
3. Pembuktian bahwa sel testikular ikan gurami yang diisolasi dari gonad yang dipreservasi pada suhu 4 oC dalam larutan fisiologis mampu terkolonisasi pada ikan nila.
4. Penggunaan larva ikan nila sebagai resipien untuk xenotransplantasi sel testikular ikan gurami.
MANFAAT PENELITIAN
ABSTRAK
Salah satu faktor pembatas dalam melakukan transplantasi adalah bahwa tipe sel spermatogonia yang memiliki kemampuan terkolonisasi tidak terkarakterisasi dengan baik. Penelitian ini bertujuan untuk 1) melakukan karakterisasi tipe sel spermatogonia dari jaringan testis ikan gurami dan 2) menentukan sumber donor ikan gurami. Untuk keperluan karakterisasi, dilakukan kajian histologis testis dari 3 ekor ikan gurami (bobot 700-900 g/ekor) dengan karakter morfologi yang diamati adalah diameter sel dan inti, volume sel dan inti, volume sitoplasma dan jumlah sel dalam satu sista. Penentuan sumber donor dilakukan dengan kajian histologis testis ikan gurami dari bobot tubuh <500 g, 500–1000 g dan >1000 g, masing-masing 3 ekor. Parameter yang diamati adalah kelimpahan sel spermatogonia yang diformulasikan sebagai frekuensi relatif sel spermatogonia. Hasil yang diperoleh menunjukkan bahwa karakter diameter sel, volume sel, dan volume sitoplasma dapat dijadikan karakter pembeda tipe sel spermatogonia ikan gurami. Tipe spermatogonia yang memiliki peluang terkolonisasi adalah sel yang berdiameter 14,43–20,53µm. Bobot ikan gurami yang terbaik dijadikan sebagai sumber donor adalah yang berada pada kisaran 500 g hingga 1000 g per ekor.
Kata kunci : karakterisasi, morfologi, sel spermatogonia, ikan gurami, donor
II. THE MORPHOLOGICAL CHARACTERIZATION OF
GIANT GOURAMI SPERMATOGONIA AND THE
DETERMINATION OF DONOR
ABSTRACT
One of the major limitation to the transplant procedure is that the type of spermatogenic that are able to colonize is not well characterized. The aim of this research were 1) to identify type and characteristic of spermatogonia in testis of spermatogonia per cyst. Meanwhile, to determine donor based on the abundant of spermatogonia in each testis formulated as relative frequency, the testis were isolated from three different body weight group, those were <500 g, 500–1000 g and >1000 g (n=3,each). The result showed that diameter of cell, volume of cell and volume of cytoplasm could be used for characterization of type of spermatogonia. The type of spermatogonia with cell diameter ranged between 14.43 to 20.53 µm were identified having high probability of colonization. The best source of donor was testis of giant gourami weighed ranged from 500 g to 1000 g
Key words : characterization, morphology, spermatogonia, giant gourami, donor
PENDAHULUAN
Spermatogonia merupakan sel germinal yang merupakan cikal bakal terbentuknya spermatozoa yang selanjutnya setelah proses fertilisasi akan berkembang menjadi satu organisme baru yang membawa material genetik dari gamet asalnya. Selama proses spermatogenesis berlangsung, spermatogonia akan mengalami tahapan perkembangan selanjutnya menjadi spermatosit, spermatid dan spermatozoa dalam satu sista (Vilela et al. 2003). Perkembangan sel germinal yang sama dalam satu sista ini yang membedakan tahapan perkembangan sel germinal ikan dengan tahapan perkembangan sel germinal pada vertebrata lainnya.
spermatogonia), 2) tahap meiosis (tahap spermatosit) dan 3) tahap diferensiasi sel (tahap spermiogenik) (Hess & Franca 2007). Tahap spermatogonia merupakan tahapan perkembangan sel yang paling diminati untuk diteliti karena sel spermatogonia mengawali proses spermatogenesis dan peningkatan jumlah sel germinal bergantung pada proliferasi aktif spermatogonia (deRooij & Russel 2000).
Spermatogonia memiliki beberapa keistimewaan karena terdapat sekolompok sel yang memiliki karakteristik menyerupai PGC (primordial germ cell) atau sel punca dengan tingkat development plasticity yang tinggi yakni spermatogonia yang dapat berkembang tidak hanya menjadi sel spermatozoa tetapi juga dapat berkembang menjadi oosit (Okutsu et al. 2006a). Sifat-sifat spermatogonia tersebut menjadikan lebih banyak peneliti yang menggunakan sel spermatogonia sebagai sel donor dibandingkan PGC yang jumlahnya sangat terbatas dalam satu individu.
Secara umum spermatogonia terbagi menjadi dua tipe, yaitu spermatogonia yang tidak terdiferensiasi (spermatogonia A) dan spermatogonia yang terdiferensiasi (spermatogonia B). Spermatogonia yang tidak terdiferensiasi ini memiliki sifat seperti sel punca dan pada aplikasi teknologi transplantasi, hanya spermatogonia yang memiliki karakteristik menyerupai sel punca saja yang mampu terkolonisasi pada gonad resipien (Okutsu et al. 2006a, Yano et al. 2008). Beberapa peneliti cenderung membagi spermatogonia atas beberapa tipe, yaitu diawali dengan sel punca spermatogonia (primary spermatogonia), spermatogonia A, spermatogonia transisi (intermediate spermatogonia) dan spermatogonia B yang dibedakan berdasarkan karakter morfologisnya, yaitu diameter sel, morfologi inti dan jumlah sel dalam satu sista (Miura 1999, Schulz et al. 2005, Fishelson et al. 2006, Almeida et al. 2008, Zapata 2009). Selama ini karakterisasi terhadap spermatogonia dapat menjadi faktor pembatas dalam tahapan transplantasi.
penggunaan penanda spesifik untuk sel spermatogonia dan pendekatan biologi dengan memanfaatkan sifat-sifat biologi reproduksi hewan tersebut, seperti penggunaan hewan mutan yang pada testisnya hanya ada kelompok sel spermatogonia (Grisswold et al. 2001).
Pada ikan, penggunaan penanda sel spesifik untuk isolasi spermatogonia dalam kegiatan transplantasi telah dilakukan pada ikan rainbow trout oleh Yano et al. (2008). Pendekatan lain adalah berdasarkan sifat biofisik sel. Salah satu metode yang umum digunakan adalah pemisahan sel spermatogonia dari sel testikular lainnya dengan metode percoll gradient densitas seperti yang dilakukan pada ikan nila (Lacerda et al. 2008). Dengan metode tersebut suspensi sel testikular yang kaya akan spermatogonia dapat diperoleh.
BAHAN DAN METODE Karakterisasi Morfologi Sel Spermatogonia
Gonad ikan jantan (testis) dari 3 ekor ikan gurami dengan bobot tubuh sekitar 700–900 g/ekor diisolasi dan difiksasi dalam larutan Bouin selama 24 jam untuk selanjutnya diproses secara histologis menurut metode Kiernan (1990) hingga diperoleh preparat potongan melintang dan berseri dengan ketebalan potongan 5 µm. Preparat diwarnai dengan pewarnaan Hematoksilin-Eosin dan diamati di bawah mikroskop. Identifikasi morfologi sel-sel testikular merujuk pada Takashima & Hibiya (1995). Parameter yang diamati adalah diameter sel dan inti sel, volume sel dan inti sel, volume sitoplasma serta jumlah sel dalam satu sista. Pengamatan morfologi sel serta diameter sel dan inti sel dilakukan pada 30 sel/tipe sel yang dipilih secara acak dari tiga lapang pandang pada setiap potongan melintang testis. Untuk menghindari perhitungan berulang, pengamatan dilakukan pada setiap potongan dengan kelipatan 6 dari setiap preparat testis bagian tengah. Volume sitoplasma adalah selisih antara volume inti dan volume sel. Pengamatan jumlah sel per sista dilakukan pada enam sista utuh per tipe sel spermatogonia pada setiap testis.
Estimasi Kelimpahan Sel Spermatogonia pada Testis Ikan Gurami
Data kelimpahan diformulasikan sebagai frekuensi relatif (FR), yaitu persentase rasio jumlah grid yang di dalamnya terdapat tipe sel yang diamati dan total grid (Carasso et al. 1998).
Analisis Data
Data kuantitatif karakteristik morfologi yang disajikan dalam bentuk nilai tengah diuji secara statistik menggunakan ANOVA (analysis of variance), dan dilanjutkan dengan uji Duncan multiple range test untuk menentukan beda nyata antar perlakuan. Analisis menggunakan program SPSS 17.0 for windows dan MS Office Excell 2007.
HASIL DAN PEMBAHASAN Karakteristik Morfologi Sel Spermatogonia Ikan Gurami
Testis ikan gurami terdiri atas sepasang organ yang tidak simetris (Gambar 1A). Hasil pengamatan preparat histologis jaringan testis ikan gurami (indeks gonad somatik/IGS= [11,78±2,93]x10-5) memperlihatkan bahwa terdapat tiga tahap spermatogenesis pada jaringan yang diamati, yaitu tahap spermatogonia, tahap spermatosit dan tahap spermiogenik. Testis ikan gurami memiliki tipe unrestricted spermatogonia yang berarti spermatogonia tersebar di sepanjang tubulus (Gambar 1B dan 1C). Spermatogonia berukuran lebih besar dibandingkan sel-sel testikular lainnya, dan umumnya terletak di bagian tepi serta dikelilingi oleh satu atau beberapa sel sertoli (Gambar 1C, ditunjukkan dengan tanda panah). Distribusi sel spermatogonia pada ikan gurami ini juga terlihat pada ikan rainbow trout, gilthead seabream, ikan nila dan beberapa ikan lainnya (Takashima & Hibiya 1995).
sebelum spermatogonia tak terdiferensiasi (deRooij & van Dissel-Emiliani 1997). Untuk karakterisasi morfologis tipe-tipe spermatogonia, umumnya para peneliti melakukannya berdasarkan diameter sel dan inti sel, morfologi inti sel dan jumlah sel dalam satu sista seperti pada ikan rainbow trout (Takashima & Hibiya 1995), catfish (Santos et al. 2001), ikan nila (Schulz et al. 2005, Nobrega et al. 2009), dan ikan zebra (Leal et al. 2009). Berdasarkan studi histomorfometrik jaringan testikular beberapa jenis ikan tersebut diketahui deskripsi morfologi beberapa tipe spermatogonia.
Gambar 1 Testis dan penampang melintang histologis testis ikan gurami. A. Sepasang organ testis tidak simetris (bobot tubuh= 740 g,
IGS=1,35x10-4), skala: 1 mm; B. Penampang melintang testis (insersi: kotak), skala: 200 µm; C. Insersi: spermatogonia (Sp) tersebar di daerah tepi tubulus (Tb) dengan sel sertoli (SS) di sekitarnya, skala: 20 µm. Pewarnaan: Hematoksilin-Eosin.
Leal et al. (2009) menggambarkan SpA terdiferensiasi dengan ciri-ciri benang-benang kromatin pada inti sudah mulai memadat menyerupai flek-flek yang tidak beraturan pada bagian membran inti sel. Jumlah SpA dalam satu sista pada ikan zebra adalah 2, 4, atau 8 sel. Namun, pada ikan nila jika jumlah sel dalam sista sudah mencapai lebih dari dua sel dikategorikan sebagai SpB (Schulz et al. 2005). Hingga saat ini belum ada terminologi yang jelas mengenai spermatogonia tidak terdiferensiasi dan terdiferensiasi. Menurut deRooij & Russel (2000) istilah terdiferensiasi dan tidak terdiferensiasi erat kaitannya dengan perubahan fungsi sel sebagai sel punca. Meskipun demikian dinyatakan pula bahwa spermatogonia telah mengalami diferensiasi jika terjadi perubahan penampakan morfologis pada sitoplasma dan intinya.
Sel SpA akan berproliferasi menghasilkan SpB dengan ciri-ciri sudah terjadi kondensasi heterokromatin dan terdistribusi secara merata pada bagian tepi membran inti sehingga membran inti semakin terlihat jelas, berbentuk bulat dengan diameter menjadi lebih kecil dari diameter SpA. Umumnya para peneliti menyebut SpB sebagai spermatogonia terdiferensiasi. Menurut Chaves-Poso et al. (2005) selama proses spermatogenesis berlangsung diameter inti sel berkurang sekitar 1–2 µm.
Gambar 2 Tipe spermatogonia yang ditemukan pada preparat histologis ikan gurami. SSC: sel punca spermatogonia, SpA:spermatogonia tipe A, SpT: spermatogonia transisi, SpB: spermatogonia tipe B. Panah merah menunjukkan sel sertoli. Skala : 20 µm. Pewarnaan : Hematoksilin-Eosin.
lebih pekat dengan benang-benang kromatin di tepi sel yang menurut deRooij & Russel (2000) morfologi tersebut mengindikasikan kemungkinan telah terjadi proses diferensiasi yang ditandai dengan semakin banyaknya benang-benang heterokromatin pada inti sel.
Deskripsi morfologi tipe-tipe spermatogonia yang ada pada ikan gurami menunjukkan bahwa karakter diameter sel, volume sel dan volume sitoplasma berbeda nyata pada keempat tipe spermatogonia yang teridentifikasi (Tabel 1 dan Lampiran 1). Dengan demikian untuk kebutuhan identifikasi dapat digunakan ukuran diameter sel, volume sel dan volume sitoplasma sebagai karakter pembeda.
Tabel 1 Deskripsi morfologi tipe spermatogonia pada ikan gurami
Tipe
Keterangan: SSC: sel punca spermatogonia, SpA: Spermatogonia tipe A, SpT: spermatogonia transisi, SpB: spermatogonia tipe B.
Huruf superskrip yang berbeda setelah angka pada kolom yang sama menunjukkan beda nyata (P<0,05). Angka adalah rata-rata±SD, n=3.
Berdasarkan penelitian Yano et al. (2008), hanya spermatogonia tidak terdiferensiasi yang terkolonisasi pada resipien ikan rainbow trout. Spermatogonia ikan rainbow trout tidak terdiferensiasi ini dikategorikan sebagai SpA dengan ukuran diameter sel sekitar 15 µm. Spermatogonia terdiferensiasi atau SpB yang berukuran sekitar 10 µm tidak terkolonisasi. Namun demikian pada hewan mencit telah dibuktikan bahwa SpA terdiferensiasi (SpA1-4) juga dapat terkolonisasi, meskipun dengan efisiensi kolonisasi yang rendah (Barocca et al. 2009).
berukuran 992±35 µm dan 251±9 µm atau ukuran diameter sel SpA dan SpB pada ikan nila masing-masing 16,28 µ m dan 12,38 µm. Dengan demikian diameter sel SpA ikan nila dan ikan gurami ini tidak berbeda jauh dengan spermatogonia ikan gurami, meskipun secara taksonomi kedua ikan ini telah terpisah pada tingkat ordo. Berdasarkan hasil identifikasi tipe sel spermatogonia pada Tabel 1 dan beberapa rujukan diameter sel donor spermatogonia yang berhasil terkolonisasi pada beberapa jenis ikan air tawar (Okutsu et al. 2006b, Lacerda et al. 2010), diduga spermatogonia yang memiliki peluang terkolonisasi pada ikan gurami adalah yang dikategorikan sebagai SSC dan SpA dengan diameter sel masing-masing 18,63±1,90 µm dan 15,96±1,53 µm, atau dapat dikatakan bahwa sel spermatogonia yang memiliki peluang untuk terkolonisasi adalah sel yang berdiameter antara 14,43 hingga 20,53 µm.
Evaluasi Testis Ikan Gurami sebagai Sumber Donor pada Beberapa Tahap Perkembangan Berdasarkan Bobot Tubuh
Berbeda dengan ikan air tawar pada umumnya, ikan gurami belum dapat diidentifikasi jenis kelaminnya berdasarkan ciri-ciri seks sekunder pada umur muda. Dari 10 ekor ikan gurami berbobot tubuh <500 g yang diduga jantan, hanya 3 ekor yang gonadnya teridentifikasi jantan setelah dilakukan pemeriksaan di bawah mikroskop dengan bobot tubuh rata-rata 301±88 g. Pada kelompok ikan dengan bobot tubuh 500–1000 g dan >1000 g, jenis kelamin jantan sudah dapat dikenali berdasarkan ciri-ciri sekundernya, yaitu memiliki benjolan atau nonong pada dahinya dan pangkal sirip dadanya yang putih bersih tanpa pigmen. Bobot tubuh rata-rata ikan gurami dari kelompok 500-1000 g adalah 733±104 g sedangkan dari kelompok > 1000 g bobot tubuh rata-rata ikan gurami yang digunakan adalah 1393±261 g. Pengelompokan berdasarkan bobot tubuh dilakukan karena hingga saat ini belum ada informasi yang jelas tentang tahap perkembangan gonad pada ikan gurami.
Bendsen et al. 2001, Segatelli et al. 2004). Pada penelitian ini digunakan grid 10x10 dengan luas grid 220x170 µm2.
Hasil kuantifikasi sel testikular preparat histologis testis ikan gurami pada berbagai bobot tubuh dapat dilihat pada Tabel 2 dan Lampiran 2. Frekuensi relatif rata-rata SSC pada testis dari kelompok ikan gurami <500 g tidak berbeda nyata (P>0,05) dengan testis dari kelompok ikan gurami 500–1000 g dan lebih tinggi dibandingkan dengan kelompok ikan gurami berbobot tubuh >1000 g. Nilai FR rata-rata SpA, SpT dan SpB tertinggi (P<0,05) terdapat pada testis dari kelompok ikan gurami berbobot tubuh 500–1000 g. Jenis sel selain spermatogonia tampak mendominasi pada semua kelompok dengan perbedaan tidak nyata (P>0,05).
Tabel 2 Frekuensi relatif rata-rata (%) spermatogonia dari jaringan testis ikan gurami pada berbagai bobot tubuh (g)
Tipe sel <500 g
Keterangan: SSC: sel punca spermatogonia, SpA: Spermatogonia tipe A, SpT: spermatogonia transisi, SpB: spermatogonia tipe B, SL: sel germinal derivat sel spermatogonia dan sel-sel somatik, BT: bobot tubuh, IGS: indeks gonada somatik.
Huruf superskrip yang berbeda setelah angka pada baris yang sama menunjukkan beda nyata (P<0,05). Angka adalah rata-rata±SD, n=3.
Berdasarkan studi karakteristik morfologi spermatogonia ikan gurami sebelumnya diketahui bahwa jenis sel yang memiliki peluang terkolonisasi adalah SSC dan SpA. Dengan demikian berdasarkan hasil perhitungan kelimpahan spermatogonia pada Tabel 2 maka ikan gurami yang terbaik dijadikan sebagai sumber donor adalah yang berasal dari kelompok dengan kisaran bobot tubuh 500–1000 g karena memiliki populasi SSC yang relatif besar, jumlah SpA tertinggi serta jumlah SL (sel derivat spermatogonia dan sel somatik) yang terendah dibandingkan testis ikan yang berasal dari kedua kelompok bobot tubuh ikan gurami lainnya.
Kelayakan testis dari kelompok ikan berbobot tubuh 500–1000 g sebagai sumber donor juga tampak pada profil penampang melintang jaringan histologis testis (Gambar 3). Penampang melintang jaringan histologis testis pada Gambar 3 menggambarkan bahwa pada ikan dengan bobot <500 g, tubulus yang berisi sel-sel germinal hanya mengisi sebagian dari rongga gonad dan sebagian lagi terisi oleh jaringan-jaringan somatik sehingga besarnya nilai FR dari komponen SL pada ikan berbobot tubuh <500 g didominasi oleh sel-sel somatik. Beda halnya dengan kelompok ikan dengan bobot tubuh >1000 g yang hampir seluruh bagian testis tersusun atas tubulus yang berisi sel germinal sehingga tingginya jenis sel selain spermatogonia disebabkan oleh melimpahnya jumlah sel testikular tahap spermatosit dan spermiogenik.
Berdasarkan hasil evaluasi profil penampang melintang jaringan histologis testis, sumber sel donor terbaik dari penelitian ini adalah testis dari kelompok ikan gurami dengan bobot tubuh berada dalam kisaran 500 g hingga 1000 g dengan bobot rata-rata 733±104 g karena memiliki frekuensi relatif SSC dan SpA yang tinggi dan SL yang lebih rendah. Faktor lain yang perlu dipertimbangkan adalah bahwa ikan gurami dengan bobot tubuh >500 g lebih mudah diidentifikasi jenis kelaminnya melalui ciri-ciri sekundernya dibandingkan ikan gurami dengan bobot tubuh <500 g.
Gambar 3 Penampang melintang histologis testis ikan gurami. A. Kelompok ikan bobot tubuh <500 g (344 g,IGS=1,75x10-4), B. Kelompok ikan bobot tubuh 500–1000 g (700 g, IGS=1,97x10-4), C. Kelompok ikan bobot tubuh > 1000 g (1,6kg,IGS=1,19x10-4).
Sp;spermatogonia,Tb:tubulus,Js:jaringan somatik,Ta:tunika albuginea. Skala: 100 µm. Pewarnaan : Hematoksilin-Eosin.
dalamnya termasuk 10.000 spermatogonia) ke resipien dan jumlah sel yang terkolonisasi pada resipien hanya berkisar 1–9 sel per resipien. Demikian halnya pada hewan mamalia seperti tikus memiliki peluang kolonisasi sel donor spermatogonia pada gonad resipien hanya sekitar 7–20% dari 100 SSC yang ditransplantasikan (Nagano et al. 1999).
Semakin sedikit jumlah spermatogonia yang terkandung dalam suspensi sel yang disuntikkan tentunya akan semakin sedikit peluang sel yang dapat terkolonisasi. Berbagai macam teknik digunakan para peneliti untuk mengisolasi sel spermatogonia dari populasi sel testikular namun untuk teknik-teknik tersebut membutuhkan teknologi tinggi dan biaya yang cukup besar. Mencari sumber donor berdasarkan ukuran, umur atau bobot tubuh merupakan teknik yang paling sederhana untuk mendapatkan sumber donor yang kaya akan spermatogonia.
KESIMPULAN
1. Karakter diameter sel, volume sel dan volume sitoplasma dapat dijadikan karakter pembeda ke empat tipe spermatogonia ikan gurami, yaitu SSC, SpA, ST, dan SpB.
2. Sel spermatogonia ikan gurami yang memiliki peluang terkolonisasi adalah yang memiliki ukuran diameter sel 14,43 µm hingga 20,53 µm.
ABSTRAK
Disosiasi jaringan testikular untuk mendapatkan suspensi sel donor yang mengandung populasi sel spermatogonia banyak dan viabilitas tinggi merupakan teknik dasar yang menunjang keberhasilan transplantasi. Pada penelitian ini dilakukan pengujian jenis larutan disosiasi dan lama inkubasi terhadap jumlah dan viabilitas sel spermatogonia yang dihasilkan pascadisosiasi. Dua jenis larutan disosiasi yang diuji, yaitu larutan A: tripsin 0,5% dalam PBS (phosphate buffered solution) , dan larutan B dengan komposisi: tripsin 0,5%, dan DNase 10 unit/µL dalam PBS dilengkapi dengan 1 mM CaCl2, 25 mM HEPES, dan 5% FBS (fetal bovine serum). Lama inkubasi dalam larutan disosiasi adalah 1, 2, 3, 4, dan 5 jam. Setiap perlakuan dilakukan 3 ulangan. Testis segar didisosiasi pada masing-masing larutan hingga mendapatkan suspensi sel testikular. Jumlah sel spermatogonia yang berdiameter >10 µm dihitung menggunakan hemositometer dan viabilitas sel diidentifikasi menggunakan pewarna trypan blue; sel yang hidup (viable) terlihat transparan, sedangkan yang mati berwarna biru. Hasil penelitian menunjukkan bahwa jumlah rata-rata sel spermatogonia hasil disosiasi menggunakan larutan B lebih banyak (P<0,05) dibandingkan larutan A, sedangkan viabilitas sel spermatogonia pada kedua jenis larutan tidak berbeda (P>0,05). Lama waktu inkubasi tidak berpengaruh nyata terhadap jumlah sel (P>0,05), namun berbeda nyata terhadap viabilitas sel. Hasil uji lanjut menunjukkan bahwa viabilitas sel hingga lama masa inkubasi 3 jam belum berbeda nyata dengan lama inkubasi 1 dan 2 jam. Dengan demikian dapat disimpulkan bahwa larutan disosiasi B lebih baik dari larutan A untuk disosiasi jaringan testikular ikan gurami, dan masa inkubasi optimum dalam larutan B adalah 3 jam.
Kata kunci: testis, spermatogonia, ikan gurami, disosiasi, viabilitas .
III. THE DISSOCIATION OF TESTICULAR TISSUE ON
GIANT GOURAMI
ABSTRACT
Testis dissociation is the first necessary steps to obtain highly amount and viable population of spermatogonia as donor cells for transplantation. This research examined the effect of two methods of testis dissociations (i.e. medium A contained 0.5% trypsin in PBS (phosphate buffered solution) and medium B contained 0.5% trypsin and DNase 10 IU/µL in PBS complemented with 1 mM CaCl2, 25 mM HEPES and 5% FBS (fetal bovine serum). We also determined the optimum incubation time (1, 2, 3, 4 and 5 hours) in dissociation medium. Freshly isolated testis of immature giant gouramy were minced in dissociation medium and then incubated to get monodisperce cell suspension. Parameters observed were the number and viability of spermatogonia (ø > 10 µm). The viability was analyzed using trypan blue exclusion dye, a cell with blue color indicated a death cell. The results showed that the average number of spermatogonia observed in medium B was higher than in medium A (P<0.05), meanwhile the viability of spermatogonia between medium A and B were not significantly different (P>0.05). The viability of spermatogonia decreased by the increasing of duration time of dissociation, however the amount of spermatogonia were not different significantly by the increasing of duration time of incubation. Post hoc test
Key words: testis, spermatogonia, giant gourami, dissociation, viability.
PENDAHULUAN
Tahap pertama yang dilakukan untuk mendapatkan spermatogonia sebagai sel donor adalah disosiasi jaringan gonad testis dengan tujuan memisahkan sel-sel gamet dari bagian atau jaringan pengikat tempatnya melekat, dan menghilangkan bagian-bagian yang nekrotik, pembuluh darah dan lemak yang menempel. Jaringan dapat didisosiasi secara mekanik melalui proses pencacahan dan pemipetan secara perlahan-lahan. Cara lain adalah secara enzimatik, yaitu dengan menggunakan enzim-enzim tertentu seperti tripsin, kolagenase, elastase, hyaluronidase, DNase, pronase atau variasi dari beberapa jenis enzim dalam larutan dapar atau medium tertentu sampai diperoleh suspensi sel tunggal (Worthington 2003). Selain bertujuan untuk mendapatkan suspensi sel testikular yang tunggal, teknik disosiasi yang efektif seharusnya menghasilkan suspensi sel yang memiliki viabilitas tinggi dan dapat meminimumkan terjadinya proses agregasi sel kembali pascadisosiasi (Freshney 2005). Oleh karena itu berbagai macam teknik disosiasi pada hewan vertebrata dilakukan oleh para peneliti untuk mendapatkan suspensi sel yang memiliki kriteria-kriteria tersebut, namun sedikit sekali yang menjelaskan teknik disosiasi pada ikan.
Penelitian disosiasi jaringan testikular pada ikan masih sangat terbatas (Takeuchi et al. 2003, Hong et al. 2004, Okutsu et al. 2006b, Lacerda et al. 2008). Sementara itu, disosiasi jaringan dapat berbeda-beda pada setiap jenis hewan dan jaringan karena setiap hewan atau jaringan memiliki karakteristik anatomi yang berbeda-beda khususnya yang berkaitan dengan besarnya jaringan pengikat antar tubulus pada testis dan kekuatan membran tunika yang membungkus testis (Kim et al. 2006). Selain jenis dan asal jaringan yang digunakan, umur hewan, tipe enzim, dan larutan dapar atau medium serta lama inkubasi jaringan dalam larutan disosiasi juga menentukan efektivitas proses disosiasi (Worthington 2003). Oleh karena itu, untuk mendapatkan suspensi sel spermatogonia ikan gurami yang dapat digunakan sebagai sel donor, dibutuhkan uji coba metode disosiasi yang tepat untuk jaringan gonad ikan gurami.
menggunakan dua enzim pengurai, yaitu tripsin dan DNase untuk mendapatkan suspensi sel testikular tunggal dari jaringan testis ikan nibe. Tripsin dikenal sebagai enzim pengurai yang kuat, sedangkan DNase merupakan enzim pengurai yang lemah (Worthington 2003). Tripsin bertugas melepaskan matriks ekstraseluler glikoprotein dari sel dan sekaligus menguraikan sisa-sisa matriks yang terdapat dalam larutan disosiasi (Jones & Werb 1980). Sementara DNase pada beberapa kasus ditambahkan ke dalam larutan disosiasi untuk menghindari terjadinya penggumpalan sel akibat pelepasan DNA bebas dari sel-sel yang mati selama proses disosiasi (Crabbe et al. 1997). Kombinasi dari kedua enzim ini diharapkan juga dapat meningkatkan jumlah sel spermatogonia tunggal dalam suspensi sel testikular yang dihasilkan pascadisosiasi.
Beberapa penelitian melaporkan bahwa dalam proses disosiasi jaringan, enzim dapat menyebabkan efek kerusakan pada sel (Nicosia et al. 1975, Bellve et al. 1977, Du et al. 2006). Lama waktu inkubasi dalam larutan disosiasi yang mengandung enzim merupakan faktor yang penting diketahui dalam melakukan disosiasi. Hal ini bertujuan untuk menghindari kerusakan pada sel-sel selama proses disosiasi berlangsung. Oleh karena itu pada penelitian ini juga dilakukan pengujian lama waktu inkubasi terhadap hasil disosiasi yang meliputi jumlah dan viabilitas sel spermatogonia. Metode disosiasi dengan larutan disosiasi yang tepat dan waktu inkubasi yang optimum diharapkan dapat menghasilkan suspensi sel spermatogonia ikan gurami dalam jumlah dan viabilitas yang tinggi. Metode disosiasi yang efektif akan memperbesar peluang keberhasilan transplantasi spermatogonia pada ikan khususnya pada ikan gurami.
BAHAN DAN METODE
skapel atau gunting dalam 1 mL larutan disosiasi dan diinkubasi pada suhu ruang masing-masing selama 1, 2, 3, 4 dan 5 jam.
Larutan disosiasi pertama terdiri atas larutan tripsin (Worthington) 0,5% dalam Phosphate Buffered Saline/PBS (selanjutnya diberi nama larutan A) dan larutan disosiasi kedua terdiri atas larutan tripsin 0,5% dan 30 µL DNase 10 IU/µL dalam larutan PBS yang telah ditambahkan 5% fetal bovine serum/FBS (Sigma), 1 mM CaCl2 dan 25 mM HEPES (selanjutnya diberi nama larutan B). Setiap 30 menit inkubasi, suspensi sel dipipet dengan perlahan-lahan agar jaringan ikat cepat terlepas dari sel. Setelah masa inkubasi selesai, suspensi sel hasil disosiasi disaring menggunakan nylon screen steril dengan ukuran 35 μm untuk menghilangkan jaringan-jaringan yang tidak diinginkan. Untuk menghilangkan aktivitas tripsin, suspensi sel dicuci dengan PBS sebanyak 2 kali. Percobaan ini diulang sebanyak tiga kali dengan rancangan acak lengkap faktorial pada lima taraf lama waktu inkubasi.
Parameter yang diamati adalah jumlah dan viabilitas sel spermatogonia yang berdiameter >10 µm atau sebesar satu skala pada pembesaran lensa objektif mikroskop 10x. Sebanyak 10 µL suspensi sel hasil disosiasi diwarnai dengan menggunakan pewarna vital trypan blue 0,4% (1:1). Sel yang mati akan terwarnai oleh trypan blue sehingga terlihat berwarna biru, sedangkan yang hidup akan tetap terlihat transparan. Jumlah total sel spermatogonia dan jumlah sel spermatogonia yang mati dihitung menggunakan hemositometer di bawah mikroskop. Viabilitas dihitung berdasarkan persentase jumlah sel spermatogonia yang hidup per jumlah total sel spermatogonia.
Jumlah dan viabilitas sel spermatogonia pada setiap perlakuan dianalisis dengan sidik ragam. Perbedaan antar perlakuan diuji dengan Duncan multiple range test (DMRT). Data diolah dengan menggunakan program SPSS 17.0 dan MS Office Excell 2007.
HASIL DAN PEMBAHASAN
berdasarkan perbedaan ukuran diameter sel. Sel punca spermatogonia (SSC) adalah sel spermatogonia yang paling mudah dikenali karena memiliki ukuran yang terbesar dengan membran sel yang lebih tipis dan transparan (Gambar 4B). Sel spermatogonia lainnya hanya dapat dibedakan berdasarkan ukuran diameter selnya. Dengan pewarnaan trypan blue, sel-sel yang mati tampak berwarna biru (Gambar 4C), sedangkan sel-sel yang transparan adalah sel-sel testikular yang masih hidup.
Gambar 4 Suspensi sel testikular ikan gurami pascadisosiasi. A. Tipe-tipe sel spermatogonia. B. Sel punca spermatogonia dengan membran sel yang tipis (kepala panah adalah membran sel). C. Sel yang mati berwarna biru setelah pewarnaan dengan trypan blue. Skala 20 µm. SSC = sel punca spermatogonia, SpA = spermatogonia A, SpT = spermatogonia transisi, SpB = spermatogonia B.
Pengaruh Lama Waktu Inkubasi dan Jenis Larutan Disosiasi terhadap Jumlah dan Viabilitas Sel Spermatogonia