PADA TANAMAN MANGGIS (Garcinia mangostana)
RD. SELVY HANDAYANI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi Rekayasa Teknologi Sambung Mikro dan Setek Mikro Pada Tanaman Manggis (Garcinia mangostana)
adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Agustus 2012
RD. SELVY HANDAYANI. Engineering Technology of Micrografting and Microcutting in Mangosteen (Garcinia mangostana). Supervised by ROEDHY
POERWANTO, SOBIR, AGUS PURWITO, TRI MUJI ERMAYANTI.
The purpose of this study was to assemble propagation technology in mangosteen plant using micrografting and microcutting. This study consisted of four experimental steps, 1) in vitro bud induction technology development from bud
explants of mangosteen seedling shoot, 2) physiology and anatomy studies of micrografting in mangosteen, 3) in vitro medium manipulation on mangosteen microcutting; 4) optimization of microcutting acclimatization on mangosteen with sterile porous medium technique (MSP) / in vitro soil-less propagation (IVS). The results of experiment I showed that the best medium for shoot induction phase was MS + BA 4,0 + TDZ 0,2 mg/l, MS + BA 8,0 BA + TDZ 0,2 or MS + BA 4,0 mg /l. Medium multiplication could not obtain shoot multiplication, only addition of nodes and elongation of shoots. The best medium for shoot elongation was medium MS + BA 1 mg/l + KIN 1 mg/l. Experiment II showed that the rootstock derived from a single intact seed germination was better success than other treatments in almost all the observed variables, such as flush shoot that was better success than dormant shoot. There are several factors that determine the success of micrografting, which is width of meristem encounter between the rootstock and scion, the equal cell growth rate between rootstock and scion cells, as well as the similarity in size and structural congeniality between rootstock and scion. The results of anatomical tissue observation (4 months after micrografting) indicated that there was a good graft union on micrografting. Roostsock and scion xylem tissue were fused perfectly. Experiment III results showed that the concentration of 25% MS medium concentration on various substrates with or without the addition of IBA might cause 50-80% of microcutting rooted with the root length between 1,8 to 4,38 cm. Experiment IV results showed that microcutting carried out using MSP technique could grow roots, even at the microcutting that were untreated with root growth stimulating substances. Microcutting that planted using a MSP technique with IBA and Rootone-F treatments at varied concentrations could cause mangosteen microcutting 100% rooted with the root length from 3,44 to 6,88 cm.
pada tanaman manggis (Garcinia mangostana). Dibimbing oleh ROEDHY
POERWANTO, SOBIR, AGUS PURWITO, TRI MUJI ERMAYANTI.
Biji manggis memiliki sifat apomitik yaitu terbentuknya embrio tanpa proses penyatuan sel kelamin jantan dan betina. Organisme apomitik pada umumnya tidak memiliki variasi genetic, namun ternyata ditemukan adanya beberapa klon lokal yang merupakan sumber keragaman genetik tanaman manggis. Klon-klon lokal yang memiliki banyak keunggulan itu banyak tersebar di Indonesia. Oleh karenanya perbanyakan cepat klon-klon lokal tersebut melalui perbanyakan vegetatif yang sesuai mutlak diperlukan. Perbanyakan vegetatif tanaman manggis umumnya dilakukan dengan penyambungan (grafting), dengan menggunakan tunas plagiotrop sebagai batang atas. Kelemahan dari pemakaian tunas ini adalah bibit manggis hasil sambungan seringkali tumbuh kerdil dan pertumbuhan terhambat. Hasil sambungan manggis yang menggunakan batang atas tunas orthotrop tidak menunjukkan hambatan pertumbuhan, namun jumlah tunas orthorop pada manggis sangat terbatas dan sulit dijangkau karena tumbuh di bagian atas tanaman. Perbanyakan cepat batang atas tersebut dapat dilakukan dengan sistem perbanyakan in vitro. Oleh karena itu dilakukan serangkaian
penelitian untuk mendapatkan metode perbanyakan bibit manggis secara in vitro,
sambung mikro, setek mikro, serta media aklimatisasi steril (MSP)/In vitro Soil-less Propagation (IVS). Secara umum penelitian ini bertujuan untuk merakit
teknologi perbanyakan tanaman manggis dengan cara sambung mikro dan setek mikro.
Bagian I penelitian ini adalah pengembangan teknologi induksi tunas manggis in vitro dari eksplan mata tunas pucuk bibit manggis. Percobaan
dilakukan untuk mengetahui metode perbanyakan in vitro untuk penyediaan bahan
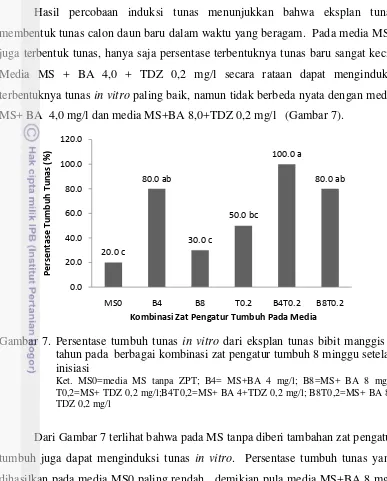
perbanyakan manggis. Hasil percobaan menunjukkan bahwa eksplan mata tunas pucuk dari bibit manggis 4 tahun dapat ditanam secara in vitro untuk membentuk
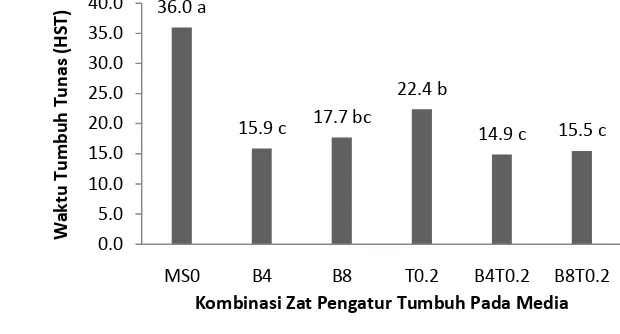
tunas, dan selanjutnya dijadikan sebagai bagian tanaman yang dapat menjadi sumber perbanyakan tanaman. Media terbaik untuk tahap induksi tunas, adalah media MS + BA 4,0 + TDZ 0,2 mg/l, MS + BA 8,0 BA + TDZ 0,2 atau MS + BA 4,0 mg /l. Media multiplikasi belum dapat menghasilkan multiplikasi tunas, hanya penambahan buku dan pemanjangan tunas. Media terbaik untuk pemanjangan tunas adalah media MS + BA 1 mg/l + KIN 1 mg/l.Pada percobaan
ini sudah didapatkan tunas in vitro, namun belum berhasil tumbuh akar. Tunas ini
selanjutnya digunakan sebagai salah satu sumber batang atas pada percobaan sambung mikro. Tunas yang dihasilkan masih terlalu kecil dan ruas bagian bawah tunas masih terlalu pendek sehingga tidak dapat digunakan sebagai bahan perbanyakan untuk percobaan setek mikro.
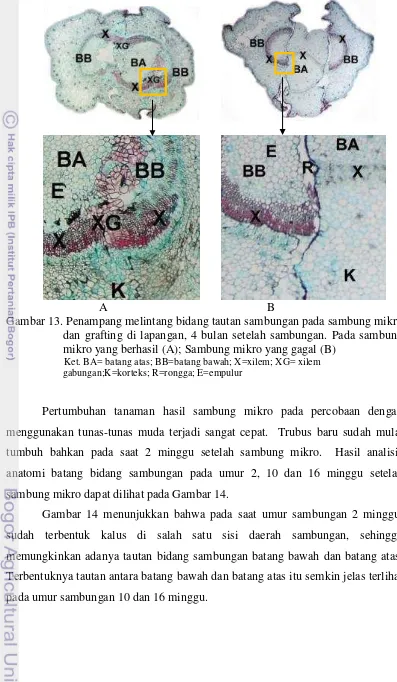
pada batang atas yang menggunakan tunas yang sedang dalam stadia trubus, seringkali tidak ditemukan stagnasi pertumbuhan, karena beberapa hari setelah penyambungan sudah terlihat pertumbuhan trubus muda yang membesar menuju ke arah pertumbuhan daun baru. Tunas muda (in vitro maupun semai) memiliki
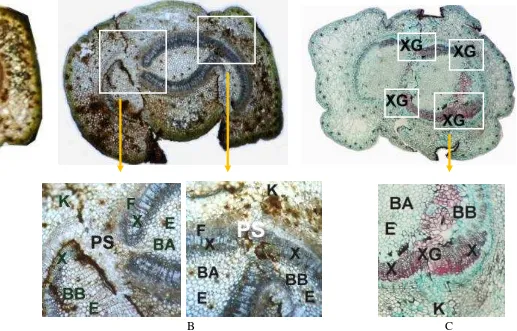
kecepatan pertumbuhan yang tinggi karena pada tunas muda masih sangat banyak mengandung sel-sel meristematis. Hasil pengamatan anatomi pada daerah sambungan menunjukkan bahwa pembentukan kalus yang sangat aktif terjadi di kedua sisi, baik pada batang bawah maupun batang atas. Keseimbangan laju pertumbuhan sel batang bawah dan batang atas ini menyebabkan proses pertautan sambungan terjadi lebih cepat. Pada sambung mikro antara tunas-tunas muda, kalus tumbuh cepat sehingga luas pertautan permukaan meristem batang atas dan batang bawah menjadi lebih lebar. Pembentukan kalus yang cepat dapat menjadi jembatan penghubung antara batang bawah dan batang atas. Hal ini akan menjamin ketersediaan nutrisi bagi kelangsungan pertumbuhan sambungan yang juga menjadi faktor penentu keberhasilan sambungan.
Pada pengamatan bentuk dan ukuran diameter batang dan jaringan pembuluh batang manggis terlihat ada kesesuaian bentuk dan ukuran batang bawah dan batang atas dari tunas-tunas muda. Hal ini akan sangat memudahkan terbentuknya penyatuan lingkaran jaringan pembuluh antara batang bawah dan batang atas, sehingga pertumbuhan selanjutnya lebih baik.
Hasil sambung mikro dengan batang bawah dan batang atas berbeda usia atau pada hasil sambungan (grafting) di lapangan menunjukkan keberhasilan yang rendah, dan pertumbuhan hasil sambungan berlangsung lebih lambat. Hal ini disebabkan karena usia batang bawah dan terutama batang atas sudah lanjut. Batang bawah berumur 2 – 3 tahun, sedangkan batang atas bisa berumur puluhan tahun, sehingga jumlah jaringan meristem tidak sebanyak tunas muda.
Bagian III adalah percobaan setek mikro secara in vitro dengan
memanipulasi media tumbuh. Hasil Percobaan setek mikro secara in vitro dengan
cara memanipulasi media tanam menunjukkan bahwa setek batang yang dilakukan secara in vitro pada perlakuan yang tepat dapat tumbuh akar. Akar tumbuh baik
pada media MS yang diencerkan (MS 25%), dan pada media dengan konsentrasi agar-agar dikurangi atau menggunakan substrat vermikulit yang diberi larutan MS cair. Konsentrasi komposisi media MS 25% pada berbagai substrat yang diberi atau tanpa diberi IBA memberikan pengaruh yang sangat baik bagi persentase tumbuh akar dan panjang akar setek mikro manggis in vitro.
Bagian IV adalah percobaan setek mikro yang dilakukan di pesemaian dengan teknik Media Steril Porous (MSP)/In vitro Soil-less Propagation (IVS).
teknik MSP memiliki diameter yang lebih kecil daripada diameter akar hasil perkecambahan biji manggis konvensional di pesemaian. Akan tetapi hal ini tidak mempengaruhi efektifitas penyerapan hara. Kandungan N, P, K, dan gula total daun tanaman hasil setek mikro dan perkecambahan biji tidak menunjukkan perbedaan yang nyata.
© Hak cipta milik IPB, tahun 2012 Hak cipta dilindungi undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
RD. SELVY HANDAYANI
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor
pada Program Studi Agronomi dan Hortikultura
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Penguji Luar Komisi
Ujian Tertutup : 1. Dr. Ani Kurniawati, SP., M.Si.
Departemen Agronomi dan Hortikultura Fakultas Pertanian
Institute Pertanian Bogor
2. Dr. Ir. Ketty Suketi, M.Si.
Departemen Agronomi dan Hortikultura Fakultas Pertanian
Institut Pertanian Bogor
Ujian Terbuka : 1. Dr. Ir. Saptowo J. Pardal, M.Si.
Peneliti Bioteknologi Balai Besar Litbang
Bioteknologi dan Sumberdaya Genetik Pertanian Badan Litbang Pertanian
2. Dr. Ir. M. Rahmad Suhartanto, M.Si. Staf Pengajar Departemen Agronomi dan Hortikultura Fakultas Pertanian
Nama Mahasiswa : Rd. Selvy Handayani
NIM : A262070041
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. Roedhy Poerwanto, MSc Prof. Dr. Ir. S o b i r, MS
Ketua Anggota
Dr.Ir. Agus Purwito, MSc.Agr Dr. Tri Muji Ermayanti
Anggota Anggota
Diketahui
Ketua Program Studi Agronomi Dekan Sekolah Pascasarjana IPB dan Hortikultura
Prof. Dr. Ir Munif Ghulamahdi, MS. Dr. Ir. Dahrul Syah, MSc.Agr
atas rahmat dan hidayat-Nya penelitian dan penulisan Disertasi ini berhasil diselesaikan. Penelitian ini dibiayai oleh Program Riset Unggulan Strategis Nasional (RUSNAS) melalui Pusat Kajian Buah-Buahan Tropika, LPPM-IPB, dan Program Kerjasama Kemitraan Penelitian Pertanian dengan Perguruan Tinggi (KKP3T) tahun 2010.
Pada kesempatan ini penulis mengucapkan rasa terimakasih yang tulus kepada:
1. Prof. Dr. Ir. Roedhy Poerwanto, MSc., Prof. Dr. Ir. Sobir, MS, Dr. Ir. Agus Purwito, MSc.Agr., Dr. Tri Muji Ermayanti, selaku komisi pembimbing yang telah memberikan kepercayaan dan bimbingan selama penelitian sampai penyusunan Disertasi.
2. Prof. Dr. Ir. Munif Ghulamahdi, MS selaku Ketua Program Studi Agronomi dan Hortikultura dan seluruh dosen Program Studi Agronomi yang selalu memberikan dukungan.
3. Dr. Ani Kurniawati, SP., MSi. dan Dr. Ir. Ketty Suketi, MSi., selaku penguji luar komisi pada saat ujian tertutup yang telah banyak memberikan saran. Kepada Dr. Ir. Darda Effendi, MS dan Dr. Ir. Winarso Dr. Widodo, MS selaku penguji luar komisi pada saat ujian prakualifikasi lisan bersama Dr. Ir. Maya Melati, MSc. sebagai wakil Program Studi Agronomi dan Hortikultura.
4. Dr. Ir. Saptowo J. Pardal, MSi. dan Dr. Ir. M. Rahmad Suhartanto, MSi. selaku penguji luar komisi pada saat ujian sidang terbuka, serta Dr. Ir. Eny Widajati sebagai wakil Program Studi Agronomi dan Hortikultura.
5. Rektor dan Dekan Fakultas Pertanian Universitas Malikussaleh Aceh Utara, yang memberikan kesempatan untuk mengikuti program S3 di IPB. 6. Direktorat Jenderal Pendidikan Tinggi, yang telah memberikan beasiswa
BPPS.
Rahmad Suhartanto MS, Dr. Ir. M. Firdaus, MSi., Dr. Eddy Santoso MS, Sulassih, SP., MSi., Endang Gunawan SP., MSi., Kusuma Darma SP. MSi., Heri Harti SP. MSi, Rena Destriani Amd., Rika Lesmawati Amd., Naekman Naiboho SP, Mar’ah SP, dan Ubaydillah SP., Bapak Sulaeman, Pipit, teh Imas, Rizal di Laboratorium PKHT-IPB, mas Joko Mulyono lab Mikroteknik IPB, mas Yudi lab Molekukuler IPB, dan mas Bambang di lab Analisis Tanaman dan Kormatografi IPB, serta Mbak Wido dan pak Ujang Hafid di Puslit Biologi LIPI-Cibinong, atas bantuan dan kerjasamanya selama penelitian berlangsung
8. Pak Ibram, mas Awang, pak Ade, bu Yuyun serta seluruh karyawan Kebun Percobaan Tajur atas segala bantuannya.
9. Teman-teman seperjuangan Departemen Agronomi dan Hortikultura mayor ITB, AGH, dan PBT angkatan tahun 2007, 2008, 2009.
10. Teman-teman FORSCA, IKAMAPA, serta ikhwan-akhwat HIMMPAS IPB atas dukungannya.
11. Ibunda Rd. Sumirat Puranegara, Ayahanda Rd. Trisana Sumadipura (Alm), teh Ance, teh Tia, Teh Dewi, Susi, K’Ndien (alm.), K’Lukman, Apa Fuad, dan Apep.
12. Ibu dan ayah mertua Cut Hendon dan Muhammad Yunus (alm.), K’Nu, Bang Din, K’Asmara, K’Ni, Bang Yan.
13. Suami tercinta Ismadi Yunus, SP., M.Si atas pengorbanan, ketulusan, kesabaran dan pengertian yang telah diberikan selama in dan ananda M. Dzaky Ramadhan (Alm)
14. Semua pihak yang telah membantu dan memberikan dukungan selama pendidikan S3.
Akhirnya, diiringi doa semoga seluruh kegiatan studi ini bernilai ibadah dihadapan Allah SWT, baik bagi penulis maupun semua pihak yang terlibat di dalamnya, semoga hasil-hasil penelitian ini dapat didayagunakan lebih lanjut bagi kemaslahatan masyarakat maupun bagi kemajuan ilmu pengetahuan.
Penulis dilahirkan di Bandung pada tanggal 11 September 1968, adalah anak keempat dari lima bersaudara pasangan Rd. Trisana Sumadipura dan Rd. Sumirat Puranegara. Penulis menyelesaikan pendidikan dasar di SDN Sudirman 1 Purwakrta pada tahun 1981, SMP Negeri 2 Purwakarta tahun 1984, dan SMA Negeri 1 Purwakarta tahun 1987. Penulis melanjutkan di Universitas Padjadjaran Bandung Fakultas Pertanian dan lulus pada tahun 1992. Tahun 1996 penulis diangkat sebagai dosen honorer di Fakultas Pertanian Universitas Garut, dan pada tahun 2001 penulis diterima sebagai staf pengajar di Fakultas Pertanian Universitas Malikussaleh Aceh Utara sampai saat ini. Tahun 2000 penulis melanjutkan pendidikan Master di Institut Pertanian Bogor pada Program Studi Agronomi dan lulus tahun 2004. Pada tahun 2007 penulis mendapat kesempatan untuk melanjutkan ke jenjang doktor pada Program Studi Agronomi dan Hortikultura (AGH) Institut Pertanian Bogor.
Selama mengikuti program S3, penulis menyajikan karya ilmiah berjudul
Pengaruh Berbagai Jenis Batang Bawah dan Batang Atas untuk Keberhasilan Mikrografting Manggis pada Seminar Nasional Perhimpunan
Hortikultura Indonesia di Bali pada bulan November 2010. Pada Seminar Nasional Perhimpunan Hortikultura Indonesia di Bandung pada bulan Oktober 2011 penulis juga menyajikan karya ilmiah berjudul “Induksi Perakaran Tunas Manggis In vitro dengan Cara Manipulasi Media”. Sebuah artikel akan
diterbitkan pada Jurnal Agronomi Indonesia Vol. XL, No. 3 Desember 2012, dengan judul “Pengaruh Batang Bawah dan Jenis Tunas pada Mikrografting Manggis (Garcinia mangostana L.) Secara In vitro”. Karya ilmiah tersebut
DAFTAR TABEL ……….
Studi Fisiologi dan Anatomi Keberhasilan Sambung Mikro
Tanaman Manggis………...……….. Manipulasi Media pada Setek Mikro Manggis Secara In vitro...
Optimalisasi Aklimatisasi Setek Mikro Manggis
dengan Teknik Media Steril Porous (MSP)...
Studi Fisiologi dan Anatomi Keberhasilan Sambung Mikro
Tanaman Manggis………...……….. Manipulasi Media pada Setek Mikro Manggis Secara In vitro...
Optimalisasi Aklimatisasi Setek Mikro Manggis
dengan Teknik Media Steril Porous (MSP)...
Pembentukan Tunas Adventif ……….……….. 77
Sambung Mikro ……… 81
Setek mikro ……… 85
Masalah dan Pendekatan Masalah ………….……… 93
KESIMPULAN DAN SARAN
Kesimpulan ………..……….
Saran ………..……… 107 108
DAFTAR PUSTAKA………. 109
Halaman
1 Persentase pertumbuhan tunas dan jumlah buku tunas manggis ... 52
2 Pertumbuhan tanaman hasil sambung mikro antara
batang bawah tunas in vitro dengan batang atas tunas in vitro…… 55
3 Pertumbuhan tanaman hasil sambung mikro antara batang bawah tunas in vitro dengan batang atas tunas in vitro dari
eksplan tunas bibit manggis 4 tahun ……… 56
4 Pertumbuhan tanaman hasil sambung mikro antara batang bawah tunas kecambah di pesemaian dengan batang atas tunas
kecambah di pesemaian……… 57
5 Pertumbuhan tanaman hasil sambung mikro antara batang bawah tunas kecambah di pesemaian dengan batang atas
tunas in vitro……… 58
6 Rataan ukuran diameter (panjang dan lebar) batang dan jaringan pembuluh batang in vitro, semai, dan batang tunas bibit
manggis yang ditanam secara in vitro……… 60
7 Rataan ukuran diameter (panjang dan lebar) batang dan jaringan pembuluh batang seedling, batang plagiotrop, dan
batang in vitro……… 66
8 Pengaruh konsentrasi komposisi media MS, jenis substrat dan konsentrasi IBA terhadap pertumbuhan setek mikro
4 bulan setelah perlakuan……… 68
9 Pengaruh konsentrasi komposisi media MS, jenis substrat, dan konsentrasi IBA terhadap diameter akar dan diameter
jaringan pembuluh akar 4 bulan setelah perlakuan………. 71
10 Diameter akar dan jaringan pembuluh, kandungan hara N, P, K, dan gula total daun dari tanaman hasil percobaan setek mikro dan
kecambah biji di pesemaian pada 4 bulan setelah perlakuan…….. 71 11 Pertumbuhan kecambah semai manggis pada berbagai
media tanam 3 bulan setelah tanam……… 72
12 Pertumbuhan setek mikro teknik MSP dan konvensional 3 bulan
13 Pertumbuhan setek mikro teknik MSP yang diberi IBA dan
Rootone-F 3 bulan setelah tanam……… 74
14 Diameter akar dan diameter jaringan pembuluh pada perlakuan
IBA dan Rootone-F 4 bulan setelah perlakuan……… 76
15 Diameter akar dan jaringan pembuluh, kandungan hara N, P, K, dan gula total daun dari tanaman hasil percobaan setek mikro
MSP dan kecambah biji di pesemaian pada 4 bulan setelah
Halaman
1 Alur kerja penelitian…….………. 9
2 Tipe sambung mikro batang atas C. ledgeriana dengan
batang bawah C. succirubra(a) tipe V dan (b) tipe L………….. 22
3 Model regulasi penghantaran signal auksin-pengaturan ekspresi gen dengan menghilangkan faktor yang
menghambat proses transkripsi (protein reseptor)
dari gen target………. 25
4 Mekanisme persepsi terhadap signal sitokinin sebagai
model pada system pensignalan dua komponen……… 27
5 Eksplan tunas bibit manggis 4 tahun……….. 31
6 Pertumbuhan tunas manggis in vitro dari eksplan tunas bibit
manggis 4 tahun ………. 49
7 Persentase tumbuh tunas in vitro dari eksplan tunas bibit manggis
4 tahun pada berbagai kombinasi zat pengatur tumbuh
8 minggu setelah inisiasi……… 50
8 Waktu tumbuh tunas in vitro dari eksplan tunas bibit manggis
4 tahun pada berbagai kombinasi zat pengatur tumbuh
8 minggu setelah inisiasi……… 51
9 Pertambahan panjang tunas manggis yang dilakukan pada
media MS dengan penambahan BA dan kinetin……… 52
10 Hasil perbanyakan in vitro biji manggis yang memiliki
tunas majemuk lebih dari 15 tunas……… 53
11 Hasil sambung mikro manggis... 55
12 Tanaman hasil sambung mikro 6 bulan setelah sambungan
dan 15 bulan setelah sambungan……….…… 59
13 Penampang melintang bidang tautan sambungan pada mikrografting dan grafting di lapangan, 4 bulan
14 Anatomi daerah sambungan sambung mikro pada umur 2 minggu (A), 10 minggu (B), dan 16 minggu (C) setelah sambung
mikro... 62
15 Proliferasi kalus pada percobaan sambung mikro... 64
16 Penampang melintang bidang tautan sambungan pada sambung mikro dan grafting di lapangan, 4 bulan setelah
sambungan... 65
Halaman
1 Prosedur penetapan N total dengan metode Kjeldahl……… 117
2 Metode penentuan fosfor dan kalium……….………... 118
3 Prosedur pengamatan mikroskopis (Metode Parafin)……… 119
4 Cara penetapan gula total, gula pereduksi, dan sukrosa………… 122
5 Komposisi kimiawi sekam……… 123
6 Pelaksanaan sambung mikro in vitro teknik sambung celah V
tanpa pengikatan di daerah sambungan……… 124
7 Pelaksanaan sambung mikro di pesemaian teknik sambung celah V dengan dilakukan pengikatan di daerah sambungan
embrio yang berasal dari suatu titik tumbuh yang tidak lazim.
Aklimatisasi : Masa adaptasi planlet dari lingkungan fisik aseptik terkendali ke lingkungan tanah.
Apomiksis .
: Reproduksi melalui bentuk seperti biji tetapi tanpa melalui penyerbukan
Cocopeat : media tanam yang dapat digunakan sebagai
pengganti tanah, berasal dari sabut kelapa yang diambil seratnya (cocofiber), sehingga menghasilkan butiran-butiran halus
Eksplan
. : Bagian tanaman yang digunakan sebagai bahan untuk inisiasi suatu kultur misalnya kultur in vitro
Floem : Pembuluh pada kulit kayu bagian dalam pada batang
yang berguna untuk mendistribusikan protein dan karbohidrat, merupakan serangkaian sel yang membentuk pembuluh ayak, mempunyai sel dasar berupa sel tapis yang berdinding sel tipis.
In vitro : Di dalam tabung atau di dalam botol kultur
dipelihara pada laboratorium
In vivo : Di dalam tanaman utuh yang tumbuh di rumah kaca
atau di lapang.
Juvenil : Suatu periode tanaman sebelum fase generatif, ketika pembungaan tidak terjadi dan tanaman tidak dapat dirangsang untuk berbunga dengan ZPT atau perangsang pembungaan lainnya.
Kalus : sekumpulan sel amorphous (tidak berbentuk atau belum terdiferensiasi) yang terbentuk dari sel-sel yang membelah terus menerus
Media steril porous (MSP)/in vitro soil-less propagation (IVS)
Meristem : Jaringan tanaman yang terdiri dari sel-sel hidup dan berdinding tipis yang mampu membelah berulang-ulang sangat aktif
Planlet : Tanaman lengkap hasil regenerasi kultur in vitro
Sistem jaringan vaskuler
: Sistem yang dibentuk oleh xilem dan floem diseluruh tumbuhan, yang berfungsi sebagai sistem transpor untuk air (xilem) dan nutrien (floem).
Zat pengatur tumbuh (ZPT)
: Semua senyawa baik alami maupun sintetik yang dalam konsentrasi rendah dapat mengatur (merangsang atau menghambat) pertumbuhan dan perkembangan sel atau tanaman. Dapat dikatakan bahwa semua hormon adalah ZPT, tetapi tidak semua ZPT adalah hormon.
Tunas orthotrop : Tunas yang tumbuh secara vertikal pada batang utama tanaman manggis.
Tunas plagiotrop : Tunas yang tumbuh secara horizontal pada batang tanaman manggis.
Vermikulit : Media anorganik yang dihasilkan dari pemananasan kepingan-kepingan mika serta mengandung Potassium dan Helium, serta memiliki kemampuan kapasitas tukar kation yang tinggi terutama dalam keadaan padat dan pada saat basah.
Manggis (Garcinia mangostana) memiliki peran penting dalam industri
buah nusantara, karena memiliki rasa, aroma dan warna yang sangat digemari konsumen dalam maupun luar negeri. Permintaan pasar terhadap buah manggis memiliki prospek yang baik. Manggis merupakan salah satu buah yang mempunyai nilai ekonomi tinggi di Indonesia. Volume ekspor manggis terus meningkat, dari 5.697 ton dengan nilai U$ 3,612 juta tahun 2006 menjadi 11,388 ton dengan nilai U$ 8,754 juta tahun 2010 (BPS 2012).
Biji manggis bersifat apomitik, karena terbentuk tanpa proses fertilisasi, melainkan melalui perkembangan jaringan nuselus. Sifat apomiksis mengakibatkan sifat genetik turunan identik dengan induknya (Fauza et al. 2003).
Tumbuh-tumbuhan apomitik dianggap tidak memiliki variasi genetik, namun hasil penelitian Mansyah (2012) mengungkapkan adanya keragaman genetik pada manggis, beberapa diantaranya klon lokal unggul. Variasi genetik dijumpai pada tanaman induk dari berbagai lokasi maupun antar tanaman induk dan keturunannya. Untuk pohon induk yang mewakili populasi tanaman dari berbagai lokasi variasi genetiknya sebesar 56,6 % (Mansyah 2003).
Perbanyakan vegetatif tanaman manggis umumnya dilakukan dengan penyambungan (grafting), karena manggis sulit berakar sehingga sukar/tidak dapat diperbanyak dengan cara setek, perundukan, pemisahan, atau dengan cangkok (Ashari 1995). Perbanyakan dengan grafting juga dapat mempercepat kematangan reproduktif tanaman dan produksi buah lebih awal. Batang bawah untuk perbanyakan grafting manggis adalah bibit semai berumur 2-3 tahun, sedangkan batang atasnya adalah cabang plagiotrop dari tanaman yang sudah berproduksi di lapangan. Cabang plagiotrop adalah cabang yang tumbuh secara horizontal pada tanaman manggis dewasa.
2
pertumbuhannya terhambat, bahkan mengalami stagnasi pertumbuhan. Hal ini disebabkan karena lingkaran jaringan pembuluh pada cabang plagiotrop mengalami disorientasi akibat pemelintiran batang sehingga kondisi ini mempersulit usaha untuk mendapatkan kontak kambium yang optimal antara batang bawah dan batang atas (Tirtawinata 2003).
Beberapa tanaman manggis yang disambungkan dengan cabang orthotrop (cabang yang tumbuh secara vertikal pada tanaman manggis dewasa), menunjukkan pertumbuhan yang baik dan tidak kerdil (Tirtawinata 2003). Tantangan dari penggunaan cabang orthotrop sebagai batang atas adalah jumlahnya sangat terbatas dan tumbuh di bagian atas pohon sehingga sulit dijangkau. Usaha mendapatkan perbanyakan tunas dari cabang orthotrop secara massal dapat dilakukan dengan sistem perbanyakan in vitro.
Perbanyakan in vitro selain dari biji dengan tujuan multiplikasi tunas
manggis sudah banyak dilakukan, misalnya dari eksplan daun muda bibit dan pohon dewasa (Goh et al. 1990), atau daun muda dari kultur in vitro (Te-chato &
Lim 2000). Percobaan mengenai pembentukan tunas melalui regenerasi tanaman secara in vitro melalui organogenesis langsung (dari daun muda) maupun
organogenesis tidak langsung (dari daun muda melalui fase kalus), juga sudah berhasil dilakukan (Qosim 2006). Permasalahan yang dihadapi adalah belum tumbuh akar dari tunas-tunas manggis in vitro tersebut.
Upaya pengakaran tunas manggis in vitro yang belum berakar tersebut
dapat dilakukan dengan dua pendekatan. Tunas manggis yang tidak dapat berakar tersebut dapat langsung disambungkan dengan tunas manggis hasil perkecambahan biji yang sudah berakar. Pengakaran tunas juga dapat dilakukan dengan menginduksi pertumbuhan tunas manggis melalui setek mikro. Oleh karena itu penelitian sambung mikro dan setek mikro pada tanaman manggis menjadi penting untuk dipelajari.
Sambung mikro (micrografting) pada tanaman, berasal dari kata micro
(kecil/kecil sekali) dan grafting (penyambungan), artinya penyambungan bagian tanaman pada keadaan masih sangat kecil/muda. Naz et al. (2007) menyatakan
atau teknik sambung mikro in vitro yaitu teknik penyambungan potongan batang
atas pada batang bawah dalam kultur jaringan (Toruan-Mathius et al. 2006).
Percobaan mengenai berbagai teknik sambung mikro secara in vitro telah
banyak dilakukan sebelumnya pada berbagai tanaman, misalnya pada alpukat (Raharjo & Litz 2003), pistacia (Onay et al. 2003), kina (Toruan-Mathius et al. 2006;
Toruan-Mathius et al. 2007), protea (Wu et al. 2007), jeruk (Naz et al. 2007; Singh et al.
2008). Sambung mikro juga dilakukan di pesemaian misalnya pada tanaman arabidopsis (Turnbull et al. 2002), pistacia (Onay et al. 2003), jeruk (Naz et al. 2007),
dan kaktus (Moghadam et al. 2012).
Setek mikro adalah suatu teknik pembiakan mikro, dengan menggunakan batang tanaman dengan ukuran mini. Pada tanaman kentang proses setek dapat dilakukan bahkan pada tanaman yang baru memiliki 1-3 node (Jasminarni 2007). Pada teknik ini dapat diambil langsung bagian tanaman (tunas) untuk ditanam pada media, supaya tumbuh akar dan selanjutnya dapat tumbuh menjadi individu baru.
Teknik setek mikro dapat dilakukan dalam keadaan aseptik melalui kultur jaringan, maupun saat pembibitan di pesemaian. Penelitian mengenai setek mikro sudah banyak dilakukan pada berbagai jenis tanaman. Beberapa contoh penelitian setek mikro, misalnya pada tanaman apel (De Klerk 2002), kentang (Jasimarni 2007), cherry (Lamrioui et al. 2009), zaitun (Haq et al. 2009), maupun karet
(Harris et al. 2010).
Pada tanaman manggis teknik perbanyakan tanaman melalui setek (batang, daun, tunas, akar) belum pernah dilakukan, karena manggis merupakan tanaman yang sulit untuk berakar. Setek mikro yang dilakukan pada penelitian ini dilakukan dengan melakukan setek batang pada tunas manggis hasil perbanyakan
in vitro. Tunas manggis dipotong sepanjang 3 cm dan ditanam pada media yang
dapat menginduksi perakaran. Penanaman setek mikro hasil perkecambahan biji dilakukan secara in vitro dengan memanipulasi media tumbuh, maupun di
4
Pengakaran setek mikro yang dilakukan di pesemaian dengan menggunakan teknik Media Steril Porous (MSP) atau dikenal juga dengan istilah
In Vitro Soi-less Propagation (IVS), dapat menyebabkan tunas mikro dapat
berakar dan siap untuk tumbuh di lapangan. MSP adalah teknik perbanyakan tanaman dengan menggunakan media yang porous dan steril, dengan sistem aerasi yang lebih baik dibandingkan dengan sistem perbanyakan konvensional yang menggunakan berbagai campuran media tanam. Penelitian di Australia menunjukkan bahwa teknik ini telah dapat meningkatkan perakaran setek mikro tanaman Chamelaucium sebesar 42-82% (Newell 2006). Akan tetapi penelitian
MSP sendiri masih sangat sedikit publikasinya, dan belum ada metode yang baku, sehingga perlu dilakukan penelitian agar diperoleh perlakuan yang sesuai untuk proses pengakaran manggis.
Perumusan Masalah
Perbanyakan tanaman manggis mengalami banyak kendala, diantaranya pertumbuhan tanaman yang lambat karena sistem perakaran yang buruk. Kendala lainnya adalah perbanyakan tanaman manggis secara vegetatif konvensional masih belum berhasil dengan baik karena tanaman yang diperbanyak secara vegetatif mempunyai ukuran bervariasi, lemah, tumbuh sangat lambat (Normah et al. 1995; Cruz 2001).
species Garcinia. Satu-satunya cara mendapatkan tunas orthotrop secara massal adalah
dengan teknik kultur jaringan (perbanyakan in vitro)
Perbanyakan tunas manggis in vitro dari eksplan tunas manggis di
pesemaian atau di lapangan belum pernah dilakukan, karena sulitnya proses sterilisasi. Oleh karena itu salah satu tahap penelitian ini adalah mendapatkan bahan perbanyakan tunas in vitro dari eksplan tunas manggis umur 4 tahun di
pesemaian. Pada berbagai penelitian sudah dapat dihasilkan tunas manggis in vitro yang berasal biji maupun daun (daun muda atau dewasa). Kesulitan yang
dihadapi adalah tunas in vitro dari eksplan daun tidak dapat tumbuh akar,
sehingga harus dicari cara mengakarkan tunas-tunas in vitro tersebut. Cara
pengakaran tunas in vitro pada penelitian ini dilakukan dengan dua cara. Yang
pertama, tunas in vitro yang gagal tumbuh akar dapat disambungkan dengan tunas
batang bawah yang sudah berakar (sambung mikro). Cara kedua adalah mengakarkan tunas in vitro secara langsung dengan cara memanipulasi media
tumbuh secara in vitro, maupun perlakuan di pesemaian (setek mikro). Setek
mikro yang dilakukan di pesemain akan dicoba diakarkan dengan menggunakan teknik Media Steril Porous (MSP) / In Vitro Soil-less Propagation (IVS).
Melalui teknik kultur jaringan, akan dapat disediakan bahan tanaman batang bawah maupun batang atas secara massal, tidak dipengaruhi musim, seragam dan tidak membutuhkan waktu yang lama. Sambung mikro diharapkan dapat menjadi solusi bagi tunas manggis yang gagal berakar, dengan cara menyambungkannya dengan tunas manggis yang sudah berakar. Penyediaan batang bawah juga dapat dipersingkat waktunya dibandingkan penyiapan batang bawah untuk sambungan di lapangan. Pada tanaman jeruk, tunas untuk batang bawah pada teknik sambung mikro in vitro dan pesemaian sudah dapat dilakukan
penyambungan sejak 2 minggu setelah biji berkecambah (Naz et al. 2007). Bagian
6
Teknik sambung mikro in vitro juga dapat dilakukan di pesemaian dengan
kondisi tanaman yang sama seperti pada sambung mikro in vitro. Teknik sambung
mikro akan memiliki laju pertumbuhan yang lebih baik dibandingkan grafting di lapangan. Hal ini karena batang usia muda memiliki jaringan meristem yang lebih banyak, sehinga proses penyembuhan luka akibat sayatan pada saat penyambungan lebih cepat pulih (Tirtawinata 2003). Oleh karena itu diharapkan pertumbuhan selanjutnya akan lebih baik.
Pada penelitian ini juga dilakukan teknik perbanyakan setek mikro. Perbanyakan dengan cara setek sudah sangat dikenal dan dilakukan sejak lama. Perbanyakan dengan setek lebih ekonomis, lebih mudah, tidak memerlukan keterampilan khusus dan cepat dibandingkan dengan cara perbanyakan vegetatif buatan lainnya. Selama ini tanaman manggis tidak diperbanyak dengan setek karena tanaman manggis tidak dapat berakar. Oleh karenanya informasi mengenai setek pada tanaman manggis belum pernah ada. Dengan pemberian berbagai zat pengatur tumbuh dan substrat yang dapat menginduksi pertumbuhan akar dan tunas diharapkan dapat menjawab permasalah tersebut.
Tahap aklimatisasi merupakan tahap yang sangat penting pada sistem perbanyakan kultur jaringan. Pada tahap ini tanaman hasil kultur jaringan diharapkan dapat beradaptasi dengan lingkungan tumbuh yang sebenarnya, sehingga dapat tumbuh berkembang di lapangan.
Percobaan sambung mikro dan setek mikro harus didukung dengan pertumbuhan akar yang baik agar menjamin kelangsungan pertumbuhan tanaman selanjutnya. Penelitian tentang Media Steril Porous (MSP) atau In Vitro Soi-less Propagation (IVS) pada setek mikro in vitro dan ex vitro beberapa tanaman
Tujuan Penelitian
Secara umum penelitian ini bertujuan untuk merakit teknologi perbanyakan tanaman manggis dengan cara sambung mikro dan setek mikro. Secara khusus penelitian ini bertujuan:
a. Mendapatkan metode perbanyakan in vitro untuk penyediaan bahan
perbanyakan manggis
b. Mendapatkan pemahaman tentang aspek fisiologi dan anatomi serta metode perbanyakan tanaman manggis dengan teknik sambung mikro.
c. Menginduksi perakaran setek mikro dengan cara manipulasi media kultur jaringan.
d. Menginduksi perakaran setek mikro manggis dengan cara media steril porous (MSP)/ In vitro Soil Propagation (IVS).
Hipotesis
a. Pemberian benzyl adenin, thidiazuron dan kinetin menyebabkan eksplan mata tunas pucuk bibit manggis dapat menghasilkan tunas in vitro.
b. Perbedaan area pertemuan meristem pada daerah sambungan akan berpengaruh terhadap keberhasilan penyatuan sambungan batang bawah dengan batang atas.
c. Penurunan konsentrasi komposisi media dan penurunan kepadatan substrat dapat menumbuhkan akar setek mikro manggis yang dilakukan secara in vitro.
e. Teknik Media steril porous (MSP)/In Vitro Soil-less (IVS) dapat
meningkatkan keberhasilan tanaman hasil setek mikro yang dapat tumbuh di lapangan.
Strategi Penelitian
Disertasi ini disusun berdasarkan empat topik penelitian. Topik penelitian pertama adalah “Pengembangan Teknologi Induksi Tunas Manggis In Vitro dari Eksplan Mata Tunas Pucuk Bibit Manggis” yang terdiri atas tiga tahap
8
Topik penelitian kedua adalah “Studi Fisiologi dan Anatomi Sambung Mikro Pada Tanaman Manggis”. Penelitian ini terdiri atas dua percobaan,
yaitu: 1) percobaan Sambung Mikro Secara In vitro dan 2) Sambung Mikro di
Pesemaian. Masing masing percobaan terdiri atas tiga sub percobaan berdasarkan sumber batang atasnya, yaitu dari sesama tunas muda (in vitro atau semai),
eksplan tunas dari mata tunas tanaman manggis dewasa yang telah berproduksi di lapangan, dan tunas in vitro dari eksplan tunas bibit manggis 4 tahun.
Topik penelitian ketiga adalah “Manipulasi Media Pada Setek Mikro Manggis Secara In Vitro”, dan topik penelitian keempat adalah “Optimalisasi Aklimatisasi Setek Mikro Manggis Dengan Cara Media Steril Porous (MSP)”. Bagan alur kerja penelitian yang menunjukkan keterkaitan antar
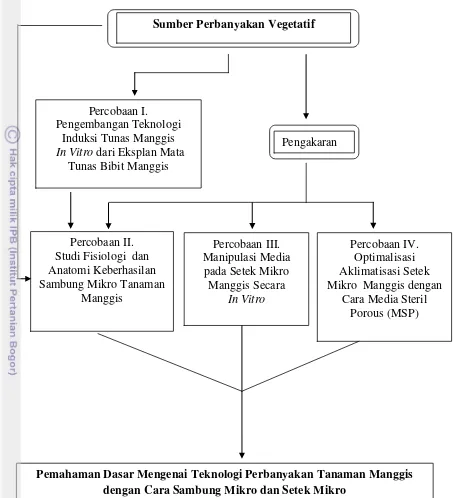
Gambar 1. Alur Kerja Penelitian Percobaan I. Pengembangan Teknologi
Induksi Tunas Manggis
In Vitro dari Eksplan Mata
Tunas Bibit Manggis
Percobaan III. Manipulasi Media
pada Setek Mikro Manggis Secara
In Vitro
Percobaan II. Studi Fisiologi dan Anatomi Keberhasilan Sambung Mikro Tanaman
Manggis
Percobaan IV. Optimalisasi Aklimatisasi Setek Mikro Manggis dengan
Cara Media Steril Porous (MSP)
Pemahaman Dasar Mengenai Teknologi Perbanyakan Tanaman Manggis dengan Cara Sambung Mikro dan Setek Mikro
Pengakaran
TINJAUAN PUSTAKA
Tanaman Manggis (Garcinia mangostana)
Buah manggis (Garcinia mangostana) selain digemari karena rasanya,
juga sangat bermanfaat untuk kesehatan tubuh karena diketahui mengandung xanthone sebagai antioksidan, antiproliferasi, antiinflamasi dan antimikrobial. Kulit buah manggis (pericarp) mengandung senyawa xanthone dan derifatnya
yaitu 3-isomangoestein, alpha mangostin, gamma-mangostin, garcinone A, garcinone B, C, D dan garcinone E, maclurin, mangostenol (Iswari dan
Sudaryono 2007).
Dari berbagai penelitian menunjukkan bahwa kandungan xanthone dan derivatnya efektif melawan kanker payudara, juga sebagai obat penyakit jantung. Khasiat garcinone E (devirat xanthone) ini jauh lebih efektif untuk menghambat kanker bila dibandingkan dengan obat kanker seperti flaraucil, cisplatin, vincristin, metohotrexete, dan mitoxiantrone. Kulit buah manggis bermanfaat sebagai obat karena mengandung xanthone yang sangat tinggi yaitu mencapai 123,97 mg/100ml, juga mengandung vitamin dan mineral lainnya seperti : vitamin B1 (mg) 20,66, vitamin B2 (mg)1.79, vitamin B6 (mg) 0,948, dan vitamin C (mg) 17,92 (Iswari dan Sudaryono 2007).
Manggis merupakan salah satu tanaman buah yang berasal dari Indonesia, kelezatan daging buah manggis juga disukai konsemen luar negeri. Permintaan pasar, terutama pasar luar negeri terhadap buah manggis selalu meningkat, dari 5,697 ton dengan nilai U$ 3,612 juta tahun 2006 menjadi 11,388 ton dengan nilai U$ 8,754 juta tahun 2010 (BPS 2012).
usaha pengembangan dan perbaikan produktivitas buah manggis adalah bibit bermutu dalam jumlah banyak dan tersedia dalam waktu singkat serta dengan harga yang terjangkau.
Masalah lambatnya pertumbuhan tanaman manggis telah banyak diidentifikasi. Ada beberapa penyebabnya, yaitu sistem perakaran yang lemah (perakaran manggis hanya terdiri dari satu akar tunggang dengan beberapa akar lateral tanpa bulu akar) (Cox, 1976). Tanaman manggis asal biji umumnya baru mulai berbuah setelah 10-15 tahun, tergantung pada pemeliharaan selama dipembibitannya. Di Malaysia, tanaman asal biji sudah mulai berbuah sektar lima tahun setelah tanam di lapangan (Hashim & Mamat 1991), di Cairns dan Darwin (Australia) pohon manggis berbuah pada umur 6-7 tahun (Wieble et al. 1992).
Manggis (Garcinia mangostana) termasuk ke dalam famili Guttiferae
merupakan tanaman yang berasal dari Asia Tenggara khususnya Thailand, Malaysia dan Indonesia (Nakasone & Paull 1999). Tanaman manggis menyebar ke timur sampai ke Papua Nugini dan Kepulauan Mindanau (Filipina), dan ke utara melalui Semenanjung Malaysia menyebar terus ke Thailand bagian selatan, Myanmar, Vietnam, dan Kamboja. Tanaman ini dijumpai tumbuh liar pada kisaran jenis tanah dan lokasi yang cukup luas.
Richard (1990) menjelaskan bahwa bunga manggis bersifat uniseksual dioecious (berumah dua), akan tetapi hanya bunga betina yang dapat dijumpai, sedangkan bunga jantan tidak berkembang sempurna (rudimenter), yaitu tumbuh kecil kemudian mengering dan tidak dapat berfungsi. Bunga betina terdapat pada pucuk ranting muda dengan diameter 5 – 6 cm, pedikelnya pendek, tebal dan panjangnya 1,8 – 2,0 cm terletak pada dasar bunga. Bunga memiliki empat sepal dan empat petal dengan tangkai bunga pendek dan tebal berwarna merah kekuning-kuningan. Bunganya tidak tahan lama, membuka pada sore hari dan petalnya segera jatuh setelah itu.
13
Perbaikan sifat tanaman manggis diarahkan untuk mendapatkan sifat pertumbuhan cepat, masa juvenil pendek, produktivitas tinggi, kualitas buah yang baik dan tahan terhadap hama dan penyakit. Rekombinasi genetik dengan teknik hibridisasi tidak dapat dilakukan karena benang sari tidak dapat berkembang (rudimenter) dan serbuk sari bersifat hampa (Richards 1990; Poerwanto 2000). .
Kultur Jaringan
Teknik kultur jaringan menurut Katuuk (1989) adalah sebagai teknik mikropropagasi atau in vitro propagation atau juga perbanyakan klon yang
istilah-istilah itu mempunyai arti yang sama yaitu teknik perbanyakan tanaman dengan menggunakan potongan kecil jaringan atau sel yang dipelihara dalam suatu media dan dikerjakan seluruhnya dalam kondisi aseptik. Untuk menjadi tanaman lengkap, pada teknik kultur jaringan dikenal ada beberapa metode regenerasi tanaman, yaitu organogenesis langsung (direct organogenenesis), organogenesis
tidak lansung (indirect organogenesis) dan embryogenesis somatic (somatic embryogenesis).
Media kultur jaringan dibedakan menjadi media dasar basal/basic medium dan media tambahan. Komposisi media dasar mengandung hara esensial
baik makro maupun mikro, sumber energi dan vitamin yang jumlah dan macamnya tergantung dari penemunya. Komposisi media perlakuan merupakan komposisi media tambahan yang dapat berupa vitamin, senyawa organik komplek atau zat pengatur tumbuh.
Zat pengatur tumbuh khususnya auksin dan sitokinin adalah suatu zat organik utama yang mengendalikan proses morfogenesis pada teknik kultur jaringan. Kepekaan jaringan terhadap zat yang ditambahkan pada media perlakuan khususnya zat pengatur tumbuh ditentukan oleh konsentrasi zat pengatur tumbuh yang sudah terdapat di dalam jaringan tersebut (Starling et al. 1986). Semakin
Media kultur jaringan tanaman selain menyediakan unsur hara makro dan hara mikro juga diberi karbohidrat yang pada umumnya berupa gula untuk menggantikan karbon. Gunawan (1988) mengemukakan bahwa pada umumnya media kultur jaringan dibedakan menjadi media dasar dan media perlakuan. Resep media dasar adalah resep kombinasi zat yang mengandung hara esensial (makro dan mikro), sumber energi dan vitamin. Media kultur jaringan dapat berupa media padat dan media cair. Bentuk media cair mempunyai keuntungan bahwa kontak eksplan dengan media adalah maksimum, hanya aerasi perlu diperbaiki dengan pengocokan media dan pemakaian botol kultur yang bentuknya dapat mempertinggi aerasi sebagai tempat media kultur. Pengaruh lain dari media bentuk cair adalah peningkatan unsur hara dan zat pengatur tumbuh dalam metabolisme zat - zat yang beracun akan berdifusi lebih efektif.
Media dalam bentuk padat didapatkan dengan menambahkan bahan pemadat/bahan pengental, misalnya agar-agar, phytagel dan gelatin. Arrilaga et al. (1992) menyatakan bahwa terjadi beda nyata pada perlakuan kekentalan media
(antara media padat dan media cair) dan komposisinya, khususnya formulasi garam atau unsur hara. Interaksi dari rata-rata jumlah tunas yang terbentuk pada setiap eksplan baik asal apikal maupun nodal. Dalam perkembangan komposisi media perlakuan, vitamin juga sering ditambahkan untuk membentuk komposisi media perlakuan berbagai macam vitamin. Jenis vitamin yang sering digunakan dalam kultur jaringajn adalah thiamin (vitamin B1). Thiamin merupakan vitamin yang esential dalam keberhasilan suatu kultur jaringan tanaman. Menurut George dan Sherington (1984) kemungkinan peranan thiamin adalah melalui keikutsertaannya dalam lintasan-lintasan asam D-galakturonat yang menghasilkan vitamin C dan pektin. Juga dilaporkan ada kemungkinan peranannya dalam inkorporasinya fosfoinasitida dan fosfatidil inositol yang berperan dalam pembelahan sel selama eksplan melakukan pertumbuhan dalam kultur jaringan.
15
untuk proses morfogenesis akar dan tunas biasanya dibutuhkan suatu imbangan taraf auksin dan sitokinin dalam media.
Dalam perkembangan teknik kultur jaringan dengan adanya zat pengatur tumbuh perlu dicari konsentrasi dan imbangan atau interaksi antara dua jenis zat pengatur tumbuh yang diberikan dalam media perlakuan dan yang diproduksi oleh sel/ jaringan secara endogen dapatmenentukan perkembangan dari suatu kultur. Penambahan auksin atau sitokinin eksogen mengubah level/taraf zat pengatur tumbuh endogen sel. Level/taraf zat pengatur tumbuh ini kemudian merupakan faktor pemicu atau penggerak untuk proses – proses yang tumbuh dan morfogenesisnya.
Kultur Jaringan pada Manggis
Perbanyakan manggis dengan cara in vitro dilakukan terutama untuk
tujuan menyediakan bibit manggis secara massal, seragam, dan sepanjang tahun. Hal yang sangat penting dalam proses kultur jaringan manggis adalah multiplikasi tunas, sehingga tujuan memperoleh bahan tanaman secara massal dapat terpenuhi. Perbanyakan in vitro tujuan multiplikasi tunas manggis sudah banyak dilakukan,
dapat dari perkecambahan biji, ataupun eksplan daun.
Perbanyakan in vitro untuk mendapatkan tunas adventif yang paling
mudah dan paling banyak dilakukan adalah dari segmen kotiledon yang ditanam pada media MS. Goh et al. (1988), melakukan penanam segmen kotiledon
manggis pada media MS dilengkapi dengan BAP konsentrasi 5,0 mg/L. Rostika
et al. (2005) menyatakan bahwa media MS ditambah BA 5,0 mg/L dapat
menginduksi tunas hingga 100% dengan jumlah tunas per biji 2,7 tunas. Demikian halnya yang dilakukan Qosim (2006), biji manggis yang ditanam pada media MS dengan penambahan BAP sebanyak 22,2 M dapat mengiduksi pertumbuhan tunas terbaik dengan rata-rata jumlah tunas per biji 1,7 tunas. Keberhasilan pembentukan tunas dari biji sangat tinggi, terutama karena pada manggis kemungkinan sel-sel embriogenik terdapat di sepanjang permukaan biji (Yaccob & Tindall 1995), sehingga biji bersifat poliembrioni.
Pembentukan tunas secara in vitro dapat pula dilakukan dari segmen
langsung adalah proses pembentukan tunas adventif langsung dari eksplan. Organogenesis tidak langsung adalah proses pembetukan tunas adventif melalui pembentukan kalus terlebih dahulu. Tunas adventif atau embrio somatik dapat dibentuk dari kalus jika konserntrasi zat pengatur tumbuh khususnya auksin rendah. Kalus dapat diperoleh dari berbagai spesies tanaman, akan tetapi tidak semua kalus dari spesies tanaman dapat diregenerasikan menjadi planlet tergantung dari sifat totipotensinya (Yeoman 1986).
Perbanyakan tunas in vitro dari eksplan daun sudah pernah dilakukan.
Goh et al. (1990) telah melakukan multiplikasi tunas dari eksplan daun muda bibit
dan pohon dewasa. Te-chato dan Lim (2000) juga menggunakan eksplan daun muda untuk mendapatkan tunas adventif.
Qosim (2006) telah berhasil mendapatkan tunas adventif dari eksplan daun melalui organogenesis langsung dan tidak langsung. Perlakuan organogenesis langsung adalah perbedaan konsentrasi BAP, yaitu 0,0; 11,1 ; 22,2 ; 33,3 ; 44,4 M. Penanaman dilakukan pada media MS dengan penambahan 3% gula pasir, 0,8% agar, dan 1,39 M PVP. Pada pembentukan tunas melalui organogenesis tidak langsung dilakukan dalam dua tahap percobaan. Tahap pertama adalah pembentukan kalus nodular dengan perlakuan konsentasi BAP 2,2 M dan 4,4 M, dan konsentrasi TDZ 1,14 M, 2,27 M, dan 4,54 M. Penanaman dilakukan pada media MS padat yang dilengkapi dengan 3% gula pasir, 1,39 M PVP, 0,8% agar murni. Tahap kedua adalah pembentukan tunas dari kalus nodular dengan kombinasi perlakuan 2,2 M BAP dan 2,27 M TDZ diregenerasikan menjadi planlet dengan menanam kalus nodular pada medium WPM ditambahkan 1,39 M PVP, 0,8% agar murni, 3% gula pasir.
Hasil penelitian yang dilakukan Qosim (2006) menunjukkan bahwa pembentukan tunas adventif manggis in vitro dapat dilakukan melalui tiga tipe
17
konsentrasi BAP 2,2 M. Pembentukan tunas asal biji pertumbuhannya relatif cepat dan menghasilkan banyak tunas dibandingkan ke dua tipe regenerasi lainnya. Tipe regenerasi organogenesis langsung dan tidak langsung waktu yang diperlukan untuk pertumbuhan tunas relatif. Tunas adventif yang dihasilkan melalui organogenesis tidak langsung sangat banyak. Perpanjangan tunas pada manggis in vitro sangat lambat dan belum berhasil dilakukukan induksi perakaran.
Sambung Mikro
Berbagai usaha memperbanyak bibit manggis telah dicoba dengan harapan dapat memperpendek masa juvenilnya. Penelitian untuk mempercepat pertumbuhan manggis telah dilakukan dengan pemupukan, pemberian zat pengatur tumbuh, atau modifikasi media tumbuh, tetapi hasilnya belum memuaskan. Perlakuan pemacuan pertumbuhan hanya mempercepat pertumbuhan 10-20%. Percobaan setek dan mencangkok mengalami kegagalan karena sulit menumbuhkan akarnya. Okulasi mata tempel juga sulit dilakukan karena mata tunasnya tersembunyi diantara dua tangkai daun yang berhadapan dan merupakan karakter khas species Garcinia (Tirtawinata 2003). Adapun cara yang memberi
harapan adalah penyambungan (grafting) dengan menggunakan semai sebagai batang bawah (calon perakaran) dan entris sebagai batang atasnya (calon tajuk).
Tirtawinata (2003) menyatakan bahwa, sambung pucuk merupakan metode yang paling sering digunakan pada penyambungan manggis dengan tingkat keberhasilan hingga 95%. Semai manggis yang telah berumur 18-36 bulan digunakan sebagai batang bawah dan disambung dengan entris dari pohon dewasa yang telah berbuah. Walaupun tingkat keberhasilan penyambungan tinggi, pertumbuhan selanjutnya dari batang atas sangat lambat. Pertambahan ruas dan daun (trubus) hanya terjadi 1-2 kali dalam setahun, bahkan seringkali terjadi stagnasi. Penyebab sebenarnya dari stagnasi pertumbuhan ini hingga sekarang belum diketahui, hanya diduga ada hubungannya dengan sistem perakaran manggis yang lemah dan ditambah dengan pertautan sambungan yang tidak sempurna.
yang dilakukan pada tanaman manggis in vitro (sambung mikro) diharapkan dapat
menjadi alternatif perbanyakan tanaman melalui sambungan, yang menjanjikan tingkat keberhasilan dan pertumbuhan selanjutnya yang tinggi.
Sambung mikro yang dilakukan secara in vitro adalah salah satu cara
perbanyakan vegetatif penyambungan tanaman yang dilakukan pada kondisi aseptik dengan menggunakan teknik kultur in vitro (Toruan-Mathius 2007). Hal
ini dilakukan untuk mempersatukan kedua batang atas dan batang bawah yang biasanya memiliki sifat unggul yang berbeda. Keunggulan sistem sambung mikro dibandingkan grafting biasa terutama adalah pada waktu yang diperlukan untuk mendapatkan tanaman batang bawah siap sambung yang jauh lebih singkat, yaitu hanya 3 bulan saja. Setelah tanaman disambungkan dan menghasilkan trubus baru (sekitar 2-3 bulan berikutnya), maka tanaman in vitro hasil sambung mikro
tersebut sudah dapat diaklimatisasi (Lukman 1998). Selain itu dalam kondisi mikro, perbedaan anatomi antara batang atas dan batang bawah tersebut kemungkinan belum terjadi. Batang muda yang digunakan sebagai batang bawah maupun batang atas memiliki jaringan meristem yang lebih banyak dibandingkan batang dewasa, sehingga proses penyembuhan luka akibat sayatan saat penyambungan lebih cepat pulih (Tirtawinata 2003). Oleh karenanya diperkirakan keberhasilan sambungan yang menghasilkan bibit terpacu menjadi lebih besar, sehingga jaminan pertumbuhan di lapangan menjadi lebih baik.
Estrada et al. (2002) menyatakan bahwa dengan teknik sambung mikro
dapat meremajakan tanaman, meregenerasi tanaman, menghasilkan tanaman yang bebas penyakit dan mempersingkat waktu dalam penyediaan bibit untuk dapat dipindah ke lapang. Mekanisme terjadinya pertautan pada sambung mikro sama dengan yang terjadi secara in vivo yaitu terjadinya kontak kambium antara batang
atas dan batang bawah dengan tepat.
Daya gabung (kompatibilitas) antara batang atas dan batang bawah merupakan hal yang penting, karena kompatibilitas mempengaruhi kelangsungan hidup tanaman hasil sambungan dan kemampuannya berproduksi. Pada saat tanaman dapat disambungkan, maka hubungan source dan sink bergantung pada
19
dan dapat berkembang menjadi suatu kesatuan yang utuh. Sebaliknya dapat pula terjadi inkompatibilitas yang dapat disebabkan oleh respon fisiologi antara kedua bagian yang disambungkan. Oleh karenaanya faktor penentu keberhasilan sambung mikro adalah kesesuaian batang atas dan bawah, proteksi selama masa penyembuhan penyatuan luka, dan pemulihan hasil sambungan (Obeidy dan Smith 1991).
Menurut Hartman et al. (2002), pada penyambungan yang kompatibel
terjadi lignifikasi dinding sel yang dapat menyatukan sel-sel yang berdekatan di luar daerah penyatuan sambungan. Sebaliknya dinding sel daerah penyatuan sambungan pada gabungan yang inkompatibel tidak menghasilkan lignin dan hanya dihubungkan oleh serat selulosa.
Sobhana et al. (2001) menyatakan bahwa interaksi batang bawah dengan
batang atas yang baik dapat mempercepat laju pertumbuhan planlet. Pada kombinasi batang bawah dan batang atas yang kompatibel menyebabkan proses metabolisme planlet dapat berlangsung dengan baik. Sebaliknya pada kombinasi yang tidak kompatibel proses metabolism planlet menjadi terganggu dan mengakibatkan pertumbuhan planlet terhambat.
Tirtawinata (2003) menyatakan bahwa posisi kambium batang bawah dengan batang atas sangat menentukan untuk perkembangan tanaman selanjutnya. Kontak kambium yang tidak tepat atau partial dapat mengakibatkan pertautan jaringan pembuluh antara batang bawah dengan batang atas tidak sempurna. Selanjutnya berakibat pada translokasi senyawa-senyawa penting untuk metabolisme pertumbuhan tanaman dari batang bawah ke batang atas atau translokasi hasil fotosintesis dari batang atas ke batang bawah tidak dapat berlangsung secara lancar. Dengan demikian semua aspek dalam penyambungan baik fisik, mekanis maupun fisiologis perlu diusahakan dalam kondisi seoptimal mungkin sehingga keberhasilan lebih terjamin. Pada tanaman hasil sambung mikro terjadi penyatuan antara dua sistem kehidupan yaitu sistem kehidupan batang bawah dan batang atas sehingga terjadi penyatuan, suatu proses alami yang kompleks.
dari penyambungan dengan batang bawah yang superior (Gebhardt dan Goldbach 1988). Teknik sambung mikro juga diharapkan dapat mengatasi masalah yang dialami apabila eksplan tidak berakar. Oleh karenanya teknik ini merupakan alternatif teknik produksi yang dapat dilakukan apabila tunas mikro sulit untuk berakar.
Hasil-Hasil Penelitian tentang Sambung Mikro
Pada tanaman alpukat telah dilakukan proses sambung mikro terutama pada tanaman alpokat hasil transformasi gen (Raharjo & Litz 2003). Hal ini dilakukan karena meskipun perkembangan embrio somatik alpukat normal, namun umumnya kehilangan sifat bipolarnya, yaitu umumnya tidak memiliki tunas apikal. Perkecambahan tunas umumnya menjadi nekrotik sehingga laju perkecambahan menjadi sangat rendah. Pada penelitian ini telah dilakukan kultur embrio alpukat yang telah ditransformasi dengan beberapa konstruksi gen, yang kemudian digunakan sebagai batang atas. Langkah selanjutnya adalah menyambungkan batang atas tersebut dengan kecambah alpokat in vitro yang
telah berumur 3-4 minggu. Teknik sambung mikro yang digunakan adalah sambung pucuk dengan sayatan berbentuk V pada bagian bawah batang atas, yang kemudian diselipkan pada potongan batang bawah. Keberhasilan teknik ini mencapai 70%.
Percobaan sambung mikro pada tanaman cherry (Prunus avium L.)
dilakukan oleh Amiri (2006). Perkembangan teknik sambung mikro in vitro pada
tanaman cherry penting dilakukan terutama untuk meremajakan jaringan dewasa dan juga untuk perbanyakan tanaman yang bebas penyakit. Pada percobaan ini digunakan batang bawah dari hasil perkecambahan in vitro biji cherry, sedangkan
batang atas adalah dari kultur tunas meristem cherry berasal dari tanaman cherry umur 4 tahun. Setelah kultur tunas meristem berumur 5-6 minggu baru digunakan sebagai sumber batang atas. Hasil penelitian menunjukkan bahwa keberhasilan sambung mikro ditentukan oleh metode dan ukuran tunasnya. Persentase keberhasilan tertinggi (65%) adalah pada sambung tunas pucuk dengan ukuran tunas batang atas lebih dari 6 mm dengan menggunakan metode sayatan huruf V. Pada percobaan sambung mikro Pistacia vera L. cv. ÒSiirtÓ (Onay et al.
21
eksplan hasil perkecambahan biji (10-14 hari) sebagai batang bawahnya. Tanaman disambungkan secara in vitro dengan metode sayatan huruf V, lalu
diikat dengan menggunakan pita parafilm. Tanaman hasil sambung mikro tersebut ternyata dapat tumbuh dengan baik bahkan ketika dipindahkan ke media tanah.
Pada tanaman jeruk, teknik sambung mikro digunakan untuk pengembangan tanaman jeruk bebas virus (Naz et al. 2007). Digunakan biji jeruk
Rough Lemon yang dikecambahkan secara in vitro sebagai batang bawah, dan
tunas yang diambil dari 2 kultivar jeruk sebagai batang atas. Tunas pucuk yang telah memiliki minimal 3 primordia daun, dipotong sepanjang 1-2 mm, lalu disambungkan dengan batang bawah dengan berbagai macam teknik sambung mikro. Hasil percobaan menunjukkan bahwa keberhasilan sambung mikro 34,7% pada tanaman dengan teknik sambung mikro metode sayatan huruf T terbalik.
Sambung mikro pada tanaman protea menggunakan planlet dari perkecambahan biji sebagai batang bawah (Wu et al. 2007). Bagian biji yang
dikecambahkan adalah bagian embrionya, yang ditanam tegak lurus pada media, dilakukan secara in vitro. Segmen tanaman berasal dari tanaman umur 1 tahun
yang ditanam di greenhouse digunakan sebagai batang atas. Tunas tanpa daun
yang memiliki 1-2 mata tunas dipotong, disterilisasi lalu ditanam di growth chamber selama 30 hari. Setelah itu tunas aksilarnya dipotong dan digunakan
sebagai batang atas. Dilakukan penyambungan dengan metode sayatan huruf V. Hasil percobaan yang terbaik adalah dengan menempatkan tunas batang atas mikro tersebut secara langsung di atas potongan batang bawah tanpa adanya pre treatment (pencelupan eksplan pada larutan antioksidan, atau pemberian media
pada di sekitar area sambungan).
Sambung mikro juga telah dilakukan pada tanaman jeruk bali (Hamaraie
et al. 2003). Menggunakan biji jeruk asam yang dikultur secara in vitro sebagai
batang bawah, dan tunas pucuk jeruk bali sebagai batang atas. Biji jeruk asam dikecambahkan secara in vitro, lalu setelah 2 minggu dipotong bagian akar dan
menempatkan mata tunas pada batang bawah dengan teknik sayatan bentuk huruf T terbalik.
Toruan-Mathius et al. (2006), melakukan percobaan sambung mikro pada
tanaman kina Cinchona succirubra dengan C. ledgeriana. Tujuan penelitian ini
adalah menetapkan tipe sambung mikro, medium terbaik untuk planlet hasil sambung mikro, dan perbanyakan tanaman kina dengan sambung mikro. Bahan tanaman yang digunakan sebagai batang atas adalah planlet Cinchona ledgeriana
klon QRC, sedang sebagai batang bawah digunakan planlet C. succirubra,
berumur empat bulan. Teknik sambung mikro yang digunakan adalah bentuk sambung tipe V dan L (Gambar 2).
Gambar 2. Tipe sambung mikro batang atas C. ledgeriana dengan batang bawah C. succirubra (a) tipe V dan (b) tipe L.
Sumber: Toruan-Mathius (2006)
23
Setek Mikro
Pembentukan akar adventif dari perbanyakan tunas mikro adalah fase wajib dalam regenerasi tanaman dan menentukan efektivitas dari setiap tanaman Dalam sistem perbanyakan in vitro (Haq et al. 2009). Pada tanaman dikotil, akar
adventif juga dapat beregenerasi dari batang (Visser et al. 1996). Pembentukan
akar merupakan faktor awal yang sangat penting selama selama pertumbuhan tanaman. Apabila setek telah dapat membentuk akar, maka kemampuan untuk tumbuh dan membentuk tunas akan lebih tinggi.
Keadaan persediaan makanan yang ada di dalam bahan setek mempunyai peranan penting terhadap pembentukan akar dan tunas setek. Bahan makanan yang terkandung di dalam bahan setek digunakan sebagai sumber energi sebelum setek hidup menjadi bibit. Pemilihan bahan setek didasarkan pada perimbangan keadaan karbohidrat dan senyawa nitrogen dalam setek (Hartman et al. 2002).
Beberapa faktor yang dapat mempengaruhi pembentukan akar adalah kondisi bagian tanaman sebagai bahan setek, lingkungan serta media tumbuhnya (Wuryaningsih & Andyantoro 1998). Setek batang sebagai material sangat menguntungkan, sebab batang mempunyai persediaan makanan yang cukup terhadap tunas-tunas batang dan akar (Rochiman dan Hariadi, 1973), dan juga dapat dihasilkan dalam jumlah besar.
Akan tetapi metode setek bukannya tanpa kendala, karena cara perbanyakan dengan metode setek akan kurang menguntungkan jika bertemu dengan kondisi tanaman yang sukar berakar, akar yang baru terbentuk tidak tahan stress lingkungan dan adanya sifat plagiotrop tanaman yang masih bertahan (Widiarsih et al. 2008). Oleh karenanya untuk memperbesar keberhasilan setek
harus diberi perangsang pertumbuhan akar (zat pengatur tumbuh), juga lingkungan yang mendukung kelangsungan pertumbuhan tanaman.
Teknik setek mikro dapat dilakukan dalam keadaan aseptik melalui kultur jaringan, maupun saat pembibitan di pesemaian. Penelitian mengenai setek mikro sudah banyak dilakukan pada berbagai jenis tanaman. Beberapa contoh penelitian setek mikro, misalnya pada tanaman apel (De Klerk 2002), kentang (Jasimarni 2007), cherry (Lamrioui et al. 2009), zaitun (Haq et al. 2009), maupun karet
Pada tanaman kentang setek mikro sudah dapat dilakukan pada tanaman yang sangat muda. Pengakaran tanaman kentang bahkan dapat dilakukan pada potongan kecambah yang baru 1 sampai 3 nodus. Nodus kentang tersebut kemudian juga dilakukan setek mikro dan ditanam pada styrofoam yang sudah
dilubangi, diberi pupuk NPK mutiara dan pupuk mikro. Hasil penelitian menunjukkan bahwa semua bahan tanamn setek kentang dapat tumbuh akar.
De Klerk melakukan setek mikro pada tanaman apel, mawar, dan gerbera. Penelitian tersebut membuktikan bahwa auksin sangat mempengaruhi pengakaran setek mikro. Pelukaan dan pemilihan jenis auksin yang tepat sangat penting untuk pengakaran in vitro. Hal penting lainnya adalah hubungan antara perakaran dan
setek mikro selama aklimatisasi. Penelitian tersebut menunjukkan bahwa bahan tanaman setek mikro berakar yang tumbuh baik selama aklimatisasi dapat dihasilkan dengan cara menghilangkan etilen atau dengan pemberian senyawa pelindung.
Setek mikro juga dapat dilakukan untuk tujuan peremajaan. Peremajaan tanaman dengan setek mikro banyak dilakukan pada tanaman kehutanan, misalnya jati (Sukmajaya dan Mariska 2003), Eucalyptus (Adinugraha et al. 2007), karet
(Harris et al. 2010).
Auksin dan Penghantaran Signal Auksin
Auksin merupakan salah satu contoh hormon tumbuh-tumbuhan yang secara luas mengatur proses perkembangan, memediasi regulasi transkripsi melalui degradari protein. Mekanisme molekular auksin baru dapat dimengerti secara terpisah sementara dasar molekuler bagi perkembangan khususnya respon auksin masih belum jelas. Studi biokimia dan biokimia-genetika akhir ini telah memperluas penelitian untuk pengaturan signal auksin. Respon auksin membutuhkan degradasi inhibitor Aux/IAA, yang menyebabkan dibebaskannya interaksi faktor transkripsi ARF yang kemudian dapat meregulasi gen target (Tan
et al. 2007).
25
tersedianya auksin di dalam tanaman ditambah pemacu auksin (Rooting Co-factors) yang secara bersama-sama mengatur sintesis RNA untuk membentuk primordia akar (Hartmann et al. 2002).
Harison (2006), menjelaskan bagaimana mekanisme penghantaran sinyal sehingga tanaman dapat memberikan respon terhadap adanya atau tidak adanya senyawa auksin. Hal tersebut dapat dijelaskan sebagai mekanisme fisiologis respon tanaman terhadap signal tertentu, yang dapat dibedakan menjadi tiga proses utama yaitu:
1. Penerimaan signal (signal perception): merupakan kemampuan untuk
mengenali dan menerima signal. Hal ini dapat berupa secara fisik terjadi pengikatan (binding) dari signal ke reseptor proteinnya atau terjadi perubahan konformasi protein dalam sitoplasma sebagai respon terhadap signal perubahan lingkungan. Signal perubahan lingkungan antara lain berupa cahaya atau perubahan orientasi terhadap gravitasi. Jika signal tertentu adalah faktor yang mengaktifkan proses penghantaran signal maka signal tersebut disebut sebagai penghantar signal primer (primary messenger).
2. Penghantaran signal (signal transduction): satu rangkaian proses biokimiawi
yang terinduksi setelah sel menerima signal. Proses penghantaran signal melibatkan induksi berbagai senyawa seluler yang terlarut dalam sitoplasma,
secondary messenger yang berfungsi melakukan amplifikasi signal yang
diterima sehingga akhirnya secara langusng berpengaruh terhadap fungsi seluler
3. Respon (response): respon terhadap signal dimanifestasikan sebagai
perubahan dalam fungsi seluler sebagai akibat adanya pengubahan fungsi protein, induksi proses degradasi protein, atau perubahan ekspresi gen. Respon yang spesifik dikarakterisasi berdasarkan ketersediaan target (enzim, protein, kanal ion, dan gen) dari tahapan penghantaran signal dalam suatu tipe sel tertentu. Dengan demikian berbagai tipe sel yang berbeda masing-masing akan dapat memberikan respon tertentu yang unik terhadap signal yang sama.