EKSTRAK Tithonia diversifolia (Hemsley) A. Gray SEBAGAI
INSEKTISIDA NABATI UNTUK PENGENDALIAN
ULAT DAUN KUBIS Plutella xylostella Linn.
(LEPIDOPTERA : YPONOMEUTIDAE)
EFRIN FIRMANSYAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul “Ekstrak Tithonia diversifolia (Hemsley) A. Gray sebagai Insektisida Nabati untuk Pengendalian Ulat Daun Kubis Plutella xylostella Linn.(Lepidoptera : Yponomeutidae)” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan da-lam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari pe-nulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2016
Efrin Firmansyah
RINGKASAN
EFRIN FIRMANSYAH. Ekstrak Tithonia diversifolia (Hemsley) A. Gray sebagai Insektisida Nabati untuk Pengendalian Ulat Daun Kubis Plutella xylostella Linn. (Lepidoptera : Yponomeutidae). Dibimbing oleh DADANG dan RULY ANWAR.
Ulat daun kubis, Plutella xylostella (Lepidoptera : Yponomeutidae) merupa-kan salah satu hama yang paling merusak pada tanaman kubis-kubisan. Umumnya petani menggunakan insektisida sintetik untuk mengendalikan hama ini. Aplikasi insektisida sintetik yang dilakukan secara terus-menerus dan secara tidak bijak-sana akan mengakibatkan munculnya kejadian resistensi, resurjensi dan dampak negatif terhadap lingkungan. Salah satu upaya yang dapat dilakukan untuk memi-nimalkan dampak negatif tersebut adalah dengan memanfaatkan bahan alam yang berpotensi untuk dijadikan sebagai insektisida nabati. Salah satunya adalah ta-naman Tithonia diversifolia (Asteraceae). Tujuan penelitian ini untuk mempelajari aktivitas ekstrak T. diversifolia sebagai insektisida nabati untuk pengendalian P. xylostella.
Penelitian dilakukan dalam beberapa tahap yang meliputi ekstraksi tumbuh-an, uji toksisitas ekstrak dengan metode residu pada daun dan aplikasi topikal, uji penghambatan makan dilakukan dengan metode pilihan dan tanpa pilihan, uji penghambatan perkembangan dan uji penghambatan peneluran. Uji keamanan ha-yati ekstrak dilakukan dengan uji toksisitas terhadap musuh alami hama, parasi-toid Diadegma semiclausum dan uji fitotoksisitas dilakukan pada tanaman broko-li.
Ekstrak bunga lebih tinggi aktivitas mortalitasnya terhadap P. xylostella dari pada ekstrak daun baik pada perlakuan dengan metode residu pada daun maupun aplikasi topikal. Ekstrak bunga pada konsentrasi 0.86% mengakibatkan tingkat penghambatan makan kuat (82.55%) dan ekstrak daun pada konsentrasi 0.97% mengakibatkan tingkat penghambatan makan lemah (54.90%) yang diuji dengan metode pilihan. Pengujian dengan metode tanpa pilihan menunjukkan baik ekstrak bunga pada konsentrasi 0.86% maupun daun pada konsentrasi 0.97% mengakibat-kan tingkat penghambatan mamengakibat-kan lemah yaitu berturut-turut 57.16% dan 59.7%. Ekstrak daun dan bunga T. diversifolia memberikan pula pengaruh penghambatan perkembangan dan penghambatan aktivitas peneluran P. xylostella. Ekstrak daun dan bunga T. diversifolia tidak berpengaruh negatif terhadap musuh alami dan ta-naman brokoli.
SUMMARY
EFRIN FIRMANSYAH. Extracts of Tithonia diversifolia (Hemsley) A. Gray as a Botanical Insecticide to Control The Diamondback Moth Plutella xylostella Linn. (Lepidoptera : Yponomeutidae). Supervised by DADANG and RULY ANWAR.
The diamondback moth, Plutella xylostella (Lepidoptera : Yponomeutidae) is one of the most destructive pests on cruciferous plants. Generally, farmers use synthetic insecticides to control this pest. Intensive and improper applications of syntethic insecticides have led to increase selection pressure for insect resistance, resurgence and detrimental effect on environment. One effort to solve the problem caused by inappropriate applications of synthetic insecticides is by utilization of botanical materials as botanical insecticides. One of the potential plant species is
Tithonia diversifolia (Asteraceae). Therefore, the purpose of this research was to study the insecticidal activity of T. diversifolia as a botanical insecticide against P. xylostella.
The research was conducted in several steps including; extracting T. diversifolia plant parts, testing the mortality activity of the extract by leaf residual and topical application methods, testing feeding inhibition activity of the extract by choice and no-choice methods, testing inhibition of growth and oviposition activity of P. xylostella, testing the selectivity to the natural enemy of pest, parasitoid Diadegma semiclausum, and phytotoxicity test conducted on broccoli plant.
The results showed that the flower extract of T. diversifolia was better mortality activity on insect than the leaf extract on both leaf residual and topical application methods. The larvae feeding inhibitory activity by the choice method showed that the flower extract at 0.86% resulted in a stronger inhibition rate (82.55%) and the leaf extract at 0.97% resulted in a weak inhibition rate (54.90%). Meanwhile by no-choice method, the flower extract at 0.86% and the leaf extract at 0.97% resulted in a weak inhibition rate 57.16% and 59.70%, respectively. There were development inhibitory activity and inhibition of oviposition of P. xylostella caused by the leaf and flower extracts of T. diversifolia. The extracts of leaf and flower of T. diversifolia did not adversely affect on both natural enemy and broccoli plant (no phytotoxic effect).
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Entomologi
EKSTRAK Tithonia diversifolia (Hemsley) A. Gray SEBAGAI
INSEKTISIDA NABATI UNTUK PENGENDALIAN
ULAT DAUN KUBIS Plutella xylostella Linn.
(LEPIDOPTERA : YPONOMEUTIDAE)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wata’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang di-pilih dalam penelitian yang dilaksanakan sejak bulan November 2015 ini ialah in-sektisida nabati, dengan judul Ekstrak Tithonia diversifolia (Hemsley) A. Gray se-bagai Insektisida Nabati untuk Pengendalian Ulat Daun Kubis Plutella xylostella
Linn.(Lepidoptera : Yponomeutidae).
Terima kasih penulis ucapkan kepada Prof Dr Ir Dadang MSc dan Dr Ir Ruly Anwar MSi selaku pembimbing, serta Ir Djoko Prijono MAgrSc yang telah banyak memberi arahan selama di Laboratorium Fisiologi dan Toksikologi Se-rangga IPB. Terima kasih penulis sampaikan pula kepada Maryono SPi dan Wawan SSi yang telah membantu selama pengumpulan sampel penelitian di la-pangan. Terima kasih yang setinggi-tingginya penulis sampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Oktober 2016
DAFTAR ISI
Pengendalian P. xylostella 4
Tithonia diversifolia 5
Persebaran dan Biologi 5
Manfaat T. diversifolia pada Bidang Pertanian 6
Insektisida Nabati 6
BAHAN DAN METODE
Tempat dan Waktu 8
Metodologi 8
Penanaman dan Pemeliharaan Brokoli 8
Pemeliharaan dan Perbanyakan Serangga Uji 8
Ekstraksi Tumbuhan 9
Uji Toksisitas Ekstrak terhadap Larva P. xylostella 9
Uji Penghambatan Makan 10
Uji Penghambatan Perkembangan 11
Uji Penghambatan Peneluran 11
Uji Pengaruh Ekstrak terhadap Musuh Alami 12
Uji Fitotoksisitas Ekstrak pada Tanaman Brokoli 13
Analisis Data 14
HASIL DAN PEMBAHASAN
Hasil 15
Toksisitas Ekstrak pada Larva P. xylostella 15
Penghambatan Makan 17
Penghambatan Perkembangan 18
Penghambatan Peneluran 18
Pengaruh Ekstrak terhadap Musuh Alami 19
Fitotoksisitas Ekstrak pada Tanaman Brokoli 19
Pembahasan 19
SIMPULAN DAN SARAN
Simpulan 23
DAFTAR PUSTAKA 24
LAMPIRAN 29
DAFTAR TABEL
1 Kriteria penghambatan makan larva P.xylostella oleh ekstrak T.
diver-sifolia 11
2 Kriteria keamanan ekstrak terhadap musuh alami 13
3 Penduga parameter regresi probit hubungan antara konsentrasi atau dosis ekstrak T. diversifolia dengan mortalitas larva P. xylostella pada
pengamatan 144 JSP. 17
4 Persen penghambatan aktivitas makan larva P. xylostella pada perlakuan
ekstrak daun dan bunga T. diversifolia 17
5 Pengaruh perlakuan ekstrak daun dan bunga T. diversifolia terhadap waktu terbentuknya pupa (WP) dan imago (WI) P. xylostella 18 6 Pengaruh ekstrak daun dan bunga T. diversifolia terhadap penghambatan
peneluran imago P. xylostella 18
7 Pengaruh ekstrak T. diversifolia terhadap mortalitas parasitoid D.
semi-clausum 19
DAFTAR GAMBAR
1 Siklus perkembangan P. xylostella 3
2 Tanaman (kiri) dan bunga (kanan) T. diversifolia 5
3 Kurungan tempat pemeliharaan serangga 8
4 Pengujian penghambatan makan dengan metode pilihan (A) dan tanpa
pilihan (B), T= perlakuan, C= kontrol. 10
5 Kurungan tempat uji penghambatan peneluran 12
6 Pengujian ekstrak terhadap musuh alami (A) dan penyimpanannya (B) 12 7 Pengujian fitotoksik pada tanaman brokoli (A), daun bagian atas (B),
tengah (C) dan bawah (D) 13
8 Perkembangan mortalitas larva P. xylostella pada perlakuan ekstrak daun dan bunga T. diversifolia dengan metode residu pada daun. 15 9 Perkembangan mortalitas larva P. xylostella pada perlakuan ekstrak daun
dan bunga T. diversifolia dengan metode aplikasi topikal. 16
DAFTAR LAMPIRAN
1 Rata-rata mortalitas larva P. xylostella pada perlakuan ekstrak daun dan bunga T. diversifolia dengan metode residu pada daun 30 2 Rata-rata mortalitas larva P. xylostella pada perlakuan ekstrak daun dan
bunga T. diversifolia dengan metode aplikasi topikal 31 3 Data pengamatan penghambatan aktivitas makan ekstrak metanol bunga T.
diversifolia pada larva P. xylostella dengan metode pilihan 32
4 Data pengamatan penghambatan aktivitas makan ekstrak metanol daun T.
diversifolia pada larva P. xylostella dengan metode pilihan 33
5 Data pengamatan penghambatan aktivitas makan ekstrak metanol bunga T. diversifolia pada larva P. xylostella dengan metode tanpa pilihan 34 6 Data pengamatan penghambatan aktivitas makan ekstrak metanol daun T.
7 Data pengamatan penghambatan aktivitas peletakkan telur imago P. xylostella pada perlakuan ekstrak daun dan bunga T. diversifolia 36 8 Gejala fitotoksik pada daun brokoli yang diberi perlakuan ekstrak daun T.
PENDAHULUAN
Latar Belakang
Tanaman kubis-kubisan (Brassicaceae) merupakan jenis tanaman sayuran yang banyak dibudidayakan oleh petani Indonesia. Dalam periode 4 tahun ter-akhir dari 2011-2015 produksi tanaman kubis-kubisan mengalami penurunan setiap tahunnya. Tanaman kubis mengalami penurunan sebesar 0.17%, kol kembang 10.18%, sawi 3.64%, dan lobak 32.67% (BPS 2015). Beberapa faktor yang berkontribusi dalam penurunan produksi tanaman di antaranya adalah pe-nurunan kesuburan lahan, berkurangnya lahan produksi dan adanya serangan organisme pengganggu tanaman (OPT) (Sastrosiswojo et al. 2005). Ulat daun kubis Plutella xylostella (Lepidoptera : Yponomeutidae) merupakan salah satu hama yang paling merusak pada tanaman kubis-kubisan (Brassicaceae) di seluruh dunia (Sarfraz dan Kaddie 2005). Kerusakan tanaman disebabkan oleh aktivitas makan larva yang pada populasi tinggi dapat merusak tanaman secara berat (Capinera 2001).
Pengendalian menggunakan insektisida sintetik merupakan teknik pe-ngendalian yang paling umum dilakukan untuk mengendalikan P. xylostella di seluruh dunia (Syed et al. 2004). Penggunaan insektisida sintetik merupakan cara yang efektif namun jika penggunaannya secara terus menerus dan tidak bijaksana dapat menyebabkan resistensi serangga (Kau dan Cheng 2001), berpengaruh buruk pada kesehatan lingkungan dan adanya residu pada produk pertanian yang dapat membahayakan konsumen (Dadang dan Prijono 2008).
Salah satu upaya yang dapat dilakukan untuk meminimalisasi masalah akibat penggunaan pestisida sintetik adalah dengan memanfaatkan bahan alami yang berpotensi untuk digunakan sebagai bahan baku insektisida nabati. Insek-tisida nabati merupakan insekInsek-tisida yang bahan dasarnya adalah senyawa tum-buhan yang mudah terurai di alam (Mkenda et al. 2014), relatif aman terhadap organisme bukan sasaran, dapat dipadukan dengan komponen lain pengendalian hama terpadu, dan dapat memperlambat laju resistensi (Dadang dan Prijono 2008). Berdasarkan hal tersebut penggunaan insektisida nabati diharapkan mampu mengurangi atau mungkin dapat menggantikan penggunaan pestisida sintetik di lapangan dan menjadi bahan pengendali yang ramah lingkungan, aman dan sehat (Djunaedy 2009).
2
sebagai pakan ternak dan pupuk organik, sementara potensinya sebagai bahan insektisida nabati belum banyak dipelajari khususnya untuk mengendalikan ulat daun kubis P. xylostella.
Perumusan Masalah
Penggunaan insektisida sintetik secara terus-menerus dan secara tidak bijak-sana dapat menimbulkan dampak negatif seperti terjadinya resistensi hama terhadap insektisida dan meningkatnya residu pada produk pertanian yang ber-bahaya bagi konsumen. Salah satu upaya yang dapat dilakukan untuk memini-malkan dampak negatif tersebut adalah dengan pemanfaatan tumbuh-tumbuhan yang berpotensi dijadikan sebagai insektisida nabati. T. diversifolia merupakan salah satu tumbuhan yang berpotensi untuk mengendalikan OPT di pertanaman. Namun di Indonesia penelitian tentang potensi T. diversifolia sebagai insektisida nabati belum banyak dilakukan.
Tujuan Penelitian
Tujuan penelitian ini mempelajari aktivitas insektisida ekstrak T. diversifolia sebagai insektisida nabati untuk mengendalikan ulat daun kubis P. xylostella.
Hipotesis
Ekstrak T. diversifolia mempunyai aktivitas insektisida terhadap ulat daun kubis P. xylostella.
Manfaat Penelitian
1. Menambah informasi tentang potensi ekstrak T. diversifolia untuk me-ngendalikan ulat daun kubis P. xylostella.
3
TINJAUAN PUSTAKA
Plutella xylostella
Persebaran dan Biologi
Ulat daun kubis, P. xylostellakemungkinan berasal dari Eropa. Serangga ini selain ditemukan di Eropa, juga ditemukan di Amerika, Asia Tenggara, Australia dan Selandia Baru. Di Amerika, serangga ini pertama kali diamati di Illinois, Amerika Utara pada tahun 1854 kemudian menyebar ke Florida dan Pegunungan Rocky pada tahun 1883. Kemudian dilaporkan juga keberadaannya di British Columbia (Kanada) pada tahun 1905. Di Amerika Utara keberadaan ulat daun P. xylostella dapat ditemukan hampir pada setiap pertanaman kubis-kubisan (Capinera 2001). Di Indonesia, P. xylostella ditemukan terbatas hanya pada daerah perbukitan atau pegunungan, tempat tumbuhnya tanaman kubis-kubisan. Serangga ini ditemukan di Pulau Jawa pada ketinggian 700-1500 m dpl (Kalshoven 1981).
Ulat daun kubis hanya memakan tanaman yang termasuk Famili Brassi-caceae, di antaranya brokoli, kol, kubis, sawi putih, kol kembang, lobak, sawi, dan selada air. Selain itu, beberapa tanaman yang tergolong gulma dapat menjadi inang bagi P. xylostella, seperti Barbarea vulgaris, Capsella bursapastoris,
Lepidium spp., dan Brassica spp. Satu siklus hidup serangga P. xylostella rata-rata 27-30 hari yang meliputi fase telur, larva, pupa dan imago (Gambar 1).
Telur serangga ini berbentuk lonjong pipih berukuran 0.44 mm x 0.26 mm berwarna kuning atau hijau pucat. Telur biasanya tidak berkelompok atau berkelompok dalam jumlah sedikit antara 3-8 telur per kelompok yang diletakkan di permukaan bawah daun tanaman meskipun terkadang dapat juga pada bagian tanaman yang lainnya. Setiap individu betina rata-rata mampu menghasilkan 150 telur selama hidup (Capinera 2001).
Perkembangan P. xylostella setelah melewati fase telur adalah fase larva yang terdiri dari 4 instar. Rata-rata stadium instar I, II, III dan IV berturut-turut
4
adalah 4.5, 4, 4 dan 5 hari (Capinera 2001). Sementara itu, Herlinda et al. (2004) menyatakan bahwa rata-rata stadium larva berturut-turut adalah 4, 2, 3 dan 3 hari untuk instar I, II, III dan IV. Perbedaan lama perkembangan dapat terjadi karena perbedaan keadaan lingkungan (suhu dan kelembapan) atau jenis tumbuhan inangnya (Capinera 2001).
Larva instar I yang baru menetas biasanya mengorok di dalam daun selama beberapa hari. Selanjutnya larva instar II sampai instar IV sudah dapat terlihat di bagian luar daun. Kepala larva berwarna kekuningan dan seluruh bagian tubuh berwarna hijau terang. Larva tumbuh hingga mencapai 9 mm dan bergerak aktif ketika disentuh (Kalshoven 1981).
Pupa P. xylostella berwarna kekuningan terbungkus kokon berwarna putih yang biasanya ditemukan di bagian permukaan bawah daun atau di bagian atasnya. Pada tanaman kol dan brokoli, pupa dapat ditemukan pada bakal bunga atau kuncup bunga. Stadium pupa di lapangan antara 5-11 hari, dan di laboratorium antara 3-4 hari (Hasanshahi et al. 2014).
Serangga dewasa (imago) berukuran kecil dan ramping, berwarna kelabu cokelat dengan antena yang sangat panjang (Webb 2002). Pada bagian sayap terdapat pola seperti berlian berwarna putih terang yang menjadikan serangga ini disebut sebagai ngengat punggung berlian atau diamondback moth (DBM). stadium imago jantan rata-rata 12 hari, sedangkan imago betina 16 hari. Ngengat merupakan penerbang yang lemah yang hanya mampu terbang pada ketinggian 2 m dari permukaan tanah dengan jangkauan jarak terbang yang tidak terlalu jauh (Capinera 2001).
Pengendalian P. xylostella
Terdapat beberapa cara yang dapat dilakukan untuk mengendalikan P. xylostella di lapangan di antaranya : pegendalian melalui sistem budidaya, pe-ngendalian secara biologi dan pepe-ngendalian secara kimia.
Pengendalian melalui sistem budidaya dapat dilakukan dengan beberapa cara di antaranya : 1) Sistem rotasi tanaman. P. xylostella memiliki cakupan inang yang sedikit sehingga sistem rotasi tanaman akan mengurangi tingkat populasi dan tingkat kerusakan yang diakibatkan oleh serangan serangga; 2) Sistem tumpang sari. Sistem ini dilakukan dengan cara menanam tanaman kubis-kubisan yang dipadukan dengan tanaman lain seperti tomat atau bawang. Hal tersebut akan mempengaruhi prilaku serangga dalam menemukan tanaman inang yang secara tidak langsung akan mengurangi tingkat populasi serangga; 3) Penggunaan tanaman perangkap. Penggunaan tanaman perangkap yang lebih atraktif terhadap serangga sehingga serangga lebih memilih tanaman perangkap daripada tanaman budidaya. Contoh tanaman yang dapat dijadikan se-bagai tanaman perangkap untuk P. xylostella adalah tanaman semanggi (Tripolium L.) dan tanaman mustard (Brassica juncea); 4) Penggunaan varietas resisten terhadap P. xylostella dan 5) Penggunaan feromon seks yang mengganggu proses perkawinan (Philips et al. 2014).
Pengendalian secara biologi dilakukan dengan memanfaatkan musuh alami
P. xylostella termasuk parasitoid dan predator. Setiap fase perkembangan P. xylostella dapat diserang oleh musuh alami, mulai dari fase telur hingga pupa. Telur P. xylostella dapat diparasit oleh parasitoid telur Trichogramma
5 terhitung masih rendah. Pada fase larva, parasitoid larva merupakan musuh alami
P. xylostella yang mendominasi dan paling efektif dalam mengendalikan P. xylostella. Parasitoid larva yang paling banyak digunakan di seluruh dunia yaitu
Diadegma (Hymenoptera : Ichneumonidae) dan Cotesia (Hymenoptera : Braconidae). Pada fase pupa, parasitoid yang memarasit P. xylostella yaitu
Oomyzus sokolowskii (Hymenoptera : Eulophidae). Selain parasitoid, terdapat beberapa serangga predator dan patogen yang dapat menyerang P. xylotella. Serangga famili Staphylinidae, Syrphidae, Vespidae, Chrysopidae dan kelompok laba-laba merupakan predator penting P. xylostella. Sementara contoh patogen yang dilaporkan dapat menyerang P. xylostella yaitu Bacillus thuringiensis var. Kurstakii merupakan patogen yang banyak digunakan untuk mengendalikan P. xylostella di seluruh dunia (Philips et al. 2014).
Pengendalian secara kimia dilakukan dengan pengaplikasian insektisida baik insektisida sintetik maupun nabati. P. xylostella diketahui telah mengalami ketahanan (resistensi) terhadap banyak insektisida (Xia et al. 2014; Jiang et al.
2015). Penggunaan insektisida nabati diharapkan dapat mengurangi tingkat resistensi P. xylostella terhadap insektisida sintetik (Philips et al. 2014). Wei et al.
(2015) membuktikan minyak atsiri ekstrak Chenopodium ambrosioides berpotensi untuk digunakan sebagai penghambat aktivitas makan larva dan sebagai insektisida penghambat pertumbuhan P. xylostella. Mari (2012) menyatakan ekstrak tumbuhan Azadirachta indica lebih toksik dari ekstrak tumbuhan
Nicotiana tabacum terhadap larva P. xylostella.
Tithonia diversifolia
Persebaran dan Biologi
Tithonia diversifolia (Asteraceae) merupakan tumbuhan herbal berkayu yang memiliki tinggi 1.2 m - 3 m dengan ukuran daun 5 cm – 7 cm x 5 cm – 15 cm. Tumbuhan ini memiliki bunga berwarna kuning dan menghasilkan bunga sepanjang tahun (Gambar 2).
6
Persebarannya dapat terjadi sepanjang tahun yang dilakukan oleh bantuan angin, air, hewan termasuk serangga atau aktivitas manusia. T. diversifolia
merupakan tumbuhan asli dari Meksiko dan Amerika Tengah yang dikenal de-ngan nama Mexican sunflower (Mwanauta et al. 2014). Tumbuhan ini telah di-introduksi ke sebagian besar negara-negara tropik di Asia Tenggara termasuk Indonesia. Di Indonesia tumbuhan ini dikenal dengan nama umum kipait, se-dangkan di Jawa dikenal dengan nama kembang bulan. Tumbuhan ini mampu tumbuh hingga pada ketinggian 200-1500 m dpl (Setiawati et al. 2008).
Manfaat T. diversifolia pada Bidang Pertanian
T. diversifolia dikenal sebagai tanaman gulma di Indonesia. Akhir-akhir ini berbagai penelitian menunjukkan berbagai potensi dari tumbuhan ini dalam membantu meningkatkan produksi pertanian, baik secara langsung sebagai pupuk organik yang kaya akan unsur hara, maupun secara tidak langsung sebagai bahan untuk mengendalikan organisme pengganggu tanaman (OPT). Olabode (2007) menyatakan tumbuhan ini merupakan salah satu tumbuhan yang berpotensi untuk dijadikan bahan penyubur tanah. Selain memiliki kandungan unsur hara yang bermanfaat dalam menyuburkan tanah, tanaman ini memiliki kandungan insektisida dan nematisida (Setiawati et al. 2008) yang menjadikannya berpotensi untuk dijadikan bahan pengendali serangga hama. Otusanya dan Ilori (2012) dalam risetnya menyatakan ekstrak daun T. diversifolia mengandung senyawa flavonoid, tanin, glikosida, terpenoind dan fenol. Senyawa–senyawa tersebut merupakan beberapa senyawa yang mempunyai sifat racun dan antimakan pada serangga hama (Hassanali dan Lwande 1989).
Beberapa hasil penelitian menunjukkan keefektifan penggunaan T.
diversifolia sebagai bahan pengendali hama pada pertanaman di antaranya se-bagai antijamur dan antibakteri (Linthoingambi dan Singh 2013). Penelitian lain menunjukkan 500 g/l ekstrak kasar daun T. diversifolia dapat meningkatkan mortalitas larva Cosmopolites sordidus (Germar) (Coleoptera : Curculionidae) sampai 82% (Mukasa et al. 2008). Sementara Wardhana dan Diana (2014) menyatakan bahwa ekstrak metanol daun T. diversifolia efektif pada konsentrasi 1% menyebabkan kematian, penurunan bobot pupa dan menghalangi terben-tuknya pupa serta daya tetas pada larva Chrysomya bezziana (Diptera : Challiphoridae). Hasil penelitian lainnya menunjukan ekstrak T. diversifolia
mampu mengendalikan serangan Atta cephalotes (Hymenoptera : Formicidae) (Castano-Quintana et al. 2013), Macrotermes bellicosus (Isoptera : Termitidae) (Oyedokun et al. 2011), Macrotermes spp. (Isoptera : Termitidae) (Osipitan dan Oseymi 2012), larva nyamuk Aedes aegypti (Diptera : Culicidae) (Bernard 2012), dan hama gudang Callosobrochus maculatus (Coleoptera : Bruchidae) (Kolawole
et al. 2014).
Insektisida Nabati
7 pengamatan terhadap tanaman yang menunjukkan ketahanan terhadap serangan serangga hama, kemudian orang mulai menggunakannya sebagai insektisida nabati (El-Wakeil 2013).
Terdapat empat kelompok senyawa utama tumbuhan yang berperan dalam insektisida nabati, yaitu 1) senyawa yang mengandung nitrogen contohnya alkaloid dan glukosinolat; 2) senyawa fenolik contohnya fenol dan flavonoid; 3) senyawa terpenoid contohnya monoterpen, sesquiteren dan limonoid; dan 4) senyawa poliasetat contohnya poliasetilen. Insektisida nabati yang sudah beredar di pasaran yaitu dari kelompok senyawa terpenoid yang berasal dari pyrethrum, mimba, dan produk minyak atsiri (Miresmailli dan Isman 2014).
Phyrethrin yang berasal dari tanaman phyretrum bekerja pada ion channel, mengganggu proses pertukaran ion sodium dan potassium yang mengakibatkan terganggunya pengiriman impuls syaraf. Senyawa ini bekerja cepat dalam mengakibatkan kelumpuhan serangga (knockdown). Meskipun senyawa ini bekerja cepat, namun beberapa serangga mampu memecah pyrethrin sehingga serangga mampu bertahan hidup. Untuk mencegah serangga memecah pyrethrin dan bertahan hidup, pyrethrin bekerja sinergis dengan Piperonil Butoksida (PBO) (Rattan 2010).
Pada serangga, senyawa yang terkandung pada nimba lebih aktif sebagai penghambat aktivitas makan, namun dapat juga berperan sebagai repellent, pengatur pertumbuhan, penghambatan peneluran, atau bersifat toksik. Sebagai penghambat aktivitas makan, senyawa ini mengakibatkan serangga berhenti makan segera setelah menelan makanan yang diakibatkan oleh pengaruh fisio-logis dari senyawa penghambat makan (Salama dan Sharaby 1988). Sebagai penghambat pertumbuhan, nimba menghambat proses pertumbuhan dengan cara mengganggu proses sintesis kitin (pada proses ganti kulit) (El-Wakeil 2013).
8
BAHAN DAN METODE
Tempat dan Waktu
Penelitian dilaksanakan di Laboratorium Fisiologi dan Toksikologi Se-rangga Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian dilakukan mulai bulan November 2015 sampai Juni 2016.
Metodologi
Penanaman dan Pemeliharaan Brokoli
Tanaman brokoli (Brassica oleraceae L. Var. Italica) digunakan sebagai media untuk menguji pengaruh ekstrak T. diversifolia terhadap ulat daun kubis P. xyostella. Benih brokoli disemai pada wadah penyemaian yang berisi tanah dan pupuk kandang (2:1, w/w) yang telah dicampur rata. Setelah berumur 3 minggu, sebanyak satu bibit tanaman dipindahtanamkan ke tiap polybag berukuran besar (5 liter) yang telah berisi campuran tanah dan pupuk kandang (2:1, w/w). Pemupukan tambahan dilakukan ketika tanaman berumur 3-4 minggu melalui pemberian pupuk NPK dengan dosis 1 g/polybag. Pemeliha-raan tanaman brokoli yang dilakukan meliputi penyiraman yang dilakukan dua kali sehari, penyulaman pada tanaman yang mati, penyiangan gulma, dan pe-ngendalian hama yang dilakukan secara mekanik. Tanaman berumur 2 bulan digunakan sebagai pakan larva P. xylostella.
Pemeliharaan dan Perbanyakan Serangga Uji
Serangga yang digunakan sebagai serangga uji adalah P. xylostella larva instar III dan imago mulai generasi kedua yang diperoleh dari pemeliharaan di laboratorium. Imago serangga didapatkan dari pertanaman sayuran di daerah Cipanas, Cianjur (6o44’58.81”LS - 107o1’17.47”BT). Imago dikumpulkan dan dipelihara di laboratorium dengan cara dimasukkan ke dalam kurungan kasa tempat pemeliharan (100 cm x 50 cm x 50 cm) (Gambar 3).
Imago diberi makan larutan madu 10% (v/v) yang diserapkan pada kapas yang digantungkan di tengah-tengah kurungan menggunakan seutas benang. Pada bagian dasar kurungan diletakkan daun brokoli pada botol kecil (diameter 3 cm
9 dan tinggi 5 cm) berisi air sebagai tempat peletakkan telur. daun yang telah diletaki telur kemudian dipindahkan pada wadah plastik tempat pemeliharaan (30 cm x 25 cm x 7 cm). Telur-telur tersebut dipelihara hingga menetas kemudian setelah menjadi larva, serangga diberi makan daun brokoli bebas pestisida.
Ekstraksi Tumbuhan
Metode yang digunakan untuk mendapatkan ekstrak T. diversifolia adalah metode maserasi (Dadang dan Prijono 2011). Bahan tanaman diperoleh dari Cisarua, Bogor (6o41’20.30”LS - 106o56’55.63BT). Bagian tanaman yang di-gunakan adalah daun dan bunga. Masing-masing bahan tersebut dipotong men-jadi bagian-bagian kecil, dikeringanginkan selama 7 hari, dan dihaluskan menggunakan blender secara terpisah hingga menjadi serbuk. Serbuk diayak menggunakan pengayak kasa berjalin 1 mm. Masing-masing serbuk direndam dalam metanol (1:10, w/v) selama 48 jam. Rendaman disaring menggunakan corong Buchner yang dialasi kertas saring. Hasil saringan diuapkan dengan menggunakan rotary evaporator pada suhu 50oC dan tekanan 240 mbar sehingga diperoleh ekstrak kasar. Ekstrak disimpan dalam lemari es (4oC) hingga saat digunakan.
Uji Toksisitas Ekstrak terhadap Larva P. xylostella
Setiap ekstrak diuji pada lima taraf konsentrasi yang diharapkan dapat mengakibatkan kematian serangga uji 5% hingga 95%, yang ditentukan dengan uji pendahuluan. Konsentrasi ekstrak yang digunakan untuk uji pendahuluan adalah 5%, 3%, 1%, 0.5%, dan 0.1%. Setelah memperoleh data mortalitas hasil uji pendahuluan kemudian dilakukan analisis probit untuk memperoleh konsentrasi yang akan digunakan pada uji lanjutan. Konsentrasi uji lanjut ekstrak metanol daun dan bunga T. diversifolia berturut-turut yaitu 0.02%, 0.04%, 0.09%, 0.22%, dan 0.97%; dan 0.01%, 0.04%, 0.08%, 0.19% dan 0.86%. Pembuatan konsentrasi larutan ekstrak dilakukan dengan metode pengenceran berseri (serial dilution). Pengujian toksisitas dilakukan dengan dua metode yaitu metode residu pada daun dan metode aplikasi topikal.
Metode residu pada daun. Potongan daun brokoli (4 cm x 4 cm) dicelupkan ke dalam sediaan ekstrak pada konsentrasi tertentu kemudian dikeringanginkan. Daun kontrol dicelupkan ke dalam 100 ml larutan air yang mengandung metanol dan Tween 80 (5:1, v/v). Sebanyak 2 lembar daun dimasukkan ke dalam petri dish (diameter 9 cm), lalu dimasukkan pula 10 ekor larva P. xylostella instar III. Setiap perlakuan dan kontrol diulang lima kali. Daun perlakuan dan kontrol diganti setiap 24 jam setelah perlakuan dengan daun tanpa perlakuan. Pengamatan mortalitas larva dilakukan setiap 24 jam selama 6 hari. Persentase kematian untuk setiap konsentrasi ekstrak dianalisis dengan program analisis probit untuk menentukan hubungan konsentrasi/dosis dengan kematian serangga uji (Finney 1997).
10
diulang sebanyak lima kali. Pengamatan dilakukan setiap 24 jam selama 6 hari dengan menghitung jumlah larva yang mati.
Uji Penghambatan Makan
Metode yang digunakan untuk pengujian penghambat makan adalah me-tode pilihan (choice) dan tanpa pilihan (no-choice). Daun pakan serangga dipo-tong berukuran 4 cm x 4 cm. Podipo-tongan daun kemudian ditimbang dalam ke-lompok yang terdiri atas dua lembar daun per keke-lompok. Untuk memperkirakan bobot kering awal, dua lembar daun yang diambil dari lembaran daun tadi ditimbang dan dikeringkan dalam oven pada suhu 105oC selama 2 jam kemudian daun yang telah dikeringkan ditimbang kembali (Dadang dan Prijono 2008).
Potongan daun perlakuan dicelup dalam sediaan bahan uji pada konsentrasi perlakuan (LC15, LC35, LC55, LC75 dan LC95), kemudian dikeringanginkan, sedangkan daun kontrol dicelup dalam air yang mengandung metanol dan Tween 80 (1:5, v/v). Setelah pelarut menguap, dua lembar daun perlakuan dan dua lembar daun kontrol diletakkan secara berselang-seling di dalam cawan petri (diameter 14 cm) yang dialasi tisu, kemudian 10 ekor larva P. xylostella instar III diletakkan dalam cawan tersebut (metode pilihan). Pada metode tanpa pilihan,
setiap 2 daun perlakuan dan 2 daun kontrol masing-masing diletakkan pada cawan petri (diameter 9 cm) secara terpisah (Gambar 4).
Setelah 24 jam, daun sisa dikeringkan (daun perlakuan dan daun kontrol untuk setiap ulangan dipisah) dalam oven pada suhu 1050C selama 2 jam, dan daun yang telah dikeringkan ditimbang. Selisih bobot kering awal dan bobot kering sisa merupakan bobot daun yang dimakan. Setiap perlakuan dan kontrol diulang sebanyak lima kali (Dadang dan Prijono 2008).
Gambar 4 Pengujian penghambatan makan dengan metode pilihan (A) dan tanpa pilihan (B), T= perlakuan, C=kontrol.
11 Persentase penghambatan makan dihitung berdasarkan rumus Ling et al.
(2008) :
BKK : Berat kering daun yang dimakan pada kontrol (g) BKP : Berat kering daun yang dimakan pada perlakuan (g)
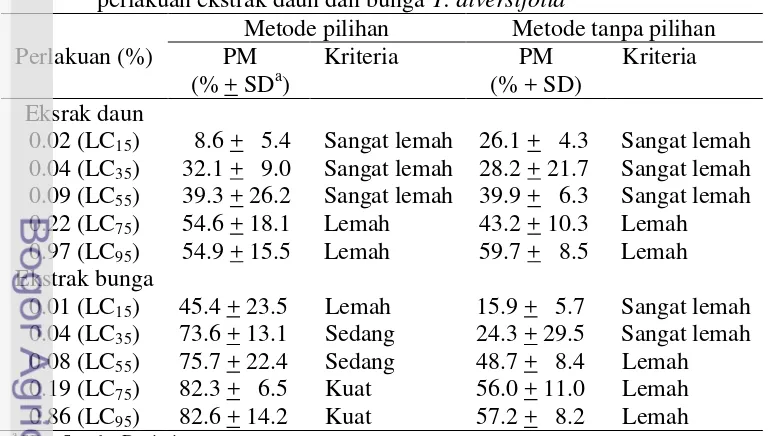
Persentase penghambatan makan kemudian dikelompokkan berdasarkan kriteria Park et al. (1997) (dengan sedikit modifikasi) yaitu :
Uji Penghambatan Perkembangan
Pengujian tingkat penghambatan perkembangan P. xylostella dilakukan pada 10 larva instar III dengan mengaplikasikan ekstrak tumbuhan dengan ber-bagai konsentrasi yang telah ditentukan (LC15, LC35, dan LC55) dan kontrol seperti pengujian toksisitas dengan metode residu pada daun. Setiap perlakuan dan kontrol diulang lima kali. Setiap 24 jam daun diganti dengan daun segar tanpa perlakuan. Pengamatan dilakukan terhadap waktu perubahan larva menjadi pupa dan pupa menjadi imago (Ambarningrum et al. 2009). Hasil pengamatan dianalisis dengan menggunakan analisis ragam dan dilanjutkan dengan uji Duncan jika terdapat perbedaan diantara perlakuan.
Uji Penghambatan Peneluran
Pengujian penghambatan peneluran dilakukan di dalam kurungan bermensi 20 cm x 13 cm x 9 cm (Gambar 5). Sediaan insektisida yang telah di-tambahi pelarut dan pengemulsi (konsentrasi akhir 1% dan 0.2%) diencerkan dengan air untuk memperoleh 2 taraf konsentrasi (LC99 dan 2 x LC99) (Syahputra 2008).
Tanaman kontrol disemprot dengan air yang mengandung pelarut 1% dan pengemulsi 0.2%. Sediaan insektisida yang telah disiapkan berikut kontrol di-semprotkan pada bagian tanaman dengan menggunakan alat semprot tangan (hand spayer). Dua pasang imago yang berumur 2 hari dimasukkan ke dalam kurungan yang telah berisi tanaman perlakuan dan kontrol masing-masing satu tanaman yang disusun berdampingan. Larutan madu 10% (v/v) diikat dengan seutas benang dan digantungkan di tengah setiap kurungan sebagai makanan imago. Perlakuan Tabel 1 Kriteria penghambatan makan larva P. xylostella oleh ekstrak T.
12
tersebut diulang sebanyak enam kali. Imago dibiarkan bertelur selama 3 hari, kemudian jumlah telur yang diletakkan pada tanaman perlakuan dan tanaman kontrol masing-masing dihitung dan dibandingkan (Dadang dan Prijono 2008). Pengolahan data dilakukan dengan analisis uji t-berpasangan (α = 0.05) (Steel dan Torrie 1993) menggunakan program SAS (SAS Institute 1990).
Uji Pengaruh Ekstrak terhadap Musuh Alami
Pengaruh ekstrak terhadap musuh alami diuji terhadap imago Diadegma semiclausum (Hellen) (Hymenoptera : Ichneumonidae) yang merupakan salah satu parasitoid larva P. xylostella (Yuliadhi dan Sudiarta 2012). Ekstrak T. diversifolia diuji terhadap imago parasitoid D. semiclausum dengan metode kontak pada permukaan gelas (Dadang dan Prijono 2008). Konsentrasi yang diuji adalah LC99 dan 2 x LC99. Imago yang digunakan adalah imago yang berumur 1 hari. Tabung reaksi dilumuri sediaan ekstrak sementara kontrol dilumuri dengan cairan yang mengandung metanol dan Tween-80 (5:1) (v/v), dikeringanginkan selama beberapa menit. Satu ekor imago D. semiclausum dimasukkan ke dalam setiap tabung. Imago dibiarkan kontak selama 2 jam kemudian dipindahkan pada tabung tanpa perlakuan (Gambar 6).
Larutan madu 10% (v/v) digunakan sebagai pakan imago dioleskan pada kain kasa yang digunakan sebagai penutup tabung. Perlakuan dan kontrol di-lakukan masing-masing terhadap 18 ekor imago parasitoid. Pengamatan didi-lakukan 24 dan 48 jam setelah perlakuan dengan menghitung jumlah serangga yang mati. Gambar 6 Pengujian ekstrak terhadap musuh alami (A) dan penyimpanannya (B)
A B
13 Untuk mengetahui tingkat keamanan ekstrak T. diversifolia terhadap musuh alami, persentase mortalitas D. semiclausum dikelompokkan berdasarkan Hassan et al. (1991) (dengan sedikit modifikasi) yaitu:
Uji Fitotoksisitas Ekstrak pada Tanaman Brokoli
Pengujian dilakukan pada tanaman brokoli yang ditanam pada polybag. Konsentrasi yang digunakan adalah konsentrasi LC99 dan 2 x LC99 dari setiap ekstrak. Kontrol adalah larutan yang mengandung metanol dan Tween-80 5:1 (v/v). Sediaan ekstrak diteteskan menggunakan microapplicator pada daun ta-naman yang terdiri dari daun bagian atas, tengah dan bawah. Masing-masing terdiri dari 6 titik penetesan sebagai ulangan (Gambar 7).
Gejala fitotoksisitas diamati setiap 24 jam selama 7 hari. Pengamatan di-lakukan dengan cara mengamati bagian daun yang mengalami nekrosis atau pengerutan akibat perlakuan ekstrak (Dadang et al. 2007).
Tabel 2 Kriteria keamanan ekstrak terhadap musuh alami
Mortalitas (%) Kriteria
x < 50 Aman
50 ≤ x < 80 Sedikit berbahaya
80 ≤ x < 99 Cukup berbahaya
x > 99 Berbahaya
Gambar 7 Pengujian pengaruh fitotoksik pada tanaman brokoli (A), daun bagian atas (B), tengah (C) dan bawah (D).
A B
C
D
Label
14
Analisis Data
15
HASIL DAN PEMBAHASAN
Hasil
Toksisitas Ekstrak terhadap Larva P. xylostella
Kematian larva P. xylostella pada perlakuan ekstrak daun T. diversifolia
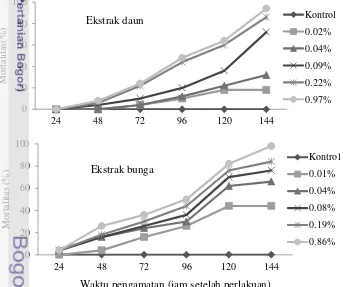
dengan metode residu pada daun mulai terjadi pada 48 jam setelah perlakuan (JSP) sampai 144 JSP, kecuali pada perlakuan 0.02% dan 0.04% kematian larva mulai terjadi pada 72 JSP. Pengamatan pada 96 JSP menunjukkan kematian larva kurang dari 50% pada semua perlakuan. Persentase kematian tertinggi dan terendah berturut-turut sebesar 48% dan 10% terjadi pada perlakuan dengan konsentrasi 0.97% dan 0.02%. Pengamatan pada 144 JSP menunjukkan mortalitas larva 94%, 86%, 72%, 32%, dan 18% pada konsentrasi berturut-turut 0.97%, 0.22%, 0.09%, 0.04%, dan 0.02% (Gambar 8).
Perkembangan mortalitas larva P. xylostella pada perlakuan ekstrak bunga T. diversifolia dengan metode residu pada daun menunjukkan kematian larva terjadi sejak 24 JSP sampai 144 JSP kecuali pada perlakuan 0.01%, kematian larva mulai terjadi pada 48 JSP. Pengamatan pada 96 JSP menunjukkan kematian larva mencapai 50% pada konsentrasi 0.86% dan 26% pada konsentrasi 0.01%. Pengamatan pada144 JSP menunjukkan mortalitas larva mencapai 98%, 84%, 76%, 66%, dan 44% pada konsentrasi berturut-turut 0.86%, 0.19%, 0.08%, 0.04%, dan 0.01% (Gambar 8).
Waktu pengamatan (jam setelah perlakuan)
Gambar 8 Perkembangan mortalitas larva P. xylostella pada perlakuan ekstrak daun dan bunga T. diversifolia dengan metode residu pada daun.
16
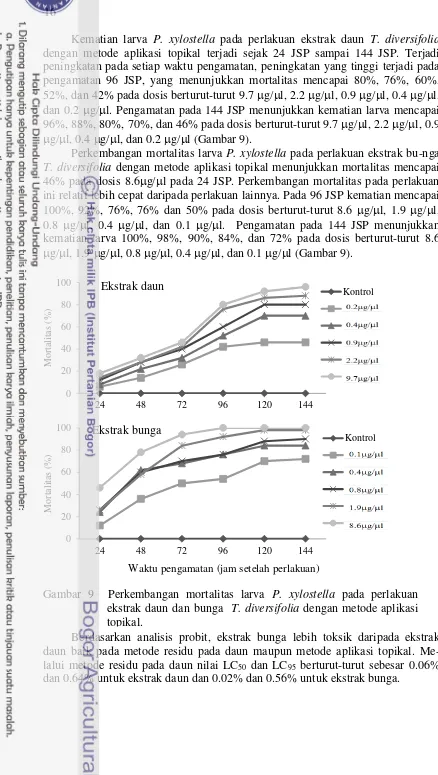
Kematian larva P. xylostella pada perlakuan ekstrak daun T. diversifolia
dengan metode aplikasi topikal terjadi sejak 24 JSP sampai 144 JSP. Terjadi peningkatan pada setiap waktu pengamatan, peningkatan yang tinggi terjadi pada pengamatan 96 JSP, yang menunjukkan mortalitas mencapai 80%, 76%, 60%, 52%, dan 42% pada dosis berturut-turut 9.7 g/l, 2.2 g/l, 0.9 g/l, 0.4 g/l, dan 0.2 g/l. Pengamatan pada 144 JSP menunjukkan kematian larva mencapai 96%, 88%, 80%, 70%, dan 46% pada dosis berturut-turut 9.7 g/l, 2.2 g/l, 0.9
g/l, 0.4 g/l, dan 0.2 g/l (Gambar 9).
Perkembangan mortalitas larva P. xylostella pada perlakuan ekstrak bu-nga
T. diversifolia dengan metode aplikasi topikal menunjukkan mortalitas mencapai 46% pada dosis 8.6g/l pada 24 JSP. Perkembangan mortalitas pada perlakuan ini relatif lebih cepat daripada perlakuan lainnya. Pada 96 JSP kematian mencapai 100%, 92%, 76%, 76% dan 50% pada dosis berturut-turut 8.6 g/l, 1.9 g/l, 0.8 g/l, 0.4 g/l, dan 0.1 g/l. Pengamatan pada 144 JSP menunjukkan kematian larva 100%, 98%, 90%, 84%, dan 72% pada dosis berturut-turut 8.6
g/l, 1.9 g/l, 0.8 g/l, 0.4 g/l, dan 0.1 g/l (Gambar 9).
Berdasarkan analisis probit, ekstrak bunga lebih toksik daripada ekstrak daun baik pada metode residu pada daun maupun metode aplikasi topikal. Me-lalui metode residu pada daun nilai LC50 dan LC95 berturut-turut sebesar 0.06% dan 0.64% untuk ekstrak daun dan 0.02% dan 0.56% untuk ekstrak bunga.
Waktu pengamatan (jam setelah perlakuan)
17 Sementara itu nilai LD50 dan LD95 ekstrak bunga yang diaplikasikan de-ngan metode aplikasi topikal berturut-turut sebesar 0.04 g/l dan 1.32 g/l menunjukkan nilai yang lebih rendah daripada nilai LD50 dan LD95 ekstrak daun yang berturut-turut sebesar 0.17 g/l dan 5.14 g/l (Tabel 3).
Penghambatan Makan
Semua ekstrak pada setiap konsentrasi baik pada pengujian dengan metode pilihan maupun tanpa pilihan memiliki pengaruh penghambatan aktivitas makan. Penghambatan makan tertinggi dihasilkan pada perlakuan ekstrak bunga pada konsentrasi 0.86% (LC95) yang menyebabkan penghambatan makan sebesar 82.60% yang termasuk kriteria penghambatan kuat. Sementara perlakuan lainnya hanya menghasilkan tingkat penghambatan makan yang lemah dan sangat lemah. Secara umum tingkat penghambatan meningkat seiring dengan peningkatan konsentrasi perlakuan baik pada metode pilihan maupun tanpa pilihan (Tabel 4).
Tabel 3 Penduga parameter regresi probit hubungan antara konsentrasi atau dosis ekstrak T. diversifolia dengan mortalitas larva P. xylostella pa-da 144 JSP
Perlakuana ab + GB bc+ GBd LC e 50(SK f
95)(%) LC95 (SK 95)(%)
DR 1.95 + 0.23 1.57 + 0.19 0.06 (0.023-0.114) 0.64 (0.252-11.213) BR 1.92 + 0.24 1.09 + 0.18 0.02 (0.010-0.031) 0.56 (0.291-1.87)
LDg50 (SK 95)(g/l) LD95 (SK 95)(g/l)
DT 0.83 + 0.10 1.04 + 0.18 0.16 (0.07-0.27) 6.02 (3.07 -21.07) BT 1.56 + 0.16 1.17 + 0.26 0.04(0.015-0.095) 1.32 (0.72-6.65) a
DR = ekstrak daun dengan metode residu pada daun, BR = ekstrak metanol bunga dengan metode residu pada daun, DT = ekstrak daun dengan metode aplikasi topikal. BT = ekstrak bunga dengan metode perlakuan ekstrak daun dan bunga T. diversifolia
Perlakuan (%)
18
Penghambatan Perkembangan
Hasil pengamatan menunjukkan terdapat pengaruh aplikasi ekstrak bunga T. diversifolia pada konsentrasi 0.08% terhadap perkembangan pupa menjadi imago
P. xylostella. Sementara ekstrak daun T. diversifolia tidak terlalu berpengaruh terhadap lama hari perkembangan larva menjadi pupa dan pupa menjadi imago (Tabel 5).
Penghambatan Peneluran
Ekstrak T. diversifolia baik daun maupun bunga menunjukkan adanya aktivitas penghambatan peneluran imago P. xylostella. Perlakuan ektrak daun pada konsentrasi 2.80% (LC99) mengakibatkan penghambatan sebesar 87.29% dan pada konsentrasi 5.60% (2 x LC99) penghambatan mencapai 100%. Perla-kuan ekstrak bunga pada konsentrasi 2.50% (LC99) mengakibatkan pengham-batan sebesar 88.09% dan pada konsentrasi 50% (2 x LC99) penghampengham-batan mencapai 95.89% (Tabel 6). Pengamatan menunjukkan persentase penghambatan meningkat seiring dengan peningkatan konsentrasi perlakuan.
Tabel 5 Pengaruh perlakuan ekstrak daun dan bunga T. diversifolia terhadap waktu terbentuknya pupa (WP) dan imago (WI) P. xylostella
Perlakuan (%) Daun (hari)
WP= mulai dari larva insar III, b SD=Standar deviasi, c WI= mulai dari terbentuknya pupa
Tabel 6 Pengaruh ekstrak daun dan bunga T. diversifolia terhadap pengham-batan peneluran imago P. xylostella
19
Pengaruh Ekstrak terhadap Musuh Alami
Hasil pengamatan pada 24 jam setelah perlakuan (JSP) menunjukkan tidak ada pengaruh negatif ekstrak T. diversifolia terhadap parasitoid (musuh alami) D. semiclausum. Namun pada 48 JSP terjadi kematian sebesar 5.5% parasitoid pada perlakuan ekstrak bunga pada konsentrasi 2 x LC99 (Tabel 7). Namun demikian kematian sebesar 5.5% masih termasuk kategori aman berdasarkan kriteria keamanan Hassan et al. (1991).
Fitotoksisitas Ekstrak pada Tanaman Brokoli
Hasil pengamatan menunjukkan secara umum semua perlakuan ekstrak T. diversifolia, daun maupun bunga tidak menunjukkan adanya gejala fitotoksik pada tanaman brokoli. Pengamatan hari kelima terdapat gejala seperti fitotoksik yang terjadi pada perlakuan ekstrak daun pada konsentrasi 2 x LC99, namun gejala itu hanya terjadi pada satu dari enam titik yang diberi perlakuan, dan terjadi pada daun tua.
Pembahasan
Tithonia diversifolia diketahui mengandung beberapa senyawa metabolit sekunder di antaranya sesquiterpen, diterpen, monoterpen dan kandungan ali-siklik yang bersifat toksik yang berasal dari bagian daun, batang, atau bunga (Mkenda et al. 2014, Mkenda dan Ndakidemi 2014). Tanaman ini juga diketahui mengandung senyawa glikosida, tanin, flavonoid, saponin, fenol, terpenoid dan alkaloid (Otusanya dan Ilori 2012). Hasil penelitian menunjukkan perlakuan ekstrak bunga baik dengan metode aplikasi topikal maupun metode residu pada daun, lebih baik daripada ekstrak daun. Hasil tersebut sejalan dengan penelitian Mukasa et al. (2008) yang menyatakan ekstrak bunga T. diversifolia lebih toksik daripada ekstrak daun. Fouad et al. (2014) menyatakan ekstrak bunga T. diversifolia dengan metode aplikasi topikal menjadi salah satu bahan alami yang berpotensi dijadikan sebagai insektisida nabati untuk mengendalikan hama
Sitotroga cereallea (Lepidoptera : Gelechiidae).
Ekstrak bunga T. diversifolia mengandung senyawa fenol, tanin dan
20
berperan sebagai perangsang aktivitas makan yang mengakibatkan serangga uji mati karena banyak memakan senyawa toksik pada daun perlakuan. Menurut Ibrahim et al. (2001) senyawa monoterpen bersifat toksik yang masuk melalui lapisan kutikula (racun kontak), saluran pernafasan dan saluran pencernaan (ra-cun perut) dapat mempengaruhi kematian serangga.
Sesquiterepen dan flavonoid mampu membuka lapisan lipid bilayer yang terdapat di kutikula sehingga mengakibatkan cairan membran meningkat dan permeabilitas sel otot terganggu. Kondisi ini akan melemahkan gerakan serangga dan berakhir dengan kematian (Ivanice et al. 2004).
Selain itu senyawa golongan sesquiterpen dapat bekerja sebagai peng-hambat kerja enzim asetilkolinesterase. Pada kondisi normal asetilkolinesterase berfungsi sebagai pemecah asetilkolin menjadi asam asetat dan kolin yang berfungsi sebagai penghantar impuls dari sel syaraf ke sel otot. Adanya peng-hambatan fungsi asetilkolinesterase mengakibatkan terjadi penumpukkan asetilkolin yang mengakibatkan terjadinya gangguan pada sistem pengantar im-puls ke sel otot, sehingga otot menjadi tidak terkendali dan muncul gejala kejang yang berakhir dengan kematian serangga (Ibrahim et al. 2013). Perbedaan tingkat mortalitas yang ditimbulkan masing-masing perlakuan dapat diakibatkan oleh adanya perbedaan karakteristik dari senyawa metabolit sekunder yang terkandung di dalam masing-masing ekstrak termasuk perbedaan dari cara kerja senyawa tersebut (War et al. 2013).
Hasil penelitian menunjukkan perlakuan dengan metode aplikasi topikal mengakibatkan mortalitas yang lebih cepat dan lebih tinggi dari pada metode residu pada daun, hal ini menunjukkan senyawa kimia yang dominan terkandung dalam ekstrak T. diversifolia bersifat sebagai racun kontak pada P. xylostella, oleh karena itu efek kontak insektisida terhadap musuh alami perlu dilakukan sebagai salah satu syarat untuk menilai kelayakan insektisida untuk diaplikasikan di lapangan.
21 mengakibatkan serangga mati kelaparan dan mengurangi tingkat kerusakan tanaman yang diakibatkan oleh aktivitas makan serangga.
Pada beberapa spesies serangga ordo Lepidoptera, beberapa sesquiterpen lakton dapat menurunkan laju pertumbuhan, meningkatkan lama hari pemben-tukkan pupa, menurunkan berat pupa dan mengurangi laju kelangsungan hidup serangga (Picman 1986). Lama hari terbentuknya imago akan mempengaruhi proses perkembangan selanjutnya seperti proses peneluran. Sehingga apabila terjadi perlambatan pembentukan imago, proses selanjutnya akan terlambat juga. Hasil penelitian ini menunjukkan ekstrak bunga T. diversifolia pada konsentrasi 0.08% berpengaruh nyata terhadap lama hari perkembangan pupa menjadi imago
P. xylostella.
Hasil penelitian menunjukkan ekstrak T. diversifolia, daun maupun bunga memiliki aktivitas penghambat peneluran imago P. xylostella. Semakin tinggi konsentrasi mengakibatkan persentase penghambatan semakin tinggi. Hasil penelitian serupa menunjukkan ekstrak T. diversifolia efektif dalam menghambat peneluran Callosobruchus maculatus. Senyawa kimia yang paling berperan sebagai penghambat peneluran adalah 7-germacranolide dan 4-eudesmonalide (Adedire dan Akinneye 2004).
Penghambatan peneluran mungkin diakibatkan oleh senyawa yang ter-kandung dalam ekstrak T. diversifolia yang bersifat repellent (penolak) terhadap imago P. xylostella, sehingga imago tidak meletakkan telur pada tanaman yang diberi perlakuan ekstrak T. diversifolia (Chagas-Paula et al. 2012). Aktivitas penghambatan peneluran imago P. xylostella akan mempengaruhi populasi serangga generasi berikutnya. Semakin tinggi nilai penghambatan mengakibatkan semakin sedikit jumlah telur yang diletakkan imago, sehingga akan terjadi penurunan jumlah populasi yang muncul pada generasi berikutnya. Hal tersebut akan berpengaruh pada kerusakan tanaman yang diakibatkan oleh aktivitas makan larva. Semakin sedikit jumlah telur yang diletakkan imago maka akan semakin sedikit jumlah larva yang terbentuk sehingga intensitas serangan dan kerusakan tanaman akan menurun.
Keamanan aplikasi insektisida terhadap musuh alami merupakan salah satu syarat kelayakan aplikasi dalam sistem pengendalian hama terpadu (Zarkani et al. 2010). Hasil pengamatan mortalitas D. semiclausum yang diberi perlakuan ekstrak
T. diversifolia baik ekstrak daun maupun bunga menunjukkan bahwa ekstrak T. diversifolia tidak berpengaruh negatif terhadap parasitoid D. semiclausum
sehingga aplikasi insektisida ekstrak T. diversifolia tidak akan mengganggu populasi musuh alami. Di lapangan laju parasitisasi D. semiclausum pada P. xyostella mencapai 35% - 80% (Philips et al. 2014). Dengan demikian pengenda-lian secara kimia dengan insektisida nabati ekstrak T. diversifolia dapat berjalan bersamaan dengan berperannya parasitoid dalam mengendalikan P. xylostella di lapangan.
22
23
SIMPULAN DAN SARAN
Simpulan
Ekstrak bunga Tithonia diversifolia memiliki aktivitas mortalitas lebih tinggi dari pada ekstrak daun terhadap larva P. xylostella baik pada perlakuan dengan metode residu pada daun maupun aplikasi topikal. Baik ekstrak bunga maupun daun T. diversifolia memiliki efek penghambatan aktivitas makan larva dan aktivitas peneluran imago P. xylostella. Ekstrak bunga T. diversifolia
memberikan pengaruh terhadap perkembangan pupa menjadi imago. Ekstrak T. diversifolia tidak berpengaruh negatif terhadap parasitoid D. semiclausum dan tanaman brokoli.
Saran
Perlu dilakukan uji fitokimia dan fraksinasi ekstrak untuk mengetahui senyawa-senyawa yang berperan pada masing-masing parameter pengamatan secara spesifik.
24
DAFTAR PUSTAKA
Adedire CO, Akinneye JO. 2004. Biological activity of tree marigold, Tithonia diversifolia, on cowpea seed bruchid, Callosobruchus maculatus
(Coleoptera: Bruchidae). Ann. appl. Biol. 144:185-189.
Ambarningrum TB, Pratiknyo H, Priyanto S. 2009. Indeks nutrisi dan kesintasan larva Spodoptera litura F. yang diberi pakan mengandung ekstrak kulit jengkol (Pithecellobium lobatum benth). J. HPT Trop 9(2): 109-114.
Ambrosio SR, Oki Y, Gomes-Heleno VC, Chaves JS, Nacimento PGBD, Lichston JE, Gomes-Constantino M, Mouro-Varanda E, Batista Da Costa F. 2008. Constituents of glandular trichomes of Tithonia diversifolia: relationships to herbivory and antifeedant activity. Phytochemistry 69: 2052–2060.
Bernard LK, David SK, Mark NO, Charles MK, Geoffrey RM, Charles M, Laban I,Willy TK. 2012. Larvicidal action of extracts from Tithonia diversifolia
against the dengue mosquito Aedes aegypti (Diptera: Culi-cidae). JBAPN
2(1): 46-49.
[BPS] Badan Pusat Statistik. 2015. Produksi sayuran Indonesia tahun 2011-2015. Capinera JL. 2001. Handbook of Vegetable Pests. California (US) : Academic
Press.
Castano-Quintana K, Montoya-Lerma J, Giraldo-Echeverri C. 2013. Toxicity of foliage extracts of Tithonia diversifolia (Asteraceae) on Atta cepha-lotes
(Hymenoptera : Myrmicinae) workers. Industrial Crops and Products 44: 391– 395.
Chagas-Paula DA, Oliveira RB, Rocha BA, Da Costa FB. 2012. Ethnobotany, chemistry, and biological activities of the genus Tithonia (Asteraceae).
Chemistry & Biodiversity 9: 210-235.
Dadang, Isnaeni N, Ohsawa K. 2007. Ketahanan dan pengaruh fitotoksik cam-puran ekstrak Piper retrofractum dan Annona squamosa pada pengujian semi lapangan. JHPT Trop 7(2): 91-99.
Dadang, Prijono D. 2008. Insektisida Nabati: Prinsip, Pemanfaatan dan Pe-ngembangan. Bogor (ID) : Dept. Proteksi tanaman, Fakultas Pertanian IPB. Dadang, Prijono D. 2011. Pengembangan teknologi formulasi insektisida nabati
untuk pengendalian hama sayuran dalam upaya menghasilkan produk sayuran sehat. JIPI 6(2): 100-111.
Djunaedy A. 2009. Biopestisida sebagai pengendali organisme pengganggu ta-naman (OPT) yang ramah lingkungan. Embryo 6(1): 88-95.
25 Gama RM, Guimaraes M, Abreu LC, Junior JA. 2014. Phytochemical screening and antioxidant activity of ethanol extract of Tithonia diversifolia (Hemsl) A. Gray dry flowers. Asian Pac J Trop Biomed 4(9): 740-742.
Hasanshahi G, Jahan F, Abbasipour H, Salehi-Tabar M, Askarianzadeh A, Karimi J, Rahimi AH. 2014. Biology and demography of the diamonback moth,
Plutella xylostella (Lepidoptera : Plutellidae) on five cauliflower cultivars under laboratory conditions. Acta Ento Sinica 57(1): 61-66.
Hassan SA, Bigler F, Bogenschutz H, Boller E, Brunn J, Calis JNM, Chiverton P, Coremans-Peleseneer J, Duso C, Lewis GB, et al.1991.Results of the fifth joint pesticide testing programme carried out by the IOBC/WPRS-working group ”pesticides and beneficial organisms”. Entomopagha 36 (1): 55-67. Hassanali A, Lwande W. 1989. Antipest Secondary Metabolites from African
Plants. dalam: Arnason LT. Philogene BJR, dan Morand P., Eds., In-secticides of Plant Origin, ACS Symposium Series 387, 23 Februari 1989. American Chemical Society. Washington DC: 78-94.
Herlinda S, Thalib R, Saleh RM. 2004. Perkembangan dan preferensi Plutella xylostella L. (Lepidoptera: Plutellidae) pada lima jenis tumbuhan inang.
Hayati 11(4): 130-134.
Ibrahim M, Farooq T, Hussain N, Hussain A, Gulzar T, Hussain I, Akash MS, Rehmani FS. 2013. Acetyl and butyryl cholinesterase inhibitory sesqui-terpene lactones from Amberboa ramosa. Chemistry Central Journal 7 (116): 1-5.
Ibrahim MA, Kainulainen P, Aflatuni A, Tiilikkala K, Halopainen JK. 2001. Insecticidal, repellent, antimicroba activity and phytotoxicity of essential oils: with special reference to limonene and its suitability for control of insect pest. Agric Food Sci Finl. 10: 243-259.
Isman MB. 2014. Botanical Insecticides : A Global Perspective. in Biopesticide : State of The Art and The Future Opportunities. Washington, DC (US). ACS. Ivanice MC, Sarti SJ, Waib CM, Branco Jr AC. 2004. Evaluation of the potential insecticide activity of Tegetes minuta (Asteraceae) essential oil against the head lice Pediculus humanus capitis (Phthiraptera: Pediculidae). Neotropic Entomol. 33: 805-807.
Jiang T, Wu S, Yang T, Zhu C, Gao C. 2015. Monitoring field populations of
Plutella xylostella (Lepidoptera: Plutellidae) for resistance to eight insecti-cides in China. Flor Ento 98(1): 65-73.
Kalshoven LGE. 1981. The Pests of Crops in Indonesia. Laan PA van der, pe-nerjemah. Jakarta: Ichtiar Baru van Hoeve. Terjemahan dari: De Plagen van de Cultuurgewassen in Indonesie.
Kau CH, Cheng EY. 2001. Insecticides resistence in P. xylostella L. Jour Agric Res China 50(4): 80-89.
Kolawole AO, Olajuyigbe FM, Ajele JO, Adedire CO. 2014. Activity of the Antioxidant Defense System in a Typical Bioinsecticide and Synthetic Insecticide-treated Cowpea Storage Beetle Callosobrochus maculatus F. (Coleoptera: Chrysomelidae). IJIS: 99–108.
LeOra Software. 1987. POLO-PC User’s Guide. Petaluma: LeOra Software. Ling B, Wang G, Ya Ji, Zhang M, Liang G. 2008. Antifeedant activity and active
ingredients against Plutella xylostella from Momordica charantia leaves.
26
Lingathurai S, Vendan SE, Paulraj MG, Ignacimuthu S. 2011. Antifeedant and larvicidal activities of Acalypha fruticosa Forssk. (Euphorbiaceae) against
Plutella xylostella L. (Lepidoptera: Yponomeutidae) larvae. JKSUS 23: 11-16.
Linthoingambi W, Singh MS. 2013. Antimicrobial activities of different solvent extracts of Tithonia diversifolia (Hemsely) A. Gray. Asian J. Plant Sci. Res.
3(5): 50-54.
Mari JM. 2012. Efficacy of Different Plant Extracts Against Diamondback Moth,
Plutella xylostella (L.) on Cauliflower. International Conference on Applied Life Sciences. 10-12 September. Turkey.
Miranda MAFM, Varela RM, Torres A, Molinillo JMG, Gualtieri SCJ, Macias FA. 2015. Phytotoxins from Tithonia diversifolia. J. Nat. Prod: 1-10.
Miresmailli S, Isman MB. 2014. Botanical insecticides inspired by plant– herbivore chemical interactions. Trends in Plant 19(1): 29-35.
Mkenda PA, Mtei K, Ndakidemi PA. 2014. Pesticidal efficacy of Tephrosia vogelii and Tithonia diversifolia against field insect pests of common beans
Phaseolus vulgaris L. within African farming communities. African-American Institute 2 (1): 9-26.
Mkenda PA, Ndakidemi PA. 2014. Pesticidal efficacy of four botanical pesticides on survival, oviposition and progeny development of bruchid, Calloso-bruchus maculatus in stored cowpea, Vigna unguiculata. IJPS 3(12): 1504-1523.
Mukasa D, Olila D, Tinzaara W, Kagezi GH. 2008. Effects of Tithonia and
Phytolacca extracts against the banana weevil, Cosmopolites sordidus
(Germar) (Coleoptera: Curculionidae). AJABS 3(1): 24-29.
Mwanauta RW, Mtei KA, Ndakidemi PA. 2014. Prospective bioactive com-pounds from Vernonia amygdalina, lippia javanica, Dysphania ambro-sioides and Tithonia diversifolia in controlling legume insect pests. Agri Sci
2014(5): 1129-1139.
Olabode OS, Sola O, Akanbi WB, Adesina GO, Babajide PA. 2007. Evaluation of
Tithonia diversifolia (Hemsl.) A Gray for soil improvement. World Journal of Agricultural Sciences 3(4): 503-507.
Osipitan AA, Oseymi AE. 2012. Evaluation of bio-insectisidal potential of some trofical plant extracts against termite (Termitidae: Isoptera) in Ogun State Nigeria. J. Entomol: 1-9.
Otusanya O, Ilori O. 2012. Phytochemical screening and the phytotoxic effects of aqueous extracts of Tithonia diversifolia (Hemsl) A. Gray. IJB 4(3): 97-101. Oyedokun AV, Anikwe JC, Okelana FA, Mokwunye IU, Azeez OM. 2011. Pesticidal efficacy of three tropical herbal plants’ leaf extracts against
Macrotermes bellicosus, an emerging pest of cocoa, Theobroma cacao L.
Journal of Biopesticides, 4 (2): 131-137.
Pardono. 2011. Potensi Chromolaena odorata dan Tithonia diversifolia sebagai sumber nutrisi bagi tanaman berdasarkan kecepatan dekomposisinya.
Agrovigor 4(2): 80-85.
Park JS, Lee SC, Shin BY, Lee, Ahn YJ. 1997. Larvicidal and antifeeding activities of oriental medicinal plat extract four species of forest insect pest.
27 Passreiter CM, Isman MB. 1997. Antifeedant bioactivity of sesquiterpene lactones from Neurolaena lobata and their antagonism by gamma aminobutric acid.
Bio sys and ecol. 25(5): 371-377.
Philips CR, Fu Z, Kuhar TP, Shelton AM, Cordero RJ. 2014. Natural history, ecology, and management of diamondback moth (Lepidoptera: Plutellidae), with emphasis on the United States. J. Integ. Pest Mngmt. 5(3):1-11.
Picman AK. 1986. Biological activities of sesquiterpene lactones. Biochem. Syst. Ecol. 14: 255–281.
Rattan RS. 2010. Mechanism of action of insecticidal secondary metabolites of plant origin. Crop Prot 29: 913–920.
Salaki CL, Paendong E, Pelealu J. 2012. Biopestisida dari ekstrak daun pangi (Pangium sp.) terhadap serangga Plutella xylostella di Sulawesi Utara.
Eugenia 18(3): 171-178.
Salama HS, Sharaby AM. 1988. Feeding deterrence induced by some plants in
Spodoptera littoralis and their potentiating effect on Bacillus thuringiensis
Berliner. Internat J Tropical Insect Sci 9:573–577.
Sarfraz M, Kaddie BA. 2005. Conserving the efficacy of insecticides against
Plutella xylostella (L.) (Lepidoptera : Plutellidae). JEN 129(3): 149–157. SAS Institute, 1990. SAS/STAT User’s Guide, Version 6. Fourth Edition, Volume 2.
North Carolina: SAS Institute Inc.
Sastrosiswojo S, Uhan TS, Sutarya R. 2005. Penerapan Teknologi PHT pada Tanaman Kubis. Bandung(ID). Balai Penelitian Tanaman Sayuran.
Setiawati W, Murtiningsih R, Gunaeni N, Rubiati T. 2008. Tumbuhan Bahan Pestisida Nabati dan Cara Pembuatannya untuk Pengendalian Organisme Pengganggu Tanaman (OPT). Bandung (ID). Balai Penelitian Tanaman Sayuran.
Steel RGD, Torrie JH. 1991. Prinsip dan Prosedur Statistik. Ed ke-2. Sumantri B, penerjemah. Jakarta (ID): Gramedia Pustaka Utama. Terjemahan dari:
Principles and Procedures of Statistics.
Syahputra E. 2008. Bioaktivitas sediaan buah Brucea javanica sebagai insekti-sida nabati untuk serangga hama pertanian. Bul. Littro. 19(1): 57- 67. Syed TS, Abro GH, Ahmed S. 2004. Efficacy of different insecticides against
Plutella xylostella under field conditions. Pak Jour of Bio Sci 7(1): 10-13. Utami S, Syaufina L, Haneda NF. 2010. Daya racun ekstrak kasar daun bintaro
(Cerbera odollam Gaertn) terhadap larva Spodoptera litura Fabricius. JIPI
15(2) : 96-100.
War AR, Paulraj MG, Husain B, Buhroo AA, Ignacimuthu S, Sharma HC. 2013. Effect of plant secondary metabolites on legume pod borer, Helicoverpa armigera. J Pest Sci 86: 399–408.
Wardhana AH, Diana N. 2014. Aktivitas biolarvasidal ekstrak metanol daun kipahit (Tithonia diversifolia) terhadap larva lalat Chrysomya bezziana.
JITV 19(1): 43-51.
Webb SE. 2002. Insect management for crucifers (cole crops) (broccoli, cabbage, cauliflower, collards, kale, mustard, radishes, turnips). University of Florida. Wei H, Liu J, Li B, Zhan Z, Chen Y, Tian H, Lin S, Gu X. 2015. The toxicity and physiological effect of essential oil from Chenopodium ambrosioides
against the diamondback moth, Plutella xylostella (Lepidoptera: Plutellidae).
28
Xia Y, Lu Y, Shen J, Gao X, Qiu H, Li J. 2014. Resistance monitoring for eight insecticides in Plutella xylostella in Central China. Crop Protection 30: 1-7. Yuliadhi KA, Sudiarta P. 2012. Struktur komunitas hama pemakan daun kubis
dan investigasi musuh alaminya. Agrotrops 2(2): 191-196.
Yunita EA, Suprapti NH, Hidayat JW. 2009. Pengaruh ekstrak daun teklan
(Eupatorium riparium) terhadap mortalitas dan perkembangan larva Aedes aegypti. Bioma 11(1): 11-17.
Zarkani A, Prijono D, Pudjianto. 2010. Efikasi insektisida nabati ekstrak daun
Tephrosia vogelii Hook. terhadap Crocidolomia pavonana (F.) dan Plutella xylostella (L.) serta pengaruhnya pada Diadegma semiclausum (Hellen).
29
30
Lampiran 1 Rata-rata mortalitas larva P. xylostella pada perlakuan ekstrak daun dan bunga T. diversifolia dengan metode residu pada daun
Perlakuan/ konsentrasi
(%)
Mortalitas larva pada pengamatan ke- (JSP)a (individu + SDb)
24 48 72 96 120 144
---Ekstrak daun--- 0.00 0.0 + 0.0 0.0 + 0.0 0.0 + 0.0 0.0 + 0.0 0.0 + 0.0 0.0 + 0.0 0.02 0.0 + 0.0 0.0 + 0.0 2.0 + 0.9 5.0 + 1.0 9.0 + 1.5 9.0 + 1.5 0.04 0.0 + 0.0 0.0 + 0.0 2.0 + 0.6 6.0 + 0.5 11.0 + 0.5 16.0 + 0.5 0.09 0.0 + 0.0 2.0 + 0.6 5.0 + 0.7 10.0 + 1.2 18.0 + 1.8 36.0 + 1.1 0.22 0.0 + 0.0 3.0 + 0.6 11.0 + 0.8 22.0 + 1.3 30.0 + 1.1 43.0 + 1.1 0.97 0.0 + 0.0 4.0 + 0.8 12.0 + 0.6 24.0 + 0.8 32.0 + 0.9 47.0 + 0.9 ---Ekstrak bunga---
0.00 0.0 + 0.0 0.0 + 0.0 0.0 + 0.0 0.0 + 0.0 0.0 + 0.0 0.0 + 0.0 0.01 0.0 + 0.0 2.0 + 0.6 8.0 + 1.8 13.0 + 2.3 22.0 + 1.5 22.0 + 1.5 0.04 2.0 + 0.6 8.0 + 1.1 12.0 + 2.3 15.0 + 2.5 31.0 + 0.5 33.0 + 0.9 0.08 2.0 + 0.6 8.0 + 1.1 13.0 + 1.3 18.0 + 1.7 35.0 + 1.2 38.0 + 0.6 0.19 2.0 + 0.6 9.0 + 0.8 15.0 + 1.2 22.0 + 2.2 38.0 + 1.1 42.0 + 0.6 0.86 2.0 + 0.6 13.0 + 0.6 18.0 + 0.6 25.0 + 1.0 41.0 + 0.8 49.0 + 0.5 a