TRANSFORMASI GENETIK PADA PADI INDICA
MENGGUNAKAN METODE INFEKSI AWAL JARINGAN
SKUTELUM
Melania
Departemen Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
TRANSFORMASI GENETIK PADA PADI INDICA
MENGGUNAKAN METODE INFEKSI AWAL JARINGAN
SKUTELUM
MELANIA
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
Departemen Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Judul Skripsi : Transformasi Genetik Pada Padi Indica Menggunakan Metode
Infeksi Awal Jaringan Skutelum
Nama
: Melania
NRP
: G34060231
Disetujui
Pembimbing I
Pembimbing II
Dr.Ir. Suharsono, DEA
Dr.Ir. Sri Koerniati, M.Sc
(NIP. 19610428 198703 1 003)
(NIP. 19610916 198603 2 001)
Mengetahui
Ketua Departemen Biologi
Dr.Ir. Ence Darmo Jaya Supena, M.Si
(NIP. 19641002 198903 1 002)
PRAKATA
Puji dan syukur penulis haturkan pada Tuhan Yang Maha Esa atas terselenggaranya penelitian dan pembuatan karya ilmiah dengan judul Transformasi Genetik Pada Padi Indica Menggunakan Metode Infeksi Awal Jaringan Skutelum. Penelitian dilaksanakan selama enam bulan dari Maret 2010 sampai dengan Agustus 2010 bertempat di Laboratorium Biologi Molekular milik Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian, Bogor. Selama menjalankan penelitian, penulis mendapatkan pengetahuan baru terkait kultur jaringan dan transformasi.
Pada kesempatan ini penulis ingin mengucapkan terima kasih kepada :
1. Kedua orang tua dan kelurga yang telah memberikan bantuan moril berupa nasehat, doa, dorongan semangat dan kasih sayang.
2. Bapak Dr.Ir.Suharsono, DEA selaku pembimbing pertama yang telah bersedia membimbing dan memberikan saran pada penulis selama dalam pengerjaan karya ilmiah ini.
3. Ibu Dr.Ir.Sri Koerniati, M.Sc. selaku pembimbing kedua yang telah meluangkan waktu untuk membimbing penulis selama dalam penelitian dan pembuatan karya ilmiah. 4. Kak Hani Widhianata yang telah bersedia menjelaskan banyak hal selama penelitian
berlangsung.
5. Kak Fauziatun Nisak yang telah memberi masukan kepada penulis. 6. Kak Anto yang telah membantu selama proses penelitian.
7. Pak Hery, Pak Umar, Ibu Nur dan semua staf di kelompok peneliti Biologi Molekular yang telah membantu pelaksanaan penelitian dari awal pealaksanaan hingga akhir. 8. Novita, Sira, Dorothy, Magda, Vina, Laila, kakak kelas dan teman-teman Biologi 43 yang
telah memberikan dukungan dan semangat kepada penulis. Demikianlah karya tulis ini dibuat, semoga bermanfaat.
Bogor, 29 Oktober 2010
RIWAYAT HIDUP
Penulis dilahirkan lalu di Jakarta pada tanggal 24 Februari 1989 dan merupakan anak tunggal dari pasangan ayah Djohan Tjahaya dan ibu Inawaty Taher. Penulis bersekolah di SD St. Agnes Padang pada tahun 1994 selama 6 tahun. Pada tahun 2000 penulis melanjutkan pendidikan di SMP St. Maria dan pada tahun 2003 di SMU Don Bosco Padang. Penulis kemudian diterima masuk di Institut Pertanian Bogor pada tahun 2006 melalui jalur seleksi penerimaan mahasiswa baru dan menjadi bagian dari mahasiswa Biologi pada tahun 2007.
Selama masa perkuliahan, penulis aktif menjadi anggota sekretariat Keluarga Mahasiswa Katholik IPB (Kemaki). Penulis juga aktif menjadi anggota beberapa kepanitian yang diadakan oleh IPB seperti menjadi anggota sie acara Revolusi Sains pada tahun 2008, anggota leading
operational pada acara Pesta Sains 2008, leading operational pada acara LCTB (Lomba Cepat
ABSTRAK
MELANIA. Transformasi Genetik Pada Padi Indica Menggunakan Metode Infeksi Awal Jaringan Skutelum. Dibimbing oleh Dr.Ir.SUHARSONO, DEA dan Dr.Ir.SRI KOERNIATI, M.Sc
Transformasi genetik pada padi indica yaitu varietas Ciherang, Inpari6, dan Bio110 telah berhasil dilakukan dengan menggunakan Agrobacterium tumefaciens strain AGL1 yang mengandung gen SNAC1 dan Agrobacterium tumefaciens strain EHA105 yang mengandung gen
HVA1 yang diinfeksikan ke jaringan skutelum biji yang berkecambah. Vektor biner yang terdapat di dalam kedua A. tumefaciens tersebut mengandung gen penanda seleksi higromisin fosfotransferase (hpt). Efisiensi transformasi pada Ciherang adalah 5,69%, dan pada Inpari6 1,6%-5,88%. Setelah regenerasi, transformasi ini menghasilkan 18 tanaman putatif transgenik yang resisten terhadap agen seleksi higromisin. Analisis PCR terhadap tanaman putatif transgenik menunjukkan bahwa 14 tanaman mengandung gen sisipan hpt yang terdiri dari 7 padi Ciherang, dan 7 padi Inpari6.
ABSTRACT
MELANIA. Genetic Transformation of Indica Rice Use Early Infection of Scutellum Tissue. Supervised by Dr.Ir.SUHARSONO, DEA and Dr.Ir.SRI KOERNIATI, M.Sc.
Genetic transformation of indica rice cultivar such as Ciherang, Inpari6, and Bio110 were successfully use Agrobacterium tumefaciens strain AGL1 contains SNAC1 gene and A.tumefaciens
PENDAHULUAN
Latar Belakang
Padi indica merupakan salah satu subspesies padi yang ada di dunia. Padi indica umumnya terdapat di daerah tropis sehingga termasuk varietas hari panjang. Padi ini sensitif terhadap beberapa kondisi stres abiotik seperti salinitas, kekeringan, dan rentan terkena penyakit (Saharan, 2004). Suatu usaha perlu dilakukan untuk mengatasi masalah tersebut, salah satunya adalah dengan transformasi genetik.
Transformasi genetik menggunakan bantuan bakteri Agrobacterium tumefaciens
sudah banyak diaplikasikan untuk mendapatkan varietas-varietas tanaman unggul yang toleran terhadap kekeringan. Teknik ini memiliki beberapa keunggulan seperti efisiensi transformasi dengan salinan gen tunggal yang tinggi, dapat dilakukan dengan peralatan sederhana, dan pengerjaannya mudah (Rahmawati, 2006).
Meskipun keberhasilan transformasi padi indica telah dilaporkan namun tingkat efisiensinya masih rendah atau keberhasilannya hanya terjadi pada genotipe tertentu (Zhang et al, 1997). Beberapa peneliti seperti Zhang et al (1997), Mohanty et al (1999), Kumria et al (2001), Khanna & Raina (2002) telah melakukan percobaan transformasi terhadap beberapa varietas padi indica. Frekwensi keberhasilan transformasi yang dilakukan pada varietas IR72 sebesar 4,2%, pada varietas IR64 sebesar 2,5%, sedangkan pada varietas TSC10 hanya sebesar 0,7% (Hiei & Toshihiko, 2006). Keberhasilan transformasi padi indica yang telah dilaporkan ini menggunakan metode kalus embriogenik dan immature embryo.
Sifat toleran kekeringan disandikan oleh banyak gen. Shinozaki dan Yamaguchi (1997) mengklasifikasikan gen-gen tersebut ke dalam dua kelompok utama. Pertama, gen penyandi protein yang terkait dengan perlindungan sel selama kekeringan (proteksi makromolekul, enzim untuk biosintesis osmolit, enzim detoksifikasi, aliran air, transpoter) contohnya gen HVA1 ; dan kedua adalah gen penyandi protein regulator (protein kinase, protein fosfat, enzim fosfolipid serta faktor transkripsi) contohnya gen SNAC1 (Shinozaki & Yamaguchi, 1997).
Gen HVA1 pertama kali diisolasi
dari permukaan aleuron biji barley
(Hordeum vulgare L.) sebagai
ABA-inducible-gen. Gen HVA1 menyandikan
golongan 3 protein LEA (3 late embryogenesis abundant). Protein LEA berperan dalam pemeliharaan protein atau struktur membran, perintah ion, pengikatan air, operasi molekul chaperon dan menjaga toleransi kekeringan pada tanaman padi transgenik melalui perlindungan sel membran (Xu D et al, 1996).
SNAC1 adalah faktor transkripsi yang
berperan dalam pengendali sifat ketahanan stres abiotik yaitu salinitas, dan kekeringan pada stadia reproduktif padi. SNAC1 diinduksi di dalam sel penjaga oleh kekeringan dan menyandi faktor transkripsi NAM, ATAF, dan CUC (Hu et al, 2006).
Tujuan
Penelitian ini bertujuan untuk mengetahui efisiensi transformasi genetik pada beberapa varietas padi indica menggunakan metode infeksi awal jaringan skutelum.
BAHAN DAN METODE
Penelitian dilakukan di laboratorium Biologi Molekular, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian Bogor dan dilaksanakan dari bulan Maret 2010 hingga Agustus 2010.
Agrobacterium tumefaciens strain AGL1 yang
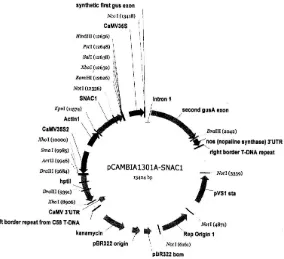
mengandung vektor biner pCambia1301 (Lampiran 1) yang telah disisipi gen SNAC1
(Nisak, 2009) serta Agrobacteriumtumefaciens
strain EHA105 dengan vektor biner pAY560326 (Lampiran 1) yang mengandung
gen HVA1 (Widhianata, 2010) digunakan untuk
transformasi genetik padi indica varietas Inpari6, Ciherang, dan Bio110.
Pembuatan Sel Kompeten Agrobacterium tumefaciens strain EHA105
Koloni tunggal Agrobacterium
tumefaciens strain EHA105 ditanam pada media
LB cair yang mengandung rifampicin 50 mg/ml, diinkubasi dan digoyang selama 48 jam pada suhu ruang. Kultur bakteri diukur nilai OD600 hingga mencapai nilai 0.4 – 0.8.
Sebanyak 1 ml biakan bakteri yang telah diukur OD nya dimasukkan dalam eppendorf 1,5ml lalu disentrifuse dengan kecepatan 5000 rpm selama semenit pada suhu 40C. Supernatan yang terbentuk dibuang kemudian ditambahkan 1 ml CaCl2. Setelah dihomogenkan biakan bakteri
semenit pada suhu 40C. Supernatan yang terbentuk dibuang dan endapan yang tertinggal ditambah dengan 200µl CaCl2.
Setelah dihomogenkan sebentar, biakan bakteri diinkubasi kembali di dalam es selama 15 menit. Sel kompeten bakteri siap untuk ditransformasi.
Transformasi Agrobacterium tumefaciens strain EHA105 Dengan Gen HVA1
Sebanyak 1µl plasmid pAY560326 yang mengandung gen HVA1 dicampur dengan 100µl sel kompeten. Biakan bakteri diinkubasi di dalam es selama 30 menit kemudian diberi perlakuan heatshock
dengan suhu 420C selama 50 detik. Suspensi sel ditambah 750µL media LB (Lampiran 2) dan diinkubasi dalam shaker bergoyang pada suhu ruang selama 60 menit. Setelah 60 menit, biakan bakteri disentrifuse dengan kecepatan 6000 rpm selama 2 menit.
Endapan yang terbentuk ditambah dengan 5 µL media LB yang digunakan untuk melarutkan endapan, kemudian disebar ke media LB padat yang mengandung rifampicin 50 mg/L dan kanamycin 50 mg/l dan diinkubasi dalam inkubator pada suhu 270C selama 2 hari. Bakteri dengan koloni tunggal dipilih kemudian dibiakkan dalam 5ml LB cair yang telah ditambahkan 50mg/l rifampicin dan 50mg/l kanamycin. Kultur bakteri kemudian diinkubasi di shaker bergoyang selama 2 hari.
Konfirmasi Hasil Transformasi
PCR dilakukan untuk melihat keberhasilan transformasi. Proses PCR yang dilakukan menggunakan enzim Taq polymerase supermix (Invitrogen) dan primer spesifik gen HVA, 5’-TGGCCTCCAACCAGAACCAG-3’
(Forward primer) dan
5’-ACGACTAAAGGAACGGAAAT-3’
(Reverse primer). Satu kali reaksi PCR
mengandung 10ng DNA template bakteri
(Stok dalam 1µL), 1µL Primermix dan
22.5µL Taq polymerase.
PCR dilakukan dengan 20 siklus dengan kondisi reaksinya adalah pra denaturasi pada suhu 950C selama 2 menit, denaturasi pada 940C selama 1 menit, tahap
annealing pada suhu 500C selama 45 detik,
extension awal pada 720C selama 1 menit,
dan extension akhir pada suhu 720C selama 15 menit. Tahap termination pada suhu 100C
selama 15 menit, dan perlahan suhu turun pada 40C. Produk PCR kemudian dimigrasikan dalam 1% gel agarose dalam bufer TAE 1x (Lampiran 3).
Penumbuhan Agrobacterium tumefaciens
Setelah dikonfirmasi dengan PCR, bakteri yang mengandung gen HVA1 kemudian ditumbuhkan dalam media AB (Lampiran 2) yang mengandung 50mg/l higromisin dan 50mg/l kanamisin. Kultur diinkubasi selama 2-3 hari dalam inkubator bersuhu 270C dan bakteri siap untuk digunakan.
Persiapan Eksplan
Benih padi varietas Ciherang, Inpari 6, Bio 110 terlebih dahulu disterilisasi. Benih disterilisasi dengan cara merendam benih padi dalam alkohol 70% selama 1 menit. Kemudian benih padi direndam selama 30 menit dalam larutan bayclean 20% yang telah ditambahkan satu tetes larutan Tween. Selanjutnya benih dibilas dengan akuades steril beberapa kali dan dikeringanginkan beberapa saat. Benih kemudian ditanam dalam media pre kultur N6D (Lampiran 4) dan disimpan dalam ruang gelap selama 5 hari.
Transformasi Kecambah Padi
Benih yang telah berkecambah ditransformasi dengan cara merendam kecambah dalam larutan AAM (Lampiran 4) yang telah mengandung bakteri Agrobacterium
tumefaciens dengan OD600 0,02 selama 15
menit. Setelah dikeringkan, benih ditanam pada media kokultivasi 2N6-AS (Lampiran 4) di dalam ruang gelap selama 4 hari.
Seleksi, Regenersi, dan Aklimatisasi
Setelah kokultivasi selama 4 hari, eksplan dipindahkan ke media seleksi N6D-AB (Lampiran 4) yang mengandung 100mg/l vancomisin, 400mg/l cefotaxime, dan 50mg/l higromisin dan diinkubasi dalam ruang gelap pada suhu 230C selama seminggu. Eksplan kemudian disubkultur ke media yang sama selama seminggu.
seminggu. Kemudian planlet siap ditanam di rumah kaca.
Isolasi DNA Total Tanaman dan PCR
Isolasi DNA dalam jumlah yang sedikit, dilakukan menggunakan alat Retsch Miller MM301. Sebanyak 0,5-1 g sampel daun dimasukkan dalam tabung dengan ironball didalamnya untuk menjaga agar tetap dingin dan tidak merusak jaringan daun, nitrogen cair dituangkan ke dalam tabung dan ditutup. Tabung diletakkan pada Retsch Miller MM301 untuk proses penggerusan.
Sebanyak 400µL larutan penyangga (Lampiran 5) ditambahkan ke dalam tabung yang berisi suspensi sel daun, digoyang dalam waterbath 650C selama 15 menit. Sebanyak 400µL larutan chloroform : isoamylalcohol (24:1) ditambahkan ke dalam suspensi sel, dicampur perlahan-lahan dan digoyang selama 15 menit. Suspensi sel disentrifuge dengan kecepatan 12000rpm selama 5 menit. Supernatant yang terbentuk diambil, dipindahkan dalam minitube baru. Etanol absolute dingin ditambahkan sebanyak 2X volume supernatant dan dibalik-balik perlahan, didiamkan dalam es selama 15-30 menit, kemudian disentrifuge dengan kecepatan 12000rpm selama 15 menit. Endapan dicuci dengan menambahkan etanol 70% dan disetrifuge 12000rpm selama 15menit. Supernatan yang terbentuk dibuang. Pencucian ini dilakukan 2 kali. DNA berupa endapan dalam minitube dikeringkan dengan oven. Kemudian DNA dilarutkan dalam 100 µL TE (Lampiran 6) yang mengandung 10µg/ml RNase untuk menghilangkan RNA.
Tahapan terakhir adalah PCR. Kondisi PCR yang dilakukan adalah sama dengan kondisi PCR yang dilakukan untuk mengkonfirmasi keberadaan gen HVA pada bakteri. Komposisi reaksi PCR yang digunakan tertera pada lampiran 7.
Analisis Hasil
Hasil yang didapat kemudian dianalisis dengan cara menghitung efisiensi transformasi dan efisiensi regenerasi. Efisiensi transformasi didefinisikan sebagai jumlah eksplan yang menghasilkan tanaman transgenik dibandingkan dengan total eksplan yang ditransformasi. Efisiensi regenerasi didefinisikan sebagai jumlah eksplan yang menghasilkan tunas dibandingkan dengan jumlah eksplan yang ditumbuhkan di media regenerasi (Lee, 2004).
HASIL
Transformasi dengan menggunakan dua konstruksi gen berbeda dengan strain bakteri yang berbeda yaitu A. tumefaciens strain AGL1 yang mengandung plasmid pCambia 1301-SNAC1 dan A. tumefaciens strain EHA105 yang mengandung plasmid pAY560326-HVA1 telah menghasilkan tanaman padi transgenik.
Setelah dikulturkan dalam media N6 (Lampiran 4) selama 5 hari, benih membentuk kecambah seperti pada gambar 1 yang dijadikan eksplan. Eksplan kecambah yang ditransformasi, diseleksi dan diregenerasikan membentuk plantlet pada hari ke 47 (Gambar 2). Hanya satu tunas plantlet yang dapat dihasilkan oleh satu eksplan. Planlet yang terbentuk kemudian dipindahkan ke ember (Gambar 3). Hasil percobaan transformasi padi indica disajikan pada tabel 1.
Gambar 3 Padi indica cv Ciherang dan Inpari 6 putatif transgenik
Keterangan : No. 2 adalah padi indica cv Inpari 6 yang ditransformasi dengan AGL1-SNAC1 No. 18 adalah padi indica cv Inpari 6 yang ditransformasi dengan EHA105-HVA1 No. 3 adalah padi indica cv Ciherang yang ditransformasi dengan EHA105-HVA1
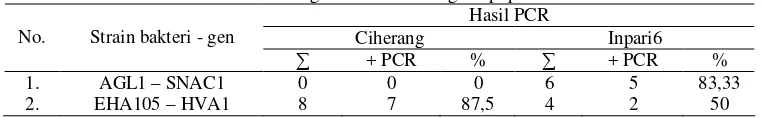
Tabel 1 Efisiensi transformasi padi indica yang ditransformasi dengan A.tumefaciens strain AGL1 (gen SNAC1) dan strain EHA105 (gen HVA1)
AGL1 – SNAC1 EHA105 – HVA1
Ciherang Inpari6 Bio110 Ciherang Inpari6 Bio110 Parameter yang diamati
∑ % ∑ % ∑ % ∑ % ∑ % ∑ %
Jumlah eksplan yang ditransformasi
110 - 85 - 107 - 123 - 125 - 68 -
Jumlah eksplan tahan higromisin 22 20 27 31,76 10 9,34 47 38,21 25 20 10 14,71 Jumlah eksplan yang beregenerasi 3 13,64 8 29,63 0 0 13 27,66 6 24 0 0 Jumlah plantlet yang hidup
setelah aklimatisasi 0 0 6 - 0 0 8 - 4 - 0 0
Jumlah tanaman transgenik 0 0 5 5,88 0 0 7 5,69 2 1,6 0 0
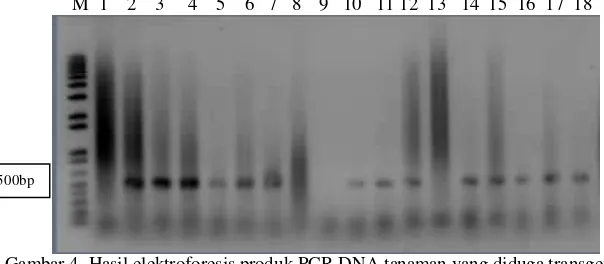
Analisis integrasi transgen ke dalam genom padi dilakukan dengan PCR menggunakan primer spesifik untuk gen hpt. Hasil PCR dimigrasikan di gel dengan elektroforesis dengan menggunakan 1kb
ladder plus (Invitrogen) sebagai penanda ukuran DNA. Hasil elektroforesis DNA hasil PCR dari tanaman yang diduga transgenik dan non transgenik disajikan pada gambar 4, dan diringkas di tabel 2.
M 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
Gambar 4 Hasil elektroforesis produk PCR DNA tanaman yang diduga transgenik. M: marker, 1,8,9 & 13: tidak ada sisipan gen hpt, 2-7, 10-12 &14-18: sisipan gen hpt teramplifikasi
Tabel 2 Ringkasan hasil PCR gen hpt padi indica
Transformasi diawali dengan mengkulturkan benih selama 5 hari dalam media N6 sesuai dengan metode yang dilakukan oleh Toki et al (2006). Menurut Toki et al (2006) jaringan skutelum yang berasal dari kecambah yang berumur 5 hari cocok dijadikan target transformasi karena sel-selnya telah menjadi kompeten. Sterilisasi menggunakan alkohol dengan penambahan larutan Tween 20 bukan hanya efektif dalam mensterilkan benih tapi juga mampu menghilangkan berbagai jenis minyak dan parafin dari benih yang dapat menghalangi penetrasi ke jaringan skutelum. Beberapa faktor dapat menjelaskan tentang keberhasilan transformasi ini. Selain sifat sel, masa periode eksplan juga menentukan. Semakin cepat eksplan ditanam dalam kondisi in vitro, semakin tinggi efisiensinya. Kemampuan regenerasi akan semakin menurun jika berada dalam kondisi in vitro yang lama (Wu et al, 1998).
Keberhasilan suatu transformasi genetik sangat terkait dengan keberhasilan pembentukan planlet dan sistem regenerasi tanaman. Menurut Ge et al (2006) potensi regenerasi kultur jaringan padi sangat tergantung pada beberapa faktor seperti genotipe tanaman donor, komposisi dan konsentrasi garam, komponen organik dan hormon pengatur pertumbuhan dalam media. Dari sejumlah faktor tersebut genotipe merupakan faktor utama.
Media N6 adalah media yang digunakan untuk regenerasi tanaman dengan metode sederhana seperti kalus yang berasal dari embrio dewasa (Rance et al 1994). Pembengkakan pada jaringan skutelum mulai terlihat di hari ketiga di media N6 karena penambahan asam amino seperti prolin, glutamin, dan casamino acid (Hare & Cress, 1997).
Tabel 1 memperlihatkan perbedaan hasil transformasi menggunakan konstruksi gen dan strain bakteri yang berbeda. Total benih yang ditransformasi menggunakan AGL1-SNAC1 ada sebanyak 302 benih dan
sebanyak 316 benih yang ditransformasi menggunakan EHA105-HVA1.
Hasil menunjukkan bahwa padi Ciherang memiliki efisiensi transformasi yang baik pada transformasi dengan EHA105-HVA1 yaitu sebesar 5,69%. Sebaliknya padi Inpari6 lebih efisien pada transformasi menggunakan AGL1-SNAC1 dengan efisiensi sebesar 5,88%. Sementara besar efisiensi padi Inpari6 dengan menggunakan EHA105-HVA1 adalah 1,6%.
Kondisi terbaik perlu diciptakan agar transformasi lebih efektif. Kondisi yang turut berperan antara lain waktu perendaman eksplan dalam suspensi bakteri, penggunaan asetosyringone, lama kokultivasi, dan konsentrasi bakteri yang digunakan (Ozawa, 2009). Lama perendaman jaringan dalam suspensi bakteri berpengaruh terhadap persentase regenerasi eksplan. Semakin lama eksplan direndam maka kesempatan bakteri untuk menenpel dan menginfeksi eksplan tersebut juga akan semakin lama sehingga peluang untuk transfer T-DNA ke dalam genom tanaman akan lebih tinggi (Purnamaningsih, 2010).
Menurut Siregar (1999), tanaman monokotil lebih sulit diinfeksi oleh A.
tumefaciens sehingga biasanya membutuhkan
waktu perendaman yang lebih lama. Namun jika perendaman dilakukan lebih dari 30 menit akan menyebabkan infeksi bakteri terlalu banyak sehingga jaringan tanaman menjadi stres dan tidak dapat tumbuh. Waktu perendaman yang digunakan pada penelitian ini adalah 15 menit.
Lamanya kokultivasi antara bakteri dan eksplan menentukan keefektifan kerja bakteri. Idealnya waktu kokultivasi berkisar 3-5 hari. Apabila waktu terlalu cepat, infeksi bakteri kurang baik sehingga bakteri belum bekerja optimal mentransfer T-DNA ke jaringan sel. Jika waktu terlalu lama akan menimbulkan infeksi bakteri yang berlebih. Waktu kokultivasi pada penelitian ini adalah 4 hari.
tanaman memproduksi senyawa fenolik (Godwin, 1991). Konsentrasi OD600 bakteri
merupakan faktor selanjutnya. Konsentrasi yang disarankan adalah 0,01-0,1. Konsentrasi yang terlalu besar akan menyebabkan pertumbuhan yang berlebihan, sementara konsentrasi yang terlalu kecil tidak akan efektif. Oleh sebab itu, pada penelitian ini konsentrasi yang dipakai adalah 0,02 (Ishida et al, 1996).
Kecepatan eksplan berproliferasi pada medium seleksi yang mengandung higromisin 50 mg/l menunjukkan kemampuan eksplan mendetoksifikasi higromisin pada media. Hal ini merupakan indikasi awal bahwa gen yang diintroduksikan terdapat dalam genom tanaman meskipun masih harus dibuktikan dengan analisis PCR (Maftuchah, 2003). Penggunaan antibiotik seperti higromisin pada media seleksi bertujuan untuk menyeleksi galur transgenik.
Higromisin merupakan sistem seleksi untuk ketahanan antibiotik yang banyak digunakan pada tanaman monokotiledon terutama graminae (Bashir et al, 2004). Higromisin akan menghambat sintesis protein dengan mengganggu translokasi sehingga menyebabkan kesalahan translasi pada ribosom 80S. Enzim higromisin fosfotransferase yang dihasilkan gen hpt, dapat mendetoksifikasi antibiotik higromisin B dan mengkatalis fosforilasi kelompok hydroxyl dalam higromisin sehingga menjadi tidak aktif dan tidak meracuni sel tanaman (Bashir et al, 2004). Penggunaan higromisin dengan konsentrasi 50mg/L masih memungkinkan adanya tanaman tidak terseleksi yaitu tanaman yang tahan higromisin tapi tidak mengandung gen target. Sehingga peningkatan kosentrasi higromisin secara bertahap diharapkan dapat menekan pertumbuhan tanaman non transgenik (Park, 1996).
Pada penelitian ini regenerasi diupayakan melalui organogenesis langsung yaitu eksplan langsung membentuk tunas dan menghindarkan pembentukan kalus. Setelah transformasi, kurang lebih pada hari ke 39 mulai terbentuk calon tunas berwarna hijau. Spot berwarna hijau yang akan beregenerasi menjadi calon tunas terbentuk di media regenerasi. Regenerasi terus berlangsung hingga membentuk plantlet sempurna sekitar hari ke 47 setelah transformasi (terlihat pada gambar 2). Eksplan yang dapat beregenerasi tidak
semuanya dapat membentuk tunas yang hidup. Beberapa eksplan tetap membentuk calon tunas, tetapi calon tunas tersebut menjadi coklat dan akhirnya mati. Beberapa tunas yang pada awalnya dapat tumbuh dengan baik setelah disubkultur beberapa kali tidak dapat bertahan hidup dan akhirnya mati.
Jumlah waktu yang dibutuhkan adalah relatif sama untuk kedua galur A. tumefaciens
yang digunakan untuk transformasi. Total waktu yang diperlukan pada penelitian ini jika dibandingkan dengan metode serupa yang diaplikasikan pada padi japonica lebih lama. Total waktu yang dibutuhkan padi japonica untuk tumbuh adalah sekitar 36 hari (Toki et al, 2005). Namun, jika dibandingkan dengan metode immature embryo dan kalus embriogenik, total waktu 47 hari tergolong singkat.
Dari 141 eksplan yang tahan higromisin, hanya 30 eksplan yang mampu beregenerasi membentuk 30 tunas. Dari 30 plantlet hanya 18 plantlet yang dapat tumbuh normal setelah aklimatisasi, lainnya mengalami kematian akibat perbedaan kondisi lingkungan. Tanaman transgenik memerlukan waktu kurang lebih sebulan agar dapat tumbuh tegak besar (Lampiran 8).
Analisis molekular untuk melihat hasil transformasi berupa keberadaan gen hpt yang telah masuk pada tanaman regeneran dilakukan dengan PCR. Total 18 tanaman yang berhasil tumbuh terdiri dari 8 tanaman padi Ciherang dan 10 tanaman padi Inpari6. DNA dari 18 nomor tanaman yang ada telah berhasil diisolasi dan dilakukan PCR. Hasil PCR menunjukkan 14 tanaman mengandung gen hpt dengan ukuran pita DNA 500 bp (Tabel 2). Hal ini menunjukkan bahwa tanaman tersebut adalah transgenik
Tanaman transgenik yang berhasil tumbuh adalah varietas Ciherang dan Inpari6. Sebanyak 7 tanaman padi Ciherang transgenik diperoleh dari transformasi dengan EHA105-HVA1 dan 6 tanaman padi Inpari6 transgenik terdiri dari 5 tanaman dari transformasi dengan AGL1-SNAC1 dan 1 tanaman dari transformasi dengan EHA105-HVA1.
menghasilkan tanaman padi transgenik hanya pada satu varietas padi indica yaitu Basmati 370 (data tidak ditunjukkan). Meskipun angka efisiensi yang didapat kecil, namun hasil penelitian ini membuktikan bahwa metode infeksi awal pada jaringan skutelum dapat menghasilkan 14 tanaman transgenik padi indica dengan efisiensi transformasi berkisar antara 1,6%-5,88%.
KESIMPULAN DAN SARAN
Kesimpulan
Sebanyak 18 tanaman telah berhasil diregenerasikan dari hasil transformasi menggunakan metode infeksi awal jaringan skutelum. Setelah PCR, dari 18 tanaman 14 tanaman adalah transgenik yang berasal dari varietas Inpari6 dan Ciherang. Transformasi menggunakan Agrobacterium tumefaciens
strain EHA105–HVA1 lebih efisien dari pada strain AGL1-SNAC1 dengan efisiensi transformasi pada padi Ciherang adalah 5,69% dan pada padi Inpari6 1,6-5,88%.
Saran
Untuk memastikan tanaman yang dihasilkan adalah transgenik dan mengetahui jumlah kopi dari DNA sisipan, hibridisasi Southern terhadap 14 tanaman transgenik perlu dilakukan.
Ucapan terima kasih dihaturkan atas terselenggaranya penelitian ini yang sepenuhnya didanai oleh proyek BB-Biogen.
DAFTAR PUSTAKA
Bashir et al. 2004. Hygromycin based selection of transformant in a local inbred line of Zea mays (L).
Pakistan Journal of Biological
Sciencs 7 : 18-323.
Ge X, Chu Z, Lin Y, and Wang S. 2006. A tissue culture system for different germplasms of indica rice. Plant
Cell Report 25 : 392-402.
Godwin I, Todd G, Ford B, Newburry HJ. 1991. The effect of acetosyringone
and pH on Agrobacterium
-mediated transformation varies according to plant species. Plant Cell 9: 671-675.
Hare PD, Cress WA. 1997. Metabolic implications of stress induce praline
accumulation in plant. Plant Growth
Regulation 21 : 79-102.
Hiei Y, Toshihiko K. 2006. Improved protocols for transformation of indica rice mediated by Agrobacterium
tumefaciens. Plant Cell, Tissue and
Organ Culture 85 : 271-28.
Hodges TK, Jianying P, Leszek AL, David SK. 1991. Transformation and
Regeneration of Rice Protoplasts.
USA : Perdue University
Hu H et al. 2006. Over-expressing a NAM, ATAF and CUC (NAC) transcription factor enhances drought resistance and salt tolerance in rice. PNAS 103: 12987-12992.
Ishida Y et al. 1996. High efficiency transformation of maize mediated by
Agrobacterium tumefaciens. Research
Article: 745-751.
Lee YH. 2004. A new selection method for pepper transformation : callus mediated shoot formation. Plant Cell Rep. 23: 50-58.
Maftuchah. 2003 Transformasi genetic padi indica dengan gen crylA(b) dan crylB melalui Agrobacterium tumefaciens
untuk ketahanan terhadap hama peggerek batang. [disertasi]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Mulyaningsih ES, Regy H, Inez H, Slamet L. 2009. Genetic transformation of transcription factor gene into rice genome and transformant analysis of
hpt gene by PCR and hygromycin resistance test. Biodiversitas 10 : 63-69.
Nisak F. 2009. Transformasi padi (Oryza sativa
L.) Japonica cv Nipponbare dengan
gen SNAC1 menggunakan
Agrobacterium tumefaciens. [tesis].
Malang: Program Pascasarjana, Universitas Brawijaya
Ozawa K. 2009. Establishment of a high efficiency Agrobacterium mediated transformation system of rice (Oryza
sativa L.). Plant Science 176 :
522-527.
Park SH, Pinson SMR, Smith RH. 1996. T-DNA integration into genomic T-DNA of rice following A. tumefaciens
inoculation of isolated
shoot apices. Plant Mol Biol. 32: 1135-1148.
menggunakan vektor
Agrobacterium tumefaciens. Jurnal
AgroBiogen 6(1) : 18-25.
Rance I et al. 1994. Partial desiccation of mature emryo-derived calli, a simple treatment that dramatically enhanced the regeneration ability of indica rice. Plant Cell Rep. 13 : 647-651.
Rahmawati S. 2006. Status perkembangan perbaikan sifat genetik padi menggunakan transformasi
Agrobacterium. AgroBiogen
2(1):36-44.
Saharan V, Yadav RC, Yadav RM, Ram K. 2004. Studies on improved
Agrobacterium - mediated
transformation in two indica rice (Oryza sativa L.). African Journal
of Biotechnology 3(11): 572-575
Sambrook JE, Fritsch F, Maniatis T. 1989.
Molecular Cloning a Laboratory
Manual. Cold Spring Harbor
Laboratory Press. New York. Shinozaki K, Yamaguchi K. 1997. Gene
expression and signal transduction in water stress response. Plant
Physiology 115: 327-334.
Siregar EBM. 1999. Transformasi genetika dan regenerasi tanaman cabai transgenic dengan bantuan
Agrobacterium. [disertasi]. Bogor :
Institut Pertanian Bogor.
Siregar H. 1981. Budidaya Tanaman Padi di
Indonesia. Jakarta : PT Sastra Hudaya.
Toki S. et al. 2006. Early infection of scutellum tissue with Agrobacterium allows high speed transformation of rice. The Plant
Journal 47 : 969-976.
Utami DW et al. 2005. Gen Pengendali Sifat Ketahanan Blas (Pyricularia grisea
Sacc.) Pada Spesies Padi Liar Oryza
rufipogin Griff. dan Padi Budi Daya
IR64. Jurnal AgroBiogen 1(1) : 1-6. Widhianata H. 2010. Konstruksi plasmid vector
dengan gen responsif kekeringan
HVA1 dan introduksinya ke dalam
Agrobacterium tumefaciens strain
EHA105. [tesis]. Malang: Program Pascasarjana, Universitas Brawijaya. Wu H., Mccormac AC, Elliot MC, and Chen
DF. 1998. Agrobacterium mediated stable transformation of cell suspension cultures of barley
(Hordeum vulgare). Plant Cell Tissue
Organ Cult. 4 : 161-171.
Lampiran 1 Peta plasmid
Gambar 5 Peta Plasmid pCambia 1301
pAY56 03 26 9946 bp
aadA HptII
MCS
35S
RB LB
CaMV polyA
35S
3 'NOS
Acc65I (326)
BanII (16)
BglII (333)
BplI (355)
EcoICRI (14)
EcoRI (346)
KpnI (330)
SacI (16)
SalI (352)
SciI (342)
SpeI (319)
XhoI (340)
Lampiran 2 Komposisi Media Kultur Bakteri
a. Media LB (Luria-Bertani Broth)
Bacto trypton 10 g/L
NaCl 10 g/L
Yeast extract 5 g/L Bacto Agar (solid) 15 g/L
b. AB medium
50 ml AB buffer stock : K2HPO4 60 g/L
NaH2PO4 20 g/L
50 ml AB salt stock : NH4Cl 20 g/L MgSO4.7H2O 6 g/L KCl 3 g/L CaCl2.2H2O 0.2g/L FeSO4.7H2O 50mg/L 900 ml aquades untuk melarutkan :
Glucose 5 g/L
Lampiran 3 Komposisi bufer TAE
50x TAE (untuk 1 liter) :
Tris base : 242 g
Glacial acetic acid : 57,1 ml
0.5M EDTA : 50 ml
ddH2O : 892.9 ml 1x TAE :
50x TAE :20 ml
Lampiran 4 Komposisi berbagai media kultur (Toki et al., 2006)
L-aspartic acid 300
Myo-inositol 100 100 100 100 100 100
Acetosyringone 10~20 10~20
Lampiran 5 Komposisi bufer TE
Buffer TE (untuk 1 liter):
1 M Tris-HCl pH 8 :10 ml 0.5M EDTA pH 8 : 2 ml
ddH2O : 988 ml
Lampiran 6 Komposisi larutan penyangga
STR3X loading buffer (untuk 100 ml) :
4M NaOH : 0,25 ml
95%formamide : 95 ml
Bromophenol blue : 50 mg
Xylene cyanol FF : 50 mg
ddH2O : 4.75 ml
Lampiran 7 Komposisi reaksi PCR
DNA 1 µl
Primer higromisin F 0,1 µl Primer higromisin R 0,1 µl 2x Taq Polimerase 5 µl
MQ 2,7 µl
MgCl2 0,3 µl
Lampiran 8 Gambar padi transgenik
Gambar 7 Padi Inpari6 dengan perlakuan AGL1-SNAC1
DAFTAR ISI
Halaman
DAFTAR GAMBAR………..…... VII
DAFTAR LAMPIRAN ………...VII
DAFTAR TABEL ... VII
PENDAHULUAN ...1
Latar Belakang ... 1
Tujuan ... 1
BAHAN DAN METODE ... 1
Bahan ... 1
Metode ... 1
Pembuatan sel kompeten A. tumefaciens strain EHA105... 1
Transformasi A. tumefaciens strain EHA105 dengan gen HVA1 ... 2
Konfirmasi hasil transformasi... 2
Penumbuhan A. tumefaciens... 2
Persiapan Eksplan... 2
Transformasi kecambah... 2
Pasca Transformasi ... 2
Isolasi DNA dan PCR... 3
Analisis Hasil ... 3
HASIL ... 3
PEMBAHASAN ... 5
KESIMPULAN DAN SARAN ... 7
Kesimpulan ... 7
Saran ... 7
DAFTAR GAMBAR
Halaman
1. Gambar benih dalam media N6 prekultur 5 hari ... 3
2. Gambar plantlet yang terbentuk di hari ke-47 ... 3
3. Gambar padi putatif transgenik ... 4
4. Gambar hasil elektroforesis produk PCR ... 4
5. Gambar peta plasmid pCambia 1301 ... 10
6. Gambar peta plasmi pAY560236 ... 10
7. Gambar tanaman transgenik ... 16
DAFTAR LAMPIRAN Halaman 1. Peta plasmid ... 10
2. Komposisi media kultur bakteri ... 11
3. Komposisi buffer TAE ... 12
4. Komposisi media kultur ... 13
5. Komposisi bufer TE ... 14
6. Komposisi larutan penyangga ... 14
7. Komposisi reaksi PCR ... 14
8. Gambar tanaman transgenik ... 15
DAFTAR TABEL Halaman 1. Efisiensi transformasi padi indica yang ditransformasi dengan A.tumefaciens strain AGL1 (gen SNAC1) dan strain EHA105 (gen HVA1) ... 4