S
FAKUL
SINTESIS
DA
LTAS MA I
S DAN PE
RI CANG
DENGAN
TAT
DEP TEMATIK INSTITUT
ENCIRIA
GKANG K
N METO
TANG HI
ARTEME KA DAN I T PERTA
BOGO 2013
AN HIDR
KERANG
DE
SOL-IDAYAT
EN KIMIA ILMU PE ANIAN BO
OR 3
ROKSIAP
G HIJAU
-GEL
A
ENGETAH OGOR
PATIT
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi berjudul Sintesis dan Pencirian Hidroksiapatit dari Cangkang Kerang Hijau dengan Metode Sol-Gel adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, April 2013
Tatang Hidayat
ABSTRAK
TATANG HIDAYAT. Sintesis dan Pencirian Hidroksiapatit dari Cangkang Kerang Hijau dengan Metode Sol-Gel. Dibimbing oleh CHARLENA dan AKHIRUDDIN MADDU
Hidroksiapatit (HAp) merupakan komponen utama tulang dan gigi. HAp secara luas digunakan untuk memperbaiki, mengisi, memperluas, dan merekonstruksi jaringan tulang yang rusak. Pada penelitian ini, HAp telah disintesis dari cangkang kerang hijau dengan menggunakan metode sol-gel. Parameter sintesis yang diatur adalah pH, dan peubah yang dibandingkan adalah suhu pemanasan pada 900 dan 1100 oC. HAp yang terbentuk dicirikan dengan difraktometer sinar-X (XRD), spektofotometer inframerah transformasi Fourier, dan mikroskop elektron pemayaran. Hasil síntesis menunjukkan bahwa HAp terbentuk pada pH basa. Pola XRD memperlihatkan HAp terbentuk disertai apatit karbonat tipe A, oktakalsium fosfat, α- dan β-trikalsium fosfat. Kristalinitas sampel meningkat dengan meningkatnya waktu dan suhu pemanasan. Kualitas HAp akan semakin baik dengan meningkatnya kristalinitas. Meningkatnya suhu pemanasan juga akan meningkatkan jumlah HAp yang terbentuk.
Kata kunci: hidroksiapatit, kerang hijau, sol-gel
ABSTRACT
TATANG HIDAYAT. Synthesis and Characterization of Hydroxyapatite from Green Mussel Shell with Sol-Gel Method. Supervised by CHARLENA and AKHIRUDDIN MADDU.
Hydroxyapatite (HAp) is a major component of bones and teeth. HAp is widely used to repair, fill, extend, and reconstruct damaged bone tissue. In this research, HAp has been synthesized from green mussel shell by using sol-gel method. The controlled synthesis parameter was pH, and the variable being compared was heating temperature at 900 and 1100 oC. The HAp products were characterized by X-ray diffractometer (XRD), Fourier transform infrared spectrophotometer, and scanning electron microscope. The results showed that HAp was formed at alkaline pH. The XRD pattern showed that Hap was formed along with type A apatite carbonate, octacalcium phosphate, α- and β-tricalcium phosphate. The crystallinity was increased by raising the temperature and prolonging the heating time. The quality of HAp will get better with increasing crystallinity, and incrasing the temperature will raise the amount of HAp formed as well.
SINTESIS DAN PENCIRIAN HIDROKSIAPATIT
DARI CANGKANG KERANG HIJAU
DENGAN METODE SOL-GEL
TATANG HIDAYAT
Skripsi
sebagai salah satu syarat memperoleh gelar Sarjana Sains
pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Sintesis dan Pencirian Hidroksiapatit dari Cangkang Kerang Hijau dengan Metode Sol-Gel
Nama : Tatang Hidayat NIM : G44104008
Disetujui oleh
Dr Charlena, MSi Pembimbing I
Dr Akhiruddin Maddu, SSi, MSi Pembimbing II
Diketahui oleh
Prof Dr Ir Tun Tedja Irawadi, MS Ketua Departemen Kimia
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segala limpahan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah yang berjudul Sintesis dan Pencirian Hidroksiapatit dari Cangkang Kerang Hijau dengan Metode Sol-Gel. Karya ilmiah ini disusun berdasarkan penelitian yang dilaksanakan pada bulan April hingga November 2012 di Laboratorium Anorganik, Institut Pertanian Bogor (IPB), Dramaga.
Penulis mengucapkan terima kasih atas semua bimbingan, dukungan, dan kerja sama yang telah diberikan oleh Ibu Charlena, MSi selaku pembimbing pertama dan Bapak Dr Akhiruddin Maddu, SSi MSi selaku pembimbing kedua. Di samping itu, penghargaan penulis sampaikan kepada Ayah, Ibu, serta keluarga atas segala doa dan semangat yang diberikan. Terima kasih juga kepada Chaecar Himawan, Yuanita, Fina, Artha, Laras dan para laboran Laboratorium Anorganik atas bantuan yang telah diberikan selama penulis melakukan penelitian.
Semoga laporan ini dapat bermanfaat. Terima kasih.
Bogor, April 2013
DAFTAR ISI
DAFTAR GAMBAR vii DAFTAR LAMPIRAN vii
PENDAHULUAN 1
BAHAN DAN METODE 2
Bahan dan Alat 2
Lingkup Penelitian 2
HASIL DAN PEMBAHASAN 3
Hasil Kalsinasi dan Hidrasi 3
Hidroksiapatit dan Hasil Pencirian dengan XRD 5
Hasil Pencirian dengan Spektrofotometer FTIR 9
Hasil Pencirian dengan SEM 11
SIMPULAN DAN SARAN 12
DAFTAR PUSTAKA 13
LAMPIRAN 15
DAFTAR GAMBAR
1 Difraktogram hasil kalsinasi cangkang kerang pada suhu 1100 oC selama 12 jam
dan 18 jam 4
2 Difraktogram hasil kalsinasi (1100 °C, 18 jam) dan hidrasi (A). Pola 5
3 Difraktogram HAp hasil sintesis dari CaO dan Ca(OH)2 0.8 M dengan H3PO4 0.5
M pada 1100 oC (a dan b) dan 900 oC (c dan d) 6
4 Spektrum FTIR HAp hasil sintesis dari CaO 0.8 M dan Ca(OH)2 0.8 M dengan
H3PO4 0.5 M pada 1100 oC (a dan b) dan 900 oC (c dan d) 10 5 Morfologi HAp dengan bahan awal CaO dan Ca(OH)2 dengan pemanasan pada
1100 oC (a dan b) dan 900 oC (c dan d). Perbesaran 250× 11
6 Morfologi HAp dengan bahan awal CaO dan Ca(OH)2 dengan pemanasan 1100 o
C (a dan b) dan 900 oC (c dan d). Perbesaran 1000× 12
7 Hasil analisis SEM produk HAp komersial pada perbesaran 1500× 12
DAFTAR LAMPIRAN
1 Diagram alir sintesis HAp metode sol-gel 15
2 Komposisi bahan awal HAp 16
3 Radas sintesis HAp 17
4 Data JCPDS 18
5 Perhitungan konsentrasi kalsium cangkang kerang 23
6 Difraktogram HAp komersial 24
7 Perhitungan ukuran kristal sampel 24
1
PENDAHULUAN
Kerusakan jaringan keras tubuh yang berupa kecacatan struktur tulang banyak terjadi di Indonesia. Pengembangan bahan biomaterial sintetis untuk rehabilitasi jaringan tulang dan gigi diharapkan dapat meningkatkan pertumbuhan sel-sel yang akan melanjutkan fungsi daur kehidupan jaringan yang digantikan. Salah satu bahan yang sedang dikembangkan adalah biokeramik.
Bahan biokeramik yang lazim digunakan untuk rehabilitasi jaringan adalah hidroksiapatit sintetik [HAp, Ca10(PO4)6(OH)2]. Hidroksiapatit merupakan
komponen utama dari tulang dan gigi. HAp menyerap dengan cukup baik unsur-unsur kimia organik dalam tubuh serta memiliki sifat biokompatibilitas dan bioaktivitas yang baik pula (Suzuki et al. 1993). Sifat bioaktif HAp mampu merangsang pertumbuhan tulang baru di sekitar implan tulang. Selain bersifat bioaktif, HAp juga bersifat biokompatibel, artinya mampu bertahan terhadap korosi dan tidak menimbulkan penolakan oleh jaringan tubuh (Tazaki et al. 2009).
Material HAp dapat diperoleh dari tulang-tulang mamalia dan juga dari terumbu karang. Di laboratorium, HAp dapat dibuat dengan menggunakan beberapa proses, seperti reaksi dalam fase padat, presipitasi, metode hidrotermal, dan proses sol-gel. Nisbah molar antara kalsium dan fostat (Ca/P) pada hidroksiapatit adalah 1.67, mendekati nisbah molar Ca/P di dalam jaringan tulang (Aoki 1991). Senyawa HAp sintetik yang dipakai sekarang sangat mahal karena diimpor dari luar negeri. Kelemahan ini mendorong pencarian bahan alternatif lain untuk pembuatan HAp sintetik yang jauh lebih murah, mudah didapat, namun memiliki kualitas yang sama dengan HAp sintetik komersial produk Jepang (Muntamah 2011).
Penelitian ini menyintesis HAp menggunakan bahan dasar cangkang kerang hijau. Kerang hijau (Perna viridis) merupakan komoditas yang melimpah di perairan Indonesia. Berdasarkan penelitian sebelumnya (Nadjib 2008), kandungan terbesar cangkang kerang ialah kalsium karbonat, magnesium karbonat, dan kalsium fosfat, dengan sebagian kecil bahan anorganik lain. Kandungan kalsium karbonat yang tinggi (98%) sangat berpotensi dijadikan sumber kalsium pada sintesis HAp (Awang-Hazmi et al. 2005).
Penelitian ini bertujuan menyintesis dan menganalisis HAp dari cangkang kerang hijau. Pencirian menggunakan difraktometer sinar-X (XRD), spektrofotometer infaramerah transformasi Fourier (FTIR), dan mikroskop elektron pemayaran (SEM). Penelitian dilakukan berdasarkan penelitian sebelumnya (Muntamah 2011) yang menyintesis HAp melalui metode basah dengan menggunakan proses sol-gel. HAp yang diperoleh dengan proses sol-gel memiliki tingkat kemurnian yang tinggi, komposisi yang homogen, dan ukuran yang lebih kecil (Vazquez et al. 2005). Cangkang kerang hijau dikalsinasi dan dihidrasi menghasilkan bahan awal berupa CaO dan Ca(OH)2, yang kemudian
direaksikan dengan asam fosfat (H3PO4). Hasil sintesis kemudian dicirikan
2
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan pada penelitian ini adalah cangkang kerang hijau dari Pasar Bogor, etanol 96%, H3PO4 80%, NH4OH 1 M, asam nitrat, dan air
suling. Alat-alat yang digunakan meliputi cawan keramik, alat kaca yang lazim digunakan di laboratorium kimia, pemanas listrik, pengaduk magnet, dan neraca analitik. Penentuan kadar kalsium menggunakan spektrofotometer serapan atom (AAS) Shimadzu AA-7000 di Laboratorium Bersama, Departemen Kimia IPB. Pencirian hasil sintesis menggunakan XRD Shimadzu 6000, FTIR Shimadzu IRPrestige-21, dan SEM Philips 515 di Puslitbang Keteknikan Kehutanan dan Pengolahan Hasil Hutan Bogor.
Lingkup Penelitian
Sintesis HAp pada penelitian ini dilakukan dengan metode reaksi basah (sol-gel) (Lampiran 1). Lima tahapan penelitian meliputi (1) kalsinasi cangkang kerang hijau, (2) pembuatan Ca(OH)2, (3) penentuan kadar Ca dalam cangkang
kerang hijau, (4) sintesis HAp dengan metode sol-gel, dan (5) pencirian HAp menggunakan XRD, FTIR, dan SEM.
Kalsinasi Cangkang Kerang Hijau (modifikasi Muntamah 2011)
Cangkang kerang hijau dibersihkan dari kotoran lalu dikeringkan di udara terbuka. Kalsinasi cangkang kerang dilakukan pada suhu 1100 oC selama 12 jam dan 18 jam. Hasil kalsinasi dihaluskan kemudian dianalisis dengan menggunakan XRD untuk pencirian CaO dan AAS untuk penentuan kadar kalsium.
Konversi CaO menjadi Ca(OH)2
Abu yang didapat dari proses kalsinasi dihidrasi dengan cara dibiarkan kontak dengan udara (yang mengandung uap air) selama 1 malam di suhu kamar. Untuk memastikan terbentuknya Ca(OH)2, abu yang telah dibiarkan kontak
dengan udara dianalisis pola difraksi XRD-nya.
Penentuan Kadar Ca dalam Cangkang Kerang Hijau
Sampel ditimbang 0.1000 g, lalu ditambah 1 mL asam nitrat pekat dan dilarutkan dalam labu takar 100 mL dengan air suling bebas ion. Sebanyak 1 mL dipipet dan dilarutkan kembali dalam labu takar 100 mL, kemudian dianalisis dengan menggunakan AAS.
Sintesis Hidroksiapatit dengan Metode Sol-Gel (modifikasi Muntamah 2011)
Serbuk CaO hasil kalsinasi atau Ca(OH)2 hasil hidrasi dan asam fosfat
dilarutkan dalam etanol 96% masing-masing sebanyak 50 mL (Lampiran 2). Presipitasi dilakukan dengan meneteskan asam fosfat ke dalam larutan CaO atau Ca(OH)2 pada suhu 37 oC dengan pengadukan 300 rpm dan laju alir 1.0 mL/menit
3
dipanaskan dengan penangas air pada suhu 60 oC selama 1 jam dan diendapkan selama 24 jam. Setelah itu, diaduk pada suhu 60 oC dengan kecepatan 300 rpm sampai larutan berubah menjadi gel berwarna putih. Gel yang diperoleh dipanaskan pada suhu 900 dan 1100 oC selama 2 jam. Metode yang sama juga dilakukan tanpa pengaturan pH.
Pencirian dengan XRD
Difraktometer yang digunakan adalah XRD Shimadzu 6000, dengan sumber target Cu yang memiliki panjang gelombang 1.5406 Å. Sampel disiapkan sebanyak 2 g, kemudian dimasukan ke dalam holder yang berukuran (2×2) cm2 pada difraktometer. Sudut awal diambil pada 10o dan sudut akhir pada 70o dengan kecepatan pembacaan 2o per menit.
Pencirian dengan FTIR
Sampel disiapkan sebanyak 2 mg, dicampur dengan 100 mg KBr dan dibuat pelet. Analisis spektrum FTIR dilakukan pada kisaran bilangan gelombang 4000−400 cm−1.
Pencirian dengan SEM
Sampel diletakkan pada pelat aluminium dan diamati dengan menggunakan SEM dengan tegangan 10 kV, perbesaran 250 dan 1000 kali.
HASIL DAN PEMBAHASAN
Hasil Kalsinasi dan Hidrasi
Cangkang kerang hijau perlu dikalsinasi sebelum digunakan sebagai prekursor kalsium (Ca). Kalsinasi dilakukan pada suhu 1100 °C selama 12 jam dan 18 jam. Dengan kondisi tersebut, seluruh komponen organik cangkang kerang hijau akan terbakar habis menjadi CO2 dan H2O (Adak dan Purohit 2011).
Langkah ini juga membebaskan gas CO2 dari aragonit. Dengan demikian di akhir
proses kalsinasi, seluruh cangkang kerang hijau dapat berubah menjadi CaO. Hasil kalsinasi berupa serbuk berwarna putih. Reaksi yang terjadi pada saat kalsinasi adalah
CaCO3 CaO + CO2
Keberadaan ion karbonat harus dihilangkan karena akan berpengaruh dalam pembuatan HAp (Dahlan et al. 2009). Adanya ion karbonat akan menempati 2 posisi dalam struktur HAp, menggantikan gugus OH− membentuk apatit karbonat tipe-A (AKA) dengan rumus kimia (Ca10(PO4)6CO3), atau menggantikan gugus
PO43− membentuk apatit karbonat tipe-B (AKB) dengan rumus kimia
(Ca10(PO4)3(CO3)3(OH)2).
4
senyawa CaO (standar JCPDS No. 37-1497) (Lampiran 4).
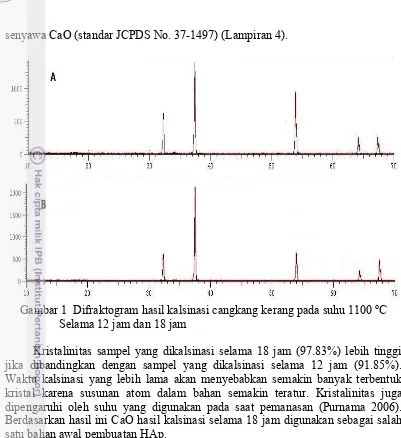
Gambar 1 Difraktogram hasil kalsinasi cangkang kerang pada suhu 1100 oC Selama 12 jam dan 18 jam
Kristalinitas sampel yang dikalsinasi selama 18 jam (97.83%) lebih tinggi jika dibandingkan dengan sampel yang dikalsinasi selama 12 jam (91.85%). Waktu kalsinasi yang lebih lama akan menyebabkan semakin banyak terbentuk kristal karena susunan atom dalam bahan semakin teratur. Kristalinitas juga dipengaruhi oleh suhu yang digunakan pada saat pemanasan (Purnama 2006). Berdasarkan hasil ini CaO hasil kalsinasi selama 18 jam digunakan sebagai salah satu bahan awal pembuatan HAp.
Penelitian ini selain menggunakan bahan awal CaO juga menggunakan bahan awal Ca(OH)2. CaO dapat dengan mudah diubah menjadi Ca(OH)2 melalui
reaksi eksoterm dengan air.
CaO + H2O Ca(OH)2
Serbuk CaO hasil kalsinasi dihidrasi dengan cara dibiarkan kontak dengan udara (yang mengandung uap air) selama 1 malam di suhu ruang.
Gambar 2 menunjukkan sudut difraksi pada 2θ = 18.03°, 28.70°, 34.11°, 47.14°, 50.83°, dan 62.62°. Sudut 2θ tersebut sesuai dengan senyawa Ca(OH)2
(standar JCPDS No. 44-1481) (Lampiran 4). Derajat kristalinitas yang diperoleh cukup baik, yaitu 87.35%, tetapi lebih rendah daripada kristalinitas CaO. Berdasarkan hasil XRD, ukuran partikel CaO lebih besar daripada Ca(OH)2.
Umumnya semakin tinggi kristalinitas, semakin besar ukuran partikelnya. Adanya senyawa karbonat juga dapat menurunkan kristalinitas (Qoniah dan Prasetyoko 2010). Spektrum FTIR menunjukkan bahwa Ca(OH)2 mengandung karbonat lebih
5
Gambar 2 Difraktogram hasil kalsinasi (1100 °C, 18 jam) dan hidrasi (A). Pola XRD sampel dicerminkan dengan Ca(OH)2 (standar JCPDS No. 44-
1481) (B)
Kadar kalsium (Ca) dalam serbuk hasil kalsinasi pada suhu 1100 oC selama 18 jam diukur dengan AAS. Persentase Ca yang diperoleh sebesar 45.62% (Lampiran 5). Kandungan kalsium ini lebih besar dibandingkan dengan cangkang kerang hijau hasil Yulianti (2009), yaitu berkisar antara 28.97% dan 39.55%, atau cangkang tutut (25.89%) (Irfana dan Herawati 2012). Namun, masih lebih kecil dibandingkan dengan cangkang kerang darah (61.23%) (Muntamah 2011) atau cangkang telur ayam (71.68%) (Samsiah 2009).
Hidroksiapatit
Hidroksiapatit merupakan suatu senyawa kalsium fosfat yang mengandung hidroksida, rumus molekulnya Ca10(PO4)6(OH)2. HAp dapat dibuat dengan
menggunakan metode basah. Keuntungan utama sintesis dengan metode basah adalah hasil sampingnya air, kemungkinan kontaminasi selama pengolahan sangat rendah, dan biaya pengolahan rendah. Reaksinya juga sederhana, cocok untuk industri skala besar, dan tidak mencemari lingkungan (Kehoe 2008). Sintesis HAp cara basah yang dipilih adalah teknik sol-gel, yang diharapkan menghasilkan keseragaman dan stokiometri yang terkendali hingga terbentuknya HAp (Vazquez
et al. 2005).
Serbuk CaO atau Ca(OH)2 dicampurkan dengan H3PO4 80% yang
masing-masing dilarutkan ke dalam 50 mL etanol 96% (pH diatur dengan penambahan
NH4OH 1 M). Nisbah Ca/P yang digunakan 1.67 (0.8 M Ca/0.5 M P).
Berdasarkan Trianita (2012), proses reaksi yang terlibat dalam sintesis HAp antara lain
Reaksi 1 (pembentukan CaO dan Ca(OH)2)
CaCO3 CaO + CO2
CaO + H2O Ca(OH)2
Reaksi 2 (ionisasi)
H3PO4 H+ + H2PO4−
H2PO4− H+ + HPO42−
6
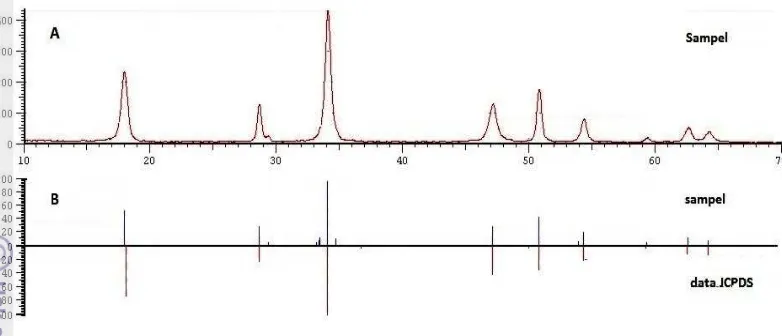
Reak Reak krista JCPD deng deng 25.87 punc 31.04 meru itu te inten renda Gam (Gam faseksi 3 (pembe
ksi lengkap 1
Metode X al. Pola difr DS No. 09-gan CaO pad gan sebagia
7o, 31.78o, cak lain den 4o. Mengac upakan fase erdapat fas nsitas rendah
ah dianggap
mbar 3 Difr H3P
Difraktogr mbar 3b) ju HAp, yaitu
entukan HA 10 Ca2+ + 10Ca(OH)2
6H3PO4 +
XRD dapat fraksi yang
-0432 (Lam da suhu 110 an besar pu
32.20o, 32 ngan intens cu pada data
trikalsium se apatit ka h pada sudu p sebagai la
raktogram H O4 0.5 M p
ram HAp h uga mengha pada sudut
Ap)
+ 6PO43− + 2
+ 6H3PO4
+ 10CaO digunakan dihasilkan d mpiran 4). D
00 oC (Gam uncak beras 2.92o, 39.8 itas yang re a JCPDS N
fosfat (TCP arbonat tipe
ut 2θ = 35.4 atar belakang
HAp hasil si ada 1100 oC hasil reaksi
asilkan punc t 2θ= 25.90o
2OH− Ca
Ca10(PO4
Ca10(PO4)6
untuk men dicocokkan Difraktogram mbar 3a) me
sal dari fas 82o, dan 46
endah, yaitu No. 29-0359
P) dengan r e A (AKA) 47o. Puncak
g atau derau
intesis dari C C (a dan b) d
H3PO4 deng
cak-puncak
o
, 31.79o, 32
a10(PO4)6(O
4)6(OH)2 + 6(OH)2 + 8H
nentukan fa n dengan da m HAp hasi enunjukkan se HAp, ya
6.70o. Mas u pada 2θ (Lampiran rumus mole ) (Ca10(PO4
k-puncak den u.
CaO dan Ca dan 900 oC gan Ca(OH k dengan in 2.22o, 32.94
OH)2
18H2O
H2O
ase dari sua ata standar H
il reaksi ba intensitas y aitu pada s
ih terdapat = 27.79o, 2 n 4), sudut 2
ekul Ca3(PO 4)6CO3), ju
ngan intens
a(OH)2 0.8
(c dan d)
H)2 pada suh
ntensitas ter 4o, 39.83o, 4
atu sampel HAp, yaitu sah H3PO4
yang tinggi udut 2θ = t beberapa 29.63o, dan
2θ tersebut O4)2. Selain
uga dengan sitas sangat
M dengan
7
49.40o. Selain itu, terdapat fase lain dengan intensitas rendah pada 2θ = 31.06o dan 43.90o, yang merupakan fase TCP.
Dengan CaO pada suhu 900 oC, difraktogram (Gambar 3c) tetap
menunjukkan fase HAp (2θ = 31.81o, 32.96o, 32.24o, 46.75o, dan 25.88o) serta TCP (2θ = 31.06o, 34.38o, 27.83o, 59.51o, dan 13.71o). Fase TCP dalam sampel ini memunculkan cukup banyak puncak difraktogram, sebagian dengan intensitas yang cukup tinggi, meskipun fase HAp masih lebih dominan. Terdapat pula fase AKA dengan intensitas yang cukup rendah pada sudut 2θ = 29.53o serta fase kalsium karbonat (CaCO3) pada sudut 2θ = 63.04o.
Hasil serupa ditunjukan oleh difraktogram hasil reaksi Ca(OH)2 dan H3PO4
pada suhu 900 oC (Gambar 3d). Fase HAp pada sudut 2θ = 31.80o, 32.94o, 32.19 o, 49.47o, dan 25.89o diperoleh bersama fase TCP pada sudut 2θ = 31.05o, 27.82o, 34.36o, dan 37.35o. Fase HAp masih lebih dominan ketimbang fase TCP. Fase oktakalsium fosfat (OKP) dengan rumus molekul Ca4H(PO4)3•25H2O juga
muncul pada sudut 2θ = 41.98o.
Hasil XRD semua sampel dalam penelitian ini memperlihatkan terbentuknya HAp dari reaksi antara asam fosfat dan bahan awal CaO maupun Ca(OH)2. Beberapa fase lain masih terbentuk seperti OKP, TCP, AKA, dan
CaCO3. Fase HAp paling stabil di antara senyawa kalsium fosfat lainnya pada
suhu ruang. Namun, pada pemanasan dengan suhu tinggi (sintering), HAp dapat berubah fase menjadi senyawa kalsium fosfat yang lain. HAp terdekomposisi menjadi trikalsium fosfat Ca3(PO4)2 (α-TCP dan β-TCP), kalsium oksida (CaO)
dan tetrakalsium fosfat Ca4(PO4)O pada suhu tertentu dan tergantung atmosfer di
sekitarnya (Bernache-Assolant et al. 2002).
Muntamah (2011) melaporkan bahwa sintesis HAp dengan metode sol-gel dengan bahan baku cangkang kerang darah menghasilkan HAp dengan kemurnian tinggi tanpa didapatkan fase lain. Perbedaan tingkat kemurnian ini dapat disebabkan oleh bahan awal dan kondisi sintesis yang berbeda.
Pada semua sampel terdapat fase β-TCP. Fase ini dengan pemanasan lebih lanjut dapat membentuk α-TCP yang keberadaannya terlihat pada sampel HAp dari CaO dengan pemanasan 1100 oC. Perubahan fase HAp menjadi TCP merupakan akibat dari lepasnya gugus OH− (dan melepaskan uap air) sehingga HAp mengalami dehidrasi dan membentuk TCP. Berdasarkan penelitian Bernache-Assolant et al. (2002), fase TCP dapat terbentuk mulai dari suhu 600
o
C dengan kalsium bersumber dari kalsium nitrat tetrahidrat (Ca(NO3)2•24H2O)
direaksikan dengan diamonium hidrogen ortofosfat ((NH3)2HPO4).
Untuk mendapatkan HAp dengan densitas tinggi dan stabil, perlu dilakukan
sintering sampai suhu tertentu dan dijaga agar tidak terjadi dekomposisi HAp menjadi β-TCP atau senyawa lainnya. Suhu saat sintering merupakan faktor yang dapat memengaruhi dekomposisi karena secara aktif permukaan HAp dapat berinteraksi dengan lingkungan di sekitarnya pada suhu tertentu (Arifianto 2006).
8
pembentukan tulang dapat melalui AKA ini. AKA termasuk fraksi mineral jaringan keras yang jika ikut diimplankan bersama dengan HAp tidak membahayakan tubuh makhluk hidup (Aoki 1991).
Fase CaCO3 merupakan fase terbanyak pada cangkang kerang. Masih
terdeteksinya CaCO3 menunjukkan bahwa belum semua CaCO3 berhasil diubah
menjadi CaO pada saat proses kalsinasi. Namun CaCO3 juga dapat ditimbulkan
oleh reaksi CO2 dari udara dengan CaO selama proses sintesis. Hidayat et al.
(2006) menyatakan bahwa meningkatnya karbonat akan menurunkan proses kristalisasi. Dengan kata lain, pembentukan kristal HAp akan terganggu.
Dari hasil studi dengan material sintetis, konversi kalsium fosfat amorf menjadi HAp berlangsung melalui pembentukan kristal nonapatit, yaitu OKP dan dikalsium fosfat dihidrat (Soejoko 1999). Munculnya puncak difraksi yang sesuai dengan kristal OKP pada sampel Ca(OH)2 dan H3PO4 suhu 900 oC menunjukkan
bahwa fase HAp belum sepenuhnya terbentuk dan sekaligus membuktikan bahwa pembentukan HAp didahului oleh pembentukan kristal nonapatit. Hasil sintesis HAp pada penelitian ini juga memiliki pola difraksi yang hampir sama dengan HAp komersial (Lampiran 6).
XRD dapat digunakan untuk menentukan sistem kristal, parameter kisi, kristalinitas, dan fase suatu sampel (Cullity dan Stock 2001). Tabel 1 menunjukkan pengaruh suhu dan bahan awal sintesis HAp pada kristalinitas HAp yang dihasilkan. Kristalinitas menyatakan kandungan kristalin dalam suatu bahan dengan membandingkan luas kurva kristal dengan total luas amorf dan kristal. Persentase kristalinitas didapati meningkat seiring dengan kenaikan suhu pemanasan. Suhu pemanasan yang semakin tinggi menyebabkan susunan atom semakin teratur sehingga semakin banyak terbentuk fase kristalin. Hal ini terlihat dari semakin tingginya intensitas dan semakin sempitnya lebar setengah puncak (full width at half maximum [FWHM]) pada sudut 2θ = 31.78o (CaO; 1100 oC) dan 31.79o (Ca(OH)2; 1100 oC) serta 31.81o (CaO; 900 oC) dan 31.80o (Ca(OH)2;
900 oC).
Tabel 1 Kristalinitas, parameter kisi, dan ukuran kristal (d) sampel HAp sintetis
Bahan awal Suhu (oC) Kristalinitas (%) Parameter kisi d(002) (nm) a (Å) c (Å)
CaO 1100 84.47 9.417 6.881 86.66
Ca(OH)2 1100 91.99 9.413 6.876 99.04
CaO 900 79.31 9.416 6.88 69.33
Ca(OH)2 900 81.93 9.412 6.894 81.56
Perbedaan bahan awal sintesis HAp turut memengaruhi kristalinitas. Kalsium hidroksida memberikan kristalinitas yang lebih tinggi daripada kalsium oksida. Hal ini terkait dengan ukuran partikel kristal yang terbentuk. Umumnya semakin tinggi kristalinitas, semakin besar ukuran partikelnya. Sebagaimana ditunjukkan pada Tabel 1, penggunaan Ca(OH)2 sebagai bahan awal sintesis HAp
9
dan 94%. Kristalinitas tersebut lebih tinggi dibandingkan dengan metode basah (sol-gel) karena tidak banyak melibatkan pereaksi. Solihat (2008) menyintesis HAp dari cangkang telur menggunakan metode hidrotermal. Fase HAp dihasilkan bersama fase lain, yaitu CaO dengan kristalinitas 96%. Hasil tersebut juga lebih tinggi, baik dari segi kemurnian maupun kristalinitasnya. Metode hidrotermal melibatkan tekanan tinggi dengan kondisi sintesis yang tertutup maka dimungkinkan pembentukan kristal apatit secara lebih baik.
Jarak antarsel satuan dalam segala arah disebut parameter kisi. Parameter kisi kristal HAp berdasarkan Aoki (1991) adalah a = 9.432 Å dan c = 6.875 Å. Berdasarkan hasil pengukuran dengan XRD, parameter kisi sampel (Tabel 1) berada pada kisaran parameter HAp tersebut sehingga membuktikan bahwa fase HAp telah terbentuk pada sampel. Ukuran kristal dihitung menggunakan persamaan Scherrer (Lampiran 7) dan berbanding lurus dengan kenaikan suhu (Tabel 1), tetapi berbanding terbalik dengan nilai FWHM.
Pada penelitian ini dilakukan pula sintesis HAp tanpa pengaturan pH pada saat pencampuran H3PO4 dengan sumber kalsium. pH yang terukur sekitar 3.
Berdasarkan difraktogram pada Lampiran 8, senyawa HAp yang terbentuk sangat sedikit, hasil yang dominan ialah TCP. Trikalsium fosfat juga merupakan biomaterial yang umum dalam rekonstruksi tulang karena memiliki tingkat biodegradasi yang sesuai dengan laju pertumbuhan tulang dan bersifat osteokonduktif (Khrisna et al. 2007).
Selain karena pengaruh pH dan suhu, pembentukan TCP dapat disebabkan oleh pengaruh CO2 pada saat sintesis. Oleh karena itu, pada awal pembuatan HAp
harus dipastikan bahwa hanya terbentuk fase HAp. Jika fase α- dan β-TCP telah muncul pada awal pembuatan sampel, maka setelah pemanasan fase-fase tersebut akan memiliki puncak (pola XRD) yang semakin kuat, artinya tingkat dekomposisi bertambah besar (Arifianto 2006).
Hasil penelitian menunjukkan pentingnya pengaturan pH pada saat pencampuran agar terbentuk HAp. pH dikondisikan di atas 7 dengan penambahan NH4OH 1 M. Penelitian sebelumnya menyatakan bahwa kandungan fase kristal
apatit dalam sampel meningkat seiring dengan naiknya pH dan mulai signifikan bila pH larutan lebih dari 5 (Soedjoko dan Wahyuni 2002).
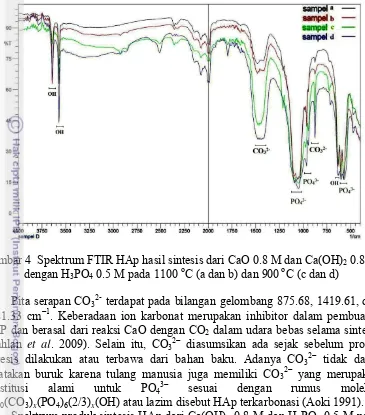
Hasil Pencirian dengan Spektrofotometer FTIR
Analisis FTIR digunakan untuk mengidentifikasi gugus fungsi OH−, PO43−,
dan CO32− pada sampel. Pada spektrum produk sintesis HAp dari CaO 0.8 M dan
H3PO4 0.5 M pada suhu 1100 oC (Gambar 4a), terdapat pita serapan untuk vibrasi
asimetris tekuk (4) fosfat pada bilangan gelombang 570.93 dan 601.79 cm−1,
vibrasi asimetris ulur (3) fosfat pada 1049.28 dan 1091.71 cm−1, vibrasi ulur (1)
fosfat pada 955.16 cm−1, tetapi tidak terdeteksi pita serapan untuk vibrasi tekuk (2) fosfat. Konsentrasi pereaksi pada saat sintesis HAp berpengaruh terhadap
10
Gambar 4 Spektrum FTIR HAp hasil sintesis dari CaO 0.8 M dan Ca(OH)2 0.8 M
dengan H3PO4 0.5 M pada 1100 oC (a dan b) dan 900 oC (c dan d)
Pita serapan CO32- terdapat pada bilangan gelombang 875.68, 1419.61, dan
1481.33 cm−1. Keberadaan ion karbonat merupakan inhibitor dalam pembuatan HAP dan berasal dari reaksi CaO dengan CO2 dalam udara bebas selama sintesis
(Dahlan et al. 2009). Selain itu, CO32− diasumsikan ada sejak sebelum proses
sintesis dilakukan atau terbawa dari bahan baku. Adanya CO32− tidak dapat
dikatakan buruk karena tulang manusia juga memiliki CO32− yang merupakan
substitusi alami untuk PO43− sesuai dengan rumus molekul
Ca10(CO3)x(PO4)6(2/3)x(OH) atau lazim disebut HAp terkarbonasi (Aoki 1991).
Spektrum produk sintesis HAp dari Ca(OH)2 0.8 M dan H3PO4 0.5 M pada
suhu 1100 oC (Gambar 4b) juga menunjukan pita serapan fosfat pada bilangan gelombang 570.93 dan 601.79 cm−1 (4), 964.41 cm−1 (1), 1056.99 dan 1091.71
cm−1 (3). Gugus fungsi OH− memunculkan serapan pada 3572.17, 3641.6, dan
632.65 cm−1, sedangkan pita serapan CO32− terdapat pada 875.68, 1411.89, dan
1481.33 cm−1.
Spektrum produk sintesis HAp dari CaO 0.8 M dan H3PO4 0.5 M pada suhu
900 oC (Gambar 4c) memiliki pita serapan vibrasi fosfat pada bilangan gelombang 570.93 dan 601.79 cm−1 (4), 962.12 cm−1 (1), 1049.28 dan 1091.71 cm−1 (3).
Gugus fungsi OH− ditunjukkan oleh serapan di 3572.17,3641.6,dan 632.65 cm−1, sedangkan pita serapan CO32− terdapat di 875.68 dan 1450.47 cm−1.
Spektrum produk sintesis HAp dari Ca(OH)2 0.8 M dan H3PO4 0.5 M pada
suhu 900 oC (Gambar 4d) memperlihatkan pita serapan untuk vibrasi fosfat pada bilangan gelombang 570.93 dan 601.79 cm−1 (4), 964.41 cm−1 (1), 1026.13 dan
1083.99 cm−1 (3). Gugus fungsi OH− memunculkan serapan di 3572.17,3641.6,
dan 628.79 cm−1. Pita serapan CO32− diperoleh di 875.68 dan 1442.75 cm−1.
karb fosfat dan sampel. P pada suhu menunjuk transmitan bahwa kan Suhu yang Sint CO32− yan
pembuatan semalam. tetapi juga Pita gelombang semua sam Pem (Gambar 5 5a dan b) dengan na kecil. Pem Gamb Foto kristal beb morfologi permukaan presipitasi bonat (Nurla n hidroksil. erbedaan su u 900 dan kkan bahwa ns CO32− da
ndungan C g semakin ti
esis HAp d ng lebih b n Ca(OH)2,
Selama pr a CO2, yang
fosfat pada g 960 cm−1 mpel HAp h
manasan pad 5c dan d) d
. Hal ini d aiknya suh mbentukan k
bar 5 Morfo pema
o SEM deng berapa seny seperti g n yang kasa i berupa bu
aela 2009). . Hal ini m uhu kalsina
1100 oC a kalsinasi aripada kal O32− pada s
inggi akan m dengan bah banyak dar , terdapat p roses ini, d g dapat bere a spektrum
1
(Muntama hasil sintesis
Has
da suhu 900 ibandingkan disebabkan o hu pemanas
kristal pun s
fologi HAp d anasan pada
gan perbesa yawa apatit granul den
ar. V’azque utiran halus
Keempat sa menunjukka asi memeng
menyebabk i pada suh sinasi pada suhu 900 oC meningkatk han awal Ca
ripada sinte proses pemb imungkinka eaksi dengan m HAp kom
ah 2011). P s.
sil Penciria
0 oC mengha n dengan pe oleh menge san sehingg semakin me
dengan bah a 1100 oC ( Perb
aran 1000× t yang berg ngan butira
ez et al. (20 s yang beru
ampel menu an bahwa H
aruhi intens kan elimina hu 900 oC a suhu 1100 C lebih bes kan eliminas a(OH)2 juga
esis berbah biaran samp
an tidak ha n CaO mem mersial berup
ita yang sa
an dengan S
asilkan sam emanasan p ecilnya luas ga gumpala
ningkat.
han awal Ca (a dan b) da besaran 250×
(Gambar 6) gabung me an yang s 005) melapo
ukuran sera
unjukkan ke HAp telah sitas pita se asi CO32−.
C lebih me 0 oC. Hal i sar daripada si CO32−(Fi
a menghasi han dasar C
pel di udara anya uap ai mbentuk kals pa pita kec ama teramat
SEM
mpel berbent pada suhu 1 s permukaan an yang ter
aO dan Ca(O an 900 oC
×
) memperlih enjadi lebih seragam, n orkan hasil agam. Perbe eberadaan g terbentuk erapan. Kals Spektrum enurunkan ini menunju
a suhu 110 fia 2008). ilkan kandu CaO. Pada a terbuka se
ir yang terj sium karbon cil pada bila ti pada spek
tuk menggu 100 oC (Ga n butiran se rbentuk sem
OH)2 dengan
(c dan d).
hatkan morf h besar. Ta namun mem
SEM HAp edaan morf
11
gugus pada sinasi FTIR nilai ukkan 00 oC.12
ditun yang halus Gam Gam CaO ke p menu FTIR awal karen yang yang njukkan ole g membentu s (Trianita 2mbar 6 Morf p
mbar 7 Hasil
Sintesis H dan Ca(OH pH 7 diper
unjukkan H R menunjuk l Ca(OH)2
na menghas g tinggi. Fo g seragam, n
eh HAp kom uk agregat. U
2012).
fologi HAp pemanasan
l analisis SE
SI
HAp berhas H)2 hasil ka
rlukan untu HAp sebagai
kkan kebera dan peman silkan HAp oto SEM m namun mem
mersial (Ga Ukuran gran
dengan bah 1100 oC (a
EM produk
IMPULAN
sil dilakuka alsinasi dan uk pemben i fase domi adaan gugus nasan padap dengan k memperlihat miliki permu
ambar 7), p nul tidak me
han awal Ca dan b) dan 100
HAp kome
N DAN S
an dengan m n hidrasi can
ntukan HAp nan dengan s fosfat dan suhu 1100 kristalinitas,
tkan morfol ukaan yang k
partikel terd erata, dan m
aO dan Ca(O 900 oC (c d 0×
ersial pada p
SARAN
metode sol ngkang kera
p tersebut. n sedikit fas hidroksil. S 0 oC merup
parameter logi seperti kasar.
diri atas gra memiliki str
OH)2 deng
dan d). Perb
perbesaran 1
l-gel dari b ang hijau. P
Difraktog se-fase lain. Sintesis den pakan kond r kisi, dan i granul de
13
Masih diperlukan penelitian lebih lanjut dengan meminimumkan kandungan CO32− dalam hasil kalsinasi cangkang kerang hijau, serta mengoptimumkan
teknik-teknik eksperimental seperti pH, suhu, dan kecepatan pengadukan. Penelitian ini dapat dilanjutkan dengan menyintesis HAp dalam bentuk scaffold
yaitu dengan penambahan komposit tertentu agar memiliki matriks berpori.
DAFTAR PUSTAKA
Adak MD, Purohit KM. 2011. Synthesis of nano-crystalline hydroxyapatite from dead snail shells for biological implantation. Organs. 25(3):101-106.
Aoki H. 1991. Science and Medical Applications of Hydroxyapatite. Tokyo (JP): Tokyo Medical and Dental Univ.
Arifianto. 2006. Pengaruh atmosfer dan suhu sintering terhadap komposisi pelet hidroksiapatit yang dibuat dengan sintesa kimia dengan pelarut air dan SBF [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Awang-Hazmi AJ, Zuki ABZ, Noordin MM, Jalila A, Norimah Y. 2005. Mineral composition of the cokle (Anadara granosa) shells of west coast of Peninsular Malaysia and it’s potential as biomaterial for use in bone repair.
Animal & Veterinary Adv. 6(5):591-594.
Bernache-Assolant D, Ababou A, Champion E, Heughebaert M. 2002. Sintering of calcium phosphate hydroxyapatite Ca10(PO4O)6(OH)2 [internet]. [diunduh
2012 Des 1]. Tersedia pada: http://www.elsevier.com.
Cullity BD, Stock SR. 2001. Elements of X-Ray Diffraction. New Jersey (US): Prentice Hall.
Dahlan K, Prasetyanti F, Sari YW. 2009. Sintesis hidroksiapatit dari cangkang telur menggunakan dry method. JBiofisika. 5(2):71-78.
Fifia Z. 2008. Spektroskopi inframerah, serapan atomik, dan ultraviolet-visible
hidroksiapatit dari cangkang telur [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Hidayat Y, Maddu A, Soedjoko DS. 2006. Spektroskopi Fourier transform infrared (FTIR) senyawa kalsium fosfat pengaruh ion F− dan Mg2+ hasil presipitasi. JBiofisika. 1:21-27.
Irfana L, Herawati L. 2012. Sintesis hidroksiapatit dari cangkang tutut (Bellamya javanica) [laporan praktikum]. Bogor (ID): Institut Pertanian Bogor.
Kehoe S. 2008. Optimization of hydroxyapatite (HAp) for orthopaedic application via the chemical precipitation technique [tesis]. Dublin (IE): Dublin City University.
Krishna SR, Siddharthan A, Seshadri SK, Kumar S. 2007. A novel route for synthesis of nanocrystalline hydroxyapatite from eggshell waste. Mat Med.
18:1735-1743.
Muntamah. 2011. Sintesis dan karakterisasi hidroksiapatit dari limbah cangkang kerang darah (Anadara granosa) [tesis]. Bogor (ID): Institut Pertanian Bogor.
14
Nurlaela A. 2009. Penumbuhan kristal apatit dari cangkang telur ayam dan bebek pada kitosan dengan metode presipitasi [tesis]. Bogor (ID): Institut Pertanian Bogor.
Purnama EF. 2006. Pengaruh suhu reaksi terhadap derajat kristalinitas dan komposisi dibuat dengan media air dan cairan tubuh buatan (synthetic body fluid)[skripsi]. Bogor (ID): Institut Pertanian Bogor.
Qoniah I, Prasetyoko D. 2010. Penggunaan cangkang bekicot sebagai katalis untuk reaksi transesterifikasi refined palm oil [skripsi]. Jakarta (ID): Institut Teknologi Sepuluh Nopember.
Samsiah R. 2009. Karakteristik biokomposit apatit-kitosan dengan XRD (X-ray diffraction), FTIR (Fourier transform infrared), SEM (scanning electron microscopy) dan uji mekanik [skripsi]. Bogor (ID): Institut Pertanian Bogor. Soejoko DS. 1999. Kajian komposisi dan struktur senyawa mineral dalam
kutikula Macrobrachium rosenbergii dan Penaeus monodon serta evolusinya selama periode molting [disertasi]. Bandung (ID): Institut Teknologi Bandung.
Soejoko DS, Wahyuni S. 2002. Spektroskopi inframerah senyawa kalsium fosfat hasil presipitasi. Makara Sains. 6(3):117-120.
Solihat R. 2008. Hydrothermal synthesis of hydroxyapatite from eggshell: XRD, FTIR and SEM-EDXA characterization [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Suzuki DT, Griffiths AJF, Miller JH, Lewontin RC, Gelbart WM. 1993. An Introduction to Genetic Analysis. New York (US): Freeman.
Tazaki J, Murata M, Akazawa T, Yamamoto M, Ito K, Arisue M, Shibata T, Tabata Y. 2009. BMP-2 release and dose-response studies in hydroxyapatite and β-tricalcium phosphate. Bio-Med Mat & Eng. 19:141-146.
Trianita VN. 2012. Sintesis hidroksiapatit berpori dengan porogen polivinil alkohol dan pati [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Vazquez CG, Barba CP, Munguia N. 2005. Stochiometric hydroxyapatite obtained by precipitation and sol gel processes. Investigaci’ on Revista Mexiana De F’isica. 51(3):284-239.
15
Lampiran 1 Diagram alir sintesis HAp metode sol-gel
Pencucian dan pengeringan cangkang kerang
Kalsinasi
(1100 oC, 12 dan 18 jam)
Ditambahkan H3PO4+ etanol
Diaduk 300 rpm 37 oC laju alir 1 mL/menit
Dipanaskan dengan penangas air (60 oC, selama 1 jam)
Didiamkan 24 jam
Diaduk 300 rpm 60 oC sampai terbentuk gel
Dipanaskan (2 jam pada 900 dan 1100 oC)
Ca(OH)2
XRD
FTIR
SEM
CaO
H2O
XRD XRD
16
Lampiran 2 Komposisi bahan awal HAp
Sampel Massa (g) Volume H3PO4 (mL)
CaO 2.3400 1.90
Ca(OH)2 3.1700 1.90
CaO 2.3400 1.90
Ca(OH)2 3.1700 1.90
Contoh perhitungan:
Massa P :
ρ H3PO4 80% = 1.628 g/mL m
H
3PO
4=
ρ
×
V
= 1.628 g/mL × 1000 mL = 1628 g
m
H
3PO
4 80% = 1628 g= 1302.4 g
M =
L
= .
L L
L = 13.2898 M
V1 × M1 = V2 × M2
V1 × 13.2898 = 50 mL × 0.5 M
V1 = 1.90 mL
Konsentrasi Ca/P :
Ca/P = 1.67
Ca/P = 0.5 M × 1.67 = 0.835 M
Massa CaO:
M =
L
0.835 M =
L L
L
m CaO = 2.338 g
Massa Ca(OH)2:
M =
L
0.835 M =
L L
L
Lampiran 3 Radas siintesis HAp
18
Lampiran 4 Data JCPDS
Kalsium oksida (CaO) JCPDS No. 37-1497
Kalsium karbonat (CaCO3)
19
lanjutan Lampiran 4
Kalsium hidroksida (Ca(OH)2)
JCPDS No. 44-1481
Hidroksiapatit (Ca10(PO4)6(OH)2 )
20
lanjutan Lampiran 4
Apatit karbonat tipe A (AKA) (Ca10(PO4)6CO3 )
JCPDS No. 35-0180
Apatit karbonat tipe B (AKB) (Ca10(PO4)3(CO3)3(OH)2)
21
lanjutan Lampiran 4
Oktakalsium fosfat (Ca4H(PO4)3.25H2
JCPDS No. 44-0778
22
lanjutan Lampiran 4
23
Lampiran 5 Perhitungan konsentrasi kalsium cangkang kerang
a. Kurva standar
b. Konsentrasi kalsium pada cangkang kerang hijau
Sampel CaO Absorbans Konsentrasi Bobot sampel FP Konsentrasi
(ppm) (g) (% b/v)
Ulangan 1 0.1583 4.4529 0.1000 100 44.53
Ulangan 2 0.166 4.6698 0.1 100 46.7
Rerata 45.62
Contoh perhitungan ulangan 1
Persamaan garis:
y = 0.00041 + 0.03546x
0.1583 = 0.00041 + 0.03546x
0.03546x = 0.1579 x = 4.4529
Konsentrasi Ca =
L L
%
Konsentrasi Ca = . L
L L
. %
Konsentrasi Ca = 44.53% (b/b)
0.0000 0.5000
0 5 10 15
Absorbans
Konsentrasi (ppm)
Konsentrasi (ppm) Absorbans
2
0.069 1
4
0.143 7
6
0.214 0
8
0.286 8
10
24
Lampiran 6 Difraktogram HAp komersial
Lampiran 7 Perhitungan ukuran kristal sampel
d = β α
θ , k = 0.9 α = 0.15406 nm
HAp dengan Suhu 2θ θ
cos θ β β β cos θ d(002)
menggunakan (°C) (deg) (deg) (deg) (rad) (nm)
CaO 1100 25.87 12.93 0.9746 0.09445 0.0016 0.0016 86.66
Ca(OH)2 1100 25.9 12.95 0.9746 0.0825 0.0014 0.0014 99.04
CaO 900 25.88 12.94 0.9746 0.1178 0.002 0.002 69.33
Ca(OH)2 900 25.89 12.94 0.9746 0.0971 0.0017 0.0017 81.56
2θ Intensitas Fase
10.825 34 HAp
16.731 29 HAp
25.808 72 HAp
28.084 27 HAp
28.842 36 HAp
31.687 185 HAp
32.852 123 AKA
33.99 119 HAp
35.399 54 HAp
39.733 49 AKA
46.615 67 HAp
48.105 30 HAp
49.405 59 HAp
50.435 30 HAp
51.166 30 AKB
52.006 26 HAp
25
Lampiran 8 Difraktogram hasil sintesis HAp pada pH 3
CaO 1100 oC
Ca(OH) 2 1100 oC
CaO 900 oC
Ca(OH) 2 900 oC
Keterangan: HAp : hidroksiapatit
AKA : apatit karbonat tipe A AKB : apatit karbonat tipe B
αTCP : α-trikalsium fosfat
26
RIWAYAT HIDUP
Penulis dilahirkan di Depok pada tanggal 18 September 1988 dari Ayah Muhammad Nasikin dan Ibu Srimurniati. Penulis merupakan anak pertama dari 2 bersaudara. Penulis menyelesaikan studi di SMA Sejahtera I pada tahun 2006. Pada tahun yang sama penulis diterima di Akademi Kimia Analisis Bogor (AKA). Tahun 2009 penulis melaksanakan kegiatan praktik kerja lapangan di Pusat Laboratorium Forensik (Puslabfor) Mabes Polri di Jakarta dengan judul laporan “Pengujian Kadar Beberapa Logam Berat dalam Limbah Padat Industri Kulit Imitasi Secara TCLP (Toxicity Characteristic Leaching Procedure) Menggunakan Spektrofotometer Serapan Atom”.