KEEFEKTIFAN PERLAKUAN PANAS KERING
DAN IRADIASI UV-C UNTUK MEMATIKAN
CENDAWAN MODEL Microcyclus ulei
APRIDA CRISTIN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Keefektifan Perlakuan Panas Kering dan Iradiasi UV-C untuk Mematikan Cendawan Model Microcyclus ulei
adalah karya saya dengan arahan dari Komisi Pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Mei 2012
Aprida Cristin
ABSTRACT
APRIDA CRISTIN. The Effectiveness of Dry Heat Treatment and UV-C Irradiation to kill the fungus models of Microcyclus ulei. Supervised by MEITY SURADJI SINAGA and ABDUL MUIN ADNAN.
This study was carried out to develop methods of treatment as well as determine the effective dose of dry heat treatment and UV-C irradiation to kill the fungus models of Microcyclus ulei on soybean grains and soybean meals without damaging its nutritional content. The fungus models used in this research were
Colletotrichum gloeosporioides, Botryodiplodia theobromae, Fusariumoxysporum
f.sp. niveum, and Sclerotium rolfsii. The results of this research showed that UV-C treatment until 12 and 24 hours exposure times at 15 and 30 cm from UV-C light was not effective to kill all the fungus models in PDA, probably due to the influence of NUV light from the lamp which was not pure at wavelength of UV-C. Therefore, further test on soybean would not be continued. Dry heat treatment at 55 ºC for 30 and 60 minutes had been shown effective to kill C. gloeosporioides, B. theobromae, and S. rolfsi in PDA, except F. oxysporum f.sp. niveum. Further experiments on soybean showed that 55 ºC for 30 minutes was effective to kill conidia of C. gloeosporioides, B. theobromae, and F. oxysporum f.sp. niveum,
without damaging its protein content. However, dry heat treatment at 60 ºC for 60 minutes has been proved not effective to kill sclerotia of S. rolfsii. If M. ulei had the similar resistance as S. rolfsii, then it would need a higher temperature and time than used in this study. Therefore, experiments using a large amount of soybean were still needed.
RINGKASAN
APRIDA CRISTIN. Keefektifan Perlakuan Panas Kering dan Iradiasi UV-C untuk Mematikan Cendawan Model Microcyclus ulei. Dibimbing oleh MEITY SURADJI SINAGA dan ABDUL MUIN ADNAN.
Microcyclus ulei (P. Henn) v. Arx, penyebab penyakit hawar daun Amerika Selatan (South American Leaf Blight, SALB) merupakan faktor utama yang menghambat perkembangan industri karet alam di Amerika Selatan dan menjadi ancaman bagi perkebunan karet di Asia Pasifik, termasuk Indonesia. Meskipun telah ditetapkan sebagai OPTK A1, risiko masuknya M. ulei ke Indonesia tidak dapat dihindari. Saat Indonesia mengalami ketergantungan terhadap kedelai impor, peluang terbawanya M. ulei sebagai kontaminan pada kedelai impor dari Brazil cukup tinggi karena daerah produksi kedelai di Brazil merupakan daerah sebar M. ulei. Meskipun hanya bersifat sebagai kontaminan M. ulei masih berisiko tinggi untuk tersebar dan berkembang di Indonesia karena askospora dan konidia M. ulei mampu bertahan pada kondisi ekstrim dalam waktu yang cukup lama.
Perlakuan karantina yang selama ini diterapkan di Indonesia untuk komoditas non karet dari negara endemis SALB adalah iradiasi sinar ultraviolet (253-257 nm) selama 15 menit atau perlakuan uap panas suhu 55 °C selama 30 menit sebagaimana tercantum pada lampiran Keputusan Menteri Pertanian No. 861/Kpts/LB.720/12/1989 tentang Pencegahan Masuknya Penyakit Hawar Daun Hevea Amerika Selatan ke Dalam Wilayah Negara Republik Indonesia. Namun, hasil penelitian terakhir menunjukkan bahwa konidia M. ulei mati dengan perlakuan iradiasi sinar UV-C selama 60 menit atau perlakuan panas kering pada suhu 55 °C selama 30 menit. Berdasarkan hal tersebut, keefektifan perlakuan karantina tumbuhan untuk mematikan M. ulei sebagaimana tercantum pada lampiran Kepmentan No. 861/Kpts/LB.720/12/1989 perlu dikaji kembali dengan studi kasus biji dan bungkil kedelai impor.
Kajian dilakukan dalam suatu penelitian yang bertujuan: (1) mengembangkan metode perlakuan yang efektif mematikan cendawan model
M. ulei pada biji dan bungkil kedelai tanpa merusak kandungan nutrisi biji dan bungkil kedelai, serta (2) menentukan dosis iradiasi dan perlakuan panas kering yang efektif mematikan cendawan model M. ulei pada biji dan bungkil kedelai tanpa merusak kandungan nutrisi biji dan bungkil kedelai. Status M. ulei sebagai OPTK A1 di Indonesia menjadi dasar digunakannya cendawan model yang memiliki kemiripan karakteristik bertahan pada kondisi ekstrim seperti M. ulei, yaitu Colletotrichum gloeosporioides, Botryodiplodia theobromae, Fusarium oxysporum f.sp. niveum, dan Sclerotium rolfsii.
Hasil penelitian menunjukkan bahwa perlakuan iradiasi UV-C hingga waktu papar 12 dan 24 jam pada jarak 15 dan 30 cm dari lampu UV-C tidak efektif mematikan biakan C. gloeosporioides, B. theobromae, F.oxysporum f.sp. niveum
dan S. rolfsi pada media PDA. Hal ini terjadi kemungkinan akibat pengaruh sinar NUV yang juga dipancarkan oleh lampu karena lampu yang tertera sebagai UV-C ternyata tidak murni pada panjang gelombang UV-C. Berdasarkan hal tersebut, pengujian selanjutnya pada biji dan bungkil kedelai tidak dilakukan. Sementara itu, perlakuan panas kering pada suhu 55 ºC selama 30 dan 60 menit efektif mematikan biakan C. gloeosporioides, B. theobromae, dan S. rolfsi di media PDA, kecuali F. oxysporum f.sp. niveum. Namun, perlakuan pada suhu 60 ºC selama 30 menit telah efektif mematikan semua biakan cendawan model. Berdasarkan hal tersebut, pengujian selanjutnya pada biji dan bungkil kedelai dilakukan pada suhu 50, 55, dan 60 ºC selama 30 dan 60 menit. Hasil uji perlakuan panas kering terhadap biji dan bungkil kedelai menunjukkan bahwa
suhu 55 ºC selama 30 menit efektif mematikan konidia C. gloeosporioides, B. theobromae, dan F. oxysporum f.sp. niveum tanpa merusak kandungan
protein total kedelai. Akan tetapi, perlakuan hingga suhu 60 ºC selama 60 menit
masih belum mampu mematikan sklerotia dari S. rolfsii. Apabila sifat tahan
M. ulei terhadap panas kering lebih menyerupai sklerotia dari S. rolfsii maka diperlukan suhu dan waktu perlakuan panas kering yang lebih tinggi daripada suhu dan waktu perlakuan yang digunakan dalam penelitian ini. Namun demikian, masih perlu dilakukan pengujian perlakuan panas kering dan iradiasi UV-C murni pada komoditas biji dan bungkil kedelai dalam jumlah yang lebih besar.
© Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apa pun tanpa izin IPB.
KEEFEKTIFAN PERLAKUAN PANAS KERING
DAN IRADIASI UV-C UNTUK MEMATIKAN
CENDAWAN MODEL Microcyclus ulei
APRIDA CRISTIN
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Keefektifan Perlakuan Panas Kering dan Iradiasi UV-C untuk Mematikan Cendawan Model Microcyclus ulei
Nama : Aprida Cristin NIM : A352100214
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. Meity Suradji Sinaga, MSc. Dr. Ir. Abdul Muin Adnan, MS.
Ketua Anggota
Diketahui
Ketua Program Studi Fitopatologi Dekan Sekolah Pascasarjana
Dr. Ir. Sri Hendrastuti Hidayat, MSc. Dr. Ir. Dahrul Syah, MSc.Agr.
PRAKATA
Puji syukur Penulis panjatkan kepada Tuhan Yang Maha Esa atas limpahan berkatNya sehingga karya ilmiah ini dapat diselesaikan. Tesis ini berjudul ”Keefektifan Perlakuan Panas Kering dan Iradiasi UV-C untuk Mematikan Cendawan Model Microcyclus ulei”.
Dalam tesis dikaji perlakuan karantina tumbuhan secara khusus untuk mematikan penyebab SALB pada karet yang mungkin terbawa pada produk impor non karet dengan studi kasus biji dan bungkil kedelai. M. ulei adalah OPTK A1 di Indonesia, oleh karena itu studi perlakuan karantina tumbuhan dilakukan pada cendawan model yang memiliki kemiripan karakteristik bertahan pada kondisi ekstrim seperti M. ulei.
Pada kesempatan ini, Penulis mengucapkan terimakasih kepada:
1. Prof. Dr. Meity Suradji Sinaga, MSc. dan Dr. Ir. Abdul Muin Adnan, MS. sebagai Komisi Pembimbing yang selalu siap memberikan arahan, bimbingan, dan motivasi kepada Penulis selama penelitian berlangsung hingga selesainya penyusunan karya ilmiah ini;
2. Dr. Ir. Eliza Suryati Rusli, MSi sebagai penguji luar komisi pada ujian tesis yang telah banyak memberikan saran untuk perbaikan dan pengayaan informasi dalam tesis ini;
3. Badan Karantina Pertanian yang telah memberikan beasiswa kepada Penulis untuk mengikuti Program Khusus Magister Sains Entomologi - Fitopatologi IPB;
4. Balai Uji Terap Teknik dan Metoda Karantina Pertanian yang telah memberikan dukungan fasilitas laboratorium kepada Penulis selama penelitian;
5. Balai Karantina Pertanian Kelas II Cilegon yang telah memberikan sampel bungkil kedelai asal Brazil untuk Penulis gunakan dalam penelitian ini;
6. Dr. Akhiruddin Maddu, Ketua Departemen Ilmu Fisika IPB atas kesediaannya menguji lampu UV-C;
7. Departemen Proteksi Tanaman IPB atas dukungan dan kerjasamanya selama Penulis mengikuti Program Khusus Magister Sains Entomologi -Fitopatologi IPB;
8. Rekan-rekan mahasiswa Program Khusus Magister Sains Karantina Tumbuhan TA 2010 atas semangat dan kebersamaannya selama menjalani Program Khusus Magister Sains Entomologi - Fitopatologi IPB;
9. David Ardhian dan kedua putri tercinta (Nadine dan Valine) serta seluruh keluarga besar Penulis atas doa, dukungan, pengertian, dan kasih sayangnya yang tulus sehingga Penulis dapat menyelesaikan studi ini tepat pada waktunya.
Penulis berharap semoga karya ilmiah ini dapat bermanfaat bagi Badan Karantina Pertanian dalam mencegah masuknya Organisme Pengganggu Tumbuhan Karantina ke dalam wilayah negara Republik Indonesia.
Bogor, Mei 2012
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 26 April 1977 dari ayah Kasman Panjaitan dan ibu Kalementina Sinurat. Penulis merupakan putri kedua dari empat bersaudara.
Tahun 1995, Penulis diterima sebagai mahasiwa Jurusan Hama dan Penyakit Tumbuhan, Fakultas Pertanian, Institut Pertanian Bogor (IPB) melalui jalur PMDK dan lulus sebagai Sarjana Pertanian pada tahun 1999.
Sejak tahun 2001 hingga sekarang, Penulis bekerja di Badan Karantina Pertanian, Kementerian Pertanian. Pada tahun 2010, Penulis mendapat beasiswa dari Badan Karantina Pertanian untuk mengikuti Program Khusus Magister Sains pada Program Studi Entomologi – Fitopatologi IPB, kerjasama Badan Karantina Pertanian dengan Institut Pertanian Bogor.
DAFTAR ISI
Kebutuhan Kedelai di Indonesia ……..………....………… .. 7
Karakteristik Cendawan Model …...………..……..………... 9
Perlakuan Iradiasi UV-C …..………..………..…..… . 10
Perlakuan Panas Kering ……….………..……….…… . 12
Pengaruh Suhu Tinggi terhadap Protein ………..….…….…… . 13
BAHAN DAN METODE ……..……... 15
Waktu dan Tempat …….………... 15
Bahan dan Alat …...………..….…………..………..………... 15
Metode Penelitian ………... 15
Peremajaan Cendawan Model Sebelum Perlakuan ...……….. 15
Pengujian Pengaruh Perlakuan Iradiasi UV-C terhadap Pertumbuhan Koloni Cendawan Model ….……...…………. 16
Pengujian Pengaruh Perlakuan Panas Kering terhadap Pertumbuhan Koloni Cendawan Model …..………….………... 17
Analisis Data …..…………....……….……… 17
Pengujian Pengaruh Perlakuan Panas Kering terhadap Daya Tumbuh Cendawan Model pada Biji dan Bungkil Kedelai …… 17
Pengujian Pengaruh Perlakuan Panas Kering terhadap Kandungan Protein pada Biji dan Bungkil Kedelai ………….... 18
HASIL DAN PEMBAHASAN ……… 19
Pertumbuhan Koloni Cendawan Model Hasil Peremajaan ………... 19
Perlakuan Iradiasi UV-C terhadap Pertumbuhan Koloni Cendawan Model ………...………. . 21
Perlakuan Panas Kering terhadap Pertumbuhan Koloni Cendawan Model …... 24
Perlakuan Panas Kering terhadap Daya Tumbuh Cendawan Model pada Biji dan Bungkil Kedelai ... . 32
DAFTAR TABEL
Halaman
1 Pemasukan kedelai impor dari Brazil melalui UPT Badan
Karantina Pertanian tahun 2010-2011 ...………. . 9 2 Penghambatan relatif (PHR) pertumbuhan cendawan model
M. ulei setelah perlakuan iradiasi UV-C pada berbagai waktu
papar dengan jarak 40 cm dari lampu UV-C ... 21 3 Penghambatan relatif (PHR) pertumbuhan cendawan model
M. ulei setelah perlakuan iradiasi UV-C pada berbagai waktu
papar dengan jarak 30 cm dari lampu UV-C .….……… . 22 4 Penghambatan relatif (PHR) pertumbuhan cendawan model
M. ulei setelah perlakuan iradiasi UV-C selama 12 dan 24 jam
pada jarak 15 dan 30 cm dari lampu UV-C …..…... . 22 5 Penghambatan relatif (PHR) pertumbuhan cendawan model
M. ulei setelah perlakuan panas kering pada berbagai suhu
selama 30 dan 60 menit ……….. 25 6 Penghambatan relatif (PHR) pertumbuhan cendawan model
M. ulei dengan pengamatan aktual, analisis Polo Plus Versi 1.0,
dan regresi ………..………. . 32 7 Jumlah koloni cendawan model M. ulei pada biji dan bungkil
DAFTAR GAMBAR
Halaman
1 Spora Microcyclus ulei ………....……… 5 2 Biakan C. gloeosporioides umur 7 hari pada media PDA dalam
cawan petri ………..……….... 19 3 Biakan B. theobromae umur 7 hari pada media PDA dalam cawan
petri ………...……..…...………... 20 4 Biakan F. oxysporum f.sp. niveum umur 7 hari pada media PDA
dalam cawan petri ………... 20 5 Biakan S. rolfsii umur 7 hari pada media PDA dalam cawan
petri……….…………... 21 6 Panjang gelombang lampu UV-C yang digunakan dalam
pengujian ...………... 23 7 Hubungan antara suhu perlakuan panas kering dan
penghambatan relatif (PHR) pertumbuhan koloni
C. gloeosporioides (Program PoloPlus Versi 1.0) ………. 26 8 Hubungan antara suhu perlakuan panas kering dan
penghambatan relatif (PHR) pertumbuhan koloni
C. gloeosporioides…...……… 27
9 Hubungan antara suhu perlakuan panas kering dan
penghambatan relatif (PHR) pertumbuhan koloni B. theobromae
(Program PoloPlus Versi 1.0) ………………… 27 10 Hubungan antara suhu perlakuan panas kering dan
penghambatan relatif (PHR) pertumbuhan koloni B. theobromae .. . 28 11 Hubungan antara suhu perlakuan panas kering dan
penghambatan relatif (PHR) pertumbuhan koloni F. oxysporum
f.sp. niveum (Program PoloPlus Versi 1.0) ……… 28 12 Hubungan antara suhu perlakuan panas kering dan
penghambatan relatif (PHR) pertumbuhan koloni F. oxysporum
f.sp. niveum .………...... 29 13 Hubungan antara suhu perlakuan panas kering dan
penghambatan relatif (PHR) pertumbuhan miselium S. rolfsii
(Program PoloPlus Versi 1.0) ……… 29 14 Hubungan antara suhu perlakuan panas kering dan
penghambatan relatif (PHR) pertumbuhan miselium S. rolfsii ……. 30 15 Hubungan antara suhu perlakuan panas kering dan
penghambatan relatif (PHR) pertumbuhan sklerotia S. rolfsii
(Program PoloPlus Versi 1.0) ……… 30 16 Hubungan antara suhu perlakuan panas kering dan
penghambatan relatif (PHR) pertumbuhan sklerotia S. rolfsii ……. 31 17 Pengaruh perlakuan panas kering dan inokulasi C.gloeosporioides
DAFTAR LAMPIRAN
Halaman
1 Sidik ragam pengaruh perlakuan iradiasi UV-C terhadap
pertumbuhan koloni cendawan model M. ulei pada waktu papar 0,
30, 60, 90, dan 120 menit dengan jarak 40 cm dari lampu UV-C ... 45 2 Sidik ragam pengaruh perlakuan iradiasi UV-C terhadap
pertumbuhan koloni cendawan model M. ulei pada waktu papar
0, 3, 5, 7, 9, 12, dan 24 jam dengan jarak 30 cm dari lampu V-C ... 45 3 Sidik ragam pengaruh perlakuan iradiasi UV-C terhadap
pertumbuhan koloni cendawan model M. ulei pada waktu papar 0,
12, dan 24 jam dengan jarak 15 dan 30 cm dari lampu UV-C ….... . 45 4 Sidik ragam pengaruh perlakuan panas kering pada suhu 45, 50,
55, 60, dan 65 °C selama 0. 30, dan 60 menit terhadap
pertumbuhan koloni cendawan model M. ulei ... . 45 5 Kandungan protein pada biji dan bungkil kedelai hasil uji
perlakuan panas kering ……….. 46 6 Biji kedelai asal USA dan bungkil kedelai asal Brazil sebagai
bahan pengujian ……….. 47 7 Oven merk Memmert yang telah dikalibrasi sebagai alat perlakuan
panas kering ……… 47
8 Rak aluminium dengan lampu UV-C sebagai alat perlakuan
PENDAHULUAN
Latar Belakang
Indonesia merupakan salah satu penghasil karet alam terbesar di dunia dan menempati peringkat kedua setelah Thailand. Bagi Indonesia, karet merupakan komoditas unggulan ekspor yang menjadi sumber devisa negara yang cukup penting dari sektor non-migas. Data statistik perkebunan menunjukkan bahwa nilai ekspor karet Indonesia umumnya selalu mengalami peningkatan. Pada tahun 2000 nilai ekspor karet Indonesia adalah 888 ribu US$ kemudian meningkat menjadi 2.5 juta US$ pada tahun 2005 dan mencapai 6 juta US$ pada tahun 2008 (Ditjen Perkebunan 2010). Salah satu faktor yang dapat mengancam kelangsungan ekspor karet Indonesia adalah serangan OPT yang paling berbahaya bagi pertanaman karet di dunia, yaitu Microcyclus ulei.
Microcyclus ulei (P. Henn) v. Arx, penyebab penyakit hawar daun hevea Amerika Selatan (South American Leaf Blight, SALB) merupakan faktor utama yang menghambat perkembangan industri karet alam di Amerika Selatan dan dapat menjadi ancaman bagi negara-negara penghasil karet alam di Asia Pasifik, termasuk Indonesia (Langford 1945; Edathil 1986). Cendawan Ascomycetes ini diketahui memiliki kemampuan merusak secara menyeluruh pada pertanaman karet sehingga menyebabkan kerugian ekonomi maupun sosial di negara-negara penghasil karet di Amerika Selatan. Sejarah mencatat, di Suriname, sepertiga dari 40 000 pohon karet yang ditanam pada tahun 1911 hancur pada tahun 1918 akibat serangan M. ulei. Di Panama, perkebunan karet yang didirikan oleh
Goodyear Company pada tahun 1935 juga hancur pada tahun 1940 akibat serangan M. ulei. Di Fordlândia (Brazil), sekitar 25% dari 3500 ha perkebunan karet yang dibuka oleh Ford Company (Amerika Serikat) pada tahun 1928 terserang M. ulei pada tahun 1933 sehingga perkebunan tersebut dipindahkan ke Belterra pada tahun 1934 dengan luas lahan 6570 ha dan ditanami klon unggul asli. Namun, pada tahun 1941 dan 1942 serangan M. ulei meningkat secara signifikan dan menyebabkan perkebunan tersebut hancur pada tahun 1943. Di Bahia (Brazil), perkebunan karet hancur akibat serangan M. ulei hanya dalam waktu 5 tahun sejak dibuka pada tahun 1982 (CABI 2007).
2
Salvador, Honduras, Guatemala, Belize), dan Amerika Utara (Mexico). Negara-negara penghasil karet alam di Asia Pasifik yang tergabung dalam Asia Pacific Plant Protection Commission (APPPC) hingga saat ini terus melakukan pencegahan penyebaran M. ulei ke Asia Pasifik, yaitu dengan menetapkan
M. ulei sebagai Organisme Pengganggu Tumbuhan Karantina (OPTK) yang dilarang pemasukannya ke Asia Pasifik (FAO 2007). Secara khusus, Indonesia juga selalu menetapkan M. ulei sebagai OPTK A1, yaitu OPTK yang belum terdapat di Indonesia dan dilarang pemasukannya ke dalam wilayah negara Republik Indonesia (RI) (Kementan 2011).
Risiko masuknya M. ulei ke Indonesia melalui kegiatan impor komoditas pertanian tidak dapat dihindari. Saat kebutuhan nasional Indonesia akan kedelai impor sebagai bahan pangan maupun pakan semakin tinggi dan mencapai 60% pada tahun 2006 (Supadi 2009), serta didukung dengan adanya peningkatan hubungan kerjasama internasional antara Indonesia dan Brazil, mendorong dilakukannya importasi kedelai dari Brazil yang merupakan negara penghasil kedelai terbesar kedua di dunia setelah Amerika Serikat. Importasi kedelai dari Brazil berpeluang tinggi membawa M. ulei karena daerah produksi kedelai di Brazil, yaitu Sao Paulo, Parana, Mato Grosso, Mato Grosso do Sul, dan Minas Gerais merupakan daerah sebar M. ulei (Flaskerud 2003, CABI 2007). Selain itu, data e-plaq Badan Karantina Pertanian (Barantan) menunjukkan bahwa 99% kedelai Brazil yang masuk ke Indonesia pada tahun 2010-2011 adalah bentuk bungkil sebagai pakan ternak. Di Brazil, ada kemungkinan penanganan bungkil sebagai komoditas ekspor tidak sebaik pada biji kedelai sehingga bungkil sangat berpeluang terhadap kontaminasi M. ulei.
Cendawan M. ulei masih berisiko tinggi untuk tersebar dan berkembang di wilayah pertanaman karet Indonesia meskipun hanya bersifat sebagai kontaminan. Askospora dan konidia M. ulei diketahui mampu bertahan hidup pada kondisi ekstrim dan dalam waktu yang cukup lama, baik pada komoditas pertanian maupun material lainnya. Konidia M. ulei yang diletakkan pada kaca objek dan disimpan dalam desikator selama 16 minggu masih mampu berkecambah, sementara askospora yang disimpan dalam desikator juga masih mampu bertahan hidup selama 15 hari (Chee 1976). Selain itu, konidia M. ulei
3
berhasil masuk dan tersebar ke wilayah pertanaman karet di Indonesia, kemungkinan besar dapat berkembang dengan baik karena adanya kesamaan iklim Indonesia dengan ekosistem M. ulei di Brazil.
Selama ini, pencegahan masuknya M. ulei ke wilayah RI telah dilakukan oleh Barantan melalui implementasi Keputusan Menteri Pertanian (Kepmentan) Nomor 861/Kpts/LB.720/12/1989 tentang Pencegahan Masuknya Penyakit Hawar Daun Hevea Amerika Selatan ke Dalam Wilayah Negara Republik Indonesia (Deptan 1989). Pada lampiran Kepmentan tersebut antara lain menyebutkan bahwa perlakuan karantina yang diberikan terhadap hasil tanaman berupa bahan tanaman mati adalah iradiasi sinar ultra violet (253-257 nm) selama 15 menit atau perlakuan uap panas 55 °C selama 30 menit. Namun, hasil penelitian terakhir menunjukkan bahwa konidia M. ulei mati dengan perlakuan iradiasi sinar UV-C selama 60 menit (LebaiJuri et al. 1997) atau dengan perlakuan panas kering pada suhu 55 °C selama 30 menit (Hashim 2007). Oleh karena itu, perlakuan sebagaimana tercantum dalam lampiran Kepmentan No. 861/1989 dalam hal keefektifannya mematikan cendawan M. ulei perlu ditinjau kembali, terutama ketika M. ulei menjadi kontaminan pada komoditas kedelai. Namun, karena status patogen tersebut sebagai OPTK A1 maka digunakan cendawan model yang sudah ada di Indonesia yang memiliki karakteristik bertahan pada kondisi ekstrim mirip M. ulei, dan diutamakan berasal dari kelas yang sama dengan M. ulei, yaitu Ascomycetes atau dari kelas lainnya, seperti Sclerotium rolfsii.
Tujuan Penelitian
Penelitian ini bertujuan:
1. Mengembangkan metode perlakuan yang efektif mematikan cendawan model
M. ulei pada biji dan bungkil kedelai tanpa merusak kandungan nutrisi biji dan bungkil kedelai.
4
Hipotesis
Perlakuan iradiasi UV-C dan perlakuan panas kering pada dosis yang tepat dapat mematikan cendawan model M. ulei pada biji dan bungkil kedelai tanpa merusak kandungan nutrisi biji dan bungkil kedelai.
Manfaat Penelitian
TINJAUAN PUSTAKA
Biologi dan Arti Penting Microcyclus ulei
Microcyclus ulei (P. Henn) v. Arx merupakan penyebab penyakit hawar daun hevea Amerika Selatan (South American Leaf Blight, SALB). Secara taksonomi, M. ulei termasuk ke dalam filum Ascomycota, kelas Ascomycetes, sub kelas Dothideomycetidae, ordo Mycosphaerellales, dan famili Mycosphaerellaceae (CABI 2007). Inang M. ulei terbatas pada genus Hevea, yaitu Hevea brasiliensis, H. spruceana, dan H. guianensis (CABI 2007; Hashim 2007).
Cendawan M. ulei lebih sering menyerang bagian tanaman karet yang masih muda, seperti daun, batang, bunga, dan buah karena bagian tanaman yang sudah tua bersifat lebih tahan. Gejala awal infeksi M. ulei pada daun muda ialah terjadinya distorsi bentuk pada daun, yaitu daun menjadi keriting dan layu. Selanjutnya, pada permukaan bawah daun akan terbentuk lesio dengan pola yang tidak beraturan, berwarna abu-abu kemudian menjadi kehitaman dan akhirnya menyebabkan daun gugur. Infeksi berat M. ulei pada tanaman karet dapat menyebabkan daun gugur, mati pucuk dan batang hingga kematian tanaman sepenuhnya (Hashim 2007).
Penyebab SALB ini menghasilkan 3 tipe spora, yaitu konidia dan pikniospora pada fase aseksual, serta askospora pada fase seksual. Bentuk konidia M. ulei sangat khas, terdiri dari dua sel dengan bentuk salah satu selnya agak terpilin. Pikniospora berbentuk seperti batang korek api dengan salah satu ujung lebih besar dibandingkan ujung lainnya. Askospora berbentuk elips, terdiri dari dua sel, bersepta, dan hialin (Gambar 1). Konidia dan askospora bertanggungjawab terhadap terjadinya infeksi dan penyebaran penyakit SALB sedangkan pikniospora tidak memiliki kemampuan tersebut (Hashim 2007).
Gambar 1 Spora M. ulei: (a) konidia, (b) pikniospora, (c) askospora (Sumber: Hashim 2007).
6
Secara alami, penyebaran konidia dan askospora M. ulei dalam suatu pertanaman atau dari satu area ke area lain terjadi dengan bantuan angin dan percikan air hujan. Hujan membantu penglepasan spora dan meningkatkan konsentrasi spora di udara, sedangkan angin berperan sebagai agens penyebaran jarak jauh. Daun-daun tanaman karet yang kering dan mengandung askopora M. ulei dapat terbawa angin dan menjadi sumber infeksi serta penyebaran SALB. Secara tidak sengaja, konidia dan askospora M. ulei dapat terbawa pada tubuh hewan, manusia, dan material lainnya saat terjadi kontak dengan tanaman terinfeksi atau mengunjungi kebun karet terinfeksi M. ulei (CABI 2007).
Askospora dan konidia M. ulei mampu bertahan hidup pada kondisi ekstrim dan dalam waktu yang cukup lama, baik pada komoditas pertanian maupun material lainnya. Konidia M. ulei yang diletakkan pada kaca objek dan disimpan dalam desikator selama 16 minggu masih mampu berkecambah, dan askospora yang disimpan dalam desikator juga masih mampu bertahan hidup selama 15 hari (Chee 1976). Selain itu, konidia M. ulei yang disimpan selama 7 hari pada kertas, kaca, plastik, kulit sintetis, pakaian, besi, dan tanah baik kering maupun basah masih mampu berkecambah sebesar 5.8-31.6% (Zhang et al. 1986 dalam
Hashim 2007).
7
1982. Selain menyebabkan kerugian secara ekonomi, penyakit SALB juga menyebabkan kerugian secara sosial karena banyaknya tenaga kerja yang kehilangan pekerjaan sehingga harus bermigrasi (CABI 2007).
Produksi Kedelai di Brazil
Brazil merupakan negara produsen kedelai terbesar di Amerika Selatan. Hasil produksi dan luas areal produksi kedelai di Brazil berkembang lebih pesat daripada di Amerika Serikat. Peningkatan luas areal produksi kedelai di Amerika Serikat pada tahun 1987 sampai 1989 hanya 125%, sementara di Brazil mencapai 141% pada tahun 2001 sampai 2003. Selain itu, peningkatan hasil produksi kedelai di Brazil mencapai 153%, sementara di Amerika Serikat hanya 124% (Flaskerud 2003).
Saat ini, Brazil memiliki luas areal produksi kedelai sekitar 16.3 juta ha dengan kemampuan produksi 42 juta ton per tahun. Hal tersebut menjadikan Brazil sebagai produsen kedelai terbesar kedua di dunia setelah Amerika Serikat yang memiliki luas areal produksi kedelai 29 juta ha dan kemampuan produksi 73 juta ton per tahun (Arsyad 2011).
Daerah produksi kedelai di Brazil terletak di Rio Grande do Sul, Santa Catarina, Sao Paulo dan Parana, kemudian berkembang ke wilayah lainnya di Mato Grosso, Mato Grosso do Sul, Minas Gerais (Flaskerud 2003). Sebagian besar wilayah tersebut juga merupakan daerah sebar penyakit SALB di Brazil, yaitu Sao Paulo, Parana, Mato Grosso, Mato Grosso do Sul, Minas Gerais (CABI 2007). Oleh karena itu, importasi kedelai dari Brazil berpeluang besar membawa
M. ulei sebagai kontaminan.
Kebutuhan Kedelai di Indonesia
Kedelai atau Glycine max (L.) Merr. termasuk ke dalam filum Spermatophyta, subfilum Angiospermae, kelas Dicotyledonae, ordo Fabales, famili Fabaceae, dan sub famili Papilionoideae (CABI 2007).
8
Kedelai dan produk olahannya dikenal sebagai makanan sehat karena memiliki kandungan protein yang tinggi. Selain itu, kedelai juga mengandung isoflavones yang berperan sebagai antioksidan dan bermanfaat bagi kesehatan manusia, antara lain untuk mencegah penyakit kanker, penyakit kardiovaskular, osteoporosis, dan mencegah gejala-gejala menopause (Stajner et al. 2007).
Pada tahun 2004, kebutuhan Indonesia akan kedelai sekitar 2.02 juta ton, sementara produksi dalam negeri baru mencapai 0.71 juta ton atau sekitar 35% dari kebutuhan total kedelai sehingga harus dilakukan impor kedelai sebesar 1.31 juta ton (Simatupang et al. 2005). Berita resmi statistik BPS (2010) menyatakan bahwa produksi kedelai Indonesia tahun 2010 (Angka Ramalan/ARAM III) diperkirakan sebesar 905.02 ribu ton biji kering, turun 69.50 ribu ton (7.13%) dibandingkan produksi tahun 2009. Penurunan produksi ini terjadi karena adanya penurunan luas panen sebesar 50.55 ribu hektar (6.99%) dan penurunan produktivitas sebesar 0.02 kuintal/hektar (0.15%). Penurunan luas panen kemungkinan berkaitan erat dengan banjirnya kedelai impor yang menyebabkan nilai kompetitif dan komparatif tanaman kedelai merosot, sedangkan penurunan produktivitas kemungkinan lebih disebabkan belum berkembangnya industri benih kedelai bermutu di Indonesia. Menurut Simatupang et al. (2005), pemakaian benih unggul bersertifikat pada tanaman kedelai masih kurang dari 10%.
Di Indonesia, konsumsi biji kedelai tertinggi adalah untuk bahan industri pangan, yaitu tahu dan tempe. Pada tahun 2002, konsumsi biji kedelai untuk bahan baku olahan tahu dan tempe mencapai 1.776 juta ton atau sekitar 88% dari total kebutuhan dalam negeri (BPS 2002 dalam Simatupang et al. 2005). Selain pangan, industri pakan ternak (unggas) juga merupakan kegiatan agribisnis hilir yang cukup penting dalam agribisnis kedelai. Dalam pembuatan pakan ternak, bungkil kedelai merupakan bahan terpenting kedua setelah jagung, yaitu sekitar 15-20% dari komposisi pakan (Simatupang et al. 2005).
9
karena ada kemungkinan penanganan bungkil sebagai komoditas ekspor di Brazil tidak sebaik pada biji sehingga bungkil rentan terhadap kontaminasi M. ulei.
Tabel 1 Pemasukan kedelai impor dari Brazil melalui UPT Badan Karantina Pertanian tahun 2010-2011
UPT tempat pemasukan Komoditas Jumlah (kg)
BBKP Belawan Kacang Kedelai 1 017 775
Bungkil Kedelai 43 010 030
BBKP Surabaya Bungkil Kedelai 311 156 694
BBKP Tanjung Priok Bungkil Kedelai 49 240
BKP Kelas II Cilegon Bungkil Kedelai 275 278 612
Sumber : e-Plaq Barantan (diunduh 6 Juni 2011).
Karakteristik Cendawan Model
Cendawan model yang dipilih adalah cendawan yang sudah ada di Indonesia, memiliki karakteristik bertahan pada kondisi ekstrim mirip M. ulei, dan diutamakan berasal dari kelas yang sama dengan M. ulei, yaitu Botryodiplodia theobromae, Colletotrichum gloeosporioides, dan Fusarium oxysporum f.sp.
niveum yang kelas stadia perfeknya sama, atau dari kelas lainnya seperti
Sclerotium rolfsii.
Botryosphaeria rhodina (Berk & Curt.) [teleomorf] syn. Lasiodiplodia theobromae (Pat.) Griffiths & Maubl. [anamorf] syn. Botryodiplodia theobromae
Pat. [anamorf] merupakan cendawan Ascomycetes yang terdapat di Brazil dan Indonesia. Karet merupakan salah satu inang utamanya dan kedelai sebagai inang minornya. Cendawan ini diketahui dapat berperan sebagai plurivorous wound, patogen sekunder, dan saprofit. Penyebarannya dapat terjadi melalui tanah (soilborne), benih (seedborne), udara (air-borne), atau serangga (insect transmitted). Infeksi biasanya terjadi saat ada luka pada jaringan inangnya. Konidiomata (piknidia) dihasilkan dengan miselium seperti benang halus, dan pertumbuhan optimum terjadi pada suhu 30 °C. Pada benih, patogen ini bertahan sebagai miselium dorman dan pada kondisi yang sesuai akan menghasilkan piknidia dan pikniospora yang berperan sebagai sumber inokulum utama (CABI 2007).
Glomerella cingulata (Stonem.) Spauld & Schrenk [teleomorf] syn.
10
inang utamanya dan kedelai sebagai inang minornya. Cendawan ini umumnya hidup sebagai saprofit dan opportunistic invader yang menyerang jaringan tanaman rusak atau mati. Pada jaringan tua, perkembangan cendawan ini lebih terbatas. seringkali berada dalam keadaan dorman (quiescent), dan tidak membahayakan. Namun, seiring dengan terjadinya perubahan fisiologis atau kerusakan pada jaringan inangnya akan memicu munculnya fase agresif dari cendawan ini. Apresoria dengan struktur dinding yang tebal memungkinkan cendawan ini tetap dorman pada permukaan tanaman hingga kondisi lingkungan mendukungnya untuk aktif kembali mengkoloni jaringan inangnya (CABI 2007).
Fusarium oxysporum f.sp. niveum (E.F. Sm.) Snyder & H.N. Hansen [anamorf] merupakan cendawan Ascomycetes yang terdapat di Amerika Selatan (Argentina dan Chile) dan Indonesia. Semangka merupakan inang tunggal dari cendawan ini. Klamidospora F. oxysporum f.sp. niveum masih dapat berkecambah dan menginfeksi perakaran semangka meskipun telah melewati saluran pencernaan ternak, termasuk unggas, atau berada pada sisa-sisa
tanaman atau kompos (CABI 2007). Agrios (2005) menyatakan bahwa
F. oxysporum mampu bertahan dalam tanah dalam waktu yang lama dalam bentuk klamidospora yang dihasilkan oleh miselium tua.
Sclerotium rolfsii Sacc. merupakan cendawan Deuteromycetes yang terdapat di Brazil dan Indonesia. Cendawan ini tidak menghasilkan konidia
sehingga digolongkan ke dalam mycelia sterilia. Sumber inokulum utama dari
S. rolfsii untuk menyerang berbagai inangnya (termasuk kedelai) adalah sklerotia berwarna coklat yang merupakan massa hifa yang memadat dan mengeras. Cendawan ini dipilih sebagai model karena memiliki sklerotia dengan kemampuan bertahan yang sangat tinggi pada kondisi yang tidak menguntungkan dan tanpa kehadiran tanaman inangnya. Viabilitas sklerotia di lahan masih tetap tinggi, yaitu berkisar 56-73% meskipun setelah masa inkubasi mencapai 8-10 bulan, sementara miselium mampu bertahan selama 6 bulan pada tanah kering. Sklerotia dari S. rolfsii juga dapat tetap hidup pada kelembaban tanah 80% dan pertumbuhannya optimum pada kelembaban 60-70% (CABI 2007).
Perlakuan Iradiasi UV-C
11
daripada sinar X. Sinar UV-C memiliki panjang gelombang yang paling pendek (200-280 nm) dibandingkan dengan UV-A (315-400 nm) maupun UV-B (280-315 nm) (Simon et al. 2011).
Iradiasi UV-C telah lama digunakan sebagai perlakuan untuk menghambat pertumbuhan atau mengeradikasi bakteri, cendawan, dan virus, karena pada dasarnya semua mikroorganisme rentan terhadap panjang gelombang 230-290 nm (Witham 2008). Namun, umumnya panjang gelombang 254-265 nm yang efektif memberikan pengaruh germisidal.
Sinar UV-C dan UV-B diketahui dapat menyebabkan kerusakan langsung pada asam nukleat dan protein sehingga mengakibatkan mutasi genetik atau kematian sel (Hockberger 2002), sedangkan sinar UVA atau NUV diketahui dapat membantu sporulasi beberapa cendawan, di antaranya Fusarium nivale
(Leach 1967).
Keefektifan perlakuan iradiasi UV-C sangat dipengaruhi oleh lamanya tingkat interaksi antara patogen dengan cahaya UV-C (waktu dan jarak papar UV-C) dan spesies patogen yang diberi perlakuan (Udi Putra et al. 2007; Begum
et al. 2009; Simon et al. 2011). Witham (2008) menyatakan bahwa cendawan lebih tahan dan lebih sulit mati dengan perlakuan UV-C sehingga diperlukan waktu papar yang lebih lama.
Menurut LebaiJuri (1997), perlakuan iradiasi UV-C selama 60 menit yang diberikan pada suspensi konidia M. ulei pada jarak 12 cm dari sumber cahaya UV-C mampu mematikan daya tumbuh konidia cendawan penyebab SALB hingga 100%. Waktu perlakuan tersebut adalah 15 menit lebih lama dibandingkan dengan waktu yang direkomendasikan untuk dekontaminasi bagasi dan barang tentengan penumpang pesawat yang datang dari Amerika Selatan.
Perlakuan iradiasi UV-C (254 nm) pada biakan Colletotrichum acutatum
selama 100 menit pada jarak 30 cm dari sumber cahaya UV-C juga diketahui 100% efektif mematikan spora C. acutatum (Fernando et al. 2000).
Marquenie et al. (2002) melaporkan bahwa Monilia fructigena lebih rentan terhadap sinar UV-C dibandingkan dengan Botrytis cinerea. Perlakuan iradiasi UV-C (254 nm) dengan variasi dosis 0.01-1.50 J/cm2 (setara dengan 4-600 detik) pada jarak 14 cm dari sumber cahaya UV-C terhadap spora M. fructigena dan
12
Menurut Begum et al. (2009), perlakuan iradiasi UV-C efektif menginaktifkan spora cendawan Aspergillus flavus, A. niger, Penicillium corylophilum dan Eurotium rubrum. Namun tingkat efikasinya berbeda, tergantung metode papar sinar UV-C dan genus cendawan yang diberi perlakuan. Perlakuan iradiasi UV-C selama 15 menit terhadap spora cendawan yang diletakkan pada permukaan media agar efektif mengurangi viabilitas spora hingga 80-99%, kecuali spora A. niger yang viabilitas hanya berkurang 62%. Namun, apabila spora A. niger dikeringkan pada membran filter dan diberi perlakuan iradiasi UV-C selama 180 detik maka penurunan viabilitas spora dapat mencapai 3.5 log10.
Perlakuan Panas Kering
Perlakuan panas kering diketahui dapat menghambat pertumbuhan atau mematikan cendawan patogen. Namun, hal ini tidak selalu terjadi pada setiap cendawan yang mendapat perlakuan pada waktu dan suhu yang sama karena setiap spesies cendawan memiliki sensitivitas yang berbeda terhadap panas (Narayanasamy 2006). Perbedaan sensitivitas cendawan patogen terhadap panas tidak selalu dipengaruhi oleh ukuran spora, bentuk, atau umur inokulum (Schirra et al. 2000), namun kemungkinan lebih dipengaruhi oleh struktur bertahan yang dimiliki oleh setiap cendawan.
Perlakuan panas kering pada suhu 55 °C selama 30 menit dinyatakan efektif mematikan konidia M. ulei (Hashim 2007).
Perlakuan panas kering pada suhu 65 °C selama 4-7 hari atau pada suhu 70 °C selama lebih dari 4 hari secara signifikan dapat mengurangi bahkan mengeradikasi Colletotrichum lupini yang menginfeksi biji lupin (Thomas & Adcock 2004).
Usmani dan Ghaffar (1986) melaporkan bahwa perlakuan panas kering pada suhu 55 °C selama 2 jam efektif mematikan sklerotia dari Sclerotium oryzae.
Tingkat bertahan hidup Fusarium roseum yang mendapat perlakuan panas kering pada suhu 50-75 °C akan semakin berkurang dengan adanya penambahan waktu perlakuan hingga tidak ada lagi yang bertahan hidup (Nakagawa & Yamaguchi 1989).
13
kerusakan pada mitokondria dan membran luar sel, serta terganggunya pembentukan vakuola dalam sitoplasma sel.
Penelitian Baker dan Smith (1969) menunjukkan bahwa Rhizopus stolonifer
yang mendapat perlakuan panas pada suhu 52 °C selama 2.5 menit mati karena mengalami gangguan pada nukleus, mitokondria, dan ribosom.
Pengaruh Suhu Tinggi terhadap Protein
Suhu tinggi dapat menyebabkan kerusakan protein atau lebih dikenal dengan istilah denaturasi protein. Perlakuan panas yang dapat menyebabkan denaturasi sebagian besar protein berkisar pada suhu 70-75 °C.
BAHAN DAN METODE
Waktu dan Tempat
Penelitian dilaksanakan pada bulan Nopember 2011 hingga Maret 2012 di Laboratorium Patologi dan Ruang Preparasi Balai Uji Terap Teknik dan Metoda Karantina Pertanian (BUTTMKP) Bekasi.
Bahan dan Alat
Komoditas uji yang digunakan adalah biji kedelai konsumsi asal Amerika Serikat dan bungkil kedelai asal Brazil.
Isolat murni cendawan Ascomycetes yang digunakan sebagai model bagi struktur konidia M. ulei adalah B. theobromae (isolasi dari jeruk, asal Garut,
koleksi Laboratorium Mikologi, Departemen Proteksi Tanaman IPB),
C. gloeosporioides (isolasi dari cabai, asal Bandung, koleksi Laboratorium Mikologi, Fakultas Pertanian Universitas Padjajaran), dan F. oxysporum f.sp.
niveum (isolasi dari semangka, asal Karawang, koleksi Laboratorium Mikologi,
Departemen Proteksi Tanaman IPB). Selain itu, sebagai model struktur bertahan
M. ulei pada kondisi ekstrem digunakan isolat murni cendawan S. rolfsii (isolasi dari sengon, asal Bandung, koleksi Laboratorium Mikologi, Fakultas Pertanian Universitas Padjajaran) yang membentuk sklerotia sebagai struktur yang sangat tahan terhadap kondisi ekstrim.
Alat yang digunakan untuk perlakuan panas kering adalah oven merk Memert yang telah dikalibrasi, sedangkan untuk perlakuan iradiasi UV-C digunakan chamber alumunium berukuran 118 cm x 59 cm x 48 cm dan sebuah lampu dengan spesifikasi UV-C yang memiliki daya 36 Watt.
Metode Penelitian
Pengujian pengaruh perlakuan iradiasi UV-C dan panas kering terhadap cendawan model M. ulei dilakukan pada media buatan Potato Dextrose Agar
(PDA), biji kedelai, dan bungkil kedelai.
Peremajaan Cendawan Model sebelum Perlakuan
16
yang dilakukan dengan memindahkan 1 sklerotia ke media PDA, kemudian diinkubasi selama 7 hari. Peremajaan cendawan model bertujuan mendapatkan umur biakan yang seragam saat diberi perlakuan.
Pengujian Pengaruh Perlakuan Iradiasi UV-C terhadap Pertumbuhan Koloni Cendawan Model
Pengujian dilakukan untuk mengetahui pengaruh perlakuan iradiasi UV-C terhadap pertumbuhan koloni cendawan model sekaligus memberikan gambaran waktu dan jarak papar perlakuan iradiasi UV-C yang efektif mematikan cendawan model. Pengujian ini menggunakan Rancangan Acak Lengkap (RAL) dengan 3 ulangan.
Perlakuan diberikan pada semua biakan cendawan model berumur 7 hari selama 0 menit (kontrol), 30, 60, 90, dan 120 menit pada jarak 40 cm dari lampu UV-C. Dalam perlakuan ini, penutup cawan petri diganti dengan pembungkus plastik (plastic film) untuk menghindari kontaminasi dan memaksimalkan penetrasi sinar UV-C pada cendawan model. Setelah diberi perlakuan, biakan cendawan model segera ditumbuhkan kembali pada media PDA dengan cara memindahkan potongan biakan (diameter 3 mm) dari 3 sisi (kanan, tengah, kiri) dan diinkubasi selama 3 hari pada suhu ruang. Sklerotia dari S. rolfsii yang menjadi inokulum awal saat peremajaan juga ikut ditumbuhkan kembali pada cawan petri yang sama dengan miseliumnya.
Peubah yang diamati adalah diameter koloni cendawan model. Penghambatan relatif perlakuan terhadap kontrol dihitung dengan rumus Abbott 1925 dalam Kaiser et al. 2005, yaitu :
PHR = dk-dp x 100% dk
PHR = penghambatan relatif perlakuan terhadap kontrol (%) dk = diameter koloni cendawan model tanpa perlakuan (kontrol) dp = diameter koloni cendawan model yang diberi perlakuan
17
dengan menambahkan waktu papar hingga 12 dan 24 jam pada jarak 15 cm dan 30 cm. Apabila pada waktu dan jarak tersebut masih belum mampu mematikan cendawan model, maka pengujian dihentikan.
Pengujian Pengaruh Perlakuan Panas Kering terhadap Pertumbuhan Koloni Cendawan Model
Pengujian dilakukan untuk mengetahui pengaruh perlakuan panas kering terhadap pertumbuhan koloni cendawan model sekaligus memberikan gambaran suhu dan waktu perlakuan yang efektif mematikan cendawan model. Pengujian menggunakan RAL faktorial 3 x 5 dengan 3 ulangan. Faktor pertama adalah waktu, yaitu 0 (kontrol), 30, dan 60 menit, sedangkan faktor kedua adalah suhu, yaitu 45, 50, 55, 60, dan 65 ºC.
Perlakuan diberikan pada semua biakan cendawan model berumur 7 hari. Biakan yang telah diberi perlakuan segera ditumbuhkan pada media PDA dengan cara dan tahapan yang sama pada perlakuan iradiasi UV-C. Pengamatan dilakukan terhadap pertumbuhan koloni cendawan model dengan peubah yang diamati adalah diameter koloni. Selanjutnya, penghambatan relatif perlakuan terhadap kontrol (PHR) dihitung dengan menggunakan rumus yang sama pada perlakuan iradiasi UV-C.
Analisis Data
Data hasil pengujian perlakuan iradiasi UV-C dan panas kering dianalisis dengan sidik ragam (Analysis of Variance, ANOVA) dan dilanjutkan dengan uji Tukey pada taraf nyata 1%. Hal ini dilakukan untuk memperoleh metode dan dosis perlakuan yang efektif mematikan cendawan model (PHR=100%). Analisis data dilakukan dengan menggunakan Program Minitab 16.
Pengujian Pengaruh Perlakuan Panas Kering terhadap Daya Tumbuh Cendawan Model pada Biji dan Bungkil Kedelai
18
Percobaan diawali dengan melakukan inokulasi buatan cendawan model pada biji dan bungkil kedelai yang akan diberi perlakuan maupun tanpa
perlakuan (kontrol). Inokulasi C. gloeosporioides, B. theobromae, dan
F. oxysporum f.sp. niveum dilakukan dengan cara menambahkan suspensi inokulum (konidia) ke dalam cawan petri yang berisi 80 biji kedelai atau 5 g bungkil kedelai. Inokulum yang ditambahkan pada biji adalah sebanyak 2 ml dengan kepadatan + 102 cfu/ml sedangkan pada bungkil adalah 4 ml dengan kepadatan + 103 cfu/ml. Sementara itu, inokulasi
S. rolfsii dilakukan dengan menambahkan 4 sklerotia berumur sekitar 3 minggu secara langsung pada biji atau bungkil kedelai.
Biji dan bungkil kedelai yang telah diinokulasi dan telah diberi perlakuan panas kering maupun tanpa perlakuan (kontrol) dicuci dengan 10 ml akuades steril, dan sebanyak 1 ml cairan hasil pencucian tersebut ditanam di media PDA kemudian diinkubasi selama 3-5 hari. Pencucian bungkil dilakukan dengan bantuan vortex pada kecepatan 2500 rpm selama 30 detik, sedangkan pencucian biji dilakukan dengan cara menggoyangkan cawan petri secukupnya. Hal ini dimaksudkan untuk membantu melepaskan konidia cendawan model dari biji dan bungkil kedelai. Pencucian tidak dilakukan terhadap biji dan bungkil yang diinokulasi sklerotia, tetapi sklerotia tersebut langsung dipindahkan ke media PDA dan diinkubasi selama 3-5 hari. Pengamatan dilakukan terhadap jumlah koloni cendawan model yang tumbuh pada media PDA.
Pengujian Pengaruh Perlakuan Panas Kering terhadap Kandungan Protein pada Biji dan Bungkil Kedelai
Analisis kandungan protein dilakukan terhadap biji dan bungkil kedelai yang diinokulasi C. gloeosporioides, baik yang diberi perlakuan maupun tanpa perlakuan (kontrol), tanpa dilakukan pencucian. Sebagai pembanding, analisis protein juga dilakukan pada biji dan bungkil tanpa inokulasi C. gloeosporioides
19
HASIL DAN PEMBAHASAN
Pertumbuhan Koloni Cendawan Model Hasil Peremajaan
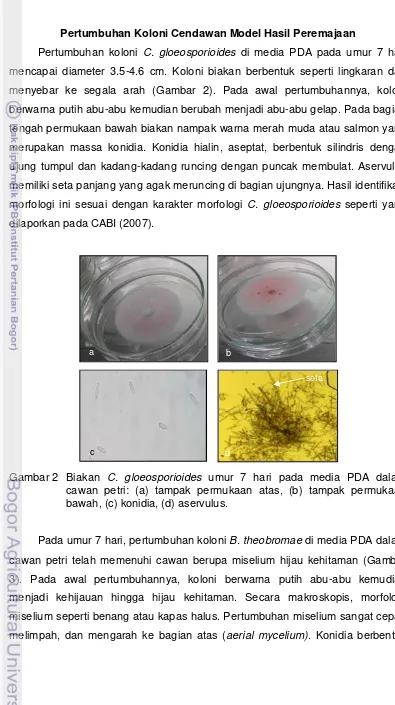
Pertumbuhan koloni C. gloeosporioides di media PDA pada umur 7 hari mencapai diameter 3.5-4.6 cm. Koloni biakan berbentuk seperti lingkaran dan menyebar ke segala arah (Gambar 2). Pada awal pertumbuhannya, koloni berwarna putih abu-abu kemudian berubah menjadi abu-abu gelap. Pada bagian tengah permukaan bawah biakan nampak warna merah muda atau salmon yang merupakan massa konidia. Konidia hialin, aseptat, berbentuk silindris dengan ujung tumpul dan kadang-kadang runcing dengan puncak membulat. Aservulus memiliki seta panjang yang agak meruncing di bagian ujungnya. Hasil identifikasi morfologi ini sesuai dengan karakter morfologi C. gloeosporioides seperti yang dilaporkan pada CABI (2007).
Gambar 2 Biakan C. gloeosporioides umur 7 hari pada media PDA dalam cawan petri: (a) tampak permukaan atas, (b) tampak permukaan bawah, (c) konidia, (d) aservulus.
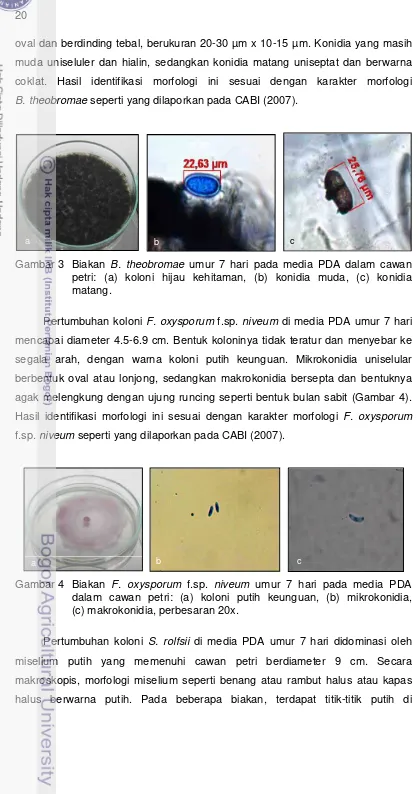
Pada umur 7 hari, pertumbuhan koloni B. theobromae di media PDA dalam cawan petri telah memenuhi cawan berupa miselium hijau kehitaman (Gambar 3). Pada awal pertumbuhannya, koloni berwarna putih abu-abu kemudian menjadi kehijauan hingga hijau kehitaman. Secara makroskopis, morfologi miselium seperti benang atau kapas halus. Pertumbuhan miselium sangat cepat, melimpah, dan mengarah ke bagian atas (aerial mycelium). Konidia berbentuk
a
c
b
d
20
oval dan berdinding tebal, berukuran 20-30 µm x 10-15 µm. Konidia yang masih muda uniseluler dan hialin, sedangkan konidia matang uniseptat dan berwarna
coklat. Hasil identifikasi morfologi ini sesuai dengan karakter morfologi
B. theobromae seperti yang dilaporkan pada CABI (2007).
Gambar 3 Biakan B. theobromae umur 7 hari pada media PDA dalam cawan petri: (a) koloni hijau kehitaman, (b) konidia muda, (c) konidia matang.
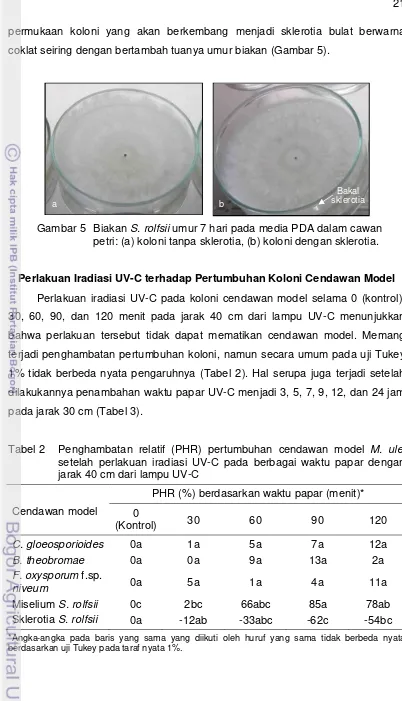
Pertumbuhan koloni F. oxysporum f.sp. niveum di media PDA umur 7 hari mencapai diameter 4.5-6.9 cm. Bentuk koloninya tidak teratur dan menyebar ke segala arah, dengan warna koloni putih keunguan. Mikrokonidia uniselular berbentuk oval atau lonjong, sedangkan makrokonidia bersepta dan bentuknya agak melengkung dengan ujung runcing seperti bentuk bulan sabit (Gambar 4). Hasil identifikasi morfologi ini sesuai dengan karakter morfologi F. oxysporum
f.sp. niveum seperti yang dilaporkan pada CABI (2007).
Gambar 4 Biakan F. oxysporum f.sp. niveum umur 7 hari pada media PDA dalam cawan petri: (a) koloni putih keunguan, (b) mikrokonidia, (c) makrokonidia, perbesaran 20x.
Pertumbuhan koloni S. rolfsii di media PDA umur 7 hari didominasi oleh miselium putih yang memenuhi cawan petri berdiameter 9 cm. Secara makroskopis, morfologi miselium seperti benang atau rambut halus atau kapas halus berwarna putih. Pada beberapa biakan, terdapat titik-titik putih di
a
a b
c
b
21
permukaan koloni yang akan berkembang menjadi sklerotia bulat berwarna coklat seiring dengan bertambah tuanya umur biakan (Gambar 5).
Gambar 5 Biakan S. rolfsii umur 7 hari pada media PDA dalam cawan petri: (a) koloni tanpa sklerotia,(b) koloni dengan sklerotia.
Perlakuan Iradiasi UV-C terhadap Pertumbuhan Koloni Cendawan Model
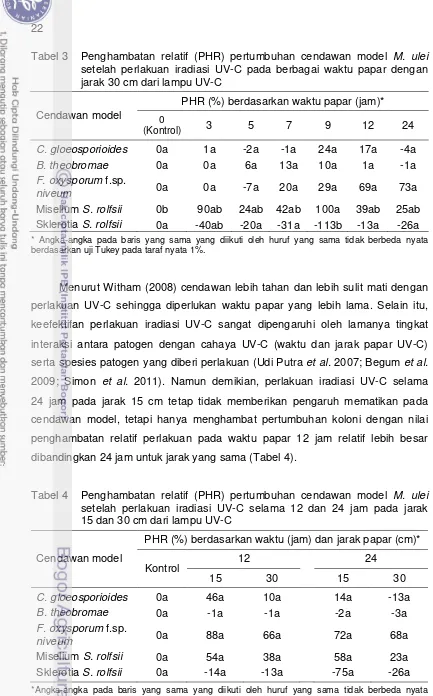
Perlakuan iradiasi UV-C pada koloni cendawan model selama 0 (kontrol), 30, 60, 90, dan 120 menit pada jarak 40 cm dari lampu UV-C menunjukkan bahwa perlakuan tersebut tidak dapat mematikan cendawan model. Memang terjadi penghambatan pertumbuhan koloni, namun secara umum pada uji Tukey 1% tidak berbeda nyata pengaruhnya (Tabel 2). Hal serupa juga terjadi setelah dilakukannya penambahan waktu papar UV-C menjadi 3, 5, 7, 9, 12, dan 24 jam pada jarak 30 cm (Tabel 3).
Tabel 2 Penghambatan relatif (PHR) pertumbuhan cendawan model M. ulei
setelah perlakuan iradiasi UV-C pada berbagai waktu papar dengan jarak 40 cm dari lampu UV-C
Cendawan model
PHR (%) berdasarkan waktu papar (menit)* 0
(Kontrol) 30 60 90 120
C. gloeosporioides 0a 1a 5a 7a 12a
B. theobromae 0a 0a 9a 13a 2a
F. oxysporum f.sp.
niveum 0a 5a 1a 4a 11a
Miselium S. rolfsii 0c 2bc 66abc 85a 78ab Sklerotia S. rolfsii 0a -12ab -33abc -62c -54bc
*Angka-angka pada baris yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji Tukey pada taraf nyata 1%.
a b
22
Tabel 3 Penghambatan relatif (PHR) pertumbuhan cendawan model M. ulei
setelah perlakuan iradiasi UV-C pada berbagai waktu papar dengan jarak 30 cm dari lampu UV-C
Cendawan model
PHR (%) berdasarkan waktu papar (jam)*
0 berdasarkan uji Tukey pada taraf nyata 1%.
Menurut Witham (2008) cendawan lebih tahan dan lebih sulit mati dengan perlakuan UV-C sehingga diperlukan waktu papar yang lebih lama. Selain itu, keefektifan perlakuan iradiasi UV-C sangat dipengaruhi oleh lamanya tingkat interaksi antara patogen dengan cahaya UV-C (waktu dan jarak papar UV-C) serta spesies patogen yang diberi perlakuan (Udi Putra et al. 2007; Begum et al.
2009; Simon et al. 2011). Namun demikian, perlakuan iradiasi UV-C selama 24 jam pada jarak 15 cm tetap tidak memberikan pengaruh mematikan pada cendawan model, tetapi hanya menghambat pertumbuhan koloni dengan nilai penghambatan relatif perlakuan pada waktu papar 12 jam relatif lebih besar dibandingkan 24 jam untuk jarak yang sama (Tabel 4).
Tabel 4 Penghambatan relatif (PHR) pertumbuhan cendawan model M. ulei
setelah perlakuan iradiasi UV-C selama 12 dan 24 jam pada jarak 15 dan 30 cm dari lampu UV-C
Cendawan model
PHR (%) berdasarkan waktu (jam) dan jarak papar (cm)*
23
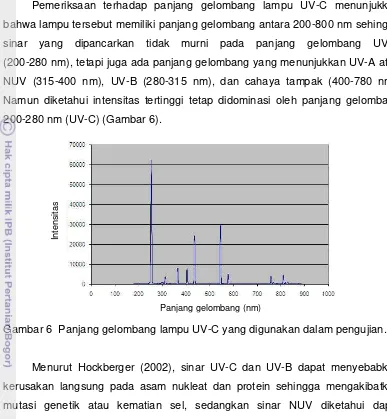
Pemeriksaan terhadap panjang gelombang lampu UV-C menunjukkan bahwa lampu tersebut memiliki panjang gelombang antara 200-800 nm sehingga
sinar yang dipancarkan tidak murni pada panjang gelombang UV-C (200-280 nm), tetapi juga ada panjang gelombang yang menunjukkan UV-A atau
NUV (315-400 nm), UV-B (280-315 nm), dan cahaya tampak (400-780 nm). Namun diketahui intensitas tertinggi tetap didominasi oleh panjang gelombang 200-280 nm (UV-C) (Gambar 6).
Gambar 6 Panjang gelombang lampu UV-C yang digunakan dalam pengujian.
Menurut Hockberger (2002), sinar UV-C dan UV-B dapat menyebabkan kerusakan langsung pada asam nukleat dan protein sehingga mengakibatkan mutasi genetik atau kematian sel, sedangkan sinar NUV diketahui dapat menstimulasi sporulasi beberapa cendawan, diantaranya F. nivale (Leach 1967). Oleh karena itu, ketidakefektifan perlakuan iradiasi UV-C dalam mematikan cendawan model dalam pengujian ini kemungkinan besar disebabkan oleh lampu UV-C yang tidak murni berada pada panjang gelombang UV-C dan mengandung panjang gelombang NUV, sehingga cendawan model tetap masih tumbuh.
Dugaan tersebut semakin diperkuat dengan hasil penelitian Fernando et al.
(2000) yang menunjukkan bahwa perlakuan UV-C (254 nm) selama 100 menit
pada jarak 30 cm dari sumber cahaya 100% efektif mematikan biakan
C. acutatum. Sementara itu, hasil uji perlakuan iradiasi UV-C pada
C. gloeosporioides selama 120 menit pada jarak 30 cm atau selama 3 jam pada jarak 30 cm tetap menunjukkan pertumbuhan koloni yang tidak berbeda nyata dengan perlakuan kontrol. Oleh karena itu, uji lanjut perlakuan iradiasi UV-C pada biji dan bungkil kedelai tidak dilakukan.
In
te
n
si
ta
s
24
Berbagai penelitian tentang pengujian perlakuan iradiasi UV-C terhadap cendawan menunjukkan bahwa perlakuan iradiasi UV-C efekif mematikan spora cendawan hanya dengan waktu papar yang relatif singkat dan jarak papar yang relatif pendek. Namun, pengujian tersebut umumnya dilakukan pada cendawan yang ditumbuhkan di media biakan (Fernando et al. 2000; Begum et al. 2009) atau secara langsung pada suspensi konidia cendawan seperti yang dilakukan oleh LebaiJuri (1997) terhadap M. ulei. Hal ini menunjukkan bahwa iradiasi UV-C efektif mematikan daya kecambah spora cendawan yang berada pada bagian permukaan. Oleh karena itu diketahui bahwa perlakuan iradiasi UV-C lebih sesuai digunakan sebagai perlakuan karantina untuk dekontaminasi bagasi atau barang tentengan penumpang pesawat di pelabuhan udara, dan bukan sebagai perlakuan karantina pada komoditas pertanian impor yang masuk dalam jumlah yang relatif besar, baik di pelabuhan laut (dalam kontainer) maupun pelabuhan udara (dalam kemasan kargo).
Pengujian perlakuan iradiasi UV-C dengan menggunakan lampu UV-C murni masih perlu dilakukan terutama pada komoditas biji dan bungkil kedelai dengan berbagai ketebalan (biji dan bungkil kedelai diuji dalam jumlah yang lebih besar) untuk mengetahui keefektifan perlakuan iradiasi UV-C dan daya tembus UV-C yang efektif mematikan cendawan model. Namun demikian, dalam setiap pengujian perlakuan iradiasi UV-C perlu diawali dengan pemeriksaan panjang gelombang lampu UV-C. Hal ini sangat penting untuk menjamin bahwa lampu yang sudah tertera sebagai UV-C hanya memiliki panjang gelombang UV-C.
Berdasarkan percobaan ini diketahui bahwa ada kemungkinan lampu yang tertera sebagai UV-C tidak murni UV-C. Oleh karena itu, perlu segera dilakukan verifikasi terhadap panjang gelombang lampu UV-C yang selama ini digunakan dalam perlakuan karantina untuk meningkatkan keefektifan perlakuan dalam mencegah masuknya M. ulei ke wilayah negara RI.
Perlakuan Panas Kering terhadap Pertumbuhan Koloni Cendawan Model
25
Tabel 5 Penghambatan relatif (PHR) pertumbuhan cendawan model M. ulei setelah perlakuan panas kering pada berbagai suhu selama 30 dan 60 menit
Cendawan model
PHR (%) berdasarkan suhu perlakuan (°C)*
Kontrol 30 menit 60 menit
45 50 55 60 65 45 50 55 60 65
C. gloeosporioides 0c 0c 100a 100a 100a 100a 12b 100a 100a 100a 100a
B .theobromae 0cd -2cd 6c 100a 100a 100a -6d 51b 100a 100a 100a
F. oxysporum f.sp. niveum 0c 15bc 22bc 38bc 100a 100a 15bc 13bc 42b 100a 100a
Miselium S. rolfsii 0b -2b 100a 100a 100a 100a -2b 100a 100a 100a 100a Sklerotia S. rolfsii 0b -4b 11b 100a 100a 100a -2b 100a 100a 100a 100a
*Angka-angka pada baris yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji Tukey pada taraf nyata 1%.
2
26
Berdasarkan analisis data PHR pertumbuhan cendawan model M. ulei
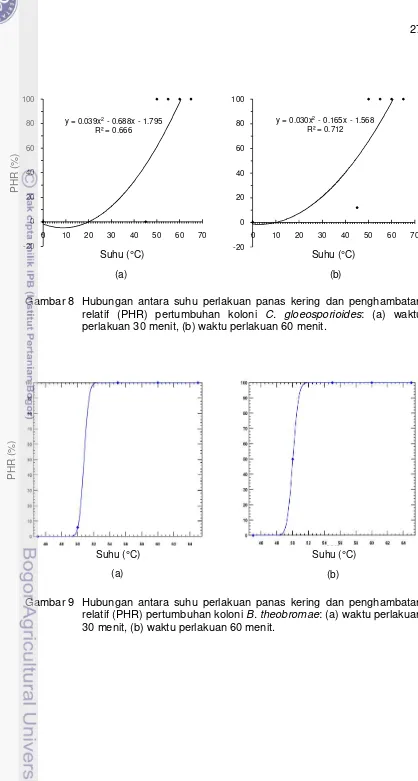
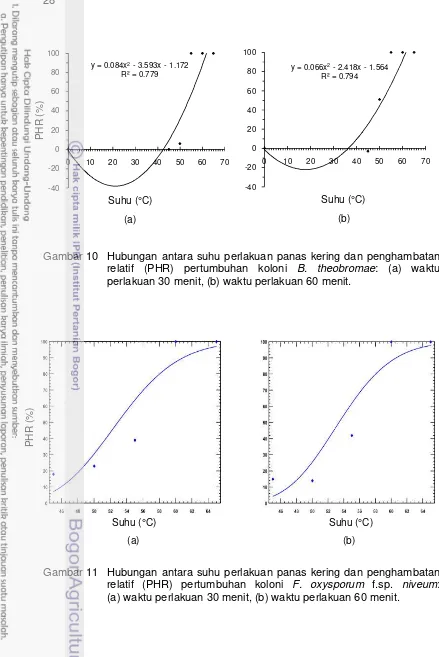
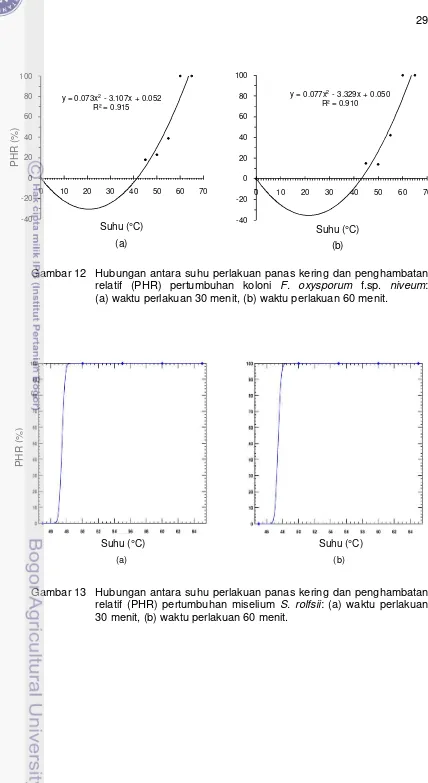
pada Tabel 5 dengan menggunakan Program PoloPlus Versi 1.0 diperoleh dosis efektif perlakuan yang dapat menghambat 99% pertumbuhan koloni (Lethal Dose
99, LD99), yaitu suhu 48.5 °C selama 30 menit dan 47 °C selama 60 menit untuk C. gloeosporioides (Gambar 7), suhu 52.5 °C selama 30 menit dan 51.5 °C selama 60 menit untuk B. theobromae (Gambar 9), suhu di atas 65 °C selama 30 dan 60 menit untuk F. oxysporum f.sp. niveum (Gambar 11), suhu 48.5 °C selama 30 dan 60 menit untuk miselium S. rolfsii (Gambar 13), serta suhu 52 °C selama 30 menit dan 48.5 °C selama 60 menit untuk sklerotia S. rolfsii (Gambar 15).
Sementara itu, hasil regresi data PHR pertumbuhan cendawan model
M. ulei pada Tabel 5 dengan menggunakan Program Minitab 16 diperoleh dosis efektif perlakuan yang dapat menghambat 100% pertumbuhan koloni atau
mematikan koloni, yaitu suhu 61 °C selama 30 dan 60 menit untuk
C. gloeosporioides (Gambar 8), suhu 62 °C selama 30 menit dan 61.5 °C selama 60 menit untuk B. theobromae (Gambar 10), suhu 64 °C selama 30 menit dan 63.5 °C selama 60 menit untuk F. oxysporum f.sp. niveum (Gambar 12), suhu 61 °C selama 30 dan 60 menit untuk miselium S. rolfsii (Gambar 14), serta suhu 62 °C selama 30 menit dan 61 °C selama 60 menit untuk sklerotia S. rolfsii
(Gambar 16).
Gambar 7 Hubungan antara suhu perlakuan panas kering dan penghambatan relatif (PHR) pertumbuhan koloni C. gloeosporioides: (a) waktu perlakuan 30 menit, (b) waktu perlakuan 60 menit.
Suhu (°C) Suhu (°C)
P
H
R
(%
)
27
Gambar 8 Hubungan antara suhu perlakuan panas kering dan penghambatan relatif (PHR) pertumbuhan koloni C. gloeosporioides: (a) waktu perlakuan 30 menit, (b) waktu perlakuan 60 menit.
Gambar 9 Hubungan antara suhu perlakuan panas kering dan penghambatan relatif (PHR) pertumbuhan koloni B. theobromae: (a) waktu perlakuan 30 menit, (b) waktu perlakuan 60 menit.
28
Gambar 10 Hubungan antara suhu perlakuan panas kering dan penghambatan relatif (PHR) pertumbuhan koloni B. theobromae: (a) waktu perlakuan 30 menit, (b) waktu perlakuan 60 menit.
Gambar 11 Hubungan antara suhu perlakuan panas kering dan penghambatan
relatif (PHR) pertumbuhan koloni F. oxysporum f.sp. niveum:
29
Gambar 12 Hubungan antara suhu perlakuan panas kering dan penghambatan relatif (PHR) pertumbuhan koloni F. oxysporum f.sp. niveum: (a) waktu perlakuan 30 menit, (b) waktu perlakuan 60 menit.
Gambar 13 Hubungan antara suhu perlakuan panas kering dan penghambatan relatif (PHR) pertumbuhan miselium S. rolfsii: (a) waktu perlakuan 30 menit, (b) waktu perlakuan 60 menit.
30
Gambar 14 Hubungan antara suhu perlakuan panas kering dan penghambatan relatif (PHR) pertumbuhan miselium S. rolfsii: (a) waktu perlakuan 30 menit, (b) waktu perlakuan 60 menit.
Gambar 15 Hubungan antara suhu perlakuan panas kering dan penghambatan relatif (PHR) pertumbuhan sklerotia S. rolfsii: (a) waktu perlakuan 30 menit, (b) waktu perlakuan 60 menit.
31
Gambar 16 Hubungan antara suhu perlakuan panas kering dan penghambatan relatif (PHR) pertumbuhan sklerotia S. rolfsii: (a) waktu perlakuan 30 menit, (b) waktu perlakuan 60 menit.
Secara umum, hasil analisis data menggunakan Program Polo Plus Versi 1.0 lebih sesuai dengan data aktual pengujian perlakuan panas kering karena LD99 terjadi pada suhu yang sedikit lebih rendah dibanding suhu aktual
pengujian, kecuali pada F. oxysporum f.sp. niveum yang menunjukkan LD99 pada
32
Tabel 6 Penghambatan relatif (PHR) pertumbuhan cendawan model M. ulei
dengan pengamatan aktual, analisis Polo Plus Versi 1.0, dan regresi
Cendawan
Perlakuan Panas Kering terhadap Daya Tumbuh Cendawan Model pada Biji dan Bungkil Kedelai
Hasil uji perlakuan panas kering terhadap biji dan bungkil kedelai menunjukkan bahwa suhu 55 °C selama 30 menit efektif mematikan konidia
33
Tabel 7 Jumlah koloni cendawan model M. ulei pada biji dan bungkil kedelai setelah perlakuan panas kering
Perlakuan Jumlah koloni yang terbentuk*
34
demikian, karena pengujian hanya dilakukan pada komoditas kedelai dalam jumlah kecil maka masih diperlukan lagi pengujian keefektifan perlakuan panas kering pada komoditas kedelai dalam jumlah yang lebih besar.
Perlakuan panas kering dapat menghambat pertumbuhan atau mematikan cendawan patogen, tetapi hal ini tidak selalu terjadi pada setiap cendawan yang mendapat perlakuan pada waktu dan suhu yang sama karena setiap spesies cendawan memiliki sensitivitas yang berbeda terhadap panas (Narayanasamy 2005). Perbedaan sensitivitas ini tidak selalu dipengaruhi oleh ukuran dan bentuk spora, ataupun umur inokulum (Schirra et al. 2000), namun kemungkinan lebih dipengaruhi oleh struktur tahan yang dimiliki oleh setiap cendawan.
Panas menyebabkan terjadinya perubahan dalam inti sel dan dinding sel serta kerusakan mitokondria sehingga menghambat pertumbuhan atau mematikan cendawan model (Barkai-Golan & Phillips 1991). Penelitian sebelumnya oleh Baker dan Smith (1969) telah menunjukkan bahwa Rhizopus stolonifer mati karena adanya gangguan pada nukleus, mitokondria, dan ribosom setelah mendapat perlakuan panas pada suhu 52 °C selama 2.5 menit.
Perlakuan Panas Kering terhadap Kandungan Protein Total pada Biji dan Bungkil Kedelai
Hasil analisis kandungan protein menunjukkan bahwa perlakuan panas kering pada suhu 55 dan 60 ºC relatif tidak mempengaruhi kandungan protein total pada biji dan bungkil kedelai (Gambar 17).
Gambar 17 Pengaruh perlakuan panas kering dan inokulasi C. gloeosporioides