ISOLASI DAN IDENTIFIKASI SENYAWA SAPOGENIN DARI TERIPANG Holothuria sp.
SKRIPSI
Oleh:
ENNI PURWANTI 040804061
FAKULTAS FARMASI
2008
ISOLASI DAN IDENTIFIKASI SENYAWA SAPOGENIN DARI
TERIPANG Holothuria sp.
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk mencapai gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
DIAJUKAN OLEH : ENNI PURWANTI
040804061
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
PENGESAHAN SKRIPSI
ISOLASI DAN IDENTIFIKASI SENYAWA SAPOGENIN DARI
TERIPANG Holothuria sp.
Diajukan Oleh :
ENNI PURWANTI 040804061
Dipertahankan dihadapan Panitia Penguji Skripsi Fakultas Farmasi
(Dra. Aswita Hafni Lubis, M.Si., Apt.) NIP: 131 270 667
KATA PENGANTAR
Assalamu’alaikum Wr. Wb.
Bismillahirrahmaaanirrahim. Segala puji dan syukur penulis ucapkan
kehadirat Allah SWT karena atas rahmat, hidayah, karunia dan ridha-Nya, yang
memberikan kekuatan dan kesempatan kepada penulis, serta salawat beriring
salam untuk Nabi besar Muhammad SAW sehingga penulis dapat menyelesaikan
penelitian dan penulisan skripsi ini.
Penulis mengucapkan terima kasih dan penghargaan khusus tak terhingga
kepada orang tua tercinta dan adik-adik yang tersayang, atas doa, perhatian,
nasehat, dorongan semangat dan segala kasih sayangnya kepada penulis sehingga
penulis dapat tetap berdiri dengan tegar dalam meraih cita-cita.
Penulis menyadari bahwa skripsi ini tidak akan terwujud tanpa adanya
bantuan dari berbagai pihak, untuk itu dengan segala kerendahan dan ketulusan
hati penulis menyampaikan terimakasih yang sebesar-besarnya kepada:
1. Bapak Prof. Dr. Sumadio Hadisahputra, Apt. sebagai Dekan Fakultas Farmasi,
Ibu Dra. Siti Aman, M.Si., Apt. sebagai penasehat akademik penulis, beserta
seluruh staf pengajar Fakultas Farmasi USU Medan yang telah mendidik
penulis selama perkuliahan.
2. Ibu Dra. Suwarti Aris, M. Si., Apt. dan Ibu Dra. Aswita Hafni Lubis, M. Si.,
Apt. atas waktu, bimbingan dan kesabaran serta tanggung jawab kepada
3. Drs. M. Pandapotan Nst, MPS., Apt. , Ibu Dra. Misrah Gaffar, M.S., Apt. dan
Bapak Drs. Suryadi Achmad, M.Sc., Apt., selaku dosen penguji yang telah
memberikan kritik, saran dan arahan kepada penulis dalam menyelesaikan
skripsi ini.
4. Bapak Drs. Panal Sitorus, M.Si., Apt. sebagai kepala Laboratorium
Farmakognosi beserta staf yang telah memberikan bantuan, petunjuk, saran
dan fasilitas kepada penulis selama melaksanakan penelitian.
5. Ayahanda Alm. Darlis Darwis, S.Pd dan Ibunda Hartini M. , serta acik,
paklek, nenek, Mas Eko, dan adik-adikku Ulfa dan Berry atas segala doa,
kasih sayang, dorongan semangat dan segala pengorbanan baik moril maupun
materil kepada penulis selama ini.
6. Para senior yang baik teruntuk Kak Merlyn, Kak Dani, Mbak Ayu, dan Kak
Ipeh yang telah membantu dan mencari solusi kepada penulis disaat
mengalami benturan dalam menjalani penelitian.
7. Rekan-rekan Farmasi 2004 Fina, Nia, Ratih, Lela, Ocha, Lily, Katarin dan
seluruh rekan Farmasi senasib seperjuangan yang tidak dapat disebutkan
satu-persatu, terima kasih atas kebersamaannya selama ini, dan semua dukungan
semangat serta pengorbanan baik moril maupun material dalam
menyelesaikan skripsi ini.
8. Teman-temanku Willy Suwardi, Lyla, Ica, Kak Sisma, Kak Vie, Kak Pita,
Kak Ledy, Kak Rahma, Arhien, Sandy, Tina, Linda, Maria, Diana yang telah
memberikan bantuan, dorongan dan semangat kepada penulis serta ketulusan
Penulis menyadari sepenuhnya bahwa skripsi ini masih belum sempurna,
sehingga penulis mengharapkan kritik dan saran yang bersifat membangun demi
kesempurnaan srikpsi ini. Penulis berharap semoga skripsi ini dapat menjadi
sumbangan yang bermanfaat bagi ilmu pengetahuan khususnya dibidang farmasi.
Akhirnya penulis memohon maaf atas segala keterbatasan dan
kekurangan penulis dalam penulisan skripsi ini. Wassalamua’laikum Wr. Wb.
Medan, Januari 2009
Penulis,
ABSTRAK
Telah dilakukan uji pendahuluan terhadap senyawa kimia golongan
saponin, steroid/triterpenoid, ekstraksi, isolasi, serta identifikasi senyawa sapoge
nin hasil isolasi dari teripang Holothuria sp.
Sampel teripang diekstraksi dengan cara maserasi menggunakan pelarut
etanol 95%, kemudian dihidrolisis dengan asam klorida 2 N, selanjutnya disari
dengan kloroform. Kemudian dilanjutkan dengan isolasi senyawa sapogenin
secara kromatografi lapis tipis preparatif. Terhadap isolat dilakukan uji kemurnian
dengan kromatografi lapis tipis dan kromatografi lapis tipis dua arah. Isolat yang
diperoleh diidentifikasi dengan spektrofotometri ultraviolet (UV), spektrofoto
metri inframerah (IR), spektrometri massa (MS).
Hasil uji pendahuluan senyawa kimia menunjukkan adanya senyawa
saponin dan steroid/triterpenoid. Dari hasil isolasi diperoleh 2 isolat, yaitu isolat I
(Rf = 0,47), isolat II (Rf = 0,72). Hasil identifikasi isolat II secara
spektrofotometri ultraviolet memberikan absorbansi maksimum pada panjang
gelombang (λ) 229 nm. Hasil identifikasi isolat II secara spektrofotometri
inframerah menunjukkan adanya gugus -OH, C-H alifatis, C-O, C=C, C-Br. Hasil
karakterisasi spektrometri massa mempunyai berat molekul (BM) 448, dan diduga
ABSTRACT
A preliminary test to saponin, steroid/triterpenoid chemical compound,
extraction, isolation, and characteritation of sapogenin compound isolated from
sea cucumber Holothuria sp.
The sea cucumber sample was extracted by maceration method using
ethanol 95% as solvent, then it was hydrolyzed by hydrochloric acid 2 N and
extracted with chloroform. After that, isolation of sapogenin was done using
preparative thin layer chromatography. To the isolate, purity test was done using
thin layer chromatography and two dimentional thin layer chromatography. The
isolate obtained then identified using UV spectrophotometry, IR
spectrophotometry, and mass spectrometry.
The result of chemical compound preface test shows that there is saponin
and steroid/triterpenoid. From isolation result, two isolates was obtained, which
are isolate I (Rf = 0,47), isolate II (Rf = 0,72). The characteritation result of
isolate II using UV spectrophotometry shows maximum absorbance at wavelength
229 nm. The characteritation result of isolate II using IR spectrophotometry shows
the existence of –OH, alyphatic C-H, C-O, C=C, C-Br functionalities. The
characteritation result using mass spectrometry shows the molecular mass of 448,
2.3 Uraian Kimia ... 6
2.3.1 Triterpenoid/steroid ... 6
2.4 Ekstraksi ... 7
2.5 Kromatografi ... 9
2.5.1 Kromatografi Lapis Tipis ... 10
2.5.2 Kromatografi Lapis Tipis Preparatif ... 11
2.6 Spektrofotometri Ultraviolet ... 12
3.3 Pengumpulan dan Pengolahan Sampel ... 18
3.3.1 Pengumpulan Sampel ... 18
3.4.5 Larutan Liebermann-Burchard (LB) ... 19
3.5 Pemeriksaan Karakteristik Simplisia………. 19
3.5.2 Penetapan Kadar Air ... 20
3.6 Pemeriksaan Senyawa Saponin ... 21
3.6.1 Uji Busa ... 21
3.6.2 Uji Hemolisis Darah ... 21
3.7 Pemeriksaan Senyawa Steroid/Triterpenoid... 21
3.7.1 Reaksi Warna dengan Pereaksi Liebermann Burchard (LB) ... 21
3.8 PembuatanEkstrak ... 22
3.9 Analisis Ekstrak Etanol dengan Cara KLT ... 22
3.10 Isolasi Senyawa Sapogenin dari Ekstrak Etanol ... 23
3.11 Analisis Ekstrak Kloroform dengan Cara KLT ... 23
3.12 Isolasi Senyawa Sapogenin dengan KLT Preparatif ... 24
3.13 Uji Kemurnian Isolat dengan KLT... 25
3.14 Uji Kemurnian Isolat dengan KLT Dua Arah ... 25
3.15 Identifikasi Isolat ... 26
3.15.1 Identifikasi Isolat dengan Spektrofotometer Ultraviolet ... 26
3.15.2 Identifikasi Isolat dengan Spektrofotometer Inframerah ... 26
3.15.3 Karakterisasi Isolat dengan Spektrometer massa... 27
DAFTAR GAMBAR
Gambar Halaman
1 Teripang segar Holothuria sp...22
2. Simplisia teripang Holothuria sp ... 23
3. Bagan ekstraksi senyawa sapogenin dari teripang ... 24
4. Bagan isolasi senyawa sapogenin dari ekstrak kloroform ... 25
5. Kromatogram KLT ekstrak etanol ... 26
6. Kromatogram KLT ekstrak kloroform ... 27
7. Kromatogram KLT ekstrak kloroform ... 28
8. Kromatogram ekstrak kloroform secara KLT preparatif ... 29
9. Kromatogram hasil KLT uji kemurnian isolat ... 30
10.Kromatogram KLT dua arah dari isolat…...………...………31
11. Spektrum ultraviolet dari isolat……….………...32
12. Spektrum inframerah dari isolat……….………..33
13. Spektrum massa dari isolat………...………34
DAFTAR LAMPIRAN
Lampiran Halaman
1. Hasil identifikasi teripang dari Pusat Penelitian Oseanografi ...21
2. Gambar teripang segar Holothuria sp ... 22
3. Gambar simplisia teripang Holothuria sp ... 23
4. Bagan ekstraksi senyawa sapogenin dari teripang ... 24
5 Bagan isolasi senyawa sapogenin dari ekstrak kloroform ... 25
6. Gambar kromatogram KLT ekstrak etanol ... 26
7. Gambar kromatogram KLT ekstrak kloroform ... 27
8. Gambar kromatogram ekstrak kloroform secara KLT preparatif ... 29
9. Gambar kromatogram hasil KLT uji kemurnian isolat ... 30
10.Gambar kromatogram KLT dua arah dari isolat ... 31
11.Gambar spektrum ultraviolet dari isolat ... 32
12.Gambar spektrum inframerah dari isolat ... 33
13.Gambar spektrum massa dari isolat ... 34
14.Gambar spektrum massa dari pembanding ... 35
ABSTRAK
Telah dilakukan uji pendahuluan terhadap senyawa kimia golongan
saponin, steroid/triterpenoid, ekstraksi, isolasi, serta identifikasi senyawa sapoge
nin hasil isolasi dari teripang Holothuria sp.
Sampel teripang diekstraksi dengan cara maserasi menggunakan pelarut
etanol 95%, kemudian dihidrolisis dengan asam klorida 2 N, selanjutnya disari
dengan kloroform. Kemudian dilanjutkan dengan isolasi senyawa sapogenin
secara kromatografi lapis tipis preparatif. Terhadap isolat dilakukan uji kemurnian
dengan kromatografi lapis tipis dan kromatografi lapis tipis dua arah. Isolat yang
diperoleh diidentifikasi dengan spektrofotometri ultraviolet (UV), spektrofoto
metri inframerah (IR), spektrometri massa (MS).
Hasil uji pendahuluan senyawa kimia menunjukkan adanya senyawa
saponin dan steroid/triterpenoid. Dari hasil isolasi diperoleh 2 isolat, yaitu isolat I
(Rf = 0,47), isolat II (Rf = 0,72). Hasil identifikasi isolat II secara
spektrofotometri ultraviolet memberikan absorbansi maksimum pada panjang
gelombang (λ) 229 nm. Hasil identifikasi isolat II secara spektrofotometri
inframerah menunjukkan adanya gugus -OH, C-H alifatis, C-O, C=C, C-Br. Hasil
karakterisasi spektrometri massa mempunyai berat molekul (BM) 448, dan diduga
ABSTRACT
A preliminary test to saponin, steroid/triterpenoid chemical compound,
extraction, isolation, and characteritation of sapogenin compound isolated from
sea cucumber Holothuria sp.
The sea cucumber sample was extracted by maceration method using
ethanol 95% as solvent, then it was hydrolyzed by hydrochloric acid 2 N and
extracted with chloroform. After that, isolation of sapogenin was done using
preparative thin layer chromatography. To the isolate, purity test was done using
thin layer chromatography and two dimentional thin layer chromatography. The
isolate obtained then identified using UV spectrophotometry, IR
spectrophotometry, and mass spectrometry.
The result of chemical compound preface test shows that there is saponin
and steroid/triterpenoid. From isolation result, two isolates was obtained, which
are isolate I (Rf = 0,47), isolate II (Rf = 0,72). The characteritation result of
isolate II using UV spectrophotometry shows maximum absorbance at wavelength
229 nm. The characteritation result of isolate II using IR spectrophotometry shows
the existence of –OH, alyphatic C-H, C-O, C=C, C-Br functionalities. The
characteritation result using mass spectrometry shows the molecular mass of 448,
BAB I PENDAHULUAN
I. I Latar Belakang
Perairan pantai Indonesia kondisi alam dan iklimnya hampir tidak banyak
mengalami perubahan sepanjang tahun, sehingga memungkinkan banyak jenis
biota yang hidup di perairan pantai. Salah satu jenis biota ekonomis penting
tersebut adalah teripang (Martoyo dkk, 2006).
Teripang adalah kelompok hewan invertebrata laut berkulit duri (halus)
bertubuh lunak dan silindris memanjang seperti mentimun. Hewan ini hidup
sampai pada kedalaman lebih dari 30 m. Teripang termasuk kelas holothuroidea
(Filum Echinodermata) (Anonim, 2008).
Jenis biota ini dikenal juga dengan sebutan ketimun laut, suala, sea
cucumber (Inggris), trepang, gamat (Malaysia), haysom (Hongkong), attai (India),
seegueke (Jerman), beche de-mer (Perancis), namako (Jepang), pling khao
(Thailand) atau dalam istilah pasaran internasional dikenal dengan sebutan teat
fish. Komoditi perikanan ini mempunyai prospek yang cukup baik dan bernilai
ekonomis tinggi, baik di pasar lokal maupun internasional. Untuk konsumsi pasar
internasional, biasanya teripang diperdagangkan dalam bentuk daging dan kulit
kering (Martoyo dkk, 2006).
Teripang bernilai ekonomis tinggi, karena kandungan atau kadar
kering berupa protein (82%), lemak (1,7%), kadar abu (8,6%), kadar air (8,9%),
karbohidrat (4,8%), vitamin A, vitamin B1, B2, B3. Kandungan lemaknya
mengandung asam lemak tidak jenuh yang sangat diperlukan bagi kesehatan
jantung (Anonim, 2008).
Teripang mempunyai khasiat pengobatan untuk bermacam-macam
penyakit antara lain sebagai obat luka ringan, sakit sendi, paru-paru, tekanan
darah tinggi, diabetes melitus, kolesterol (Anonim, 2008).
Berdasarkan hal tersebut di atas, peneliti melakukan isolasi senyawa
sapogenin yang terdapat pada teripang Holothuria sp. dengan cara maserasi dan
kromatografi lapis tipis (KLT) terhadap simplisia teripang yang berasal dari
perairan Sabang, Aceh, serta identifikasi senyawa sapogenin hasil isolasi dari
simplisia teripang secara spektrofotometri ultraviolet (UV), spektrofotometri
1. 2 Perumusan Masalah
1. Apakah teripang Holothuria sp. mengandung senyawa sapogenin?
2. Apakah senyawa sapogenin dapat diisolasi dengan cara KLT dan isolat
yang diperoleh dapat diidentifikasi dengan spektrofotometri ultraviolet
(UV), spektrofotometri inframerah (IR), spektrometri massa (MS)?
1.3Hipotesis
1. Diduga teripang Holothuria sp. mengandung senyawa sapogenin.
2. Senyawa sapogenin dapat diisolasi dengan cara KLT dan dapat
diidentifikasi dengan spektrofotometri ultraviolet (UV), spektrofotometri
inframerah (IR), spektrometri massa (MS).
1. 4 Tujuan Penelitian
1. Untuk mengetahui senyawa sapogenin yang terdapat dalam teripang
Holothuria sp.
2. Untuk mengetahui cara mengisolasi senyawa sapogenin yang terdapat
dalam teripang Holothuria sp. dan cara mengidentifikasi isolatnya dengan
spektrofotometri ultraviolet (UV), spektrofotometri inframerah (IR),
BAB II
TINJAUAN PUSTAKA
2.1Uraian Hewan
2.1.1 Sistematika Hewan
Sistematika dari hewan teripang (Martoyo dkk, 2006) adalah sebagai berikut:
Filum : Echinodermata
Sub-filum : Echinozoa
Kelas : Holothuroidea
Sub-kelas : Aspidochirotacea
Ordo (bangsa) : Aspidochirotida
Famili (suku) : Holothuriidae
Genus (marga) :
1. Holothuria
2. Actynopyga
3. Stichopus
Teripang merupakan salah satu anggota hewan berkulit duri
(Echinodermata). Namun, tidak semua jenis teripang mempunyai duri pada
Filum Echinodermata terbagi menjadi lima kelas yaitu Holothuroidea
(timun laut atau teripang), Asteroidea (bintang laut), Echinoidea (bulu babi),
Ophiuroidea (bintang laut ular), Crinoidea (Anonim, 2008).
Teripang bertubuh lunak, berdaging dan berbentuk silindris memanjang
seperti buah ketimun. Oleh karena itu, hewan ini dinamakan ketimun laut.
Gerakan teripang sangat lambat sehingga hampir seluruh hidupnya berada di dasar
laut. Warna tubuh teripang bermacam-macam, mulai dari hitam, abu-abu,
kecokelat-cokelatan, kemerah-merahan, kekuning-kuningan, sampai putih
(Martoyo dkk, 2006).
Tidak semua jenis teripang yang ditemukan di perairan Indonesia
mempunyai nilai ekonomis penting. Jenis teripang yang dapat dimakan dan
mempunyai nilai ekonomis penting terbatas pada famili Holothuriidae genus
Holothuria, Actynopyga, dan Stichopus (Martoyo dkk, 2006).
2.2Kandungan Tubuh Teripang
Teripang mempunyai nilai ekonomis penting karena kandungan atau
kadar nutrisinya yang tinggi. Dari hasil penelitian, kandungan nutrisi teripang
dalam kondisi kering terdiri dari protein sebanyak 82%, lemak 1,7%, kadar air
8,9%, kadar abu 8,6%, dan karbohidrat 4,8% (Martoyo dkk, 2006).
Kandungan kimia teripang dalam keadaan basah yaitu 44 - 45% protein,
2.3 Uraian Kimia
2.3.1 Triterpenoid dan Steroid
Triterpenoid adalah senyawa yang kerangka karbonnya berasal dari enam
satuan isopren dan secara biosintesis diturunkan dari hidrokarbon C-30 asiklik
yaitu skualena. Triterpenoid dapat dibagi atas empat golongan yaitu triterpenoid
sebenarnya, steroid, saponin dan glikosida jantung (Harbone, 1987).
a. Triterpen sebenarnya b. Steroid
Steroid adalah triterpen yang kerangka dasarnya cincin siklopentana
perhidrofenantren (Harbone, 1987). Inti steroid dasar sama dengan inti lanosterol
dan triterpenoid tetrasiklik lain. Istilah “sterol” dipakai khusus untuk steroid
alkohol. Sterol biasanya mempunyai gugus hidroksil pada atom C-3 dan suatu
ikatan rangkap pada posisi 5 dan 6.
Kerangka dasar dan sistem penomoran steroid (Robinson, 1995) dapat
dilihat pada gambar berikut ini:
c. Saponin
Saponin mula-mula diberi nama demikian karena sifatnya yang khas
Saponin adalah glikosida yang aglikonnya disebut sapogenin.
Keberadaan saponin sangat mudah ditandai dengan pembentukan larutan koloidal
dengan air yang apabila dikocok menimbulkan buih yang stabil. Saponin juga
bersifat menghancurkan butir darah merah lewat reaksi hemolisis (Farnsworth,
1966; Gunawan dan Mulyani, 2004).
Berdasarkan struktur dari aglikonnya, saponin dapat dibedakan menjadi
dua macam, yaitu saponin steroid dan saponin triterpenoid. Saponin steroid
mudah larut dalam air dan alkohol, tetapi tidak larut dalam eter. Saponin steroid
tersusun dari suatu aglikon steroid (sapogenin) yang terikat pada suatu
oligosakarida yang biasanya heksosa dan pentosa (Farnsworth, 1966). Sebaliknya,
hasil hidrolisisnya, yaitu sapogenin steroid mudah larut dalam pelarut organik
(seperti kloroform, eter, n-heksan) dan tidak larut dalam air (Trease and Evans,
1983).
d. Glikosida Jantung
2.4 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut tertentu. Proses
ekstraksi akan menghasilkan ekstrak. Ekstrak adalah sediaan kental yang
diperoleh dengan mengekstraksi senyawa aktif dari simplisia menggunakan
pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan
Beberapa metode ekstraksi dengan menggunakan pelarut (Depkes, 2000) yaitu :
A. Cara dingin
1. Maserasi
Maserasi adalah proses penyarian simplisia yang mengandung zat aktif
yang mudah larut dalam cairan penyari.dengan perendaman dan beberapa
kali pengocokan atau pengadukan pada temperatur kamar (kamar).
Remaserasi berarti proses maserasi yang dilanjutkan dengan pengulangan
penambahan pelarut setelah dilakukan penyaringan maserat pertama, dan
seterusnya.
2. Perkolasi
Perkolasi adalah ekstraksi yang dilakukan dengan mengalirkan pelarut
yang selalu baru hingga terjadi penyarian sempurna yang umumnya
dilakukan pada temperatur kamar. Proses terdiri dari tahapan
pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya
(penetesan/penampungan ekstrak) terus menerus sampai diperoleh ekstrak
(perkolat).
B. Cara panas
(1) Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya,
selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan
(2) Soksletasi
Soksletasi adalah ekstraksi menggunakan pelarut yang selalu baru,
dilakukan menggunakan alat soxhlet sehingga terjadi ekstraksi kontinu
dengan jumlah pelarut relatif konstan dengan adanya pendingin balik.
(3) Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada
temperatur yang lebih tinggi dari temperatur kamar, yaitu secara umum
dilakukan pada temperatur 40-50oC.
(4) Infundasi
Infundasi adalah ekstraksi dengan pelarut air pada temperatur 90oC selama
15 menit.
(5) Dekok
Dekok adalah ekstraksi dengan pelarut air pada temperatur 90o
1. Fase gerak zat cair-fase diam padat (kromatografi serapan) meliputi:
kromatografi lapis tipis dan kromatografi penukar ion
C semala 30
menit.
2.5 Kromatografi
Kromatografi didefinisikan sebagai teknik pemisahan campuran dua atau
lebih senyawa yang berbeda yang terdistribusi antara dua fase, yaitu fase diam dan
fase gerak. Cara-cara kromatografi dapat dikelompokkan berdasarkan fase gerak
dan fase diam yang digunakan (Sastrohamidjojo, 1985) yaitu:
3. Fase gerak cair-fase diam cair (kromatografi partisi) : kromatografi
kertas
4. Fase gerak gas-fase diam cair meliputi: kromatografi gas cair dan
kromatografi kolom kapiler
2.5.1 Kromatografi Lapis Tipis
Kromatografi lapis tipis (KLT) merupakan kromatografi serapan dimana
adsorben (penyerap) bertindak sebagai fase diam (berupa zat padat) dan fasa gerak
berupa zat cair yang disebut larutan pengembang (Gritter. dkk, 1991).
Fasa diam (penjerap) dapat dibagi dua, yaitu penjerap polar dan penjerap
non polar. Campuran yang akan dipisahkan berupa larutan ditotolkan berupa
noda atau isolat. Setelah plat diletakkan di dalam bejana tertutup rapat yang berisi
larutan pengembang yang cocok (fasa gerak), pemisahan terjadi selama
pengembangan. Fasa gerak merupakan medium angkut dan terdiri atas satu atau
beberapa pelarut yang bergerak di dalam fasa diam karena adanya gaya kapiler
(Sthal, 1985). Noda yang timbul pada senyawa yang terpisah pada lempeng
lapisan tipis dapat dideteksi dengan pereaksi warna ataupun dengan sinar UV
dengan panjang gelombang tertentu, yaitu 254 nm dan 366 nm (Sastrohamidjojo,
1985).
Empat macam adsorben yang umum dipakai adalah silika gel, alumina,
kieselguhr, dan selulosa. Zat-zat penyerap ini dibuburkan dengan air lalu dibuat
lapisan tipis yang merata pada lempeng kaca. Plat yang telah kering dipanaskan
atau diaktifkan dengan cara memanaskannya pada suhu kira-kira 1000C selama 30
menit. Campuran senyawa yang akan dipisahkan terlebih dahulu dilarutkan dalam
Kemudian dimasukkan kedalam bejana tertutup rapat berisi larutan pengembang
yang cocok (fase gerak) (Adnan, 1997; Sastrohamidjojo, 1991).
Fase gerak yang dipakai umumnya berupa campuran beberapa pelarut
dengan perbandingan tertentu, tujuannya adalah untuk memperoleh polaritas yang
tepat sehingga diperoleh pemisahan senyawa yang baik. Proses pengembangan
akan lebih baik bila bejana pengembangan telah jenuh dengan uap fase gerak
(Adnan, 1997; Gritter, dkk., 1991).
Jarak pengembangan senyawa pada kromatogram biasanya digunakan
dengan Rf. Angka Rf berjangka 0,00-1,00 dan hanya dapat ditemukan dua
desimal (Stahl, 1985).
Faktor-faktor yang mempengaruhi harga Rf yaitu struktur kimia dari
senyawa yang dipisahkan, sifat dari penyerap, tebal dan kerataan lapisan penjerap,
pelarut, suhu, sifat dari campuran, derajat kejenuhan dari bejana pengembang,
tehnik percobaan, jumlah cuplikan yang digunakan, dan kesetimbangan
(Sastrohamidjojo, 1991).
2.5.2 Kromatografi Lapis Tipis Preparatif
Kromatografi lapis tipis preparatif merupakan salah satu metode
pemisahan yang pengerjaannya lebih mudah dan menggunakan peralatan
sederhana (Harbone, 1987).
Penjerap yang paling umum digunakan adalah silika gel dipakai untuk
pemisahan senyawa lipofilik maupun hidrofilik dengan ketebalan 0,5-2 mm.
Kebanyakan penjerap kromatografi lapis tipis preparatif mengandung
indikator fluoresensi yang membantu mendeteksi letak isolat yang terpisah
sepanjang senyawa yang dipisahkan menyerap sinar ultraviolet. Untuk senyawa
yang tidak menyerap sinar ultraviolet pendeteksian dilakukan dengan cara
menutup plat dengan sepotong kaca lalu menyemprot salah satu sisi dengan
pereaksi penyemprot (Hostettmann, 1995). Setelah isolat ditampakkan, lalu isolat
dikerok dari plat kaca. Cara ini berguna untuk memisahkan campuran beberapa
senyawa sehingga diperoleh senyawa murni (Gritter,1991).
2.6 Spektrofotometri Ultraviolet
Spektrofotometri ultraviolet adalah suatu metode spektrofotometri
serapan dengan cara mengukur serapan radiasi elektromagnetik suatu larutan pada
panjang gelombang tertentu. Spektrum ultraviolet digambarkan sebagai hubungan
antara panjang gelombang dengan intensitas serapan (transmitansi atau
absorbansi) (Sastrohamidjojo, 1985).
Panjang gelombang di dalam ultra violet biasanya dinyatakan dalam
nanometer (1 nm = 10-9 m). Spektrum serapan yabg lebih kecil dari 200 nm
disebut spektrometri ultra violet jauh. Bagian ultra violet (ultra violet dekat) dari
spektrum elektromagnetik terentang dari 200-400 nm (Silverstein dkk,1981).
Pada instrumen spektrofotometer ultraviolet yang digunakan sebagai
sumber cahaya adalah lampu hidrogen atau deuterium. Panjang gelombang dari
sumber cahaya akan dibagi oleh pemisahan panjang gelombang seperti prisma
Apabila suatu molekul menyerap radiasi ultraviolet, maka didalam
molekul tersebut terjadi perpindahan (transisi) tingkat energi elektron-elektron
ikatan di orbital molekul paling luar dari tingkat energi yang paling rendah
(orbital ikatan π) ke tingkat energi yang lebih tinggi (orbital anti ikatan π*). Dalam
praktek, spektrofotometri ultraviolet digunakan terbatas pada sistem-sistem
terkonjugasi. Keuntungan dari serapan ultraviolet adalah selektifitasnya dimana
gugus-gugus yang khas dapat dikenali (Noerdin, 1985; Sastrohamidjojo, 1985;
Silverstein, dkk., 1986).
2.7 Spektrofotometri Inframerah
Bila sinar inframerah dilewatkan melalui cuplikan senyawa organik,
maka sejumlah frekuensi diserap sedang frekuensi yang lain diteruskan atau
ditransmisikan tanpa diserap. Pengukuran pada spektrum inframerah dilakukan
pada daerah bilangan gelombang 4000-400 cm-1
1. Apakah terdapat gugus karbonil?
. Isolat absorbsi inframerah sangat
khas dan spesifik untuk setiap tipe ikatan kimia atau gugus fungsi, artinya
senyawa yang berbeda akan mempunyai spektrum yang berbeda pula (Noerdin,
1985; Sastrohamidjojo, 1991; Dachriyanus, 2004).
Berikut ini langkah-langkah umum untuk memeriksa isolat-isolat serapan
yang penting:
Gugus C=O memberikan puncak pada daerah 1820-1660 cm-1
2. Jika gugus C=O ada, periksalah gugus-gugus berikut.Jika C=O tidak ada
langsung ke nomor 3.
. Puncak ini
Asam : apakah ada gugus O–H? Serapan melebar di daerah 3300-2500
cm-1. (biasanya tumpang tindih dengan C–H)
Amida : apakah ada N–H? Serapan medium di dekat 3500 cm-1,
kadang-kadang dengan puncak rangkap.
Ester : apakah ada C–O? Serapan dengan intensitas medium di daerah
1300-1000 cm-1.
Anhidrida : mempunyai dua serapan C=O di daerah 1810 dan 1760 cm-1.
Aldehida : apakah ada C–H aldehid? Dua serapan lemah di dekat
2850-2750 cm-1
3. Bila gugus C=O tidak ada
yaitu di sebelah kanan serapan C-H.
Keton : jika kelima kemungkinan di atas tidak ada.
Eter : periksalah gugus C–O (serapan O–H tidak ada), yaitu
serapan medium di daerah 1300-1000 cm-1.
Alkohol/fenol : periksalah gugus O–H, merupakan serapan melebar di
daerah 3600-3300 cm-1 yang diperkuat adanya serapan C–O
di daerah 1300-1000 cm-1.
Amina : periksalah gugus N–H, yaitu serapan medium di daerah
3500 cm-1
4. Ikatan rangkap dua dan/atau cincin aromatik .
- C=C mempunyai serapan lemah di daerah 1650 cm-1
- Serapan medium sampai kuat pada daerah 1650-1450 cm
.
-1
sering
- Buktikan kemungkinan di atas dengan memperhatikan serapan pada
daerah C–H aromatik di sebelah kiri 3000 cm-1
5. Ikatan rangkap tiga
, sedangkan C–H alifatis
terjadi di sebelah kanan daerah tersebut.
- C≡N mempunyai serapan medium dan tajam di daerah 2250 cm-1
- C≡C mempunyai serapan lemah tapi tajam di daerah 2150 cm
.
-1
. Periksa
juga –CH asetilenik di dekat 3300 cm-1
6. Gugus Nitro
.
Gugus nitro muncul dua serapan kuat pada 1600-1500 cm-1 dan 1690-1300
cm-1
7. Hidrokarbon
.
- Apabila keenam kemungkinan di atas tidak ada.
- Serapan utama di daerah CH dekat 3000 cm-1
- Spektrum sangat sederhana, hanya terdapat serapan lain di daerah
1450-1375 cm
.
1
2.8 Spektrometri Massa
Spektometri massa menembaki bahan yang sedang diteliti dengan berkas
elektron dan secara kuantitatif mencatat hasilnya sebagai suatu fragmen.
Terpisahnya fragmen didasarkan pada massanya (lebih tepat, massa dibagi
muatan).
.
Keuntungan utama spektrometri massa sebagai metode analisis yaitu
metode ini lebih sensitif dan spesifik untuk identifikasi senyawa yang tidak
memberikan informasi mengenai bobot molekul dan rumus molekul. Puncak ion
molekul penting dikenali karena memberikan bobot molekul senyawa yang
diperiksa. Puncak paling kuat pada spektrum, disebut puncak dasar (base peak),
dinyatakan dangan nilai 100% (Silverstein dkk, 1986).
BAB III
METODOLOGI PENELITIAN
Metode yang digunakan adalah metode eksperimental meliput i
pengumpulan sampel, pembuatan simplisia, pemeriksaan saponin, pembuatan
ekstrak, isolasi senyawa sapogenin dari ekstrak, meliputi analisis senyawa
sapogenin secara KLT, pemisahan senyawa sapogenin dengan cara KLT
preparatif, uji kemurnian senyawa sapogenin hasil isolasi dengan KLT dua arah
serta identifikasi isolat secara spektrofotometri UV, IR, dan spektrometri massa
(MS).
3. 1 Alat-alat yang digunakan
Alat-alat yang digunakan dalam penelitian ini adalah: alat-alat gelas
laboratorium, oven listrik (stork), elektromantel (EM 2000), hair-dryer, cawan
penguap, termometer, lampu UV 366 nm (Dessaga), neraca analitik (Vibra AJ),
neraca kasar (Salter AND), penangas air (Yenaco), seperangkat alat kromatografi
lapis tipis (Dessaga), spektrofotometer ultraviolet (Shimadzu mini 1240),
spektrofotometer inframerah (Shimadzu), spektrometer massa (Shimadzu
QP2010S).
3. 2 Bahan-bahan yang digunakan
Bahan yang digunakan adalah teripang Holothuria sp. dan suspensi
darah. Bahan kimia yang digunakan kecuali dinyatakan lain berkualitas pro
asetat, metanol, toluen, kalium fosfat monobasa, kloroform, natrium hidroksida,
n-heksan, plat pra lapis silika gel GF254 (E. Merck). Etanol 95% hasil destilasi dan
air suling laboratorium.
3. 3 Pengumpulan dan Pengolahan Sampel 3. 3. 1 Pengumpulan Sampel
Pengumpulan sampel dilakukan secara purposif, yaitu tanpa membanding
kan dengan daerah lain. Sampel yang digunakan adalah teripang yang masih segar
dari perairan Sabang, Aceh.
3. 3. 2 Identifikasi Hewan
Identifikasi hewan dilakukan di Pusat Penelitian Oceanografi Jakarta.
Hasil identifikasi dan gambar hewan dapat dilihat pada lampiran 1-2 halaman
21-22.
3. 3. 3 Pengolahan Sampel
Teripang dibersihkan dari kotoran dengan cara mencuci di bawah air
mengalir hingga bersih, ditiriskan lalu ditimbang, diperoleh berat basah 1 ekor
teripang = 1,2 kg. Kemudian teripang dipotong dengan ukuran 5x5 cm dan
dikeringkan dalam lemari pengering. Teripang yang sudah kering ini disebut
simplisia hewan. Selanjutnya simplisia diperkecil potongannya dan disimpan
3. 4 Pembuatan Larutan Pereaksi 3. 4. 1 Larutan Asam Klorida 2 N
Sebanyak 17 ml larutan asam klorida pekat ditambahkan air suling
hingga 100 ml (Depkes, 1979).
3. 4. 2 Larutan Natrium Hidroksida 0,2 N
Sebanyak 800 mg natrium hidroksida dilarutkan dalam air suling bebas
karbondioksida hingga 100 ml (Depkes, 1979).
3. 4. 3 Larutan Kalium Fosfat Monobasa 0,2 M
Sebanyak 2,72 g kalium fosfat monobasa dilarutkan dalam air suling
bebas karbondioksida hingga 100 ml (Depkes, 1979).
3. 4. 4 Larutan Dapar Fosfat pH 7,4
Sebanyak 50 ml kalium fosfat monobasa 0,2 M dicampurkan dengan
39,1 ml natrium hidroksida 0,2 N, lalu diencerkan dengan air suling bebas
karbondioksida hingga 200 ml (Depkes, 1979).
3. 4. 5 Larutan Liebermann-Burchard (LB) sebagai penampak noda
Campurkan 5 ml asam asetat anhidrat dengan 5 ml asam sulfat pekat,
kemudian campuran dimasukkan kedalam 50 ml etanol 95%. Pengerjaan
dilakukan dalam kondisi dingin dan pereaksi dibuat baru (Depkes RI, 1995).
3. 5 Pemeriksaan Karakteristik Simplisia
Pemeriksaan identifikasi simplisia meliputi pemeriksaan makroskopik
3. 5. 1 Pemeriksaan Makroskopik
Pemeriksaan makroskopik dilakukan terhadap teripang segar dan
simplisia dengan cara mengamati warna, bau, bentuk dan ukuran. Hasil dapat
dilihat pada lampiran 2-3 gambar 1-2 hal 22-23.
3. 5. 2 Penetapan Kadar Air
Penetapan kadar air dilakukan dengan metode Azeotropi (Destilasi
Toluen). Alat-alat terdiri dari labu alas bulat 500 ml, alat penampung, pendingin,
tabung penyambung, pemanas, tabung penerima 5 ml.
(a) Penjenuhan Toluen
Sebanyak 200 ml toluen dan 2 ml air suling dimasukkan kedalam labu alas
bulat, dipasang alat penampung dan pendingin, kemudian didestilasi
selama 2 jam. Destilasi dihentikan, lalu dibiarkan dingin selama 30 menit,
kemudian volume air dalam tabung penerima dibaca dengan ketelitian
0,01 ml.
(b) Penetapan Kadar Air
Cara kerja :
Kedalam labu yang berisi toluen jenuh di atas dimasukkan 5 g simplisia
yang telah ditimbang seksama, lalu dipanaskan hati-hati selama 15 menit,
setelah toluen mendidih, kecepatan tetesan diatur 2 tetes untuk tiap detik
sampai sebagian air terdestilasi, kemudian kecepatan destilasi dinaikkan
sampai 4 tetes tiap detik. Setelah semua air terdestilasi, bagian bagian
dalam pendingin dibilas dengan toluen, destilasi dilanjutkan selama 5
menit, kemudian tabung penerima dibiarkan mendingin pada suhu kamar.
ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai dengan
kandungan air yang di dalam bahan yang diperiksa. Kadar air dihitung
dalam persen (Depkes, 1979).
3. 6 Pemeriksaan Senyawa Saponin 3. 6. 1 Uji Busa
Sebanyak 0,5 g simplisia dimasukkan kedalam tabung reaksi,
ditambahkan 10 ml air suling panas, didinginkan kemudian dikocok kuat-kuat
selama 10 detik. Adanya saponin ditunjukkan dengan terbentuknya buih yang
mantap selama tidak kurang dari 10 menit setinggi 1 cm sampai 10 cm dan
dengan penambahan 1 tetes asam klorida 2 N, buih tidak hilang (Depkes, 1995).
3. 6. 2 Uji Hemolisis Darah
Sebanyak 0,5 g simplisia dicampur dengan 50 ml larutan dapar fosfat pH
7,4, dipanaskan pada suhu 100 0
Sebanyak 0,5 g simplisia ditambahkan 10 ml etanol, kemudian dimasuk
kan asam klorida 2 N, selanjutnya larutan direfluks selama 10 menit dan disaring
dalam keadaan panas. Filtrat diencerkan dengan 10 ml air suling, setelah dingin C selama 10 menit, didinginkan lalu di saring.
Kemudian 1 ml filtrat dicampur dengan 1 ml suspensi darah dan didiamkan
selama 30 menit. Terjadinya hemolisis total menunjukkan adanya saponin yang
ditandai dengan terbentuknya lapisan bening bewarna merah kekuningan di
bagian tengah larutan (Depkes, 1995).
3. 7 Pemeriksaan Senyawa Steroid/Triterpenoid
ditambahkan 10 ml n-heksan, dikocok hati-hati dan dibiarkan memisah. Lapisan
n-heksan diambil dan diuapkan pada cawan penguap. Pada sisa ditetesi 20 tetes
asam asetat anhidrat dan 1 tetes asam sulfat pekat (pereaksi LB). Hasil positif
adanya steroid bila memberikan warna hijau, biru dan triterpenoid bila
memberikan warna merah, merah muda atau ungu (Farnsworth, 1966).
3. 8 Pembuatan Ekstrak
Pembuatan ekstrak dilakukan menurut badan POM (2004) dengan cara
maserasi menggunakan pelarut etanol 95%.
Cara kerja :
Sebanyak 120 g simplisia teripang dimasukkan kedalam wadah gelas
bertutup (maserator), lalu sebanyak 1,2 L etanol 95% dituang kedalam maserator
sambil sesekali diaduk, lalu ditutup dan dibiarkan 24 jam, kemudian disaring dan
filtrat ditampung. Perlakuan yang sama dilakukan sebanyak 3 kali. Filtrat yang
diperoleh digabungkan menjadi satu, kemudian dipekatkan dengan rotari evapora
tor hingga diperoleh ekstrak kental (Badan POM, 2004). Bagan proses ekstraksi
dapat dilihat pada lampiran 4 halaman 24.
3. 9 Analisis ekstrak etanol dengan cara KLT
Terhadap ekstrak etanol teripang dilakukan analisis dengan KLT
menggunakan fase diam: plat pra lapis silika gel GF254, fase gerak: n-heksan – etil
asetat dengan perbandingan (90:10), (80:20), (70:30), (60:40), (50:50) dengan
Cara kerja:
Ekstrak etanol teripang ditotolkan pada plat pra lapis silika gel GF254,
setelah kering plat dimasukkan kedalam masing-masing bejana yang telah jenuh
dengan uap pengembang, kemudian dikembangkan hingga batas pengembangan.
Plat dikeluarkan, dikeringkan kemudian disemprot dengan pereaksi LB. Lalu plat
dipanaskan pada suhu 110 0
Terhadap ekstrak kloroform teripang dilakukan analisis dengan KLT
menggunakan fase diam plat pra lapis silika gel GF
C selama 10 menit (Gritter, 1991).Perubahan warna
yang terjadi diamati dan harga Rf dihitung. Kromatogram hasil KLT dapat dilihat
pada lampiran
3.10 Isolasi Senyawa Sapogenin dari Ekstrak Etanol
Isolasi senyawa sapogenin dilakukan dengan cara menghidrolisis ekstrak
etanol selama 6 jam dengan penambahan asam klorida 2 N, kemudian hasil hidro
lisis diekstraksi dengan kloroform (Harborne, 1987).
Cara kerja:
Sebanyak 8 g ekstrak etanol teripang ditambahkan asam klorida 2 N.
Kemudian dihidrolisis dengan cara merefluksnya selama 6 jam, selanjutnya filtrat
diekstraksi dengan kloroform sebanyak 3 kali, aglikon sapogenin berada dalam
lapisan kloroform. Ekstrak kloroform hasil hidrolisis digabung dan dipekatkan.
Bagan isolasi senyawa sapogenin dapat dilihat pada lampiran 4 halaman 24.
3. 11 Analisis Ekstrak Kloroform dengan Cara KLT
asetat dan kloroform-toluen dengan perbadingan (90:10), (80:20), (70:30),
(60:40), (50:50) dan penampak noda pereaksi LB.
Cara kerja:
Ekstrak kloroform teripang ditotolkan pada plat pra lapis silika gel GF254,
biarkan mengering. Kemudian plat dimasukkan kedalam masing-masing bejana
yang telah jenuh dengan uap pengembang, lalu dikembangkan sampai garis batas
pengembangan. Plat dikeluarkan, dikeringkan kemudian disemprot dengan pe
reaksi LB, lalu plat dipanaskan pada suhu 110 0C selama 10 menit. Kromatogram
diamati dan harga Rf dihitung, sehingga diketahui perbandingan fase gerak yang
terbaik untuk digunakan pada KLT preparatif (Gritter, 1991). Bagan analisis
ekstrak kloroform dapat dilihat pada lampiran 5 halaman 25.
3. 12 Isolasi Senyawa Sapogenin dengan KLT Preparatif
Terhadap ekstrak kloroform teripang dilakukan pemisahan dengan KLT
preparatif menggunakan fase diam silika gel GF254
Ekstrak kloroform teripang ditotolkan berupa isolat pada plat KLT
preparatif berukuran 20 x 20 cm, setelah kering plat dimasukkan kedalam bejana
yang telah jenuh dengan uap pengembang. Kemudian dikembangkan sampai garis
batas pengembangan, plat dikeluarkan dan dikeringkan. Pada sisi kanan dan kiri
plat disemprot dengan pereaksi LB dan dipanaskan dengan bantuan hair-dryer
hingga diperoleh noda yang jelas. Bagian plat silika yang sejajar dengan noda
yang memberikan reaksi positif dengan pereaksi LB dikerok kemudian dilarutkan , fase gerak kloroform-toluen
(80:20) dan penampak noda pereaksi LB.
dengan pelarut metanol, lalu disaring, diuapkan pelarut metanolnya kemudian
disimpan kedalam lemari pendingin (Hostettmann, 1995). Hasil kromatogram
KLT preparatif dapat dilihat pada lampiran 8 halaman 29.
3. 13 Uji kemurnian Isolat dengan KLT
Terhadap isolat dilakukan uji kemurnian dengan KLT menggunakan plat
pra lapis silika gel GF254, fase gerak kloroform-toluen (80:20) dan penampak
noda pereaksi LB. Senyawa sapogenin dikatakan murni jika hasilnya telah
menunjukkan satu noda.
Cara Kerja:
Senyawa isolat dengan KLT preparatif ditotolkan pada plat pra lapis
silika gel GF254, biarkan mengering. Kemudian plat dimasukkan kedalam bejana
yang telah jenuh dengan uap pengembang, lalu dikembangkan sampai garis batas
pengembangan. Plat dikeluarkan, dikeringkan kemudian disemprot dengan
pereaksi LB, lalu plat dipanaskan pada suhu 110 0C selama 10 menit (Gritter,
1991). Kromatogram diamati dan harga Rf dihitung. Hasil kromatogram dapat
dilihat pada lampiran 9 halaman 30.
3. 14 Uji Kemurnian Isolat dengan KLT Dua Arah
Terhadap isolat dilakukan uji kemurnian dengan KLT dua arah meng
gunakan plat pra lapis silika gel GF254, fase gerak I kloroform-toluen (80:20) dan
Cara kerja:
Senyawa hasil isolasi dengan KLT preparatif ditotolkan pada plat pra
lapis silika gel GF254, setelah kering dimasukkan kedalam bejana yang telah jenuh
dengan uap pengembang, dan dikembangkan dengan larutan pengembang I
sampai garis batas pengembangan, kemudian plat dikeluarkan dan dikeringkan.
Plat diputar 90o dan dikembangkan kembali dengan larutan pengembang II sampai
garis batas pengembangan. Plat dikeluarkan, dikeringkan kemudian disemprot
dengan pereaksi LB. Lalu plat dipanaskan pada suhu 110 0
3.15.2 Identifikasi Isolat dengan Spektrofotometer Inframerah
C selama 10 menit
(Gritter, 1991). Kromatogram diamati dan harga Rf dihitung. Hasil kromatogram
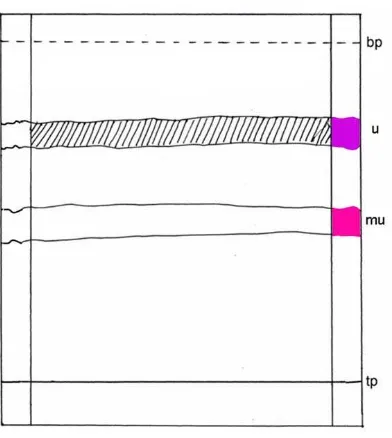
dapat dilihat pada lampiran 10 halaman 31.
3.15 Identifikasi Isolat
3.15.1 Identifikasi Isolat dengan Spektrofotometer Ultraviolet
Cara kerja:
Isolat dilarutkan dalam pelarut metanol, kemudian dimasukkan kedalam
kuvet yang telah dibilas dengan larutan sampel. Selanjutnya absorbansi larutan
sampel diukur pada panjang gelombang 200-400 nm (Noerdin, 1985). Spektrum
dapat dilihat pada lampiran 11 halaman 32.
Cara kerja:
Isolat hasil isolasi digerus halus kemudian ditambahkan KBr, dihaluskan.
Campuran dimasukkan kedalam alat pellet die dihubungkan dengan alat pompa
vakum dan penekan hidrolik 10 menit (tekanan 10000 – 15000 pound per inci).
pellet KBr dikeluarkan. Pellet KBr ditempatkan pada pemegang cuplikan (sell
holder) (Noerdin, 1985). Spektrum inframerah isolat dapat dilihat pada lampiran
12 halaman 33.
3.15.3 Karakterisasi Isolat dengan Spektrometer Massa
Karakterisasi isolat secara kromatografi gas-spektrofotometri massa
dilakukan dengan cara melarutkan isolat dengan pelarut n-hexan kemudian
dimasukkan melalui tempat penyuntikan kedalam suatu aliran gas pembawa pada
pangkal kolom dalam bentuk uap dan mengalami proses pembagian antara fase
gas dan fase tidak bergerak. Hasil pemisahan kromatografi gas difragmentasi
sehingga diperoleh fragmen-fragmen pada spektrum. Spektrum massa dapat
BAB IV
HASIL DAN PEMBAHASAN
Hasil identifikasi yang telah dilakukan oleh pusat penelitian dan
pengembangan Oseanografi LIPI Jakarta adalah termasuk hewan teripang filum
Echinodermata, kelas Holothuroidea, jenis Holothuria sp.
Hasil uji pendahuluan terhadap senyawa kimia menunjukkan adanya
senyawa golongan saponin dan steroid/triterpenoid. Uji pendahuluan senyawa
kimia golongan saponin terdiri dari uji busa dan uji hemolisis darah, sedangkan
untuk golongan steroid/triterpenoid yaitu reaksi warna dengan pereaksi
Liebermann-Burchard (LB).
Pada simplisia dilakukan identifikasi, meliputi pemeriksaan makroskopik
terhadap teripang segar dan simplisia, dan pemeriksaan kadar air dengan metode
azeotropi (destilasi toluen). Hasil pemeriksaan makroskopik terhadap teripang
segar, ditemuka n bewarna cokelat tua agak kehijauan, berbau spesifik, berbentuk
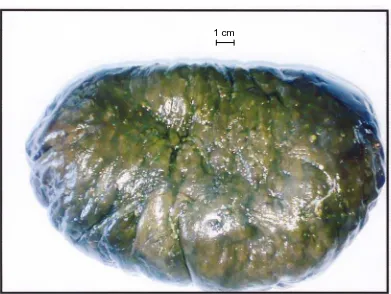
lonjong, berukuran panjang 20 cm, lebar 13 cm, tebal 5 cm. Sedangkan simplisia
teripang bewarna kuning dengan bagian tepi bewarna hitam, sedikit berbau. Dan
hasil dari penetapan kadar air diperoleh kadar air 8%. Hasil ini masih sesuai
dengan standar mutu teripang kering, sesuai dengan surat Keputusan Menteri
Pertanian No. 701/Kpts/TP>830/10/1987 yaitu kadar air maksimum 20%
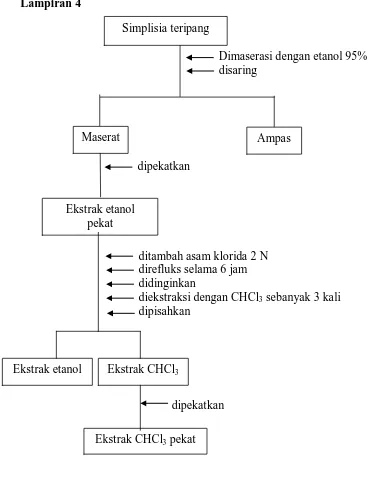
Simplisia teripang diekstraksi dengan cara maserasi menggunakan
pelarut etanol 95%, selanjutnya ekstrak etanol dihidrolisis selama 6 jam dengan
bantuan HCl 2 N, kemudian disari dengan kloroform untuk mendapatkan senyawa
sapogenin secara sempurna. Hasil maserasi dari 120 g simplisia diperoleh 9,335 g
ekstrak etanol.
Analisis ekstrak etanol secara KLT menggunakan fase diam plat pra lapis
silika gel GF254, fase gerak n-heksan-etil asetat dengan berbagai perbandingan dan
sebagai penampak noda adalah pereaksi LB, diperoleh 1 noda senyawa saponin.
Pemutusan ikatan glikosida dilakukan dengan cara merefluks dengan HCl 2 N,
lalu diuapkan. Kemudian sisanya disari dengan CHCl3. Selanjutnya diambil
lapisan CHCl3 dan diuapkan hingga diperoleh ekstrak kental. Ekstrak kloroform
yang diperoleh adalah sebanyak 3 g.
Hasil KLT ekstrak kloroform dengan berbagai fase gerak menggunakan
penampak noda LB diperoleh fase gerak yang memberikan pemisahan terbaik
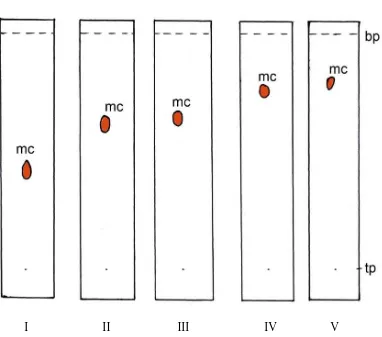
yaitu kloroform-toluen (80:20). Hasilnya diperoleh 2 noda senyawa sapogenin,
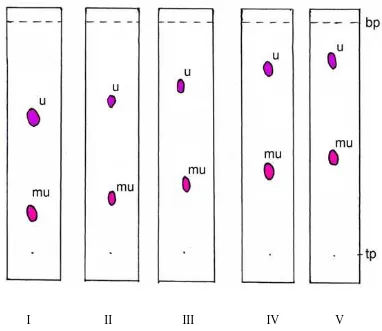
yaitu noda 1 dengan harga Rf = 0,4 (merah ungu) dan noda 2 dengan harga Rf =
0,76 (ungu). Kromatogram KLT ekstrak kloroform dapat dilihat pada gambar 7
halaman 28.
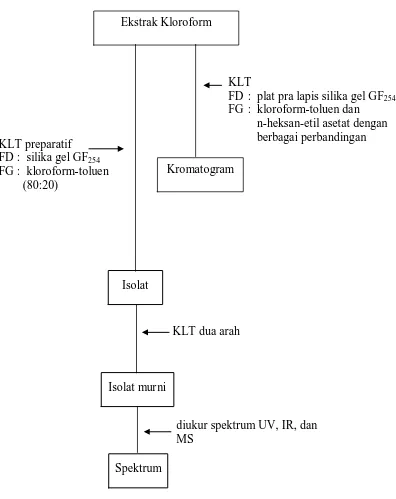
Pemisahan ekstrak kloroform dilakukan dengan KLT preparatif
menggunakan fase gerak kloroform-toluen (80:20) dan penampak noda LB. Hasil
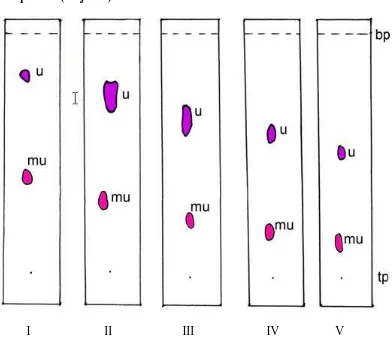
KLT preparatif diperoleh 2 isolat, yaitu isolat I dengan Rf = 0,47 (merah ungu),
isolat II Rf = 0,72 (ungu). Kemudian isolat II diidentifikasi secara
Hasil identifikasi isolat II secara spektrofotometri ultraviolet diperoleh
panjang gelombang maksimum (λ) 229 nm, dengan absorbansi 0,640
menunjukkan adanya gugus kromofor yang mengalami transisi π π*
(Creswell, 1982).
Hasil spektrum inframerah menunjukkan puncak yang lebar pada
bilangan gelombang 3410,15 cm-1 yang berasal dari gugus –OH. Gugus –OH
terikat pada atom C siklik yang diperkuat dengan adanya puncak di daerah
1080,14 cm-1 yaitu gugus C-O. Puncak kuat pada bilangan gelombang 2924,09
cm-1 menunjukkan adanya gugus –CH alifatis. Puncak di daerah 1566,20 cm-1
menunjukkan adanya gugus C=C. , ikatan C-Br dijumpai di daerah 555,50 cm-1.
(Silverstein dkk, 1986). Spektrum dapat dilihat pada lampiran 12 halaman 33.
Hasil analisis spektrometri massa dari isolat adalah sebagai berikut :
diduga merupakan senyawa 3-bromo-cholest-5-ene (C27H45Br). Berdasarkan
perbandingan antara spectrum unknown dan library, maka senyawa ini
disimpulkan sebagai kolesterol dengan tingkat kemiripan (similarity index) =
85%. Senyawa ini mempunyai M+ 448 yang merupakan bobot molekul (BM).
Dari spektrum massa diperoleh puncak-puncak berurutan sebagai berikut m/z 368,
213, 121. Pelepasan HBr dari puncak ion molekul C27H45Br menghasilkan
fragmen [C27H44]+ dengan m/z 368. Pelepasan .C11H23 menghasilkan fragmen
[C16H21]+ dengan m/z 213. Pelepasan C7H8 menghasilkan fragmen [C9H13]+
dengan m/z 121. Spektrum massa dapat dilihat pada lampiran 14 halaman 35 dan
Rumus bangun senyawa 3-bromo-cholest-5-ene:
CHMe (CH2) 3CHMe2
Me
Me
BAB V
KESIMPULAN DAN SARAN
5. 1 Kesimpulan
Hewan yang diteliti adalah teripang Holothuria sp. Hasil uji pendahuluan
senyawa kimia terhadap teripang menunjukkan adanya golongan senyawa saponin
dan steroid/triterpenoid.
Hasil pemisahan isolat dengan KLT preparatif diperoleh dua senyawa
sapogenin yaitu dengan harga Rf = 0,47 (merah ungu), Rf = 0,72 (ungu) dengan
fase gerak kloroform-toluen (80:20).
Hasil spektrum ultraviolet menunjukkan panjang gelombang (λ)
maksimum 229 nm. Hasil spektrum inframerah menunjukkan adanya gugus –OH
(3410,15 cm-1), –CH alifatis (2924,09 cm-1), C=C (1566,20 cm-1), C-O (1080,14
cm-1), dan C-Br (555,50 cm-1). Hasil identifikasi isolat secara spektrometri massa
menunjukkan bahwa isolat identik dengan senyawa 3-bromo-cholest-5-ene
(C27H45Br) dengan berat molekul (BM) = 448.
5. 2 Saran
Diharapkan kepada peneliti selanjutnya untuk menguji efek anti diabetes
DAFTAR PUSTAKA
Anonim.(2008). Teripang Geliat Potensi dari Timur. http://www. dkp. go. id.
Anonim.(2008). Penyembuh dari Dasar Samudera. http//www. luxor. com.
Adnan, M. (1997). Teknik Kromatografi untuk Analisis Bahan Makanan.
Yogyakarta: ANDI. Hal. 10,14.
Badan POM. (2004). Monografi Ekstrak Tumbuhan Obat Indonesia. Vol. 1.
Jakarta: Badan POM. Hal. 25.
Creswell, C. J., Runguist, O. A., Campbell, M. M. (1982). Analisa Spektrum
Senyawa Organik. Penerjemah : K. Padmawinata dan Soediro. Edisi II.
ITB-Press. Bandung. Hal. 25.
Dachriyanus. (2004). Analisis Struktur Senyawa Organik Secara Spektroskopi.
Universitas Andalas-Press. Padang. Hal. 39, 45, 60-64.
Depkes RI. (1979). Farmakope indonesia. Edisi III. Jakarta: Departemen
Kesehatan RI. Hal. 14,53, 412, 649, 687, 748, 755, 816.
Depkes RI. (1995). Materia Medika Indonesia. Jilid VI. Cetakan pertama. Jakarta
: Departemen Kesehatan RI. Hal. 303, 323-324.
Depkes RI. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Cetakan
Pertama. Jakarta: Departemen Kesehatan RI. Hal. 10-11.
E. Merck. (1978). Dyeing Reagent for Thin Layer and Paper Chromatography.
Farnsworth, N. R. (1966). Biological and Phytochemical Screening Of Plants.
Journal of Pharmaceutical Sciences. Vol. 55(3): 257-260.
Gritter, R. J., J.M, Bobitt & Arthur E. Schwarting. (1991). Pengantar
Kromatografi. Penerjemah: K. Padmawinata. Edisi II. ITB-Press.
Bandung. Hal. 1, 6, 107-109.
Gunawan, D. & Sri, M. (2004). Ilmu Obat Alam (Farmakognosi). Jilid 1. Jakarta:
Penebar Swadaya. Hal. 87-92.
Harborne, J. B. (1987). Metode Fitokimia, penuntun cara moderen menganalisa
tumbuhan. Penerjemah: K. Padmawinata. Edisi II. ITB-Press. Bandung.
Hal. 49, 69-71,147-158.
Hostettmann, K., Hostettmann, M., Marston, A. (1995). Cara Kromatografi
Preparatif: Penggunaan Pada Isolasi Senyawa Alam. Penerjemah:
K.Padmawinata. ITB-Press. Bandung. Hal. 9-11.
Martoyo, dkk. (2006). Budi Daya Teripang. Edisi Revisi. Jakarta: Penebar
Swadaya. Hal. 8-16.
Noerdin, D. (1985). Elusidasi struktur senyawa organik dengan cara spektroskopi
ultralembayung dan inframerah. Edisi I. Bandung: Penerbit Angkasa. Hal.
1-4, 8-9, 54, 82-83.
Sastrohamidjojo, H. (1985). Spektroskopi.. Edisi I. Yogyakarta : Liberty. Hal. 10-15.
Sastrohamidjojo, H. (1991). Kromatografi. Edisi I. UGM-Press. Yogyakarta. Hal.
1-2, 26-32, 35-36.
Silverstein, R. M, Bessler, G. C. & Morrill, T. C. (1986). Penyidikan
Spektrometrik Senyawa Organik. Alih bahasa Hartono, dkk. Jakarta:
Stahl, E. (1985). Analisis Obat Secara Kromatografi dan Mikroskopi.
Penerjemah: K. Padmawinata dan Sudiro L. ITB-Press. Bandung. Hal.
3-33.
Tarigan, P. (1980). Beberapa Aspek Kimia Sapogenin Steroid pada Tumbuhan di
Indonesia. Bandung: Penerbit Alumni. Hal. 12-62.
Trease, G. E., & William, C. E. (1983). Pharmacognosy. London: Bailliere
Tindall. Pages 475-485.
Lampiran 1
Lampiran 2
Gambar 1. Teripang Segar Holothuria sp.
Lampiran 3
Gambar 2. Simplisia Teripang Holothuria sp.
Lampiran 4
Gambar 3. Bagan Ekstraksi Senyawa Sapogenin dari Teripang
Keterangan :
CHCl3 : kloroform
Dimaserasi dengan etanol 95% disaring
Ekstrak etanol pekat
ditambah asam klorida 2 N direfluks selama 6 jam didinginkan
diekstraksi dengan CHCl3 sebanyak 3 kali
Lampiran 5 (lanjutan)
Gambar 4. Bagan Isolasi Senyawa Sapogenin dari Ekstrak Kloroform
Keterangan :
diukur spektrum UV, IR, dan MS
Spektrum
Lampiran 6
I II III IV V
Gambar 5. Kromatogram KLT ekstrak etanol
Keterangan: Fase diam silika gel GF254, fase gerak n-heksan-etil asetat, penampak
noda Liebermann-Burchard, mc = merah coklat, bp = batas pengembangan, tp = titik penotolan
Lampiran 7
I II III IV V
Gambar 6. kromatogram KLT ekstrak kloroform
Keterangan: Fase diam silika gel GF254, fase gerak n-heksan-etil asetat, penampak
noda Liebermann-Burchard, u = ungu, mc = merah coklat, bp = batas pengembangan, tp = titik penotolan
Lampiran 7 (lanjutan)
I II III IV V
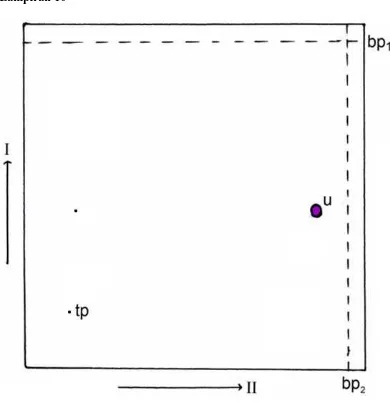
Gambar 7. Kromatogram KLT ekstrak kloroform
Keterangan: Fase diam silika gel GF254, fase gerak kloroform-toluen, penampak
noda Liebermann-Burchard, u = ungu, mu = merah ungu, bp = batas pengembangan, tp = titik penotolan
Lampiran 8
Gambar 8. Kromatogram ekstrak kloroform secara KLT Preparatif
Keterangan: Fase diam silika gel GF254, fase gerak kloroform-toluen (80:20),
Lampiran 9
Gambar 9. Kromatogram hasil KLT uji kemurnian isolat
Keterangan: Fase diam silika gel GF254, fase gerak kloroform-toluen (80:20),
Lampiran 10
Gambar 10. Kromatogram KLT dua arah dari isolat
Keterangan: Fase diam silika gel GF254, fase gerak I kloroform-toluen (80:20),
Lampiran 11
Lampiran 12
Gambar 12. Spektrum Inframerah dari isolat
%T
Lampiran 13
Lampiran 14
Lampiran 15
Pola fragmentasi komponen hasil analisis spektometri massa
HBr C11H23 C7H
[C
8