ISOLASI SENYAWA ALKALOIDA
DARI BATANG TUMBUHAN BROTOWALI
(Tinospora crispa (L.)MIERS.)
SKRIPSI
TULUS MPL TOBING
020802028
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
ISOLASI SENYAWA ALKALOIDA
DARI BATANGTUMBUHAN BROTOWALI (Tinospora crispa (L.)MIERS.)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
TULUS MPL TOBING
020802028
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : ISOLASI SENYAWA ALKALOIDA DARI BATANG TUMBUHAN BROTOWALI (
Tinospora crispa (L.)MIERS.)
Kategori : SKRIPSI
Nama : TULUS MPL TOBING
Nomor Induk Mahasiswa : 020802028
Program Studi : SARJANA ( S-1 ) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM ( FMIPA ) UNIVERSITAS SUMATERA UTARA
Disetujui di
Medan, November 2007
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Drs. Phillipus Siregar , MSi Drs. S. Hadjuangan Hutapea NIP. 131 572 435 NIP. 130 353 142
Diketahui/Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
ISOLASI SENYAWA ALKALOIDA
DARI BATANGTUMBUHAN BROTOWALI (Tinospora crispa (L.)MIERS.)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, November 2007
TULUS MPL TOBING 020802028
PENGHARGAAN
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas limpahan rahmat dan karunia-Nya kertas kajian ini berhasil diselesaikan dalam waktu yang telah ditetapkan.
ISOLASI SENYAWA ALKALOIDA DARI BATANG TUMBUHAN BROTOWALI ( Tinospora Crispa (L.)MIERS.)
ABSTRAK
ISOLATION OF ALKALOIDA COMPOUNDS WHICH ARE
CONTAINED IN STEM OF BROTOWALI ( Tinospora Crispa (L.)MIERS.)
ABSTRACT
Isolation alkaloida compound which contained in stem of Brotowali(Tinospora crispa(L.)MIERS.) has been done with maseration technique with ethanol solven and
then partition with Etil acetate : water,and take the water fraction, steam up then additing HCl, filtration, then by additing NH4OH will formed precipitate and then extracted with CHCl3 : Water and take the solution for separated and stem up until we
got crude extract alkaloid and so on analysed with thin layer chromatography then isolated with column chromatography. It was eluted with chloroform : ethanol ( 4 : 1 v/v
) solvent. The while, needle crystal was obtained and then recrystallized with ethanol. The melting point of crystal from this isolation is 175 – 177 0C. The yielded crystal from this isolation is 1,38 g. crystal was identified by using infra red spectroscopy and nuclear
DAFTAR ISI
1.4. Manfaat Penelitian 3
1.5. Lokasi Penelitian 3
1.6. Metodologi Penelitian 3
Bab 2 Tinjauan Pustaka 5
2.1. Tumbuhan Brotowali 5
2.1.1. Morfologi Tumbuhan Brotowali 5 2.1.2. Sistematika Tumbuhan Brotowali 5 2.1.3. Manfaat Tumbuhan Dan Kandungan Kimia 6 Tumbuhan Brotowali
2.2. Senyawa Organik Bahan Alam 7
2.2.1. Senyawa Alkaloida 9
2.2.2. Klasifikasi Alkaloida 11
2.2.3. Sifat - sifat Alkaloida 15
2.2.4. Identifikasi, Isolasi dan Pemurnian Alkaloida 16 2.2.4.1. Identifikasi Alkaloida 16 2.2.4.2. Isolasi Senyawa Alkaloida 18 2.2.4.3. Pemurnian Senyawa Alkaloida 20
2.2.5. Biosintesis Alkaloida 21
2.3. Metode Pemisahan 22
2.3.1. Kromatografi 22
2.3.1.1. Kromatografi Lapisan Tipis 25
2.3.1.2. Kromatografi Kertas 25
2.3.1.3. Kromatografi Kolom 28
2.4. Teknik Spektroskopi 30
2.4.1. Spektrofotometri Infra Merah (FT-IR) 31 2.4.2. Spektrofotometri Resonansi Magnetik Inti Proton 34
Bab 3 Bahan dan Metode Penelitian 37
3.1. Alat - Alat 37
3.2. Bahan - Bahan 38
3.3. Prosedur Penelitian 38
3.3.1. Penyediaan Sampel 38
3.3.2. Uji Skrining Fitokimia 38
3.3.3. Prosedur Untuk Memperoleh Senyawa Kimia 39 Ekstrak Batang Tumbuhan Brotowali
3.3.4. Analisis Kromatografi Lapis Tipis 39 3.3.5. Isolasi Senyawa Alkaloida dengan Kromatografi Kolom 40 3.3.6. Pemurnian kristal Hasil Isolasi 41 3.3.7. Analisis Kristal Hasil Isolasi 41 3.3.7.1. Analisis Pada Kromatografi Lapis Tipis 41 3.3.7.2. Uji Reaksi Warna terhadap Kristal Hasil 41
Isolasi dengan Pereaksi Alkaloida
3.3.7.3. Penentuan Titik Lebur 42
3.3.7.4. Analisis Spektroskopi Kristal Hasil Isolasi 42
Bagan Penelitian 43
Bab 4 Hasil dan Pembahasan 44
4.1. Hasil Penelitian 44
4.2. Pembahasan 45
Bab 5 Kesimpulan dan Saran 49
5.1. Kesimpulan 49
5.2. Saran 49
DAFTAR TABEL
Halaman Tabel 1. Daftar Harga Rf Kromatografi Lapisan Tipis Serbuk 53 Batang tumbuhan Brotowali Melalui Penampakan
Bercak Dengan Sinar Ultra Violet
ISOLASI SENYAWA ALKALOIDA DARI BATANG TUMBUHAN BROTOWALI ( Tinospora Crispa (L.)MIERS.)
ABSTRAK
ISOLATION OF ALKALOIDA COMPOUNDS WHICH ARE
CONTAINED IN STEM OF BROTOWALI ( Tinospora Crispa (L.)MIERS.)
ABSTRACT
Isolation alkaloida compound which contained in stem of Brotowali(Tinospora crispa(L.)MIERS.) has been done with maseration technique with ethanol solven and
then partition with Etil acetate : water,and take the water fraction, steam up then additing HCl, filtration, then by additing NH4OH will formed precipitate and then extracted with CHCl3 : Water and take the solution for separated and stem up until we
got crude extract alkaloid and so on analysed with thin layer chromatography then isolated with column chromatography. It was eluted with chloroform : ethanol ( 4 : 1 v/v
) solvent. The while, needle crystal was obtained and then recrystallized with ethanol. The melting point of crystal from this isolation is 175 – 177 0C. The yielded crystal from this isolation is 1,38 g. crystal was identified by using infra red spectroscopy and nuclear
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Senyawa organik bahan alam adalah senyawa organik yang merupakan hasil proses metabolisme dalam organisme hidup. Senyawa dari jenis ini disebut juga metabolit. Secara sistematik, penyelidikan dalam bidang ini telah dimulai sejak 200 tahun lalu. Pada akhir abad 18, Scheele misalnya telah mengekstraksi beberapa senyawa organik sederhana dari sumbernya, baik dari tumbuh- tumbuhan maupun dari hewan, antara lain: gliserol, asam oksalat, asam laktat, dan asam sitrat. Pada tahun 1806, Serturner memperoleh morfin dari opium dan 15 tahun kemudian Peletier dan Cafenton telah dapat mengisolasi striknin, brusin, quinin, sinkonin, dan kafein. Senyawa- senyawa tersebut merupakan bahan alam yang dapat diisolasi untuk pertama sekali dalam keadaan murni. Setelah itu, isolasi bahan alam berkembang makin lama makin pesat terutama setelah penemuan teknik dan instrumen yang makin mutakhir.
Himbauan ini merupakan tantangan serta dorongan bagi para ilmuwan untuk meningkatkan penelitian dalam bidang Kimia Organik Bahan Alam Hayati. Tumbuh- tumbuhan merupakan sumber senyawa bahan alam hayati yang penting bagi umat manusia, yaitu sebagai bahan obat- obatan. Bertitik tolak dari sumber bahan alam hayati yang mempunyai peranan penting dalam penyediaan senyawa- senyawa baru dan diharapkan mempunyai aktivitas sebagai obat berbagai penyakit.
Sebagai sumber bahan alam hayati ini yang tersebar luas di hutan baik di hutan percobaan maupun hutan yang belum pernah dijamah manusia dijumpai beraneka ragamhayati sebagai sumber senyawa- senyawa baru dan diharapkan memberikan nilai tambah yang positif.
Tumbuhan Brotowali(Tinospora crispa (L.)MIERS.)adalah merupakan salah satu dari famili menispermaceae yang merupakan tumbuhan merambat dengan panjang mencapai 2,5m atau lebih. Masyarakat sudah biasa menggunakan tanaman ini untuk pengobatan berbagai penyakit antara lain: rematik, demam, sakit kuning, kencing manis, dan penyakit kolera, dengan merebus batangnya dan air rebusan diminum yang berasa pahit. Dari hasil uji skrining fitokimia yang menggunakan pereaksi- pereaksi untuk senyawa alkaloida antara lain: pereaksi wagner, mayer, drangendorff dan pereaksi bouchardat, yang mana serbuk halus batang Brotowali diekstraksi dengan HCl 0,5N dalam alkohol yang memberi hasil positif.
Oleh karena itu penulis tertarik untuk mengisolasi senyawa kimia bahan alam hayati dari golongan alkaloida yang terkandung pada batang tumbuhan Brotowali.
1.2.Permasalahan
Permasalahan dalam penelitian ini adalah bagaimana cara mengisolasi senyawa alakaloida dari batang tumbuhan Brotowali ( Tinospora crispa(L.)MIERS.)
1.3.Tujuan Penelitian
Untuk mengisolasi senyawa alkaloida dari batang tumbuhan Brotowali (Tinospora crispa(L.)MIERS.)
1.4. Manfaat Penelitian
Hasil dari penelitian ini diharapkan dapat memberikan informasi ilmiah dalam bidang kimia bahan alam hayati maupun bidang farmasi dalam upaya pemanfaatan senyawa alkaloida dari tumbuhan Brotowali(Tinospora crispa (L.)MIERS.)
1.5. Lokasi Penelitian
Sampel yang diteliti diperoleh dari pajak sore Padang Bulan Medan. Penelitian dilakukan di Laboratorium Kimia Organik Bahan Alam Hayati, FMIPA, Universitas Sumatera Utara. Identifikasi kristal dilakukan di Universitas Airlangga Surabaya.
1.6. Metodologi Penelitian
skrining fitokimia terhadap sampel batang tumbuhan Brotowali (Tinospora crispa(L.)MIERS.) dengan menggunakan pereaksi Meyer, Wagner, Dragendorff dan Bouchardat, untuk menunjukkan adanya senyawa alkaloida.
Tahapan isolasi yang dilakukan adalah: 1. Maserasi
2. Analisis Kromatografi Lapisan Tipis 3. Analisis Kromatografi Kolom 4. Rekristalisasi
Tahapan analisis kristal hasil isolasi yang dilakukan adalah: 1. Analisis Kromatografi Lapisan Tipis
2. Pengukuran titik lebur
BAB 2
TINJAUAN PUSTAKA
2.1. Tumbuhan Brotowali
2.1.1.Morfologi Tumbuhan Brotowali
Brotowali merupakan tumbuhan merambat dengan panjang mencapai 2,5 m atau lebih, biasa tumbuh liar dihutan,ladang atau ditanam dihalaman dekat pagar dan biasanya ditanam sebagai tumbuhan obat. Batang sebesar jari kelingking, berbintil- bintil rapat,dan rasanya pahit. Daun tunggal,bertangkai dan berbentuk seperti jantung atau agak membundar, berujung lancip dengan panjang 7-12 cm dan lebar 5-10 cm. Bunga kecil, berwarna hijau muda atau putih kehijauan. Brotowali menyebar merata hampir diseluruh wilayah Indonesia dan beberapa negara lain di Asia Tenggara dan India. Brotowali tumbuh baik di hutan terbuka atau semak belukar didaerah tropis. Cara perbanyakan tnaman ini sangat mudah yaitu dengan stek batang.
2.1.2. Sistematika Tumbuhan Brotowali
Dalam dunia ilmiah,brotowali diklasifikasikan sebagai berikut : Kingdom : Plantae
Divisi : Spermatophyta Class : Dicotyledon Ordo : Ranunculales Famili : Menispermaceae Genus : Tinospora
2.1.3.Manfaat dan Kandungan Kimia Tumbuhan Brotowali
Brotowali (Tinospora crispa(L.)MIERS.) merupakan tumbuhan obat dari famili menispermaceae yang serbaguna karena dapat digunakan untuk obat berbagai penyakit seperti rematrik, kencing manis, sakit kuning, dan beberapa penyakit lainnya.
Masyarakat sudah biasa mnenggunakan tanaman ini untuk pengobatan berbagai macam penyakit. Batangnya digunakan untuk pengobatan rematik, memar, demam, merangsang nafsu makan, sakit kuning, cacingan, dan batuk. Air rebusan daun brotowali dimanfaatkan untuk mencuci luka atau penyakit kulit seperti kudis dan gatal- gatal; sedangkan air rebusan daun dan batang untuk penyakit kencing manis. Seluruh bagian tanaman ini bisa digunakan untuk penyakit kolera
Banyaknya manfaat tumbuhan ini mungkin berkaitan dengan banyaknya jenis senyawa kimia yang dikandungnya, antara lain, alkaloida, damar lunak, pati, glikosida, zat pahit, pikroretin, harsa, barberin, palmatin, kolumbin, dan jatrorhize. Zat pahit pikroretin merangsang kerja urat saraf sehingga alat pernafasan dapat bekerja dengan baik. Kandungan alkaloid berberin berguna untuk membunuh bakteri pada luka. Selain itu brotowali juga bermanfaat untuk menambah nafsu makan dan menurunkan kadar gula.
Orang – orang kuno di desa – desa biasa memelihara tanaman brotowali. Tanaman yang merambat dan rasanya sangat pahit itu banyak manfaatnya terutama untuk mengobati beberapa penyakit. Dikenal juga sebagai tanaman obat, sehingga hampir semua industri jamu memiliki kebun brotowali.
Sebagai obat tradisional air rebusan batang atau ranting brotowali manjur untuk mengobati penyakit malaria, demam, penyakit kulit, serta membersihkn ginjal dan menyembuhkan luka. Batang brotowali penuh ditutupi dengan kutil dan mengandung banyak air. Rebusan batang brotowali juga merangsang kerja pernapasan dan menggiatkan pertukaran zat sehingga dapat menurunkan panas.
Kandungan berberin untuk membunuh bakteri pada luka. Kandungan bahan yang lain dimanfaatkan untuk menambah nafsu makan maupun menurunkan kadar gula darah. Batang brotowali juga digunakan untuk pengobatan penyakit kuning, kencing manis dan nyeri perut. Pada pemakaian sebagai obat luar, rendaman batang brotowali bisa digunakan untuk membersihakan luka atau kudis.
Karena rasanya yang pahit, mungkin darah pemakai brotowali juga berasa pahit. ”Terbukti nyamuk pun tak mau menggigit”, kata Albertus Soetjipto yang biasa mengkonsumsi brotowali. Ia mengaku dirumahnya kampung Manggarai, Jakarta, ia menanam brotowali hingga tumbuh subur bahkan menjalar kemana – mana sampai keatas genting.
Menanam brotowali sangatlah mudah. Hanya dengan memotong batangnya lalu ditancapkan ditanah (stek), bisa hidup. Potongan batang yang akan ditanamtidak perlu panjang, cukup satu jengkal saja bisa hidup, namun tanaman ini lebih suka ditanah yang gembur dan ada perlindungan.(www.suaramerdeka.com).
2.2.Senyawa Organik Bahan Alam
Senyawa organik bahan alam dapat diklasifikasikan berdasarkan sifat- sifat yang dimilikinya. Ada empat cara klasifikasi senyawa organik bahan alam, yaitu:
1. Klasifkasi berdasarkan Struktur Kimiawi
a. Senyawa alifatik rantai terbuka atau lemak dan minyak
Contoh : asam- asam lemak, gula dana asam- asam amino pada umumnya b. Senyawa alisiklik atau sikloalifatik
Contoh : Terpenoid, steroida c. Senyawa aromatik atau benzenoid
Contoh : Golongan fenolat, golongan kuinon d. Senyawa heterosiklik
Contoh : alkaloida, flavonoida
2. Klasifikasi Berdasarkan Sifat Fisiologik
Setelah penelitian yang lebih mendalam dilakukan terhadap morfin, penisilin dan prostaglandin, maka perhatian para ahli sering ditujukan terhadap isolasi dan penentuan fungsi fisiologis dari senyawa-senyawa organik bahan alam tertentu.
Hampir separuh dari obat-obatan yang kita gunakan sehari-hari merupakan bahan- alam, misalnya alkaloida dan antibiotik. Oleh karena itu senyawa organik bahan alam dapat juga diklasifikasikan dari segi aktivitas fisiologik dari bahan alam yang bersangkutan. Misalnya : kelas hormon, vitamin, antibiotik dan mikotoksin (racun yang dihasilkan oleh jamur). Meskipun senyawa-senyawa dalam satu kelas mempunyai struktur dan asal-usul biogenetik yang sangat bervariasi, namun ada kalanya terdapat korelasi yang dekat antara aspek-aspek tersebut dengan kegiatannya.
3. Klasifikasi Berdasarkan Taksonomi
Pengklasifikasian ini didasarkan pada penyelidikan morfologi komparatif dari tumbuh- tumbuhan yaitu taksonomi tumbuhan. Pada hewan dan sebagian mikroorganisme, metabolit terakhir biasanya dibuang keluar tubuh, sedang pada tumbuh-tumbuhan, metabolit tersimpan di dalam tubuh tumbuhan itu sendiri.
dapat diisolasi dari spesies, genus, suku atau famili tumbuhan tertentu. Malah dalam satu spesies tunggal, dapat ditemukan sejumlah konstituen yang strukturnya berhubungan erat satu sama lain. Misalnya, “opium” dari Papaver somniferum mengandung dua puluhan alkaloida termasuk alkaloida morfin, tebain, kodein dan narkotin yang kesemuanya dibiosintesis dari prekusor yaitu 1-benzilisokuinolin melalui penggandengan/coupling secara oksidasi. Oleh karena itu alkaloida - alkaloida tersebut yang strukturnya mirip satu sama lain dan berasal dari genus tumbuhan tertentu, disebut alkaloida opium.
4. Klasifikasi Berdasarkan Biogenesis
Semua konstituen tumbuhan dan binatang dibiosintesis dalam mikroorganisme melalui reaksi- reaksi yang dibantu oleh enzim tertentu. Dalam hal ini sumber utama dari karbon biasanya adalah glukosa, yang dibiosintesis dalam tumbuhan hijau atau yang diperoleh dari lingkungan dalam organisme.
Beberapa ahli mulai menyusun teori langkah-langkah biogenetik dari senyawa organik bahan alam yang berlangsung dalam mikroorganisme hidup. Basis dari teori ini adalah keteraturan struktural yang teramati sejak awal sampai akhir reaksi. Teori yang paling menonjol adalah “aturan isoprena” yang diusulkan oleh Ruzicka. Dia menyatakan semua senyawa terpenoid terbentuk dari “unit isoprena” C5.
Dari kesemua teori biogenesis ini dapat disimpulkan adanya 4 kelas senyawa organik bahan alam, yakni :
(a) Poliketida (asetogenin) (b) Fenolat (fenilpropanoid) (c) Isoprenoid
2.2.1. Senyawa Alkaloida
Alkaloida adalah senyawa organik yang mengandung nitrogen (biasanya dalam bentuk siklik) dan bersifat basa. Senyawa ini tersebar luas dalam dunia tumbuh- tumbuhan dan banyak diantaranya yang mempunyai efek fisiologi yang kuat. Beberapa dari efek tersebut telah dikenal dan dimanfaatkan oleh manusia primitif jauh sebelum ilmu kimia organik berkembang.
Alkaloida “Cinchona” yang terkandung dalam kulit pohon Cinchona dan Remijia misalnya telah dikenal oleh penduduk asli di pegunungan Andes. Quinin yang merupakan salah satu konstituen utama dari ekstrak kulit kayu dilaporkan telah dikenal sebagai anti malaria yang efektif sejak tahun 1633. Karena banyaknya senyawa alkaloida serta keterkaitannya dengan bidang lain seperti farmasi, sebenarnya dunia alkaloida memerlukan satu bidang tersendiri (Tobing,1989).
Sejak dahulu kala alkaloida telah digunakan dalam berbagai hal. Kebanyakan alkaloida digunakan sebagai suatu zat beracun yang dapat menyebabkan kematian seperti strysin. Strysin telah digunakan sebagai suatu zat pembunuh selama beberapa abad dan juga merupakan suatu zat yang menyebabkan kematian pada beberapa jenis unggas. Strysin merupakan suatu zat yang dapat merusak sel-sel tubuh yang lama-kelamaan dapat menyebabkan kematian. Koniin didalam Conium maculatum digunakan oleh orang-orang Yunani untuk hukuman eksekusi, dan Sokrates adalah pemimpin Yunani yang sering menggunakannya. Beberapa alkaloida dapat menyebabkan halusinasi seperti grup opium di dalam Papaver somniferum, turunan-turunan dari asam lisergis dalam tumbuhan Claviceps purpurea, sebuah tumbuhan parasit ( Torssell, 1983 ).
dan alkaloida yang berwarnapun langka (Berberina dan Terpentina berwarna kuning). Alkaloida sering bersifat aktif optik, dan biasanya hanya satu dari isomer optik yang dijumpai di alam, meskipun dalam beberapa hal dikenal campuran rasemat, dan pada kasus lain satu tumbuhan mengandung satu isomer sementara tumbuhan lain mengandung enantiomernya.
Fungsi dari alkaloida belum dapat dipastikan dengan baik untuk beberapa jenis alkaloida, walaupun telah kita ketahui bahwa turunan - turunan dari pirimidin, purin dan pterin memainkan peranan yang sangat baik dalam proses kehidupan manusia. Semua alkaloida dapat dibuat dari poliketida asam sikimat atau bagian dari senyawa asam mevalonat yang digabung dengan asam amino, yang secara otomatis dapat memberikan sebuah sistematisasi yang tinggi secara rumus dan struktural yang akan menghasilkan suatu senyawa.
Dengan kata lainnya, komponen asam amino membentuk karakter dari alkaloida dan klasifikasinya dapat dibuat dengan baik berdasarkan bentuk morfologinya. Alkaloida juga digunakan sebagai penyebab proses solusi dan biogenetik dibandingkan dengan beberapa jenis asam amino yang merupakan pembentuk alkaloida, seperti glisin (di dalam pembentuk N-heterosiklik), asam glutamat, ornitin, lisin, fenilalanin, tirosin, triptofan dan asam antralin. Kebanyakan alkaloida dapat ditemukan di dalam segala jenis tumbuhan, dari tumbuhan tingkat tinggi sampai ke mikroorganisme. Beberapa alkaloida dapat ditemukan dalam hewan, dan alkaloida juga dapat ditemukan di dalam biota laut ( Robinson, 1995 ).
2.2.2.Klasifikasi alkaloida
(a) Alkaloida Sesungguhnya.
Alkaloida sesungguhnya adalah racun, senyawa tersebut menunjukkan aktivitas fisiologi yang luas, hampir tanpa terkecuali bersifat basa, lazim mengandung nitrogen dalam cincin heterosiklis, diturunkan dari asam amino, biasanya terdapat dalam tanaman sebagai garam organik. Beberapa pengecualian terhadap aturan tersebut adalah kolkhisin dan asam aristolokhat yang bersifat bukan basa dan tidak memiliki cincin heterosiklis dan alkaloida kuartener, yang bersifat agak asam.
(b) Protoalkaloida
Protoalkaloida merupakan amin yang relatif sederhana dalam mana nitrogen asam amino tidak terdapat dalam cincin heterosiklis. Protoalkaloida diperoleh berdasarkan biosintesis dari asam amino yang bersifat basa. Pengertian amin biologis sering digunakan untuk kelompok ini. Contoh adalah meskalin, efedrin , dan N, N-dimetiltriptamin .
(c) Pseudoalkaloida
Pseudoalkaloida tidak diturunkan dari prekursor asam amino. Senyawa biasanya bersifat basa. Ada dua seri alkaloida yang penting dalam kelas ini, yaitu alkaloida stereoidal (konessin, purin dan kaffein ). ( Sastrohamijojo, 1996).
Senyawa alkaloid dapat diklasifikasikan dari segi sumber atau dari segi gugus fungsi yang dikandungnya. Klasifikasi berdasarkan gugus fungsi adalah sebagai berikut:
1. Alkaloida feniletilamin, misalnya efedrin, dimana struktur dasar alkaloida feniletilamin yaitu:
NH2
2. Alkaloida pirolidin, misalnya higrin dari koka. Struktur dasar alkaloida pirolidin yaitu:
N
3. Alkaloida piridin, misalnya asam nikotinat. Struktur dasar alkaloida piridin yaitu:
N
4. Alkaloida perpaduan pirolidin dan piridin, misalnya nikotin. Struktur dasar alkaloida pirolidin yaitu:
N
N
5. Alkaloida kuinolin, misalnya kinin. Struktur dasar alkaloida kuinolin yaitu:
N
6. Alkaloida isokuinolin, misalnya papaverin. Struktur dasar alkaloida isokuinolin yaitu:
N
7. Alkaloida fenantren, misalnya morfin. Struktur dasar alkaloida fenantren yaitu:
N CH3
8. Alkaloida indole yang masih dapat digolong- golongkan menjadi: a. Alkaloida sederhana, misalnya triptamin
b. Alkaloida ergot, misalnya serotonin c. Alkaloida Harmala, misalnya ß-karbolin d. Alkaloida Yohimbe, misalnya reserpin
e. Alkaloida Strychnos, misalnya brusin dan striknin. (Tobing, 1989).
Ada juga yang mengklasifikasikan alkaloid berdasarkan bentuk inti dari molekulnya yeng terdapat di alam, terbagi atas beberapa kelompok, yaitu :
1. Kelompok Feniletilamin 2. Kelompok Pirolidin 3. Kelompok piridin 1. Kelompok quinolin 5. Kelompok isoquinolin 6. Kelompok pirrolidin- piridin
7. Kelompok penantren (Finar,1983)
Dari beberapa alkaloida yang telah ditemukan, kita dapat melihat letak dari atom Nitrogen yang membuat alkaloida bersifat basa. Ada beberapa alkaloida yang
1. Alkaloida Heterosiklik, dimana pada alkaloida jenis ini atom Nitrogen berada pada cincin hetrosikliknya. Contohnya: Alkaloida pirolidin, Alkaloida indole, Alkaloida Piperidine, alkaloida pyridine, alkaloida Tropane, Histiane, Imidazole dan juga alkaloida isokuinolin.
2. Alkaloida dengan atom Nitrogen eksosiklik (atom Nitrogen berada diluar cincin heterosiklis dan alkaloida Spermine). Contohnya: Casseine, Epehedrine, Capsaicine, Uvariosamine.
3. Alkaloida Putrescina, Alkaloida Spermidina dan Alkaloida Spermine, ketiga jenis alkaloida ini merupakan amina biogenetik, akan tetapi turunan-turunannya (kebanyakan mengandung residu asam lemak atau asam sinamat) merupakan suatu alkaloida. Contohnya Paucino yang merupakan turunan dari Pentaclethra sp, dan Inandenine yang merupakan turunan dari Oncinotis sp
4. Alkaloida peptide, merupakan suatu bagian grup peptide yang bersifat basa, yang telah dianggap merupakan suatu jenis alkaloida, misalnya ergot, integerrine, yang mengandung asam amino triptopan.
5. Alkaloida diterpen, dimana alkaloida monoterpen dan seskuiterpen telah dianggap sebagai alkaloida pirolidin, pipridine. Contoh alkaloida diterpen adalah Veatchine, Atisine, Aeonitine, Heteratisine.
6. Alkaloida Steroidal, merupakan jenis alkaloida dengan bentuk cincin seperti steroida dengan atom Nitrogen yang bergabung. Alkaloida steroidal dapat berada baik pada hewan ataupun tumbuh-tumbuhan. Samandarino merupakan alkaloida yang berasal dari hewan. Contoh alkaloida steroidaal yaitu : Paravallarine, Terminaline, Conessine, Solasodine ( Manfred, 1995) .
Berdasarkan biogenetiknya, senyawa – senyawa alkaloida dapat diklasifikasikan menjadi :
1. Alisiklik alkaloida, terdiri dari : - Lupinin alkaloida
- Tropane alkaloida
- Morfin
- Amarilis alkaloida 3. Indole Alkaloida, terdiri dari :
- Caly canthin - Quinin - Vindolin
-Ajmalin dan Mitrphilin - Reserpin
- Ibogaine
Dari klasifikasi diatas dapat disimpulkan bahwa belum ada keseragaman dalam pengklsifikasian senyawa alkaloida (Hendrikson,1965).
2.2.3.Sifat- Sifat Alkaloida
Alkaloida sebagai golongan dibedakan dari sebagian besar komponen tumbuhan lain berdasarkan sifat basanya (kation). Oleh karena itu senyawa ini biasanya terdapat dalam tumbuhan sebagai garam berbagai asam organik dan sering ditangani di laboratorium sebagai garam dengan asam hidroklorida dan asam sulfat. Garam ini dan alkaloid bebas yang terdapat di alam, berupa senyawa padat berbentuk kristal tidak berwarna. Ada beberapa alkaloid berupa cairan dan ada juga alkaloid yang berwarna yaitu berberina dan serpentina berwarna kuning. Alkaloid pada umumnya bersifat optis aktif, dan biasanya hanya satu dari isomer optik alkaloid yang dijumpai di alam, meskipun dalam beberapa kasus dikenal campuran rasemat; dan pada kasus lain satu tumbuhan mengandung satu isomer sementara tumbuhan lain mengandung enantiomernya (Robinson,1995).
Secara umum, golongan senyawa alkaloida mempunyai sifat-sifat sebagai berikut :
2. Bersifat basa; pada umumnya berasa pahit, bersifat racun, mempunyai efek. 3. Dapat membentuk endapan dengan larutan asam fosfowolframat, asam
fosfomolibdat, asam pikrat, kalium merkuriiodida dan lain sebagainya. Dari endapan-endapan ini, banyak juga yang memiliki bentuk kristal yang khusus sehingga sangat bermanfaat dalam identifikasinya (Tobing,1989)
2.2.4. Identifikasi, isolasi dan pemurnian alkaloida
2.2.4.1.Identifikasi alkaloida
Karena secara kimia alkaloida begitu heterogen dan begitu banyak, maka tidak dapat diidentifikasi dalam ekstrak tumbuhan dengan menggunakan kromatografi tunggal. Pada umumnya sukar mengidentifikasi alkaloida dari sumber tumbuhan baru tanpa mengetahui kira-kira jenis alkaloida apa yang mungkin ditemukan dalam tumbuhan tersebut.
Di samping itu, karena kelarutan dan sifat alkaloida sangat berbeda-beda, cara penyaringan umum untuk alkaloida dalam tumbuhan mungkin tidak akan berhasil mendeteksi senyawa khas.
Metode yang banyak digunakan untuk mendeteksi tanaman yang mengandung alkaloida yaitu prosedur Wall, yang meliputi ekstraksi sekitar 20 gram bahan kering yang direfluks dengan etnol 80 %. Kumpulan filtrat diuapkan, residunya dilarutkan dengan air, disaring kemudian diasamkan dengan HCl 1 %. Lalu diuji dengan pereksi Meyer atau dengan silikotungstat. Bila hasil positif larutan tersebut dibasakan dan diekstraksi dengan pelarut organik dan diekstraksi kembali kedalam larutan asam. Jika larutan asam ini menghasilkan endapan dengan pereksi alkaloida berarti tanaman ini mengandung alkaloida. Fasa berair juga harus diteliti untuk menetukan adanya alkaloid kuartener.
Metode lain yaitu Kiang – Douglas, dimana bahan tanaman kering diubah menjadi basa bebas dengan larutan amonia. Hasil yang diperoleh diekstraksi dengan kloroform. Ekstrak dipekatkan dan diasamkan dengan cara menambahkan HCl 2 N. Filtratnya diuji dengan pereksi alkaloida yaitu pereaksi Meyer, Wagner, Dragendorf, dan Bouchardat. Perkiraaan kandungan alkaloida yang potensial dapat diperoleh dengan menggunakan larutan encer standard alkaloida. (Geoffrey,1981)
Pereaksi deteksi yang paling umum dipakai untuk menyemprot kromatogram pereaksi ini beberapa nonalkaloid meskipun kepekaan terhadap alkaloid sekitar sepuluh kalinya, beberapa pereaksi lain untuk mendeteksi alkaloid adalah flouresamina dan 7,7,8,8-tetra sianokuinondimetana. Keuntungannya adalah bahwa pereaksi ini bereaksi secara berlainan dengan jenis struktur yang berbeda. Alkaloid yang mengandung gugus fenol dapat dideteksi dengan pereaksi khusus fenol. (Robinson, T . 1995)
2.2.4.2.Isolasi senyawa alkaloida
Senyawa alkaloida dapat diisolasi dalam larutan asam berair ( umumnya asam hidroklorida, sitrat, atau tartarat ) dan komponen netral atau bersifat asam, yang dipisahkan dengan ekstraksi pelarut. Setelah larutan berair dibasakan, maka alkaloida yang diperoleh dapat diekstraksi dengan pelarut yang sesuai.
Metode lain yang umum digunakan untuk mengekstraksi yaitu dengn penambahan amonia pada bahan tanaman,untuk mengubah garam alkaloida menjadi basa bebas yang kemudian diekstraksi dengan pelarut organik yang cocok. Setiap alkaloida kuartener yang terdapat pada bahan tanaman dapat dipisahkan dengan cara ini, tapi dengan cara mengekstraksinya dengan alkohol.(Geoffrey,1981)
Pada umumnya alkaloid diekstraksi dari tumbuhan/ sumbernya melalui proses sebagai berikut:
1. Tumbuhan (daun, bunga, buah, kulit dan/atau akar) dikeringkan, lalu dihaluskan 2. Alkaloid diekstraksikan dengan pelarut tertentu, misalnya dengan etanol,
kemudian pelarutnya diuapkan.
3. Residu yang diperoleh diberi asam anorganik untuk menghasilkan garam ammonium kuartener; kemudian diekstraksikan kembali
4. Garam N+
5. Campuran alkaloid- alkaloid yang diperoleh akhirnya diisolasi melalui berbagai cara, misalnya dengan metode kromatografi.
yang diperoleh direaksikan dnegan Natrium Karbonat (sehingga menghasilkan alkaloid- alkaloid yang bebas) kemudian diekstraksi dengan pelarut tertentu seperti eter, kloroform atau pelarut lainnya.
Sebagaimana telah dikemukakan, alkaloid diperoleh dari tumbuh- tumbuhan namun, ada juga yang dibuat sintesis, misalnya efedrin dan papaverin.
Isolasi alkaloida menurut metode Hess
Sampel tumbuh – tumbuhan dikeringkan dan dihaluskan, kemudian diekstraksi dengan eter selama tiga hari dalam alat soklet, lalu endapan alkaloida dilarutkan dengan amonia.
Endapan diekstraksi lagi dengan pelarut lain misalnya kloroform, kemudian dipisahkan melalui kromatografi kolom dengan adsorben silika gel dan benzen – kloroform sebagai pengelusi.
Isolasi alkaloida menurut metode BT. Cromwell
Sampel tumbuh – tumbuhan dikeringkan dan dihaluskan, kemudian diekstraksi dengan HCl 0,2 M dalam etanol, biarkan kira – kira 10 jam pada temperatur 60 0C, kemudian saring dalam keadaan panas, ampas dicuci kembali dengan pelarut yang sama sampai menunjukkan test negatif terhadap pereaksi alkaloida.
Ekstrak yang diperoleh didinginkan dan dibiarkan selama 12 jam, kemudian disaring dan filtrat yang diperoleh ditambahkan NH4OH(p) sampai pH 10, kemudian didinginkan selama 24 jam pada temperatur kamar.
Endapan dipisahkan kemudian dilarutkan dalam kloroform lalu disaring. Ekstrak yang diperoleh dipekatkan dan residunya dipisahkan untuk memperoleh alkaloida dengan kromatografi.
Isolasi alkaloida menurut metode Harborne
Sampel tumbuh – tumbuhan dikeringakn dan dihaluskan, kemudian diekstraksi dengan pelarut metanol panas sampai menunjukkan test .negatif terhadap pereaksi alkaloida.
Serbuk kering yang diperoleh diekstraksi kembali dengan kloroform, kemudian ditest dengan pereaksi alkaloida. Ekstrak kloroform dipekatkan dengan alat rotavapor sehingga diperoleh residu. Residu direkristalisasi sehingga diperoleh senyawa
alkaloida.(Harborne,1987)
2.2.4.3.Pemurnian senyawa alkaloida
Ekstrak alkaloida kompleks yang masih kotor dipisahkan menjadi komponen – komponennya. Sejumlah metode konvensional dipakai untuk memurnikan campuran alkaloida, hal ini tergantung pada campuran alkaloida yang diperoleh.
a. Kristalisasi langsung
Meskipun cara ini cukup sederhana, tetapi jarang memberikan hasil yang memuaskan untuk pemisahan alkaloida murni, kecuali bila suatu alkaloida yang terdapat dalam bahan tidak larut. Beberapa kombinasi pelarut yang sering digunakan untuk kristalisasi alkaloida meliputi metanol, etanol berair, metanol – kloroform, metanol – eter, metnol – aseton, dan etanol – aseton.
b. Metode gradien pH
2.2.5.Biosintesis alkaloida
Prekusor alkaloid yang paling umum adalah asam amino, meskipun sebenarnya, biosintesis alkaloid lebih rumit. Secara kimia, alkaloid merupakan suatu golongan heterogen. Ia berkisar dari senyawa sederhana seperti koniina, yaitu alkaloid utama. Conium maculatum, sampai ke struktur pentasiklik seperti strikhnina, yaitu racun kulit Strychnos. Amina tumbuhan (misalnya meskalina) dan basa purina dan pirimidina (misalnya kafeina) kadang- kadang digolongkan sebagai alkaloid dalam arti umum, (Manito,1992).
Banyak alkaloid bersifat terpenoid dan beberapa diantaranya (misalnya solanina, alkaloid-steroid kentang, Solanum Tuberosum) sebaiknya ditinjau dari segi biosintesis sebagai terpenoid termodifikasi. Yang lainnya terutama berupa senyawa aromatik (misalnya kolkhisina, alkaloid-tropolon umbi ‘crocus musim gugur’) yang mengandung gugus basa sebagai gugus rantai samping. Banyak sekali alkaloid yang khas pada suatu suku tumbuhan atau beberapa tumbuhan sekerabat. Jadi, nama alkaloid sering kali diturunkan dari sumber tumbuhan penghasilnya, misalnya alkaloid Atropa atau alkaloid tropana dan sebagainya. (Harborne,1987)
2.3.Metode Pemisahan
2.3.1.Kromatografi
pita bewarna itu maka dia mengusulkan nama kromatografi yang berasal dari bahasa Yunani kromatos yang berarti warna dan graphos yang berarti menulis. (Sudjadi, 1986 ).
Berbagai metode kromatografi memberikan cara pemisahan paling kuat di laboratorium kimia. Gagasan dasarnya sederhana untuk dipahami, mulai dari cara yang sederhana sampai yang agak rumit dari segi kerja dan peralatan, metode ini dapat dipakai untuk setiap jenis senyawa. Kata kromatografi mengandung makna warna namun tidak ada hubungannya langsung karena senyawa pertama yang dipisahkan dengan cara ini adalah pigmen hijau tumbuhan.
Metode kromatografi, karena pemanfaatannya yang leluasa, dipakai secara luas untuk pemisahan analitik dan preparatif. Hampir setiap campuran kimia, mulai dari bobot molekul rendah sampai tinggi, dapat dipisahkan menjadi komponen-komponennya dengan beberapa metode kromatgrafi. Jenis pemisahan analitik atau preparatif, tidak ditentukan oleh ukuran cuplikan, melainkan lebih oleh keperluan khusus. Biasanya kromatografi analitik dipakai pada tahap permulaan untuk semua cuplikan, dan kromatografi preparatif hanya dilakukan jika diperlukan fraksi murni dari campuran.
Pemisahan secara kromatografi dilakukan dengan cara mengotak-atik langsung beberapa sifat fisika umum dari molekul. Sifat utama yang terlibat adalah:
1. Kecenderungan molekul untuk melarut dalam cairan (kelarutan)
2. Kecenderungan molekul untuk melekat pada permukaan serbuk halus (adsorbsi, penjerapan)
3. Kecenderungan molekul untuk menguap atau berubah ke keadaan uap (keatsirian)
Ada beberapa cara dalam mengelompokkan teknik kromatografi. Kebanyakan berdasarkan pada macam fasa yang digunakan (fasa gerak-fasa diam), misalnya kromatografi gas dan kromatografi cairan. Cara pengelompokan lainnya berdasarkan mekanisme yang membuat distribusi fasa. Disini metoda kromatografi sebagian dikelompokkan berdasarkan macam fasa yang digunakan dan sebagian lain berdasarkan pada mekanisme pada distribusi fasa.
Kromatografi cairan-padat atau kromatografi serapan, ditemukan oleh Tswett dan dikenalkan kembali oleh Khun dan Lederer pada 1931, telah digunakan sangat luas untuk analisis organik dan biokima. Pada umumnya sebagai isi kolom adalah silika gel atau alumina, yang mempunyai angka banding luas permukaan terhadap volume sangat besar. Sayangnya hanya ada beberapa bahan penyerap, maka pemilihannya sangat terbatas. Keterbatasan yang lebih nyata pada kenyataan bahwa koefisien distribusi untuk serapan kerap kali tergantung pada kadar total. Hal ini akan menyebabkan pemisahan tidak sempurna.
Kromatografi cairan-cairan atau kromatografi partisi, dikenalkan oleh Martin dan Synge pada 1941, dan kemudian mendapatkan hadiah Nobel untuk itu. Fasa diam terdiri atas lapisan tipis cairan yang melapisi permukaan dari padatan inert yang berpori-pori. Ada banyak macam kombinasi cairan yang dapat digunakan sehingga metode ini sangat berguna. Lebih lanjut, koefisien distribusi sistem ini lebih tidak tergantung pada kadar, memberikan pemisahan yang lebih tajam.
Kromatografi gas-padat, digunakan sebelum tahun 1800 untuk memurnikan gas. Pada waktu dulu teknik ini tidak berkembang karena keterbatasannya yang sama seperti halnya kromatografi cairan-padat, tetapi penelitian lebih lanjut dengan macam fasa padat baru memperluas penggunaan teknik ini.
adalah bahan cuplikan harus mempunyai tekanan uap paling tidak beberapa torr pada suhu kolom. Sistem ini sangat baik sehingga dapat dikatakan sebagai metoda pilihan dalam kromatografi karena dapat memisahkan dengan cepat dan peka ( Sudjadi, 1986 ).
Kromatografi adalah suatu tekhnik pemisahan tertentu dengan menggunakan dua fasa yaitu fasa diam dan fasa gerak. Pemisahan tergantung pada gerakan relatif dari dua fasa ini. Cara- cara kromatografi dapat digolongkan sesuai dengan sifat- sifat dari fasa gerak, yang dapat berupa zat padat atau zat cair. Jika fasa tetap berupa zat padat maka cara tersebut dikenal sebagai kromatografi serapan (absorption chromatography) dan jika zat cair maka kromatografi tersebut dikenal dengan kromatografi partisi (partition chromatography).
Berbagai metode kromatografi memberikan cara pemisahan paling kuat di laboratorium kimia. Gagasan dasarnya sederhana untuk dipahami; caranya beragam, mulai dari cara yang sederhana sampai yang agak rumit dari segi kerja dan peralatan, dan metode ini dapat dipakai untuk setiap jenis senyawa (Sastrohamidjojo,1985).
2.3.1.1. Kromatografi Kertas
Satu keuntungan utama kromatografi kertas ialah kemudahan dan kesederhanaannya pada pelaksanaan pemisahan, yaitu hanya pada lembaran kertas saring yang berlaku sebagai medium pemisahan dan juga penyangga. Keuntungan lain ialah keterulangan bilangan Rf yang besar pada kertas sehingga penggukuran Rf merupakan parameter yang berharga dalam memaparkan senyawa tumbuhan baru.
guna dan dapat digunakan untuk memisahkan purina dan pirimidina biasa, dan secara umum dapat dipakai juga untuk senyawa fenol dan glikosida tumbuhan. (Harbone,1987).
2.3.1.2.Kromatografi Lapisan Tipis
Kromatografi lapis tipis merupakan pemisahan komponen komponen berdasrkan adsorpsi atau partisi oleh fasa diam dibawah gerakan pelarut pengembang atau pelarut pengembang campuran. Pemilihan pelarut pengembang atau pelarut pengembang campuran sangat dipengaruhi oleh macam polaritas zat – zat kimia yang dipissahkan. Fasa diam yang umum dan banyak dipakai adalah silika gel yang dicampur dengan CaSO4 untuk menambah daya lengket partikel silika gel.(Mulja,1995)
Teknik ini dikembangkan tahun 1939 oleh Ismailoff dan Schraiber. Adsorbent dilapiskan pada lempeng kaca yang bertindak sebagai penunjang fasa diam. Fasa bergerak akan merayap sepanjang fasa diam dan terbentuklah kromatogram. Biasanya yang sering digunakan sebagai materi pelapisnya adaqlah silika gel, tetapi kadangkala bubuk selulosa dan tanah diatomae, kieselguhr dapat juga digunakan. Pemilihan sistem pelarut dan komposisi lapisan tipis ditentukan oleh prinsip kromatografi yang akan digunakan. Sampel diteteskan pada salah satu bagian tepi plat kromatografi (sebanyak 0,01 - 10µg zat).
Zat-zat bewarna dapat terlihat langsung, tetapi dapat juga digunakan reagen penyemprot untuk melihat bercak suatu noda. Untuk menempatkan posisi suatu zat, reagen dapat juga disemprotkan pada bagian tepi saja. Bagian yang lain dapat diperoleh kembali tanpa pengotoran dari reagen dengan pengerokan setelah pemisahan selesai. Aplikasi KLT sangatlah luas. Senyawa-senyawa yang tidak mudah menguap serta terlalu labil untuk kromatografi cair dapat dianalisis dengan KLT ( Khopkar, 2002 ).
dan preparatif. Kedua dipakai untuk menjajaki sistem pelarut dan sistem penyangga yang akan dipakai dalam kromatografi kolom atau kromatografi cair kinerja tinggi.
Pada hakikatnya Kromatografi Lapisan Tipis melibatkan dua peubah: sifat fasa diam atau sifat lapisan dan sifat fase gerak atau campuran pelarut pengembang. Fasa diam dapat berupa serbuk halus yang berfungsi sebagai permukaan penyerap (kromatografi cair-padat) atau berfungsi sebagai penyangga untuk lapisan zat cair (kromatografi cair- cair). Fasa diam pada KLT sering disebut penyerap, walaupun sering berfungsi sebagai penyangga untuk lapisan zat cair di dalam sistem kromatografi cair- cair. Hampir segala macam serbuk dapat dipakai sebagai penyerap pada KLT, yaitu: silika gel (asam silikat), alumina (aluminium oksida), kiselgur (tanah diatome), dan selulosa. Fasa gerak dapat berupa hampir segala macam pelarut atau campuran pelarut. (Gritter,1991)
Pelarut-pelarut
Pemilihan pertama dari pelarut ialah bagaimana sifat kelarutnnya. Tetapi sering lebih baik untuk memilih suatu pelarut yang tak tergantung daripada kekeuatan elusi sehingga zat-zat elusi yang lebih kuat dapat dicoba. Yang dimaksud dengan kekuatan dari zat elusi adalah daya penyerapan pada penyerap dalam kolom. Biasanya untuk penyerap-penyerap yang polar seperti alumina dan silika gel, maka kekuatan penyerap naik dengan kenaikan polaritas dari zat yang diserap. Menurut TRAPPE, kekuatan elusi dari dari deret-deret pelarut untuk senyawa-senyawa dalam kolm dengan menggunakan silika gel akan diturunkan dalam urutan sebagai berikut : airmurni < metanol < etanol < propanol < aseton < etil-asetat < dietil-eter < kloroform < metilena klorida < benzena < toluena < trikloroetilena < karbontetraklorida < sikloheksana < heksana.
Urutan ini adalah dari kenaikan polaritas atau penurunan panjang rantai dari homolog. Sedangkan untuk alumina dan silika gel urutannya ada sebaliknya. Kemurnian dari pelarut-pelarut harus setinggi mungkin.
Kemungkinan yang paling populer dan biasanya digunakan sebagai penyerap adalah alumina, tetapi hal ini tak berarti bahwa yang lain tak dapat digunakan.
Suatu pengertian yang digunakan dalam hubungannya dengan penyerap-penyerap adalah aktifas. Kadang-kadang ia dihubungkan dengan luas permukaaan spesifik dari zat padat, yaitu luas permukaan yang diukur dalam meter persegi tiap gram, dalam hal karbon, silika gel dan alumina dapat dibuat menjadi menjadi aktif dengan memiliki permukaan spesifik beratus-ratus meter persegi.
Sedangkan seperti kalsium karbonat dan kalsium hidroksida, mempunyai permukaan spesifik yang mempunyai ukuran dalam puluhan meter persegi atau kurang sehingga mereka dikategorikan relatif tak aktif. Pada keadaan lain, pengertian ”aktifitas” sering digunakan untuk menyatakan kekuatan dari serapan dan ini yang biasa digunakan dalam kromatografi. Aktifitas kromatografi adalah spesifik yang mempunyai pengertian zat padat dengan luas permukaan yang besar menyerap dengan kuat. Telah diketahui bahwa kekuatan serapan dari gugus polar pada senyawa-senyawa polar naik dalam urutan :
-COOR, = C = 0, -NH2
Banyak penyerap seperti alumina, silika gel, karbon aktif, dan magnesium silikat dapat diperoleh dalam perdagangan. Mereka sering memerlukan aktivasi sebelum dipakai; hal ini dapat dikerjakan dengan pemanasan, mungkin dengan pengurangan tekanan. Suhu optimum untuk aktvasi aluminium biasanya sekitar 400
, -OH, -COOH.
o
Zat-zat aktif yang digunakan sebagai penyerap dalam kromatografi kolom merupakan katalisator yang baik; ini merupakan bahaya yang perlu mendapat perhatian. Alumina, terutama bila bersifat alkali, sering menyebabkan perubahan kimia dan menimbulkan reaksi-reaksi; sebagai misal, ia dapat menyebabkan kondensasi dari aldehida-aldehida dan keton-keton, hingga bila hal ini terjadi, maka harus menggunakan alumina yang bersifat netral. Silika gel dapat menyebabkan isomerisasi dari berbagai
senyawa-senyawa seperti terpen dan sterol (Sastrohamidjojo, 1985). 2.3.1.3.Kromatografi Kolom
Ada empat jenis kromatografi yang dapat dimasukkan dalam kromatografi kolom, yaitu kromatografi adsorbsi, kromatografi pertukaran ion, kromatografi partisi, dan kromatografi filtrasi gel. Secara umum dapat digambarkan,bahwa kromatografi tersebut dilaksanakan dalam suatu kolom yang diisi dengan fase stasioner yang porous. Cairan dipakai sebagai fase mobil untuk mengelusi komponen sampel keluar melalui kolom.
Dalam kromatografi adsorbsi, komponen yang dipisahkan secara selektif teradsorbsi pada permukaan adsorben yang dipakai untuk bahan isian kolom. Dalam kromatografi partisi komponen yang dipisahkan secara selektif mengalami partisi antara lapisan cairan tipis pada penyangga padat yang bertindak sebagai fase stasioner dan eluen yang bertindak sebagai fase gerak. Kromatografi pertukaran ion memisahkan komponen yang berbentuk ion. Komponen-komponen ion tersebut yang terikat pada penukar ion sebagai fase stasioner secara selektif akan terlepas atau terelusi oleh fase gerak. Dalam kromatografi filtrasi gel, kolom diisi dengan gel yang permiabel sebagai fase stasioner. Pemisahan berlangsung seperti proses pengayakan, yang didasarkan atas ukuran molekul dari komponen yang dipisahkan. (Adnan,1997)
Pada kromatografi kolom, campuran yang akan dipisahkan diletakkan berupa pita pada bagian atas kolom penyerap yang berada dalam tabung kaca, tabung logam atau bahkan tabung plastik. Pelarut (fasa gerak) dibiarkan mengalir melalui kolom karena aliran yang disebabkan oleh gaya berat atau didorong oleh tekanan. Pita senyawa linarut bergerak melalui kolom dengan laju yang berbeda, memisah dan dikumpulkan berupa fraksi ketika keluar dari alas kolom.
Ada empat perubahan utama yang dilakukan pada cara kolom klasik. Pertama dipakai penyerap yang lebih halus dengan kisaran ukuran mesh lebih sempit, agar tercipta kesetimbangan yang lebih baik di dalam sistem. Kedua sistem tekanan biasanya pompa mekanis, dipakai untuk mendorong pelarut melalui penyerap yang halus. Ini perlu karena ukuran partikel kecil, tetapi pompa itu juga menyebabkan kromatografi lebih cepat, jadi memperkecil difusi. Ketiga detektor telah dikembangkan sehingga diperoleh analisis senyawa yang bersinambungan ketika senyawa itu keluar dari kolom. Data analisi ini dapat dipakai untuk membagi- bagi fraksi ketika keluar, dan jika diperlakukan dengan tepat, dapat memberikan data kuantitatif mengenai banyaknya senyawa yang ada. Akhirnya penyerap baru dan cara pengemasan kolom baru dikembangkan sehingga memungkinkan derajat daya pisah yang tinggi tercapai. ( Gritter, 1991 ).
Pemilihan pertama dari pelarut untuk kromatografi kolom ialah bagaimana sifat kelarutannya. Tetapi lebih baik untuk memilih suatu pelarut bergantung pada kekuatan elusinya sehingga zat – zat elusi yang lebih kuat dapat dicoba. Yang dimaksudkan dengan kekuatan elusi ialah daya penyerapan pada penyerap dalam kolom. Biasanya pada penyerap – penyerap yang polar seperti alumina dan silika gel, maka kekuatan penyerapan baik dengan naiknya polaritas zat yang diserap. Menurut TRAPPE, kekuatan elusi dari deret – deret pelarut untuk senyawa – senyawa elusi dalam kolom dengan menggunakan silika gel akan diturunkan dalam urutan sebagai berikut.
Air murni, methanol, etanol, propanol, aseton, etil asetat, dietil eter, kloroform, metilena klorida, benzene, toluene, trikloroetilena, karbon tetraklorida, sikloheksana, heksana.(Stahl,1990).
2.4. Teknik Spektroskopi
Spektroskopi adalah studi mengenai interaksi cahaya dengan atom dan molekul. Radiasi cahaya atau elektromagnet dapat menyerupai gelombang. Beberapa sifat fisika cahaya paling baik diterangkan dengan ciri gelombangnya, sedangkan sifat lain diterangkan dengan sifat partikel. (Creswell,1982).
Pada zaman awal kimia organik, penetapan struktur senyawa baru sering merupakan tugas yang berat. Tetapi sejak tahun 1940-an, munculnya bermacam-macam jenis spektroskopi sangat membantu menyederhanakan masalah ini. Metode spektroskopi mempunyai banyak keuntungan. Biasanya hanya diperlukan sejumlah kecil untuk analisis. Dan kadang-kadang jumlah itupun dapat diperoleh kembali (tidak musnah atau rusak). Pengerjaannya cepat, biasanya hanya diperlukan beberapa menit saja. Sering sekali diperoleh informasi struktur yang lebih banyak dari spektra dibandingkan dengan metode laboratorium biasa. (Hart,Harold.1983).
Informasi Spektroskopi Inframerah menunjukkan tipe-tipe dari adanya gugus fungsi dalam satu molekul, Resonansi Magnet Inti yang memberikan informasi tentang bilangan dari setiap tipe dari atom hidrogen. Ini juga memberikan informasi yang menyatakan tentang alam serta lingkungan dari setiap tipe dari atom hidrogen. Kombinasinya dan data yang ada kadang-kadang menentukan struktur yang lengkap dari molekul yang tidak diketahui. ( Pavia, 1979 ).
2.4.1. Spektrofotometri Inframerah ( FT-IR )
Spektrum infra merah suatu senyawa memberikan gambaran menegenai berbagai gugus fungsional dalam sebuah molekul organik, tetapi hanya memberikan petunjuk mengenai bagian hidrokarbon molekul.
merah atau infra red spectroscopy (IR) berkisar pada bilangan gelombang 12800 – 10 cm-1
Umumnya daerah radiasi IR terbagi dalam daerah atau pada panang gelombang 0,78 – 1000 m.
a. IR dekat (12800 – 4000 cm-1 ; 3,8 – 1,2 x 1014
daerah yang paling banyak digunakan untuk berbagai keperluan praktis adalah daerah IR tengah.
Hz ; 50 – 1000 m)
Spektrum inframerah suatu molekul adalah hasil transisi antara tingkat energi getaran yang berlainan. Pancaran inframerah yang kerapatannya kurang dari 100 cm-1 (panjang gelombang lebih daripada 100 µm) diserap oleh sebuah molekul organik dan diubah menjadi putaran energi molekul. Penyerapan ini tercantum, namun spektrum getaran terlihat bukan sebagai garis – garis melainkan berupa pita – pita. Hal ini disebabkan perubahan energi getaran tunggal selalu disertai sejumlah perubahan energi putaran. Pita energi putaran yang penting terletak antara 4000 – 600 cm-1
Untuk menganalisa suatu senyawa yang belum diketahui, perhatian harus dipusatkan pada penentuan ada atau tidaknya beberapa gugus fungsional utama seperti C=O ; C-H ; C-O ; C=C dan NO
.
2
Beberapa syarat – syarat yang harus dipenuhi dalam menafsirkan sebuah spektrum infra merah :
.
a. Spektrum haruslah cukup terpisah dan mempunyai kuat puncak yang memadai. b. Spektrum harus dibuata dari senyawa yang cukup rumit.
c. Spektrofotometer harus dikalibrasi sebagai pita akan teramati pada kerapatan atau panjanggelombang yang semestinya. Kalibrasi yang benar dapat dilakukan dengan baku – baku yang dapat dipercaya, misalnya polistiren.
d. Metode penanganan cuplikan.( Silverstein, 1984 ).
1. Vibrasi Regang
Terjadi perubahan jarak antara dua atom dalam suatu molekul secara terus-menerus. Vibrasi regang ada dua macam, yakni vibrasi regang simetris dan tak simetris.
2. Vibrasi Lentur
Terjadi perubahan sudut antara dua ikatan kimia. Ada dua macam vibrasi lentur yaitu vibrasi lentur dalam bidang (scissoring dan rocking) dan vibrasi luar bidang (waging dan twisting) ( Noerdin, 1999 ).
Vibrasi spektrum Infra merah dari amina primer dan sekunder yang sangat khas dapat dihubungkan dengan adanya ikatan N-H. Keduanya dalam bentuk alkil dan aril amina primer dapat ditunjukkan dengan adanya dua buah vibrasi N-H yang merupakan sebuah ikatan stretching yang asimetrik ditunjukkan pada panjang gelombang 3490 cm-1 dan juga sebuah ikatan stretching simetrik pada panjang gelombang mendekati 3400 cm-1 . Serapan pada bagian ini dapat terjadi karena adanya ikatan hidrogen, akan tetapi pengaruh dari ikatan hidrogen ini pada N-H tidak sama dengan pengaruh ikatan hydrogen 0-H pada vibrasi molekulnya. Dimana ketika ikatan hidrogen intra molekul terjadi, maka akan membentuk sebuah kompleks yang menyebabkan serapan panjang gelombang pada 3300-3000 cm-1. ( Silverstain, 1986 ).
Vibrasi regang N-H juga dipengaruhi oleh ikatan hidrogen, tetapi pengruhnya terhadap pergeseran frekuensi vibrasi lebih kecil. Pada amin tersier, tidak mungkin terjadi ikatan hidrogen. Pada amin primer puncak serapan berupa doblet yang disebabkan regang N-H tak simetris dan regang N-H simetris. Kedua doblet ini terpisah satu sama lain sebesar 100 cm-1 dan besarnya pemisahan ini tidak tergantung pada konsentrsi.
serapannya singlet atau tunggal, dan frekwensi vibrasinya jauh lebih besar dari frekwensi dalam larutan pekat. Puncak doblet juga akan terjadi bila gugusan N-H atau O-H suatu molekul jumlahnya masing – masing dua. Vibrasi lentur N-H dari amin primer biasanya memberikan puncak serapan antara 1580 – 1650cm
(Noerdin,1999)
-1
Amina sekunder memberikan satu vibrasi molekul N-H pada panjang gelombang 3450-3300 cm-1 . Sebuah frekuensi serapan yang tinggi biasanya menunjukkan sebuah aril dan alkil sekunder, ketika sebuah serapan terjadi pada panjang gelombang 3350-3300 cm-1 menunjukkan sebuah alkil amina sekunder, akan tetapi amina tersier tidak menunjukkan adanya vibrasi molekul N-H.
Vibrasi C-N dari amina akan terjadi dengan vibrasi molekul sama dengan yang dimiliki oleh ikatan C-C dan C-0 ( biasanya mendekati panjang gelombang 1350-1200 cm-1 ) dan data ini tidak cocok dalam penentuan strukturnya. N-metil amina hadir dengan vibrasi molekul mendekati 2750 ±50 cm-1
.(Ternau,J.R.1979).
Hanya getaran yang menghasilkan perubahan momen dwikutub secara berirama saja yang teramati di dalam inframerah. Medan listrik yang berganti-ganti, yang dihasilkan oleh perubahan penyebaran muatan yang menyertai getaran menjodohkan getaran molekul dengan medan listrik pancaran elektromagnet yang berayun ( Silverstain, 1986 ).
2.4.2. Spektrometri Resonansi Magnetik Inti Proton ( 1H-NMR )
Spektrum NMR dari amina sangat beragam, sama seperti NMR yang ditunjukkan pada alkohol. Serapan N-H dari sebuah amina alifatik berada pada δ 0,5 sampai 3 ppm, sedangkan serapan amina aromatik berada pada δ 3,0 sampai 5,0 ppm. Sebagai hasil dari adanya ikatan hidrogen pada amina sekunder ataupun amina primer maka pergeseran kimia dari proton N-H bervariasi, dimana pergeseran kimia ini tergantung pada pelarut, konsentrasi dan temperaturnya. Hal ini hampir serupa dengan alkohol. Sama juga dengan alkohol, amina juga mungkin dapat dibedakan proton dari N-H dengan menggunakan deuterium yaitu D2O. Serapan proton dari N-H juga dapat dengan mudah diketahui dengan mencocokkan dengan pertukaran isotopnya dengan kontaminan yang mendekati peak dari HOD dengan pertukarannya menggunakan air ( Alan, 1981 ).
Beberapa keuntungan dari pemakaian standar internal TMS yaitu :
1. TMS mempunyai 12 proton yang setara sehingga akan memberikan spektrum puncak tunggal yang kuat.
2. TMS merupakan cairan yang mudah menguap, dapat ditambahkan ke dalam larutan sampel dalam pelarut CDCl
3
3 atau CCl4
Boleh dikatakan semua senyawa organik memberikan resonansi bawah medan terhadap TMS. Hal ini disebabkan Si lebih bersifat elektro positif dibandingkan atom C.
.
TMS sendiri dari segi kimia bersifat lembam, tidak bercampur dengan H2O ataupun air berat ( Muldja, 1995 ).
Efek Perisai ( Shielding Effect )
yang mengelilingi inti bertindak seperti perisai yang melindungi medan magnet inti terhadap pengaruh H0, sebagai contoh CH4 yang keempat protonnya lebih terlindungi oleh awan elektron, sedangkan H – tidak mempunyai awan elektron.
Karena setiap proton dalam molekul zat organik beranekaragam, maka setiap proton didalam molekul zat organik membrikan tetapan perisai ( δ ) yang berbeda. Ada dua hal yng sangat berpengaruh terhadap tetapan perisai yang menunjukkan kerapatan elektron terhadap proton yaitu adanya efek polar dan efek induksi. (Mulja,1995)
Pergeseran Kimia
Spektroskopi NMR dalam kimia tidak didasarkan pada kemmpuannya untuk membeda – bedakan unsur dalam suatu senyawa, tetapi didasarkan pada kemampuannya untuk mengetahui inti tertentu dengan memperhatikan lingkungannya dalam molekul. Frekuensi resonansi individu intidipengaruhi oleh distribusi elektron pada ikatan kimia dalam molekul, dengan demikian harga frekwensi resonansi suatu inti tertentu tergantung pada struktur molekul.
Untuk memberikan gambaran NMR sebagai gambaran inti adalah proton,sebagai benzil asetat akan menghasilkan tiga sinyal NMR yang berbeda yaitu masing – masing untuk satu proton fenil, metilen, dan gugus metil. Hal ini dihasilkan oleh pengaruh lingkungan kimia yang berbeda pada suatu proton tersebut dalam molekul, keadaan ini dikenal dengan pergeseran kimiafrekwensi resonansi atau lebih sederhana sebagai pergeseran kimia.
Resonansi magnetik inti memiliki kegunaan yang besar karena tidak setiap proton dalam molekul beresonansi pada frekwensi yang identik sama. Ini disebabkan oleh kenyataan bahwa berbagai proton dalam molekkul dikelilingi elektron dan menunjukkan sedikit perbedaan lingkungan elektronik dari suatu proton dengan proton lainnya. Proton – proton ini dilindungi oleh elektron – elektron yang mengelilinginya.
Didalam medan magnet, perputaran elektron – elektron valensi dari proton menghsailkan medan magnet yang melawan medan magnet yang digunakan, hingga tiap proton dalam molekul dilindungi dari medan magnet yang digunakan yang mengenainya dan besarnya perlindungan ini tergantung pada kerapatan elektron yang mengelilingi inti, maka makinbesar pula medan magnet yang digunakan. Akibat secara keseluruhan adalah inti/proton merasakan adanya pengurangan medan yang mengenainya. Karena inti merasakan medan magnet yang lebih kecil, maka ia akan mengalami presesi pada frekwensi yang lebih rendah. Setiap proton dalam molekul mempunyai llingkkungan kimia yang sedikit berbeda dan mempunyai perloindungan elektron yang sedikit berbeda yang akak mengakibatkan dalam frekwensi resonansi sedikit berbeda. (Fessenden, 1997)
BAB 3
BAHAN DAN METODE PENELITIAN
3.1. Alat-alat
1. Neraca Analitik Mettler PM 480
2. Rotary Evaporator Buchi
3. Corong
4. Gelas Beaker Pyrex
5. Gelas Ukur Pyrex
6. Kolom Kromatografi Pyrex
7. Plat Skrining
8. Labu Erlenmeyer Pyrex
9. Oven
10.Melting Point Apparatus Fisher Johns 11.Bosch Monoscope
12.Lampu UV 13.Tabung Reaksi 14.Rak Tabung Reaksi
15.Plat Kromatografi Lapis Tipis 16.Magnetik Stirer
17.Hot Plate Nuova
18.Chamber
19.Indikator Universal 20.Alat soklet
21.Labu Alas Pyrex
22.Blender Maspion
23.Stoples
25.Spektrofotometer IR Jasco FT-IR 5300 26.Spektrometer 1H-NMR Hitachi FT-NMR-1900
3.2. Bahan – bahan
1. Batang Brotowali
2. Etanol (P.a. E.Merck)
3. HCl 2 N
4. NH4
5. Kloroform (P.a. E.Merck)
OH Pekat
6. Aquadest 7. MgSO4
8. Pereaksi Meyer Anhidrat
9. Pereaksi Wagner 10.Pereaksi bouchardat 11.Pereaksi Dragendorf
12.Silika Gel 60 G ( E.Merck. Art. 7734)
13.Silika Gel 60 GF254 ( E.Merck. Art. 10180)
3.3. Prosedur Penelitian
3.3.1. Penyediaan Sampel
Sampel yang diteliti adalah batang tumbuhan Brotowali (Tinospora crispa (L.)MIERS) yang diperoleh dari pajak sore Padang Bulan Medan yang kemudian dibuat dalam bentuk serbuk halus sebanyak 1000 g
3.3.2. Uji Skrining Fitokimia
sampel dengan uji skrining fitokimia, yaitu serbuk batang tumbuhan Brotowali ditimbang sebanyak 5 g, dimaserasi dengan 20 ml etanol, selama 2 jam, disaring dan filtrat yang diperoleh dibagi menjadi 4 bagian, yaitu :
Filtrat I : ditambahkan 2 tetes pereaksi Meyer ternyata terbentuk endapan warna putih, hal ini menunjukkan adanya senyawa alkaloida.
Filtrat II : ditambahkan 2 tetes pereaksi Dragendorf ternyata terbentuk endapan warna jingga, hal ini menunjukkan adanya senyawa alkaloida.
Filtrat III : ditambahkan 2 tetes pereaksi Wagner ternyata terbentuk endapan warna coklat, hal ini menunjukkan adanya senyawa alkaloida.
Filtrat IV : ditambahkan 2 tetes pereaksi Bouchardat ternyata terbentuk endapan warna coklat, hal ini menunjukkan adanya senyawa alkaloida
3.3.3.Prosedur Untuk Memperoleh Senyawa Kimia Ekstrak Batang Tumbuhan Brotowali (Tinospora crispa(miers))
3.3.4. Analisis Kromatografi Lapis Tipis
Analisis dimaksudkan untuk mencari pelarut yang sesuai di dalam analisis kromatografi kolom. Dimana ekstrak kasar yang diperoleh dilakukan analisis secara kromatografi lapisan tipis dengan pelarut yang digunakan adalah kloroform 100% dan campuran pelarut kloroform : etanol (5 : 1 v/v, 4 : 1 v/v, 3 : 1 v/v, 2 : 1 v/v, 1 : 1 v/v). Sehingga akan diperoleh perbandingan pelarut kloroform : metanol yang sesuai untuk kromatografi kolom.
Prosedur :
Ke dalam bejana kromatografi lapis tipis dimasukkan 10 ml larutan fasa gerak kloroform 100 %. Ekstrak encer dietil eter ditotolkan pada palat KLT yang diaktifkan. Plat dimasukkan ke dalam bejana yang berisi developer – developer yang telah dijenuhkan, kemudian ditutup rapat dan dielusi. Setelah dielusi, plat dikeluarkan dari bejana, dikeringkan. Noda yang terbentuk diamati dengan sinar ultraviolet. Kemudian harga Rf nya dihitung.
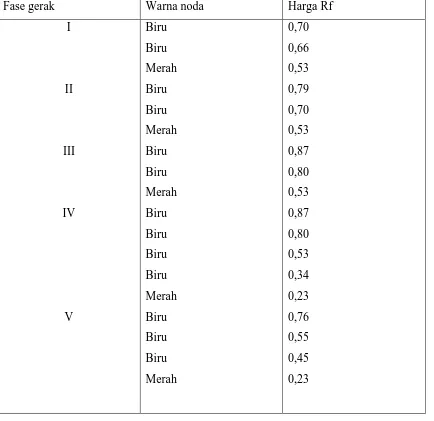
Perlakuan yang sama dilakukan untuk campuran pelarut antara kloroform : etanol (5 : 1 v/v, 4 : 1 v/v, 3 : 1 v/v, 2 : 1 v/v, 1 : 1 v/v). Dari hasil analisis KLT menunjukkan bahwa batang tumbuhan Brotowali mengandung senyawa alkaloida. Dari hasil pemisahan yang lebih baik diberikan pada fase gerak kloroform : etanol ( 4 : 1 v/v). Harga Rf nya dapat dilihat pada kromatogram ( tabel 1 )
3.3.5. Isolasi Senyawa alkaloida dengan Kromatografi Kolom
Terhadap 18 g ekstrak kasar dilakukan isolasi senyawa alkaloida dengan kromatografi kolom. Fasa diamnya adalah silika gel 60 G (E.Merck Art. 7734) dan fasa geraknya adalah kloroform : etanol (4 : 1 v/v).
Prosedur :
kloroform 100 % hingga bubur silika gel padat dan homogen. Dimasukkan 18 g ekstrak kasar batang tumbuhan brotowali ke dalam kolom kromatografi yang telah berisi bubur silika gel. Sampel dibiarkan turun dan terserap dengan baik pada silika gel dipuncak kolom, lalu ditambahkan fase gerak kloroform : etanol ( 4 : 1 v/v) secara perlahan –lahan dan diatur sehingga liran fraksi yang keluar dari kolom sama banyaknya dengan penambahan fasa gerak dari atas. Hasil yang diperoleh ditampung dalam beberapa botol vial, lalu diuapkan diudara terbuka sampai pelarutnya habis hingga terbentuk kristal alkaloida.
3.3.6. Pemurnian Kristal Hasil Isolasi
Dari analisis taip – tiap fraksi dengan kromatografi lapisan tipis, diperoleh noda – noda dengan harga Rf yang hampir sama, ykni pada fraksi 15 – 30. lalu fraksi tesebut digabungkan dan diuapkan, diperoleh larutan pekat berwarna Kuning kehijauan. Kemudian dicuci dengan pelarut etanol secara berulang – ulang sebanyak 3 kali, kemudian dikeringkan hingga terbentuk kristal berwarna kuning berbentuk jarum sebanyak 1,38 g
3.3.7. Analisis Kristal Hasil Isolasi
3.3.7.1. Analisis Pada Kromatografi Lapis Tipis
1. Kristal yang diperoleh dari hasil rekristalisasi ditimbang sebanyak 15 mg lalu dilarutkan dalam 10 ml etanol, lalu ditotolkan pada plat KLT
2. Larutan fasa gerak yaitu kloroform : etanol ( 4 : 1 v/v ) dimasukkan kedalam bejana kromatografi yang telah dijenuhkan dengan bantuan kertas saring. Plat yang telah ditotolkan sampel dimasukkkan kedalam bejana kromatografi dan dielusi.
3.3.7.2. Uji Reaksi Warna Terhadap Kristal Hasil Isolasi Dengan Pereaksi Alkaloida
Larutan kristal dari prosedur 3.3.7.1 dibagi dalam empat tabung reaksi :
1. Tabung I ditambahkan dengan 2 tetes pereaksi Mayer memberikan endapan berwarna putih
2. Tabung II ditambahkan dengan 2 tetes pereaksi Wagner memberikan endapan berwarna coklat.
3. Tabung III ditambahkan dengan 2 tetes pereaksi Bouchardat memberikan endapan berwarna coklat.
4. Tabung IV ditambahkan dengan 2 tetes pereaksi Drangendorff memberikan endapan berwarna jingga.
3.3.7.3. Penentuan Titik Lebur
Kristal hasil isolasi yang telah murni diletakkan diatas plat melting point apparatus, dihidupkan alat dan diatur temperaturnya. Lalu diamati temperatur sampai kristal melebur. Titik lebur kristal yang diperoleh 175 - 177 0C.
3.3.74. Analisis Spektroskopi Kristal Hasil Isolasi
Analisis kristal hasil isolasi dengan alat spektrofotometer FT – IR dan spektrometer 1
BAGAN PENELITIAN Sampel kering, bubuk 1000 gr
← Diekstraksi secara maserasi dengan pelarut etanol (2 L) ← Disaring
← Diulangi pekerjaan sebanyak 4 kali
Ekstrak etanol Ampas
← Skrining Fitokimia
← Pekatkan dengan rotary evaporator
Ekstrak pekat etanol
Fraksi etil asetat
← Diskrining fitokimia ← Dipekatkan dipenangas air
← Diasamkan dengan HCl 2 M sampai pH 2,diaduk dengan magnetic stirer selama 3 jam, disaring
Larutan asam Lapisan Atas
← Dibasakan dengan NH4OH pekat sampai pH 10,aduk dengan magnetic stirer selama 3 jam,diamkan selama 3 jam
← Disaring
Endapan
← Dikeringkan dalam oven ← Dilarutkan dengan etanol
← Diekstraksi partisi dengan CHCl3 : air ( 1:1 v/v) 300 ml ulangi sebanyak 4 kali
← Diekstraksi secara partisi dengan pelarut etil asetat : air (1:1 v/v )sebanyak 3 kali
Fraksi air
← Dicuci dengan aguadest sampai netral, keringkan dengan MgSO4 anhidreat 15 g,diamkan 1 malam dan disaring
Ekstrak CHCl3
Filtrat larutan basa
← Dipekatkan dengan rotarievaporator
Ekstrak CHCl3 pekat
← Diskrining Fitokimia
← Dianalisis KLT dengan pelarut kloroform 100% , Kloroform : etanol (5:1), (4:1),(3:1),(2:1),(1:1) v/v
← Dipisahkan dengan kolom kromatografi dengan fasa diam silica gel 60 G dan fasa gerak kloroform : etanol (4:1) V/V ← Ditampung tiap fraksi sebanyak 5 ml
← Dianalisis KLT dan digabung fraksi dengan Rf yang sama
Fraksi 15 -30
← Diuapkan pelarutnya
Residu warna kuning kehijauan
← Direkristalisaasi dengan pelarut etanol
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
Hasil isolasi senyawa alkaloida dari ekstrak batang brotowali dengan cara maserasi dengan pelarut etanol. Setelah ekstrak etanol dipekatkan, kemudian diasamkan dan diaduk, kemudian disaring dan kemudian dibasakan sampai pH 10. Aduk selama 3 jam, diamkan, disaring dan diekstraksi secara partisi dengan kloroform : air, lalu dipisahkan. Ekstrak kloroform dipekatkan dan dianalisa dengan kolom kromatografi. Dari hasil analisa kromatografi dengan menggunakan silika gel 60 G sebagai adsorben dan dielusi dengan kloroform : etanol ( 4 : 1 v/v ). Fraksi yang diperoleh dipekatkan dan residu yang terbentuk direkristalisasi dengan etanol berulang – ulang. Dari hasil rekristalisasi diperoleh kristal berwarna kuning, berbentuk jarum dengan titik lebur 175 – 177 0C.
Dari hasil analisa kromatografi dengan menggunakan fase gerak kloroform : etanol ( 4 : 1 v/v ), menunjukkan noda tunggal berwarna biru yang daimati dibawah lampu UV, berarti kristal hasil isolasi adalah murni.
Hasil analisis dengan menggunakan spektroskopi Infra Merah (FT – IR ) pada kristal hasil isolasi menghasilkan pita – pita serapan pada daerah bilangan gelombang sebagai berikut :
1. Pada bilangan gelombang 3474,64 cm 2. Pada bilangan gelombang 2922,42 cm -1
3. Pada bilangan gelombang 2851,14 cm -1
4. Pada bilangan gelombang 1732,86 cm -1
5. Pada bilangan gelombang 1651,02 cm -1
6. Pada bilangan gelombang 1503,79 cm -1
7. Pada bilangan gelombang 1461,69 cm -1