PEMANFAATAN Methylobacterium spp. PADA INVIGORASI
DAN TEKNIK COATING UNTUK MENINGKATKAN VIGOR
BENIH KEDELAI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis berjudul “Pemanfaatan
Methylobacterium spp. pada Invigorasi dan Teknik Coating Untuk Meningkatkan Vigor Benih Kedelai” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2013
Ratri Tri Hapsari
ABSTRACT
RATRI TRI HAPSARI. Utilization of Methylobacterium spp. in Invigoration and Seed Coating Technique for Enhancing Soybean Seed Vigor. Under direction of ENY WIDAJATI, SELLY SALMA, MARYATI SARI.
Soybean seed deterioration is one of the problem in supplying high seed quality in tropical environtment such as Indonesia. Methylobacterium spp. for invigoration and enhancing soybean seed storage by coating technique can be used to solve this problem. The aims of the research were: (1) to find out the potency of Methylobacterium spp. for soybean seed invigoration, (2) to get
Methylobacterium spp coating formulation to enhancing soybean seed storage. (3) to enumerate viable Methylobacterium spp. in coated seed during open storage. Experiments were conducted in Soil Biology Laboratory and Screen House Indonesian Soil Research Institute (ISRI), PT. East West Seed Indonesia Laboratory, Seed Technology Laboratory IPB, Bogor from November 2011 to July 2012. The research materials were soybean seed (Argomulyo), four isolates of Methylobacterium spp namely TD-TPB3, TD-J7, TD-TM3 and TD-TM1. The research consisted of two experiment (1) Methylobacterium spp application for seed invigoration in different viability, (2) Methylobacterium spp. application with seed coating at various storage period. The first experiment using Randomized Complete Block Design factorial. The first factor were six levels invigoration aplication i.e: control, soaking seed by steril water, soaking seed by TD-TPB3, soaking seed by TD-J7, soaking seed by TD-TPB3 + TD-TM3, and soaking seed by TPB-3 + TD-J7. Second factor were different seed viabiliaty, i.e: V1 (seed germination: 78 %); V2 (seed germination: 83 %); V3 (seed germination: 94 %). The second experiment using Nested Design. The first factor was storage period, i.e: 0, 1, 2, 3, 4, 5, 6 month. Second factor were 11 level formulations: control, coating with arabic gum, coating with arabic gum + tochopherol 800 ppm, coating with arabic gum + TD-TM1, coating with arabic gum + TD-TM3, coating with arabic gum + TD-TPB3, coating with arabic gum + TD-TPB3 + TD-TM1, coating with arabic gum + TD-TPB3 + TD-TM3, coating with arabic gum + peat, coating with arabic gum + TD-TPB3 + TD-TM1 + peat, coating with arabic gum + TD-TPB3 + TD-TM3 + peat. The result showed that at laboratory level, invigoration enhancing vigor index 8.9-20.6 %, and hypocotyls length 1.5-2.5 cm compare to control. In screen house experiment there was no significant improvement for vegetative stage in soybean. Coating with formula arabic gum, arabic gum + tochopherol 800 ppm, and arabic gum+TD-TM3 consistently maintain significant higher seed germination (SG) and germination rate (GR) seed viability until 6 month storage compare to control also have no significant vigor index (VI) compare to control. Coating formula with peat resulting low SG (78.3-80.7 %), whereas coating formula with
Methylobacterium spp resulting higher SG (81.3-86.7 %) compare to without
RINGKASAN
RATRI TRI HAPSARI. Pemanfaatan Methylobacterium spp. pada Invigorasi dan Teknik Coating Untuk Meningkatkan Vigor Benih Kedelai. Dibimbing oleh ENY WIDAJATI, SELLY SALMA, MARYATI SARI.
Kemunduran benih kedelai merupakan salah satu masalah dalam penyedian benih bermutu di lingkungan tropis seperti Indonesia. Methylobacterium spp. pada teknik coating dan invigorasi dapat dimanfaatkan sebagai salah satu upaya untuk memecahkan masalah tersebut. Tujuan dari penelitian ini adalah: (1) Mengetahui potensi Methylobacterium spp. untuk invigorasi benih kedelai, (2) mendapatkan formulasi coating dengan Methylobacterium spp. yang dapat mempertahankan viabilitas benih selama di penyimpanan, (3) mengetahui jumlah Methylobacterium
spp. yang hidup pada coating benih kedelai selama penyimpanan.
Penelitian ini dilaksanakan di Laboratorium Biologi Tanah dan Rumah Kaca Balai Penelitian Tanah (Cimanggu-Bogor), Laboratorium PT. East West Seed Indonesia (Purwakarta) dan Laboratorium Teknologi Benih IPB (Bogor) pada bulan November 2011 sampai Juli 2012. Bahan yang digunakan dalam penelitian ini adalah benih kedelai Argomulyo dan empat isolat Methylobacterium
spp, yaitu TD-TPB3, TD-TM1, TD-TM3, TD-J7.
Penelitian ini terdiri atas dua percobaan, yaitu (1) Aplikasi
Methylobacterium spp. untuk invigorasi pada benih kedelai. (2) aplikasi
Methylobacterium spp untuk mempertahankan daya simpan benih kedelai dengan teknik coating pada berbagai periode simpan. Percobaan satu menggunakan Rancangan Acak Kelompok faktorial. Faktor pertama adalah aplikasi invigorasi, yaitu: kontrol (tanpa aplikasi perendaman air/isolat), perendaman benih dengan air steril, perendaman benih dengan Methylobacterium TD-TPB3, perendaman benih dengan Methylobacterium TD-J7, perendaman benih dengan Methylobacterium
TD-TPB3+TD-TM3, perendaman benih dengan Methylobacterium TD-TPB3+TD-J7. Faktor kedua adalah tingkat viabilitas awal benih yang berbeda, yaitu: V1 (DB: 78 %); V2 (DB: 83 %); V3 (DB: 94 %).
Percobaan kedua, menggunakan Rancangan Petak Tersarang (Nested Design). Faktor pertama sebagai petak utama adalah periode simpan benih yaitu: 0, 1, 2, 3, 4, 5, 6 bulan. Faktor kedua sebagai anak petak adalah formulasi coating
dengan Methylobacterium spp., yaitu: (1) kontrol (tanpa coating), (2) coating arabic gum, (3) coating arabic gum + tokoferol 800 ppm, (4) coating arabic gum+TD-TM1, (5) coating arabic gum+TD-TM3, (6) coating arabic gum +TD-TPB-3, (7) coating arabic gum+TD-TPB3+TD-TM1, (8) coating arabic gum+TD-TPB3+TD-TM3, (9) coating arabic gum+gambut, (10) coating arabic gum+TD-TPB3+TD-TM1+gambut, (11) coating arabic gum +TD-TPB3+TD-TM3+gambut.
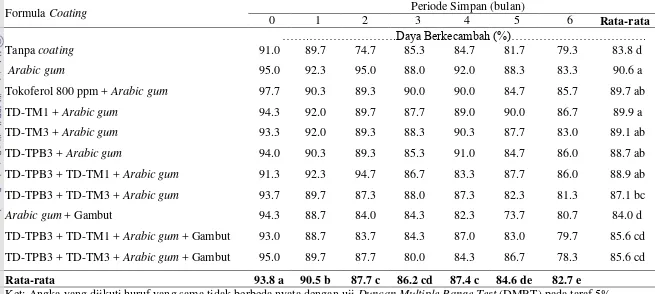
periode simpan 6 bulan yang nyata lebih tinggi dibandingkan kontrol berdasarkan kecepatan tumbuh (KCT) dan daya berkecambah (DB) serta memiliki nilai vigor
(IV) yang tidak berbeda nyata dengan kontrol. Formula coating dengan gambut menghasilkan DB yang rendah (78.3-80.7 %), sedangkan formula coating dengan
Methylobacterium spp menghasilkan DB yang lebih tinggi (81.3-86.7 %) dibandingkan dengan tanpa coating (79.3 %) setelah disimpan sampai 6 bulan.
Methylobacterium spp. tetap hidup dalam coating benih selama periode simpan 6 bulan. Jumlah koloni berkurang dari 5.00 x 104 - 1.80 x 107 cfu g-1 benih menjadi 1 x 101 - 1.14 x 102 cfu g-1 benih setelah 6 bulan periode simpan.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
PEMANFAATAN Methylobacterium spp. PADA INVIGORASI
DAN TEKNIK COATING UNTUK MENINGKATKAN VIGOR
BENIH KEDELAI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu dan Teknologi Benih
RATRI TRI HAPSARI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Pemanfaatan Methylobacterium spp. pada Invigorasi dan Teknik
Coating Untuk Meningkatkan Vigor Benih Kedelai Nama : Ratri Tri Hapsari
NIM : A251100061
Disetujui oleh Komisi Pembimbing
Dr. Ir. Eny Widajati, MS Ketua
Dra. Selly Salma, MSi Anggota
Maryati Sari, SP, MSi Anggota
Diketahui oleh
Ketua Program Studi Ilmu dan Teknologi Benih
Prof. Dr. Ir. Satriyas Ilyas, MS
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, MScAgr
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan kasih sayangNya sehingga penulisan karya ilmiah dengan judul “Pemanfaatan
Methylobacterium spp. pada Invigorasi dan Teknik Coating Untuk Meningkatkan Vigor Benih Kedelai” dapat diselesaikan.
Penelitian dan penulisan tesis ini berlangsung di bawah bimbingan Dr. Ir. Eny Widajati, MS selaku Ketua Komisi Pembimbing dan dua orang Anggota Komisi Pembimbing yaitu: Dra. Selly Salma, MSi, dan Maryati Sari, SP, MSi. Penulis menyampaikan rasa terimakasih dan penghargaan atas arahan, semangat dan bimbingan sejak perencanaan hingga penyelesaian tesis ini.
Penghargaan dan ucapan terimakasih penulis sampaikan kepada:
1. Kepala Badan Litbang Kementrian Pertanian, Kepala PUSLITBANGTAN, dan Kepala BALITKABI yang telah memberikan kesempatan dan beasiswa untuk mengikuti program S2 di IPB
2. Program KKP3T yang telah memfasilitasi pendanaan penelitian ini
3. Prof. Dr. Ir. Satriyas Ilyas, MS selaku Ketua Program Studi Ilmu dan Teknologi Benih Sekolah Pascasarjana IPB, atas dorongan dan arahan yang diberikan
4. Dr. Ir. Darda Efendi M.Sc selaku Wakil Program Studi Ilmu dan Teknologi Benih Ilmu, atas arahan dan saran pada ujian tesis
5. Dr. Ir. Giyanto, MSi selaku penguji luar komisi atas arahan dan masukan yang diberikan pada ujian tesis.
6. Seluruh staf Laboratorium Konservasi Mikrobiologi BB-BIOGEN, Biologi Tanah BALITTANAH, Ilmu dan Teknologi Benih IPB, dan UPBS BALITKABI atas bantuan dan kerjasamanya.
7. Suami tersayang (Anggraita Kusuma) atas doa, pengertian, kesabaran, dan semangat yang diberikan kepada penulis selama menempuh pendidikan. 8. Keempat orang tua (Bapak Supiyono, Ibu Sumbangsih, Bapak H. Soehartono
dan Ibu Hj. Sri Wahyuni), kakak dan adik tersayang atas doa, kasih sayang, dan semangat yang diberikan kepada penulis selama ini.
9. Keluarga Benih 2010, Pasca ITB 2011 dan 2012, teman-teman AGH 45 benih, teman kost “KKB-Cibanteng” dan “Wisma Putri-Komplek IPB-2 Sindangbarang” atas kebersamaan, bantuan dan dukungan selama penelitian. 10. Kepada semua pihak yang telah membantu, namun tidak dapat disebutkan
satu per satu dalam karya ilmiah ini, semoga Allah SWT membalas kebaikan dengan pahala berlipat ganda.
Penulis menyadari masih banyak kekurangan dalam tesis ini karena kesempurnaan hanyalah milik Allah SWT. Semoga karya ilmiah ini dapat bermanfaat.
Bogor, Januari 2013
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada 30 Oktober 1984 sebagai anak ketiga dari empat bersaudara pasangan Bapak Supiyono dan Ibu Sumbangsih.
Pendidikan sarjana ditempuh di program studi Pemuliaan Tanaman, Fakultas Pertanian Universitas Jendral Soedirman (UNSOED) Purwokerto pada tahun 2007 melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB).
DAFTAR ISI
Halaman
DAFTAR TABEL ... xviii
DAFTAR GAMBAR ... xx
DAFTAR LAMPIRAN ... xxi
PENDAHULUAN Latar Belakang ... 1
Tujuan Penelitian ... 3
Ruang Lingkup Penelitian ... 4
TINJAUAN PUSTAKA Potensi Methylobacterium spp. dalam Meningkatkan Vigor Benih .... 5
Potensi Methylobacterium spp. dalam Mempertahankan Daya Simpan Benih ... 10
Pelapisan Benih (Seed Coating) ... 13
Invigorasi ... 15
BAHAN DAN METODE Tempat dan Waktu Penelitian ... 17
Bahan dan Alat Penelitian ... 17
Metode Penelitian... 18
HASIL DAN PEMBAHASAN 29
SIMPULAN DAN SARAN Simpulan ... 53
Saran ... 53
DAFTAR PUSTAKA ... 55
DAFTAR TABEL
Halaman
1. Konsentrasi fitohormon yang terdapat pada 17 suspensi kultur
Methylobacterium spp ... 6 2. Konsentrasi tokoferol yang terdapat pada 21 suspensi kultur
Methylobacterium spp ... 11 3. Konsentrasi Methylobacterium spp. yang digunakan untuk invigorasi
benih ... 20 4. Konsentrasi Methylobacterium spp. yang digunakan untuk seed coating 25 5. Pengaruh faktor tunggal lot benih terhadap kecepatan tumbuh pada uji
di laboratorium ... 29 6. Pengaruh faktor tunggal lot benih terhadap daya berkecambah pada uji
di laboratorium ... 30 7. Pengaruh faktor tunggal lot benih terhadap panjang akar pada uji di
laboratorium... 31 8. Pengaruh faktor tunggal lot benih terhadap Berat Kering Kecambah
Normal (BKKN) pada uji di laboratorium ... 31 9. Pengaruh faktor tunggal perlakuan invigorasi dan lot benih terhadap
indeks vigor pada uji di laboratorium ... 32 10. Pengaruh faktor tunggal lot benih terhadap panjang hipokotil pada uji
di laboratorium ... 33 11. Pengaruh faktor tunggal lot benih dan perlakuan invigorasi terhadap
tinggi tanaman 14 hst, 21 hst, 28 hst, dan 35 hst pada uji di rumah kaca 34 12. Pengaruh faktor tunggal lot benih dan perlakuan invigorasi terhadap
jumlah daun 28 hst, dan 35 hst pada uji di rumah kaca ... 36 13. Pengaruh perlakuan invigorasi terhadap bobot kering tajuk pada uji di
rumah kaca ... 36 14. Nilai rata-rata panjang akar dan bobot kering akar pada uji di rumah
15. Pengaruh faktor tunggal lot benih terhadap daya tumbuh bibit kedelai pada uji di rumah kaca ... 37 16. Pengaruh faktor tunggal periode simpan dan formula coating terhadap
daya berkecambah ... 44 17. Pengaruh faktor tunggal periode simpan terhadap bobot kering
kecambah normal kedelai... 46 18. Pengaruh interaksi periode simpan dan formula coating terhadap
kecepatan tumbuh benih kedelai ... 48 19. Pengaruh interaksi periode simpan dan formula coating terhadap indeks
vigor benih kedelai ... 49 20. Rata-rata jumlah Methylobacterium spp. yang hidup pada benih yang
DAFTAR GAMBAR
Halaman
1. Alur pelaksanaan penelitian ... 17 2. Proses perendaman benih dengan isolat Methylobacterium spp
menggunakan aerator ... 21 3. Grafik imbibisi benih kedelai ... 40 4. Koloni bakteri yang terdapat dicoating benih kedelai pada periode
DAFTAR LAMPIRAN
Halaman
1. Deskripsi kedelai Argomulyo ... 63 2. Media AMS dalam 1 liter ... 63 3. Trace elemen per 100 ml ... 63 4. Tryptophan ... 64 5. Proses coating benih kedelai hingga dikemas untuk 6 bulan periode
simpan ... 64 6. Rekapitulasi analisis keragaman pengaruh lot benih dan perlakuan
invigorasi terhadap beberapa variabel pengamatan pada uji di laboratorium ... 65 7. Rekapitulasi analisis keragaman pengaruh perlakuan invigorasi dan lot
benih terhadap beberapa variabel pengamatan pada uji di rumah kaca .... 65 8. Pengaruh faktor tunggal lot benih dan perlakuan invigorasi terhadap
kadar air benih pada uji di laboratorium ... 66 9. Rekapitulasi analisis keragaman periode simpan dan formula coating
serta interaksinya terhadap beberapa variabel pengamatan pada benih kedelai ... 66 10. Pengaruh faktor tunggal periode simpan dan formula coating terhadap
1
PENDAHULUAN
Latar Belakang
Kedelai merupakan tanaman pangan fungsional dan sumber protein penting di Indonesia. Kandungan protein varietas kedelai di Indonesia berkisar antara 30-45 % sedangkan kandungan lemak berkisar antara 7-25 % (BALITKABI 2008). Input utama dalam menghasilkan produk kedelai yang berkualitas adalah penyediaan benih kedelai bermutu tinggi. Salah satu faktor pembatas penyediaan benih kedelai di daerah tropis, seperti Indonesia adalah kemunduran benih yang berlangsung cepat selama penyimpanan sehingga mengurangi ketersediaan benih bermutu tinggi.
Benih bermutu tinggi dapat dicirikan dari vigor yang tinggi (Ilyas 2012). Menurut Sadjad et al. (1999), vigor benih adalah kemampuan benih tumbuh normal dalam keadaan lapang suboptimum. Secara umum, vigor benih dibagi menjadi dua kategori, yaitu vigor kekuatan tumbuh dan vigor daya simpan. Vigor kekuatan tumbuh mengindikasikan vigor benih pada kondisi alam suboptimum, sedangkan vigor daya simpan adalah kemampuan benih untuk disimpan dalam kondisi suboptimum.
Salah satu upaya yang dapat dilakukan untuk meningkatkan vigor benih adalah dengan teknik seed enhancement. Menurut Taylor et al. (1998), terdapat tiga teknik yang dapat digunakan untuk meningkatkan mutu benih, yaitu pre-sowing hydration treatment (priming), teknologi coating dan seed conditioning.
Priming adalah perlakuan benih sebelum tanam dengan cara menyeimbangkan potensial air benih untuk merangsang kegiatan metabolisme di dalam benih sehingga benih siap berkecambah. Menurut Kuswanto (2003), seed coating
merupakan pelapisan benih menggunakan zat tertentu seperti zat pengatur tumbuh, zat hara mikro, mikroba, fungisida ataupun antioksidan yang dapat meningkatkan penampilan benih di lapangan.
2
mengalami penyimpanan, proses oksidasi yang terjadi dapat memutuskan ikatan rangkap asam lemak tak jenuh sehingga menghasilkan radikal-radikal bebas yang dapat bereaksi dengan lipida lainnya. Menurut Bewley dan Black (1986) akumulasi radikal bebas menyebabkan kerusakan membran yang mengakibatkan terjadinya kebocoran elektrolit, sehingga berpotensi menurunkan viabilitas benih. Sattler et al. (2004) melaporkan tokoferol merupakan salah satu zat antioksidan yang dapat membatasi oksidasi lipid nonenzimatik selama penyimpanan, perkecambahan, dan perkembangan awal bibit. Tokoferol, telah diketahui sebagai antioksidan yang mampu mempertahankan integritas membran. Menurut Ardiansyah (2007), senyawa tersebut dilaporkan bekerja sebagai scavenger
radikal bebas oksigen, peroksidasi lipid dan oksigen singlet. Mekanisme kerja antioksidan terkait dengan struktur molekulnya yang dapat memberikan elektronnya kepada molekul radikal bebas tanpa terganggu, sehingga dapat memutus reaksi berantai dari radikal bebas.
Tokoferol dapat dimanfaatkan sebagai coating untuk meningkatkan daya simpan benih kedelai. Tokoferol bisa didapat secara alami dari tanaman dan
Methylobacterium spp. ataupun secara sintetik. Hughes dan Tove (1982), berhasil mendeteksi kandungan derivat tokoferol menggunakan HPLC (High Performance Liquid Chromatography) pada Methanobacteria dan mikroorganisme lainnya. Hal ini didukung oleh penelitian Widajati et al. (2011) dengan perangkat HPLC dapat mendeteksi kemampuan Methylobacterium spp dalam memproduksi tokoferol.
Methylobacterium spp. atau disebut juga Pink Pigmented Facultative Metylotroph (PPFM) juga memiliki keistimewaan dapat menghasilkan fitohormon. Hasil penelitian Widajati et al. (2008) menunjukkan bahwa analisis fitohormon pada kultur Methylobacterium spp yang diisolasi dari berbagai jenis tanaman Indonesia menghasilkan kadar IAA berkisar antara 1.42 ppm – 15.14 ppm, kadar GA3 berkisar antara 20.28 ppm - 129.83 ppm, sedangkan kadar Trans
zeatin berkisar antara 22.28 ppm – 89.21 ppm.
3 (Meenakshi & Savalgi 2009). Hasil penelitian Radha et al. (2009), pada kedelai yang diinokulasi isolat bakteri Methylobacterium spp. yang dikombinasikan dengan Bradyrhizobium japonicum strain SB 120 dapat meningkatkan tinggi tanaman, jumlah daun, bobot kering tajuk dan bobot kering akar, jumlah nodul dan bobot kering nodul.
Manfaat mikroba dalam usaha pertanian belum disadari sepenuhnya, karena pandangan umum terhadap mikroba lebih terfokus secara selektif pada mikroba patogen yang menyebabkan penyakit pada tanaman (Saraswati & Sumarno 2008). Berbagai penelitian menunjukkan perlakuan benih menggunakan mikroba dapat melindungi tanaman tidak hanya pada tahap pembibitan atau persemaian, tetapi selama siklus hidup tanaman tersebut (Copeland & McDonald 2001). Holland et al. (1996) melaporkan PPFM dapat digunakan sebagai inokulum pada benih atau
seed coating yang bertujuan untuk meningkatkan perkecambahan, vigor dan daya simpan benih.
Methylobacterium spp. dapat diaplikasikan dalam pelapisan dan invigorasi benih kedelai. Berdasarkan beberapa hasil penelitian dan potensi isolat
Methylobacterium spp. yang dapat menghasilkan fitohormon dan tokoferol, diharapkan potensi Methylobacterium spp. tersebut dapat meningkatkan daya simpan dan vigor kekuatan tumbuh benih kedelai.
Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Mengetahui potensi Methylobacterium spp. untuk meningkatkan vigor kekuatan tumbuh benih kedelai dengan teknik invigorasi.
2. Mendapatkan formulasi coating dengan Methylobacterium spp. yang dapat mempertahankan viabilitas benih selama di penyimpanan.
4
Ruang Lingkup Penelitian
Untuk mencapai tujuan penelitian disusun percobaan yang meliputi: (1) aplikasi Methylobacterium spp. untuk invigorasi pada benih kedelai. (2) aplikasi
5
TINJAUAN PUSTAKA
Potensi Methylobacterium spp. dalam Meningkatkan Vigor Benih
Methylobacterium spp. disebut juga Pink Pigmented Facultative Methylotroph (PPFM) karena memiliki pigmentasi merah muda yang khas. Menurut Holland et al. (2002), PPFM berwarna merah muda karena memiliki pigmen karetenoid, produk dari metabolisme isoprenoid. Green (1992) melaporkan bakteri PPFM memiliki ciri khas dapat hidup pada senyawa berkarbon tunggal (C1) dari tanaman yaitu metanol (CH3OH) atau metilamina
(CH3NH2) sebagai sumber karbonnya. Kemampuan Methylobacterium spp dalam
memanfaatkan gugus metil maupun kemampuannya untuk tumbuh pada senyawa multi karbon seperti suksinat, piruvat atau glioksilat, maka bakteri tersebut termasuk kelompok bakteri fakultatif metilotrof.
Methylobacterium spp. merupakan mikrobiota normal pada filosfer hampir semua tanaman, lumut dan paku-pakuan. Menurut Amelia (2002) sebagai mikroflora normal pada filosfer hampir semua tanaman, hal ini memungkinkan bakteri tersebut memiliki peranan untuk mendukung pertumbuhan tanaman inang. Glick et al. (1999) melaporkan secara langsung maupun tidak langsung bakteri dapat mempunyai pengaruh yang kuat terhadap pertumbuhan dan perkembangan tanaman. Secara tidak langsung, bakteri tersebut dapat mengurangi atau mencegah kerusakan yang disebabkan oleh organisme fitopatogen melalui satu atau beberapa mekanisme yang berbeda seperti produksi antibiotik, antifungi dan lain-lain. Secara langsung, umumnya bakteri mensintesis senyawa tertentu seperti hormon tumbuh, vitamin, siderofor atau mempermudah pengambilan nutrien dari lingkungan.
Simbiosis Methylobacterium dengan tanaman berawal dari pemanfaatan metanol yang diproduksi oleh tanaman. Metanol merupakan produk samping dari metabolisme pektin pada dinding sel yang sedang berkembang (Kutschera 2007). Salma et al. (2005) melaporkan metanol merupakan produk dari aktivitas enzim
6
Metanol yang dihasilkan tanaman merupakan tempat hidup yang baik untuk
Methylobacterium spp. Sebagai bentuk simbiosisnya dengan tanaman,
Methylobacterium spp dilaporkan dapat memproduksi hormon pertumbuhan yang berguna untuk pertumbuhan dan perkembangan tanaman. Menurut Lidstrom dan Chistoserdova (2002) hormon pertumbuhan yang dihasilkan adalah jenis sitokinin
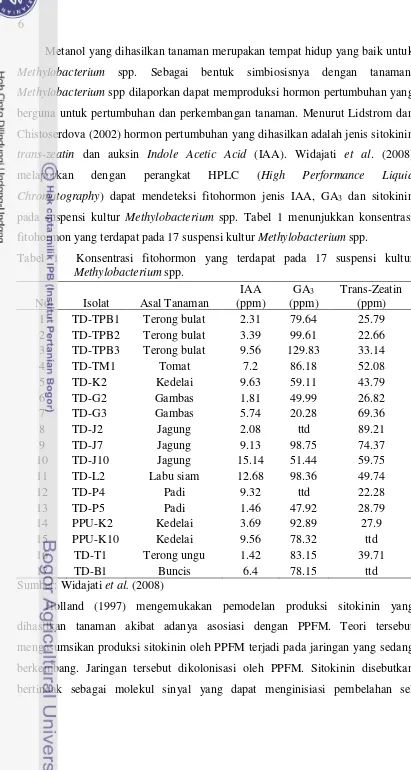
trans-zeatin dan auksin Indole Acetic Acid (IAA). Widajati et al. (2008) melaporkan dengan perangkat HPLC (High Performance Liquid Chromatography) dapat mendeteksi fitohormon jenis IAA, GA3 dan sitokinin
pada suspensi kultur Methylobacterium spp. Tabel 1 menunjukkan konsentrasi fitohormon yang terdapat pada 17 suspensi kultur Methylobacterium spp.
Tabel 1 Konsentrasi fitohormon yang terdapat pada 17 suspensi kultur
7 sehingga mendorong terjadinya demetilasi pektin yang melepaskan metanol. Metanol tersebut, dikonsumsi PPFM sebagai sumber nutrisi. Menurut Ivanova et al. (2007) gen yang bertanggung jawab dalam sintesis sitokinin adalah gen ipt
pada hampir semua genom bakteri Methylotropic yang di uji menggunakan analisis PCR (Polymerase Chain Reaction). Hal ini dapat diketahui dari kemampuan pembentukan akar plantlet tembakau transgenik yang mengekspresikan gen ipt.
Selain menghasilkan sitokinin, Methylobacterium spp. juga dilaporkan dapat memproduksi IAA. Omer et al (2004) dengan kombinasi perangkat HPLC dan NMR (Nuclear Magnetic Resonance) berhasil mendeteksi fitohormon jenis IAA pada 16 suspensi kultur PPFM. Menurut Ivanova et al. (2007) pada
Methylobacterium extorquens, gen RMQ09094 yang bernama BfdC
(Benzoylformate Dercaboxylase) bertanggung jawab sebagai reaksi kunci pada sintesis IAA, misalnya pada dekarboksilasi indole-3-pyruvate (IpyA). Senyawa IpyA adalah senyawa intermediet dalam lintasan utama sintesis IAA.
Hormon asam indol-3-asetat (IAA) merupakan auksin alami yang bersifat tidak stabil dan berperan merangsang pembelahan dan pembesaran sel pada pucuk tanaman, serta dalam pembentukan akar. Hormon asam geberelat (GA3) dapat
merangsang pertumbuhan organ baru serta dapat mempengaruhi pembentukan daun dan akar. Hormon trans-zeatin (TZ) merupakan hormon sitokinin yang berperan dalam pembelahan sel jaringan dan merangsang tunas daun (Wetherell 1982).
Kemampuan Methylobacterium spp. dalam memproduksi fitohormon menyebabkan bakteri ini dapat menstimulus perkecambahan benih. Holland dan Pollaco (1994) dalam Selvakumar et al. (2008) melaporkan benih yang diberi perlakuan PPFM memperlihatkan perkecambahan dan perkembangan tanaman yang lebih baik dibandingkan dengan yang tidak diberi perlakuan PPFM. Pengurangan populasi PPFM pada kulit benih menyebabkan daya berkecambah benih tersebut juga berkurang.
Berbagai penelitian di dalam dan luar negri juga telah banyak membuktikan
8
kacang tanah (Madhaiyan et al. 2006a), tomat (Madhaiyan et al. 2007), cabai rawit (Afifah 2009), kakao (Sadikin 2009), dan cabai besar (Goni 2010). Menurut Riupassa (2003), Methylobacterium spp. memiliki pola adaptasi untuk mampu hidup pada lingkungan dengan daya dukung yang beragam, walaupun bakteri ini merupakan satu kelompok metilotrof.
Hasil penelitian Madhaiyan et al. (2004) pada benih padi yang diberi perlakuan Methylobacterium spp. dapat meningkatkan rata-rata daya berkecambah berkisar antara 33.44 % - 38.74 % dibandingkan dengan kontrol 32.81 %. Selanjutnya, Madhaiyan et al. (2006a) melaporkan bahwa pada benih kacang tanah yang dimbibisikan dengan Methylobacterium sp. PPFM-Ah secara nyata dapat meningkatkan persentase daya berkecambah dari 82 % menjadi 98 % dan indeks vigor dari 2939 menjadi 3998 dibandingkan dengan kontrol. Radha et al. (2009), melaporkan bahwa benih kedelai yang diinokulasi isolat bakteri
Methylobacterium yang dikombinasikan dengan Bradyrhizobium japonicum strain SB 120 mempunyai dampak yang signifikan meningkatkan tinggi tanaman, jumlah daun, bobot kering tajuk, bobot kering akar, jumlah nodul dan berat kering nodul.
Secara tidak langsung, Methylobacterium spp juga dilaporkan dapat mengurangi atau mencegah efek yang ditimbulkan oleh mikroorganisme patogen melalui ketahanan sistemik terinduksi atau induced systemic resistance (ISR) pada padi (Madhaiyan et al. 2004) dan kacang tanah (Madhaiyan et al. 2006a). Madhaiyan et al. (2006a) melaporkan pada benih kacang tanah yang telah diimbibisi dengan Methylobacterium sp. PPFM Ah dan diinokulasi dengan
Aspergilus niger dan Sclerotium rolfsii dapat meningkatkan daya berkecambah dan indeks vigor. Selain itu, juga dapat meningkatkan pathogenesis related- protein (PR-protein) dan fenolik dibandingkan dengan kontrol. Hal ini didukung oleh peningkatan aktivitas phenylalanine ammonia lyase (PAL), β-1.3 glukanase dan enzim peroksidase (PO) pada benih yang diberi perlakuan Methylobacterium
9 dan fungsi membran sel patogen dan pertahanan dinding sel tanaman. Kelompok PR-protein yang umum dikenal antara lain kitinase, dan β-1.3 glukanase.
Penelitian Madhaiyan et al. (2006b) melaporkan bahwa enzim 1-aminocyclopropane-1-carboxylate (ACC) deaminase terdapat pada benih kanola yang diberi perlakuan dengan Methylobacterium fujisawaens. Benih kanola yang diberi perlakuan M. fujisawaens menunjukkan jumlah ACC yang lebih rendah dibandingkan dengan kontrol. Jumlah ACC yang berkurang diduga disebabkan oleh aktivitas ACC deaminase yang dihasilkan bakteri M. fujisawaens. Aktivitas ACC deaminase berperan menurunkan level etilen dengan cara mendegradasi ACC (prekursor hormon etilen). ACCD yang dihasilkan M. fujisawaens dapat meniadakan efek etilen sehingga dapat memacu pemanjangan akar dan memberikan pengaruh yang baik pada pertumbuhan tanaman. Lemus et al. 2009 melaporkan pada tanaman tomat, ACC deaminase yang dihasilkan oleh
Burkholderia sp. dapat mempengaruhi level etilen serta memiliki peran penting dalam pertumbuhan tanaman. Hasil penelitian Akhwan et al. (2012) membuktikan bahwa bakteri penghasil ACC deaminase memberikan pengaruh lebih baik bagi pertumbuhan dan hasil bawang merah seperti pada berat kering akar, luas daun, laju pertumbuhan tanaman (LPT), berat kering total, tinggi tanaman, berat kering oven umbi, diameter umbi, indeks panen, berat segar umbi, susut bobot umbi, dan berat umbi jemur matahari.
10
tanaman terjadi karena adanya perbaikan lingkungan tumbuh dengan adanya interaksi mikroba tanaman.
Potensi Methylobacterium spp dalam Mempertahankan Daya Simpan Benih
Zat antioksidan ternyata juga terdapat pada bakteri Methylotroph yang dapat mensintesis PQQ (Pyrroloquinoline Quinon). Senyawa PQQ adalah suatu gugus prostetik (koenzim) dari metanol dehidrogenase. Pyrroloquinoline Quinon terletak pada periplasma dalam enzim metanol dehridogenase (Lidstrom et al. 1998). Kasahara dan Kato (2003) melaporkan enzim-enzim yang mengandung PQQ antara lain enzim metanol dehidrogenase. Pada bakteri metilotrof, perombakan metanol dan metilamina menjadi formaldehida (CH2O) memerlukan enzim
metanol dehidrogenase dan metilamina dehidrogenase. Formaldehida selanjutnya dapat teroksidasi atau berasimilasi ke dalam sel karbon (Lidstrom et al. 1998). Morris et al. (1994) melaporkan pada Methylobacterium extorquens AM-1 dibutuhkan tujuh gen untuk mensistesis PQQ. Gen tersebut berkode pqqDGCBA dan pqqEF.
Pyrroloquinoline Quinon dilaporkan dapat bekerja sebagai pembersih (scavenging) superoksida dan mampu mengikat radikal bebas beracun lainnya. Fungsi PQQ serupa dengan vitamin E, β-karoten, karetenoid, vitamin C, flavonoid, asam linoleat terkonjugasi dan senyawa fenolik (Klinman 1996). Hal serupa juga dikemukakan He et al. (2003) bahwa PQQ dapat berfungsi sebagai vitamin dan dapat bersifat sebagai antioksidan.
11 memberikan elektronnya kepada molekul radikal bebas tanpa terganggu, sehingga dapat memutus reaksi berantai dari radikal bebas.
Tokoferol bisa didapat secara alami dari tanaman dan Methylobacterium
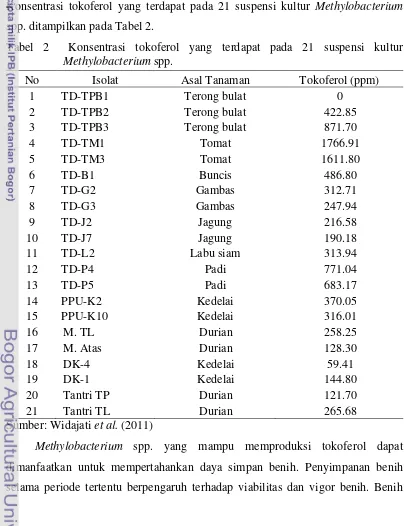
spp. ataupun secara sintetik. Hughes dan Tove (1982), berhasil mendeteksi kandungan derivat tokoferol menggunakan HPLC (High Performance Liquid Chromatography) pada Methanobacteria dan mikroorganisme lainnya. Hal ini didukung oleh penelitian Widajati et al. (2011) dengan perangkat HPLC dapat mendeteksi kemampuan Methylobacterium spp dalam memproduksi tokoferol. Konsentrasi tokoferol yang terdapat pada 21 suspensi kultur Methylobacterium
spp. ditampilkan pada Tabel 2.
Tabel 2 Konsentrasi tokoferol yang terdapat pada 21 suspensi kultur
Methylobacterium spp.
No Isolat Asal Tanaman Tokoferol (ppm)
1 TD-TPB1 Terong bulat 0
12
yang telah disimpan akan mengalami kemunduran benih yang ditunjukkan dengan menurunnya viabilitas dan vigor benih. Kemunduran benih adalah proses bertahap yang diikuti oleh terakumulasinya metabolit beracun yang makin lama semakin menekan daya berkecambah dan pertumbuhan kecambah. Kemunduran benih akan terjadi semakin cepat dikarenakan denaturasi protein akibat proses oksidasi lemak. Benih berkadar lemak tinggi cenderung tidak tahan disimpan lama. Proses yang terjadi selama penyimpanan dapat memutuskan ikatan rangkap asam lemak tak jenuh sehingga menghasilkan radikal-radikal bebas yang dapat bereaksi dengan lipida lainnya. Hal ini yang menyebabkan rusaknya struktur membran sel (Justice dan Bass 2002).
Sattler et al. (2004) melakukan penelitian pada daun dan biji tanaman
Arabidopsis thaliana dengan cara mengisolasi dan mengkarakterisasi lokus vitamin E (vte1 dan vte2) kemudian melakukan mutasi pada lokus tersebut. Mutasi menyebabkan defisiensi tokoferol di semua jaringan. Mutasi pada salah satu lokus tersebut menyebabkan umur benih berkurang secara signifikan dibandingkan dengan tipe liarnya. Pertumbuhan bibit mutan vte2 selama perkecambahan mengalami kerusakan dengan tingkat lemak hidroperoksida dan asam lemak hidroksi meningkat hingga 4 – 100 kali dibandingkan dengan tipe liarnya. Hal ini menunjukkan pentingnya peran tokoferol dalam mempertahankan viabilitas benih.
Pemberian tokoferol sebelum masa simpan diduga dapat mempertahankan viabilitas benih selama periode simpan. Tokoferol diduga dapat berperan sebagai antioksidan untuk mengurangi efek radikal bebas yang terbentuk selama benih dalam penyimpanan. Penghambatan pembentukan radikal bebas dapat mempertahankan struktur membran sel dari kemunduran. Hasil penelitian Sari (2009) menunjukkan benih kacang panjang yang dicoating dengan formulasi
13
Pelapisan Benih (Seed Coating)
Pelapisan benih merupakan salah satu metode seed enhancement, yaitu suatu metode untuk memperbaiki mutu benih menjadi lebih baik melalui penambahan bahan kimia pada lapisan luar benih yang dapat mengendalikan perkecambahan benih. Penambahan bahan kimia lain yang menguntungkan seperti ZPT atau hormon sintetik, zat hara mikro, mikroba dan fungisida pada pelapis dapat digunakan untuk meningkatkan performansi benih di lapangan (Copeland & McDonald 2001).
Manfaat pelapisan benih menurut Kuswanto (2003) antara lain, yaitu melindungi benih dari gangguan atau pengaruh kondisi lingkungan selama penyimpanan atau dalam rantai pemasaran, mempertahankan kadar air benih, menyeragamkan ukuran benih, meningkatkan efisiensi pemakaian alat penanaman benih sehingga dapat digunakan untuk menanam berbagai jenis benih, memudahkan penyimpanan benih dan mengurangi dampak buruk kondisi lingkungan penyimpanan serta memperpanjang daya simpan benih.
Copeland dan McDonald (2001) menyatakan bahwa polimer untuk pelapis benih idealnya memiliki karakter sebagai berikut: (1) water-based polymer, (2) nilai viskositas yang rendah, (3) memiliki konsentrasi yang tinggi pada saat padat, (4) memiliki pengaturan keseimbangan antara hidrofilik dengan hidrofobik, (5) membentuk lapisan tipis keras selama pengeringan. Selain itu, menurut Kuswanto (2003) bahan coating yang digunakan tidak bersifat toxic terhadap benih, mudah pecah dan larut apabila terkena air sehingga tidak menghambat proses perkecambahan. Bahan coating juga bersifat porus, sehingga benih masih dapat memperoleh oksigen untuk respirasi, bersifat higroskopis, tidak bereaksi dengan pestisida, bersifat perambat dan penyimpan panas yang rendah serta harus mudah didapat dengan harga yang relatif murah, sehingga dapat menekan harga benih. Desai et al. (1997) melaporkan bahwa bahan polimer yang memiliki sifat adhesi yang baik untuk digunakan pada coating benih, diantaranya adalah arabic gum, dextran, methylcellulose, dan parafin.
14
terhadap mutu fisiologi benih, konsentrasi arabic gum yang baik untuk pelapisan benih cabai adalah 0.05 g ml-1. Pada konsentrasi tersebut nilai daya berkecambah dan potensi tumbuh maksimum masing-masing sebesar 95 % dan 98.5 %.
Arabic gum atau gum Arab berasal dari getah atau eksudat yang dihasilkan oleh pohon akasia (Acacia sp.) yang merupakan respon tanaman karena adanya pelukaan yang disebut dengan gummosis. Fennema (1996) melaporkan arabic gum tersusun atas monosakarida (D-galaktosa dan D-glucoronic acid) dan polisakarida. Polimer penyusun arabic gum antara lain β-D-galactose, L-arabinose, D-gluconic acid, L-rhamnose, dan 4-O-methyl-D-glucoronic acid. Karakter arabic gum antara lain yaitu dapat larut dalam air dingin, kelarutan dalam air cukup tinggi (lebih dari 50%), pengemulsi yang baik dan menstabilkan emulsi, viskositas relatif pada konsentrasi tinggi, dan pH berkisar antara 4.0 – 4.8.
Seed coating menggunakan PPFM telah dilakukan dan dipatenkan oleh Holland et al. (1996). Menurut Holland, jumlah populasi awal yang disarankan agar dapat meningkatkan perkecambahan pada benih kedelai adalah sekitar 107 -108 sel bakteri ml-1. Proporsi larutan coating pada benih dapat berkisar 0.1 sampai 25 % dari berat benih, bergantung dari tipe benihnya. Bahan perekat yang dapat digunakan dapat berupa vinyl pyrrolodine atau vinyl acetate, sedangkan carier
yang dapat digunakan, antara lain gambut atau vermikulit. Proses pengeringan benih dapat dilakukan dengan airdryer menggunakan suhu tidak lebih dari 30 0C.
15
Invigorasi
Invigorasi merupakan suatu proses yang dilakukan untuk meningkatkan vigor benih yang telah mengalami deteriorasi atau kemunduran (Ilyas 2012). Invigorasi sering juga disebut seed enhacement atau peningkatan mutu benih. Menurut Taylor et al. (1998), seed enhacement dapat didefinisikan sebagai perlakuan pasca panen yang dapat memperbaiki perkecambahan atau pertumbuhan kecambah atau memfasilitasi benih, dan materi lain yang diperlukan saat tanam. Definisi tersebut mencakup tiga metode umun, yaitu (1) pre-sowing hydration treatment atau priming, (2) teknologi coating dan (3) seed conditioning.
Teknik priming mencakup dua kategori, yaitu (1) penyerapan air secara terkontrol dan (2) tidak terkontrol. Penyerapan air secara tidak terkontrol merupakan metode dimana air tersedia bebas dan tidak dibatasi oleh lingkungan. Oleh karena itu, pengambilan air diatur oleh afinitas jaringan benih. Teknik umum yang digunakan dalam penyerapan air tidak terkontrol adalah mengimbibisi benih pada media blotters yang lembab atau merendam benih dalam air. Perendaman benih dalam air dapat dilakukan dengan atau tanpa menggunakan aerasi. Penyerapan air secara terkontrol adalah metode yang mengatur kadar air sehingga mencegah perkecambahan. Terdapat tiga metode yang dapat digunakan untuk membatasi pengambilan air, yaitu: priming dengan larutan, priming dengan teknik matriks padat dan drum priming dengan hidrasi terkontrol (Taylor et al. 1998)
Perlakuan invigorasi juga dapat diintegrasikan dengan hormon untuk meningkatkan perkecambahan. Selain itu, bisa pula dengan pestisida, biopestisida, dan mikroba yang menguntungkan untuk melawan penyakit benih dan bibit selama awal penanaman, atau untuk memperbaiki status hara, pertumbuhan, dan hasil tanaman (Ilyas 2012).
Menurut Sutariati (1998) perlakuan invigorasi dengan menggunakan GA3
secara nyata dapat meningkatkan viabilitas dan vigor benih cabai serta mampu meningkatkan konsentrasi protein pada benih. Sitorus (2005) juga melaporkan perendaman benih kacang hijau dengan GA3 50 ppm, 100 ppm dan 150 ppm
16
terhadap pembelahan dan perpanjangan sel, merangsang sintesis enzim hidrolisis serta meningkatkan plastisitas dan turgiditas sel.
17
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Biologi Tanah dan Rumah Kaca Balai Penelitian Tanah (Cimanggu-Bogor), Laboratorium PT. East West Seed Indonesia (Purwakarta) dan Laboratorium Teknologi Benih (IPB-Bogor) pada bulan November 2011 sampai Juli 2012. Penelitian ini terdiri atas beberapa tahapan kegiatan seperti yang tersaji pada Gambar 1.
Gambar 1 Alur pelaksanaan penelitian
Bahan dan Alat Penelitian
Bahan yang digunakan dalam penelitian ini adalah benih kedelai varietas Argomulyo (Lampiran 1), empat isolat Methylobacterium spp (TPB3, TD-TM1, TD-TM3, TD-J7), media kultur Amonium Mineral Salt (AMS), arabic gum, tokoferol, air steril, gambut, kertas stensil. Peralatan yang digunakan
Perbanyakan isolat Methylobacterium spp
Aplikasi ke benih
Invigorasi
Pengujian viabilitas benih di laboratorium dan rumah kaca
Seed coating
Penyimpanan 0-6 bulan pada suhu kamar
Pengujian viabilitas benih dan jumlah Methylobacterium spp
18
meliputi alat untuk mengkultur bakteri, waterbath sonicator, shaker, vortex,
aerator, alat pengecambah benih IPB 72-1, alat seed coating, plastik polipropilen,
sealer.
Metode Penelitian
Percobaan I: Aplikasi Methylobacterium spp. untuk invigorasi pada benih kedelai
Rancangan percobaan menggunakan Rancangan Acak Kelompok (RAK) faktorial dua faktor. Faktor pertama adalah aplikasi invigorasi, yaitu:
P0: kontrol (tanpa aplikasi perendaman air/isolat) P1: aplikasi perendaman benih dengan air steril
P2: aplikasi perendaman benih dengan Methylobacterium TD-TPB3 P3: aplikasi perendaman benih dengan Methylobacterium TD-J7
P4: aplikasi perendaman benih dengan Methylobacterium TPB3 + TD-TM3
P5: aplikasi perendaman benih dengan Methylobacterium TPB3 + TD-J7
Faktor kedua adalah tingkat viabilitas awal benih Argomulyo yang berbeda, yaitu: V1 (DB awal: 78 %, tanggal panen 18-10-2010); V2 (DB awal: 83 %, tanggal panen 8-4-2011); V3 (DB awal: 94 %, tanggal panen 25-8-2011). Sebanyak 18 kombinasi perlakuan diulang sebanyak 3 kali, sehingga diperoleh 54 satuan percobaan.
Model linear dalam Rancangan Acak Kelompok Faktorial sebagai berikut: Yijk = µ + αi+ βj+ (αβ)ij+ ρk + εijk
Keterangan:
Yijk = nilai pengamatan pada faktor aplikasi invigorasi taraf ke-i, faktor tingkat viabilitas awal benih taraf ke-j, dan ulangan ke-k
µ = nilai tengah pengamatan karakter yang diamati
αi = pengaruh utama dari faktor perlakuan aplikasi invigorasi ke-i
βj = pengaruh utama dari faktor perlakuan tingkat viabilitas awal benih ke-j
(αβ)ij = komponen interaksi dari faktor aplikasi invigorasi dan faktor tingkat
viabilitas awal benih
ρk = pengaruh aditif dari kelompok dan disumsikan tidak berinteraksi dengan perlakuan
19 i = perlakuan aplikasi invigorasi
j = perlakuan lot benih k = ulangan 1, 2, 3
Apabila diperoleh hasil yang berbeda nyata pada analisis sidik ragam dengan taraf kepercayaan 95 %, maka analisis dilakukan dengan menggunakan Duncan’s Multiple Range Test (DMRT).
Pemilihan isolat yang digunakan untuk aplikasi invigorasi didasarkan pada konsentrasi fitohormon tertinggi yang diproduksi Methylobacterium spp. menurut hasil penelitian Widajati et al. (2008) (Tabel 1). Selain itu, kemudahan isolat tersebut diperbanyak pada media cair juga menjadi pertimbangan karena dibutuhkan suspensi bakteri dalam jumlah yang cukup besar (+ 2 l per satu kombinasi perlakuan invigorasi). Berdasarkan penelitian sebelumnya
Methylobacterium spp tidak memiliki kekhususan inang sehingga koleksi isolat
Methylobacterium spp yang tercantum pada Tabel 1 dapat diaplikasikan pada berbagai jenis tanaman, yaitu diantaranya pada padi (Fitriani 2008), kakao (Sadikin 2009), cabai rawit (Afifah 2009), cabai besar (Goni 2010), dan kedelai (Danial 2011). Hal ini diperkuat oleh pernyataan Riupassa (2003), bahwa
Methylobacterium spp. memiliki pola adaptasi untuk mampu hidup pada lingkungan dengan daya dukung yang beragam.
Prosedur Penelitian
Persiapan Bakteri pada Media Cair
Peremajaan isolat dilakukan terlebih dahulu dengan cara mengambil 1 ose biakan murni dari koleksi agar miring kemudian digoreskan pada media padat AMS. Media padat AMS adalah media yang berisi larutan AMS (Lampiran 2) dan
trace elemen (Lampiran 3) sebanyak 25 μl l-1. Sebelum disterilisasi, terlebih dahulu diukur keasaman larutan dengan pH meter (pH=7) kemudian diberi penambahan bacto agar (20 g l-1). Media yang telah larut kemudian disterilisasi menggunakan autoklaf selama 20 menit pada suhu 121 0C.
20
membran filter berpori (millipore) 0.22 μm merek Millex®GP. Media tersebut kemudian dituang secara aseptik dalam cawan petri yang telah di sterilisasi. Media padat digunakan untuk menumbuhkan dan memperbanyak isolat bakteri sebanyak yang dibutuhkan sebelum dikulturkan kembali pada media cair. Media padat yang telah digoreskan isolat Methylobacterium spp. kemudian diinkubasi selama 7 hari pada inkubator.
Perbanyakan isolat pada media cair dilakukan dengan cara menyiapkan media cair AMS dengan penambahan trace elemen pada erlemeyer, kemudian disterilisasi. Penambahan metanol (10 ml l-1) dan triptofan (Lampiran 4) sebanyak 1 ml l-1 secara aseptik juga dilakukan setelah suhu media (+ 30 0C). Triptofan
yang diberikan terlebih dahulu disterilkan dengan cara menyaring larutan tersebut dengan membran filter berpori (millipore) 0.22 μm merek Millex®GP. Sebanyak 1 ose biakan murni dari media padat dimasukkan ke dalam erlemeyer yang berisi media cair AMS secara aseptik. Erlemeyer kemudian diinkubasi dalam orbital shaker selama 7 hari dengan kecepatan 100 rpm pada suhu kamar.
Sebelum digunakan untuk aplikasi, kerapatan bakteri dihitung dengan metode TPC (Total Plate Count). TPC dilakukan dengan melakukan serial pengenceran (10-1, 10-2, 10-3, 10-4, 10-5). Serial pengenceran dilakukan menggunakan garam fisiologis (NaCl 0.85 % ). Kemudian sebanyak 50 μl suspensi isolat pada pengenceran tersebut disebar menggunakan segitiga batang penyebar pada media padat AMS secara aseptik. Inkubasi dilakukan selama 7 hari pada suhu kamar untuk menumbuhkan bakteri yang telah disebar. Konsentrasi
Methylobacterium spp. yang digunakan untuk invigorasi benih ditunjukkan pada Tabel 3.
Tabel 3 Konsentrasi Methylobacterium spp. yang digunakan untuk invigorasi benih
Nama isolat Asal tanaman Konsentrasi
TD-TM3 Tomat 3.00 x 106 cfu ml-1
TD-TPB3 Terong Putih Bulat 4.82 x 107 cfu ml-1
21
Perendaman Benih
Aplikasi invigorasi dengan priming dilakukan dengan cara merendam benih dalam wadah gelas plastik berukuran 420 ml yang berisi kultur
Methylobacterium spp.
Perendaman benih dalam media air/isolat dilakukan selama 2 jam pada suhu kamar (29 0C) dan diberi suplai oksigen menggunakan aerator (Gambar 2). Pengunaan aerator bertujuan untuk memberikan suplai oksigen kepada benih sehingga meminimalisasi terjadinya kondisi anaerob. Perbandingan benih dengan air/isolat 3:10 (w/v).
Gambar 2 Proses perendaman benih dengan isolat Methylobacterium spp menggunakan aerator
Penanaman di laboratorium
Penanaman di laboratorium dilakukan menggunakan teknik Uji Kertas Digulung didirikan dalam plastik (UKDdp). Setiap perlakuan diulang sebanyak tiga kali dan setiap ulangan menggunakan sample sebanyak 100 benih. Benih dikecambahkan pada ekogerminator tipe IPB-72-1. Pengamatan dilakukan setiap hari hingga hitungan terakhir (hari ke-5).
Penanaman di rumah kaca
22
kg ha-1, SP-36 50 kg ha-1, KCl 75 kg ha-1 dan kompos 2 ton ha-1 dilakukan sesuai dengan dosis rekomendasi (BALITKABI 2012). Jika jarak tanam yang digunakan 40 cm x 10 cm, maka diasumsikan 1 ha lahan memiliki populasi tanaman kedelai sebanyak 250,000 sehingga setiap polibag diberikan pupuk urea 0.045 g, SP-36 0.072 g, KCl 0.18 g, dan kompos 8 g. Pupuk diberikan seluruhnya pada saat tanam, kecuali kompos yang telah diberikan 1 minggu sebelum tanam.
Setiap perlakuan terdiri dari 3 ulangan dimana setiap ulangan terdiri dari 3 polibag yang ditanam 4 benih per polibag dan disisakan 1 tanaman sehat saat berumur 14 hari setelah tanam (hst). Penanaman dilakukan sore hari sehingga diharapkan benih yang telah direndam isolat tidak mengalami perubahan suhu yang ekstrim.
Pemeliharaan
Pemeliharaan yang dilakukan meliputi penyiraman yang dilakukan setiap hari. Penyemprotan pestisida Decis (bahan aktif deltametrin 25 g l-1) dengan konsentrasi 0.5 ml l-1 dilakukan setiap minggu untuk mencegah serangan hama.
Pemanenan
Panen dilakukan pada umur 35 hst ketika tanaman kedelai telah mencapai masa vegetatif akhir. Panen dilakukan dengan cara mencabut tanaman dengan hati-hati kemudian akarnya dibersihkan dengan air mengalir. Akar yang telah bersih kemudian dibungkus dengan kertas koran.
a. Peubah yang diamati di Laboratorium
1. Kecepatan Tumbuh (% etmal-1)
Kecambah tumbuh (KCT) dihitung berdasarkan nilai pertambahan
perkecambahan (persentase kecambah normal) setiap hari pada kurun waktu perkecambahan dalam kondisi optimum.
Dimana: i = kurun waktu perkecambahan (selama 5 hari)
23 2. Daya Berkecambah (%)
Penghitungan daya berkecambah (DB) dilakukan berdasarkan persentase kecambah normal (KN) pada pengamatan pertama dan kedua. Pengamatan pertama pada hari ke-3 setelah tanam (KN hitungan I) dan pengamatan kedua pada hari ke-5 setelah tanam (KN hitungan II). Nilai Daya Berkecambah (DB) didapat dengan rumus:
Penghitungan indeks vigor (IV) dilakukan berdasarkan persentase kecambah normal pada pengamatan pertama (KN hitungan I), yaitu hari ke-3
% kecambah normal yang telah dibuang kotiledonnya pada hari ke-5. Kecambah dikeringkan pada oven dengan suhu 60 0C selama 3x24 jam.
b. Peubah yang diamati di Rumah Kaca:
1. Daya Tumbuh (%)
24
2. Tinggi Tanaman (cm)
Tinggi tanaman diukur mulai dari pangkal batang sampai titik tumbuh. Pengukuran tinggi tanaman dilakukan setiap minggu selama fase vegetatif. 3. Jumlah Daun
Tanaman kedelai dihitung jumlah daunnya ketika sudah ada daun trifoliat. Pengukuran jumlah daun dilakukan setiap minggu selama fase vegetatif.
4. Bobot Kering Tajuk (g)
Bobot kering tajuk ditetapkan dengan memisahkan bagian tajuk dan akar, kemudian tajuk dioven. Setelah dioven tajuk ditimbang bobot keringnya. Bobot kering tajuk dihitung setelah tanaman berumur 35 hst.
5. Bobot Kering Akar (g)
Bobot kering akar dilakukan dengan cara mengoven akar yang dipanen pada 35 hst. Akar dikeringkan pada oven dengan suhu 60 0C selama 3 x 24 jam. Setelah mencapai bobot yang konstan, akar kemudian ditimbang.
Percobaan II: Aplikasi Methylobacterium spp untuk mempertahankan daya simpan benih kedelai dengan teknik coating pada berbagai periode simpan
Penelitian ini bertujuan untuk mendapatkan formulasi coating yang dapat meningkatkan daya simpan dan vigor benih serta mampu mempertahankan viabilitas Methylobacterium spp. selama penyimpanan. Penelitian disusun menggunakan Rancangan Petak Tersarang (Nested Design).
Faktor pertama sebagai petak utama adalah periode simpan benih yaitu: S0 = 0 bulan S4 = 4 bulan
S1 = 1 bulan S5 = 5 bulan S2 = 2 bulan S6 = 6 bulan S3 = 3 bulan
Faktor kedua sebagai anak petak adalah formulasi coating dengan
Methylobacterium spp., yaitu: 1. P1 = Kontrol (tanpa coating)
2. P2 = Coating arabic gum
3. P3 = Coating arabic gum + tokoferol 800 ppm
25 5. P5 = Coating arabic gum + TD-TM3
6. P6 = Coating arabic gum + TD-TPB3
7. P7 = Coating arabic gum + TD-TPB3 + TD-TM1
8. P8 = Coating arabic gum + TD-TPB3 + TD-TM3
9. P9 = Coating arabic gum + gambut
10. P10 = Coating arabic gum + TD-TPB3 + TD-TM1 + gambut
11. P11= Coating arabic gum + TD-TPB3 + TD-TM3 + gambut
Model aditif linier :
Yijk = μ + Mi+ Kk(Mi) + Pj + (M*P)ij + εijk
Keterangan :
Yijk : respon perlakuan periode penyimpanan ke-i, formula coating ke-j
dan ulangan ke-k μ : rataan umum
Mi : pengaruh utama periode penyimpanan ke-i
Kk(Mi) : pengaruh ulangan ke-k dalam periode penyimpanan ke-i
Pj : pengaruh utama formula coating pada waktu ke-j
(M*P)ij : pengaruh interaksi antara periode penyimpanan dan formula coating
εijk : galat percobaan
Pemilihan isolat yang digunakan untuk proses seed coating didasarkan pada konsentrasi tokoferol tertinggi yang diproduksi Methylobacterium spp. menurut hasil penelitian Widajati et al. (2011) (Tabel 2).
Proses coating benih
Seed coating dilakukan dengan melapisi benih kedelai dengan bahan perekat dan media cair yang berisi isolat Methylobacterium spp. Bahan perekat yang digunakan adalah arabic gum 0.25 g ml-1 (Sari 2009). Konsentrasi isolat yang digunakan disajikan pada Tabel 4.
Tabel 4 Konsentrasi Methylobacterium spp. yang digunakan untuk seed coating
Nama isolat Asal tanaman Konsentrasi
TD-TM1 Tomat 5.80 x 107 cfu ml-1
TD-TM3 Tomat 1.00 x 106 cfu ml-1
26
Pelapisan benih dilakukan dengan mesin seed coater PT. East West Seed Indonesia. Formula coating diberikan dengan cara mencampur kultur cair
Methylobacterium spp dengan arabic gum sampai homogen. Perbandingan benih dengan formula coating adalah 20:1 (w/v). Perbandingan benih dengan gambut adalah 1:3 (w/w). Pemberian gambut yang telah disterilisasi, dilakukan setelah benih yang dicoating keluar dari mesin seed coater.
Benih yang telah terlapisi kemudian ditempatkan pada kain strimin, dikeringkan dengan airdryer selama + 1 jam pada suhu 30 0C hingga benih memiliki kadar air kurang dari 12 % agar aman untuk disimpan. Benih yang telah kering dimasukkan segera pada kemasan plastik, ditutup rapat menggunakan alat
sealer kemudian benih disimpan dalam kondisi suhu kamar selama 6 bulan (Suhu 28-29 0C, RH 71-78 %). Proses coating benih kedelai hingga dikemas untuk 6 bulan periode simpan dapat dilihat pada Lampiran 5.
Pengujian viabilitas benih dan jumlah Methylobacterium spp. yang hidup (viable count)
Pengujian viabilitas benih di laboratorium dilakukan menggunakan teknik Uji Kertas Digulung didirikan dalam plastik (UKDdp). Setiap perlakuan terdiri dari tiga ulangan dimana setiap ulangan terdiri dari 100 benih. Pengamatan terhadap peubah pengamatan dilakukan setiap hari.
Pengujian jumlah Methylobacterium spp yang hidup pada benih yang dicoating juga dilakukan setiap bulannya dengan metode Total Plate Count
27
Peubah yang diamati meliputi:
1. Kadar air (%) 2. Indeks vigor (%) 3. Daya berkecambah (%)
4. Kecepatan tumbuh (% etmal-1) 5. Bobot kering kecambah normal (g)
29
HASIL DAN PEMBAHASAN
Percobaan I: Aplikasi Methylobacterium spp. untuk invigorasi benih kedelai
A. Pengujian di Laboratorium
Hasil rekapitulasi analisis keragaman pengaruh lot benih dan perlakuan invigorasi terhadap beberapa variabel pengamatan pada uji di laboratorium (Lampiran 6) menunjukkan tidak terdapat interaksi antara tingkat viabilitas benih yang berbeda dengan perlakuan invigorasi terhadap peubah yang diamati. Hal ini bermakna bahwa perilaku lot benih terhadap berbagai perlakuan invigorasi adalah sama pada semua variabel yang diamati. Pengaruh perbedaan nilai kecepatan tumbuh (Tabel 5), daya berkecambah (Tabel 6), panjang akar (Tabel 7) dan bobot kering kecambah normal (BKKN) (Tabel 8) nyata disebabkan tiga tingkat viabilitas benih yang berbeda.
Tabel 5 Pengaruh faktor tunggal lot benih terhadap kecepatan tumbuh pada uji di laboratorium
Perlakuan Lot benih
V1 V2 V3
.….Kecepatan Tumbuh (% etmal-1)……
Kontrol (tanpa perendaman) 21.7 23.7 25.2
Air steril 20.1 22.0 25.7 Multiple Range Test (DMRT) pada taraf 5%
Kecepatan tumbuh (KCT) lot benih V3 nyata berbeda dengan lot benih V1
dan V2 sedangkan kecepatan tumbuh lot benih V1 dan V2 tidak berbeda nyata (Tabel 3). Hasil ini menginformasikan bahwa lot benih V3 memiliki performa kecepatan tumbuh yang lebih baik dibandingkan V1 dan V2.
Menurut Sadjad et al. (1999), kecepatan tumbuh merupakan salah satu tolok ukur yang mengindikasikan vigor kekuatan tumbuh benih. Nilai KCT yang tinggi
30
waktu yang relatif singkat. Ilyas (1986) melaporkan bahwa pada benih kedelai, tolok ukur kecepatan tumbuh memiliki korelasi yang erat dengan produksi benih per hektar dibandingkan daya berkecambah, keserempakan tumbuh bibit, tinggi tanaman dan jumlah buku produktif. Berdasarkan hasil penelitian tersebut dapat diasumsikan semakin tinggi kecepatan tumbuh suatu benih maka akan semakin tinggi juga produksi benihnya per hektar.
Lot benih V3 yang lebih vigor juga tampak pada peubah daya berkecambah (Tabel 6). Menurut Ilyas (2012), daya berkecambah merupakan salah satu tolok ukur untuk mengetahui viabilitas benih. Viabilitas benih menunjukan daya hidup benih, aktif secara metabolis dan memiliki enzim yang dapat mengkatalisis reaksi metabolisme yang diperlukan untuk perkecambahan dan petumbuhan kecambah.
Daya berkecambah benih lot V3 nyata berbeda dengan lot V1 dan lot V2. Lot benih V3 memiliki daya berkecambah yang lebih tinggi 13.5 % dibandingkan dengan lot V2 sedangkan dibandingkan lot V1, daya berkecambah lot V3 lebih tinggi 14.2 %. Lot benih V1 dan V2 tidak berbeda nyata secara statistik sehingga kemampuan daya berkecambah lot V1 dan lot V2 dianggap sama.
Tabel 6 Pengaruh faktor tunggal lot benih terhadap daya berkecambah pada uji di laboratorium
Perlakuan Lot benih
V1 V2 V3
.…..Daya Berkecambah (%)……
Kontrol (tanpa perendaman) 78.3 82.7 94.0
Air steril 71.7 73.0 84.0 Multiple Range Test (DMRT) pada taraf 5%
31
Kontrol (tanpa perendaman) 12.7 13.6 15.9
Air steril 13.3 13.7 13.6 Multiple Range Test (DMRT) pada taraf 5%
Akar merupakan bagian tanaman yang memiliki peranan sangat penting dalam pertumbuhan dan perkembangan tanaman. Akar yang lebih panjang memungkinkan kecambah untuk memenuhi kebutuhan air yang akan terus dibutuhkan hingga fase perkembangan dan pertumbuhan tanaman selanjutnya. Hal ini membuktikan bahwa lot benih yang memiliki viabilitas tinggi ditunjang oleh akar kecambah yang panjang.
32
Lot benih V3 tetap konsisten memiliki vigor terbaik dibandingkan lot benih V1 dan V2. Nilai rata-rata BKKN lot benih V3 lebih tinggi 0.7 g dibandingkan dengan lot benih V1 sedangkan lot benih V1 memiliki nilai rata-rata BKKN lebih tinggi 0.4 g dibandingkan dengan lot benih V2.
Bobot kering kecambah normal (BKKN) menggambarkan viabilitas potensial benih yang ditanam pada kondisi optimum. Sadjad et al. (1999) melaporkan benih yang vigor memiliki proses reaktifasi yang cepat apabila berada pada kondisi lingkungan optimal dan proses metabolisme tidak terhambat sehingga proses katabolisme maupun anabolisme berjalan normal dan benih menunjukkan kecepatan tumbuh yang tinggi dalam proses pertumbuhannya. Hal yang serupa juga dilaporkan Copeland dan McDonald (2001) yang menyatakan benih yang berviabilitas tinggi memiliki kemampuan untuk mensitesis material baru secara efisien dan dengan cepat mentransfer material tersebut untuk pertumbuhan kecambah sehingga mengakibatkan peningkatan akumulasi bobot kering kecambah.
Perlakuan invigorasi mampu memperbaiki performa perkecambahan pada variabel pengamatan indeks vigor (Tabel 9), dan panjang hipokotil (Tabel 10). Perlakuan invigorasi terbukti efektif untuk meningkatkan vigor benih Argomulyo yang memiliki kisaran nilai indeks vigor awal 28.7-42.3 %. Kenaikan indeks vigor rata-rata sebesar 8.9-20.6 % dibandingkan kontrol.
Tabel 9 Pengaruh faktor tunggal perlakuan invigorasi dan lot benih terhadap Multiple Range Test (DMRT) pada taraf 5%
33 TD-K2 mampu meningkatkan indeks vigor 17.3 % dibandingkan kontrol. Kurniati (2009) juga melaporkan bahwa perlakuan invigorasi pada benih padi dengan perendaman isolat Methylobacterium TD-L2, TD-TPB3 dan TD-G3 sangat nyata meningkatkan nilai indeks vigor pada benih tingkat viabilitas sedang dengan sebesar 45.3 %, 48 %, dan 36 % dibandingkan kontrol 22.7 %.
Panjang hipokotil benih kedelai yang diberi perlakuan invigorasi secara statistik berbeda nyata dengan benih yang tidak direndam (Tabel 10). Armstrong dan McDonald (1992) melaporkan perlakuan priming pada benih kedelai tanpa diikuti perlakuan pengeringan dapat meningkatkan panjang plumula, radikula dan berat kecambah. Walaupun demikian, hasil uji lanjut DMRT menginformasikan bahwa benih yang direndam dengan air steril secara statistik tidak berbeda nyata dengan perendaman isolat Methylobacterium spp., baik pada variabel indeks vigor maupun panjang hipokotil. Artinya, secara umum perendaman benih kedelai dengan Methylobacterium spp. selama 2 jam belum menunjukkan performa yang lebih baik dibandingkan dengan perendaman air steril.
Tabel 10 Pengaruh faktor tunggal lot benih terhadap panjang hipokotil pada uji di laboratorium Multiple Range Test (DMRT) pada taraf 5%
34
Methylobacteria membentuk asosiasi yang stabil antara bakteri dengan tanaman inangnya sehingga dapat meningkatkan regenerasi dan formasi akar.
B. Pengujian di Rumah Kaca
Hasil rekapitulasi analisis keragaman pengaruh perlakuan invigorasi dan lot benih terhadap beberapa variabel pengamatan pada uji di rumah kaca (Lampiran 8) menunjukkan bahwa tidak terdapat interaksi antara pengaruh perlakuan invigorasi dan lot benih terhadap semua variabel yang diamati. Hal ini bermakna perilaku lot benih terhadap berbagai perlakuan invigorasi untuk seluruh variabel yang diamati adalah sama. Perlakuan invigorasi tidak menghasilkan pertumbuhan yang lebih baik dibandingkan kontrol pada tinggi tanaman (Tabel 11), jumlah daun (Tabel 12), bobot tajuk (Tabel 13), panjang dan bobot kering akar (Tabel 14), dan daya tumbuh (Tabel 15).
Tabel 11 Pengaruh faktor tunggal lot benih dan perlakuan invigorasi terhadap tinggi tanaman 14 hst, 21 hst, 28 hst, dan 35 hst pada uji di rumah kaca
Perlakuan Tinggi Tanaman 14 hst (cm) Tinggi Tanaman 21 hst (cm)
Lot Benih Rata- Lot Benih Rata-
Perlakuan Tinggi Tanaman 28 hst (cm) Tinggi Tanaman 35 hst (cm)
35 Secara umum, tinggi tanaman kedelai pada umur 14, 21, 28 dan 35 hst memiliki pola yang sama (Tabel 11). Lot benih V3 secara statistik, nyata memiliki batang yang lebih tinggi dibandingkan dengan lot V1 dan lot V2 pada umur 14, 21 dan 28 hst. Trend yang hampir sama juga terjadi ketika tanaman berumur 35 hst, dimana lot V3 terlihat lebih tinggi dibandingkan dengan lot V1 dan V2, namun perbedaannya tidak nyata secara statistik.
Perlakuan invigorasi tidak memberikan peningkatan panjang batang tanaman dibandingkan kontrol saat tanaman berumur 14 hst. Pada saat tanaman berumur 35 hst, tidak terdapat pengaruh dari perbedaan lot benih dan perlakuan invigorasi. Akan tetapi pola pertumbuhan dari masing-masing perlakuan hampir sama dengan hasil yang didapat pada umur 14, 21, dan 28 hst. Benih yang tidak direndam dan perlakuan perendaman TD-TPB3 stabil memberikan nilai rata-rata tinggi tanaman yang lebih tinggi dibandingkan dengan perlakuan lain. Sedangkan perlakuan perendaman dengan isolat TD-J7 memperlihatkan nilai rata-rata tinggi tanaman yang terendah dibandingkan dengan perlakuan lainnya.
Jumlah daun tanaman pada umur 14 hst dan 21 hst secara statistik tidak dipengaruhi oleh lot benih maupun perlakuan invigorasi. Perlakuan invigorasi baru tampak memberikan pengaruh yang nyata terhadap variabel jumlah daun ketika tanaman berumur 28 hst dan 35 hst (Tabel 12). Perlakuan perendaman benih dengan air steril dan isolat TD-TPB3 menghasilkan jumlah daun yang sama dengan kontrol pada saat tanaman berumur 28 hst. Perendaman dengan isolat TD-J7, TD-TPB3 + TD-TD-J7, dan TD-TPB3 + TD-TM1 belum memberikan pengaruh jumlah daun yang lebih banyak pada umur 28 hst dibandingkan kontrol.
Ketika tanaman berumur 35 hst, seluruh perlakuan invigorasi tidak menghasilkan jumlah daun yang lebih banyak dibandingkan kontrol. Secara umum, perlakuan perendaman benih dengan isolat Methylobacterium spp saja belum cukup mampu memberikan kontribusi yang efektif pada variabel jumlah daun. Walaupun dengan perendaman benih diharapkan kolonisasi awal bakteri