TOKSISITAS DAN AKTIVITAS ANTIOKSIDAN EKSTRAK
DAUN POHON PENGHASIL GAHARU HASIL
INOKULASI
KARTIKA SARI DEWI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini menyatakan skripsi yang berjudul Toksisitas dan Aktivitas Antioksidan Ekstrak Daun Pohon Penghasil Gaharu Hasil Inokulasi adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada Perguruan Tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
KARTIKA SARI DEWI. Toksisitas dan Aktivitas Antioksidan Ekstrak Daun Pohon Penghasil Gaharu Hasil Inokulasi. Dibimbing oleh DUDI TOHIR dan ERDY SANTOSO.
Daun gaharu diduga mengandung senyawa metabolit sekunder yang tinggi sebagai respons terhadap infeksi jamur pada pohon penghasil gaharu. Penelitian ini bertujuan menentukan kandungan fitokimia, toksisitas, dan aktivitas antioksidan daun pohon penghasil gaharu jenis Aquilaria microcarpa dan A.malaccensis dengan dan tanpa inokulasi oleh jamur. Daun gaharu diekstraksi menggunakan pelarut metanol. Uji fitokimia pada ekstrak kasar yang diperoleh menunjukkan keberadaan tanin, steroid, fenol, dan flavonoid. Uji toksisitas dengan menggunakan larva udang menunjukkan bahwa semua sampel berpotensi sebagai bahan aktif, namun hanya daun muda A. microcarpa hasil inokulasi jamur asal Papua dan Gorontalo yang berpotensi antikanker dengan nilai LC50 < 30 μg/mL. Aktivitas penangkalan radikal bebas 2,2-difenil-1-pikrilhidrazil oleh ekstrak menunjukkan aktivitas antioksidan yang tinggi dengan nilai IC50 < 200 μg/mL. Aktivitas tertinggi ditunjukkan oleh daun muda A. microcarpa hasil inokulasi jamur asal Timor dan daun tua A. malaccensis tanpa inokulasi.
Kata kunci: antioksidan, Aquilaria microcarpa, Aquilaria malaccensis, daun gaharu, toksisitas.
ABSTRACT
KARTIKA SARI DEWI. Toxicity and Antioxidant Activity of Inoculated Gaharu-Producing Trees’ Leave Extract. Supervised by DUDI TOHIR and ERDY SANTOSO.
Gaharu leaves are expected to contain many secondary metabolic compounds as a response against fungal infection on gaharu-producing trees. This study aimed to determine the phytochemical components, cytotoxic and antioxidant activities of Aquilaria microcarpa and A. malaccensis leaves with and without fungal inoculation. Gaharu leaves were extracted by using methanol. The phytochemical assay of the crude extract revealed the presence of tannins, steroids, phenols, and flavonoids. The toxicity evaluation with brine shrimp showed that all samples were potencial as active ingredient, but only the juvenile leaves of A. microcarpa inoculated by fungi from Papua and Gorontalo had the potency as anticancer due to their LC50 value < 30 μg/mL. Free radical scavenging activity of the extracts against 2,2-diphenyl-1-picrylhydrazyl showed strong antioxidant activities with IC50 value of < 200 μg/mL. The highest antioxidant activity was exhibited by juvenile leaves of A.microcarpa inoculated by fungi from Timor and uninoculated mature leaves of A. malaccensis.
TOKSISITAS DAN AKTIVITAS ANTIOKSIDAN EKSTRAK
DAUN POHON PENGHASIL GAHARU HASIL
INOKULASI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada Departemen Kimia
KARTIKA SARI DEWI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Toksisitas dan Aktivitas Antioksidan Ekstrak Daun Pohon Penghasil Gaharu Hasil Inokulasi
Nama : Kartika Sari Dewi
NIM : G44080063
Disetujui oleh
Drs Dudi Tohir, MS Pembimbing I
Dr Erdy Santoso, MS Pembimbing II
Diketahui oleh
Prof Dr Ir Tun Tedja Irawadi, MS Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah yang berjudul “Toksisitas dan Aktivitas Antioksidan Ekstrak Daun Penghasil Gaharu Hasil Inokulasi” berhasil diselesaikan. Karya ilmiah ini disusun berdasarkan penelitian yang dilaksanakan pada bulan Juni 2012 hingga Maret 2013 di Laboratorium Kimia Organik, Departemen Kimia, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Bapak Drs Dudi Tohir, MS selaku pembimbing I dan Bapak Dr Erdy Santoso, MS selaku pembimbing II, serta Bapak Dr Ir Maman Turjaman, DEA yang telah banyak memberi saran, bimbingan, dan dukungan. Di samping itu, penghargaan penulis sampaikan kepada Bapak Budi Arifin, MSi dan Bapak Drs Muhammad Farid, MSi atas segala diskusi dan saran yang berkaitan dengan penelitian. Terima kasih juga kepada Bapak Sabur, Ibu Yenni Karmila atas bantuannya selama penelitian. Ungkapan terima kasih juga disampaikan kepada Ibu, Arif, Indra, Dian, Amin, Ami, Rifai, Taufik, Nenah dan teman-teman kimia 45 atas tambahan ilmu dan semangatnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
BAHAN DAN METODE 2
Bahan dan Alat 2
Metode 2
HASIL DAN PEMBAHASAN 5
Kadar Air dan Rendemen Ekstrak Kasar 5
Kandungan Fitokimia Ekstrak Kasar 6
Toksisitas Ekstrak Kasar 6
Aktivitas Antioksidan Ekstrak Kasar 8
SIMPULAN DAN SARAN 9
Simpulan 9
Saran 9
DAFTAR PUSTAKA 10
DAFTAR GAMBAR
1 Aquilaria microcarpa daun muda (a), daun sedang (b), dan daun tua (c) 3 2 Diagram persentase kadar air dan rendemen ekstrak kasar daun gaharu 5
3 Diagram nilai LC50 ekstrak kasar daun gaharu 7
4 Reaksi penangkapan H oleh DPPH 8
5 Larutan sampel dan DPPH setelah diinkubasi 8
6 Diagram nilai IC50 ekstrak kasar daun gaharu 9
DAFTAR LAMPIRAN
1 Bagan alir lingkup kerja penelitian 12
2 Nama jenis dan pengodean sampel 13
3 Kadar air simplisia daun 14
4 Rendemen ekstrak kasar sampel 16
5 Hasil uji fitokimia ekstrak kasar sampel 17
6 Hasil uji toksisitas ekstrak kasar sampel 18
PENDAHULUAN
Radikal bebas merupakan atom atau molekul yang tidak stabil dan sangat reaktif karena mengandung satu atau lebih elektron tidak berpasangan pada orbital terluarnya (Andayani et al. 2008). Efek yang ditimbulkan oleh radikal bebas di dalam tubuh meliputi kerusakan RNA, DNA, protein, dan lipid (Saleh et al. 2010), kemunduran fungsi sel tubuh, radang, katarak, jantung, kanker, dan aterosklerosis (Kuncahyo dan Sunardi 2007). Tubuh manusia dapat terlindungi dari kerusakan-kerusakan akibat radikal bebas tersebut dengan sistem pertahanan kompleks yang disebut antioksidan (Aris et al. 2007).
Pohon penghasil gaharu, disebut juga agarwood, eaglewood, atau karas, termasuk ke dalam divisi Termathophyta, subdivisi Angiospermae, kelas Dicotyledonae, ordo Myrtales, famili Thymeleacae, serta genus Aquilaria dan Gyrinops (Tarigan 2004). Gaharu merupakan komoditas hasil hutan bukan kayu yang terbentuk melalui proses patologis yang unik akibat respons terhadap infeksi jamur pada pohon pembentuk gaharu (Santoso et al. 2007).
Gaharu berupa resin, berbentuk gumpalan padat berwarna cokelat kehitaman sampai hitam, dan berbau harum, terdapat pada bagian kayu atau akar tanaman pohon inang. Gubal gaharu memiliki nilai ekonomi tinggi dan banyak digunakan sebagai bahan dasar minyak wangi, dupa, dan obat tradisional di Asia Timur (Yagura et al. 2005).
Gaharu mengandung senyawa fitoaleksin yang merupakan metabolit sekunder dari pohon penghasil gaharu sebagai mekanisme pertahanannya terhadap infeksi. Pohon gaharu sehat tidak pernah memproduksi seskuiterpenoid sebagai metabolit sekunder yang beraroma harum (Novriyanti 2009).
Gubal kayu yang merupakan tempat pembentukan gaharu diketahui mengandung senyawa agarofuran, agarospirol, jinkohol, jinkohon-eremol, kusunol, dihidrokaranon, dan kromon (Siran 2010). Berdasarkan penelitian sebelumnya, senyawa aktif pada gubal gaharu dapat mengurangi hipersensitivitas (Kim et al. 1997), menekan sistem saraf pusat sebagai antidepresan (Okugawa et al. 1996: Kim et al. 1997), serta berkhasiat antipiretik, antiradang (Zhou et al. 2008), antimikrob (Dash et al. 2008), dan antioksidan (Mega dan Swastini 2010).
Tingginya harga jual gaharu menyebabkan perburuan gaharu besar-besaran yang mengakibatkan semakin langkanya pohon penghasil gaharu. Aquilaria malaccensis, salah satu tumbuhan penghasil gaharu terbaik yang banyak tumbuh di Kalimantan, telah dimasukkan ke dalam Appendix II CITES sejak tahun 2004 sebagai tumbuhan yang terancam punah sehingga dalam penebangan dan perdagangannya perlu dibatasi (CITES 2004). Prospek untuk memulihkan produksi gaharu kembali terbuka dengan ditemukannya teknologi inokulasi yang mampu merekayasa produksi gaharu. Dengan teknologi ini, produksi gaharu dapat direncanakan dan dipercepat melalui induksi jamur pembentuk gaharu pada batang pohon penghasil gaharu (Siran 2010).
terutama daun. Hal ini menyebabkan daun gaharu memiliki potensi sebagai antioksidan.
Menurut Huda et al. (2009), ekstrak daun gaharu (Aquilaria malaccensis) mengandung senyawa metabolit sekunder alkaloid, flavonoid, terpenoid, steroid, dan saponin serta berpotensi sebagai antioksidan dengan nilai konsentrasi penghambatan (IC50) sebesar 800, 160, 140, dan 30 µg/mL berturut-turut untuk pelarut n-heksana, diklorometana, etil asetat, dan metanol. Oleh karena itu, penelitian ini bertujuan menguji kandungan fitokimia, toksisitas, dan aktivitas antioksidan daun pohon penghasil gaharu jenis Aquilaria microcarpa dan A. malaccensis tanpa inokulasi dan setelah diinokulasi dengan beberapa jenis jamur. Bagan alir penelitian ditunjukkan pada Lampiran 1.
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan antara lain daun gaharu dari pohon berumur 17 tahun jenis A. microcarpa tanpa inokulasi dan hasil inokulasi jamur (isolat asal Papua, Jambi, Gorontalo, dan Timor) pada tahun 2009, daun gaharu dari pohon A. malaccensis tanpa inokulasi dan hasil inokulasi jamur (Fusarium sp.), 2,2-difenil-1-pikrilhidrazil (DPPH), metanol, Tween 80, larva udang, kuersetin, HCl pekat, n-amil alkohol, pereaksi Lieberman-Buchard, kloroform-amonia, H2SO4 2 M, pereaksi Mayer, Dragendorf, Wagner, serbuk Mg, pereaksi FeCl3 1%, dan NaOH 10%.
Alat yang digunakan antara lain penguap putar, labu ukur, pelat tetes, mikropipet, dan spektrofotometer ultraviolet-tampak (UV-Vis) berkas ganda (Pharma Spec 1700 Shimadzu).
Metode
Penelitian ini terdiri atas tahap pengambilan sampel, preparasi sampel, ekstraksi maserasi dengan pelarut metanol, uji fitokimia (Harborne 1987), uji toksisitas dengan metode uji letalitas larva udang (BSLT), dan uji antioksidan dengan metode DPPH.
Pengambilan Sampel
Pengambilan sampel dilakukan di 2 lokasi yaitu KHDTK Carita, Banten (6° 28´ LS; 105° 85´ BB) dan Hutan Gunung Ciapus, Bogor (6° 36´ LS, 106° 47´ BB). Daun gaharu yang akan digunakan dalam penelitian berasal dari pohon jenis A. microcarpa (tanpa dan hasil inokulasi) yang diambil di Carita dan A. malaccensis (tanpa dan hasil inokulasi) yang diambil di Ciapus.
3
adalah beberapa tangkai setelah daun sedang sampai ujung dahan yang daunnya bertekstur kasar, sangat kaku, dan berwarna hijau tua.
Setelah disortasi, sampel kemudian diberi kode berupa deret 3 huruf yang menunjukkan identitas sampel tersebut. Huruf pertama menunjukkan jenis pohon. Daun dari pohon jenis A. microcarpa diberi kode A, sedangkan daun dari jenis A. malaccensis diberi kode B. Huruf kedua menunjukkan asal jamur/inokulat. Pada jenis A. microcarpa, pohon tanpa inokulasi (kontrol) diberi kode K, sedangkan pohon hasil inokulasi jamur asal Papua diberi kode P, Jambi diberi kode J, Gorontalo diberi kode G, dan Timor diberi kode T. Pada jenis A. malaccensis, pohon tanpa inokulasi (kontrol) diberi kode K, sedangkan pohon hasil inokulasi jamur diberi kode I. Huruf ketiga menunjukkan jenis daun. Daun muda diberi kode M, daun sedang S, daun daun tua T (Gambar 1). Pengodean sampel lebih jelas dapat dilihat pada Lampiran 2.
Gambar 1 Aquilaria microcarpa daun muda (a), sedang (b), dan tua (c). Preparasi Sampel
Sampel dikeringkan hingga kadar air kurang dari 10% di dalam oven bersuhu tidak lebih dari 50 oC. Setelah itu, digiling hingga menjadi serbuk yang selanjutnya disebut simplisia.
Ekstraksi
Simplisia daun gaharu ditimbang masing-masing 60 g lalu dimasukkan ke dalam labu erlenmeyer. Metanol ditambahkan dengan nisbah simplisia-metanol (1:13) dan maserasi dilakukan selama 3×24 jam. Filtrat disaring, dikumpulkan, lalu dipekatkan dengan penguap putar dan ditentukan rendemennya.
Penentuan Kadar Air (AOAC 950.46 (B) 2005)
Setiap simplisia ditimbang sebanyak 1 g kemudian dimasukkan ke dalam cawan porselen yang telah dipanaskan sebelumnya di dalam oven bersuhu 105 oC selama 30 menit sampai bobotnya konstan. Cawan berisi sampel dipanaskan di dalam oven bersuhu 105 oC selama 3 jam lalu didinginkan di dalam eksikator dan ditimbang. Pemanasan diulangi hingga diperoleh bobot konstan. Kadar air contoh ditentukan dengan persamaan
Kadar air (%) =
×
100%Keterangan: A = bobot contoh basah (g) B = bobot contoh kering (g)
4
Uji Fitokimia (Harborne 1987)
Uji alkaloid dilakukan dengan mencampurkan 0.25 g ekstrak kasar daun dengan 2.5 mL kloroform-amonia kemudian disaring. Filtrat yang diperoleh ditambah H2SO4 2 M beberapa tetes, kemudian dikocok sehingga terbentuk 2 lapisan. Lapisan asam (tidak berwarna) dibagi 3 ke dalam tabung reaksi, berturut-turut ditambahkan beberapa tetes pereaksi Mayer, Wagner, dan Dragendorf. Uji positif alkaloid apabila berturut-turut terbentuk endapan putih, cokelat , dan merah jingga.
Uji triterpenoid dan steroid dilakukan dengan mencampurkan 0.1 g ekstrak kasar daun dengan 5 mL etanol kemudian dipanaskan pada 50 °C dan disaring. Filtrat diuapkan hingga kering kemudian dilarutkan dengan eter. Lapisan eter diteteskan di atas pelat tetes, dikeringudarakan, lalu ditambahkan pereaksi Lieberman-Buchard. Uji positif triterpenoid jika terbentuk warna merah, dan positif steroid jika terbentuk warna hijau atau biru.
Uji saponin dan tanin dilakukan dengan mencampurkan 0.1 g ekstrak kasar daun dengan 10 mL akuades kemudian dipanaskan hingga mendidih selama 5 menit. Larutan disaring dan dibagi 2. Sebagian filtrat didinginkan lalu dikocok hingga berbusa. Hasil uji positif saponin jika busa tidak menghilang setelah 10 menit. Sebagian lagi ditambahkan larutan FeCl3 1%. Hasil uji positif tanin ditandai dengan terbentuknya warna biru tua atau hijau kehitaman.
Uji fenol dan flavonoid dilakukan dengan mencampurkan 0.1 g ekstrak kasar daun dengan 15 mL air kemudian dididihkan selama 2 menit dan disaring. Untuk uji fenol, 5 mL filtrat ditambahkan NaOH 10% beberapa tetes. Terbentuknya warna merah menunjukkan adanya senyawa fenolik. Untuk uji flavonoid, 5 mL filtrat dibagi ke dalam 3 tabung reaksi lalu setiap tabung ditambahkan 0.1 g serbuk Mg, 1 mL alkohol klorhidrat (campuran HCl 37% dan etanol 95% dengan volume yang sama), dan 5 mL amil alkohol. Tabung dikocok kuat. Hasil uji positif flavonoid ditunjukkan oleh terbentuknya warna merah, kuning, atau jingga pada lapisan amil alkohol.
Uji Toksisitas
Sebanyak ±100 mg telur udang ditetaskan dengan cara dimasukkan ke dalam wadah berisi air laut yang diberi suplai udara menggunakan aerator selama 48 jam. Sementara itu, larutan uji dibuat dengan melarutkan ekstrak kasar daun dengan air laut dan ditambahkan 2 tetes Tween 80 kemudian ditambahkan air laut kembali hingga konsentrasinya 2000 ppm (larutan stok).
Ke dalam tabung vial masing-masing dimasukkan 10 ekor larva udang lalu ditambahkan larutan uji dengan konsentrasi 0–500 ppm hingga volumenya 2 mL. Perlakuan dilakukan 2 kali ulangan. Larva udang kemudian diinkubasi selama 24 jam. Jumlah larva yang mati dihitung dan direratakan dari 2 kali ulangan yang dilakukan. Logaritma konsentrasi larutan ekstrak kasar daun sebagai sumbu x dan nilai probit persentase kematian larva udang sebagai sumbu y dialurkan ke dalam kurva. Nilai konsentrasi mematikan 50% (LC50) ditentukan dari persamaan garis yang diperoleh.
Uji Antioksidan
konsentrasi 10, 20, 30, 40, 50, dan 60 ppm serta larutan kuersetin sebagai standar dengan konsentrasi 0, 1, 2, 3, 4, dan 5 ppm juga disiapkan dengan pelarut metanol dalam labu takar 10 mL.
Sampel dan standar masing-masing dimasukkan sebanyak 4 mL ke dalam tabung reaksi. Blangko, yaitu 4 mL metanol juga dipipet ke dalam tabung reaksi. Larutan DPPH 126.80 µM ditambahkan sebanyak 2 mL ke dalam setiap tabung tepat sebelum campuran diinkubasi pada suhu inkubasi 37 °C selama 30 menit. Campuran diukur absorbansnya pada panjang gelombang 517 nm. Nilai konsentrasi penghambatan 50% (IC50) dihitung dari persentase aktivitas penghambatan radikal DPPH dan logaritma konsentrasi sampel dan standar. Uji antioksidan dilakukan di Laboratorium Bersama, Departeman Kimia, Institut Pertanian Bogor.
HASIL DAN PEMBAHASAN
Kadar Air dan Rendemen Ekstrak Kasar
Kadar air menunjukkan jumlah air yang terikat secara fisis pada sampel. Simplisia daun gaharu dikeringkan pada suhu tidak lebih dari 50 °C sebelum ditentukan kadar airnya. Penentuan kadar air berguna untuk menduga keawetan atau ketahanan sampel dalam penyimpanan serta untuk mengoreksi rendemen yang dihasilkan. Kadar air simplisia bahan alam biasanya harus lebih rendah dari 10% agar bakteri atau jamur tidak tumbuh sehingga simplisia dapat disimpan dalam waktu yang lama (Winarno 1992).
Gambar 2 memperlihatkan bahwa kadar air tertinggi terdapat pada sampel AKS dan rendemen terendah diperoleh dari sampel ATT, sedangkan rendemen tertinggi diperoleh dari sampel APT. Secara keseluruhan, simplisia daun gaharu memiliki kadar air 11.90–18.01% (Lampiran 3) sehingga dapat digunakan, tetapi tidak tahan lama disimpan. Sementara itu, rendemen yang diperoleh berkisar 3.37–11.20% (Lampiran 4). Keragaman rendemen disebabkan oleh perbedaan sampel, kondisi ekstraksi, penyaringan, dan pemekatan.
Gambar 2 Diagram persentase kadar air dan rendemen ekstrak kasar daun gaharu
0.00
AKM AKT APS AJM AJT AGS ATM ATT BKS BIM BIT
6
Rendemen ekstrak kasar daun gaharu diperoleh dari proses maserasi dalam pelarut metanol. Daun gaharu sebelumnya digiling terlebih dahulu untuk memperluas permukaan sampel yang kontak dengan pelarut. Menurut Huda et al. (2009), pelarut metanol memberikan rendemen yang lebih tinggi dan nilai IC50 yang lebih rendah dibandingkan dengan n-heksana, diklorometana, dan etil asetat. Metanol mampu mengekstraksi senyawa polar dan nonpolar karena tetapan dielektriknya besar. Selain itu, metanol mudah diuapkan dan harganya relatif murah.
Kandungan Fitokimia Ekstrak Kasar
Berdasarkan hasil uji, seluruh ekstrak kasar metanol daun gaharu mengandung tanin, steroid, fenol, dan flavonoid (Lampiran 5). Tanin, fenol, dan flavonoid memiliki gugus fungsi fenol yang biasanya aktif sebagai antioksidan. Intensitas warna tanin, steroid, fenol, dan flavonoid tidak begitu berbeda pada ekstrak gaharu kontrol dan hasil inokulasi.
Saponin dan alkaloid tidak terdeteksi oleh uji fitokimia. Hal ini dimungkinkan karena sedikit atau tidak adanya kandungan kedua senyawa tersebut. Triterpenoid ataupun seskuiterpenoid juga tidak terdeteksi pada uji fitokimia meskipun senyawa tersebut merupakan penciri dari terbentuknya gaharu. Di sisi lain, menurut Huda et al. (2009), ekstrak daun gaharu (A. malaccensis) mengandung senyawa metabolit sekunder alkaloid, flavonoid, terpenoid, steroid, dan saponin. Hal ini dapat disebabkan oleh persebaran metabolit sekunder yang tidak merata pada seluruh daun.
Toksisitas Ekstrak Kasar
Senyawa bioaktif hampir selalu bersifat toksik pada dosis tinggi. Oleh karena itu, daya bunuh in vivo (toksisitas) senyawa terhadap suatu organisme hewan dapat digunakan untuk menapis ekstrak tumbuhan yang mempunyai bioaktivitas dan juga memantau fraksi bioaktif selama fraksinasi dan pemurnian (Juniarti et al. 2009). Uji toksisitas dalam penelitian ini menggunakan metode BSLT dengan larva udang (Artemia salina Leach.) sebagai bioindikator. Metode ini praktis dan murah karena telur udang A. salina dapat dengan mudah diperoleh dan dapat disimpan bertahun-tahun dalam keadaan kering (McLaughlin et al. 1998).
Uji toksisitas dilakukan dengan menghitung konsentrasi toksikan (ekstrak metabolit sekunder) yang dapat mematikan 50% dari populasi awal hewan uji, yaitu larva udang selama 24 jam (LC50). Respons hewan uji terhadap toksikan selalu binomial (mati/tidak mati) dan hubungan antara respons dan konsentrasi toksikan selalu berbentuk sigmoid. Analisis probit digunakan untuk mengubah bentuk kurva sigmoid ini ke bentuk linear agar mudah dianalisis (Finney 1971). Metode analisis probit dilakukan secara manual.
7
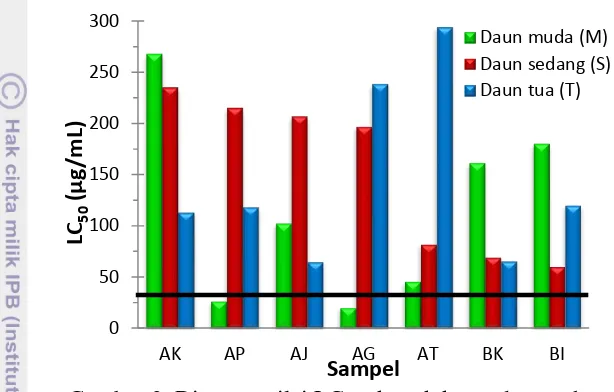
Perhitungan LC50 dapat dilihat pada Lampiran 6 dan diagram nilai LC50 dari setiap ekstrak dapat dilihat pada Gambar 3. Berdasarkan hasil uji toksisitas, seluruh sampel kecuali APM dan AGM memiliki nilai LC50 > 30 μg/mL. Hal tersebut menunjukkan bahwa seluruh sampel bersifat toksik, tetapi hanya APM dan AGM yang berpotensi sebagai antikanker.
Gambar 3 Diagram nilai LC50 ekstrak kasar daun gaharu
Secara umum, nilai LC50 sampel daun A. malaccensis lebih rendah sehingga dapat dikatakan lebih toksik dibandingkan dengan A. microcarpa. Sampel A. microcarpa setelah diinokulasi juga cenderung lebih toksik daripada sebelum diinokulasi. Sebaliknya pada A. malaccensis, sampel sebelum diinokulasi jauh lebih toksik daripada setelah diinokulasi.
Sampel AKT lebih toksik dibandingkan dengan AKM dan AKS, demikian pula sampel BKT lebih toksik daripada sampel BKM dan BKS. Hal ini menunjukkan bahwa sebelum diinokulasi, toksisitas cenderung meningkat seiring bertambahnya umur daun. Berbeda dengan sampel setelah diinokulasi, daun muda cenderung lebih toksik, kecuali pada sampel AJM dan BIM.
Perbedaan toksisitas antara A.microcarpa dan A. malaccensis tidak hanya disebabkan oleh perbedaan jenis pohon, tetapi juga oleh perbedaan lokasi tumbuh pohon. Lokasi pengambilan sampel di Carita memiliki topografi bergelombang sampai bergunung. Curah hujan tahunan sekitar 3.959 mm. Suhu minimum 26 °C dan maksimum 32 °C. Kelembapan udara rata-rata berkisar antara 77% dan 85%. Lokasi pengambilan sampel di Ciapus juga memiliki topografi bergelombang sampai bergunung, tetapi curah hujan tahunan lebih rendah (sekitar 3600 mm), demikian pula suhu udara (24–30 °C). Kelembapan udara rata-rata berkisar antara 80% dan 90% (Pratiwi 2009).
Suhu dan kelembapan lokasi tumbuh pohon, keterbukaan tajuk, virulensi inokulan yang digunakan, jarak antartitik lubang, dan faktor-faktor lain pada saat inokulasi juga dapat memengaruhi kecocokan jamur (isolat) dengan pohon inang (Siran 2010). Faktor yang memengaruhi kecocokan dalam inokulasi juga memengaruhi tidak meratanya proses metabolisme dari pohon yang terinfeksi sehingga metabolit sekunder yang tersebar antardaun tidak sama.
8
Aktivitas Antioksidan Ekstrak Kasar
Radikal bebas merupakan senyawa yang sangat reaktif dan tidak stabil yang dihasilkan di dalam tubuh selama proses metabolisme atau berasal dari lingkungan luar (Saleh et al. 2010). Antioksidan bekerja mempertahankan oksidan pada jumlah yang optimum dan mereduksi radikal bebas serta menghentikan pembentukannya sebelum merusak sel-sel dalam tubuh (Aris et al. 2007).
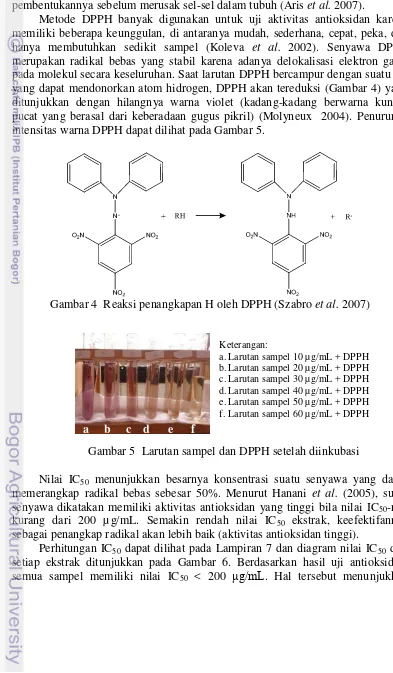
Metode DPPH banyak digunakan untuk uji aktivitas antioksidan karena memiliki beberapa keunggulan, di antaranya mudah, sederhana, cepat, peka, dan hanya membutuhkan sedikit sampel (Koleva et al. 2002). Senyawa DPPH merupakan radikal bebas yang stabil karena adanya delokalisasi elektron gasal pada molekul secara keseluruhan. Saat larutan DPPH bercampur dengan suatu zat yang dapat mendonorkan atom hidrogen, DPPH akan tereduksi (Gambar 4) yang ditunjukkan dengan hilangnya warna violet (kadang-kadang berwarna kuning pucat yang berasal dari keberadaan gugus pikril) (Molyneux 2004). Penurunan intensitas warna DPPH dapat dilihat pada Gambar 5.
Gambar 4 Reaksi penangkapan H oleh DPPH (Szabro et al. 2007)
Keterangan:
a.Larutan sampel 10 µg/mL + DPPH
b.Larutan sampel 20 µg/mL + DPPH
c.Larutan sampel 30 µg/mL + DPPH
d.Larutan sampel 40 µg/mL + DPPH
e.Larutan sampel 50 µg/mL + DPPH
f.Larutan sampel 60 µg/mL + DPPH
Gambar 5 Larutan sampel dan DPPH setelah diinkubasi
Nilai IC50 menunjukkan besarnya konsentrasi suatu senyawa yang dapat memerangkap radikal bebas sebesar 50%. Menurut Hanani et al. (2005), suatu senyawa dikatakan memiliki aktivitas antioksidan yang tinggi bila nilai IC50-nya kurang dari 200 µg/mL. Semakin rendah nilai IC50 ekstrak, keefektifannya sebagai penangkap radikal akan lebih baik (aktivitas antioksidan tinggi).
Perhitungan IC50 dapat dilihat pada Lampiran 7 dan diagram nilai IC50 dari setiap ekstrak ditunjukkan pada Gambar 6. Berdasarkan hasil uji antioksidan, semua sampel memiliki nilai IC50 < 200 μg/mL. Hal tersebut menunjukkan
seluruh sampel memiliki aktivitas antioksidan yang baik. Namun, aktivitas tersebut belum sebaik standar kuersetin yang memiliki nilai IC50 2.91 μg/mL.
Gambar 6 Diagram nilai IC50 ekstrak kasar daun gaharu
Aktivitas antioksidan yang sangat baik pada sampel A. microcarpa ditunjukkan oleh sampel hasil inokulasi jamur asal Gorontalo dan asal Timor dengan nilai IC50 terkecil ialah 13.51 μg/mL pada sampel ATM. Sementara pada sampel A. malaccensis, aktivitas antioksidan yang sangat baik ditunjukkan oleh sampel tanpa inokulasi, yaitu BKT dengan nilai IC50 10.69 μg/mL. Secara keseluruhan, perbedaan aktivitas antarsampel tidak terlalu jauh. Nilai IC50 yang tidak terlalu jauh berbeda antara daun gaharu kontrol dan hasil inokulasi menunjukkan bahwa aktivitas antioksidan sampel tidak dipengaruhi oleh jenis daun dan inokulasi pohon penghasil gaharu.
SIMPULAN DAN SARAN
Simpulan
Semua ekstrak kasar metanol daun gaharu yang diujikan mengandung tanin, steroid, fenol, dan flavonoid. Semua sampel tersebut juga bersifat toksik dan memiliki aktivitas antioksidan yang baik. Sampel daun A. microcarpa muda setelah diinokulasi lebih toksik daripada sampel lain, dengan sampel yang diinokulasi dengan jamur asal Papua dan Gorontalo berpotensi sebagai antikanker karena memiliki nilai LC50 < 30 μg/mL. Aktivitas antioksidan terbaik ditunjukkan oleh sampel A. malaccensis tanpa inokulasi, dengan nilai IC50 terhadap radikal DPPH 10.69 μg/mL. Aktivitas antioksidan sampel tidak dipengaruhi oleh jenis daun dan inokulasi pohon penghasil gaharu.
Saran
Penelitian lebih lanjut dapat dilakukan untuk pengembangan produksi daun gaharu sebagai teh. Fraksionasi lebih lanjut dan analisis kualitatif serta kuantitatif komponen-komponen diperlukan untuk menentukan senyawa murni yang
berpotensi sebagai antikanker pada sampel APM dan AGM, serta sebagai antioksidan pada sampel AGS, AGT, ATM, BKS, dan BKT.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemist. 2005. Official Methods of Analysis. Washington: AOAC International.
Andayani R, Lisawati Y, Maimunah. 2008. Penentuan aktivitas antioksidan, kadar fenolat total dan likopen pada buah tomat (Solanum lycopersicum L). J Sains Teknol Farm. 13:1-9.
Ariffin SHZ, Haryani WH, Omar W, Ariffin ZZ, Safian MF, Senafi S, Wahab RMA. 2009. Intrinsic anticarcinogenic effects of Piper sarmentosum ethanolic extract on a human hepatoma cell line. Cancer Cell Int Primary Res. 9(6):1-9.Open Access
Aris SRS, Mustafa S, Ahmat N, Jaafar FM, Ahmad R et al. 2007. Phenolic content and antioxidant activity of fruits of Ficus deltoidea var Angustifolia sp. Malay J Anal Sci. 13:146-150.
[CITES] Convention on International Trade in Endangered Species of Wild Flora and Fauna. 2004. Amendments to Appendices I and II of CITES. Sydney (AU): CITES.
Dash M, Patra JK, Panda PP. 2008. Phytochemical and antimicrobial screening of extracts of Aquilaria agallocha Roxb. African J Biotechnol. 7:3531-3534. Finney DJ. 1971. Probit Analysis. Ed ke-3. Cambridge (GB): Cambridge Univ Pr. Hanani E, Abdul M, Ryany S. 2005. Identifikasi senyawa antioksidan dalam
Callyspongia sp dari Kepulauan Seribu. Maj Ilmu Kefarmasian. 2:127-133. Harborne JB. 1987. Metode Fitokimia. Padmawinata K, Soediro I, penerjemah;
Niksolihin S, editor. Bandung: ITB. Terjemahan dari: Phytochemical Methods.
Huda AWN, Munira MAS, Fitrya SD, Salmah M. 2009. Antioxidant activity of Aquilaria malaccensis (Thymelaeaceae) leaves. Pharmacognosy Res. 1:270-273.
Juniarti, Osmeli D, Yuhernita. 2009. Kandungan senyawa kimia, uji toksisitas (brine shrimp lethality test) dan antioksidan (1,1-diphenyl-2-picrylhydrazyl) dari ekstrak daun saga (Abrus precatorius L.). Makara Sains. 13(1):50-54. Kim YC, Lee EH, Lee YM, Kim HK, Song BK, Lee EJ et al. 1997. Effect of the
aqueous extract of Aquilaria agallocha stems on the immediate hypersensitivity reactions. J Ethnopharmacol. 58:31-38.
Koleva I, van Beek T, Linnssen JPH, de Groot A, Evstarieva LN. 2002. Screening of plant extracts for antioxidant activity: a comparative study on three testing methods. Phytochem Anal. 13:494-500.
11
McLaughlin JL, Rogers LL, Anderson JE. 1998. The use of biological assays to evaluate botanicals. Drug Information J. 22:513-524.
Mega IM, Swastini DA. 2010. Screening fitokimia dan aktivitas antiradikal bebas ekstrak metanol daun gaharu (Gyrinops versteegii). J Kim. 4(2):187-192. Meyer BN, Ferrigni NR, Putnam JE, Jacobsen LB, Nichols DE, McLaughlin JL et
al. 1982. Brine shrimp: a convenient general bioassay for active plant constituents. Planta Med. 45:31-34.
Molyneux P. 2004. The use of stable free radical diphenylpicryl-hydrazyl (DPPH) for estimazing antioxidant activity. Songklanakarin J Sci Technol. 26:211-219.
Novriyanti E. 2009. Kajian kimia gaharu hasil inokulasi Fusarium sp. pada Aquilaria microcarpa. Di dalam: Pengembangan Teknologi Produksi Gaharu Berbasis Pemberdayaan Masyarakat Sekitar Hutan. Prosiding Workshop Gaharu; 2009 Apr 29; Bogor, Indonesia. Bogor (ID): Pusat Penelitian dan Pengembangan Hutan dan Konservasi Alam bekerja sama dengan ITTO PD 425/06 Rev.I(1). hlm 23-38.
Okugawa H, Ueda R, Mutsumoto K, Kawanishi K, Kato A. 1996. Effect of jinkoh-eremol and agarospiral from agarwood on the central nervous system in mice. Planta Med. 62:2-6.
Pratiwi. 2009. Karakteristik lahan habitat pohon penghasil gaharu di beberapa hutan tanaman di Jawa Barat. Di dalam: Pengembangan Teknologi Produksi Gaharu Berbasis Pemberdayaan Masyarakat Sekitar Hutan. Prosiding Workshop Gaharu; 2009 Apr 29; Bogor, Indonesia. Bogor (ID): Pusat Penelitian dan Pengembangan Hutan dan Konservasi Alam bekerja sama dengan ITTO PD 425/06 Rev.I(1). hlm 171-192.
Saleh MA, Clark S, Woodard B, Deolu-Sobogun SA et al. 2010. Antioxidant and free radical scavenging activities of essential oils. Ethnicity and Disease. 20:S1 78-S1 82.
Santoso E, Agustini L, Sitepu IR, Turjaman M. 2007. Efektivitas pembentukan gaharu dan komposisi senyawa resin gaharu pada Aquilaria spp. J. Penelitian Hutan dan Konservasi Alam. 4(6):543-551.
Siran SA. 2010. Perkembangan pemanfaatan gaharu. Di dalam: Siran SA, Turjaman M, editor. Pengembangan Teknologi Produksi Gaharu Berbasis Pemberdayaan Masyarakat Sekitar Hutan. Bogor (ID): Pusat Penelitian dan Pengembangan Hutan dan Konservasi Alam. hlm 1-34.
Szabro MR, Iditoiu C, Chambre D, Lupea AX. 2007. Improved DPPH determination for antioxidant activity spectrophotometric assay. Chem Papers. 61(3):214-216.
Tarigan K. 2004. Profil Pengusahaan (Budidaya) Gaharu. Jakarta (ID): Pusat Bina Penyuluhan Kehutanan, Departemen Kehutanan.
Winarno FG. 1992. Kimia Pangan dan Gizi. Jakarta (ID): Gramedia.
Yagura T, Shibayama N, Ito M, Kiuchi F, Honda G. 2005. Three novel diepoxy tetrahydrochromones from agarwood artificially produced by intentional
wounding. Tetrahedron Lett. 46:4395-4398.
Zhou M, Wang H, Suolangjiba, Kou J, Yu B. 2008. Antinociceptive and anti-inflammatory activities of Aquilaria sinensis (Lour.) Gilg. leaves extract. J Ethnopharmacol. 117:345-350.
12
Lampiran 1 Bagan alir lingkup kerja penelitian Daun gaharu segar (A. microcarpa, A. malaccensis)
- Dikeringkan (50 °C, 3 hari)
- Digiling
Penentuan kadar air Simplisia
-Diekstraksi dengan metanol (3×24 jam) -Dipekatkan dengan penguap putar
Ekstrak kasar
Uji fitokimia Uji toksisitas Uji Antioksidan - alkaloid (Metode BSLT) (Metode DPPH) - triterpenoid
- steroid - saponin
- tanin LC50 IC50 - fenol
- flavonoid
13
Lampiran 2 Nama jenis dan pengodean sampel
Bahan yang digunakan adalah daun gaharu yang berasal dari pohon A. microcarpa (KHDTK Carita, Banten) dan A. malaccensis (Ciapus, Bogor) tanpa inokulasi dan dengan inokulasi.
14
15
Kadar air (%) = bobot basah sampel–bobot kering sampel
bobot basah sampel 100
16
Lampiran 4 Rendemen ekstrak kasar sampel Sampel Bobot sampel
awal (g) Kadar air (%)
Bobot ekstrak
(g) Rendemen (%)
AKM 60.10 14.31 2.4495 4.76
AKS 60.07 18.01 2.9557 6.00
AKT 60.10 14.30 2.7886 5.41
APM 60.05 13.96 2.5789 4.99
APS 60.08 13.63 2.9740 5.73
APT 60.05 14.35 5.7607 11.20
AJM 60.04 14.35 3.2193 6.26
AJS 60.06 12.78 1.9564 3.73
AJT 60.07 15.20 1.8891 3.71
AGM 60.08 14.01 2.7555 5.33
AGS 60.14 12.92 2.9323 5.60
AGT 60.08 13.56 4.5067 8.68
ATM 60.04 14.83 3.5430 6.93
ATS 60.06 14.48 2.8602 5.57
ATT 60.08 12.21 1.7750 3.37
BKM 60.10 13.18 4.9655 9.52
BKS 40.11 13.81 2.6460 7.65
BKT 40.08 11.90 1.9985 5.66
BIM 40.06 12.68 2.3424 6.70
BIS 40.10 13.14 2.2540 6.47
BIT 60.15 12.25 2.4500 4.64
Contoh perhitungan: Sampel AKM
Rendemen (%) = bobot ekstrak
bobot a al sampel (1 – kadar air) 100
= 2. g
0.10 g (1 – 0. ) 100
17
Lampiran 5 Hasil uji fitokimia ekstrak kasar sampel A. microcarpa
Sampel Saponin Tanin Alkaloid Triterpenoid Steroid Fenol Flavonoid
AKM - + - - + + +
AKS - + - - + + +
AKT - + - - + + +
APM - + - - + + +
APS - + - - + + +
APT - + - - + + +
AJM - + - - + + +
AJS - + - - + + +
AJT - + - - + + +
AGM - + - - + + +
AGS - + - - + + +
AGT - + - - + + +
ATM - + - - + + +
ATS - + - - + + +
ATT - + - - + + +
A. microcarpa
Sampel Saponin Tanin Alkaloid Triterpenoid Steroid Fenol Flavonoid
BKM - + - - + + +
BKS - + - - + + +
BKT - + - - + + +
BIM - + - - + + +
BIS - + - - + + +
BIT - + - - + + +
Keterangan: – : Hasil negatif + : Hasil positif
Uji tanin Uji steroid
18
18 Lampiran 6 Hasil uji toksisitas ekstrak kasar sampel
A. microcarpa kontrol
mati %kematian Nilai probit
Jumlah larva
mati %kematian Nilai probit
Jumlah larva
21
lanjutan Lampiran 6 A. malaccensis inokulasi
Konsentrasi (µg/mL)
BIM BIS BIT
Jumlah larva mati
%
kematian Nilai probit
Jumlah larva
mati % kematian Nilai probit
Jumlah larva
mati % kematian Nilai probit Ulangan
1 2 1 2 1 2 1 2 1 2 1 2
10 0 0 0 0 - - 0 0 0 0 - - 0 0 0 0 - -
50 1 1 10 10 3.72 3.72 4 5 40 50 4.75 5.00 0 1 0 10 - 3.72
100 2 1 20 10 4.17 3.72 7 6 70 60 5.52 5.25 4 5 40 50 4.75 5.00
150 3 3 30 30 4.48 4.48 9 10 90 100 6.28 8.09 4 4 40 40 4.75 4.75
200 3 4 30 40 4.48 4.75 - - - 8 8 80 80 5.84 5.84
300 6 8 60 80 5.25 5.84 - - - 9 10 90 100 6.28 8.09
400 9 10 90 100 6.28 8.09 - - - -
LC50 206.96 153.56 62.18 58.70 133.30 108.06
22
22 Contoh perhitungan:
Sampel AKM Ulangan 1 %kematian = jumlah larva mati
jumlah larva uji 100
= 1
10
= 10%
Kurva hubungan nilai probit dan log konsentrasi sampel AKM Ulangan 1
Persamaan regresi linear: y = 2.1244x – 0.0114 LC50 diperoleh saat y = 5, oleh karena itu: 5 = 2.1244x – 0.0114
x = (5 + 0.0114) / 2.1244 x = 2.3590
log konsentrasi = 2.3590, maka nilai LC50 sebesar 228.55 μg/mL
23
Lampiran 7 Hasil uji antioksidan ekstrak kasar sampel A. microcarpa kontrol
Konsentrasi (µg/mL)
AKM AKS AKT
Absorbans % inhibisi Absorbans % inhibisi Absorbans % inhibisi
Ulangan
1 2 1 2 1 2 1 2 1 2 1 2
Blangko 0.3430 0.3430 0.00 0.00 0.3430 0.3430 0.00 0.00 0.3430 0.3430 0.00 0.00
10 0.3000 0.2780 12.54 18.95 0.2800 0.2720 18.37 20.70 0.3270 0.3260 4.66 4.96
20 0.2670 0.2580 22.16 24.78 0.2240 0.2000 34.69 41.69 0.3030 0.3070 11.66 10.50
30 0.2330 0.1990 32.07 24.78 0.1850 0.1310 46.06 61.81 0.2010 0.2090 41.40 39.07
40 0.1840 0.1320 46.36 61.52 0.1240 0.0780 63.85 77.26 0.1970 0.1990 42.57 41.98
50 0.1660 0.1110 51.60 67.64 0.0980 0.0580 71.43 83.09 0.1850 0.1900 46.06 44.61
60 0.1290 0.0730 62.39 78.72 0.0660 0.0390 80.76 88.63 0.1710 0.1470 50.15 57.14
LC50 46.47 30.87 27.86 22.02 55.65 53.00
Rerata 38.67 ± 11.03 24.94 ± 4.13 54.33 ± 1.87
A. microcarpa Papua
Konsentrasi (µg/mL)
APM APS APT
Absorbans % inhibisi Absorbans % inhibisi Absorbans % inhibisi
Ulangan
1 2 1 2 1 2 1 2 1 2 1 2
Blangko 0.4970 0.4970 0.00 0.00 0.4970 0.4970 0.00 0.00 0.4970 0.4970 0.00 0.00
10 0.4210 0.4130 15.29 16.90 0.4170 0.4080 16.10 17.91 0.4430 0.4320 10.87 13.08
20 0.3800 0.3700 23.54 25.55 0.3480 0.3170 29.98 36.22 0.3520 0.3430 29.18 30.99
30 0.3300 0.3140 33.60 36.82 0.2410 0.2320 51.51 53.32 0.2760 0.2740 44.47 44.87
40 0.2810 0.2620 43.46 47.28 0.1850 0.1530 62.78 69.22 0.2610 0.2380 47.48 52.11
50 0.2600 0.2030 47.69 59.15 0.1670 0.1160 66.40 76.66 0.1910 0.1660 61.57 66.60
60 0.2260 0.1610 54.53 67.61 0.1220 0.0780 75.45 84.31 0.1540 0.1350 69.01 72.84
LC50 55.35 39.39 29.62 25.40 36.43 33.01
24 lanjutan Lampiran 7
A. microcarpa Jambi
Konsentrasi (µg/mL)
AJM AJS AJT
Absorbans % inhibisi Absorbans % inhibisi Absorbans % inhibisi
Ulangan
1 2 1 2 1 2 1 2 1 2 1 2
Blangko 0.4780 0.4780 0.00 0.00 0.4780 0.4780 0.00 0.00 0.4780 0.4780 0.00 0.00
10 0.4230 0.4130 11.51 13.60 0.4250 0.4210 11.09 11.92 0.4200 0.4130 12.13 13.60
20 0.3700 0.3160 22.59 33.89 0.3610 0.3560 24.48 25.52 0.2880 0.2640 39.75 44.77
30 0.3140 0.2910 34.31 39.12 0.3020 0.2940 36.82 38.49 0.2690 0.2560 43.72 46.44
40 0.2940 0.2600 38.49 45.61 0.2590 0.2310 45.82 51.67 0.2400 0.2200 49.79 53.97
50 0.2680 0.2450 43.93 48.74 0.2480 0.1980 48.12 58.58 0.2280 0.1960 52.30 59.00
60 0.2320 0.1860 51.46 61.09 0.2000 0.1450 58.16 69.67 0.1770 0.1400 62.97 70.71
LC50 63.24 44.95 48.85 37.69 38.75 32.04
Rerata 54.09 ± 12.94 43.27 ± 7.89 35.39 ± 4.75
A. microcarpa Gorontalo Konsentrasi
(µg/mL)
AGM AGS AGT
Absorbans % inhibisi Absorbans % inhibisi Absorbans % inhibisi
Ulangan
1 2 1 2 1 2 1 2 1 2 1 2
Blangko 0.4780 0.4780 0.00 0.00 0.4780 0.4780 0.00 0.00 0.4780 0.4780 0.00 0.00
10 0.3770 0.3700 21.13 22.59 0.3280 0.3220 31.38 32.64 0.3250 0.2890 32.01 39.54
20 0.2960 0.2910 38.08 39.12 0.2370 0.2290 50.42 52.09 0.1930 0.1770 59.62 62.97
30 0.2280 0.2110 52.30 55.86 0.1790 0.1610 62.55 66.32 0.1080 0.0870 77.41 81.80
40 0.1790 0.1550 62.55 67.57 0.1110 0.0880 76.78 81.59 0.0930 0.0690 80.54 85.56
50 0.1660 0.1170 65.27 75.52 0.0870 0.0650 81.80 86.40 0.0480 0.0390 89.96 91.84
60 0.0930 0.0670 80.54 85.98 0.0640 0.0460 86.61 90.38 0.0420 0.0370 91.21 92.26
LC50 26.95 24.03 18.72 17.44 15.67 12.98
25
lanjutan Lampiran 7 A. microcarpa Timor
Konsentrasi (µg/mL)
ATM ATS ATT
Absorbans % inhibisi Absorbans % inhibisi Absorbans % inhibisi
Ulangan
1 2 1 2 1 2 1 2 1 2 1 2
Blangko 0.4510 0.4510 0.00 0.00 0.4510 0.4510 0.00 0.00 0.4510 0.4510 0.00 0.00
10 0.2360 0.2110 47.67 53.22 0.2870 0.2770 36.36 38.58 0.3490 0.3230 22.62 28.38
20 0.2340 0.1890 48.12 58.09 0.2640 0.2610 41.46 42.13 0.2570 0.2120 43.02 52.99
30 0.2110 0.1610 53.22 64.30 0.2090 0.1890 53.66 58.09 0.1460 0.1330 67.63 70.51
40 0.1380 0.0860 69.40 80.93 0.1940 0.1380 56.98 69.40 0.1370 0.0980 69.62 78.27
50 0.0760 0.0490 83.15 89.14 0.1810 0.0940 59.87 79.16 0.0900 0.0610 80.04 86.47
60 0.0740 0.0450 83.59 90.02 0.1190 0.0810 73.61 82.04 0.0820 0.0600 81.82 86.70
LC50 15.91 11.11 24.72 19.40 21.93 18.08
Rerata 13.51 ± 3.40 22.06 ± 3.76 20.00 ± 2.72
A. malaccensis kontrol
Konsentrasi (µg/mL)
BKM BKS BKT
Absorbans % inhibisi Absorbans % inhibisi Absorbans % inhibisi
Ulangan
1 2 1 2 1 2 1 2 1 2 1 2
Blangko 0.4510 0.4510 0.00 0.00 0.4280 0.4280 0.00 0.00 0.4280 0.4280 0.00 0.00
10 0.4040 0.3500 10.42 22.39 0.3200 0.3200 25.23 25.23 0.2430 0.2370 43.22 44.63
20 0.3820 0.2990 15.30 33.70 0.2030 0.2030 52.57 52.57 0.1410 0.1170 67.06 72.66
30 0.2260 0.1850 49.89 58.98 0.1160 0.1130 72.90 73.60 0.0620 0.0610 85.51 85.75
40 0.2200 0.1380 51.22 69.40 0.0800 0.0770 81.31 82.01 0.0310 0.0310 92.76 92.76
50 0.1740 0.1150 61.42 74.50 0.0760 0.0680 82.24 84.11 0.0280 0.0310 93.46 92.76
60 0.1490 0.0660 66.96 85.37 0.0360 0.0370 91.59 91.36 0.0260 0.0270 93.93 93.69
LC50 37.21 24.42 18.53 18.38 11.26 10.13
26 lanjutan Lampiran 7
A. malaccensis inokulasi Konsentrasi
(µg/mL)
BIM BIS BIT
Absorbans % inhibisi Absorbans % inhibisi Absorbans % inhibisi
Ulangan
1 2 1 2 1 2 1 2 1 2 1 2
Blangko 0.4510 0.4510 0.00 0.00 0.4280 0.4280 0.00 0.00 0.4510 0.4510 0.00 0.00
10 0.4150 0.3360 7.98 25.50 0.3510 0.3470 17.99 18.93 0.3390 0.3310 24.83 26.61
20 0.3380 0.2410 25.06 46.56 0.2600 0.2600 39.25 39.25 0.2970 0.2920 34.15 35.25
30 0.2600 0.1620 42.35 64.08 0.1840 0.1850 57.01 56.78 0.2260 0.2180 49.89 51.66
40 0.0950 0.0800 78.94 82.26 0.1390 0.1360 67.52 68.22 0.1930 0.1830 57.21 59.42
50 0.0590 0.0500 86.92 88.91 0.0710 0.0710 83.41 83.41 0.1110 0.0960 75.39 78.71
60 0.0440 0.0380 90.24 91.57 0.0510 0.0530 88.08 87.62 0.0520 0.0460 88.47 89.80
LC50 27.00 19.70 24.00 23.83 25.91 24.57
Rerata 23.35 ± 5.16 23.92 ± 0.12 25.24 ± 0.95
Standar kuersetin Konsentrasi
(µg/mL)
Kuersetin
Absorbansi % inhibisi
Ulangan 1 Ulangan 2 Ulangan 1 Ulangan 2
Blangko 0.4510 0.4510 - -
1 0.2880 0.2780 36.14 38.36
2 0.2790 0.2650 38.14 41.24
3 0.2440 0.2290 45.90 49.22
4 0.2190 0.1900 51.44 57.87
5 0.1730 0.1600 61.64 64.52
IC50 3.26 2.57
27
Contoh perhitungan: Standar kuersetin
%inhibisi = (absorbans blangko– absorbans standar)
absorbans blangko 100
= (0. 10– 0.2 0)
0. 10 100
= 36.14%
Kurva hubungan %inhibisi dan ln konsentrasi standar kuersetin Persamaan regresi linear: y = 14.8767x + 32.4074
IC50 diperoleh saat y = 50, oleh karena itu: 50 = 14.8767x + 32.4074
x = (50 – 32.4074) / 14.8767 = 1.1826
ln konsentrasi = 1.1826, maka nilai IC50sebesar 3.2 μg/mL
28
Sampel AKM
%inhibisi = (absorbans blangko– absorbans sampel)
absorbans blangko 100
= (0.3 30– 0.3000)
0.3 30 100
= 12.54%
Kurva hubungan %inhibisi dan ln konsentrasi sampel AKM Persamaan regresi linear: y = 27.6274x – 56.0568
RIWAYAT HIDUP
Penulis dilahirkan di Bogor, pada tanggal 9 Juni 1990 dari pasangan Engkus Kusnadi dan Dedeh Warsih. Penulis merupakan anak pertama dari 2 bersaudara. Penulis menyelesaikan pendidikan di SMAN 5 Bogor tahun 2008, kemudian melanjutkan pendidikan di Departemen Kimia, IPB.
Selama kuliah, penulis berpartisipasi sebagai staf PKS Ikatan Mahasiswa Kimia (Imasika) Institut Pertanian Bogor tahun 2009/2010. Penulis melakukan praktik
lapangan di PT Bayer Health Care Cimanggis Plant dengan judul laporan “Analisis
Tiamina Monofosfat Klorida Dihidrat sebagai Bahan Baku dalam Pembuatan Tablet Suplemen” pada tahun 2011. Penulis juga pernah menjadi asisten praktikum
Kimia Tingkat Persiapan Bersama IPB tahun 2009–2012, asisten Praktikum Kimia