margarita DAN Acaulospora tuberculata
SITI CHALIMAH
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
ii Saya menyatakan dengan sebenar-benarnya, bahwa segala pernyataan dalam disertasi yang berjudul :
PEMANFAATAN TEKNOLOGI IN VITRO UNTUK PERKEMBANGAN SPORA Gigasporamargarita DAN Acaulosporatuberculata
merupakan hasil penelitian saya di bawah bimbingan komisi pembimbing. Penelitian ini terdiri dari lima topik. Penelitian dibiayai oleh APBN melalui Balai Penelitian Bioteknologi Perkebunan Indonesia. Penelitian ini belum pernah diajukan untuk memperoleh gelar pada program sejenis di perguruan tinggi lain. Semua data dan informasi yang digunakan telah dinyatakan dengan jelas dan dapat diperiksa kebenarannya.
Bogor, Februari 2007
iii Gigaspora margarita dan Acaulospora tuberculata. Dibimbing oleh MUHADIONO, LATIFAH K DARUSMAN, SAID HARAN dan NURITA TORUAN-MATHIUS.
Cendawan mikorhiza arbuskular (CMA) adalah mikroorganisme bersifat simbion obligat. Perbanyakan CMA secara konvensional menggunakan kultur pot, menghadapi beberapa kendala karena terkontaminasi mikroorganisme lain, dan keterbatasan lahan. Salah satu upaya menanggulangi masalah tersebut adalah memanfaatkan teknologi kultur in vitro. Tujuan penelitian ini adalah: (i) mendapatkan akar rambut yang mampu beradaptasi pada kultur ganda secara in vitro, (ii) mendapatkan tempat tumbuh dan inang kompatibel untuk perkembangan G margarita dan A. tuberculata secara konvensional, (iii) mendapatkan teknik sterilisasi spora dan inokulum steril CMA uji dengan eksplan tomat dan wortel, (iv) mengembangkan G. margarita dan A. tuberculata secara in vitro dengan teknologi akar rambut wortel, dan (v) teknik enkapsulasi spora dan propagul CMA dengan Na-alginat.
Hasil yang diperoleh menunjukkan bahwa akar rambut wortel mampu beradaptasi pada kultur ganda, selanjutnya digunakan sebagai inang perkembangan G. margarita dan A. tuberculata secara in vitro. Tempat tumbuh cawan Petri, inang sorghumdan Pueraria phaseoloides.L., dengan medium zeolit, kompatibel untuk perkembangan G. margarita dan A. tuberculata dalam kultur pot di rumah kaca, selanjutnya digunakan sebagai sumber spora. Teknik sterilisasi spora terbaik adalah pencucian dan pelembutan permukaan spora dengan MgSO4.7H2O dan Tween 20 (10%), permukaan spora dibersihkan dengan NaOCl2 0,52% (Bayclin10%), disterilisasi ke dalam antibiotik gentamisin, streptomisin, penisilin 100 ppm, dan tetrasiklin 2,5 ppm, dibilas dengan akuades, spora steril siap sebagai inokulum. Spora G. margarita dan A. tuberculata berkembang baik secara in vitro, memiliki daya infeksi tinggi terhadap inang planlet tomat, wortel maupun akar rambut. Kedua medium kultur ganda MM dan MSR, kedua inang eksplan wortel dan tomat dapat digunakan untuk perkembangan spora kultur aksenik, namun medium MM lebih baik dibandingkan dengan MSR, dan inang wortel lebih baik dibandingkan dengan inang tomat. Inang akar rambut wortel mempunyai kecenderungan yang sama, yaitu medium MM lebih baik dibandingkan dengan MSR. Tidak ditemukan perbedaan pola perkembangan struktur organ CMA dalam akar inang pada kultur pot, maupun inang tomat, wortel, akar rambut, secara in vitro. Enkapsulasi spora CMA terbaik kadar 1,75% Na-alginat, dengan daya viabilitas dan persentase infeksi akar tinggi, dalan masa simpan 2 bulan. Simpulan teknologi in vitro dapat digunakan untuk perkembangan dan perbanyakan kultur aksenik G. margarita dan A. tuberculata dengan teknik in vitro.
iv SITI CHALIMAH. In vitro technology for development of Gigaspora margarita and Acaulospora tuberculata stores Under the impervition of MUHADIONO, LATIFAH K DARUSMAN, SAID HARAN and NURITA TORUAN-MATHIUS
Arbuscular mycorrhizal fungi (AMF) is an obligatory symbion microorganism. Conventional technique for AMF propagation or production was by pot culture with the host plant, this technique faces many problems, due to contamination with other microorganisms, and limited farm area. One of the efforts to be overcome the weakness was by AMF in vitro culture. The objectives of this research were (i)) to obtain hairy root culture techniques of several host plants, (ii) to obtain growth container, inoculum and compatible host for spore production by conventional techniques, (iii) to obtain sterile inoculum of G. margarita and A. tuberculata in axenic culture of tomato and carrot as host plants (iv) to develop G. margarita and A. tuberculata in carrot hairy root culture, and (v) encapsulation technique of AMF spore and propagule, with Na-alginate.
The results showed that carrot hairy root could adapt in dual culture medium, hence used as plants to develop G. margarita and A tuberculata in vitro. Sorghum and Pueraria phaseloides L. cultured in colored plastic cup with zeolith as a carrier, compatible for producing spores and inoculum in green house condition, than used as spores supply. The best sterilization technique consists of washing the surface of spore with MgSO4.7H2O and sterile Tween 20 (10 %), followed by sterilization with, gentamycin, streptomycin, penicillin 100 ppm each and cleaned by 0,52 % NaOCl2. G. margarita and A. tuberculata spores can develop well and have high infection rate in axenic culture with tomato and carrot as host plants, cultured in minimal medium (MM). Carrot hairy root culture can be use as an host for G. margarita and A. tuberculata spores development by in vitro culture. G. margarita and A. tuberculata with carrot hairy root as an host cultured in MM medium were able to build external hyphae, sporulation and root infection. There is no difference in the development and root infection by AMF on host plants cultured in green house, axenic and hairy root culture. Spores of AMF encapsulation with 1.75% Na-alginate could producte spores with high viability and infection capability, in 2-month-storage period.
It could be concluded that G. margarita and A. tuberculata can be developed by in vitro technology with axenic culture.
---
v
Hak cipta milik Siti Chalimah, tahun 2007
Hak cipta dilindungi
Dilarang mengutip dan memperbanyak tanpa izin tertulis dari Institut Pertanian Bogor, sebagian atau seluruhnya dalam bentuk apapun, baik cetak, foto kopi,
vi
margarita dan Acaulospora tuberculata
SITI CHALIMAH
DISERTASI
Sebagai salah satu syarat untuk memperoleh gelar
Doktor pada
Program Studi Biologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
vii N Nama Mahasiswa
UNTUK PERKEMBANGAN SPORA Gigaspora margarita DAN Acaulosporatuberculata
: SITI CHALIMAH N Nomor Pokok
P Proogram Studi
: G361020111 : BIOLOGI
Disetujui Komisi Pembimbing
Dr. Muhadiono, MSc. Prof. Dr. Latifah K. Darusman, MSc. Ketua Anggota
Dr. Ir. Said Harran, MSc. Dr. Nurita TORUAN-MATHIUS, MS. Anggota Anggota
Diketahui
Ketua Program Studi Biologi Dekan Sekolah Pascasarjana
Dr. Ir. Dedi Duryadi Solihin, DEA. Prof. Dr.Ir. Khairil Anwar Notodiputro, MS.
viii Alhamdulillah puji syukur kehadirat Illahi Robbi atas segala karunia, nikmat, rahmat dan hidayahNYA, disertasi ini dapat diselesaikan dari bulan Maret 2003 sampai bulan Mei 2006, tentang perkembangan Cendawan Mikorhiza Arbuskula (CMA) dengan judul “Pemanfaatan Teknologi In Vitro Untuk Perkembangan Spora Gigaspora margarita Dan Acaulospora tuberculata”. Disertasi ini disusun berdasarkan lima topik penelitian, dan mendapatkan dana APBN melalui Balai Penelitian Bioteknologi Perkebunan Indonesia.
Dalam kesempatan ini disampaikan penghargaan yang tinggi dan ucapan terimakasih kepada yang terhormat :
1. Dr. Muhadiono, M.Sc. bertindak sebagai ketua komisi pembimbing, Prof. Dr. Ir Latifah K. Darusman, MS, Dr. Nurita-TORUAN MATHIUS,MS, dan Dr. Said Harran, M.Sc. sebagai anggota komisi pembimbing. Atas segala bantuan moril dan materiil, saran mulai dari rencana penelitian hingga penyelesaian penulisan. Tidak terhingga pengetahuan yang diberikan, kebijaksanaan, kesabaran, ketegasan, kedisiplinan serta tanggung jawab seorang peneliti ditanamkan secara tidak langsung sejalan dengan proses penyelesaian studi. Hanya Allah SWT yang dapat membalas segala kebaikan, dan sebagai catatan ibadah disis i Allah SWT
2. Pimpinan Balai Penelitian Bioteknologi Perkebunan Indonesia, di Bogor dan penanggung jawab Laboratorium Rekayasa Genetika dan Biomolekuler yang telah memberikan kesempatan untuk menggunakan fasilitas laboratorium. 3. Pimpinan PT Intidaya Agrolestari (INAGRO), Bogor yang telah memberikan
inokulum CMA jenis Acaulospora tuberculata melalui Bapak Yudha Hartanto SP, MS.
4. Pimpinan Laboratorium Fisiologi Tumbuhan IPB yang telah memberikan kesempatan untuk menggunakan fasilitas laboratorium.
ix telah diberikan.
7. Bapak Ketua Yayasan Drs Ngarbi dan Rektor IKIP PGRI TUBAN atas izin, dukungan, motivasi dan kebijakan yang diberikan dalam menyelesaikan studi program Doktor.
8. Ayahanda H. Setiohadi Woerjanto, lbunda Hj. Salmiah, Abi dan Umi A. Marzuki almarhum. Suami tercinta Edwi Mahajoeno, ananda tersayang Kautsar Hidayatullah, Nashril Abdillah dan Aldilla Arifatunurillah, dengan penuh keikhlasan berkorban, pengertian, dorongan dan semangat untuk terus maju serta do’a yang selalu dipanjatkan kepada Allah SWT, sehingga mampu menyelesaikan penulisan disertasi ini.
9. Kakak dan adikku tercinta Asjito sekeluarga, Eko Wicaksono sekeluarga, Zaenal Arifin Marzuki, Nurchikmah Marzuki, Hasan Sukarno Marzuki, Hindun Marzuki, terutama kakakku Drs.H. Totok Supiyanto,MM. sekeluarga dan Drs.Rameli,MSi. sekeluarga yang telah banyak memberikan bantuan materi dan dorongan serta do’a yang tiada hentinya
10.Bapak/Ibu sekaligus teman baik, berbagi cerita suka dan duka, yang mampu memotivasi dalam banyak kegiatan baik dalam perkuliahan, penelitian hingga penyelesaian disertasi ini, Dr. Sumarmi,MSc. Dr.Hj. Endang Gatilestari,MS. Dr. Enny Widyati., Ir. Abimanyu,MSi. sekeluarga, Dra. Fitma,MS, Dra. Eny Zulaika,MSi sekeluarga, Ir. Yeni Lucia,MSi., Dra. Agustin, MSc, Ir. Helen, MS. serta teman-teman seperjuangan yang tidak dapat saya sebutkan. Semoga disertasi ini dapat bermanfaat bagi pihak yang memerlukan, dan semoga bimbingan serta semua kebaikan menjadi nilai ibadah di sisi Allah SWT, Amin Amin Yarobbal ‘Alamiien.
Bogor, Januari 2007
x SITI CHALIMAH, putri kedelapan dari sepuluh bersaudara, dari Ayah Achmad Marzuki (Alm) dan Ibu Chajatoen (Alm), dilahirkan pada tanggal 16 Desember 1959 di Tuban, menikah tanggal 28 Januari 1988 dengan Edwi Mahajoeno dikaruniai tiga anak putra dan putri, Kautsar Hidayatullah (Surabaya, 14 Oktober 1988), Nashril Abdillah (Tuban, 15 April 1990), Aldilla Arifatunnurillah (Tuban, 21 Desember 1994), sampai sekarang penulis sebagai dosen tetap IKIP PGRI TUBAN di Tuban.
Penulis menyelesaikan pendidikan dasar dan menengah pertama di Tuban, yaitu di SD Negeri Kutorejo I (tahun 1972) dan SMP Negeri I Tuban (tahun 1975), dan melanjutkan di SMA Negeri 2 Yogyakarta (Tahun 1979). Gelar sarjana Biologi diperoleh dari Fakultas Biologi Universitas Gajah Mada Jurusan Ekologi. Pada tahun 1998 mendapatkan gelar Magister Pendidikan Teknologi di IKIP Yogyakarta. Pada tahun 2002 melanjutkan studi pada jenjang Doktor (S3) program studi Biologi Sekolah Pascasarjana Institut Pertanian Bogor di Bogor. Beasiswa pendidikan pascasarjana diperoleh dari DIKTI melalui BPPS.
xi
Halaman
Daftar Gambar
……… xiii
Daftar Tabel
……… xv
Daftar Lampiran
……….. xvii
BAB I
PENDAHULUAN
1Latar Belakang ... Permasalahan ... Tujuan Penelitian ……… Hipotesis ... Pendekatan Penelitian ... Manfaat Penelitian ...
1 5 6 6 7 7
BAB II
BAHAN DAN METODE
8 Materi Penelitian ...Alir Kerja dan Output Setiap Tahap Penelitian ...
8 10
BAB III
TINJAUAN PUSTAKA
A. Agrobacterium rhizogenes ... B. Cendawan Mikorhiza Arbuskula (CMA) ………. C. Kultur Aksenik secara in vitro ... D. Enkapsulasi spora ...
11 16 24 28
BAB IV
Pengembangan Teknologi Akar Rambut Beberapa Tanaman Secara In VitroABSTRAK ... Abstract ...
1. PENDAHULUAN ... 2. BAHAN DAN METODE ...
3. HASIL ……….
4. PEMBAHASAN ……….
5. SIMPULAN ...
xii Abstract...
1. PENDAHULUAN ... 2. BAHAN DAN METODE ... 3. H A S I L ... 4. PEMBAHASAN ... 5. SIMPULAN... 49 50 52 55 64 70
BAB VI
Penyediaan Inokulum Steril Gigasporamargarita danAcaulospora tuberculata Kultur Aksenikdengan Eksplan Tomat dan Wortel
ABSTRAK ...
Abstract ……….………
1. PENDAHULUAN ……… 2. BAHAN DAN METODE ....……… 3. HASIL ………. 4. PEMBAHASAN ………. 5. SIMPULAN ………..
72 72 73 76 79 88 97
BAB VII
Perkembangan Gigaspora margarita dan Acaulosporatuberculata In Vitro Dengan Teknologi Akar Rambut Wortel ABSTRAK ……….
Abstract ………
1. PENDAHULUAN ………...
2. BAHAN DAN METODE ... 3. HASIL ... 4. PEMBAHASA... 5. SIMPULAN ...
98 98 99 102 106 112 119
BAB VIII
Teknologi Enkapsulasi Untuk Pengemasan G. margarita dan A. tuberculata dengan Natrium–alginatABSTRAK ... Abstract ... 1. PENDAHULUAN ... 2. BAHAN DAN METODE ... 3. HASIL ……….
4. PEMBAHASAN ……….
5. SIMPULAN ………....
120 121 121 124 126 131 135
BAB IX
BAB X
PEMBAHASAN UMUM SIMPULAN DAN SARAN DAFTAR PUSTAKAPENDAHULUAN
Latar Belakang
Cendawan mikorhiza arbuskula (CMA) adalah mikroorganisme tanah berperana n penting memperbaiki produktivitas lahan, bersifat simbion obligat, karena tanpa tanaman inang (asimbiotik) pertumbuhan hifa tidak berkembang dan hanya mampu bertahan hidup 20-30 hari (Fortin et al. 2002). CMA juga berperan penting dalam siklus hara, memperbaiki struktur tanah dan menyalurkan unsur karbon dari akar ke organisme tanah lainnya. Selain itu CMA juga mampu mengeluarkan enzim fosfatase dan asam organik, sehingga pada tanah yang kahat P, CMA mampu melepas P yang terikat membantu penyediaan unsur P tanah (Smith et al. 2003).
Di dalam simbiosis, CMA memperoleh energi dari fotosintat tanaman dan tanaman memperoleh manfaat dari CMA tergant ung kedua simbion tersebut (tanaman dan CMA), serta karakteristik lingkungan (Bever 2002, Heijden 2002). Jasa paling utama diberikan oleh CMA berupa pengambilan, asimilasi, dan translokasi nutrisi di luar zona rhizosfir kepada akar tanaman. Pengambilan hara dilaksanakan oleh ekstraradikal miselium (Ezawa et al. 2002, Johansen et al. 1993). Penggunaan CMA umumnya meningkatkan kesuburan tanaman, daya tahan terhadap serangan patogen dan kekeringan (Ezawa et al. 2002). CMA juga menguntungkan untuk pertanian (Jeffries et al. 2003) maupun reklamasi lahan (Jasper 1994, de-Souza & Sulva 1996), dan sebagai sumber daya efisien yang dapat diperbaharui (Jakobsen 2000).
tanah marjinal adalah kemampuan serapan hara P. Simbiosis tanaman inang dan CMA dapat meningkatkan kemampuan akar tanaman untuk menyerap hara P. Hifa eksternal sebagai panjang tangan akar dapat membantu dalam serapan P, sehingga nutrisi P tanaman meningkat.
Clark (1997) menyatakan bahwa ada peningkatan penyerapan mineral P dan Zn serta konsentrasi mineral oleh tanaman bermikorhiza, sekalipun terjadi defisiensi hara seperti Ca, Mg, dan K pada tanah masam. Namun demikian tanaman bermikorhiza juga mampu meningkatkan unsur N dan K (Smith & Read 1997) serta unsur mikro seperti Cu dan Zn (Marschner & Dell 1994). Hal tersebut menunjukkan bahwa manfaat CMA sangat luas, oleh karena itu perlu diupayakan teknik memperbanyak CMA yang lebih efisien dan efektif.
Gigaspora margarita adalah salah satu CMA yang berhasil dikembangkan melalui kultur in vitro. Jenis CMA tersebut infektif dan efektif terhadap pertumbuhan tanaman perkebunan, di antaranya tanaman kelapa sawit (Widiastuti 2004), kakao, jambu mente (Trisilawati 2001). Di satu sisi A. tuberculata juga efisien terhadap pertumbuhan tanaman perkebunan (Widiastuti 2004), tanaman manggis (Lucia 2005). Schulz et al. (1999) menyatakan bahwa A. tuberculata adalah CMA yang efektif untuk meningkatkan daya hidup planlet kelapa sawit, dari 40 % tidak diinokulasi, menjadi 91% diinokulasi dengan CMA. Acaulospora tuberculata merupakan salah satu CMA yang belum dikembangkan secara in vitro. Kedua jenis CMA infektif dan efektif terhadap pertumbuhan tanaman perkebunan, pertanian dan hortikultura. Perkembangan dan perbanyakan jenis CMA tersebut sangat penting dipelajari untuk meningkatkan efisiensi, efektivitas, dan kualitasnya, sehingga penelitian untuk perbanyakan kultur aksenik spora in vitro menjadi sangat penting dilakukan.
penelitian perkembangan dan perbanyakan kedua CMA tersebut dapat menambah khasanah ilmu pengetahuan, khususnya di Indonesia
Perbanyakan CMA umumnya dilakukan menggunakan kultur pot. Teknik kultur in vivo kurang efektif karena spora yang dihasilkan tidak steril, dan besar kemungkinan terjadi kontaminasi jamur hiperparasitik atau asosiasi bakteri dengan dinding spora tidak mudah steril (Frances et al. 1996). Hijri et al. (2000) menyatakan bahwa kelemahan penggunaan kultur pot antara lain spora CMA terkontaminasi oleh jenis CMA lain dan tidak murni, juga kemungkinan kontaminan mikroorganisme lain, seperti Microdochium dapat menyebabkan perbanyakan spora menurun sangat cepat. Kesulitan yang dihadapi dalam mempelajari simbion obligat dan tujuan praktis memperbanyak inokulum CMA secara masal, memperkuat motivasi pengembangan kultur CMA secara aksenik. Menurut Diop et al. (1994) di negara-negara berkembang lebih baik memilih pengembangan CMA menggunakan kultur aksenik karena lebih murah dari pada kultur pot di rumah kaca.
Perbanyakan spora dengan organ akar rambut atau akar transforman merupakan perspektif baru perbanyakan spora CMA masal (Fortin et al. 2002). Sistem tersebut memberi kemudahan pengamatan perkembangan biologi CMA melalui ekstraradikal miselium (Bago et al. 1998a). Selain itu bermanfaat untuk mempelajari urutan perkembangan spora CMA dan kemudahan dalam riset. Hasil penelitian juga mengungkapkan bahwa perbanyakan spora CMA dengan organ akar rambut lebih luas dibandingkan dengan kultur konvensional in vivo (de-Souza 1999, Dalpe & Declerck 2002).
Akar rambut mempunyai beberapa kelebihan yaitu (i) meningkatkan infeksi CMA (Becard & Piche 1992), (ii) mempermudah adaptasi sehingga mudah disubkultur dan meningkatkan biomas CMA lebih cepat (Tepfer 1989; Becard & Piche 1992), (iii) hidup lebih lama tanpa subkultur, dan (iv) memerlukan hara dalam jumlah lebih sedikit (Adholeya et al. 1997), (v) meningkatkan kestabilan beberapa karakter penting, seperti morfologi, kapasitas pertumbuhan, dan genetik maupun struktur biokimia (Tanaka, 1997), (vi) mampu mensintesis peningkatan biomasa seperti akar normal, dengan laju pertumbuhan lebih cepat, mudah tumbuh pada media kultur tanpa penambahan zat pengatur tumbuh (Rhodes 1994). Beberapa kelebihan teknik akar rambut tersebut menjadi pertimbangan utama inovasi teknologi perkembangan dan perbanyakan CMA secara efisien dan efektif untuk menghasilkan spora lebih berkualitas, murni dan steril.
Kultur aksenik secara in vitro umumnya menggunakan inang akar rambut untuk perbanyakan CMA steril, dapat pula dengan eksplan tanaman untuk penyediaan inokulum CMA steril. Penggunaan kultur aksenik menunjukkan hasil yang menggembirakan untuk dikembangkan (Becard & Piche 1992, Becard & Fortin 1988). Kultur aksenik adalah biakan mikroorganisme tidak terkontaminasi mikroba lain, disebut juga biakan murni dan steril (Abercrombie et al. 1993, Anonimus 2006). Pemanfaatan kultur aksenik G. margarita dan atau A. tuberculata asli Indonesia sebagai biakan murni dan steril sampai saat ini belum dimanfaatkan dan dikembangkan, dengan demikian perbanyakan CMA indigenous (asli setempat) dengan kultur aksenik in vitro untuk mendukung pertanian dan kehutanan masih terbuka peluang dan perlu dilakukan penelitian untuk meningkatkan kualitas perbanyakan CMA in vitro.
Pengemasan CMA umumnya menggunakan zeolit, pasir, limbah kayu gergaji dan campuran tanah. Pengemasan dengan cara tersebut sulit diketahui kuantitas maupun kualitas spora, juga tidak mudah dilihat secara kasat mata kandungan spora di dalam kemasan (carrier) dan kurang efisien. Sebaliknya secara komersial diperlukan pengemasan dan penyimpanan CMA lebih menarik, mudah dilakukan dan dapat segera diketahui kuantitas dan kualitas spora serta mudah dilihat dan efisien.
CMA menggunakan Na-alginat mengurangi kelemahan cara yang umum digunakan. Na-alginat senyawa karbohidrat berwarna putih bening atau transparan memungkinkan spora CMA terselimuti dalam Na-alginat, mudah dilihat ada tidaknya spora dan jumlah spora. Akhir-akhir ini Na-alginat banyak digunakan untuk pengemasan spora atau enkapsulasi di antaranya benih sintetik, planlet mikro, CMA dan lainnya (Papi et al. 2005, Wang et al. 2005).
Permasalahan
Permasalahan dalam perbanyakan masal CMA belum tersedia teknik perbanyakan CMA maupun cara pengemasan yang efektif dan efisien. Teknologi konvensional perbanyakan CMA umumnya digunakan dengan kultur pot di rumah kaca, tetapi seringkali perbanyakan CMA terkontaminasi oleh jenis lain maupun mikroorganisme pencemar, serta diperlukan areal luas dan waktu perkembangan cukup lama. Inovasi teknik perbanyakan dan perkembangan CMA efisien dan efektif masih perlu dikembangkan untuk menghasilkan spora masal, berkualitas, steril dan murni. Pengembangan kultur in vitro merupakan salah satu inovasi untuk menanggulangi permasalahan tersebut
Eksplan tanaman ditransformasi dengan T-DNA A. rhizogenes akan dihasilkan akar rambut. Akar rambut terbentuk karena integrasi T-DNA pada genom sel tanaman. T-DNA adalah bagian DNA plasmid A. rhizogenes yang ditransfer ke dalam sel tanaman melalui pelukaan. T-DNA mengandung gen yang mensintesis hormon pertumbuhan. Ekspresi gen dalam sel tanaman mendorong pembentukan akar adventif pada tempat infeksi yang disebut akar rambut (Gelvin 2000). Transformasi gen pada akar tanaman meningkatkan pertumbuhan lebih baik dibandingkan dengan akar tanaman normal atau tanaman yang tidak ditransformasi. Akar rambut bersifat seperti akar tanaman normal dapat digunakan sebagai inang perkembangan CMA in vitro, namun tidak setiap tanaman mampu merespons T-DNA A. rhizogenes.
berikutnya dapat digunakan untuk perbanyakan CMA masal, murni, steril, efektif, efisien dan berkualitas.
Permasalahan perbanyakan CMA dan cara pengemasan belum efisien dan efektif dapat ditanggulangi dengan perbanyakan spora CMA kultur aksenik in vitro. Natrium alginat telah berhasil dikembangkan sebagai bahan pengemas cendawan ektomikorhiza dan perlu diuji untuk pengemas CMA secara in vitro.
Tujuan Penelitian
Berdasarkan identifikasi masalah, penelitian bertujuan untuk menguji: 1. Respons tanaman jagung, sorghum, kentang dan wortel terhadap A.
rhizogenes, dan media pertumbuhan akar rambut
2. Pengaruh tempat tumbuh, jenis inang terhadap perbanyakan spora G. margarita dan A. tuberculata dalam kultur pot (konvensional).
3. Pengaruh jenis medium kultur ganda MM dan MSR terhadap kultur aksenik CMA uji, dan optimasi metode sterilisasi spora CMA uji.
4. Pengaruh jenis inang terhadap perkembangan inokulum CMA in vitro. 5. Teknik enkapsulasi spora dan propagul CMA uji dengan Na-alginat
Hipotesis Penelitian
1. Tanaman jagung, sorghum, kentang Granola, Atlantik dan wortel tidak semua dapat merespons T-DNA A. rhizogenes dengan membentuk akar rambut.
2. Tempat tumbuh cawan Petri plastik, gelas plastik warna, jenis inang sorghumdan P. phaseoloides,L., berpengaruh terhadap perbanyakan dan perkembangan A. tuberculata dan G. margarita secara konvensional. 3. Media pertumbuhan kultur ganda MM dan MSR berpengaruh terhadap
kultur aksenik CMA uji in vitro.
4. Eksplan tomat, wortel, dan akar rambut tanaman wortel, dapat digunakan sebagai inang kultur aksenik CMA
Pendekatan Penelitian
Pendekatan penelitian melakukan dan mengamati beberapa hal antara lain:
1. Pengaruh jenis tanaman dan media terhadap pertumbuhan dan perkembangan akar rambut
2. Pengaruh tempat tumbuh, jenis inang terhadap perbanyakan inokulum CMA secara konvensional
3. Pengaruh jenis media kultur ganda terhadap penyediaan inokulum dan perbanyakan spora dalam kultur aksenik dan optimasi sterilisasi spora. 4. Pengaruh jenis inang untuk perbanyakan spora dan inokulum CMA steril
dengan teknik in vitro
5. Enkapsulasi spora CMA dengan Na-alginat
Manfaat Penelitian
Manfaat Penelitian untuk mendapatkan:
1. Medium terbaik untuk pertumbuhan optimal akar rambut wortel.
2. Teknik perbanyakan spora G. margarita dan A. tuberculata secara konvensional
3. Teknik penyediaan inokulum CMA yang steril sebagai dasar perkembangan CMA in vitro.
4. Medium dan inang
untuk pertumbuhan G. margarita dan A. tuberculata secara in vitro
BAHAN DAN METODE
A.Tempat dan waktu penelitian
Penelitian ini dilakukan di rumah kaca dan Laboratorium Rekayasa Genetik Biomolekuler, Balai Penelitian Bioteknologi Perkebunan Indonesia (BPBPI), Bogor dan Laboratorium Fisiologi Tumbuhan Jurusan Biologi FMIPA, Institut Pertanian Bogor. Seluruh kegiatan penelitian dilaksanakan dari bulan Juli 2003 sampai Mei 2006.
Penelitian ini terdiri dari lima percobaan, yaitu :
1. Pengembangan teknologi akar rambut beberapa tanaman secara in vitro 2. Perbanyakan G. margarita dan A. tuberculata dengan kultur pot di rumah
kaca
3. Penyediaan inokulum steril G. margarita dan A. tuberculata dalam kultur aksenik dengan eksplan tomat dan wortel
4. Perkembangan G. margarita dan A. tuberculata secara in vitro menggunakan teknologi akar rambut wortel
5. Teknologi enkapsulasi untuk pengemasan G. margarita dan A. tuberculata dengan Na-alginat
Bahan dan metode percobaan diuraikan secara lengkap pada masing- masing percobaan. Alur penelitian yang menunjukkan keterkaitan antar percobaan disajikan dalam Gambar 1.
B. Materi penelitian
Materi penelitian secara keseluruhan digunakan beberapa bahan, yang dikelompokkan ke dalam satu sampai lima subtopik penelitian, sebagai berikut :
Becard & Fortin (1988). Primer yang digunakan adalah TL Primer TL-DNA rol B1
(5’atggatcccaaattgctattccccacga3’),
dan rolB2(’ttaggcttctttcattcgggtttactgcagc3’).
Primer TR-DNA TR1 :(5’ggaaattgtggctcgttgtggac3’
) TR2:(5’aatcgttcagagagcgtccgaagtt3’).
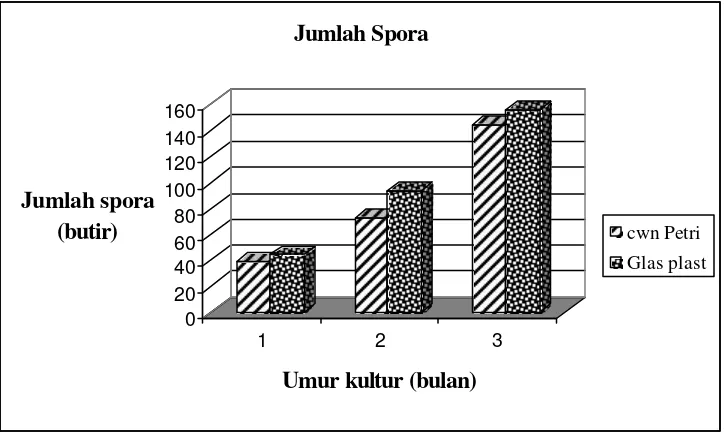
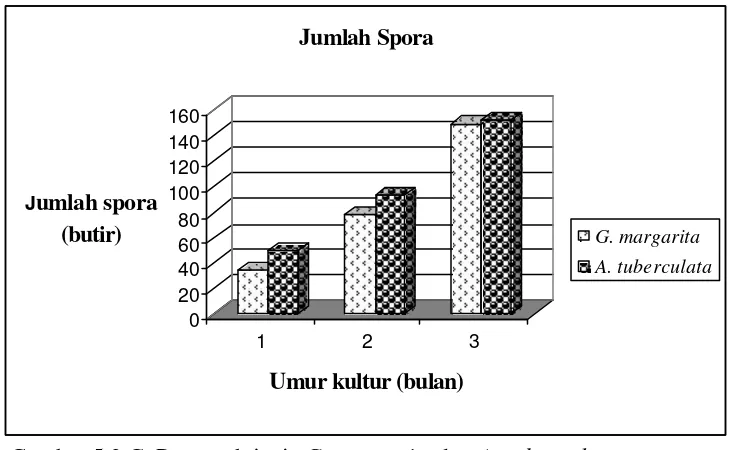
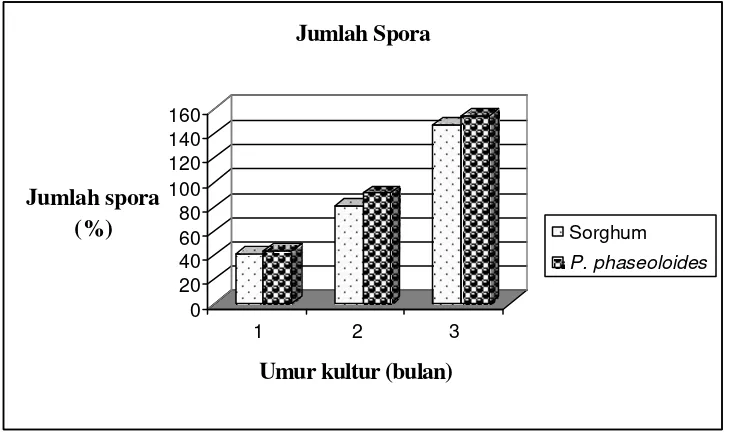
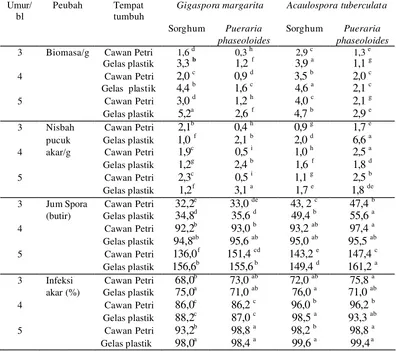
Penelitian II. Digunakan tempat tumbuh cawan Petri plastik dan gelas plastik warna dengan media tumbuh zeolit, tanaman sorghum dan Pueraria phaseoloides.L. sebagai inang untuk perbanyakan spora G. margarita koleksi BPBPI dan A. tuberculata koleksi PT. Intidaya Agrolestari (Inagro), yang diperbanyak di rumah kaca, dan digunakan sebagai sumber spora steril untuk penelitian III dan V.
Penelitian III. Sumber spora diperoleh dari penelitian II. Digunakan tiga macam sterilisasi, yaitu menurut Buce et al. (2000) sebagai sterilisasi 1, Chabot (1992) sebagai sterilisasi 2, menurut Declerck et al. (1998) sebagai sterilisasi 3 (Lampiran 9), dan dua jenis cendawan mikorhiza arbuscula (CMA) yaitu G. margarita dan A. tuberculata. Tanaman inang digunakan eksplan tomat dan wortel, medium kultur ganda yang digunakan terdiri dari dua macam yaitu medium MM (Becard & Fortin, 1988) dan MSR (Strullu & Romand 1986) (Lampiran 1A).
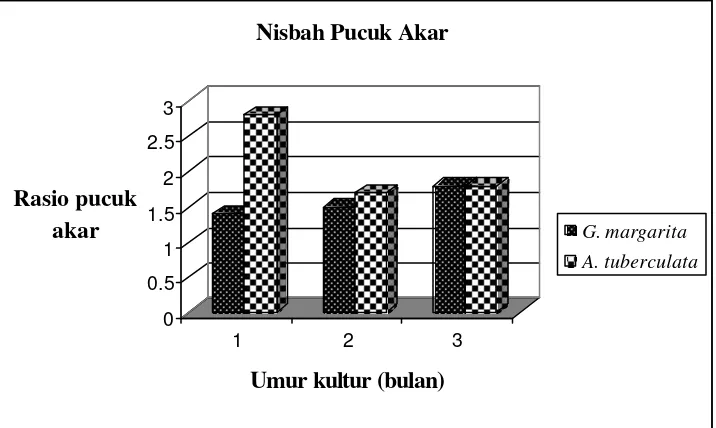
Penelitian IV. Sumber inokulum steril G. margarita dan A. tuberculata diperoleh dari penelitian III, dengan inang akar rambut diperoleh dari penelitian I, dipilih akar rambut yang mampu tumbuh baik pada medium kultur ganda, mempunyai percabangan akar banyak dan tidak terpengaruh dengan subkultur.
Gambar 1. Alur penelitian “Pemanfaatan teknologi in vitro untuk perkembangan spora G. margarita dan A. tuberculata”.
Percobaan 1
Pengembangan teknologi akar rambut beberapa tanaman secara in vitro
Output:
• Tanaman yang merespons T-DNA A.rhizogenes
membentuk akar rambut
• Mendapatkan medium optimal untuk pertumbuhan akar rambut
• Mendapatkan akar rambut yang tumbuh kembang paling baik pada kultur ganda
Percobaan 3
Penyediaan inokulum steril Gigaspora margarita dan Acaulospora tuberculata di dalam kultur aksenik dengan eksplan tomat dan wortel
Output:
• Mendapatkan spora, dan propagul sebagai inokulum steril.
• Mengetahui pengaruh tanaman dan media, terhadap persediaan inokulum steril.
• Mendapatkan teknis sterilisasi spora yang optimal
Output penelitian
• Inang terbaik untuk perbanyakan CMA secara in vitro
• Mendapatkan inang yang kompatibel, dan metode untuk perbanyakan spora CMA secara konvensional di rumah kaca
• Mendapatkan teknik perbanyakan spora CMA steril secara in vitro dengan kultur aksenik maupun dengan kultur ganda
• Mendapatkan teknik enkapsulasi spora CMA
Percobaan 2
Perbanyakan Gigaspora margarita
dan Acaulospora tuberculata
kultur pot di rumah kaca
Output :
? Tanaman inang yang kompatibel ? Tempat tumbuhan yang tepat
untuk perbanyakan inokulum CMA secara optimal
Percobaan 4
Perkembangan Gigaspora margarita dan Acaulospora tuberculata
secara in vitro menggunakan teknologi akar rambut wortel
Output:
• Media kultur ganda terbaik untuk pertumbuhan CMA
• Mengetahui pola pertumbuhan akar rambut yang diinokulasi dan yang tidak diinokulasi CMA
Percobaan 5
Teknologi pengemasan Na-alginat spora CMA (Gigaspora margarita dan
Acaulospora tuberculata) Output:
TINJAUAN PUSTAKA
Pemanfaatan teknologi in vitro merupakan salah satu upaya peningkatan kualitas produksi cendawan mikorhiza arbuskula (CMA). Teknologi in vitro adalah teknologi perkembangan mikroorganisme steril dalam laboratorium, dengan media khusus dikond usifkan untuk pertumbuhannya (Sarin 1996, Yatim 1999). Kultur aksenik adalah biakan mikroorganisme steril dan murni (Abercrombie et al. 1993, Anonimus 2006 a). Beberapa aspek diuraikan guna mendukung penelitian pemanfaatan teknologi in vitro untuk perkembangan spora Gigaspora margarita dan Acaulospora tuberculata, yaitu aspek teknologi akar rambut oleh Agrobacterium rhizogenes, aspek perkembangan CMA kultur pot dan kultur aksenik CMA in vitro, serta enkapsulasi spora.
A. Agrobacterium rhizogenes A.1. Karakteristik A. rhizogenes.
A. rhizogenes bakteri Gram negatif termasuk dalam kelompok Rhizobiaceae, hidup di tanah, bersifat aerobik, tidak membentuk spora, motil dan berbentuk batang. Agrobacterium dapat mentransfer T-DNA ke dalam genom tanaman. DNA terintegrasi stabil pada kromosom tanaman dan mampu mengubah susunan genetik tanaman, diturunkan ke sel anak dan ekspresi gen T-DNA menimbulkan penyakit akar rambut. T-T-DNA berukuran sekitar 15-30 kb dan memiliki beberapa gen (Twyman 1998).
akar transformasi, sedang gen TR-DNA mengkode biosintesis opin dan auksin meskipun tidak selalu ditemukan (Nasir 2002).
Gambar 2. Plasmid Ri (Jacobsen 2004)
A.2. Transformasi gen oleh A. rhizogenes
Sheng & Citovsky (1996) menyatakan bahwa tiga komponen genetik harus dimiliki oleh Agrobacterium untuk melaksanakan transfer T-DNA yaitu: 1) T-DNA ditransfer ke tanaman, 2) berbagai gen virulensi (vir) terdiri atas virA, vir B, vir D dan virG berfungsi untuk proses terjadinya transfer T-DNA dari bakteri ke tanaman, vir C dan vir E meningkatkan efisiensi transfer T-DNA ke sel tanaman dan, 3) beberapa gen pada kromosom Agrobacterium yaitu Chromosomal virulence (chv) terdiri dari chv A dan chv B, sebagai penyandi enzim untuk sintesis dan ekspresi β-1,2 glukan dari sel Agrobacterium berfungsi untuk pelekatan bakteri ke dalam sel tanaman.
Gelvin (2000) menyatakan sedikitnya terdapat tujuh langkah dalam proses transfer molekul T-DNA sel Agrobacterium ke sel tanaman yaitu : 1) pengenalan sel tanaman rentan, 2) induksi ekspresi gen vir, 3) kopi T-DNA yang ditransfer, 4) transfer kompleks DNA ke dalam membran bakteri, 5) transfer kompleks T-DNA membran bakteri ke sitoplasma tanaman, 6) tranfer kompleks T-T-DNA sitoplasma tanaman ke membran inti, dan 7) integrasi T-DNA ke dalam genom inti tanaman (Zambryski 1998). Proses transfer T-DNA sel Agrobacterium ke sel tanaman (Gambar 3)
respons kemotaksis terhadap metabolit, dikeluarkan oleh sel tanaman luka berupa monosiklik fenolik seperti asetosiringon dan monosakarida seperti glukosa dan galaktosa, dan Agrobacterium akan bergerak aktif menuju sel tanaman. T-DNA ditransfer lebih dari satu molekul T-DNA, situs integrasi T-DNA pada kromosom tanaman bersifat acak, dan T-DNA akan terintegrasi stabil pada kromosom tanaman (Giri & Narasu 2000).
Senyawa metabolit dikeluarkan oleh sel tanaman luka, berfungsi sebagai inducer mengaktifkan gen vir. Senyawa gula dan pH bersifat asam merupakan faktor penting dalam proses induksi gen vir, di samping senyawa asetosiringon (Baron & Zambryski 1995). Mekanisme selanjutnya induksi faktor vir mengatur pemotongan dan pemindahan T-DNA ke dalam sel tanaman. Faktor vir terinduksi akibat senyawa fenol yang dikeluarkan oleh tanaman yang dilukai. Beberapa senyawa fenol dapat menginduksi faktor vir yaitu asetosiringon, hidroksi asetosiringon, konifenil alkohol, koniferin (feniproponoid glukosida) dan etil firulat (Winans 1992). Apabila asetosiringon tidak diproduksi, monosakarida seperti glukosa, galaktosa, arabinosa, fruktosa dan silosa menginduksi faktor vir (Cangelosi et al. 1989). Terdapat enam faktor virulens diketahui berfungsi untuk proses pemindahan T-DNA, yaitu vir A, vir B, vir C, vir D, vir E dan vir G.
Senyawa fenolik dikeluarkan menginduksi vir A memproduksi suatu protein vir A. Protein vir A mengalami autofosforilasi dan menginduksi fosforilasi protein vir G. Selanjutnya potein vir G mengaktifkan gen vir lain. Produk berupa protein vir D1, dan vir D2 memotong T-DNA pada daerah flanking (daerah susunan DNA berulang). Daerah tersebut sebagai pembatas kiri (left border) dan pembatas kanan (right border) T-DNA. Komponen pembatas kanan mutlak diperlukan dalam transfer T-DNA. Adanya pemotongan gen vir D menyebabkan terbentuk molekul DNA utas tunggal (ss-DNA) atau disebut T-strand. Struktur T-strand ditransfer sel Agrobacterium ke sel tanaman berupa DNA-protein kompleks (Powell et al. 1989).
complex (NPC). T-DNA berintegrasi dengan genom tanaman dan ekspresi gen membentuk opin dan hormon pertumbuhan menyebabkan terjadinya proliferasi akar melimpah pada bagian tanaman terinfeksi (Baron & Zambryski 1995).
Gambar 3. Mekanisme transfer T-DNA Agrobacterium ke dalam sel tanaman (Gelvin 2000)
A.3. Ekspresi T-DNA pada genom tanaman
T-DNA mengandung gen berperan biosintesis senyawa opin yaitu turunan gula dan asam amino. Opin diekskresikan tanaman ke lingkungan, dan dimetabolisasi oleh Agrobacterium. Opin dimanfaatkan Agrobacterium sebagai sumber karbon dan nitrogen. Tujuan Agrobacterium menginfeksi sel tanaman adalah untuk mensintesis senyawa opin (Nillson & Olsson 1997). Selain gen sintesis opin, T-DNA mengandung onkogen yaitu gen penyandi pembentukan hormon pertumbuhan auksin dan sitokinin. Integrasi T-DNA di dalam kromosom tanaman mengakibatkan ketidak seimbangan hormon sel tanaman, sehingga terjadi over produksi hormon. Hal tersebut menyebabkan pertumbuhan sel tidak terkontrol, dan ekspresi gen tersebut membentuk akar rambut.
T r a n s f e r T -D N A d a r iA.rhizogenes
k e t a n a m a n
Induksi genvir
V i rA V i rG Plasmid R i
Eksisi T D N A
VirE 2 VirD2
A T PVirD4
Vir B
R e s e p t o r tanaman O C H 3
OH C C H 3 O
O C H 3
Asetosiringon p H a s a m Gula Pelukaan Sitoplasmik transport Opine Integrasi Sitokinin Auksin
S e l Tanaman
N P C
H a iry root
A.4. Faktor yang mempengaruhi kultur akar rambut
Faktor yang berpengaruh terhadap pertumbuhan akar rambut antara lain, medium tumbuh, nutrisi, lingkungan biotik dan abiotik. Medium tumbuh di dalam kultur jaringan ada tiga jenis yaitu padat, semi padat dan cair. Medium tumbuh harus dicukupi unsur makro dan mikro nutrien, baik kualitatif maupun kuantitatif tergantung keadaan fisiologi jaringan atau eksplan yang dikultur. Susunan nutrien, tekanan osmosis dan kekuatan ion timbul di dalam sel berpengaruh pada pertumbuhan akar rambut (Sikuli & Demeyer 1997). Ernawati (1990) memperoleh media terbaik perangsang pertumbuhan akar rambut P. tinchlorium. Ait., pada media Marashige dan Skoog (MS) (1962) yang mengandung 2mM NH4NO3 1650 mg/l. Di samping itu dengan penurunan unsur fosfor media dapat meningkatkan kandungan flavonoid.
Vitamin sering digunakan dalam kultur jaringan, di antaranya tiamin (vitamin B1), asam nikotinat (niasin) dan pyridoksin (B6). Vitamin berfungsi sebagai koenzim dalam metabolisme karbohidrat dan protein. Kecuali susunan medium buatan, pilihan penggunaan medium padat atau cair menentukan keberhasilan suatu kultur tumbuhan. Pilihan medium padat atau cair umumnya dilakukan sesuai kebutuhan dan tujuan penelitian serta fasilitas yang tersedia (Gunawan 1992).
Lingkungan tumbuh mencakup suhu, kelembaban udara, pH dan cahaya, berpengaruh pada pertumbuhan kultur akar rambut. Lingkungan tumbuh optimum untuk pertumbuhan kultur akar bervariasi antar spesies. Toivonen et al. (1992) memperoleh pertumbuhan akar rambut Catharanthus roseus paling cepat apabila dikulturkan pada suhu 32 oC dibandingkan dengan suhu 19,5 oC dan 24 oC. Pada kedua suhu tersebut akar berwarna cokelat dan terbentuk kalus.
B. Cendawan Mikorhiza Arbuskula (CMA) B.1. Struktur umum CMA
Mikorhiza merupakan asosiasi cendawan dengan akar tanaman dalam bentuk simbiosis. Pada kondisi alami, hampir sebagian besar tanaman darat di dunia bersimbiosis dengan mikorhiza. Namun, CMA adalah tipe mikorhiza paling umum dijumpai sekitar 80% spesies tanaman darat (de-Souza 2005, Heijden & Sanders 2002, Smith & Read 1997). Pada saat ini sudah diakui secara luas peran penting simbiosis mikorhiza pada ketersediaan hara tumbuhan. Pada pertanian berkelanjutan, simbiosis CMA dengan tanaman memainkan peran kunci membantu tidak hanya ketahanan hidup tanaman, tetapi menjadikan lebih produktif pada kondisi tanah marjinal (Jeffries et al. 2003)
Banyak sekali jenis CMA dalam tanah, misalkan Gigaspora margarita dan Acaulospora tuberculata. CMA tersebut telah diteliti untuk tanaman perkebunan dan buah di antaranya adalah, kelapa sawit, kakao (Widiastuti 2004, Baon 1995), dan tanaman manggis (Lucia 2005). CMA tersebut digunakan untuk perkembangan in vitro, yaitu G. margarita dan A. tuberculata.
Gambar 4. Spora CMA genus Acaulospora dan Gigaspora (Lucia 2005). A. Acaulospora tuberculata,
B. Acaulospora rehmi, C. Gigaspora microsporophora, D. Gigaspora margarita
A
D B
C D
B.2. Karakteristik interaksi CMA dan simbion
Genus Gigaspora dan Acaulospora, merupakan CMA yang mempunyai ciri specifik yaitu, Gigaspora dengan bulbus suspensor, dan substanding hifa (sporophore), dinding luar terdiri dari satu lapis, dan halus. Sedang ciri specifik Acaulospora adanya hyphal terminus, pada spora matang terdapat lubang kecil disebut ciatrik, sebagai penghubung spora dan hifa terminus. Dinding luar terdiri tiga lapis, dan permukaan kasar seperti kulit jeruk (Gambar 3). Kedua genus tersebut disebut azygospora, karena spora terbentuk tidak langsung, berasal dari hifa, tetapi spora berkembang dari suspensor (Delvian et al. 2001, Lucia 2005).
B.3. Mekanisme infeksi CMA
Sebelum terjadi infeksi, spora CMA berkecambah dan terjadi pertumb uhan hifa. Selanjutnya terjadi kontak antara hifa dengan permukaan akar inang dan menghasilkan apresoria. Jaringan akar yang terinfeksi akan membentuk hifa interseluler dan intraseluler, hifa eksternal, dan arbuskula. Sedang beberapa spesies lain membentuk vesikula. Jaringan akar spesifik seperti epidermis dan korteks membentuk koloni, karena CMA tidak mempunyai enzim untuk degradasi lignin dan suberin.
Secara umum proses infeksi CMA akar tanaman melewati empat tahap yaitu, 1) induksi perkecambahan spora dan pertumbuhan hifa, 2) kontak hifa dan permukaan akar, menyebabkan pengenalan dan pembentukan apresorium, 3) penetrasi hifa ke dalam akar, dan 4) perkembangan struktur arbuskula internal, sehingga terjadi simbiosis fungsional (Bonfante & Perotto 1995). Mekanisme infeksi akar, baik secara in vitro maupun konvensional (in vivo) hampir tidak berbeda. Perbedaan hanya pada perlakuan inokulum, untuk in vitro proses sterilisasi permukaan spora, dan stratifikasi pendinginan untuk mencegah dormansi, sedang untuk in vivo tanpa melalui proses tersebut. Untuk spora in vitro spora yang dihasilkan steril, dan sebaliknya secara konvensional sering tercemar.
sampai 14 hari. Sumber karbon di dalam kultur pot berasal dari hasil fotosintesis, sedang pada sistem in vitro bersumber pada metabolisme proses siklus glikolisis.
B.4. Induksi perkecambahan spora dan pertumbuhan hifa
Beberapa peneliti mengemukakan bahwa eksudat akar mempengaruhi perkecambahan spora dan pertumbuhan hifa, yaitu pembengkakan dan percabangan hifa (Giovannetti et al. 1993). Orcutt & Nielsen (2000) mengelompokkan senyawa organik yang dikeluarkan akar berdasarkan pergerakannya di tanah ke dalam tiga kelompok yaitu 1) larut air dan berdifusi, 2) volatil dan berdifusi, dan 3) tidak dapat berdifusi. Kemampuan eksudat akar volatil menarik tabung perkecambahan lebih tinggi dibandingkan dengan yang larut air, sebab eksudat volatil dapat menarik tabung perkecambahan pada jarak lebih dari 10 mm, sedang eksudat yang larut air aktivitas biolo ginya hilang pada jarak 1 mm. Selanjutnya ditunjukkan bahwa eksudat volatil bukan berasal dari inang yang menghambat perkecambahan spora CMA.
Beberapa peneliti mengemukakan bahwa eksudat akar tanaman inang tidak hanya menstimulasi pertumbuhan hifa, tetapi juga memberikan pengaruh morfogenetik terhadap cendawan. Beberapa flavonoid seperti kuersetin yang terdapat dalam eksudat akar dapat menginduksi perkecambahan spora dan pemanjangan hifa Glomus etunicatum (Tsai & Phillips 1991). Selanjutnya Bécard et al. (1995) mengemukakan bahwa sebagian besar metabolit termasuk flavonoid menstimulasi pertumbuhan CMA, walaupun dalam pengembangan simbiosis flavonoid tidak diperlukan lagi. Isoflavon sebagai molekul penanda dalam simbiosis CMA dengan tanaman dapat menginduksi pertumbuhan hifa, percabangan, dan diferensiasi serta penetrasi hifa ke sel inang, karena mempengaruhi permiabilitas membran akar.
baik secara kuantitatif maupun kualitatif komponen eksudat akar tanaman yang tidak dipupuk P dan dipupuk P. Pada konsentrasi P eksternal rendah, jumlah eksudat lebih banyak bila dibandingkan dengan keadaan P tinggi. Hubungan antara tingkat efisiensi P empat kultivar jagung dan kemampuan menarik tabung perkecambahan menunjukkan, bahwa kultivar efisien kurang mampu menarik tabung perkecambahan spora, sedang kultivar tidak efisien lebih mampu menarik tabung perkecambahan (Suriyapperuma & Koske 1995).
B.5. Pembentukan apresorium
Hasil penelitian Giovannetti et al. (1993, 1994, 1995), dan Nagahashi et al. (1995) menunjukkan bahwa tanaman mengeluarkan sinyal kimia dalam bentuk eksudat akar yang penyebabkan perubahan morfologi hifa, berupa proliferasi dan percabangan hifa sebelum pembentukan apresorium. Sinyal ini tidak diinduksi oleh cendawan, namun merupakan komponen konstitutif eksudat inang (Nagahashi et al. 1995). Perkembangan hifa ekstensif berasosiasi dengan akar tanaman inang, menyebabkan terbentuknya apresorium. Apresorium merupakan ujung hifa berbentuk elips, rata dan terbentuk pada permukaan akar inang.
B.6. Mekanisme penetrasi hifa ke dalam akar
Penetrasi CMA ke jaringan inang di samping secara enzimatis juga secara mekanik. Hal ini ditunjukkan dengan tingginya tekanan dihasilkan oleh apresorium. Tekanan mekanis menyebabkan cendawan mampu menembus dinding sel khususnya me lalui pembentukan kaki penetrasi. Beberapa komponen dinding sel seperti, melanin berperan penting dalam meningkatkan tekanan hidrostatik, karena komponen dinding sel tersebut menangkap cairan dalam apresoria, dapat menyebabkan terjadinya peningkatan gradien osmose dan penyerapan air (Bonfante & Perotto 1995).
Apresoria menghasilkan hifa cenderung tumbuh di antara sel epidermis dan tidak memotong dinding luar. Masuknya apresoria ke dalam akar, terbentuk hifa interseluler tumbuh dalam saluran banyak udara (Brundrett & Kendrick 1990). Memotong dinding sel korteks menjadi hifa intraseluler, menghasilkan kaki penetrasi dan hanya sedikit menyebabkan perubahan struktur dinding sel inang (Bonfante & Vian 1989). Sedikitnya perubahan struktur dinding sel inang menunjukkan penetrasi CMA ke akar merupakan kombinasi mekanik dan enzimatis (Bonfante & Perotto 1995).
Di sisi lain penetrasi CMA ke akar tanaman melakukan serangkaian mekanisme pertahanan. Salah satunya adalah dengan akumulasi protein berkaitan dengan patogenesis melalui aktivitas antimikroba. Enzim yang berkaitan dengan pertahanan tanaman seperti kitinase dapat dilawan dengan penyebaran hifa cendawan. Kitinase berperan dalam melawan cendawan patogen melalui reaksi hidrolisis (Pozo et al. 2002).
Secara umum peningkatan pertumbuhan tanaman bermikorhiza disebabkan oleh penyerapan P, khusus dari sumber P tersedia. Selain daya jelajah hifa sangat tinggi dibandingkan dengan akar, mikorhiza mampu meningkatkan enzim fosfatase, yang berfungsi menguraikan unsur P terfiksasi atau terikat. Selain itu diameter hifa sangat kecil (2–4 µ m) menyebabkan daya terobos lebih besar (Bolan 1991, Marschner & Dell 1994).
Marschner & Dell (1994) menyatakan bahwa pengambilan dan tansport N15 oleh hifa pada tanaman seledri, menunjukkan peningkatan N total sebesar 2,5 % dan 3,5 % setelah 30 hari. Kondisi ini terjadi pada tanaman bermikorhiza. Arbuskula adalah struktur paling berarti dalam CMA berfungsi komplek sebagai tempat pertukaran metabolit antara cendawan dan tanaman. Bonfante & Scannerini (1992) menyatakan bahwa arbuskula sangat penting untuk identifikasi terjadinya infeksi pada akar tanaman. Seluruh endofit termasuk genus Gigaspora, Scutellospora, Glomus, Sclerocystis, dan Acaulospora mampu membentuk arbuskula.
Vesikula menurut Abbott & Gazey (1994) berbentuk globus berasal dari gelembung hifa internal CMA. Vesikula ditemukan baik di dalam maupun di luar lapisan kortek parenkhim, dan tidak semua CMA membentuk vesikula dalam akar inang. Pada umumnya vesikula berfungsi sebagai organ reproduktif atau organ tempat menyimpan makanan, kemudian diangkut ke dalam sel dimana metabolisme berlangsung. Pendapat la in menganggap vesikula sebagai organ istirahat, karena jumlahnya meningkat pada saat tanaman tua atau tanaman menuju kematian (Abbott & Gazey 1994, Bonfante & Vian 1989).
B.7. Perubahan struktur cendawan dan tanaman selama proses infeksi
mengemukakan bahwa umur arbuskula Scutellospora, Acaulospora dan Glomus caledonium berkisar antara 16 hari. Pengujian ultra struktur menunjukkan bahwa sebagian besar modifikasi terjadi pada bagian sel cendawan, seperti dinding sel secara progresif menjadi lebih tipis dengan adanya infeksi di akar dan sitoplasma (Bonfante & Scannerini 1992). Selain itu aktivitas enzimatis cendawan spesifik dimulai selama infeksi jaringan tanaman seperti ekspresi alkalin fosfatase. Bagaimanapun juga, mekanisme pengendali diferensiasi struktur CMA khususnya arbuskula belum dikenal.
Ruang interfase adalah tempat terjadinya pertukaran hara dua arah (Smith & Smith 1990). Hasil analisis aktivitas ATPase menunjukkan bahwa kemungkinan membran di sekitar cendawan (perifungi) sangat berperan dalam transport hara. Sebagian aktivitas ini disebabkan adanya H+/ATPase terdapat di membran perifungi mengalami invaginasi di sekitar arbuskula. Membran cendawan merupakan bagian penting karena pada bagian ini terjadi transfer dua arah antara tanaman dan cendawan. Menurut Gianinazzi-Pearson (1994), berdasarkan konsistensi aktivitas H+/ATPase, pertukaran terjadi baik pada interfase arbuskula maupun interfase dinding sel korteks dan hifa interseluler. Adanya aktivitas H+/ATPase mencirikan simbiosis mutualisme, sebagaimana dijumpai membran tanaman sekitar bakteri bintil akar. Hal ini tidak dijumpai pada membran haustoria di sekitar interaksi patogen-tanaman (Bonfante & Perotto 1995).
B.8. Peningkatan serapan P tanaman sebagai respons kolonisasi CMA
Serapan P oleh hifa sangat dipengaruhi oleh jarak dan kualitas hifa. Semakin dekat hifa terhadap sumber P, maka serapan P semakin tinggi demikian pula hifa yang matang akan lebih mampu menyerap P dibandingkan dengan hifa belum matang. Bago (2004) menyatakan bahwa morfogenesis, arsitektur, percabangan, struktur penyerapan, dan sporulasi miselia ekstraradikal dipengaruhi oleh senyawa kimia dalam medium. Respons ditimbulkan dengan adanya PO4 3- sama dengan respons yang ditumbuhkan pada medium agar murni, yaitu hifa jelajah (hifa runner) meluas secara radial di sekitar koloni. Sedangkan adanya NO3- akan menambah jumlah hifa runner meningkatkan percabangan struktur penyerapan, meningkatkan jumlah spora dan derajat kebasaan. Pemberian NH4+ berlebih menyebabkan penurunan sporulasi, dan induksi perubahan morfologi.
Peningkatan ketersediaan P organik kemungkinan berkaitan dengan produksi fosfatase asam dan alkalin CMA di rhizosfir maupun hifosfer yang diinokulasi G. mosseae (Tarafdar & Marschner 1994). Namun pada medium yang diinokulasi G. caledonium dan G. inverinaium dengan penambahan 1 % bahan organik tidak terjadi peningkatan fosfatase. Hifa eksternal CMA dapat menghasilkan fosfatase yang berperan dalam mineralisasi P organik secara langsung (Joner & Johansen 2000) ataupun tidak langsung (Joner et al. 1995). Hasil penelitian Joner & Johansen (2000) me nunjukkan bahwa hifa eksternal Glomus intraradices dan Glomus claroideum mampu menghasilkan fosfatase.
C. Kultur Aksenik CMA secara in vitro
Kultur aksenik CMA adalah kultur CMA tidak terkontaminasi mikroba lain disebut biakan murni dan atau steril (Abercrombie et al. 1993, Anonimus 2006 a). Di Indosesia teknik tersebut belum dikembangkan, sehingga inovasi produksi CMA asli Indonesia perlu dilakukan.
Kultur aksenik merupakan salah satu inovasi untuk meningkatkan kualitas produksi spora, maupun spora CMA yang dihasilkan. Produksi spora masal kultur aksenik in vitro umum menggunakan inang akar rambut, tetapi juga dapat dilakukan dengan eksplan tanaman untuk penyediaan inokulum, dan teknik tersebut berpotensi dikembangkan (Becard & Piche 1992,Becard & Fortin 1988, Dalpe & Declerck 2002). Tidak semua CMA dapat dikembangkan dengan kultur tersebut, namun pada umumnya Glomus dan Gigaspora, Acaulospora rehmii (Dalpe & Declerck 2002) dan Scutellospora (de-Souza 2005).
Kultur aksenik secara in vitro dengan menggunakan akar rambut dapat digunakan sebagai alat penyederhanaan dalam mempelajari tahapan CMA bersimbiosis. Fortin et al. (2002) menyatakan bahwa akar rambut telah digunakan sebagai terobosan baru ke arah interaksi langsung CMA dan jasad renik tanah, pengambilan bahan nutrisi oleh CMA (Jolicoeur 2002, Bago et al. 2000, Toussaint 2002), meningkatkan produksi CMA dan propagul (Jolicoeur 1999). Pada umumnya percobaan secara in vitro dilakukan dengan menggunakan akar rambut wortel (Becard & Fortin 1988), akar rambut arbei (Nuutile et al. 2001) dan tomat (Khaliq & Bagyaraj et al. 2000). Untuk kultur aksenik CMA diperlukan informasi tentang beberapa hal yang berpengaruh terhadap kultur aksenik yaitu sterilisasi spora, dan produksi spora CMA in vitro.
C.1. Sterilisasi spora CMA
Fortin et al. (2002) menyatakan bahwa sterilisasi permukaan spora sangat penting untuk keberlanjutan pertumbuhan dan perkembangan spora secara in vitro, atau penyediaan kultur aksenik CMA.
Pada umumnya penggunaan bahan sterilan dari beberapa metode memberikan hasil kurang memuaskan. Hal ini ditunjukkan oleh tingkat kontaminasi sangat tinggi. Dalam waktu singkat hampir semua kultur terkontaminasi oleh bakteri. Frances et al. (1996) memperlihatkan permukaan spora belum disterilisasi memberikan kenampakan permukaan berlendir, membentuk pupil atau tonjolan mengkilat diindikasikan bakteri. Bakteri tersebut menempel di permukaan spora, namun ada beberapa bakteri yang tinggal di dalam dinding spora. Kondisi ini menyebabkan sulit memperoleh spora steril. Will & Sylvia (1990) melaporkan bahwa organisme yang berhubungan dengan permukaan spora CMA dapat saling merangsang, dapat pula menghalangi dan atau menunda perkecambahan spora.
Pada prinsipnya sterilisasi dilakukan untuk membersihkan permukaan spora, dilanjutkan dengan membunuh mikroba dalam epidermis CMA dengan antibiotik. Namun ada beberapa sterilan menggunakan perlakuan menekan terjadinya dormansi spora. Buce et al. (2000) menggunakan MgSO4.7H2O 0,1 % dan Tween 20 steril untuk sterilisasi permukaan spora. MgSO4.7H2O berfungsi mencegah dormansi spora (Frances et al.1996). Menurut Fortin et al. (2002) Tween 20 berfungsi pelembut spora, sehingga antibiotik berfungsi sebagai pembunuh organisme pencemar dengan baik. Antibiotik streptomisin sering digunakan untuk membunuh bakteri Gram negatif. Antibiotik lainnya adalah penisilin pembunuh bakteri Gram positif, gentamisin dan tetrasiklin mempunyai spektrum lebih luas berfungsi pembunuh kuman bersifat Gram negatif maupun positif dan kemoterapi. Banyak jenis antibiotik yang digunakan diharapkan fungsi antibiotik semakin luas.
(2003) menyatakan bahwa kegagalan perkecambahan mungkin disebabkan kerusakan tabung perkecambahan atau fisiologi CMA, misalkan spora belum matang, juga kemungkinan faktor lingkungan kurang mendukung. Di samping itu adanya pengaruh bahan kimia digunakan untuk sterilisasi dan lama waktu sterilisasi kurang tepat, sehingga dapat mempengaruhi tabung perkecambahan dan akhirnya spora tidak mampu berkecambah. Bahan kimia adalah salah satu faktor yang dapat menghambat perkecambahan (Giovanetti et al. 1993, Bianciotto & Bonfante 1993). Diop et al. (1994) menyatakan bahwa konsentrasi Zn dan Mg di dalam media agar menghambat perkecambahan spora. Di satu sisi kehadiran eksudat tanaman sangat diperlukan, karena bersifat kemoatraktif terhadap hifa CMA.
C.2. Produksi CMA in vitro
Produksi CMA in vitro menggunakan kultur ga nda yaitu media MM dan MSR, pada umumnya inang yang digunakan akar rambut wortel. Banyak faktor mempengaruhi produksi CMA in vitro. Jenis CMA, karena tidak semua CMA dapat dikultur in vitro, sampai saat ini yang sudah dapat dikultur in vitro pada umumnya Glomus, Gigaspora dan Acaulospora rehmii (Dalpe & Declerck 2002) dan Scutellospora (de-Souza 2005).
Produksi spora dapat terjadi apabila kedua simbion sudah membentuk asosiasi mantap dan stabil. Asosiasi tersebut diawali dengan spora berkecambah, hifa dapat berkembang dengan baik, terbentuk arbuskula dan vesikula. Terbentuknya struktur organ tersebut sebagai ciri spesifik suksesnya simbiosis antara inang dan CMA (Dalpe & Declerck 2002). Akhirnya dapat dikatakan bahwa simbiosis telah terjadi dan stabil, CMA dapat berkembang maka produksi spora CMA bisa diperoleh.
sebagai inokulum, akar terinfeksi tinggi dan menghasilkan 450 spora G. margarita dalam 30 ml medium. Produksi spora sistem in vitro menghasilkan spora sangat banyak, pertumbuhan akar lebih aktif jika nutrisi dalam kultur dikurangi (miskin). Oleh sebab itu penting sekali dibuat suatu sistem untuk meningkatkan produksi inokulum CMA (Douts & Schenk 1990).
Perkecambahan spora terlihat setelah 2 minggu inokulasi. Kolonisasi akar rambut wortel dan tomat terlihat setelah 40 hari, dan kolonisasi akar wortel lebih tinggi apabila dibandingkan dengan kolonisasi tomat, dan meningkat cepat antara hari ke 36–72 hari dan mencapai 2,5 % - 3,35 % (Klironomos & Hart 2002). Selain itu ditemukan juga konsentrasi fosfat rendah (22:7), tetapi dapat memacu proses simbiosis, sedang dengan P awal tinggi dapat menghambat pembentukan mikorhiza, dengan kata lain konsentrasi P awal dalam media merupakan faktor penentu proses simbiosis.
Peranan fosfat dalam simbiosis CMA masih belum jelas, ketersediaan P lebih rendah dalam medium dan pengambilan sangat cepat, diduga awal penetapan simbiosis. Selanjutnya konsentrasi N, sukrosa, fosfat dan Na2SO4 di dalam sistem in vitro infeksi CMA mengalami penurunan. Pengaruh pengurangan unsur-unsur tersebut akan meningkatkan produksi eksudat akar rambut, sebagai faktor petunjuk terbentuknya simbiosis lebih luas. Namun demikian eksudat akar juga dapat merangsang percabangan hifa CMA (Nagashi & Douds 2000). Eksudat akar hidrofobik, fosfat rendah dapat merangsang pertumbuhan hifa sebelum terjadinya kolonisasi (Nagahashi 2000). Tahir (2003) menyatakan bahwa produksi spora CMA secara in vitro mempunyai prospek penting untuk mendapatkan spora dan propagul steril.
media kultur ganda adalah media miskin untuk perkecambahan CMA. Ada dua macam media kultur ganda yaitu MM (Becard & Fortin 1988), dan MSR (Strullu & Romand 1986). Sedang Strullu & Romand (1986) menyatakan bahwa kultur ganda adalah medium yang digunakan untuk perkembangan CMA in vitro dengan kadar P 44 mg/l. Faktor yang berpengaruh dalam kultur ganda, seperti kultur umumnya, yaitu komposisi nutrisi media, jenis media, cahaya dan suhu. Jenis medium berpengaruh nyata terhadap induksi akar rambut (Giri & Narasu 2000).
D. Enkapsulasi spora
Enkapsulasi spora adalah spora dibungkus dengan Na-alginat atau sodium alginat. Maggies et al. (2005) menyatakan bahwa mikroenkapsulasi adalah suatu pendekatan alternatif gen terapi. Sel genetikal dimasukkan ke dalam mikrokapsul untuk pengiriman produk obat rekombinasi efektif untuk manusia. Umumnya mikrokapsul menggunakan alginat dimasukkan dalam zat kapur.
Anonimus (2006 c) menyatakan bahwa alginat dihasilkan dari tanaman hidup di laut dalam atau ganggang cokelat. Fungsi utama alginat adalah sebagai agen gelasi. Beberapa jenis ganggang cokelat menghasilkan alginat antara lain Microcystis pyryfera dan Ascophyllum nodosum berasal dari lautan Atlantis Utara dan Selatan. Struktur ganggang penghasil alginat berbentuk linier tidak bercabang, bersifat polimer berisi ß-1 asam D- mannuronic 4 (M) dan a-1 asam L-guluronic 4(G).
Calvet et al. (1996) menyatakan bahwa sodium alginat digunakan untuk pengemasan dan penyimpanan mikroorganisme termasuk Glomus mosseae dan Glomus intraradices. Dalam percobaan digunakan sodium alginat 2 %. Setelah diinkubasi pada suhu 25 oC selama 4 hari dapat berkecambah. Pengamatan perkecambahan dengan membuka lapisan sodium alginat di bawah mikroskop binokuler. Persentase perkecambahan 44 % untuk G. mosseae dan 28 % untuk G. intraradices.
sodium-alginat tidak menghambat perkecambahan cendawan mikorhiza arbuskula, khususnya G. mosseae dan G. intraradices (Calvet 1996).
Pengembangan Teknologi Akar Rambut Beberapa Tanaman
Secara
In Vitro
ABSTRAK
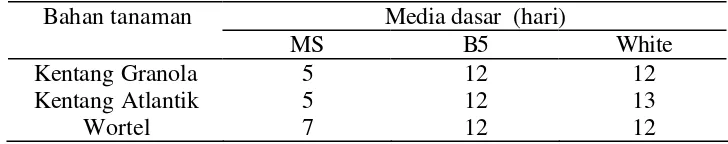
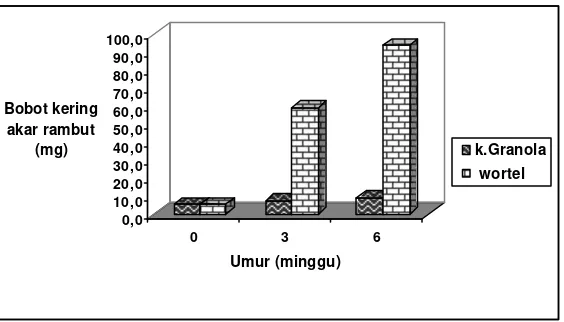
Teknologi akar rambut pada umumnya dimanfaatkan untuk perbanyakan dan perkembangan CMA in vitro, namun di Indonesia belum dilakukan. Penelitian ini bertujuan untuk mendapatkan (1) tanaman yang mampu menginduksi akar rambut, (2) medium terbaik untuk pertumbuhan akar rambut kentang dan wortel, (3) pertumbuhan akar rambut yang mampu tumbuh dengan baik dalam medium kultur ganda, dan (4) konfirmasi hasil T-DNA A. rhizogenes pada akar rambut tanaman uji. Percobaan menggunakan tanaman jagung, sorghum, kentang Granola, kentang Atlantik dan wortel diinfeksi A. rhizogenes galur LBA 9457. Eksplan dik ulturkan dalam medium MS, B5 dan White tanpa penambahan zat pengatur tumbuh. Kultur diinkubasi dalam ruang gelap. Percobaan menggunakan Rancangan Acak Lengkap Faktorial, dengan ulangan lima kali. Integrasi T-DNA A. rhizogenes dalam akar rambut tanaman uji dianalisis dengan primer spesifik TL dan TR dengan PCR. Hasil yang diperoleh menunjukkan bahwa pertumbuhan akar rambut paling baik tanaman wortel dikulturkan pada medium White, dapat beradaptasi pada medium modifikasi minimal MM. Uji integrasi T-DNA menunjukkan bahwa masing- masing akar rambut teramplifikasi TL dan TR-DNA pada ukuran basa 780 pb TL dan TR 1600 pb. Disimpulkan bahwa akar rambut wortel berpotensi untuk digunakan sebagai inang perbanyakan dan perkembangan CMA G. margarita dan A. tuberculata in vitro.
---
Kata kunci : Akar rambut, Agrobacterium rhizogenes, Gigaspora margarita, Acaulospora
tuberculata, kultur in vitro, kultur ganda, Daucus carota, Solanum tuberosum, sorghum, Zea mays.
The development of hairy root technology of several plants
through
in vitro
culture
Abstract
and carrot infected by A. rhizogenes strain LBA 9457. Explants were cultured on MS, B5, and White medium without the addition of growth hormones, and incubated in dark culture room. Completely Randomized Design were used in these experiments with five replications of each treatment. Hairy root with the best performance were cultured in minimum medium (MM), so that medium MSR for dual culture. The integration of T-DNA of A. rhizogenes on hairy root of tested host plants was analyzed by TL and TR primer by PCR. The result showed that carrot cultured on the White medium gave the best growth of hairy root. Carrot hairy root is the most adaptable on minimum medium (MM). Confirmation test of insertions of A. rhizogenes T-DNA found that there are two bands of DNA with base size of 1600 bp TR and 780 bp TL. It showed that TL and TR DNA from A. rhizogenes have well integrated in hairy root. This research suggested that carrot hairy root can be further developed on AMF host in vitro, especially for G. margarita and A. tuberculata.
---
Keys words : Hairy root, Agrobacterium rhizogenes, Gigaspora margarita, Acaulospora tuberculata, dual culture, in vitro- culture, Daucus carota, Solanum tuberosum, sorghum, Zea mays.
1. PENDAHULUAN
Akar transforman merupakan salah satu hasil teknologi kultur jaringan, dan hasil induksi T-DNA A. rhizogenes yang dapat mengekspresikan pembentukan akar rambut (Giri & Narasu 2000). Perpindahan T-DNA A. rhizogenes ke dalam sel tanaman, ditandai dengan pembentukan dan pertumbuhan akar rambut yang cepat disebut dengan hairy root (Downs et al. 1994, Frugis et al. 1995), dan ekspresi onkogen plasmid Ri memacu terbentuknya akar adventif (hairy root) pada tempat terinfeksi(Nillson & Olsson 1997).
Gen tersebut penyandi hormon pertumbuhan auksin dan sitokinin. Apabila onkogen terekspresi maka terjadi pertumbuhan sel yang sangat cepat, sehingga mencirikan pembentukan akar adventif pada tempat yang diinfeksi (Nillson & Olsson 1997). Akar tersebut bersifat otonomi terhadap fitohormon. Gen tersebut selalu ditemukan dalam akar tanaman yang ditransformasi oleh Agrobacterium, sedang TR-DNA yang mengkode biosintesis opin dan auksin tidak selalu ditemukan pada akar transforman (Nasir 2002, Christey & Braun 2004).
Christey & Braun (2004) menyatakan bahwa sedikitnya ada tujuh langkah dalam proses transfer molekul T-DNA dari sel Agrobacterium ke sel tanaman, yaitu (1) pengenalan sel tanaman yang rentan (2) induksi ekspresi gen vir, (3) produksi kopy T-DNA yang dapat ditransfer, (4) transfer kompleks T-DNA ke membran bakteri, (5) transfer kompleks T-DNA melalui membran bakteri dan sitoplasma tanaman, (6) transfer kompleks T-DNA melalui sitoplasma tanaman dan membran inti, terakhir integrasi elemen T-DNA kedalam genom inti tanaman.
Keberhasilan integrasi T-DNA pada sel tanaman dapat diuji dengan menggunakan teknik Polymerase Chain Reaction (PCR) yaitu suatu teknik sintesis dan amplifikasi DNA secara in vitro (Handoyo & Ruditerna 2000, Bourgaize et al. 2000, Mondal et al. 2001). Toruan-Mathius et al. (2004) melaporkan bahwa tanaman kina C. ledgeriana dan C. succirubra mampu membentuk akar rambut melalui eksplan daun yang dilukai dan diinfeksi dengan A. rhisogenes galur LBA 9457. Eksplan yang mampu membentuk akar rambut berkembang baik dalam medium Murashige & Skoog (1962) tanpa penambahan zat pengatur tumbuh. Akar rambut mempunyai keunggulan dalam beberapa karakter penting, seperti morfologi, kapasitas pertumbuhan, dan struktur biokimianya, sehingga banyak digunakan sebagai inang CMA dalam kultur aksenik (Tanaka 1997).
al. 2002, Bago et al. 2000, Toussains 2002). Jolicoeur et al. (1999) menyatakan bahwa CMA yang dikembangkan dalam kultur akar rambut in vitro dapat meningkatkan propagul.
Pada umumnya penelitian pengembangan CMA secara in vitro menggunakan akar rambut (Becard & Fortin 1988, Nuutile et al. 2001, Khaliq & Bagyaraj 2000). Boisson-Sernier et al. (2001) menyatakan akar rambut Medicago trunculata digunakan untuk mempelajari asosiasi antara CMA dan Rhizobium. Selain itu kultur akar rambut juga dapat diamplifkasi sebagai inang untuk menghasilkan protein asing seperti anti bodi (Wongsamuth & Doran 1997).
Giri & Narasu (2000) menyatakan bahwa ada beberapa faktor yang mempengaruhi pertumbuhan dan biomasa kultur akar rambut, antara lain komposisi nutrisi di dalam medium, jenis medium, jenis tanaman dan faktor fisik seperti suhu, dan cahaya. Ernawati (1990) melaporkan bahwa peningkatan konsentrasi sukrosa sampai 6 % dapat meningkatkan produksi senyawa anti jamur pada kultur akar rambut Polygonum tinchorium.Ait. Selain itu juga diperoleh media terbaik merangsang pertumbuhan akar rambut P. tinchorium.Ait., dengan media dasar MS, demikian juga bobot kering dan antosianin yang dihasilkan.
Tidak semua tanaman memberikan respons terhadap T-DNA dari A. rhizogenes, karena proses terakumulasinya T-DNA A. rhizogenes pada tanaman merupakan suatu proses yang sangat kompleks. Banyak faktor yang mempengaruhi, di antaranya eksplan yang akan diinokulasi, jenis tanaman, media dan jenis bakteri yang digunakan, serta lingkungan abiotik dan biotik (Aneloi 2004, Reflini 2002).
2. BAHAN DAN METODE
Penelitian dilakukan di Laboratorium Biomolekuler dan Rekayasa Genetik, Balai Penelitian Bioteknologi Perkebunan Indonesia dan Laboratorium Fisiologi Tumbuhan, Jurusan Biologi FMIPA Institut Pertanian Bogor dari bulan Juni 2003–Desember 2003. Penelitian terdiri dari beberapa percobaan, yaitu (1) seleksi tanaman inang yang mampu membentuk akar rambut, (2) seleksi media pertumbuhan akar rambut (3) pertumbuhan akar rambut dalam medium modifikasi minimal (kultur ganda), dan (4) uji konfirmasi T-DNA A. rhizogenes
2.1. Seleksi tanaman inang membentuk akar rambut
Bahan tanaman yang digunakan adalah jagung, sorghum, kentang Granola, kentang Atlantik dan wortel. Benih jagung, sorghum dan wortel disterilkan dengan alkohol 70 % 3 menit dan Bayclin 30 % (NaOCl2,1,56 %), selama 5 menit, kemudian dicuci dengan akuades steril. Benih dikecambahkan di dalam cawan Petri berisi kertas saring steril yang dilembabkan dengan akuades steril, dan digunakan setelah kecambah umur dua minggu. Selanjutnya lima kecambah dari masing- masing tanaman dik ulturkan dalam botol berisi medium MS. Kultur diinkubasi dalam ruang bercahaya 75-100 luks 12 jam/hari, Rh 80-90 %, dan suhu 26 oC. Untuk bahan tanam kentang Granola dan Atlantik digunakan planlet berumur 1-2 bulan berasal dari Lab. Kultur Jaringan jurusan Agronomi IPB. Secara rutin setiap 1 bulan kultur diremajakan melalui penggandaan tunas aksilar dalam medium MS dengan penambahan 0,1 mg/l kinetin.
Sebelum A. rhizogenes galur LBA 9457 diinokulasikan, terlebih dahulu diperbanyak dengan dikulturkan dalam medium suspensi YMB (Lampiran 2) dan dikocok menggunakan mesin pengocok dengan kecepatan 100 rpm (12 jam/hari) (Sambrook et al. 1989). Kultur ditempatkan dalam ruang kultur bercahaya 12 jam /hari, suhu 26 oC Rh 80-90 %. Kultur berumur 48 jam siap digunakan untuk inokulasi tanaman uji.
Setelah dikeringkan di atas kertas saring steril, sebanyak tiga potong dari masing-masing tanaman dik ulturkan dalam medium Murashige dan Skoog (MS), B5 dan