38 Lampiran 1. Bagan alur penelitian
Usus halus kelinci
Usus halus kelinci segaryang terbalik dan yang tidak terbalik
Usus halus kelinci yang dikeringkan terbalik dan tidak terbalik dengan
Pemeriksaan absorpsi dengan menggunakan ibuprofen baku
39
Lampiran 2. Flowsheet pembuatan larutan induk baku ibuprofen dalam larutan dapar fosfat pH 6,4 isotonis
Ditimbang seksama 50 mg Dimasukkan ke dalam labu tentukur 1000ml
Dicukupkan dengan dapar fosfat pH 6,4 isotonis sampai dengan garis tanda
Ibuprofen baku
40
Lampiran 3. Flowsheet penentuan panjang gelombang maksimum ibuprofen baku dalam larutan dapar fosfat pH 6,4 isotonis
Dipipet 1,8 ml
Dimasukkan ke dalam labu tentukur 10 ml
Dicukupkan dengan dapar fosfat pH 6,4
isotonis sampai dengan garis tanda Diukur pada panjang gelombang 200-400 nm
Larutan induk baku
41
42
Lampiran 5. Flowsheet pembuatan kurva kalibrasi ibuprofen baku dalam larutan dapar fosfat pH 6,4 isotonis
Dipipet masing-masing 0,3 ml; 0,8 ml; 1,3 ml; 1,8 ml; 2,3 ml; 2,8 ml; 3,3 ml atau setara dengan konsentrasi 1,5; 4; 6,5; 9; 11,5; 14; 16,5 mcg/ml Dimasukkan ke dalam labu tentukur 10 ml
Dicukupkan dengan dapar fosfat pH 6,4
isotonis sampai dengan garis tanda Diukur pada panjang gelombang 222 nm
Larutan induk baku
43
Lampiran 6. Penentuan persamaan regresi dan kurva kalibrasi ibuprofen baku dalam larutan dapar fosfat pH 6,4 isotonis
Konsentrasi
NO Konsentrasi (mcg/ml) Absorbansi Rata-Rata
44 Lampiran 6, (Lanjutan)
b = y – ax
b = 0,361 – (0,0468)(7,875) b = - 0,00752
45
Lampiran 7. Flowsheet pembuatan usus halus terbalik kelinci
Berat 1,5 – 2 kg
Dipuasakan selama 20-24 jam
Dianestesi dengan menggunakan kloroform
Dilakukan pembedahan pada bagian perut dan ususnya dikeluarkan
Dibersihkan dari jaringan yang mengikat pembuluh darah halus
Diambil pada jarak 25 cm dari pylorus
Bagian atas jejunum diukur 10 cm dan diikat dengan benang, digunakan sebagai kontrol
Bagian bawahnya diukur 10 cm dan dipotong serta salah satu bagian diikat dan dilakukan sebanyak 3 kali, digunakan untuk percobaan
Isinya dibersihkan dengan cara dicelupkan dalam larutan thyrode dingin
Dibalik menggunakan batang pembalik berpenampang 2 mm Dilepaskan dari batang pembalik dan dicelupkan kembali dalam larutan thyrode dingin
Kelinci Jantan
Usus bersih
Potongan Usus
46
Lampiran 7. Flowsheet pembuatan usus halus tidak terbalik kelinci
Berat 1,5 – 2 kg
Dipuasakan selama 20-24 jam
Dianestesi dengan menggunakan kloroform
Dilakukan pembedahan pada bagian perut dan ususnya
dikeluarkan Dibersihkan dari jaringan yang mengikat pembuluh darah halus
Diambil pada jarak 25 cm dari pylorus
Bagian atas jejunum diukur 10 cm dan diikat dengan benang, digunakan sebagai kontrol
Bagian bawahnya diukur 10 cm dan dipotong serta salah satu bagian diikat dan dilakukan sebanyak 3 kali, digunakan untuk percobaan
Isinya dibersihkan dengan cara dicelupkan dalam larutan thyrode dingin
Kelinci Jantan
Usus bersih
Potongan Usus
47
Lampiran 8. Flowsheet penentuan pola penembusan membran oleh berbagai sediaan ibuprofen pada usus halus terbalik kelinci
10 cm potongan usus terbalik
Ujung bagian atas dihubungkan dan diikat pada kanula dengan panjang 7 cm
Ke dalam kantong usus diisi 3 ml cairan serosa berupa larutan dapar fosfat pH 6,4 isotonis
Dimasukkancairanmukosaberupalarutandaparfosfat pH 6,4isotonis yang mengandunglarutan ibuprofen baku dengan konsentrasi 2 mmol
kedalamtabungcairan
Diaturthermostat pada temperatur 37 ± 0,5oC.
Dialirioksigen secara terus-menerus dengan kecepatan kira-kira 1 gelembung/detik
Pada menit ke-5, 10, 15, 30, 60, 90, 120, 150 cairan serosa diambil sebanyak 1 ml melalui kanula dan dimasukkan 1 ml setiap pengambilan
Dimasukkan ke dalam labu tentukur 25 ml dan diencerkan dengan larutan daparfosfat pH 6,4 isotonis sampai dengan garis tanda
Diukur serapan dengan Spektrofotometer UV pada λ 222,5 nm
Dilakukan cara yang sama untuk usus tidak terbalik
48
Lampiran 9. Contoh perhitungan pembuatan larutan obat ibuprofen 2 mmol/L
Contoh perhitungan konsentrasi ibuprofen dengan menggunakan rumussebagai berikut sehingga diperoleh konsentrasi 2 mmol/L:
V
Jadi, untuk membuat larutan obat ibuprofen dengan konsentrasi 2 mmol/L dilakukan dengan melarutkan 20,628 mg ibuprofen dengan larutan dapar fosfat pH
49
Lampiran 10. Contoh perhitungan penentuan harga konsentrasi ibuprofen baku dalam cairan serosa usus halus terbalik kelinci dalam mcg/ml
Harga konsentrasi dari ibuprofen baku dalam larutan dapar fosfat pH 6,4 isotonis pada interval waktu tertentu dihitung dengan menggunakan persamaan garis regresi : Y = 0,0468 X – 0,0072
Dimana;
Y = Absorbansi X = Konsentrasi
Misal, pada waktu t = 5 menit untuk ibuprofen pada kantung terbalik usus halus kelinci segar diperoleh absorbansi 0,147.
Maka konsentrasi cuplikan pada menit ke-5 adalah : X
X = 3,344 mcg/25ml = 0,134
50
Lampiran 11. Contoh perhitungan penentuan harga konsentrasi kumulatif ibuprofen baku dalam cairan serosa usus halus terbalik kelinci dalam mcg/ml
Nilai konsentrasi dari ibuprofen baku dalam larutan dapar fosfat pH 6,4 isotonis pada interval waktu dihitung dengan menggunakan persamaan garis regresi;
Y = 0,0468X – 0,0072
Pada waktu t = 5 menit untuk ibuprofen baku, dipipet larutan sebanyak 1 ml, diencerkan dengan larutan dapar fosfat pH 6,4 dalam labu tentukur 25 ml sampai garis tanda. Kemudian serapannya diukur pada panjang gelombang 222 nm sehingga diperoleh absorbansi 0,147.
Maka konsentrasi cuplikan pada menit ke-5 adalah : X
X = 3,344 mcg/25ml = 0,134mcg/ml
Pada waktu t = 10 menit, diperoleh absorbansi (A) = 0,1473, maka konsentrasi cuplikan pada menit ke-10 adalah:
51
Lampiran 12. Contoh perhitungan penentuan harga AUC (area under the curve) ibuprofen baku dalam mcg.menit/ml
Penentuan harga AUC dari ibuprofen baku diperoleh dengan cara memplot konsentrasi terhadap waktu sehingga dihasilkan kurva absorpsi. Kemudian luas daerah di bawah kurva absorpsi dihitung dengan menggunakan metode luas trapesium berdasarkan rumus:
Luas= ½ (Jumlah sisi yang sejajar) x tinggi
Misal, pada waktu t = 5 menit sampai dengan t = 10 menit maka luas daerah di bawah kurva adalah:
= (½ (0,134mcg/ml +0,132 mcg/ml) x (10 menit-5 menit) = 0,664 mcg.menit/ml
52
Lampiran 13. Data absorbansiberbagaisediaan ibuprofen dalamcairan serosa usus halus terbalik kelincisegardanusushaluskelinciterbalik yang dikeringkan
a. Data absorbansi ibuprofen bakudalamcairan serosa usus halus terbalik kelincisegar
No Waktu (Menit) Absorbansi Sampel
1 5 0,147
No Waktu (Menit) Absorbansi Sampel
1 5 0,147
No Waktu (Menit) Absorbansi Sampel
53
b. Data absorbansi ibuprofen bakudalamcairan serosa usus halus terbalik kelincikering
No Waktu (Menit) Absorbansi Sampel
1 5 0,146
No Waktu (Menit) Absorbansi Sampel
1 5 0,147
No Waktu (Menit) Absorbansi Sampel
54
c. Data absorbansi ibuprofen bakudalamcairan serosa usus halustidak terbalik kelinci yang dikeringkan
No Waktu (Menit) Absorbansi Sampel
1 5 0,144
No Waktu (Menit) Absorbansi Sampel
1 5 0,143
No Waktu (Menit) Absorbansi Sampel
55
d. Data absorbansi ibuprofen bakudalamcairan serosa usus halus tidak terbalik kelinci yang dikeringkan
No Waktu (Menit) Absorbansi Sampel
1 5 0,142
No Waktu (Menit) Absorbansi Sampel
1 5 0,145
No Waktu (Menit) Absorbansi Sampel
56
Lampiran 14a. Data konsentrasi ibuprofen dalamcairan serosa usus halus terbalik dan tidak terbalik kelincisegardanusushalusterbalik dan tidak terbalikkelinci yang dikeringkan
a. Data konsentrasiberbagaisediaan ibuprofen dalamcairan serosa usus halus terbalik kelincisegar dan yang dikeringkan
Perlakuan
Waktu (menit)
Konsentrasi Ibuprofen Dalam Interval Waktu Tertentu (mcg/ml)
Konsentrasi Ibuprofen Dalam Interval Waktu Tertentu (mcg/ml)
b. Data konsentrasiberbagaisediaan ibuprofen dalamcairan serosa usus halus tidak terbalik kelincisegar dan yang dikeringkan
Perlakuan Waktu (menit)
58
Lampiran 14b. Data AUC ibuprofen dalamcairan serosa usus halus terbalik dan tidak terbalik kelincisegardanusushalusterbalik dan tidak terbalik kelinci yang dikeringkan
a. Data AUCsediaan ibuprofen dalamcairan serosa usus halus terbalik kelincisegar dan yang dikeringkan
Perlakuan
Waktu (menit)
AUC Ibuprofen Dalam Interval Waktu
Tertentu (mcg.menit/ml) AUC Rata-Rata Obat (ppm)
AUC Ibuprofen Dalam Interval Waktu
Tertentu (mcg.menit/ml) AUC Rata-Rata Obat (ppm) b. Data AUCsediaan ibuprofen dalamcairan serosa usus halus tidak terbalik
kelincisegar dan yang dikeringkan Perlakuan Waktu
(menit)
AUC Ibuprofen Dalam Interval Waktu
59
AUC Ibuprofen Dalam Interval
60
Lampiran15. Hasil analisis uji independent sample t test dan uji one way anova laju absorpsi ibuprofen
61 Lampiran 15. (Lanjutan)
62
63 Lampiran 17. Gambar alat-alat yang digunakan
Alatspektrofotometer uv-visibel
64
Tabung Gas
65
66 Lampiran 18. Gambar usus halus kelinci
Usus halus kelinci segar
36
DAFTAR PUSTAKA
Anonim. (2009). Mammalian Ileum, Lab Tutor For AD Instrument.
Tanggal Akses 24 Mei 2014.
Aiache, J.M., Devissaguet, J., dan Guyot,H.A.M. (1993). Farmasetika 2. Biofarmasi. Edisi Kedua. Penerjemah : Widji Soeratri. Surabaya: Penerbit Airlangga University Press. Hal. 8, 32-42, 153-154, 178-179, 247-248.
Anderson, P.O., Konoben, J.E., dan Troutman, W.G. (2002). Handbook of Clinical Drug Data. Edisi X. New York: McGraw-Hill. Hal. 20-21.
Ansel, C.H. (1989). Bentuk Sediaan Farmasi. Penerjemah: Farida Ibrahim. Cetakan I. Edisi IV. Jakarta: Universitas Indonesia Press. Hal. 112.
Barthe, L., Woodley, J., dan Houin, G. (1999). Gastrointestinal Absorption of Drugs: Methods and Studies. Fundamental and Clinical Pharmacology. New York: Marcell Dekker Inc. Hal. 154-168.
Chowhan, Z.T., dan Amaro, A.A. (1977). Everted Rat Intestinal Sacs As an In Vitro Model For Assessing Absorptivity of New Drugs. Journal of Pharmaceutical Sciences. 66(3): 1249-1253.
Dahan, A.S., dan Amidon, G.L. (2009). Gastrointestinal Dissolution and Absorption of Class II Drugs. Methods and Principles in Medicinal Chesmistry. Dalam Buku: Drug Bioavailability, Estimation of Solubility, Permeability, Absorption and Bioavailability. Journal of Pharmaceutical Sciences. 2(40): 34-45.
Ditjen POM ( 1979). Farmakope Indonesia. Edisi III. Jakarta: Departemen Kesehatan RI. Hal. 15, 746, 748.
Ditjen POM ( 1995). Farmakope Indonesia. Edisi IV. Jakarta: Departemen Kesehatan R.I. Hal. 400-401, 450-451, 1124, 1144, 1165, 1210.
Fawcett, D.W. (2002). Buku Ajar Histologi. Edisi 12. Alih Bahasa: J. Tambayong. Jakarta: Buku Kedokteran EGC. Hal. 552.
Gandjar, I. G., dan Rohman, A. (2009). Kimia Farmasi Analisis. Yogyakarta: Pustaka Pelajar. 220, 226, 228, 240, 243.
Joenoes, N.Z. (2002). Ars Prescribendi - Penulisan Resep yang Rasional. Cetakan Ketiga. Surabaya: Airlangga University Press. Hal. 27, 33-46.
37
Muchtadi, T.R. (1992). Ilmu Pengetahuan Bahan Pangan. Bogor: Institut Pertanian Bogor. Hal. 9.
Shargel, L., dan Yu, A.B.C. (2005). Biofarmasetika dan Farmakokinetika Terapan. Edisi II. Surabaya: Airlangga University Press. Hal. 85-94.
Sinatra, R.S., Hord, A.H., dan Grinsberg, B. (1992). Acute Pain Mechanisms & Management. Missouri: Mosby Year Book. Hal. 112-121.
Siswandono dan Soekarjo, B. (2000). Kimia Medisinal. Edisi II. Surabaya: Airlangga University Press. Hal.127, 130, 300, 303.
Stoelting, R.K., dan Hillier, S.C. (2006). Pharmacology & Physiology in Anesthetic Practice. Edisi IV. Philadelphia: Lipincott William & Wilkins. Hal. 276-290. Syukri, Y. (2002). Biofarmasetika. Yogyakarta: Penerbit UII Press. Hal. 12-15. Tambunan, A.H., dan Manalu, L.P. (2000). Mekanisme Pengeringan Beku Produk
Pertanian. Jurnal Sains dan Teknologi Indonesia. II(5): 66-74.
Trevor, A.J., Katzung, B.G., dan Masters, S.B. (2005). Pharmacology Examination & Board Review. New York: Mc-Graw Hill. Hal. 307-313.
21 BAB III
METODE PENELITIAN
Metode yang digunakan dalam penelitian ini adalah penelitian eksperimental (experimental research). Penelitian dimaksudkan untuk mengetahui pengaruh atau
hubungan antara variabel bebas dengan variabel terikat. Dalam penelitian ini yang termasuk variabel bebas adalah: ibuprofen, usus halus kelinci terbalik dan tidak terbalik yang dikeringkan dan usus halus kelinci terbalik dan tidak terbalik yang segar. Sedangkan variabel terikat adalah konsentrasi yang terabsorbsi.
3.1 Rancangan Penelitian
Penelitian ini dilakukan dengan pembuatan usus halus kelinci yang terbalik dan tidak terbalik dikeringkan dan usus halus kelinci terbalik dan tidak terbalik yang segar. Kemudian dilanjutkan dengan pemeriksaan konsentrasi yang terabsorbsi pada usus halus kelinci yang dikeringkan dan usus halus kelinci yang segar.
Hewan terbagi dalam 4 kelompok dan tiap kelompok terdiri dari tiga pengulangan dengan uraian sebagai berikut:
1. Kelompok pertama usus halus kelinci terbalik segar diberi ibuprofen baku yang dilarutkan dalam larutan buffer fosfat pH 6,4 isotonis dengan konsentrasi 2 mmol/L.
2. Kelompok kedua usus halus kelinci terbalik yang dikeringkan diberi ibuprofen baku yang dilarutkan dalam buffer fosfat pH 6,4 dengan konsentrasi 2 mmol/L. 3. Kelompok ketiga usus halus kelinci tidak terbalik yang segar diberi ibuprofen baku
22
4. Kelompok keempat usus halus kelinci tidak terbalik yang dikeringkan diberi ibuprofen baku yang dilarutkan dengan buffer fosfat pH 6,4 dengan konsentrasi 2 mmol/L.
3.2 Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Penelitian dan Farmakokinetika dan Laboratorium Farmakologi dan Toksikologi, Fakultas Farmasi, Universitas Sumatera Utara, Medan, Provinsi Sumatera Utara, Indonesia.
3.3 Alat dan Bahan 3.3.1 Alat
Alat-alat yang digunakan adalah alat freeze dryer (Virtis), alat uji absorpsi (alat Crane dan Wilson yang telah dimodifikasi), beaker gelas, gelas ukur, kotak kelinci, labu ukur, neraca analitik (Metler Toledo), pH meter (Hanna), pipet volume, spektrofotometer UV-visibel (Shimadzu UV-Mini 1240), stopwatch, tabung oksigen dan regulator, tabung reaksi, termometer, termostat, satu set alat bedah, vial dan alat lain yang dibutuhkan.
3.3.2 Bahan
Bahan-bahan yang digunakan adalah akuades(lokal), carbogen, d-glukosa monohidrat (E.Merck), ibuprofen baku (PT. Kairos Tritunggal), kalium dihidrogenfosfat (E.Merck), kalium klorida (E.Merck), kalsium klorida (E.Merck), magnesium klorida (E.Merck), natrium bikarbonat (E.Merck), natrium dihidrogenfosfat (E.Merck), natrium klorida (E.Merck).
3.4 Hewan Percobaan
23 3.5 Prosedur Kerja
3.5.1 Pembuatan pereaksi
3.5.1.1 Pembuatan air bebas karbondioksida
Air murni dididihkan selama 5 menit atau lebih dan didiamkan sampai dingin dan tidak boleh menyerap karbondioksida dari udara (Ditjen POM, 1995).
3.5.1.2 Pembuatan kalium dihidrogenfosfat 0,2 M
Dilarutkan 27,218 g kalium dihidrogenfosfat P dalam air bebas karbondioksida P hingga 1000 ml (Ditjen POM, 1979).
3.5.1.3 Pembuatan larutan natrium hidroksida 0,2 N
Dilarutkan 8,001 natrium hidroksida P dalam air hingga 1000 ml (Ditjen POM, 1979).
3.5.1.4 Pembuatan dapar fosfat pH 6,4 isotonis
Dicampur 50,0 ml kalium dihidrogenfosfat 0,2 M dengan 11,6 ml natrium hidroksida 0,2 N dan diencerkan dengan air bebas karbondioksida P secukupnya hingga 200 ml (Ditjen POM, 1979).
3.5.1.5 Pembuatan larutan thyrode
Dilarutkan 8,0 g natrium klorida; 0,2 g kalium klorida; 0,2 g kalsium klorida; 0,1 g magnesium klorida; 0,05 g natrium dihidrogenfosfat; 1,0 g natrium bikarbonat; dan 2,0 g d-glukosa monohidrat dalam 1000 ml akuades (Anonim1, 2009).
3.5.2 Pembuatan kurva serapan ibuprofen dalam medium dapar fosfat pH 6,4 isotonis
24
konsentrasi 9 mcg/ml. Serapan diukur pada panjang gelombang 200-400 nm dengan menggunakan spektrofotometer UV. Panjang gelombang yang dipilih adalah panjang gelombang dimana ibuprofen memperlihatkan serapan paling tinggi.
3.5.3 Pembuatan kurva kalibrasi ibuprofen dalam medium dapar fosfat pH 6,4 isotonis
Ditimbang seksama 50 mg ibuprofen dan dimasukkan ke dalam labu tentukur 1000 ml kemudian ditambahkan larutan dapar fosfat pH 6,4 isotonis sampai garis tanda. Dari larutan tersebut di pipet 0,3 ml; 0,8ml; 1,3 ml; 1,8 ml; 2,3 ml; 2,8 ml; 3,3 ml. Dimasukkan ke dalam labu tentukur 10 ml, kemudian masing-masing diencerkan dengan larutan dapar fosfat pH 6,4 isotonis sampai garis tanda. Serapan diukur pada panjang gelombang maksimum yang diperoleh dari kurva serapan ibuprofen menggunakan spektrofotometer UV dan sebagai blanko digunakan dapar fosfat pH 6,4 isotonis. Kurva kalibrasi antara jumlah serapan dan konsentrasi dibuat dari data yang diperoleh, lalu dihitung persamaan regresi dan koefisien korelasinya.
3.5.4 Pembuatan larutan obat ibuprofen baku dengan konsentrasi 2 mmol/L Ditimbang seksama 20,628 mg ibuprofen baku, dimasukkan ke dalam labu tentukur 50 ml. Dilarutkan dengan dapar fosfat pH 6,4 isotonis, dicukupkan sampai garis tanda sehingga diperoleh konsentrasi 2 mmol/L.
3.5.5 Pembuatan usus halus kelinci
3.5.5.1 Pembuatan usus halus kelinci terbalik segar
25
dan dicuci dengan larutan thyrode dingin. Lalu diangkat dan dibalik dengan menggunakan batang pengaduk berpenampang 2 mm. Lalu diikat pada bagian ujung dengan benang dan dilepaskan dari batang pengaduk, dicelupkan ke dalam larutan Thyrode dingin.
3.5.5.2 Pembuatan usus halus kelinci terbalik yang dikeringkan
Hewan percobaan berupa kelinci jantan dipuasakan selama 20-24 jam. Setelah itu kelinci tersebut dianestesi, kemudian dilakukan pembedahan pada bagian perut tetapi jangan sampai mengenai tulang dada. Setelah usus halus dikeluarkan dan dibersihkan bagian dalamnya dari kotoran dan bagian luar dari jaringan yang mengikat pembuluh darah halus, dan sebagainya dengan bantuan pinset dan gunting, dan dicuci dengan larutan thyrode dingin. Lalu diangkat dan dibalik dengan menggunakan batang pengaduk berpenampang 2 mm. Lalu diikat pada bagian ujung dengan benang dan dilepaskan dari batang pengaduk, dicelupkan ke dalam larutan Thyrode dingin. Kemudian dikeringkan dengan menggunakan freeze dryer pada suhu -40°C.
3.5.5.3 Pembuatan usus halus kelinci tidak terbalik segar
Hewan percobaan berupa kelinci jantan dipuasakan selama 20 - 24 jam. Setelah itu kelinci tersebut dianestesi, kemudian dilakukan pembedahan pada bagian perut tetapi jangan sampai mengenai tulang dada. Setelah usus halus dikeluarkan dan dibersihkan bagian dalamnya dari kotoran dan bagian luar dari jaringan yang mengikat pembuluh darah halus, dan sebagainya dengan bantuan pinset dan gunting, dan dicuci dengan larutan thyrode dingin. Lalu diangkat dan diikat pada bagian ujung dengan benang dan dilepaskan dari batang pengaduk, dicelupkan ke dalam larutan Thyrode dingin.
26
Hewan percobaan berupa kelinci jantan dipuasakan selama 20 - 24 jam. Setelah itu kelinci tersebut dianestesi, kemudian dilakukan pembedahan pada bagian perut tetapi jangan sampai mengenai tulang dada. Setelah usus halus dikeluarkan dan dibersihkan bagian dalamnya dari kotoran dan bagian luar dari jaringan yang mengikat pembuluh darah halus, dan sebagainya dengan bantuan pinset dan gunting, dan dicuci dengan larutan thyrode dingin. Lalu diangkat dan diikat pada bagian ujung dengan benang dan dilepaskan dari batang pengaduk, dicelupkan ke dalam larutan Thyrode dingin. Kemudian dikeringkan dengan menggunakan freeze dryer pada suhu -40°C.
3.5.6 Penentuan absorpsi ibuprofen
3.5.6.1 Penentuan absorpsi ibuprofen dalam usus halus kelinci terbalik dan tidak terbalik segar dalam larutan dapar fosfat pH 6,4 isotonis
Usus halus terbalik dan tidak terbalik kelinci dengan panjang efektif masing-masing 7 cm diikat pada kanula dan masing-masing-masing-masing diisi dengan cairan serosa 3 ml ke dalamnya berupa larutan dapar fosfat pH 6,4 isotonis yang tidak mengandung bahan obat. Usus halus dimasukkan ke dalam tabung berisi 75 ml cairan mukosa berupa larutan buffer posfat pH 6,4 isotonis yang mengandung bahan obat ibuprofen baku dengan konsentrasi 2 mmol. Selanjutnya dimasukkan tabung ke dalam termostat dengan temperatur 37 ± 0,5°C. Selama berlangsung percobaan dijaga agar seluruh bagian usus tetap terendam dalam cairan mukosa serta terus menerus dialiri aliran oksigen dengan kecepatan kira-kira 1 gelembung per detik.
27
serosa. Serapan larutan yang diperiksa, diukur pada panjang gelombang maksimum yaitu 222 nm dengan spektrofotometer ultraviolet.
3.5.6.2 Penentuan absorpsi ibuprofen dalam usus halus kelinci terbalik dan tidak terbalik yang dikeringkan dalam larutan dapar fosfat pH 6,4 isotonis
Usus halus terbalik dan tidak terbalik kelinci yang telah dikeringkan dengan panjang efektif masing-masing 7 cm diikat pada kanula dan masing-masing diisi dengan cairan serosa 3 ml ke dalamnya berupa larutan dapar fosfat pH 6,4 isotonis yang tidak mengandung bahan obat. Usus halus dimasukkan ke dalam tabung berisi 75 ml cairan mukosa berupa larutan buffer posfat pH 6,4 isotonis yang mengandung bahan obat ibuprofen baku dengan konsentrasi 2 mmol. Selanjutnya dimasukkan tabung ke dalam termostat dengan temperatur 37 ± 0,5oC. Selama berlangsung percobaan dijaga agar seluruh bagian usus tetap terendam dalam cairan mukosa serta terus menerus dialiri aliran oksigen dengan kecepatan kira-kira 1 gelembung per detik.
Pada menit 5, 10, 15, 30, 60, 90, 120, 150 cairan serosa diambil 1 ml melalui kanula dan selanjutnya diencerkan dengan larutan buffer fosfat pH 6,4 isotonis hingga 25 ml. Dimasukkan kembali sebanyak 1 ml untuk setiap pengambilan cairan serosa. Serapan larutan yang diperiksa, diukur pada panjang gelombang maksimum yaitu 222 nm dengan spektrofotometer ultraviolet.
3.6 Analisis Data
28 BAB IV
HASIL DAN PEMBAHASAN
4.1 Penentuan Panjang Gelombang Maksimum Ibuprofen dalam Larutan Dapar Fosfat pH 6,4 Isotonis
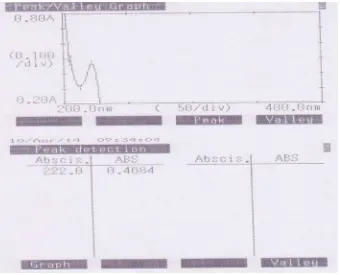
Untuk mengetahui panjang gelombang maksimum ibuprofen dalam larutan dapar fosfat pH 6,4 isotonis maka dilakukan pengukuran pada larutan induk baku ibuprofen (9 mcg/ml) dengan menggunakan alat spektrofotometer ultraviolet. Dari pengukuran diperoleh panjang gelombang ibuprofen dalam larutan dapar fosfat pH 6,4 isotonis adalah 222 nm. Panjang gelombang yang diperoleh mendekati dengan panjang gelombang ibuprofen yang tertera pada U.S.P 29 yaitu 221 nm. Hasil pengukuran dapat dilihat pada gambar di bawah ini.
29
4.2 Pembuatan Kurva Kalibrasi dan Penentuan Persamaan Regresi Ibuprofen Baku dalam Larutan Dapar Fosfat pH 6,4 Isotonis
Untuk menentukan kurva kalibrasi dari ibuprofen baku dalam larutan dapar fosfat pH 6,4 isotonis dilakukan pengukuran absorbansi dari larutan induk ibuprofen pada konsentrasi 1,5; 4; 6,5; 9; 11,5; 14; dan 16,5 mcg/ml sehingga diperoleh absorbansi dari masing-masing konsentrasi dan persamaan regresi y = 0,0468x – 0,0072. Hasilnya dapat dilihat di bawah ini
Tabel 4.1. Data absorbansi untuk menentukan Kalibrasi Ibuprofen
Gambar 4.2 Kurva Kalibrasi Ibuprofen dalam Dapar Fosfat pH 6,4
NO Konsentrasi (mcg/ml) Absorbansi Rata-Rata
1 0,0000 0,000
2 1,5000 0,058
3 4,0000 0,176
4 6,5000 0,288
5 9,0000 0,424
6 11,5000 0,533
7 14,0000 0,650
30
4.3 Data Konsentrasi Ibuprofen pada Absorbsi Berbagai Jenis Usus
Tabel 4.2. Data konsentrasi ibuprofen pada interval waktu 5-150 menit dalam mcg/ml pada usus halus kelinci terbalik segar
Konsentrasi Obat Pada Usus Terbalik Segar
Waktu Absorbansi Konsentrasi Obat (ppm)
5 0,147 0,132 ± 0,0006
Tabel 4.3. Data konsentrasi ibuprofen pada interval waktu 5-150 menit dalam mcg/ml pada usus halus kelinci terbalik dikeringkan.
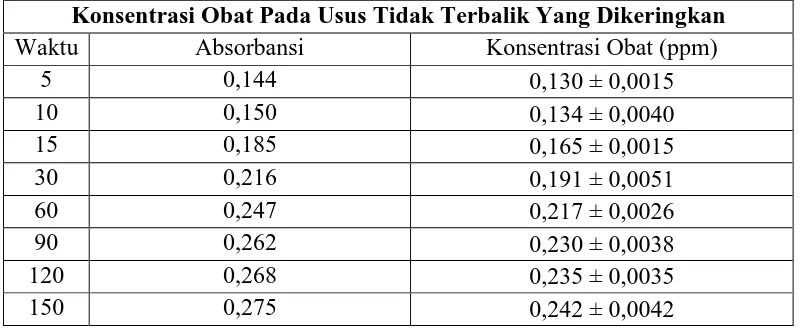
Konsentrasi Obat Pada Usus Terbalik yang Dikeringkan
Waktu Absorbansi Konsentrasi Obat (ppm)
5 0,145 0,130 ± 0,0021
Tabel 4.4. Data konsentrasi ibuprofen pada interval waktu 5-150 menit dalam mcg/ml pada usus halus kelinci tidak terbalik segar
Konsentrasi Obat Pada Usus Tidak Terbalik Segar
Waktu Absorbansi Konsentrasi Obat (ppm)
31
Tabel 4.5. Data konsentrasi ibuprofen pada interval waktu 5-150 menit dalam mcg/ml pada usus halus kelinci tidak terbalik dikeringkan
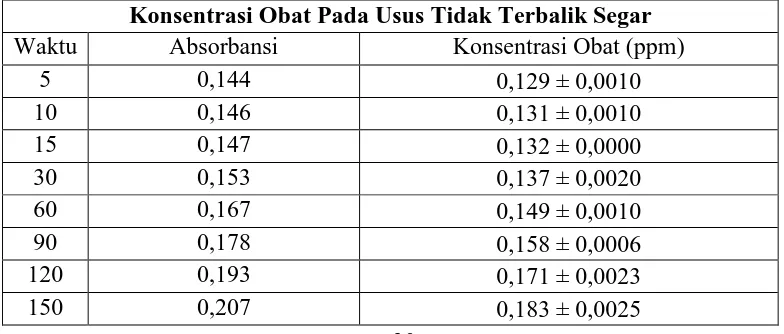
Konsentrasi Obat Pada Usus Tidak Terbalik Yang Dikeringkan
Waktu Absorbansi Konsentrasi Obat (ppm)
5 0,144 0,130 ± 0,0015
Dari data pada Tabel 4.2 dan Tabel 4.3 dapat dilihat bahwa nilai konsentrasi ibuprofenbaku pada usus halus kelinciterbalik segar mencapai 0,260 ± 0,0000mcg/ml; pada usus halus kelinci terbalik dikeringkan mencapai 0,303 ± 0,0010 mcg/ml. Hal ini menunjukkan bahwa penyerapan obat masih terjadi sampai pada menit ke-150 dengan nilai konsentrasi ibuprofen baku pada usus halus kelinci terbalik dikeringkan > ibuprofen baku pada usus halus kelinci terbalik segar.
Dari data pada Tabel 4.4 dan Tabel 4.5 dapat dilihat bahwa nilai konsentrasi untuk ibuprofen baku pada usus halus kelinci tidak terbalik segar mencapai 0,183 ± 0,0025 mcg/ml; pada usus halus kelinci tidak terbalik dikeringkan 0,242 ± 0,0042 mcg/ml. Hal ini menunjukkan bahwa penyerapan obat masih terjadi sampai pada menit ke-150 dengan nilai konsentrasi ibuprofen baku pada usus halus kelinci tidak terbalik dikeringkan > ibuprofen baku pada usus halus kelinci tidak terbalik segar.
32
terbalik dan tidak terbalik yang segar. Hal ini dikarenakan ukuran pori-pori usus halus kelinci yang dikeringkan lebih besar dari pada usus halus kelinci segar.
4.4 Pengaruh Perbedaan Jenis Usus Terhadap Harga AUC (Area Under The Curve) Ibuprofen pada Usus Halus Terbalik dan Tidak Terbalik Kelinci
Untuk mengetahui lebih lanjut perbedaan jumlah ibuprofen yang terabsorpsi, maka dilakukan penentuan harga AUC dari jenis usus halus kelinci segar dan usus halus kelinci yang dikeringkan, yang dapat dilihat pada tabel dan grafik AUC dengan waktu di bawah ini:
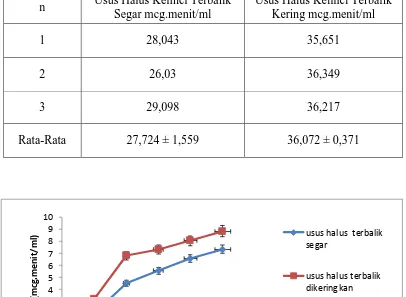
Tabel 4.6 Data perbandingan harga AUC (area under the curve) berbagai sediaan ibuprofen dalam cairan serosa usus halus terbalik segar dan dikeringkan dalam mcg.menit/ml
n Usus Halus Kelinci Terbalik Segar mcg.menit/ml
33
Gambar 4.3 Grafik AUC terhadap waktu dari ibuprofen baku pada usus halus kelinci terbalik segar dan yang dikeringkan.
Tabel 4.7 Data perbandingan harga AUC (area under the curve) berbagai sediaan ibuprofen dalam cairan serosa usus halus tidak terbalik kelinci segar dan dikeringkan dalam mcg.menit/ml
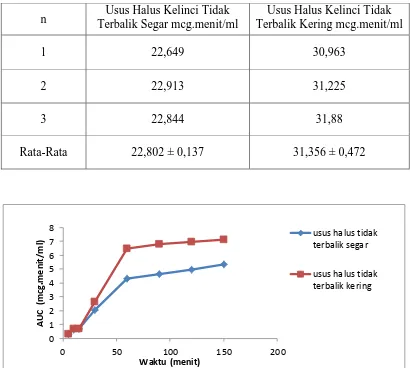
n Terbalik Segar mcg.menit/ml Usus Halus Kelinci Tidak Terbalik Kering mcg.menit/ml Usus Halus Kelinci Tidak
1 22,649 30,963
2 22,913 31,225
3 22,844 31,88
Rata-Rata 22,802 ± 0,137 31,356 ± 0,472
Gambar 4.4 Grafik AUC terhadap waktu dari ibuprofen baku pada usus halus kelinci tidak terbalik segar dan yang dikeringkan.
Untuk mengetahui perbedaan secara keseluruhan, maka nilai AUC dari setiap jenis usus ditotalkan kemudian dibandingkan dan hasilnya dapat dilihat pada Tabel 4.6 dan Tabel 4.7.
Dari data pada Tabel 4.6 dapat dilihat bahwa nilai total AUC ibuprofen baku pada usus halus kelinci terbalik dikeringkan > ibuprofen baku pada usus halus kelinci
34
tidak terbalik dikeringkan > ibuprofen baku pada usus halus kelinci terbalik segar > ibuprofen baku pada usus halus kelinci tidak terbalik segar.
Selain itu, dari data pada Tabel 4.6 juga dapat dilihat bahwa nilai AUC dari absorbsi ibuprofen usus halus kelinci yang dikeringkan lebih tinggi dibandingkan yang segar. Selanjutnya data diuji secara statistik menggunakan uji Anova Test- Bonferroni untuk jenis usus terbalik segar dan terbalik dikeringkan serta untuk jenis
usus tidak terbalik segar dan tidak terbalik dikeringkan. Dari hasil uji Anova Test- Bonferroni diketahui bahwa terdapat perbedaan yang signifikan antara absorpsi
ibuprofen pada usus halus terbalik segar dan terbalik dikeringkan serta untuk jenis usus tidak terbalik segar dan tidak terbalik dikeringkan dengan nilai signifikansi 0,000. Dari data ini, diketahui bahwa usus halus kelinci yang dikeringkan dengan menggunakan freeze dryer lebih besar absorbsinya dibandingkan dengan usus halus kelinci yang segar. Hal ini dikarenakan ukuran pori-pori usus halus kelinci yang dikeringkan lebih besar dari pada usus halus kelinci segar.
Data yang diperoleh selanjutnya diuji secara statistik menggunakan uji Independent Sample T Test untuk jenis usus terbalik dan tidak terbalik. Dari hasil uji
Independent Sample T Test diketahui bahwa tidak terdapat perbedaan yang signifikan
35 BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Terdapat perbedaan AUC antara absorbsi ibuprofen baku pada usus halus kelinci terbalik dikeringkan (36,072 ± 0,372mcg/ml) dengan absorbsi ibuprofen baku ibuprofen baku pada usus halus kelinci tidak terbalik dikeringkan (31,356 ± 0,472mcg/ml) dan absorbsi ibuprofen baku pada usus halus kelinci terbalik segar (27,724 ± 1,559 mcg/ml), absorbsi ibuprofen baku pada usus halus kelinci tidak terbalik segar (22,802 ± 0,137mcg/ml) terhadap nilai pelepasan obat dengan nilai signifikansi dengan nilai signifikansi 0,001. 2. Terdapat perbedaan AUC antara absorbsi ibuprofen baku usus halus kelinci
terbalik dikeringkan (36,072 ± 0,372mcg/ml) dengan absorbsi ibuprofen baku pada usus halus kelinci terbalik segar (27,724 ± 1,559 mcg/ml) dan absorbsi ibuprofen baku ibuprofen baku pada usus halus kelinci tidak terbalik dikeringkan (31,356 ± 0,472mcg/ml) dengan absorbsi ibuprofen baku pada usus halus kelinci tidak terbalik segar (22,802 ± 0,137mcg/ml) terhadap nilai pelepasan obat dengan nilai signifikansi dengan nilai signifikansi 0,000.
5.2 Saran
6 BAB II
TINJAUAN PUSTAKA
2.1 Absorpsi
Yang dimaksud dengan absorpsi atau penyerapan suatu zat aktif adalah masuknya molekul-molekul obat ke dalam tubuh atau menuju peredaran darah tubuh setelah melewati sawar biologik.
Untuk dapat diserap, semua zat aktif harus terlarut lebih dahulu. Oleh sebab itu laju penyerapan merupakan fungsi dari laju pelarutan zat aktif didalam cairan tubuh (saluran cerna misalnya) dan laju difusi molekul-molekul yang terlarut dalam cairan tersebut melintasi membran seluler, sesuai dengan skema sebagai berikut:
Proses penyerapan tersebut berkaitan dengan prinsip: sebelum melintasi membran biologik, zat aktif harus terlarut lebih dahulu didalam cairan disekitar membran.
7
Bila proses pelepasan terjadi sangat lambat, maka pelepasan akan mempengaruhi seluruh waktu dan tahapan proses pelarutan, difusi dan penyerapan zat aktif. Jadi tahapan yang paling lambat dari rangkaian predisposisi zat aktif sediaan obat didalam tubuh merupakan tahap penentu.
Dengan demikian, penyerapan zat aktif akan bergantung pada : laju pelarutan zat aktif dalam cairan biologik disekitar membran, karakter fisikokimia yang dapat mempengaruhi proses penyerapan (pKa, koefisien partisi, stabilitas, dan lain-lain) (Aiache, et al., 1993).
2.1.1 Membran sel
Membran sel merupakan bagian sel yang mengandung komponen-komponen yang terorganisasi dan dapat berinteraksi dengan mikromolekul secara khas. Struktur membran biologis sangat kompleks dan dapat mempengaruhi intensitas dan masa kerja obat. Sesudah pemberian secara oral, obat harus melewati sel epitel saluran cerna, membran sistem peredaran tertentu, melewati membran kapiler menuju sel-sel organ atau reseptor obat.
Menurut Siswandono dan Soekarjo (2000), membran sel terdiri dari komponen-komponen yang terorganisasi, yaitu:
1. Lapisan lemak bimolekul.
8 2. Protein.
Bentuk protein bervariasi, ada yang besar, berat molekulnya ± 300.000 dan ada pula yang sangat kecil. Protein bersifat ampivil karena mengandung gugus hidrofil dan hidrofob.
3. Mukopolisakarida.
Jumlah mukopolisakarida pada membran biologis kecil dan strukturnya tidak dalam keadaan bebas tetapi dalam bentuk kombinasi dengan lemak, seperti glikolipilid, atau dengan protein, seperti glikoprotein.
2.1.2 Struktur membran sel
9
Pori-pori yang tampak pada sumbu utama protein globuler tebalnya ± 85 Angstrom. Model ‘Mosaik Cair’ konsisten tentang eksistensi dari chanel-chanel ion khusus dan reseptor-reseptor di dalam dan di sepanjang permukaan membran (Syukri, 2002).
Gambar 2.2 Stuktur membran sel 2.1.3 Cara penembusan obat melalui membran biologis
Pada umumnya obat menembus membran biologis secara difusi. Mekanisme difusi dipengaruhi oleh struktur kimia, sifat fisika kimia obat dan sifat membran biologis.
Cara penembusan obat ke dalam membran biologis dibagi atas: 1. Difusi pasif
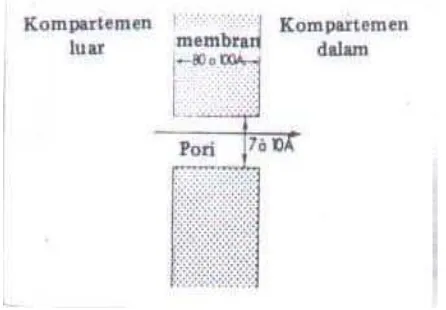
Penembusan membran biologis secara difusi pasif dibedakan menjadi tiga, yaitu difusi pasif melalui pori (cara penyaringan), difusi pasif dengan cara melarut dalam lemak penyusun membran dan difusi pasif dengan fasilitas.
a. Difusi Pasif Melalui Pori
10
bulat, atau lebih kecil dari 400 jika molekulnya terdiri atas rantai panjang (Aiache, et al., 1993). Untuk lebih jelasnya difusi pasif melalui pori dapat dilihat pada Gambar 2.3.
Gambar 2.3 Difusi pasif melalui pori b. Difusi Pasif dengan Cara Melarut pada Lemak Penyusun Membran
Penembusan terjadi karena adanya perbedaan konsentrasi atau elektrokimia tanpa memerlukan energi, sehingga mencapai keseimbangan di kedua sisi membran. Bila molekul semakin larut lemak, maka koefisien partisinya semakin besar dan difusi transmembran terjadi lebih mudah. Kebanyakan zat aktif merupakan basa atau asam organik, maka dalam keadaan terlarut sebagian molekul berada dalam bentuk terionkan dan sebagian dalam bentuk tak terionkan. Hanya fraksi zat aktif yang terionkan dan larut dalam lemak yang dapat melalui membran dengan cara difusi pasif.
11 c. Difusi Pasif dengan Fasilitas
Beberapa bahan obat dapat melewati membran sel karena ada tekanan osmosa, yang disebabkan adanya perbedaan kadar antar membran, pengangkutan ini berlangsung dari daerah dengan kadar tinggi ke daerah dengan kadar yang lebih rendah dan berhenti setelah mencapai kesetimbangan, gerakan ini tidak memiliki energi dan terjadi secara spontan.
Diduga molekul obat membentuk kompleks dengan suatu molekul pembawa dalam membran, yang bersifat mudah larut dalam lemak, sehingga dengan mudah bergerak menembus membran. Pada sisi membran yang lain kompleks akan terurai melepas molekul obat dan molekul pembawa bebas kembali ke tempat semula.
Pembawa dapat berupa enzim atau ion yang muatannya berlawanan dengan muatan molekul obat. Penembusan obat ke dalam membran biologis dapat berjalan dengan cepat bila ada katalisator enzim dan ukuran bentuk kompleks cukup kecil. Penyerapan pasif terjadi hingga tercapainya keseimbangan dan proses akan berhenti bila aliran darah tidak lagi mengangkut zat aktif dalam jumlah yang setara dengan jumlah yang diserap (Aiache, et al., 1993).
2. Transpor Aktif
12
Sistem transpor aktif bersifat jenuh, artinya jika semua molekul pembawa telah digunakan maka kapasitas maksimalnya tercapai. Sistem ini menunjukkan adanya suatu kekhususan untuk setiap molekul atau suatu kelompok molekul. Oleh sebab itu dapat terjadi persaingan beberapa molekul yang berafinitas sama pada pembawa tertentu, dan molekul yang mempunyai afinitas tinggi dapat menghambat kompetisi transpor dari molekul yang afinitasnya lebih rendah.
Transpor dari satu sisi membran ke sisi yang lain dapat terjadi dengan mekanisme perbedaan konsentrasi. Transpor aktif ini memerlukan energi yang diperoleh dari hidrolisa adenosintrifosfat (ATP) di bawah pengaruh suatu ATP-ase. (Aiache, et al., 1993). Mekanisme transpor aktif dapat dilihat pada Gambar 2.4.
Gambar 2.4 Sistem pengangkutan aktif 3. Pinositosis
13
Gambar 2.5 Sistem pengangkutan secara pinositosis
Kebanyakan dari obat melewati membran biologis dengan cara difusi pasif. Senyawa obat yang berbobot molekul kecil dengan bebas melewati mikroporus dari sel. Dengan catatan mungkin obat larut diluar fase membran plasma menembus membran dan masuk ke dalam sitoplasma sel. Karena bersifat lipid membran sel mempunyai daya afinitas yang lebih tinggi terhadap bentuk obat yang larut dalam lipid. Obat asam lemah dan basa lemah mungkin berada dalam keadaan tak terion pada harga pH dari fasa berair pada bagian eksternal dan internal membran. Selama bentuk tak terion dari obat lebih mudah larut dalam lipid dari pada bentuk terion, bentuk tak terion larut ke dalam membran dan seterusnya maka difusi akan lebih cepat dari pada bentuk terion (Wolf, 1994).
2.2 Usus Halus
Usus halus merupakan lanjutan lambung yang terdiri atas tiga bagian yaitu; duodenum, jejunum dan illeum yang bebas bergerak. Diameter usus halus beragam tergantung pada letaknya yaitu 2 – 3 cm dan panjang keseluruhan antara 5 - 9 m.
14
dengan jejenum, yang terikat pada dinding dorsal rongga melalui mesenterium. Jejenum dapat digerakkan bebas pada mesenteriumnya dan merupakan 2/5 bagian proksimal usus halus, sedangkan ileum merupakan sisa 3/5 nya. Kelokan-kelokan jejenum menempati bagian pusat abdomen, sedangkan ileum menempati bagian bawah rongga (Fawcett, 2002). Mukosa usus halus, kecuali yang terletak pada bagian atas duodenum berbentuk lipatan-lipatan atau disebut juga valvula conniventes. Lipatan-lipatan inilah yang berfungsi sebagai permukaan penyerapan dan penuh dengan villi yang tingginya 0,75 – 1,00 mm dan selalu bergerak. Adanya villi ini lebih memperluas permukaan mukosa penyerapan hingga 40 – 50 m (Aiache, et al, 1993).
Bahan obat dari lambung masuk ke duodenum, fungsi utama duodenum dan bagian pertama jejenum adalah untuk sekresi, sedangkan fungsi bagian kedua dari jejenum dan illeum ialah untuk absorpsi. pH usus halus meningkat dari duodenum 4- 6, jejenum 6-7, illeum 7-8. pH dalam usus halus berperan besar dalam hal absorpsi obat sebagai akibat disolusi berbagai bentuk sediaan (Aiache, et al., 1993).
Karakteristik anatomi dan fisiologi usus (dengan makrovilli dan mikrovillinya) lebih menguntungkan untuk penyerapan obat, seperti halnya juga penyerapan zat makanan.
15
Gerakan usus dan gerakan villi usus di sepanjang saluran cerna akan mendorong terjadinya penembusan menuju pembuluh darah. Keadaan pH serta tebal dinding yang beragam di setiap bagian usus menyebabkan perbedaan penembusan yang cukup besar pada molekul zat aktif terutama molekul asam yang penyerapannya dipengaruhi oleh pH lambung.
Bagian lain dari usus halus juga merupakan tempat terjadinya pelintasan membran dengan intensitas yang besar, dan disini lebih banyak terjadi difusi pasif.
Difusi pasif berkaitan dengan sejumlah senyawa yang larut lemak atau fraksi-fraski tak terionkan yang larut lemak.
Difusi pasif terutama terjadi pada bagian pertama usus halus, karena konsentrasi obat-obat yang tinggi dalam liang usus akan meningkatkan gradien difusi, hal yang sama terjadi pula pada bagian usus sebelah bawah dan pada penyerapan susjacent. Skema usus halus dengan villi dan perfusinya dapat dilihat pada Gambar 2.6.
16
Gambar 2.6 Skema usus halus dengan villi dan perfusinya
2.3 Metode Kantung Terbalik (Everted Sac)
Preformulasi melibatkan sejumlah pemeriksaan untuk menghasilkan informasi yang bermanfaat untuk tahap formulasi selanjutnya meliputi kestabilan fisikokimia dan kecocokan dosis obat secara biofarmasi.
Penelitian awal biofarmasi dari senyawa obat juga dilakukan selama preformulasi. Uji-uji ini didesain untuk menelusuri karakteristik ketersediaan senyawa obat secara in vitro. Hasil penelitian ini mengkontribusikan suatu produk sediaan obat yang efektif, rasional, aman, dan ekonomis.
Suatu teknik dengan menggunakan everted intestinal sac dapat digunakan dalam mengevaluasi karakteristik absorpsi dari zat obat (Ansel, 1989).
17
50%. Kedua bagian, baik serosa maupun mukosa dapat dijadikan sampel untuk analisis.
Everted sac merupakan teknik yang sederhana yang menghadirkan kerumitan
yang lebih sedikit bila dibandingkan dengan pengujian konsentrasi obat secara in vivo.
Kondisi dari temperatur, oksigen, ketersediaan makanan sebagai sumber energi dapat diatur dalam metode ini, namun tidak ada lagi sirkulasi mesenterikum dan kehadiran obat secara total pada bagian dalam kantung pada difusi melalui serosa (Swarbrick and Boylan, 1992).
2.4 Ibuprofen
2.4.1 Sifat fisikokimia
Ibuprofen ((±)-2-(p-isobutilfenil) asam propionat) dengan rumus molekul C13H18O2 dan berat molekul 206,28. Rumus bangun ibuprofen seperti yang ditunjukkan pada Gambar 2.1.
.
Gambar 2.1 Rumus bangun ibuprofen
18
titik lebur 75 - 77ºC dengan pKa 4,4; 5,2 dan log P (oktanol/air) 4,0 (Moffat, et al., 2005).
2.4.2 Farmakokinetik
Ibuprofen diabsorpsi dengan cepat melalui saluran pencernaan dengan bioavailabilitas lebih besar dari 80%. Puncak konsentrasi plasma dapat dicapai setelah 1-2 jam. Ibuprofen menunjukkan pengikatan (99%) yang menyeluruh dengan protein plasma (Anderson, 2002). Pada manusia sehat volume distribusi relatif rendah yaitu (0,15 ± 0,02 L/kg). Waktu paruh plasma berkisar antara 2 - 4 jam. Kira-kira 90% dari dosis yang diabsorpsi akan dieksresi melalui urin sebagai metabolit atau konyugatnya. Metabolit utama merupakan hasil hidroksilasi dan karboksilasi (Stoelting, 2006; Sinatra, et al., 1992).
2.4.3 Farmakodinamik
Mekanisme kerja ibuprofen melalui inhibisi sintesa prostaglandin dan menghambat siklooksigenase-I (COX I) dan siklooksigenase-II (COX II). Namun tidak seperti aspirin hambatan yang diakibatkan olehnya bersifat reversibel. Dalam pengobatan dengan ibuprofen, terjadi penurunan pelepasan mediator dari granulosit, basofil dan sel mast, terjadi penurunan kepekaan terhadap bradikinin dan histamin, mempengaruhi produksi limfokin dan limfosit T, melawan vasodilatasi dan menghambat agregasi platelet (Stoelting, 2006).
2.4.4 Indikasi dan dosis terapi
19
mg. Untuk demam pada anak-anak 5 mg/kg berat badan, untuk nyeri pada anak-anak 10 mg/ kg berat badan, untuk arthritis juvenil 30 - 40 mg/ kg berat badan/hari (Anderson, et al., 2002).
2.5 Spektrofotometri Ultraviolet - visibel
Radiasi elektromagnetik, yang mana sinar ultraviolet dan sinar tampak merupakan salah satunya, dapat dianggap sebagai energi yang merambat dalam bentuk gelombang. Beberapa istilah dan hubungan digunakan untuk menggambarkan gelombang ini. Panjang gelombang merupakan jarak linier dari suatu titik pada satu gelombang ke titik yang bersebelahan pada gelombang yang berdekatan. Sinar ultraviolet mempunyai panjang gelombang antara 200 - 400 nm, sementara sinar tampak mempunyai panjang gelombang 400 – 750 nm (Gandjar dan Rohman, 2009).
Jika suatu molekul sederhana dikenakan radiasi elektromagnetik maka molekul tersebut akan menyerap radiasi elektromagnetik yang energinya sesuai. Interaksi antara molekul dengan radiasi elektromagnetik ini akan meningkatkan energi potensial elektron pada tingkat keadaan tereksitasi. Apabila pada molekul yang sederhana tadi hanya terjadi transisi elektronik pada satu macam gugus yang terdapat pada molekul, maka hanya akan terjadi satu absorbsi. Pada kenyataannya, spektrum UV–Vis yang merupakan korelasi antara absorbansi (sebagai ordinat) dan panjang gelombang (sebagai absis) bukan merupakan garis spektrum akan tetapi merupakan pita spektrum. Terbentuknya pita spektrum UV–Vis tersebut disebabkan oleh terjadinya eksitasi elektronik lebih dari satu macam pada gugus molekul yang sangat kompleks (Gandjar dan Rohman, 2009).
20 a. Aspek Kualitatif
Data spektra UV – Vis secara tersendiri tidak dapat digunakan untuk identifikasi kualitatif obat atau metabolitnya. Akan tetapi jika digabung dengan cara lain seperti spektroskopi infra merah, resonansi magnet inti, dan spektroskopi massa, maka dapat digunakan untuk maksud identifikasi/ analisis kualitatif suatu senyawa tersebut. Data yang diperoleh dari spektroskopi UV dan Vis adalah panjang gelombang maksimal, intensitas, efek pH, dan pelarut; yang kesemuanya itu dapat diperbandingkan dengan data yang sudah dipublikasikan (Gandjar dan Rohman, 2009).
b. Aspek Kuantitatif
1 BAB I PENDAHULUAN
1.1Latar Belakang
Absorpsi atau penyerapan zat aktif adalah masuknya molekul-molekul obat kedalam tubuh atau menuju ke peredaran darah tubuh setelah melewati sawar biologik (Aiache, et al., 1993). Absorpsi obat adalah peran yang terpenting untuk akhirnya menentukan efektivitas obat (Joenoes, 2002). Agar suatu obat dapat mencapai tempat kerja di jaringan atau organ, obat tersebut harus melewati berbagai membran sel. Membran sel mempunyai pori yang bergaris tengah antara 3,5-4,2 Ǻ, merupakan saluran berisi air dan dikelilingi oleh rantai samping molekul protein yang bersifat polar. Zat terlarut dapat melewati pori ini secara difusi karena kekuatan tekanan darah (Siswandono dan Soekardjo, 2000). Sebelum obat diabsorpsi, terlebih dahulu obat itu larut dalam cairan biologis. Kelarutan serta cepat-lambatnya melarut menentukan banyaknya obat terabsorpsi. Dalam hal pemberian obat per oral, cairan biologis utama adalah cairan gastrointestinal, dari sini melalui membran biologis obat masuk ke peredaran sistemik (Joenoes, 2002).
Usus halus mempunyai karakteristik anatomi dan fisiologi yang lebih menguntungkan untuk penyerapan obat. Pentingnya permukaan penyerapan pada usus halus terutama karena banyaknya lipatan-lipatan mukosa yang terutama banyak terdapat di daerah duodenum dan jejunum (Aiache, et al., 1993). Metode in vitro pada usus halus mempunyai kekurangan yang disebabkan oleh ketidakmampuan usus halus untuk mempertahankan strukturnya dalam jangka waktu yang lama.
2
untuk mengeringkan suatu zat dengan tujuan agar zat tersebut tidak rusak dalam penyimpanannya. Pengeringan beku (freeze drying) adalah salah satu metode pengeringan yang mempunyai keunggulan dalam mempertahankan mutu hasil pengeringan, khususnya untuk produk-produk yang sensitif terhadap panas. Keunggulan pengeringan beku dibandingkan metode lainnya yaitu dapat mempertahankan stabilitas produk, dapat mempertahankan stabilitas struktur bahan dan dapat meningkatkan daya rehidrasi sehingga dapat kembali ke sifat fisiologis, organoleptik dan betuk fisik yang hampir sama dengan sebelum pengeringan (Tambunan dan Manalu, 2000). Proses pengeringan usus halus kelinci dengan menggunakan freeze dryer diharapkan dapat mempertahankan struktur dari usus halus kelinci dalam jangka waktu yang lama dan dapat memberikan hasil pengujian yang sama dengan usus halus kelinci segar.
Metode kantung terbalik merupakan teknik in vitroyang mudah dan cepat dilaksanakan serta dapat ditemukan seluruh tipe sel dan lapisan mukosa sehingga mencerminkan proses/lingkungan sebenarnya saat obat mengalami proses absorpsi di usus (Barthe, et al., 1999). Metode ini baik digunakan untuk menentukan absorpsi pada tempat yang berbeda pada usus halus. Hal ini sangat berguna untuk mengestimasi first-pass metabolism dari obat dalam sel epithelial intestinal (Chowhan dan Amaro, 1977).
3
sampai 2 jam setelah pemberian oral, waktu paruh 1,8-2 jam (Siswadono dan Soekardjo, 2000).
Berdasarkan hal-hal tersebut, peneliti tertarik untuk memeriksa absorpsi ibuprofen bakupada usus halus kelinci (oryctolagus cuniculus) terbalik dan tidak terbalik yang dikeringkan dengan freeze dryer dan yangsegar dan memeriksakan apakah akan terjadi difusi dan transfor aktif dariabsorpsi ibuprofen baku pada usus halus kelinci (oryctolagus cuniculus) terbalik dan tidak terbalik yang dikeringkan dengan freeze dryer dan yang segar.
1.2 Perumusan Masalah
Berdasarkan latar belakang di atas, maka yang menjadi perumusan masalah dalam penelitian ini adalah:
- Apakah ada perbedaan absorpsi ibuprofen pada usus halus kelinci terbalik dan tidak terbalik yang dikeringkan dengan yang segar.
- Apakah ada perbedaan absorpsi ibuprofen pada usus halus kelinci yang dikeringkan dengan yang segar.
1.3Hipotesis
Berdasarkan perumusan masalah di atas, maka yang menjadi hipotesis dalam penelitian ini adalah:
- Terdapat perbedaan antara absorpsi ibuprofen pada usus halus kelinci terbalik dan tidak terbalik yang dikeringkan dengan yang segar.
4 1.4Tujuan Penelitian
Berdasarkan hipotesis di atas, maka yang menjadi tujuan dalam penelitian ini adalah :
- Untuk mengetahui perbedaan absorpsi ibuprofen pada usus halus kelinci terbalik dan tidak terbalik yang dikeringkan dengan yang segar sehingga dapat diketahui kelayakan pengeringan usus dengan teknik freeze dryer agar dapat digunakan pada penelitian absorpsi suatu obat.
- Untuk mengetahui perbedaan absorpsi ibuprofen pada usus halus kelinci yang dikeringkan dengan yang segar sehingga dapat diketahui kelayakan pengeringan usus dengan teknik freeze dryer agar dapat digunakan pada penelitian absorpsi suatu obat..
1.5 Manfaat Penelitian
Adapun manfaat penelitian ini adalah untuk pengembangan metode absorpsi secara in vitro pada usus halus kelinci yang segar dan yang dikeringkan.
1.6 Kerangka Pikir Penelitian
Penelitian dimulai dengan pembuatan usus halus kelinci segar dan usus halus kelinci yang dikeringkandan penentuan absorpsi ibuprofen pada kedua usus tersebut.
vi
PERBANDINGAN UJI ABSORPSI IBUPROFEN PADA USUS
HALUS KELINCI(Oryctolagus cuniculus) TERBALIK DAN
TIDAK TERBALIK PADA KONDISI BASAH DAN KERING
Abstrak
Usus halus mempunyai karakteristik anatomi dan fisiologi yang lebih menguntungkan untuk penyerapan obat. Metode kantung terbalik merupakan teknik in vitroyang mudah dan cepat dilaksanakan.Pengeringan beku (freeze drying) adalah salah satu metode pengeringan yang mempunyai keunggulan dalam mempertahankan mutu hasil pengeringan, khususnya untuk produk-produk yang sensitif terhadap panas.Tujuan penelitian ini adalah untuk mengetahui perbedaan absorpsi ibuprofen pada usus halus kelinci terbalik dan tidak terbalik yang dikeringkan dengan yang segar sehingga dapat diketahui kelayakan pengeringan usus dengan teknik freeze dryer agar dapat digunakan pada penelitian absorpsi suatu obat.
Penelitian ini dilakukan dengan metode usus halus terbalik kelinci, menggunakan alat Crane dan Wilson yang telah dimodifikasi. Jenis usus yang dibandingkan adalah usus terbalik segar, usus terbalikkering, usus tidak terbalik segar dan usus tidak terbalik dikeringkan dengan media larutan dapar fosfat pH 6,4 isotonis. Kadar ibuprofen yang terabsorpsi diperiksa dalam larutan dapar fosfat dengan menggunakan spektrofotometer ultraviolet pada panjang gelombang 222 nm dan data yang diperoleh dianalisis dengan menggunakan Statistical Program Service Solution (SPSS).
Hasil penelitian menunjukkan bahwa absorpsi ibuprofen dipengaruhi oleh jenis keadaan usus. Pada absorbsiibuprofen bakupada usus halus kelinci terbalik dikeringkan (36,072 ± 0,372mcg/ml)>ibuprofen baku pada usus halus kelinci tidak terbalik dikeringkan (31,356±0,472mcg/ml) dan absorbsi ibuprofen baku pada usus halus kelinciterbalik segar (27,724 ± 1,559 mcg/ml)>ibuprofen baku pada usus halus kelinci tidak terbalik segar (22,802±0,137mcg/ml) dan uji Anova Test Bonferroni diketahui bahwa terdapat perbedaan yang signifikan antara absorpsi ibuprofen pada usus halus terbalik segar dan terbalik dikeringkan serta untuk jenis usus tidak terbalik segar dan tidak terbalik dikeringkan dengan nilai signifikansi 0,000.
vii
IBUPROFEN ABSORPTION RATE TEST IN RABBIT SMALL INTESTINE (Oryctolagus cuniculus)REVERSED AND NOT REVERSE
FREEZE-DRIED AND FRESH
Abstract
The intestine has advantageous anatomy and physiological characteristic for drug absorption. However, the in vitro method for intestine has a disadvantage caused by its inability to mantain its structure in a long period of time. Freeze drying is a drying method which has advantageous for maintaining the quality of the dried materials especially for heat-sensitive products.The purpose of this research is to determine differences in the rate of ibuprofen absorption infreeze-dried and fresh small intestine so as to know the feasibility of infreeze-dried of freeze dryer intestine that can be used to absorption of a drug research.
This research was done with everted sac of rabbit’s intestine, used Crane and Wilson apparatus which have been modified. The type of preparation of ibuprofen compared to isthe small intestine of rabbits inverted drained,small intestine not reversed drained, fresh upside rabbit small intestine, small intestine not reversed fresh.Determination of absorptedibuprofen which was checked in buffer phosphate isotonic solution by using ultraviolet spectrophotometer at wavelength 222 nm and obtained data was analyzed by using Statistical Program Service Solution (SPSS).
The result of this research showed that the rate of ibuptofen absorption is influenced by the type of intestine conditions. Ibuprofen absorption in the small intestine of rabbits inverted drained(36.072 ± 0.372 mcg/ml)> ibuprofen raw rabbit small intestine not reversed drained(31.356 ± 0.472 mcg/ml) and absorption ibuprofen raw fresh upside rabbit small intestine(27.724 ± 1.559 mcg/ml)> ibuprofen raw rabbit small intestine not reversed fresh(22.802 ± 0.137 mcg/ml)and based on the results of statistical tests using Anova Test Bonferroni absorption ibuprofen is known there are significant differences between ibuprofen absorption in the small intestine of rabbits inverted and not inverted at dry and fresh condition with a significance value of 0.000
PERBANDINGAN UJI ABSORPSI IBUPROFEN PADA USUS
HALUS KELINCI (Oryctolagus cuniculus) TERBALIK DAN TIDAK
TERBALIK PADA KONDISI BASAH DAN KERING
SKRIPSI
jra Uta
OLEH:
ARUM CAHYA MENTARI
NIM 101501087
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PERBANDINGAN UJI ABSORPSI IBUPROFEN PADA USUS
HALUS KELINCI (Oryctolagus cuniculus) TERBALIK DAN TIDAK
TERBALIK PADA KONDISI BASAH DAN KERING
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh
gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
jra Uta
OLEH:
ARUM CAHYA MENTARI
NIM 1015010187
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
PERBANDINGAN UJI ABSORPSI IBUPROFEN PADA USUS
HALUS KELINCI (Oryctolagus cuniculus) TERBALIK DAN
TIDAK TERBALIK PADA KONDISI BASAH DAN KERING
OLEH:
ARUM CAHYA MENTARI NIM 101501087
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal : 24 Oktober 2014 Pembimbing I, Panitia Penguji,
Prof. Dr. M. T. Simanjuntak, M.Sc., Apt. Prof. Dr. Karsono, Apt.
NIP 195212041980021001 NIP 195409091982011001
iv
KATA PENGANTAR
Puji syukur kehadirat Allah SWT yang telah memberikan karunia yang berlimpah sehingga penulis dapat menyelesaikan penyusunan skripsi yang berjudul Perbandingan Uji Absorpsi pada Usus Halus Kelinci (Oryctolagus cuniculus) Terbalik dan Tidak Terbalik pada Kondisi Bash dan Kering. Skripsi ini
diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini, dengan segala kerendahan hati penulis mengucapkan terima kasih kepada Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas Farmasi yang telah menyediakan fasilitas kepada penulis selama perkuliahan di Fakultas Farmasi. Penulis juga mengucapkan terima kasih yang sebesar-besarnya kepada Bapak Prof. Dr. M. T. Simanjuntak, M.Sc., Apt., dan Bapak Dr. Edy Suwarso, S.U., Apt., yang telah membimbing penulis dengan penuh kesabaran dan tanggung jawab, memberikan petunjuk dan saran-saran selama penelitian hingga selesainya skripsi ini. Ucapan terima kasih juga penulis sampaikan kepada Prof. Dr. Karsono, Apt., selaku ketua penguji, Bapak Dr. Kasmirul Ramlan Sinaga, M.S., Apt., dan Bapak Drs. Saiful Bahri, M.S., Apt., selaku anggota penguji yang telah memberikan saran untuk menyempurnakan skripsi ini, dan Ibu Dra. Tuty Roida Pardede, M.Si., Apt., selaku dosen penasehat akademik yang telah banyak membimbing penulis selama masa perkuliahan hingga selesai.
v
yang tak ternilai dengan apapun. Penulis juga mengucapkan terima kasih kepada teman-teman mahasiswa/i Farmasi angkatan 2010 yang selalu mendoakan dan memberi semangat.
Penulis menyadari sepenuhnya bahwa penulisan skripsi ini masih belum sempurna. Oleh karena itu, penulis mengharapkan saran dan kritik yang membangun demi kesempurnaan skripsi ini. Akhir kata penulis berharap semoga skripsi ini bermanfaat bagi ilmu pengetahuan khususnya di bidang farmasi.
Medan, Oktober 2014
Penulis,
vi
PERBANDINGAN UJI ABSORPSI IBUPROFEN PADA USUS
HALUS KELINCI(Oryctolagus cuniculus) TERBALIK DAN
TIDAK TERBALIK PADA KONDISI BASAH DAN KERING
Abstrak
Usus halus mempunyai karakteristik anatomi dan fisiologi yang lebih menguntungkan untuk penyerapan obat. Metode kantung terbalik merupakan teknik in vitroyang mudah dan cepat dilaksanakan.Pengeringan beku (freeze drying) adalah salah satu metode pengeringan yang mempunyai keunggulan dalam mempertahankan mutu hasil pengeringan, khususnya untuk produk-produk yang sensitif terhadap panas.Tujuan penelitian ini adalah untuk mengetahui perbedaan absorpsi ibuprofen pada usus halus kelinci terbalik dan tidak terbalik yang dikeringkan dengan yang segar sehingga dapat diketahui kelayakan pengeringan usus dengan teknik freeze dryer agar dapat digunakan pada penelitian absorpsi suatu obat.
Penelitian ini dilakukan dengan metode usus halus terbalik kelinci, menggunakan alat Crane dan Wilson yang telah dimodifikasi. Jenis usus yang dibandingkan adalah usus terbalik segar, usus terbalikkering, usus tidak terbalik segar dan usus tidak terbalik dikeringkan dengan media larutan dapar fosfat pH 6,4 isotonis. Kadar ibuprofen yang terabsorpsi diperiksa dalam larutan dapar fosfat dengan menggunakan spektrofotometer ultraviolet pada panjang gelombang 222 nm dan data yang diperoleh dianalisis dengan menggunakan Statistical Program Service Solution (SPSS).
Hasil penelitian menunjukkan bahwa absorpsi ibuprofen dipengaruhi oleh jenis keadaan usus. Pada absorbsiibuprofen bakupada usus halus kelinci terbalik dikeringkan (36,072 ± 0,372mcg/ml)>ibuprofen baku pada usus halus kelinci tidak terbalik dikeringkan (31,356±0,472mcg/ml) dan absorbsi ibuprofen baku pada usus halus kelinciterbalik segar (27,724 ± 1,559 mcg/ml)>ibuprofen baku pada usus halus kelinci tidak terbalik segar (22,802±0,137mcg/ml) dan uji Anova Test Bonferroni diketahui bahwa terdapat perbedaan yang signifikan antara absorpsi ibuprofen pada usus halus terbalik segar dan terbalik dikeringkan serta untuk jenis usus tidak terbalik segar dan tidak terbalik dikeringkan dengan nilai signifikansi 0,000.
vii
IBUPROFEN ABSORPTION RATE TEST IN RABBIT SMALL INTESTINE (Oryctolagus cuniculus)REVERSED AND NOT REVERSE
FREEZE-DRIED AND FRESH
Abstract
The intestine has advantageous anatomy and physiological characteristic for drug absorption. However, the in vitro method for intestine has a disadvantage caused by its inability to mantain its structure in a long period of time. Freeze drying is a drying method which has advantageous for maintaining the quality of the dried materials especially for heat-sensitive products.The purpose of this research is to determine differences in the rate of ibuprofen absorption infreeze-dried and fresh small intestine so as to know the feasibility of infreeze-dried of freeze dryer intestine that can be used to absorption of a drug research.
This research was done with everted sac of rabbit’s intestine, used Crane and Wilson apparatus which have been modified. The type of preparation of ibuprofen compared to isthe small intestine of rabbits inverted drained,small intestine not reversed drained, fresh upside rabbit small intestine, small intestine not reversed fresh.Determination of absorptedibuprofen which was checked in buffer phosphate isotonic solution by using ultraviolet spectrophotometer at wavelength 222 nm and obtained data was analyzed by using Statistical Program Service Solution (SPSS).
The result of this research showed that the rate of ibuptofen absorption is influenced by the type of intestine conditions. Ibuprofen absorption in the small intestine of rabbits inverted drained(36.072 ± 0.372 mcg/ml)> ibuprofen raw rabbit small intestine not reversed drained(31.356 ± 0.472 mcg/ml) and absorption ibuprofen raw fresh upside rabbit small intestine(27.724 ± 1.559 mcg/ml)> ibuprofen raw rabbit small intestine not reversed fresh(22.802 ± 0.137 mcg/ml)and based on the results of statistical tests using Anova Test Bonferroni absorption ibuprofen is known there are significant differences between ibuprofen absorption in the small intestine of rabbits inverted and not inverted at dry and fresh condition with a significance value of 0.000
viii
ix
2.2 Usus Halus ... 12
2.3 Metode Kantung Terbalik (Everted Sac) ... 15
2.4 Ibuprofen ... 16
2.4.1 Sifat fisikokimia ... ... 17
2.4.2 Farmakokinetik ... ... 17
2.4.3 Farmakodinamik ... ... 17
2.4.4 Indikasi dan dosis terapi ... 17
2.5 Spektrofotometri Ultraviolet-visibel ... 18
BAB III METODE PENELITIAN ... 21
x
3.5.3 Pembuatan kurva kalibrasi ibuprofen dalam medium dapar
fosfat pH 6,4 isotonis ... 24
3.5.4 Pembuatan larutan obat ibuprofen baku dengan konsentrasi 2 mmol/L ... 24
3.5.9 Penentuan absorpsi ibuprofen ... 26
3.5.9.1 Penentuan absorpsi ibuprofen dalam usus halus Kelinci terbalik dan tidak terbalik segar dalam Larutan dapar fosfat pH 6,4 isotonis ... 26
3.5.9.2 Penentuan absorpsi ibuprofen dalam usus halus Kelinci terbalik dan tidak terbalik yang dikeringkan dalam larutan dapar fosfat pH 7,4 isotonis ... 27
3.6 Analisis Data ... 27
BAB IV HASIL DAN PEMBAHASAN ... 28
4.1 Penentuan Panjang Gelombang Maksimum Ibuprofen dalam Larutan Dapar Fosfat pH 6,4Isotonis ... 28
4.2 Pembuatan Kurva Kalibrasi dan Penentuan Persamaan Regresi Ibuprofen Baku dalam Larutan Dapar Fosfat pH 6,4 Isotonis .. ... 29
4.3 Pengaruh Perbedaan Jenis UsusTerhadap Konsentrasi Ibuprofen yang Terabsorpsipada Usus Halus Kelinci ... 30
4.4 Pengaruh Perbedaan Jenis Usus dan Jenis Sediaan Ibuprofen Terhadap Harga AUC (Area Under The Curve) Ibuprofen pada Usus Halus Terbalik dan Tidak Terbalik Kelinci ... 32
BAB V KESIMPULAN DAN SARAN ... 35
5.1 Kesimpulan ... 35
xi
xii
DAFTAR TABEL
Halaman Tabel 4.1 Data Absorbansi untuk menentukan Kurva Kalibrasi ... 29 Tabel 4.2 Data Konsentrasi Ibuprofen pada Interval Waktu Tertentu
dalam mcg/ml pada Usus Halus Kelinci Terbalik Segar... 30 Tabel 4.3 Data Konsentrasi Ibuprofen pada Interval Waktu Tertentu
dalam mcg/ml pada Usus Halus Kelinci Terbalik yang Dikeringkan ... 30 Tabel 4.4 Data Konsentrasi Ibuprofen pada Interval Waktu Tertentu
dalam mcg/ml padaUsus Halus Kelinci Tidak Terbalik Segar 30 Tabel 4.5 Data Konsentrasi Ibuprofen pada Interval Waktu Tertentu
dalam mcg/ml pada Usus Halus Kelinci Tidak Terbalik yang Dikeringkan ... 31 Tabel 4.6 Data AUC sediaan ibuprofen dalam cairan serosa usus halus
terbalik kelinci segar dan yang dikeringkan ... 32 Tabel 4.7 Data AUC sediaan ibuprofen dalam cairan serosa usus halus
xiii
DAFTAR GAMBAR
Halaman
Gambar 1.1 Kerangka pikir penelitian ... 4
Gambar 2.2 Struktur membran sel ... 8
Gambar 2.3 Difusi pasif melalui pori ... 9
Gambar 2.4 Sistem pengangkutan aktif ... 11
Gambar 2.5 Sistem pengangkutan secara pinositosis ... 12
Gambar 2.6 Skema usus halus dengan villi dan perfusinya ... 15
Gambar 2.7 Rumus bangun ibuprofen ... 16
Gambar 4.2 Grafik Kurva Kalibrasi Ibuprofen dalam Dapar Posfat pH 6.4 ... 29
Gambar 4.3 Grafik AUC Terhadap Waktu dari Ibuprofen pada Usus Halus Kelinci Terbalik ... 32
xiv
DAFTAR LAMPIRAN
Halaman Lampiran 1 Bagan Alur Penelitian ... 38 Lampiran 2 Flowsheet Pembuatan Larutan Induk Baku Ibuprofen
dalam Larutan Dapar Fosfat pH 6,4 Isotonis ... 39 Lampiran 3 Flowsheet Penentuan Panjang Gelombang Maksimum
Ibuprofen Baku dalam Larutan Dapar Fosfat pH 6,4 Isotonis ... 40 Lampiran 4 Penentuan Kurva Serapan Ibuprofen Baku dalam
Larutan Dapar Fosfat pH 6,4 Isotonis ... 41 Lampiran 5 Flowsheet Pembuatan Kurva Kalibrasi Ibuprofen Baku
dalam Larutan Dapar Fosfat pH 6,4 Isotonis .. ... 42 Lampiran 6 Penentuan Persamaan Regresi dan Kurva Kalibrasi
Ibuprofen Baku dalam Larutan Dapar Fosfat pH 6,4 Isotonis ….. ... 43 Lampiran 7 Flowsheet Pembuatan Usus Halus Terbalik dan Tidak
Terbalik Kelinci ... 45 Lampiran 8 Flowsheet Penentuan Pola Penembusan Membran Oleh
Berbagai Sediaan Ibuprofen pada Usus Halus Terbalik dan Tidak Terbalik Kelinci ... 47 Lampiran 9 Contoh Perhitungan Penentuan Pembuatan Larutan
Obat Ibuprofen 2 mmol/L ... 48 Lampiran 10 Contoh Perhitungan Penentuan Harga Konsentrasi
Ibuprofen Baku dalam Cairan Serosa Usus Halus Kelinci dalam mcg/ml ... 49 Lampiran 11 Contoh Perhitungan Penentuan Harga Konsentrasi
Kumulatif Ibuprofen Baku dalam Cairan Serosa Usus Halus Kelinci dalam mcg/ml ... 50 Lampiran 12 Contoh Perhitungan Penentuan Harga AUC (Area Under
The Curve) Ibuprofen Baku dalam mcg.menit/ml ... 51 Lampiran 13 Data Absorbansi Berbagai Sediaan Ibuprofen dalam