PENGARUH ASPIRIN TERHADAP ABSORPSI
PARASETAMOL PADA USUS HALUS
KELINCI (Oryctolagus cuniculus)
YANG DIHOMOGENKAN
SKRIPSI
OLEH:
ZULHA YENI
NIM 091524087
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGARUH ASPIRIN TERHADAP ABSORPSI
PARASETAMOL PADA USUS HALUS
KELINCI (Oryctolagus cuniculus)
YANG DIHOMOGENKAN
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh
gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
ZULHA YENI
NIM 091524087
PROGRAM EKSTENSI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2013
PENGARUH ASPIRIN TERHADAP ABSORPSI PARASETAMOL PADA USUS HALUS
KELINCI (Oryctolagus cuniculus) YANG DIHOMOGENKAN
OLEH: ZULHA YENI NIM 091524087
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi
Universitas Sumatera Utara
Pada Tanggal : 21 Agustus 2013
Pembimbing I, Panitia Penguji:
Prof. Dr. M. T. Simanjuntak, M.Sc., Apt. Prof. Dr. Hakim Bangun, Apt.
NIP 195212041980021001 NIP 195201171980031002
Prof. Dr. M.T.Simanjuntak, M.Sc., Apt. NIP 195212041980021001
Pembimbing II,
Dr. Kasmirul Ramlan Sinaga, M.S., Apt. NIP 195504241983031003
Prof. Dr. Karsono, Apt.
NIP 195409091982011001 Dr. Edy Suwarso, S.U., Apt.
KATA PENGANTAR
Puji dan syukur penulis ucapkan kehadirat Allah yang Maha Kuasa yang telah melimpahkan rahmat, karunia dan kasihNya sehingga penulis dapat melaksanakan penelitian dan menyelesaikan penulisan skripsi ini yang berjudul “Pengaruh aspirin terhadap absorpsi parasetamol pada usus halus kelinci (Oryctolagus cuniculus) yang dihomogenkan”. Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera Utara.
Penulis menyampaikan terima kasih kepada Bapak Prof. Dr. M. T. Simanjuntak, MSc., Apt., dan Bapak Prof. Dr. Karsono., Apt., atas waktu bimbingan, kesabaran dan tanggung jawab kepada penulis selama melakukan penelitian hingga selesainya penulisan skripsi ini.
Penulis juga menyampaikan terima kasih kepada Bapak Prof. Dr. Sumadio Hadisahputra, Apt., sebagai Dekan Fakultas Farmasi, Bapak Prof. Dr. Hakim Bangun., Apt., Bapak Dr. Kasmirul Ramlan Sinaga, M.S., Apt., dan Bapak Dr. Edy Suwarso, S.U., Apt., selaku dosen penguji yang telah memberikan petunjuk dan masukan kepada penulis dalam penyelesaian skripsi ini.
Dan pada kesempatan ini pula penulis menyampaikan terima kasih dan penghargaan yang tulus kepada Ayahanda dan Ibunda serta kakak-kakak serta keponakan-keponakan yang telah memberikan semangat, doa dan pengorbanan baik moril maupun materil dalam penyelesaian skripsi ini.
Penulis juga menyampaikan terima kasih kepada seluruh Staf Pengajar, Pegawai Tata Usaha dan Teman-teman yang telah membantu selama penelitian hingga selesainya penulisan skripsi ini.
Penulis menyadari sepenuhnya bahwa skripsi ini masih belum sempurna, sehingga penulis masih mengharapkan kritik dan saran yang bersifat membangun demi kesempurnaan skripsi ini. Akhir kata penulis berharap semoga skripsi ini dapat menjadi sumbangan yang bermanfaat bagi ilmu pengetahuan khususnya dibidang farmasi.
Medan, Oktober 2013 Penulis,
PENGARUH ASPIRIN TERHADAP ABSORPSI PARASETAMOL PADA USUS HALUS KELINCI (Oryctolagus cuniculus)
YANG DIHOMOGENKAN
ABSTRAK
Absorpsi sistemik suatu obat dari saluran cerna atau tempat ekstravaskuler yang lain tergantung pada faktor fisikokimia obat, anatomi dan fisiologi tempat absorpsi. Tujuan penelitian ini adalah untuk mengetahui pengaruh inhibisi aspirin terhadap absorpsi parasetamol dengan berbagai konsentrasi pada usus halus kelinci (Oryctolagus cuniculus) yang dihomogenkan, yang diharapkan akan dapat melengkapi informasi tentang parasetamol untuk keperluan preformulasi.
Penelitian ini dilakukan secara in vitro dengan menggunakan usus halus kelinci (Oryctolagus cuniculus) yang dihomogenkan. Larutan obat yang digunakan ada dua larutan yaitu larutan parasetamol dan larutan aspirin. Konsentrasi larutan parasetamol yang digunakan adalah 1 mM, 2 mM, 3 mM, 5 mM dan 10 mM. Dan konsentrasi larutan aspirin yang digunakan adalah 0,1 mM, 0,3 mM dan 0,5 mM yang dilakukan pada waktu 0,75 menit, 2 menit dan 5 menit. Hasil pengamatan kemudian dianalisis dengan Uji T menggunakan Statistical Program Servise Solution (SPSS).
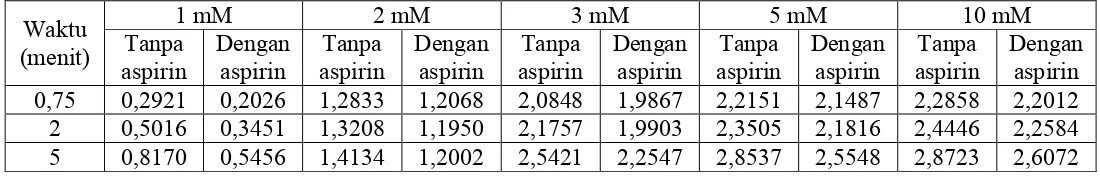
Pada konsentrasi 1 mM jumlah P1 yang diabsorpsi pada waktu 0,75 menit = 0,2921 dan P2 = 0,2026, waktu 2 menit P1 = 0,5016 dan P2 = 0,3451, waktu 5 menit P1 = 0,8170 dan P2 = 0,5456; pada konsentrasi 2 mM jumlah P1 yang diabsorpsi pada waktu 0,75 menit = 1,2833 dan P2 = 1,2068; waktu 2 menit P1 = 1,3208 dan P2 = 1,1950; waktu 5 menit P1 = 1,4134 dan P2 = 1,2002; pada konsentrasi 3 mM jumlah P1 yang diabsorpsi pada waktu 0,75 menit = 2,0848 dan P2 = 1,9867; waktu 2 menit P1 = 2,1757 dan P2 = 1,9903; waktu 5 menit P1 = 2,5421 dan P2 = 2,2547; pada konsentrasi 5 mM jumlah P1 yang diabsorpsi pada waktu 0,75 menit = 2,2151 dan P2 = 2,1487; waktu 2 menit P1 = 2,3505 dan P2 = 2,1816; waktu 5 menit P1 = 2,8537 dan P2 = 2,5548; pada konsentrasi 10 mM jumlah P1 yang diabsorpsi pada waktu 0,75 menit = 2,2858 dan P2 = 2,2012; waktu 2 menit P1 = 2,4446 dan P2 = 2,2584; waktu 5 menit P1 = 2,8723 dan P2 = 2,6072. Hasil analisis data menggunakan Uji T menunjukkan terdapat perbedaan yang signifikan terhadap jumlah absorpsi parasetamol (P1) dengan parasetamol dengan penambahan aspirin (P2) dalam usus halus kelinci yang dihomogenkan. Sehingga dapat disimpulkan bahwa aspirin dapat menurunkan absorpsi parasetamol.
THE EFFECT OF ASPIRIN THROUGH PARACETAMOL ABSORPTION AT RABBIT’S (Oryctolagus cuniculus) SMALL INTESTINE
WHICH HOMOGENIZED
ABSTRACT
Systematical absorption of a drug from alimentary tract or place of other ekstravasculer depends on physicochemical drug factors, anatomy and physiology place of absorption. The aim of this research was to know the effect of aspirin inhibition through paracetamol absorption by some concentrations at rabbit’s (Oryctolagus cuniculus) small intestine which homogenized, so it hopefully can complete the information about paracetamol for preformulation needed.
This research was done in vitro by using rabbit’s (Oryctolagus cuniculus) small intestine which homogenized. The drug solution that is used there are two kinds of solutions, they are paracetamol solution and aspirin solution. The concentration of paracetamol solution that is being used are 1 mM, 2 mM, 3 mM, 5 mM, and 10 mM. And the concentration of aspirin solution is being used are 0.1 mM, 0.3 mM and 0.5 mM that was done at timing 0.75 minutes, 2 minutes, and 5 minutes. Result observations then performed data analysis with T Test Statistical Program Servise Solution (SPSS).
The at concentration 1 mM amount of P1 which in absorption at timing 0.75 minutes = 0.2921 and P2 = 0.2026, at timing 2 minutes P1 = 0.5016 and P2 = 0.3451, at timing 5 minutes P1 = 0.8170 and P2 = 0.5456; the at concentration 2 mM amount of P1 which in absorption at timing 0.75 minutes = 1.2833 and P2 = 1.2068; at timing 2 minutes P1 = 1.3208 and P2 = 1.1950; at timing 5 minutes P1 = 1.4134 and P2 = 1.2002; the at concentration 3 mM amount of P1 which in absorption at timing 0.75 minutes = 2.0848 and P2 = 1.9867; at timing 2 minutes P1 = 2.1757 and P2 = 1.9903; at timing 5 minutes P1 = 2.5421 and P2 = 2.2547; the at concentration 5 mM amount of P1 which in absorption at timing 0.75 minutes = 2.2151 and P2 = 2.1487; at timing 2 minutes P1 = 2.3505 and P2 = 2.1816; at timing 5 minutes P1 = 2.8537 and P2 = 2.5548; the at concentration 10 mM amount of P1 which in absorption at timing 0.75 minutes = 2.2858 and P2 = 2.2012; at timing 2 minutes P1 = 2.4446 and P2 = 2.2584; at timing 5 minutes P1 = 2.8723 and P2 = 2.6072. The result of data analysis using T Test showed there are significant difference from absorption paracetamol (P1) and absorption of paracetamol with increment aspirin (P2) in rabbit’s (Oryctolagus cuniculus) small intestine which homogenized. So that inferential be that of aspirin can degrade the paracetamol absorption.
DAFTAR ISI
2.2.1 Faktor-faktor yang mempengaruhi absorpsi obat ... 8
2.2.2 Mekanisme lintas membran ... 9
2.3 Usus Halus ... 15
2.4 Kinetika Laju Absorpsi ... 17
2.5 Spektrofotometri Ultraviolet-visibel ... 18
BAB III METODE PENELITIAN ... 21
3.4.2 Pembuatan larutan natrium dihidrogenfosfat 0,8 % ... 21
3.4.3 Pembuatan larutan dinatrium hidrogenfosfat 0,9 % ... 22
3.4.4 Pembuatan larutan dapar fosfat pH 7,4 isotonis ... 22
3.4.5 Pembuatan larutan natrium klorida 0,9 % ... 22
3.4.6 Pembuatan usus halus kelinci yang dihomogenkan ... 22
3.4.7 Pembuatan Larutan Induk Baku I (LIB I) parasetamol dalam dapar fosfat pH 7,4 isotonis ... 23
3.4.8 Pembuatan Larutan Induk Baku II (LIB II) parasetamol dalam dapar fosfat pH 7,4 isotonis ... 23
3.4.9 Pembuatan larutan parasetamol dengan berbagai konsentrasi ... ... 23
3.4.11 Penentuan kurva absorpsi parasetamol dalam usus
halus kelinci yang dihomogenkan ... 24
3.4.12 Penentuan kurva kalibrasi parasetamol dalam usus halus kelinci yang dihomogenkan ... 24
3.4.13 Penentuan absorpsi parasetamol dalam usus halus kelinci yang dihomogenkan ... 25
3.4.14 Penentuan absorpsi parasetamol dalam usus halus kelinci yang dihomogenkan dengan penambahan aspirin ... 25
BAB IV HASIL DAN PEMBAHASAN ... 26
4.1 Hasil Penentuan Panjang Gelombang Maksimum Parasetamol dalam Usus Halus Kelinci yang Dihomogenkan pada Dapar Fosfat pH 7,4 Isotonis ... 26
4.2 Hasil Penentuan Kurva Kalibrasi Parasetamol dalam Usus Halus Kelinci yang Dihomogenkan pada Dapar Fosfat pH 7,4 Isotonis ... 26
4.3 Penentuan Jumlah Parasetamol yang Diabsorpsi dalam Usus Halus Kelinci yang Dihomogenkan pada Dapar Fosfat pH 7,4 Isotonis ... 27
4.4 Penentuan Jumlah Parasetamol yang Diabsorpsi dalam Usus Halus Kelinci yang Dihomogenkan pada Dapar Fosfat pH 7,4 Isotonis dengan Penambahan Aspirin ... 29
DAFTAR TABEL
Halaman Tabel 4.1 Data kalibrasi parasetamol dalam usus halus kelinci yang
dihomogenkan pada dapar fosfat pH 7,4 isotonis ... 26 Tabel 4.2 Jumlah parasetamol yang diabsorpsi pada konsentrasi
1 mM, 2 mM, 3 mM, 5 mM dan 10 mM ... 28 Tabel 4.3 Jumlah parasetamol yang diabsorpsi pada konsentrasi
1 mM, 2 mM, 3 mM, 5 mM dan 10 mM dengan penambahan aspirin 0,1 mM, 0,3 mM dan 0,5 mM pada waktu 0,75, 2 dan
5 menit ... 29 Tabel 4.4 Perbandingan jumlah parasetamol yang diabsorpsi pada
konsentrasi 1 mM, 2 mM, 3 mM, 5 mM dan 10 mM tanpa dan dengan penambahan aspirin pada waktu 0,75, 2 dan
DAFTAR GAMBAR
Halaman
Gambar 2.1 Rumus bangun parasetamol ... 5
Gambar 2.2 Rumus bangun aspirin ... 6
Gambar 2.3 Fase biofarmasetik obat ... 7
Gambar 2.4 Transpor trans membran transpor konvektif ... 9
Gambar 2.5 Transpor trans membran difusi pasif ... 12
Gambar 2.6 Transpor aktif ... 13
Gambar 2.7 Difusi sederhana ... 13
Gambar 2.8 Transpor trans membran pinositosis ... 14
Gambar 2.9 Transpor trans membran transpor pasangan ion ... 14
Gambar 2.10 Usus halus ... 16
Gambar 4.1 Kurva kalibrasi parasetamol dalam usus halus kelinci yang dihomogenkan pada dapar fosfat pH 7,4 isotonis ... 27
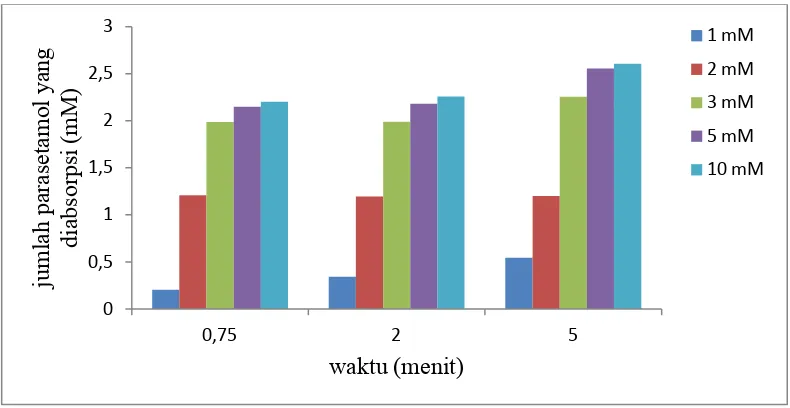
Gambar 4.2 Grafik jumlah parasetamol yang diabsorpsi vs waktu pada konsentrasi 1 mM, 2 mM, 3 mM, 5 mM dan 10 mM ... 28
Gambar 4.3 Grafik jumlah parasetamol yang diabsorpsi vs waktu pada konsentrasi 1 mM, 2 mM, 3 mM, 5 mM dan 10 mM dengan penambahan aspirin 0,1 mm, 0,3 mM dan 0,5 mM pada waktu 0,75, 2 dan 5 menit ... 30
DAFTAR LAMPIRAN
Halaman Lampiran 1. Flowsheet pembuatan larutan dapar fosfat pH 7,4
isotonis ... 36 Lampiran 2. Flowsheet pembuatan usus halus homogen ... 37 Lampiran 3. Flowsheet pembuatan Larutan Induk Baku I parasetamol
dalam dapar fosfat pH 7,4 isotonis ... 38 Lampiran 4. Flowsheet pembuatan Larutan Induk Baku II parasetamol
dalam dapar fosfat pH 7,4 isotonis ... 39 Lampiran 5. Flowsheet pembuatan larutan parasetamol dengan
berbagai konsentrasi ... 40 Lampiran 6. Flowsheet pembuatan larutan aspirin dengan berbagai
konsentrasi ... 41 Lampiran 7. Flowsheet penentuan kurva absorbsi parasetamol dalam
usus halus yang dihomogenkan ... 42 Lampiran 8. Kurva absorpsi parasetamol dalam usus halus kelinci
yang dihomogenkan ... 43 Lampiran 9. Flowsheet penentuan kurva kalibrasi parasetamol dalam
usus halus kelinci yang dihomogenkan ... 44 Lampiran 10. Flowsheet penentuan absorpsi parasetamol dalam usus
halus kelinci yang dihomogenkan ... 45 Lampiran 11. Flowsheet penentuan absorpsi parasetamol dengan
penambahan aspirin dalam usus halus kelinci
yang dihomogenkan ... 46 Lampiran 12. Penentuan persamaan regresi dan kurva kalibrasi
parasetamol pada usus halus kelinci yang
dihomogenkan ... 47 Lampiran 13. Contoh perhitungan konsentrasi larutan parasetamol
2 mM ... 48 Lampiran 14. Contoh perhitungan konsentrasi parasetamol dalam usus
halus kelinci yang dihomogenkan ... 49 Lampiran 15. Contoh perhitungan Standar Deviasi (SD) ... 50 Lampiran 16. Gambar usus halus kelinci ... 51 Lampiran17. Gambar alat homogenizer mixer modifikasi dan
usus halus homogen ... 52 Lampiran 18. Hasil uji T-Test profil laju absorpsi parasetamol dalam
PENGARUH ASPIRIN TERHADAP ABSORPSI PARASETAMOL PADA USUS HALUS KELINCI (Oryctolagus cuniculus)
YANG DIHOMOGENKAN
ABSTRAK
Absorpsi sistemik suatu obat dari saluran cerna atau tempat ekstravaskuler yang lain tergantung pada faktor fisikokimia obat, anatomi dan fisiologi tempat absorpsi. Tujuan penelitian ini adalah untuk mengetahui pengaruh inhibisi aspirin terhadap absorpsi parasetamol dengan berbagai konsentrasi pada usus halus kelinci (Oryctolagus cuniculus) yang dihomogenkan, yang diharapkan akan dapat melengkapi informasi tentang parasetamol untuk keperluan preformulasi.
Penelitian ini dilakukan secara in vitro dengan menggunakan usus halus kelinci (Oryctolagus cuniculus) yang dihomogenkan. Larutan obat yang digunakan ada dua larutan yaitu larutan parasetamol dan larutan aspirin. Konsentrasi larutan parasetamol yang digunakan adalah 1 mM, 2 mM, 3 mM, 5 mM dan 10 mM. Dan konsentrasi larutan aspirin yang digunakan adalah 0,1 mM, 0,3 mM dan 0,5 mM yang dilakukan pada waktu 0,75 menit, 2 menit dan 5 menit. Hasil pengamatan kemudian dianalisis dengan Uji T menggunakan Statistical Program Servise Solution (SPSS).
Pada konsentrasi 1 mM jumlah P1 yang diabsorpsi pada waktu 0,75 menit = 0,2921 dan P2 = 0,2026, waktu 2 menit P1 = 0,5016 dan P2 = 0,3451, waktu 5 menit P1 = 0,8170 dan P2 = 0,5456; pada konsentrasi 2 mM jumlah P1 yang diabsorpsi pada waktu 0,75 menit = 1,2833 dan P2 = 1,2068; waktu 2 menit P1 = 1,3208 dan P2 = 1,1950; waktu 5 menit P1 = 1,4134 dan P2 = 1,2002; pada konsentrasi 3 mM jumlah P1 yang diabsorpsi pada waktu 0,75 menit = 2,0848 dan P2 = 1,9867; waktu 2 menit P1 = 2,1757 dan P2 = 1,9903; waktu 5 menit P1 = 2,5421 dan P2 = 2,2547; pada konsentrasi 5 mM jumlah P1 yang diabsorpsi pada waktu 0,75 menit = 2,2151 dan P2 = 2,1487; waktu 2 menit P1 = 2,3505 dan P2 = 2,1816; waktu 5 menit P1 = 2,8537 dan P2 = 2,5548; pada konsentrasi 10 mM jumlah P1 yang diabsorpsi pada waktu 0,75 menit = 2,2858 dan P2 = 2,2012; waktu 2 menit P1 = 2,4446 dan P2 = 2,2584; waktu 5 menit P1 = 2,8723 dan P2 = 2,6072. Hasil analisis data menggunakan Uji T menunjukkan terdapat perbedaan yang signifikan terhadap jumlah absorpsi parasetamol (P1) dengan parasetamol dengan penambahan aspirin (P2) dalam usus halus kelinci yang dihomogenkan. Sehingga dapat disimpulkan bahwa aspirin dapat menurunkan absorpsi parasetamol.
THE EFFECT OF ASPIRIN THROUGH PARACETAMOL ABSORPTION AT RABBIT’S (Oryctolagus cuniculus) SMALL INTESTINE
WHICH HOMOGENIZED
ABSTRACT
Systematical absorption of a drug from alimentary tract or place of other ekstravasculer depends on physicochemical drug factors, anatomy and physiology place of absorption. The aim of this research was to know the effect of aspirin inhibition through paracetamol absorption by some concentrations at rabbit’s (Oryctolagus cuniculus) small intestine which homogenized, so it hopefully can complete the information about paracetamol for preformulation needed.
This research was done in vitro by using rabbit’s (Oryctolagus cuniculus) small intestine which homogenized. The drug solution that is used there are two kinds of solutions, they are paracetamol solution and aspirin solution. The concentration of paracetamol solution that is being used are 1 mM, 2 mM, 3 mM, 5 mM, and 10 mM. And the concentration of aspirin solution is being used are 0.1 mM, 0.3 mM and 0.5 mM that was done at timing 0.75 minutes, 2 minutes, and 5 minutes. Result observations then performed data analysis with T Test Statistical Program Servise Solution (SPSS).
The at concentration 1 mM amount of P1 which in absorption at timing 0.75 minutes = 0.2921 and P2 = 0.2026, at timing 2 minutes P1 = 0.5016 and P2 = 0.3451, at timing 5 minutes P1 = 0.8170 and P2 = 0.5456; the at concentration 2 mM amount of P1 which in absorption at timing 0.75 minutes = 1.2833 and P2 = 1.2068; at timing 2 minutes P1 = 1.3208 and P2 = 1.1950; at timing 5 minutes P1 = 1.4134 and P2 = 1.2002; the at concentration 3 mM amount of P1 which in absorption at timing 0.75 minutes = 2.0848 and P2 = 1.9867; at timing 2 minutes P1 = 2.1757 and P2 = 1.9903; at timing 5 minutes P1 = 2.5421 and P2 = 2.2547; the at concentration 5 mM amount of P1 which in absorption at timing 0.75 minutes = 2.2151 and P2 = 2.1487; at timing 2 minutes P1 = 2.3505 and P2 = 2.1816; at timing 5 minutes P1 = 2.8537 and P2 = 2.5548; the at concentration 10 mM amount of P1 which in absorption at timing 0.75 minutes = 2.2858 and P2 = 2.2012; at timing 2 minutes P1 = 2.4446 and P2 = 2.2584; at timing 5 minutes P1 = 2.8723 and P2 = 2.6072. The result of data analysis using T Test showed there are significant difference from absorption paracetamol (P1) and absorption of paracetamol with increment aspirin (P2) in rabbit’s (Oryctolagus cuniculus) small intestine which homogenized. So that inferential be that of aspirin can degrade the paracetamol absorption.
BAB I
PENDAHULUAN
1.1Latar Belakang
Parasetamol merupakan derivat para amino fenol yang merupakan
metabolit fenasetin dengan efek antipiretik. Obat ini digunakan untuk
menghilangkan nyeri ringan sampai sedang termasuk sakit kepala serta
menurunkan demam yang disertai infeksi bakteri dan virus. Parasetamol memiliki
efek samping yang jarang terjadi dan biasanya ringan, hanya pada penggunaan
kronis dapat menimbulkan kerusakan hati yang fatal (Tan dan Kirana, 2007).
Parasetamol diabsorpsi cepat dan sempurna dalam saluran cerna.
Konsentrasi tertinggi dalam plasma dicapai dalam waktu ½ jam dan masa paruh
plasma antara 1-3 jam, dengan rute pemberian peroral tersedia dalam bentuk
tablet, sirup dan suspensi (Tan dan Kirana, 2007).
Demikian juga aspirin merupakan obat anti nyeri tertua yang sampai kini
paling banyak digunakan di seluruh dunia. Selain itu, zat ini juga berkhasiat
anti-demam kuat dan pada dosis rendah berdaya menghambat agregasi trombosit (Tan
dan Kirana, 2007).
Efek samping dari aspirin yang sering terjadi berupa iritasi mukosa
lambung dengan resiko tukak lambung. Anak-anak kecil yang menderita cacar air
atau flu sebaiknya jangan diberikan aspirin (melainkan parasetamol), karena
beresiko terkena rye sindroma yang berbahaya. Resorpsinya cepat dan praktis
lengkap, terutama dibagian pertama duodenum dan masa paruhnya 2-3 jam pada
Absorpsi sistemik suatu obat dari saluran cerna atau tempat ekstravaskuler
yang lain tergantung pada faktor fisikokimia obat, anatomi dan fisiologi tempat
absorpsi (Shargel dan Yu, 1988).
Ada beberapa cara terjadinya absorbsi dalam menembus membran yaitu
transpor pasif, transpor aktif, difusi sederhana, pinositosis dan transpor oleh
pasangan ion. Transpor pasif menyangkut senyawa yang dapat larut dalam
komponen penyusun membran, penembusan terjadi karena adanya perbedaan
konsentrasi atau elektrokimia tanpa memerlukan energi, sehingga mencapai
keseimbangan di kedua sisi membran (Aiache, 1993).
Bagian lain dari usus halus juga merupakan tempat terjadinya perlintasan
membran dengan intensitas yang besar, dan lebih banyak terjadi difusi pasif.
Difusi pasif terutama terjadi pada bagian pertama usus halus, karena konsentrasi
obat-obat yang tinggi dalam liang usus sebelah bawah dan pada penyerapan
susjacent (Aiache, 1993).
Transpor dari satu sisi membran ke sisi yang lain dapat terjadi dengan
mekanisme perbedaan konsentrasi. Konsentrasi zat aktif, seperti halnya pada
mekanisme difusi pasif juga merupakan faktor penentu laju penyerapan (Aiache,
1993).
Menurut penelitian sebelumnya (Lisa, 2011) hasil absorpsi dari obat
golongan NSAID pada usus halus kelinci (Oryctolagus cuniculus) yang
dihomogenkan memperlihatkan bahwa perbedaan konsentrasi mempengaruhi
jumlah absorpsi obat.
Berdasarkan hal-hal tersebut di atas, peneliti tertarik untuk memeriksa
yang dihomogenkan dan pengaruh penambahan aspirin terhadap absorpsi
parasetamol pada usus halus kelinci yang dihomogenkan.
1.2Perumusan Masalah
Berdasarkan latar belakang di atas, maka yang menjadi perumusan
masalahnya adalah:
1. Bagaimanakah pengaruh perbedaan konsentrasi parasetamol terhadap
jumlah absorpsi pada usus halus kelinci yang dihomogenkan?
2. Apakah aspirin mempengaruhi jumlah absorpsi parasetamol pada usus
halus kelinci yang dihomogenkan?
1.3Hipotesis
Berdasarkan perumusan masalah di atas, maka yang menjadi hipotesisnya
adalah:
1. Perbedaan konsentrasi parasetamol dapat mempengaruhi jumlah absorpsi
pada usus halus kelinci yang dihomogenkan.
2. Aspirin dapat menurunkan jumlah absorpsi parasetamol pada usus halus
kelinci yang dihomogenkan.
1.4Tujuan Penelitian
Berdasarkan hipotesis di atas, maka yang menjadi tujuan dalam penelitian
ini adalah:
1. Untuk mengetahui bagaimana pengaruh perbedaan konsentrasi
parasetamol terhadap jumlah absorbsi pada usus halus kelinci yang
2. Untuk mengetahui pengaruh aspirin terhadap jumlah absorbsi parasetamol
pada usus halus kelinci yang dihomogenkan.
1.5 Manfaat Penelitian
Adapun manfaat penelitian ini diharapkan dapat memberikan informasi
kepada masyarakat mengenai efek absorpsi parasetamol dengan penambahan
aspirin pada usus halus kelinci yang dihomogenkan, dan dapat memberikan
informasi kepada industri farmasi mengenai absorpsi parasetamol dengan
konsentrasi berbeda dan dengan penambahan aspirin pada usus halus kelinci yang
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Bahan
2.1.1 Parasetamol
a. Rumus bangun parasetamol (dapat dilihat pada Gambar 2.1)
Gambar 2.1 Rumus bangun parasetamol (Ditjen POM, 1995).
b. Rumus molekul : C8H9NO2 c. Berat molekul : 151,16
d. Sifat fisika
- Pemerian : Serbuk hablur, putih, tidak berbau, rasa sedikit pahit.
- Kelarutan : Larut dalam air mendidih dan dalam natrium
hidroksida 1N, mudah larut dalam etanol (Ditjen
POM,1995).
e. Farmakologi
- Kegunaan : analgetik dan antipiretik(Tan dan Kirana, 2007).
- Efek Samping : reaksi hipersensitifitas dan kelainan darah. Pada
penggunaan kronis dapat terjadi kerusakan hati.
Overdosis dapat menimbulkan mual, muntah dan
2.1.2 Aspirin
a. Rumus bangun aspirin (dapat dilihat pada Gambar 2.2)
Gambar 2.2 Rumus bangun aspirin (Ditjen POM, 1995).
b. Rumus molekul : C9H8O4 c. Berat molekul : 180,16
d. Sifat fisika
- Pemerian : Hablur tidak berwarna atau serbuk hablur putih, tidak
berbau atau hampir tidak berbau, rasa asam.
- Kelarutan : Agak sukar larut dalam air, mudah larut dalam etanol
(95%) P, larut dalam kloroform P dan dalam eter P.
(Ditjen POM,1995).
e. Farmakologi
- Kegunaan : analgetik dan antipiretik(Tan dan Kirana, 2007).
- Efek Samping : reaksi hipersensitifitas dan kelainan darah. Pada
penggunaan kronis dapat terjadi kerusakan hati.
Overdosis dapat menimbulkan mual, muntah dan
2.2 Absorbsi
Absorpsi atau penyerapan zat aktif adalah masuknya molekul-molekul
obat kedalam tubuh atau menuju ke peredaran darah setelah melewati sawar
biologik (Aiache, dkk, 1993). Absorpsi obat adalah peran yang terpenting untuk
akhirnya menentukan efektivitas obat (Joenoes, 2002). Agar suatu obat dapat
mencapai tempat kerja di jaringan atau organ, obat tersebut harus melewati
berbagai membran sel. Pada umumnya, membran sel mempunyai struktur
lipoprotein yang bertindak sebagai membran lipid semipermeabel (Shargel dan
Yu, 1985). Sebelum obat diabsorpsi, terlebih dahulu obat itu larut dalam cairan
biologis. Kelarutan (serta cepat-lambatnya melarut) menentukan banyaknya obat
terabsorpsi. Dalam hal pemberian obat per oral, cairan biologis utama adalah
cairan gastrointestinal; dari sini melalui membran biologis obat masuk ke
peredaran sistemik. Disolusi obat didahului oleh pembebasan obat dari bentuk
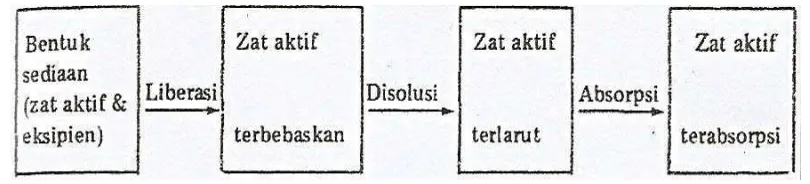
sediaannya. Secara ringkas proses biofarmasetik dapat dilihat pada Gambar 2.3
(Joenoes, 2002).
Gambar 2.3 Fase Biofarmasetik Obat(Joenoes, 2002).
Obat yang terbebaskan dari bentuk sediaannya belum tentu diabsorpsi:
kalau obat tersebut terikat pada kulit atau mukosa disebut adsorpsi. Kalau obat
sampai tembus ke dalam kulit, tetapi belum masuk ke kapiler disebut penetrasi.
saluran darah baru itu disebut absorpsi (Joenoes, 2002). Berarti suksesnya
perpindahan obat dari suatu bentuk sediaan dosis oral kedalam sirkulasi umum
bisa dicapai dengan empat langkah proses yaitu :
1. Penghantaran obat pada tempat absorpsinya
2. Keberadaan obat dalam bentuk larutan
3. Pergerakan dari obat larut melalui membran saluran cerna
4. Pergerakan obat dari tempat absorpsi ke dalam sirkulasi umum (Syukri, 2002).
Absorpsi obat adalah langkah utama untuk disposisi obat dalam tubuh dari
sistem LADME (Liberasi-Absorpsi-Distribusi-Metabolisme-Ekskresi). Bila
pembebasan obat dari bentuk sediaannya (liberasi) sangat lamban, maka disolusi
dan absorpsinya juga lama, sehingga dapat mempengaruhi efektivitas obat secara
keseluruhan (Joenoes, 2002).
2.2.1 Faktor-faktor yang mempengaruhi absorpsi obat
1. Pengaruh besar-kecilnya partikel obat
Kecepatan disolusi obat berbanding langsung dengan luas permukaan yang
kontak dengan cairan/pelarut; bertambah kecil partikel, bertambah luas
permukaan total, bertambah mudah larut (Joenoes, 2002).
2. Pengaruh daya larut obat
Pengaruh daya larut obat/bahan aktif tergantung pada:
a. Sifat kimia: modifikasi kimiawi obat
b. Sifat fisik: modifikasi fisik obat
c. Prosedur dan teknik pembuatan obat
3. Beberapa faktor lain fisiko-kimia obat
a. pKa dan derajat ionisasi obat
b. Koefisien partisi lemak/air (Joenoes, 2002).
2.2.2 Mekanisme Lintas Membran
Mekanisme pasif dan aktif (termasuk pembentukan membran) bersaing
dalam proses perlintasan zat aktif melalui membran (Aiache, dkk, 1993).
a. Filtrasi
Filtrasi atau yang disebut juga “difusi secara konvensi” adalah mekanisme
penembusan pasif melalui pori-pori suatu membran. Semua senyawa yang
berukuran cukup kecil dan larut dalam air dapat melewati kanal membran.
Sebagian besar membran (membran seluler epitel usus halus dan lain-lain)
berukuran kecil (4-7 Å) dan hanya dapat dilalui oleh molekul dengan bobot
molekul yang kecil yaitu lebih kecil dari 150 untuk senyawa yang bulat, atau lebih
kecil dari 400 jika molekulnya terdiri atas rantai panjang (Syukri, 2002). Difusi
pasif melalui pori dapat dilihat pada Gambar 2.4
b. Difusi pasif “pH partisi hipotesis”
Difusi pasif menyangkut senyawa yang larut dalam komponen penyusun
membran. Penembusan terjadi karena adanya perbedaan konsentrasi atau
elektrokimia tanpa memerlukan energi, sehingga mencapai keseimbangan dikedua
sisi membran. Waktu yang diperlukan untuk mencapai keseimbangan tersebut
mengikuti hukum difusi Fick (Syukri, 2002).
V = P (Ce – Ci)
Dimana P adalah tetapan permeabilitas, sedangkan Ce dan Ci adalah konsentrasi pada kedua kompartemen.
Jadi konsentrasi (C) senyawa di kedua sisi membran berpengaruh pada
proses penembusan, tetapi perlu ditekankan bahwa hanya fraksi bebas dari zat
aktif yang diperhitungkan dalam perbedaan konsentrasi. Kombinasi zat
aktif-protein yang terbentuk tersebut tidak dapat terdifusi karena alasan bobot
molekulnya. Dalam hal ini hanya fraksi bebas yang dapat berdifusi, rantai protein
merupakan faktor yang secara tidak langsung mempengaruhi laju difusi melalui
membran (Syukri, 2002).
Kebanyakan zat aktif merupakan basa atau asam organik, maka dalam
keadaan terlarut sebagian molekul berada dalam bentuk terionkan dan sebagian
dalam bentuk tak terionkan. Jika ukuran molekul tidak dapat melalui kanal-kanal
membran, maka polaritas yang kuat dari bentuk terionkan akan menghambat
proses difusi transmembran. Hanya fraksi zat aktif yang tak terionkan dan larut
dalam lemak yang dapat melalui membran dengan cara difusi pasif. Pentingnya
(derajat ionisasi molekul, pH kompartemen) digarisbawahi dalam “Teori Difusi
Non Ionik atau Hipotesa pH Partisi” (Syukri, 2002).
Untuk obat yang zat aktifnya merupakan garam dari suatu asam kuat atau
basa kuat, derajat ionisasi berperan pada hambatan difusi transmembran.
Sebaliknya untuk elektrolit lemah berupa garam yang berasal dari asam lemah
atau basa lemah yang sedikit terionisasi, maka difusi melalui membran tergantung
kelarutan bentuk tak terionkan (satu-satunya yang berpengaruh pada konsentrasi),
serta derajat ionisasi molekul (Syukri, 2002).
Derajat ionisasi tergantung pada dua faktor, (persamaan Henderson
Hasselbach) yaitu:
a. Tetapan ionisasi dari suatu senyawa atau pKa
b. pH cairan dimana terdapat molekul zat aktif
Untuk asam :
Karakteristik fisiko-kimia sebagian besar molekul (polaritas, ukuran
molekul, dan sebagainya) merupakan hambatan penembusan transmembran oleh
mekanisme pasif secara filtrasi dan difusi. Pengikutsertaan proses aktif dapat
menjelaskan perjalanan obat yang kadang-kadang melintasi membran sel dengan
sangat cepat (Syukri, 2002). Transport transmembran difusi pasif dapat dilihat
Gambar 2.5 Transpor trans membran difusi pasif(Joenoes, 2002).
c. Transpor aktif
Transpor aktif suatu molekul merupakan cara pelintasan transmembran
sangat berbeda dengan difusi pasif. Pada transpor aktif diperlukan adanya
pembawa. Pembawa ini dengan molekul yang dapat membentuk kompleks pada
permukaan membran. Kompleks tersebut melintasi membran dan selanjutnya
molekul dibebaskan pada permukaan lainnya, lalu pembawa kembali menuju ke
permukaan asalnya (Syukri, 2002).
Sistem transpor aktif bersifat jenuh. Sistem ini menunjukkan adanya suatu
kekhususan untuk setiap molekul atau suatu kelompok molekul. Oleh sebab itu
dapat terjadi persaingan beberapa molekul yang berafinitas tinggi dapat
menghambat kompetisi transpor dari molekul yang berafinitas lebih rendah.
Transpor dari satu sisi membran ke sisi membran yang lain dapat terjadi dengan
mekanisme perbedaan konsentrasi. Tranpor ini memerlukan energi yang diperoleh
dari hidrolisa adenosin trifosfat (ATP) dibawah pengaruh suatu ATP-ase (Syukri,
2002). Transport aktif dapat dilihat pada Gambar 2.6.
Gambar 2.6 Transpor aktif(Joenoes, 2002).
d. Difusi sederhana
Difusi ini merupakan cara pelintasan membran yang memerlukan suatu
pembawa dengan karakteristik tertentu (kejenuhan, spesifik dan kompetitif).
Pembawa tersebut bertanggungjawab terhadap transpor aktif, tetapi di sini
perlintasan terjadi akibat gradien konsentrasi dan tanpa pembebasan energi
(Syukri, 2002). Difusi sederhana dapat dilihat pada Gambar 2.7.
Gambar 2.7 Difusi sederhana(Joenoes, 2002).
e. Pinositosis
Pinositosis merupakan suatu proses perlintasan membran oleh
molekul-molekul besar dan terutama oleh molekul-molekul yang tidak larut. Perlintasan terjadi
dengan pembentukan vesikula (bintil) yang melewati membran (Syukri, 2002).
Gambar 2.8 Transpor trans membran pinositosis(Joenoes, 2002).
f. Transpor oleh pasangan ion
Transpor oleh pasangan ion adalah suatu cara perlintasan membran dari
suatu senyawa yang sangat mudah terionkan pada pH fisiologik. Perlintasan
terjadi dengan pembentukan kompleks yang netral (pasangan ion) dengan
senyawa endogen seperti musin, dengan demikian memungkinkan terjadinya
difusi pasif kompleks tersebut melalui membran (Syukri, 2002). Transport oleh
pasangan ion dapat dilihat pada Gambar 2.9.
Gambar 2.9 Transpor trans membran transpor pasangan ion (Joenoes,
2.3 Usus Halus
Usus halus adalah tempat berlangsungnya sebagian besar pencernaan dan
penyerapan. Dengan panjang sekitar 6,3 m dengan diameter yang kecil yaitu
2,5cm/1 inch. Bergulung di rongga abdomen dan terbentang dari lambung sampai
usus besar. Usus halus terdiri dari tiga bagian, yaitu:
a. Duodenum
Duodenum disebut juga usus dua belas jari. Bagian pertama usus halus
yang berbentuk sepatu kuda melingkari pankreas.
b. Jejunum
Disebut juga usus kosong. Terjadi pencernaan secara kimia, menghasilkan
enzim pencernaan.
c. Ileum
Ileum disebut juga usus penyerapan. Terjadi penyerapan makanan
(absorpsi) (Fawcett, 1994).
Bagian pertama duodenum memegang peranan yang sangat penting pada
proses penyerapan. Bagian lain dari usus halus juga merupakan tempat terjadinya
perlintasan membran dengan intensitas yang besar, dan disini lebih banyak terjadi
difusi pasif. Difusi pasif terutama terjadi pada bagian pertama usus halus, karena
konsentrasi obat-obat yang tinggi dalam liang usus akan meningkatkan gradient
difusi, hal yang sama terjadi pula pada bagian usus sebelah bawah dan pada
Anatomi usus halus dapat dilihat pada Gambar 2.10.
Gambar 2.10 Usus Halus(Deferme, et al, 2008).
Duodenum, dengan panjang sekitar 25 cm, terikat erat pada dinding dorsal
abdomen, dan sebagian besar terletak retroperitoneal. Jalannya berbentuk-C,
mengitari kepala pankreas dan ujung distalnya menyatu dengan jejunum, yang
terikat pada dinding dorsal rongga melalui mesenterium. Jejunum dapat
digerakkan bebas pada mesenteriumnya dan merupakan dua-perlima bagian
proksimal usus halus, sedangkan ileum merupakan sisa tiga-perlimanya.
Kelokan-kelokan jejunum menempati bagian pusat abdomen, sedangkan ileum menempati
bagian bawah rongga. Terdapat perbedaan kecil dalam histologi mukosa ketiga
segmen usus halus itu, namun batas di antara ketiganya tidak jelas. Dinding usus
halus terdiri atas empat lapis konsentris: mukosa, submukosa, muskularis, dan
serosa (Fawcett, 1994).
Bahan obat dari lambung masuk ke duodenum; fungsi utama duodenum
dan bagian pertama jejunum adalah untuk sekresi, sedangkan fungsi bagian kedua
duodenum 4-6, jejunum 6-7, ileum 7-8. Usus halus merupakan tempat absorpsi
yang penting untuk obat-obat karena pHnya yang cocok dan permukaan yang luas
(Ansel, 1989).
2.4Kinetika Laju Absorbsi
a. Persamaan Michaelis Menten (Inui, et al, 1988)
V =
Dimana; V = Kecepatan absorpsi awal (mcg/ml.menit)
Vmaks = Kecepatan absorpsi maksimum (mcg/ml.menit) Km = Tetapan Michaelis Mentens (M)
[C] = Konsentrasi (M)
Kd = Koefisien Difusi
b. Lineweaver Burk
Kurva hubungan konsentrasi [C] dan kecepatan absorpsi [V] yang
dikemukakan oleh Michaelis mentens dapat diubah ke dalam kurva garis lurus
apabila digunakan harga resiproknya (1/V dan 1/C) (Armstrong, 1995).
2.5 Spektrofotometri Ultraviolet-visibel
Spektrofotometer UV-vis adalah pengukuran panjang gelombang dan
intensitas sinar ultraviolet dan cahaya tampak yang diabsorpsi oleh sampel. Sinar
ultraviolet dan cahaya tampak memiliki energi yang cukup untuk mempromosikan
elektron pada kulit terluar ke tingkat energi yang lebih tinggi. Spektroskopi
UV-vis biasanya digunakan untuk molekul dan ion anorganik atau kompleks di dalam
larutan. Spektrum ini sangat berguna untuk pengukuran secara kuantitatif.
Konsentrasi dari analit di dalam larutan bisa ditentukan dengan mengukur
absorban pada panjang gelombang tertentu dengan menggunakan hukum
Lambert-Beer. Sinar ultraviolet berada pada panjang gelombang 200-400 nm
sedangkan sinar tampak berada pada panjang gelombang 400-800 nm
(Dachriyanus, 2004).
Ketika suatu atom atau molekul menyerap cahaya maka energi tersebut
akan menyebabkan tereksitasinya elektron pada kulit terluar ke tingkat energi
yang lebih tinggi. Tipe eksitasi tergantung pada panjang gelombang cahaya yang
diserap. Sinar ultraviolet dan sinar tampak akan menyebabkan elektron tereksitasi
ke orbital yang lebih tingi. Sistem yang bertanggung jawab terhadap absorpsi
cahaya disebut dengan kromofor (Dachriyanus, 2004). Kromofor merupakan
semua gugus atau atom dalam senyawa organik yang mampu menyerap sinar
ultraviolet dan sinar tampak (Rohman, 2007).
Hukum Lambert-Beer (Beer’s law) adalah hubungan linieritas antara
absorban dengan konsentrasi larutan analit. Biasanya hukum Lambert-Beer ditulis
A = ε. b. C
A = absorban (serapan)
ε = koefisien ekstingsi molar (M-1cm-1)
b = tebal kuvet (cm)
C = konsentrasi (M)
Pada beberapa buku ditulis juga:
A = E. b. C
E = koefisien ekstingsi spesifik (ml g-1cm-1)
b = tebal kuvet (cm)
C = konsentrasi (gram/100 ml)
Hubungan antara E dan ε adalah:
E=
massa molar 10. ε
Pada percobaan, yang terukur adalah transmitan (T), yang didefinisikan sebagai
berikut:
T = I/Io
I = intensitas cahaya setelah melewati sampel
Io = intensitas cahaya awal
Hubungan antara A dan T adalah:
A = -log T = -log (I/Io)
Jika absorbansi suatu seri konsentrasi larutan diukur pada panjang
gelombang, suhu, kondisi pelarut yang sama; dan absorbansi masing-masing
larutan diplotkan terhadap konsentrasinya maka suatu garis lurus akan teramati
Lambert-Beer dan jika garis yang dihasilkan merupakan suatu garis lurus maka dapat
dikatakan bahwa hukum Lambert-Beer dipenuhi pada kisaran konsentrasi yang
BAB III
METODE PENELITIAN
3.1 Alat
Alat-alat yang digunakan dalam penelitian ini adalah neraca listrik
(Sartorius), homogenizer mixer (Modifikasi), sentrifuge (Health), touch mixer
(Health), spektrofotometer ultraviolet (Shimadzu), stopwatch, politube,
mikropipet, pH meter, alat-alat gelas, satu set alat bedah, dan alat-alat lain yang
dibutuhkan.
3.2 Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah parasetamol
baku, aspirin baku, aquadest, natrium dihidrogen fosfat, dinatrium hidrogen fosfat,
natrium klorida, etanol, kloroform, es batu, usus halus kelinci.
3.3 Hewan Percobaan
Hewan yang digunakan adalah kelinci jantan dengan berat 1,5-2 kg.
3.4 Prosedur Kerja
3.4.1 Pembuatan aquadest bebas CO2
Aquadest dididihkan selama 5 menit atau lebih dan didiamkan sampai
dingin dan tidak boleh menyerap CO2 dari udara (Ditjen POM, 1995).
3.4.2 Pembuatan larutan natrium dihidrogenfosfat 0,8%
3.4.3 Pembuatan larutan dinatrium hidrogenfosfat 0,9%
Larutkan 0,9 g dinatrium hidrogenfosfat dalam aquadest bebas CO2 secukupnya hingga 100 ml (Ditjen POM, 1979).
3.4.4 Pembuatan larutan dapar fosfat pH 7,4 Isotonis
Campur 20,0 ml natrium dihidrogenfosfat 0,8% dengan 80,0 ml dinatrium
hidrogenfosfat 0,9% dan ditambahkan dengan 0,44 g/100 ml natrium klorida
(Ditjen POM, 1979) (Flowsheet dapat dilihat pada Lampiran 1).
3.4.5 Pembuatan larutan natrium klorida 0,9 %
Larutkan 0,9 g natrium klorida dalam aquadest hingga 100 ml (Ditjen
POM, 1995).
3.4.6 Pembuatan usus halus kelinci (Oryctolagus cuniculus) yang dihomogenkan
Hewan percobaan berupa kelinci jantan dipuasakan selama 20-24 jam.
Kemudian kelinci tersebut dianastesi, lalu dilakukan pembedahan pada bagian
perut tetapi jangan sampai mengenai tulang dada. Setelah usus halus dikeluarkan
dan dibersihkan bagian dalamnya dari kotoran dan bagian luar dari jaringan yang
mengikat pembuluh darah halus, dan sebagiannya dengan bantuan pinset dan
gunting, dan dicuci dengan natrium klorida fisiologis dingin. Lalu usus halus
ditimbang, dipotong kecil-kecil, dimasukkan kedalam alat homogenizer mixer dan
ditambahkan dapar fosfat pH 7,4 isotonis sebanyak 5 kali berat usus halus lalu
dihomogenkan. Dipipet 50 µl usus homogen dan dimasukkan kedalam politube
3.4.7 Pembuatan Larutan Induk Baku I (LIB I) parasetamol dalam dapar fosfat pH 7,4 isotonis
Timbang seksama 100 mg parasetamol baku dimasukkan ke dalam labu
tentukur 50 ml, dilarutkan dengan dapar fosfat pH 7,4 isotonis lalu ditambahkan
dapar fosfat pH 7,4 isotonis sampai garis tanda dan dikocok hingga homogen,
sehingga diperoleh konsentrasi 2000 mcg/ml (LIB I) (Flowsheet dapat dilihat
pada Lampiran 3).
3.4.8 Pembuatan Larutan Induk Baku II (LIB II) parasetamol dalam dapar fosfat pH 7,4 isotonis
Dari LIB I dipipet masing-masing 0,5 ml, 1 ml, 1,5 ml, 2 ml, 3,5 ml, 4,5 ml,
5,5 ml, 6,5 ml, 7,5 ml kemudian masukkan kedalam labu tentukur 10 ml,
ditambahkan dapar fosfat pH 7,4 isotonis sampai garis tanda hingga diperoleh
konsentrasi 100 mcg/ml, 200 mcg/ml, 300 mcg/ml, 400 mcg/ml, 700 mcg/ml, 900
mcg/ml, 1100 mcg/ml, 1300 mcg/ml, 1500 mcg/ml ( LIB II ) (Flowsheet dapat
dilihat pada Lampiran 4).
3.4.9 Pembuatan larutan obat parasetamol dengan berbagai konsentrasi
Ditimbang seksama 7,5 mg, 15,1 mg, 22,6 mg, 37,8 mg dan 75,5 mg
parasetamol baku, dimasukkan ke dalam labu tentukur 50 ml. Dilarutkan dengan
dapar fosfat pH 7,4 isotonis, dicukupkan sampai garis tanda hingga diperoleh
konsentrasi 1 mM, 2 mM, 3 mM, 5 mM dan 10 mM (Flowsheet dapat dilihat pada
Lampiran 5).
3.4.10 Pembuatan larutan obat aspirin dengan berbagai konsentrasi
Ditimbang seksama 0,9 mg, 2,7 mg dan 4,5 mg aspirin baku, dimasukkan
cukupkan sampai garis tanda hingga diperoleh konsentrasi 0,1 mM, 0,3 mM dan
0,5 mM (Flowsheet dapat dilihat pada Lampiran 6).
3.4.11 Penentuan kurva absorpsi parasetamol dalam usus halus kelinci yang dihomogenkan
Politube yang berisi 50µl usus halus homogen disimpan pada temperatur
0-40C dengan bantuan es yang dimasukkan kedalam bakerglass, kemudian diprainkubasi selama 3 menit pada temperature 27ºC. Lalu dilakukan percobaan
up take dengan cara memasukkan LIB I parasetamol dengan konsentrasi 2000
mcg/ml sebanyak 100 µl kedalam politube, dan dihomogenkan dengan bantuan
touch mixer (pencampur sentuh) kemudian diinkubasi selama 3 menit pada
temperatur 27ºC. Lalu ditambahkan etanol sebanyak 4 kali volume sampel, dicampur homogen dengan bantuan touch mixer (pencampur sentuh) dan
disentrifugasi selama 30 detik, 3000 rpm. Dipipet supernatan sebanyak 0,5 ml,
dimasukkan kedalam labu tentukur 10 ml dan ditambahkan dengan dapar fosfat
pH 7,4 isotonis sampai garis tanda. Kemudian diukur absorbansinya dengan
spektrofotometer uv pada panjang gelombang 200-400 nm (Flowsheet dapat
dilihat pada Lampiran 7).
3.4.12 Penentuan kurva kalibrasi parasetamol dalam usus halus kelinci yang dihomogenkan
Dilakukan perlakuan yang sama dengan melakukan percobaan up take
dengan cara memasukkan LIB II parasetamol dengan konsentrasi 100 mcg/ml,
200 mcg/ml, 300 mcg/ml, 400 mcg/ml, 700 mcg/ml, 900 mcg/ml, 1100 mcg/ml,
1300 mcg/ml, 1500 mcg/ml sebanyak 100µl kedalam politube. Kemudian
ditetapkan absorbansinya dengan spektrofotometer ultraviolet pada panjang
3.4.13 Penentuan absorpsi parasetamol dalam usus halus kelinci yang dihomogenkan
Dilakukan perlakuan yang sama dengan melakukan percobaan up take
dengan cara memasukkan larutan parasetamol dengan konsentrasi 1 mM sebanyak
100 µl kedalam politube, dan dihomogenkan dengan bantuan touch mixer
(pencampur sentuh) kemudian diinkubasi dengan variasi waktu 30 detik, 45 detik,
1 menit, 2 menit, 3 menit, 5 menit, 7 menit, 10 menit dan 15 menit pada
temperatur 27ºC. Kemudian diukur absorbansinya dengan spektrofotometer ultraviolet dengan panjang gelombang 243,5 nm. Diulangi perlakuan dengan
variasi konsentrasi 2 mM, 3 mM, 5 mM dan 10 mM (Flowsheet dapat dilihat pada
Lampiran 10).
3.4.14 Penentuan absorpsi parasetamol dalam usus halus kelinci yang dihomogenkan dengan penambahan aspirin
Dilakukan perlakuan yang sama dengan melakukan percobaan up take
dengan cara memasukkan larutan parasetamol dengan konsentrasi 1 mM sebanyak
100 µl kedalam politube lalu ditambahkan aspirin dengan konsentrasi 0,1 mM, 0,3
mM dan 0,5 mM ke dalam politube yang sama, dan dihomogenkan dengan
bantuan touch mixer (pencampur sentuh) kemudian diinkubasi dengan variasi
waktu 30 detik, 2 menit, dan 5 menit pada temperatur 27ºC. Kemudian diukur absorbansinya dengan spektrofotometer ultraviolet dengan panjang gelombang
243,5 nm. Diulangi perlakuan dengan variasi konsentrasi 2 mM, 3 mM, 5 mM dan
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Penentuan Panjang Gelombang Maksimum Parasetamol dalam Usus Halus Kelinci yang Dihomogenkan pada Dapar Fosfat pH 7,4 Isotonis
Hasil penentuan panjang gelombang maksimum parasetamol dalam usus
halus kelinci yang dihomogenkan pada dapar fosfat pH 7,4 isotonis yang
dilakukan pengukuran dengan menggunakan alat spektrofotometer uv adalah
243,5 nm (kurva absorbsi dapat dilihat pada Lampiran 8).
Panjang gelombang yang diperoleh dapat digunakan untuk pengukuran hasil
karena sudah berada pada rentang sinar ultraviolet spektrofotometer dengan
panjang gelombang 200 – 400 nm.
4.2 Hasil Penentuan Kurva Kalibrasi Parasetamol dalam Usus Halus Kelinci yang Dihomogenkan pada Dapar Fosfat pH 7,4 Isotonis
Hasil penentuan kurva kalibasi parasetamol dalam usus halus kelinci yang
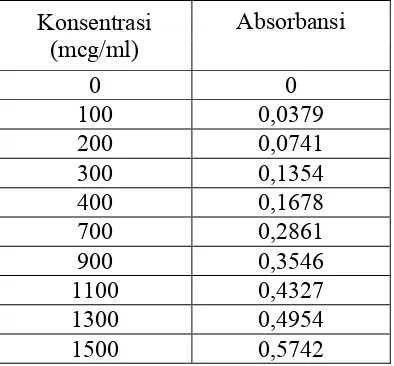
dihomogenkan pada dapar fosfat pH 7,4 isotonis dapat dilihat pada Tabel 4.1.
Tabel 4.1 Data kalibrasi parasetamol dalam usus halus kelinci yang dihomogenkan pada dapar fosfat pH 7,4 isotonis
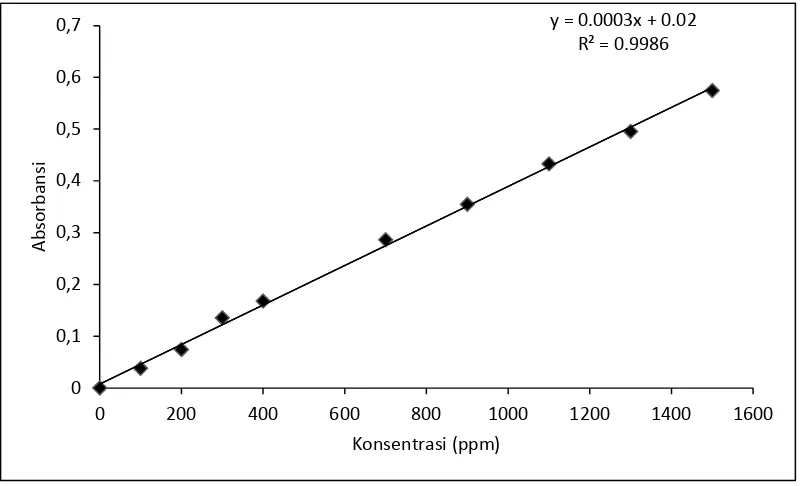
Dari data kalibrasi tersebut, diperoleh kurva kalibrasi yang dapat dilihat
pada Gambar 4.1.
Gambar 4.1 Kurva kalibrasi parasetamol dalam usus halus kelinci yang dihomogenkan pada dapar fosfat pH 7,4 isotonis
Dari gambar grafik di atas diperoleh hubungan yang linier antara
konsentrasi dengan absorbansi. Dengan peningkatan konsentrasi maka absorbansi
yang diperoleh juga semakin besar (perhitungan persamaan regresi dapat dilihat
pada Lampiran 12).
4.3 Penentuan Jumlah Parasetamol yang Diabsorpsi dalam Usus Halus Kelinci yang Dihomogenkan pada Dapar Fosfat pH 7,4 Isotonis
Pengujian jumlah parasetamol yang diabsorpsi dalam usus halus kelinci
yang dihomogenkan pada dapar fosfat pH 7,4 isotonis yang dilakukan secara
Jumlah parasetamol yang diabsorpsi pada konsentrasi 1 mM, 2 mM,
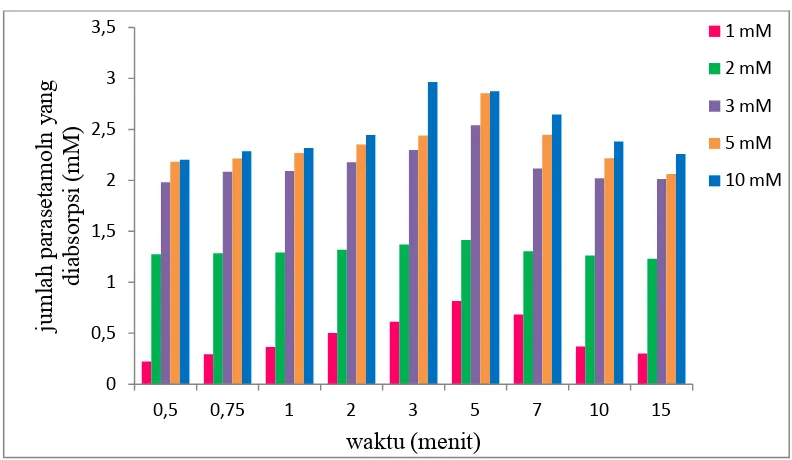
Dari Tabel 4.2 di atas, diperoleh grafik dengan menghubungkan jumlah
parasetamol yang diabsorpsi vs waktu yang dapat dilihat pada Gambar 4.2.
Pada Gambar 4.2 menunjukkan hubungan jumlah parasetamol yang
diabsorpsi vs waktu pada variasi konsentrasi terjadi peningkatan jumlah obat yang
diabsorpsi pada menit ke 3 dan menit ke 5 kemudian pada menit ke 7, menit ke 10
dan menit ke 15 mengalami penurunan. Hal ini disebabkan sel-sel usus halus
homogen yang digunakan sebagai medium absorpsi tidak optimal lagi sehingga
terjadi penurunan jumlah absorpsi parasetamol.
4.4 Penentuan Jumlah Parasetamol yang Diabsorpsi dalam Usus Halus Kelinci yang Dihomogenkan pada Dapar Fosfat pH 7,4 Isotonis dengan Penambahan Aspirin
Pengujian jumlah parasetamol yang diabsorpsi dalam usus halus kelinci
yang dihomogenkan pada dapar fosfat pH 7,4 isotonis yang dilakukan secara
uptake dengan waktu 0,5; 0,75; 1, 2, 3, 5, 10 dan 15 menit pada konsentrasi
1 mM, 2 mM, 3 mM, 5 mM dan 10 mM dengan penambahan aspirin 0,1 mM,
0,3 mM dan 0,5 mM pada waktu 0,75, 2 dan 5 menit.
Jumlah parasetamol yang diabsorpsi pada konsentrasi 1 mM, 2 mM, 3 mM,
5 mM dan 10 mM dengan penambahan aspirin 0,1 mM, 0,3 mM dan 0,5 mM pada
waktu 0,75, 2 dan 5 menit dapat dilihat pada Tabel 4.3.
Tabel 4.3 Jumlah parasetamol yang diabsorpsi pada konsentrasi 1 mM, 2 mM, 3 mM, 5 mM dan 10 mM dengan penambahan aspirin 0,1 mM, 0,3 mM dan 0,5 mM pada waktu 0,75, 2 dan 5 menit
Waktu
(menit) 1 mM 2 mM 3 mM 5 mM 10 mM
0,75 0,2026 1,2068 1,9867 2,1487 2,2012
2 0,3451 1,1950 1,9903 2,1816 2,2584
Dari Tabel 4.3 di atas, diperoleh grafik dengan menghubungkan jumlah
parasetamol yang diabsorpsi vs waktu yang dapat dilihat pada Gambar 4.3.
Gambar 4.3 Grafik jumlah parasetamol yang diabsorpsi vs waktu pada konsentrasi 1 mM, 2 mM, 3 mM, 5 mM dan 10 mM dengan penambahan aspirin 0,1 mM, 0,3 mM dan 0,5 mM pada waktu 0,75, 2 dan 5 menit
Pada Gambar 4.3 menunjukkan hubungan jumlah parasetamol yang
diabsorpsi dengan penambahan aspirin vs waktu pada variasi konsentrasi
mengalami penurunan pada menit ke 0,75, menit ke 2 dan menit ke 5. Hal ini
disebabkan aspirin bersifat lebih asam daripada parasetamol sehingga dapat
menghambat absorpsi parasetamol.
4.5 Perbandingan Jumlah Parasetamol yang Diabsorpsi dalam Usus Halus Kelinci yang Dihomogenkan Tanpa dan Dengan Penambahan Aspirin pada Waktu 0,75, 2 dan 5 menit
Perbandingan jumlah parasetamol yang diabsorpsi pada konsentrasi 1 mM,
konsetrasi 0,1 mM, 0,3 mM dan 0,5 mM pada waktu 0,75, 2 dan 5 menit dapat
dilihat pada Tabel 4.4.
Tabel 4.4 Perbandingan jumlah parasetamol yang diabsorpsi pada konsentrasi 1 mM, 2 mM, 3 mM, 5 mM dan 10 mM tanpa dan dengan penambahan aspirin dengan konsetrasi 0,1 mM, 0,3 mM dan 0,5 mM pada waktu 0,75, 2 dan 5 menit
Dari Tabel 4.4 di atas, diperoleh grafik dengan menghubungkan jumlah
parasetamol yang diabsorpsi vs waktu yang dapat dilihat pada Gambar 4.4.
4.5.2 Perbandingan jumlah parasetamol yang diabsorpsi pada konsentrasi 2 mM tanpa dan dengan penambahan aspirin
Perbandingan jumlah parasetamol yang diabsorpsi pada konsentrasi
2 mM tanpa dan dengan penambahan aspirin dengan konsetrasi 0,1 mM, 0,3 mM
dan 0,5 mM pada waktu 0,75, 2 dan 5 menit dapat dilihat pada Tabel 4.13.
Tabel 4.13 Perbandingan jumlah parasetamol yang diabsorpsi pada konsentrasi 2 mM tanpa dan dengan penambahan aspirin dengan konsetrasi 0,1 mM, 0,3 mM dan 0,5 mM pada waktu 0,75, 2 dan 5 menit
Waktu (menit)
Jumlah parasetamol yang diabsorpsi tanpa penambahan
aspirin (mM)
Jumlah parasetamol yang diabsorpsi dengan penambahan
aspirin (mM)
0,75 1,2833 1,2068
2 1,3208 1,1950
5 1,4134 1,2002
Dari Tabel 4.13 di atas, diperoleh grafik dengan menghubungkan jumlah
parasetamol yang diabsorpsi vs waktu yang dapat dilihat pada Gambar 4.13.
4.5.3 Perbandingan jumlah parasetamol yang diabsorpsi pada konsentrasi 3 mM tanpa dan dengan penambahan aspirin
Perbandingan jumlah parasetamol yang diabsorpsi pada konsentrasi
3 mM tanpa dan dengan penambahan aspirin dengan konsetrasi 0,1 mM, 0,3 mM
dan 0,5 mM pada waktu 0,75, 2 dan 5 menit dapat dilihat pada Tabel 4.14.
Tabel 4.14 Perbandingan jumlah parasetamol yang diabsorpsi pada konsentrasi 3 mM tanpa dan dengan penambahan aspirin dengan konsetrasi 0,1 mM, 0,3 mM dan 0,5 mM pada waktu 0,75, 2 dan 5 menit
Waktu (menit)
Jumlah parasetamol yang diabsorpsi tanpa penambahan
aspirin (mM)
Jumlah parasetamol yang diabsorpsi dengan penambahan
aspirin (mM)
0,75 2,0848 1,9867
2 2,1757 1,9903
5 2,5421 2,2547
Dari Tabel 4.14 di atas, diperoleh grafik dengan menghubungkan jumlah
parasetamol yang diabsorpsi vs waktu yang dapat dilihat pada Gambar 4.14.
4.5.4 Perbandingan jumlah parasetamol yang diabsorpsi pada konsentrasi 5 mM tanpa dan dengan penambahan aspirin
Perbandingan jumlah parasetamol yang diabsorpsi pada konsentrasi
5 mM tanpa dan dengan penambahan aspirin dengan konsetrasi 0,1 mM, 0,3 mM
dan 0,5 mM pada waktu 0,75, 2 dan 5 menit dapat dilihat pada Tabel 4.15.
Tabel 4.15 Perbandingan jumlah parasetamol yang diabsorpsi pada konsentrasi 5 mM tanpa dan dengan penambahan aspirin dengan konsetrasi 0,1 mM, 0,3 mM dan 0,5 mM pada waktu 0,75, 2 dan 5 menit
Waktu (menit)
Jumlah parasetamol yang diabsorpsi tanpa penambahan
aspirin (mM)
Jumlah parasetamol yang diabsorpsi dengan penambahan
aspirin (mM)
0,75 2,2151 2,1487
2 2,3505 2,1816
5 2,8537 2,5548
Dari Tabel 4.15 di atas, diperoleh grafik dengan menghubungkan jumlah
parasetamol yang diabsorpsi vs waktu yang dapat dilihat pada Gambar 4.15.
4.5.5 Perbandingan jumlah parasetamol yang diabsorpsi pada konsentrasi 10 mM tanpa dan dengan penambahan aspirin
Perbandingan jumlah parasetamol yang diabsorpsi pada konsentrasi
10 mM tanpa dan dengan penambahan aspirin dengan konsetrasi 0,1 mM, 0,3 mM
dan 0,5 mM pada waktu 0,75, 2 dan 5 menit dapat dilihat pada Tabel 4.16.
Tabel 4.16 Perbandingan jumlah parasetamol yang diabsorpsi pada konsentrasi 10 mM tanpa dan dengan penambahan aspirin dengan konsetrasi 0,1 mM, 0,3 mM dan 0,5 mM pada waktu 0,75, 2 dan 5 menit
Waktu (menit)
Jumlah parasetamol yang diabsorpsi tanpa penambahan
aspirin (mM)
Jumlah parasetamol yang diabsorpsi dengan penambahan
aspirin (mM)
0,75 2,2858 2,2012
2 2,4446 2,2584
5 2,8723 2,6072
Dari Tabel 4.16 di atas, diperoleh grafik dengan menghubungkan jumlah
parasetamol yang diabsorpsi vs waktu yang dapat dilihat pada Gambar 4.16.
4.6 Jumlah Parasetamol yang Diabsorpsi dalam Usus Halus Kelinci yang Dihomogenkan dengan Berbagai Konsentrasi pada Waktu 5 menit
Data konsentrasi parasetamol pada waktu 5 menit dapat dilihat pada Tabel
4.17.
Tabel 4.17 Data konsentrasi parasetamol pada waktu 5 menit
Variasi konsentrasi (mM)
Jumlah parasetamol yang diabsorpsi tanpa penambahan aspirin pada
waktu 5 menit
Jumlah parasetamol yang diabsorpsi dengan
penambahan aspirin pada waktu 5 menit
0 0 0
1 0,8170 0,5456
2 1,4134 1,2002
3 2,5421 2,2547
5 2,8537 2,5548
10 2,8723 2,6072
Dari Tabel 4.17 di atas, diperoleh grafik dengan menghubungkan jumlah
parasetamol yang diabsorpsi vs konsentrasi parasetamol yang dapat dilihat pada
Gambar 4.17.
Pada grafik (Gambar 4.12 – 4.16) menunjukkan perbandingan
jumlah parasetamol yang diabsorpsi tanpa dan dengan penambahan aspirin vs
waktu yang menunjukkan bahwa dengan penambahan aspirin terjadi absorpsi
yang lebih kecil dibandingkan dengan absorpsi parasetamol tanpa penambahan
aspirin.
Pada grafik (Gambar 4.17) menunjukkan hubungan antara jumlah obat
yang diabsorpsi dengan konsentrasi terlihat bahwa pada proses tersebut terdapat
jumlah maksimum pada konsentrasi tertentu. Ini membuktikan bahwa carier sudah
jenuh, sehingga tidak mungkin menampung atau mengikat senyawa lagi
(Poedjiadi, 1994). Selain itu, pada grafik (Gambar 4.17) juga memperlihatkan
perbandingan antara absorpsi parasetamol dengan penambahan aspirin dengan
absorpsi parasetamol tanpa penambahan aspirin, yang menunjukkan hasil yang
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Perbedaan konsentrasi parasetamol mempengaruhi jumlah absorpsi dalam usus
halus kelinci (Oryctolagus cuniculus) yang dihomogenkan pada dapar fosfat
pH 7,4 isotonis.
2. Aspirin dapat menurunkan absorpsi parasetamol dalam usus halus kelinci
(Oryctolagus cuniculus) yang dihomogenkan pada dapar fosfat pH 7,4
isotonis.
5.2 Saran
1. Disarankan kepada peneliti selanjutnya untuk membandingkan absorpsi
parasetamol pada usus halus kelinci (Oryctolagus cuniculus) yang
DAFTAR PUSTAKA
Abdou, H.M. (1989). Dissolution, Bioavailability and Bioequivalence. Pennsylvania: Mack Printing Company. Hal. 308-312.
Aiache, J.M., Ddevissaguet, J., dan Guyot H.A.M. (1993). Farmasetika 2 Biofarmasi. Edisi Kedua. Penerjemah: Widji Soeratri. Surabaya: Airlangga University Press. Hal. 35, 247, 238.
Ansel, H.C. (1989). Pengantar Bentuk Sediaan Farmasi. Edisi Keempat. Penerjemah: Farida Ibrahim. Jakarta: Penerbit Universitas Indonesia. Hal. 59.
Dachriyanus. (2004). Analisis Struktur Senyawa Organik Secara Spektroskopi. Padang: Andalas University Press. Hal. 1, 5, 8, 9.
Deferme, S., Annaert, P., dan Augustijns, P. (2008). In Vitro Screening Models to Asses Intestinal Drug Absorption and Metabolism. New York: Biomedical and Life Sciences. Hal. 184.
Ditjen POM. (1979). Farmakope Indonesia. Edisi Ketiga. Jakarta: Departemen Kesehatan RI. Hal. 37.
Ditjen POM. (1995). Farmakope Indonesia. Edisi Keempat. Jakarta: Departemen Kesehatan RI. Hal. 1124, 1154, 1157, 1195.
Fawcett, D.W. (1994). Buku Ajar Histologi. Edisi Keduabelas. Alih Bahasa: Jan Tambayong. Jakarta: Buku Kedokteran EGC. Hal. 552-553.
Joenoes, N.Z. (2002). Ars Prescribendi – Penulisan Resep Yang Rasional. Cetakan Ketiga. Surabaya: Airlangga University Press. Hal. 27, 33-46.
Lisa, R.H. (2011). Pengaruh Absorpsi Asam Mefenamat dengan Berbagai Konsentrasi pada Usus Halus Kelinci yang Dihomogenkan. Medan: Universitas Sumatera Utara. Hal. 32.
Moffat, A.C., Jackson, J.V., Moss, M.S., dan Widdop, B. (1986). Clarke’s Isolation and Identification of Drugs. Edisi Kedua. London: The Pharmaceutical Press. Hal. 697.
Poedjiadi, A. (1994). Dasar-Dasar Biokimia. Jakarta: UI-Press. Hal: 146.
Shargel, L., dan Yu, A.B.C. (1988). Biofarmasetika dan Farmakokinetika Terapan. Edisi Kedua. Penerjemah: Fasich dan Siti Sjamsiah. Surabaya: Airlangga University Press. Hal. 88, 136.
Siswandono, M.S., dan Soekarjo, B. (1995). Kimia Medisinal. Edisi Kedua. Surabaya: Airlangga University Press. Hal. 21-23.
Syukri, Y. (2002). Biofarmasetika. Yogyakarta: UI Press. Hal. 7, 10-18.
Sweetman, S.C. (2005). Martindale The Complete Drug Reference. Edisi Ketigapuluh empat. London: Pharmaceutical Press. Hal. 46, 51.
Wilmana, P.F. (1995). Farmakologi dan Terapi. Edisi Keempat. Jakarta: Gaya Baru. Hal. 214.
Tamai, I., Ling, H.Y., Simanjuntak, M.T., Nishikido, J., dan Tsuji, A. (1987). Stereospesific Absorption and Degradation of Cephalexin. Journal Pharmacy and Pharmacology. Hal. 320-324.
LAMPIRAN
Lampiran 1. Flowsheet pembuatan larutan dapar fosfat pH 7,4 isotonis
ditimbang 0,8 g ditimbang 0,9 g
dilarutkan dengan 100 ml aquadest dilarutkan dengan
bebas CO2 100 ml aquadest
bebas CO2
dipipet 20 ml dipipet 80 ml
ditambahkan 0,44 g/100 ml NaCl
diaduk sampai larut dan dihomogenkan Natrium
dihidrogen fosfat
Dinatrium hidrogen fosfat
campuran
Lampiran 2.Flowsheet pembuatan usus halus homogen
dipuasakan selama 20-24 jam
dianastesi
dibedah pada bagian perut tetapi jangan sampai mengenai tulang dada
dibersihkan bagian dalam dan bagian luarnya
dicuci dengan NaCl fisiologis dingin
ditimbang
dipotong kecil-kecil
dimasukkan kedalam alat homogenizer mixer
ditambahkan dapar fosfat pH 7,4 isotonis dingin sebanyak 5 kali berat usus halus
dihomogenkan
dipipet 50 µl
dimasukkan kedalam politube
disimpan pada temperature 0-40C dengan bantuan es Kelinci jantan
Usus halus
Usus halus homogen
Lampiran 3. Flowsheet pembuatan LIB I parasetamol dalam dapar fosfat pH 7,4 isotonis
dimasukkan kedalam labu tentukur 50 ml
dilarutkan dengan dapar fosfat pH 7,4 isotonis
ditambahkan dapar fosfat pH 7,4 isotonis sampai garis tanda
dikocok homogen 100 mg parasetamol
Lampiran 4. Flowsheet pembuatan LIB II parasetamol dalam dapar fosfat pH 7,4 isotonis
dipipet masing-masing 0,5 ml; 1 ml; 1,5 ml; 2 ml; 3,5 ml; 4,5 ml; 5,5 ml; 6,5 ml dan 7,5 ml
dimasukkan kedalam labu tentukur 10 ml
ditambahkan dapar fosfat pH 7,4 isotonis sampai garis tanda
dikocok homogen
LIB I parasetamol
LIB II dengan konsentrasi 100 mcg/ml, 200 mcg/ml, 300 mcg/ml, 400 mcg/ml, 700 mcg/ml, 900 mcg/ml,
Lampiran 5. Flowsheet pembuatan larutan parasetamol dengan berbagai konsentrasi
dimasukkan masing-masing ke dalam labu tentukur 50 ml
dilarutkan dengan dapar fosfat pH 7,4 isotonis
dicukupkan dengan dapar fosfat pH 7,4 isotonis sampai garis tanda
dikocok sampai homogen 7,5 mg; 15,1 mg; 22,6 mg; 37,8
mg; 75,5 mg parasetamol baku
Larutan parasetamol dengan konsentrasi 1 mM, 2 mM, 3 mM,
Lampiran 6. Flowsheet pembuatan larutan aspirin dengan berbagai konsentrasi
dimasukkan masing-masing ke dalam labu tentukur 50 ml
dilarutkan dengan dapar fosfat pH 7,4 isotonis
dicukupkan dengan dapar fosfat pH 7,4 isotonis sampai garis tanda
dikocok sampai homogen 0,9 mg; 2,7 mg, 4,5 mg
aspirin baku
Lampiran 7. Flowsheet penentuan kurva absorpsi parasetamol dalam usus halus kelinci yang dihomogenkan
disimpan pada temperatur 0-40C dengan bantuan es diprainkubasikan selama 3 menit pada suhu kamar
dimasukkan 100 µl LIB I kedalam politube
dihomogenkan dengan touch mixer
diinkubasi selama 3 menit pada suhu kamar
ditambahkan etanol sebanyak 4 kali volume sampel
dihomogenkan dengan touch mixer
disentrifuse selama 30 detik, 3000 rpm
dipipet 0,5 ml
dimasukkan kedalam labu tentukur 10 ml cukupkan dengan dapar fosfat pH 7,4 isotonis dingin
diukur absorbansinya pada panjang gelombang 200-400 nm
Supernatan Endapan
(dibuang)
Panjang gelombang maksimum
Lampiran 9.Flowsheetpenentuan kurva kalibrasi parasetamol dalam usus halus kelinci yang dihomogenkan
disimpan pada temperature 0-40C dengan bantuan es diprainkubasi selama 3 menit
dimasukkan 100 µl LIB II kedalam politube
dihomogenkan dengan touch mixer
diinkubasi selama 3 menit pada temperatur 270C ditambahkan etanol sebanyak 4 kali volume sampel
dihomogenkan dengan touch mixer
disentrifuse selama 30 detik, 3000 rpm
dipipet 0,5 ml
dimasukkan kedalam labu tentukur 10 ml
cukupkan dengan dapar fosfat pH 7,4 isotonis dingin sampai garis tanda
diukur absorbansinya dengan spektrofotometer pada λ 243,5 nm 50µl Usus halus homogen
Supernatan Endapan
(dibuang)
Lampiran 10. Flowsheet penentuan absorpsi parasetamol dalam usus halus kelinci yang dihomogenkan
disimpan pada temperatur 0-40C dengan bantuan es diprainkubasi selama 3 menit
dimasukkan 100 µl larutan obat berbagai konsentrasi kedalam politube
dihomogenkan dengan touch mixer
diinkubasi selama 3 menit pada suhu kamar
diinkubasi dengan variasi waktu 0,5 menit, 0,75 menit, 1 menit, 2 menit, 3 menit, 5 menit, 7 menit, 10 menit dan 15 menit
ditambahkan etanol sebanyak 4 kali volume sampel
dihomogenkan dengan touch mixer
disentrifuse selama 30 detik, 3000 rpm
dipipet 0,5 ml
dimasukkan kedalam labu tentukur 10 ml
cukupkan dengan dapar fosfat pH 7,4 isotonis dingin sampai garis tanda
diukur absorbansinya dengan spektrofotometer pada λ 243,5 nm
Supernatan Endapan
(dibuang)
Hasil
Lampiran 11. Flowsheet penentuan absorpsi parasetamol dengan penambahan aspirin dalam usus halus kelinci yang dihomogenkan
disimpan pada temperatur 0-40C dengan bantuan es diprainkubasi selama 3 menit
dimasukkan 100 µl larutan obat parasetamol berbagai konsentrasi kedalam politube
dimasukkan 100 µl larutan aspirin berbagai konsentrasi ke dalam politube yang sama
dihomogenkan dengan touch mixer
diinkubasi selama 3 menit pada suhu kamar
diinkubasi dengan variasi waktu 0,75 menit, 2 menit dan 5 menit
ditambahkan etanol sebanyak 4 kali volume sampel
dihomogenkan dengan touch mixer
disentrifuse selama 30 detik, 3000 rpm
dipipet 0,5 ml
dimasukkan kedalam labu tentukur 10 ml
cukupkan dengan dapar fosfat pH 7,4 isotonis dingin sampai garis tanda
diukur absorbansinya dengan spektrofotometer pada λ 243,5 nm
Supernatan Endapan
(dibuang)
Hasil
Lampiran 12. Penentuan persamaan regresi dan kurva kalibrasi parasetamol pada usus halus kelinci yang dihomogenkan dalam dapar fosfat pH 7,4 isotonis
700 0,2861 490000 0,08185321 200,2700
900 0,3546 810000 0,12574116 319,1400
1100 0,4327 1210000 0,18722929 475,9700
1300 0,4954 1690000 0,24542116 644,0200
1500 0,5742 2250000 0,32970564 861,3000
Σx = 6500 Σy = 2,5582 Σ x
b = 0,25582– (0,0003)(650)
b = 0,0200
Jadi, persamaan regresi adalah y = 0,0003x + 0,0200
Lampiran 13. Contoh perhitungan konsentrasi larutan obat parasetamol 2 mM
Contoh perhitungan konsentrasi larutan obat parasetamol dengan
menggunakan rumus sebagai berikut sehingga diperoleh konsentrasi 2 mM :
V x BM
mg
C = 1000
50 1000 16
, 151
11 , 15
x C =