HUBUNGAN PERMEABILITAS BEBERAPA OBAT YANG MEMPUNYAI SATU GUGUS ASAM KARBOKSILAT
TERHADAP LAJU ABSORPSI PADA USUS HALUS YANG DIHOMOGENKAN
SKRIPSI
OLEH:
FANNY FERLIANY SIMANJUNTAK NIM 040804040
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2008
HUBUNGAN PERMEABILITAS BEBERAPA OBAT YANG MEMPUNYAI SATU GUGUS ASAM KARBOKSILAT
TERHADAP LAJU ABSORPSI PADA USUS HALUS YANG DIHOMOGENKAN
SKRIPSI
Diajukan Untuk Melengkapi Salah Satu Syarat Untuk Mencapai Gelar Sarjana Farmasi Pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH
FANNY FERLIANY SIMANJUNTAK NIM 040804040
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2008
Lembar Pengesahan Skripsi
HUBUNGAN PERMEABILITAS DARI BEBERAPA OBAT YANG MEMPUNYAI SATU GUGUS ASAM KARBOKSILAT
TERHADAP LAJU ABSORPSI PADA USUS HALUS YANG DIHOMOGENKAN
OLEH
FANNY FERLIANY SIMANJUNTAK NIM 040804040
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada tanggal: Desember 2008
Pembimbing I, Panitia Penguji,
(Drs. Syahrial Yoenoes, SU., Apt.) (Prof. Dr. Urip Harahap, Apt.) NIP 131 286 001 NIP 131 283 720
(Drs. Syahrial Yoenoes, SU., Apt.) Pembimbing II, NIP 131 286 001
(Prof. Dr. M. T. Simanjuntak, MSc., Apt.) (Dr. Karsono, Apt.) NIP 130 809 699 NIP 131 415 891
(Dra. Azizah Nasution, MSc., Apt.) NIP 130 810 737
Dekan,
(Prof. Dr. Sumadio Hadisahputra, Apt.) NIP 131 238 716
KATA PENGANTAR
Puji syukur kepada Tuhan Yang Maha Kuasa yang hanya oleh karena berkat dan kasih karunia yang berlimpah sehingga penulis dapat menjalani masa perkuliahan dan penelitian hingga akhirnya menyelesaikan penyusunan skripsi ini dengan baik.
Penulis mengucapkan terima kasih yang sebesar-besarnya kepada Ayahanda Wilson Simanjuntak dan Ibunda Yosfenny Paruliana br Hutagalung, abang-abang tercinta (Fernando Simanjuntak dan Fredrik Simanjuntak), juga ompung dan tante yang telah sabar dan setia memberikan dukungan, doa, semangat, dan materil selama perkuliahan hingga penyelesaian skripsi ini.
Penulis juga mengucapkan terima kasih yang sebesar-besarnya kepada: 1. Bapak Drs. Syahrial Yoenoes, SU., Apt. dan Bapak Prof. Dr. M. T.
Simanjuntak, MSc., Apt., selaku dosen pembimbing yang telah membimbing penulis dengan kesabaran dari awal penelitian hingga menyelesaikan penyusunan skripsi ini.
2. Bapak Drs. Nahitma Ginting, MSi., Apt., selaku penasehat akademik yang telah memberikan motivasi dan bimbingan selama perkuliahan.
3. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku dekan Fakultas Farmasi yang telah meyediakan fasilitas kepada penulis selama perkuliahan di Fakultas Farmasi.
4. Bapak dan Ibu penguji yang telah memberikan kritik dan saran demi kesempurnaan skripsi ini.
5. Dosen-dosen di Fakultas Farmasi yang telah membimbing penulis selama perkuliahan sehingga dapat meyelesaikan skripsi ini.
6. Teman-teman kelompok kecil ”VALORIE”: Kak Eka, Yessy, Lowysa, dan Trisna, atas kebersamaan, dukungan, semangat dan saling berbagi satu sama lain.
7. Rekan-rekan penelitian: bang Jonson, Lambok, dan kak Rikha, yang telah membantu penulis dalam pelaksanaan penelitian.
8. Teman-teman stambuk 2004, khususnya “KANTIN” dan “KAPAS” (“OMNIPRESENT”) atas dukungan semangat dan kebersamaan selama perkuliahan hingga selesainya penulisan skripsi ini.
9. Abang, kakak, dan adik-adik Fakultas Farmasi atas dukungan dan semangat penulisan skripsi ini.
Penulis menyadari sepenuhnya bahwa skripsi ini masih memiliki banyak kekurangan. Oleh sebab itu dengan segala kerendahan hati penulis mengharapkan kritik dan saran yang membangun pada skripsi ini. Akhirnya penulis berharap semoga skripsi ini dapat menjadi sumbangan yang bermanfaat bagi ilmu pengetahuan pada umumnya dan ilmu farmasi pada khususnya.
Medan, Desember 2008 Penulis,
Fanny Ferliany Simanjuntak
ABSTRAK
Telah dilakukan penelitian mengenai hubungan permeabilitas beberapa obat yang mempunyai satu gugus asam karboksilat terhadap laju absorpsi pada usus halus kelinci yang dihomogenkan, yang mana tediri dari dua rancangan percobaan yaitu penentuan log P dan penentuan laju absorpsi dengan menggunakan asam mefenamat, ibuprofen, dan ketoprofen sebagai sampel. Penetapan kadar obat menggunakan spektrofotometer ultraviolet. Penentuan log P menggunakan kloroform jenuh dapar fosfat pH 7,4 dan dapar fosfat pH 7,4 jenuh kloroform. Penentuan laju absorpsi menggunakan dapar fosfat pH 7,4. Kedua percobaan ini menggunakan larutan obat dengan konsentrasi 0,002 M pada temperatur kamar. Data yang diperoleh dianalisis dengan menggunakan analisis varians (ANAVA) dan uji beda nyata.
Tujuan dari penelitian ini adalah untuk mengetahui hubungan antara struktur kimia dengan permeabilitas dan juga untuk mengetahui hubungan antara permeabilitas dengan laju absorpsi pada usus halus yang dihomogenkan dari beberapa obat yang mempunyai satu gugus asam karboksilat.
Hasil penelitian menunjukkan bahwa hubungan struktur kimia berbanding lurus dengan permeabilitasnya, tergantung pada gugus hidrofilik dan lipofilik yang dimiliki oleh senyawa obat tersebut.
Hasil penelitian juga menunjukkan hubungan permeabilitas dari ketiga obat tersebut berbanding terbalik dengan laju absorpsi yang dilakukan pada temperatur kamar.
ABSTRACT
The research about relationship between permeability of some drugs having one carboxylic acid group to absorption rate at rabbit’s intestinal homogenated, which consist of two experimental designs that is determination of logarithm of P and determination of absorption rate by using mefenamic acid, ibuprofen, and ketoprofen as samples has been conducted. The concentration of drugs was determined by ultraviolet spectrofotometric. Determination of logarithm of P used chloroform saturated buffer phosphate solution pH 7.4 and buffer phosphate solution pH 7.4 saturated chloroform. The determination of absorption rate used buffer phosphate solution pH 7.4 . Both of this experimental used drugs solution with concentration 0.002 M at room temperature. The experimental data was analyzed by Analysis of Variance (ANOVA) and Least Significant Difference (LSD).
The aim of this research is to know the relationship between chemical structure with permeability and to know the relationship between permeability with absorption rate at intestinal homogenated of some drugs having one carboxylic acid group.
The result of research showed that relationship between chemistry structure linear with its permeability, depends on hidrophylic and lipophylic groups had by drug compound.
The result of research also showed that relationship permeability from three drugs inversely proportional with absorption rate done at room temperature.
DAFTAR ISI
Halaman
JUDUL ... i
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... ... vii
DAFTAR ISI ... viii
DAFTAR TABEL...xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvi
BAB I. PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 4
BAB II. TINJAUAN PUSTAKA ... 5
2.1 Uraian Bahan ... 5
2.1.1 Asam Mefenamat ... 5
2.1.2 Ibuprofen ... 6
2.1.3 Ketoprofen ... 7
2.2 Absorpsi ... 8
2.2.1 Faktor-faktor yang mempengaruhi absorpsi obat ... 10
2.2.2 Mekanisme Lintas Membran ... 10
2.3 Permeabilitas ... 16
2.4 Membran Sel ... 18
2.5 Usus Halus ... 20
2.6 Spektrofotometri Ultraviolet-visibel ... 21
BAB III. METODE PENELITIAN ... 24
3.1 Alat dan Bahan ... 24
3.1.1 Alat ... ...24
3.1.2 Bahan ... 24
3.2 Hewan Percobaan ... ... 24
3.3 Prosedur ... 24
3.3.1 Pembuatan Air Bebas Karbondioksida ... 25
3.3.2 Pembuatan Larutan Kalium dihidrogenfosfat 0,2 M... 25
3.3.3 Pembuatan Larutan Natrium Hidroksida 0,2 N ... 25
3.3.4 Pembuatan Larutan Natrium Hidroksida 0,1 N... 25
3.3.5 Pembuatan Larutan Dapar Fosfat pH 7,4 ... 25
3.3.6 Pembuatan Larutan Natrium Klorida Fisiologis ... ... 25
3.3.7 Pembuatan Indikator Fenolftalein ... 25
3.3.8 Pembuatan Etanol Netral……...26
3.3.9 Pembakuan Larutan Natrium Hidroksida 0,1 N ... 26
3.3.10 Penetapan Kadar Asam Mefenamat……...26
3.3.11 Penetapan Kadar Ibuprofen ... 26
3.3.12 Penetapan Kadar Ketoprofen ...26
3.3.13 Pembuatan Pelarut Kloroform Jenuh Dapar Fosfat pH 7,4 dan Dapar Fosfat pH 7,4 Jenuh Kloroform………...27
3.3.14 Pembuatan Larutan Induk Baku Asam Mefenamat dalam Kloroform Jenuh Dapar Fosfat pH 7,4 ... ...27 3.3.14.1 Pembuatan Larutan Induk Baku I ... 27 3.3.14.2 Pembuatan Larutan Induk Baku II ... 27
3.3.15 Penentuan Kurva Absorpsi Asam Mefenamat dalam
Kloroform Jenuh Dapar Fosfat pH 7,4 ... 27 3.3.16 Penentuan Kurva Kalibrasi Asam Mefenamat dalam
Kloroform Jenuh Dapar Fosfat pH 7,4 ... 28 3.3.17 Pembuatan Larutan Induk Baku Asam Mefenamat dalam
Dapar Fosfat pH 7,4 Jenuh Kloroform ... 28 3.3.17.1 Pembuatan Larutan Induk Baku I ... 28 3.3.17.2 Pembuatan Larutan Induk Baku II ... 28 3.3.18 Penentuan Kurva Absorpsi Asam Mefenamat dalam
Dapar Fosfat pH 7,4 Jenuh Kloroform ... 29 3.3.19 Penentuan Kurva Kalibrasi Asam Mefenamat dalam
Dapar Fosfat pH 7,4 Jenuh Kloroform ... 29 3.3.20 Pembuatan Larutan Induk Baku Ibuprofen dalam
Kloroform Jenuh Dapar Fosfat pH 7,4 ... 29 3.3.21 Penentuan Kurva Absorpsi Ibuprofen dalam Kloroform
Jenuh Dapar Fosfat pH 7,4 ... 29 3.3.22 Penentuan Kurva Kalibrasi Ibuprofen dalam Kloroform
Jenuh Dapar Fosfat pH 7,4 ... 30 3.3.23 Pembuatan Larutan Induk Baku Ibuprofen dalam
Dapar Fosfat pH 7,4 Jenuh Kloroform ... 30 3.3.23.1 Pembuatan Larutan Induk Baku I ...30 3.3.23.2 Pembuatan Larutan Induk Baku II ... 30 3.3.24 Penentuan Kurva Absorpsi Ibuprofen dalam Dapar Fosfat pH
7,4 Jenuh Kloroform ... 30 3.3.25 Penentuan Kurva Kalibrasi Ibuprofen dalam Dapar Fosfat
pH 7,4 Jenuh Kloroform ... 31
3.3.26 Pembuatan Larutan Induk Baku Ketoprofen dalam
Kloroform Jenuh Dapar Fosfat pH 7,4 ... 31
3.3.26.1 Pembuatan Larutan Induk Baku I ...31
3.3.26.2 Pembuatan Larutan Induk Baku II ... 31
3.3.27 Penentuan Kurva Absorpsi Ketoprofen dalam Kloroform Jenuh Dapar Fosfat pH 7,4 ... 31
3.3.28 Penentuan Kurva Kalibrasi Ketoprofen dalam Kloroform Jenuh Dapar Fosfat pH 7,4 ... 32
3.3.29 Pembuatan Larutan Induk Baku Ketoprofen dalam Dapar Fosfat pH 7,4 Jenuh Kloroform ... 32
3.3.29.1 Pembuatan Larutan Induk Baku I ... 32
3.3.29.2 Pembuatan Larutan Induk Baku II ... 32
3.3.30 Penentuan Kurva Absorpsi Ketoprofen dalam Dapar Fosfat pH 7,4 Jenuh Kloroform... 32
3.3.31 Penentuan Kurva Kalibrasi Ketoprofen dalam Dapar Fosfat pH 7,4 Jenuh Kloroform ... 33
3.3.32 Penetapan Log P ... 33
3.3.32.1 Pembuatan Larutan Obat ... 33
3.3.32.2 Percobaan ………...…………...….... 33
3.3.33 Pembuatan Usus Halus Yang Dihomogenkan ...34
3.3.34 Pembuatan Larutan Induk Baku Asam Mefenamat dalam Dapar Fosfat pH 7,4 ... 34
3.3.35 Penentuan Kurva Absorpsi Asam Mefenamat dalam Dapar Fosfat pH 7,4 ... 34
3.3.36 Penentuan Kurva Kalibrasi Asam Mefenamat dalam Dapar Fosfat pH 7,4 ... 34
3.3.37 Penentuan Waktu Up take Asam Mefenamat dalam Usus Halus yang Dihomogenkan ... 35
3.3.38 Penentuan Kurva Kalibrasi Asam Mefenamat dalam Usus Halus yang Dihomogenkan ... 35
3.3.39 Pembuatan Larutan Induk Baku Ibuprofen dalam
Dapar Fosfat pH 7,4 ... 36
3.3.40 Penentuan Kurva Absorpsi Ibuprofen dalam Dapar Fosfat pH 7,4 ... 36
3.3.41 Penentuan Kurva Kalibrasi Ibuprofen dalam Dapar Fosfat pH 7,4 ...36
3.3.42 Penentuan Waktu Up Take Ibuprofen dalam Usus Halus yang Dihomogenkan ………... 36
3.3.43 Penentuan Kurva Kalibrasi Ibuprofen dalam Usus Halus yang Dihomogenkan ………...………... 37
3.3.44 Pembuatan Larutan Induk Baku Ketoprofen dalam Dapar Fosfat pH 7,4 ... 38
3.3.45 Penentuan Kurva Absorpsi Ketoprofen dalam Dapar Fosfat pH 7,4 ... 38
3.3.46 Penentuan Kurva Kalibrasi Ketoprofen dalam Dapar Fosfat pH 7,4 ... ....38
3.3.47 Penentuan Waktu Up Take Ketoprofen dalam Usus Halus yang Dihomogenkan ... 38
3.3.48 Penentuan Kurva Kalibrasi Ketoprofen dalam Usus Halus yang Dihomogenkan ... 39
3.3.49 Penentuan Laju Absorpsi ... 39
3.3.49.1 Penyiapan Larutan Obat ...39
3.3.49.2 Percobaan ... 40
3.3.50 Analisis data...40
BAB IV. HASIL DAN PEMBAHASAN ...41
4.1 Hasil Penentuan Normalitas NaOH...41
4.2 Hasil Penetapan Kadar Asam Mefenamat...41
4.3 Hasil Penetapan Kadar Ibuprofen……….41
4.4 Hasil Penetapan Kadar Ketoprofen...42
4.5 Hasil Penentuan Panjang gelombang Maksimum Asam Mefenamat, Ibuprofen dan Ketoprofen dalam
Kloroform Jenuh Dapar Fosfat pH 7,4...42
4.6 Hasil Penentuan Panjang gelombang Maksimum Asam Mefenamat, Ibuprofen dan Ketoprofen dalam Dapar Fosfat pH 7,4 Jenuh Kloroform...42
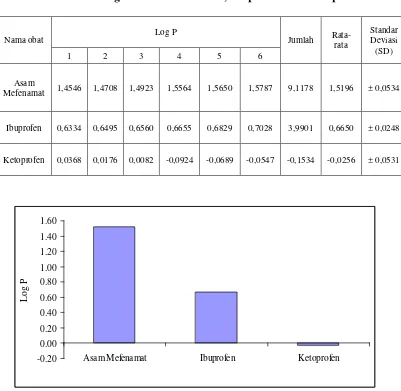
4.7 Hasil penentuan Log P Asam Mefenamat, Ibuprofen dan Ketoprofen...43
4.8 Hasil penentuan Log D Asam Mefenamat, Ibuprofen dan Ketoprofen...45
4.9 Hubungan Struktur Kimia dengan Permeabilitas Asam Mefenamat, Ibuprofen, dan Ketoprofen...46
4.10 Hasil Penentuan Panjang gelombang Maksimum Asam Mefenamat, Ibuprofen dan Ketoprofen dalam Dapar Fosfat pH 7,4... 47
4.11 Hasil Penentuan Kurva Kalibrasi Asam Mefenamat, Ibuprofen, dan Ketoprofen dalam Usus Halus yang Dihomogenkan pada Temperatur Kamar; pH 7,4...47
4.12 Hasil Pengukuran Laju Absorpsi Asam Mefenamat, Ibuprofen, dan Ketoprofen pada Usus Halus yang Dihomogenkan; Temperatur Kamar; pH 7,4...47
4.13 Hubungan antara permeabilitas dengan Laju Absorpsi Asam Mefenamat, Ibuprofen, dan Ketoprofen pada Usus halus yang Dihomogenkan...50
BAB V. KESIMPULAN DAN SARAN ... 52
5.1 Kesimpulan ... 52
5.2 Saran ... 52
DAFTAR PUSTAKA ... 53
LAMPIRAN ... 55
DAFTAR TABEL
Halaman Tabel 1. Data Log P Asam Mefenamat, Ibuprofen dan Ketoprofen... 43 Tabel 2. Data Nilai Log D Asam Mefenamat, Ibuprofen dan Ketoprofen... 45 Tabel 3. Data Konsentrasi Asam Mefenamat dalam 50 µl Usus Halus yang
Dihomogenkan dengan Konsentrasi 480 mcg/ml; Temperatur Kamar; pH 7,4... 48 Tabel 4. Data Konsentrasi Ibuprofen dalam 50 µl Usus Halus yang
Dihomogenkan dengan Konsentrasi 420 mcg/ml;
Temperatur Kamar; pH 7,4 ... 48 Tabel 5. Data Konsentrasi Ketoprofen dalam 50 µl Usus Halus yang
Dihomogenkan dengan Konsentrasi 500 mcg/ml; Temperatur Kamar; pH 7,4... 49
DAFTAR GAMBAR
Halaman
Gambar 1. Rumus bangun Asam Mefenamat ... 5
Gambar 2. Rumus Bangun Ibuprofen ... 6
Gambar 3. Rumus Bangun Ketoprofen ... 7
Gambar 4. Fase Biofarmasetik Obat ... 9
Gambar 5. Transpor trans membran transpor konvektif ... 11
Gambar 6. Transpor trans membran difusi pasif ... 13
Gambar 7. Transpor trans membran transpor aktif ... 14
Gambar 8. Transpor trans membran transpor yang dipermudah ... 15
Gambar 9. Transpor trans membran pinositosis ...15
Gambar 10. Transpor trans membran transpor pasangan ion ... 16
Gambar 11. Usus Halus ... 20
Gambar 12. Grafik Log P Asam Mefenamat, Ibuprofen dan Ketoprofen ... 43
Gambar 13. Grafik Log D Asam Mefenamat, Ibuprofen dan Ketoprofen...45
Gambar 14. Grafik Konsentrasi Asam mefenamat, Ibuprofen, dan Ketoprofen dalam usus Halus yang Dihomogenkan dengan Konsentrasi 0,002 M; Temperatur Kamar; pH 7,4...49
Gambar 15. Grafik Hubungan antara permeabilitas dengan Laju Absorpsi Asam Mefenamat, Ibuprofen, dan Ketoprofen pada Usus halus yang Dihomogenkan... .. 50
DAFTAR LAMPIRAN
Halaman Lampiran 1. Diagram Rancangan Percobaan ...55 Lampiran 2. Flowsheet Pembakuan Larutan Natrium Hidroksida 0,1 N... 56 Lampiran 3. Contoh Perhitungan Penentuan Normalitas NaOH pada
Penetapan Kadar Asam Mefenamat...57 Lampiran 4. Contoh Perhitungan Penentuan Normalitas NaOH pada
Penetapan Kadar Ibuprofen...58 Lampiran 5. Contoh Perhitungan Penentuan Normalitas NaOH pada
Penetapan Kadar Ketoprofen...59 Lampiran 6. Flowsheet Penetapan Kadar Bahan Obat secara Titrasi Semi
Bebas Air... 60 Lampiran 7. Contoh Perhitungan Penetapan kadar Asam Mefenamat secara
Titrasi Semi Bebas Air ... 61 Lampiran 8. Contoh Perhitungan Penetapan kadar Ibuprofen secara Titrasi
Semi Bebas Air ... 62 Lampiran 9. Contoh Perhitungan Penetapan kadar Ketoprofen secara Titrasi
Semi Bebas Air ... 63 Lampiran 10. Flowsheet Pembuatan Pelarut Kloroform Jenuh Dapar Fosfat
pH 7,4 dan Dapar Fosfat pH 7,4 Jenuh Kloroform ... 64 Lampiran 11. Flowsheet Pembuatan Larutan Induk Baku Asam Mefenamat
dalam Kloroform Jenuh Dapar Fosfat pH 7,4 ... 65 Lampiran 12. Flowsheet Penentuan Kurva Absorpsi Asam Mefenamat dalam
Kloroform Jenuh Dapar Fosfat pH 7,4 ... 66 Lampiran 13. Kurva absorpsi Asam Mefenamat dalam kloroform jenuh
dapar fosfat pH 7,4... 67 .
Lampiran 14. Flowsheet Penentuan Kurva Kalibrasi Asam Mefenamat dalam Kloroform Jenuh Dapar Fosfat pH 7,4 ... 68 Lampiran 15. Penentuan Persamaan Regresi dan Kurva Kalibrasi
Asam Mefenamat dalam Kloroform Jenuh Dapar Fosfat pH 7,4... 69
Lampiran 16. Flowsheet Pembuatan Larutan Induk Baku Asam Mefenamat dalam Dapar Fosfat pH 7,4 Jenuh Kloroform ...71 Lampiran 17. Penentuan Kurva Absorpsi Asam Mefenamat dalam
Dapar Fosfat pH 7,4 Jenuh Kloroform ... 72 Lampiran 18. Kurva Absorpsi Asam Mefenamat dalam Dapar Fosfat pH 7,4
Jenuh Kloroform ...73 Lampiran 19. Flowsheet Penentuan Kurva Kalibrasi Asam Mefenamat dalam
Dapar Fosfat pH 7,4 Jenuh Kloroform ...74 Lampiran 20. Penentuan Persamaan Regresi dan Kurva Kalibrasi
Asam Mefenamat dalam Dapar Fosfat pH 7,4 Jenuh Kloroform... 75 Lampiran 21. Flowsheet Pembuatan Larutan Induk Baku Ibuprofen dalam
Kloroform Jenuh Dapar Fosfat pH 7,4 ...77 Lampiran 22. Flowsheet Penentuan Kurva Absorpsi Ibuprofen dalam
Kloroform Jenuh Dapar Fosfat pH 7,4...78 Lampiran 23. Kurva Absorpsi Ibuprofen dalam Kloroform Jenuh
Dapar Fosfat pH 7,4 ... 79 Lampiran 24. Penentuan Kurva Kalibrasi Ibuprofen dalam Kloroform Jenuh
Dapar Fosfat pH 7,4 ... 80 Lampiran 25. Penentuan Persamaan Regresi dan Kurva Kalibrasi Ibuprofen
dalam Kloroform Jenuh Dapar Fosfat pH 7,4 ...81 Lampiran 26. Flowsheet Pembuatan Larutan Induk Baku Ibuprofen dalam
Dapar Fosfat pH 7,4 Jenuh Kloroform ... 83 Lampiran 27. Flowsheet Penentuan Kurva Absorpsi Ibuprofen dalam
Dapar Fosfat pH 7,4 Jenuh Kloroform ... 84 Lampiran 28. Kurva Kalibrasi Ibuprofen dalam Dapar Fosfat pH 7,4 Jenuh
Kloroform ... 85 Lampiran 29. Flowsheet Penentuan Kurva Kalibrasi Ibuprofen dalam
Dapar Fosfat pH 7,4 Jenuh Kloroform ... 86 Lampiran 30. Penentuan Persamaan Regresi dan Kurva Kalibrasi Ibuprofen
dalam Dapar Fosfat pH 7,4 Jenuh Kloroform ...87 Lampiran 31. Flowsheet Pembuatan Larutan Induk Baku Ketoprofen dalam
Kloroform Jenuh Dapar Fosfat pH 7,4 ... 89
Lampiran 32. Flowsheet Penentuan Kurva Absorpsi Ketoprofen dalam
Kloroform Jenuh Dapar Fosfat pH 7,4 ... 90
Lampiran 33. Kurva Absorbsi Ketoprofen dalam Kloroform Jenuh Dapar Fosfat pH 7,4... 91
Lampiran 34. Flowsheet Penentuan Kurva Kalibrasi Ketoprofen dalam Kloroform Jenuh Dapar Fosfat pH 7,4 ... 92
Lampiran 35. Penentuan Persamaan Regresi dan Kurva Kalibrasi Ketoprofen dalam Kloroform Jenuh Dapar Fosfat pH 7,4 ... 93
Lampiran 36. Flowsheet Pembuatan Larutan Induk Baku Ketoprofen dalam Dapar Fosfat pH 7,4 Jenuh Kloroform ... 95
Lampiran 37. Flowsheet Penentuan Kurva Absorpsi Ketoprofen dalam Dapar Fosfat pH 7,4 Jenuh Kloroform ... 96
Lampiran 38. Kurva Absorpsi Ketoprofen dalam Dapar Fosfat pH 7,4 Jenuh Kloroform ... 97
Lampiran 39. Penentuan Persamaan Regresi dan Kurva Kalibrasi Ketoprofen dalam Dapar Fosfat pH 7,4 Jenuh Kloroform ... 98
Lampiran 40. Flowsheet Percobaan Penetapan Log P ...100
Lampiran 41. Data Hasil Pengukuran Konsentrasi Asam Mefenamat, Ibuprofen dan Ketoprofen dalam Kloroform Jenuh Dapar Fosfat pH 7,4 ... 101
Lampiran 42. Data Hasil Pengukuran Konsentrasi Asam Mefenamat, Ibuprofen dan Ketoprofen dalam Dapar Fosfat pH 7,4 Jenuh Kloroform... 102
Lampiran 43. Contoh Perhitungan Log P... 103
Lampiran 44. Contoh Perhitungan Log D ... 104
Lampiran 45. Contoh Perhitungan Standar Deviasi (SD)... 105
Lampiran 46. Analisis Data secara statistika Log P ketiga obat yang mempunyai satu gugus asam karboksilat ... 106
Lampiran 47. Analisis Data secara statistika Log D ketiga obat yang mempunyai satu gugus asam karboksilat ... 109
Lampiran 48. Analisis Data secara statistika Log D ketiga obat yang mempunyai satu gugus asam karboksilat ... 112
Lampiran 49. Flowsheet Pembuatan Usus Halus yang Dihomogenkan ... 115 Lampiran 50. Pembuatan Larutan Induk Baku Asam Mefenamat dalam
Dapar Fosfat pH 7,4... 116 Lampiran 51. Flowsheet Penentuan Kurva Absorpsi Asam Mefenamat dalam
Dapar Fosfat pH 7,4 ... 117 Lampiran 52. Kurva Absorpsi Asam Mefenamat dalam Usus Halus yang
Dihomogenkan pada Temperatur Kamar ...118 Lampiran 53. Flowsheet Penentuan Kurva Kalibrasi Asam Mefenamat dalam
Dapar Fosfat pH 7,4... 119 Lampiran 54. Flowsheet Penentuan Waktu Up Take Bahan Obat dalam
Usus Halus yang Dihomogenkan... 120 Lampiran 55. Flowsheet Penentuan Kurva Kalibrasi Bahan Obat dalam
Usus Halus yang Dihomogenkan ... 121 Lampiran 56. Penentuan Persamaan Regresi dan Kurva Kalibrasi
Asam Mefenamat dalam Usus Halus yang Dihomogenkan pada Temperatur Kamar... 122 Lampiran 57. Flowsheet Pembuatan Larutan Induk Baku Ibuprofen dalam
Dapar Fosfat pH 7,4 ...124 Lampiran 58. Flowsheet Penentuan Kurva Absorpsi Ibuprofen dalam
Dapar Fosfat pH 7,4 ...125 Lampiran 59. Kurva Absorpsi Ibuprofen dalam Usus halus yang
Dihomogenkan ...126 Lampiran 60. Flowsheet Penentuan Kurva Kalibrasi Ibuprofen dalam
Dapar Fosfat pH 7,4...127 Lampiran 61. Penentuan Persamaan Regresi dan Kurva Kalibrasi Ibuprofen
dalam Usus Halus yang Dihomogenkan pada
Temperatur Kamar...128 Lampiran 62. Pembuatan Larutan Induk Baku Ketoprofen dalam
Dapar Fosfat pH 7,4...130 Lampiran 63. Flowsheet Penentuan Kurva Absorpsi Ketoprofen dalam
Dapar Fosfat pH 7,4... 131 Lampiran 64. Kurva Absorpsi Ketoprofen dalam Usus Halus yang
Dihomogenkan...132
Lampiran 65. Flowsheet Penentuan Kurva Kalibrasi Ketoprofen dalam Dapar Fosfat pH 7,4...133
Lampiran 66. Penentuan Persamaan Regresi dan Kurva Kalibrasi Ketoprofen dalam Usus Halus yang Dihomogenkan pada
Temperatur Kamar...134 Lampiran 67. Flowsheet Percobaan Penentuan Laju Absorpsi. ...136 Lampiran 68. Data penentuan waktu uptake Asam Mefenamat dalam
usus halus yang dihomogenkan pada panjang gelombang 209,0 nm...137 Lampiran 69. Kurva waktu uptake Asam Mefenamat dalam usus halus yang
dihomogenkan pada panjang gelombang 209,0 nm...138 Lampiran 70. Data penentuan waktu uptake Ibuprofen dalam usus halus
yang dihomogenkan pada panjang gelombang 222,0 nm...139 Lampiran 71. Kurva waktu uptake Ibuprofen dalam usus halus yang
dihomogenkan pada panjang gelombang 222,0 nm...140 Lampiran 72. Data penentuan waktu uptake Ketoprofen dalam usus halus
yang dihomogenkan pada panjang gelombang 206,0 nm...141 Lampiran 73. Kurva waktu uptake Ketoprofen dalam usus halus yang
dihomogenkan pada panjang gelombang 206,0 nm...142 Lampiran 74. Gambar Alat Flask Shaker... 143 Lampiran 75. Gambar Cara Pendiaman Pembuatan Larutan Kloroform Jenuh
Dapar Fosfat pH 7,4 dan Larutan Dapar Fosfat pH 7,4 Jenuh
Kloroform...144 Lampiran 76. Gambar Alat Homogenizer Mixer Modifikasi...145 Lampiran 77. Gambar Larutan Dapar Fosfat pH 7,4 Dingin...146
ABSTRACT
The research about relationship between permeability of some drugs having one carboxylic acid group to absorption rate at rabbit’s intestinal homogenated, which consist of two experimental designs that is determination of logarithm of P and determination of absorption rate by using mefenamic acid, ibuprofen, and ketoprofen as samples has been conducted. The concentration of drugs was determined by ultraviolet spectrofotometric. Determination of logarithm of P used chloroform saturated buffer phosphate solution pH 7.4 and buffer phosphate solution pH 7.4 saturated chloroform. The determination of absorption rate used buffer phosphate solution pH 7.4 . Both of this experimental used drugs solution with concentration 0.002 M at room temperature. The experimental data was analyzed by Analysis of Variance (ANOVA) and Least Significant Difference (LSD).
The aim of this research is to know the relationship between chemical structure with permeability and to know the relationship between permeability with absorption rate at intestinal homogenated of some drugs having one carboxylic acid group.
The result of research showed that relationship between chemistry structure linear with its permeability, depends on hidrophylic and lipophylic groups had by drug compound.
The result of research also showed that relationship permeability from three drugs inversely proportional with absorption rate done at room temperature.
ABSTRAK
Telah dilakukan penelitian mengenai hubungan permeabilitas beberapa obat yang mempunyai satu gugus asam karboksilat terhadap laju absorpsi pada usus halus kelinci yang dihomogenkan, yang mana tediri dari dua rancangan percobaan yaitu penentuan log P dan penentuan laju absorpsi dengan menggunakan asam mefenamat, ibuprofen, dan ketoprofen sebagai sampel. Penetapan kadar obat menggunakan spektrofotometer ultraviolet. Penentuan log P menggunakan kloroform jenuh dapar fosfat pH 7,4 dan dapar fosfat pH 7,4 jenuh kloroform. Penentuan laju absorpsi menggunakan dapar fosfat pH 7,4. Kedua percobaan ini menggunakan larutan obat dengan konsentrasi 0,002 M pada temperatur kamar. Data yang diperoleh dianalisis dengan menggunakan analisis varians (ANAVA) dan uji beda nyata.
Tujuan dari penelitian ini adalah untuk mengetahui hubungan antara struktur kimia dengan permeabilitas dan juga untuk mengetahui hubungan antara permeabilitas dengan laju absorpsi pada usus halus yang dihomogenkan dari beberapa obat yang mempunyai satu gugus asam karboksilat.
Hasil penelitian menunjukkan bahwa hubungan struktur kimia berbanding lurus dengan permeabilitasnya, tergantung pada gugus hidrofilik dan lipofilik yang dimiliki oleh senyawa obat tersebut.
Hasil penelitian juga menunjukkan hubungan permeabilitas dari ketiga obat tersebut berbanding terbalik dengan laju absorpsi yang dilakukan pada temperatur kamar.
BAB I PENDAHULUAN 1.1 Latar Belakang
Absorpsi asam mefenamat dalam saluran cerna cepat dan hampir sempurna, ± 99% obat terikat oleh protein plasma. Kadar plasma tertinggi dicapai dalam ± 2 jam setelah pemberian oral, waktu paruh plasma ± 3-4 jam (Siswandono dan Soekardjo, 2000), dengan rute pemberian per oral tersedia dalam bentuk tablet, kaplet, suspensi, dan kapsul (ISFI, 2007).
Ibuprofen diabsorpsi dengan cepat dalam saluran cerna, kadar serum tertinggi terjadi dalam 1-2 jam setelah pemberian oral, waktu paruh 1,8-2 jam (Siswandono dan Soekardjo, 2000), dengan rute pemberian per oral tersedia dalam bentuk tablet, kapsul, kaplet, dan suspensi (ISFI, 2007).
Ketoprofen diabsorpsi secara cepat dan sempurna dalam saluran cerna, kadar plasma tertinggi dicapai dalam 0,5-1 jam setelah pemberian oral, waktu paruh eliminasi ± 2-3 jam (Siswandono dan Soekardjo, 2000), dengan rute pemberian per oral tersedia dalam bentuk tablet (ISFI, 2007).
Ketiga obat ini merupakan obat yang mempunyai satu gugus asam karboksilat dengan struktur kimia yang berbeda satu sama lain, yang mana kelarutannya praktis tidak larut dalam air. Ketiga obat ini banyak tersedia di pasaran dalam bentuk sediaan yang diberikan secara per oral dibandingkan rute pemberian yang lain.
asam mefenamat termasuk turunan asam N-arilantranilat sedangkan ibuprofen dan ketoprofen termasuk turunan asam arilasetat.
1.2 Perumusan Masalah
Berdasarkan latar belakang di atas, maka yang menjadi perumusan masalah dalam penelitian ini adalah:
a. apakah ada hubungan struktur kimia senyawa obat yang mempunyai satu gugus asam karboksilat dengan permeabilitas ?
b. apakah ada hubungan permeabilitas dari beberapa obat yang mempunyai satu gugus asam karboksilat terhadap laju absorpsi pada usus halus yang dihomogenkan ?
1.3 Hipotesis
Berdasarkan perumusan masalah di atas, maka yang menjadi hipotesis dalam penelitian ini adalah:
a. ada hubungan struktur kimia senyawa obat yang mempunyai satu gugus asam karboksilat dengan permeabilitas
b. ada hubungan permeabilitas dari beberapa obat yang mempunyai satu gugus asam karboksilat terhadap laju absorpsi pada usus halus yang dihomogenkan
1.4 Tujuan Penelitian
Berdasarkan hipotesis di atas, maka yang menjadi tujuan dalam penelitian ini adalah untuk:
a. mengetahui hubungan struktur kimia senyawa obat yang mempunyai satu gugus asam karboksilat dengan permeabilitas
1.5 Manfaat Penelitian
BAB II
TINJAUAN PUSTAKA 2.1 Uraian Bahan
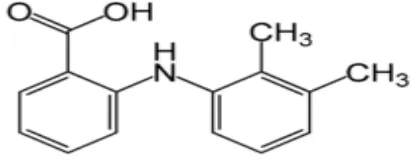
2.1.1 Asam Mefenamat a. Rumus bangun
Gambar 1. Rumus bangun Asam Mefenamat b. Rumus molekul : C15H15NO2
c. Berat molekul : 241,29 d. Sifat fisika
- Pemerian : Serbuk hablur, putih atau hampir putih; melebur pada suhu lebih kurang 230˚ disertai peruraian. - Kelarutan : Larut dalam larutan alkali hidroksida; agak sukar
larut dalam kloroform; sukar larut dalam etanol dan dalam metanol; praktis tidak larut dalam air (Ditjen POM,1995).
- pKa : 4,2 (Moffat, et al, 1986). e. Farmakologi
osteoarthritis, dan rheumatoid arthritis (Sweetman, 2005).
- Efek Samping :Terjadi steatorrhoea, haemolitik anemia, leukopenia, neutropenia, agranulositosis, gagal ginjal non-oligurik (Sweetman, 2005), dan iritasi lambung (Siswandono dan Soekardjo, 2000).
2.1.2 Ibuprofen a. Rumus bangun
Gambar 2. Rumus Bangun Ibuprofen b. Rumus molekul : C13H18O2
c. Berat molekul : 206,28 d. Sifat fisika
- Pemerian : Serbuk hablur, putih hingga hampir putih; berbau khas lemah.
- Kelarutan : Praktis tidak larut dalam air; sangat mudah larut dalam etanol, dalam metanol, dalam aseton dan dalam kloroform; sukar larut dalam etil asetat (Ditjen POM,1995).
e. Farmakologi
- Kegunaan : Digunakan pada sakit yang ringan sampai sedang dan inflamasi dalam kondisi seperti
dysmenorrhoea, sakit kepala termasuk migrain, sakit setelah pembedahan, sakit gigi, osteoarthritis,
rheumatoid arthritis, dan mengurangi demam (Sweetman, 2005).
- Efek Samping : Menyebabkan dispepsia, muntah, mual, perdarahan pada pencernaan, peptic ulcers, haematuria, hipersensitifitas, perforasi, agranulositosis, dan trombositopenia (Sweetman, 2005).
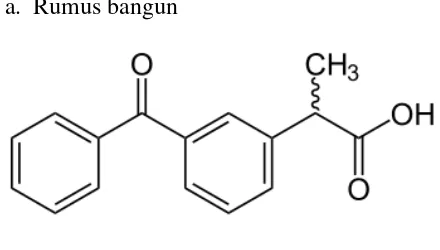
2.1.3 Ketoprofen a. Rumus bangun
Gambar 3. Rumus Bangun Ketoprofen b. Rumus molekul : C16H14O3
c. Berat molekul : 254,3 d. Sifat fisika
- Kelarutan : Mudah larut dalam etanol, dalam kloroform dan dalam eter; praktis tidak larut dalam air
(Ditjen POM,1995). - pKa : 4,5 (Kasim, et al, 2003). e. Farmakologi
- Kegunaan : Digunakan pada osteoarthritis, rheumatoid
arthritis, dysmenorrhoea, sakit setelah pembedahan, kondisi inflamasi seperti gout yang akut, dan mengurangi demam (Sweetman, 2005). - Efek Samping : Asma, urtikaria (Sweetman, 2005), dan iritasi
saluran cerna (Siswandono dan Soekardjo, 2000).
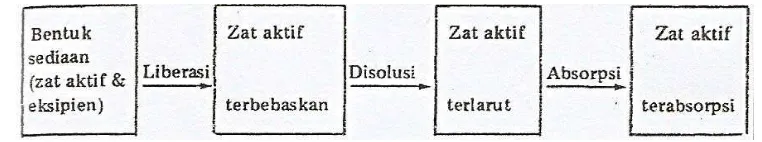
2.2 Absorpsi
sediaannya. Secara ringkas proses biofarmasetik digambarkan dalam gambar 4 (Joenoes, 2002).
Gambar 4. Fase Biofarmasetik Obat (Joenoes, 2002)
Obat yang terbebaskan dari bentuk sediaannya belum tentu diabsorpsi: kalau obat tersebut terikat pada kulit atau mukosa disebut adsorpsi. Kalau obat sampai tembus ke dalam kulit, tetapi belum masuk ke kapiler disebut penetrasi. Hanya kalau obat meresap/menembus dinding kapiler dan masuk ke dalam saluran darah baru itu disebut absorpsi (Joenoes, 2002).
Berarti suksesnya perpindahan obat dari suatu bentuk sediaan dosis oral kedalam sirkulasi umum bisa dicapai dengan empat langkah proses yaitu :
1. Penghantaran obat pada tempat absorpsinya 2. Keberadaan obat dalam bentuk larutan
3. Pergerakan dari obat larut melalui membran saluran cerna 4. Pergerakan obat dari tempat absorpsi ke dalam sirkulasi umum
(Syukri, 2002).
2.2.1 Faktor-faktor yang mempengaruhi absorpsi obat 1. Pengaruh besar-kecilnya partikel obat
Kecepatan disolusi obat berbanding langsung dengan luas permukaan yang dalam kontak dengan cairan/pelarut; bertambah kecil partikel, bertambah luas permukaan total, bertambah mudah larut (Joenoes, 2002).
2. Pengaruh daya larut obat
Pengaruh daya larut obat/bahan aktif tergantung pada:yang tidak. a. Sifat kimia: modifikasi kimiawi obat
b. Sifat fisik: modifikasi fisik obat c. Prosedur dan teknik pembuatan obat
d. Formulasi bentuk sediaan/galenik dan penambahan eksipien (Joenoes, 2002). 3. Beberapa faktor lain fisiko-kimia obat
a. pKa dan derajat ionisasi obat
Konsentrasi relatif bentuk ion/molekul bergantung pada pKa obat dan juga pada pH lingkungannya. Kebanyakan obat berupa asam lemah atau basa lemah; oleh karena absorpsi dengan cara difusi pasif hanya terjadi dalam bentuk tidak terionisasi (atau molekul), maka perbandingan obat yang tidak terionisasi sangat menentukan absorpsi. pKa obat merupakan faktor penting, apakah obat itu bila diberikan per oral diabsorpsi lebih banyak di lambung atau lebih banyak di usus (Joenoes, 2002).
b. Koefisien partisi lemak/air (Joenoes, 2002). 2.2.2 Mekanisme Lintas Membran
Koefisien Difusi x Koefisien Partisi Ketebalan Membran
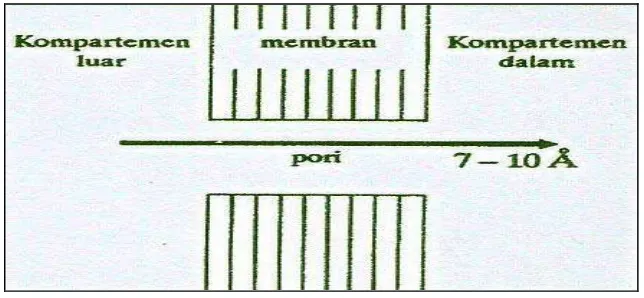
a. Filtrasi atau konvektif
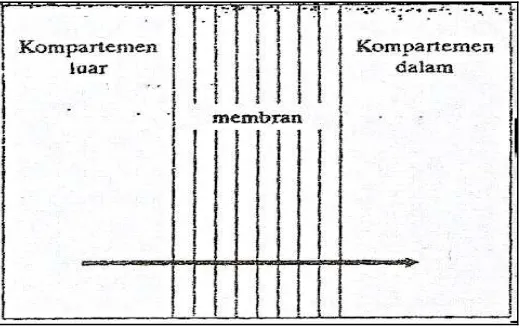
[image:33.595.151.473.304.453.2]Filtrasi atau yang disebut juga “difusi secara konvensi” adalah mekanisme penembusan pasif melalui pori-pori suatu membran. Semua senyawa yang berukuran cukup kecil dan larut dalam air dapat melewati kanal membran. Sebagian besar membran (membran seluler epitel usus halus dan lain-lain) berukuran kecil (4-7 Å) dan hanya dapat dilalui oleh molekul dengan bobot molekul yang kecil yaitu lebih kecil dari 150 untuk senyawa yang bulat, atau lebih kecil dari 400 jika molekulnya terdiri atas rantai panjang (Syukri, 2002).
Gambar 5. Transpor trans membran transpor konvektif (Joenoes, 2002) b. Difusi pasif “pH partisi hipotesis”
Difusi pasif menyangkut senyawa yang larut dalam komponen penyusun membran. Penembusan terjadi karena adanya perbedaan konsentrasi atau elektrokimia tanpa memerlukan energi, sehingga mencapai keseimbangan dikedua sisi membran. Waktu yang diperlukan untuk mencapai keseimbangan tersebut mengikuti hukum difusi Fick (Syukri, 2002).
Laju penetrasi = Konstanta Permeabilitas x Luas Permukaan x Perbedaan Konsentrasi
Konstanta permeabilitas =
Jadi konsentrasi (C) senyawa di kedua sisi membran berpengaruh pada proses penembusan, tetapi perlu ditekankan bahwa hanya fraksi bebas dari zat aktif yang diperhitungkan dalam perbedaan konsentrasi. Kombinasi zat aktif-protein yang terbentuk tersebut tidak dapat terdifusi karena alasan bobot molekulnya. Dalam hal ini hanya fraksi bebas yang dapat berdifusi, rantai protein merupakan faktor yang secara tidak langsung mempengaruhi laju difusi melalui membran (Syukri, 2002).
Kebanyakan zat aktif merupakan basa atau asam organik, maka dalam keadaan terlarut sebagian molekul berada dalam bentuk terionkan dan sebagian dalam bentuk tak terionkan. Jika ukuran molekul tidak dapat melalui kanal-kanal membran, maka polaritas yang kuat dari bentuk terionkan akan menghambat proses difusi transmembran. Hanya fraksi zat aktif yang tak terionkan dan larut dalam lemak yang dapat melalui membran dengan cara difusi pasif. Pentingnya faktor-faktor yang berpengaruh pada difusi transmembran dari suatu molekul (derajat ionisasi molekul, pH kompartemen) digarisbawahi dalam “Teori Difusi Non Ionik atau Hipotesa pH Partisi” (Syukri, 2002).
Konsentrasi bentuk terionkan Konsentrasi bentuk tak terionkan Konsentrasi bentuk tak terionkan Konsentrasi bentuk terionkan
Derajat ionisasi tergantung pada dua faktor, (persamaan Henderson Hasselbach) yaitu:
a. Tetapan ionisasi dari suatu senyawa atau pKa b. pH cairan dimana terdapat molekul zat aktif
Untuk asam : pH = pKa + log
Untuk basa : pH = pKa + log
[image:35.595.183.443.429.593.2]Karakteristik fisiko-kimia sebagian besar molekul (polaritas, ukuran molekul, dan sebagainya) merupakan hambatan penembusan transmembran oleh mekanisme pasif secara filtrasi dan difusi. Pengikutsertaan proses aktif dapat menjelaskan perjalanan obat yang kadang-kadang melintasi membran sel dengan sangat cepat (Syukri, 2002).
Gambar 6. Transpor trans membran difusi pasif (Joenoes, 2002) c. Tranpor aktif
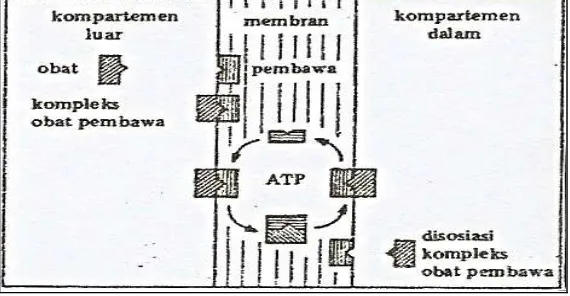
molekul dibebaskan pada permukaan lainnya, lalu pembawa kembali menuju ke permukaan asalnya (Syukri, 2002).
[image:36.595.170.455.362.510.2]Sistem transpor aktif bersifat jenuh. Sistem ini menunjukkan adanya suatu kekhususan untuk setiap molekul atau suatu kelompok molekul. Oleh sebab itu dapat terjadi persaingan beberapa molekul yang berafinitas tinggi dapat menghambat kompetisi transpor dari molekul yang berafinitas lebih rendah. Transpor dari satu sisi membran ke sisi membran yang lain dapat terjadi dengan mekanisme perbedaan konsentrasi. Tranpor ini memerlukan energi yang diperoleh dari hidrolisa adenosin trifosfat (ATP) dibawah pengaruh suatu ATP-ase (Syukri, 2002).
Gambar 7. Transpor trans membran transpor aktif (Joenoes, 2002) d. Difusi sederhana (dipermudah = fasilitas)
Gambar 8. Transpor trans membran transpor yang dipermudah (Joenoes, 2002)
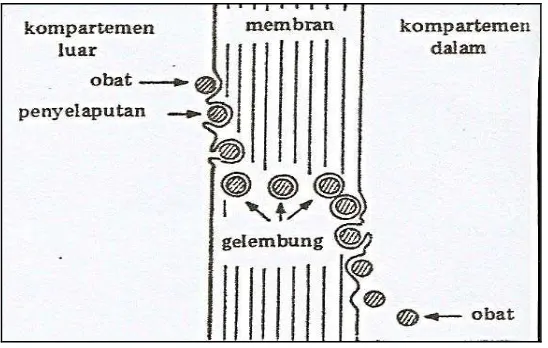
e. Pinositosis
Pinositosis merupakan suatu proses perlintasan membran oleh molekul-molekul besar dan terutama oleh molekul-molekul yang tidak larut. Perlintasan terjadi dengan pembentukan vesikula (bintil) yang melewati membran (Syukri, 2002).
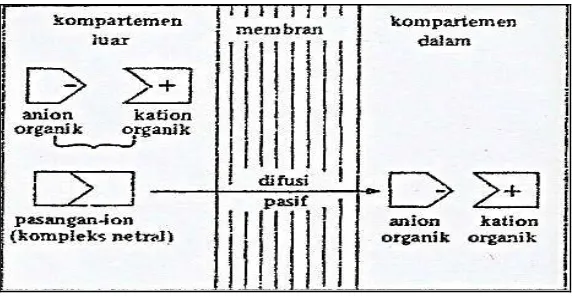
Gambar 9. Transpor trans membran pinositosis (Joenoes, 2002) f. Transpor oleh pasangan ion
[image:37.595.176.450.392.566.2]Gambar 10. Transpor trans membran transpor pasangan ion (Joenoes, 2002) 2.3 Permeabilitas
Suatu senyawa obat untuk dapat memberikan aktivitas harus mampu menembus membran biologis dan mencapai jaringan target dalam jumlah yang cukup untuk menimbulkan aktivitas. Parameter sifat fisika kimia yang paling berperan dalam proses ditribusi tersebut adalah parameter lipofilik (Siswandono dan Soekardjo, 2000).
Membran-membran biologis dengan sifat lipoid, biasanya lebih permeabel terhadap zat-zat yang larut dalam lemak. Oleh karena itu pengangkutan melewati membran-membran ini sebagian tergantung pada kelarutan lemak dari jenis zat yang mendifusi. Kelarutan dalam lemak dari suatu obat ditentukan oleh adanya gugus nonpolar dalam struktur molekul obat tersebut, sebagaimana gugus-gugus yang dapat terion dipengaruhi oleh pH setempat (Lachman, dkk, 1989).
terionisasi, bahwa hanya bentuk tidak terionisasi yang dikaitkan dengan penembusan membran (Gennaro, 2001).
Koefisien partisi dari obat tergantung pada polaritas dan ukuran dari molekul. Obat dengan momen dipol yang tinggi, walaupun tidak terionisasi, mempunyai kelarutan dalam lemak rendah, dan oleh karena itu sedikit terpenetrasi. Ionisasi bukan saja mengurangi kelarutan dalam lemak sangat besar tetapi juga menghalangi perlintasan melewati membran yang bermuatan (Gennaro, 2001). Umumnya koefisien partisi lemak/air dari suatu molekul merupakan indeks yang berguna dalam kecenderungan untuk absorpsi oleh difusi pasif (Lachman, dkk, 1989).
Koefisien partisi minyak/air merupakan ukuran sifat lipofilik suatu molekul, ini merupakan rujukan untuk sifat fase hidrofilik atau lipofilik. Koefisien partisi harus dipertimbangkan dalam pengembangan bahan obat menjadi bentuk obat. Koefisien partisi (P) menggambarkan rasio pendistribusian obat kedalam pelarut sistem dua fase, yaitu pelarut organik dan air (Ansel, 1989). Bila molekul semakin larut lemak, maka koefisien partisinya semakin besar dan difusi trans membran terjadi lebih mudah. Tidak boleh dilupakan bahwa organisme terdiri dari fase lemak dan air, sehingga bila koefisien partisi sangat tinggi ataupun sangat rendah maka hal tersebut merupakan hambatan pada proses difusi zat aktif (Aiache, dkk, 1993).
(pada suhu yang tetap) sehingga dapat ditentukan nilai koefisien partisinya (Siswandono dan Soekardjo, 2000). Menurut Nernst, koefisien partisi dapat disederhanakan sesuai dengan persamaan:
P = Co/Cw atau Log P = log Co – log Cw
Co adalah kadar molal dalam fase non-air dan Cw kadar molal dalam air, setelah mengalami kesetimbangan partisi (Sardjoko, 1993).
Nilai P seringkali dinyatakan dengan nilai log P. Sebagai contoh nilai log P 1 setara dengan nilai P 10. Nilai P = 10 merupakan nilai P untuk senyawa tertentu yang mengalami partisi ke dalam pelarut organik dalam jumlah yang sama. P = 10 berarti bahwa 10 bagian senyawa berada dalam lapisan organik dan 1 bagian berada dalam lapisan air (Rohman, 2007).
2.4 Membran Sel
Membran sel terdiri komponen-komponen yang terorganisasi, yaitu : a. Lapisan Lemak Bimolekul
Tebal lapisan lemak bimolekul ± 35 Ǻ, mengan dung kolesterol netral dan fosfo lipid terionkan, yang terdiri dari fosfatidiletanolamin, fosfatidilkolin, fosfatidilserin dan spingomielin. Berdasarkan sifat kepolarannya lapisan lemak bimolekul dibagi menjadi dua bagian yaitu bagian non polar, terdiri dari rantai hidrokarbon, dan bagian polar yang terdiri dari gugus hidroksil kolesterol dan gugus gliserilfosfat fosfolipid (Siswandono dan Soekardjo, 2000).
b. Protein
Bentuk protein bervariasi, ada yang besar, berat molekulnya ± 300.000 dan ada pula yang sangat kecil. Protein bersifat ampifil karena mengandung gugus hidrofil dan hidrofob (Siswandono dan Soekardjo, 2000).
c. Mukopolisakarida
Jumlah mukopolisakarida pada membran biologis kecil dan strukturnya tidak dalam keadaan bebas tetapi dalam bentuk kombinasi dengan lemak, seperti glikolipid, atau dengan protein, seperti glikoprotein (Siswandono dan Soekardjo, 2000).
Membran sel mempunyai pori yang bergaris tengah antara 3,5-4,2 Ǻ, merupakan saluran berisi air dan dikelilingi oleh rantai samping molekul protein yang bersifat polar. Zat terlarut dapat melewati pori ini secara difusi karena kekuatan tekanan darah (Siswandono dan Soekardjo, 2000).
plasenta, membran glomerulus, membran tubulus renalis, dan sel epidermis kulit (Siswandono dan Soekardjo, 2000).
2.5 Usus Halus
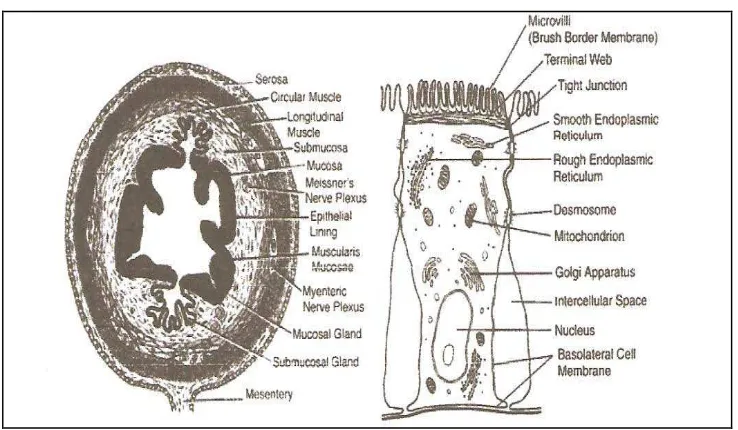
[image:42.595.128.497.383.598.2]Pencernaan makanan yang dimulai dalam lambung, dilanjutkan dalam usus halus oleh enzim-enzim yang dihasilkan mukosanya dan dibantu agen pengemulsi dan enzim yang disekresi ke dalam lumennya oleh hati dan pankreas (Fawcett, 1994). Usus halus merupakan lanjutan lambung yang terdiri atas tiga bagian yaitu duodenum yang terfiksasi, jejunum dan ileum yang bebas bergerak. Diameter usus halus beragam tergantung pada letaknya (2-3 cm) dan panjang keseluruhan antara 5-9 m. Panjang tersebut akan berkurang oleh gerakan regangan otot, yang melingkari peritoneum (Aiache, dkk, 1993).
Gambar 11. Usus Halus (Deferme, et al, 2008)
digerakkan bebas pada mesenteriumnya dan merupakan dua-perlima bagian proksimal usus halus, sedangkan ileum merupakan sisa tiga-perlimanya. Kelokan-kelokan jejunum menempati bagian pusat abdomen, sedangkan ileum menempati bagian bawah rongga. Terdapat perbedaan kecil dalam histologi mukosa ketiga segmen usus halus itu, namun batas di antara ketiganya tidak jelas. Dinding usus halus terdiri atas empat lapis konsentris: mukosa, submukosa, muskularis, dan serosa (Fawcett, 1994). Mukosa terdiri dari empat lapisan: permukaan lapisan tunggal, membran basal, lamina propia dan lamina muskularis mukosa (Deferme, et al, 2008). Mukosa usus halus, kecuali yang terletak pada bagian atas duodenum berbentuk lipatan-lipatan atau disebut juga valvula conniventes. Lipatan-lipatan inilah yang berfungsi sebagai permukaan penyerapan dan penuh dengan villi yang tingginya 0,75-1 mm dan selalu bergerak. Adanya vili ini lebih memperluas permukaan mukosa penyerapan hingga 40-50 m2 (Aiache,dkk,1993).
Bahan obat dari lambung masuk ke duodenum; fungsi utama duodenum dan bagian pertama jejunum adalah untuk sekresi, sedangkan fungsi bagian kedua dari jejunum dan ileum ialah untuk absorpsi. pH usus halus meningkat dari duodenum 4-6, jejunum 6-7, ileum 7-8. pH dalam usus halus berperan besar dalam hal absorpsi obat, sebagai akibat disolusi dari berbagai bentuk sediaannya. Pada pH yang berbeda-beda absorpsi optimal suatu obat tergantung juga pada pKa obat (Joenoes, 2002).
2.6 Spektrofotometri Ultraviolet-visibel
elektron pada kulit terluar ke tingkat energi yang lebih tinggi. Spektroskopi UV-vis biasanya digunakan untuk molekul dan ion anorganik atau kompleks di dalam larutan. Spektrum ini sangat berguna untuk pengukuran secara kuantitatif. Konsentrasi dari analit di dalam larutan bisa ditentukan dengan mengukur absorban pada panjang gelombang tertentu dengan menggunakan hukum Lambert-Beer. Sinar ultraviolet berada pada panjang gelombang 200-400 nm sedangkan sinar tampak berada pada panjang gelombang 400-800 nm (Dachriyanus, 2004).
Ketika suatu atom atau molekul menyerap cahaya maka energi tersebut akan menyebabkan tereksitasinya elektron pada kulit terluar ke tingkat energi yang lebih tinggi. Tipe eksitasi tergantung pada panjang gelombang cahaya yang diserap. Sinar ultraviolet dan sinar tampak akan menyebabkan elektron tereksitasi ke orbital yang lebih tingi. Sistem yang bertanggung jawab terhadap absorpsi cahaya disebut dengan kromofor (Dachriyanus, 2004). Kromofor merupakan semua gugus atau atom dalam senyawa organik yang mampu menyerap sinar ultraviolet dan sinar tampak (Rohman, 2007).
Hukum Lambert-Beer (Beer’s law) adalah hubungan linieritas antara absorban dengan konsentrasi larutan analit. Biasanya hukum Lambert-Beer ditulis dengan:
A = ε. b. C
A = absorban (serapan)
ε = koefisien ekstingsi molar (M-1cm-1)
10. ε massa molar Pada beberapa buku ditulis juga:
A = E. b. C E = koefisien ekstingsi spesifik (ml g-1cm-1) b = tebal kuvet (cm)
C = konsentrasi (gram/100 ml)
Hubungan antara E dan ε adalah:
E =
Pada percobaan, yang terukur adalah transmitan (T), yang didefinisikan sebagai berikut:
T = I/Io I = intensitas cahaya setelah melewati sampel Io = intensitas cahaya awal
Hubungan antara A dan T adalah
A = -log T = -log (I/Io) (Dachriyanus, 2004)
BAB III
METODE PENELITIAN
Penelitian ini bersifat eksperimental yaitu dilakukan pengujian penetapan log P dan penentuan laju absorpsi pada usus halus yang dihomogenkan di laboratorium dengan metode Rancangan Acak Lengkap.
3.1 Alat dan Bahan 3.1.1 Alat
Alat-alat yang digunakan adalah flask shaker (Edmund Bühler), corong pisah, homogenizer mixer (modifikasi), sentrifuge, vortex mixer (Health), spektrofotometer ultraviolet (Shimadzu), neraca analitis (Vibra AJ), stopwatch, politube, mikropipet, pH meter (Hanna), buret, erlenmeyer, maat pipet, gelas ukur, labu tentukur, statif, klem, corong, satu set alat bedah, dan alat-alat lain yang dibutuhkan.
3.1.2 Bahan
Bahan-bahan yang digunakan adalah Asam Mefenamat baku, Ibuprofen baku, Ketoprofen baku, Kloroform p.a (E.Merck), aquadest, Kalium dihidrogen fosfat p.a (E.Merck), Natrium Klorida p.a (E.Merck), Etanol p.a (E.Merck), Natrium Hidroksida p.a (E.Merck), Kalium biftalat p.a (E.Merck), Fenolftalein, usus halus kelinci.
3.2 Hewan Percobaan
3.3 Prosedur
3.3.1 Pembuatan Air Bebas Karbondioksida
Air murni dididihkan kuat-kuat selama 5 menit atau lebih dan didiamkan sampai dingin dan tidak boleh menyerap karbondioksida dari udara (Ditjen POM, 1995).
3.3.2 Pembuatan Larutan Kalium dihidrogenfosfat 0,2 M
Dilarutkan 27,218 g kalium dihidrogenfosfat dalam air bebas karbondioksida secukupnya hingga 1000 ml (Ditjen POM, 1979).
3.3.3 Pembuatan Larutan Natrium Hidroksida 0,2 N
Dilarutkan 8,001 g natrium hidroksida P dalam air secukupnya hingga 1000 ml (Ditjen POM, 1979).
3.3.4 Pembuatan Larutan Natrium Hidroksida 0,1 N
Dilarutkan 4,001 g natrium hidroksida P dalam air secukupnya hingga 1000 ml (Ditjen POM, 1979).
3.3.5 Pembuatan Larutan Dapar Fosfat pH 7,4
Dicampur 50,0 ml kalium dihidrogenfosfat 0,2 M dengan 39,1 ml natrium hidroksida 0,2 N dan diencerkan dengan air bebas karbondioksida secukupnya hingga 200,0 ml (Ditjen POM, 1979).
3.3.6 Pembuatan Larutan Natrium Klorida Fisiologis
Dilarutkan 9,0 g natrium klorida dalam air hingga 1000 ml (Ditjen POM, 1995).
3.3.7 Pembuatan Indikator Fenolftalein
3.3.8 Pembuatan Etanol Netral
Pada sejumlah etanol ditambahkan 2 tetes atau 3 tetes fenolftalein dan natrium hidroksida 0,02 N atau 0,1 N secukupnya hingga terjadi warna merah muda pucat (Ditjen POM, 1995).
3.3.9 Pembakuan Larutan Natrium Hidroksida 0,1 N
Ditimbang seksama 150 mg kalium biftalat yang sebelumnya telah dihaluskan dan dikeringkan pada suhu 1200C selama 2 jam, dan dilarutkan dalam air bebas karbondioksida hingga 50 ml. Dipipet sebanyak 40 ml dan ditambahkan 3 tetes fenolftalein dan dititrasi dengan larutan natrium hidroksida 0,1 N hingga terjadi warna merah muda yang stabil selama 30 detik.
3.3.10 Penetapan Kadar Asam Mefenamat
Timbang seksama lebih kurang 150 mg asam mefenamat, dilarutkan dalam 30 ml etanol yang telah dinetralkan terhadap fenolftalein, dititrasi dengan natrium hidroksida 0,1 N menggunakan indikator fenolftalein hingga terbentuk warna merah muda yang stabil selama 30 detik.
3.3.11 Penetapan Kadar Ibuprofen
Timbang seksama 150 mg ibuprofen, dilarutkan dalam 7,5 ml etanol yang telah dinetralkan terhadap fenolftalein. Ditambahkan 7,5 ml air, dititrasi dengan natrium hidroksida 0,1 N menggunakan indikator fenolftalein hingga terbentuk warna merah muda yang stabil selama 30 detik.
3.3.12 Penetapan Kadar Ketoprofen
dititrasi dengan natrium hidroksida 0,1 N menggunakan indikator fenolftalein (Ditjen POM, 1995).
3.3.13 Pembuatan Pelarut Kloroform Jenuh Dapar Fosfat pH 7,4 dan Dapar Fosfat pH 7,4 Jenuh Kloroform
Dimasukkan kloroform kedalam corong pisah, lalu dimasukkan dapar fosfat pH 7,4. Kemudian digojog dengan menggunakan alat flask shaker pada 250 goyangan per menit selama 3 jam. Kemudian didiamkan semalaman, dan dipisahkan antara fase kloroform yang telah jenuh dengan dapar fosfat pH 7,4 dan dapar fosfat pH 7,4 yang telah jenuh kloroform.
3.3.14 Pembuatan Larutan Induk Baku Asam Mefenamat dalam Kloroform Jenuh Dapar Fosfat pH 7,4
3.3.14.1 Pembuatan Larutan Induk Baku I
Ditimbang seksama 10 mg asam mefenamat yang telah dikeringkan selama 4 jam pada suhu 1050C, dimasukkan kedalam labu tentukur 10 ml, dilarutkan dengan kloroform jenuh dapar fosfat pH 7,4 lalu dicukupkan dengan kloroform jenuh dapar fosfat pH 7,4 sampai garis tanda dan dikocok hingga homogen, sehingga diperoleh konsentrasi 1000 mcg/ml.
3.3.14.2 Pembuatan Larutan Induk Baku II
Dipipet 5,0 ml dari Larutan Induk Baku I, dimasukkan kedalam labu tentukur 50 ml. Lalu dicukupkan dengan kloroform jenuh dapar fosfat pH 7,4 sampai garis tanda dan dikocok hingga homogen, sehingga diperoleh konsentrasi 100 mcg/ml.
3.3.15 Penentuan Kurva Absorpsi Asam Mefenamat dalam Kloroform Jenuh Dapar Fosfat pH 7,4
pH 7,4 sampai garis tanda. Kemudian diukur absorbansinya pada panjang gelombang 200-400 nm.
3.3.16 Penentuan Kurva Kalibrasi Asam Mefenamat dalam Kloroform Jenuh Dapar Fosfat pH 7,4
Dipipet 0,7 ml; 1,0 ml; 1,2 ml; 1,5 ml; 1,8 ml; 2,0 ml dari Larutan Induk Baku II, lalu masing-masing dimasukkan kedalam labu tentukur 10 ml dan dicukupkan dengan kloroform jenuh dapar fosfat pH 7,4 sampai garis tanda, sehingga diperoleh konsentrasi 7 mcg/ml; 10 mcg/ml; 12 mcg/ml; 15 mcg/ml; 18 mcg/ml; 20 mcg/ml. Kemudian diukur absorbansinya pada panjang gelombang 359,0 nm.
3.3.17 Pembuatan Larutan Induk Baku Asam Mefenamat dalam Dapar Fosfat pH 7,4 Jenuh Kloroform
3.3.17.1 Pembuatan Larutan Induk Baku I
Ditimbang seksama 10 mg asam mefenamat yang telah dikeringkan selama 4 jam pada suhu 1050C, dimasukkan kedalam labu tentukur 10 ml,
dilarutkan dengan natrium hidroksida lalu dicukupkan dengan dapar fosfat pH 7,4 jenuh kloroform sampai garis tanda dan dikocok hingga homogen, sehingga diperoleh konsentrasi 1000 mcg/ml.
3.3.17.2 Pembuatan Larutan Induk Baku II
3.3.18 Penentuan Kurva Absorpsi Asam Mefenamat dalam Dapar Fosfat pH 7,4 Jenuh Kloroform
Dipipet 1,1 ml Larutan Induk Baku II asam mefenamat, dimasukkan dalam labu tentukur 10 ml lalu dicukupkan dengan dapar fosfat pH 7,4 jenuh kloroform sampai garis tanda. Kemudian diukur absorbansinya pada panjang gelombang 200-400 nm.
3.3.19 Penentuan Kurva Kalibrasi Asam Mefenamat dalam Dapar Fosfat pH 7,4 Jenuh Kloroform
Dipipet 0,7 ml; 0,9 ml; 1,1 ml; 1,3 ml; 1,5 ml; 1,7 ml dari Larutan Induk Baku II, lalu masing-masing dimasukkan kedalam labu tentukur 10 ml dan dicukupkan dengan dapar fosfat pH 7,4 jenuh kloroform sampai garis tanda, sehingga diperoleh konsentrasi 7 mcg/ml; 9 mcg/ml; 11 mcg/ml; 13 mcg/ml; 15 mcg/ml; 17 mcg/ml. Kemudian diukur absorbansinya pada panjang gelombang 286,0 nm.
3.3.20 Pembuatan Larutan Induk Baku Ibuprofen dalam Kloroform Jenuh Dapar Fosfat pH 7,4
Ditimbang seksama 25 mg ibuprofen dimasukkan kedalam labu tentukur 50 ml, dilarutkan dengan kloroform jenuh dapar fosfat pH 7,4 lalu dicukupkan dengan kloroform jenuh dapar fosfat pH 7,4 sampai garis tanda dan dikocok hingga homogen, sehingga diperoleh konsentrasi 500 mcg/ml.
3.3.21 Penentuan Kurva Absorpsi Ibuprofen dalam Kloroform Jenuh Dapar Fosfat pH 7,4
3.3.22 Penentuan Kurva Kalibrasi Ibuprofen dalam Kloroform Jenuh Dapar Fosfat pH 7,4
Dipipet 6,0 ml; 7,0 ml; 8,0 ml; 9,0 ml; 10,0 ml dari Larutan Induk Baku, lalu masing-masing dimasukkan kedalam labu tentukur 10 ml dan dicukupkan dengan kloroform jenuh dapar fosfat pH 7,4 sampai garis tanda, sehingga diperoleh konsentrasi 300 mcg/ml; 350 mcg/ml; 400 mcg/ml; 450 mcg/ml; 500 mcg/ml. Kemudian diukur absorbansinya pada panjang gelombang 263,5 nm.
3.3.23 Pembuatan Larutan Induk Baku Ibuprofen dalam Dapar Fosfat pH 7,4 Jenuh Kloroform
3.3.23.1 Pembuatan Larutan Induk Baku I
Ditimbang seksama 10 mg ibuprofen dimasukkan kedalam labu tentukur 10 ml, dilarutkan dengan natrium hidroksida lalu dicukupkan dengan dapar fosfat pH 7,4 jenuh kloroform sampai garis tanda dan dikocok hingga homogen, sehingga diperoleh konsentrasi 1000 mcg/ml.
3.3.23.2 Pembuatan Larutan Induk Baku II
Dipipet 5,0 ml dari Larutan Induk Baku I, dimasukkan kedalam labu tentukur 50 ml. Lalu dicukupkan dengan dapar fosfat pH 7,4 jenuh kloroform sampai garis tanda dan dikocok hingga homogen, sehingga diperoleh konsentrasi 100 mcg/ml.
3.3.24 Penentuan Kurva Absorpsi Ibuprofen dalam Dapar Fosfat pH 7,4 Jenuh Kloroform
3.3.25 Penentuan Kurva Kalibrasi Ibuprofen dalam Dapar Fosfat pH 7,4 Jenuh Kloroform
Dipipet 0,6 ml; 0,8 ml; 1,0 ml; 1,2 ml; 1,4 ml dari Larutan Induk Baku II, lalu masing-masing dimasukkan kedalam labu tentukur 10 ml dan dicukupkan dengan dapar fosfat pH 7,4 jenuh kloroform sampai garis tanda, sehingga diperoleh konsentrasi 6 mcg/ml; 8 mcg/ml; 10 mcg/ml; 12 mcg/ml; 14 mcg/ml. Kemudian diukur absorbansinya pada panjang gelombang 222,5 nm.
3.3.26 Pembuatan Larutan Induk Baku Ketoprofen dalam Kloroform Jenuh Dapar Fosfat pH 7,4
3.3.26.1 Pembuatan Larutan Induk Baku I
Ditimbang seksama 10 mg ketoprofen dimasukkan kedalam labu tentukur 10 ml, dilarutkan dengan kloroform jenuh dapar fosfat pH 7,4 lalu dicukupkan dengan kloroform jenuh dapar fosfat pH 7,4 sampai garis tanda dan dikocok hingga homogen, sehingga diperoleh konsentrasi 1000 mcg/ml.
3.3.26.2 Pembuatan Larutan Induk Baku II
Dipipet 5,0 ml dari Larutan Induk Baku I, dimasukkan kedalam labu tentukur 50 ml. Lalu dicukupkan dengan kloroform jenuh dapar fosfat pH 7,4 sampai garis tanda dan dikocok hingga homogen, sehingga diperoleh konsentrasi 100 mcg/ml.
3.3.27 Penentuan Kurva Absorpsi Ketoprofen dalam Kloroform Jenuh Dapar Fosfat pH 7,4
3.3.28 Penentuan Kurva Kalibrasi Ketoprofen dalam Kloroform Jenuh Dapar Fosfat pH 7,4
Dipipet 0,2 ml; 0,4 ml; 0,6 ml; 0,8 ml; 1,0 ml dari Larutan Induk Baku II, lalu masing-masing dimasukkan kedalam labu tentukur 10 ml dan dicukupkan dengan kloroform jenuh dapar fosfat pH 7,4 sampai garis tanda, sehingga diperoleh konsentrasi 2 mcg/ml; 4 mcg/ml; 6 mcg/ml; 8 mcg/ml; 10 mcg/ml. Kemudian diukur absorbansinya pada panjang gelombang 254,0 nm.
3.3.29 Pembuatan Larutan Induk Baku Ketoprofen dalam Dapar Fosfat pH 7,4 Jenuh Kloroform
3.3.29.1 Pembuatan Larutan Induk Baku I
Ditimbang seksama 10 mg ketoprofen dimasukkan kedalam labu tentukur 10 ml, dilarutkan dengan natrium hidroksida lalu dicukupkan dengan dapar fosfat pH 7,4 jenuh kloroform sampai garis tanda dan dikocok hingga homogen, sehingga diperoleh konsentrasi 1000 mcg/ml.
3.3.29.2 Pembuatan Larutan Induk Baku II
Dipipet 5,0 ml dari Larutan Induk Baku I, dimasukkan kedalam labu tentukur 50 ml. Lalu ditambahkan dapar fosfat pH 7,4 jenuh kloroform sampai garis tanda dan dikocok hingga homogen, sehingga diperoleh konsentrasi 100 mcg/ml.
3.3.30 Penentuan Kurva Absorpsi Ketoprofen dalam Dapar Fosfat pH 7,4 Jenuh Kloroform
3.3.31 Penentuan Kurva Kalibrasi Ketoprofen dalam Dapar Fosfat pH 7,4 Jenuh Kloroform
Dipipet 0,3 ml; 0,5 ml; 0,7 ml; 0,9 ml; 1,1 ml dari Larutan Induk Baku II ketoprofen, lalu masing-masing dimasukkan kedalam labu tentukur 10 ml dan dicukupkan dengan kloroform jenuh dapar fosfat pH 7,4 sampai garis tanda, sehingga diperoleh konsentrasi 3 mcg/ml; 5 mcg/ml; 7 mcg/ml; 9 mcg/ml; 11 mcg/ml. Kemudian diukur absorbansinya pada panjang gelombang 260,0 nm.
3.3.32 Penetapan Log P
3.3.32.1 Pembuatan Larutan Obat
Ditimbang seksama masing-masing 48 mg asam mefenamat; 41 mg ibuprofen; 51 mg ketoprofen. Lalu masing-masing dimasukkan kedalam labu tentukur 100 ml, dilarutkan dengan kloroform jenuh dapar fosfat pH 7,4 dan dicukupkan dengan kloroform jenuh dapar fosfat pH 7,4 sampai garis tanda dan dikocok hingga homogen, sehingga diperoleh konsentrasi masing-masing larutan obat 0,002 M.
3.3.32.2 Percobaan
3.3.33 Pembuatan Usus Halus yang Dihomogenkan
Hewan percobaan berupa kelinci jantan dipuasakan selama 20-24 jam. Setelah itu kelinci tersebut dianaestesi, kemudian dilakukan pembedahan pada bagian perut tetapi jangan sampai mengenai tulang dada. Setelah usus halus dikeluarkan dan dibersihkan bagian dalamnya dari kotoran dan bagian luar dari jaringan yang mengikat pembuluh darah halus, dan sebagainya dengan bantuan pinset dan gunting, dan dicuci dengan natrium klorida fisiologis dingin. Lalu usus halus ditimbang, dipotong kecil-kecil, dimasukkan kedalam alat homogenizer
mixer dan ditambahkan dapar fosfat pH 7,4 sebanyak 5 kali berat usus halus lalu dihomogenkan. Dipipet 50 µl usus halus homogen dan dimasukkan kedalam politube lalu disimpan pada temperatur 0-4˚C dengan bantuan es.
3.3.34 Pembuatan Larutan Induk Baku Asam Mefenamat dalam Dapar Fosfat pH 7,4
Ditimbang seksama 50 mg asam mefenamat dimasukkan kedalam labu tentukur 25 ml, dilarutkan dengan natrium hidroksida lalu ditambahkan dapar fosfat pH 7,4 sampai garis tanda dan dikocok hingga homogen, sehingga diperoleh konsentrasi 2000 mcg/ml.
3.3.35 Penentuan Kurva Absorpsi Asam Mefenamat dalam Dapar Fosfat pH 7,4
Dipipet 1,25 ml Larutan Induk Baku asam mefenamat, dimasukkan dalam labu tentukur 10 ml lalu dicukupkan dengan dapar fosfat pH 7,4 sampai garis tanda. Kemudian diukur absorbansinya pada panjang gelombang 200-400 nm.
3.3.36 Penentuan Kurva Kalibrasi Asam Mefenamat dalam Dapar Fosfat pH 7,4
dengan dapar fosfat pH 7,4 sampai garis tanda, sehingga diperoleh konsentrasi 300 mcg/ml; 400 mcg/ml; 500 mcg/ml; 600 mcg/ml; 700 mcg/ml. Kemudian diukur absorbansinya pada panjang gelombang 209,0 nm.
3.3.37 Penentuan Waktu Up take Asam Mefenamat dalam Usus Halus yang Dihomogenkan
Politube yang berisi 50 µl usus halus homogen disimpan pada temperatur 0-4˚C dengan bantuan es, kemudian diprainkubasikan selama 3 menit. Lalu dilakukan percobaan up take dengan cara memasukkan larutan Asam mefenamat dengan konsentrasi 0,002 M sebanyak 100 µl kedalam politube, dan dicampur homogen dengan bantuan vortex kemudian diinkubasi dengan variasi waktu 30 detik; 1 menit; 2 menit; 3 menit; 5 menit; 7 menit; 10 menit; 15 menit pada temperatur kamar. Lalu ditambahkan etanol sebanyak 4 kali volume sampel, dicampur homogen dengan bantuan vortex dan disentrifugasi selama 30 detik, 3000 rpm. Dipipet supernatan sebanyak 0,5 ml, dimasukkan kedalam labu tentukur 10 ml dan ditambahkan dengan dapar fosfat pH 7,4 sampai garis tanda. Kemudian diukur absorbansinya dengan spektrofotometer ultraviolet.
3.3.38 Penentuan Kurva Kalibrasi Asam Mefenamat dalam Usus Halus yang Dihomogenkan
4 kali volume sampel, dicampur homogen dengan bantuan vortex dan disentrifugasi selama 30 detik, 3000 rpm. Dipipet supernatan sebanyak 0,5 ml, dimasukkan kedalam labu tentukur 10 ml dan ditambahkan dengan dapar fosfat pH 7,4 sampai garis tanda. Kemudian ditetapkan absorbansinya dengan spektrofotometer ultraviolet pada panjang gelombang 209,0 nm.
3.3.39 Pembuatan Larutan Induk Baku Ibuprofen dalam Dapar Fosfat pH 7,4
Ditimbang seksama 75 mg ibuprofen dimasukkan kedalam labu tentukur 25 ml, dilarutkan dengan natrium hidroksida lalu ditambahkan dapar fosfat pH 7,4 sampai garis tanda dan dikocok hingga homogen, sehingga diperoleh konsentrasi 3000 mcg/ml.
3.3.40 Penentuan Kurva Absorpsi Ibuprofen dalam Dapar Fosfat pH 7,4 Dipipet 5,0 ml Larutan Induk Baku ibuprofen, dimasukkan dalam labu tentukur 10 ml lalu dicukupkan dengan dapar fosfat pH 7,4 sampai garis tanda. Kemudian diukur absorbansinya pada panjang gelombang 200-400 nm.
3.3.41 Penentuan Kurva Kalibrasi Ibuprofen dalam Dapar Fosfat pH 7,4
Dipipet 2,5 ml; 3,5 ml; 4,5 ml; 5,5 ml; 6,5 ml dari Larutan Induk Baku lalu masing-masing dimasukkan kedalam labu tentukur 10 ml dan dicukupkan dengan
dapar fosfat pH 7,4 sampai garis tanda, sehingga diperoleh konsentrasi 750 mcg/ml; 1050 mcg/ml; 1350 mcg/ml; 1650 mcg/ml; 1950 mcg/ml. Kemudian
diukur absorbansinya pada panjang gelombang 222,0 nm.
3.3.42 Penentuan Waktu Up take Ibuprofen dalam Usus Halus yang Dihomogenkan
dilakukan percobaan up take dengan cara memasukkan larutan ibuprofen dengan konsentrasi 0,002 M sebanyak 100 µl kedalam politube, dan dicampur homogen dengan bantuan vortex kemudian diinkubasi dengan variasi waktu 30 detik; 1 menit; 2 menit; 3 menit; 5 menit; 7 menit; 10 menit; 15 menit pada temperatur kamar. Lalu ditambahkan etanol sebanyak 4 kali volume sampel, lalu dicampur homogen dengan bantuan vortex dan disentrifugasi selama 30 detik, 3000 rpm. Dipipet supernatan sebanyak 0,5 ml, dimasukkan kedalam labu tentukur 10 ml dan ditambahkan dengan dapar fosfat pH 7,4 sampai garis tanda. Kemudian diukur absorbansinya dengan spektrofotometer ultraviolet.
3.3.43 Penentuan Kurva Kalibrasi Ibuprofen dalam Usus Halus yang Dihomogenkan
3.3.44 Pembuatan Larutan Induk Baku Ketoprofen dalam Dapar Fosfat pH 7,4
Ditimbang seksama 50 mg ketoprofen dimasukkan kedalam labu tentukur 25 ml, dilarutkan dengan natrium hidroksida lalu ditambahkan dapar fosfat pH 7,4 sampai garis tanda dan dikocok hingga homogen, sehingga diperoleh konsentrasi 2000 mcg/ml.
3.3.45 Penentuan Kurva Absorpsi Ketoprofen dalam Dapar Fosfat pH 7,4 Dipipet 0,5 ml Larutan Induk Baku ketoprofen, dimasukkan dalam labu tentukur 10 ml lalu dicukupkan dengan dapar fosfat pH 7,4 sampai garis tanda. Kemudian diukur absorbansinya pada panjang gelombang 200-400 nm.
3.3.46 Penentuan Kurva Kalibrasi Ketoprofen dalam Dapar Fosfat pH 7,4
Dipipet 0,5 ml; 1,0 ml; 2,0 ml; 2,5 ml; 3,0 ml dari Larutan Induk Baku lalu masing-masing dimasukkan kedalam labu tentukur 10 ml dan dicukupkan dengan
dapar fosfat pH 7,4 sampai garis tanda, sehingga diperoleh konsentrasi 100 mcg/ml; 200 mcg/ml; 400 mcg/ml; 500 mcg/ml; 600 mcg/ml. Kemudian
diukur absorbansinya pada panjang gelombang 206,0 nm.
3.3.47 Penentuan Waktu Up take Ketoprofen dalam Usus Halus yang Dihomogenkan
homogen dengan bantuan vortex dan disentrifugasi selama 30 detik, 3000 rpm. Dipipet supernatan sebanyak 0,5 ml, dimasukkan kedalam labu tentukur 10 ml dan ditambahkan dengan dapar fosfat pH 7,4 sampai garis tanda. Kemudian diukur absorbansinya dengan spektrofotometer ultraviolet.
3.3.48 Penentuan Kurva Kalibrasi Ketoprofen dalam Usus Halus yang Dihomogenkan
Politube yang berisi 50 µl usus halus homogen disimpan pada temperatur 0-4˚C dengan bantuan es, kemudian diprainkubasikan selama 3 menit. Lalu dilakukan percobaan up take dengan cara memasukkan larutan Ketoprofen dengan konsentrasi 100 mcg/ml; 200 mcg/ml; 400 mcg/ml; 500 mcg/ml; 600 mcg/ml sebanyak 100 µl kedalam politube, dan dicampur homogen dengan bantuan vortex kemudian diinkubasi selama 5 menit (berdasarkan prosedur 3.3.47 dan lampiran 70) pada temperatur kamar. Lalu ditambahkan etanol sebanyak 4 kali volume sampel, lalu dicampur homogen dengan bantuan vortex dan disentrifugasi selama 30 detik, 3000 rpm. Dipipet supernatan sebanyak 0,5 ml, dimasukkan kedalam labu tentukur 10 ml dan ditambahkan dengan dapar fosfat pH 7,4 sampai garis tanda. Kemudian ditetapkan absorbansinya dengan spektrofotometer ultraviolet pada panjang gelombang 206,0 nm.
3.3.49 Penentuan Laju Absorpsi 3.3.49.1 Penyiapan Larutan Obat
3.3.49.2 Percobaan
Politube yang berisi 50 µl usus halus homogen disimpan pada temperatur 0-4˚C dengan bantuan es, kemudian diprainkubasikan selama 3 menit. Lalu dilakukan percobaan up take dengan cara memasukkan larutan obat sebanyak 100 µl kedalam politube, dan dicampur homogen dengan bantuan vortex kemudian diinkubasi dengan variasi waktu 1 menit dan 5 menit pada temperatur kamar. Lalu ditambahkan etanol sebanyak 4 kali volume sampel, lalu dicampur homogen dengan bantuan vortex dan disentrifugasi selama 30 detik, 3000 rpm. Dipipet supernatan sebanyak 0,5 ml, dimasukkan kedalam labu tentukur 10 ml dan ditambahkan dengan dapar fosfat pH 7,4 sampai garis tanda. Kemudian ditetapkan absorbansinya dengan spektrofotometer ultraviolet.
3.3.50 Analisis data
BAB IV
HASIL DAN PEMBAHASAN 4.1 Hasil Penentuan Normalitas NaOH
Untuk mengetahui normalitas NaOH maka dilakukan pembakuan dengan menggunakan lebih kurang 150 mg kalium biftalat yang sebelumnya telah dihaluskan dan dikeringkan pada suhu 1200 C selama 2 jam, dan dilarutkan dalam
air bebas karbondioksida dalam labu tentukur 50 ml. Ditambahkan 3 tetes fenolftalein dan dititrasi dengan larutan natrium hidroksida 0,1 N hingga terjadi warna merah muda mantap. Normalitas NaOH yang diperoleh adalah 0,0946 N untuk asam mefenamat; 0,0962 N untuk ibuprofen; 0,1043 N untuk ketoprofen. Hasil ini dapat dillihat pada lampiran 3-5 halaman 57-59.
4.2 Hasil Penetapan Kadar Asam Mefenamat
Penetapan kadar asam mefenamat dilakukan secara titrasi semi bebas air yaitu menggunakan NaOH 0,0946 N sebagai pentiter dan fenolftalein sebagai indikator sehingga diperoleh kadar asam mefenamat 99,68 %. Hasil dapat dilihat pada lampiran 7 halaman 61. Kadar yang diperoleh memenuhi persyaratan yang tertera pada Farmakope Indonesia edisi IV yang menyatakan bahwa asam mefenamat mengandung tidak kurang dari 98,