Lampiran 1. Lampiran Jadwal Kegiatan
Jenis Kegiatan Minggu ke –
1 2 3 4 5 6 7 8 9 10 Sterilisasi Alat X
Pembuatan Media X Pengambilan Bahan
Tanaman
X Sterilisasi Bahan
Tanaman
X Persiapan Ruang Tanam X
Penanaman X
Subkultur
Pemeliharaan Eksplan X X X X X X X X
Panen X
Peubah amatan
Persentase munculnya tunas (%)
X Umur munculnya tunas
(hari)
X
X X X X
Jumlah tunas X
Panjang tunas X
Jumlah daun X
Jumlah akar X
Lampiran2.Komposisi media MurashigedanSkoog (MS)
Bahan Kimia Konsentrasi Media (ppm)
Makro Nutrien (Stok I)
NH4 NO3 1650,000
KNO3 CaCl2.2H2O MgSO4.7H2O
1900,000 440,000 370,000
KH2PO4 170,000
Mikro Nutrien (Stok II) MnSO4.H2O
ZnSO4.7H2O H3BO3
6,900 8,600 6,200
KI 0,830
Na2MoO4.2H20 0,250
CuSO4.5H2O 0,025
CoCl2.6H2O Iron (Stok III)
0,025
FeSO4.7H2O 27,800
Na2.EDTA 37,200
Vitamin (Stok IV)
Nikotinic acid 0,500
Pyridoxin HCL 0,500
Thiamine HCL 0,100
Myo-inositol 100,000
Sukrosa Agar
Lampiran 3. Komposisi media VacindanWent (VW)
Bahan Kimia Konsentrasi Media (ppm)
Makro Nutrien (Stok I)
(NH4)SO4 500,000
KNO3
MgSO4.7H2O KH2PO4
525,000 250,000 250,000 Mikro Nutrien (Stok II)
Fe3 Tartrat MnSO4.H2O
28,000 7,500 Sukrosa
Agar
Lampiran 4. Komposisi media NitschdanNitsch (NN)
Bahan Kimia Konsentrasi Media (ppm)
Makro Nutrien (Stok I)
NH4 NO3 720,000
KNO3 CaCl2.2H2O MgSO4.7H2O
950,000 166,000 185,000
KH2PO4 68,000
Mikro Nutrien (Stok II) MnSO4.H2O
ZnSO4.7H2O H3BO3
18,900 10,000 10,000
Na2MoO4.2H20 0,250
CuSO4.5H2O 0,025
CoCl2.6H2O Iron (Stok III)
0,005
FeSO4.7H2O 27,800
Na2.EDTA 37,200
Vitamin (Stok IV)
Nikotinic acid 5,000
Pyridoxin HCL 0,500
Thiamine HCL 0,500
Lampiran 5. Persentase Terbentuknya Tunas(%)
Data Pengamatan Persentase Terbentuknya Tunas Setelah Transformasi Arcusinus (1/4 n)
Perlakuan Ulangan Total Rataan
I II III IV V
B1J1 - - 87,13 87,13 - 174,26 87,13
B1J2 87,13 2,87 2,87 87,13 87,13 267,13 53,43 B1J3 87,13 2,87 87,13 87,13 - 264,26 66,07 B1J4 - 87,13 87,13 87,13 87,13 348,52 87,13
BIJ5 87,13 87,13 - 87,13 - 261,39 87,13
B1J6 87,13 87,13 - 87,13 87,13 348,52 87,13
B2J1 87,13 87,13 87,13 - - 261,39 87,13
B2J2 87,13 87,13 87,13 87,13 87,13 435,65 87,13 B2J3 87,13 87,13 87,13 87,13 87,13 435,65 87,13
B2J4 - 87,13 - 87,13 87,13 261,39 87,13
B2J5 87,13 87,13 87,13 87,13 87,13 435,65 87,13 B2J6 87,13 87,13 87,13 87,13 87,13 435,65 87,13 Total 784,17 789,91 699,91 958,43 697,04 3929,46 Rataan 87,13 71,81 77,77 87,13 87,13 82,57
Perlakuan Ulangan Total Rataan
I II III IV V
B1J1 - - 100,00 100,00 - 200,00 100,00
B1J2 100,00 0,00 0,00 100,00 100,00 300,00 60,00 B1J3 100,00 0,00 100,00 100,00 - 300,00 75,00 B1J4 - 100,00 100,00 100,00 100,00 400,00 100,00
Tabel Analisis Sidik Ragam Persentase Terbentuknya Tunas
SK Db JK KT F.Hit 0,05 Ket
Perlakuan
B 1 1573,24 1573,24 4,09 4,11 tn
J 5 2297,56 459,51 1,19 2,48 tn
B*J 5 2252,74 450,55 1,17 2,48 tn
Galat 36 13844,51 384,57
Total 47 19968,04 424,85
Keterangan FK = 321680 KK = 23,75% *= nyata
Lampiran 6. Jumlah Tunas (buah)
Perlakuan Ulangan Total Rataan
I II III IV V
B1J1 - - 1,00 3,00 - 4,00 2,00
B1J2 3,00 0,00 0,00 1,00 2,00 6,00 1,20
B1J3 1,00 0,00 1,00 3,00 - 5,00 1,25
B1J4 - 2,00 1,00 2,00 2,00 7,00 1,75
BIJ5 1,00 1,00 - 1,00 - 3,00 1,00
B1J6 2,00 1,00 - 1,00 2,00 6,00 1,50
B2J1 2,00 1,00 1,00 - - 4,00 1,33
B2J2 3,00 2,00 1,00 3,00 4,00 13,00 2,60 B2J3 3,00 3,00 2,00 1,00 3,00 12,00 2,40
B2J4 - 2,00 - 2,00 3,00 7,00 2,33
B2J5 2,00 1,00 3,00 2,00 3,00 11,00 2,20 B2J6 3,00 3,00 3,00 4,00 2,00 15,00 3,00 Total 20,00 16,00 13,00 23,00 21,00 93,00 Rataan 2,22 1,45 1,44 2,09 2,63 1,88 Data pengamatan jumlah tunas setelah transformasi (x+0,5)1/2
Perlakuan Ulangan Total Rataan
I II III IV V
B1J1 - - 1,22 1,87 - 3,09 1,55
B1J2 1,87 0,71 0,71 1,22 1,58 6,09 1,22
B1J3 1,22 0,71 1,22 1,87 - 5,02 1,26
B1J4 - 1,58 1,22 1,58 1,58 5,96 1,49
BIJ5 1,22 1,22 - 1,22 - 3,66 1,22
B1J6 1,58 1,22 - 1,22 1,58 5,60 1,40
B2J1 1,58 1,22 1,22 - - 4,02 1,34
B2J2 1,87 1,58 1,22 1,87 2,12 8,66 1,73 B2J3 1,87 1,87 1,58 1,22 1,87 8,41 1,68
B2J4 - 1,58 - 1,58 1,87 5,03 1,68
Tabel Analisis Sidik Ragam Jumlah Tunas
SK Db JK KT F.Hit 0,05 Ket
Perlakuan
B 1 1,36 1,36 13,71 4,11 **
J 5 0,28 0,06 0,56 2,48 tn
B*J 5 0,60 0,12 1,20 2,48 tn
Galat 36 3,57 0,10
Total 47 5,80 0,12
Keterangan FK = 110,93 KK = 20,93% *= nyata
Lampiran 7. Panjang Tunas (cm)
Perlakuan Ulangan Total Rataan
I II III IV V
B1J1 - - 0,70 1,00 - 1,70 0,85
B1J2 0,50 0,00 0,00 0,70 1,20 2,40 0,48
B1J3 0,50 0,00 0,50 0,70 - 1,70 0,43
B1J4 - 0,90 0,80 0,60 0,50 2,80 0,70
BIJ5 0,40 0,30 - 0,30 - 1,00 0,33
B1J6 0,70 0,90 - 1,50 0,80 3,90 0,98
B2J1 0,90 1,30 0,50 - - 2,70 0,90
B2J2 0,90 0,80 1,20 1,10 1,00 5,00 1,00
B2J3 0,50 0,60 0,50 0,70 0,80 3,10 0,62
B2J4 - 0,70 - 0,50 0,30 1,50 0,50
B2J5 1,60 1,80 1,50 1,00 0,90 6,80 1,36
B2J6 0,60 0,40 0,70 0,60 0,50 2,80 0,56
Total 6,60 7,70 6,40 8,70 6,00 35,40
Rataan 0,73 0,70 0,71 0,79 0,75 0,73
Data pengamatan panjang tunas setelah transformasi (x+0,5)1/2
Perlakuan Ulangan Total Rataan
I II III IV V
B1J1 - - 1,10 1,22 - 2,32 1,16
B1J2 1,00 0,71 0,71 1,10 1,30 4,81 0,96
B1J3 1,00 0,71 1,00 1,10 - 3,81 0,95
B1J4 - 1,18 1,14 1,05 1,00 4,37 1,09
BIJ5 0,95 0,89 - 0,89 - 2,73 0,91
B1J6 1,10 1,18 - 1,41 1,14 4,83 1,21
B2J1 1,18 1,34 1,00 - - 3,52 1,17
B2J2 1,18 1,14 1,30 1,26 1,22 6,11 1,22 B2J3 1,00 1,05 1,00 1,10 1,14 5,29 1,06
B2J4 - 1,10 - 1,00 0,89 2,99 1,00
B2J5 1,45 1,52 1,41 1,22 1,18 6,79 1,36 B2J6 1,05 0,95 1,10 1,05 1,00 5,14 1,03 Total 9,91 11,77 9,75 12,41 8,89 52,72
Tabel Analisis Sidik Ragam Panjang Tunas
SK Db JK KT F.Hit 0,05 Ket
Perlakuan
B 1 0,14 0,14 7,70 4,11 **
J 5 0,18 0,04 1,98 2,48 tn
B*J 5 0,52 0,10 5,74 2,48 **
Galat 36 0,65 0,02
Total 47 1,48 0,03
Keterangan FK = 57,91 KK = 12,28% *= nyata
Lampiran 8. Umur Muncul Tunas (hari)
Perlakuan Ulangan Total Rataan
I II III IV V
B1J1 - - 14,00 12,00 - 26,00 13,00
B1J2 12,00 - - 14,00 11,00 37,00 12,33
B1J3 13,00 - 14,00 12,00 - 39,00 13,00
B1J4 - 12,00 13,00 14,00 14,00 53,00 13,25
BIJ5 12,00 12,00 - 13,00 - 37,00 12,33
B1J6 10,00 12,00 - 11,00 12,00 45,00 11,25
B2J1 10,00 14,00 14,00 - - 38,00 12,67
B2J2 10,00 11,00 13,00 12,00 10,00 56,00 11,20 B2J3 13,00 12,00 12,00 14,00 11,00 62,00 12,40
B2J4 - 12,00 - 13,00 12,00 37,00 12,33
B2J5 13,00 14,00 10,00 14,00 12,00 63,00 12,60 B2J6 10,00 11,00 11,00 10,00 12,00 54,00 10,80 Total 103,00 110,00 101,00 139,00 94,00 547,00 Rataan 11,44 12,22 12,63 12,64 11,75 12,26 Tabel Analisis Sidik Ragam Umur Muncul Tunas
SK Db JK KT F.Hit 0,05 Ket
Perlakuan
B 1 3,33 3,33 2,11 4,14 tn
J 5 22,50 4,50 2,85 2,50 **
B*J 5 1,91 0,38 0,24 2,50 tn
Galat 33 52,17 1,58
Total 44 79,91 1,82
Keterangan FK = 6649,09 KK = 10,25% *= nyata
Lampiran 9. Jumlah Daun (helai)
Perlakuan Ulangan Total Rataan
I II III IV V
B1J1 - - 14,00 10,00 - 24,00 12,00
B1J2 11,00 8,00 6,00 12,00 17,00 54,00 10,80
B1J3 8,00 6,00 9,00 9,00 - 32,00 8,00
B1J4 - 8,00 8,00 8,00 13,00 37,00 9,25
BIJ5 10,00 8,00 - 8,00 - 26,00 8,67
B1J6 10,00 11,00 - 6,00 9,00 36,00 9,00
B2J1 12,00 9,00 7,00 - - 28,00 9,33
B2J2 13,00 11,00 9,00 13,00 15,00 61,00 12,20 B2J3 14,00 8,00 10,00 10,00 11,00 53,00 10,60
B2J4 - 11,00 - 12,00 9,00 32,00 10,67
B2J5 15,00 9,00 16,00 11,00 17,00 68,00 13,60 B2J6 15,00 14,00 13,00 13,00 13,00 68,00 13,60 Total 108,00 103,00 92,00 112,00 104,00 519,00 Rataan 12,00 9,36 10,22 10,18 13,00 10,64 Data pengamatan jumlah daun setelah transformasi (x+0,5)1/2
Perlakuan Ulangan Total Rataan
I II III IV V
B1J1 - - 3,81 3,24 - 7,05 3,52
B1J2 3,39 2,92 2,55 3,54 4,18 16,57 3,31
B1J3 2,92 2,55 3,08 3,08 - 11,63 2,91
B1J4 - 2,92 2,92 2,92 3,67 12,42 3,11
BIJ5 3,24 2,92 - 2,92 - 9,07 3,02
B1J6 3,24 3,39 - 2,55 3,08 12,26 3,07
B2J1 3,54 3,08 2,74 - - 9,35 3,12
B2J2 3,67 3,39 3,08 3,67 3,94 17,76 3,55 B2J3 3,81 2,92 3,24 3,24 3,39 16,60 3,32
B2J4 - 3,39 - 3,54 3,08 10,01 3,34
B2J5 3,94 3,08 4,06 3,39 4,18 18,66 3,73 B2J6 3,94 3,81 3,67 3,67 3,67 18,77 3,75 Total 31,68 34,36 29,15 35,75 29,21 160,15
Tabel Analisis Sidik Ragam Jumlah Daun
SK db JK KT F.Hit 0,05 Ket
Perlakuan
B 1 1,62 1,62 11,61 4,11 **
J 5 0,84 0,17 1,20 2,48 tn
B*J 5 1,18 0,24 1,68 2,48 tn
Galat 36 5,03 0,14
Total 47 8,66 0,18
Keterangan FK = 634,36 KK = 11,28% *= nyata
Lampiran 10. Jumlah Akar (buah)
Perlakuan Ulangan Total Rataan
I II III IV V
B1J1 - - 1,00 2,00 - 3,00 1,50
B1J2 1,00 4,00 5,00 4,00 3,00 17,00 3,40
B1J3 1,00 4,00 2,00 4,00 - 11,00 2,75
B1J4 - 2,00 3,00 3,00 6,00 14,00 3,50
BIJ5 3,00 1,00 - 2,00 - 6,00 2,00
B1J6 5,00 3,00 - 1,00 2,00 11,00 2,75
B2J1 2,00 4,00 4,00 - - 10,00 3,33
B2J2 6,00 3,00 4,00 6,00 5,00 24,00 4,80
B2J3 5,00 7,00 5,00 3,00 5,00 25,00 5,00
B2J4 - 3,00 - 3,00 3,00 9,00 3,00
B2J5 2,00 2,00 3,00 3,00 3,00 13,00 2,60
B2J6 3,00 3,00 4,00 3,00 3,00 16,00 3,20
Total 28,00 36,00 31,00 34,00 30,00 159,00
Rataan 3,11 3,27 3,44 3,09 3,75 3,15
Data pengamatan jumlah akar setelah transformasi (x+0,5)1/2
Perlakuan Ulangan Total Rataan
I II III IV V
B1J1 - - 1,22 1,58 - 2,81 1,40
B1J2 1,22 2,12 2,35 2,12 1,87 9,68 1,94
B1J3 1,22 2,12 1,58 2,12 - 7,05 1,76
B1J4 - 1,58 1,87 1,87 2,55 7,87 1,97
BIJ5 1,87 1,22 - 1,58 - 4,68 1,56
B1J6 2,35 1,87 - 1,22 1,58 7,02 1,76
B2J1 1,58 2,12 2,12 - - 5,82 1,94
B2J2 2,55 1,87 2,12 2,55 2,35 11,44 2,29
B2J3 2,35 2,74 2,35 1,87 2,35 11,65 2,33
B2J4 - 1,87 - 1,87 1,87 5,61 1,87
B2J5 1,58 1,58 1,87 1,87 1,87 8,77 1,75
B2J6 1,87 1,87 2,12 1,87 1,87 9,60 1,92
Total 16,59 20,97 17,60 20,53 16,30 92,00
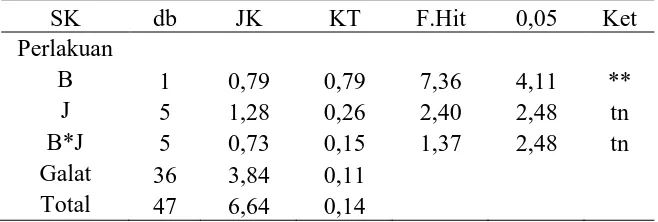
Tabel Analisis Sidik Ragam Jumlah Akar
SK db JK KT F.Hit 0,05 Ket
Perlakuan
B 1 0,79 0,79 7,36 4,11 **
J 5 1,28 0,26 2,40 2,48 tn
B*J 5 0,73 0,15 1,37 2,48 tn
Galat 36 3,84 0,11 Total 47 6,64 0,14 Keterangan
FK = 176,32 KK = 17,43% *= nyata
Lampiran 11. Panjang Akar (cm)
Perlakuan Ulangan Total Rataan
I II III IV V
B1J1 - - 0,60 0,80 - 1,40 0,70
B1J2 0,30 0,50 0,50 0,30 0,40 2,00 0,40
B1J3 0,30 0,20 0,30 0,40 - 1,20 0,30
B1J4 - 0,60 0,70 0,60 0,40 2,30 0,58
BIJ5 0,70 1,00 - 0,80 - 2,50 0,83
B1J6 1,30 1,20 - 1,00 1,10 4,60 1,15
B2J1 0,70 1,00 0,50 - - 2,20 0,73
B2J2 1,20 0,80 0,70 1,10 0,90 4,70 0,94
B2J3 0,60 0,70 0,80 0,70 1,00 3,80 0,76
B2J4 - 0,50 - 0,60 0,30 1,40 0,47
B2J5 0,40 0,50 0,50 0,80 0,50 2,70 0,54
B2J6 0,40 0,60 0,50 0,70 1,10 3,30 0,66
Total 5,90 7,60 5,10 7,80 5,70 32,10
Rataan 0,66 0,69 0,57 0,71 0,71 0,67
Data pengamatan panjang akar setelah transformasi (x+0,5)1/2
Perlakuan Ulangan Total Rataan
I II III IV V
B1J1 - - 1,05 1,14 - 2,19 1,09
B1J2 0,89 1,00 1,00 0,89 0,95 4,74 0,95
B1J3 0,89 0,84 0,89 0,95 - 3,58 0,89
B1J4 - 1,05 1,10 1,05 0,95 4,15 1,04
BIJ5 1,10 1,22 - 1,14 - 3,46 1,15
B1J6 1,34 1,30 - 1,22 1,26 5,13 1,28
B2J1 1,30 1,22 1,00 - - 3,53 1,18
B2J2 1,30 1,14 1,10 1,26 1,18 5,98 1,20 B2J3 1,05 1,10 1,14 1,10 1,22 5,60 1,12
B2J4 - 1,00 - 1,05 0,89 2,94 0,98
B2J5 0,95 1,00 1,00 1,14 1,00 5,09 1,02 B2J6 0,95 1,05 1,00 1,10 1,26 5,36 1,07 Total 9,78 11,92 9,28 12,04 8,73 51,75
Tabel Analisis Sidik Ragam Panjang Akar
SK Db JK KT F.Hit 0,05 Ket
Perlakuan
B 1 0,02 0,02 2,88 4,11 tn
J 5 0,15 0,03 4,58 2,48 **
B*J 5 0,40 0,08 12,05 2,48 **
Galat 36 0,24 0,01
Total 47 0,80 0,02
Keterangan FK = 55,78 KK = 7,51% *= nyata
Lampiran 12. Tahapan Pelaksanaan Penelitian
Sterilisasi Alat- Alat Pembuatan Media Persiapan Bahan Tanam Persiapan Ruang Tanam
Penanaman Pemeliharaan Eksplan
Lampiran 13. Gambar planlet anggrekC.trianae
B1J1 B1J2 B1J3
B1J6 B1J5
B1J4
B2J3 B2J2
B2J1
B2J6 B2J5
DAFTAR PUSTAKA
Abbas.B.2011. Prinsip Dasar teknik Kultur Jaringan. CV.Bandung.
Arditti, J. and R. Ernst. 1992. Micropropagation of Orchids. Departemen of Horticulture. Second Edition. Butterworth-Heinemann Ltd. Jordan Hill. P.38.
Badan Pusat Statistika, 2015. Produksi Tanaman Anggrek Tahun 2009 – 2014. Indonesia
Bey, Y., W. Syafii, Dan Sutrisna. 2006. Pengaruh pemberian Giberalin (GA3) dan air kelapa terhadap perkecambahan bahan biji anggrek bulan (Phalaenopsis amabilis BL.) secara in vitro. Jurnal Biogenesis. 2(2): 41-46
de Faria, R.T., Santiago., D.C., Saridakis., D.P., Albino, U.B dan Araújo, R. 2002. Preservation of the brazilian orchid Cattleya walkeriana Gardner. Londrina State University, Brasil.
Dewi, I. R. 2008. Peranan dan Fungsi Fitohormon bagi Pertumbuhan Tanaman. Makalah Universitas Padjadjaran. Bandung..
Ganapathi, T.R., P. Suprasanna, V.M. Kulkarni, V.A. Bapat, and P.S. Rao. 2002. Strategies for in vitro propagation and synthetic seeds in banana. Nuclear Agriculture and Biotechnology Division. Bhabha Atomic Research Centre.
George, E. F., M. A. Hall dan Geert, J. D. K. 2007. Plant Propagation by Tissue Culture 3rd Edition. The Background. Springer The Netherlands. Vol 1. 12-13
Gunawan, L. W. 1992. Teknik Kultur Jaringan Tumbuhan. Depdikbud. Dirjen Pendidikan Tinggi, Pusat Antar Universitas Boiteknologi. IPB. Bogor. 165 hal.
Hvoslef-Eide AK, C Munster, PH Heyerdahl, RL Yngved & OAS Olsen .2003. Liquid culture system for plant propagation. Acta Hort 625, 173-185.
Kasi, D.P dan Sumaryono .2007. Morphological changes during the development of somatic embryos of sago (Metroxylon saguRottb.). Indonesian J Agric Sci 8(2), 43-47.
Kasim, W. 2006. Cattleya Berbunga Sepanjang Masa.
Lawalata, I. J. 2011. Pemberian Beberapa Kombinasi ZPT Terhadap Regenerasi TanamanGloxinia (Siningia speciosa) dari Eksplan Batang dan Daun Secara In vitro. J.Exp. Life Sci. 1(2). Hal 83-84.
Lubis, N. N. 2010. Mikropropagasi Tunas Anggrek Hitam (Coelogyne pandurataLindl) Dengan Pemberian Benzil Amino Purin Dan Naftalen Asam Asetat. [Skripsi] Universitas Sumatera Utara. Medan.
Mordocco AM, JA Brumbley & P Lakshmanan. 2009. Development of a temporary immersion system (RITA®) for mass production of sugarcane (Saccharum spp.) interspecific hybrids. In Vitro Cell & Develop Biol 45 (4), 450-457.
Muawanah, G. 2005. Penggunaan Pupuk Hyponex, Ekstrak Tomat dan Ekstrak Pisang dalam Perbanyakan dan Perbesaran Planlet Anggrek Dendrobium (Dendrobium canayo) secara In Vitro. Skripsi. Program Studi Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor. Bogor. 49 hal. Murashige T & Skoog F .1962. A revised medium for rapid growth and bioassays
with tobacco tissue culture. Physiol Plant 15, 473-497.
Nasir, M. 2002. Bioteknologi. Potensi dan Keberhasilannya Dalam Bidang Pertanian. PT Raja Grafindo Persada. Jakarta.
Nurmalinda dan Widiastoety. 2010. Pengaruh Suplemen Non sintetik pertumbuhan planlet Anggrek Vanda Hort.hal 60-66
Pandiangan, D. 2011. Produksi Katarantin Melalui Kultur Jaringan. Lubuk Agung. Bandung.
Pardal, S.J., 2012. Regenerasi Tanamansecara In vitrodan Faktor-Faktoryang Mempengaruhi. BB BiogenKementan. Bogor.
Rahayu,E.S., Kultur Fotoautotrofik: Solusi Mikropropagasi Tumbuhan Berkayu. 2015. CV.Swadaya Manunggal. Semarang.
Salisbury, F. B., and C. W. Ross. 1992. Plant Physiology. Belmont, CA: Wadsworth. pp. 357-407, 531-548.
Steel, R.G dan J.H. Torrie, 1993. Prinsip Dan Prosedur Statiska (Pendekatan Biometric) Penerjemah B. Sumantri. Gramedia Pustaka Utama, Jakarta Steenis, C. G. G. K. 2005. Flora. PT. Pradnya Paramita. Jakarta.
Sumaryono, I Riyadi, PD Kasi & G Ginting .2007. Pertumbuhan dan perkembangan kalus embriogenik dan embrio somatik kelapa sawit (Elaeis guineensisJacq.). Menara Perkebunan 75 (1), 32-42.
Sumaryono, N. Mardiana & J. S. Tahardi .1994. Embryogenic suspension culture of oil palm. Menara Perkebunan, 62(3), 41-46.
Supriati, Y. 2010. Efisiensi Mikropropagasi Pisang Kepok Amorang melalui Modifikasi Formula Media dan Temperatur. Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian. Jurnal AgroBiogen 6(2):91-100
Syafii, W, Sutrisna. 2006. Pengaruh Pemberian Giberalin ( GA3 ) dan Air Kelapa Terhadap Perkecambahan Bahan Biji Anggrek Bulan (Phalaenopsis amabilis BL ) Secara In Vitro. FKIP. Universitas Riau.
Tahardi, J. S., I. Riyadi & W. A. Dodd .2003. Enhancement of somatic embryo development and plant recovery in Camellia sinensis by temporary liquid immersion. Jurnal Biotek. Pertanian, 8(1), 1-7.
Tuhuteru,S. Hehanussa, M. L. Dan Raharjo, S.H.T. 2012. Pertumbuhan Dan Perkembangan Anggrek Dendrobium Anosmum Pada Media Kultur In Vitro Dengan Beberapa Konsentrasi Air Kelapa. Jurnal Agrologia, Vol. 1, No. 1, April 2012, Hal. 1-12
Wattimena, G.A. 1991. Zat Pengatur Tumbuh Tanaman. Buku Ajar, Laboratorium Kultur Jaringan. Pusat Antar Universitas Bioteknologi. IPB Bogor.
________., L. W. Gunawan; N. A. Mattjik; Endang. S; N. M. A. Wiendi dan Andri. E. 1988. Bioteknologi Tanaman. Penerjemah Ahmad Sukarti Abidin. Pusat Antar Universitas Bioteknologi IPB: Bogor.
Wetter, L.R. dan F. Constabel. 1991. Metode Kultur Jaringan Tanaman. Edisi Kedua. ITB. Bandung.
________., S. K. Ningrum dan Purbadi. 2005. Pengaruh pH Media Terhadap Pertumbuhan Plantlet Anggrek Dendrobium. J. Hort. 15: 18 – 21.
________., S. Kusumo dan Syafni. 1997. Pengaruh Tingkat Ketuaan Air Kelapa dan Jenis Kelapa Terhadap Pertumbuhan Plantlet Anggrek Dendrobium. J. Hort. 7: 768-772.
Yanti, R. 2014. Pengayaan Nutrisi Pada Media Vacin Dan Went Terhadap Pertumbuhan Planlet Anggrek Dendrobium spectabile. Skripsi. Unand. Yusnita. 2003. Kultur Jaringan. Cara Memperbanyak Tanaman Secara Efisien.
Cetakan Ketiga. Agro Media Pustaka. Jakarta.
Yuswanti,H., Astawa, I. N. G. Dan Maya Dewi, N.N.A. 2014. Pertumbuhan Plantlet Anggrek Cattleya sp. dengan Perlakuan Benzyl Amino Purine pada Media Dasar Pupuk Daun Modifikasi. Jurusan Agroekoteknologi, Fakultas Pertanian Universitas Udayana. Agrotrop, Vol. 4, NO. 2 (2014) Yuwono, P. 2006. Bioteknologi Pertanian. Gadjah Mada University Press
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Kultur JaringanUPT. Balai Benih Induk, MedanJohor, Sumatera Utara, Indonesia. Penelitian ini dimulai pada bulan September 2016sampai dengan Januari 2017.
Bahan dan Alat Penelitian
Penelitian dilakukan dengan menggunakan eksplan hasil subkultur ke-2 yang berumur 1 bulan dari anggrek C.trianaedengan jumlah daun 4 helaiyang didapat dari UPT.Balai Benih Induk Johor sebagai bahan perbanyakan. Komposisi media yang digunakan larutan stok media MS, ½ MS, ¼ MS, VW, Nitsch & Nitsch, ½ NN sebagai media tumbuh tanaman dengan BAP sebagai zat pengatur tumbuh (ZPT) yang digunakan. Air kelapa sebagai zat pengatur tumbuh alami. Bahan penyusun media lainnya, agar, akuades steril, dan bahan lainnya yang mendukung penelitian ini.
Alat yang digunakan dalam penelitian ini adalah Laminar Air Flow Cabinet (LAFC), shaker, botol kultur, autoklaf, timbangan analitik, rak kultur, hot
plate dengan magnetik stirer, erlenmeyer, gelas ukur, kaca tebal, pipet ukur, pinset, gunting, scalpel, lampu bunsen, pH meter, oven, aluminium foil, kompor gas, mikropipet, pipet tetes, dan alat-alat lainnya yang mendukung penelitian ini. Metode Penelitian
Penelitian ini dilakukan dengan menggunakan Rancangan Acak Lengkap (RAL) dengan dua faktor perlakuan yaitu :
B2 : Media Padat
Faktor II : Jenis komposisi media dengan 6 taraf J1 : MS + BAP 1 ppm +air kelapa150ml/l J2 : ¾ MS + BAP 1 ppm +air kelapa 150ml/l J3 : ½ MS+ BAP 1 ppm +air kelapa 150ml/l J4 : VW+ BAP 1 ppm +air kelapa 150ml/l
J5 : Nitsch & Nitsch + BAP 1 ppm +air kelapa 150ml/l J6 : ½ Nitsch & Nitsch + BAP 1 ppm +air kelapa 150ml/l Sehingga diperoleh kombinasi perlakuan sebagai berikut:
B1J1 B2J1 B1J2 B2J2 B1J3 B2J3 B1J4 B2J4 B1J5 B2J5 B1J6 B2J6 Jumlah perlakuan : 12
Jumlah ulangan : 5
Jumlah eksplan tiap tabung uji : 3 Jumlah seluruh tabung uji : 60 Jumlah seluruh eksplan : 180
Adapun model liner dari sidik ragam penelitian sebagai berikut: Yijk = µ + αi + βj + (αβ)ij + ε ijk
Yijk = Nilai pengamatan unit percobaan pada perlakuan bentuk media ke-i,
perlakuan jenis komposisi media ke-j, dan ulangan ke-k µ = Nilai tengah umum
αi = Pengaruhbentuk media ke-i
βj = Pengaruh jenis komposisi media ke-j
(αβ)ij = Nilai tambah pengaruh interaksi bentuk media ke-i dan pengaruh
jenis komposisi ke-j
εijk = Galat percobaan
PELAKSANAAN PENELITIAN
Sterilisasi Alat-Alat
Sebelum semua alat-alat disterilisasi dan alat-alat kaca digunakan untuk kultur in vitro maka terlebih dahulu dicuci dan dikeringkan. Kemudian bungkus tabung dengan plastik tahan panas atau letakkan pada rak tabung, sedangkan untuk botol biasanya bisa langsung diletakkan pada autoklaf. Disterilkan tabung/botol dengan autoklaf pada suhu 121oC dengan tekanan 17,5 psi selama 60 menit. Setelah itu sterilkan secara kering tabung/botol di dalam oven pada suhu 150oC selama 1-2 jam.
Pembuatan Media
Media yang digunakan dalam penelitian ini adalah mediaMurashige &Skoog(MS), ¾ MS, ½ MS, Vacin & Went, Nitsch & Nitsch dan ½ Nitsch & Nitsch yang dibuat dalam bentuk padat maupun cair. Sebelum dilakukan
pembuatan media tersebut, dilakukan pembuatan larutan stok hormon BAP serta penyediaan air kelapa. Larutan stok hormon BAP dibuat 1mg/l dan 150ml/l air kelapa. Kemudian larutan stok BAP disterilkan menggunakan autoclaf untuk meningkatkan sterilitas dari hormon tersebut.
Pengambilan Bahan Tanaman
Sterilisasi Bahan Tanaman di Laboratorium
Sterilisasi di laboratorium ialah dengan eksplan berasal dari biji yang telah tumbuh menjadi tunas mikro dengan jumlah daun 4 helai dipisahkan dari rumpunnya sehingga didapat satu tunas pereksplan. Tunas mikro dibersihkan dari sisa media yang masih melekat.
Persiapan Ruang Tanam
Seluruh permukaan laminar air flow cabinet sebelumnya dibersihkan terlebih dahulu dengan di lap menggunakan alkohol 70% lalu di sterilkan dengan sinar Ultra Violet selama 30 menit sebelum proses penanaman dilakukan. Semua alat dan bahan yang akan dipakai harus disemprot dengan alkohol 70% dan beberapa alat seperti pinset, gunting, scalpel setelah disemprot lalu dibakar di dalam ke dalam laminar air flow cabinet selama 1 menit. Hal ini dilakukan untuk menghindari resiko bahan penelitian terkontaminasi.
Penanaman
Pemeliharaan Eksplan
Tabung-botol kultur diletakkan pada shaker di dalam ruang kultur. Ruangan ini diusahakan bebas dari bakteri dan cendawan, dimana setiap hari disemprot dengan alkohol 70% atau dan disemprot formalin agar bebas dari organisme yang menyebabkan terjadi kontaminasi. Dalam penelitian ini suhu ruangan kultur yang digunakan 20+25°C, paling optimum 16oC dan intensitas cahaya 2000 lux serta dengan kondisi ruangan memiliki air conditionerdilengkapi filter hefa yang dibersihkan selama 6 bulan sekali. Apabila mengalami kontaminasi, segera diambil dari rak kultur agar mencegah kontaminasi ke tabung lainnya.
Peubah Amatan
Persentase Terbentuknya Tunas (%)
Persentase terbentuknya tunas dihitung pada akhir penelitian (8 MST) dengan rumus:
Persentase terbentuknya tunas = jumlah tunas yang terbentuk
jumlah eksplan seluruhnya (per perlakuan) x 100%
Jumlah Tunas (tunas)
Dihitung pada akhir penelitian dengan menghitung banyaknya tunas baru yang terbentuk dari setiap eksplan.
Panjang Tunas (cm)
Umur Muncal Tunas (hari)
Umur muncul tunas dihitung dari awal penanaman hingga terbentuknya tunas dalam satuan hari.
Jumlah Daun (helai)
Jumlah daun dihitung dari daun yang terbentuk yang telah terbuka sempurna pada eksplan yang dilakukan pada akhir percobaan.
Jumlah Akar (buah)
Akar yang dihitung adalah seluruh akar yang terbentuk. Jumlah akar dihitung pada saat akhir penelitian.
Panjang Akar (cm)
HASIL DAN PEMBAHASAN
Hasil
Dari hasil analisis data secara statistik diperoleh bahwa perlakuan bentuk media yang berbeda memberikan pengaruh yang nyata terhadap jumlah tunas, panjang tunas, jumlah daun dan jumlah akar, tetapi tidak memberikan pengaruh yang nyata terhadap persentase terbentuknya tunas, umur munculnya tunas dan jumlah akar.
Perlakuan jenis komposisi media yang berbedamemberikan pengaruh yang nyata pada umur munculnya tunas dan panjang akar, tetapi tidak memberikan pengaruh yang nyata terhadap persentase terbentuknya tunas, jumlah tunas, panjang tunas, jumlah daun dan jumlah akar.
Interaksi antara bentuk media dan jenis komposisi mediamemberikan pengaruh yang nyata terhadappanjang tunas dan panjang akar, tetapi tidak memberikan pengaruh yang nyata pada persentase terbentuknya tunas, jumlah tunas, umur munculnya tunas, jumlah daun dan jumlah akar.
Tabel 1. Rekapitulasi peubah amatan sidik ragam pada perbanyakan tanaman anggrek C. trianae pada bentuk dan jeniskomposisi media (8 minggu setelah tanam)
Peubah Amatan Perlakuan
B J B x J
Persentase TerbentuknyaTunas (%)a tn tn tn
Jumlah Tunas (buah) a ** tn tn
Panjang Tunas (cm) a ** tn **
Umur Muncul Tunas (hari) tn ** tn
Jumlah Daun (helai) a ** tn tn
Jumlah Akar (buah) a ** tn tn
Panjang Akar (cm) a tn ** **
Keterangan: B = Bentuk media
J = Jenis komposisi media
BxJ = Interaksi bentuk media dengan jenis komposisi media ** = Sangat nyata pada taraf 5 %
[image:31.595.101.516.540.746.2]Tabel 1 menunjukkan bahwabentuk media berpengaruh sangat nyata pada jumlah tunas, panjang tunas, jumlah daun dan jumlah akar. Eksplan berpengaruh sangat nyata padaumur muncul tunas dan panjang akar. Sedangkan interaksi bentuk x jenis berpengaruh sangat nyata pada panjang tunas dan panjang akar. Interaksi yang nyata menunjukkan adanya perbedaan respon eksplan yang diuji pada 2 bentuk media dan 6 jenis komposisi media tanam.
Persentase terbentuknya tunas (%)
Hasil pengamatan persentase terbentuknya tunas beserta sidik ragamnya dapat dilihat pada Lampiran 5.Berdasarkan hasil sidik ragam diketahui bahwa bentuk media, jenis komposisi media dan interaksi antara keduanya berpengaruh tidak nyata terhadap pembentukan tunas.
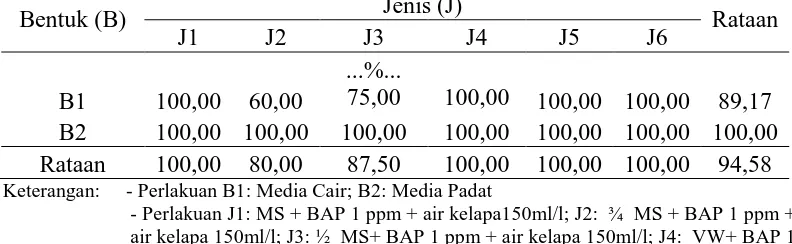
Tabel 2. Pengaruh perlakuan bentuk media dan jenis komposisi media terhadap persentase terbentuknya tunas.
Bentuk (B) Jenis (J) Rataan
J1 J2 J3 J4 J5 J6
B1 100,00 60,00
...%...
75,00 100,00 100,00 100,00 89,17 B2 100,00 100,00 100,00 100,00 100,00 100,00 100,00 Rataan 100,00 80,00 87,50 100,00 100,00 100,00 94,58 Keterangan: - Perlakuan B1: Media Cair; B2: Media Padat
- Perlakuan J1: MS + BAP 1 ppm + air kelapa150ml/l; J2: ¾ MS + BAP 1 ppm + air kelapa 150ml/l; J3: ½ MS+ BAP 1 ppm + air kelapa 150ml/l; J4: VW+ BAP 1 ppm + air kelapa 150ml/l; J5: Nitsch & Nitsch+ BAP 1 ppm + air kelapa 150ml/l; J6: ½ Nitsch & Nitsch+ BAP 1 ppm + air kelapa 150ml/l
-Analisis dilakukan berdasarkan transformasi Arcusinus (1/4 n)
Tabel 2menunjukkan bahwa bentuk media, jenis komposisi media serta interaksi antara keduanya tidak berpengaruh nyata terhadap persentase terbentuknya tunas anggrek C.trianae.
Jumlah Tunas (buah)
[image:32.595.112.508.434.556.2]berpengaruh nyata terhadap jumlah tunas yang dihasilkan. Namun, jenis komposisi mediaserta interkasi keduanya menunjukkan pengaruh yang tidak nyata terhadap jumlah tunas.
Rataan jumlah tunas dari perlakuan bentuk media dan jenis komposisi media dapat dilihat pada Tabel 3.
Tabel 3. Pengaruh perlakuan bentuk media dan jenis komposisi media terhadap jumlah tunas.
Bentuk (B) Jenis (J) Rataan
J1 J2 J3 J4 J5 J6
B1 2,00 1,20
....buah....
1,00 1,50 1,45b 1,25 1,75
B2 1,33 2,60 2,40 2,33 2,20 3,00 2,31a Rataan 1,67 1,90 1,83 2,04 1,60 2,25 1,88 Keterangan: - Angka-angka yang diikuti huruf yang sama pada baris dan kolom yang sama
menunjukkan tidak berbeda nyata pada Uji Jarak Berganda Duncan pada taraf 5%. - Perlakuan B1: Media Cair; B2: Media Padat
- Perlakuan J1: MS + BAP 1 ppm + air kelapa150ml/l; J2: ¾ MS + BAP 1 ppm + air kelapa 150ml/l; J3: ½ MS+ BAP 1 ppm + air kelapa 150ml/l; J4: VW+ BAP 1 ppm + air kelapa 150ml/l; J5: Nitsch & Nitsch+ BAP 1 ppm + air kelapa 150ml/l; J6: ½ Nitsch & Nitsch+ BAP 1 ppm + air kelapa 150ml/l
-Analisis dilakukan berdasarkan transformasi (x+0,5)½
Tabel 3 menunjukkan bentuk media berpengaruh nyata pada jumlah tunas. Jumlah tunas rataan terbanyak adalah 2,31 (buah) yaitu pada perlakuan (B2)media padat. Sedangkan jumlah tunas rataan terendah adalah 1,45 (buah) yaitu pada perlakuan (B1) media cair.
Penampilan tunas yang berasal ditanam pada (B2) media padat dan (B1) media cair dapat dilihat pada gambar 3.
[image:33.595.143.475.593.696.2]Gambar 3. menunjukkan bahwa eksplan yang ditanam pada (B2) media padat dapat membentukjumlah tunasyang lebih banyak dibandingkan dengan eksplan yang ditanam pada (B1) media cair.
Panjang tunas (cm)
Hasil pengamatan panjang tunas beserta sidik ragamnya dapat dilihat pada Lampiran 7. Berdasarkan hasil sidik ragam diketahui bahwa bentuk media tanam dan interaksi antara bentuk media dengan jenis komposisi media berpengaruh nyata terhadap pertambahan panjang tunas. Jenis komposisi media menunjukkan pengaruh yang tidak nyata terhadap pertambahan panjang tunas.
Rataan panjang tunas dari perlakuan bentuk media dan jenis komposisi media dapat dilihat pada Tabel 4.
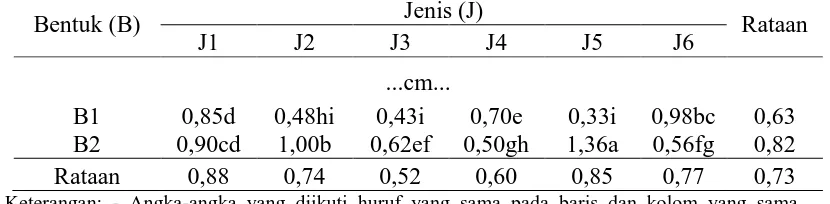
Tabel 4. Pengaruh perlakuan bentuk media dan jenis komposisi media terhadap panjang tunas.
Bentuk (B) Jenis (J) Rataan
J1 J2 J3 J4 J5 J6
...cm... B1 B2 0,85d 0,90cd 0,48hi 1,00b 0,43i 0,62ef 0,70e 0,50gh 0,33i 1,36a 0,98bc 0,56fg 0,63 0,82 Rataan 0,88 0,74 0,52 0,60 0,85 0,77 0,73 Keterangan: - Angka-angka yang diikuti huruf yang sama pada baris dan kolom yang sama
menunjukkan tidak berbeda nyata pada Uji Jarak Berganda Duncan pada taraf 5%. - Perlakuan B1: Media Cair; B2: Media Padat
- Perlakuan J1: MS + BAP 1 ppm + air kelapa150ml/l; J2: ¾ MS + BAP 1 ppm + air kelapa 150ml/l; J3: ½ MS+ BAP 1 ppm + air kelapa 150ml/l; J4: VW+ BAP 1 ppm + air kelapa 150ml/l; J5: Nitsch & Nitsch+ BAP 1 ppm + air kelapa 150ml/l; J6: ½ Nitsch & Nitsch+ BAP 1 ppm + air kelapa 150ml/l
-Analisis dilakukan berdasarkan transformasi (x+0,5)½
[image:34.595.111.526.420.522.2]150 ml/l), B1J6 yaitu media cair (B1) pada jenis komposisi media J6(½ NN+ BAP 1 ppm + air kelapa 150 ml/l) dengan rataan panjang tunas masing- masing 1,00 (cm) dan 0.98 (cm). Panjang tunas terendah adalah 0,33 (cm) pada perlakuan B1J5 yaitu bentuk mediapadat (B1) pada media J5(NN +BAP 1 ppm + air kelapa 150 ml/l).Perlakuan B2J5 berbedanyata dengan perlakuan B1J1, B1J2, B1J3, B1J4, B1J5, B1J6, B2J1, B2J2, B2J3, B2J4 dan B2J6.
[image:35.595.125.508.332.543.2]Penampilan tunas yang berasal ditanam pada media padat B2J5(NN + BAP 1 ppm + air kelapa 150 ml/l) dan media cair B1J5(NN + BAP 1 ppm + air kelapa 150 ml/l) dapat dilihat pada gambar 4.
Gambar 4. a. Penampilan tunas yang berasal dari media padat B2J5 (NN + BAP 1ppm + air kelapa 150 ml/l)
b.Penampilan tunas yang berasal dari media cair B1J5
(NN+ BAP 1ppm + air kelapa 150 ml/l)
Gambar 4. menunjukkan bahwa eksplan yang ditanam pada media B2J5 dapat membentuktunasyang lebih tinggi dibandingkan dengan eksplan yang ditanam pada media B1J5.
Umur Munculnya Tunas (hari)
Hasil pengamatan umur munculnya tunas beserta sidik ragamnya dapat dilihat pada Lampiran 8. Berdasarkan hasil sidik ragam diketahui bahwa jenis komposisi media tanam berpengaruh nyata terhadap umur munculnya tunas.
Bentuk media dan interkasi antara bentuk media dengan jenis komposisi media menunjukkan pengaruh yang tidak nyata terhadap umur munculnya tunas.
[image:36.595.113.527.228.340.2]Rataan umur munculnya tunas dari perlakuan bentuk media dan jenis komposisi media dapat dilihat pada Tabel 5.
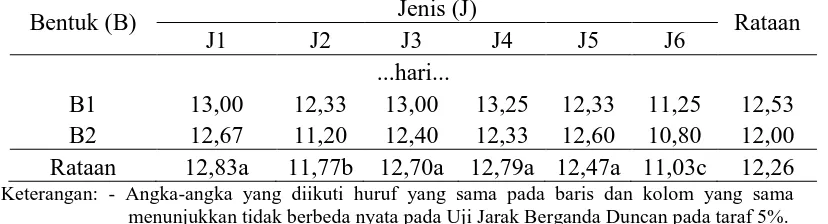
Tabel 5. Pengaruh perlakuan bentuk media dan jenis komposisi media terhadap umur munculnya tunas
Bentuk (B) Jenis (J) Rataan
J1 J2 J3 J4 J5 J6
...hari...
B1 13,00 12,33 13,00 13,25 12,33 11,25 12,53 B2 12,67 11,20 12,40 12,33 12,60 10,80 12,00 Rataan 12,83a 11,77b 12,70a 12,79a 12,47a 11,03c 12,26 Keterangan: - Angka-angka yang diikuti huruf yang sama pada baris dan kolom yang sama
menunjukkan tidak berbeda nyata pada Uji Jarak Berganda Duncan pada taraf 5%. - Perlakuan B1: Media Cair; B2: Media Padat
- Perlakuan J1: MS + BAP 1 ppm + air kelapa150ml/l; J2: ¾ MS + BAP 1 ppm + air kelapa 150ml/l; J3: ½ MS+ BAP 1 ppm + air kelapa 150ml/l; J4: VW+ BAP 1 ppm + air kelapa 150ml/l; J5: Nitsch & Nitsch+ BAP 1 ppm + air kelapa 150ml/l; J6: ½ Nitsch & Nitsch+ BAP 1 ppm + air kelapa 150ml/l
Tabel 5. menunjukkan umur munculnya tunastercepat adalah 11,03 (hari) setelah tanam pada perlakuan J6(½ NN + BAP 1 ppm + air kelapa150ml/l), diikuti J2 (¾ MS+ BAP 1 ppm + air kelapa150 ml/l) dengan rataan umur 11,77 (hari). Umur muncul tunas paling lama adalah pada perlakuan J1 (MS+ BAP 1 ppm + air kelapa150ml/l) yaitu dengan rataan 12,83(hari) setelah inisisasi.Perlakuan J6 dan J2 berbedanyata dengan perlakuan J1, J3, J4 dan J5 dalam mempercepat munculnya tunas.
Jumlah Daun (helai)
Rataan jumlah daun dari perlakuan bentuk media dan jenis komposisi media dapat dilihat pada Tabel 6.
Tabel 6. Pengaruh perlakuan bentuk media dan jenis komposisi media terhadap pertambahanjumlah daun.
Bentuk (B) Jenis (J) Rataan
J1 J2 J3 J4 J5 J6
...helai...
B1 12,00 10,80 8,00 9,25 8,67 9,00 9,62b
B2 9,33 12,20 10,60 10,67 13,60 13,60 11,67a Rataan 10,67 11,50 9,30 9,96 11,13 11,30 10,64 Keterangan: - Angka-angka yang diikuti huruf yang sama pada baris dan kolom yang sama menunjukkan tidak berbeda nyata pada Uji Jarak Berganda Duncan pada taraf 5%. - Perlakuan B1: Media Cair; B2: Media Padat
- Perlakuan J1: MS + BAP 1 ppm + air kelapa150ml/l; J2: ¾ MS + BAP 1 ppm + air kelapa 150ml/l; J3: ½ MS+ BAP 1 ppm + air kelapa 150ml/l; J4: VW+ BAP 1 ppm + air kelapa 150ml/l; J5: Nitsch & Nitsch+ BAP 1 ppm + air kelapa 150ml/l; J6: ½ Nitsch & Nitsch+ BAP 1 ppm + air kelapa 150ml/l
-Analisis dilakukan berdasarkan transformasi (x+0,5)½
Tabel 6.Menunjukkan bentuk media berpengaruh nyata pada pertambahanjumlah daun. Jumlah daun yang tertinggi dihasilkan pada perlakuan (B2) bentuk media padat dengan rataan 11,67 helai. Jumlah daun terendah pada (B1) bentuk media cair dengan rataan 9,62 helai. Perlakuan B1 berbeda nyata dengan perlakuan B2.
[image:37.595.120.455.560.706.2]Penampilan tunas yang berasal ditanam pada (B2) media padat dan (B1)media cair dapat dilihat pada gambar 5.
Gambar 5. a. Penampilan tunas yang berasal dari (B2)media padat b.Penampilan tunas yang berasal dari (B1) media cair
Gambar 5. menunjukkan bahwa eksplan yang ditanam pada (B2) media padat dapat membentukdaunyang lebih baik dibandingkan dengan eksplan yang ditanam pada (B1) media cair.
Jumlah Akar (buah)
Hasil pengamatan jumlah akar beserta sidik ragamnya dapat dilihat pada Lampiran 10. Berdasarkan hasil sidik ragam diketahui bahwa bentuk media tanam berpengaruh nyata terhadap jumlah akar namun jenis komposisi media berpengaruh tidak nyata terhadap pertambahan jumlah akar. Jenis komposisi media dan interaksi keduanya menunjukkan pengaruh tidak nyata.
Rataan jumlah akar dari perlakuan bentuk media dan jenis komposisi media dapat dilihat pada Tabel 7.
Tabel 7. Pengaruh perlakuan bentuk media dan jenis komposisi media terhadap pertambahanjumlah akar.
Bentuk (B) Jenis (J) Rataan
J1 J2 J3 J4 J5 J6
...buah...
B1 1,50 3,40 2,75 3,50 2,00 2,75 2,65b
B2 3,33 4,80 5,00 3,00 2,60 3,20 3,66a
Rataan 2,42 4,10 3,88 3,25 2,30 2,98 3,15 Keterangan: - Angka-angka yang diikuti huruf yang sama pada baris dan kolom yang sama menunjukkan tidak berbeda nyata pada Uji Jarak Berganda Duncan pada taraf 5%. - Perlakuan B1: Media Cair; B2: Media Padat
- Perlakuan J1: MS + BAP 1 ppm + air kelapa150ml/l; J2: ¾ MS + BAP 1 ppm + air kelapa 150ml/l; J3: ½ MS+ BAP 1 ppm + air kelapa 150ml/l; J4: VW+ BAP 1 ppm + air kelapa 150ml/l; J5: Nitsch & Nitsch+ BAP 1 ppm + air kelapa 150ml/l; J6: ½ Nitsch & Nitsch+ BAP 1 ppm + air kelapa 150ml/l
-Analisis dilakukan berdasarkan transformasi (x+0,5)½
Tabel 7 Penampilan akar yang berasal ditanam pada (B2) media padat dan (B1) media cair dapat dilihat pada gambar 6.
Gambar 6. a. Penampilan akar yang berasal dari media padat b.Penampilan akar yang berasal dari media cair
Gambar 6. menunjukkan bahwa eksplan yang ditanam pada media padat dapat membentukakaryang lebih banyak dibandingkan dengan eksplan yang ditanam pada media cair.
Panjang Akar (cm)
Rataan panjang akar dari perlakuan bentuk media dan jenis komposisi media dapat dilihat pada Tabel 8.
Tabel 8. Pengaruh perlakuan bentuk media dan jenis komposisi media terhadap panjang akar.
Bentuk (B) Jenis (J) Rataan
J1 J2 J3 J4 J5 J6
...cm...
B1 0,70ef 0,40j 0,30k 0,58gh 0,83cd 1,15a 0,66 B2 0,73bc 0,9b 0,76de 0,47ij 0,54hi 0,66fg 0,68 Rataan 0,72 0,67 0,53 0,52 0,69 0,91 0,67 Keterangan: - Angka-angka yang diikuti huruf yang sama pada baris dan kolom yang sama
menunjukkan tidak berbeda nyata pada Uji Jarak Berganda Duncan pada taraf 5%. - Perlakuan B1: Media Cair; B2: Media Padat
- Perlakuan J1: MS + BAP 1 ppm + air kelapa150ml/l; J2: ¾ MS + BAP 1 ppm + air kelapa 150ml/l; J3: ½ MS+ BAP 1 ppm + air kelapa 150ml/l; J4: VW+ BAP 1 ppm + air kelapa 150ml/l; J5: Nitsch & Nitsch+ BAP 1 ppm + air kelapa 150ml/l; J6: ½ Nitsch & Nitsch+ BAP 1 ppm + air kelapa 150ml/l
-Analisis dilakukan berdasarkan transformasi (x+0,5)½
Tabel 8. menunjukkan jenis komposisi media tanam dan interaksi antara bentuk media dengan jenis komposisi media berpengaruh nyata terhadap
pertambahan panjang akar. Bentuk media menunjukkan pengaruh yang tidak nyata terhadap pertambahan panjang akar.Hasil pengamatan panjang akar beserta sidik ragamnya dapat dilihat pada Lampiran 11.
Panjang akar tertinggi adalah 1,15 (cm) pada perlakuan B1J6 yaitu media cair (B1) pada jenis komposisi media J6 (½ NN + BAP 1 ppm + air kelapa 150ml/l).Panjang akar terendah adalah 0,30 (cm) pada perlakuan B1J3 yaitu bentuk cair (B1) pada media J3(½ MS +BAP 1 ppm + air kelapa 150ml/l).Perlakuan B1J6 dan B1J3 berbedanyata dengan perlakuan B1J1, B1J2, B1J4, B1J5, B2J1, B2J2, B2J3, B2J4, B2J5 dan B2J6.
[image:40.595.119.525.415.614.2]Penampilan akar yang berasal ditanam pada media cair B1J6 (½ NN + BAP 1 ppm + air kelapa 150 ml/l) dan media cair B1J3 (½ MS + BAP 1 ppm + air kelapa 150 ml/l) dapat dilihat pada gambar 6.
Gambar 6. a. Penampilan akar yang berasal dari media cair B1J6 (½ NN + BAP 1 ppm + air kelapa 150 ml/l)
b.Penampilan akar yang berasal dari media cair B1J3 (½ MS+ BAP 1 ppm + air kelapa 150 ml/l)
Gambar 6. menunjukkan bahwa eksplan yang ditanam pada media B1J6 dapat membentukakaryang lebih panjang dibandingkan dengan eksplan yang ditanam pada media B1J3.
Pembahasan
Pengaruh bentuk media yang berbeda terhadap perbanyakan tanaman anggrek CattleyatrianaeLindl & Rchb.fil secara in vitro
Dari hasil penelitian yang telah dilakukan, secara statistik diperoleh bahwa perlakuan bentuk media berpengaruhnyata terhadap pertambahan jumlah tunas, panjang tunas, jumlah daun dan jumlah akar tanaman anggrek, namun tidak memberikan pengaruh yang nyata terhadap persentase pembentukan tunas, umur munculnya tunas dan panjang akar.Eksplan yang ditanam pada media padat dapat menghasilkanjumlah tunas, panjang tunas, jumlah daun serta jumlah akar yang lebih baik dibandingkan dengan bentuk media cair.
Pada peubah amatan persentase pembentukan tunas yang tertinggi dihasilkan pada bentuk media B2 (media padat) dengan rataan 100%, sedangkan persentase tunas terendah dihasilkan pada bentuk media B1 (media cair) dengan rataan sebesar 89,75%.Penambahan agar pada media dapat mempengaruhi terbentuknya tunas pada tanaman anggrek Cattleya. Diduga,penggenangan menyebabkan ketersediaan oksigen kurang baik pada media cair sehingga
menghambat pembentukan tunas. Hal ini didukung oleh penelitian Sumaryono et al., (1994)kultur cair telah berhasil dilakukan pada kelapa sawit.
dengan perendaman secara terus-menerus, transfer oksigen tidak cukup. Oleh karena itu, pertumbuhan tunas menjadi terhambat.
Menurut Rahayu (2015), laju difusi O2 dari udara didalam bejana kedalam jaringan eksplan berlangsung optimal bila eksplan terpapar dalam atmosfer bejana dan tidak tenggelam. Apabila eksplan tenggelam,O2 diperoleh dari gas yang terlarut didalam medium kultur. Dibandingkan melalui udara, O2 berdifusi jauh lebih lambat melalui air. Difusi O2 dari medium cair ke dalam jaringan tumbuhan terhambat akibat tekanan antar muka air-jaringan. Resistensi untuk difusi berkurang jika air atau medium diaduk atau dikocok. Oleh karena itu penyerapan O2 terjadi sangat lambat pada jaringan yang terendam dikedalaman berapapun.
Pada penelitian yang dilakukan Kasi dan Sumaryono, (2008)peningkatan bobot kalus embriogenik sagu pada medium cair lebih baik dibandingkan dengan medium padat. Pada kultur kalus embriogenik kelapa sawit juga menunjukkan hal yang serupa, dimana pertumbuhan kalus pada medium cair lebih baik dibandingkan pada medium padat (Sumaryono et al., 1994). Pada medium padat, hanya sebagian dari kalus embriogenik yang bersinggungan dengan permukaan medium, sementara pada medium cair seluruh kalus embriogenik terpapar pada medium. Hal ini berpengaruh terhadap penyerapan medium oleh kalus yang digunakan untuk tumbuh. Pemaparan kalus embriogenik terhadap medium secara terus-menerus dapat menyebabkan kalus mengalami kekurangan oksigen yang juga menghalangi pertumbuhan kalus.
Pengaruh jenis komposisi media yang berbeda terhadap perbanyakan tanaman anggrek Cattleya trianaeLindl & Rchb.filsecara in vitro
tunas dan panjang akar, namun tidak memberikan pengaruh yang nyata terhadap persentase pembentukan tunas, jumlah tunas, panjang tunas, jumlah daun dan jumlah akar. Eksplan yang ditanam pada media menunjukkan pengaruh pertumbuhan yang berbeda. Eksplan tunas mikro berdaun 4 dari hasil subkulutr yang ditanam pada semua jenis komposisi media pada hari ke 12 mulai menunjukkan adanya mucul tunas mikro pada ruas-ruas batang dan pada hari ke 16mucul akar.
Jenis komposisi media terbaik adalah pada perlakuan J6(½ NN + BAP 1 ppm + air kelapa150ml/l) dengan rataan umur mucul tunas tercepat , jumlah daun, jumlah tunas dan panjang akar tertinggi. Diduga,komposisi unsur hara dari media Nitsch & Nitsch ½ dari standart sesuai bagi pertumbuhan eksplan anggrek C.trianaehasil subkultur. Hal ini sesuai dengan hasil penelitianSurpriati, (2010)
pada penelitian multiplikasi tunas penghematan bahan kimia dapat dilakukan dengan mengurangi konsentrasi garam makro pada media dasar MS sampai 25% dari standar, sehingga untuk memperoleh jumlah tunas yang sama hanya diperlukan ¾ MS. Dengan demikian dari penelitian multiplikasi ini dapat diperoleh langkah efisiensi dalam penggunaan bahan kimia untuk media dasar MS dan NN sebagai pemicu multiplikasi tunas.
Pengaruh interaksi bentuk media dan jenis komposisi media yang berbeda terhadap perbanyakan tanaman anggrek Cattleya trianaeLindl & Rchb.filsecara in vitro
Dari hasil penelitian yang telah dilakukan, secara statistik diperoleh bahwa interaksi bentuk media dan jenis komposisi media berpengaruh nyata terhadap panjang tunas dan panjang akar.Namun, interaksi antara keduanya tidak memberikan pengaruh yang nyata pada parameter lainnya. Setiap eksplan memberikan pengaruh yang berbeda pada tiap parameter perlakuan.
Interaksi bentuk media dan jenis komposisi media terhadap panjang tunas adalah hasil yang didapatkan untuk melihat respon eksplan tanaman anggrek yang ditanam pada komposisi media dalam membentuk tunas. Dengan demikian, interaksi antara bentuk dan jeniskomposisi media berpengaruh nyata terhadappertambahan panjang tunas. Dari data yang didapat pada pertambahan panjangtunas paling tinggi adalah 1,36cmpada perlakuan B2J5media padat (B2) pada jenis komposisi media J5 (NN + BAP 1 ppm + air kelapa 150ml/l) dan yang paling rendahterdapat pada perlakuan B1J5 yaitu , media cair (B1) pada jenis komposisi media J5 (NN + BAP 1 ppm + air kelapa150ml/l) yaitu0,33 cm. Pada pertambahan jumlah daun tertinggi juga terdapat pada media B2J5 dengan rataan daun 13,60 helai. Pada pertambahan jumlah tunas tertinggi terdapat pada perlakuan B2J6 dengan jumlah tunas rataan 3,00 buah. Sedangkan pertambahan jumlah daun tertinggi terdapat pada perlakuan B2J3 yaitu dengan rataan jumlah akar tertinggi 5,00 buah.
KESIMPULAN DAN SARAN
Kesimpulan
1. Pertumbuhan tunas anggrek C.trianae pada media padat lebih baik dari pertumbuhan pada media cair.
2. Pertumbuhan tunas anggrek C.trianae di media J6(½ NN + BAP 1 ppm + air kelapa 150ml/l) lebih baik dari pada pertumbuhan di perlakuan komposisi media lainnya.
3. Pertumbuhan tunas anggrek C.trianaeyang terbaik terdapatpada media NN + BAP 1 ppm + air kelapa 150ml/ldalam bentuk padat.
Saran
TINJAUAN PUSTAKA
Botani Tanaman
Sistematika bahan tanaman anggrek Cattleyamenurut Steenis (2005) adalah sebagai berikut : Kingdom : Plantae, Divisio: Spermatophyta, Subdivisio : Angiospermae, Kelas : Monocotyledoneae, Ordo : Asparagales, Famili : Orchidaceae, Subfamili : Epidendroideae, Suku : Epidendrea, Subsuku : Laeliinae , Genus : Cattleya,Spesies: Cattleya trianaeLindl & Rchb.fil.
Akar anggrek pada umumnya lunak dan mudah patah dengan ujung akar meruncing. Akar anggrek mempunyai lapisan velamen yang bersifat spongy (berongga) yang dibawahnya mengandung klorofil. Pada jenis monopodial,
terdapat banyak akar aerial yaitu akar yang keluar dari batang di atas (Gunawan, 1992).
Anggrek memiliki dua macam pola pertumbuhan, yaitu pertumbuhan monopodial dan simpodial. Anggrek yang memiliki pola pertumbuhan monopodial, batang berbentuk tunggal dengan bagian ujung batang tumbuh lurus tidak terbatas. Vanda, Arachnis, dan Aranda merupakan anggrek yang termasuk pola monopodial. Selain monopodial, terdapat pola pertumbuhan simpodial, pada pola ini pertumbuhan ujung batang anggrek terbatas karena hanya akan tumbuh hingga mencapai batas maksimum. Pertumbuhan baru akan dilanjutkan oleh anakan yang tumbuh di sampingnya. Pada anggrek simpodial terdapat suatu penghubung yang disebut rizom atau batang dibawah tanah. Contoh anggrek simpodial adalah Cattleya (Gunawan, 1992).
dengan daun pada buku berikutnya atau berpasangan (Gunawan, 1992). Berdasarkan pertumbuhannya, anggrek Cattleya termasuk golongan evergreen yaitu daun tetap segar dan hijau, serta tidak gugur secara serentak. Daunnya berbentuk lebar, tebal, dan berdaging (Widiastoety, 2005).
[image:48.595.160.395.400.555.2]Bunga terdiri atas 5 bagian utama yaitu sepal (kelopak bunga), petal (mahkota bunga), benang sari, putik dan ovari (bakal buah). Sepal merupakan pelindung bunga terluar sewaktu bunga masih kuncup. Sepal berjumlah 3 helai dengan letak membentuk segitiga. Setelah sepal, ada tiga helai petal yang juga terletak dalam bentuk segitiga. Dua helai yang diatas membentuk 1200 dengan lembar ke-3 yang lebih besar yang disebut labelum atau bibir. Labelum membentuk semacam platform tempat serangga hinggap (Gunawan, 1992).
Gambar 1. Struktur bunga anggrek Cattleya trianae Sumber: Orchidswiki (2009)
Bunga anggrek Cattelya terbentuk pada pucuk tanaman. Jenis Cattleya berdaun satu memiliki 1−2 kuntum bunga yang berukuran besar, sedangkan jenis Cattleyaberdaun 2−3 mempunyai 3−8 kuntum dengan ukuran kecil. Panjang tangkai bunga anggrek ini termasuk pendek. Bunga Cattleya memiliki diameter 5 hingga lebih dari 16 cm, memiliki daya tahan 1-2 minggu bila tidak dipotong, atau 3-4 hari bila digunakan sebagai bunga potong (Widiastoety, 2005). Pada
Petal Anther cap
dasarnya, struktur bunga pada genus Cattleya sederhana, sepal berbentuk lebar, petal menjuntai di atas labellum yang besar, dan biasanya labellum memiliki warna yang berbeda dengan sepal dan petal (Hawkes, 1965).
Gambar 2. Anggrek Cattleya trianae Lindl & Rchb.fil. Sumber: Orchidswiki (2009)
Buah anggrek merupakan buah capsular (seperti butiran) yang berbelah enam. Biji-biji anggrek di dalam buah tidak memiliki endosperm yaitu cadangan makanan seperti biji tanaman lainnya. Cadangan makanan ini diperlukan dalam perkecambahan dan pertumbuhan awal biji (Gunawan, 1992).
Kultur Jaringan
Teknik kultur jaringan berkembang didasarkan pada penelitian-penelitian Schleiden dan Schwann tentang kompetensi sel secara total yang disebut totipotensial. Schleiden (1833) dan Schwann (1839) mengatakan, sel merupakan unit dari struktural dan fungsional dari organisme yang dapat berkembang biak secara otonomi. Teori ini diuji coba oleh Voching (1878) pada induksi kalus dan
akhirnya dapat bergenerasi tumbuh ke bagian atas membentuk tunas dan ke bagian bawah membentuk akar (bipolar).
Eksplan
Eksplan adalah bagian tanaman yang digunakan sebagai bahan untuk inisiasi suatu kultur. Eksplan yang digunakan harus dalam keadaan aseptik melalui prosedur sterilisasi dengan berbagai bahan kimia. Dari eksplan aseptik kemudian diperoleh kultur aseptik yaitu kultur dengan hanya satu macam organisme yang diinginkan (Gunawan,1992).
bodies (plb)merupakan struktur yang menyerupai protocrom yang terbentuk dari
jaringan eksplan dan atau kalus dari in vitro (Yusnita,2003).
Dalam perbanyakan tanaman secara kultur jaringan, eksplan merupakan faktor penting penentu keberhasilan. Umur fisiologis, umur ontogenetik, ukuran eksplan, serta bagian tanaman yang diambil merupakan hal-hal yang harus dipertimbangkan dalam memilih eksplan yang akan digunakan sebagai bahan awal kultur. Umumnya, bagian tanaman yang digunakan sebagai eksplan adalah jaringan muda yang sedang tumbuh aktif. Jaringan tanaman yang masih muda mempunyai daya regenerasi lebih tinggi, sel-sel masih aktif membelah diri, dan relatif lebih bersih (mengandung lebih sedikit kontaminan) (Yusnita, 2003).
Ada beberapa fase dalam pertumbuhan dan perkembangan biji anggrek menjadi plantlet yang diamati pada perkecambahan biji dan perkembangan plantlet dari tanaman anggrek. Pertama, biji (fase 0) yang berubah menjadi protocorm (fase 1) menandakan biji berkecambah. Fase pekembangan selanjutnya merupakan pembentukan primordia daun pada bagian atas protocorm (fase 2). Primordia daun kemudian berkembang menjadi daun pertama (fase 3). Akhirnya, anggrek melanjutkan pertumbuhan dan perkembangan beberapa daun berkembang (fase 4) menjadi tanaman kecil yang disebut sebagai plantlet (fase 5).
Media Kultur Jaringan
asam organik, metabolit dan ekstrak tambahan tidak mutlak, tetapi dapat menguntungkan ketahanan sel dan perbanyakannya (Wetter dan Constabel, 1991).
Media kultur merupakan salah satu faktor penentu keberhasilan perbanyakan tanaman secara kultur jaringan. Berbagai komposisi media kultur telah diformulasikan untuk mengoptimalkan pertumbuhan dan perkembangan
tanaman. Kebutuhan nutrisi mineral untuk tanaman yang dikulturkan secara in vitro pada dasarnya sama dengan kebutuhan hara tanaman yang ditumbuhkan
ditanah, meliputi hara-hara makro dan mikro (Yusnita, 2003).
Medium yang digunakan untuk kultur in vitro tanaman dapat berupa medium padat atau cair. Medium padat digunakan untuk menghasilkan kalus yang selanjutnya diinduksi membentuk tanaman yang lengkap (plantlet), sedangkan medium cair biasanya digunakan untuk kultur sel. Medium yang digunakan mengandung lima komponen utama, yaitu: senyawa anorganik, sumber karbon, vitamin, zat pengatur tumbuh, dan suplemen organik (Yuwono, 2006).
baik karena nutrisi dapat diserap secara bersamaan dalam proporsi seimbang (Kasi dan Sumaryono, 2008).
Menurut Sumaryono et al.,(2007) penggunaan medium padat pada fase proliferasi kalus tebu merupakan teknik yang umum digunakan saat ini. Namun penggunaan medium padat dianggap tidak efisien dalam hal tingkat produksi planlet, tenaga kerja dan ruang. Penggunaan medium cair dapat mengatasi kelemahan tersebut dengan dimungkinkannya otomatisasi sehingga dapat meningkatkan skala produksi secara massal (HvoslefEide et al., 2003).
Medium padat dapat digunakan untukproliferasi kalus karena mempercepatpembentukan kalus sekunder dan pembentukankalus embriogenik remah yanglebih banyak. Sementara pada SPS (sistem perendaman sesaat) danmedium cair, pembentukan kalus embriogenikremah relatif sedikit, sehinggaterbentuk lebih banyak sel embriogenikyang menunjang proses pendewasaanmenjadi embrio somatik. Oleh karena itu, penggunaan medium cair dan mediumSPS (sistem perendaman sesaat) dapat direkomendasikan sebagaimedium tumbuh untuk pendewasaan kalusembriogenik menjadi embrio somatik (Kasi dan Sumaryono, 2008).
diperoleh langkah efisiensi dalam penggunaan bahan kimia untuk media dasar MS sebagai pemicu multiplikasi tunas.
Lingkungan In vitro
Pemuliaan tanaman in vitromencakup semua teknik kultur sel dan jaringan yang meliputi perbanyakan, pengamatan dan manipulasi genetik tanaman tanpa melibatkan siklus seksual. Pada dasarnya kulturin vitromerupakan suatu proses perbanyakan sel, jaringan, organ atau proptoplas dengan teknik steril (Nasir, 2002).
Pekerjaan mengisiolasi dan mentransfer bahan tanaman biasanya diruangan khusus atau didalam lemari dimana mikroorganisme dapat dikecualikan. Lemari yang digunakan untuk isolasi dapat ditempatkan dalam rancangan laboratorium, tetapi jauh lebih baik di ruangan inokulasi atau transfer ruangan khusus yang disediakan. Pada saat ditempatkan di inkubator pencahayaan, suhu dan kelembaban dapat dikontrol. Laju pertumbuhan tergantung pada suhu dan juga pencahayaan yang diadopsi (George et al., 2007).
Kondisi lingkungan yang menentukan keberhasilan dalam pembiakan tanaman dengan kulturjaringan meliputi cahaya, suhu, dan komponen atmosfer.
Cahaya dibutuhkan untuk mengatur proses morfogenetik tertentu. Dalam teknik kultur jaringan, cahaya dinyatakan dengan dimensi lama penyinaran, intensitas,
Kualitas cahaya yang baik untuk perkembangan tanaman harus diperhatikan. Lampu flourescens jauh lebih baik dibanding lampu pijar, karena
panasnya relatif rendah. Intensitas cahaya yang dibutuhkan berkisar 1000-4000 lux. Intensitas cahaya diatur menempatkan lampu dengan kekuatan
tertentu dengan jarak 40-50 cm dari tabung kultur untuk luas tertentu (Pardal, 2012).
Suhu juga berpengaruh terhadap kesehatan tanaman yang dikulturkan. Suhu yang umum digunakan untuk pengkulturan berbagai jenis tanaman adalah 26 ± 20C. Untuk kebanyakan tanaman, suhu yang terlalu rendah (kurang dari 200C) dapat menghambat pertumbuhan, dan suhu yang terlalu tinggi (lebih dari 320C) menyebabkan tanaman merana. Namun, pada kultur tanaman yang biasanya memerlukan suhu rendah untuk pertumbuhan terbaiknya (Yusnita, 2003).
Zat Pengatur Tumbuh
Hormon diperlukan dalam konsentrasi yang rendah untuk mempengaruhi pertumbuhan dan perkembangan tumbuhan. Banyak molekul sintesis zat alami yang telah dikenal memiliki aktivitas serupa perangsang tumbuh. Senyawa sintesis perangsang tumbuh yang secara alami ada dikenal dengan zat pengatur tumbuh. Dalam kultur jaringan, tambahan (exogenous) zat pengatur tumbuh diberikan untuk memperoleh efek pertumbuhan (Pandiangan, 2011).
sintetik, misalnya NAA(napthaleneacetic acid), 2,4D (2,4 dichlorophenoxyacetic acid) dan MCPA (2-methyl-4chlorophenoxyacetic acid)
(Dewi, 2008).
Sitokinin merupakan zat pengatur tumbuh yang mendorongpembelahan (sitokinesis), pertumbuhan danperkembangan kulktur sel tanaman. Sitokininjuga menunda penuaan daun, bunga dan buahdengan cara mengontrol dengan baik proseskemunduran yang menyebabkan kematian sel-seltanaman. Pada tumbuhan, efek sitokinin seringdipengaruhi oleh keberadaan auksin, misalnyajumlah akar yang banyak akan menghasilkan sitokinin dalam jumlah banyak. Peningkatankonsentrasi sitokinin ini akan menyebabkansistem tunas membentuk cabang dalam jumlahyang lebih banyak(Lawalata, 2011).
Auksin dan sitokinin ditambahkan dalam media kultur untuk menginduksi perkembangan eksplan. Auksin yang umum digunakan dalam media kultur jaringan adalah IAA (indole acetic acid), IBA (3-indolebutyric acid), 2,4D (2,4- dichlorophenoxyacetic acid), dan NAA (1-naphthylacetic acid). Auksin berperan
dalam merangsang pembelahan dan pembesaran sel yang terdapat pada pucuk tanaman, dan menyebabkan pertumbuhan pucuk-pucuk baru (Wetherell, 1982).
Menurut Wattimena (1988)sitokinin yang sering dipakai dalamperbanyakan in vitrotanaman adalah BAP. Hal ini dikarenakan BAP lebih
stabil,tidak mahal, mudah tersedia, bisa disterilisasi, dan efektif. Menurut Yuswanti et al.,(2014) pemberian BAP 1 ppm dapat meningkatkan pertumbuhan
plantlet anggrek Cattleyasp, yang dapat ditunjukkan pada variabel tertinggi yaitu: tinggi plantlet (5,67 cm), jumlah daun (4,67 helai ), panjang akar (2,07 cm) ,berat basah (0,36 g) dan berat kering oven (0,043 g).
Anggrek yang diperbanyak secara in vitro membutuhkan nutrisi yang penting bagi pertumbuhan planlet selain nutrisi, juga dapat menambahkan hormon tumbuh yang dibutuhkan bagi pertumbuhan planlet, sumber nutrisi yang dapat mengantikan peran ZPT yang mahal. Sumber Nutrisi berasal dari Ekstrak buah dan air kelapa. Ekstrak buah yang digunakan antara lain buah pisang, nenas, tomat dan pepaya (Yanti, 2014).
Menurut (Widiastoety 1997) pemberian air kelapa pada pembuatan media Vacin dan Went mampu menstimulasi pembelahan sel dan pertumbuhan anggrek Bulan. Penggunaan ekstrak buah dilakukan karena ekstrak buah mengandung karbohidrat, protein, lemak dan vitamin serta unsur hara yang berfungsi sebagai sumber energi yang berguna untuk pertumbuhan planlet.
respirasi. Oleh karena itu air kelapa mempunyai kemampuan besar untuk mendorong pembelahan sel dan proses deferensiasi. Menurut Bey et al., (2006) perlakuan tunggal air kelapa dapat mempercepat munculnya plb pada tanaman anggrek bulan (Phalaenopsis amabilis sp.).Hasil penelitian Syafi’i (2006) saat munculnya plb lebih cepat pada perlakuan tunggal air kelapa pada konsentrasi 200 ml/l dimana plb tumbuh pada rentang waktu 14 – 18 hsp pada tanaman anggrek bulan.
Perbanyakan Anggrek Secara Konvensional
Perbanyakan anggrek dapat dilakukan secara vegetatif dan generatif. Perbanyakan secara vegetatif dianggap kurang efektif karena jumlah anakan yang relatif sedikit, sedangkan perbanyakan secara generatif dengan biji memerlukan waktu tumbuh yang lama. Perbanyakan secara vegetatif dilakukan dengan cara memisahkan tanaman anakan dari tanaman induknya. Tanaman anakan dapat berupa tunas yang tumbuh dari pangkal batang atau dapat juga berupa keki. Keki merupakan tunas yang tumbuh dari nodus batang atau tangkai bunga (Arditi dan Ernst, 1994).
Kajian Kultur Jaringan Tanaman Anggrek
Perbanyakan anggrek secara generatif lebih banyak dilakukan dalam laboratorium secara in vitro yaitu dengan menyebar dan mengecambahkan biji anggrek di dalam media agar yang steril (Hendaryono dan Wijayani, 1994). Biji anggrek dapat tumbuh jika ditanam pada media yang mengandung nutrisi yang cukup untuk pertumbuhan dan perkembangannya. Kultur secara in vitro digunakan untuk perbanyakan tanaman yang endemik atau terancam punah. Kultur biji anggrek pada media yang sesuai akan menghasilkan tanaman anggrek yang berlimpah (Abbas et al., 2011).
Air kelapa 150 ml/l pada media VW mampu mendorong pembentukan plb(protocorm like bodies) sebagai calon tanaman. Protocorm adalah bentukan bulat yang siap membentuk pucuk dan akar sebagai awal perkecambahan anggrek. Air kelapa terkandung hormone sitokinin 5,8 mg/l, auksin 0,07 mg/l dan giberalin yang dapat menstimulasi perkecambahan dan pertumbuhan tanaman, berfungsi sebagai penstimulir dalam proliferasi jaringan, memperlancar metabolisme dan respirasi (Gunawan, 1992).
Menurut Bey et al., (2006) perlakuan tunggal air kelapa dapat mempercepat munculnya plb pada tanaman anggrek bulan (Phalaenopsis amabilis sp.).Hasil penelitian Syafi’i (2006) saat munculnya plb lebih cepat pada perlakuan
PENDAHULUAN
Latar belakang
Anggrek merupakan tanaman hias yang memiliki bentuk, warna bunga serta karakteristik unik yang menjadi daya tarik bagi konsumen. Tanaman anggrek memiliki nilai ekonomis lebih tinggi jika dibandingkandengan tanaman hias yang lain, baik sebagai bunga potong maupun bunga pot. Beberapa genus yang dikenal secara komersial adalah Dendrobium, Phalaenopsis, Arachnis, Cymbidium, Cattleya dan Vanda (Widiastoety et al., 1997).
Indonesia memiliki kekayaan alam yang beragam dan diperkirakan terdapat sekitar 5.000 spesies anggrek, setengah dari spesies anggrek tersebut terdapat di Papua, sedangkan 2.000 spesies lainnya terdapat di Kalimantan dan sisanya tersebar di pulau-pulau lain di Indonesia Jenis, ukuran, bentuk dan warna bunga anggrek berbeda-beda sesuai dengan habitat tumbuhnya (Lubis, 2010).
Permintaan pasar anggrek cenderung meningkat setiap tahunnya, namun perkembangan produksi anggrek di Indonesia masih relatif lambat (Widiastoety, 2001). Produksi tanaman anggrek di Indonesia pada tahun 2009 – 2014 mengalami peningkatan. Pada tahun 2009 kebutuhan anggrek 16.205.949, tahun 2010 14.050.445, tahun 2011 15.490.256, tahun 201220.727.891, tahun 2013 20.277.672 dan pada tahun 2014 24.633.789 (Badan Pusat Statistika dan Direktorat Jenderal Hortikultura , 2015).
Pengembangan anggrek di Indonesia menghadapi berbagai masalah diantaranya penyediaan bibit yang terbatas, kualitas bibit yang masih rendah dan teknik budidaya yang belum dilakukan dengan baik, karena dilakukan dengan pemisahan anakan. Dengan cara mikropropagasi akan diperoleh bibit dalam jumlah banyak dalam waktu yang relatif singkat dan seragam (Yuswanti et al., 2014).
Media merupakan faktor utama dalam perbanyakan dengan kultur jaringan. Keberhasilan perbanyakan dan perkembangbiakan tanaman anggrek dengan metode kultur jaringan sangat tergantung pada jenis media. Media tumbuh multiplikasi tunas anggrek pada kultur jaringan sangat besar pengaruhnya terhadap pertumbuhan dan perkembangan eksplan serta bibit yang dihasilkannya (Tuhuteru et al., 2012).
Bahan kimia merupakan salah satu faktor yang perlu disederhanakan untuk menekan biaya produksi. Hal ini dapat dicapai melalui penggurangan penggunanaan agar, penyederhanaan media dasar serta minimalisasi pemakaian pengatur tumbuh. (Ganapathi et al., 2002). Menurut Supriati (2010), pada penelitian multiplikasi tunas penghematan bahan kimia dapat dilakukan dengan mengurangi konsentrasi garam makro pada media dasar MS sampai 25% dari standar, sehingga untuk memperoleh jumlah tunas yang sama hanya diperlukan ¼ MS. Dengan demikian dari penelitian multiplikasi ini dapat diperoleh langkah efisiensi baik dalam penggunaan bahan kimia untuk media dasar MS maupun penggunaan zat pengatur tumbuh BAP sebagai pemicu multiplikasi tunas.
agar, penggunaan air kelapa sebagai pengatur tumbuh serta menggunakan media cair pada eksplan untuk tahap multiplikasi. Penelitian ini dilakukan untuk (1) mengetahui perbedaan antara ekplsan anggrek yang ditanam pada media padat dan eksplan anggrek yang di tanam dengan media cair.(2) mengetahui komposisi media yang terbaik sebagai media multiplikasi anggrekCattleya trianaeLindl & Rchb.fil..
Berdasarkan uraian diatas peneliti ingin melakukan penelitian perbanyakan anggrek Cattleya trianaeLindl & Rchb.fil. menggunakan beberapa komposisi media.
Tujuan Penelitian
Untuk mendapatkan media multiplikasi yang terbaik untuk produksi bibit anggrek Cattleya trianaeLindl & Rchb.fil.unggul secara massal, cepat dan seragam melalui kultur in vitro.
Hipotesis Penelitian
Ada perbedaan pertumbuhan tunas dari beberapa komposisi media padat
dan cair terhadap multiplikasi pada kultur tanaman anggrek Cattleya trianaeLindl & Rchb.fil.
Kegunaan Penelitian
ABSTRAK
SHELA LIA NIKA BR SEMBIRING, 2017: Perbanyakan Anggrek (Cattleya trianae Lindl & Rchb.fil.) Menggunakan Beberapa Komposisi Media
Padat dan Cair Secara In Vitro, dibimbing oleh Luthfi A. M. Siregar dan Emmy Harso Kardhinata.
Penelitian ini bertujuan untuk mendapatkan media multiplikasi yang terbaik untuk produksi bibit anggrek Cattleya trianae Lindl & Rchb.fil.melalui kultur in vitro. Penelitian ini dilakukan di Laboratorium Kultur Jaringan UPT. Benih Induk Hortikultura Gedung Johor Medan, Sumatera Utara, Indonesia, pada September 2016 sampai dengan Januari 2017. Penelitian ini menggunakan rancangan acak lengkap dengan dua faktor, yaitu: bentuk media, terdiri dari dua tingkatan: media cair dan media padat, dan jenis komposisi media terdiri dari enam komposisi; MS + BAP 1ppm + air kelapa150 ml/l, ¾ MS + BAP 1ppm + air kelapa 150 ml/l, ½ MS+ BAP 1ppm + air kelapa 150 ml/l,VW+ BAP 1ppm + air kelapa 150 ml/l, Nitsch & Nitsch + BAP 1ppm + air kelapa 150 ml/l, ½ Nitsch & Nitsch + BAP 1ppm +