LAMPIRAN
Lampiran 1. Gambar Penelitian
32
Lampiran 2 . Komposisi Media MS (Murashige & Skoog) 1962
Bahan Kimia
Konsentrasi Dalam Media (mg/l)
Sum of
Lampiran 3. Data Berat Kering Kalus (g) dan Uji Statistik
Perlakuan U1 U2 U3 U4 U5 U6 Jumlah Rata-rata
Test of Homogeneity of Variances Ulangan
Perlakuan_bb s
N Subset for alpha = 0.05
1 2 3
K1 K3 K2 K0 Sig.
6 6 6 6
,1833 ,2067
,237
,2067 ,2400 ,097
,2400 ,2617 ,271
34
Ulangan Duncana
Means for groups in homogeneous subsets are displayed.
Sum of
Lampiran 4. Indeks Pertumbuhan (g) dan Uji Statistik
Perlakuan U1 U2 U3 U4 U5 U6 Jumlah Rata-rata
Test of Homogeneity of Variances Ulangan
Perlakuan_bb s
N Subset for alpha = 0.05
1 2 3
K1 K3 K2 K0 Sig.
6 6 6 6
,1100 ,1300
,125
,1300 ,1483 ,158
,1483 ,1683 ,125
36
Ulangan Duncana
Means for groups in homogeneous subsets are displayed.
37
Lampiran 5. Luas Area Standar, Retention Time Linear
dan Uji Statistik Regresi
Konsentrasi ( ppm )
Rata-Rata Luas Area
1210266,5
1,38E+13 1,38E+13 38,60289 7,15E+11 3,58E+11
1,45E+13
0,02494
Standard
L
uas A
re
a
38
Lampiran 6. Kurva Analisis Regresi Linear Standar Katekin
7000000
6000000 y = 8215,14x - 2146753
R²= 0,97729 5000000
4000000
3000000
2000000
1000000
0
0 200 400 600 800 1000 1200
39
Lampiran 7. Luas Area Perlakuan dan Retention Time
Perlakuan
K0 K1 K2 K3
Rata-Rata Luas Area
536592 1168564 5913723 874057
Rata-Rata Retention Time
40
Lampiran 8. Retention Time Standar dan Sampel
Standar (ppm) Retention time
41
Lampiran 9. Analisis Kandungan Katekin Secara Kuantitatif dan Uji Statistik
Perlakuan
K0 K1 K2 K3
Rata-Rata Luas Area Sampel
536592 1168564 5913723 874057
Kadar Katekin (ppm)
Statistic 95% Confidence Interval for Mean
Upper Bound 95% Confidence Interval for Mean
Upper Bound 95% Confidence Interval for Mean
Upper Bound 95% Confidence Interval for Mean
Upper Bound 95% Confidence Interval for Mean
Sum of
Test of Homogeneity of Variances Ulangan
ANOVA Ulangan
Ulangan Duncana
44
Lampiran 10. Out Put High Performance Liquid Chromatography ( HPLC )
a. Out put Standar Katekin 250 Ppm
45
Lampiran 11. Perhitungan Kandungan Katekin Sampel Secara Kuantitatif
Y = bx + a
Y = 8215,14 x - 2146753 Keterangan:
Y = Luas Area Sampel b = koefisien regresi
a = konstansta luas area standar x = kadar katekin
Kandungan katekin kontrol Y = bx + a
536592 = 8215,14 x – 2146753 -8215,14 x = -536592 – 2146753
DAFTAR PUSTAKA
Adrian, M., Jeandet, P., Douillet-Breuil, A.C., Tessosn, L. and Bessis, R. 2000. Stilbene Content of Mature Vitis vinifera Berries in Response to UV- Elicitation. Journal of Agricultural and Food Chemistry. 48: 6103-6105 Alamm G., W., Soegihardjo, C.J., , Sudarsono dan Gobel, R.B. 2002. Jurnal
Bahan Alam Indonesia. 1(1):232-235.
Almagro, L., Lopez, P.A.J. and Pedreno, M.A. 2010. New Method To Enhance Ajmalicine Production In Catharanthus roseus Cell Cultures Based On The Use Of Cyclodextrins. Biotechnology Letters. 3(2): 381 -385 Brannon, C. 2007. Green Tea. Nutrition Dimention Inc. New York
Buitelaar, R.M., Cesario, M.T. and Tramper, J. 1991. Strategies to Improve the Production of Secondary Metabolites with Plant Cell Cultures: a literature review. Jounal of Biotechnology. 23(2): 111 – 141
Cantos, E., Espín, J.C., Fernandez, M.J., Oliva, J. and Tomas, B.F.A. 2003. Postharvest UV-C Irradiated Grapes As Potential Source For Producing Stilbene Enriched Red Wines. Journal of Agricultural and Food
Chemistry.51(5):1208-1214
Chawla, H.S. 2002, Introduction to Plant Biotechnology. Edition 2. Science Publisher Inc. New York. Page. 532
Chen, Z. and Xu, M.N. 2002. Agronomy and Commercial Production of Tea. United Kingdom. London. Pages. 243–256
Day, R.A. and Underwood, A.L. 2002. Analisis Kimia Kuantitatif. Ed ke-5. Pudjaatmaka AH, Penerjemah. Erlangga. Jakarta. Terjemahan dari: Quantitative Analysis.
De, G and Rauen H. 1998. Tissue Injury By Reactive Oxygen Species And The Protective Effects Of Flavonoids. Fundam Pharmacol. Page. 249 Dewi, N.V.A. 2008. Pengaruh Pemberian Polifenol Teh Hijau terhadap
Sebukan Sel Mononuklear Adenokarsinoma. Mammae Mencit C3H. [Skripsi]. Semarang: Fakultas Kedokteran Universitas Diponegoro Ehsanpour, A.A., and Razavizadeh, A. 2005. Effect of UV-C on drought
27
Evans, D.E.J., O.D. Coleman and A. Kearns. 2003. Plant Cell Culture. Bio Scientific Publisher. New York
Gangga, E., Hernita, A., dan N. Linda. 2007. Analisis Pendahuluan Metabolit Sekunder dari Kalus Mahkota Dewa (Phaleria macrocarpa [Skripsi]. Fakultas Farmasi Universitas Pancasila. Jakarta Selatan
Gardner, F.P., R.B. Pearce, dan R.L. Mitchell. 1991. Fisiologi Tanaman Budidaya. UI Press, Jakarta
George, E.F., and P.D. Sherington.1984. Plant Propagation by Tissue Culture. Exegetics Ltd.England.
Ghanati, F., F. Khatami. and E, Bemani. 2013. Effects of UV B and UV C
Radiation on Viability, Growth, and Major Natural Compounds of Malve neglecta L. Cells. Iranian Journal of Plant Physiology. 4(1). 881-887.
Gonzalez, Barrio, R., Beltran, D., Cantos, E., Gil, M.I., Espín, J.C. and Tomas- B.F.A (2006). Comparison of Ozone and UV-C Treatments on the Postharvest Stilbenoid Monomers, Dimers and Trimers Induction in Var. ’Superior’ White Table Grapes. Journal of Agricultural and Food
Chemistry. 54(12): 4222-4228
Gunawan, L.W., 1995, Teknik Kultur Jaringan In Vitro dalam Hortikultura. Penebar Swadaya, Jakarta.
Harborne, J.B. 1987. Metode Fitokimia: Penuntun Cara Modern Menganalisis Tumbuhan, Edisi II, diterjemahkan oleh Padmawinata K., Sudiro I., ITB. Bandung.
Hartanti, F.M., Tutik, N. dan Mukhamad, M. 2012. Budidaya Tanaman Tembakau (Nicotiana tabacum. L. var. Prancak 95) pada Cekaman Kekeringan Polyethylene Glycol (PEG) Secara In Vitro. Institut Teknologi Sepuluh November. Surabaya
Hendayana, S., Kadarohman, A., Sumarna, A., dan Supriatna, A. 1994. Kimia Analitik Instrumen. IKIP Semarang Press. Semarang
Hendaryono, D.P.S. dan A. Wijayani. 1994. Teknik Kultur Jaringan Pengenalan dan Petunjuk Perbanyakan Tanaman secara Vegetatif Modern. Kanisius. Yogyakarta
28
Maeta, K., N, Wataru., T, Yoshifumi., I. Shingo. And I. Yoshiharu. 2007. Green Tea Polyphenols Function as Prooxidants to Activated Oxidative Strees Responsive transcription Factor In Yeasts. Appl Environt Microbial. 73: 572-580
Moreno, R.H.P., Van der Heijden, R. and Verpoorte R. 1994. Cell and Tissue Culture of Catharanthus roseus L.G. Don. a literature survey II. In: Influence of Stress Factors on the Secondary Metabolites in Suspension Cultured Catharanthus roseus Cells. Pages. 9–52
Muchtar, J. 1988. Budidaya Tanaman Teh Gambung. Balai Penelitian Teh dan Kina.12
Murashige, T., 1974. Plant Propagation Through Tissue Cultures. Plant Physiol. 25: 135-136
Namdeo, A. G. 2007. Plant Cell Elicitation for Production of Secondary Metabolites. Pharmacognosy Reviews. India. 1: 67-69
Narayanaswamy, S. 1994. In: Plant Cell Tissue Culture. 72 Tata Mc Graw Hill Publishing Co. Ltd. New Delhi
Padua, L. S. Bunyapraphatsara, N and Lemmen, R. H. M. J. 1999. Plant Resource of South Asia. Prosea Foundation. Bogor. Page 676
Pandey, B. P. 2003. A Textbook of Botany Angiosperm. S. Chand and Company LTD. New Delhi. Pages. 27-36
Pandiangan, D. dan Nainggolan, N. 2006. Peningkatan Kandungan Katarantin pada Kultur Kalus Catharanthus roseus dengan Pemberian Naphtalene Acetic Acid. [Skripsi]. Fakultas MIPA. Universitas Sam Ratulangi. Manado
Parikrama, R. And Esyanti, R.R. 2014. Effect of UV Elicitation on Callus Growth, Alkaloid and Terpenoid Contents in Eurycoma longifolia Jack. Int’l
Journal of Advances in Chemical Engg., & Biological Sciences (IJACEBS). 1(1). 12-13
Punyasiri, P.A.N., Abeysinghe, I.S.B., Kumar, V., Treutter, D., Goschd, C., Marten, S., Forkmann, G. And T.C. Fischer. 2004. Flavonoid Biosynthesis in the Tea Plant Camellia sinensis Properties of Enzymes of the Prominent Epicatechin and Catechin Pathways. Archives of Biochemistry and
Biophysics. 431.22-30
Purwanto, A.W. 2008. Sansievera Flora Cantik Penyerap Racun.Yogyakarta. Kanisius. 26
29
Setiti, E., 2000. Prospek Aplikasi Teknik Kultur Jaringan Dalam
Agrobisnis.Prospek Agrobisnis Menyongsong Otonomi Daerah. Prosiding Fakultas MIPA Unair. Surabaya. 1-6
Sitinjak, R.R., Siregar, A.H. dan Rizkita, R.E. 2000. Pengaruh Pemberian Ekstrak Saccharomyces cerevisiae terhadap Kandungan Gosipol Kultur Kalus Gossypium hirsutum L. Dalam Berita Biologi. 5 (2): 131-135
Staba, E.J. 1980. Plant Tissue Culture as A Source of Biochemicals. CRC. Press, Inc. Boca Raton. Florida. Pages 280-285
Sugiyama, M. 1999. Organogenesis In Vitro. Current Opinion in Plant Biology 2:61–64
Sulastri, 2010. Pengembangan Alfalfa Tropis Toleran Kekeringan Hasil Radiasi Sinar UV-C: Seleksi In Vitro, In Vivo dan Uji Multilokasi. Pusat Teknologi Produksi Pertanian. Jakarta
Sumaryono, W. 1996, Pengkajian Metabolit Sekunder dan Prospeknya PerkembanganIndustri Nasional. Kuliah Tamu pada Forum Himpunan Mahasiswa Kimia FMIPA-ITS-Surabaya, Sub Direktorat Medika- Direktorat Pengkajian Ilmu Dasar dan Terapan BPPT. Agromedia Pustaka. Jakarta.12-14
Sutini, 2008. Meningkatkan Produksi Flavan-3-ol Melalui kalus Camellia sinensis L. dengan Elisitor Cu 2+. Journal of Biological Researches. 14: 39-44
Sutini, 2010. Produksi Epigallocatechin Gallate Melalui Kalus Camellia Sinensis L., dengan Induksi Elisitor, Cu2+, Asam Salisilat dan Prekursor Fenilalanin. Disertasi. Program Pascasarjana Fakultas Pertanian. Universitas Brawijaya. Malang
Sutini, 2012. Identifikasi Polifenol pada Kultur Kalus in Vitro Kalus Camellia sinensis untuk Bahan Minuman Fungsional. Jurnal Rekapangan. 6: 19-23
Tabata, M. 1977. Recent advances in the Production of Medicinal Substances by Plant Cell Cultures. Springer-Verlag. New York. 3-16
Vanisree, M., Chen Y.L., Shu, F.L., Nalawade, S.M., Lin, C.Y and Hsin, S.T. 2004. Studies on the Production of some Important Secondary Metabolites from Medicinal Plants by Plant Tissue Cultures. Agricultural Research Institute. Taiwan. 413(45).1-22
30
Versari, A., Parpinello, G.P., Tornielli, G.B., Ferrarini, R. and Giulivo, C. 2001. Stilbene Compounds and Stilbene Synthase Expression During Ripening Wilting and UV Treatment in Grape cv. Corvina. Journal of Agricultural and Food Chemistry.49(11). 5531–5536
Watimena, G.A. 1992. Bioteknologi Tanaman. IPB Pusat antar Universitas. Bogor Wetter, L. R. and Constabel, F. 1991. Metode Kultur Jaringan Tanaman. Ed Ke2.
Institut Teknologi Bandung. Bandung. 2
Williges, U. 2004. Status of Organic Agriculture in Sri Lanka with Special Emphasis on Tea Production Systems (Camellia Sinensis (L.)O. Kuntze) Disertasi.Faculty of Plant Production. Justus-Liebig-University of Giessen
Yang, C.S. and J.M. Landau. 2000. Effects of Tea Consumption On Nutritition and Health. Journal Nutrition. 130: 2409-2413
Yusnita. 2003. Kultur Jaringan: Cara Memperbanyak Tanaman Secara Efisien. Agromedia Pustaka. Jakarta. 19-25
Zakaria, D. 2010. Pengaruh Konsentrasi Sukrosa dan BAP (Benzil Amino Purin) dalam Media Murashige dan Skoog (MS) terhadap Pertumbuhan dan Kandungan Reserpin Kalus Pule Pandak (Rauvolfia verticilata Lour.). [Skripsi]. Surakarta. Universitas Sebelas Maret
BAB 3
METODE PENELITIAN
3.1 Waktu Dan Tempat
Penelitian ini telah dilaksanakan pada bulan September 2013 sampai dengan September 2014 di Laboratorium Fisiologi Tumbuhan Kultur Jaringan Tumbuhan Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam dan Laboratorium Pengujian Mutu dan Residu Pestisida Medan Johor Sumatera Utara.
3.2 Alat Dan Bahan 3.2.1 Alat
Adapun alat yang digunakan pada penelitian ini adalah autoklaf, oven, beaker glass, gelas ukur, pipet volume, drag ball, hot plate, magnetik stirer, pH meter, erlenmeyer, timbangan analitik, pipet tetes, spatula, panci, batang pengaduk, kompor, Laminar Air Flow (LAF), aluminium foil, plastik, karet gelang, botol kultur dan label tempel, bunsen, mancis, pinset, gunting, pisau, anak pisau, cawan petri, kertas saring dan masker, entkas, lampu ultraviolet C (UV-C), mortal dan alu, labu ukur, termometer, corong pisah, statif dan klem, rotari evaporator, tisue, sonikator, tabung reaksi, rak tabung reaksi, kertas whatmann 2 µm, botol pial dan HPLC (High Performance Liquid Chromathography).
3.2.2. Bahan
Adapun bahan yang digunakan dalam penelitian ini adalah sumber eksplan pucuk tanaman teh (Camellia sinensis L.) varietas Gambong yang diambil dari Pusat Penelitian Teh dan Kina Bah Butong Sidamanik Kabupaten Simalungun (Lampiran 1. Gambar a. Halaman 31), media Murashige dan Skoog ( MS )
(Lampiran 2. Halaman 32), 2,4-D 1 ppm, kinetin 1 ppm, agar, HCl 1 N, KOH 1 N, sukrosa atau gula putih, aquades, alkohol 70 %, detergent, fungisida, tween 8
0
11
3.3 Rancangan Penelitian
Rancangan yang digunakan dalam penelitian ini adalah Rancangan Acak Lengkap Satu Arah (Complete Randomized Design One Way). Perlakuan pada penelitian ini adalah pemberian elisitor berupa sinar Ultraviolet C (UV-C) dengan 4 tingkat lama penyinaran yaitu 0 menit ( kontrol ), 15 menit, 30 menit dan 45 menit dengan 6 kali ulangan yang diaplikasikan pada sub kultur ke-2 minggu ke-4 (Adrian et al., 2000; Versari et al., 2001; Cantos et al., 2003; Gonzalez-Barrio et al., 2006; Almagro et al. 2010).
Keterangan: K0= Disinari UV-C 0 menit (kontrol) K1= Disinari UV-C 15 menit
K2= Disinari UV-C 30 menit K3= Disinari UV-C 45 menit
3.4 Cara Kerja 3.4.1 Sterilisasi Alat
Semua peralatan gelas yang akan digunakan dicuci bersih dan dikeringkan. Alat-alat tersebut disterilisasi dalam autoklaf pada suhu 121 °C dengan tekanan 15
psi selama 15 menit. Bersamaan dengan itu aquades dalam erlenmeyer yang telah ditutup dengan aluminium foil juga ikut disterilkan. Kemudian disimpan di ruang pemeliharaan kultur yang telah aseptik dengan cara disemprot setiap hari dengan menggunakan alkohol 70%. Suhu ruangan tetap di jaga berkisaran 25 °C dengan
pengaturan AC.
3.4.2 Sterilisasi bahan
Untuk sterilisasi bahan tanaman dilakukan dengan mengambil pucuk daun teh (Camellia sinensis L.) pada daun ke-2. Daun teh tersebut digosok dengan sunlight sambil dicuci di bawah air mengalir sampai bersih. Kemudian direndam di
12
direndam dalam larutan HgCl 0,5% selama 2 menit lalu dibilas 3 kali dengan akuades steril. Selanjutnya, dipindahkan pada cawan petri steril.
3.4.3 Pembuatan Media
Kombinasi media yang digunakan yaitu 1 ppm 2,4 - D dan 1 ppm kinetin. Menurut penelitian Sutini et al. (2009), kombinasi media 2,4 - D 1 ppm dan kinetin 1 ppm merupakan media yang paling baik untuk pertumbuhan kalus teh (Camellia sinensis L.) dan memproduksi katekin paling tinggi.
Tahap awal pembuatan media dalah pembuatan larutan stok, yang terdiri dari stok hara mikro iron, mio-inositol vitamin dan zat pengatur tumbuh. Sementara sukrosa dan agar-agar ditimbang langsung sesuai kebutuhan tanpa harus dijadikan larutan stok.
Pembuatan larutan Murashige dan Skoog diawali dengan cara hara makro, iron, vitamin, sukrosa dimasukkan ke dalam erlenmeyer yang ditambahkan akuades hingga 500 mL kemudian ditambahkan akuades hingga 1000 mL. Selanjutnya dimasukkan 2,4 - D dan kinetin. Kemudian diukur derajat keasaman (pH) yang diukur setiap perlakuan dengan menggunakan pH meter 5,8. Untuk mendapatkan pH yang optimum maka bisa ditambahkan NaOH 0,1 N atau HCl 0,1 N.
Pada setiap media 1000 mL ditambahkan 7 g agar-agar dan gula 3 g sambil dimasak sampai mendidih. Media dimasukkan ke dalam botol-botol kultur, mulut botol kultur ditutup alumunium foil, ditutup dengan plastik kemudian diikat dengan karet. Kemudian botol-botol itu disterilkan dengan autoklaf pada tekanan 15 psi, pada suhu 121 °C selama 30 menit, setelah selesai kemudian disimpan di rak kultur
dengan suhu 25 °C selama 4 hari setelah itu media siap dipakai.
3.4.4 Penanaman Eksplan
13
bunsen agar lebih steril. Pucuk daun teh yang telah steril dihilangkan tulang dan tepi daun, kemudian dipotong-potong dengan ukuran 2 cm untuk induksi kalus. Potongan ditanam sebanyak 1 eksplan per botol kultur. Setelah botol diisi eksplan botol kemudian ditutup dengan menggunakan aluminium foil, plastik dan diikat dengan karet. Botol kultur di inkubasi di ruang dengan suhu 25 °C dan disusun
sesuai dengan layout perlakuan dan ditutup dengan kain hitam.
3.4.5 Pemeliharaan Eksplan
Botol-botol yang berisi eksplan disusun pada rak kultur sesuai dengan layout penelitian. Intensitas cahaya yang digunakan pada rak kultur adalah dengan
menggunakan lampu neon 500 lux, suhu ± 25 °C, ditutup dengan kain berwarna
hitam dan disemprot alkohol 70% setiap hari.
3.4.6 Pemberian Elisitor Sinar Ultraviolet (UV) C
Setelah kalus tumbuh, dilakukan sub-kultur sebulan sekali sebanyak 2 kali. Perlakuan elisitor sinar UV C dengan 4 lama penyinaran 0 ( Kontrol), 15, 30 dan 45 menit yang diaplikasikan pada saat kalus berumur 4 minggu setelah sub kultur ke-2.
3.4.7 Analisis Kandungan Katekin
Untuk menganalisis kandungan katekin pada Camellia sinensis L. Dilakukan dengan cara sebagai berikut:
1. Ekstraksi Kalus
Dengan cara kalus ditimbang 250 mg dihaluskan menggunakan mortal dan alu dan ditambah 10 mL aquabides panas temperatur 70-80 °C, didiamkan selama ±
14
kemudian diekstraksi dengan 12,5 mL etil asetat terbentuk fase etil asetat yang terdiri dari 2 lapisan yang diambil adalah lapisan bawah lakukan sebanyak 3 kali kemudian ditampung ekstrak katekin lalu dirotari evaporator dengan kecepatan 280 rpm dan suhu 75 °C sampai terbentuk kerak atau endapan katekin. Setelah itu
dinginkan dan larutkan menggunakan ethanol sampai volumenya 5 mL disaring menggunakan kertas saring Whatmann 0,2 µm dan masukkan ke dalam botol pial (Lampiran 1. Gambar b. Halaman 31) (Harbone 1987 dimodifikasi oleh Sutini 2008).
2. Analisis katekin dengan HPLC (High Performance Liquid Chromatography) Untuk mengetahui kandungan katekin pada kalus teh terlebih dahulu diatur kondisi operasional HPLC berupa temperatur 30ºC-40 °C, panjang gelombang 275 nm, fase gerak terdiri dari ethanol: aquabides: etil asetat = 20:75:5, laju alir fase gerak 1 mL/ menit, kolom yang digunakan adalah C18 dan detektor yang digunakan adalah UV Vis Shimadzu. Dibuat larutan standar katekin dengan
berbagai macam konsentrasi dengan kadar 250, 500, 750 dan 1000 ppm, kemudian masing-masing konsentrasi disuntikkan sebanyak 100 μL pada instrumen HPLC dengan kondisi operasional yang sudah di seting.. maka akan didapat kromatog dengan retention time (tR). Setelah itu diidentifikasi dengan cara membandingkan retention time larutan standar katekin dengan ekstrak kalus katekin (Jhonson et al.,
1978 dimodifikasi oleh Sutini 2008).
3.5 Parameter yang Diamati
Parameter yang diamati adalah: a. Morfologi kalus
Morfologi kalus berupa warna dan tesktur kalus diamati secara langsung dengan kasat mata di awal tumbuh, saat sub kultur dan di akhir penelitian.
b. Berat kering kalus
Untuk mendapatkan kalus yang kering adalah kalus basah tiap perlakuan dikeringkan didalam oven selama 3 jam dengan suhu 60 °C sampai beratnya
15
c. Indeks Pertumbuhan Kalus
Indeks pertumbuhan dihitung dengan rumus: Indeks Pertumbuhan (IP) = Berat akhir kalus
Berat awal kalus d. Kandungan Katekin Secara Kualitatif
Kandungan katekin secara kualitatif diperoleh dengan membandingkan
retention time larutan standar dengan retention time sampel, jika retention time
larutan standar dan sampel hampir sama maka sampel tersebut mengandung katekin.
e. Kandungan Katekin Secara Kuantitatif
Kandungan Katekin Secara Kuantitatif diperoleh dengan cara terlebih dahulu dicari analisis regresi linear dari larutan standar sehingga didapatkan Y= bx + a. Setelah itu area sampel diinterpolasi ke dalam analisis standar regresi linear tersebut.
3.6 Analisis Data
Data dianalisis dengan Analisis of Variance (ANOVA) dengan SPSS versi 21. Jika terdapat perbedaan yang nyata (p>0.05), dilanjutkan dengan Uji Duncan New Multiple Range Test (DNMRT) pada taraf 5 % dan data regresi linear
BAB 4
HASIL DAN PEMBAHASAN
4.1 Morfologi Kalus
4.1.1 Morfologi Kalus Awal Pertumbuhan
Berdasarkan hasil penelitian sebelum terbentuknya kalus terlebih dahulu eksplan menggembung dan kemudian kalus muncul dibagian tepi eksplan yang dapat di lihat pada ( Gambar 4.1.1)
b
c
a
1 cm
Gambar 4.1.1 Morfologi kalus di awal muncul, a): Media, b): Sisa ekplan, c): Kalus
Dari Gambar 4.1.1 dapat dilihat bahwa kalus muncul di tepi eksplan. Menurut Hartanti et al. (2012), hal itu terjadi karena di semua tepi eksplan telah dilukai sehingga eksplan pada media inisiasi kalus mengalami pertambahan volume karena terjadinya pembesaran ukuran sel-selnya. Eksplan mulai menggembung pada usia tanam 3-7 hari. Menurut Sutini (2008), eksplan daun menggembung mulai dari tepi eksplan yang terpotong hal ini disebabkan tepi yang terpotong mengambil nutrisi dari media untuk membentuk kalus, hingga seluruh eksplan membentuk kalus secara keseluruhan.
17
organ yang terpotong untuk merespon/melindungi sebagai respon perlindungan tanaman untuk memperbaiki jaringan yang rusak. Kalus mulai muncul pada usia tanam 7 sampai 21 hari, kalus muncul diawal berwarna putih dan berbentuk kompak, rapat, padat, dan sulit dipisah-pisahkan. Pada permukaan bawah eksplan yang tumbuh menjadi kalus terlihat kondisi jaringan yang berair. Kondisi ini disebabkan bagian jaringan yang ada di permukaan bawah langsung bersentuhan dengan media dan berperan sebagai area penyerapan media. Menurut Verporte (1983) kalus putih merupakan akibat dari tidak terbentuknya kloroplas dimana hal ini dapat terjadi karena sitokinin lebih dulu digunakan untuk pertumbuhan eksplan menjadi kalus. Menurut Hendaryono dan Wijayani (1994), massa sel ini terbentuk di seluruh permukaan irisan eksplan sehingga semakin luas permukaan irisan eksplan semakin cepat dan semakin banyak kalus yang terbentuk.
4.1.2 Morfologi Kalus Sub Kultur dan Akhir Penelitian
Berdasarkan hasil penelitian didapatkan pertumbuhan kalus dari sub kultur 1 sampai akhir penelitian yang dibuktikan dengan bertambah besarnya ukuran kalus, warna dan tekstur kalus diamati setia sub kultur dan di akhir penelitian dapat dilihat pada ( Gambar 4.1.2 ).
a
1 cmb
1 cmc
1 cmd
1 cmGambar 4.1.2 Morfologi kalus sub kultur dan akhir penelitian, a): Sub kultur 1, b): Sub kultur 2, c): Akhir penelitian sebelum di elisitasi, d): setelah di elisitasi
18
kalus tetap tersedia. Menurut Hartanti et al. (2012), warna putih pada kalus menandakan keberadaan leukoplas atau etioplas pada sel yaitu butir-butir plastida yang tidak berwarna dan mengandung pati.
Tekstur kalus dari sub kultur 1 sampai akhir penelitian yaitu kompak. Menurut Hartanti et al. (2012), kalus yang kompak ditandai dengan bentuknya yang terorganisir dan terlihat padat. Pada perlakuan ini, potensial osmotik medium lebih rendah dibandingkan potensial osmotik sel sehingga air beserta zat-zat hara dapat masuk ke dalam sel secara osmosis. Keberadaan air dan zat-zat hara tersebut akan meningkatkan turgiditas (kekakuan) dinding sel dimana secara morfologi hal tersebut ditandai dengan terbentuknya kalus kompak.
Menurut Alam et al. (2002), sub kultur dilakukan untuk memberikan makanan baru, karena dalam media lama telah terjadi gradien makanan, dan pada daerah sekitar kalus jumlah makanan sangat berkurang. Menurut Sugiyama (1999), bahwa sel pada jaringan eksplan harus memiliki sifat kompeten. Sifat kompeten merupakan kemampuan dari sel atau jaringan untuk merespon sinyal dari zat pengatur tumbuh yang ditambahkan, sehingga sel atau jaringan dapat berkembang.
Menurut Sutini (2010) apabila kalus sudah mulai berproliferasi dengan luas ±1-2 cm sebaiknya segera dilakukan perbanyakan/sub kultur untuk mendapatkan masa yang lebih banyak, menghindari kontaminasi dan kematian sel. Menurut Pandiangan dan Nainggolan (2006) setelah subkultur, pertumbuhan kalus terlihat
lebih cepat, bila dibandingkan dengan kultur sebelumnya (tahap induksi) dan warna
kalus semakin terang. Hal ini menunjukkan bahwa sel sudah mulai beradaptasi
dengan lingkungannya terutama dengan media, sehingga kalus yang terbentuk
tampak lebih baik. Besar atau ukuran kalus mengalami peningkatan seiring dengan
meningkatnya konsentrasi NAA yang diberikan pada media. Berat kering kalus
juga mengalami hal yang sama.
4.2 Berat Kering Kalus
Hasil analisis statistik terhadap berat kering kalus menunjukkan bahwa bahwa K1 dan K3 berbeda nyata dengan K0 dimana berat keringnya lebih rendah dari K0
19
Tabel 4.2 Berat Kering Kalus
Perlakuan
Keterangan : Nilai yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji DNMRT. ** p > 0,05
Dari Tabel 4.2 dapat dilihat berat kering kalus yang paling tinggi yaitu pada
K0 sebesar 0,26 g sedangkan berat kering yang paling rendah yaitu pada perlakuan
K1 sebesar 0,18 g. Perbedaan berat kering kalus tersebut tergantung pada
kandungan air yang ada pada kalus.
Dari (Lampiran 3. Halaman 33) dapat dilihat nilai signifikansi atau P=
0,01<0,05 yang berarti bahwa berat kering kalus dengan perlakuan tidak signifikan
atau memiliki varian yang berbeda. Hal ini sesuai dengan penelitian yang telah
dilakukan (Ghanati et al., 2013 dan Parikrama and Esyan, 2014) dimana berat
kering kontrol lebih tinggi daripada semua perlakuan dan uji statistik tidak
signifikan. Menurut Ghanati et. al (2013), menurunnya berat kering karena
penyinaran sinar UV-C terjadi karena sinar UV-C merusak viabilitas sel. Semakin
lama penyinaran maka semakin tinggi kerusakan viabilitas sel.
Bobot kering kalus mencerminkan pertumbuhan kalus yang sebenarnya. Penimbunan bobot kering umumnya digunakan sebagai petunjuk yang memberikan ciri pertumbuhan (Gardrner et al., 1991).
4.3 Indeks Pertumbuhan Kalus
Indeks Pertumbuhan kalus digunakan untuk mengetahui pertumbuhan kalus. Indeks pertumbuhan diperoleh dengan membandingkan berat kering kalus dengan berat basah kalus setelah di elisitasi. Indeks Pertumbuhan dapat dilihat pada (Tabel 4.3). Tabel 4.3. Indeks Pertumbuhan Kalus
Perlakuan
20
Dari Tabel 4.3 dapat dilihat bahwa indeks pertumbuhan kalus paling tinggi terdapat pada perlakuan K0 sedangkan indeks pertumbuhan paling rendah terdapat pada perlakuan K1. Dari Tabel 4.3 dilihat bahwa K0 berbeda nyata dengan K1 dan K3 tetapi tidak dengan K2. Dari (Lampiran 7. Halaman 41) dilihat nilai signifikansi atau P= 0,49 > 0,05 yang berarti indeks pertumbuhan signifikan atau tidak
memiliki varian yang berbeda. Dari Tabel 4.3 juga dilihat F hitung > F Tabel yaitu 7,983 > 0,000 (Lampiran 4. Halaman 35) yang berarti bahwa perlakuan berpengaruh terhadap indeks pertumbuhan.
Lama radiasi 30 dan 60 menit didasarkan pada hasil penelitian Ehsanpour and Razavizadeh ( 2005) bahwa pada lama radiasi UV-C 30 dan 60 menit akan
menginduksi mutasi (variasi somaklonal) pada kalus, sedangkan lama radiasi kurang dari 30 menit tidak menginduksi mutasi dan lebih dari 60 menit akan menyebabkan kematian sel jaringan.
4.4 Kurva Analisis Standar Regresi Linear
Analisis regresi linear dari kurva standar dapat dilihat pada (Lampiran 6, halaman 38) mempunyai nilai 0,97729 yang berarti bahwa rata-rata kadar katekin standar sebesar 0,97729. Besarnya linearitas ini mendekati nilai satu sehingga dapat dikatakan bahwa absorbansi merupakan fungsi yang besarnya berbanding lurus dengan konsentrasi dan mengikuti persamaan regresi linear Y= bx + a. Berdasarkan hasil uji statistik, diperoleh nilai intercept sebesar -2146753 dan slope sebesar 8215,14 sehingga persamaan yang diperoleh dari kurva y = 8215,14 x – 2146753.
Menurut Pandiangan dan Nainggolan (2006), Kurva standar tersebut digunakan untuk analisis kuantitatif metabolit sekunder. Untuk mendapatkan konsentrasi metabolit sekunder diperoleh dengan cara mengkonversikan luas area sampel dengan luas area standar yang telah diketahui konsentrasinya pada kurva standar.
4.5 Analisis Kandungan Katekin
4.5.1 Analisis Kandungan Katekin Secara Kualitatif
K
Tabel 4.5.1 Analisis Kandungan Katekin Secara Kualitatif
Rata-Rata Retention time
Standar katekin Sampel katekin
3,3020 3,4271
Dari Tabel 4.6.1 dilihat bahwa rata-rata retention time sampel katekin bila dibandingkan dengan retention time standar katekin mempunyai retention time yang hampir sama. Hal ini berarti perlakuan elisitor dengan penyinaran sinar UV-C mengandung katekin.
Menurut Sutini (2012), perbedaan retention time antara standar dan sampel katekin dikarenakan kalus diduga mengandung senyawa lain sehingga waktu retensi terdapat perbedaan yang kurang bermakna. Selain itu, menurut Gangga et al. (2007) ada perbedaan profil kromatogram tetapi dengan adanya perbedaan itu
tidak menutup kemungkinan ada senyawa yang sama karena pada beberapa retention time memberikan puncak yang sama walau tinggi puncaknya sedikit
berbeda. Hal ini mungkin disebabkan dari konsentrasi senyawa yang tidak sama.
4.5.2 Analisis Kandungan Katekin Secara Kuantitatif
Kandungan katekin secara kuantitatif diperoleh dengan cara terlebih dahulu dicari analisis regresi linear dari larutan standar sehingga didapatkan Y= bx + a. Setelah itu area sampel diinterpolasi ke dalam analisis standar regresi linear tersebut. Kandungan katekin secara kuantitatif dapat dilihat pada ( Lampiran 13, halaman 39) dan pada ( Gambar 4.6.2)
22
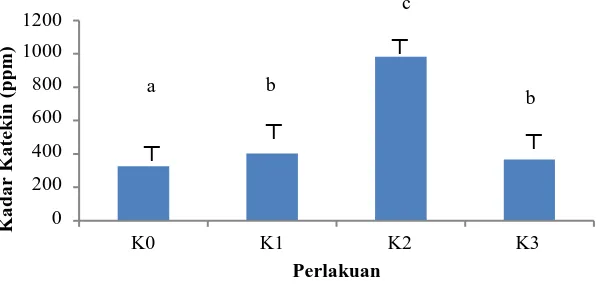
Dari Gambar 4.5.2 dapat dilihat kandungan kadar katekin yang paling rendah terdapat pada K0 yaitu sebesar 326,63412 ppm (Lampiran 9, halaman 41) dan yang paling tinggi terdapat pada perlakuan K2 yaitu sebesar 981,17330 ppm (Lampiran 13, halaman 39). Hal ini membuktikan bahwa perlakuan elisitor dengan penyinaran UV-C dapat meningkatkan produksi katekin pada kalus teh (Camellia sinensis L.). Dari Gambar 4.5.2 juga dapat dilihat bahwa K1 kadarnya meningkat
dibanding K0. K2 kadarnya meningkat dibanding K1, sedangkan K3 mengalami penurunan kadar dibandingkan dengan K2 . Perlakuan K2 (penyinaran 30 menit) merupakan perlakuan elisitor yang paling baik untuk memproduksi katekin dari kalus teh..
Menurut Chen et al. (2002) kandungan komponen senyawa katekin pada daun teh segar adalah 13,5 – 31%. Menurut Sitinjak et al. (2000), lama elisitasi mempengaruhi kandungan metabolit sekunder dengan adanya efek post binding. Efek post binding merupakan efek yang terjadi setelah efektor diterima reseptor. Peningkatan kandungan katekin setelah diberi elisitor berupa penyinaran sinar UV-C diduga karena terinduksinya serangkaian proses yang mengarah pada akumulasi katekin. Moreno et al. (1994) menyatakan bahwa hasil interaksi antara elisitor dengan reseptor yang ada pada membran sel tanaman akan memicu jalur tranduksi sinyal, antara lain mengaktivasi secondary messenger (misalnya Ca2+ dan
kalmodulin) yang akan menginduksi protein kinase untuk berperan dalam induksi transkripsi gen.
Konsentrasi elisitor merupakan salah satu faktor pembatas yang
menentukan kandungan metabolit sekunder pada kultur jaringan yang dielisitasi. Hal ini menunjukkan bahwa pada membran plasma terdapat reseptor untuk elisitor dengan jumlah tertentu, sehingga untuk meningkatkan kandungan katarantin diperlukan konsentrasi elisitor yang optimum. Kontak antara elisitor dan reseptor memerlukan waktu yang optimum hingga dihasilkan metabolit sekunder yang maksimum. Waktu elisitasi tersebut menggambarkan lamanya waktu yang
23
tertentu seperti toleransi terhadap salinitas tinggi, kekeringan atau produksi metabolit sekunder (Sulastri, 2010).
Tanaman kaya akan senyawa bioaktif antara lain alkaloid, glikosida, flavonoid dan minyak atsiri dengan perbandingan sesuai dengan aktifitas fitokimia suatu tanaman. Kultur jaringan tanaman merupakan alternatif yang paling baik untuk memproduksi metabolit sekunder (Ramachandra and Ravishankar, 2002). Seperti yang diketahui juga, bahwa komposisi dari nutrien media dengan
kombinasi antara auksin dan sitokinin tidak hanya berhasil dalam kultur jaringan tetapi juga berhasil dalam memproduksi metabolit sekunder (Narayanaswamy, 1994).
Biosintesis dari katekin adalah senyawa flavonoid dari golongan
leukosianidin dibentuk dari dihidroquersetin dengan katalis enzim dihidroflavonol 4‐reduktase. Golongan leukosianidin ini merupakan senyawa penting pada tanaman dalam memproduksi tanin terkondensasi. Enzim leukosianidin 4‐reduktase secara langsung mengatalisis perubahan leukosianidin menjadi (+)‐katekin (golongan flavan‐3ol). Isomer (+)‐ katekin, yaitu(‐)‐epikatekin, merupakan senyawa dari golongan flavan‐3ol yang banyak terdapat ditanaman, terutama teh. Berbeda
dengan isomernya, (‐)‐epikatekin tidak secara langsung terbentuk dari leukosianidin. Pertama, dengan katalis enzim leukosianidin deoksigenase
leukosianidin dikonversi terlebih dahulu menjadi sianidin (golongan antosianidin). Sianidin inilah yang kemudian diubah menjadi(‐) epikatekin oleh enzim
antosianidin reduktase. Tanin terkondensasi didapat dari hasil polimerasi leukosianidin dan flavan‐3ol (Punyasiri et al., 2004).
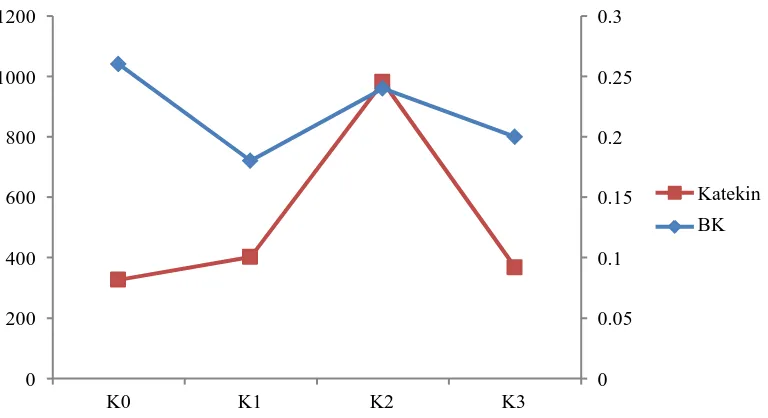
4.6 Hubungan Berat Kering dengan Kandungan Katekin
24
1200
1000
800
0.3
0.25
0.2
600
400
200
0
0.15
0.1
0.05
0
Katekin
BK
K0 K1 K2 K3
Gambar 4.6 Hubungan berat kering dengan kandungan katekin Dari Gambar 4.6 dapat kita lihat berat kering paling tinggi terdapat pada K0 tapi kandungan katekinnya paling rendah. Berat kering K1 lebih rendah dari K0 tetapi kandungan katekinnya meningkat dari K0. Berat kering K2 lebih tinggi dari K1 dan kandungan katekinnya meningkat dari K1. Berat kering K3 lebih rendah dari K2 dan kandungan katekinnya menurun dari K2. Penelitian pengaruh sinar UV-C telah dilakukan oleh (Ghanati et al., 2013, Parikrama and Esyanti, 2014 ) dimana berat kering kontrol atau tanpa penyinaran sinar UV-C lebih tinggi dan kandungan metabolit sekundernya paling tinggi dengan penyinaran sinar UV-C selama 30 menit.
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Adapun kesimpulan dari penelitian ini adalah:
a. Elisitor dengan pemberian sinar UV C mampu meningkatkan produksi katekin dari kalus pucuk daun teh (Camellia sinensis L.).
b. Lama penyinaran sinar UV C yang paling baik untuk meningkatkan produksi katekin adalah lama penyinaran 30 menit yang menghasilkan kandungan katekin 981,17330 ppm.
c. Berat kering tertinggi adalah kontrol sebesar 0,26 g sedangkan terendah adalah disinari UV C 15 menit sebesar 0,18 g. Indeks pertumbuhan tertinggi adalah kontrol sebesar 0,16 g sedangkan indeks pertumbuhan terendah adalah disinari UV C 15 menit sebesar 0,11 g.
5.2 Saran
BAB 2
TINJAUAN PUSTAKA
2.1 Botani Teh (Camellia sinensis L.)
Tanaman teh berasal dari daerah pegunungan di Assam, China, Burma,Thailand, dan Vietnam. Produksi teh maksimum dicapai pada suhu 13-30 oC. Tanaman teh
tumbuh baik pada kondisi tanah vulkanik muda dengan drainase yang baik dan tanah yang masam (pH 4.5-5.5 ). Teh tidak tahan terhadap kekeringan yang lama, karenanya teh terpusat didaerah bagian barat Indonesia yang memiliki curah hujan antara 2500 mm per tahun sampai 3500 mm per tahun( Sutini, 2008).
5
Taksonomi dari teh adalah sebagai berikut: Kerajaan
: Camellia sinensis L. (Padua et al., 1999 and Pandey, 2003)
2.2 Metabolit Sekunder
Metabolit sekunder adalah senyawa metabolit yang digunakan secara langsung bagi pertumbuhan organisme dan ditemukan dalam bentuk yang unik atau berbeda-beda antara spesies yang satu dan lainnya. Setiap organisme biasanya menghasilkan senyawa metabolit sekunder yang berbeda-beda, bahkan mungkin satu jenis senyawa metabolit sekunder hanya ditemukan pada satu spesies dalam suatu kingdom. Senyawa ini juga tidak selalu dihasilkan, tetapi hanya pada saat dibutuhkan saja atau pada fase-fase tertentu. Fungsi metabolit sekunder adalah untuk mempertahankan diri dari kondisi lingkungan yang kurang menguntungkan, misalnya untuk mengatasi hama dan penyakit, menarik polinator, dan sebagai molekul sinyal. Singkatnya, metabolit sekunder digunakan organisme untuk berinteraksi dengan lingkungannya (Dewi, 2008).
Senyawa metabolit sekunder merupakan senyawa yang disintesis oleh suatu makhluk hidup bukan untuk memenuhi kebutuhan dasarnya, akan tetapi untuk mempertahankan eksistensinya dalam berinteraksi dengan ekosistem. Dalam proses interaksi dengan lingkungan hidupnya, seringkali kadar metabolit sekunder yang disintesis berubah-ubah. Secara khusus, senyawa metabolit sekunder
mempunyai fungsi umum yaitu sebagai alat pengikat (attractant) bagi serangga atau hewan lainnya untuk membantu penyerbukan, sebagai alat penolak (repellant) terhadap gangguan hama atau hewan pemangsanya, dan sebagai alat pelindung (protectant) terhadap kondisi lingkungan fisik yang ekstrim (Sumaryono, 1996).
6
2.3 Katekin
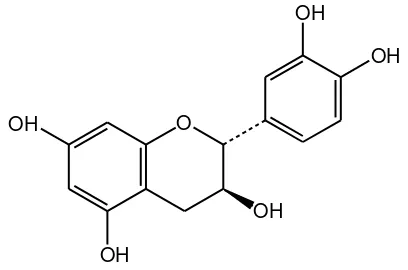
Katekin bersifat asam lemah (pKa1 = 7,72 dan pKa2 = 10,22) sukar larut dalam air dan sangat tidak stabil diudara terbuka. Bersifat mudah teroksidasi pada pH mendekati netral (pH 6,9) dan lebih stabil pada pH lebih rendah (2,8 dan 4,9). Katekin juga mudah terurai oleh cahaya dengan laju reaksi lebih besar pada pH rendah (3,45) dibandingkan pH 4,9 (Maeta et al., 2007). Sifat fisikokimianya menjadi tantangan tersendiri dalam formulasi katekin menjadi sediaan obat. Struktur kimia dari katekin adalah sebagai berikut:
OH
OH
OH O
OH
OH
Gambar 2. Struktur Kimia Katekin 2.4 Kultur Jaringan
Praktik luar kultur jaringan tanaman bermula dari pembuktian sifat
totipotensi (total genetic potential) sel, yaitu bahwa setiap sel tanaman yang hidup dilengkapi dengan informasi genetik dan perangkat fisiologis yang lengkap untuk tumbuh dan berkembang menjadi tanaman utuh, jika kondisinya sesuai (Yusnita, 2003). Kearah mana sel-sel tanaman dapat diinduksi untuk mengekspresikan totipotensinya sangat tergantung pada sejumlah variabel termasuk faktor eksplan, komposisi medium, zat pengatur tumbuh, dan stimulus fisik, seperti cahaya, suhu dan kelembaban. Sebagai konsekuensinya, keberhasilan teknik kultur jaringan sangat tergantung pada optimasi variabel-variabel tersebut Aplikasi kultur jaringan tanaman bermanfaat terutama dalam perbanyakan klon atau perbanyakan massal dari tanaman yang sifat genetiknya identik satu sama lain (Zulkarnain, 2009).
7
Sel yang berasal dari spesies tanaman apapun dapat dibiakkan atau dikulturkan secara aseptik pada medium hara. Kultur biasanya dimulai dengan menanamkan satu iris jaringan steril pada medium hara yang dipadatkan dengan agar. Dalam waktu 2-3 minggu akan terbentuk kalus. Kalus semacam ini dapat disubkulturkan dengan memindahkan potongan kecil pada medium agar segar. Jika diinginkan kultur suspensi sel kalus dipindahkan pada medium cair, dan wadahnya kemudian ditempatkan pada pengocok. Berangsur-angsur dalam waktu beberapa minggu dan dengan melakukan subkultur, akan didapat kultur suspesi sel. Waktu yang dibutuhkan untuk mendapatkan kalus dan kultur suspensi sel amat beragam, dan terutama bergantung pada jaringan eksplan dan komposisi medium kultur. Kultur suspensi sel terdiri dari campuran agregat sel, kumpulan sel dan sel tunggal (Wetter and Constabel, 1991).
2.5 Kultur Jaringan Untuk Memproduksi Metabolit Sekunder
Kemampuan totipotensi adalah kemampuan setiap sel untuk tumbuh menjadi tanaman sempurna bila diletakkan dilingkungan yang sesuai (Suryowinoto, 1991 cit. Hendaryono dan wijayanti, 1994). Pada prinsipnya kultur jaringan memerlukan tiga tahap utama. Tahap pertama meliputi, yaitu menjaga agar kultur yang
ditumbuhkan dapat berkembang dengan baik dalam kondisi aseptik. Tahap kedua adalah melakukan usaha agar dapat terjadi multiplikasi (penggandaan) propagula dengan cepat sehingga diperoleh tunas dalam jumlah besar. Tahap ketiga
merupakan persiapan pemindahan planlet ke media tanam dalam pot atau tanah. Perkembangan teknik perbanyakan klon melalui kultur in vitro mengarah kepada optimasi beberapa aspek penting, yaitu sifat eksplan awal, komposisi media, kondisi fisik media, dan lingkungan kultur (Murashige, 1974). Keuntungan kultur jaringan diantaranya, yaitu mendapatkan tanaman baru dengan waktu relatif singkat dan produksi metabolit sekunder. Menurut Gunawan (1995) melalui kultur kalus dan kultur sel dapat memproduksi metabolit sekunder.
8
demikian, sistem kultur suspensi sel sering menghadapi banyak masalah, utamanya yang menyangkut “dinamika sel”, yaitu bahwa sel yang berada dalam perubahan bentuk maupun lingkungan akan mengakibatkan biosintesis metabolit sekunder akan meningkat atau menurun (Staba,1980).
Kultur jaringan dapat digunakan sebagai metode alternatif untuk
memperoleh metabolit sekunder. Kultur organ, terutama kultur akar, merupakan salah satu tipe kultur jaringan yang banyak digunakan untuk mempelajari biosintesis metabolit sekunder (Hashimoto and Yamada, 1994). Kultur jaringan dapat digunakan sebagai salah satu alternatif untuk memproduksi bahan bioaktif dalam tumbuhan. Menurut Tabata (1977) dan Vanisree et al. (2003) keuntungan produksi metabolit sekunder melalui kultur jaringan tumbuhan adalah sebagai berikut :
1.Melalui kultur jaringan tumbuhan dapat dibentuk senyawa yang bermanfaat dalam kondisi terkontrol dan dalam waktu yang relatif lebih singkat.
2.Sel-sel tumbuhan dapat diperbanyak dengan mudah untuk memperoleh metabolit tertentu.
3. Pertumbuhan sel secara otomatis terawasi dan proses metabolisme dapat diatur secara rasional.
4. Hasil produksi yang diperoleh lebih konsisten, baik dalam kualitas maupun kuantitas.
5. Melalui kultur jaringan tumbuhan dapat dibentuk senyawa baru yang tidak terdapat dalam tanaman induknya dan senyawa baru ini mungkin berguna untuk dikembangkan atau dimanfaatkan lebih jauh.
6. Kultur tidak bergantung pada kondisi lingkungan seperti keadaan geografis, iklim, musim dan tidak memerlukan lahan yang luas.
9
Elisitasi adalah induksi dengan penambahan elisitor untuk memperoleh metabolit yang sempurna. Elisitor dapat diklasifikasikan berdasarkan sumbernya yaitu elisitor abiotik dan biotik. Elisitor abiotik merupakan elisitor non-biologis seprti ion logam dan senyawa anorganik seperti Cu. Cd, Ca2+, sinar ultraviolet
(UV) dan sebagainya. Elisitor biotik merupakan elisitor biologis seperti jamur, bakteri dan sebagainya. Pada saat ini, produksi metabolit sekunder melalui kultur sel tanaman melalui elisitasi telah membuka peluang baru yang penting bagi industri farmasi (Namdeo, 2007).
2.6 Kromatografi Cair Kinerja Tinggi (KCKT)/ High Performance Liquid
Chromathography (HPLC)
Kromatografi merupakan salah satu metode pemisahan komponen-komponen campuran dalam keadaan kesetimbangan diantara dua fase yaitu fase diam yang dapat menahan cuplikan dan fase gerak yang dapat membawa cuplikan.
Kromatografi berdasarkan fase geraknya dapat dibedakan menjadi dua, yaitu kromatografi gas dan kromatografi cair (Day and Underwood, 2002).
KCKT merupakan salah satu contoh kromatografi cair yang menggunakan zat cair sebagai fase gerak. Selain untuk pemisahan, metode ini juga dapat
digunakan untuk analisis kualitatif dan kuantitatif. Keuntungan menggunakan KCKT antara lain jumlah sampel yang diperlukan sangat sedikit (beberapa
mikroliter), waktu yang diperlukan oleh suatu komponen untuk mencapai detektor atau waktu retensinya hanya dalam beberapa menit, dan batas deteksinya sampai nanogram perliter. Instrumen dasar KCKT terdiri dari pompa, sistem pemasukan sampel, kolom, detector f dan rekorder (Hendayana et al, 1994).
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Teh (Camellia sinensis L.) mengandung komponen bioaktif polifenol, berperan besar dalam pencegahan berbagai macam penyakit. Polifenol teh dalam mencegah berbagai penyakit bekerja dalam tiga cara. Pertama, polifenol mencegah radikal bebas merusak DNA dan menghentikan perkembangan sel-sel liar yang akan berkembang menjadi kanker dan meningkatkan sistem imun. Kedua, polifenol mengontrol pertumbuhan sel-sel yang tak terkendali dan menghambat perkembangan kanker. Ketiga, polifenol tertentu dapat menghancurkan kanker tanpa merusak sel-sel di sekitarnya (Dewi, 2008).
Selain itu, teh dipercaya dapat memperbaiki fungsi imun, membantu detoksifikasi, dan memperpanjang umur (Brannon, 2007). Teh juga mampu
mencegah penyakit jantung dan stroke, menstimulisir sistem sirkulasi, memperkuat pembuluh darah, menurunkan kolesterol dalam darah, dan anti diabetes. Manfaat teh bagi kesehatan manusia diyakini akibat kandungan komponen bioaktif utama yaitu polifenol jenis katekin dan turunannya yang berperan sebagai antioksidan. Senyawa polifenol berperan sebagai penangkap radikal bebas hidroksil (OH) sehingga tidak mengoksidasi lemak, protein dan Deoxyribosa Nucleic Acid (DNA) dalam sel. Kemampuan polifenol menangkap radikal bebas 100 kali lebih efektif dibandingkan vitamin C dan 25 kali lebih efektif dibandingkan vitamin E (Yang and Landau, 2000).
2
karena itu produksi metabolit sekunder bioaktif polifenol perlu dikembangkan dengan teknik kultur in vitro dengan pemberian elisitor baik abiotik dan biotik.
Teknik kultur in vitro mempunyai keuntungan dalam produksi metabolit dibandingkan dengan tanaman utuh karena kecepatan pertumbuhan sel dan biosintesis dalam kultur yang diinisiasi dari eksplan sangat tinggi dan dalam periode yang sangat singkat. Beberapa keuntungan dari pemakaian teknik kultur in vitro untuk produksi metabolit sekunder antara lain tidak tergantung musim, sistem
produksi dapat diatur sesuai kebutuhan, lebih konsisten dan mengurangi
penggunaan lahan (Watimena, 1992). Kultur in vitro juga lebih ekonomis untuk tanaman yang memerlukan waktu lama untuk mencapai kemasakan fisiologis. Dalam penelitian Sutini (2008) diperoleh hasil bahwa media yang paling baik digunakan untuk menumbuhkan dan memproduksi Epigallocatechin gallate (EGCG) pada kultur kalus teh Camellia sinensis yaitu dengan kombinasi media 2, 4 - D 1 ppm dan kinetin 1 ppm.
Penelitian untuk meningkatkan metabolit sekunder dari tanaman dengan menggunakan elisitor berupa sinar UV-C dan UV-A telah dilakukan pada Vitis vinifera. untuk memproduksi trans-resveratrol. Sinar UV-C dan UV-A mampu
meningkatkan produksi trans-resveratrol. Sinar UV-C dengan lama penyinaran 15 menit meningkatkan produksi trans-resveratrol paling tinggi. Sedangkan sinar UV- A dengan lama penyinaran 30 menit memproduksi trans-resveratrol paling tinggi (Adrian et al., 2000; Versari et al., 2001; Cantos et al., 2003; Gonzalez-Barrio et al., 2006). Almagro et al. (2010) juga melakukan penelitian pada kultur Catharantus roseus untuk memproduksi ajmalisin dan kultur Daucus carota untuk
3
1.2 Permasalahan
Semakin meningkatnya permintaan katekin di dunia farmasi dan industri sehingga diperlukan penelitian untuk meningkatkan produksi katekin melalui kultur jaringan dengan penambahan elisitor abiotik berupa sinar ultraviolet C (UV- C).
1.3 Tujuan Penelitian
Tujuan dari penelitian ini adalah:
a. Mengetahui pengaruh sinar ultraviolet C (UV-C) terhadap produksi katekin dari teknik kultur jaringan pucuk daun teh (Camellia sinensis L.).
b. Mengetahui lama penyinaran sinar ultraviolet C (UV-C) yang paling baik untuk meningkatkan produksi katekin pada kultur kalus pucuk daun teh (Camellia sinensis L.).
1.4 Hipotesis
Hipotesis dari penelitian ini adalah:
a. Sinar UV-C mempunyai pengaruh terhadap produksi katekin dan pertumbuhan kalus pucuk daun teh (Camellia sinensis L.).
b. Pemberian sinar UV-C dengan lama penyinaran 30 menit menghasilkan katekin paling tinggi.
1.5 Manfaat Penelitian
PENGARUH LAMA PENYINARAN SINAR ULTRAVIOLET C
(UV-C) SEBAGAI ELISITOR UNTUK MENINGKATKAN
PRODUKSI KATEKIN MELALUI KULTUR KALUS PUCUK
DAUN TEH (Camellia sinensis L.)
ABSTRAK
Penelitian mengenai pengaruh lama penyinaran sinar Ultraviolet C (UV-C) sebagai elisitor untuk meningkatkan produksi katekin melalui kultur kalus pucuk daun teh (Camellia sinensis L.) telah dilakukan. Metode yang digunakan adalah Rancangan Acak Lengkap Satu Arah dengan perlakuan pemberian elisitor berupa sinar UV C dengan empat lama penyinaran yaitu 0 (kontrol), 15, 30 dan 45 menit dengan 6 kali ulangan yang di aplikasikan pada sub kultur ke-2 pada minggu ke-4. Penelitian ini dilakukan dalam enam parameter yaitu morfologi kalus, berat basah, berat kering, indeks pertumbuhan, kandungan katekin secara kualitatif dan
kuantitatif. Hasil pengamatan morfologi kalus secara visual menunjukkan bahwa kalus berwarna putih dan putih kekuningan dengan tekstur yang kompak..
Pertambahan berat basah kalus dari sebelum dan setelah di elisitasi yang tertinggi adalah perlakuan dengan penyinaran UV-C 45 menit. Berat kering kalus tertinggi yaitu pada kontrol. Indeks pertumbuhan tertinggi yaitu pada kontrol. Kalus teh mengandung katekin yang di uji secara kualitatif yaitu retention time standar dan sampel sama sedangkan kandungan katekin kalus teh secara kuantitatif tertinggi pada perlakuan disinari UV-C 30 menit. Berdasarkan kandungan katekin yang diperoleh menunjukkan bahwa penyinaran sinar UV-C mempunyai pengaruh terhadap produksi katekin melalui kultur kalus pucuk daun teh.
EFFECT OF LONG-RAYS ULTRAVIOLET (UV) C AS
ELICITOR TO INCREASE PRODUCTION OF CATECHINS
THROUGH CALLUS CULTURE LEAF TEA
(Camellia Sinensis L.)
ABSTRACT
The study about effect of long-rays Ultraviolet (UV) C as elicitor to increase production of catechins through callus culture leaf tea (Camellia sinensis L.) has been carried out. Method used was a completely randomized design one way elicitor treatment provision in the form of UV C with four long irradiation ie 0, 15, 30 and 45 minutes with 3 repetitions were applied to 4th week in the sub- cultured of the 2nd. This study was conducted in six parameters: callus
morphology, wet weight, dry weight, growth index, catechin content qualitatively and quantitatively. Analysis showed that callus morphology in the form of white and yellowish white color, texture compact callus. The highest callus fresh weight UV irradiated C 45 minutes. The highest callus dry weight in UV C irradiation control C 0 min. Index highest callus growth in control. Callus tea contains catechins in qualitative test of standard and sample retention time together while callus tea catechin content quantitatively the highest in the treatment of UV C irradiation 30 minutes. Based on the content of catechins showed that UV C irradiation has effect production of catechins through callus culture leaf tea.
PENGARUH LAMA PENYINARAN SINAR ULTRAVIOLET C
(UV-C) SEBAGAI ELISITOR UNTUK MENINGKATKAN
PRODUKSI KATEKIN MELALUI KULTUR KALUS PUCUK
DAUN TEH (Camellia sinensis L.)
SKRIPSI
IMA SRI MERY YANTI SIPAYUNG 090805008
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PENGARUH LAMA PENYINARAN SINAR ULTRAVIOLET C
(UV-C) SEBAGAI ELISITOR UNTUK MENINGKATKAN
PRODUKSI KATEKIN MELALUI KULTUR KALUS PUCUK
DAUN TEH (Camellia sinensis L.)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
IMA SRI MERY YANTI SIPAYUNG 090805008
DEPARTEMEN BIOLOGI
PENGHARGAAN
Puji Syukur penulis ucapkan kepada Tuhan Yang Maha Esa karena atas kuasa dan rahmatnyalah penulis bisa menyelesaikan skripsi ini. Skripsi ini penulis
persembahkan kepada Ayahanda terkasih Roma Domu Sipayung, Ibunda terkasih Rosma Br Purba, S.Pd. atas doa, pengertian, dukungan, motivasi dan nasehat yang membuat penulis semakin kuat untuk melewati banyak tantangan dalam
penyusunan skripsi ini sehingga penyusunan skripsi ini terselesaikan dengan baik. Untuk saudara-saudara terkasih, Maspriando Sipayung, Risdo Kurniawan
Sipayung dan Mawi Nirwana Sipayung terima kasih atas kehangatan kasih sayang, canda tawa dan dukungan yang menyemangati penulis setiap hari.
Penulis menyampaikan ucapan terima kasih kepada Ibu Dr. Suci Rahayu, M.Si., selaku dosen pembimbing I, Ibu Dra. Elimasni, M.Si selaku dosen
pembimbing II yang telah memberikan bimbingan dan arahan serta waktu dan perhatiannya kepada penulis dalam menyelesaikan penelitian ini. Penulis juga menyampaikan ucapan terima kasih kepada Ibu Dr. Nursahara Pasaribu, M.Sc. selaku Ketua Departemen Biologi FMIPA USU dan dosen penguji I Bapak Riyanto Sinaga, S.Si, M.Si serta Ibu Dra. Emita Sabri, M.Si selaku dosen penguji II, Ibu Prof. Dr. Retno Widhiastuty, MS, selaku dosen pembimbing akademik yang telah memberi saran serta motivasi demi penyempurnaan skripsi ini. Terima kasih kepada Kepada Bang Endra Raswin, Kak Roslina Ginting, Ibu Nurhasni Muluk S.Si, M.Si, Ibu Mizarwati, M.Si, terima kasih atas kesabaran dan kabaikannya dalam membantu penulis selama masa pendidikan di Departemen Biologi.
Selanjutnya ucapan terima kasih penulis kepada teman seperjuangan, Nora, Sukma dan Inur, semoga kerja keras kita selama ini memberi arti dalam hidup kita. untuk sahabatku Fivin, Rissa, Mona dan Anderson terimakasih atas persahabatan yang sangat indah ini yang kita lalui bersama disaat suka dan duka. teman-teman di Laboratorium Kultur Jaringan, Imam, Nuri, Offi dan Novi terimakasih atas ilmu dan hari-hari yang menyenangkan di Laboratorium. Terimakasih kepada adek asuh penulis Rani dan Risky yang selalu mendukung dan membuat penulis semangat. Kepada Sahabat-sahabat angkatan 2009, Aan, Riris, Popo, Afni, Nurul, Hotman, Yeni, Bertua, Fika, Venny, Jessica, Julie, Astri, Yully, Sabeth, Hans, Laura, Putri, Frisi, Ledy, Rencina, Sylvia, Rita, Boy, Uba, Sahat, Sepwin, raymon, essy dan yang tak bisa disebutkan namanya satu-persatu dan kepada abang dan kakak angkatan 2006, 2007, 2008 dan adik-adik angkatan 2010, 2011 dan 2012, terima kasih telah mengisi hari-hari penulis dengan kebersamaan dan mengajarkan penulis untuk saling mengerti dan memahami. Kepada semua pihak yang telah membantu dalam penelitian dan penulisan skripsi ini, penulis ucapkan terima kasih yang sebesar-besarnya.
PENGARUH LAMA PENYINARAN SINAR ULTRAVIOLET C
(UV-C) SEBAGAI ELISITOR UNTUK MENINGKATKAN
PRODUKSI KATEKIN MELALUI KULTUR KALUS PUCUK
DAUN TEH (Camellia sinensis L.)
ABSTRAK
Penelitian mengenai pengaruh lama penyinaran sinar Ultraviolet C (UV-C) sebagai elisitor untuk meningkatkan produksi katekin melalui kultur kalus pucuk daun teh (Camellia sinensis L.) telah dilakukan. Metode yang digunakan adalah Rancangan Acak Lengkap Satu Arah dengan perlakuan pemberian elisitor berupa sinar UV C dengan empat lama penyinaran yaitu 0 (kontrol), 15, 30 dan 45 menit dengan 6 kali ulangan yang di aplikasikan pada sub kultur ke-2 pada minggu ke-4. Penelitian ini dilakukan dalam enam parameter yaitu morfologi kalus, berat basah, berat kering, indeks pertumbuhan, kandungan katekin secara kualitatif dan
kuantitatif. Hasil pengamatan morfologi kalus secara visual menunjukkan bahwa kalus berwarna putih dan putih kekuningan dengan tekstur yang kompak..
Pertambahan berat basah kalus dari sebelum dan setelah di elisitasi yang tertinggi adalah perlakuan dengan penyinaran UV-C 45 menit. Berat kering kalus tertinggi yaitu pada kontrol. Indeks pertumbuhan tertinggi yaitu pada kontrol. Kalus teh mengandung katekin yang di uji secara kualitatif yaitu retention time standar dan sampel sama sedangkan kandungan katekin kalus teh secara kuantitatif tertinggi pada perlakuan disinari UV-C 30 menit. Berdasarkan kandungan katekin yang diperoleh menunjukkan bahwa penyinaran sinar UV-C mempunyai pengaruh terhadap produksi katekin melalui kultur kalus pucuk daun teh.
EFFECT OF LONG-RAYS ULTRAVIOLET (UV) C AS
ELICITOR TO INCREASE PRODUCTION OF CATECHINS
THROUGH CALLUS CULTURE LEAF TEA
(Camellia Sinensis L.)
ABSTRACT
The study about effect of long-rays Ultraviolet (UV) C as elicitor to increase production of catechins through callus culture leaf tea (Camellia sinensis L.) has been carried out. Method used was a completely randomized design one way elicitor treatment provision in the form of UV C with four long irradiation ie 0, 15, 30 and 45 minutes with 3 repetitions were applied to 4th week in the sub- cultured of the 2nd. This study was conducted in six parameters: callus
morphology, wet weight, dry weight, growth index, catechin content qualitatively and quantitatively. Analysis showed that callus morphology in the form of white and yellowish white color, texture compact callus. The highest callus fresh weight UV irradiated C 45 minutes. The highest callus dry weight in UV C irradiation control C 0 min. Index highest callus growth in control. Callus tea contains catechins in qualitative test of standard and sample retention time together while callus tea catechin content quantitatively the highest in the treatment of UV C irradiation 30 minutes. Based on the content of catechins showed that UV C irradiation has effect production of catechins through callus culture leaf tea.
DAFTAR ISI BAB I PENDAHULUAN
1.1 Latar Belakang 1.2 Permasalahan 1.3 Tujuan Penelitian 1.4 Hipotesis
1.5 Manfaat Penelitian BAB 2 TINJAUAN PUSTAKA
2.1 Botani Teh ( Camellia sinensis ) 2.2 Metabolit Sekunder
2.3 Katekin
2.4 Kultur Jaringan
2.5 Kultur Jaringan untuk Memproduksi Metabolit Sekunder
2.6 Kromatografi Cair Kinerja Tinggi (KCKT)/ High Performance Liquid Chromatography (HPLC)
BAB 3 METODE PENELITIAN 3.1 Waktu dan Tempat 3.2 Alat dan Bahan
3.2.1 Alat 3.2.2 Bahan
3.3 Rancangan Percobaan 3.4 Cara Kerja
3.4.1 Sterilisasi Alat 3.4.2 Sterilisasi Bahan 3.4.3 Pembuatan Media 3.4.4 Penanaman Eksplan 3.4.5 Pemeliharaan Eksplan
3.4.6 Pemberian Elisitor Sinar Ultraviolet ( UV ) C 3.4.7 Analisis Kandungan Katekin
BAB 4 HASIL DAN PEMBAHASAN 4.1 Morfologi Kalus
4.1.1 Morfologi kalus Awal Pertumbuhan
4.1.2 Morfologi Kalus Sub Kultur dan Akhir Penelitian 4.2 Berat Kering Kalus
4.3 Indeks Pertumbuhan Kalus
4.4 Kurva Analisis Standar Regresi Linear 4.5 Analisis Kandungan Katekin
4.5.1 Analisis Kandungan Katekin Secara Kualitatif 4.5.2 Analisis Kandungan katekin Secara Kuantitatif 4.6. Hubungan Berat Kering Kalus dengan Kandungan
Katekin
BAB 5 KESIMPULAN DAN SARAN 5.1. Kesimpulan
5.2. Saran DAFTAR PUSTAKA LAMPIRAN
DAFTAR TABEL
Nomor 4.2 4.3 4.5.2
Judul Tabel Berat Kering Kalus
Indeks Pertumbuhan
Analisis Kandungan Katekin Secara Kualitatif
DAFTAR GAMBAR
Nomor 2.1. 4.1.1 4.1.2 4.5.2 4.6
Judul Gambar Camellia sinensis L.
Morfologi Kalus Awal Pertumbuhan
Morfologi Kalus Sub Kultur dan Akhir Penelitian Kandungan Katekin Secara Kuantitatif
Hubungan Berat Kering dengan Kandungan katekin
DAFTAR LAMPIRAN
Komposisi Media MS (Murashige & Skoog) 1962 Data Berat Kering dan Uji Statistik
Indeks Pertumbuhan dan Uji Statistik
Luas Area Standar Katekin, Retention Time dan Uji Statistik Regresi Linear
Kurva Analisis Regresi Linear Standar Katekin Luas Area Perlakuan dan Retention Time Retention Time Standar dan Sampel
Analisis Kandungan Katekin Secara Kuantitatif dan Uji Statistik
Out Put High Performance Liquid Chromatography ( HPLC )