KAJIAN TINGKAT KETAHANAN
CABAI
MERAH
(Capsicum annuum
L)
TERHADAP
PENYAKIT
ANTRAKNOSA
Oleh :
BAMBANG SURYOTOMO
PROGRAM PASCASARJANA
INSTITUT PERTANIAN
BOGOR
"
Barang siapa yang 6ertaqwa @ p d a g f i h , niscaya
~
a k n
mengda&n 6aginya jahn &liar (dbri ksulitan) dun gllirh a b n
mem6erinya rezee
hriarah yang tiada 6iang&-sangknya. Barang
siapa yang menyerahkn
diri
kpada gllirh, niscaya gllirh a b n
mencu&-upkn
(&perCuan)nya
"(QS.
Ath
ThaIbaq: 2-
3)m
a
ini &persem6ah&n untuk
Kajian Tingkat Ketahanan Cabai Merah (Capsicum anmum L) terhadap Penyakit Antraknosa.
[ Study on the resistance of hot pepper (Capsicum annuum L) to anthracnose disease ]
by
Bambang Suryotomo
Abstract
The research was conducted in the greenhouse of The Department of
Agronomy and Laboraty of The Department of Plant Pest and Disease, Faculty of
Agriculture, Bogor Agricultural University from April 2000 to March 2001. The
objective of this research was to evaluate the best method and time of inoculation,
and the resistance of four hot pepper genotypes to anthracnose on pre and post
harvested fruits. Resistance evaluation on pre-harvested fruits was done in the
greenhouse with "spray" inoculation method of lo6 sporedml Colletotrzchum
gloeosporzoides suspension at flowering stage and fruit-set stage. Resistance study
on post-harvested fruits was done in the laboratory with "paste" method of
inoculation on mature green and mature red stage fruits. Both experiments were
set in a factorial and completely randomized design with four replications and five
plants per experimental unit. The genotypes evaluated were UPM, Titsuper,
Yogya, and Jatilaba. Observations were done on disease severity, disease incidence
and percentage of fruit damage.
The results showed that resistance level of all genotypes tested were lower
when inoculated at fruit set stage compared to at flowering stage. The best method
of evaluation for resistance to anthracnose on hot pepper was the greenhouse test
inoculation at hit-set stage with variable of disease incidence was considered as
the best method of evaluation on the resistance to C. gloeosporioides. All
genotypes tested were considered very susceptible to C. gloeosporioides. There was no significant different between inoculation on green and red mature fruits in
Surat Pernyataan
Dengan ini saya menyatakan bahwa tesis saya yang berjudul :
" Kajian Tingkat Ketahanan Cabai Merah (Capsicum annuum L.)
Terhadap Penyakit Antrakuosa
"
adalah benar hasil karya sendiri dan belum pernah dipublikasikan. Semua
sumber data clan informasi telah dinyatakan secara jelas dan dapat diperksi kebenarannya
Bogor, April 2002
Bambang Suryotomo
KAJIAN TINGKAT KETAHANAN
CABAI MERAH
(Capsicum annuum
L)
TERHADAP PENYAKIT ANTRAKNOSA
Oleh :
BAMBANG SURYOTOMO
Tesis
sebagai salah satu syarat
untuk
memperoleh gelarMagister Sains
Pada Program Studi Agronomi
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : KAJIAN TINGKAT KETAHANAN CABAI MERAH (Capsicum annuum L.) TERHADAP PENYAKIT ANTRAKNOSA
Nama Mahasiswa : Bambang Suryotomo
Nomor Pokok : 98050
Program Studi : Agronomi
1. Komisi Pembimbing
-
Prof. Dr. Ir. Sarsidi SastrosumarioKetua
2. Dr. Ir. Sriani Suii~rihati. MS. 3. Dr. Ir. Meitv S. ginaea, MSc.
2. Ketua Program Studi Agronomi
a-
Dr. Ir. Sudirman Yahva, MSc.
RJWAYAT HIDUP
Penulis dilahirkan di Pati, Jawa tengah pada tanggal 9 Februari 1959,
sebagai putera kedua dari delapan bersaudara dari pasangan Bapak Soejoto (Alm)
dengan Ibu Oemi Laeli.
Pada tahun 1971 penulis menyelesaikan pendidikan Sekolah Dasar
Kebondalem V di Pemalang. Lulus dari Sekolah Menengah Pertama Negeri I di
Pemalang pada tahun 1974, dan pada tahun 1977 lulus Sekolah Menengah Atas
Negeri di kota yang sama. Pada tahun 1985 penulis menyelesaikan pendidikan di
program Studi Agronomi Fakultas Pertanian Universitas Jenderal Soedirman, di
Punvokerto - Jawa Tengah.
Pada tahun 1988 penulis menikah dengan Dra. Hayati Soeprapto, hingga
saat ini dikaruniai dua orang puteri yang diberi nama Masita Wulandari
Suryoputri dan Zahra Tamami Suryahardini.
Sejak tanggal 1 April 1990, penulis diterima sebagai staf pengajar Kopertis Wilayah VI Jawa Tengah dan dipekerjakan pada Akademi Pertanian Muhammadiyah (APM) di Pemalang hingga sekarang. Mulai tahun akademik
199811999 penulis mendapatkan beasiswa BPPS dari Dirjen DIKTI, Departemen
Pendidikan Nasional untuk melanjutkan studi pada progran Pascasarjana Institut
Pertanian Bogor, pada Sub program Studi Pemuliaan Tanaman.
Bogor, Maret 2002
PRAKATA
Puji syukur penulis panjatkan kehadirat Tuhan Yang Maha Pengasih dan
Penyayang atas segala limpahan rahmat dan karunia-Nya, sehingga penulis dapat
menyelesaikan laporan penelitian ini.
Tesis ini disusus berdasarkan penelitian yang dilakukan di Instalasi Rumah
Kaca Jurusan Budidaya Pertanian, Kebun Percobaan Jurusan Budidaya Pertanian
di Tajur serta Laboratorium Mikologi, Jurusan Hama dan Penyakit Tumbuhan,
Fakultas Pertanian Institiut Pertanian Bogor.
Adapun tujuan dari penelitian ini adalah untuk mencari metode yang
terbaik dan waktu inokulasi yang tepat dalam penentuan tingkat ketahanan cabai
merah (Capsicum annuum L) terhadap antraknosa, pada saat buah-buah masih di
pohon (di rumah kaca) dan telah dipetik (di laboratorium).
Penelitian ini dapat terlaksana berkat bantuan dari berbagai fihak, terutama
Pusat Studi Pemuliaan Tanaman (PSPT) melalui proyek RUT VIII.l tahun
anggaran 2000/2001. Oleh karena itu pada kesempatan ini perkenankanlah
penulis mengucapkan banyak terima kasih kepada:
1 . Bapak Prof Dr. Ir. Sarsidi Sastrosumarjo, Ibu Dr. Ir. Sriani Sujiprihati, MS, dan Ibu Dr. Ir. Meity S. Sinaga, M.Sc., atas bimbingan, dorongan serta
arahannya sejak merencanakan penelitian sampai dengan penulisan tesis ini.
2. Kepala Laboratorium Mikologi, Jurusan Hama dan Penyakit Tumbuhan
Institut Pertanian Bogor beserta staf, atas segala fasilitas serta pelayanannya
sehingga telah mendukung keberhasilan penelitian.
3. Kepala Pusat Studi Pemuliaan Tanaman (PSPT) Fakultas Pertanian Institut
Pertanian Bogor berserta jajarannya, atas segala bantuan fasilitas yang
4. Rekan-rekan sesama staf pengajar dari APM Pemalang, Universitas Bengkulu,
Halo-oleo, Brawijaya dan Universitas Darusalam dan Sriwijaya, atas segala
saran, masukan dan bantuan selama penelitian.
5. Pengelola Kebun percobaan Jurusan Budidaya Pertanian IPB, di Tajur
berserta staf atas dukungan dan bantuannya sehingga penelitan berjalan lancar.
6. Pimpinan Jurusan Tanah dan Agrometeorologi Fakultas Pertanian IPB, atas
fasilitas yang diberikan selama penelitian berlangsung.
7. Ibu Hj. Oerni Laeli, Bapak Drs. H. Kartono sekeluarga dan Bapak H.
Soeprapto sekeluarga atas segala bantuan, dukungan moral maupun do'a
restunya yang selalu menyertai penulis selama menyelesaikan studi.
8. Istri dan Anak tercinta atas pengorbanan, dorongan moril maupun meteriil
serta dengan penuh kesabaran dan pengertian telah mendampingi penulis
menyelesaikan studi.
9. Bapak Catur dan Ibu Tika yang telah banyak sekali membantu terwujutnya
tesis ini.
10. Semua fihak yang tidak dapat disebutkan satu persatu yang turut membantu
baik dalam pelaksanaan penelitian maupun penyelesaian tesis, mudah-
mudahan kesemuanya menjadikan rangkaian tambahan amal yang berlipat
ganda.
Akhirnya penulis menyadari bahwa tesis ini masih jauh dari sempurna,
namun demikian mudah-mudahan masih ada manfmtnya baik bagi pembaca
maupun peneliti lainnya, serta d e q p iringan do'a semoga seluruh studi ini dapat
bernilai ibadah dihadapan Allah SWT.
Bogor,
Maret
2002DAFTAR IS1
Hal
... DAFTAR IS1
DAFTAR TABEL ...
DAFTAR LAMPIRAN ...
DAFTAR GAMBAR ...
... PENDAIWLUAN
Latar Belakang ...
Tujuan Penelitian ... Manfaat Penelitian ... Hipotesis ...
TINJAUAN PUSTAKA ... ... Sejarah Perkembangan
Botani dan Ekologi Tanaman Cabai ... Syarat Tumbuh ...
Budidaya ... Penyakit Antraknosa ...
... Gejala. Siklus dan Ekologi Patogen Antraknosa
... Ketahanan Tanaman Cabai Terhadap Antraknosa
... Pengendalian Penyakit Antraknosa
BAHAN DAN METODE ... Waktu dan Tempat ...
Bahan dan Alat ...
Metode Penelitian
...
Pelaksanaan Percobaan
...
Andisis Data ...
...
HASIL DAN
PEMBAHASAN
1 . Keadaan Umum Percobaan
...
2 . Hasil uji ketahanan terhadap penyakit antraknosa pada buahrnasih di pohon (di Rumah Kaca) ...
3 . Hasil uji ketahanan terhadap antraknosa pada buah
...
pada
buah setelah dipetik4 . Evaluasi metode penentuan tingkat ketahanan terhadap antraknosa
... KESIMPULAN DAN SARAN
1 . Kesimpulan
...
2 . S a r a n ...DAFTAR TABEL
Tabei
-
Teks Halaman1 Nilai rataan keparahan penyakit, kejadian penyakit, tingkat
kerusakan dan laju infeksi serta kategori ketahanan dari
empat Genotipa Cabai hasil uji di Rumah kaca ... 27
2 Pengaruh inokulasi pada saat berbunga terhadap persentase ...
gugur bunga 30
Nilai rataan keparahan penyakit, kejadian penyakit, tingkat kerusakan dan laju infeksi serta kategori ketahanan dari
empat genotipe hasil uji di laboratorium ... 33
Hasil uji Koefisien korelasi (r) antara parameter ketahanan
DAFTAR LAMPIRAN
Lam~iran
-
Teks Halaman1 ANOVA data percobaan Sebelum Panen (di Rumah
Kaca) ... 44
2 ANOVA data percobaan Sesudah Panen (di
Laboratorium) ... 45
3 Hasil pengamatan suhu dan kelembaban di Rumah kaca
selama pelaksanaan penelitian ... 46
DAFTAR GAMBAR
Tabel
-
TeksSiklus penyakit antraknosa yang disebabkan oleh Colletotiichum sp. (Agrios, 1 997) ...
Kondisi pertanaman setelah inokulasi pada pengujian di rumah kaca. Pertumbuhan vegetatif tanaman tidak terganggu oleh penyemprotan inokulum C. gloeosporioides..
...
Inkubasi buah cabai setelah diinokulasi di laboratorium. Alas tisu basah di dalam bak serta tutup plastik wrap
...
untuk menjaga kelembaban
Gejala yang muncul pada buah akibat inokulasi saat berbunga (A) dan inokulasi saat berbuah (B) ...
Respon ketahanan empat genotipa terhadap waktu inokulasi buah hijau dan buah merah di laboratorium. Masing-masing genotipa tersebut menunjukkan respon yang sama terhadap inokulasi ketika buah hijau maupun merah ...
Penampakan gejala antraknosa pada Genotipa UPM (A), Titsuper
(B),
Yogya dan Jatilaba @) pada pengujian di laboratorium ...PENDAHULUAN
Cabai merah (Capsicum annuum L.) adalah komoditas sayuran yang sangat
penting di Indonesia. Hal ini ditunjukkan dengan areal pertanaman cabai merah
yang terluas diantara tanaman sayuran yang diusahakan di Indonesia (Dirjen Bina
Produksi Hortikultura, 2001). Pada tahun 1997 luas pertanaman cabai sekitar
161.602 ha (BPS, 1997), dan pada tahun 2000 mencapai 174.708 ha atau sekitar
20,39% dari total areal pertanaman sayuran @*en Bina Produksi Hortikultura,
2001). Bertambahnya luas areal ini disebabkan oleh permintaan cabai merah
untuk konsumsi segar, bumbu, kosmetik, dan obat-obatan yang meningkat dan
nilai ekonomis yang tinggi dalam perdagangan komoditas tanaman hortikultura.
Meningkatnya jumlah penduduk, dan berkembangnya industri makanan
olahan serta obat-obatan dengan bahan baku pendamping cabai merah,
menyebabkan perrnintaan komoditas ini setiap tahun akan terus meningkat.
Dengan tingkat konsumsi cabai merah yang telah mencapai 3,16 kg perkapita per
tahun pada tahun 1993 (BPS, 1993), dan perkiraan jumlah penduduk 210 juta,
maka total kebutuhan cabai diperkirakan mencapai 663.600 ton/tahun (BPS,
1996).
Produksi cabai merah di dalam negeri termasuk masih rendah, yaitu rata-
rata sekitar 4,17 tonha @irjen Bina Produksi Hortikultura, 2001). Kurangnya
produksi cabai dalam negeri menyebabkan pemerintah hams melakukan impor
cabai merah dari negara tetangga. Pada tahun 1997 impor cabai merah mencapai
3.382 ton (senilai US $ 2,8 juta) karena produksi nasional belum mencukupi
(BPS, 1997).
Tingkat produksi cabai merah di Indonesia jauh lebih rendah bila
tonha serta Spanyol 31,l tonlha (Rubatzky dan Yamaguchi, 1997). Hal ini
kemungkinan disebabkan oleh jenis yang ditanam umumnya varietas lokal, jarang
yang menggunakan varietas hibrida. Menurut Permadi dan Kusandriani (1999),
daya hasil varietas hibrida bila dibudidayakan dapat mencapai 20-30 tonha,
sedangkan varietas lokal hanya sekitar 12 tonha.
Sebagaimana diketahui, pertanaman cabai merah di Indonesia hampir selalu
terserang berbagai macam penyakit. Dari sekian banyak macam penyakit, antraknosa adalah penyakit yang paling penting dan merugikan (Suhardi, 1987).
Antraknosa adalah penyakit yang disebabkan oleh cendawan Gloeosporium
piperaturn (Semangun, 1989), Collefotrichurn gloeosporioides dan C. capsici
(Mordue, 1967). Hasil penelitian di beberapa sentra produksi cabai dilaporkan
bahwa antraknosa yang disebabkan oleh patogen C. gloeosporioides mempunyai
tingkat kejadian penyakit @I) yang lebih tinggi dibanding dengan C. capsici
(Hartman dan Wang, 1992; Sanjaya, 1998). Hal ini kemungkinan disebabkan C.
gloeosporioides mempunyai inang yang lebih beragam.
Penyakit ini terutama menyerang buah baik pada waktu di lapangan
maupun sebagai penyakit pascapanen. Gejala yang terlihat adalah adanya lesio
pada permukaan buah yang disertai dengan bercak melingkar konsentrik
(AVRDC, 1988) dan menyebabkan buah tidak dapat dipasarkan. Di Indonesia,
penyakit antraknosa sudah sangat meluas, baik pada pertanaman cabai di dataran
rendah maupun dataran tinggi, dan menyebabkan kerugian yang sangat besar. Di
daerah Brebes (Jawa Tengah) sekalipun dengan pengendalian yang intensif,
dilaporkan masih menyebabkan kerugian hingga 45% (Sanjaya, 1997). Di
Sumatra Barat, kerugian yang ditimbulkan mencapai 3 5% (Vos, 1994). Sedang-
kan di Segunung (dataran tinggi) dan Rlampok (dataran rendah), masing-masing
pernah menyerang pertanaman cabai di daerah Demak, dan dilaporkan
intensitasnya mencapai 5 - 65% (Suhardi, 1989). Penanaman cabai yang terus menerus dalam areal yang sama merupakan faktor yang memudahkan tersebarnya
patogen tersebut. Tanpa pengendalian yang efektif, penyakit antraknosa akan
berkembang sangat capat.
Penyakit antraknosa sulit dikendalikan karena infeksi patogennya bersifat
laten dan sistemik serta menyerang semua fase pertumbuhan tanaman (Meity
Sinaga et al., 1992). Upaya pengendalian penyakit antraknosa yang biasa dilakukan ialah dengan hngisida. Akan tetapi cara ini seringkali kurang efisien
dan bersifat sementara (Wijaya, 1991). Selain itu, pengendalian secara kimiawi diketahui dapat menyebabkan pencemaran produk dan lingkungan, biaya relatif
mahal, berbahaya bagi petani, dan menyebabkan tekanan seleksi yang dapat
menimbulkan ras-ras patogen baru yang resisten (Suhardi, 1991; Suryaningsih dan Suhardi, 1993; Vos, 1994). Oleh karena itu, metode yang paling dianjurkan adalah menggunakan varietas yang resisten terhadap antraknosa. Penggunaan
tanaman resisten akan lebih ekonomis, mudah aplikasinya, murah, dan ramah
lingkungan dibandingkan dengan pengendalian secara kimiawi (Fraser, 1985).
Perakitan varietas cabai yang resisten memerlukan seleksi plasma nutfah
yang intensif untuk mendapatkan genotipa donor gen ketahanan. Pengujian
resistensi terhadap antraknosa pada beberapa spesies cabai telah dilakukan di
beberapa negara (Hartman dan Wang, 1992). Namun demikian hingga saat ini belum diketahui varietas cabai yang tahan terhadap antraknosa. Hal ini antara lain
disebabkan oleh hasil pengujian resistensi seringkali tidak konsisten, sekalipun
pada materi genotipa yang sama (Sanjaya, 1997). Tidak konsistennya hasil pengujian tersebut dapat disebabkan oleh beberapa faktor, antara lain faktor
parsial, ras patogen yang beragam, interaksi antara inang dan patogen berbeda-
beda, atau metode dan lingkungan pengujian yang tidak sama (Sanjaya, 1998).
Tidak konsistennya hasil pengujian ketahanan suatu varietas tanaman cabai
terhadap antraknosa merupakan masalah bagi pemulia tanaman dalam rangka
memilih tetua donor. Hal ini terjadi mungkin disebabkan oleh metode seleksi
yang diterapkan, yaitu umumnya dilakukan terhadap buah yang telah dipetik dari
pohonnya. Metode ini sangat artifisial dan mengabaikan faktor interaksi inang-
patogen dan lingkungan, sehingga tidak sesuai dengan kondisi lapangan. Padahal
proses terjadinya penyakit sangat ditentukan oleh interaksi inang-patogen dan
lingkungannya.
Tanaman yang tahan terhadap penyakit adalah tanaman yang mampu meng-
hambat perkembangan patogen sehingga patogen tersebut tidak dapat berkembang
dan menyebar. Sebaliknya, tanaman rentan adalah tanaman yang tidak mampu
menghambat perkembangan patogen penyebab penyakit (Black ef al., 1991).
Respon tanaman terhadap patogen dipengaruhi oleh faktor genetik dan
lingkungan. Oleh karena itu bervariasinya tingkat ketahanan antar varietas
bergantung kepada respon interaksi inang-patogen maupun lingkungannya.
Pengujian ketahanan tanaman terhadap antraknosa umumnya dilakukan
dengan inokulasi buatan. Buah yang telah dipetik selanjutnya diinokulasi dengan
cara menempelkan inokulum pada permukaan buah yang telah terlebih dahulu
dilukai (Sanjaya, 1998; Park, et al., 1990; Setiamihardja dan Qosim, 1991).
Metode tersebut sebenarnya mengabaikan mekanisme yang kemunglunan
berperan dalam ketahanan terhadap antraknosa. Inokulasi yang dilakukan secara
buatan dengan terlebih dahulu melukai buah adalah telah mengabaikan aspek
ketahanan struktural seperti lapisan lilin, serta keras dan tebalnya lapisan
secara tidak langsung juga telah mengabaikan aspek ketahanan hngsional, karena
proses pembentukan protein dan metabolit lain yang kemungkinan berperan dalam
ketahanan terhadap antraknosa menjadi berkurang atau terhenti pada buah yang
telah dipetik. Oleh karena itu perlu dilakukan suatu studi untuk menetapkan
metode pengujian ketahanan yang tidak mengabaikan aspek ketahanan struktural
maupun hngsional. Salah satu metode pengujian adalah dengan melakukan
inokulasi terhadap tanaman atau buah yang masih di pohon. Metode ini lebih
mendekati kondisi alami di lapangan. Akan tetapi belum banyak laporan
mengenai metode tersebut dalam seleksi terhadap antraknosa.
Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. mengevaluasi tingkat ketahanan empat genotipa cabai terhadap antraknosa
berdasarkan pengujian di rumah kaca (sebelum panen) dan di laboratorium
(sesudah panen).
2. mengetahui waktu inokulasi yang tepat untuk keperluan evaluasi tingkat
ketahanan terhadap antraknosa di rumah kaca,
3. mengevaluasi tingkat ketahanan terhadap antraknosa pada buah cabai masak fisiologis (hijau) dan buah masak penuh (merah) di laboratorium.
4. Mendapatkan metode terbaik dalam pengujian ketahanan cabai terhadap
penyakit antraknosa.
Manfaat Penelitian
Penelitian ini dapat merupakan informasi yang berharga, terutama
mengenai metode yang tepat dan praktis dalam penentuan tingkat ketahanan
SeIain itu dapat pula memberikan informasi tentang tingkat ketahanan empat
genotipa cabai terhadap antraknosa di rumah kaca maupun di laboratorium.
Kerangka Pemikiran dan Peogajuan Hipotesis
Pengujian ketahanan tanaman terhadap antraknosa umumnya dilakukan di
laboratorium terhadap buah-buah yang telah dipetik (Park, et al., 1990;
Setiamihardja dan Qosim, 1991; Sanjaya, 1998). Metode ini nampaknya
mengabaikan kemungkman terjadinya mekanisme pertahanan fbngsional yang
terdapat dalam tubuh tanaman. Karena dengan buah telah dipetik, maka semua
proses pembentukan protein dan metabolit lain yang dapat berperan dalam
pertahanan tersebut menjadi terhenti. Oleh karena itu untuk mengetahui tingkat
ketahanan terhadap antraknosa, pengujian tidak hanya dilakukan di laboratorium,
tetapi inolculasi perlu juga dilakukan terhadap buah-buah yang rnasih terdapat di
pohon (di lapang).
Namun demikian peristiwa terjadinya infeksi tentunya tidak
akan
menunggu tamman membentuk buah. Sehingga kernungkinan infeksi dapat
terjadi kapan saja. Seperti diketahui, proses infeksi penyakit antraknosa diawali
dengan masuknya spora melalui ruang antar sel epidermis, atau malalui luka pada
buah.
Bagian
luardari
spora tersebut mengandung perekat yang dapat dengm mudah menempelsasaran
infeksi lewat percikan air siraman atauair
hujan. Setelah spora m m p u berkembang,maka
gejala yang timbul dicirikan oleh adanya bercak &at kehitarnan pada permulcaan buah, pada serangan lanjut buahakan
mengering dan keriput seperti jerami. (Semangun, 1994; Suryaningsih,etal.,.
1996). Infeksi patogennya bersifat laten dan sistemik serta menyerangpada
semua
fase pertumbuhan (Meity Sinaga et al., 1992).Sejauh ini belum diternukan informasi fase pertumbuhan tanaman cabai
buah merah lebih rentan dibanding buah hijau. Hal ini diduga karena pada buah
merah senyawa antimikrobial (phytoalexin, Capsidiol) sudah mengalami
degradasi menjadi Capsenon yang toksisitasnya lebih rendah, sehingga tidak
mampu menghambat perkembangan spora maupun perturnbuhan miselia
cendawan (Adikaram, Brown dan Swinburne, 1982). Sementara itu dari hasil penelitian menunjukan bahwa genotipa UPM tergolong relatif tahan (Hidayat,
2000)'. Sedsagkan Titsuper, Jogya dan Jatilaba t e m s u k dalam kategori rentan
(Setiamihardja dan Qosim, 1991). Berdasarkan uraian di atas, maka dalarn
penelitian ini dikemukaan hipotesis sebagai berikut:
1. Genotipa UPM Iebih tahsn dibanding dengan genotipa Titsuper, Jogya,
maupun Jatilaba.
2.
Waktu
inokulasi yang berbeda di rumah kaca,akan
memberikan respon ketahanan terhadap antraknosa sama.3. Bush rnasak penuh (merah) lebih rentan terhadap penyakit antraknosa
TINJAUAN PUSTAKA
Sejarah dan penyebaran
Rubatzky dan Yamaguchi (1997) mengemukakan bahwa tanaman cabai
besar (Capsicum annum L.) berasal dari dunia baru (Mexico, Amerika Tengah,
dan pegunungan Andes di Amerika Selatan). Thompson dan Kelly (1957)
menyatakan bahwa tanaman cabai telah diketahui sebelum zaman prasejarah di
Peru dan telah dibudidayakan di Amerika Tengah dan Amerika Selatan sebelum
diperkenalkan di Eropa. Pada tahun 1493 Columbus membawa dan
memperkenalkan benih cabai ke Spanyol yang selanjutnya menyebar dengan
cepat di Benua Eropa. Tanaman cabai dibawa ke Asia dan menyebar ke Asia
Tenggara termasuk Indonesia oleh bangsa Portugis dan Spanyol dari Amerika
Selatan pada abad ke-16 (Suwandi, 1996).
Botani dan Ekologi Tanaman Cabai
Tanaman cabai besar dikenal dengan nama botani Capsicum annuum L.,
digolongkan ke dalam genus Capsicum, famili Solanaceae, sub klas Dycotyledone
dan klas Angiospermae (Van Steenis, 1988). Beberapa spesies Capsicum antara
lain C. anmum L., C. frutescens L., C. chinense Jacquin, C. pendulum
Willdenow dan C. pubescens Ruiz dan Pavon. Spesies Capsicum pendulum
Willd. mempunyai hubungan tertutup dengan C. microcarpum Cavanilles yang
kemudian diklasifikasikan secara botani merupakan varietas dari C. baccatum
dan dideskripsikan oleh Linneaus (Greenleaf, 1986).
Jumlah bunga pada setiap nodus merupakan salah satu sifat morfologi yang
membedakan spesies Capsicum, dimana pada spesies C. annuum biasanya hanya
bunga per nodus, sedang pada spesies C. chinense terdapat tiga sampai lima
bunga per nodus (Subramanya, 1983).
Menurut Permadi dan Kusandriani (1996) tanaman cabai termasuk
tanaman dikotil berbentuk semak, batangnya berkayu, tipe percabangannya tegak
atau menyebar. Struktur perakarannya diawali dari akar tunggang yang sangat
kuat dan bercabang ke samping dengan akar-akar rambut. Pola pertumbuhan
vegetatif berupa percabangan-percabangan dikotomi dari batang utama dan tunas-
tunas lateralnya. Berumur satu tahun atau menahun dengan tinggi 1-2,5 meter.
Mempunyai bunga menunduk dengan bunga mahkota berbentuk roda. Bunga
tanaman cabai akan muncul dari ketiak daun dengan jumlah bervariasi antara 1 -
8 bunga per mas tergantung spesiesnya. Bunga terdiri dari lima stamen dan
sebuah pistil. Memiliki mahkota berwarna putih sampai ungu, anther berwarna
biru keunguan dan kelopak daun bergerigi (Permadi dan Kunsandriani, 1994).
Bunga pada tanaman cabai umumnya mengalami penyerbukan sendiri
(Rubatzky dan Yamaguchi, 1997). Hal ini disebabkan pada tanaman cabai
penyerbukan terjadi setelah bunga mekar (Cha;mnogami), yaitu polen pecah
beberapa saat setelah bunga mekar. Tetapi karena bobot polen yang relatif berat
sehingga tidak mudah diterbangkan oleh angin, oleh karena itu polen akan jatuh
pada putik dari bunganya sendiri. Namun menurut Greenleaf (1986) penyerbukan
silang secara alami dapat terjadi terutama dengan bantuan lebah. Persentase
persilangan alami pada cabai berkisar antara 7.6 - 36,8% dengan rata-rata 16,5%
tergantung pada populasi lebah penyerbuk.
Thompson dan Kelly (1957) menerangkan bahwa C. annum L. merupakan
spesies yang mempunyai bentuk buah ramping dengan panjang berkisar antara 1-
30 cm dan memiliki daging buah yang tebal. Buah yang belum masak berwarna
coklat atau tetap benvarna hijau. Buah cabai memiliki panjang berkisar antara 0,8
- 30 cm dan diameter lebih dari 8 mm dengan bentuk buah ramping sampai yang mempunyai diameter lebih dari 10 mm. Buah cabai memiliki bentuk kerucut
kecil, langsing, dengan panjang buah 1-30 cm (Greenleaf, 1986; Nonnecke,
1989).
Cabai merah merupakan komoditas yang memiliki nilai ekonomis tinggi
karena banyak diperlukan, terutarna untuk konsumsi segar, dan bahan baku
industri makanan olahan, kosmetik maupun obat-obatan. Kualitas buah yang
dipanen sangat menentukan nilai dan tingkat permintaannya. Kualitas buah,
secara biokimiawi ditentukan oleh rasa pedas (kandungan Capsaisin), kandungan
gula, protein, dan vitamin A. Sedangkan secara fisik ditentukan oleh ukuran buah,
jumlah biji, tebal daging buah, dan warna buah (Kalloo, 1988; Pujiati, 1993).
Kualitas buah sangat dipengaruhi oleh kadar air buah dan ada tidaknya penyakit
yang menyerang buah tersebut. Di pasaran, kualitas kesehatan dan kesegaran
buah bahkan secara langsung menentukan tinggi rendahnya harga.
Syarat Tumbuh
Tanaman cabai merah dapat tumbuh pada berbagai jenis tanah, asalkan
mempunyai drainase dan aerasi cukup baik. Tingkat kemasaman tanah (pH tanah)
antara 5.5 - 6.8 merupakan kondisi yang baik untuk tanaman cabai merah (Sumarni, 1996). Menurut Ashari (1995), tanaman cabai dapat tumbuh pada
berbagai jenis tanah, dengan struktur yang remah, kaya bahan organik dan
memiliki drainase baik.
Untuk dapat tumbuh optimal, tanaman cabai merah memerlukan kisaran
suhu udara 18" - 27" C. Suhu udara yang optimum untuk pertumbuhan dan pembungaannya adalah 21" - 27" C dan untuk pembuahanya antara 16" - 23" C.
pembungaan. Suhu optimum untuk pertumbuhan vegetatif adalah 15"
-
20" C(Sumarni, 1996).
Sementara itu Rubatzky dan Yamaguchi (1997), menyatakan bahwa
intensitas curah hujan yang sesuai untuk pertumbuhan tanaman cabai adalah 600 -
1.200 mdtahun. Tanaman cabai kurang tahan terhadap curah hujan yang tinggi,
terutama pada saat berbunga, karena bunga akan gugur. Curah hujan yang merata
sepanjang tahun berpengaruh baik, karena tidak terjadi kekurangan ataupun
kelebihan air selama pertumbuhannya.
Budidaya
Untuk mendapatkan pertumbuhan tanaman cabai yang baik, mutu bibit
sangat menentukan. Bibit yang baik diperoleh dari benih yang sehat, yaitu diambil
dari tanaman berbuah lebat, seragam, serta bebas dari serangan hama dan penyakit
(Sumarni, 1996).
Penanaman cabai dapat dilakukan dengan cara pindah tanaman
(transplanting) ataupun dengan cara sebar langsung tanpa penyemaian. Untuk
mempercepat perkecambahan, biji dapat diiendam dalam air panas (50" C).
Media persemaian yang baik adalah campuran antara pupuk kandang dan tanah
dengan perbandingan 1 : 1 (Surnarni, 1996; Rubatzky dan Yamaguchi, 1997).
Ashari (1995) menyatakan bahwa 2-3 minggu setelah biji disemai, dapat
dilakukan pembumbungan. Pada 5-7 rninggu setelah semai, bibit dapat
dipindahkan ke lapang. Jarak tanam yang biasa digunakanyaitu 60-80 cm untuk
jarak antar baris, dan 40-50 cm untuk jarak dalam baris. Jarak tanam yang terlalu
rapat mengakibatkan tanaman tumbuh terlalu tinggi, sehingga mudah patah oleh
angin.
Kebutuhan pupuk untuk tanaman di lapang dan rumah kaca akan berbeda,
mendapatkan hara dari dalam tanah, sehingga daerah perakarannya menjadi luas.
Sedangkan tanaman yang ditanam dalam polibag di dalam rumah kaca, hanya
memperoleh hara dari pemupukan, sehingga pupuk yang diberikan lebih banyak
daripada pemupukan untuk tanaman di lapang. Tanaman cabai di lapang
memerlukan pupuk kurang lebih 170-220 kg Nlha, dan 22 kg P h a serta
potassium ditambahkan apabila ketersediannya kurang (Rubatzky dan
Yamaguchi, 1997). Hasil temuan Santika (1999) menunjukkan bahwa, pada
tanaman cabai di lahan bekas sawah memerlukan 1.660 kg pupuk
buatanlha/musim. Sedang pada lahan bekas tanaman tebu dalam satu musim
dibutuhkan 1.070 Kg N/ha (setara 2,3 ton UreaJha), 90 kg P205/ha (setara 200 kg
TSP/ha) dan 68 kg K20/ha (setara 125 kg KCVha yang diberikan 3-4 kali.
Penyakit Antraknosa
Penyakit antraknosa disebabkan oleh serangan cendawan patogen,
merupakan kendala biologis yang paling besar dalam usahatani cabai merah,
terutama karena menyerang buah yang terbentuk maupun setelah buah dipanen.
Patogen yang menyerang buah merupakan kendala terbesar dalam peningkatan
produksi cabai merah, karena buah dapat gugur sebelum dipanen atau buah
menjadi busuk sebelum dan setelah dipanen, sehingga mengurangi produksi buah
yang dapat dipasarkan. Penyakit antraknosa dapat berlanjut menyerang buah
dalam penyimpanan di tingkat konsumen. Oleh karena itu penyakit ini dianggap
sebagai yang paling merugikan dibandingkan dengan penyakit lain. (Suhardi,
1989).
Penyebab penyakit antraknosa pada cabai adalah Colletotrichum piperaturn
dan C. q s i c i Syd and Bisb. (Chupp dan She< 1960; Black et al., 1991).
Patogen lain yang dapat menyebabkan antraknosa pada cabai merah adalah
coccodes (Wailr.) Huges. Dari kelima patogen tersebut yang paling banyak
menyerang tanaman cabai merah adalah , C. capsici (Syd.) Butler and Bisb. dan
C. gloeosporioides Penz. Sacc. (Hadden dan Black, 1989). Di Indonesia, spesies
C. capsici Sydow dan C. gloeosporioides Penz. Sacc adalah yang paling banyak
dijumpai. Dari hasil penelitian diketahui bahwa Spesies C. capsici lebih banyak
menyerang pertanaman cabai di dataran tinggi dan C. gloeosporides pada dataran
rendah (Suryaningsih et al., 1996).
Serangan penyakit antraknosa sangat berfluktuasi bergantung pada kondisi
lingkungan. Tingkat serangan terberat terjadi pada musim penghujan, atau pada
lingkungan pertanaman dengan kelembaban lebih dari 90%, dengan suhu di atas
30' C (AVRDC, 1988; Baoli; 1991; Wijaya, 1991). Di Indonesia, penyakit antraknosa sudah sangat meluas, baik pada pertanaman di dataran rendah maupun
dataran tinggi, dan menyebabkan kerugian yang sangat besar karena menyerang
buah pada berbagai fase pertumbuhan, baik yang baru terbentuk maupun yang
telah siap dipanen. Di daerah Brebes (Jawa Tengah) sekalipun dengan
pengendalian yang sangat intensif dilaporkan masih menyebabkan kerugian
hingga 45% (Sanjaya, 1997), sedangkan di Sumatera Barat mencapai 35% (Vos,
1994).
Gejala, Siklus dan Ekologi Patogen Antraknosa
Penyakit antraknosa menimbulkan gejala busuk buah yang dicirikan oleh
adanya bercak coklat kehitaman pada permukaan buah yang lalu meluas manjadi
busuk lunak, pada bagian tengah bercak terdapat kumpulan titik-titik hitam yang
terdiri dari kelompok setae dan konidium jamur. Pada serangan yang berat dapat
menyebabkan buah mengering dan keriput sehingga buah yang seharusnya
berwarna merah menjadi seperti jerami (Semangun, 1994). Serangan yang te rjadi
dapat menimbulkan rebah kecambah serta pada tanaman dewasa dapat
menimbulkan mati pucuk dan infeksi lebih lanjut dapat menyebabkan busuk
kering pada batang (Suryaningsih, et al., 1996). Cendawan ini dapat menyebabkan
infeksi ringan pada daun dan batang muda yang mungkin tidak terdeteksi, namun
cendawan mampu bertahan dan berkembang biak sampai tahap tertentu hingga
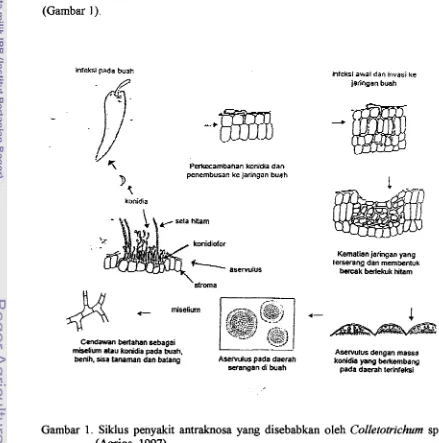
buah mulai masak dan menjadi rentan terhadap infeksi (Agrios, 1997). Cendawan
[image:38.584.82.521.249.692.2]tersebut bereproduksi dengan membentuk massa konidia dalam aservulus
(Gambar 1).
infeksi pada buah infeksi awal dan invasi ke
jaringan buah
konidia
Perkecarnbahan konidia dan penernbusan ke jaringan buah
Uematian jaringan yang terserang dan membentuk
bercek bcrlekuk hitam
-
miselium1-
Cendawan bettahan sebagai
misttiurn atau konidia pada buah. Aservulus dengan rnassa
benih. sisa tanaman dan batang Aservulus pada daerah konidia yang berkembang serangan di buah pada daerah terinfeksi
Kondisi yang sesuai untuk perkembang-an penyakit antraknosa adalah
pada kelembaban relatif 95%, yang akan rnem-bantu inisiasi infeksi dan
perkembangan penyakit selanjutnya (Suryaningsih et al., 1996). Suhu optimum
untuk perkembangan C. capsici adalah 28-36' C (AVRDC, 1989). Hal ini
menyebabkan serangan penyakit di musim hujan lebih tinggi dari pada dimusim
kemarau. Suhu, kelembaban relatif dan curah hujan yang tinggi pada saat
terjadinya proses pernasakan buah akan memacu infeksi dan sering menyebabkan
epidemi yang merusak (Agrios, 1997).
Ketahanan Tanaman Cabai Terhadap Antraknosa
Tanaman yang tahan terhadap penyakit adalah tanaman yang secara
hngsional mampu menghambat perkembangan patogen sehingga patogen tersebut
tidak dapat berkembang dan menyebar. Sebaliknya, tanaman rentan adalah
tanaman yang tidak mampu menghambat perkembangan patogen penyebab
penyakit. Ketahanan terhadap penyakit ini dapat dikelompokkan ke dalam
ketahanan struktural dan ketahanan hngsional. Ketahanan struktural adalah
ketahanan terhadap penyakit yang disebabkan oleh karena struktur tanaman itu
sendiri yang menyebabkan patogen tidak menyukai atau tidak dapat melakukan
invasi ke dalam tanaman tersebut. Ketahanan struktural ini juga disebut ketahan-
an pasif atau ketahanan prainfeksi karena tanaman tidak melakukan reaksi
terhadap patogen. Contoh ketahanan struktural ini antara lain tebal dan kerasnya
lapisan epidermis, adanya lignin pada dinding sel, adanya pubescens (duri-duri
halus) pada permukaan organ vegetatif, atau adanya lapisan lilin pada permukaan
buah. Sedangkan ketahanan hngsional atau ketahanan aktif adalah ketahanan
yang disebabkan oleh adanya reaksi biokimiawi tanaman sehingga perkembangan
patogen dapat terhambat. Ketahanan ini disebut juga ketahanan pascainfeksi.
tertenty atau terbentuknya senyawa toksik tertentu seperti fitoaleksin yang dapat
mematikan patogen (Agrios, 1997). Oleh karena itu tampilan struktural
(morfologi) tanaman maupun aktivitas biokimiawi kemungkinan dapat digunakan
sebagai penanda ada tidaknya gen pengendali ketahanan.
Seperti diketahui, proses infeksi penyakit antraknosa diawali dengan
masuknya spora ke dalam buah melalui celah antar sel epidermis, atau melalui
luka buah. Bagian luar dari spora tersebut mengadung perekat yang dapat dengan
mudah menempel sasaran infeksi lewat percikan air siraman atau air hujan
(Suryaningsih, et al. 1996). Oleh karena itu tarnpaknya masih perlu dikaji lebih
jauh tentang fase pertumbuhan pada tanaman cabai yang kritis terhadap infeksi
antraknosa serta pengaruhnya terhadap ketahanan.
Pengendalian Penyakit Antraknosa
Usaha mengatasi penyakit antraknosa pada cabai merah hingga saat ini
masih didorninasi dengan penggunaan bahan kimiawi. Usaha tersebut mampu
memberikan hasil yang cukup memuaskan, meskipun pengendalian dengan bahan
kimia dinilai kurang efisien dan bersifat sementara (Wijaya, 1991). Selain itu,
pengendalian secara kimiawi diketahui dapat menyebabkan pencemaran, baik
terhadap lingkungan maupun produk yang dihasilkan, disamping harganya relatif
mahal dan membahayakan petani. Pengendalian secara kimiawi juga diketahui
dapat menyebabkan kekebalan pada patogen penyebab penyakit, karena akan
te rjadi seleksi pada populasi patogen itu sendiri sehingga akan muncul biotipe
yang lebih kebal (Suhardi, 1991; Suryaningsih dan Suhardi, 1993; Vos, 1994).
Usaha pengendalian yang lebih mudah, murah, dan tidak membahayakan
lingkungan adalah pengendalian secara biologis dengan kultivar yang resisten
(tahan). (Setiamiharja dan Qosim, 1991; Wijaya, 1991; Amalia et al., 1994).
17
terhadap penyakit antraknosa. Hasil pengujian Setiamihardja dan Qosim (1991) di
Lembang dengan menggunakan 36 kultivar yang beredar di Jawa Barat
menunjukkan bahwa tidak ditemukan hltivar yang benar-benar tahan terhadap
penyakit antraknosa. Akan tetapi hasil pengujian di tempat lain, seperti di
AVRDC ditemukan ada genotipa yang tahan terhadap penyakit ini (AVRDC, 1 988). Dengan demikian secara alarni sebenarnya ada gen-gen ketahanan terhadap penyakit antraknosa pada plasma nutfah cabai merah.
Ketahanan tanaman terhadap penyakit antraknosa dikendalikan secara
genetik. Laporan tentang gen pengendali ketahanan terhadap antraknosa pada
cabai adalah bervariasi. Cheema (1984) dan Ahmad et al. (1991) melaporkan bahwa ketahanan terhadap antraknosa adalah bersifat aditif dan resesif.
Sedangkan menurut Park et aL (1990), ketahanan terhadap antraknosa dikendali- kan secara kuantitatif oleh gen dominan. Perbedaan kesimpulan tentang gen
pengendali tersebut disebabkan oleh sumber gen ketahanan yang diteliti berbeda-
BAHAN DAN METODE
Waktu dan Tempat
Percobaan dilaksanakan di rumah kaca Baranangsiang Jurusan Budidaya
Pertanian dengan menggunakan polibag dan jenis tanah Latosol coklat (Tajur) serta
di laboratorium Mikologi Tumbuhan, Jurusan Hama dan Penyakit Tumbuhan,
Fakultas Pertanian IPB, Bogor. Studi ini berlangsung selama 12 (duabelas) bulan, yaitu mulai bulan April 2000 hingga Maret 2001.
Bahan dan Alat
Bahan yang digunakan adalah 4 genotipa cabai yang merupakan koleksi
Pusat Studi Pemuliaan Tanaman (PSPT), IPB. Inokulum yang digunakan adalah
isolat cendawan C. gloeosporiodes yang diperbanyak dari biakan murni berumur 1
rninggu dan diperoleh dari Laboratorium Mikologi Tumbuhan Jurusan Hama dan
Penyakit Tumbuhan Fakultas Pertanian IPB Bogor. Alat-alat yang digunakan
meliputi h e m y t o m e t e r , Sprayer volume 10 liter dan hand-sprayer plastik volume
1 liter, timbangan elektrik OHAUS tipe GT 2100 dengan ketelitian 0,01 g, bak
plastik ukuran (40 x 20) cm sebagai inkubator dan alat ukur lainnya.
Metode Penelitian
1. Uii Ketahanan di Rumah Kaca.
Percobaan di rumah kaca disusun mengikuti rancangan faktorial dengan 2
(dua) faktor (genotipa dan saat inokulasi) dalam rancangan lingkungan Acak
Lengkap (RAL) dengan 4 ulangan. Setiap ulangan terdiri atas 5 tanaman, sehingga
Faktor genotipa cabai yang diteliti meliputi: genotipa UPM, Titsuper,
Yogya, dan Jatilaba. Sedangkan faktor waktu inokulasi antara lain: inokulasi pada
periode 75% tanaman telah berbunga (anthesis) dan saat berbuah.
Adapun model matematik dari rancangan penelitian ini adalah sebagai
berikut :
Yijk = p
+
a i+
pj+
(ap)ij+
~ i j kKeterangan :
1 = 1,2,3,4 (genotipe); j = 1,2, (inokulasi); k = 1,2,3 4 (ulangan). Yijk = nilai pengamatan genotipe ke-i, inokulasi ke-j, ulangan ke-k
p = rataan umum
a i = pengaruh varietas ke-i pj = pengaruh saat inokulasi ke-j
(aP)ij = pengaruh interaksi genotipe ke-i dan saat inokulasi ke-j ~ i j k = galat percobaan
2. Uii Ketahanan di laboratorium
Percobaan disusun dengan menggunakan rancangan faktorial dalam
lingkungan Acak Lengkap yang diulang empat kali. Faktor pertama adalah 4
genotipa yaitu: genotipe UPM, Titsuper, Yogya dan Jatilaba. Sedangkan faktor
yang kedua adalah waktu inokulasi buah meliputi: inokulasi saat buah masak
fisiologis (hijau) dan masak penuh (merah). Buah yang diiiokulasi didapat dari
tanaman kontrol (sehat, yang tidak diinokulasi). Buah masak fisiologis (hijau)
adalah buah yang telah mencapai ukuran maksimum dan masih benvarna hijau.
Buah cabai telah masak penuh ditandai dengan 75% telah berwarna merah. Sebagai
unit percobaan adalah bak plastik, dalam penelitian ini terdapat 32 unit percobaan.
Setiap blak plastik masing-masing diisi 6 buah cabai yang sebelumnya dialasi
(hijau) dan mas& penuh (merah) diambil kemudian dinokulasi dengan inokulum
cendawan C. gloeosporiodes di laboratorium.
Sedangkan model matematik ddam penelitian ini adalah sebagai berikut:
Yijk = p
+
a i+
pj+
(ap)ij+
~ i j kKeterangan :
1 = 1,2,3,4 (genotipe); j = 1,2, (inokulasi); k = 1,2,3 4 (ulangan) Yijk = nilai pengamatan genotipe ke-i, inokulasi ke-j, ulangan ke-k
p = rataan umum
a i = pengaruh genotipe ke-i f3j = pengaruh saat inokulasi ke-j
(af3)ij = pengaruh interaksi genotipe ke-i dan saat inokulasi ke-j
~ i j k = galat percobaan
Petaksanaan Percobaan
1. Percobaan di Rumah Kaca:
Dalam percobaan ini inokulum yang digunakan berasal dari biakan murni
cendawan C. gloeosporiodes yang telah berumur 1 minggu. Isolat kultur
ditumbuhkan dalam medium PDA (Potato Dextro Agar) pada petridish. Suspensi
diperoleh dengan menambahkan air aquadest ke medium kultur, kemudian digesek
dengan penggores gelas. Selanjutnya suspensi diencerkan hingga konsentrasi 1
o6
spora/ml air. Konsentrasi spora dihitung dengan metode pengenceran.
Penghitungan spora dilakukan dengan menggunakan alat haemocytometer.
Inokulasi dilakukan dengan metode semprot merata ke seluruh permukaan tanaman
pada waktu sesuai dengan perlakuan (periode berbunga dan berbuah).
Variabel tingkat ketahanan yang diamati adalah: persen keparahan penyakit,
persentase kejadian penyakit, tingkat kerusakan dan laju infeksi. Penentuan
terinfeksi dibanding bagian yang sehat. Pengelompokan skor dilakukan mengikuti
cara yang digunakan Meity Sinaga et. al. (1992), yaitu sebagai berikut:
Skor Gejala Antraknosa
Skor 0 : tidak ada perkembangan bercak 1 : O < x l l O %
2 : 1 0 < x 1 2 0 %
3 : 2 0 < x 1 3 0 %
4 : x > 3 0 %
Persen keparahan penyakit (% DS) dihitung mengikuti rumus Towsend
dan Heuberger [dalum Direktorat Bina Perlindungan Tanaman Departemen
Pertanian ,(1994)] sebagai berikut :
Keterangan:
DS = Keparahan penyakit
ni = jumlah buah dari tiap kategori serangan
xi = nilai skor tiap kategori serangan
N = jumlah buah yang diamati
X = nilai skor serangan tertinggi
Kriteria ketahanan tanarnan terhadap penyakit didasarkan pada keparahan
penyakit (Kadu, 1978; Wijaya, 1991; Meity Sinaga et al., 1992 dengan modifikasi)
sebagai berikut:
Kriteria Keparahan penyakit ( % )
Imun ( I ) 0
Sangat Tahan ( ST ) O < D S 5 5
Tahan ( T ) 5 < DS
r
10Rentan ( R ) 10 < DS
r
30Kejadian penyakit dihitung sebagai persentase jumlah buah yang terinfeksi ter-hadap jurnlah buah yang diamati pada satu tanaman. Tingkat kerusakan buah dihitung sebagai hasil kali keparahan penyakit dengan kejadian penyakit. Laju
infeksi dihitung berdasarkan koefisien arah (slope) kurva keparahan penyakit yang ditransformasi logit. Pengarnatan di rumahkaca dilakukan setelah gejala tirnbul,
yaitu 7 dan 14 HSI (hari setelah inokulasi) untuk perlakuan inokulasi saat berbuah.
Sedang pada perlakukan inokulasi periode berbunga, gejda muncul pada saat 20
dan 40 HSI. Kondisi pertanaman di Rumah kaca yang diinokulasi dengan
cendawan C. glueosporioides disajikan pada Gambar 2.
Gambar 2. Kondisi pertanaman setelah inokulasi pada pengujian di
rumah kaca. Pertumbuhan vegetatif tanaman tidak
[image:46.584.93.516.303.679.2]2. Percobaan di laboratorium
Inokulum yang digunakan sama, yaitu biakan murni cendawan C.
gloeosporioides yang ditumbuhkan pada medium PDA dan telah berumur 1
minggu. Inokulasi dilakukan dengan metode tempel, menggunakan potongan
inokulum patogen berdiameter 0,5 cm terhadap buah cabai yang telah dipetik.
Buah yang akan diinokulasi berasal dari tanaman sehat (kontrol). Terdiri dari
buah masak fisiologis (hijau), merupakan buah yang telah mencapai ukuran
maksimum dan benvarna hijau. Sedang buah masak penuh (merah) ditandai
dengan 75% telah berwarna merah. Sebelum diinokulasi, buah terlebih dahulu
dicuci bersih dengan larutan detergen kemudian dikeringkan. Setelah buah-buah
tersebut diinokulasi cendawan C. gloeosporiates, kemudian diinkubasikan dalarn
bak-bak plastik yang sebelumnya dialasi dengan kertas saring basah dan sedotan
limun. (Gambar 3). Untuk menjaga kelembaban dalam bak plastik ditetesi air setiap
hari, dan dibungkus dengan plastik transparan kemudian diinkubasikan di
[image:47.580.93.521.396.689.2]laboratorium.
Sebagai unit percobaan adalah bak plastik, dalam penelitian ini terdapat 32
unit percobaan. Setiap blak plastik masing-masing diisi 6 buah cabai yang
sebelumnya dialasi plastik sedotan limun. Variabel ketahanan yang diamati sarna
dengan percobaan di rumah kaca yaitu: % keparahan penyakit dan % kejadian penyakit dan tingkat kerusakan buah serta laju infeksi. Pengamatan di laboratorium
dilakukan setelah gejala timbul, yaitu 3 dan 5 HSI.
Analisis Data
1 . Analisis Ranam (.ANOVA)
Semua data hasil pengamatan ditabulasikan dan dianalisis sidik ragam.
Apabila F-hitung signifikan, maka dilanjutkan dengan Uji Jarak Berganda Duncan
(DMRT) pada taraf 5% dengan pertimbangan bahwa macam perlakuan yang
diberikan tidak saling berhubungan. Sebelum dianalisis semua data persentase
terlebih dahulu ditransformasi dalam ./(y+l).
2. Penentuan Metode Terbaik dalam Penmi-iian Ketahanan terhadap Antraknosa Uji ketahanan terhadap antraknosa lazimnya dilakukan oleh para peneliti di
laboraturium. Oleh karena itu untuk mengevaluasi 2 (dua) metode inokulasi dalam
pengujian ketahanan terhadap aatraknosa di Rumah Kaca, maka dilakukan uji
korelasi. Korelasi antara variabel ketahanan dari hasil pengujian di rumah kaca
dengan hasil pengujian di laboratorium. Nilai korelasi tertinggi digunakan sebagai
indikator pengujian terbaik.
Koefisien korelasi (r) dihitung berdasarkan rumus sebagai berikut (Steel dan
HASIL DAN PEMBAHASAN
1. Keadaan umum percobaan
Secara umum, keadaan pertumbuhan tanaman di rumah kaca dari mulai
pembibitan hingga produksi cukup baik. Hama yang dijumpai selama pertumbuhan
vegetatif adalah tungau. Sesudah dilakukan pengendalian dengan akarisida,
serangan dapat dikendalikan dan tanaman tumbuh normal. Serangan penyakit
selain antraknosa selarna percobaan berlangsung tidak ada. Hal ini kemungkinan
karena adanya sterilisasi ruangan dengan formalin sebelum percobaan berlangsung.
Suhu dan kelembaban nisbi rumah kaca cukup mendukung pertumbuhan
tanaman maupun perkembangan patogen. Suhu rata-rata harian sekitar 24
-
30" C dan kelembaban udara rata-rata 68-
81% (Tabel Lampiran 1) adalah kondisi idealuntuk pertumbuhan tanaman cabai merah (Rubatzky dan Yamaguchi, 1997), dan
cukup baik bagi perkembangan cendawan C. gloeosporioides (Black, 1991). Hal
ini terlihat dari pertumbuhan tanaman yang cukup baik, dan inokulasi buatan yang
dilakukan dengan cara semprot terhadap tanaman pada saat antheszs dan
pembentukan buah berhasil menimbulkan gejala penyakit antraknosa pada buah
cabai.
Seperti pada umumnya pertanaman di dalam rumah kaca, etiolasi
pertumbuh-an tanaman tidak terhindari, sehingga tanaman cenderung tinggi dan getas (mudah patah). Oleh karena itu dalam perlakuan maupun pengamatan perlu
penanganan yang hati-hati. Dengan pengunaan ajir bambu sebagai penopang dan
tali rafia sebagai pengikat, maka kerusakan tanaman dapat dihindari.
Pengujian di laboratorium dapat berlangsung dengan baik. Kondisi
kelembaban udara pada inkubator buatan dapat terjaga dengan baik sehingga
perkembangan inokulum yang diinokulasikan pada buah dapat berkembang seperti
2. Hasil uji ketahanan terhadap penyakit antraknosa pada buah masih di pohon (di Rumah Kaca)
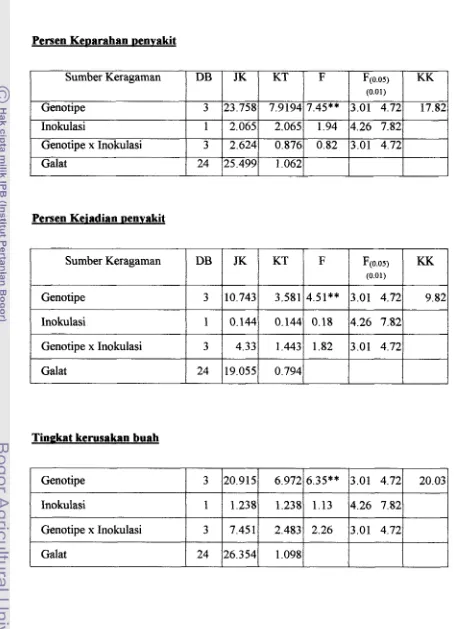
Hasil analisis ragam (ANOVA) menunjukkan bahwa faktor genotipa, waktu inokulasi, dan interaksi keduanya berpengaruh nyata
-
sangat nyata terhadapseluruh peubah yang diamati (Tabel Lampiran 2).
Hasil penelitian menunjukkan bahwa berdasarkan keparahan penyakit,
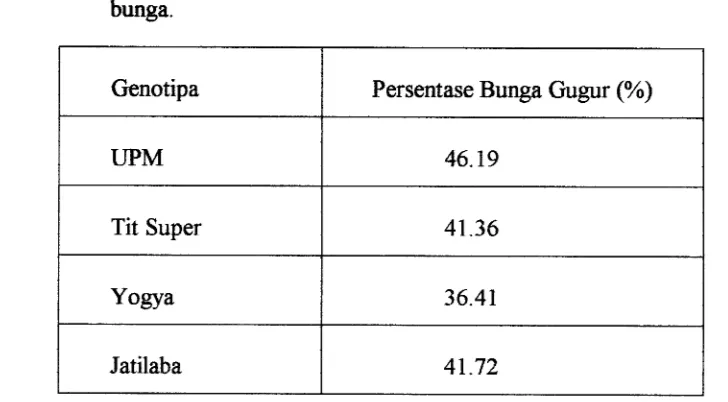
[image:51.586.101.526.287.673.2]kejadian penyakit, tingkat kerusakan dan laju infeksi genotipa UPM lebih tahan dibandingkan dengan ketiga genotipa lainya. (Tabel 1).
Tabel 1. Nilai rataan keparahan penyakit, kejadian penyakit, tingkat kerusakan dan laju infeksi serta kategori ketahanan dari empat genotipa cabai hasil uji di Rumah kaca.
Saat I&okdmi
Berbunga
UPM
Tit Super
I
JatilabaI
31.76 baI
81.91 aI
24.48 ab1
0.044 Isangat RentanKeparahan Penyakit ')
PA)
I I , I
I
7.29 c
54.69 a
Yogya
- - -
(
UPMI
35.42 ab1
33.58 b/
12.01 c1
0 . 1 3 2 Isangat i en tan KejadianPenyakit l) (%)
Rata-rata
Berbuah
12.71 c
45.83b
41.71 ab
Nilai rata-rata yang diikuti oleh hunrf yang sama pada kolom yang sama, tidak berbeda niata
berdasarkan uji DMRT pa& taraf 5%. ') Angka yang disajikan adalah data sebenanrya,
sedangkan analisis statistika dilakukan terhadap data transfonnasi d(y+l). 2, Evaluasi/Penilaian
kategori ketahanan didasarkan pada nilai keparahan penyakit penyakit. 3, Berasal dari
transformasi Logit.
Tingkat " kerusakan ("A) 33.86 Yogya Jatilaba Rata-rata 0.90 d 26.44ab
72.40 a
Laju Infeksi
( r ) (% / hari) 3,
53.21
50.30ab
38.71 ab
44.43
Kategori k e t a h m 2,
Berdasarkan keparahan penyakit, hasil penelitian ini sejalan dengan informasi
sebelurnnya bahwa genotipa UPM adalah genotipa yang tahan terhadap antraknosa
Wdayat, 2000'). Bila genotipa UPM diinokulasi pada periode berbunga akan memberikan respon tahan, namun bila diinokulasi pada saat berbuah maka genotipe
ini menunjukkan respon sangat rentan sama seperti tiga genotipa lain. (Evaluasi
peringkat ketahanan berdasarkan keparahan penyakit)
Hasil penelitian ini berbeda dengan hasil yang diperoleh Setiamihardja dan
Qosim (1991) yaitu bahwa genotipa Titsuper dan Jatilaba tergolong rentan. Pada
Tabel 1 tampak genotipa Titsuper dan Jatilaba menunjukan respon sangat rentan.
Perbedaan hasil ini kemungkinan disebabkan oleh perbedaan jenis inokulum yang
digunakan. Dalam pengujian ketahanan terhadap antraknosa, Setiamihardja dan
Qosim (1991) menggunakan biakan murni cendawan C. capsici. Sedangkan dalam
penelitian ini digunakan inokulum biakan murni cendawan C. gloeosporioides. Suryaningsih at al., (1996), mengatakan bahwa populasi C. gloeosporioides di
lapangan 5-6 kali lebih banyak daripada populasi C. capsici. Dengan demikian
tampaknya terdapat kecenderungan C. gloeosporioides lebih ganas dan dapat
menimbulkan inf'eksi laten dibandingkan dengan C. capsici (Sanjaya, 1998).
Waktu inokulasi sangat berpengaruh terhadap kejadian penyakit dan tingkat
kerusakan buah. Inokulasi pada periode berbunga menyebabkan kejadian penyalcit
dan tingkat kerusakan yang lebih tinggi dibandingkan dengan inokulasi saat
berbuah, kecuali pada genotipa UPM. Hal ini kemungkinan disebabkan oleh
banyaknya bakal buah dan buah muda yang terkontarninasi inokulum cendawan,
yang selanjutnya menyebabkan lebih banyak buah yang terinfeksi. Pola yang sama
terlihat pada tingkat kerusakan tanaman.
Bila ditinjau dari komponen laju infeksi, inokulasi pada periode berbunga
menghasilkan laju infeksi rendah pada semua genotipa berkisar antara 0.23-0.51%
per hari). Sedangkan inokulasi saat berbuah menimbulkan laju infeksi tinggi
(antara 0.13-0.14% per hari). Hal ini menunjukkan bahwa tanaman cabai pada saat
berbunga lebih tahan dibandingkan pada periode berbuah. Rendahnya laju infeksi
pada periode berbunga ini, diduga karena bakal buah yang terbentuk pada periode
berbunga yang relatif masih sangat muda, merupakan media yang kurang baik bagi
pertumbuhan patogen. Terhambatnya pertumbuhan patogen ini ditandai dengan
rendahnya laju infeksi pada periode berbunga (Tabel 1). Sebagaimana dikemukakan
oleh Black et a1.,(1991) dan Suryaningsih et al. (1996), bahwa gejala awal
antraknosa cenderung terjadi pada buah yang telah matang. Buah cabai matang
mengandung karbohidrat pada kadar yang lebih tinggi dibanding dengan buah yang
mash muda (Rubatzky dan Yamaguchi, 1997). Menurut Agrios (1997),
karbohidrat sangat diperlukan untuk perkembangan cendawan. Dengan dernikian
dapat diiaharni apabila perkembangan cendawan pada buah yang banyak
mengandung karbohidrat relatif lebih cepat dibandingkan dengan pada buah muda.
Perkembangan cendawan ini ditunjukkan pula dengan keparahan penyakit relatif
lebih tinggi bila inokulasi te rjadi pada saat berbuah.
Selain itu pada Tabel 1 tampak pula bahwa kapanpun diinokulasi, genotipa
UPM mempunyai nilai laju infeksi paling rendah dibanding yang lain. Genotipa UPM bila diinokulasi pada saat berbunga hanya mempunyai laju infeksi 0.02% per
hari dan merupakan nilai yang paling rendah dibandingkan dengan ketiga genotipa
lain yang diuji, yaitu Titsuper (0.05!40), Yogya (0.05%) dan Jatilaba (mempunyai
laju infeksi 0.04 % per hari). Demikian pula bila diinokulasi pada saat berbuah, genotipa UPM juga mempunyai laju infeksi paling rendah (0.13% per hari)
Jatilaba (mempunyai laju infeksi 0.13% per hari). Kenyataan ini memberikan
indikasi bahwa genotipa UPM lebih toleran / tahan dibanding genotipa lain, karena secara relatif tampak mampu menghambat perkembangan patogen penyebab
penyakit. Namun karena kisaran tingkat ketahanan genotipa yang digunakan dalam
penelitian ini terbatas, maka peluang untuk mendapatkan genotipe tahan dan sangat
tahan juga rendah. Dalam ha1 ini tampak hanya 1 (satu) genotipe saja yang
memberikan respon tahan (UPM).
Selanjutnya, inokulasi saat berbunga kemungkinan juga berakibat terhadap
tingginya persentase gugur bunga, yang pada akhirnya berpengaruh terhadap
jumlah buah yang terbentuk. Sebagaimana dikemukakan oleh Black (1991), bahwa
patogen penyebab penyakit antraknosa dapat menyerang hampir seluruh bagian
tanaman, tidak terkecuali bunga. Gugur bunga adalah salah satu gejala jika organ
tersebut terserang antraknosa. Hasil pengamatan yang diialcukan pada tiga hari
setelah inokulasi menunjukkan bahwa inokulasi pada saat berbunga ternyata
menyebabkan gugur bunga yang relatif tinggi, yaitu sekitar 40% dari bunga yang
telah terbentuk (Tabel 2). Namun demikian respon keempat genotipa yang diuji
[image:54.580.125.489.521.722.2]relatif tidak berbeda satu sarna lain.
Tabel 2. Pengaruh inokulasi pada saat berbunga terhadap persentase gugur bunga.
Genotipa
UPM
Tit Super
Yogya
Jatilaba
Persentase Bunga Gugur (%)
46.19
41.36
36.41
Di samping data kuantitatif, kedua metode inokulasi tersebut ternyata juga
menghasilkan efek gejala yang sedikit berbeda terhadap buah. Inokulasi saat
berbunga cenderung menimbulkan serangan pada ujung buah, sedangkan inokulasi
pada saat berbuah menimbulkan gejala pada pangkal buah. Fenomena ini dapat
dijelaskan bahwa inokulasi pada saat berbunga menyebabkan bagian ujung buah
(bagian buah yang pertama kali terbentuk) akan terlebih dahulu terinfeksi karena
inokulum yang disemprotkan akan berakumulasi pada bakal buah. Sedangkan
inokulai pada saat berbuah, inokulum akan lebih mudah terakumulasi pada
permukaan buah, tempat larutan inokulum tersebut tertimbun, yaitu kebanyakan
adalah pada bagian pangkal buah (sektiar pedikel).
Gambar 4. Gejala yang muncul pada buah akibat inokulasi saat berbunga
[image:55.586.111.521.360.681.2]3 2 3. Hasil uji ketahanan terhadap penyakit antraknosa pada buah setelah
dipetik (di Laboratorium)
Pengujian di laboratorium dapat berlangsung dengan baik. Hal ini ditandai
dengan perkembangan inokulum yang diinokulasikan pada buah dapat berkembang
seperti yang diharapkan.
Hasil analisis ragam (ANOVA) menunjukkan bahwa hanya pengaruh faktor genotipa saja yang nyata, sedangkan pengaruh waktu inokulasi (masak fisiologis,
hijau dan masak penuh, merah) serta interaksinya tidak nyata (Tabel lampiran 2).
Inokulasi buah hijau dan dan merah menghasilkan tingkat ketahanan yang sama
pada seluruh genotipa yang diuji. Secara visual gejala, penampakan gejala pada
perlakuan buah hijau dan buah merah dapat dilihat pada Garnbar 5.
[image:56.588.91.515.343.707.2]genotipa UPM masih lebih tahan dibanding genotipa yang lain. Hal ini berarti hasil
percobaan di laboratorium selaras dengan hasil uji di rumah kaca.
Gejala penyakit antraknosa pada buah cabai dari setiap genotipa hasil
inokulasi di laboratorium disajikan pada garnbar 6.
Garnbar 6. Penampalcan gejala antraknosa pada genotipa UPM (A), Tit Super (B),
Yogya (C), dan Jati Laba (D) pada pengujian di laboratorium.
4. Evaluasi metode penentuan tingkat ketahanan terhadap antraknosa
Dalam mengklasifikasi tingkat ketahanan terhadap antraknosa pada tanaman
cabai, yang lazim digunakan sekarang ini adalah dengan metode inokulasi di
laboratorium (Sanjaya, 1998). Seperti diketahui bila pada buah setelah dipetik,
maka produksi senyawa antimikrobial yang bersifat racun sebagai sistem
pertahanan fbngsionalnya akan terhenti, sehingga ketahanannya mulai menurun
(Agrios, 1997). Dengan demikian uji yang dilakukan pada saat buah rnasih di
uji ketahanan terhadap antraknosa pada buah cabai yang dilakukan oleh para
peneliti selama ini dilakukan di laboratorium, maka untuk mengevaluasi kedua
metode inokulasi di rumah kaca tersebut, dilakukan analisis korelasi antara variabel
ketahanan di rumah kaca dengan di laboratorium. Metode inokulasi yang paling
tepat adalah inokulasi yang hasilnya mempunyai koefisien korelasi tertinggi dengan
inokulasi pada pengujian di laboratorium. Hal ini dapat dievaluasi dari hasil analisis
antara variabel ketahanan dari pengujian di rumah kaca dengan di laboratorium.
Karena nilai koefisien korelasi yang tinggi antar variabel ketahanan tersebut,
mengindikasikan bahwa hasil uji ketahanan di rumah kaca selaras dengan hasil uji
[image:59.588.100.521.369.611.2]ketahanan di laboratorium.
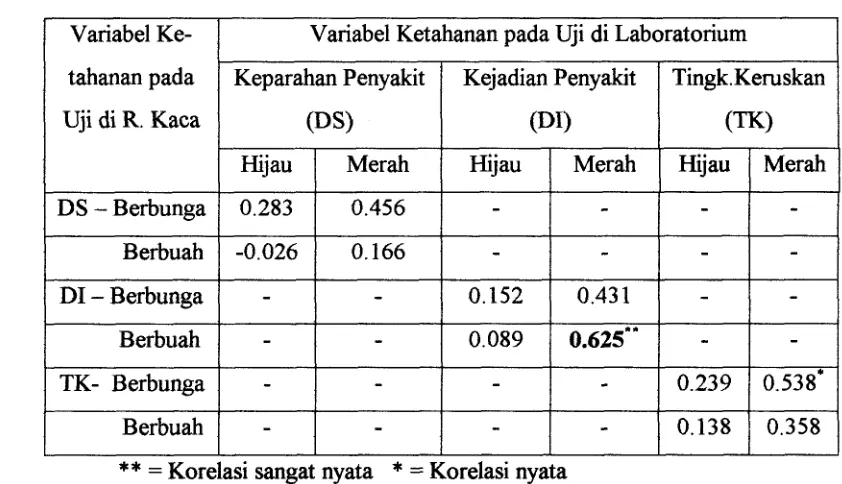
Tabel 4. Hasil uji Koefisien korelasi (r) antara variabel ketahanan dalarn uji di Laboratorium dengan di Rumah kaca.
**
= Korelasi sangat nyata*
= Korelasi nyataHasil analisis koefisien korelasi disajikan pada Tabel 4. Pada tabel tersebut
tarnpak bahwa yang mempunyai korelasi tertinggi antara uji rumah kaca dengan uji laboratorium adalah komponen kejadian penyakit (DI), yaitu pada inokulasi saat
berbuah berkorelasi positip dengan inokulasi buah merah dengan nilai korelasi Variabel Ke-
tahanan pada
Uji di
R.
KacaDS-Berbunga
Berbuah
DI - Berbunga Berbuah
TK- Berbunga
Berbuah
Variabel Ketahanan pada Uji di Laboratorium
Keparahan Penyakit (Ds) Hjau 0.283 -0.026
-
-
-
-
Kejadian Penyakit (DI) Merah 0.456 0.166-
-
-
-
Hijau-
-
0.152 0.089-
-
Tingk.Keruskan (TK) Merah-
-
0.43 1
0.625 dan sangat nyata. Hal ini berarti bahwa uji ketahanan dengan inokulasi pada
saat berbuah di rumah kaca dengan parameter kejadian penyakit, hasilnya 62,5%
sangat nyata mendekati dengan hasil di laboratorium. Sedangkan hasil uji ketahanan dengan inokulasi saat berbunga mempunyai nilai korelasi lebih rendah.
Dengan dernikian inokulasi saat berbuah nyata lebih baik dibanding inokulasi saat
berbunga pada uji ketahanan di rumah kaca. Implikasi dari temuan ini memberikan
makna bahwa inokulasi pada saat berbuah (di rumah kaca) sebaiknya digunakan
KESIMPULAN DAN SARAN
5.1. Kesimpulan
a. Berdasarkan evaluasi di rumah kaca pada inokulasi saat berbunga,
genotipa UPM tergolong agak tahan sedang Titsuper, Yogya dan Jatilaba tergolong sangat rentan terhadap cendawan C. gloeosporioides.
Sedangkan inokulasi saat berbuah keempat genotipa yang diuji
memberikan respon rentan.
b. Waktu yang tepat untuk evaluasi tingkat ketahanan terhadap antraknosa
di rumah kaca adalah inokulasi pada periode berbuah
c. Tingkat ketahanan terhadap penyakit antraknosa pada inokulasi saat
berbuah nyata lebih rendah dibanding dengan inokulasi saat periode
berbunga.
d. Genotipa UPM dan Yogya setelah panen tergolong rentan sedangkan
genotipa Titsuper dan Jatilaba setelah panen memberikan respon sangat
rentan terhadap cendawan C. gloeosporioides.
e. Hasil uji di laboratorium menunjukkan bahwa buah matang fisiologis
(hijau) dan buah matang penuh dari empat genotipa uji menghasilkan
tingkat ketahanan yang tidak berbeda
E
Metode inokulasi pada periode berbuah di rumah kaca dapat digunakanuntuk evaluasi ketahanan cabai terhadap penyakit antraknosa.
5.2. Saran
Perlu dilakukan penelitian lebih lanjut dengan menggunakan genotipa yang
lebih beragam sehingga peluang untuk mendapatkan genotipa yang tahan dan