KERAGAMAN GENETIK SUUMLAH ISOLAT
Closfridium bifermentan
BERDASARKAN
AMPLTRED
RIBOSOMAL DNA REmC77ON ANAL YSIS
DAN TOKSISITASNYA
TERHADAP LARVA NYAMUK
OLEH
:
FATURRAHMAN
PROGRAM PASCASARJANA
INSTrrUT PERTANIAN BOGOR
ABSTRACT
FATURRAHMAN. Genetic Diversity of Clostridium bifennentans Strains by
Amplified Ribosomal DNA Restriction Analysis and Their Toxicity t o Mosquito Larvae. Under the direction of ANTONIUS SUWANTO, ANJA MERYANDINI, and LILY NATALIA
The genus of Clostndium is phylogenetically closely related to Bacillus, the only genus that generated commercially available bioinsecticides, known as Bt-toxin. The purpose of this study is to examine the presence Bt-like toxin in a number of isolates of Clostndium bifermentans, a clostridial species that has been used for many kind of industrial fermentation. One hundred fifty one clostridial isolates were screened out from various habitats such as : cow's intestine, rumen contents of water buffalo, rumen contents of sheep, river sediments, swamp sediments, lake sediments, mangrove forest floor and milk processing waste. Sixteen isolate were identified as Clostridium bifermentans based on its physiology and biochemical characteristics. These isolates were further characterized employing flourescein
antibody technique. Ten isolates out of 16 showed positive flourescence
appearance. These C. bfirmentans isolates shows the phenotiic diversity, due to the intensity of it capacity in gelatine hydrolyze.
Amplified Ribosomal DNA Restriciton Analysis (ARDRA) was carry out for 10 isolates. The result showed that isolates could be separated into three distinct groups, i.e : group 1 (Cb. ATCC638, R l d l b , R2-6, R3-1, Mel-6a, R8-la, Lb-9, dan Sul-4), groups 2 (St-1 and La2-6), and group 3 that consisted only isolate Si-4.
These ten isolates were subsequently characterized for their insecticidal activity toward mosquito larvae, either Aedes aegypty or Culex spp.. The larvicidal activity was calculated as percentage of the death to the total larvae in the experiment, after exposure to spore of Clostndium for 48 h. The 3rd
-
4rd instar larvae mortality was approximately 0-30 % for Aedes aegypti challenged withlo6
-10' sporelml, and 5-40% for Culex spp. with challenged
lo8
spore/ml. CSURAT PERNYATAAN
Dengan ini saya menyatakan bahwa Tesis yang berjudul :
KERAGAMAN GENETIK SEJUMLAH ISOLAT
Clostridium bifennentans BERDASARKAN AMPLIFIED RIBOSOMAL DNA RESTRICTION ANALYSIS DAN TOKSISITASNYA TERHADAP
LARVA NYAMUK
adalah benar dan merupakan hasil karya saya sendiri dan belum pemah
dipublikasikan. Semua sumber data dan informasi yang digunakan telah dinyatakan
secara jelas dan dapat diperiksa kebenarannya.
Bogor, Pebruari 2002
KERAGAMAN GENETIK SUUMLAH ISOLAT
Closfridium bifermentans
BERDASARKAN
AMPLIFIED
RIBOSOMAL DNA RESTRIOTON ANAL YSIS
DAN TOKSISITASNYA
TERHADAP LARVA NYAMUK
FATU RRAH MAN
T e s i s
Sebagai Salah Satu Syarat
untuk Mendapatkan Gelar Magister Sains
pada Program Pascasa jana Institut Pertanian Bogor
PROGRAM PASCASAFUANA
INSTITUT PERTANIAN BOGOR
HALAMAN PENGESAHAN
Judul Tesis : Keragaman Genetik Sejumlah lsolat Clostridium
bifementans berdasarkan Amplified Ribosomal DNA
Restriction Analysis (ARDRA) dan Toksisitasnya terhadap
Larva Nyamuk
Nama Mahasiswa : Faturrahman
Nomor Pokok : 99641
Program Studi : Bioteknologi
Menyetujui :
1. Komisi Pembimbing
n
Dr. Ir. Antonius Suwanto, M.Sc Ketua
Dr. Ania Mervandini. M.S Drh. Lil Natalia M.S
Anggota Anggota
2. Ketua Program Studi Bioteknologi,
- .
Penulis dilahirkan di Sumbawa pada tanggal 03 Juli 1975, sebagai anak kedua dari tiga bersaudara, anak dari pasangan Mustafa dan Musta'rah.
Penulis lulus dari SMA Negeri Ampenan, Mataram pada tahun1994 dan pada tahun yang sama penulis diterima di Jurusan llmu Produksi Temak Fakultas Petemakan, Universitas Mataram. Selama studi S1, penulis pemah menjadi Asisten
Dosen beberapa mata kuliah dan pernah menjabat sebagai ketua Badan
Perwakilan Mahasiswa (BPM) Fakultas Petemakan UNRAM.
Pada tahun 1999, penulis melanjutkan pendidikan Magister pada Program Studi Bioteknologi, lnstitut Pertanian Bogor. Beberapa kegiatan yang menunjang kemampuan akademis dan penelitian penulis adalah Magang Penelitian di Laboratorium Mikrobiologi dan Bioteknologi PPLH-IPB dan Lab. Bakteriologi
Anaerob Balai Penelitian Veterinet selama 6 bulan dan pemah menjadi Asisten
Dosen pada mata kuliah Biologi Molekuler Keragaman Prokariot, PPs Biologi (Mikrobiologi) IPB.
PRAKATA
Segala puji bagi Allah, Rabb pencipta alam semesta beserta apa yang ada
didalamnya, yang diperuntukkan bagi kesejahteraan manusia. Biodiversitas,
keteraturan dan kesetimbangan ciptaan-Nya merupakan bagian dari keagungan- Nya yang tiada tara. Manusia diperintahkan untuk mempelajari dan mengelolanya untuk diambil kemanfaatan yang sebesar-besamya.
Penelitian dengan topik "Keragaman Genetik Sejumlah lsolat Clostridium bifermentans Berdasarkan Amplified Ribosomal DNA Restriction Analysis dan Toksisitasnya terhadap Larva Nyamuk" merupakan tugas akhir, sebagai salah satu prasarat untuk mendapatkan gelar Magister pada Program Studi Bioteknologi, lnstitut Pertanian Bogor dan upaya untuk mempelajari sebagian kecil dari keanekragaman mikroorganisme dari aspek molekuler, fisiologi, morfologi dan biokimiawi serta kemungkinan pemanfaatannya untuk kontrol biologi.
Terima kasih saya ucapkan yang setinggi-tingginya kepada Dr. Ir. Antonius Suwanto, M.Sc, Dr. Anja Meryandini, M.S., dan Drh. Lily Natalia, M.S selaku
pembimbing, yang telah meluangkan waktu, tenaga, biaya dan pikiran selama
penelitian ini berlangsung.
Pada kesempatan ini saya juga ingin menyampaikan terima kasih yang tiada terhingga kepada kedua orang tua "Ayah dan Bunda" yang telah dengan tulus dan dengan tiada putus-putusnya mendoakan, membimbing, dan memberikan motivasi sehingga apa yang kami cita-citakan bisa terwujud. Dan buat istri-ku terkasih,
kupersembahkan tulisan ini sebagai kado pernikahan kita.
Juga rasa terima kasih saya sampaikan kepada pak Syafaruddin, dik Yulia Enggel, mbak Heni, pak Oman, mas Yogi, mas Irawan, mbak Esti, mbak Rina, Anit, dan rekan-rekan yang lain yang telah banyak membantu penulis.
Kepada pengelola Research Center for Microbial Diversity (RCMD) yang telah mensponsori penelitian ini, saya sampaikan ucapkan terima kasih. Akhirnya semoga tulisan ini dapat memberi manfaat yang sebesar-besamya bagi kepentingan pendidikan dan industri bioteknologi.
DAFTAR
IS1
HALAMAN JUDUL
...
HALAMAN PENGESAHAN ... DAFTAR IS1...
...
DAFTAR TABELDAFTAR GAMBAR ...
...
DAFTAR LAMPI RAN...
PRAKATAPENDAHULUAN
...
TIN JAUAN PUSTAKAMikroorganisme Penghasil Biopestisida ... Karakteristik Clostridum bifennentans ... Nilai Bioekonomis C
.
bifementans ... ldentiiikasi dengan Fluorescein Antibody Technique...
Analisis Keragaman ~ e n e t i k dengan ARDRA...
Biologi Aedes aegypti dan Culex spp...
lnteraksi antara Toksin dengan Target Hama...
MATERI DAN METODEWaktu dan Tempat Penelitian
...
...
Bahan dan Alat... Metode Penelitian
HASlL DAN PEMBAHASAN
ldentifikasi C
.
bifennentans...
ldentifikasi berdasarkan Fluorescein Antibody Technique...
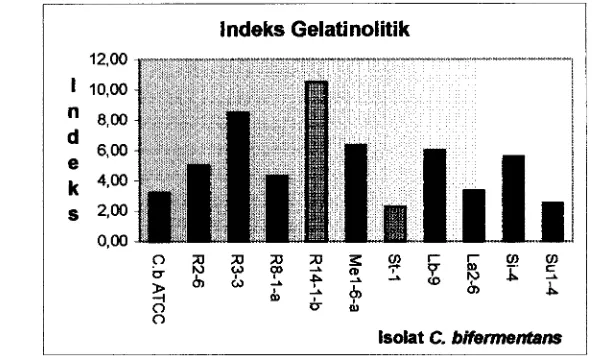
lndeks Gelatinolitik...
Analisis Keragaman Genetik...
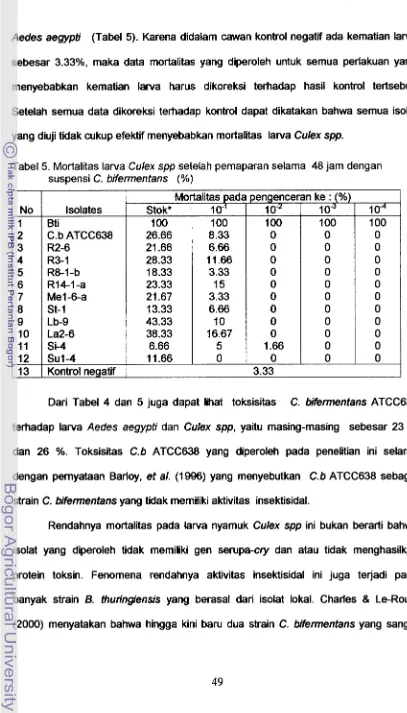
Toksisitas lsolat C . bifennentans...
KESIMPULAN ... DAFTAR PUSTAKA...
DAFTAR TABEL
1
.
Morfologi dan Penampakan Koloni BeberapaS pesies Clostridium
...
9 2.
Jadwal imunisasi...
24 3.
Hasil uji biokimiawi isolat-isolat yang diduga C.
bifermentans...
36 4.
lsolat yang teridentifikasi sebagai C.
bifermentansberdasarkan uji FAT
...
39 5.
Mortalitas larva Aedes aegypti setelah pemaparan selama48 jam dengan suspensi spora C
.
bifementans (%)...
486
.
Mortalitas larva Culex spp setelah pemaparan selama48 jam dengan suspensi C
.
bifermentans (%)...
49DAFTAR GAMBAR
1
.
Uji proteolitik isolat R14-1 b dan R3-1 pada mediumSkim Milk Agar selama 48 jam
...
37
2.
lndeks aktivitas gelatinolitik isolat C.
bifementans pada 48 jam...
41 3.
Hasil amplifikasi gen 16s rDNA...
424
.
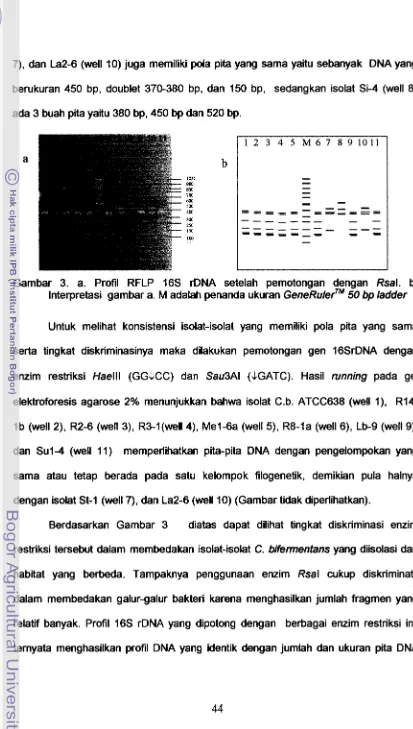
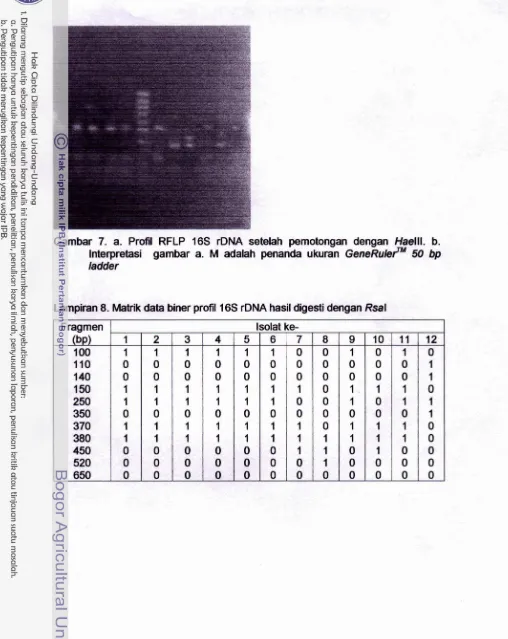
Profil RFLP 16s rDNA setelah pemotongan dengan Rsal...
44PENDAHULUAN
Latar Belakang
Serangga merupakan salah satu kelompok organisme yang keberadaannya
paling banyak dipermukaan bumi, dan sebaiian dari mereka memberikan pengaruh
merugikan bagi kehidupan manusia. Diperkirakan bahwa lebih dari 15 % tanaman
diseluruh dunia rusak akibat serangan hama serangga (Ceron, et a/., 1994) dan 30
% dari biaya produksi tanaman perkebunan dialokasikan untuk pembelian pestisida
(Krattinger, 1997). Nyamuk dan lalat tedibat dalam masalah-masalah kesehatan
manusia di sebagian besar belahan bumi. Sebagai vektor dari sejumlah penyakit
seperti malaria, encephalitis, demam berdarah, filariasis dan yellow fever (Becker dan Margalit, 1993; Charles and LeRoux, 2000), setiap tahunnya terjadi insiden
malaria sebanyak 200-300 juta kasus yang menyebabkan kematian lebih dari 1 juta
anak di Afrika (Lacey and Undeen, 1989).
Sejak tahun 1940-an, sejumlah insektisida kimiawi telah dikembangkan
dengan maksud untuk mengendalikan populasi insekta berbahaya (Glick dan
Pastemak, 1994). Meskipun dalam beberapa ha1 efektif, penggunaan insektisida
kimiawi sering menimbulkan pengaruh yang tidak diinginkan, seperti timbulnya
resistensi hama dan seringkali tidak selektii atau kehilangan spesifitasnya sehingga
menyebabkan kerusakan ekologi (Margalit, 1993) yaitu berupa akumulasi residu
yang berbahaya bagi makhluk hidup, pencemaran lingkungan, matinya musuh alami
hama yang bersangkutan dan musnahnya organisme bukan sasaran (Drobniewski,
1 994).
Oleh karena itu penting mendapatkan agen biologi yang memiliki
diproduksi secara alami oleh mikroorganisme atau tanaman menjadi pilihan terbaik,
selain karena spesifitasnya yang tinggi terhadap serangga target, juga bersifat dapat
diuraikan secara biologis (biodegradable), dapat diproduksi dalarn skala industri,
ramah lingkungan, dan resistensinya terhadap serangga target lambat (Margalit,
1990; Glick dan Pasternak, 1994).
Suatu insektisida mikrobial dapat diperoleh dari mikroorganisme yang
memproduksi substansi toksik yang dapat mematikan spesies serangga atau
memiliki kapabilitas infeksi fatalitik terhadap serangga target spesifik (Glick dan
Pasternak, 1994). Penemuan protoksin mosquitosidal dari 5acillus thuringiensis var
isfaelensis pada tahun 1976 membuka era baru dalam kontrol biologi (Becker dan
Margalit, 1993), walaupun sebenamya penggunaan 5. thuringiensis (selanjutnya
disingkat 0.t.) sebagai insektisida mikroba telah dikembangkan sejak tahun 1929
oleh Methalnikov dan Chlorine untuk mengendalikan hama ngengat Gypsi (Dubois
dan Lewis, 1981), selanjutnya 5.t. menjadi salah satu mikrwrganisme yang paling
luas dipelajari dan digunakan untuk mengendalikan hama insekta.
Bacillus thuringiensis dicirikan oleh produksi kristal paraspora yang
terbentuk selarna rnasa sporulasi (Schnepf, et a1.,1998), tersusun atas molekul-
molekul protein yang diketahui sebagai Gendotoksin atau kristal protein insektisida
(k.p.i), disandi oleh gen cry, bersifat toksik terhadap bermacam larva insekta seperti
Lepidoptera, Diptera dan Coleoptera (Ceron, et a/. , 1994), nematoda (Barloy, et al. ,
1997). Didalam ulasannya Schnepf , et al., (1998) rnenyebutkan bahwa beberapa
jenis k.p.i. juga toksik terhadap Hymenoptera, Homoptera, Orthoptera dan
Mallophaga.
K.p.i. dari 5.t telah digunakan sebagai biopestisida selama lebih dari 30
pertanian (Ceron, et a/., 1994), bahkan beberapa gen penyandi k.p.i. telah
diintroduksi kedalam genom tanaman dengan laju proteksi yang tinggi melawan
serangan beberapa hama serangga (Ballester, et a/., 1999; Ceron, et a/., 1994).
Walaupun aplikasi bioinsektisida 6.t telah digunakan begitu luas dan
menunjukkan sifat persistensi yang rendah di lingkungan, namun sejumlah laporan
menyebutkan terjadinya resistensi pada beberapa hama insekta dengan variasi
resistensi diantara subspecies yang berbeda dan dengan lokasi geografi yang
berbeda (Tabashnik, et a/., 1993; Iqbal, et a/., 1997; Schnepf, et a1.,1998;
Tabashnik, et a/., 2000). Resistensi pertama kali dilaporkan terjadi pada Plutella
xylostella, yang resisten terhadap B.t subsp. kurstaki tetapi tidak resisten terhadap
toksin dari 5.t. subsp. aizawai (Tabashnik, et al., 1993).
Salah satu usaha untuk mengatasi masalah tersebut diatas adalah dengan
meningkatkan keanekaragaman produk gen cry sebagai bahan akti insektisida
(Barloy, et a/., 1997) terutama yang mengarah kepada usaha untuk mengisolasi
mikroorganisme barn yang secara potensial menunjukkan aktivitas pengendalian
hama (control biology).
Clostridium bifermentans subsp. malaysia yang ditemukan pada penghujung
tahun 1989, merupakan bakteri anaerobik pertama yang diketahui bersifat
entomopatogenik dan juga bakteri non-B.t yang memiliki gen cry dalam genomnya.
Strain ini memiliki aktivitas yang tinggi melawan larva nyamuk dan lalat ( b l a c ~ y ) .
Protoksin yang dihasilkan C.b. subsp. malaysia disandi oleh dua buah gen, yaitu
cbm71 dan cbm72, yang disebut sebagai gen serupa-cry (cry like-genes) oleh
karena sekuen polipeptida-nya yang sangat mirip dengan Gendotoksin dari B.t.,
yang kemudian dinamakan cryl6A dan cryl7A (Seleena, et a/., 1997; Barloy, et al.,
isyarat bahwa mungkin terdapat lebih banyak lagi gen serupa-cry yarg terdistribusi
secara lebih luas pada berbagai spesies bakteri.
Pendekatan paling mutakhir yang dilakukan untuk memilih galur-galur bakteri
pembawa gen cry yang secara potensial unggul sebagai biopestisida adalah
analisis molekuler keragaman genetik. Pendekatan ini penting selain untuk
menyeleksi strain-strain unggul secara genetis juga untuk pengklasmkasiannya. Kuo
dan Chak, (1996) menggunakan teknik Restriction Fragment Length Polymorphisms-
PCR untuk mengidentifikasi galur-galur 8. thuringiensis yang mengandung gen cry
novel. Beberapa metode molekuler yang telah diterapkan khususnya terhadap B.
thuringiensis adalah analisis pola plasmid (Leredus, et al., 1982), penetapan sekuen
DNA oleh Kronstad dan Whiteley pada tahun 1986, dan analisis PCR (Carozzi, et a/,
1991). Pada penelitian ini, analisis keragaman genetik C. bikmentans dilakukan
dengan teknik Amplifed Ribosomal DNA Restriction Analysis (ARDRA). Selain
karena sifatnya yang reproducible, juga relati cepat, murah dan sederhana.
Tujuan Penelitian
Penelitian ini dilaksanakan dengan tujuan untuk mengidentikasi Clostridum
bifementans yang diisolasi dari berbagai habiat, mengetahui keragaman genetik
sejumlah isolat Clostridium Mermentans berdasarkan Amplfled Ribosomal DNA
Restriction Analysis dan toksisitasnya terhadap larva nyamuk Aedes aegypti dan
TINJAUAN PUSTAKA
Mikroorganisme Penghasil Bioinsektisida
lnsektisida mikrobial dapat diperoleh dari mikroorganisme yang memiliki daya
infeksi yang mematikan terhadap serangga target (Glick dan Pasternak, 1994).
Menurut Lacey dan Unden (1986), ada lima kelompok mikroorganisme yang dapat
digunakan sebagai bahan aktif insektisida mikroba, yaitu bakteri, virus, protozoa,
kapang, dan nematoda.
Pada awalnya bahan aktii insektisida yang diketahui dapat menyebabkan
penyakit dan kematian pada serangga adalah B. thuringiensis yang pertama kali
diisolasi oleh lshiwata pada tahun 1901 dari larva Bombyx mon yang sakit. Pada
tahun 1911, Berfiner menemukan bakteri serupa dari larva ngengat Mediterania,
Anagasta kuehnilla, di propinsi Thuringia Jerman, yang kemudian dinamai B.
thuringiensis (Dulmage, 1981). Pada tahun1927, Mattes mengisolasi kembali
Bacillus dari A. kuehnilla dan dua tahun kemudian, 1929, oleh Mathalnikov dan
Cholorine dinamakan 5. thuringiensis dan mereka menjadi pelopor bagi penggunaan
B.t. sebagai insektisida mikrobial yaitu untuk membasmi hama ngenget Gypsi
(Dubois dan Lewis, 1981). Selanjutnya diketahui bahwa penyebabkan patogenisitas
bakteri adalah protein kristal yang dihasilkan pada saat pembentukan spora atau
selama fase stasioner.
Karakteristik B.t. yang sangat spesifik terhadap serangga target mendorong
para peneliti untuk mencari galur-galur baru seiring dengan upaya untuk
mengklasifikasikannya. Beberapa metode yang digunakan untuk klasifikasi B.t.
adalah sebagai berikut :1) berdasarkan sifat morfologi dan biokimianya oleh Angus
tahun 1959, 3) spesifitas antigen flagelum oleh de Barjac dan Bonnefoi tahun 1962,
4) kerentanan terhadap antibiotik oleh Landen, Hesson dan Boman tahun 1981, 5)
pola plasmid oleh Lereclus dkk. tahun 1982, 6) penetapan sekuen DNA gen kristal
protein oleh Kroustad dan Whiteley tahun 1986, 7) aktiiitas insektisida oleh Krieg
dkk. tahun 1987, 8) analisis nukleotida oleh Hofte dan Whiteley tahun 1989
(disarikan dari Meryandini,l990 dan Darwis, 1995); dan analisis PCR oleh Coroui
dkk. pada tahun 1991. Hingga tahun 1994, dikenal lebih dari 30 subspesies B.t yang
terbagi kedalam 34 sub kelompok antigen-H (Udayasurian, et a/, 1994). Dan pada
tahun 1998 terdapat tidak kurang dari 100 gen cry yang berasal dari berbagai
spesies bakteri, kemudian Crickmore, et al., (1998) melakukan revisi nomenklatur
gen cry tersebut atas dasar homologi sekuen DNA dan membagi gen cry kedalam
22 kelas dan 2 gen cyt, dimana cbm71 (cryl6A) dan cbm72(cry17A) berubah
menjadi cryl6Aa dan cryl7Aa. lnformasi terkini yang saya peroleh bahwa sudah
terdapat 30 kelas gen cry.
Penggunaan B.t untuk kontrol spesies diptera baru dilakukan pada tahun
1977 sejak ditemukannya B. thuringiensis serovar israeknsis (Btr) dan spesies yang
sangat toksik B. sphaericus (Bsp) strain 1593 (Charles and LeRoux, 2000).
Berdasarkan pertimbangan ekologi dan perkembangan resistensi, program
skrining mikroorganisme baru yang potensial untuk pengendalian hama terus
dilakukan. Hingga tahun 1990 tak satupun catatan yang menunjukkan adanya
spesies bakteri diluar B.t. yang memiliki gen penyandi bioinsektisida (gen cry) dalam
genomnya. Pada tahun 1990, Seleena dan Lee berhasil mengisolasi bakteri
anaerobik obligat dari sampel tanah hutan mangrove Malaysia yang aktif melawan
larva nyamuk dan lalat, kemudian diketahui sebagai Clostridium bifennentans
demikian C. bifermentans subsp. malaysia bukan hanya bakteri anaerobik obligat
pertama yang diketahui bersifat entomopatogenik, tetapi juga InefUpakan spesies
non B.t. pertama yang memiliki gen cry dalam genomnya (Barloy, et al., 1998.
Dalam waktu yang relatii singkat sejumlah bakteri entomopatogenik yang
membawa gen serupa-cry berhasil diidentifikasi seperti B. popilliae yang aktif
melawan Coleoptera (Zhang, et a/., 1997). C.b. subsp. paraiba yang aktif melawan
nyamuk, beberapa spesies Clostridium yang patogen terhadap manusia dan hewan
seperti C. sonlellii dan C. septicum (Barloy, et a/., 1998), dan Brevibacillus
latemsponrs yang juga memiliki toksisitas tinggi terhadap nyamuk Ae. aegypti dan A.
stephensi (Charles and Le-Roux, 2000).
Selain bakteri, beberapa cendawan dari kelas Deuteromycetes yang
berpotensi sebagai agen pengendali populasi vector (entomopatogen) adalah
Beauveria, Culicinomyces, Metarhizium (Munif dan Mardiana, 1991). Cendawan
patogen umumnya melakukan penetrasi dengan menggunakan haustorium, yaitu
hifa infeksi yang berfungsi sebagai struktur penyerap nutrisi dan hidup dalam
jaringan inang.
Karakteristik C. bifermentans
Clostridium mempunyai banyak spesies yang berbeda. Beberapa spesies
seperti C. camis, C. histolitycum, dan C. tertium bersifat aerotoleran dan lainnya
anaerobik obligat (Smith,1975). Dalam Bergey's Manual of Determinative
Bacteriology dinyatakan bahwa diantara spesies Clostridium, mungkin bersifat
sakarolitik, proteolitik, tidak tergolong kedalam keduanya atau bahkan bersifat
negati. Kebanyakan spesies ini adalah kemoorganotropik, beberapa kemoautotropik
atau kemolitotropik; dan potensial memproduksi eksotoksin.
Organisme ini biasanya ditemukan pada saluran pencemaan temak dan
manusia (Wang et a/., 1996), lapisan tanah dan sedimen laut (Smith, 1975), sedimen
danau, sungai dan rawa; spesimen klinik (Smith, 1975; Cowen and Steele, 1974),
serta habitat-habitat yang bersifat anaerob.
C. bifermentans adalah satu diantara spesies Clostridium yang telah
diketahui mengandung gen serupa-cry dalam genomnya (Barloy et a/., 1998).
Spesies ini memiliki aktivitas yang tinggi melawan berbagai serangga hama.
Contohnya adalah C. bifermentans subsp. malaysia dan
C.
b subsp. paraiba yangaktif melawan larva nyamuk dan lalat (blackfly).
Pada mulanya C. bifermentans dianggap sebagai subspesies dari C. sordellii
karena adanya kemiripan sifat biokimiawi antara keduanya. Bahkan sejak ditemukan
oleh Tissier dan Martelty pada tahun 1902 telah menjadi subjek yang kontroversial
diantara para pakar bakteriologi mengenai hubungan taksonominya (Nishida et a/.,
1964). Pembedaan kedua spesies ini didasarkan atas kemampuan produksi urease
oleh C. sordellii (Nishida et a/., 1964; Shapton and Board, 1971), toksigenisitas, dan
potensi sporulasi (Nishida et a/., 1964 ), dan kemampuan untuk mengaglutinasi
(Huang, et a/., 1965).
Organisme ini bisa dibedakan dari spesies lainnya berdasarkan morfologi
dan penampakan koloni (morphology and colonial appearance); bentuk, posisi, dan
produksi spora; serta karakteristik biokimiawi dan fisiologinya (Smith, 1975).
Penampakan koloni, bentuk sel dan posisi spora beberapa spesies Clostridum
Tabel 1. Morfologi dan penampakan koloni beberapa spesies Clostridum
species Spores Bacilli
C. botulinus OCIS Normal
C. perfringens OC Large thick
C. tetani RT Normal
C. novyi
0s
LargeC. septicum
0s
NormalC. fallax
0s
ThickC. sordellii OC I S Large thick C. bifermentans OC I S Large thick
C. histolyticum
0s
NormalC. sporogenes
0s
ThinC. tedium OT Long thin
C. cochleariom Thin
C. butyncum OC Normal
C. nigrificans Normal
C. themosacamlyticum Normal
Haemo Colony appearance on blood
lysis agar
+ Large,fimbriate, transparent
+ Flat, circular, regular
+
Small , grey, fimbriate,translucent
+ Flat, spreading, transparent
+ Irreguler, transparent
- Large, irregular, opaque
+
Small, crenated+ Small, circular, transprant
-
Small, regular, transprant+
Medusa head,fimbriate, opaque-
Small, regular, transprant- Circular, transprant
- White, circular, irregular Black
Granular, feather edges Spores : 0, oval; R, round; S, subterminal; C, central; T, terminal
Lebih lanjut dikatakan oleh Smith, (1975) bahwa spora C. bifermentans
berbentuk oval, terletak pada posisi subterminal atau sentral dan diproduksi secara
berlimpah serta seringkali berantai. Penampakan koloni C. bifermentans pada media
agar darah adalah kecil, regular dan transparan (Willis and Hobbs, 1959). Akan
tetapi Smith (1 975) menyebutkan bahwa diameter koloni C. bifennentans berkisar
antara 2
-
3 mm, tidak terlalu konvek, dan agak tidak teratur. Wama kolonitergantung pada umur dan tahap sporulasi. Koloni yang masih muda terdiri dari set
sel nonspora atau sel vegetatif, bersifat translusen dan bennrama buram, sedangkan
koloni yang lebih tua berbentuk opaque dan berwama seperti porselin putih, terdiri
dari sel yang mengandung spora.
Beberapa karakter biokimiawi dari spesies ini adalah dapat memfermentasi
fruktosa, glukosa, maltosa, mannosa, ribosa, dan sorbitol; tidak dapat
dulcitol, eritritol, inulin, xilosa, ramnosa, melibisa, rafinosa, salisin, sorbosa,
melezitosa, sukrosa dan trehalosa (Seleena, et al., 1997).
Gelatin dihidrolisis, eskulin dan pati tidak dapat dihidrolisis, produksi indol,
dan tidak dapat mereduksi nitrat (Seleena, et a/., 1997), kasein dan daging didigesti;
lesitinase diproduksi; katalase, urease dan lipase tidak diproduksi (Smith, 1975).
Sedangkan produk akhir fermentasi meliputi asetat, isobutirat, isovalerat, asam
isokaproat, dengan atau tanpa sejumlah kecil asam butirat dan ethyl, propil, dan
isobutyl alcohol (Levett, 1991 ; Buchanan and Gibbons, 1974).
Spora C. bifermentans akan mengalami germinasi bila terdapat L-alanin dan
ion sodium. L-alanin disubstitusikan dengan kombinasi fenilalanin, arginin, laktat,
serin, dan glisin. Seperti halnya bakteri pembentuk spora lainnya, gerrninasi spora
dapat distimulasi melalui aktivasi dengan pemanasan mendadak (heat shock) pada
85 OC selama 10 menit (Smith, 1975). Faktor pertumbuhan yang dibutuhkan oleh
organisme ini adalah biotin, asam nicotinat atau amida, asam pantotenat, dan
piridoksal atau piridoksamin.
Nilai Bioekonomis C. bifermentans
Umum diketahui bahwa genus Clostnidum merupakan kelompok bakteri
paling penting sebagai agen penyebab penyakit pada manusia dan hewan. Sebagai
contoh adalah C. botulinum yang menghasilkan neurotoksin yang dapat
menyebabkan kerusakan syaraf irreversible atau kematian, C. perffingens
menimbulkan penyaki gas gangrene dan enterotoksemia baik pada manusia
maupun ternak, dan C. chauvoei yang mengakibatkan kerugian ekonomi yang
cukup besar bagi peternak karena penyaki blackleg yang menimpa ternak besar
Dalam industri bioteknologi, pemanfaatan Clostridium sebagai pabrik biologis
sangatlah luas. Bahkan Barloy, et a/., (1996) mengutif Moms, (1993) mengatakan
bahwa lebih 90 % pekerjaan-pekerjaan yang melibatkan genus Clostridium ditujukan
untuk bioindustri dan aspek-aspek medis. Sejumlah produk penting seperti asam
butirat, aseton dan butanol dapat diproduksi oleh C. bifennentans, C.
asetobutylicum, C. butyricum dan C. pasteurianum. C. kluyveri memproduksi etanol
dan asetat. Spesies yang lainnya seperti C. aceticum dan C. thennoaceticum dapat
membentuk asetat dari C02 dan H20.
C. bifermentans yang tergolong kedalam non patogenik Clostridia diketahui
mampu melakukan biotransformasi atau bioremediasi senyawa nitroaromatik seperti
2,4,6trinitrotoluena (TNT) dan turunannya melalui mekanisme hidroliik (Lewis, et
a/., 1996). Lebih lanjut Sembries dan Crawford, (1997) menyatakan bahwa spora
isolat C. bifennentans KMR-1 dapat digunakan sebagai inokulan untuk bioremediasi
tanah dan air yang terkontaminasi TNT dan 1,3,5-triaza-1,3,5trinitrosikloheksana
(RDX).
Penggunaan C. Mermentans makin luas sejak ditemukannya suatu strain
baru, C.6. subsp malaysia, yang dapat berperan sebagai kontrol biologi untuk
insekta. Strain ini adalah strain bakteri anaerobik pertama yang diidentiikasi memiliki
toksisitas terhadap larva nyamuk, dimana aktivitas larvasidalnya sangat tinggi
terhadap spesies Anopheles dibandingkan terhadap Aedes aegypti maupun Culex
pipiens (Barloy et a/., 1996). Berbeda halnya dengan C.b. subsp malaysia, C.b.
subsp paraiba, justru lebih toksik terhadap Culex quinquesfaciatus daripada
ldentifikasi dengan Antibodi Fluoresen
Teknik imunologi memegang peranan penting dalam bakteriologi modern.
Penerapan teknik imunologi terutama dalam mikrobiologi medik, meliputi diagnosa
penyakit, epidemiological typing, dan investgasi dasar mekanisme patogenik.
Eksploitasi metode-metode imunologi diarahkan untuk deteksi, identiikasi dan
quantiikasi bakteri, komponen bakteri ataupun produknya (Poxton, 1991).
ldentikasi Clostridia dengan teknik imunologi telah menunjukkan
keberhasilan, mulai dari penggunaan reaksi Nagler untuk identikasi spesifik C. perfringens pada Egg Yolk agar (EYA) sampai identifikasi definitive C. tetani dan C.
botulinum melalui test netralisasi toksin pada tikus, disamping itu metode antibodi
imunofluoresen telah dikembangkan untuk Clostridia tertentu.
Metode antibodi imunofluoresen merupakan metode yang sederhana dan
cepat untuk mengidentiikasi bakteri sampai pada tingkat spesies. Metode ini
didasarkan atas adanya fluoresensi bakteri target sebagai akibat dari terbentuknya
konjugat antara antibodi terlabel dengan komponen permukaan bakteri, seperti
flagella, fili, lipopolisakarida, kapsul, dan protein membran luar. Fluoresensi ini
dapat diamati melalui mikroskop fluoresen.
Beberapa antigen yang dapat digunakan untuk tujuan identifikasi meliputi
komponen permukaan sel seperti asam teichoic (secondary wall carbohydrate),
asam lipoteichoic (membrane carbohydrate), protein membran, kapsul dan
eksopolisakarida lain, peptidoglikan, flagella, dan produk ekstraseluler (exotoxins
dan exoenzyme) (Poxton, 1991 )
Teknik antibodi fluoresen meliputi beberapa tahapan pekerjaan yaitu
antibodi; dan identikasi bakteri (Poxton, 1991). Pada teknik ini, antigen yang
digunakan adalah sel-sel bakteri yang telah dimatikan dengan pemanasan pada air
mendidih (heat kilo.
Metode konvensional untuk produksi antibodi adalah dengan cara
menginjeksikan antigen kedalam tubuh hewan percobaan yang imuno kompeten
dalam laboratorium untuk membangkitkan tanggapan kekebalan (Johnstone and
Thorpe, 1982). Setelah pengambilan darah, serum seharusnya sesegera mungkin
dipisahkan dari sel, sebab bila sel lisis akan melepaskan kontaminan protein
termasuk enzim proteolitik yang dapat mendegradasi antibodi.
Antibodi termasuk kedalam kelompok protein yang disebut sebagai
immunoglobulin. Mereka memiliki s t ~ k t ~ r yang umum dengan dua buah rantai yaitu
dua buah rantai berat (heavy chain) dan rantai ringan (light chain). lsolasi
imunoglobulin G yang biasa dilakukan adalah kombinasi antara presipitasi dengan
penambahan sodium atau ammonium sulfat dan dilanjutkan dengan kromatografi
kolom (Johnstone and Thorpe, 1982). Untuk membuat antibodi fluoresen (FAT)
maka imunoglobulin yang telah murni dikonjugasikan dengan fluorokrom.
Fluorokrom yang umum digunakan adalah fluorescein atau tetrametilrodamin
isothiosianat, selain karena mereka dapat bereaksi secara langsung dengan
imunoglobulin, menghasilkan konjugat yang stabil dan juga memberikan sinar
fluoresensi yang jelas.
Analisis Keragaman Genetik dengan ARDRA
Metode-metode molekuler untuk identikasi dan pencirian mikroba dapat
dilakukan berdasarkan pendekatan asam nukleat maupun protein. Analisis profit
endonuklease (REA), restriction fragment length polymorpClisms (RFLP),
macrorestn'cfion fragment length polymorphisms (MFLP) yang melibatkan pulsed
field gel electrophoresis (PFGE), dan amplifikasi asam nukleat (Suwanto, 2000).
Pemilihan metode analisis sangat tergantung dari cakupan tujuan dan derajat
diskriminasi yang diinginkan, sebab menurut Suwanto, (2000) tak satupun dari
teknik tersebut menampilkan hasil yang keliru, masing-masing menyediakan cara
yang berbeda dalam memandang persoalan yang sama.
Pengetahuan mengenai keragaman genetik mikroba pada tahun-tahun
belakangan ini meningkat secara drastis, terutama setelah diperkenalkan teknik
amplifikasi PCR gen rRNA
-
RFLP atau amplified ribosomal DNA resWfionanalysis. Karakterisasi bakteri yang didasarkan pada amplifikasi gen 16s rRNA
(small subunit rRNA) dengan teknik PCR telah digunakan secara luas untuk studi
mengenai evolusi, taksonomi dan ekologi (Nubel, et a/., 1996). lnformasi sekuen
16s ribosomal DNA (rDNA) dapat digunakan untuk menganalisis filogenetik bakteri
yang belum bisa dikulturkan dari beragam lingkungan (Tanner, et a/., 1998)
Nusslein dan Tiedje, (1998) memanfaatkan metode ARDRA untuk menduga
keragaman dan mengkarakterisasi komunitas bakteri tanah Kepulauan Hawai
berdasarkan komposisi basa G + C.
Teknik ampNed ribosomal DNA mstn'ction analysis (ARDRA) pada
dasarnya merupakan turunan dari PCR-RFLP, yaitu amplifikasi sekuen dari gen
16s-rDNA (gen penyandi 16s RNA ribosom) dengan menggunakan primer universal
untuk bakteri atau prokariot. Hasil amplifikasi PCR ini kemudian dipotong dengan
enzim endonuklease restriksi yang memotong sering. Menurut Suwanto, (1995)
sebagai hasil pemotongan dengan enzim restriksi tertentu menunjukkan keragaman
genetik.
Enzim endonuklease restriksi merupakan enzim yang memotong DNA pada
situs pengenalan 4 atau 6 pasang basa yang spesifik yang bersifat poliandrom. Oleh
karena sekuen pengenalan dari endonuklease restriksi adalah terletak secara acak
dalam molekul 16s rDNA dan sekuen 16s rDNA berbeda-beda, maka pola yang
dihasilkan dari pemotongan akan bersifat unik.
Dasar penggunaan gen penyandi ribosomal RNA sebagai indikator universal
dalam analisis keragaman genetik adalah karena molekul rRNA sangat khas,
tersusun oleh daerah-daerah yang terkonservasi yang berubah relati lambat secara
evolusi dan daerah-daerah yang sekuennya cukup bervariasi. Perbandingan sekuen
yang terkonservasi ini sangat berguna untuk konstruksi pohon filogenetik universal,
sebaliknya sekuen pada 16s rRNA yang hipervariabel banyak digunakan untuk
melacak keragaman dan menempatkan galur-galur dalam satu spesies. Sifat rRNA
yang sangat terkonservasi memungkinkan untuk mensintesis primer universal untuk
proses PCR yang mampu melekat pada sekuen terlestari dari ketiga domain
filogenetik Archaea, Bakteria dan Eukarya (Amann, et a/., 1994).
Pada laboratorium Biologi Molekuler SEAMEO-BIOTROP, teknik ARDRA
secara rutin digunakan untuk menyeleksi strain-strain yang unik diantara sejumlah
isolat yang belum disekuensing dan juga untuk menganalisis hubungan kekerabatan
diantara komunitas mikroba yang diisolasi langsung dari lingkungan.
Biologi Aedes aegypti dan Culex spp
Culex dan Aedes dua dari lebih dari 30 genera pada sub famili Culicinae
sangat luas dan berfimpah, serta termasuk group yang sangat penting mengingat
aksinya yang dapat merusak kesejahteraan dan kesehatan manusia. Tahapan
larvanya ada di dalam air dan yang dewasa dapat dikenali dari tulang daun sayap,
sisik-sisik sepangjang pembuluh darah sayap dan proboskosnya yang panjang
(Borror et a/., 1992).
Spesies Aedes memiliki aktiiitas yang aneh mereka dapat beraksi harian
atau tidak tentu, berbeda halnya dengan pengigit malam Culex spp. Mereka
menyimpan telumya kedalam air yang kotor, lumpur atau tanah yang terkena banjir.
Kebanyakan spesies Aedes menjadi vektor dari berrnacam-macam penyakit. Aedes
aegypti, sinyamuk kuning penyebab demam berdarah, adalah salah satu yang sangat penting dan memiliki pengaruh yang sangat luas. Nyamuk ini merupakan
spesies yang berasal dari keturunan nyamuk dari negara Sylvatii, tepi ketika
bergabung dengan habitat manusia, nyamuk tersebut melahirkan keturunan secara
bebas didalam kontainer dan unit penyimpenan air lainnya (Robert dan Janovy,
1 996).
Siklus hidup nyamuk Aedes aegypti adalah sebagai berikut : Telur Aedes
berukurab panjang 1 mm dan berdiameter 0.25 mm. Ada dua rangsangan yang
mempercepat proses penetasan telur yaitu pencelupan telur kedalam air dan
rendahnya tekanan. Air mendidih, hampa udara atau adanya bakteri (berasosiasi
dengan makanan larva) sering digunakan untuk menstimulasi proses penetasan.
Larva nyamuk sangat tepat dalam air, jika habitatnya mengering maka larva akan
mati. Larva akan berturut-turut berganti bulu untuk mencapai tingkat pupa. Larva
kemudian berkembang dari sekitar 1,5 mm sampai 15 mm panjangnya setelah tiga
kali berganti bulu. Ukuran maksimum dapat berubah-ubah sekitar 10 mm sampai
tahapan larva dapat lebih pendek dari 4 hari. Dalam kondisi kelaparan atau
temperatur yang kurang optimum, larva bisa berumur satu bulan dalam keadaan
tidak akti. Makanan larva berupa sisa organik, bakteri, jamur dan segala sesuatu
yang dikumpukan dari dasar habitatnya di air (Munstermann, 1997).
Setelah empat kali berganti stadium, timbul bentuk pupa koma. Pada tahap
pupa dapat terjadi perubahan metabolisme dan struktural tambahan secara biasa.
Perubahan ini memungkinkan yang dewasa naik untuk bertahan hidup dalam
lingkungan global. Perototan, sayapsayap, sisik-sisik, bagian-bagian mulut dan
bagian dalan serta elemen struktural permukaan lainnya harus terbentuk sebelum
tahap ini selesai. Periode ini berlangsung 2-3 hari, lalu pupa mengapung diantara
air-udara dan yang dewasa naik ke permukaan air. Dipermulaan antara 24-48 jam
kehidupan si dewasa, perkembangan internal terus berlanjut untuk menyesuaikan
perubahan benuk ke kehidupan global.
Culex betina berbentuk bulat disekitar perutnya, sungut mereka lebih pendek dari pada hidungnya. Mereka tidak mempunyai spikular dada atau post spikular,
larva berbentuk panjang dan ramping. Kebanyakan inang Culex spp adalah burung
akan tetapi tidak mempunyai inang yang spesiftk.
Dalam catatan ilmiahnya, Seleena dan Lee (1997) melaporkan adanya
perbedaan toksisitas antara C.b. subsp. Malaysia dengan C.b. paraiba terhadap
larva C. quinquesfaciatus, Aedes aegypti dan Anopheles maculates. C.b. paraiba
cukup toksik terhadap Aedes aegypti, C. quinquesfaciatus dan An. Maculates, akan
tetapi C.b. subsp. Malaysia sangat toksik terhadap Aedes aegypti dan tidak toksik
lnteraksi antara Toksin dengan Serangga
Pada B. thuringensis telah diketahui dengan baik terdapatnya hubungan
yang sangat spesifik antara kristal protein yang dihasilkan dengan larva serangga
sasarannya yang rentan. Akan tetapi pada C. bifementans belum ada laporan yang
mengungkapkannya. Protoksin yang dihasilkan oleh C.6 dan 6endotoksin B.t.
diaktivasi oleh suasana alkali usus serangga.
Terdapat perbedaan antara faktor toksik B.t dengan C. bifermentans yaitu
C.6 tidak memproduksi protein kristal atau parasporal bodi sebagaimana halnya
pada B.t, B. sphaericus dan B. laterosporus. Toksisitas protein C.6 menurun dengan
cepat atau mengalami inaktivasi oleh perlakuan fisik atau kimiawi (Charles and
LeRoux, 2000) seperti filtrasi, sonikasi, freezing-thawing atau oleh protease yang
dilepaskan pada saat sel lisis (Barloy, et al., 1996).
Semua protein toksin yang termasuk kedalam famili Cry terdiri dari tiga
domain, yaitu domain I, II dan Ill. (Schnepf, et al., 1998; Aronson, 2000). Domain I
tersusun atas seberkas (bundle) a-heliks antiparalel yang berjumlah tujuh yang
kebanyakan terlibat dalam pembentukan saluran ion (Aronson, 2000). Domain II
memiliki tiga buah @sheet antiparalel yang bergabung membentuk suatu tipe "kunci
Yunani atau Greek key". Sedangkan domain Ill terdiri dari dua @sheet antiparalel
yang membentuk sebuah @sandwich dengan tipologi jelly roll (Schnepf, et a/.,
1 998).
Devidas, (1992) menyatakan bahwa kristal protein yang termakan oleh
serangga yang rentan akan terlawt menjadi protoksin oleh alkali usus tengah larva.
Proses pelarutan ini bervariasi diantara genus, spesies dan bahkan mungkin
alkali di usus akan melepaskan sub unit insektisidal. Kerja protease tersebut
menyebabkan protoksin kehilangan fragmen struktur ujung C dan membentuk
fragmen aktii yang disebut toksin. Toksin dapat dibagi tiga daerah struktural, yaitu 1)
area ujung N yang merupakan domain toksik, terdiri dari beberapa area hidrofobik
yang terlestari, dan mengandung a-heliks yang menyebabkan pembentukan pori
pada usus serangga, 2) area ujung C yang terlestari, dan 3) area variabel yang terletak diantara dua area tersebut.
Lebih lanjut Frankenhuyzen et a/., (1993) menyebutkan bahwa ada beberapa
faktor yang menentukan spesifitas inang yang meliputi berbagai faktor struktural dan
proses yang memungkinkan toksin berikatan dengan reseptor, kecepatan
pencemaan, pelarutan dan stabilitas toksin dalam usus. Dengan demikian protein
toksin atau 6-endotoksin yang berbeda akan mempunyai aktivitas insektisidal yang
berbeda pula.
Toksin pada umumnya mempunyai daya ikat dengan membran sel usus
serangga. Pada kondisi ini toksin akan berasosiasi dengan reseptor tertentu pada
epitelium usus. Setelah terikat pada epitelium usus serangga, toksin membentuk pori
berukuran kecil (0,51,0 nm) pada membran. Toksin yang aktii selanjutnya
mengaktiian aliran ion K dan air sehingga mengganggu keseimbangan osmose
pada akhimya epitelium usus membengkak, mikropilus hilang dan akhimya sel
mengalami lisis. Keadaan ini menyebabkan kematian sel dan selanjutnya kematian
serangga (Hofle and Whiteley, 1989; Aronson, 2000).
Pada B. thuringensis subsp. kurstaki (galur yang toksik terhadap lepidoptera)
diketahui bahwa protein toksik ini mempunyai afinitas terhadap N-
karena pengikatan tersebut. Setelah toksin terikat pada reseptor membran plasma,
akan terbentuk pori-pori kecil atau secara tak langsung mengganggu molekul-
molekul membran plasma. Toksin merusak transport ion dan glukosa sehingga
mendorong hilangnya ATP (Ellar et al., 1987). Gejala gangguan oleh toksin adalah
stimulasi pengambilan glukosa oleh sel epitelium saluran pencernaan, kemudian sel
epitelium mengalami lisis, otot saluran pencemaan dan bagian mulut lumpuh,
kemampuan makan berhenti dan kematian akan muncul 30 menit hingga 3 hari
setelah tosin terrnakan (Lynch dan Hobbi, 1988).
Reaksi yang spesifik antara protease dengan macam toksin dapat
menyebabkan spektrum hama yang sempit sehingga spesifitas insektisida ini sangat
tinggi. Spektrum hama yang sempit misalnya pada C.b. subsp. malaysia (toksin cbm
71) yang sangat toksik terhadap Blatella gennanica, akan tetapi C.b. subsp. paraiba
tidak menunjukkan produksi blatisidal (Seleena, Lee and Lecadet, 1997). Analisis
resistensi pada skala laboratorium maupun dilapangan menunjukkan telah terjadinya
resistensi pada sejumlah hama target terhadap satu atau lebih toksin B.t (Schnepf,
et al., 1998). Peningkatan keanekaragaman gen cry yang memiliki struktur toksin dan mekanisme kerja yang berbeda menjadi solusi yang baik untuk memecahkan
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Bakteriologi Anaerob Balai Penelitian
Veteriner Bogor, Laboratorium Mikrobiologi FMlPA IPB dan Laboratorium Biologi
Molekuler South East Regional Center for Tropical Biology (SEAMEO-BIOTROP),
Bogor. Penelitian ini berlangsung mulai bulan Februari-Oktober 2001.
Bahan dan Alat
Bakteri yang digunakan adalah 151 isolat Clostridium yang diperoleh dari
kegiatan penelitian sebelumnya. Selain itu disertakan pula C. bifermentans
ATCC638 koleksi dari Laboratorium Biologi Molekuler SEAMEO-BIOTROP dan 5.
thuringiensis var israelensis (Vectobac) koleksi Laboratorium Teknolog i Bioproses
PPB-IPB, sebagai kontrol. Keterangan mengenai asal dan jenis isolat dapat dilihat
pada Tabel Lampiran 2.
Bahan-bahan kimia yang digunakan dalam penelitian ini adalah akuades,
media pertumbuhan yaitu Robertson Cooked Meat Medium (RCMM), Tripthone
Yeast Extract Glucose (TYG), dan medium agar darah (5%), NaCl fisologis, NaOH,
reagen Kovac's, CuS04, merah fenol, proteinase-k, N-CetyCN,N,N-Trimethyl-
Ammonium Bromide (CTAB), Sodium Dodesyl Sulphate (SDS) lo%, fenol,
kloroform, isoamil alkohol, isopropanol, etanol (absolut dan 70%), agarosa, buffer
TrisEDTA (TE), enzim Tag DNA Polimerase, loading buffer, ethidium bromida,
enzim restriksi Rsal, Haelll dan Sau3Al (Fermentas) beserta bufemya, marker
molekuler 1-Kb DNA Ladder (Biolabs), ~ e n e ~ u l e r ~ ~ 50 bp DNA Ladder (Pharmacia-
Dua spesies larva nyamuk yang akan dipakai yaitu Aedes aegypti dan Culex
spp. Sumber larva diperoleh dari telur yang di koleksi Laboratorium Entomologi
Kesehatan FKH, IPB.
Alat-alat yang digunakan antara lain yaitu botol Bijou, perangkat anaerobik
jar (Bio-Rad, Richmond, CA), mesin PCR ( ~ e n e ~ m p @ PCR System 2400, Perkin-
Elmer, Branchburg, New Jersey), Gene Quant (Pharmacia-Biotech, Cambridge,
England), piranti elektroforesis (Bio-Rad, Richmond, CA), UV transilluminator
(UVB-36 ULTRALUM, Carson, California), Gel Doc 1000 (Bio-Rad, Richmond, CA),
mikroskop UV fluoresen, dan mikroskop fase kontras.
Metode Penelitian
A. ldentif i kasi C. bifermentans
Pewarnaan Spora. Koloni yang diwrigai sebagai C. bflermentans diuji
dengan pewamaan endospora menggunakan metode Schaeffer-Fulton. Spesimen
dikering udarakan diatas kaca objek, difiksasi panas, ditutup dengan kertas serap
yang telah dijenuhkan dengan zat wama hijau malakit 0.5% (wtv), dan ditaruh diatas
air mendidih selama 5 menit. Kaca objek tersebut diolesi dengan aquades, dan olesan diwamai dengan pewama tandingan yaitu safranin selama 30 detik, lalu
diwci dengan air, dikeringkan dan diimati dibawah mikroskop dengan perbesaran
1 oox.
Uji Katalase. Pada umumnya Clostridum sp. menunjukkan katalase negatif.
Uji katalase dapat dilakukan dengan pemberian tetes 3% H202 pada koloni bakteri.
Terbentuknya gas pada permukaan cawan menunjukkan terjadinya reaksi katalase.
Uji Blacking Media. Genus Clostridium dapat identikasi dari kemampuan
Medium (DRCM). lnokulum ditumbuhkan pada DRCM dan diinkubasi selama 2 hari
pada suhu 37°C.
Uji Fermentasi Gula. Uji fermentasi glukosa, laktosa, maltosa, fruktosa,
sukrosa dan salisin dilakukan dalam tabung ulir yang mengandung RCMM dengan
memasukkan keenam gula tersebut sebagai sumber karbohidratnya. lnkubasi
dilakukan dalam anaerobic jar pada suhu 37 OC selama 48. lndikator yang dgunakan
ialah merah fenol.
Uji Indol. Sebanyak 100 pl biakan dalam RCMM dimasukkan kedalam kaldu
tripton 1% dalam tabung ulir dan diinkubasi secara anaerob selama 48 jam pada
suhu 37 OC. Adanya indol dapat diketahui dengan menggunakan beberapa tetes
reagen Kovac's; uji positii ditunjukkan oleh terbentuknya lapisan berwama merah
diatas biakan.
Uji Hidrolisis Pati dan Gelatin. Hidrolisis pati dan gelatin dilakukan dengan
memasukkan soluble pati 1% atau gelatin 0.4% dalam Nutrien Agar. Terjadinya
hidrolisis pati ditandai dengan adanya zona bening disekiiar koloni setelah
penambahan Lugol's iodine. Hidrolisis gelatin ditandai dengan pemberian indikator
HgCl 15% (wlv) dalam 1 M HCI.
Uji Lesitinase dan Lipase. Uji keberadaan lesitinase dan lipase dilakukan
dengan mentotolkan isolat pada medium Egg Yolk Agar. Adanya lesitinase ditandai
dengan terbentuknya presipitat yang melewati lebar koloni. Adanya lipase ditandai
oleh adanya lapisan mengkilap pada permukaan koloni. Kepastian adanya lipase
dilakukan dengan meneteskan larutan CuS04 jenuh pada areal sekitar koloni dan
Uji Hidrolisis Urea. Uji hidrolisis urea dilakukan dalam medium
Christensen's yang mengandung 20 % urea dan 0.2% merah fenol. Perubahan
merah fenol dari kuning (pH 6,8) menjadi merah keunguan (pH 8,1 atau lebih)
menunjukkan terjadinya hidrolisis urea menjadi amoniak.
Uji Proteolitik. lsolat yang diduga C. bifementans ditumbuhkan pada
medium Skim Milk Agar yang mengandung 2% susu skim (Dancow, Indonesia), 2 %
Bacto agar, 0.5 % NaCl dan 0.5 % ekstrak khamir. lnkubasi dilakukan secara
anaerobik pada suhu 37' C, lalu diukur indeks proteolitiknya.
B. ldentifikasi dengan FAT (Fluorescein Antibody Technique)
Pembuatan Antigen C. bifennenfans. C. bifermentans ATCC638
dibiakkan pada lempeng Agar Darah dan diinkubasi pada suhu 37 OC selama 48
jam. Koloni tunggal yang tumbuh diambil dan diinokulasikan dalam media pepton 3
% (Oxoid L37) pH 7.5. lnkubasi dilakukan selama 24 jam. Sel bakteri dipanen
dengan cara disentrifugasi pada 5000 rpm selama 20 menit. Pelet bakteri yang
diperoleh dicuci dengan Phosphat Buffer Saline (PBS) sebanyak 3 kali. Pada
pencucian terakhir bakteri diresuspensi dalam PBS sehingga sama dengan
kekeruhan dari 'Browns Opacdy Tube' no 8 yang kira-kira mengandung
lo8
seUml.Suspensi sel dipanaskan dalam air mendidih selama 1 jam, lalu ditambahkan 0.01%
thiomersal dan disimpan pada suhu 4OC sampai saatnya digunakan
.
Pembuatan Anti C. bifermentans. Serum kebal atau hiperimun terhadap
C. bifermentans dibuat pada hewan domba dengan menyuntikkan kultur mati C. bifementans dengan dosis bertingkat dalam jangka waktu 5 hari secara intravena.
memperkuat respon spesifik antibodi anti C. Mementans. Adapun jadwal penyuntikan sebagai berikut :
Tabel 2. Jadwal imunisasi
Ket : I
=
domba putih, II=
domba spot hitamSatu minggu setelah imunisasi dilakukan, serum domba diambil dan diuji
untuk mengetahui besamya anti C. bifementans yang terbentuk. Dalam uji ini serum
domba diteteskan pada gelas objek dan antigen C. Mementans diteteskan
diatasnya. Adanya reaksi aglutinasi yang kuat menunjukkan anti C. bifermentans
yang terbentuk telah cukup tinggi. Setelah itu, dilakukan pengambilan darah domba
yang diikuti dengan pemisahan serumnya dengan sentrifugasi 1500 rpm selama 10
menit sehingga didapat antiserum yang benar-benar bening. Antiserum disimpan
pada suhu 4OC sampai saat dilakukan pemumian IgG. Domba
1 11
-
Pemurnian lgG Anti C. bifermentans. Terhadap serum domba
ditambahkan ammonium sulfat (NH4)2S04 jenuh, Tris-EDTA pH 8.0 dengan volume
yang sama. Pengendapan dilakukan secara perlahan-lahan sambil diaduk dengan
magnetic stirrer selama 20 menit. Setelah terjadi pengendapan secara keseluruhan, disentrifugasi pada 3000 rpm 20 menit. Endapan diresuspensikan kembali dengan
PBS ke volume semula, kemudian diendapkan kembali dengan (NH4)2S04 jenuh.
Presipitat yang diperoleh didialisa dengan PBS selama 3 malam pada suhu 4OC.
Tahap pemumian selanjutnya adalah melalui kolom kromatografi yaitu
DEAE sephacell. IgG dilewatkan dalam kolom dan IgG yang keluar dipantau dengan
spektrofotometer pada panjang gelombang 260 nm dan 280 nm. Pemantauan Hari
ke-
5 8.0 ml 8.0 ml 4
dilakukan untuk tiap fraksi IgG dengan volume 5 ml. Fraksi yang terendah hingga
yang tertinggi dikumpulkan (pooled) dan dihitung konsentrasi IgG nya. Sebagai
pelarut digunakan phosphat buffer pH 7.5. Rasio antara
hXo
dan h2&30 menunjukkankemumiaan IgG yang diperoleh, sedangkan konsentrasinya diestimasi berdasarkan
persamaan (Johnstones dan Thorpe, 1982) :
[IgG]
=
(Abs 280 x 1.22)-
(Abs 260 x 0.77)Pelabelan Antibodi dengan FITC. Kadar IgG yang diperoleh
dikonsentrasikan hingga menjadi 10 mglml. Adapun komposisi untuk pelabelan
FITC adalah : 2 ml IgG, 7 ml PBS pH 7.5 dan 1 ml buffer karbonat pH 9.0 sehingga
total volume menjadi 10 ml. Kebutuhan FlTC adalah 0.025 mg untuk 1.0 mg IgG.
Muhmula sebanyak 2,5 mg FlTC dilarutkan dalam campuran PBS dan buffer
karbonat pH 9.0, kemudian 2 ml IgG dimasukkan secara perlahan-lahan sambil
distirer. Stir dilakukan selama 2 jam pada suhu ruang dalam keadaan gelap. IgG
terlabel dimasukan dalam kolom Sphadex G25, lalu fraksinya ditampung 4 ml per
tabung. Fraksi IgG terlabel diuji kemungkinan terjadinya cross reaction dengan
beberapa spesies Clostridium.
ldentifikasi dengan FAT. Koloni tunggal dari Agar Darah yang diperkirakan
sebagai C. bifermentans dibuat sediaan utas dan difiksasi dengan cara dipanaskan
diatas api kemudian ditetesi dengan antibodi terhadap C. biferentans yang telah
dilabel dengan fluoresen isotiosianat (FITC). Setelah ditetesi dengan Fluorescen
Labelled Antibody, sediaan disimpan dalam ruang lembab selama 1 jam lalu dicuci
dengan PBS sebanyak 3 kali dan dikeringkan dengan keras serap pengering. Kaca
karbonat (50 % gliserol dalam 1 M Na2C03). Preparat yang dihasilkan diamati
dengan mikroskop UV fluoresen dengan perbesaran 1000x.
C. Analisis Keragaman Genetik
C.1. lsolasi DNA genom bakteri
Untuk keperluan reaksi rantai polimerase (PCR), total DNA genom
C. bifemntans diekstraksi dengan metode CTAB (Maniatis, et a/., 1989) yang dimodifikasi oleh Schaad's dan Lee's, (1995). Mula-mula isolat C. bifermentans
diremajakan dengan menumbuhkannya pada medium agar darah selama 24 jam
pada suhu 37°C. Koloni tunggal yang tumbuh diambil dan dikulturkan dalam
medium kaldu cair (TYG broth) selama semalam kemudian disentrifugasi pada 6000
rpm selama 2 menit untuk mendapatkan pelet bakteri. Pelet bakteri yang diperoleh
dimasukkan kedalam 250 pI buffer TE pH 8,O (10 mM TrisCl pH 8, 1 mM EDTA pH
8) dan disentrifusi selama 2 menit pada 6000 rpm. Pelet diresuspensikan dalam 760
yl buffer TE yang sama, ditambah 2 mglml lisozim dan diinkubasi pada 37°C selama
1 jam. Kedalam suspensi tersebut ditambahkan 40 pl SDS 10% dan 8 p1 (10 mglml)
protease-K. Campuran dikocok dan diinkubasi pada 37°C sampai terbentuk larutan
kental, kemudian ditambahkan 100 pl NaCl 5M dan 100 pI CTAB 10%. Setelah
dikocok dan dipanaskan 60-65°C selama 20 menit dalam penangas air, ditambah
500 pI campuran fenol : kloroform : isoamilalkohol (25:24:1). Campuran dikocok dan
disentrifugasi selama 5 menit pada 6000 rpm. Supernatan dipindahkan kedalam
tabung Eppendorf berisi isopropanol dingin, bolak-balik dan diamkan pada suhu
ruang hingga muncul benang-benang DNA. DNA diendapkan dengan cara
dingin. Setelah dikeringkan dalam speed vacuum, selanjutnya DNA yang diperoleh
disimpan dalam buffer Tris EDTA (TE) pH 8,O pada suhu -20°C.
C.2. Amplifikasi 16s rDNA
Amplikasi PCR untuk 16s rDNA dilakukan dengan menggunakan 2 buah
primer oligonukleotida spesifik prokariot yakni 63f (5'-CAG GCC TAA CAC ATG CAA
GTC) dan 1387r (5-GGG CGG WGT GTA CAA GGC) (Marchesi, et al. 1998).
Komponen reaksi PCR untuk total volume 25 pI terdiri atas 150-200 pglml DNA
templat, 20 pmol tiaptiap primer (Forward dan Reverse), 1 unit Taq DNA
Polymerase beserta buffemya (1,5 mM MgC12, 50 mM KCI, 10 mM Tris-HCI), 200
pM tiap-tiap dNTP, dan bahan penstabil termasuk BSA.
Proses amplikasi dijalankan dengan GeneAmp PCR System 2400 (Perkin
Elmer, New Jersey) sebagai berikut : sebelum amplikasi, dilakukan prapemanasan
(pre PCR) pada suhu 95°C selama lima menit. Denaturasi pada suhu 92°C selama
30 detik, pelekatan (annealing) pada suhu 55°C selama 30 detik, dan perpanjangan
(elongation) DNA pada 72°C selama 1 menit. Siklus ini diulang hingga 30 kali, dan
setelah daur yang terakhir, dibiarkan terjadi pemanjangan DNA (post PCR) pada
suhu 72°C selama 5 menit dan penyimpanan (store) pada suhu 4°C.
C.3. Analisis Restriksi 16s rDNA (ARDRA)
Sebanyak 5.0 p1 produk PCR didigesti dengan enzim endonuklease
restriksi Rsal (5'-GT~AC) sebanyak 1pI (2 unitlpl) dengan 1x buffer
Y'
TANGOkemudian ditambahkan akuabides hingga mencapai volume reaksi 20 pl. Campuran
diinkubasi selama semalam pada suhu 37% dalam water bath, reaksi dihentikan
elektroforesis dilakukan pada gel agarosa konsentrasi 2% dalam buffer I x TBE
dengan tegangan 55 V pada suhu ruang. Gel hasil elektroforesis diwamai dengan
ethidium bromida kemudian dibilas dengan akudes. Profil pita-pita DNA diamati
dengan transiluminator UV. Untuk dokumentasi digunakan Gel Doc 1000 dari BIO-
RAD dan kemudian profil DNA hasil elektroforesis dibandingkan untuk melihat
keragaman genetik masing-masing isolat.
Hubungan kekerabatan antar galur C. bifermentans dikonstruksi berdasarkan
profil ARDRA enzim yang paling diskriminatif dengan membuat dendrogram
menggunakan program TREECON (van de Veer, 1995).