Eka Deskawati
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Dengan ini saya menyatakan bahwa tesis yang berjudul ISOLASI SENYAWA RACUN DARI IKAN BUNTAL adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Insitut Pertanian Bogor.
Bogor, Februari 2015
Eka Deskawati
SRI PURWANINGSIH dan PURWATININGSIH SUGITA.
Indonesia memiliki keanekaragaman hayati laut yang tinggi dan berpotensi sebagai bahan baku obat, salah satunya adalah ikan buntal. Ikan ini memiliki ciri khas dapat menggembungkan dirinya dan mengeluarkan racun yang sangat mematikan. Racun dari ikan buntal ini dapat digunakan sebagai obat bius dan penghilang rasa sakit. Penelitian ini dilakukan untuk mengisolasi senyawa racun dari ikan buntal, jenis Arothron hispidus dan Diodon hystrix dengan berat diatas 200 gram. Tahapan dalam penelitian ini adalah karakterisasi ikan buntal, pemilihan cara ekstraksi racun terbaik, pemilihan spesies dan bagian organ yang memiliki kandungan racun tinggi, pengujian toksisitas ekstrak kasar secara in vivo
menggunakan model hewan tikus serta identifikasi senyawa racun. Tingkat toksisitas ekstrak racun diuji menggunakan metode Brine Shrimp Lethality Test
(BSLT).
Ikan buntal dalam penelitian ini merupakan ikan dewasa yang memiliki kadar air 79,50% untuk A. hispidus dan 82,37% D. hystrix, serta kadar protein 17,30% untuk A. hispidus dan 16,01% untuk D. hystrix. Toksisitas tertinggi terdapat pada ovarium Arothron hispidus dengan nilai Lethal concentration 50 (LC50) 29,65 ppm. Ekstrak ovarium ini mengandung alkaloid, karbohidrat, dan asam amino. Metode ekstraksi Founda (2005) ditentukan sebagai metode ekstraksi terbaik. Histopatologi hipokampus dari tikus yang diberi ekstrak ovarium
Arothron hispidus menunjukkan adanya nekrosis sel pada dosis 1 dan 4 mg/kg berat badan dan terjadi pendarahan pada dosis 4 mg/kg berat badan. Tikus yang diberikan ekstrak hati Arothron hispidus juga menunjukkan nekrosis pada dosis 0,25; 1 dan 4 mg/kg berat. Histopalotogi korteks serebri memperlihatkan semakin tinggi dosis ekstrak ovarium dan hati Arothron hispidus yang diberikan, maka jumlah sel yang mengalami nekrosis semakin banyak. Hasil fraksinasi menggunakan Kromatografi Cair Vakum (KCV) dan Kromatografi Lapis Tipis Preparatif (KLTP) menunjukkan racun yang diduga adalah curvulin.
PURWANINGSIH dan PURWATININGSIH SUGITA.
Indonesia high in marine biodiversity and potential as pharmaceutical raw materials, one of that puffer fish. This fish can inflate themselves and release the toxins in threatened condition. This toxin can be used as an anesthetic and painkillers. The objective of this study was to isolate toxin from puffer fish.
Arothron hispidus and Diodon hystrix wich had over 200 gram weight were used as raw material. This study were conducted to characterize the puffer fish, determine the best extraction method, species, and organ, in vivo test toxicity of crude extract using rat animal models and identify its toxic compounds. Toxicity level of toxin extract was assayed by Brine Shrimp Lethality Test (BSLT).
Pufferfish in this study were the adult fish that high in moisture content 79,50% for A. hispidus and 82,37% for D. hystrix) and protein (A. hispidus
17,30% and D. hystrix 16,01%). The highest toxicity was ovary of Arothron hispidus with Lethal Concentration 50 (LC50) value 29.65 ppm. The ovary extract contains alkaloid, carbohydrate and amino acid. The method by Founda (2005) as the best extraction method. The histopathology hippocampus from rats were feed with Arothron hispidus ovary extract show necrosis cell at doses 1 and 4 mg/kg weight dose and bleeding at 4 mg/kg weight dose. Rats fed with Arothron hispidus liver extract also show necrosis at dose 0,25, 1 and 4 mg/kg weight dose. Similarly, histopathology cerebral cortex cells showed more doses given to rats increased the number of necrotic cells. The fractiontion result using Vacuum Liquid Chromatography (VLC) and Preparative Thin Layer Chromatography (PTLC) shows the toxin was thought to contain toxic compound curvulin.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan,
penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
EKA DESKAWATI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Teknologi Hasil Perairan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Program Studi : Teknologi Hasil Perairan
Disetujui Komisi Pembimbing
Dr Ir Sri Purwaningsih, MSi. Prof Dr Dra Purwatiningsih Sugita, MS Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Teknologi Hasil Perairan
Dr Ir Wini Trilaksani, MSc Dr Ir Dahrul Syah, MScAgr
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala rahmat dan karunia-Nya sehingga penulisan tesis ini dapat diselesaikan. Judul tesis ini adalah ” Isolasi Senyawa Racun dari Ikan Buntal”.
Penulis mengucapkan terimakasih yang sebesar-besarnya kepada :
1. Dr Ir Sri Purwaningsih, MSi dan Prof Dr Dra Purwatiningsih Sugita, MS selaku dosen pembimbing yang telah memberikan bimbingan, arahan, dukungan, semangat serta pelajaran tentang berbagai macam hal sehingga penulis dapat menyelesaikan tesis ini.
2. Dr. Tati Nurhayati, SPi, MSi selaku penguji luar komisi pada ujian tesis.
3. Dr. Ir. Wini Trilaksani, MSc selaku Ketua Program Studi Teknologi Hasil Perairan.
4. Prof drh Ekowati Handharyani, MSi, PhD atas bantuan dan bimbingan beliau selama penulis menjalankan penelitian.
5. Keluarga besar saya, yang telah memberikan doa, dorongan semangat dan kasih sayang selama ini.
6. Keluarga besar mahasiswa sekolah pascasarjana Teknologi Hasil Perairan, yang telah memberikan dorongan semangat baik selama penelitian maupun saat penyusunan tesis ini.
7. Terima kasih penulis sampaikan kepada semua pihak yang telah membantu penyelesaian tesis ini.
Penulis menyadari bahwa masih terdapat kekurangan dalam penyusunan tesis ini. Oleh karena itu, jika terdapat kesalahan penulis memohon maaf yang sebesar-besarnya. Penulis sangat mengharapkan kritik dan saran yang membangun sehingga bermanfaat untuk penyelesaian tesis ini. Akhirnya, semoga tesis ini bermanfaat.
Bogor, Februari 2015
Halaman
DAFTAR TABEL iii
DAFTAR GAMBAR iv
DAFTAR LAMPIRAN v
PENDAHULUAN 1
Latar Belakang 1
Rumusan Masalah 2
Tujuan Penelitian 2
Hipotesis Penelitian 3
METODE PENELITIAN 4
Waktu dan Tempat 4
Bahan dan Alat 4
Prosedur Penelitian 4
Karakteristik Bahan Baku 6
Penentuan Cara Ekstraksi Racun Terbaik 8
Penentuan Jenis Ikan dan Organ Ikan Buntal Paling Toksik 8
Isolasi Racun 8
Uji Toksisitas 8
Analisis Fitokimia 10
Pemurnian dan Penentuan Struktur Kimia Ekstrak 11
Analisis Data 12
HASIL DAN PEMBAHASAN 13
Karakteristik Bahan Baku 13
Ekstraksi Racun Terpilih 17
Jenis Ikan dan Organ Ikan Buntal Paling Toksik yang Terpilih 17
Toksisitas Akut Ekstrak Racun pada Tikus 21
Pengaruh racun ikan buntal pada hipokampus 21
Pengaruh racun ikan buntal pada korteksserebri 22
Komposisi Kimia Ekstrak Racun Ikan Buntal 22
Pemurnian dan Pencirian Komponen 23
SIMPULAN DAN SARAN 30
DAFTAR PUSTAKA 30
LAMPIRAN 35
Halaman
1 Metode penentuan ekstraksi racun terbaik 8
2 Pengukuran morfometrik ikan buntal 14
3 Hasil analisis proksimat ikan buntal 15
4 Hasil penentuan cara ekstraksi racun 17
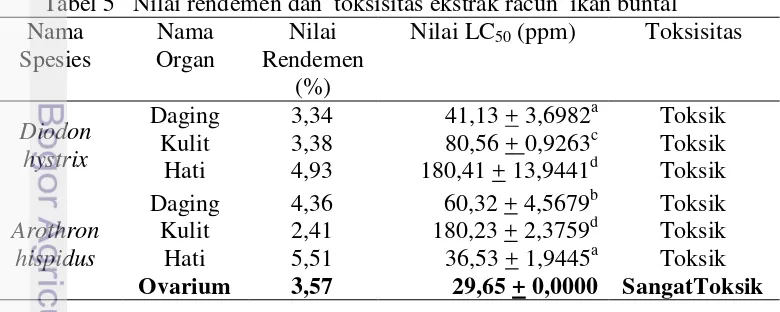
5 Nilai rendemen dan toksisitas ekstrak racun ikan buntal 18
6 Tingkat toksisitas dari beberapa jenis ikan buntal 20
7 Hasil uji fitokimia ekstrak ovarium Arothron hispidus 23
8 Data hasil pengujian toksisitas kelompok fraksi 24
9 Kondisi Liquid Chromatography Mass Spectroscopy dan waktu
retensi racun pada ikan buntal 25
Halaman
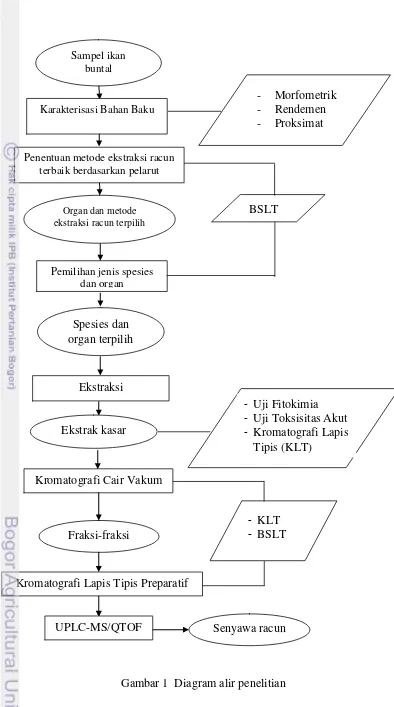
1 Diagram alir penelitian 5
2 Ikan buntal Arothron hispidus (A), ikan buntal Diodon hystrix (B) 13 3 Persentase randemen ikan buntal D. hystrix dan A. hispidus 14
4 Histopatologi sel hipokampus 22
5 Histopatologi sel korteks serebri 22
6 Kromatogram fraksi D KLTP dengan eluen butanol:asam asetat:air (2:1:1),
diamati pada lampu UV 366 nm 24
7 Kromatogram LCMS Fraksi D pada Rf1 25
8 Spektrum massa pada waktu retensi 6,21 menit 27
9 Fragmentasi senyawa curvulin 27
10 Mekanisme akumulasi racun pada hewan laut 28
Halaman
1 Surat keterangan identifikasi ikan buntal dari Lembaga Ilmu
Pengetahuan Indonesia 37
2 Perhitungan proksimat ikan buntal 38
3 Analisis ragam penentuan cara ekstraksi racun 40
4 Analisis ragam penentuan spesies dan organ paling toksik 41
5 Penentuan LC50 Daging Diodon hystrix 42
6 Penentuan LC50 Kulit Diodon hystrix 42
7 Penentuan LC50 Hati Diodon hystrix 43
8 Penentuan LC50 Daging Arothron hispidus 43
9 Penentuan LC50 Ovarium Arothron hispidus 44
10 Penentuan LC50 Hati Arothron hispidus 44
1.
PENDAHULUAN
Latar Belakang
Kebutuhan akan obat-obatan di Indonesia semakin meningkat, hal ini memicu pertumbuhan industri farmasi di Indonesia, yaitu berkisar 10-15% pada 2013. Kendati demikian, ada hal yang perlu diperbaiki terutama untuk menekan ketergantungan terhadap bahan baku impor. Berdasarkan Peraturan Meteri Kesehatan RI no 87 Tahun 2013, pasar farmasi Indonesia pada tahun 2011 berkisar sekitar 43 triliun rupiah dari jumlah tersebut diperkirakan bahan baku obat (BBO) yang digunakan adalah kurang lebih sekitar 30%-nya atau sekitar 14 triliun rupiah dan sekitar 96%-nya merupakan bahan baku impor. Jumlah ini dapat diminimalisir jika ada kemandirian di bidang obat dengan menumbuhkan industri bahan baku obat dalam negeri. Industri ini tidak akan berjalan apabila tidak didukung penelitian mengenai bahan baku obat, sehingga nantinya bangsa Indonesia bisa menjadi produsen obat dan bukan hanya sebagai pangsa pasar.
Indonesia merupakan negara kepulauan dengan biodiversitas tinggi. Kekayaan biota laut Indonesia sudah lama dikenal dan digunakan sebagai bahan baku dalam pembuatan obat-obatan meskipun efektifitasnya belum banyak teruji secara ilmiah (Purwaningsih 2006). Adanya keanekaragaman yang tinggi dari spesies biota laut menyebabkan terjadinya kompetisi yang tinggi dan ketat antar spesies untuk bertahan hidup. Kondisi ini menyebabkan spesies-spesies ini mensintesis metabolit sekunder berupa senyawa-senyawa toksik untuk mempertahankan dirinya. Struktur kimia dan aktivitas biologis senyawa dari biota laut sangat jarang ditemukan padanannya dengan biota darat. Biota laut yang hidup di wilayah tropis dan subtropis Indopasifik banyak diburu industri farmasi untuk penemuan obat antikanker, antibiotik dan antiinflamasi (Widihati 2004).
Salah satu organisme laut yang berpotensi menghasilkan metabolit sekunder berupa racun adalah ikan buntal. Ikan buntal berasal dari famili Diodontidae dan berasal dari ordo Tetraodontiformes. Nama tetraodontiformes berasal dari morfologi gigi ikan ini, yaitu memiliki dua gigi besar pada rahang atas dan bawahnya yang cukup tajam. Gigi yang menyatu bersama menjadi satu kesatuan, menciptakan mulut yang kuat dan dapat meretakan kulit kerang siput, landak laut, dan kepiting yang merupakan makanan utama ikan buntal. Ikan buntal memiliki tulang belakang yang lebih tipis, tersembunyi, dan dapat terlihat ketika ikan ini menggembungkan diri (BPOM 2006). Ikan ini banyak ragamnya di perairan tropis, sedikit di perairan zona sedang dan tidak ada di perairan dingin.
Di Indonesia ikan buntal memiliki nilai jual sangat rendah yaitu sekitar Rp. 3.000,-/kg, sehingga ikan ini tidak dijual dan hanya dikonsumsi oleh nelayan di beberapa daerah tertentu bahkan di daerah lainnya ikan buntal dibuang karena selain beracun, duri dari ikan ini dapat merusak jaring nelayan. Nilai ekonomi dari ikan ini di Indonesia belum terasa karena keterbatasan pengetahuan mengenai cara pengelolaan dan pemanfaaatannya.
merupakan racun yang menyerang syaraf dan memiliki berat molekul rendah. Racun ini menghambat konduksi syaraf dan otot secara selektif memblokir saluran natrium, sehingga dapat digunakan sebagai obat anastesi lokal. Obat dari ikan buntal yang pertama kali dirilis adalah Tectin, obat ini berbahan dasar dari tetrodotoksin dan dikembangkan oleh WEX Pharmaceutical Inc. Ketika diberikan dalam dosis kecil obat ini ampuh mengurangi rasa sakit kronis yang dialami oleh pasien kanker (Hagen 2007). Penelitian mengenai anti tumor dari racun ikan buntal juga telah dilakukan oleh Founda (2005). Penelitiannya menghasilkan racun ikan buntal efektif dalam menghilangkan sel kanker Ehrlich Ascite Carcinoma dan meningkatkan waktu hidup hewan uji hingga 46 %. Penelitian dari Soliman et al. (2014) menunjukkan bahwa racun ikan buntal
Amblyrhynchotes hypselogenion dan Lagocephalus sceleratus dari Laut Merah dapat digunakan sebagai antifouling.
Sebagian besar penelitian dari ikan buntal tertuju pada penentuan bioktivitas dari racun ikan buntal ini, tetapi masih sedikit penelitian yang berfokus pada isolasi dan pencirian racun ikan buntal. Penelitian mengenai isolasi racun dari spesies Arothron hispidus dan Diodon hystrix belum pernah dilakukan, padahal kedua spesies ini banyak terdapat di Indonesia, khususnya di Laut Pameungpeuk. Di Indonesia penelitian mengenai racun terutama dari biota laut jarang dilakukan padahal senyawa ini sangat diperlukan sebagai bahan baku obat-obatan.
Rumusan Masalah
Nilai impor bahan baku untuk obat-obatan di Indonesia sangat tinggi mencapai lebih dari 90%. Hal ini memacu pemerintah untuk meningkatkan penelitian mengenai bahan baku obat. Keanekaragaman biota laut Indonesia sangat tinggi, sehingga kompetisi antar biota ini sangat ketat. Strategi pertahan diri dari biota laut ini salah satunya dengan memproduksi senyawa metabolit sekunder berupa racun. Salah satu biota laut yang dapat memproduksi racun adalah ikan buntal. Ikan ini memproduksi racun untuk mempertahankan diri dari serangan predator dan sebagai feromon untuk memikat lawan jenis.
Racun ikan buntal ini memiliki aktivitas biologis yang sangat kuat, bahan bakunya sangat murah dan ketersediaan bahan melimpah sehingga dapat digunakan sebagai bahan obat-obatan. Diharapkan hal ini menjadikan harga jual dari obat semakin terjangkau oleh masyarakat. Ikan buntal di Indonesia tidak memiliki nilai ekonomi dan biasanya hanya dibuang, meskipun di beberapa daerah ada yang memanfaatkannnya untuk dikonsumsi dan dibuat kerupuk. Pemanfaatan racun ikan buntal ini akan meningkatkan nilai ekonomis dan diharapkan berimbas pada peningkatan kesejahteraan nelayan, karena penangkapan ikan tidak hanya terbatas oleh ikan konsumsi.
Tujuan Penelitian
Hipotesis Penelitian
2.
METODE PENELITIAN
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan November 2012 hingga Desember 2014. Sampel ikan buntal pasir (Arothron hispidus) dan buntal duren (Diodon hystrix) diambil dari Laut Pameungpeuk, Garut-Jawa Barat. Penelitian dilakukan di beberapa laboratorium, yaitu laboratorium Karakteristik Hasil Perairan, laboratorium Biokimia Hasil Perairan dan laboratorium pangan-Pusat Antar Universitas (PAU) untuk preparasi, ekstraksi, pemurnian, analisis fitokimia, dan uji Brine Shrimp Lethality Test (BSLT). Pengujian toksisitas akut terhadap tikus dilakukan di Rumah Sakit Hewan, Fakultas Kedokteran Hewan Institut Pertanian Bogor. Penentuan jenis racun menggunakan Kromatografi cair spektoskopi massa dilakukan di Laboratorium Forensik Mabes Polri.
Bahan dan Alat
Bahan utama yang digunakan yaitu ikan buntal pasir (Arothron hispidus) dan ikan buntal duren (Diodon hystrix) dengan ukuran diatas 200 gram yang diperoleh dari laut Pameungpeuk, Garut, Jawa Barat. Bahan lainnya yaitu methanol, asam asetat, akuades, pelat silika gel F254, silika gel Merck 60G, silika gel 60 (0.2-0.5 mm), asam asetat glasial, asam klorida p.a. (Merck), pereaksi FeCl3 1%, pereaksi dragendorf, pereaksi meyer, pereaksi wagner, kloroform, anhidrida asetat, asam sulfat, serbuk Mg, amil alkohol, etanol, pereaksi molisch, pereaksi benedict, ninhidrin, Artemia salina dan tikus. Tikus yang digunakan yaitu tikus putih (Rattus noeveginus) galur Sprague Dawley berkelamin jantan dengan berat 180-200 g.
Alat-alat yang digunakan antara lain timbangan digital, freeze drying,
sentrifuse dingin, penguap putar, kandang tikus, sonde, mikrotom, spluit, mikroskop cahaya, kamera mikroskop, Kromatografi Cair Vakum (KCV), kromatografi cair spektrometer massa ultra performance liquid chromatography quadrupole time-of flight mass spectrometry (UPLC-QTOF/MS) merk Waters Xevo G2-S, mikrotom dan peralatan kaca.
Prosedur Penelitian
Gambar 1 Diagram alir penelitian Kromatografi Cair Vakum
Ekstrak kasar
Fraksi-fraksi
Kromatografi Lapis Tipis Preparatif
UPLC-MS/QTOF Senyawa racun
- KLT
- BSLT Ekstraksi
Pemilihan jenis spesies dan organ
Spesies dan organ terpilih
BSLT Organ dan metode
ekstraksi racun terpilih Sampel ikan
buntal
Penentuan metode ekstraksi racun terbaik berdasarkan pelarut Karakterisasi Bahan Baku
- Morfometrik - Rendemen - Proksimat
- Uji Fitokimia
- Uji Toksisitas Akut
Karakteristik Bahan Baku
Karakterisasi ikan buntal dilakukan secara fisik yang terdiri dari pengukuran morfometrik dan perhitungan rendemen, sedangkan secara kimia berupa analisis proksimat terhadap daging dan ovarium ikan buntal yang meliputi kadar air, protein, lemak, abu, dan karbohidrat.
1) Pengukuran morfometri
Sampel ikan buntal diidentifikasi jenis spesiesnya di Pusat Penelitian Oseanografi LIPI, Ancol-Jakarta (Lampiran 1). Pengukuran morfometri panjang, lebar, dan tinggi dilakukan terhadap 12 buah sampel ikan buntal pasir dan 22 buah ikan buntal duren
2) Pengukuran rendemen
Rendemen dihitung sebagai persentasi bobot bagian tubuh ikan buntal dari bobot awal. Adapun perumusan matematik adalah sebagai berkut:
(%) Rendemen = x 100%
3) Analisis proksimat (AOAC 2005)
Analisis proksimat adalah analisis yang dilakukan untuk memprediksi komposisi kimia suatu bahan termasuk didalamnya analisis kandungan air, lemak, abu, protein dan karbohidrat.
a)Analisis kadar air
Cawan porselen dikeringkan dalam oven pada suhu 105 oC selama 1 jam, selanjutnya cawan dimasukkan ke dalam desikator (kurang lebih 15 menit) dan dibiarkan sampai dingin kemudian ditimbang. Sampel ditimbang 5 g dan dimasukkan ke dalam cawan tersebut, kemudian dikeringkan dengan oven pada suhu 105 oC selama 5 jam atau hingga beratnya konstan, kemudian cawan tersebut dimasukkan ke dalam desikator dan dibiarkan sampai dingin dan ditimbang.
Perhitungan kadar air : B- C
B-A B - A
Keterangan : A : Berat cawan kosong (gram)
B : Berat cawan yang diisi dengan sampel (gram)
C : Berat cawan dengan sampel yang sudah dikeringkan (gram)
b) Analisis kadar abu
Cawan abu dikeringkan di dalam oven pada suhu 105 oC selama 1 jam, didinginkan selama 15 menit di dalam desikator dan ditimbang hingga didapatkan berat yang konstan. Sampel ditimbang 5 g dan dimasukkan ke dalam cawan pengabuan dan dipijarkan di atas nyala api bunsen hingga tidak berasap, kemudian dimasukkan ke dalam tanur pengabuan dengan suhu 600 oC selama 1 jam, kemudian ditimbang hingga didapatkan berat yang konstan.
Kadar abu ditentukan dengan rumus:
C - A
B - A
% kadar abu = x 100%
Keterangan : A : Berat cawan porselen kosong (gram) B : Berat cawan dengan sampel (gram)
C : Berat cawan dengan sampel setelah dikeringkan (gram) c) Analisis kadar protein
Pengukuran kadar protein dilakukan dengan metode mikro Kjeldahl. Sampel ditimbang 0,25 g, kemudian dimasukkan ke dalam labu Kjeldahl 100 mL, lalu ditambahkan 0,25 g selenium dan 3 mL H2SO4 pekat. Sampel didestruksi pada suhu 410 oC selama kurang lebih 1 jam sampai larutan jernih lalu didinginkan. Aquades sebanyak 50 mL dan 20 mL NaOH 40%, ditambahkan ke dalam labu Kjeldahl kemudian dilakukan proses destilasi dengan suhu destilator 100 oC. Hasil destilasi ditampung dalam labu Erlenmeyer 125 mL yang berisi campuran 10 mL asam borat (H3BO3) 2% dan 2 tetes indikator bromcresol green-methyl red yang berwarna merah muda. Proses destilasi dihentikan setelah volume destilat mencapai 40 mL dan berwarna hijau kebiruan. Destilat dititrasi dengan HCl 0,1 N sampai terjadi perubahan warna merah muda. Volume titran dibaca dan dicatat. Larutan blanko dianalisis seperti sampel.
Kadar protein dihitung dengan rumus sebagai berikut :
% kadar protein = % N x faktor konversi dalam selongsong lemak, kemudian dimasukkan ke dalam labu lemak yang sudah ditimbang berat tetapnya (W2) dan disambungkan dengan tabung soxhlet. Selongsong lemak dimasukkan ke dalam ekstraktor tabung
soxhlet dan disiram dengan pelarut lemak (n-heksana), kemudian dilakukan refluks selama 6 jam. Pelarut lemak yang ada dalam labu lemak didestilasi hingga semua pelarut lemak menguap, selanjutnya labu lemak dikeringkan dalam oven pada suhu 105 oC, setelah itu labu didinginkan dalam desikator sampai beratnya konstan (W3). Perhitungan kadar lemak:
(W1- W2)
Analisis karbohidrat dilakukan by difference, yaitu hasil pengurangan dari 100% dengan kadar air, kadar abu, kadar protein dan kadar lemak, sehingga kadar karbohidrat tergantung pada faktor pengurangannya. Hal ini karena karbohidrat sangat berpengaruh terhadap zat gizi lainnya. Analisis kadar karbohidrat dapat dihitung dengan persamaan berikut:
% karbohidrat =100% - (kadar air+kadar abu+ kadar lemak+kadar protein) % N =
% kadar lemak = x 100%
Penentuan Cara Ekstraksi Racun Terbaik
Pemilihan cara ekstraksi terbaik menggunakan beberapa metode yang dapat dilihat pada Tabel 1. Metode terbaik ditentukan dengan nilai LC50.
Tabel 1 Metode penentuan ekstraksi rcun terbaik Nama
Metode
Jumlah sampel
Pelarut Cara Ekstraksi Perlakuan Pemekatan
Zhou
Penentuan Jenis Ikan dan Organ Ikan Buntal Paling Beracun
Sampel ikan buntal yaitu Arothron hispidus dan Diodon histryx diambil dari laut Pameungpeuk, Garut, Jawa Barat. Masing-masing organ (daging, kulit, hati, ovarium dan jantung) dari ikan buntal dipisahkan, lalu diekstrak menggunakan metode terbaik. Hasil ekstraksi di uji dengan metode Brine Shrimp Lethality Test
(BSLT). Organ dan spesies dengan nilai LC50 paling rendah akan digunakan pada tahap selanjutnya.
Isolasi Racun
Organ dari spesies dengan nilai LC50 paling rendah diisolasi menggunakan metode ekstraksi racun terbaik. Ekstrak dianalisis kandungan bioaktif, diuji toksisitasnya, kemudian dilakukan pemisahan komponen aktif.
Uji Toksisitas
1) Uji Brine Shrimp Lethality Test (BSLT)
Uji BSLT ini mengacu pada penelitian Meyer et al. (1982). Pada uji ini digunakan larva Artemia salina sebagai hewan uji. Pengujian diawali dengan penetasan telur A. salina di dalam air laut dan di bawah lampu TL 40 watt selama 48 jam dan diaerasi dengan aerator. Sepuluh ekor larva A. salina
dimasukkan ke dalam tabung reaksi, kemudian ditambahkan larutan ekstrak sampel dengan konsentrasi masing-masing 10 ppm, 100 ppm, 500 ppm dan 1000 ppm lalu ditambahkan air laut sampai volume 5 mL. Air laut tanpa pemberian ekstrak (0 ppm) digunakan sebagai kontrol. Semua tabung reaksi diinkubasi pada suhu kamar selama 24 jam di bawah penerangan lampu TL 40 watt. Pengamatan dilakukan setelah 24 jam dengan menghitung jumlah A. salina yang mati pada tiap konsentrasi. Penentuan LC50 dilakukan menggunakan analisis probit dan persamaan regresi.
2) Uji toksisitas akut
Pengujian tosksisitas dilakukan secara in vivo menggunakan tikus putih (Rattus noeveginus) galur Sprague Dawley. Tikus diadaptasikan dahulu dengan kondisi lingkungan laboratorium selama 7 hari. Selama masa adaptasi, tikus diberi pakan komersial standar dan minum secara ad libitum. Pada hari terakhir adaptasi, tikus ditimbang dan dikelompokkan menjadi 7 kelompok (n=5) dalam kandang terpisah. Kelompok perlakuan adalah sebagai berikut: Kelompok 1 : Kontrol negatif, yaitu tikus diberikan air minum yang diinduksi
secara oral pada hari ke-1.
Kelompok 2 : Perlakuan ekstrak ovarium ikan buntal bintik putih (Arothron hispidus). Tikus diberikan ekstrak dengan dosis 0,25 mg/kg BB yang diinduksi secara oral pada hari ke-1.
Kelompok 3 : Perlakuan sama dengan kelompok 2. Dosis ekstrak yang diberikan 1 mg/kg BB.
Kelompok 4 : Perlakuan sama dengan kelompok 2. Dosis ekstrak yang diberikan 4 mg/kg BB.
Kelompok 5 : Perlakuan ekstrak hati ikan buntal bintik putih (Arothron hispidus). Tikus diberikan ekstrak dengan dosis 0,25 mg/kg BB yang diinduksi secara oral pada hari ke-1.
Kelompok 6 : Perlakuan sama dengan kelompok 5. Dosis ekstrak yang diberikan 1 mg/kg BB.
Kelompok 7 : Perlakuan sama dengan kelompok 5. Dosis ekstrak yang diberikan 4 mg/kg BB.
Pemberian ekstrak ovarium dan hati ikan buntal dilakukan pada hari ke-1 dengan dosis sesuai kelompok yang telah ditentukan. Setelah 3 hari perlakuan semua tikus dikorbankan dengan cara eutanasi intraperitoneal dengan Ketamin dan Xylazin, lalu dilakukan nekropsi. Organ hati dan otak tikus kemudian diambil dan digunakan untuk pembuatan preparat histopatologi berdasarkan metode Kiernan (1990).
a) Persiapan preparat histopalogi hati
menggunakan xilol dilakukan sebanyak tiga kali selama 1 jam. Jaringan lalu ditanam dalam media parafin, dan dilakukan penyayatan menenggunakan mikrotom dengan ketebalan 4-5 mikron. Hasil sayatan dilekatkan pada kaca objek, kemudian diwarnai dengan hematoksilin-eosin (HE).
b) Persiapan preparat histopalogi otak
Organ hati dipotong tipis lalu dimasukan ke dalam cassette dan dicuci dengan NaCl fisiologis. Organ difiksasi menggunakan buffer formalin 10%. Potongan hati lalu didehidrasi dengan alkohol secara bertingkat mulai dari konsentrasi (70% dan 80%, masing-masing dua kali), 90%, 95%, dan alkohol 100% masing-masing selama 2 jam. Penjernihan dengan menggunakan xilol dilakukan sebanyak tiga kali selama 1 jam. Jaringan lalu ditanam dalam media parafin, dan dilakukan penyayatan menenggunakan mikrotom dengan ketebalan 4-5 mikron. Hasil sayatan dilekatkan pada kaca objek, kemudian diwarnai dengan hematoksilin-eosin (HE).
Analisis Fitokimia (Harbone 1987)
Organ dari spesies dengan nilai LC50 paling rendah dianalisis fitokimianya. Uji fitokimia dilakukan untuk menentukan komponen bioaktif yang terdapat pada serbuk ekstrak kasar organ ikan buntal paling toksik. Analisis fitokimia yang dilakukan terdiri dari alkaloid, steroid/triterpenoid, saponin, flavonoid, fenol hidrokuinon, molisch, benedict, biuret, ninhidrin.
1) Alkaloid
Sebanyak 1 g sampel dilarutkan dalam beberapa tetes asam sulfat 2 N kemudian diuji dengan tiga pereaksi alkaloid yaitu, pereaksi Dragendoff, pereaksi Meyer, dan pereaksi Wagner. Hasil uji dinyatakan positif bila dengan pereaksi Meyer terbentuk endapan putih kekuningan, endapan coklat dengan pereaksi Wagner dan endapan merah hingga jingga dengan pereaksi Dragendorff.
2) Steroid/triterpenoid
Sebanyak 1 gram sampel dilarutkan dalam 2 mL kloroform dalam tabung reaksi. Anhrida asetat ditambahkan sebanyak 10 tetes kemudian ditambahkan asam sulfat pekat 3 tetes ke dalam campuran tersebut. Hasil uji positif mengandung steroid dan triterpenoid yaitu dengan terbentuknya larutan berwarna merah untuk pertama kali kemudian berubah menjadi biru dan hijau.
3) Flavonoid
Sebanyak 1 gram sampel ditambah serbuk magnesium 0,1 mg dan 0,4 mL amil alkohol (campuran asam klorida 37% dan etanol 95% dengan volume yang sama) dan 4 mL alkohol kemudian campuran dikocok. Hasil uji positif sampel mengandung flavonoid ditunjukkan dengan terbentuknya warna merah, kuning atau jingga pada lapisan amil alkohol.
4) Saponin
5) Fenol hidrokuinon (pereaksi FeCl3)
Sebanyak 1 gram sampel diekstrak dengan 20 mL etanol 70%. Larutan yang dihasilkan diambil sebanyak 1 mL kemudian ditambahkan 2 tetes larutan FeCl3 5%. Hasil uji positif sampel mengandung fenol hidrokuinon ditunjukkan dengan terbentuknya warna hijau atau hijau biru.
6) Molisch
Sebanyak 1 mL larutan sampel diberi 2 tetes pereaksi Molish dan 1 mL asam sulfat pekat melalui dinding tabung. Uji positif yang menunjukkan adanya karbohidrat ditandai terbentuknya kompleks berwarna ungu diantara 2 lapisan cairan.
7) Uji Benedict
Larutan sampel sebanyak 8 tetes dimasukkan ke dalam 5 mL pereaksi Benedict. Campuran dikocok dan dididihkan selama 5 menit. Hasil uji positif sampel mengandung gula pereduksi ditunjukkan dengan terbentuknya larutan berwarna hijau, kuning atau endapan merah bata.
8) Uji Biuret
Sebanyak 1 mL larutan sampel ditambahkan 4 mL pereaksi Biuret. Campuran dikocok dengan seksama. Hasil uji positif sampel mengandung senyawa peptida dengan terbentuknya larutan berwarna ungu.
9) Uji Ninhidrin
Sebanyak 2 mL larutan sampel ditambah beberapa tetes larutan ninhidrin 0,1%. Campuran dipanaskan dalam penangas air selama 10 menit. Hasil uji positif sampel mengandung asam amino ditunjukkan warna biru.
Pemurnian dan Penentuan Struktur Kimia Ekstrak
Ekstrak kasar dari hasil ekstraksi terbaik difraksinasi lebih lanjut dengan Kromatografi Cair Vakum. Eluen yang digunakan adalah nheksana-etil asetat dan etil asetat-metanol yang ditingkatkan kepolarannya dan fase diam yang digunakan ialah silika gel.
Analisis Data
Rancangan percobaan yang digunakan adalah rancangan acak lengkap (RAL). Data yang dihasilkan dianalisis menggunakan model rancangan ANOVA (Analysis Of Variant) atau uji F (Steel & Torrie 1993) dengan formulasi:
Keterangan :
Yij = nilai pengamatan pada taraf ke-j
µ = nilai tengah atau rataan umum pengamatan
τi = pengaruh metode pengolahan pada taraf ke-i
εij = galat atau sisa pengamatan taraf ke-i dengan ulangan ke-j
Jika uji F pada ANOVA memberikan pengaruh nyata, maka dilanjutkan dengan uji lanjut Duncan, dengan rumus sebagai berikut:
Keterangan :
3. HASIL DAN PEMBAHASAN
Karakteristik Bahan Baku
Ikan buntal termasuk dalam famili Tetraodontidae, yang berisi 185 spesies dan 28 genus (Oliveira et al. 2006). Menurut Sabrah (2006) ikan buntal hidup di daerah laut tropis dan estuaria. Ikan buntal berukuran kecil sampai sedang. Spesies ini umumnya memiliki panjang 8-14 inci (20-35 cm) dan mencapai maksimum 20 inci (50 cm), namun ada juga spesies yang dapat tumbuh hingga 40 inchi. Ikan buntal bersifat predator malam hari, hidup bersembunyi di celah-celah karang di siang hari dan mencari makan pada malam hari. Gigi yang menyatu bersama menjadi satu kesatuan, menciptakan mulut yang kuat dan dapat memecahkan kulit kerang siput, landak laut, dan kepiting yang merupakan makanan utama ikan buntal. Ikan buntal memiliki keunikan pada alat pencernaannya yaitu lambung yang mampu menggelembung, sebagai alat pertahanan dirinya selain racun yang terkandung dalam tubuhnya.
Jenis-jenis ikan buntal beracun yang terdapat di Indonesia, antara lain buntal duren (Diodon hytrix) dari famili Diodontidae yang bergigi lempeng dan kuat, buntal landak (Diodon holacanthus) yang bersirip 14 berduri lemah pada punggung dan dada serta pada sirip dubur terdapat 23 duri lemah. Buntal kotak (Rhynchostrcion nasus) dan buntal tanduk (Tetronomus gibbosus) berduri di kepalanya termasuk famili Ostraciontidae. Buntal kelapa (Arothron reticularis) yang berciri duri lemah antara 10 -11 pada sirip punggung, 9-10 pada sirip dubur
dan 18 pada sirip dada. Buntal pasir (Arthron immaculatus), Buntal tutul (A. aerostaticus) dan buntal pisang (Gastrophysus lunaris). Semua jenis ikan
buntal tersebut beracun, akan tetapi tingkat toksisitas diantara spesies-spesies tersebut berbeda.
Ikan buntal yang digunakan pada penelitian ini yaitu Arothron hispidus
(Gambar 2A) dan Diodon histryx (Gambar 2B). Ikan ini diidentifikasi di laboratorium oceanografi LIPI Cibinong dengan berpedoman pada buku Allen dan Erdmann (2012) dan Leis (1998). Arothron hispidus memiliki nama lokal ikan buntal pasir (white spoted puffer fish). Ikan ini memiliki ciri empat buah gigi (dua buah diatas yang besar dan dua buah dibawah yang tajam). Sirip dorsal sebanyak 10-11, sirip anal 10-11, dan sirip pektoral 17-19. Memiliki beberapa garis disepanjang bagian ventral menuju lateral, pada bagian dasar sirip pektoral dikelilingi beberapa garis putih, warna dasar tubuh coklat kehijauan, dan memiliki totol disepanjang tubuh (Allen dan Erdmann 2012).
Gambar 2 Ikan buntal Arothron hispidus (A), ikan buntal Diodon hystrix (B)
Diodon histryx merupakan nama latin untuk ikan buntal duren (spotted porcupinefish). Ikan ini memiliki duri keras di bagian depan kepala yang lebih pendek dibandingkan bagian pektoral. Duri di bagian dorsal 14-17; duri di bagian anal 13-16. Kulitnya coklat atau kuning langsat dibagian atas dan putih dibagian bawah, terdapat banyak bintik-bintik hitam yang tersebar pada tubuh dan sirip. Ikan ini hanya memiliki dua buah gigi (Leis 1998). Karakteristik fisik ikan buntal seperti morfometrik dan rendemen ikan buntal dapat dilihat pada Tabel 2 dan Gambar 2.
Tabel 2 Pengukuran morfometrik ikan buntal
Karakteristik Satuan Arothron hispidus Diodon histryx
Panjang total Cm 29,17 + 10,20 22,20 + 8,95
Lebar Cm 9,21 + 2,69 8,48 + 2,51
Tinggi Cm 10,83 + 3,17 10,43 + 1,54
Berat total Gram 1254,16 + 1058,18 795,91 + 778,34
Ikan buntal yang dipilih pada penelitian ini yaitu ikan dewasa dengan bobot diatas 200 gram. Hal ini berdasarkan penelitian dari Vazquez et al. (2013) yaitu racun terdeteksi pada daging, hati dan gonad ikan buntal Sphoeroides annulatus
dewasa usia 36 bulan dengan ukuran panjang 215,50 + 12,15 mm serta berat 260,20 + 22,45 gram. Racun hanya terdeteksi di jeroan ikan remaja pada usia 20 bulan (panjang 172,50 + 10,36 mm serta berat 137,54 + 37,37 gram) dan usia 24 bulan (panjang 173,00 + 13,50 mm serta berat 149,60 + 8,15 gram). Racun terdeteksi di daging ikan juvenile pada usia 4 bulan (panjang 13,20 + 2,14 mm serta berat 3,29 + 0,73 gram) dan usia 16 bulan (panjang 105,63 + 8,96 mm serta berat 34,04 + 3,90 gram) . Pemilihan ikan dewasa juga didasarkan pada penelitian Noguchi dan Arakawa (2008) yaitu ikan buntal tidak mensintesis racun tetapi mengakumulasinya dari rantai makanan, sehingga diasumsikan semakin dewasa ikan semakin tinggi kandungan racunnya.
Gambar 3 Persentase rendemen ikan buntal D. hystrix dan A. hispidus
yang cukup tinggi selain itu kulit ikan buntal cukup tebal dan elastis. Proporsi lainnya yang cukup tinggi yaitu lain-lain (kepala, tulang dan organ dalam selain hati, ovarium serta usus) dimana D. hystrix (44,48%) dan A. hispidus (23,96%). Abe (1960) menyatakan bahwa kepala ikan buntal lebih besar bila dibandingkan dengan bagian tubuh lainnya. Daging pada ikan buntal A. hispidus memiliki proporsi yang sangat besar yaitu 38,12%, daging ikan buntal ini berwarna putih dan sangat tebal. Berbeda dengan A. hispidus, daging D. hystrix proporsinya tidak terlalu besar hanya 7,94%. Proporsi rendemen setiap spesies ikan buntal berbeda-beda menurut Nurjanah et al. (2014) rendemen ikan buntal pisang memiliki persentase kepala 45,17%, jeroan 7,13%, daging 38,28% dan kulit 8,87%.
Informasi mengenai kandungan kimia dapat diketahui melalui analisis komposisi kimia atau proksimat yang terdiri dari beberapa uji, yaitu uji kadar air, kadar abu, kadar protein, dan kadar lemak, serta kadar kabohidrat dengan perhitungan by different. Hasil analisis proksimat disajikan pada Tabel 3.
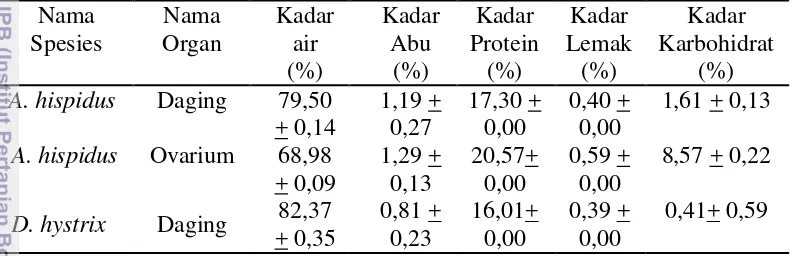
Tabel 3 Hasil analisis proksimat ikan buntal Nama
A. hispidus Ovarium 68,98 + 0,09
D. hystrix Daging 82,37 + 0,35
Tabel 3 menunjukan nilai kadar air daging dan ovarium A.hispidus masih lebih rendah bila dibandingkan kadar air daging Diodon hystrix, ikan buntal pisang Lagocephalus lunaris (81,22%) yang ada di Cirebon (Nurjanah et al. 2014) dan yang ada di India (80,32 %) serta ikan buntal L. inermis dari India (86,05%) (Eswar et al. 2014). Kadar air daging A.hispidus hampir sama dengan ikan buntal
Takifugu rubripes (78,9 %) (Saito dan Kunisaki 1998) dan L. sceleratus (78,47%) (Aydin et al. 2013). Menurut Eswar et al. (2014) ikan memiliki kadar air yang tinggi, hal ini sangat penting dalam menjaga stabilitas ikan ini selama bergerak.
Kadar abu dari daging dan ovarium A. hispidus dan lebih tinggi bila dibandingkan daging D. hystrix, daging ikan buntal pisang dari Cirebon (1,01 %) (Nurjanah et al. 2014) dan ikan buntal pisang dari India (0,96 %) (Eswar et al.
2014), serta lebih rendah bila dibandingkan dengan daging T. rubripes (1,4%) (Saito dan Kunisaki 1998), L. sceleratus (1,63%) (Aydin et al. 2013) dan
Kadar lemak dari daging, ovarium A. hispidus dan daging D. hystrix lebih rendah bila dibandingkan kadar lemak daging L. lunaris dari Cirebon (3,35%) (Nurjanah et al. 2014), L. lunaris dari India (11,25%), L. inermis (11,98%) (Eswar et al. 2014), dan T. rubripes (0,7%) (Saito dan Kunisaki 1998), tetapi lebih tinggi bila dibandingkan L. sceleratus (0,33%) (Aydin et al. 2013). Kandungan lemak sangat bervariasi, hal ini sangat tergantung pada spesis, umur, pemijahan, pakan dan tipe otot (Gehring et al. 2009). Lemak digunakan untuk kebutuhan energi jangka panjang, pergerakan dan cadangan energi selama periode kekurangan makanan. Lemak dalam tubuh menyediakan energi dua kali lebih besar dibandingkan protein (Sargent et al. 2002). Ikan dikenal sebagai penghasil
asam lemak ω-3 (PUFA) khususnya, eicosapentaenoic acid (EPA) dan
docosahexaenoic acid (DHA) yang bermanfaat bagi kesehatan. Konsumsi ikan ikan yang mengandung EPA dan DHA yang tinggi dapat mengurangi resiko penyakit jantung (Jacobsen 2004). Konsumsi EPA dan DHA juga dapat mencegah
berbagai penyakit seperti arthritis, inflamasi, kanker, dan kondisi psikologis (Larsen et al. 2011).
Kadar protein dari daging, ovarium A. hispidus dan daging D. hystrix lebih tinggi dibandingkan kadar protein daging ikan L. lunaris dari Cirebon (16,31%) (Nurjanah et al. 2014), L. lunaris dari India (9,22%), L. inermis (8,92%) (Eswar et al. 2014), dan T. rubripes (16,5%) (Saito dan Kunisaki 1998), sedangkan kadar protein L. sceleratus 21,62% (Aydin et al. 2013). Menurut Eswar (2014) variasi kadar protein pada ikan mungkin disebabkan oleh makanan dan habitat dari ikan tersebut. Ikan merupakan hewan laut yang kaya akan protein. Menurut Venugopal (2008), jumlah kandungan protein pada daging ikan mencapai 17-22%. Fungsi protein tersebut antara lain digunakan sebagai pembangun struktur utama dalam sel, enzim dan hormon. Protein merupakan sumber energi dan asam amino, yang penting untuk pertumbuhan dan perbaikan sel.
Dari analisis proksimat diketahui bahwa ikan buntal mempunyai nilai gizi yang memadai untuk suatu bahan pangan, tetapi pemanfaatannya sebagai makanan harus diwaspadai karena adanya kandungan racun pada tubuh ikan tersebut. Racun yang umum ditemui pada daging ikan buntal adalah tetrodotoksin dan saxitoksin. Racun ini menyebabkan keracunan dengan memblok saluran natrium dalam membran yang mengakibatkan terhentinya propagasi impuls syaraf. Tetrodotoksin maupun saxitoksin memiliki efek farmakologik yaitu dapat meningkatkan permeabilitas membran syaraf terhadap ion natrium (Noguchi dan Arakawa 2008).
Ekstraksi Racun Terpilih
Ekstrasi ikan buntal dilakukan menggunakan metode yang digunakan oleh Zhou et al. (2003), Chen dan Chou (1998), Founda (2005) dan Hasan et al.
(2008). Sampel yang digunakan untuk pemilihan metode ekstraksi ini adalah daging dari ikan buntal Arothron hispidus. Daging Arothron hispidus dipilih sebagai sampel karena jumlah rendemennya paling tinggi. Metode ekstraksi yang dilakukan oleh Founda (2005) adalah metode yang dipilih untuk mengekstraksi senyawa racun diantara keempat metode. Cara ekstraksi yang dilakukan Founda (2005) dipilih karena nilai LC50-nya terendah (87,95 ppm) dibandingkan cara lainnya meskipun tidak berbeda nyata dengan metode Hasan et al. (2008) dan Zhou et al. (2003). Data lengkap hasil penentuan cara ekstraksi ditampilkan pada Tabel 4.
Tabel 4 Hasil penentuan cara ekstraksi racun
Nama Metode Randemen Keterangan : angka-angka yang diikuti subscript berbeda menunjukkan hasil perlakuan yang
berbeda nyata (p<0,05)
Ekstraksi cara Founda (2005) menggunakan pelarut metanol yang ditambah 1% asam asetat. Racun-racun yang terdapat pada ikan buntal umumnya merupakan senyawa yang tingkat kepolarannya semi polar. Racun dengan struktur tetrodotoksin dan saxitoksin memiliki memiliki gugus guanidin yang tergolong basa kuat, dan diduga racun ini larut dalam metanol yang mengandung asam. Asam yang digunakan pada ekstrasi ini haruslah asam lemah, karena asam kuat dan basa kuat akan mendekomposisi racun dari ikan buntal. Pada metode ini juga dilakukan pemanasan yang berfungsi untuk menghilangkan skleroprotein.
Jenis Ikan dan Organ Ikan Buntal Paling Toksik
Setiap senyawa bioaktif pada dasarnya bersifat toksik tergantung pada besarnya konsentrasi. Pemeriksaaan toksisitas diperlukan untuk mengetahui berapa konsentrasi zat kimia yang dapat menyebabkan keracunan sehingga dapat diketahui berapa besarnya konsentrasi yang tepat (Purwaningsih 2006).
kepercayaan yang tinggi dibandingkan dengan uji in vitro dengan menggunakan sel lestari yang memerlukan biaya yang sangat mahal dan media serta keterampilan khusus (Meyer et al. 1982).
Hasil uji toksisitas ini diketahui dari jumlah kematian larva udang Artemia salina karena pengaruh ekstrak atau senyawa bahan tertentu pada media hidup larva. Larva udang yang ditetaskan selama 48 jam memiliki dinding yang lunak sehingga senyawa asing dalam air laut dengan mudah diserap dan langsung mempengaruhi kehidupan larva. Metode ini dilakukan dengan menentukan besarnya LC50 selama 24 jam. Nilai LC50 (lethal concentration) merupakan konsentrasi dari suatu zat pada suatu media lingkungan hidup yang dapat membunuh setengah dari populasi yang diamati dalam waktu tertentu. Nilai LC50 merupakan bentuk statistik yang didesain untuk menggambarkan respon yang mematikan komponen dalam beberapa populasi dari suatu percobaan. Secara kualitatif pengaruh letal merupakan tanggapan yang terjadi pada saat zat kimia mengganggu proses sel atau sub sel dalam makhluk hidup sampai suatu batas kematian. Setiap makhluk hidup mempunyai tingkat toleransi terhadap suatu rangsangan, jika di bawah tingkat tersebut maka respon tidak akan terjadi, dan jika di atasnya maka respon akan terjadi (Purwaningsih 2006).
Uji toksisitas menggunakan metode BSLT dapat diterapkan dalam menentukan tingkat toksisitas pada ikan buntal. Beberapa kasus keracunan akibat konsumsi ikan ini telah terjadi di Indonesia diantaranya pada tahun 2010 dan 2008 di Cirebon (Seo 2010). Kasus keracunan ikan buntal juga terjadi di beberapa daerah contohnya Tapanuli Tengah, Bengkulu dan Maluku. Racun pada ikan buntal biasanya digunakan oleh ikan ini sebagai alat pertahanan diri dari serangan predator.
Hasil penelitian (Tabel 5) terlihat bahwa ikan buntal yang berasal dari perairan pameungpeuk juga memiliki kadar racun yang tinggi dengan kisaran (29.65–190,27) ppm. Penentuan tingkat toksisitas ini didasarkan penelitian Meyer et. al (1982) yaitu suatu zat dianggap sangat toksik jika nilai LC50<30
Ovarium 3,57 29,65 + 0,0000 SangatToksik
Spesies Arothron hispidus lebih tinggi kandungan racunnya dibandingkan
Diodon hystrix. Hal ini dilihat dari nilai LC50-nya yang lebih rendah. Urutan toksik dari berbagai organ dari kedua ikan ini adalah daging > kulit > jantung > hati untuk
daging > kulit. Menurut Noguchi dan Arakawa (2008) racun pada ikan buntal paling tinggi terdistribusi di organ ovarium dan hati, diikuti oleh usus dan kulit. Daging dan testis merupakan organ yang umumnya tidak toksik atau toksisitasnya lemah, kecuali pada spesies Lagochephalus lunaris dan Chelonodon patoca. Penelitian lain mengenai racun ikan buntal telah dilakukan oleh Uddin et al. (2013). Hati
Tetraodon cutcutia sangat toksik dengan nilai LC50 0,75 ppm. Sampel yang terpilih dari penelitian ini adalah bagian organ ovarium dari spesies Arothron hispidus.
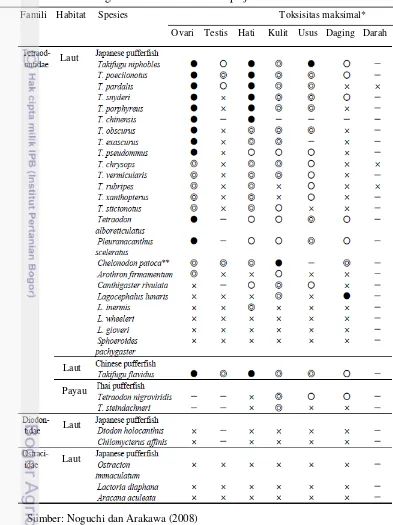
Tingkat toksisitas ikan buntal dipengaruhi oleh beberapa faktor yaitu jenis spesies, jenis kelamin, umur, musim, kondisi geografis, makanan, stimulus, dan lain-lain. Beberapa spesies ikan buntal ada yang tidak beracun, data tingkat toksisitas dari beberapa spesies dapat dilihat pada Tabel 6.
Jenis kelamin juga mempengaruhi tingkat toksisitas. Berdasarkan penelitian Itoi et al. (2012) gonad ikan buntal betina dan hati ikan buntal jantan memperlihatkan konsentrasi yang tinggi diikuti kulit pada ikan buntal jantan. Penelitian mengenai distribusi racun pada berbagai organ telah dilakukan. Kono et al. (2008) melaporkan penelitian mengenai juvenile ikan buntal
Fugu niphobles yang tidak beracun diberi makan hati Fugu poecilonotus selama 30 hari. Hasilnya racun dari makanan terakumulasi dalam hati lalu dipindahkan ke daging ke organ-organ lain melalui darah. Sedikit racun dipertahankan dalam hati, dan sebagian besar (> 96%) dari racun tetap di kulit. Ikeda et al. (2009) juga melaporkan melalui uji imunohistokimia terungkap bahwa racun yang terakumulasi di kulit terlokalisasi dalam sel-sel basal dari lapisan epidermis.
Umur dari ikan buntal juga sangat mempengaruhi tingkat toksisitas. Penelitian dari Vazquez et al. (2013) memperlihatkan racun terdeteksi pada ikan buntal Sphoeroides annulatus dewasa (daging, hati dan gonad), di juvenile dengan ukuran hanya pada daging, dan ikan remaja hanya jeroan.
Uji BSLT selain untuk menentukan toksisitas dapat juga digunakan sebagai tahap awal skrining penentuan aktivitas farmakologi suatu senyawa salah satunya antikanker. Beberapa penelitian tentang antikanker dari laut diantaranya penelitian Purwaningsih (2006) tentang keong matah merah. Keong ini mempunyai kandungan komponen bioaktif dengan nilai LC50 sebesar 10,84 ppm. Purwaningsih et al. (2008) menguji ekstrak ini terhadap sel kanker. Hasilnya menunjukkan bahwa ekstrak keong matah merah mampu menghambat sel lestari kanker, yaitu terhadap sel kanker servix HeLa sebesar 90,62%, sel kanker paru A549 sebesar 79,84%, dan sel kanker leukemia K562 sebesar 76,71%. Albuntana et al. (2011) meneliti potensi antikanker empat jenis teripang Actinopyga miliaris, Holothuria leucospilota, Bohadschia argus, dan Bohadschia marmorata dari Pulau Penjaliran Timur Taman Nasional Kepulauan Seribu, Jakarta. Hasilnya nilai LC50 ekstrak kasar dari keempat
jenis teripang yang diteliti hampir sama yaitu A.miliaris (70,536 μg/mL),
H. leucospilota (73,556 μg/mL), B. argus (69,254 μg/mL), dan B. marmorata
(77,063 μg/mL) dan bersifat aktif terhadap BSLT. Penelitian tentang antitumor dari
model tumor Ehrlich ascite carcinoma (EAC) pada tikus. Hasilnya aktivitas toksin menurunkan jumlah sel tumor. Efek sitotoksik tetrodotoksin pada sel juga terlihat jelas, menyebabkan apoptosis dan penurunan volume cairan peritoneal.
Tabel 6 Tingkat toksisitas dari beberapa jenis ikan buntal
Famili Habitat Spesies Toksisitas maksimal*
Ovari Testis Hati Kulit Usus Daging Darah
Sumber: Noguchi dan Arakawa (2008)
Keterangan : * x : <10 MU/g jaringan; O: 10-100 MU/g jaringan (toksisitas lemah); O :100-1000 MU/g jaringan (toksik); : > 1000 MU/g jaringan (sangat toksik),
dimana 1 MU (mouse unit) didefinisikan sebagai jumlah toksin yang dapat membunuh tikus jantan (berat badan 20 gr) dalam waktu 30 menit setelah intraperitoneal. Jumlahnya sebanding dengan 0,2 µg TTX. - : data tidak ada Laut
Laut
Toksisitas Akut Racun Ikan Buntal pada Tikus
Sistem syaraf pada mamalia dibagi menjadi dua bagian utama yaitu sistem syaraf pusat dan sistem syaraf perifer. Sistem syaraf pusat terdiri dari otak dan sumsum tulang belakang, sedangkan sistem syaraf perifer terdiri dari syaraf tengkorak dan spinal yang berupa syaraf motorik atau sensorik. Sel utama dalam susunan syaraf adalah neuron dan akson. Struktur sel ini bertanggung jawab terhadap penghantaran impuls syaraf (Lu 2006).
Otak terdiri dari beberapa bagian salah satunya yaitu hipokampus dan korteks serebri yang berfungsi mengatur memori dan kesadaran. Korteks serebrum yang berwarna kelabu terdapat bagian penerima rangsang (area sensor) yang terletak di sebelah belakang area motor yang berfungsi mengatur gerakan sadar atau merespon rangsangan (Price dan Wilson 2006). Otak dilindungi dari toksikan oleh sawar darah-otak, meskipun demikian otak rentan terhadap berbagai jenis toksikan. Kerentanan ini terjadi karena neuron mempunyai laju metabolisme yang tinggi, dengan sedikit kapasitas untuk metabolisme anaerobik. Sawar darah-otak efektif menjaga otak dari berbagai neurotoksin tetapi racun yang bersifat lipofilik dapat merusak otak (Lu 2006).
Racun pada ikan buntal termasuk neurotoksin atau racun syaraf. Racun ini akan menghambat proses impuls pada neuron sehingga impuls tidak akan sampai pada otak. Hal ini yang menyebabkan racun pada ikan buntal dapat digunakan sebagai obat anestesi atau analgesik. Ikan buntal diketahui memiliki mutasi pada sekuen protein dari pompa saluran natrium yang terdapat pada membran sel syaraf, dimana saluran ini merupakan titik kritis dari transmisi impulsa dan mediasi dari beberapa fungsi sel. Adanya mutasi ini mengakibatkan ikan buntal resisten terhadap racun, akibatnya racun tidak mengenali saluran natrium yang ada pada ikan buntal dan tidak dapat mengikat dan membloknya. Pada organisme lainnya yang tidak terjadi mutasi pada membran sel syaraf, maka organisme ini rentan mengalami keracunan terutama bila dosisnya melebihi ambang batas. Ambang batas racun tetrodotoksin pada manusia adalah 2 mg.
Pengaruh racun ikan buntal pada hipokampus
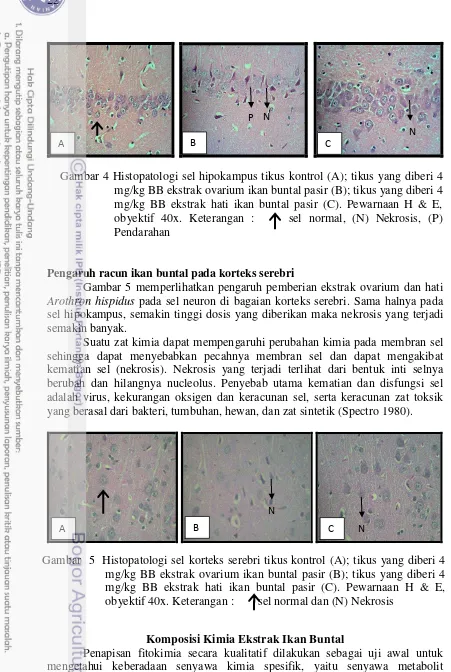
Gambaran histologi tikus kontrol menunjukkan sel hipokampus normal yang utuh dan bentuk inti sel yang hampir sama (Gambar 4A). Pemberian ekstrak ovarium dosis 0,25 mg/kg BB tidak terlalu menunjukkan perubahan pada sel
hipokampus. Perubahan mulai terjadi ketika tikus diberi ekstrak ovarium 1 mg/kg BB. Dosis tersebut mengakibatkan terjadinya nekrosis. Nekrosis
Gambar 4 Histopatologi sel hipokampus tikus kontrol (A); tikus yang diberi 4 mg/kg BB ekstrak ovarium ikan buntal pasir (B); tikus yang diberi 4 mg/kg BB ekstrak hati ikan buntal pasir (C). Pewarnaan H & E, obyektif 40x. Keterangan : sel normal, (N) Nekrosis, (P) Pendarahan
Pengaruh racun ikan buntal pada korteks serebri
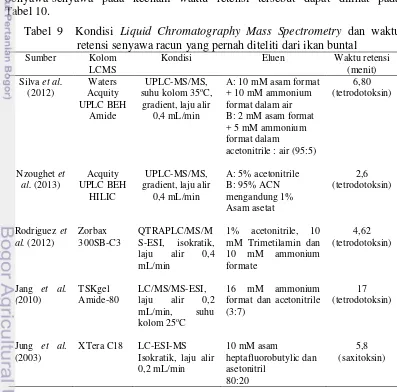
Gambar 5 memperlihatkan pengaruh pemberian ekstrak ovarium dan hati
Arothron hispidus pada sel neuron di bagaian korteks serebri. Sama halnya pada sel hipokampus, semakin tinggi dosis yang diberikan maka nekrosis yang terjadi semakin banyak.
Suatu zat kimia dapat mempengaruhi perubahan kimia pada membran sel sehingga dapat menyebabkan pecahnya membran sel dan dapat mengakibat kematian sel (nekrosis). Nekrosis yang terjadi terlihat dari bentuk inti selnya berubah dan hilangnya nucleolus. Penyebab utama kematian dan disfungsi sel adalah virus, kekurangan oksigen dan keracunan sel, serta keracunan zat toksik yang berasal dari bakteri, tumbuhan, hewan, dan zat sintetik (Spectro 1980).
Gambar 5 Histopatologi sel korteks serebri tikus kontrol (A); tikus yang diberi 4 mg/kg BB ekstrak ovarium ikan buntal pasir (B); tikus yang diberi 4 mg/kg BB ekstrak hati ikan buntal pasir (C). Pewarnaan H & E, obyektif 40x. Keterangan : sel normal dan (N) Nekrosis
Komposisi Kimia Ekstrak Ikan Buntal
Penapisan fitokimia secara kualitatif dilakukan sebagai uji awal untuk mengetahui keberadaan senyawa kimia spesifik, yaitu senyawa metabolit sekunder yang diharapkan merupakan racun pada ikan buntal. Penapisan fitokimia
A B C N
N B
A
P
C N
ini berdasarkan pada metode Harborne (1987). Hasil pengujian analisis fitokimia dapat dilihat pada Tabel 7.
Data Tabel 7 menunjukkan bahwa ovarium Arothron hispidus positif (+) mengandung alkaloid, karbohidrat dan asam amino. Uddin et al. (2013) melaporkan bahwa organ hati ikan buntal cutcutia positif mengandung alkaloid, alkohol dan glikosida, sedangkan bagian dorsal, kepala dan ekornya positif mengandung alkohol, amida dan glukosida. Senyawa racun yang pernah teridentifikasi dari ikan buntal adalah tetrodotoksin dan saxitoksin yang keduanya tergolong kelompok alkaloid. Kedua racun ini memiliki gugus guanidin dimana pada kondisi pH tubuh manusia akan terionisasi dan menggantikan ion natrium dan menyumbat saluran VGSC (Voltage-Gate Sodium Channels). Akibat penyumbatan ini, penjalaran aksi potensial terhambat sehigga melumpuhkan fungsi syaraf dan otot (Bradley 2014; Lee et al. 2008). Ikan buntal Ostracion lentiginosus yang berasal dari Hawai juga mempunyai racun berupa pahutoksin yang diisolasi dari kulitnya (Bhakuni dan Rawat 2005)
Tabel 7 Hasil uji fitokimia ekstrak ovarium Arothron hispidus
Keterangan: (+): Terdeteksi, (-): tidak terdeteksi
Beberapa organisme air juga memiliki racun yang berupa alkaloid, misalnya sponge memiliki racun latruculin, petrosin, dibromosceptrin dan clathrodin sebagai sistem pertahanan dirinya (Proksch dan Ebel 1998; Rentas et al. 1995). Kulit beberapa amphibi juga memiliki racun misalnya Batrachotoksin, histrionikotoksin, gepirotoksin, dekahidroquinolin, pumiliotoksin homopumiliotoksin, epibatidin, dan samandarin (Daly 1995). Kerang-kerangan juga memiliki racun yaitu gonyautoksin yang merupakan neurotoksin (racun syaraf). Tunikata Cystodytes dellechiajei dari Okinawa memiliki sembilan racun alkaloid berupa alkaloid piridoakridin tetrasikslik bernama cystodytins A-I yang sitotoksik terhadap sel leukemia L1210 (Bhakuni dan Rawat 2005).
Pemurnian dan Pencirian Komponen
Ekstrak kasar ovarium difraksinasi menggunakan kromatografi cair vakum (KCV). Sebanyak 43 eluat diuji pola pemisahannya menngunakan KLT dengan eluen butanol: asam asetat : air (2:1:1). Eluat-eluat yang memiliki pola pemisahan yang mirip digabung dan diperoleh 5 fraksi. Kelima fraksi ini diuji toksisitasnya dengan uji BSLT dan datanya ditampilkan pada Tabel 8.
Data Tabel 8 menunjukkan bahwa fraksi D mempunyai nilai LC50 2,35 ppm yang kategorinya sangat toksik (Meyer et al. 1982) dibanding fraksi lainnya. Berdasarkan nilai ini, fraksi D dilanjutkan ke tahap berikutnya yaitu tahap identifikasi senyawa.
Tabel 8 Data hasil pengujian toksisitas kelompok fraksi
Fraksi Bobot (g) Nilai LC50 (ppm) Toksisitas
A 0,81 32.499,00 Tidak toksik
B 1,30 10.731,00 Tidak toksik
C 2,46 8.257,00 Tidak toksik
D 3,82 2,35 Sangat toksik
E 1,06 847,50 Toksik
Fraksi D dipisahkan kembali menggunakan Kromatografi Lapis Tipis Preparatif (KLTP) menggunakan eluen butanol: asam asetat : air (2:1:1). Gambar 5 memperlihatkan hasil KLTP dimana terlihat adanya empat spot pada Rf1= 0,20-0,30 (0,0557 gram), Rf2 = 0,62-0,76 (0,6043 gram), Rf3 = 0,79-0,85 (0,2074 gram), dan Rf4 = 0,89-0,97 (0,4399 gram). Berdasarkan penelitian Zhou dan Shun (2003) senyawa racun terdeteksi dengan KLT menggunakan eluen butanol: asam asetat : air (2:1:1) pada Rf = 0,30-0,40, sehingga senyawa yang ada pada Rf1 dianalisis lebih lanjut menggunakan alat UPLC-QTOF/MS.
Gambar 6 Kromatogram fraksi D Kromatografi Lapis Tipis Preparatif dengan eluen butanol:asam asetat:air (2:1:1), diamati pada lampu UV 366 nm. Keterangan: Rf= retention factor
Hasil analisis LC-MS spot Rf1 menunjukkan bahwa spot ini masih mengandung banyak komponen, hal ini ditunjukkan dengan munculnya banyak puncak (18 puncak) pada rentang waktu retensi 0,73-18,27 menit. Kromatogram Rf1 dapat dilihat pada Gambar 7.
Rf1 = 0,20-0,30 (0,0557 gr)
EKA
Time 1.00 2.00 3.00 4.00 5.00 6.00 7.00 8.00 9.00 10.00 11.00 12.00 13.00 14.00 15.00 16.00 17.00 18.00 19.00
%
Gambar 7 Kromatogram LCMS Fraksi D pada Rf1
Pembacaan kromatogram pada Gambar 7 difokuskan pada waktu retensi 2,6-17 menit, hal ini berdasarkan kajian beberapa penelitian yang dapat dilihat pada Tabel 9. Pada rentang waktu tersebut terdapat enam puncak pada waktu retensi 6,21, 11,93, 12,77, 14,31, 15,10, dan 16,15 menit yang memiliki persentase kemiripan senyawa sangat tinggi sedangkan lima puncak lainnya memiliki persentase kemiripan senyawa sangat rendah kurang dari 50%. Senyawa-senyawa pada keenam waktu retensi tersebut dapat dilihat pada Tabel 10.
Tabel 9 Kondisi Liquid Chromatography Mass Spectrometry dan waktu retensi senyawa racun yang pernah diteliti dari ikan buntal
Sumber Kolom LCMS
Kondisi Eluen Waktu retensi
Tabel 10 Senyawa-senyawa pada rentang waktu retensi 2,6-17 menit
H 50 100 150 200 250 300 350 400 450 500 550 600 650 700 750 800 850 900 950 1000 1050 1100 1150
%
Gambar 8 Spektrum massa pada waktu retensi 6,21 menit
Gambar 9 Fragmentasi senyawa curvulin
Curvulin merupakan kristral berwarna putih dan tak berbau, memiliki titik leleh 145oC. Senyawa ini merupakan turunan dari asam fenilasetat. Curvulin (etil 3,5-dihidroksifenilasetat), asam curvulinik (asam 2-asetil l-3,5-dihidroksifenilasetat) dan curvulol (4-asetil-5-b-hidroksietil resorsinol) pertama kali diisolasi dari fungi Curvularia shidiqui oleh Kamal pada tahun 1963. Varma et al. (2006) melaporkan senyawa curvulin ini tidak memiliki aktivitas antioksidan, aktivitasnya dalam menghambat radikal DPPH kurang dari 10 %. Curvulin juga tidak memiliki aktivitas antibakteri dan antifungi karena kurang aktif terhadap E. coli, Salmonella choleraesuis, Staphylococcus aureus, Bacillus subtilis, Klebsiella pneumoneae (ATCC 10031), Pseudomonas aeruginosa
(ATCC 27853) dan Candida albicans (ATCC 10231).
Curvulin juga terdeteksi di beberapa fungi yaitu Curvularia shidiqui,
Dreschela indica dan xylaria sp. Kenfield et al. (1989) melaporkan senyawa curvulin yang diisolasi dari Drechslera indica merupakan fitotoksin yang
(Parasit atau simbiosis)
menyebabkan nekrosis pada krokot dan tanaman bayam sehingga dapat digunakan sebagai herbisida. Arunpanichlert et al. (2012) menemukan adanya senyawa curvulin dari fungi Bipolaris sp. yang diisolasi dari lamun Halophila ovalis. Lamun merupakan makanan bagi bulu babi (konsumen pertama) yang kemudian dimakan oleh ikan buntal sebagai konsumen kedua. Senyawa ini beracun bila tertelan dan terhirup, serta menyebabkan iritasi pada mata. Senyawa curvulin diperkirakan dapat masuk kedalam tubuh ikan buntal melalui rantai makanan, ataupun simbion yang hidup didalam tubuh ikan dan memproduksi senyawa curvulin.
Menurut Noguchi dan Arakawa (2008) racun ikan buntal bervariasi berdasarkan spesies dan regional/daerah (1), racun didistribusikan ke berbagai organisme, termasuk binatang yang merupakan makanan ikan buntal (2), trumpet shell mengakumulasi racun dengan menelan racun pada bintang laut (3), bakteri menghasilkan tetrodotoksin, menunjukkan bahwa ikan buntal tidak mensintesis tetrodotoksin tetapi terakumulasi melalui rantai makanan yang dimulai dari bakteri laut (4). Hal ini terlihat dari hasil penelitian dimana ikan buntal menjadi tidak beracun ketika diberi makanan diet bebas tetrodotoksin. Mekanisme akumulasi racun dapat dilihat pada gambar 10.
: Rantai makanan
: Parasitisme/simbiosis; dekomposisi
Gambar 10 Mekanisme akumulasi racun pada hewan laut Sumber: Noguchi dan Arakawa (2008)
Pada penelitian ini racun tetrodotoksin (Gambar 11) yang merupakan racun utama dalam ikan buntal tidak terdeteksi. Hal ini diperkirakan terjadi akibat beberapa faktor. Struktur dari tetrodotoksin terdiri dari gugus perhidroquinozolin dan enam buah gugus hidroksil. Gugus hidroksil inilah yang membuat tetrodotoksin tidak stabil. Tetrodotoksin juga sangat mudah terdekomposisi oleh asam kuat, karena memiliki struktur inner ester (Zhou et. al 2003). Struktur dari tetrodotoksin yang memiliki gugus siklik hemiasetal lebih stabil bila dibadingkan hemiasetal. Ketika melakukan
Vibrio alginolyticus
Racun diproduksi Shewanella alga, S. putrefaciens bakteri laut Alteromonas tetraodonis, dll
pemurnian akan banyak hemiasetal yang terdekomposisi untuk mempertahankan kesetimbangan. Menurut Tsuruda (2002) tetrodotoksin akan dihasilkan oleh ikan buntal bila diberi stimulus. Stimulus ini dapat berupa rangsangan ekstrim dengan listrik atau rangsangan yang lebih ringan misalnya diseka dengan kain kassa.
SIMPULAN DAN SARAN
Simpulan
Hasil penelitian menunjukkan bahwa ikan buntal dewasa yang diambil dari Perairan Pameungpeuk memiliki kadar air dan protein yang tinggi. Metode ekstraksi racun yang terpilih adalah metode Founda diantara dua ikan buntal yang diteliti, nilai toksisitas tertinggi yaitu organ ovarium Arothron hispidus dengan nilai LC50 yaitu 29,65 ppm dan. Ekstrak ovarium ini mengandung alkaloid, karbohidrat dan asam amino. Pencirian dengan LCMS dilakukan pada hasil fraksinasi KCV dan KLTP dengan pendugaan racun berada di fraksi D pada Rf1. Berdasarkan hasil LCMS senyawa racun yang ada Rf1 diduga senyawa curvulin. Hasil histologi sel hipokampus dan korteks serebri memperlihatkan semakin tinggi dosis ekstrak ovarium dan hati Arothron hispidus yang diberikan maka jumlah sel yang nekrosispun semakin banyak.
Saran
Penelitian lebih lanjut perlu dilakukan pengujian pengaruh ekstrak yang sudah murni terhadap organ hati dan ovarium. Penelitian mengenai sintesis tetrrodotoksin juga perlu dilakukan karena kelimpahan ikan buntal di Pameungpeuk tergantung pada musim.
DAFTAR PUSTAKA
Abe T. 1960. Taxonomic studies on the puffers from Japan and Adjacent Regions-Corrigenda and Addenda. Part II. Japanese Journal of Ichthyology. 8:3-6. Albuntana A, Yasman, dan Wardhana W. 2011. Uji toksisitas ekstrak empat jenis
teripang suku holothuriidae dari Pulau Penjaliran Timur, Kepulauan Seribu, Jakarta menggunakan brine shrimp lethality test (BSLT). Jurnal Ilmu dan Teknologi Kelautan Tropis, 3 (1): 65-72.
Allen, GR dan Erdman, MV. 2012. Reef Fishes of The East Indies. Volume I-III. Australia: Tropical Reef Research.
[AOAC] Association of Official Analytical Chemist. 2005. Official Method of Analysis of the Association of Official Analytical of Chemist. Arlington: The Association of Official Analytical Chemist, Inc.
Arunpanichlert J, Rukachaisirikul V, Tadpetch K, Phongpaichit S, Hutadilok-Towatana N, Supaphon O, Sakayaroj J. 2012. A dimeric chromanone and a phthalide: Metabolites from the seagrass-derived fungus Bipolaris sp. PSU-ES64. Phytochemistry Letters, 5(3): 604–608
Aydın M, Tufan B, SevgiliH and Köse S. 2013. Seasonal changes in proximate
composition and fatty acid profile of pufferfish (Lagocephalus sceleratus
gmelin, 1789) from the Mediterranean sea of Turkey. Journal of Aquatic Food Product Technology. 22(2) : 178-191.
Bane V, Lehane M. Dikshit M, O’Riordan A. Furey A. 2014. Tetrodotoxin: