TINJAUAN PUSTAKA
2.1Tumbuhan Bunga Kupu-kupu Rambat (Bauhinia kockiana Lour)
2.1.1 Sistematika Tumbuhan Bunga Kupu-kupu Rambat (Herbarium Medanense, 2016)
Kingdom : Plantae
Divisi : Spermatophyta Class : Dicotyledoneae Ordo : Fabales
Famili : Caesalpineaceae Genus : Bauhinia
Spesies : Bauhinia kockiana (Lour).
Nama Lokal : Bunga kupu-kupu rambat
2.1.2 Morfologi dan Manfaat Tumbuhan
2.2Senyawa Organik Bahan Alam
Pada hakekatnya kimia bahan alam merupakan pengetahuan yang telah dikenal sejak peradaban manusia tumbuh. Contohnya adalah pembuatan bahan makanan, pewarnaan benda, obat-obatan atau stimulan, dan sebagainya.
Para kimiawan pada akhir abad ke delapan belas mulai mengakhiri kepercayaan dunia mitos ke ilmu pengetahuan modern, dan diantara para ilmuan sangat antusias untuk menguak sifat-sifat yang sebenarnya dari bahan ekstrak yang diperoleh dari alam. Mereka mulai memisahkan, memurnikan, dan akhirnya menganalisis senyawa-senyawa yang dihasilkan dari sel-sel hidup. Seiring dengan kemajuan ilmu pengetahuan maka perkembangan kimia bahan alam tidak lagi diragukan hingga sekarang (Sastrohamidjojo, 1996).
Biogenesis dari produk alami, meskipun pada mulanya berkaitan dengan kimia organik dan biokimia, menjadi berlainan karena mempunyai tujuan yang berlainan. Kimia organik terutama mempelajari struktur, sifat-sifat kimia dan fisika, serta cara sintesisnya, baik secara alami ataupun in vitro dari zat-zat kimia tetapi cenderung untuk mengabaikan sifat-sifat khusus dari bahan alam, misalnya tentang cara pembentukan dan peran biologisnya. Biokimia, berusaha menjawab pertanyaan-pertanyaan yang paling banyak diajukan terutama tentang metabolisme primer, dan mengabaikan proses-proses sekunder misalnya tentang pembentukan alkaloid, terpena dan lain-lain (Manitto, 1981).
1. Klasifikasi Berdasarkan Struktur Kimia
Klasifikasi ini adalah klasifikasi formal berdasarkan kerangka struktur molekul, yaitu: a. Senyawa lemak rantai terbuka atau alifatik, seperti asam-asam lemak, gula-gula, dan
hampir semua asam amino
b. Senyawa sikloalifatik atau alisiklik, seperti terpenoid, steroid, dan beberapa alkaloid c. Senyawa benzenoid atau aromatik, seperti fenol dan kuinon.
d. Senyawa heterosiklik, seperti alkaloid, flavonoid, dan basa-basa nukleat.
2. Klasifikasi Berdasarkan Aktivitas Fisiologi
Pengembangan bahan alam didahului dengan pengamatan dan pengalaman empirik khasiat bahan alam tersebut untuk menyembuhkan penyakit tertentu. Oleh karena itu, salah satu cara penyelidikan bahan obat dari tumbuhan atau bahan alam lainnya adalah melalui ekstraksi dan penetapan khasiat farmakologi ekstrak, diikuti dengan isolasi komponen murni.
3. Klasifikasi Berdasarkan Taksonomi
Pengetahuan tentang kandungan komponen tumbuhan berkembang dengan sangat pesat karena berkembangnya metode ekstraksi, isolasi dan karakterisasinya. Hal ini mendorong berkembangnya suatu bidang baru yang disebut kemotaksonomi (chemotaxonomy) atau sistematik kimia (chemosystematic) yang mengarah ke pembagian kandungan tumbuhan berdasarkan taksa tumbuhan. Dengan kata lain, isi kandungan tumbuhan dianggap sebagai tanda bagi evolusi dan kalsifikasi tumbuhan.
4. Klasifikasi Berdasarkan Biogenesis
Biogenesis dan biosintesis memiliki arti yang sama dan sering kali digunakan tanpa perbedaan. Namun, istilah biogenesis biasanya digunakan untuk reaksi pembentukan yang masih dalam taraf hipotesis, sedangkan jika reaksi tersebut telah dibuktikan secara eksperimen, digunakan istilah biosintesis.
Sebagian besar bahkan hampir semua, senyawa kandungan kimia bahan alam adalah senyawa organik, dan sumber utama senyawa karbon atau senyawa organik ini adalah glukosa yang dibentuk melalui fotosintesis di dalam tumbuhan autotropik atau diperoleh dari organisme heterotrof.
Berbagai teori tentang pembentukan senyawa metabolit primer dan metabolit
Komponen pembangun utama untuk atom-atom karbon dan nitrogen di dalam semua senyawa bahan alam berasal dari 5 kelompok prekursor, yaitu:
Asetil ko-A
Malonil ko-A unit 2C(Me-C
O
) poliketida (asetogenin)
a.
b. asam sikimat unit 6C-3C (6C-1C atau 6C-2C) senyawa fenolik c. asam mevalonat unit prenil isoprenoid
CH2=C-CH2-CH2
Me
d. unit asam amino seperti fenilanalina, tirosina, ornitina, lisina, dan triptofan alkaloid
e.
5-5'-deoksiadenilmetionina unit 1C (Wiryowidagdo, 2008).2.3 Metabolit Sekunder
Fisik tanaman sebagian besar terdiri atas air. Kandungan air mencapai lebih dari 90% pada daun, bunga, buah (buah yang berair banyak), dan bagian tanaman yang berada di bawah tanah. Pada jaringan yang miskin organ penyimpan, kandungan airnya menurun hingga sekitar 50%, yaitu pada kulit dan kayu. Yang mengandung air paling sedikit adalah biji, umumnya mengandung ±10%.
Banyak senyawa kimia tanaman yang telah diisolasi dan dipublikasikan sebelum diketahui strukturnya. Pengelompokan senyawa kimia tanaman berdasarkan sifat khas yang dimilikinya (antara lain warna, rasa, bau, pH, kelarutan), merupakan hal penting sehingga sampai sekarang masih banyak dipakai. Berikut ini contoh pengelompokan senyawa kimia (Sirait, 2007)
A.Minyak Atsiri. Baunya khas dan dapat dipisahkan dari senyawa kimia tanaman lainnya, karena sukar larut dalam air dan dapat menguap bersama uap air.
B.Alkaloid. Pertemuan dua sifat basa dan kerja farmakologi, pada umumnya dimiliki oleh senyawa kimia yang mengandung N. Setelah empat puluh tahun sejak penemuan Serturner, ditemukan lima puluh zat berkhasiat yang bersifat basa dari simplisia obat penting. Fraksinasi senyawa kimia dari tanaman berdasarkan sifat farmakologi saja sesuai percobaan dengan binatang mengalami banyak kesulitan. Penyebab sifat basa senyawa kimia tanaman yang sangat erat kaitannya dengan kerja farmakologi pada tubuh binatang dan manusia, belum diketahui dengan jelas.
C.Zat Pahit. Berpedoman pada rasa pahit adalah suatu metoda yang mudah untuk memisahkan senyawa kimia tanaman, perlu waktu yang cukup hingga seluruh zat pahit dalam sari menjadi zat yang dapat dikristalkan. Tidak jarang zat pahit yang ditemukan secara bersamaan, kerja farmakologisnya dikenal mencolok. Contoh yang paling terkenal adalah glikosida yang bekerja pada jantung. Cara untuk mengisolasi glikosida jantung ini seperti pada zat pahit, jadi tidak dilakukan pengujian farmakologisnya terhadap jantung.
D. Zat Warna. Jumlah zat warna dari tanaman diperkirakan ±2000 jenis, 130 diantaranya merupakan bahan perdagangan yang penting. Jumlah zat warna yang sekarang benar-benar dipakai (misalnya pewarna makanan) sangat kecil. Contohnya bisein, saran, kuersetin. Pigmen tanaman mempunyai struktur kimia yang berlainan, begitu juga sifat fisika, kelarutan, warna, fluoresens, dan sebagainya.
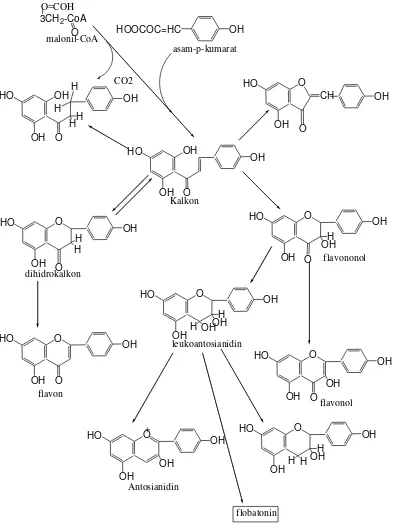
Semua varian flavonoid saling berikatan karena alur biosintesis yang sama, yang memasukkan prazat dari alur sikimat dan alur asetil-malonat, flavonoid pertama dihasilkan segera setelah kedua alur ini bertemu. Sekarang, flavonoid yang dianggap pertama kali terbentuk pada biosintesis ialah khalkon, dan semua bentuk lain diturunkan darinya melalui berbagai alur.
2.4.1 Jalur Metabolisme Flavonoid
Prazat flavonoid sensiri sudah diketahui tanpa keraguan sebagai hasil dari banyak percobaan penuntun, tetapi masih banyak pertanyaan yang belum terjawab mengenai jalur yang diikuti. Seiring teramati bahwa dalam sesies tumbuhan tertentu semua flavonoid yang berbeda-beda mempunyai pola hidroksilasi cincin yang sama, perbedaan hanya pada metilasi, glikosilasi, dan struktu bagian C-3. Hal ini menunjukkan bahwa terdapat senyawa antara C-15 yang umum yang diubah menjadi berbagai flavonoid setelah pola hidroksilasi cincin terbentuk. Akan tetapi, tampaknya berbagai jenis hidroksil ini sesungguhnya dimasukkan pada tahap yang berlainan dalam sintesis.
O
2.4.2 Klasifikasi Senyawa Flavonoida
Dalam tumbuhan, flavonoid terdapat dalam berbagai bentuk struktur. Keragaman struktur flavonoid ini disebabkan karena perbedaan tahap modifikasi dari struktur dasar flavonoid, antara lain:
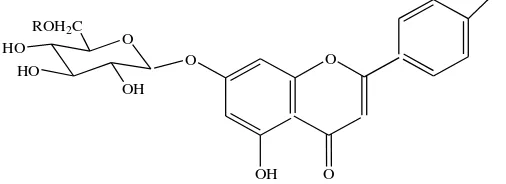
1. Flavonoid O-glikosida
Flavonoid biasanya terdapat sebagai flavonoid-O-glikosida (Gambar 2.2), pada senyawa tersebut satu gugus hidroksil flavonoid (atau lebih) terikat pada satu gula (atau lebih) dengan ikatan hemiasetal yang tak tahan asam. Pengaruh glikosilasi menyebabkan flavonoid menjadi kurang reaktif dan lebih muda larut dalam air (cairan); sifat terakhir ini memungkinkan penyimpanan flavonoid didalam vakuol sel (disinilah biasanya flavonoid berada. Walaupun gugus hidroksil pada setiap posisi dalam inti flavonoid dapat diglikosilasi, kenyataannya hidroksil pada tempat tertentu mempunyai peluang yang lebih besar untuk terglikosilasi ketimbang tempat-tempat lain, misalnya 7-hidroksil pada flavon, isoflavon dan dihidroflavon, 3-(dan 7-)hidroksil dalam flavonol dan dihidroflavonol; dan 3-(dan 5-)hidroksil dalam antosianidin. Sudah diakui bahwa dalam tumbuhan O-glikosilasi (dan metilasi) terjadi sebagai salah satu tahap akhir pada biosintesis dan katalisasi oleh enzim yang sangat khas. Ada kalanya glikosida mengalami modifikasi lebih lanjut, yaitu asilasi. Glikosida terasilasi mempunyai satu gugus hidroksil gula yang berkaitan dengan asam seperti asam asetat atau asam ferulat.
O O
OH
OH
O O ROH2C
HO HO
OH
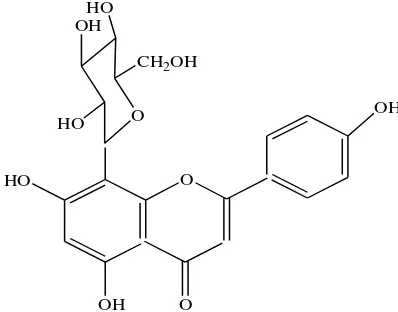
2. Flavonoid C-glikosida
Gula dapat juga terikat pada atom karbon flavonoid dan dalam hal ini gula tersebut terikat terikat langsung pada inti benzena dengan satu ikatan karbon-karbon yang tahan asam (dibanding dengan O-glikosida). Glikosida yang demikian disebut C-glikosida (Gambar 2.3). Sekarang gula yang terikat pada atom C hanya ditemukan pada atom C nomor 6 dan 8 dalam inti flavonoid. Jenis gula yang terlibat ternyata jauh lebih sedikit ketimbang jenis gula pada O-glikosida, biasanya dari jenis glukosa yang paling umum, dan juga galaktosa, ramnosa, xilosa dan arabinosa. Jenis aglikon flavonoid yang terlibat pun sangat terbatas. Jadi, walaupun isoflavon, flavanon, dan flavonol kadang-kadang terdapat dalam bentuk C-glikosida, sebegitu jauh hanya flavon C-glikosida yang paling lazim ditemukan.
O O HO
OH
OH O
CH2OH
HO OH
HO
Gambar 2.3 Flavonoid-C-Glikosida (Markam, 1988)
3. Flavonoid Sulfat
Golongan flavonoid lain yang mudah larut dalam air yang mungkin ditemukan hanya flavonoid sulfat. Senyawa ini mengandung satu ion sulfat atau lebih, yang terikat pada hidroksil fenol atau gula. Secara teknis senyawa ini sebenarnya bisulfat karena terdapat sebagai garda, yaitu flavon-O-SO3K. Banyak yang berupa
4. Biflavonoid
Seperti yang ditunjukkan oleh namanya, biflavonoid (Gambar 2.4) adalah flavonoid dimer, walaupun prosianidin dimer biasanya tidak dimasukkan ke dalam golongan ini. Flavonoid yang sering terlibat adalah flavon dan flavonon yang secara biosintesis mempunyai pola oksigen yang sederhana dan ikatan antar flavonoid berupa ikatan karbon-karbon atau kadang-kadang ikatan eter. Monomer flavonoid yang digabungkan menjadi biflavonoid dapat berjenis sama atau berbeda, dan letak ikatannya berbeda-beda.
O
Gambar 2.4 Biflavonoid (Markam, 1988)
5. Aglikon flavonoid yang aktif-optik
Aglikon flavonoid mempunyai atom karbon asimetrik dan dengan demikian menunjukkan keaktifan optik (yaitu memutar cahaya terpolarisasi-datar). Yang termasuk dalam golongan flavonoid ini adalah flavonon, dihidroflavonol, kafein, pterokarpan, rotenoid, dan beberapa biflavonoid. Putaran aglikon flavonoid alam berkaitan dengan stereokimia mutlak flavonoid.
O
Menurut Robinson (1995), flavonoida dapat dikelompokkan berdasarkan keragaman pada rantai C3 yaitu :
1. Flavonol
Flavonol paling sering terdapat sebagai glikosida, biasanya 3-glikosida, dan aglikon flavonol yang umum yaitu kamferol, kuersetin, dan mirisetin yang berkhasiat sebagai antioksidan dan antiimflamasi. Larutan flavonol dalam suasana basa dioksidasi oleh udara tetapi tidak begitu cepat sehingga penggunaan basa pada pengerjaannya masih dapat dilakukan.
O O
OH
Flavonol
2. Flavon
Flavon berbeda dengan flavonol dimana pada flavon tidak terdapat gugusan 3-hidroksi. Hal ini mempunyai serapan UV-nya, gerakan kromatografi, serta reaksi warnanya. Flavon yang paling umum dijumpai adalah apigenin dan luteolin. Jenis yang paling umum adalah 7-glukosida dan terdapat juga flavon yang terikat pada gula melalui ikatan karbon.
Flavon dianggap sebagai induk dalam nomenklatur kelompok senyawa flavonoida
O O
3. Isoflavon
Isoflavon tidak begitu menonjol, tetapi senyawa ini penting sebagai fitoaleksin. Senyawa yang lebih langka lagi ialah homoisoflavon. Senyawa ini biasanya larut dalam air panas dan alkohol meskipun beberapa flavonoid yang sangat termetilasi tidak larut dalam air.
O O
Isoflavon
4. Flavanon
Flavanon terdapat di dalam kayu, daun dan bunga. Flavanon glikosida merupakan konstituen utama dari tanaman genus prenus dan buah jeruk ; dua glikosida yang paling lazim adalah neringenin dan hesperitin, terdapat dalam buah anggur dan jeruk.
O O
Flavanon
5. Flavanonol
Senyawa ini berkhasiat sebagai antioksidan dan hanya terdapat sedikit sekali jika dibandingkan dengan flavonoida lain. Sebagian besar senyawa ini diabaikan karena konsentrasinya rendah dan tidak berwarna.
O O
6. Antosianin
Antosianin adalah pigmen daun bunga merah sampai biru yang biasa, banyaknya sampai 30% bobot kering dalam beberapa bunga. Antosianin terdapat juga dalam bagian lain tumbuhan tinggi kecuali fungus. Antosianin selalu terdapat dalam bentuk glikosida kecuali sesepora aglikon antosianidin. Hidrolisis dapat terjadi selama autolysis jaringan tumbuhan atau pada saat isolasi, sehingga antosianidin ditemukan sebagai senyawa jadian . Pada pH lebih rendah dari 2, antosianin berada sebagai kation (ion flavilium). Tetapi pada pH yang sedikit asam akan berbentuk kuinonoid.
O
OH
+
Antosianin
7. Katekin
Katekin dan proantosianidin adalah dua golongan senyawa yang mempunyai banyak kesamaan. Semuanya senyawa tanpa warna, terdapat pada seluruh dunia tumbuhan tetapi terutama dalam tumbuhan berkayu. Telah ditemukan satu epikatekin glukosida, dan beberapa katekin yang terdapat sebagai ester asam galat. Satuan katekin terdapat sebagai bagian dari berbagai senyawa oligomer dengan jenis lain fenilpropanoid, misalnya pada proantosianidin.
O
OH
OH HO
OH OH
Merupakan monomer flavan 3,4-diol, leukoantosianidin jarang terdapat sebagai glikosida, namun beberapa bentuk glikosida yang dikenal adalah apiferol, dan peltoginol.
O
OH HO
OH OH
HO OH
Leukoantosianidin
9. Auron
Berupa pigmen kuning emas terdapat dalam bunga tertentu dan bryofita. Dalam larutan senyawa ini menjadi merah ros.
O
CH
O
Auron
10. Kalkon
Pada kenyataan, pengubahan kalkon menjadi flavanon terjadi dengan mudah dalam larutan asam dan reaksi kebalikannya dalam basa. Reaksi ini mudah diamati karena kalkon warnanya jauh lebih kuat daripada warna flavanon, terutama dalam larutan basa warnya merah jingga. Oleh karena itu, hidrolisis glikosida kalkon dalam suasana asam menghasilkan aglikon flavanon sebagai senyawa jadi, bukan kalkon.
2.5Skrining Fitokimia
Banyak reagen yang dapat digunakan untuk mengetahui keberadaan dari flavonoid, meskipun beberapa juga akan bereaksi positif dengan senyawa polifenol. Reagen yang biasa digunakan adalah :
1. Shinoda Test, yaitu dengan menambahkan serbuk magnesium pada ekstrak sampel dan beberapa tetes HCl pekat, warna orange, pink, merah sampai ungu akan terjadi pada senyawa flavon, flavonol, turunan 2,3-dihidro dan xanton. Penggunaan zinc sebagai pengganti magnesium dapat dilakukan, dimana hanya flavanonol yang memberikan perubahan warna merah pekat sampai magenta, flavanon dan flavonol akan memberi warna merah muda yang lemah sampai magenta.
2. H2SO4(p), flavon dan flavonol akan memberikan perubahan larutan kuning pekat.
Kalkon dan auron menghasilkan larutan berwarna merah atau merah kebiru-biruan. Flavanon memberikan warna orange sampai merah (Cannell, 1998). 3. NaOH 10% , menghasilkan larutan biru violet
4. FeCl3 5% telah digunakan secara luas untuk mengidentifikasi senyawa fenol,
tetapi tidak dapat digunakan untuk membedakan macam-macam golongan flavonoid. Pereaksi ini memberi warna kehijauan, warna biru, dan warna hitam-biru (Robinson, 1995).
2.6Teknik Pemisahan
Teknik pemisahan memiliki tujuan untuk memisahkan komponen yang akan ditentukan berada dalam keadaan murni, tidak tercampur dengan komponen-komponen lainnya. Ada 2 jenis teknik pemisahan:
1. Pemisahan kimia adalah suatu teknik pemisahan yang berdasarkan adanya perbedaan yang besar dari sifat-sifat fisika komponen dalam campuran yang akan dipisahkan.
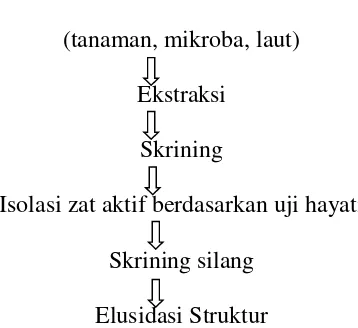
Biomassa (tanaman, mikroba, laut)
Ekstraksi Skrining
Isolasi zat aktif berdasarkan uji hayati Skrining silang
Elusidasi Struktur
Gambar 2.6 Diagram Teknik Pemisahan Metabolit Sekunder 2.6.1 Ekstraksi
Sampel yang berasal dari tanaman setelah diidentifikasi, kemudian digolongkan menjadi spesies dan famili, sampel kemudian dikumpulkan dari bagian arialnya (daun, batang, kulit kayu pada batang, kulit batang, dan akar). Sampel ini kemudian dikeringkan dengan cara diangin-anginkan untuk menghindari penguraian komponen oleh udara atau mikroba.
Jika telah dikeringkan, biomassa kemudian digiling menjadi partikel-partikel kecil menggunakan blender atau penggilingan. Proses penggilingan ini penting karena ektraksi efektif pada partikel kecil, dikarenakan memiliki luas permukaan yang lebih besar.
Pemilihan pelarut ekstraksi sangat penting. Jika tanaman diteliti dari sudut pandang etnobotani, ektraksi harus mengikuti pemakaiannya secara tradisional. Kegagalan mengekstraksi biomassa dapat menyebabkan kehilangan akses untuk mendapatkan zat aktif.
mempermudah proses isolasi. Ekstraksi dingin memungkinkan banyak senyawa terekstraksi, meskipun beberapa senyawa memiliki kelarutan terbatas dalam pelarut ekstraksi pada suhu kamar (Heinrich , 2010).
Ekstraksi dianggap selesai bila tetesan terakhir memberikan reaksi negatif terhadap senyawa yang diekstraksi. Untuk mendapatkan larutan ekstrak pekat, biasanya pelarut ekstrak diuapkan dengan menggunakan alat rotari evaporator (Harborne, 1996).
2.6.2 Partisi
Metode pemisahan yang mungkin paling sederhana adalah partisi, yang banyak digunakan sebagai tahap awal pemurnian ekstrak. Partisi menggunakan dua pelarut tak bercampur yang ditambahkan kedalam ekstrak tersebut, hal ini dapat dilakukan secara terus menerus dengan menggunakan dua pelarut yang tak bercampur yang kepolarannya meningkat. Partisi biasanya dilakukan melalui dua tahap:
1. Air/petroleum eter ringan (heksana) untuk menghasilkan fraksi nonpolar di lapisan organik
2. Air/diklorometan atau air/kloroform atau air/etil asetat untuk membuat fraksi agak polar di lapisan organik. Ini merupakan metode pemisahan yang mudah dan mengandalkan kelarutan bahan alam dan bukan interaksi fisik dengan medium lain (Heinrich , 2010).
2.6.3 Hidrolisis
Bila flavonoid telah diisolasi dengan cara kromatografi, dan spektrum UV-tampak untuk menentukan struktur telah dinilai sebagaimana mestinya, penentuan struktur glikosida lebih lanjut dilakukan dengan usaha memutuskan gula dari aglikon dengan cara hidrolisis. Dengan cara ini berbagai jenis glikosida dapat saling dibedakan dan bila terjadi pemutusan, gula, aglikon, gugus basil, dan lain-lain dapat dipisahkan dan diidentifikasi.
Waktu yang diperlukan untuk memutuskan suatu gula dari suatu flavonoid O-glikosida
dengan hidrolisis asam tidak ditentukan hanya oleh kekuatan asam, tetapi juga oleh sifat gula dan oleh tempat gula itu terikat pada inti flavonoid.
2.6.3.2 Hidrolisis Enzim
Hidrolisis enzim adalah cara yang berguna untuk menentukan sifat ikatan antara gula dan flavonoid. Menurut teori, cara ini pun merupakan cara untuk memutus monosakarida khas dari flavonoid O-glikosida, dan dengan demikian sekaligus merupakan cara untuk
mengidentifikasikannya. Tetapi, dalam praktek jarang terdapat sedemikian enzim niaga yang kemurniannya memadai yang dapat menjamin kekhasannya.
2.6.3.3 Hidrolisis Basa
Hidrolisis basa jarang digunakan pada flavonoid glikosida, tetapi cara ini dapat digunakan
untuk memutuskan gula secara selektif dari gugus hidroksil pada posisi 7 atau 4’ bila juga
ada gula yang terikat pada posisi 3-hidroksi. Keselektifan ini adalah kebalikan dari keselektifan yang ditunjukkan oleh hidrolisis asam. Perlakuan basa akan melepaskan disakarida dari 7-hidroksi asal saja ikatan antarglukosida bukan 1-2 (Markam, 1988). 2.6.4 Kromatografi
Kromatografi disefenisikan sebagai prosedur pemisahan zat terlarut oleh suatu proses migrasi diferensial dinamis dalam sistem yang terjadi atas dua fase atau lebih. Salah satu fase bergerak secara bersinambungan dalam arah tertentu dan didalamnya, zat-zat terlarut menunjukkan perbedaan mobilitas yang disebabkan oleh perbedaan absorpsi, partisi, kelarutan, tekanan uap, ukuran molekul, atau kerapatan muatan ion. Dengan demikian, masing-masing zat dapat diidentifikasi atau ditetapkan dengan metode analitik.
2.6.4.1 Kromatografi Lapis Tipis
Teknik kromatografi lapis tipis (KLT) sangat bermanfaat untuk analisis obat dan bahan lain dalam laboratorium karena hanya memerlukan peralatan sederhana, waktu cukup singkat (15-60 menit), dan jumlah zat yang diperiksa cukup kecil (±0,01 g senyawa murni atau 0,1 g simplisia). Selain itu, KLT tidak memerlukan ruang yang besar dan teknik pengerjaannya juga sederhana.
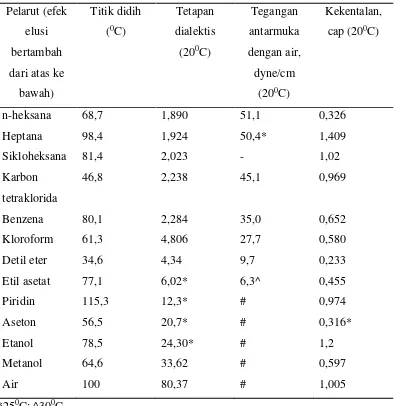
Pelarut
Tabel 2.1 Urutan pelarut sesuai dengan efek elusinya
Adsorben yang umum digunakan yang umum digunakan antara lain silika gel, Alumindo, tanah diatom, dan serbuk selulosa. Sephadex (dextran gel) atau resin penukar ion digunakan untuk penggunaan khusus. Silika gel bersifat asam dan dapat digunakan untuk kromatografi pembagian dan penyerapan. Alumindo bersifat basa dan terutama digunakan untuk kromatografi penyerapan. Tanah diatom bersifat netral dan digunakan sebagai penyangga untuk kromatografi pembagian. Bahan-bahan ini dapat langsung digunakan atau dicampur dengan perekat atau pengikat (binder), misalnya kalsium sulfat untuk membuat lapisan yang lebih kohesif.
2.6.4.2 Kromatografi Kolom
Pemisahan yang terjadi bergantung pada jenis fase gerak yang digunakan. Bila fase gerak yang digunakan sekaligus merupakan larutan campuran yang dipisahkan, kecuali eluat yang pertama, eluat berikutnya selalu mengandung komponen dari eluat sebelumnya. Jadi, komponen yang dipisahkan tidak murni. Namun, dengan cara ini, jumlah komponen dalam campuran masih dapat ditentukan.
Adsorben dan Pelarut
Adsorben yang digunakan hendaknya memenuhi persyaratan berikut: 1. Tidak larut dalam pelarut yang digunakan
2. Inert (tidak bereaksi dengan sampel)
3. Cukup aktif sehingga memungkinkan perambatan sampel 4. Tidak berwarna agar pemisahan dapat diamati
5. Memungkinkan fase gerak mengalir dengan baik 6. Dapat diproduksi dengan sifat konstan (Harmita, 2015).
2.7 Teknik Spektroskopi
Teknik analisis modern mencakup berbagai teknik analisis instrumen elektronika yang dikembangkan untuk mengukur parameter fisika dan kimia alami yang khas dan tetap dari atom atau molekul. Parameter khas yang bermakna untuk analisis adalah absorpsi dan emisi energi radiasi elektromagnet oleh atom atau molekul.
Teknik analisis spektroskopi berasaskan antaraksi radiasi elektromagnet dengan komponen atom atau molekul yang menghasilkan fenomena bermakna sebagai parameter analisis. Karena pada setiap teknik spektroskopi antaraksi radiasi elektromagnet dengan komponen atom/ molekul khas dan tidak semuanya sama, uraian teknik analisis didahului dengan mekanisme antaraksi tersebut, serta fenomena yang dipakai sebagai parameter analisisnya (Satiadarma , 1995).
2.7.1 Spektroskopi Ultraviolet (UV-Vis)
Senyawa polifenol memiliki dua karakteristik pita penyerapan Ultraviolet dengan maksimal jarak 240 sampai 285 nm dan 300 sampai 550 nm. Berbagai macam golongan flavonoid dapat dikenali dari spektrum UV mereka masing-masing, karakteristik spektra UV dari masing-masing flavonoid yang mengandung jumlah dari golongan hidroksil aglikon, pola substituen glikosida, dan golongan asil aromatik bahan alam.
Saat ini penggunaan Spektroskopi UV-Visible paling sering digunakan dalam aplikasi untuk analisa kuantitatif, dan nilai dari metode ini dapat mengurangi perbandingan informasi yang banyak dari teknik spektroskopi yang lainnya seperti NMR dan MS (Andersen, 2006).
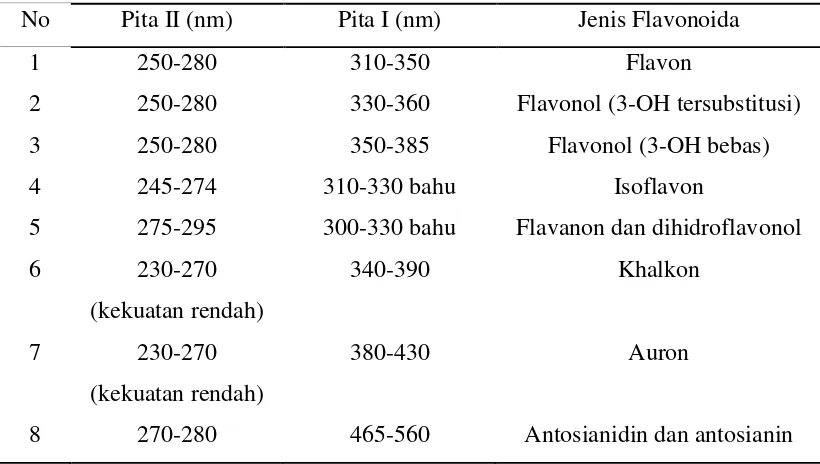
Ciri spektrum khas jenis flavonoid utama dengan pola oksigenasi yang setara disajikan pada tabel 2.2 (Markam,1988) dibawah :
Tabel 2.2 Rentangan Serapan Spektrum UV-Visible golongan Flavonoida
No Pita II (nm) Pita I (nm) Jenis Flavonoida
1 250-280 310-350 Flavon
2 250-280 330-360 Flavonol (3-OH tersubstitusi)
3 250-280 350-385 Flavonol (3-OH bebas)
4 245-274 310-330 bahu Isoflavon
5 275-295 300-330 bahu Flavanon dan dihidroflavonol
6 230-270
(kekuatan rendah)
340-390 Khalkon
7 230-270
(kekuatan rendah)
380-430 Auron
8 270-280 465-560 Antosianidin dan antosianin
Spektrum infra merah suatu molekul adalah hasil transisi antara tingkat energi getaran (vibrasi) yang berlainan. Inti-inti atom yang terikat oleh ikatan kovalen mengalami getaran (vibrasi) atau osilasi (oscillation) dengan cara serupa dengan dua bola yang terikat oleh suatu pegas.
Bila molekul menyerap radiasi inframerah, energi yang diserap menyebabkan kenaikan dalam amplitudo getaran atom-atom yang terikat itu. Jadi molekul ini berada dalam keadaan vibrasi tereksitasi , energi yang diserap ini akan dibuang dalam bentuk panas bila molekul itu kembali ke keadaan dasar. Panjang gelombang eksak dari absorpsi oleh suatu tipe ikatan, bergantung pada macam getaran dari ikatan tersebut. Oleh karena itu, tipe ikatan yang berlainan (C-H, C-C, C=O, C=C, O-H, dan sebagainya) menyerap radiasi inframerah pada panjang gelombang yang berlainan.
Dengan demikian spektrometri inframerah dapat digunakan untuk mengidentifikasi adanya gugus fungsi dalam suatu molekul. Banyaknya energi yang diserap juga beraneka ragam dari ikatan ke ikatan. Ini disebabkan sebagian oleh
perubahan dalam momen dipol (µ≠0) pada saat energi diserap. Ikatan nonpolar (seperti
C-H atau C-C) menyebabkan absorpsi lemah, sedangkan ikatan polar (seperti misalnya O-H, N-H, dan C=O) menunjukkan absorpsi yang lebih kuat.
Suatu ikatan dalam sebuah molekul dapat mengalami berbagai vibrasi molekul. Secara umum terdapat dua tipe vibrasi molekul:
1. Streching (vibrasi regang/ulur): vibrasi sepanjang ikatan sehingga terjadi perpanjangan atau pemendekan ikatan.
Oleh karena itu suatu ikatan tertentu dapat menyerap energi lebih dari satu panjang gelombang. Contohnya, ikatan O-H menyerap energi pada frekuensi 3330 cm-1, energi pada panjang gelombang ini menyebabkan kenaikan vibrasi regang ikatan O-H itu. Suatu ikatan O-H itu juga menyerap pada kira-kira 1250 cm-1, energi pada panjang gelombang ini menyebabkan kenaikan vibrasi lentur. Tipe vibrasi yang berlain-lainan ini disebut cara vibrasi fundamental (Supratman, 2010).
2.7.3 Spektroskopi Resonansi Magnetik Inti Proton (1H-NMR)
Setelah spektroskopi inframerah, spektroskopi resonansi magnetik inti (NMR) adalah yang metode yang paling penting digunakan dalam kimia organik. Dalam spektroskopi inframerah mengandung infromasi mengenai adanya gugus fungsi pada molekul, sedangkan spektroskopi NMR memberikan informasi mengenai jumlah dari masing-masing hidrogen.
Kemampuan terhebat resonansi inti magnetik timbul karena tidak semua proton dalam molekul memiliki resonansi yang identik pada frekuensi yang sama. Hal ini sesuai dengan fakta bahwa berbagai macam proton dalam molekul dikelilingi oleh elektron dan memiliki sedikit perbedaan dalam lingkungan elektronik dari satu dan yang lainnya. Proton akan terlindungi oleh elektron yang mengelilingi mereka. Dalam daerah magnetik, peredaran elektron valensi dari daerah penghasil proton yang bertentangan dengan daerah
magnetik yang berlaku. Pergeseran kimia dalam unit δ ditunjukkan dalam jumlah
resonansi proton yang bergeser dari TMS dalam bagian per juta (ppm) dari frekuensi dasar spektroskopi
δ=frekuensi spektrometer dalam MHzpergeseran dalam Hz
Unsur dasar dari spektrometer nmr adalah ilustrasi skematis. Sampel dilarutkan dalam pelarut yang tidak memiliki proton (biasanya CCl4) dan dalam jumlah yang kecil