Lampiran 3. Kromatogram Lapis TipisEkstrak Pekat Kloroform Daun Benalu Tumbuhan Coklat (Dendrophthoe flosculosa Danser) sebelum Kromatografi Kolom
E
E
E
E
I
II
III
IV
Keterangan :
Fasa diam : Kieselgel 60 F254
E : Ekstrak Pekat Lapisan Kloroform daun benalu tumbuhan coklat
No Fasa Gerak Jumlah Noda Rf
I n – heksana:etil asetat 9:1 (v/v) 1 0,09
II n – heksana:etil asetat 8:2 (v/v) 1 0,11
III n – heksana:etil asetat 7:3 (v/v) 2 0,15
0,27
IV n – heksana:etil asetat 6:4 (v/v) 3 0,19
Lampiran 4. Kromatogram Lapisan Tipis ekstrak daun benalu tumbuhan coklat penggabungan fraksi
I
E
Keterangan :
Fasa diam : Kieselgel 60 F254
E : Ekstrak Pekat Lapisan Kloroform daun tumbuhan Benalu Coklat
No Fraksi Jumlah Noda Rf
I 44 – 64 3
0,46
0,38
Lampiran 5. Kromatogram Lapis Tipis senyawa murni hasil isolasi
I
E
II
E
III
E
Keterangan :
Fase Diam : Kieselgel 60 F254
E : Gum Hasil Isolasi
No Fasa Gerak Jumlah Noda Rf
1 N-heksana : Etil Asetat 6 : 4 (v/v)
1 0,38
2 Kloroform : Etil Asetat 7 : 3 (v/v)
1 0,33
3 Kloroform : Metanol
8 : 2 (v/v)
Lampiran 7. Spektrum Ekspansi 1H-NMR senyawa hasil isolasi pada
Lampiran 9. Spektrum Ekspansi 1H-NMR senyawa hasil isolasi pada
Lampiran 10. Spektrum Ekspansi 1H-NMR senyawa hasil isolasi pada
Lampiran 11. Spektrum Ultraviolet – Visible beberapa senyawa Flavonoida
Lampiran 12a. Spektrum 1H-NMR Senyawa Hasil Flavonoida Pembandinguntuk senyawa Hasil Isolasi
(Harborne, 1987)
Lampiran 12b. Spektrum 1H-NMR Senyawa Hasil Flavonoida Pembanding untuk senyawa Hasil Isolasi
DAFTAR PUSTAKA
Armarego, W.L.F., dan Chai, C.L.L. 2003. Purification of Laboratory Chemical. Seventh Edition. USA: Elsevier Science
Barlow, B. A. 1997. Flora Malesiana. Series I. Volume 13. Malaysia
Bohm, B.A., 1998, Introduction of Flavonoid, 183, Harwoord Academic Publisher, Belanda.
Cairns, D., 2004. Intisari Kimia Farmasi. Edisi 2. Jakarta: Penerbit Buku Kedokteran EGC
Cannell, R. J. P. 2008. Natural Products Isolation. New Jersey : Humana Press
Creswell, C. J. 1982. Analisa Spektrum Senyawa Organik. Edisi Kedua. Bandung: Penerbit ITB
Crozier, A. 2006. Plant Secondary Metabolites. UK: Blackwell Publishing
Cseke, L. J., Kirakosyan, A., Kaufman, P. B., Warber, S. L., Duke, J. A., Brielmann, H. L. 2006. Natural Products From Plants. Second Edition. New York: Taylor & Francis
Dachriyanus, 2004. Analisis Struktur Senyawa Organik. Padang: Andalas University Press
Fajriah, S, Darmawan, A, Sundowo, A dan Artanti N. 2007. Isolasi Senyawa Antioksidan dari Ekstrak Etil Asetat Daun Benalu Dendrophtoe L. Miq yang Tumbuh pada Inang Lobi-Lobi. [Jurnal Kimia Indonesia] Vol.2
Fitriya, 2011. Flavonoid Kuersetin Dari Tumbuhan Benalu Teh (Scurulla Atropurpurea BL. Dans). [Jurnal Penelitian Sains]. Vol.12 No.4(C). Universitas Sriwijaya
Gritter, R.J. 1991. Pengantar Kromatografi. Edisi Kedua. Bandung: Penerbit ITB
Heinrich, M., Barnes, J., Gibbons, S., Williamson, E.M. 2010. Farmakognosi dan Fitoterapi. Jakarta: Penerbit Buku Kedokteran EGC
Jacobs, T.L. 1974. Laboratory Practise of Organic Chemistry. Fifth Edition. New York: Macmillan Publishing Co Inc
Jenie, U. A. 2014. Teknik Modern Spektroskopi NMR: Teori dan Aplikasi dalam Elusidasi Struktur Molekul Organik. Jakarta: LIPI Press
Kariman, 2014. Bebas Penyakit dengan Tanaman Ajaib. Surakarta: Open Books
Kaufman, P. B., Cseke, L. J., Kirakosyan, A., Warber, S. L., Duke, J. A., Brielmann, H. L 1999. Natural Products from Plants. USA: CRC Press LLC
Khopkar, 1990. Konsep Dasar Kimia Analitik. Jakarta : Penerbit UI
Kristianingrum, S. 2013. Spektroskopi Infra Merah. [Jurnal] Yogyakarta
Lenny, S. 2006. Senyawa Terpenoida dan Steroida, Medan [Karya Ilmiah] Universitas Sumatera Utara
Mabry, T.J., Markham, K.R., Thomas, M.B. 1970. The Sistematic Identification of Flavonoids. New York : Springer Verlag
Manito, P. 1980. Biosintesis Produk Alami. Terjemahan Koensoemardiyah. Semarang: IKIP Semarang Press.
Markham,K.R. 1988. Cara Mengidentifikasi Flavonoida. Terjemahan KosasiPadmawinata. Bandung: ITB Press
Muldja, M.H. 1995. Analisis Instrumental. Cetakan Pertama. Surabaya: Universitas Airlangga Press
Pasto, D.J. 1992. Experiment and Techniquen Organic Chemistry. New Jersey: Prentice Hall,Inc
Pitojo, S. 1996. Benalu Hortikultura Pengendalian dan Pemanfaatan. Ungaran : Trubus Agriwidya
Robinson, T. 1995. Kandungan Organik Tumbuhan Tinggi. Edisi Keenam. Bandung: Penerbit ITB
Sarker, S. D., Latif, Z., Gray, A. I. 2006. Natural Product Isolation. Second Edition. New Jersey: Humana Press Inc
Sarker, S. D., Nahar, L. 2007. Chemistry for Pharmacy Students: General, Organic, and Natural Product Chemistry. USA: John Wiley & Sons Inc
Sastrohamidjojo,H. 1985. Sintesis Bahan Alam. Yogyakarta: Gadjah Mada University Press
Satiadarma, K., M. Mulja, D. H. Tjahjono, R. E. Kartasasmita. 2004. Asas Pengembangan Prosedur Analisis. Surabaya: Airlangga University Press.
Shirataki, Y., Komatsu, M., Yokoe, I., Manaka, A. 1981. Constituents of the Root of Eucheresta Japonica Hook. Sakado: Josai University
Siahaan,C.E. 2015. Uji Skrining Fitokimia, Aktivitas Antioksidan Dan Antibakteri Ekstrak Metanol, Etil Asetat Dan N-Heksana Daun Benalu Kakao(Dendrophthoe pentandra (L.) Miq.). Medan [Skripsi]Universitas Sumatera Utara
Silverstein, R. M. 1986. Penyidikan Spektrometrik Senyawa Organik. Edisi Keempat. Jakarta : Erlangga
Sudjadi. 1986. Metode Pemisahan. Yogyakarta: Penerbit Kanisius
Sumarno, 2001. Kromatografi Teori Dasar. Yogyakarta : UGM
Tomas-Barberan, F.A., Farreres, F., 2012, Analytical Methods of Flavonols and Flavones, In Analysis of Antioxidant-Rich Phytochemical, 217-219, Wiley-Blackwell, UK.
Winasis,E.G. 2015. Khasiat Selangit Daun – daun Ajaib Tumpas Penyakit
BAB 3
METODE PENELITIAN
3.1 Alat-alat
1. Spektrofotometer FT-IR Shimadzu
2. Spektrofotometer 1H-NMR Jeol/Delta2NMR 500MHz
3. Spektrofotometer UV-Vis
4. Tabung Perkolasi/Maserasi 5000 mL Schoot/ Duran
5. Rotarievaporator Bűchi R-114
6. Labu rotarievaporator 1000 mL Schoot/ Duran
7. Alat destilasi (Ekstraktor)
8. Corong pisah 500 mL Pyrex
9. Kolom Kromatografi
10. Botol vial 10 mL
11. Neraca analitis Mettler AE 200
12. Lampu UV 254 nm/356 nm UVGL 58
13. Penangas air
14. Chamber
15. Gelas Ukur Pyrex
16. Gelas Beaker Pyrex
3.2 Bahan-bahan
1. Daun Benalu tumbuhan coklat
2. Metanol Destilasi
3. Etil asetat Teknis
4. Aquadest
5. N-heksana Teknis
6. Kloroform Teknis
7. FeCl3 5%
8. Pereaksi Benedict
9. HCl 6%
10. Kapas
11.
12.
Silika gel 40 (70-230mesh) ASTM
Plat KLT Silika gel 60 F254
E.Merck. KgA
E.Merck.Art 554
3.3 Prosedur Penelitian
3.3.1 Penyediaan Sampel
Sampel yang diteliti adalah daun benalu pada tumbuhan coklat yang diperoleh
dari daerah Jalan Djamin Ginting, KM. 38.7, Deli Serdang, Ketangkuhen,
Sibolangit. Daun benalu dikeringkan di udara terbuka, lalu dihaluskan sampai
3.3.2 Uji Pendahuluan Terhadap Ekstrak Daun Benalu Tumbuhan Coklat
Untuk mengetahui adanya senyawa flavonoida yang terdapat dalam daun benalu
tumbuhan coklat maka dilakukan uji pendahuluan secara kualitatif dengan reaksi
warna sebagai berikut; 10 g serbuk daun benalu tumbuhan coklat yang telah
dikeringkan dimasukkan ke dalam dua gelas Erlenmeyer lalu ditambahkan 25 mL
metanol ke dalam gelas Erlenmeyer I dan 25 mL etil asetat ke dalam gelas
Erlenmeyer II.
Didekantasi lalu dibagi masing – masing ekstrak sampel ke dalam dua
tabung reaksi. Untuk ektask metanol dan etil asetat :
a. Tabung I (ekstrak metanol) : dengan FeCl3 5% menghasilkan larutan
berwarna hitam
b. Tabung II (ekstrak etil asetat) : dengan FeCl3 5% menghasilkan larutan
berwarna hitam
3.3.3 Ekstraksi Daun Benalu Tumbuhan Coklat
Serbuk daun Benalu ditimbang sebanyak 1250 g, kemudian dimaserasi dengan
metanol sebanyak ± 11 L untuk lima kali pengulangan perendaman sampai semua
sampel terendam dan dibiarkan selama 24 jam. Maserat ditampung dan
dipekatkan dengan menggunakan alat rotarievaporator sehingga diperoleh ekstrak
pekat metanol. Kemudian diuapkan hingga semua pelarut metanol menguap. Lalu
dilakukan pemisahan tanin dengan cara melarutkan fraksi pekat metanol dengan
etil asetat, dan disaring. Filtrat kemudian di rotarievaporator lalu diuapkan hingga
semua pelarut etil asetat menguap. Lalu fraksi pekat etil asetat dilarutkan dengan
metanol dan di ekstraksi partisi berulang-ulang dengan n-heksana sampai lapisan
n-heksana bening.
Lapisan metanol dipisahkan dari lapisan n-heksana, lalu dipekatkan
kembali dengan rotarievaporator dan diuapkan kembali sehingga diperoleh ektrak
pekat lapisan metanol. Fraksi metanol di uji kandungan gula dengan pereaksi
Benedict, lalu dihidrolisis dengan menggunakan HCl 6% sambil di panaskan
Kemudian disaring dan filtrat yang diperoleh di ektraksi partisi dengan
kloroform sebanyak 3 kali. Ekstrak kloroform dipekatkan dengan rotarievaporator
dan diuapkan kembali sehingga diperoleh ekstrak pekat kloroform sebanyak 0,3 g.
3.3.4 Analisis Kromatografi Lapis Tipis
Analisis Kromatografi Lapis Tipis dilakukan terhadap ekstrak kloroform dengan
menggunakan fase diam silika gel 60F254 Merck. Analisis ini bertujuan untuk
mencari sistem dan perbandingan pelarut yang sesuai untuk kromatografi kolom.
Eluen yang digunakan adalah campuran pelarut n-heksana:etil asetat dengan
perbandingan 90:10, 80:20, 70:30, 60:40 (v/v).
Dimasukkan 10 ml campuran larutan fase gerak n-heksana: etil asetat
90:10 (v/v) ke dalam bejana kromatografi, kemudian dijenuhkan. Di totolkan
ekstrak pekat kloroform pada plat KLT yang telah diaktifkan. sILIKADimasukkan
plat ke dalam bejana yang telah berisi campuran pelarut yang telah dijenuhkan,
lalu di tutup dan di elusi. Plat yang telah di elusi, di keluarkan dari bejana, lalu di
keringkan. Di amati noda yang terbentuk dibawah sinar UV, kemudian difiksasi
dengan pereaksi FeCl3 5%. Diamati warna bercak yang timbul dan dihitung harga
Rf yang diperoleh. Perlakuan yang sama dilakukan untuk perbandingan pelarut
n-heksana:etil asetat dengan perbandingan 80:20, 70:30, 60:40 (v/v).
3.3.5 Isolasi Senyawa Flavonoida dengan Kromatografi Kolom
Isolasi senyawa flavonoida secara kromatografi kolom dilakukan terhadap ekstrak
pekat kloroform yang telah diperoleh. Fase diam yang digunakan adalah silika gel
40 (70-230 mesh) ASTM dan fase gerak yaitu n-heksana 100%, campuran pelarut
n-heksana:etil asetat dengan perbandingan 90:10, 80:20, 70:30, 60:40 (v/v).
Dirangkai alat kromatografi kolom. Terlebih dahulu dibuburkan silika gel
40 (70-230 mesh) ASTM dengan menggunakan n-heksana, diaduk-aduk hingga
homogen lalu dimasukkan ke dalam kolom kromatografi. Kemudian dielusi
Dilarutkan 0,3 g ekstrak pekat kloroform dengan pelarut kloroform,
kemudian dimasukkan ke dalam kolom kromatografi yang telah berisi bubur silika
gel, lalu ditambahkan eluen n-heksana:etil asetat 90:10 (v/v) secara
perlahan-lahan dan diatur sehingga aliran eluen yang keluar dari kolom sama banyaknya
dengan penambahan eluen dari atas.
Ditingkatkan kepolaran dengan menambahkan eluen n-heksana:etil asetat
dengan perbandingan 80:20 (v/v), 70:30 (v/v), dan 60:40 (v/v). Hasil yang
diperoleh ditampung dalam botol vial setiap ± 10 mL, lalu di KLT dan digabung
fraksi dengan harga Rf yang sama lalu diuji dengan FeCl3 5%. Kemudian
diuapkan sampai terbentuk gum.
3.3.6 Pemurnian
Senyawa yang telah diperoleh dari hasil isolasi dimurnikan dengan cara, gum
yang diperoleh dari isolasi dilarutkan kembali dengan etil asetat, diaduk hingga
semua gum larut sempurna. Kemudian ditambahkan N-Heksan secara
perlahan-lahan hingga terjadi pengendapan zat-zat pengotor di dasar wadah. Kemudian
didekantasi larutan bagian atas. Lalu, dianalisis KLT untuk mengetahui apakah
senyawa yang diperoleh sudah murni atau belum. Kemudian dilakukan kembali
kromatografi kolom dengan eluen yang seragam yaitu n-heksana : etil asetat 60:40
(v/v) sehingga diperoleh senyawa murni yang dibuktikan dengan noda tunggal
3.3.7 Uji kemurnian Hasil isolasi dengan Kromatografi Lapis tipis (KLT)
Uji kemurnian gum dilakukan dengan kromatografi lapis tipis dengan
menggunakan fase diam silika gel 60 F254 dengan eluen n-heksana:etil asetat 6:4
(v/v), kloroform:etil asetat 7:3 (v/v), dan kloroform:metanol 8:2 (v/v).
Dimasukkan 10 mL larutan fase gerak ke dalam bejana lalu dijenuhkan.
Ditotolkan gum yang sebelumnya dilarutkan dengan etil asetat pada plat KLT.
Dimasukkan plat KLT tersebut ke dalam bejana kromatografi lapis tipis yang
telah jenuh. Setelah pelarut fase gerak merembes sampai batas tanda, plat KLT
dikeluarkan dari bejana, dikeringkan, diamati di bawah sinar UV, dan difiksasi
dengan menggunakan pereaksi FeCl3 5% dalam metanol menghasilkan bercak
berwarna hitam yang menunjukkan adanya senyawa flavonoida.
3.3.8 Identifikasi Senyawa Hasil Isolasi
3.3.8.1 Identifikasi dengan Spektrofotometer UV-Vis
Spektrum serapan kandungan tumbuhan dapat diukur dalam larutan yang sangat
encer dengan menggunakan pembanding pelarut blanko. Senyawa tanpa warna
diukur pada rentang 200 – 400 nm dan senyawa berwarna pada rentang 200 – 700
nm. Pelarut yang banyak digunakan untuk spektroskopi UV – Vis adalah metanol.
Senyawa hasil isolasi yang bobot molekulnya diketahui, pengukuran intensitas
serapan pada panjang gelombang maksimum (λ maks) dinyatakan sebagai log ϵ, dengan ϵ= A/Сl (A = absorbansi, C = konsentrasi dalam g mol/l, l = panjang alur
sel dalam cm, umumnya 1) (Harborne, 1987).
Analisis dengan alat Spektrofotometer UV-Vis diperoleh dari
Laboratorium Pusat Penelitian Kimia – LIPI, Kawasan PUSPITEK Serpong,
3.3.8.2 Identifikasi dengan Spektrofotometer Inframerah (FT-IR)
Sinar inframerah mempunyai energi yang lebih rendah dari sinar ultraviolet atau
sinar tampak, sehingga tebal sel yang dipakai pada spektrofotometer lebih tipis
daripada untuk spektrofotometer lainnya ( 0,002 mm). Oleh karena tidak ada
pelarut yang sama sekali transparan terhadap sinar inframerah, maka sampel dapat
diukur sebagai padatan atau cairan murninya.
Sampel dalam bentuk padat digerus dalam mortir kecil bersama kristal
KBr kering dalam jumlah sedikit (0,5-2 mg cuplikan + 100 mg KBr kering).
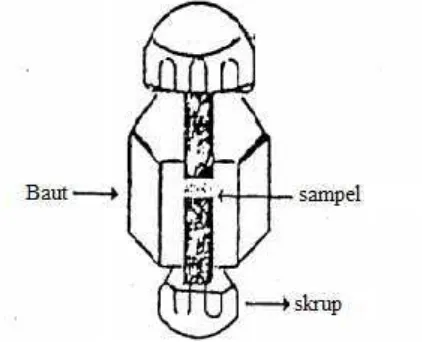
Campuran tersebut dipres diantara dua skrup (Gambar 3.1) memakai kunci,
kemudian kedua skrupnya dibuka dan band yang berisi tablet cuplikan tipis
diletakkan di tempat sel spektrofotometer inframerah dengan lubang mengarah ke
sumber radiasi (Kristianingrum, S. 2013).
Gambar 3.1 Preparasi sampel pada Spektrofotometer Inframerah (Kristianingrum,
S. 2013)
Analisis dengan alat Spektrofotometer FT-IR diperoleh dari Laboratorium
Pusat Penelitian Kimia – LIPI, Kawasan PUSPITEK Serpong, Tangerang dengan
3.3.8.3Identifikasi dengan Spektrometer Resonansi Magnetik Inti Proton
(1H-NMR)
Preparasi sampel dimulai dengan dimasukan sampel ke dalam suatu wadah berupa
tabung gelas yang berbentuk silindris, diletakkan diantara dua kutub magnet.
Sampel dilarutkan dalam pelarut tak mengandung proton seperti CCl4, CDCl3,
D2O atau acetonitril dan sejumlah kecil TMS ditambahkan sebagai standar
internal, kemudian dimasukkan kedalam tempat sampel. Sampel kemudian diputar
sekitar sumbunya untuk mengusahakan agar semua bagian dari larutan terkena
medan magnet yang sama (Kristianingrum, S. 2013).
Analisis dengan alat Spektrometer 1H-NMR diperoleh dari Laboratorium Pusat Penelitian Kimia Institut Teknologi Bandung (ITB) dengan menggunakan
3.4 Bagan Uji Flavonoida
- ekstraksi dengan pelarut metanol
Serbuk daun benalu tumbuhan coklat
(Dendrophthoe flosculosa Danser)
di ekstraksi dengan metanol disaring
dibagi ke dalam tabung reaksi Tabung I
- ekstraksi dengan pelarut etil asetat
Serbuk daun benalu tumbuhan coklat
(Dendrophthoe flosculosa Danser)
di ekstraksi dengan etil asetat disaring
3.5 Bagan Penelitian
1250 gram serbuk daun benalu coklat (Dendrophthoe flosculosa Danser)
diuji Flavonoida
dimaserasi dengan metanol hingga terendam didiamkan selama ± 24 jam
diulangi sebanyak 5 kali disaring
Ekstrak metanol
diuji dengan FeCl3 5%
dipekatkan dengan rotarievaporator
Ekstrak pekat metanol
diuapkan hingga semua pelarut metanol habis menguap
dilarutkan dengan etilasetat secara berulang-ulang sampai bening disaring
diekstraksi partisi dengan n-heksana hingga negatif
Lapisan metanol Lapisan n-heksana
(tidak dilanjutkan) diuji dengan FeCl3 5%
dipekatkan dengan rotarievaporator
dilakukan uji kandungan gula dengan penambahan pereaksi benedict (+) dihidrolisis dengan HCl 6% sambil dipanaskan selama 60 menit sambil diaduk didinginkan
disaring
Ekstrak metanol asam Residu
diekstraksi partisi dengan kloroform sebanyak 3 kali
Lapisan kloroform lapisan metanol
asam dipekatkan dengan rotarievaporator
Ekstrak pekat kloroform
Sisa Sampel (ampas)
diuapkan hingga seluruh etilasetat menguap
diuji dengan FeCl3 5%
Negatif
Lanjutan
Ekstrak pekat kloroform
diuji dengan FeCl3 5%
diuji Kromatografi Lapis Tipis untuk mengetahui eluen n-heksana:etil asetat (90:10; 80:20; 70:30; 60:40; 50:50) (v/v) dikolom kromatografi dengan fasa diam silika gel dan fase gerak (eluen) n-heksana:etil asetat (90:10; 80:20; 70:30; 60:40, 50:50)(v/v) ditampung tiap fraksi sebanyak ± 10 mL dalam botol vial
digabung fraksi dengan Rf yang sama diuji Kromatografi Lapis Tipis fraksi 1-9 hasil negatif hasil positif hasil positif hasil positif
dianalisis Kromatografi Lapis Tipis dengan eluen n-heksana:etil asetat (60:40)(v/v) menghasilkan 3 noda dengan harga Rf 0,29; 0,38; 0,46
dikolom kromatografi dengan fase diam silika gel dan fase gerak (eluen) n-heksana : etil asetat (60:40) (v/v)
Senyawa hasil isolasi
dianalisis dengan
spektrofotometer UV-Vis, spektrofotometer Inframerah (FT-IR), spektrometer 1H-NMR hasil analisis
diuji Kromatografi Lapis Tipis digabung fraksi dengan Rf yang sama fraksi 1- 30
(60 : 40)v/v fraksi 41-60(60 : 40)v/v hasil positif harga Rf 0,38 hasil negatif
ditampung tiap fraksi sebanyak ± 5 mL dalam botol vial
diuji kemurnian dengan analisis Kromatografi Lapis Tipis
dihasilkan senyawa murni dianalisis Kromatografi
Lapis Tipis dengan eluen n-heksana:etil asetat 6:4(v/v) menghasilkan 1 noda dengan harga Rf 0,38
dianalisis Kromatografi Lapis Tipis dengan
kloroform:etil asetat 7:3 (v/v) menghasilkan 1 noda dengan harga Rf 0,33
dianalisis Kromatografi Lapis Tipis dengan
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
Dari hasil uji pendahuluan terhadap ekstrak metanol dan etil asetat dari daun
Benalu Coklat (Dendrophthoe flosculosa Danser) menunjukkan bahwa sampel
positif mengandung flavonoida dengan adanya penambahan pereaksi FeCl3 untuk
menentukan senyawa flavonoida yang dikandung.
Hasil elusi dari perbandingan pelarut n-heksana:etil asetat 60:40 (v/v) pada
fraksi 44-64, dipisahkan kembali pada kolom untuk mendapatkan senyawa murni.
Sehingga diperoleh senyawa hasil isolasi berupa gum berwarna kuning
kecokelatan seberat 13,3 mg, dan nilai harga Rf= 0,38 (n-heksana:etil asetat 6:4
v/v), Rf= 0,33 (kloroform:etil asetat 7:3 v/v), dan Rf= 0,25 (kloroform:metanol
8:2 v/v).
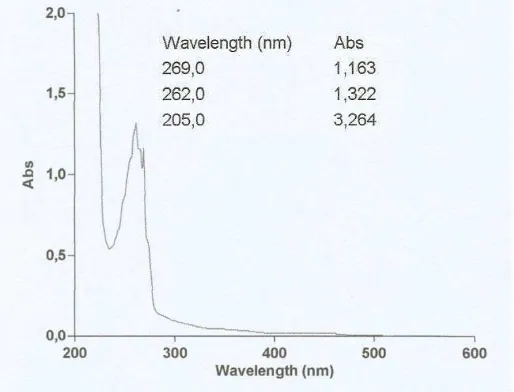
Hasil analisis spektrofotometer UV-Visible terhadap senyawa hasil isolasi
dengan menggunakan pelarut metanol memberikan serapan seperti gambar 4.1
dibawah ini:
1. Pita I memberikan panjang gelombang 269,0 nm
2. Pita II memberikan panjang gelombang 262,0 nm
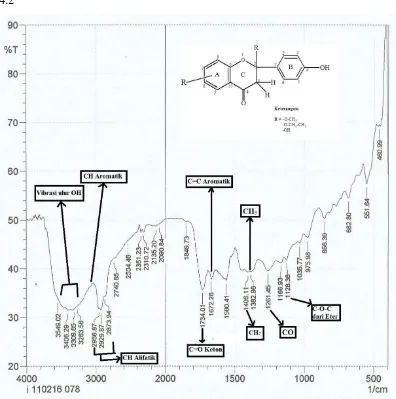
Hasil Analisis spektrofotometer FT-IR dari gum hasil isolasi memberikan
pita-pita serapan pada daerah bilangan gelombang yang dapat dilihat pada gambar
4.2
Dari hasil analisis Spektrofotometer Infra Merah (FT-IR) memberikan pita-pita
serapan pada daerah bilangan gelombang pada tabel 4.1 sebagai berikut :
Tabel 4.1 Interpretasi Spektrum FT-IR Senyawa Hasil Isolasi
Bilangan gelombang (cm-1)
Intensitas Gugus Fungsi
3549,02-3263,56
Rendah Vibrasi ulur O-H
3180-3120 Sedang Vibrasi ulur C-H
aromatik
2956,87-2873,94
Sedang Vibrasi Ulur C-H
alifatik
1734,01 Sedang Vibrasi C=O
keton
1672,28 Sedang Vibrasi ulur C=C
aromatik
1406,11 Rendah Vibrasi CH2
1382,96 Rendah Vibrasi CH3
1261,45 Rendah Vibrasi C-O
1128,36 Rendah Vibrasi C-O-C
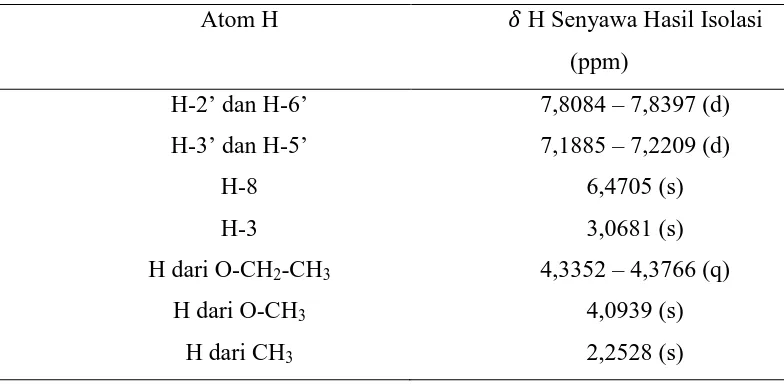
Hasil analisis Spektrometer Resonansi Magnetik Inti Proton (1H-NMR) senyawa hasil isolasi dengan menggunakan pelarut Metanol memberikan
pergeseran kimia pada daerah (ppm) seperti Gambar 4.3 berikut:
Berikut merupakan pergeseran kimia dan jenis peak 1H-NMR senyawa hasil isolasi pada tabel 4.2 :
Tabel 4.2 Pergeseran Kimia 1H-NMR Senyawa Hasil Isolasi
Atom H � H Senyawa Hasil Isolasi
4.2 Pembahasan
Hasil isolasi senyawa flavonoida dari daun benalu tumbuhan coklat
(Dendrophthoe flosculosa Danser) pada proses ekstraksi maserasi diperoleh
ekstrak pekat sebanyak 119,53 g kemudian dilarutkan dengan menggunakan
pelarut etil asetat untuk pemisahan senyawa yang diduga merupakan tanin dan
diperoleh ekstrak pekat etil asetat 19,51 g. Ekstrak pekat yang diperoleh
dilarutkan dengan metanol kemudian diekstraksi partisi dengan menggunakan
pelarut n-heksana dan dihidrolisis dalam suasana asam lalu diekstraksi partisi
dengan kloroform hingga diperoleh ekstrak pekat klorofom sebanyak 0,3 g.
Di analisis kromatografi lapis tipis sebelum kromatografi kolom dan
didapat perbandingan pelarut yang sesuai untuk mengisolasi senyawa flavonoida
dari daun tumbuhan benalu coklat adalah n-heksana : etil asetat 60:40 v/v yang
menunjukkan pemisahan yang lebih baik dari noda yang dihasilkan (Lampiran 3).
Hasil analisis kromatografi lapis tipis terhadap eluat hasil kolom kromatografi
dengan eluen yang seragam n-heksana : etil asetat 60:40 v/v menunjukkan masih
Ditunjukkan bahwa noda yang dihasilkan pada plat kromatografi lapis
tipis pada fraksi 44-64 dengan pereaksi FeCl3 5% yang paling baik maka
dilakukan pemurnian kristal hasil isolasi dengan kolom kromatografi kembali
dengan eluen n-heksana : etil asetat 60:40 v/v. Hasil analisis kromatografi lapis
tipis terhadap eluat hasil kolom kromatografi yang kedua kali dengan eluen yang
seragam n-heksana : etil asetat 60:40 v/v yang menunjukkan masih terdapat
beberapa noda yang dihasilkan pada plat kromatografi lapis tipis pada fraksi
44-64 dengan pereaksi FeCl3 5% dan merupakan sangat baik untuk dilanjutkan
(Lampiran 4), kemudian dikromatografi Lapis Tipis kembali untuk menentukan
harga Rf gum hasil isolasi dengan tiga eluen yang berbeda, yaitu n-heksana:etil
asetat 6:4 (v/v) dengan harga Rf= 0,38, kloroform:etil asetat 7:3 (v/v) dengan
harga Rf= 0,33 , dan kloroform:metanol 8:2 (v/v) dengan harga Rf= 0,25
(Lampiran 5).
Dalam penentuan struktur dari hasil isolasi senyawa flavonoida maka
diperlukan metode Ultraviolet-Visible (UV-Vis), Inframerah (FT-IR) dan
Resonansi Magnetik Inti Proton (1H-NMR). Dimana dengan menggabungkan
metode ini akan dapat ditentukan atau diduga struktur dari hasil isolasi tersebut.
Spektrofotometer Ultraviolet-Visible (UV-Vis) digunakan untuk
menentukan golongan dari flavonoida. Spektrofotometer Inframerah (FT-IR)
digunakan untuk menganalisis gugus fungsi dari aromatik yaitu C=C, hidroksida,
karbonil, dan eter. Spektrofotometer Resonansi Magnetik Inti (1H-NMR)
digunakan untuk memberikan informasi tentang keadaan dari proton yang
bertetangga, dan melihat adanya penjodohan dari proton-proton yang terjadi
dalam bentuk singlet, doublet, triplet.
Maka kombinasi dari data Spektrofotometer Ultraviolet-Visible (UV-Vis),
Spektrofotometer Inframerah (FT-IR), dan Spektrofotometer 1H-NMR dapat
Dari literatur (lampiran 11) λ maksimum untuk pita II sekitar 296 nm dan
pita I sekitar 300 nm (Markham, 1988), namun dari hasil pengukuran sampel
sedikit rumit untuk menentukan λ maksimum. Hal ini mungkin dipengaruhi oleh
jenis dan posisi substituen R.
Hasil interpretasi Spektrum Infra Merah dan Spektrum Resonansi
Magnetik Inti Proton (1H-NMR) dan FT-IR senyawa hasil isolasi dengan
menggunakan pelarut Aseton dalam standar TMS dapat diperoleh yaitu :
Pergeseran kimia pada daerah �= 7,8084 – 7,8397 ppm dengan puncak
doublet menunjukkan proton-proton dari H-2’ dan H-6’ pada cincin B dalam struktur falvonoid senyawa hasil isolasi. Hal ini juga didukung oleh data
spektrofotometer FT-IR pada bilangan 3180 – 3120 cm-1 dengan puncak sedang menunjukkan adanya vibrasi ulur –CH pada cincin aromatik.
Pergeseran kimia pada daerah �= 7,1885 – 7,2209 ppm dengan puncak
doublet menunjukkan proto-proton H-3’ dan H-5’. Hal ini juga di dukung oleh
spektrofotometer inframerah pada bilangan gelombang 3180 – 3120 cm-1 dengan puncak sedang menunjukkan adanya vibrasi ulur –CH aromatik.
Pergeseran kimia pada daerah �= 6,4705 ppm dengan puncak singlet
menunjukan proton pada cincin A, namun belum dapat ditentukan posisi yang
tepat pada atom karbonnya, baik itu atom C6 atau C7 atau C8, sedangkan pada C5
tidak ada kemungkinan terikat dengan proton dikarenakan pada spektrum NMR
pada pergeseran kimia 12 ppm tidak ada muncul peak, sehingga diduga pada atom
C5 terikat sebuah substituen.
Pergeseran kimia pada daerah � = 3,0681 ppm dengan puncak doublet
menunjukan proton H-3. Hal ini juga di dukung oleh spektrofotometer inframerah
Pergeseran kimia pada daerah �= 4,0939 ppm dengan puncak singlet
menunjukkan adanya proton dari gugus metoksi –OCH3. Hal ini juga didukung
oleh spektrometer infra merah pada bilangan gelombang 1128,36 cm-1 dengan puncak sedang menunjukkan adanya vibrasi ulur eter.
Berdasarkan analisis data dan interpretasi yang dilakukan pada spektrum
Ultraviolet-Visible (UV-Vis), Inframerah (FT-IR), dan 1H-NMR dapat diduga bahwa senyawa hasil isolasi dari daun tumbuhan Benalu Coklat adalah senyawa
flavonoida golongan flavanon. Namun penulis belum bisa menentukan posisi
substituen R yang tepat pada cincin A dan cincin C. Namun demikian struktur
senyawa yang diduga seperti pada gambar 4.4 sebagai berikut :
O
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Berdasarkan hasil skrining fitokimia flavonoida terhadap gum hasil isolasi
dari daun benalu tumbuhan coklat (Dendrophthoe flosculosa Danser)
menunjukkan hasil positif senyawa flavonoida.
2. Hasil isolasi yang diperoleh dari 1250 g daun benalu tumbuhan coklat gum
berwarna kuning kecoklatan, diperoleh sebanyak 13,3 mg, Rf = 0,38
dengan eluen n – heksan : etilasetat 60:40 (v/v).
3. Hasil analisis dengan Spektrofotometri UV-Visible, Spektrofotometri
Inframerah (FT-IR) dan Spektrometri Resonansi Magnetik Proton (1 H-NMR) menunjukkan bahwa senyawa hasil isolasi dari daun Benalu
tumbuhan Coklat diduga adalah senyawa flavonoida golongan flavanon.
5.2 Saran
Untuk memastikan struktur senyawa Flavonoida hasil isolasi, maka perlu
BAB 2
TINJAUAN PUSTAKA
2.1 Daun Benalu Tumbuhan Coklat (Dendrophthoe flosculosa Danser)
Daun benalu tumbuhan coklat memiliki bunga berwarna kuning tua sampai merah
kecoklatan. Daun tersebar dan berlawanan; helaian daun melonjong atau bundar
telur, memiliki panjang 8-21 cm dan lebar 3-9 cm, panjang tangkai daun 3-6 (-10)
mm, ujung daun menirus dan meruncing, dan pangkal daun menirus atau membaji
dan permukaan atas sedikit berkilau atau mengkilap dan permukaan daun buram.
Pertulangan daun menyirip dengan tulang lateral nyata pada kedua sisi.
Perbungaan tandan dengan 30-60 bunga, panjang sumbu perbungaan 15-80 mm,
dengan panjang pedisel 1,5 – 2,5 mm. Mahkota 5 merus, panjang 23-26 mm,
ramping dan pada bagian ujungnya tumpul, merah oranye atau kuning oranye,
membentuk tabung dengan panjang 16-19 mm.
Penyebaran Dendrophthoe flosculosa Danser meliputi Malaysia dan
Sumatera. Ekologi dan habitatnya tumbuh pada ketinggian 0 – 1550 m dpl
(Barlow, 1997).
2.1.1 Sistematika Tumbuhan Benalu Coklat
Daun Benalu Coklat (Dendrophthoe flosculosa Danser)
Kingdom : Plantae
Divisi : Magnoliophyta
Class : Magnoliopsida
Ordo : Santalales
Famili : Loranthaceae
Genus : Dendrophthoe
2.2Senyawa flavonoida
Flavonoid merupakan kelompok senyawa bahan alam terbesar turunan dari
1,3-difenilpropana yang tersebar secara luas pada tumbuhan tingkat tinggi namun juga
dapat ditemukan pada tumbuhan tingkat rendah, termasuk alga. Kebanyakan
flavonoid berwarna kuning, juga memberikan warna kuning pada bunga-bunga
dan buah-buahan, yang mana biasanya ditemukan sebagai glikosida. Sebagian
besar flavonoida berpotensi sebagai senyawa antioksidan (Sarker, 2007).
Senyawa flavonoida terdapat pada semua bagian tumbuhan termasuk
daun, akar, kayu, kulit, tepung sari, bunga, buah dan biji. Kebanyakan flavonoida
berada dalam tumbuh-tumbuhan kecuali alga. Flavonoida juga terdapat pada
hewan. Flavanoida tersebar pada tumbuhan angiospermae, klorofita, fungi
briofita (Markham, 1988).
Flavonoid memiliki potensi sebagai anti inflamasi, antitumor, antimikroba
dan antivirus. Banyak obat-obatan tradisional dan tanaman obat mengandung
flavonoid sebagai senyawa bioaktif.Sifat antioksidan flavonoid terdapat di
buah-buahan segar dan sayuran yang diperkirakan berpotensi untuk pencegahan
penyakit kanker dan jantung (Sarker, 2007).
Kandungan flavonoid yang tinggi terdapat pada epidermis daun dan kulit
buah-buahan yang berperan penting sebagai metabolit sekunder.Pada tumbuhan,
flavonoid terlibat dalam beragam proses seperti perlindungan UV, pigmentasi,
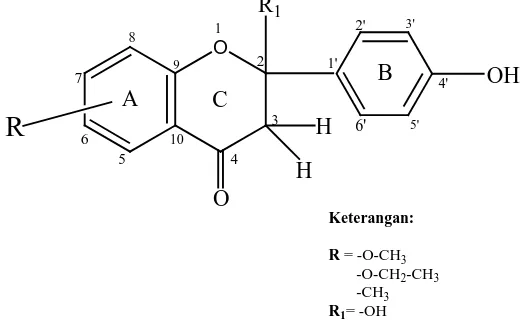
2.2.1 Struktur Dasar dan Penomoran Senyawa Flavonoida
Golongan flavonoida dapat digambarkan sebagai deretan senyawa C6 – C3 – C6.
Yang berarti bahwa kerangka atom karbonnya terdiri atas dua gugus C6 yang
dihubungkan oleh rantai alifatik tiga-karbon seperti pada gambar 2.1 di bawah ini
:
C C C
A B
Gambar 2.1 Kerangka dasar senyawa flavonoida
Flavonoid memiliki ciri khas adanya cincin piran yang menghubungkan
rantai tiga karbon dengan salah satu dari cincin benzena (Robinson, 1995).
Sistem penomoran untuk turunan flavonoid dapat dilihat pada gambar 2.2 sebagai
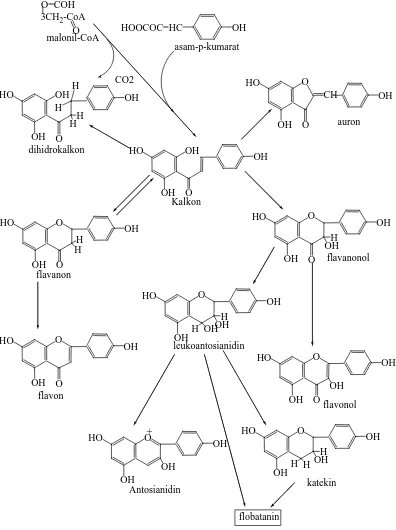
2.2.2 Jalur Metabolisme Flavonoida
Prazat utama flavonoid sudah diketahui dari berbagai hasil percobaan perunutan
tetapi jalur yang lebih rinci belum diketahui secara pasti. Fenilalanina amonia
liase merupakan enzim utama yang mengendalikan masuknya metabolit ke jalur
flavonoid. Percobaan perunutan memastikan bahwa cincin A flavonoid berasal
dari penyambungan kepala-ke-ekor tiga molekul asetat, tetapi ada dua mekanisme
yang berlainan untuk penutupan cincin.
Senyawa C6-C3 misalnya fenilalanina, asam sinamat, dan asam ferulat
merupakanprazat yang efisien untuk cincin B dan rantai C3. Pada tahap tertentu
modifikasi cincin B dapat terjadi sebelum kondensasi dengan atom pada cincin A,
namun kebanyakan modifikasi terjadi pada aras C15. Jalur metabolisme flavonoid
dapat dilihat dengan jelas pada gambar 2.3.
Dalam spesies tumbuhan tertentu terdapat flavonoid yang berbeda – beda
dengan pola hidroksilasi cincin yang sama, perbedaannya hanya pada metilasi,
glikosilasi, dan struktur bagian C3. Hal ini menunjukkan bahwa terdapat senyawa
antara C-15 yang umum yang diubah menjadi berbagai flavonoid setelah pola
hidroksilasi cincin terbentuk. Akan tetapi, berbagai jenis gugus hidroksil ini
tampaknya dimasukkan pada tahap yang berlainan dalam sintesis (Robinson,
O
2.2.3 Klasifikasi Senyawa Flavonoida
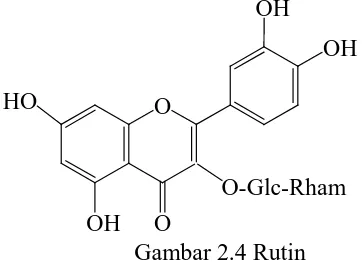
1. Flavonoida O-glikosida
Flavonoida biasanya terdapat sebagai flavonoid O-Glikosida. Pada
senyawa tersebut satu gugus hidroksil flavonoid atau lebih yang terikat
pada satu gula atau lebih dengan ikatan hemiasetal yang tak tahan asam
Pengaruh glikosilasi menyebabkan flavonoid menjadi kurang reaktif
dan lebih mudah larut dalam air. Sifat terakhir ini memungkinkan
penyimpanan flavonoid di vakuola sel (Markham, 1988). Salah satu
contohnya yaiu Rutin pada gambar 2.4 (Sarker, dkk. 2007).
2. Flavonoida C-glikosida
Gula juga dapat terikat pada atom karbon flavonoid dan dalam hal ini
gula tersebut terikat langsung pada inti benzene dengan suatu ikatan
karbon-karbon (Markham, 1988). Contoh dari flavonoida C-glikosida
dapat dilihat pada gambar 2.5 yaitu Isovitexin (Sarker, dkk. 2007).
3. Flavonoida Sulfat
Flavonoid flavonoid lain yang mudah larut dalam air yang mungkin
ditemukan hanya flavonoida sulfat. Senyawa ini mengandung satu ion
sulfat atau lebih yang terikat pada hidroksil fenol atau gula. Secara
teknis senyawa ini sebenarnya bisulfat karena terdapat sebagai garam,
yaitu flavon-O-SO3-K (Markham, 1988).
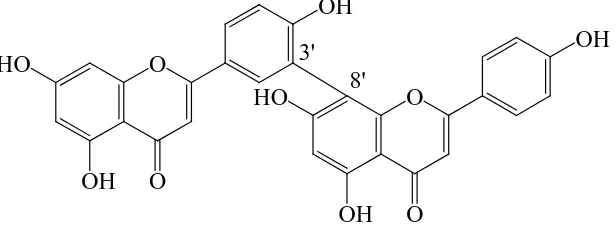
4. Biflavonoid
Biflavonoid adalah flavonoid dimer flavonoid yang biasa terlibat yaitu
biasanya flavon dan flavanon secara biosintesis mempunyai pola
oksigenasi yang sederhana dan ikatan antar flavonoid yaitu ikatan
karbon-karbon atau ikatan eter contoh pada gambar 2.6 Amentoflavon (
Markham, 1988). Biflavonoid terdapat hampir khusus dalam
gimnospermae tetapi kadang-kadang dapat juga ditemukan dalam
angiospermae (Harbone, 1987).
5. Aglikon Flavonoida
Aglikon flavonoid mempunyai atom karbon atom asimetrik dan dengan
demikian menunjukkan sifat keaktifan optik (yaitu memutar bidang
polarisasi-datar). Yang termasuk dalam golongan ini adalah flavanon,
dihidroflavonol, katekin, pterokarpan, rotenoid, dan beberapa
biflavonoid (Markham, 1988).
Flavonoida dapat dikelompokkan berdasarkan keragaman pada rantai C3 yaitu 1. Flavonol
Flavonol dapat dikatakan sebagai flavonoid yang paling tersebar luas
dan tersebar di seluruh kingdom tumbuhan kecuali alga dan fungi
(Gambar 2.7) . Flavonol seperti myricetin, quercetin, isorhamnetin dan
kaemperol pada umumnya ditemukan dalam bentuk o-glikosida
(Robinson, 1995)
2. Flavon
Flavon (Gambar 2.8) memiliki struktur yang sangat mirip dengan
flavonol (Crozier, 2006). Flavonol dan flavon paling tersebar luas dari
semua senyawa fenolik (Cseke, dkk. 2006). Hanya ada 2 flavon umum
yaitu apigenin dan luteolin. Flavon juga terdapat dalam bentuk glikosida
tetapi jenisglikosidanya lebih sedikit daripada jenis gikosida pada
flavonol (Harbone, 1987).
O O
OH
Gambar 2.7 Flavonol
O O
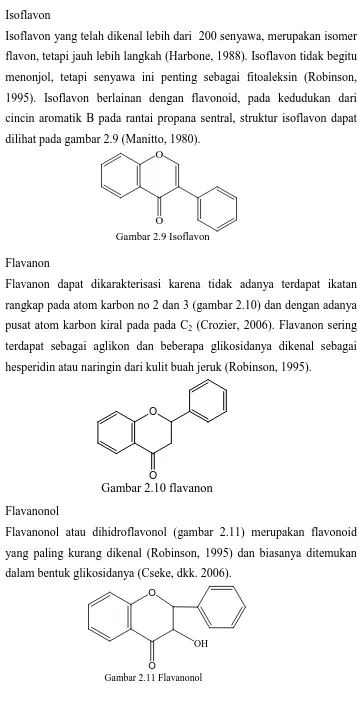
3. Isoflavon
Isoflavon yang telah dikenal lebih dari 200 senyawa, merupakan isomer
flavon, tetapi jauh lebih langkah (Harbone, 1988). Isoflavon tidak begitu
menonjol, tetapi senyawa ini penting sebagai fitoaleksin (Robinson,
1995). Isoflavon berlainan dengan flavonoid, pada kedudukan dari
cincin aromatik B pada rantai propana sentral, struktur isoflavon dapat
dilihat pada gambar 2.9 (Manitto, 1980).
4. Flavanon
Flavanon dapat dikarakterisasi karena tidak adanya terdapat ikatan
rangkap pada atom karbon no 2 dan 3 (gambar 2.10) dan dengan adanya
pusat atom karbon kiral pada pada C2 (Crozier, 2006). Flavanon sering
terdapat sebagai aglikon dan beberapa glikosidanya dikenal sebagai
hesperidin atau naringin dari kulit buah jeruk (Robinson, 1995).
5. Flavanonol
Flavanonol atau dihidroflavonol (gambar 2.11) merupakan flavonoid
yang paling kurang dikenal (Robinson, 1995) dan biasanya ditemukan
dalam bentuk glikosidanya (Cseke, dkk. 2006).
6. Antosianin
Antosianin merupakan pewarna paling penting dan paling tersebar luas
dalam tumbuhan (Harbone, 1988). Antosianin ialah pigmen daun bunga
merah sampai biru yang biasa ( meskipun apigeninidin kuning),
banyaknya sampai 30% bobot kering dalam beberapa bunga. Tidak
seperti golongan flavonoid lainnya antosianin selalu terdapat sebagai
glikosida. Salah satu contoh antosianin dari paku – pakuan misalnya
luteolinidin dapat dilihat pada gambar 2.12 (Robinson, 1995).
7. Antosianidin
Antosianidin merupakan aglikon antosianin yang terbentuk bila
antosianin dihidrolisis dengan asam (Harbone, 1988) dimana secara luas
tersebar dalam kingdom plantae dan jelas terdapat dalam jaringan bunga
dan buah. Antosianidin (gambar 2.13) ini bertanggung jawab dalam
meberikan warna merah,biru, dan ungu. Antosianidin juga ditemukan
dalam di daun, batang, biji dan jaringan akar dan memiliki peran penting
dalam menarik serangga dalam penyerbukan.
8. Auron
Auron berupa pigmen kuning emas terdapat dalam bunga tertentu dan
bryofita (gambar 2.14). Dikenal hanya lima aglikon , tetapi pola
hidroksilasi senyawa ini umumnya serupa dengan pola pada flavonoid
lain dalam larutan basa senyawa ini menjadi merah rose. Beberapa
contoh auron yaitu leptosin, aureusidin, sulfuretin, dan sulfuretin
(Robinson, 1995)
9. Kalkon
Kalkon merupakan zat warna kuning pada bunga, kadang terdapat pada
jaringan lain. Sifat khas kalkon memberikan warna merah dengan
ammonia (Sirait, 2000). Struktur salah satu kalkon dari sumber
tumbuhan dahlia pada gambar 2. 15 (Robinson, 1995)
O
Gambar 2.14 auron
O
Gambar 2.15 Kalkon Dahlia
HO OH
2.2.3 Sifat Kelarutan Flavonoida
Senyawa flavonoid termasuk senyawa polar, karena mempunyai sejumlah gugus
hidroksil ataupun suatu gugus gula. Hal ini memungkinkan flavonoid dapat larut
dalam pelarut polar seperti etanol (EtOH), metanol (MeOH), butanol, aseton,
dimetilsulfoksida (DMSO), dimetilformamida (DMF), air dan lain-lain.
Flavonoid yang berupa aglikon merupakan golongan polifenol yang
memiliki sifat senyawa fenol yaitu bersifat agak asam, Keberadaan gugus gula
yang terikat pada flavonoid (glikosida) cenderung menyebabkan flavonoid lebih
mudah terlarut dalam air. Namun hal sebaliknya tidak berlaku pada aglikon yang
kurang polar seperti isoflavon, flavanon, dan flavon serta flavonol yang
termetoksilasi cenderung lebih mudah larut dalam pelarut seperti eter dan
kloroform (Markham, 1988).
2.3Skrining Fitokimia
Banyak reagen yang dapat digunakan untuk mengetahui keberadaan dari
flavonoid, meskipun beberapa juga akan bereaksi positif dengan senyawa
polifenol. Reagen yang biasa digunakan adalah :
1. Shinoda Test, yaitu dengan menambahkan serbuk magnesium pada ekstrak
sampel dan beberapa tetes HCl pekat. Menghasilkan warna orange, pink,
merah sampai ungu akan terjadi pada senyawa flavon, flavonol, turunan
2,3-dihidro dan xanton.
2. H2SO4(p), flavon dan flavonol akan memberikan perubahan larutan kuning
pekat. Kalkon dan auron menghasilkan larutan berwarna merah atau merah
kebiru-biruan. Flavanon memberikan warna orange sampai merah.
3. NaOH 10% , menghasilkan larutan biru violet (Sarker, et al 2006).
4. FeCl3 5% telah digunakan secara luas untuk mengidentifikasi senyawa
fenol, tetapi tidak dapat digunakan untuk membedakan macam-macam
golongan flavonoid. Pereaksi ini memberi warna kehijauan, warna biru,
2.4 Teknik Pemisahan
Teknik pemisahan memiliki tujuan untuk memisahkan komponen yang akan
ditentukan berada dalam keadaan murni, tidak tercampur dengan
komponen-komponen lainnya. Ada 2 jenis teknik pemisahan:
1. Pemisahan kimia adalah suatu teknik pemisahan yang berdasarkan adanya
perbedaan yang besar dari sifat-sifat fisika komponen dalam campuran
yang akan dipisahkan.
2. Pemisahan fisika adalah suatu teknik pemisahan yang didasarkan pada
perbedaan-perbedaan kecil dari sifat-sifat fisik antara senyawa-senyawa
yang termasuk dalam satu golongan (Muldja, 1995).
2.4.1 Ekstraksi
Terdapat sejumlah metode ekstraksi, yang paling sederhana adalah ekstraksi
dingin (dalam labu besar berisi biomassa), dengan cara ini bahan kering hasil
gilingan diekstraksi pada suhu kamar secara berturut-turut dengan pelarut yang
kepolarannya makin tinggi. Keuntungan utama cara ini adalah metode ekstraksi
yang mudah karena ekstrak tidak dipanaskan sehingga kemungkinan kecil bahan
alam terurai. Penggunaan pelarut dengan peningkatan kepolaran secara berurutan
memungkinkan pemisahan bahan alam berdasarkan kelarutannya (dan
polaritasnya) dalam ektraksi. Hal ini sangat mempermudah proses isolasi.
(Heinrich et al, 2010).
Beberapa metode ekstraksi dapat digunakan untuk mengekstrak suatu
konstituen dalam suatu bahan tanaman, yang diantaranya adalah maserasi,
perkolasi, ekstraksi sokletasi, ekstraksi pelarut bertekanan, ekstraksi dengan
refluks, dan destilasi uap. Dalam ekstraksi padat-cair, bahan tanaman ditempatkan
dalam sebuah wadah, dan dibiarkan terjadi kontak dengan pelarut. Proses yang
terjadi dari seluruh proses dinamis tersebut dapat diuraikan menjadi beberapa
tahap, yaitu tahap pertama pelarut akan berdifusi ke dalam sel, kemudian pelarut
akan melarutkan metabolit, dan pada proses akhir pelarut akan berdifusi keluar
Ekstraksi dianggap selesai bila tetesan terakhir memberikan reaksi negatif
terhadap senyawa yang diekstraksi. Untuk mendapatkan larutan ekstrak pekat,
biasanya pelarut ekstrak diuapkan dengan menggunakan alat rotari evaporator
(Harborne, 1987).
2.4.2 Partisi
Metode pemisahan yang mungkin paling sederhana adalah partisi, yang banyak
digunakan sebagai tahap awal pemurnian ekstrak. Partisi menggunakan dua
pelarut tak bercampur yang ditambahkan kedalam ekstrak tersebut, hal ini dapat
dilakukan secara terus menerus dengan menggunakan dua pelarut yang tak
bercampur yang kepolarannya meningkat.
Partisi biasanya dilakukan melalui dua tahap :
1. Air/petroleum eterringan (heksana) untukmenghasilkanfraksi
nonpolar di lapisanorganik
2. Air/diklorometanatau air/kloroformatau
air/etilasetatuntukmembuatfraksiagak polar di lapisanorganik.
Inimerupakanmetodepemisahan yang
mudahdanmengandalkankelarutanbahanalamdanbukaninteraksifisi
kdengan medium lain (Heinrich et al, 2010).
Prinsip kerja dari partisi yaitu menggunakan prinsip ekstraksi cair-cair.
Ketika fase diam dilapisi dengan suatu penunjang yang berbentuk padatan atau
sering disebut dengan suatu penyangga seperti di kromatografi kolom yang
menggunakan selulosa yang dilapisi dengan air atau plat yang digunakan pada
kromatografi lapis tipis yaitu silika yang menggunakan adsorben yaitu air, fase
diam yang digunakan dibuat berdasarkan pemisahan yang bisa dibawa fase gerak
yang berupa zat organik. Fase gerak yang berupa cairan secara kimia akan
berikatan secara inert menghasilkan fase yang berikatan dan juga melibatkan
proses hidrolitik, dan juga akan membentuk ikatan yang stabil sebagai contoh
2.4.3 Hidrolisa
Hidrolisis merupakan pemecahan ikatan kimia akibat adanya reaksi oleh air
(Cairns, 2004). Hidrolisis glikosida flavonoid dapat dilakukan dengan tiga metode
yaitu hidrolisis asam, hidrolisis basa dan hidrolisis dengan bantuan enzim
(Markham, 1988). Ketiga metode hidrolisis tersebut memiliki kegunaan
masing-masing. Hidrolisis asam banyak digunakan untuk melepaskan residu gula terikat
dan aglikon flavonoid. Hidrolisis enzim digunakan untuk mengidentifikasi gula
spesifik dan posisi ikatan, sedangkan hidrolisis basa digunakan untuk
menghilangkan asam ester organik pada flavonoid (Tomas-Barberan & Farreres,
2012).
Flavonoid umumnya terdapat dalam tumbuhan, terikat pada gula sebagai
glikosida dan aglikon flavonoid yang mungkin terdapat dalam satu tumbuhan
dalam beberapa bentuk kombinasi glikosida. Pemilihan metode hidrolisis
didasarkan pada bentuk glikosida flavonoid, gula penyusun glikosida dan tempat
berikatan gula dengan aglikon. Perbedaan kecepatan hidrolisis glikosida
bergantung pada jenis gula dan tempat berikatan gula dengan aglikon (Bohm,
1998). Harborne (1965) mengkategorikan glikosida menjadi 3 kategori yaitu
mudah dihidrolisis, lambat dihidrolisis dan tahan asam.
Prosedur yang digunakan untuk hidrolisis asam dari flavonoid glikosida
adalah, sebanyak 2 mg sampel flavonoid glikosida dicampur dengan asam klorida
6% sebanyak 5 ml dengan jumlah metanol yang sangat sedikit pada sampel untuk
membuat proses hidrolisis menjadi sempurna. Larutan dipanaskan selama 45
menit lalu didinginkan, kemudian ekstrak sepenuhnya dilarutkan dengan eter.
Penguapan dari larutan akan mengendapkan ramnosa dan glukosa. Lapisan eter
setelah dikeringkan dengan menggunakan natrium sulfat akan didapatkan aglikon
2.4.4 Kromatografi
Saat ini kromatografi adalah teknik pemisahan yang paling umum dan sering
digunakan dalam bidang kimia analisis dan dimanfaatkan untuk analisis baik
secara kualitatif dan kuantitatif atau bahkan analisis preparatif. Teknik
kromatografi telah berkembang dan digunakan untuk memisahkan dan
mengkuantifikasi komponen-komponen yang kompleks, baik organik maupun
anorganik (Sudjadi, 2007).
Semua teknik kromatografi pada dasarnya menggunakan dua fasa, yaitu
fasa tetap dan fasa bergerak. Pemisahan tergantung pada gerakan relatif dari
kedua fasa tersebut. Kromatografi dapat digolongkan sesuai dengan sifat dari fasa
tetap, jika berupa zat padat dikenal sebagai kromatografi serapan (absorption
chromatography) dan jika berupa zat cair dikenal sebagai kromatografi partisi
(partition chromatography) (Sastrohamidjojo, 1985).
Proses Sorpsi
Sorpsi merupakan proses pemindahan solut dari fasa gerak ke fasa diam,
sedangkan proses sebaliknya pemindahan solut dari fasa diam ke fasa gerak
disebut desorpsi. Keduanya terjadi secara terus-menerus selama pemisahan karena
sistem kromatografi berada dalam keadaan kesetimbangan dinamis.
Solut akan terdistribusi diantara dua fasa yang sesuai dengan perbandingan
distribusinya untuk menjaga keadaan yang setimbang. Beberapa mekanisme yang
terlibat pada proses sorpsi yaitu adsorpsi, partisi, pertukaran ion, dan eksklusi
Adsorben
Silika gel merupakan jenis adsorben (fase diam) yang penggunaannya
paling luas. Permukaan silika gel terdiri atas gugus Si-O-Si dan gugus silanol
(Si-OH). Gugus silanol bersifat sedikit asam dan polar sehingga dapat membentuk
ikatan hidrogen dengan solut-solut yang agak polar sampai sangat polar.
Adanya air dari atmosfer yang diserap oleh permukaan silika gel mampu
mendeaktifkan permukaannya karena air akan menutup sisi aktif silika gel. Hal ini
dapat diatasi dengan memanaskan pada suhu 1050C, meskipun demikian
reprodusibilitasnya sulit dicapai kecuali jika suhu dan kelembapan benar-benar
dijaga secara hati-hati. Semakin polar solut maka akan semakin tertahan kuat ke
dalam adsorben silika gel ini (Sudjadi, 1986).
Silika gel dapat diaktivasi dengan cara dipanaskan pada suhu 110ºC
selama 24 jam. pH dari silika gel yang telah diaktivasi adalah 4. Di samping itu,
silika gel juga dapat di nonaktifkan (reactivation) dengan cara pemanasan pada
suhu 110ºC selama 24 jam (Armarego, dkk. 2012).
2.4.4.1 Kromatografi Lapis Tipis
Kromatografi lapis tipis dikembangkan oleh Ismailoff dan Schraiber pada tahun
1938. Metode ini sederhana, sensitif, kecepatan pemisahan tinggu dan mudah
untuk memperoleh kembali senyawa-senyawa yang terpisahkan (Khopkar,1990).
Dalam kromatografi lapis tipis, fase diamnya merupakan penjerap
berukuran kecil dengan diameter partikel antara 10-30µm. Semakin kecil ukuran
partikel fase diam, maka semakin baik kinerja efisiensi dan resolusi kromatografi
lapis tipis. Fase gerak yang dikenal sebagai pelarut pengembangan bergerak
sepanjang fase diam akibat adanya pengaruh kapiler pada pengembangan secara
menaik (ascending) ataupun pengaruh gravitasi pada pengembangan secara
Pemilihan fase gerak yang digunakan pada kromatografi lapis tipis
tergantung pada solut yang dianalsis dan fase diam yang digunakan
(Sumarno,2001).
Kromatografi lapis tipis digunakan untuk dua tujuan pertama sebagai
metode untuk memperoleh hasil kualitatif, kuantitatif atau preparatif dan yang
kedua yaitu untuk menentukan sistem pelarut yang akan digunakan pada
kromatografi kolom atau kromatografi cair kinerja tinggi. Dengan menggunakan
kromatografi lapis tipis, pemisahan yang dilakukan pada senyawa yang berbeda
seperti senyawa organik alam, senyawa organik sintetik, kompleks
anorganik-organik, dapat dilakukan dalam beberapa menit dan peralatan yang digunakan
juga tidak mahal dan jumlah cuplikan yang rendah dalam beberapa mikrogram
dapat ditangani. Kelebihan dari metode kromatografi lapis tipis ini yaitu
pemakaian pelarut dan cuplikan yang jumlahnya sedikit (Gritter,1991).
Fase diam yang digunakan dalam kromatografi lapis tipis berupa fase
polar seperti silika gel, kiselguhr, alumina (aluminium oksida), magnesium silikat
dan selulosa, dan fase non polar (fase terbalik) seperti fase diam dari silika. Bila
fase diam telah ditentukan maka pemilihan fase gerak yang akan digunkan
berpedoman pada kekuatan elusi dari fase gerak tersebut (Sumarno,2001).
2.4.4.2 Kromatografi Kolom
Pada kromatografi kolom, campuran yang akan dipisahkan diletakkan berupa pita
pada bagian atas kolom penjerap yang berada dalam tabung kaca. Pelarut sebagai
fasa gerak dibiarkan mengalir melalui kolom karena aliran yang disebabkan oleh
gaya berat atau didorong dengan tekanan. Pita senyawa pelarut bergerak melalui
kolom dengan laju berbeda, memisah, dan dikumpulkan berupa fraksi ketika
2.4.4 Kristalisasi
Kristalisai adalah pengendapan kristal dari larutan yang terbuat dari bahan
tertentu. Selama proses pembentukan kristal, molekul akan cenderung menjadi
melekat kristal tumbuh terdiri dari jenis yang sama molekul karena cocok dalam
kisi kristal untuk molekul struktur yang sama daripada molekul yang lain. Jika
proses kristalisasi diperbolehkan untuk terjadi dalam mendekati – kondisi
kesetimbangan, preferensi molekul untuk deposit pada permukaan terdiri dari
molekul seperti akan menyebabkan peningkatan dalam kemurnian bahan kristal.
Sehingga proses rekristalisasi adalah salah satu metode yang paling penting
tersedia bagi ahli kimia untuk pemurnian padatan ( Pasto, 1992 ).
2.4.5 Rekristalisasi
Amorf yang diperoleh dari hasil isolasi dilarutkan kembali dengan EtOAc, diaduk
hingga semua amorf larut sempurna. Kemudian ditambahkan n – heksana secara
perlahan – lahan hingga pembentukan kembali senyawa yang lebih murni dari
sebelumnya dan jatuh di dasar wadah. Didekantasi larutan bagian atas wadah.Lalu
diuapkan sisa pelarut dari amorf hingga diperoleh kristal yang benar – benar bebas
dari pelarut (Jacobs, 1974).
2.5 Teknik Spektroskopi
Teknik analisis spektroskopi berasaskan antaraksi radiasi elektromagnet dengan
komponen atom atau molekul yang menghasilkan fenomena bermakna sebagai
parameter analisis. Pada spektroskopi pembangkit sinyal adalah hasil antaraksi
energi radiasi elektromagnet dengan elektron dalam atom/molekul analit.
Teknik spektroskopi antaraksi radiasi elektromagnet dengan komponen
2.5.1 Spektrofotometer UV-Vis
Spektrofotometer UV-Vis merupakan pengukuran panjang gelombang dan
intensitas sinar ultraviolet dan cahaya tampak yang diabsorbsi oleh sampel.
Spektrofotometer UV-Vis umumnya digunakan untuk menentukan jenis
kromofor, ikatan rangkap terkonyugasi, serta menganalisis senyawa organik
secara kuantitatif dengan menggunakan hukum Lambert-Beer (Dachriyanus,
2004).
Spektrofotometer serapan ultraviolet juga digunakan untuk menentukan
jenis flavonoid dan menentukan pola oksigenasi. Selalin itu juga berguna untuk
menentukan kedudukan gula atau metil yang terikat pada salah satu gugus
hidroksi fenol berdasarkan penambahan pereaksi (pereaksi geser) kedalam suatu
larutan cuplikan dan mengamati pergeseran puncak serapan yang terjadi.
Spektrum flavonoid biasanya ditentukan dalam larutan dengan menggunkan
pelarut metanol atau etanol (EtOH). Spektrum yang khas dari flavonoid ini terdiri
atas dua maksimal pada rentang 240-285 nm (pita II) dan 300-550 nm (pita I)
(Markham,1988).
2.5.2 Spektrofotometer Inframerah (FT-IR)
Spektrofotometer inframerah umumnya digunakan untuk menentukan gugus
fungsi senyawa organik dan mengetahui informasi struktur suatu senyawa
organik dengan membandingkan daerah sidik jarinya.
Pengukuran spektrum inframerah dilakukan pada daerah cahaya tengah
(mid-infrared) yaitu pada panjang gelombang 2.5 – 50µm atau bilangan
gelombang 4000 – 200 cm-1. Sehingga energi yang dihasilkan oleh radiasi ini akan menyebabkan vibrasi atau getaran pada molekul. Setiap jenis ikatan kimia
Karakteristik frekuensi vibrasi IR dipengaruhi oleh perubahan yang sangat
kecil pada molekul sehingga sulit untuk menentukan struktur yang hanya
berdasarkan pada data IR saja (Dachriyanus, 2004).
2.5.3 Spektrometer Resonansi Magnetik Proton (1H-NMR)
Spektrometer resonansi magnetik inti (Nuclear Magnetic Resonance), yang
disingkat sebagai NMR, merupakan instrumen yang sangat penting untuk
memperoleh informasi senyawa kimia, juga dapat menyelesaikan dan
memecahkan masalah atau informasi yang sebelumnya sulit untuk diperoleh.
Struktur yang dianalisis dengan menggunakan NMR akan memberikan
informasi mengenai lingkungan kimia atom hidrogen, jumlah atom hidrogen
dalam setiap lingkungan da struktur gugusan yang berdekatan dengan setiap atom
hidrogen (Cresswell,1982).
Senyawa yang paling lazim digunakan sebagai acuan dalam NMR ini
adalah tetrametilsilana (TMS), dimana senyawa ini mempunyai beberapa
kelebihan yaitu lamban secara kimia, larut dalam kebanyakan pelarut organik.
TMS akan memberikan puncak serapan yang tajam tunggal serta menyerap pada
medan yang lebih tinggi daripada hampir semua proton organik
(Silverstein,1986).
NMR mempunyai peranan penting dalam ilmu kimia. Hal ini setidaknya
disebabkan oleh dua faktor. Pertama, penerapan NMR yang terbaru merupakan
hasil peningkatan selama beberapa tahun terakhir. Kedua, spektrometer NMR
merupakan instrumen yang tersedia di pasaran dan berkembang terus, tentunya
juga memenuhi standar sensitivitas, fleksibilitas, efisiensi, kecanggihan
komputasi, dan harga yang sesuai. Peningkatan NMR lainnya dapat dilihat dalam
hal spektrum NMR zat padat, NMR multi-dimensi zat cair, dan kemampuan untuk
BAB 1
PENDAHULUAN
1.1Latar Belakang
Senyawa kimia organik bahan alam merupakan senyawa yang sebagian besarnya merupakan senyawa aromatik. Secara umum senyawa tersebut tersebar secara luas sebagai zat warna alam yang memberikan warna pada bunga, kayu pohon, bermacam – macam kapang dan lumut termasuk zat warna alizarin (Lenny, 2006).
Flavonoid merupakan senyawa polifenol yang berasal dari tumbuhan yang merupakan salah satu senyawa yang paling penting dalam kebutuhan manusia yang tersebar secara luas dalam makanan (Pinheiro, 2012). Flavonoid terdiri dari lima belas atom karbon, dengan dua cincin aromatik yang dihubungkan oleh tiga atom karbon. Di antara senyawa fenolik lainnya, flavonoid paling banyak ditemukan di seluruh kingdom plantae (Crozier, 2006).
Secara umum flavonoid merupakan senyawa yang larut dalam air dan banyak ditemukan pada tanaman sebagai glikosida yang mana biasanya akan mempersulit penentuan struktur (Kaufman, dkk. 1999). Flavonoid ditemukan dalam bentuk -O atau -C glikosida dan sebagian kecil berada dalam bentuk aglikon. Flavonoid sangat berperan penting dalam pertumbuhan tanaman, perbungaan, bantalan buah, pada penyakit dan pertahanan bakteri, dll. Dalam beberapa tahun terakhir, penelitian flavonoid dilakukan dengan tujuan untuk pengembangan nilai medis, penentuan uji, ekstraksi dan teknologi isolasi (Cseke, dkk. 2006).
Senyawa flavonoid merupakan senyawa yang dapat mencegah pertumbuhan sel kanker. Senyawa aktif yang terdapat dalam benalu mengandung querstrin, alkaloida, saponin, flavonoid dan tanin. Setiap kandungan yang terdapat dalam benalu tergantung dari jenis inang yang ditumpanginya (Winasis, 2015). Benalu seringkali dianggap sebagai parasit atau tanaman yang merugikan bagi tanaman yang ditumpanginya. Namun, di samping hal itu ternyata benalu memiliki khasiat dalam hal pengobatan (Kariman, 2014). Di Indonesia, benalu sudah lama dikenal sebagai obat antikanker tradisional, selain itu juga digunakan untuk obat batuk, diuretik, dan perawatan setelah melahirkan (Fajriah, S. 2013). Khasiat dari daun benalu lainnya adalah untuk pengobatan amandel, tumor, serta campak (Kariman, 2014).
Fitrya (2011) melakukan isolasi senyawa flavonoid dari daun benalu teh (Scurullaatropurpureea BL. Dans) yang menyatakan adanya kandungan senyawa flavonoida. Berdasarkan hasil analisa spektroskopi dan uji fitokimia diduga senyawa tersebut adalah kuersetin.
Dari penelitian sebelumnya terhadap tumbuhan benalu coklat, Siahaan (2015) menyatakan bahwa uji skrining fitokimia ekstrak metanol daun benalu tumbuhan coklat mengandung golongan senyawa flavonoid, terpenoid dan tanin sedangkan ekstrak etil asetat mengandung golongan senyawa flavonoid dan terpenoid dan ekstrak n-heksana hanya mengandung terpenoid. Aktivitas antioksidan ekstrak metanol dan etil asetat daun benalu kakao termasuk kategori sangat kuat dengan nilai IC50 masing-masing sebesar
28,043 dan 23,673 ppm.
1.2Permasalahan
Permasalahan dalam penelitian ini adalah bagaimana cara mengisolasi senyawa flavonoida yang terdapat dalam daun benalu tumbuhan coklat dan menentukan golongan flavonoida apa yang terkandung di dalamnya.
1.3 Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mengisolasi senyawa flavonoida dan menentukan golongan flavonoida dari daun benalu tumbuhan coklat.
1.4 Manfaat Penelitian
Dari hasil penelitian diharapkan dapat memberikan sumber informasi ilmiah pada bidang Kimia Bahan Alam Hayati khusunya tentang golongan senyawa flavonoida yang terkandung dalam daun benalu tumbuhan coklat.
1.5 Lokasi Penelitian
1. Tempat pengambilan sampel
Sampel yang digunakan diperoleh dari Jl. Djamin Ginting, KM. 38.7, Deli Serdang, Ketangkuhen, Sibolangit.
2. Tempat melakukan penelitian
Penelitian dilakukan di laboratorium Program Pascasarjana, Departemen Kimia FMIPA-USU, Medan
3. Lokasi Identifikasi Senyawa
Analisis Spektrofotometer Resonansi Magnetik Inti Proton (1H-NMR), dilakukan di laboratorium penelitian Institut Teknologi Bandung (ITB).
Analisa Spektrofotometer Inframerah (FT-IR) dan spektrofotometer UV-Visible
dilakukan di pusat penelitian Kimia-LIPI, kawasan PUSPITEK Serpong,
1.6 Metodologi Penelitian
Dalam penelitian ini, isolasi senyawa flavonoida dilakukan terhadap daun benalu tumbuhan coklat berupa serbuk halus yang kering sebanyak 1250 gram. Tahap awal yaitu dilakukan uji polifenol dan flavonoida untuk senyawa flavonoida yaitu dengan merendam daun Benalu Tumbuhan Coklat menggunakan pelarut metanol dan etil asetat dengan menggunakan pereaksi FeCl3 5%.
ISOLASI SENYAWA FLAVONOIDA DARI DAUN BENALU TUMBUHAN COKLAT
(Dendrophthoe flosculosa Danser)
ABSTRAK
Isolasi senyawa flavonoida yang terdapat pada daun benalu tumbuhan coklat (Dendrophthoe flosculosa Danser) telah dilakukan melalui ekstraksi maserasi dengan pelarut metanol. Kemudian ekstrak pekat metanol dilarutkan dengan etil asetat untuk pemisahan tanin. Ekstrak etil asetat kemudian disaring. Ekstrak pekat etil asetat dilarutkan dengan metanol dan dipartisi dengan n-heksana. Ekstrak pekat metanol dihidrolisis dengan HCl 2N dan selanjutnya dipartisi dengan kloroform. Ekstrak pekat kloroform dipisahkan dengan kromatografi kolom dengan fasa diam silika gel 60 F254 dan
eluen n-heksana : etil asetat 90:10; 80:20; 70:30; 60:40 (v/v). Fraksi dari perbandingan (60:40) v/v dimurnikan dan dianalisis dengan kromatografi lapis tipis menghasilkan noda tunggal yang menandakan kemurnian dari senyawa hasil isolasi yang berupa gum berwarna kuning kecoklatan dengan massa = 13,3 mg, dan harga Rf = 0,38. Selanjutnya senyawa yang diperoleh dianalisis dengan Spektrofotometer UV-Visibel,Inframerah (FT-IR) dan Spektrometer Resonansi Magnetik Inti Proton (1H-NMR). Dari hasil identifikasi data spektrofotometer diindikasikan senyawa hasil isolasi adalah senyawa flavonoida golongan Flavanon.
ISOLATION OF FLAVONOID COMPOUNDS FROM PARASITE OF COCOA (Dendrophthoe flosculosa Danser)
ABSTRACT
Isolation of flavonoid compounds from parasite of cocoa (Dendrophthoe flosculosa Danser)performed by extracted maceration using methanol solvent. Concentrated methanol extract then dissolved with ethyl acetate for tannins separations. Ethyl acetate extract then filtered. Concentrated ethyl acetate extract is dissolved with methanol and partition extracted with n-hexane. Concentrated methanol extract of acidified with HCl 2N and then partitioned with chloroform. Concentrated chloroform extracts was separated by column chromatography with stationary phase silica gel 60 F254 and n-hexane eluent :
ethyl acetate 90:10 ; 80:20; 70:30 ; 60:40 (v/v). The fraction from n-hexane : ethyl acetate (60:40) v / v was purified and analyzed by thin layer chromatography to produce a single stain that indicates the purity of isolated compound and have produced tawny gum with a mass = 13.3 mg, and Rf = 0.38. Furthermore, the compound was analyzed by UV-Visible, Fourier Transform Infra Red Spectroscopy (FT – IR) and Nuclear Magnetic Resonance Spectroscopy (1H – NMR). From the data analysis and interpretation of spectroscopic, alleged that the isolated compound was flavonoid compound, flavanone class.
ISOLASI SENYAWA FLAVONOIDA DARI DAUN BENALU
TUMBUHAN COKLAT (Dendrophthoe flosculosa Danser)
SKRIPSI
TRINITA MEGA SILVIA
120802064
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
ISOLASI SENYAWA FLAVONOIDA DARI DAUN BENALU TUMBUHAN COKLAT (Dendrophthoe flosculosa Danser)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
TRINITA MEGA SILVIA
120802064
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
PERSETUJUAN
Judul : Isolasi Senyawa Flavonoida Dari Daun Benalu Tumbuhan Coklat
(Dendrophthoe flosculosa Danser) Kategori : Skripsi
Nama Mahasiswa : Trinita Mega Silvia Nomor Induk Mahasiswa : 120802064
Program Studi : Sarjana (S1) Kimia Departemen : Kimia
Fakultas : Matematika Dan Ilmu Pengetahuan Alam (FMIPA) Universitas Sumatera Utara
Disetujui di
Medan, Agustus 2016
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Lamek Marpaung, M.Phil,Ph.D Prof. Dr. Tonel Barus
NIP: 1952 0828 1982 031001 NIP: 1945 0801 1974 121001
Diketahui/ Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
ISOLASI SENYAWA FLAVONOIDA DARI DAUN BENALU TUMBUHAN COKLAT
(Dendrophthoe flosculosa Danser)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Agustus 2016
PENGHARGAAN
Segala puji dan syukur penulis panjatkan kepada Tuhan Yesus Kristus atas berkat dan penyertaanNya setiap saat sehingga penulis dapat menyelesaikan penelitian dan penyusunan skrispsi ini dengan baik. Dalam pelaksanaan penelitian hingga penyelesaian skripsi ini, penulis menyadari banyak mendapat bantuan, motivasi dan dukungan dari berbagai pihak. Untuk itu pada kesempatan ini penulis mengucapkan terimakasih kepada :
1. Bapak Prof.Dr.Tonel Barus sebagai pembimbing I dan Bapak Lamek
Marpaung,M.Phil,Ph.D sebagai pembimbing II yang dengan sabar telah memberikan dorongan, bimbingan dan saran sehingga skripsi ini dapat diselesaikan.
2. Ibu Dr.Rumondang Bulan Nst, M.S selaku Ketua Departemen Kimia
FMIPA USU dan Bapak Drs.Albert Pasaribu, M.Sc selaku Sekretaris Departemen Kimia FMIPA USU
3. Kepala Laboratorium Kimia Bahan Alam Hayati FMIPA USU Medan
Bapak Lamek Marpaung,M.Phil,Ph.D beserta Dosen dan seluruh Staff Laboratorium Kimia Bahan Alam Hayati FMIPA USU
4. Seluruh Dosen Departemen Kimia FMIPA USU yang telah memberikan
waktunya untuk memberi bimbingan selama penulis mengikuti kuliah di Departemen Kimia FMIPA USU, terkhusus kepada Ibu Sofia Lenny S.si M.si selaku dosen pembimbing akademik yang telah memberikan waktunya untuk memberikan pengarahan dalam menyelesaikan studi selama perkuliahan dan penelitian berlangsung
5. Seluruh asisten kimia bahan alam hayati yang telah membantu penulis dalam mengerjakan penelitian ini dengan baik
6. Kepada semua teman-teman penulis yang tidak disebutkan namanya satu per satu yang telah banyak membantu dan memberi semangat dan motivasi kepada penulis untuk melakukan penelitian ini serta kepada seluruh teman-teman stambuk 2012 dan adik-adik stambuk 2013-2015.
7. Kepada semua pihak yang tidak disebutkan namun telah membantu
penulis dalam penyelesaian skripsi ini.
Akhirnya saya mengucapkan terimakasih yang sebesar-besarnya kepada orangtua saya (A. Sinurat dan L br. Sitompul) yang telah memberi seluruh dukungan sarana dan prasarana dan semangat bahkan dengan setia terus membantu penulis dalam doa, serta kakak, adik, dan abang tercinta Elisha E. R. Sinurat, Shantika L. Sinurat, Partogi P. Sinurat, Elia K. Tobing, Agus Simanjuntak atas doa dan dukungannya. Skripsi ini saya persembahkan untuk kita semua. Semoga Tuhan senantiasa memberkati kita.