OPTIMASI EKSTRAKSI DAN KARAKTERISASI
KOLAGEN DARI GELEMBUNG RENANG
IKAN CUNANG (Congresox talabon)
FERNANDY M. DJAILANI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Optimasi Ekstraksi dan Karakterisasi Kolagen dari Gelembung Renang Ikan Cunang (Congresox talabon) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2016
Fernandy M. Djailani
RINGKASAN
FERNANDY M. DJAILANI. Optimasi Ekstraksi dan Karakterisasi Kolagen dari Gelembung Renang Ikan Cunang (Congresox talabon). Dibimbing oleh WINI TRILAKSANI dan TATI NURHAYATI.
Kolagen umumnya diproduksi dari kulit dan tulang hewan darat antara lain sapi, babi dan unggas yang pada sejarahnya dapat terkena wabah sapi gila, penyakit mulut dan kuku, dan flu burung. Konsumsi sapi dan babi juga bertentangan dengan pemeluk agama tertentu. Hal ini membuka kesempatan untuk mencari alternatif bahan baku kolagen dari hewan perairan. Ekstraksi kolagen dari hasil samping industri perairan diantaranya kulit, sisik, dan tulang ikan telah banyak dilakukan. Salah satu hasil samping pengolahan ikan yang belum banyak diteliti adalah gelembung renang termasuk yang dari ikan cunang (Congresox talabon). Ekstraksi kolagen dari gelembung renang beberapa jenis ikan menghasilkan rendemen yang berbeda-beda disebabkan oleh metode ektraksi dan jenis ikan yang digunakan. Tujuan penelitian ini adalah mendapatkan kondisi optimal pre-treatment NaOH, ekstraksi optimal dengan metode ASC dan hidro-ekstraksi, serta informasi karakteristik kolagen hasil ASC dan hidro-ekstraksi gelembung renang ikan cunang.
Penelitian ini dilakukan dalam 3 tahap yaitu preparasi dan karakterisasi
gelembung renang ikan cunang, optimasi pre-treatment NAOH dan optimasi
ektraksi serta karakterisasi kolagen metode ASC pada 9ºCdan hidro-ekstraksi 40ºC.
Rancangan percobaan yang digunakan pada tahappre-treatmentNaOH Rancangan
Acak Lengkap Faktorial (RALF) dan rancangan percobaan yang digunakan pada tahap optimasi ekstraksi adalah rancanganBox-Behnkenmetode respon permukaan (RSM).
Proporsi gelembung renang ikan cunang yakni 0.59% dari berat total ikan. Gelembung renang memiliki kadar air 58.28%, protein 40.12%, karbohidrat 0.70%, Abu 0.47%, dan lemak 0.43%. Tahap pre-treatment NaOH terpilih kombinasi perlakuan konsentrasi 0.15 MNaOH dan lama waktu perendaman 10 jam mampu mereduksi protein non kolagen sebesar 0.27 mg/mL. Ekstraksi kolagen dari gelembung renang ikan cunang menggunakan metode ASC yang terpilih adalah kombinasi perlakuan konsentrasi asam asetat 0.64 M, volume asam asetat 40.03 mL dan waktu perendaman 71.57 jam yang optimal menghasilkan rendemen 59.26% (bk). Ekstraksi kolagen dari gelembung renang ikan cunang menggunakan metode hidro-ekstraksi yang terpilih adalah kombinasi perlakuan konsentrasi asam asetat 0.1 M, waktu perendaman asam asetat 1.68 jam dan waktu ekstraksi akuabides 1 jam yang optimal menghasilkan rendemen 63.84% (bk). Kolagen ASC dan hidro-ekstraksi memiliki karakteristik asam amino masing-masing didominasi oleh glisin 266 dan 275 (/1000 total residu), arginin 126 dan 192 (/1000 total residu), alanin 113 dan 134 (/1000 total residu), dan prolin 109 dan 134 (/1000 total residu). Gugus fungsi FTIR menunjukkan adanya amida a, amida b, amida I, amida II, dan amida III. Kolagen ASC dan hidro-ekstraksi merupakan kolagen tipe I dicirikan adanya rantai α1dan α2. Suhu termal atau transisi gelasi kolagen ASC 63.88ºC dan
hidro-ekstraksi 67.26ºC.
SUMMARY
FERNANDY M. DJAILANI. Extraction Optimization and Characterization of Collagen form Swim bladder of Cunang (Congresox talabon). Supervised by WINI TRILAKSANI and TATI NURHAYATI.
Collagen is commonly produced from skins and animal bones of cow, pig, and poultry which historycally could be exposed by bovine spongiform encephalophaty, foot and mouth disease, and the avian influenza. In addition, the utilization of cow and pig conflict with certain faiths. This conditions provide an opportunity to search an alternative raw materials collagen from aquatic animals. Collagen extraction from industrial aquatic by product such as skin, scales, and bones of fish had already been conducted. However there is one of the fish processing by product that have not been developed to other product namely cunang swimbladders (Congresox talabon). Collagen extraction from swimbladders of various fish produced different yield caused by the extraction methods and types of fishes. The purposes of this study were to get the optimal condition of NaOH pre-treatment, optimal extraction condition using ASC and hydro-extraction methods, and to obtain the characteristics information of cunang swimbladders and collagen extracted by both ASC and hydro-extraction.
This research was carried out in three stages i.e. preparation and characterization of cunang swimbladders, optimize pre-treatment using NaOH, extraction optimization and characterization collagen using ASC at 9ºCand hydro-extraction methods at 40ºC. The experimental design on NaOH pretreatment was random complete factorials design (RALF) meanwhile experimental design in the extraction optimization was Box-Behnken design on response surface method.
Proportion of cunang swimbladders was about 0.59% from the total weight of fish. Swimbladder contained moisture 58.28%, protein 40.12%, carbohydrate 0.70%, ash 0.47%, and fat 0.43%. The best result from NaOH pre-treatment was combination treatment using 0.15 M NaOH during 10 hours of soaking which reduced 0.27 mg/ml non collagen of protein. The best collagen extraction from cunang swimbladders using ASC was combination treatment 0.64 M acetic acid, 40.03 mL volume of acetic acid, and 71.57 hours of soaking which produced yield 59.26% (db). The best collagen extraction from cunang swimbladders using hydro-extraction were combination treatment by 0.1 M acetic acid, 1.68 hours of soaking and 1 hours extraction using aquabides which produced yield 63.84% (db). The amino acid characteristics of collagen extracted by ASC and hydro-extraction was dominated by glisin 266 and 275 (/1000 total residues), arginin 126 and 192 (/1000 total residues), alanin 113 and 134 (/1000 total residues), and prolin 109 and 134 (/1000 total residues) respectively. The result of FTIR showed that collagen contained amida a, amida b, amida I, amida II, and amida III. ASC and hydro-extraction collagen result showed that this collagen was collagen type 1 that
contained α1and α2sequence. The thermal temperature and gelation transition of
collagen extracted by both ASC and hydro-extraction were 63.88 ºC and 67.26 ºC respectively.
© Hak Cipta Milik IPB, Tahun 2016 Hak Cipta Dilindungi Undang-Undang
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Teknologi Hasil Perairan
OPTIMASI EKSTRAKSI DAN KARAKTERISASI
KOLAGEN DARI DARI GELEMBUNG RENANG
IKAN CUNANG (Congrenesox talabon)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga tesis ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2015 ini adalah Optimasi Ekstraksi dan Karakterisasi Kolagen dari Gelembung Renang Ikan Cunang (Congresox talabon).
Kesuksesan Penulis melaksanakan penelitian tidak lepas dari dukungan berbagai pihak. Penulis menyampaikan banyak terima kasih yang setulusnya kepada:
1. Ibu Dr Ir Wini Trilaksani MSc dan Ibu Dr Tati Nurhayati SPi MSi selaku tim komisi pembimbing atas kesediaan waktu untuk membimbing, memberikan arahan dan saran selama penyusunan tesis.
2. Bapak Prof Dr Ir Joko Santoso MSc selaku gugus kendali mutu (GKM) atas kesediaan waktu untuk mengoreksi penulisan naskah tesis ini.
3. Bapak Dr Eng Uju SPi MSi atas kesediaan waktu selaku penguji pada sidang akhir tesis.
4. Bapak dan Ibu staf pengajar, staf administrasi dan laboran Program Studi Teknologi Hasil Perairan yang telah membantu dan bekerjasama selama penulis menempuh studi
5. Keluarga besar penulis teruntuk ayahanda Muhiddin Djailani SPi, ibunda Nelvitha Kantue, adik Julia Djailani SPi, dan adik Mohammad Ridho Djailani atas doa, motivasi, dan dukungan moril maupun materil selama penulis menempuh studi
6. Teman-teman S2 THP IPB yang telah membantu dan mendukung proses penelitian sampai penyusunan tesis selesai
Penulis menyadari bahwa masih terdapat kekurangan dalam penyusunan tesis ini. Jika terdapat kesalahan, penulis memohon maaf yang sebesar-besarnya. Semoga karya ilmiah ini membawa manfaat bagi seluruh masyarakat.
Bogor, Desember 2016
DAFTAR ISI
Karakterisasi dan preparasi bahan baku gelembung renang ikan cunang 4
Pre-treatment NaOH 4
Optimasi ekstraksi dan karakterisasi kolagen ASC dan hidro-ekstraksi 6
Prosedur Analisis 6
Analisis berat molekul dengan SDS-PAGE 9
Analisis gugus fungsi dengan FTIR 9
Analisis asam amino 9
Analisis termal differential scanning calorimetry (DSC) 10
Rancangan percobaan dan analisis data 11
3 HASIL DAN PEMBAHASAN 11
Karakterisasi Gelembung Renang 11
Proporsi gelembung renang ikan cunang 12
Karakteristik kimia gelembung renang ikan cunang 12
DAFTAR PUSTAKA 24
LAMPIRAN 28
RIWAYAT HIDUP 39
DAFTAR TABEL
1 Pembuatan larutan standar konsentrasi 0,01-0,13 mg/mL 9
2 Komposisi kimia gelembung renang ikan cunang 12
3 Karakteristik gugus fungsi kolagen hewan perairan 18
4 Komposisi asam amino kolagen dari gelembung renang ikan cunang dibandingkan penelitian terdahulu (residu/1000 residu) 20
DAFTAR GAMBAR
1 Diagram alir tahapan penelitian 5
2 Proporsi bagian tubuh ikan cunang 12
3 Pengaruh konsentrasi NaOH 0.05, 0.10 dan 0.15 M terhadap kadar
protein non-kolagen 14
4 Pengaruh lama waktu perendaman NaOH 2, 4, 6, 8, 10 dan 12 jam
terhadap kadar protein non-kolagen 14
5 Pengaruh konsentrasi, volume, dan waktu perendaman asam asetat
terhadap rendemen ASC 15
6 Pengaruh kombinasi perlakuan konsentrasi asam asetat, waktu perendaman asam asetat, dan waktu hidroekstraksi akuabides terhadap
rendemen kolagen 16
7 Pola elektroforesis kolagen metode ASC (A) dan Hidro-ekstraksi (H)
dari gelembung renang ikan cunang 17
8 Spektra FTIR kolagen ASC dan hidroekstraksi 19
9 Kurva termogram DSC kolagen metode hidroekstraksi 22
10 Kurva termogram DSC kolagen metode ASC 22
DAFTAR LAMPIRAN
1 Rata-rata nilai absorbansi standar Bovine Serum Albumin (BSA) dan
kurva regresi linier standar BSA 29
2 Data proporsi (%) bagian tubuh ikan cunang 30
3 Data proksimat gelembung renang ikan cunang 30
4 Hasil uji ANOVA dan uji lanjut Duncan pengaruh konsentrasi dan
waktu perendaman NaOH terhadap kandungan protein non-kolagen 31
5 Analisisrespone surface methodkolagen ASC 32
6 Analisisrespone surface methodkolagen Hidroekstraksi 34
7 Kromatogram asam amino standar, ASC dan hidroekstraksi 36
1 PENDAHULUAN
Latar Belakang
Kolagen adalah protein struktural utama dalam jaringan ikat vertebrata dan jumlahnya sekitar 30% dari total protein hewani (Muyonga et al. 2004; Sinthusamranet al. 2013). Zat ini merupakan komponen utama dari jaringan ikat, otot, gigi, tulang dan kulit (Potaros et al. 2009). Kolagen terdiri dari tiga rantai polipeptida triplehelix berukuran hampir sama dan setiap rantai mengandung sekitar 1000 asam amino dengan panjang rata-rata 300 nm dan diameter 1.4 nm. Urutan primer asam amino berulang yaitu posisi ketiga selalu ditempati glisin dengan urutan rantai polipeptidanya adalah Gly-X-Y, X dan Y merupakan prolin dan hidroksiprolin (Whitford 2005). Kolagen dimanfaatkan secara luas baik di bidang farmasi, pangan dan kosmetik (Liuet al.2009). Kebutuhan kolagen di pasar global pada tahun 2014 dilaporkan oleh transparencymarketsearch.com mencapai 57.4 ton, 30 ton bersumber dari kolagen sapi dan 27.4 ton dari kolagen babi.
Kolagen pada umumnya diproduksi dari kulit dan tulang hewan darat misalnya sapi, babi dan unggas (Santoset al. 2013). Bahan baku tersebut terkadang menimbulkan reaksi negatif karena hewan-hewan tersebut ada yang terkena wabah penyakit sapi gila, penyakit mulut dan kuku (PMK), dan flu burung (Liuet al.2015). Kolagen dari babi ditolak oleh pemeluk agama islam karena tidak halal (Rengensteinet al. 2003) dan kolagen yang bersumber dari sapi juga menjadi permasalahan tersendiri bagi pemeluk agama hindu (Kasankala et al. 2007). Alternatif sumber kolagen diperlukan untuk mengatasi masalah tersebut. Menurut Zhanget al.(2007) ikan dan hewan perairan lain dapat dijadikan alternatif sumber kolagen. Kolagen dari hewan perairan umumnya di ekstrak dari hasil samping pengolahan ikan seperti kulit, sisik, dan sirip. Salah satu hasil samping pengolahan ikan yang berpotensi dijadikan kolagen adalah gelembung renang.
Gelembung renang biasa dikenal sebagai gelembung udara, gelembung suara ataufish mawyang pada kenyataanya menjadi buangan yang kurang termanfaatkan dengan baik dan cenderung mencemari lingkungan (Trilaksani et al. 2007). Menurut Fernandezet al.(2008) kolagen yang berasal dari gelembung renang (hasil samping pengolahan ikan) dapat dijadikan alternatif karena aman digunakan dan bisa diterima oleh semua golongan. Ikan cunang (Congresox talabon) termasuk ikan yang memiliki gelembung renang cukup besar dan beratnya 0.6% dari berat total ikan. Potensi produksi ikan cunang tahun 2010 di jawa barat digolongkan ke dalam potensi produksi ikan layur yakni 3792.19 ton (KKP 2013). Hasil komunikasi ringkas dengan Dinas Kelautan dan Perikanan Propinsi Jawa Barat bahwa ikan cunang memiliki potensi produksi 1334.5 Ton pada tahun 2010. Ikan ini dimanfaatkan sebagai bahan baku kerupuk dan ikan kaleng (KKP 2015). Ekstraksi kolagen dari gelembung renang ikan cunang(Congresox talabon)
2
(Pangasius hypophthalmus) yang dilakukan oleh Trilaksaniet al.(2006) dihasilkan kolagen yakni 76.75% (bk), ketebalam 10-36 µm, kuat tarik 1173.33-2311.11 kgf/cm2. Ekstraksi kolagen dengan asam asetat 0.5 M volume 40 mL dari ikan herbivora big head carp (Aristichtus nobilis) yang dilakukan Liu et al. (2012) dihasilkan kolagen tipe I dengan rendemen 59% (bk), larut pada pH 1-6 dan NaCl kurang dari 30 g/L serta memiliki suhu termal 37.3 ºC. Ekstraksi kolagen dengan asam asetat 0.5 M volume 50 mL selama 48 jam dari ikan kakap putih oleh Sinthusamranet al. (2013) dihasilkan kolagen tipe I dengan rendemen 85.3% (bk) dan suhu termal 35.02 ºC. Asam asetat 0.5 M, pepsin 0.2%, volume 40 mL selama 72 jam digunakan pada ektraksi kolagen dari tuna sirip kuning oleh Kaewdanget al.(2014) dihasilkan kolagen tipe I dengan rendemen 1.07% (bk), dan memiliki suhu termal 32.97 ºC. Asam asetat 0.5 M, pepsin 0,1%, volume 40 mL selama 72 jam digunakan pada ekstraksi kolagen dari ikangrass carp oleh Liu et al.(2015) dihasilkan kolagen tipe I dan suhu termal 38.3 ºC. Hasil rendemen yang berbeda dipengaruhi oleh metode dan kondisi ekstraksi yang digunakan (Wanget al.2008), sehingga optimasi ekstraksi diperlukan untuk menghasilkan kolagen dengan rendemen terbanyak.
Ekstraksi kolagen umumnya dilakukan dengan metodeacid soluble collagen (ASC) dan pepsin soluble colagen (PSC). Penelitian ini dilakukan menggunakan metode ASC dan hidroekstraksi. Tahapan ekstraksi metode ASC yakni pre-treatmetntNaOH untuk menghilangan protein nonkolagen, hidrolisis dengan asam, presipitasi dengan garam dan buffer, sentrifugasi, dialisis dan pengeringan beku (Astiana et al. 2016; Liu et al. 2015; Kaewdang et al.2014; Sinthusamran et al. 2013; Veerurajet al.2013; Naro et al. 2013; Huang et al. 2011; Matmaroh et al. 2011; Sadowska et al. 2011 dan Zhang et al. 2011). Metode ASC memiliki keuntungan yakni dapat melarutkan tidak hanya monomer kolagen tetapi juga agregat kolagen yang memiliki beberapa ikatan silang (Liu et al. 2015). Tahapan metode hidro-ekstraksi yakni pre-treatmetnt NaOH untuk menghilangkan protein nonkolagen, hidrolisis dengan asam dengan waktu singkat yakni 1 sampai 3 jam dan ekstraksi dalam akuabides pada suhu 20 sampai 40ºC menggunakanwaterbath selama 1 sampai 2 jam (Huang et al. 2016; Alhana et al. 2015; Wulandari et al. 2015). Metode hidro-ekstraksi memiliki beberapa keuntungan antara lain waktu lebih singkat, sedikit memerlukan peralatan laboratorium, dapat diproduksi secara kontinu, rendemen tinggi, limbah sedikit dan biaya produksi lebih rendah (Huang et al. 2016).
Perumusan Masalah
3
perbandingan pelarut dengan sampel yang digunakan. Belum optimalnya metode ekstraksi dan belum tereksplorasinya gelembung renang ikan cunang sebagai sumber kolagen menjadikan penelitian tentang optimasi ekstraksi dan karakterisasi kolagen gelembung renang ikan cunang sangat penting untuk dilakukan.
Tujuan Penelitian
Penelitian ini dilakukan untuk mendapatkan rendemen kolagen yang optimal dan mendapatkan karakteristik fisikokimia kolagen yang diekstrak menggunakan metode ASC (acid soluble collagen) dan hidroekstraksi.
Hipotesis Penelitian
Pre-treatmentNaOH
H0: Konsentrasi NaOH dan waktu perendaman tidak berpengaruh terhadap
kandungan protein nonkolagen
H1: Konsentrasi NaOH dan waktu perendaman berpengaruh terhadap kandungan
protein non kolagen
Ekstraksi metode ASC
H0: Konsentrasi, volume perbandingan dan waktu perendaman asam asetat tidak
berpengaruh terhadap rendemen kolagen
H1: Konsentrasi, volume perbandingan dan waktu perendaman asam asetat
berpengaruh terhadap rendemen kolagen
Ekstraksi metode hidroekstraksi
H0: Konsentrasi asam asetat, waktu perendaman asam asetat dan waktu ekstraksi
akuabides tidak berpengaruh terhadap rendemen kolagen
H1: Konsentrasi asam asetat, waktu perendaman asam asetat dan waktu ekstraksi
akuabides berpengaruh terhadap rendemen kolagen.
2 METODE
Waktu dan Tempat
4
kestabilan termal dengan Differential Scanning Calorimetry (DSC) di Laboratorium Departemen Ilmu dan Teknologi Pangan IPB.
Bahan
Bahan utama yang digunakan dalam penelitian ini adalah gelembung renang ikan cunang (Congresox talabon) yang diperoleh dari daerah Indramayu Jawa Barat, ukuran ikan 107 ± 0.03 cm dan berat 1729 ± 0.21 gram. Bahan-bahan kimia yang digunakan adalah akuades, akuabides steril pro injection PT Ikapharmaindo
Putramas, NaOH merek Merck, asam asetat (CH3COOH) merek Emsure, metanol
merek Emsure dan garam NaCl merek Merck. Bahan-bahan lain meliputi bahan untuk analisis karakteristik kolagen.
Alat
Peralatan yang digunakan untuk ekstraksi kolagen adalah spektrofotometer UV-VIS (U-2800, Hitachi, Japan), sentrifugasi (Himac CR 21G, Hitachi, Japan) stirring hotplate (HS0707V2, Favorit, Malaysia), magnetic stirrer 5 cm, waterbath incubator shaker (BT 25, Yamato, Japan) dan freeze dryer (EW03333620, Labconco, Amerika). Alat-alat yang digunakan untuk analisis kolagen diantaranya, High Performance Liquid Chromatography (LC4000, JASCO, Japan), Fourier Transform Infrared Spectrophotometer (Tensor 37, Bruker, Germany), Differential Scanning Calorimetry (DSC-60, Shimadzu, Japan).
Prosedur Penelitian
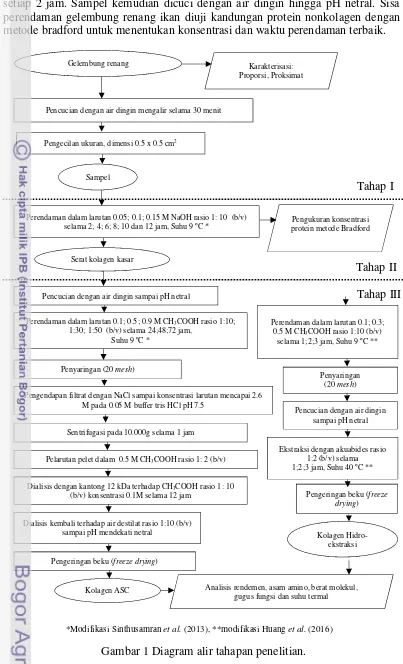
Penelitian dilakukan dalam tiga tahap, yaitu 1) Karakterisasi dan preparasi bahan baku gelembung renang ikan cunang; 2)Pre-treatmentNaOH (deproteinasi); 3) Optimasi ekstraksi dan karakterisasi kolagen metode ASC dan Hidroekstraksi. Diagram alir tahapan penelitian disajikan pada Gambar 1.
Karakterisasi dan preparasi bahan baku gelembung renang ikan cunang (Modifikasi Sintusharmanet al.2013)
Gelembung renang ikan cunang yang akan digunakan dikarakterisasi terlebih dahulu dengan menghitung proporsi gelembung renang dan melakukan analisis komposisi kimia meliputi kadar air, abu, lemak, dan protein. Gelembung renang yang akan digunakan dalam ekstraksi kolagen terlebih dahulu dicuci dengan air dingin mengalir untuk menghilangkan kotoran yang menempel kemudian dipotong kecil-kecil dengan dimensi 0.5 x 0.5 cm2.
Pre-treatment NaOH (Modifikasi Sintusharmanet al. 2013).
5
setiap 2 jam. Sampel kemudian dicuci dengan air dingin hingga pH netral. Sisa perendaman gelembung renang ikan diuji kandungan protein nonkolagen dengan metode bradford untuk menentukan konsentrasi dan waktu perendaman terbaik.
Pengukuran konsentrasi protein metode Bradford Perendaman dalam larutan 0.05; 0.1; 0.15 M NaOH rasio 1: 10 (b/v)
selama 2; 4; 6; 8; 10 dan 12 jam, Suhu 9 ºC *
Pencucian dengan air dingin sampai pH netral
Perendaman dalam larutan 0.1; 0.5; 0.9 M CH3COOH rasio 1:10; 1:30; 1:50 (b/v) selama 24;48;72 jam,
Suhu 9 ºC *
Penyaringan (20mesh)
Pengendapan filtrat dengan NaCl sampai konsentrasi larutan mencapai 2.6 M pada 0.05 M buffer tris HCl pH 7.5
Serat kolagen kasar
Sentrifugasi pada 10.000g selama 1 jam
Pelarutan pelet dalam 0.5 M CH3COOH rasio 1: 2 (b/v)
Dialisis dengan kantong 12 kDa terhadap CH3COOH rasio 1: 10 (b/v) konsentrasi 0.1M selama 12 jam
Dialisis kembali terhadap air destilat rasio 1:10 (b/v) sampai pH mendekati netral
Gelembung renang Karakterisasi: Proporsi, Proksimat
Pencucian dengan air dingin mengalir selama 30 menit
Pengecilan ukuran, dimensi 0.5 x 0.5 cm2
Sampel
Analisis rendemen, asam amino, berat molekul, gugus fungsi dan suhu termal
Gambar 1 Diagram alir tahapan penelitian.
Tahap I
Tahap II
Tahap III
6
Optimasi ekstraksi dan Karakterisasi kolagen ASC dan hidro-ekstraksi (Modifikasi Sintusharmanet al.2013).
Optimasi dilakukan pada dua metode ekstraksi kolagen yakni metodeAcid Soluble Collagen (ASC) dan hidro-ekstraksi. Karakteristik kolagen yang diamati antara lain asam amino dengan HPLC, berat molekul dengan SDS-PAGE, gugus fungsi dengan FTIR dan kestabilan termal dengan DSC.
ASC diawali dengan sampel yang telah dideproteinasi kemudian dilakukan optimasi ekstraksi pada konsentrasi 0.1; 0.5; 0.9 M asam asetat (CH3COOH)
perbandingan 1:10; 1:30 dan 1: 50 (b/v) selama 24, 48, 72 jam. Campuran disaring menggunakan dua lapis kain tipis. Kolagen dalam supernatan perlakuan terbaik diendapkan dengan menambahkan NaCl sampai konsentrasi akhir 2.6 M pada 0.05 M buffer tris HCl pH 7.5. Hasil presipitasi dipisahkan dengan sentrifugasi kecepatan 10.000 g selama 1 jam. Pelet hasil sentifugasi dilarutkan kembali dalam konsentrasi 0.5 M asam asetat dengan perbandingan 1:2 (b/v) kemudian diidialisis menggunakan kantong dialysis 12 kDa terhadap asam asetat dengan konsentrasi 0.1 M perbandingan 1:10 (b/v) selama 12 jam, selanjutnya didialisis terhadap air destilat 1:10 (b/v) sampai pH mendekati netral. Pellet hasil dialisis dikeringkan dengan freeze dryer untuk memperoleh kolagen dalam bentuk serbuk kemudian dihitung rendemen.
Hidro-ekstraksi diawali dengan sampel yang telah dideproteinasi kemudian dilakukan optimasi ekstraksi dengan cara direndam dalam asam asetat (CH3COOH)
konsentrasi 0.1; 0.3 dan 0.5 M, waktu perendaman asam asetat (1, 2, dan 3 jam) dengan perbandingan sampel dan asam asetat 1:10 1:2 (b/v). Hasil perndaman asam asetat kemudian dinetralkan dengan akuades sampai pH mendekati netral. Pelet diekstrak kolagen dengan cara direndam dalam akuabides suhu 40ºC selama 1, 2 dan 3 jam dengan perbandingan sampel dan akuabides 1:2 (b/v). Filtrat hasil perendaman disaring dengan dua lapis kain tipis. Filtrat hasil dikeringkan menggunakanfreeze dryerdan rendemen pada setiap perlakuan dihitung.
Prosedur Analisis
Rendemen
Rendemen kolagen diperoleh dari perbandingan berat kering kolagen yang dihasilkan dengan berat bahan baku gelembung renang (yang telah dibersihkan dari sisa daging dan lapisan lemak). Rendemen dapat diperoleh dengan rumus:
Rendemen Kolagen (%) = Berat Kering Kolagen
Berat Kering Gelembung Renang × 100%
Analisis kadar air (AOAC 2005)
Prinsip analisis kadar air yakni pengeringan sampel dalam oven vakum pada suhu 25-100 ºC sehingga air dapat menguap pada suhu lebih rendah dari 100 ºC.
7
atau sampai beratnya konstan. Cawan dimasukkan dalam desikator (30 menit) kemudian ditimbang (C).
Kadar air dihitung dengan rumus:
Kadar Air (%) = B C
B A × 100%
Keterangan: A = Berat cawan kosong (g)
B = Berat cawan yang diisi dengan sampel (g)
C = Berat cawan dengan sampel yang sudah dikeringkan (g)
Analisis kadar abu (AOAC 2005)
Prinsip analisis kadar abu yakni dengan mengoksidasi semua zat organik pada suhu tinggi, yaitu sekitar 500–600 ºCdan kemudian melakukan penimbangan zat yang tertinggal setelah proses pembakaran. Cawan abu porselen dibersihkan
kemudian dikeringkan dalam oven dengan suhu 105 ºC selama 30 menit. Cawan
abu porselen yang telah dikeringkan dalam oven dimasukkan dalam desikator (30 menit) dan kemudian ditimbang (A). Sampel sebanyak 5 g (C) ditimbang kemudian dimasukkan ke dalam cawan abu porselen. Cawan abu berisi sampel dibakar di atas kompor listrik sampai tidak berasap dan dimasukkan ke dalam tanur pengabuan dengan suhu 600 ºC selama 7 jam. Cawan abu berisi sampel hasil pengabuan dimasukkan dalam desikator (30 menit) kemudian ditimbang (B) diulang hingga memperoleh berat konstan. Kadar abu dihitung dengan rumus:
Kadar Abu (%) = B A
C × 100%
Keterangan: A = Berat cawan abu porselen kosong (g)
B = Berat cawan abu porselen + sampel setelah dikeringkan (g) C = berat sampel (g)
Analisis kadar protein (AOAC 2005)
Prinsip analisis kadar protein adalah protein dan komponen organik dalam sampel didestruksi dengan menggunakan asam sulfat dan katalis. Hasil destruksi dinetralkan dengan menggunakan larutan alkali dan melalui destilasi. Destilat ditampung dalam larutan asam borat. Selanjutnya ion- ion borat yang terbentuk dititrasi dengan menggunakan larutan HCl. Sebanyak 0.5 g sampel dimasukkan ke dalam labu Kjeldahl, kemudian ditambahkan sebutir kjeltab dan 10 mL H2SO4.
Labu yang berisi larutan tersebut dimasukkan ke dalam alat pemanas dengan suhu 410 ºCdan ditambahkan air sebanyak 10 mL. Proses ini dilakukan sampai larutan menjadi jernih. Larutan yang telah jernih didinginkan, kemudian ditambahkan 50 mL akuades dan 20 mL NaOH 40% dan didestilasi. Hasil destilasi ditampung dalam Erlenmeyer 125 mL berisi 25 mL asam borat (H3BO3) 2% yang mengandung
indikator campuran dari bromocresol green 0.1% dan methyl red 0.1% dengan perbandingan 2:1. Destilasi dilakukan dengan menambahkan 50 mL larutan NaOH-Na2S2O3 ke dalam alat destilasi hingga tertampung 40 mL, destilat di dalam
8
muda. Volume titran dibaca dan dicatat. Perhitungan kadar protein adalah sebagai berikut:
Nitrogen (%) = (mL HCl mL HCl Blanko) × N HCl
mg Sampel × 14 × 100%
Protein (%) = Nitrogen (%) × Faktor Konversi (6,25)
Analisis kadar lemak (AOAC 2005)
Prinsip analisis kadar lemak yakni mengeluarkan lemak dan zat yang terlarut dalam lemak tersebut dari sampel yang telah kering dengan menggunakan pelarut. Labu lemak yang akan digunakan dikeringkan dalam oven dengan suhu 105 ºC, dimasukkan dalam desikator (30 menit) dan ditimbang (W1). Sampel ditimbang sebanyak 5 g (W2), dibungkus dengan kertas saring dan dimasukkan ke dalam alat ekstraksi (soxhlet) yang telah berisi pelarut heksan. Prosesrefluxdilakukan sampai larutan jernih dan pelarut yang ada di dalam labu lemak berwarna jernih. Pelarut didestilasi sampai habis selanjutnya labu lemak yang berisi lemak hasil ekstraksi dipanaskan dalam oven pada suhu 105 ºC hingga beratnya konstan, dimasukkan dalam desikator dan ditimbang (W3). Kadar lemak dihitung dengan rumus:
Kadar Lemak (%) = W3 W1
W2 × 100%
Keterangan: W1 = Berat labu lemak kosong (g)
W2 = Berat sampel (g)
W3 = Berat labu lemak dengan lemak (g)
Pengukuran konsentrasi protein (Bradford 1976)
Konsentrasi protein ditentukan menggunakan metode Bradford dengan bovine serum albumin sebagai standar. Persiapan peraksi Bradford dilakukan dengan cara melarutkan 5 mgcoomasive briliant blueG-250 dalam 2.5 mL etanol 95% (v/v). Jika telah larut dengan sempurna lalu ditambah 5 mL asam fosfat 85% (v/v). Jika telah larut dengan sempurna ditambah akuades hingga 250 mL dan disaring dengan kertas saring Whatman no.1 serta diencerkan 5 kali sesaat sebelum digunakan.
9
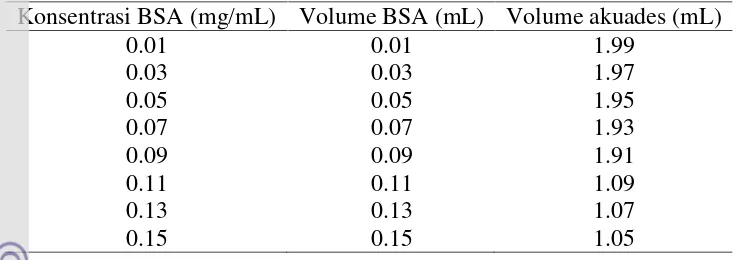
Tabel 1 Pembuatan larutan standar konsentrasi 0.01-0.15 mg/mL.
Konsentrasi BSA (mg/mL) Volume BSA (mL) Volume akuades (mL)
0.01 0.01 1.99
Analisis berat molekul dengan SDS-PAGE (Laemmli 1970)
Sampel dilarutkan dalam 5% SDS dan campuran diinkubasi pada suhu 85 ºC
selama 1 jam dalam water bathyang suhunya terkontrol. Campuran disentrifugasi pada 4000g selama 5 menit pada suhu kamar. Supernatan yang diperoleh dicampur dengan bufer (Tris HCl 60 mM, pH 6,8, mengandung 2% SDS dan 25% gliserol)
dengan rasio 1:1 (v/v) dan mengandung 10% β-merkaptoetanol (β-ME). Campuran
dipanaskan dalam air mendidih selama 2 menit. Sebanyak 5 μ L sampel dimasukkan
ke dalam gel polyacrylamide yang terdiri dari 7.5% running geldan 3% stacking gel dan dielektroforesis pada arus konstan 15 mA/gel selama 3 jam. Setelah elektroforesis selesai, gel diwarnai dengan 0,05% (b/v) coomassie blue R-250 dalam 15% (v/v) metanol dan 5% (v/v) asam asetat selama 3 jam, kemudian sampel destaining dengan campuran 30% (v/v) metanol dan 10% (v/v) asam asetat selama 2 jam. Berat molekul protein sampel diperkirakan berdasarkan berat molekul marker. Marker yang digunakan adalah Pre-stained Protein Markers (Broad Range)forSDS-PAGE dariNacalai Tesquedengan berat molekul 8.8 sampai 192 kDa.
Analisis gugus fungsi dengan FTIR (modifikasi Yanet al. 2008)
Analisis FTIR digunakan untuk mengetahui gugus-gugus fungsi khas dari kolagen yang dihasilkan. Sampel uji terlebih dahulu dibentuk pelet dengan campuran KBr. Sebanyak 100 mg KBr dan 2 mg sampel uji dicampurkan, kemudian ditumbuk sampai halus dan tercampur rata dalam mortaragate. Pengukuran sampel uji dilakukan pada gelombang antara 4 000 - 5 000 cm-1. Spektra FTIR yang dihasilkan menunjukkan puncak-puncak serapan bilangan gelombang dari sampel uji. Gugus-gugus fungsi sampel uji ditentukan berdasarkan puncak serapan bilangan gelombang yang terdeteksi dengan wilayah serapan untuk gugus fungsi protein.
Analisis asam amino (AOAC 2012)
Komposisi asam amino ditentukan dengan High Performance Liquid
10
analisis asam amino. Khusus untuk pengujian asam amino bebas, tidak dilakukan proses hidrolisis dengan asam dan pemanasan.
a. Tahap pembuatan hidrolisat protein
Sampel ditimbang sebanyak 0.2 g dan dihancurkan. Sampel yang telah hancur ditambahkan dengan HCl 6 N sebanyak 5-10 mL, kemudian dipanaskan dalam oven
pada suhu 100 ºC selama 24 jam. Proses pemanasan dilakukan untuk
menghilangkan gas atau udara yang ada pada sampel agar tidak mengganggu kromatogram yang dihasilkan dan untuk mempercepat reaksi hidrolisis. Hidrolisat protein yang diperoleh disaring dengan milipore berukuran 0.45 mikron.
b. Tahap pengeringan
Hidrolisat protein ditambah dengan 30 μ L larutan pengering. Larutan
pengering dibuat dari campuran antara metanol, natrium asetat, dan trietilamim dengan perbandingan 2:2:1. Proses pengeringan dibantu menggunakan gas nitrogen untuk mempercepat pengeringan dan mencegah oksidasi.
c. Tahap derivatisasi
Sebanyak 30 μ L larutan derivatisasi ditambahkan pada hasil pengeringan.
Larutan derivatisasi dibuat dari campuran antara larutan metanol, pikoiotisianat, dan trietilamin dengan perbandingan 3:3:4. Proses derivatisasi dilakukan agar detektor mudah untuk mendeteksi senyawa yang ada pada sampel, kemudian dilakukan pengenceran dengan cara menambahkan 10 mL asetonitil 60% atau buffer fosfat 0.1 M lalu dibiarkan selama 20 menit. Hasil pengenceran disaring kembali menggunakan milipor berukuran 0.45 mikron.
d. Injeksi ke HPLC
Hasil saringan diambil sebanyak 20 μ L untuk diinjeksikan ke dalam HPLC.
Penghitungan konsentrasi asam amino dilakukan dengan cara membandingkan kromatogram sampel dengan standar. Pembuatan kromatogram standar menggunakan asam amino yang mengalami perlakuan yang sama dengan sampel. Kandungan masing-masing asam amino pada bahan dapat dihitung dengan rumus:
Konsentrasi Asam Amino = Luas area contoh Luas area standar×
C × FP × BM × 100 Berat contoh (g)
Keterangan:
C = Konsentrasi standar asam amino
FP = Faktor pengenceran
BM = Bobot molekul dari masing-masing asam amino
Analisis termal differential scanning calorimetry (DSC) (Liuet al. 2015) DSC digunakan untuk mempelajari transisi fase, seperti melting, suhu transisi gelas (Tg), atau dekomposisi eksotermik, serta untuk menganalisa kestabilan terhadap oksidasi dan kapasitas panas suatu bahan. Acid Soluble Collagen (ASC)
11
Rancangan Percobaan dan Analisis Data
Rancangan yang digunakan untuk tahap perendaman dalam larutan NaOH adalah Rancangan Acak Lengkap Faktorial (RALF). Perlakuan merupakan konsentrasi dan waktu perendaman dalam NaOH. Semua perlakuan dilakukan sebanyak tiga kali ulangan. Data yang didapat kemudian dianalisa keragaman ANOVA dan uji lanjut duncan pada taraf 5% menggunakan software SPSS versi 16. Model rancagan ini adalah:
Yijk= µ + αi+ βj+ (µβ)ij+ εijk
Keterangan:
Yijk = respon pengaruh konsentrasi NaOH ke-i, waktu ke-j dan ulangan ke-k
µ = nilai tengah umum
αi = pengaruh konsentrasi NaOH ke-i
βj = pengaruh waktu perendaman ke-j
(µβ)ij = interaksi konsentrasi NaOH ke-i dan waktu perendaman ke-j
εijk = pengaruh acak pada konsentrasi NaOH ke-i, waktu ke-j dan ulangan ke-k
Rancangan yang digunakan untuk tahapan optimasi ekstraksi metode ASC
dan metode hidroekstraksi menggunakan desain Box-Behnken Respone Surface
Method (RSM). RSM merupakan suatu metode yang digunakan untuk membuat model dan menganalisa suatu respon yang dipengaruhi oleh beberapa variabel bebas atau faktor, untuk mengoptimalkan respon tersebut. Terdapat tiga variabel independen yang diperhatikan sebagai variabel respon yang mempengaruhi rendemen kolagen ASC dan hidroekstraksi. Variabel independen ASC yaitu konsentrasi asam asetat (X1), volume (X2), waktu ekstraksi (X3) sedangkan variabel
independen hidroekstraksi yaitu konsentrasi asam asetat (X1), waktu hidrolisis (X2)
dan waktu ekstraksi (X3). Rumus dan pengkodean level disajikan pada lampiran 5.
Data yang didapat kemudian dianalisis keragaman ANOVA menggunakan sofware
Design Expert 7.0 versi trial.Model observasi RSM berdasarkan hubungan antara respon (Y) dan variabel bebas (X) yang disajikan dalam persamaan berikut ini:
Y = f(X1,X2,...,Xk) + ε
12
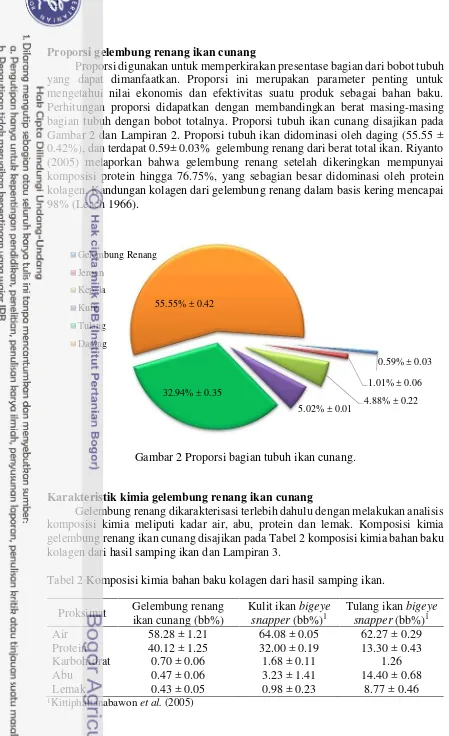
Proporsi gelembung renang ikan cunang
Proporsi digunakan untuk memperkirakan presentase bagian dari bobot tubuh yang dapat dimanfaatkan. Proporsi ini merupakan parameter penting untuk mengetahui nilai ekonomis dan efektivitas suatu produk sebagai bahan baku. Perhitungan proporsi didapatkan dengan membandingkan berat masing-masing bagian tubuh dengan bobot totalnya. Proporsi tubuh ikan cunang disajikan pada Gambar 2 dan Lampiran 2. Proporsi tubuh ikan didominasi oleh daging (55.55 ± 0.42%), dan terdapat 0.59± 0.03% gelembung renang dari berat total ikan. Riyanto (2005) melaporkan bahwa gelembung renang setelah dikeringkan mempunyai komposisi protein hingga 76.75%, yang sebagian besar didominasi oleh protein kolagen.Kandungan kolagen dari gelembung renang dalam basis kering mencapai 98% (Leach 1966).
Gambar 2 Proporsi bagian tubuh ikan cunang.
Karakteristik kimia gelembung renang ikan cunang
Gelembung renang dikarakterisasi terlebih dahulu dengan melakukan analisis komposisi kimia meliputi kadar air, abu, protein dan lemak. Komposisi kimia gelembung renang ikan cunang disajikan pada Tabel 2komposisi kimia bahan baku kolagen dari hasil samping ikandan Lampiran 3.
Tabel 2 Komposisi kimia bahan baku kolagen dari hasil samping ikan.
13
Tabel 4 menunjukan komposisi protein gelembung renang ikan lebih tinggi jika dibandingkan dengan kulit dan tulang, oleh sebab itu, gelembung renang ikan berpotensi dijadikan sebagai sumber bahan baku kolagen. Komposisi gelembung renang ikan cunang didominasi oleh kadar air. Kandungan air pada gelembung renang dilaporkan juga oleh Kaewdang et al.(2014) yakni 83.33% ikanyellowfin tuna dan Liu et al.(2012) yakni 75.2% ikan Bighead carp.Kandungan air dalam bahan ikut menentukan acceptability, kesegaran, dan daya tahan bahan itu (Astiana et al.2016).
Protein pada gelembung renang ikan merupakan komponen terbesar setelah air. Protein gelembung renang ikan cunang lebih besar dibandingkan dengan kandungan protein pada gelembung renang ikan tuna sirip kuning yakni 12.09% (Kaewdang et al. 2014). Kandungan protein yang tinggi pada gelembung renang ikan cunang menunjukkan potensi untuk dijadikan sebagai alternatif sumber kolagen. Menurut Riyanto (2005) bahwa gelembung renang mempunyai komposisi protein yang sebagian besar didomminasi oleh protein kolagen. Gelembung renang mengandung 83% protein kolagen (Hickmanet al.2000).
Gelembung renang ikan cunang memiliki kadar karbohidrat dan lemak lebih rendah, sedangkan kadar abu lebih tinggi dibandingkan dengan gelembung renang ikan tuna sirip kuning penelitian Kaewdang et al. (2014). Shon et al. (2011) menyatakan bahwa keberadaan lemak dan mineral lainnya akan mengganggu efektivitas kolagen dalam aplikasinya pada berbagai produk.
Pre-treatmentekstraksi kolagen
Pre-treatment kolagen dilakukan sebelum melakukan ekstraksi kolagen bertujuan untuk menghilangkan material yang tidak diinginkan seperti protein nonkolagen dan pigmen (Yang et al.2007). NaOH biasa digunakan dalam proses pre-treatmentekstraksi kolagen karena mampu meminimalkan kehilangan kolagen serta secara signifikan menyebabkan pembengkakan pada kulit apabila dibandingkan dengan larutan alkali lain (Liu et al. 2015). Selama perendaman dalam NaOH memungkinkan masuknya air dan menyebabkan protein nonkolagen yang terjebak dalam matrik kolagen menjadi lebih mudah dilepaskan (Jaswiret al. 2011).
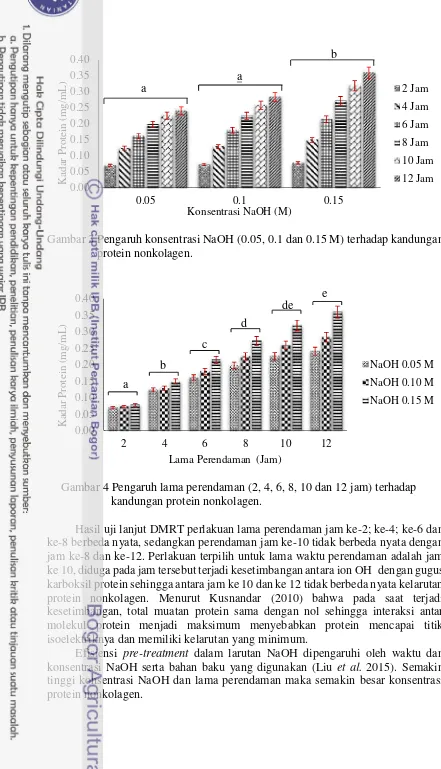
Hasil analisis ragam menunjukan bahwa interaksi perlakuan konsentrasi NaOH dengan lama waktu perendaman tidak berbeda nyata (P>0.05) tetapi masing-masing perlakuan yakni konsentrasi NaOH dan lama perendaman NaOH berpengaruh (p<0.05) terhadap kadar protein nonkolagen gelembung renang ikan cunang yang disajikan pada Gambar 3, Gambar 4 dan Lampiran 4.
Hasil uji lanjut DMRT perlakuan konsentrasi larutan NaOH 0.05 dan 0.1 M tidak berbeda nyata, sedangkan konsentrasi 0.15 M berbeda nyata. Semakin tinggi konsentrasi NaOH maka semakin tinggi protein nonkolagen yang dihasilkan, hal ini disebabkan karena konsentrasi NaOH yang tinggi menyebabkan kelebihan ion OHˉ yang akan bereaksi dengan gugus karboksil protein. Menurut Winarno (2004)
dalam larutan basa gugus karboksil protein akan bereaksi dengan OHˉ
14
Gambar 3 Pengaruh konsentrasi NaOH (0.05, 0.1 dan 0.15 M) terhadap kandungan protein nonkolagen.
Gambar 4 Pengaruh lama perendaman (2, 4, 6, 8, 10 dan 12 jam) terhadap kandungan protein nonkolagen.
Hasil uji lanjut DMRT perlakuan lama perendaman jam ke-2; ke-4; ke-6 dan ke-8 berbeda nyata, sedangkan perendaman jam ke-10 tidak berbeda nyata dengan jam ke-8 dan ke-12. Perlakuan terpilih untuk lama waktu perendaman adalah jam ke 10, diduga pada jam tersebut terjadi kesetimbangan antara ion OHˉ dengan gugus karboksil protein sehingga antara jam ke 10 dan ke 12 tidak berbeda nyata kelarutan protein nonkolagen. Menurut Kusnandar (2010) bahwa pada saat terjadi kesetimbangan, total muatan protein sama dengan nol sehingga interaksi antar molekul protein menjadi maksimum menyebabkan protein mencapai titik isoelektriknya dan memiliki kelarutan yang minimum.
15
Ekstrak Kolagen Optimal
Optimasi ekstraksi dilakukan untuk menghasilkan rendemen kolagen yang optimal. Ekstraksi kolagen dilakukan dengan metodeacid soluble collagen(ASC) dan metode hidro-ekstraksi.
Acid Soluble Collagen (ASC)
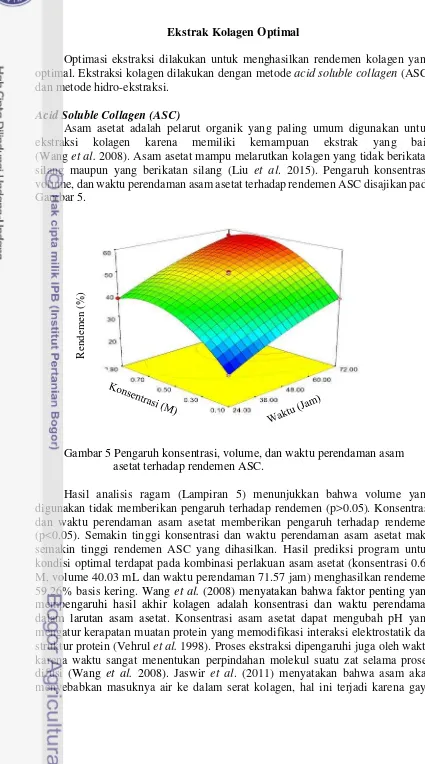
Asam asetat adalah pelarut organik yang paling umum digunakan untuk ekstraksi kolagen karena memiliki kemampuan ekstrak yang baik (Wanget al. 2008). Asam asetat mampu melarutkan kolagen yang tidak berikatan silang maupun yang berikatan silang (Liu et al. 2015). Pengaruh konsentrasi, volume, dan waktu perendaman asam asetat terhadap rendemen ASC disajikan pada Gambar 5.
Gambar 5 Pengaruh konsentrasi, volume, dan waktu perendaman asam asetat terhadap rendemen ASC.
Hasil analisis ragam (Lampiran 5) menunjukkan bahwa volume yang digunakan tidak memberikan pengaruh terhadap rendemen (p>0.05). Konsentrasi dan waktu perendaman asam asetat memberikan pengaruh terhadap rendemen (p<0.05). Semakin tinggi konsentrasi dan waktu perendaman asam asetat maka semakin tinggi rendemen ASC yang dihasilkan. Hasil prediksi program untuk kondisi optimal terdapat pada kombinasi perlakuan asam asetat (konsentrasi 0.64 M, volume 40.03 mL dan waktu perendaman 71.57 jam) menghasilkan rendemen 59.26% basis kering. Wang et al. (2008) menyatakan bahwa faktor penting yang mempengaruhi hasil akhir kolagen adalah konsentrasi dan waktu perendaman dalam larutan asam asetat. Konsentrasi asam asetat dapat mengubah pH yang mengatur kerapatan muatan protein yang memodifikasi interaksi elektrostatik dan struktur protein (Vehrulet al.1998). Proses ekstraksi dipengaruhi juga oleh waktu karena waktu sangat menentukan perpindahan molekul suatu zat selama proses difusi (Wang et al. 2008). Jaswir et al. (2011) menyatakan bahwa asam akan menyebabkan masuknya air ke dalam serat kolagen, hal ini terjadi karena gaya
R
ende
m
en (
%
16
elektrostatik antara gugus polar pada serat kolagen dengan H+ dari asam atau
terbentuknya ikatan hidrogen antara gugus nonpolar pada serat kolagen dengan H+ dari asam.
Hidroekstraksi
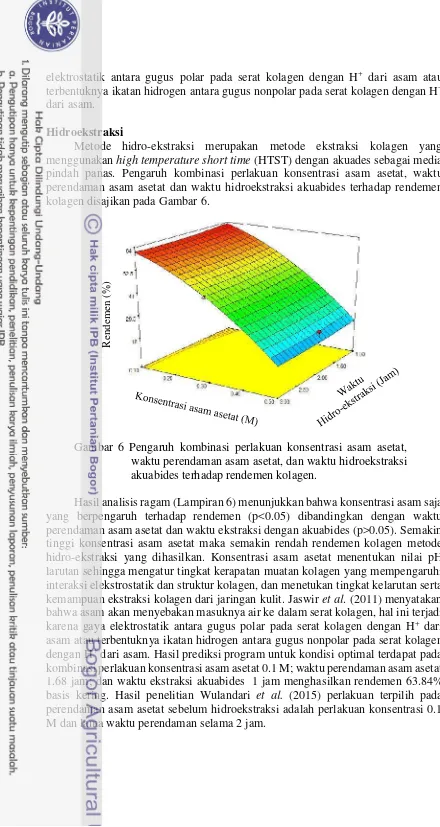
Metode hidro-ekstraksi merupakan metode ekstraksi kolagen yang menggunakanhigh temperature short time(HTST) dengan akuades sebagai media pindah panas. Pengaruh kombinasi perlakuan konsentrasi asam asetat, waktu perendaman asam asetat dan waktu hidroekstraksi akuabides terhadap rendemen kolagen disajikan pada Gambar 6.
Gambar 6 Pengaruh kombinasi perlakuan konsentrasi asam asetat, waktu perendaman asam asetat, dan waktu hidroekstraksi akuabides terhadap rendemen kolagen.
Hasil analisis ragam (Lampiran 6) menunjukkan bahwa konsentrasi asam saja yang berpengaruh terhadap rendemen (p<0.05) dibandingkan dengan waktu perendaman asam asetat dan waktu ekstraksi dengan akuabides (p>0.05). Semakin tinggi konsentrasi asam asetat maka semakin rendah rendemen kolagen metode hidro-ekstraksi yang dihasilkan. Konsentrasi asam asetat menentukan nilai pH larutan sehingga mengatur tingkat kerapatan muatan kolagen yang mempengaruhi interaksi elekstrostatik dan struktur kolagen, dan menetukan tingkat kelarutan serta kemampuan ekstraksi kolagen dari jaringan kulit. Jaswiret al. (2011) menyatakan bahwa asam akan menyebakan masuknya air ke dalam serat kolagen, hal ini terjadi karena gaya elektrostatik antara gugus polar pada serat kolagen dengan H+ dari asam atau terbentuknya ikatan hidrogen antara gugus nonpolar pada serat kolagen dengan H+dari asam. Hasil prediksi program untuk kondisi optimal terdapat pada
kombinasi perlakuan konsentrasi asam asetat 0.1 M; waktu perendaman asam asetat 1.68 jam; dan waktu ekstraksi akuabides 1 jam menghasilkan rendemen 63.84% basis kering. Hasil penelitian Wulandari et al. (2015) perlakuan terpilih pada perendaman asam asetat sebelum hidroekstraksi adalah perlakuan konsentrasi 0.1 M dan lama waktu perendaman selama 2 jam.
R
ende
m
en (
%
17
Karakteristik Kolagen
Karakteristik kolagen yang diamati antara lain asam amino dengan HPLC, berat molekul dengan SDS-PAGE, gugus fungsi dengan FTIR dan kestabilan termal dengan DSC
Berat Molekul SDS-PAGE
Sodium deodecyl sulfate polycrilamide gel electroforesis (SDS-PAGE) merupakan salah satu teknik pemisahan protein berdasar kemampuannya untuk bergerak terhadap muatan listrik. Protein terpisah berdasarkan ukuran molekul dan interaksinya terhadap muatan listrik. Metode ini digunakan untuk menganalisis protein secara kualitatif. Roy et al. (2012) menyatakan bahwa gel poliakrilamida terbentuk dari polimerisasi akrilamida dengan agen pembentuk ikatan silang bis-akrilamida dan ikatan silang dari polimer bis-akrilamida menghasilkan pori-pori dengan ukuran yang berbeda-beda. SDS-PAGE memiliki matriks berpori pada gel poliakrilamid yang akan memisahkan kompleks SDS-protein berdasarkan berat molekulnya. Protein berukuran kecil akan bergerak lebih cepat melintasi gel dibandingkan protein berukuran besar sehingga protein dengan berat molekul rendah memiliki jarak tempuh (Rf) yang lebih panjang dibandingkan protein dengan berat molekul tinggi. Bollag dan Edelstein (1991) menyatakan bahwa Berat molekul protein dapat ditentukan dengan menggunakan protein baku yang telah diketahui berat molekulnya dan membandingkan dengan nilai mobilitas relatif (Rf ) yang diperoleh. Pola elektroforesis kolagen metode ASC dan hidro-ekstraksi dari gelembung renang ikan cunang disajikan pada Gambar 7.
Gambar 7 Pola elektroforesis kolagen metode ASC (A) dan Hidro-ekstraksi (H) dari gelembung renang ikan cunang.
Kolagen metode ASC dan hidro-ekstraksi memiliki pola elektroforesis yang sama yakni pita utama rantai α1 (114 kDa), α2 (103 kDa) dan β (150 kDa). Keberadaan rantai α menunjukkan bahwa kolagen tersebut merupakan kolagen tipe I (Ogawa et al. 2004). Komponen β menunjukkan adanya molekul kolagen yang
18
mengalamicross linking. Ketebalanintensitas pita protein struktur β menunjukkan tingginya jumlah kolagen yang mengalami cross linking (Singh et al. 2011). Perbedaan tipe kolagen ditandai dengan kompleksitas yang cukup besar dan keseragaman struktur, varian sambungan (slice), non heliks domain, perakitan (assembly) dan fungsinya (Birk et al. 1988). Hasil ini sesuai dengan penelitian kolagen gelembung renang dari ikan grass cap (Liu et al. 2015), yellowfin tuna (Kaewdang et al. 2014), seabass (Sinthusamran et al. 2103) dan bighead carp (Liu et al. 2012). Pita protein di bawah rantai α terdeteksi pada kisaran berat molekul 28 kDa sampai 85 kDa. Menurut Huanget al.(2016) pita protein dibawah rantai α menunjukkan adanya protein lain dari degradasi kolagen yang memiliki fungsi sebagai antioksidan, pengkelat mineral dan aktivitas ACE Inhibitor.
Gugus Fungsi FTIR
Penentuan gugus fungsi kolagen dan nanokolagen dilakukan dengan spektrometer Fourier-Transform Infrared (FTIR) melalui pendeteksian sinar infra merah sebagai sumber radiasi elektromagnetik. Radiasi elektromagnetik ini menyebabkan terjadinya vibrasi molekul senyawa organik ketika menyerap sinar tersebut. Karakteristik kolagen hewan perairan yang diteliti oleh beberapa ahli disajikan pada Tabel 3.
Tabel 3 Karakteristik gugus fungsi kolagen hewan perairan.
Amida Wilayah
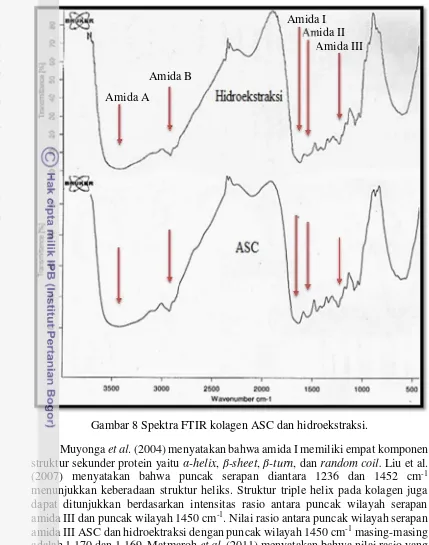
Spektra FTIR kolagen ASC dan hidroeksteaksi dari gelembung renang ikan cunang disajikan pada Gambar 8 menunjukkan puncak serapan amida A, amida B, amida I, amida II dan amida III yang mengidentifikasikan struktur pada protein kolagen. Kolagen dengan metode ASC memiliki puncak serapan Amida A yakni 3430.26 cm-1, amida B yakni 2927.04 cm-1, amida I yakni 1634.43 cm-1, amida II
yakni 1546.24 cm-1 dan amida III yakni 1238.50 cm-1. Kolagen dengan metode hidroekstraksi memiliki puncak serapan amida A yakni 3431.95 cm-1, amida B yakni 2925.55 cm-1, amida I yakni 1633.09 cm-1, amida II yakni 1546.97 cm-1dan amida III yakni 1239.57 cm-1. Puncak amida I kolagen ASC dan hidro-ekstraksi
mengalami penurunan amplitudo sampai pada puncak serapan amida III ketika dipanaskan pada suhu yang lebih tinggi. Hal ini menurut Kaewdanget al. (2014) kolagen tersebut tidak terdenaturasi menjadi gelatin selama proses ekstraksi. Gelatin memiliki wilayah serapan nilai bilangan gelombang pada kisaran 1235 cm
19
Gambar 8 Spektra FTIR kolagen ASC dan hidroekstraksi.
Muyongaet al. (2004) menyatakan bahwa amida I memiliki empat komponen struktur sekunder protein yaituα-helix,β-sheet,β-turn, dan random coil.Liu et al. (2007) menyatakan bahwa puncak serapan diantara 1236 dan 1452 cm-1 menunjukkan keberadaan struktur heliks. Struktur triple helix pada kolagen juga dapat ditunjukkan berdasarkan intensitas rasio antara puncak wilayah serapan amida III dan puncak wilayah 1450 cm-1. Nilai rasio antara puncak wilayah serapan amida III ASC dan hidroektraksi dengan puncak wilayah 1450 cm-1masing-masing adalah 1.170 dan 1.169. Matmarohet al. (2011) menyatakan bahwa nilai rasio yang mendekati 1.0 menandakan bahwa kolagen masih memiliki struktur triple helix
Asam Amino
Asam amino berkontribusi terhadap kestabilan struktur helix kolagen (Ikomaet al.2003). Komposisi asam amino kolagen yang diekstrak menggunakan metode ASC dan hidro-ekstraksi disajikan pada Tabel 4 sedangkan kromatogram asam amino standar, kolagen ASC dan kolagen hidroekstraksi disajikan pada Lampiran 7.
Amida A
Amida B
Amida I Amida II
20
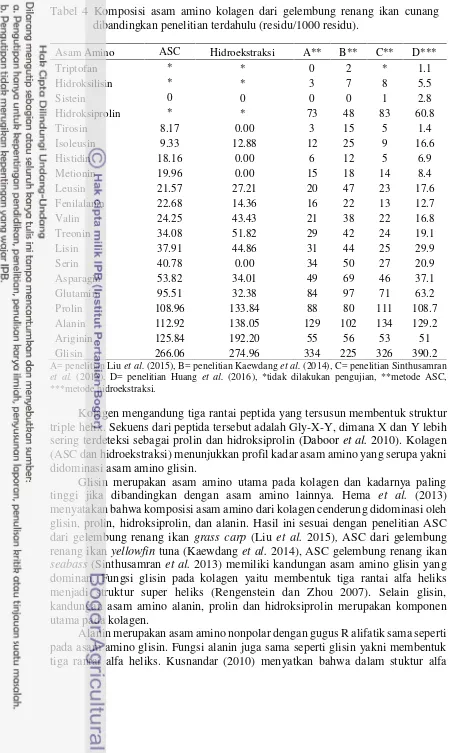
Tabel 4 Komposisi asam amino kolagen dari gelembung renang ikan cunang dibandingkan penelitian terdahulu (residu/1000 residu).
Asam Amino ASC Hidroekstraksi A** B** C** D***
Triptofan * * 0 2 * 1.1
Hidroksilisin * * 3 7 8 5.5
Sistein 0 0 0 0 1 2.8
Hidroksiprolin * * 73 48 83 60.8
Tirosin 8.17 0.00 3 15 5 1.4
Isoleusin 9.33 12.88 12 25 9 16.6
Histidin 18.16 0.00 6 12 5 6.9
Metionin 19.96 0.00 15 18 14 8.4
Leusin 21.57 27.21 20 47 23 17.6
Fenilalanin 22.68 14.36 16 22 13 12.7
Valin 24.25 43.43 21 38 22 16.8
Treonin 34.08 51.82 29 42 24 19.1
Lisin 37.91 44.86 31 44 25 29.9
Serin 40.78 0.00 34 50 27 20.9
Asparagin 53.82 34.01 49 69 46 37.1
Glutamin 95.51 32.38 84 97 71 63.2
Prolin 108.96 133.84 88 80 111 108.7
Alanin 112.92 138.05 129 102 134 129.2
Ariginin 125.84 192.20 55 56 53 51
Glisin 266.06 274.96 334 225 326 390.2
A= penelitian Liuet al.(2015), B= penelitian Kaewdanget al.(2014), C= penelitian Sinthusamran
et al. (2013), D= penelitian Huang et al. (2016), *tidak dilakukan pengujian, **metode ASC, ***metode hidroekstraksi.
Kolagen mengandung tiga rantai peptida yang tersusun membentuk struktur triple helix. Sekuens dari peptida tersebut adalah Gly-X-Y, dimana X dan Y lebih sering terdeteksi sebagai prolin dan hidroksiprolin(Daboor et al. 2010). Kolagen (ASC dan hidroekstraksi) menunjukkan profil kadar asam amino yang serupa yakni didominasi asam amino glisin.
Glisin merupakan asam amino utama pada kolagen dan kadarnya paling tinggi jika dibandingkan dengan asam amino lainnya. Hema et al. (2013) menyatakan bahwa komposisi asam amino dari kolagen cenderung didominasi oleh glisin, prolin, hidroksiprolin, dan alanin. Hasil ini sesuai dengan penelitian ASC dari gelembung renang ikan grass carp (Liu et al. 2015), ASC dari gelembung renang ikan yellowfin tuna (Kaewdang et al. 2014), ASC gelembung renang ikan seabass (Sinthusamranet al. 2013) memiliki kandungan asam amino glisin yang dominan. Fungsi glisin pada kolagen yaitu membentuk tiga rantai alfa heliks menjadi struktur super heliks (Rengenstein dan Zhou 2007). Selain glisin, kandungan asam amino alanin, prolin dan hidroksiprolin merupakan komponen utama pada kolagen.
21
heliks, energi yang dibutuhkan untuk mempertahankan struktur primer lebih rendah sehingga protein akan lebih stabil.
Prolin dan hidroksiprolin merupakan asam amino yang unik dan sering disebut imino acid. Asam amino prolin dan hidroksiprolin memiliki cincin pirolidina yang berfungsi menahan struktur superheliks pada kolagen (Nagaiet al. 2008). Kandungan asam imino (prolin dan hidroksiprolin) akan meningkatkan stabilitas termal dari kolagen (Benjakulet al.2010).
Kandungan asam amino arginin terdeteksi dan menjadi ciri khas tersendiri pada kolagen ASC dan hidroekstraksi gelembung renang ikan cunang. Arginin merupakan asam amino semi esensial yang memiliki banyak fungsi seperti telibat dalam produksi berbagai enzim, hormon dan protein struktural yang mendukung pelepasan hormon pertumbuhan, insulin, glukagin dan prolaktin yang merupakan komponen dari hormon vesopressin yang diproduksi oleh kelenjar hipofisis serta merupakan perkursor fisiologis senyawa nitrat, poliamina, prolin, glutamat, kreatin, agmatin dan urea. Arginin sebagai penguat imunitas, merangsang timus dan mendorong produksi limfosit sehingga dapat diaplikasikan pada penyembuhan luka bakar dan luka lainnya. Hal ini menunjukkan manfaat dari asam amino arginin sebagai agen farmasi yang dapat diaplikasikan sebagaianti-aging(Gad 2010).
Susunan asam amino yang teridentifikasi antara kolagen ASC dan Hidroekstraksi terdapat perbedaan yang cukup menonjol yakni pada kolagen hidroekstraksi susunan asam amino esensial lebih tinggi dibanding kolagen ASC diantaranya arginin, lisin, treonin, valin, leusin dan isoleusin. Hal ini diduga karena kolagen yang dihasilkan pada metode hidroekstraksi masih belum murni atau masih terdapat protein non-kolagen yang ikut terdeteksi alat HPLC. Metode hidroekstraksi yang digunakan merupakan modifikasi dari metode Huang et al. (2016) dan tidak dilakukan tahapan pemurnian seperti pada metode ASC. Protein non-kolagen yang terdeteksi diduga adalah hasil deproteinasi tidak sempurna pada tahap pre-treatment NaOH sehingga protein non-kolagen seperti protein sarkoplasma dan miofibril masih ada. Protein ikan umumnya terdiri dari 30% protein sarkoplasma, 40 sampai 60% protein miofibril, dan sisanya adalah protein stroma termasuk kolagen dan elastin. Kualitas protein ikan ditentukan oleh jumlah asam amino esensial yang dihitung berdasarkan rumus protein efficiency ratios (PER). PER yang tinggi pada daging ikan cod mengindikasikan tingginya kandungan asam amino esensial (Shahidi 1994).
Komposisi asam amino glisin dan prolin kolagen metode ASC dan hidroekstraksi dari gelembung renang ikan cunang berbeda dengan kolagen metode ASC dari gelembung renang ikan grass carp (Liu et al. 2015), yellowfin tuna (Kaewdang et al.2014) dan seabass (Sinthusamran et al. 2013). Hal ini diduga karena perbedaan jenis dan habitat ikan. Ikan pelagis memiliki daging yang berwarna merah lebih banyak dibadingkan ikan demersal dan ikan air tawar. Daging ikan yang berwarna putih akan memiliki kandungan protein lebih banyak dibanding daging ikan yang berwarna merah. Menurut Shahidi (1994) ikan pelagis memiliki kandungan protein sarkoplasma yang lebih tinggi dibanding ikan demersal.
Suhu Termal (DSC)
22
untuk mengukur fase-fase transisi, salah satunya adalah transisi gelasi (Tg). Suhu transisi gelasi merupakan suhu terputusnya ikatan hidrogen yang mengarah pada pembentukan polimer amorf yaitu gelatin. Pemanasan dengan suhu diatas 40 ºC menyebabkan hancurnya ikatan hidrogen dan terpotongnya sejumlah ikatan kovalen yang menstabilkan struktur triple heliks menghasilkan konversi kolagen menjadi gelatin yang larut (Karim dan Bhat 2009). Kurva termogram kolagen ASC dan hidroekstraksi disajikan pada Gambar 9 dan Gambar 10.
Gambar 9 Kurva termogram DSC kolagen metode hidro-ekstraksi.
23
Kolagen dengan metode hidro-ekstraksi memiliki suhu transisi gelasi (Tg) 67.26 ºC, sedangkan kolagen metode ASC memiliki Tg lebih rendah yakni 63.88 ºC. Perbedaan Tg berkorelasi dengan kandungan asam amino yang terkandung didalamnya (prolin dan hidroksiprolin) (Kittiphattanabawon et al. 2005). kandungan asam imino yang tinggi akan meningkatkan stabilitas termal dari kolagen (Benjakulet al. 2010).
Tg kolagen ASC dan hidro-ekstraksi dari gelembung renang ikan cunang lebih tinggi dibanding Tg kolagen gelembung renang metode ASC: grass carp 38.30 ºC (Liuet al.2015),yellowfin tuna32.97 ºC (Kaewdanget al. 2014),seabass 35.02 ºC (Sinthusamran et al. 2013), bighead carp 37.3 ºC (Liu et al. 2012). Perbedaan suhu ini dipengaruhi oleh kondisi sampel saat dilakukan pengujian. ASC dan kolagen hidro-ekstraksi dari gelembung-renang ikan cunang saat dilakukan analisis termal tidak dilarutkan dalam asam asetat 0.5 M. Huang et al. (2016) menyatakan bahwa melarutkan kolagen dalam asam asetat saat sebelum dilakukan analisis termal akan menyebabkan perbedaan puncak endotermal dan entalpi kolagen. Kolagen yang dilarutkan dalam asam memiliki puncak endotermal yang normal yakni 41 ºC (Matmaroh et al. 2011), tetapi kolagen yang tidak dilarutkan dalam asam (padat) saat analisis suhu termal memiliki puncak endotermal 77 dan 121 ºC (Safandowska dan Pietrucha 2013). Asam asetat akan menyebakan masuknya air ke dalam serat kolagen, hal ini terjadi karena gaya elektrostatik antara gugus polar pada serat kolagen dengan H+ dari asam atau terbentuknya ikatan
hidrogen antara gugus nonpolar pada serat kolagen dengan H+ dari asam. Rengenstein dan Zhou (2007) menyatakan bahwa kolagen yang berasal dari ikan yang hidup perairan panas atau hangat akan memiliki kestabilan termal lebih tinggi dibanding ikan yang hidup diperairan dingin dan beku.
4 SIMPULAN DAN SARAN
Simpulan
Kondisi optimal ekstraksi kolagen ASC pada suhu 9ºC yaitu kombinasi konsentrasi 0.64 M, volume 40.03 mL dan Waktu perendaman 71.57 jam.Kondisi optimal ekstraksi kolagen hidroekstraksi pada suhu 40ºC yaitu kombinasi konsentrasi asam asetat 0,1 M, waktu hidrolisis asam asetat 1 jam dan waktu ekstraksi dalam akuabides 1. Kolagen ASC dan hidroekstraksi merupakan kolagen tipe I dan memiliki ciri khas sebagai agen farmasi untuk anti aging serta tahan terhadap suhu denaturasi kolagen.
Saran
24
DAFTAR PUSTAKA
Ahmad M, Benjakul S. 2010. Extraction and characterization of pepsin soluble collagen from the skin of unicorn leatherjacket (Aluterus monocerous).Food Chemistry, 120:817-824.
Alhana, Suptijah P, Tarman K. 2015. Ekstraksi dan karakterisasi kolagen dari daging teripang gamma. Jurnal Pengolahan Hasil Perikanan Indonesia,
18(2): 150-161.
Astiana I, Nurjanah N, Nurhayati T. 2016. Karakteristik kolagen larut asam dari kulit ikan ekor kuning. Jurnal Pengolahan Hasil Perikanan Indonesia,
19(1):79–93.
[AOAC] Association of Official Analytical Chemist. 2012. Official Methods of Analysis. Washington DC (US): Association of Official Analytical Chemist Inc.
[AOAC] Association of Official Analytical Chemist. 2005. Official Methods of Analysis (18 Edn). Maryland (US): Association of Official Analytical Chemist Inc.
Benjakul S, Thiansilakul Y, Visessanguan W, Roytrakul S, Kishimura H, Prodprand T. 2010. Extraction and characterisation of pepsin soluble collagens from the skin of big eye snapper (Priacanthus tayenus and Priacanthus macracanthus). Journal Science of Food and Agriculture,
90:132-138
Bollag DM, Edelstein SJ. 1991.Protein Methods. New York (US): Wiley-Liss. Bradford MM. 1976. A rapid and sensitive method for the quantitation of
microgram quantities of protein utilizing the principle of protein-dye bending.
Analytical Biochemistry,72:248-254.
Daboor MS, Budge MS, Ghaly EA, Brooks S, Dave D. 2010. Extraction and purification of collagenase enzymes: A Critical review.American Journal of Biochemistry and Biotechnology,6 (4): 239-263.
Duan R, Zhang JJ, Du XQ, Yao XC, Konno K. 2009. Properties of collagen from skin, scale and bone of carp (Cyprinus carpio). Food Chemistry, 112:702–
706.
Fernandes RMT, Couto N, R G, Paschoal CWA, Rohling JH, Bezerra CWB. 2008. Collagen films from swim bladders: Preparation method and properties.
Colloids and Surfaces B: Biointerfaces,62(1):17–21.
Gad ZM. 2010. Anti-aging effects of l-arginine. Journal of Advanced Research,
1:16-177
Hema GS, Shyni K, Mathew S, Anandan R, Ninan G, Lakshmanan PT. 2013. A simple method for isolation of fish skin collagen-biochemical characterization of skin collgagen extracted from albacore tuna (Thunnus alalunga), dog shark (Scoliodon sorrakowah), and rohu (Labeo rohita).
Scholars Research Library Annals of Biological Research, 4(1):271–278. Heu MS, Lee JH, Kim HJ, Jee SJ, Lee JS, Jeon YJ. 2010. Characterization of
acid-and pepsin-soluble collagens from flatfish skin. Food Science and
Biotechnology,10:27–33.
25
Huang YR, Shiau CY, Chen HH, Huang BC. 2011. Isolation and characterization of acid and pepsin-solubilized collagens from the skin of balloon fish (Diodon holocanthus).Food Hydrocolloids,25(6):1507–1513.
Huang CY, Kuo JM, Wu SJ, Tsai HT. 2016. Isolation and characterization of fish scale collagen from tilapia (Oreochromis sp.) by a novel extrusion–hydro extraction process.Food Chemistry,190:997-1006.
Ikoma T, Kobayashi H, Tanaka J, Walsh D, Mann S. 2003. Physical properties of type I collagen extracted from fish scales ofPagrus majorandOreochromis niloticas.International Journal Biology macromolecullar,32(3-5):199-204. Jaswir I, Monsur HA, Salleh HM. 2011. Nano-structural analysis of fish collagen
extracts for new process development. African Journal of Biotechnology,
10(81):18847-18854.
Kaewdang O, Benjakul S, Kaewmanee T, Kishimura H. 2014. Characteristic of collagens from the swim bladders of yellowfin tuna (Thunnus albacares).
Food Chemistry,155: 264-270.
Kasankala LM, Xue Y, Weilong Y, Hong SD, and He Q. 2007. Optimization of gelatine extraction from grass carp (Catenopharyngodon idella) fish skin by response surface methodology.Bioresource Technology,98(17): 3338–3343. Karim AA, Bhat R. 2009. Fish gelatin:properties, challenges, and prospects as an
alternative to mammalian gelatins.Food Hydrocolloid,23:563-576.
Kittiphattanabawon P, Benjakul S, Visessanguan W, Nagai T, Tanaka M. 2005. Characterization of acid-soluble collagen from skin and bone of big eye snapper (Priacanthus tayenus).Food Chemistry,89:363-372.
[KKP] Kementrian Kelautan dan Perikanan. 2015. KKP soroti tiga UPI di sorong. http://kkp.go.id/index.php/berita/kkp-soroti-tiga-upi-di-sorong/. Diakses pada tanggal 10 mei 2015.
[KKP] Kementrian Kelautan dan Perikanan. 2012. Profil Kelautan dan Perikanan Provinsi Jawa Barat untuk Mendukung Industrialisasi Kelautan dan Perikanan. Jakarta (ID): Pusat Data Statistik dan Informasi Kementrian Kelautan dan Perikanan. Hal.57
Kusnandar F. 2010.Kimia Pangan Komponen Makro. Jakarta (ID): Dian Rakyat.
Hal (239)
Leach AA. 1966. Collagen chemistry in relation to isinglass and isinglass finings a review.Journal of the Institute of Brewing,73:8-16.
Laemmli UK. 1970. Cleavage of structural protein during the assembly of head of bacteriophage T4.Nature,277: 680-685.
Liu WT, Li GY, Miao YQ, Wu XH. 2009. Preparation and characterization of pepsin-solubilized type I collagen from the scales of snakehead (Ophiocephalus argus).Journal of Food Biochemistry,33:20–37.
Liu D, Liang L, Regenstein MJ, Zhou P. 2012. Extraction and characterization of pepsin solubilised collagen from fins, scales, skin, bones and swim bladders of bighead carp (Hypophthalmichthys nobilis). Food Chemistry, 133: 1441-1448.
Liu D, Zhang X, Li T, Yang H, Zhang H, Regenstein MJ, Zhou P. 2015. Extraction and characterization of acid and pepsin soluble collagen from the scales, skin, and swim bladders of gras carp (Ctenopharyngodon idella).Food Bioscience,
26
Liu D, Wei G, Li T, Hu J, Lu N, Rengenstein Jm, Zhou P. 2015. Effect of alkaline pretreatments and acid extraction conditions on the acid soluble collagen from grass carp (Ctenopharyngodon idella) skin.Food Chemistry,172: 836-843. Matmaroh K, Benjakul S, Prodpran T, Encarnacion AB, Kishimura H. 2011.
Characteristics of acid soluble collagen and pepsin soluble collagen from scale of spotted golden goatfish (Parupeneus heptacanthus).Food Chemistry,
129(3):1179–1186.
Muyonga JH, Cole CGB, Duodu KG. 2004. Characterization of acid soluble collagen from skins of young and adult Nile perch (Lates niloticus). Food Chemistry,85:81–89.
Nagai T, Suzuki N. 2000. Isolation of collagen from fish waste material skin bone and fins.Food Chemistry,68:277-281
Nikoo M, Xu X, Benjakul S, Xu G, Ramires-Suarez JC, Ehsani A, Kasankala LM, Duan X, Abass S. 2011. Characterization of gelatin from the skin of farmed Amur sturgeonAcipenser schrencki.International Aquatic Research,3: 135-145
Ogawa M, Portier RJ, Moody MW, Bell J, Schexnayder MA, Losso JN. 2004. Biochemical properties of bone and scale collagens isolated from the subtropical fish black drum (Pogonis cromis) and sheepshead seabream (Archosargus probatocephalus).Food Chemistry,88: 495-501.
Putra N, Sahubawa L, Ekantari N. 2013. Ekstraksi dan karakterisasi kolagen dari kulit ikan nila hitam (Oreochromis niloticus). Jurnal Pascapanen dan Bioteknologi Kelautan Perikanan,8(2):171-180
Potaros T, Raksakulthai N, Runglerdkreangkrai J, Worawattanamateekul W. 2009. Characteristics of collagen from nile tilapia (Oreochromis niloticus) skin isolated by two different methods.Natural Science,43(3):584-593.
Regenstein JM, Chaudry MM, Regenstein CE. 2003. The kosher and halal food laws.Comprehensive Reviews in Food Science and Food Safety,2:111–117. Rengenstein JM, Zhou P. 2007.Collagen and gelatin from marine by-product. In Shahidi F, Editor. Maximisisng the value of marine by-product.Boca Raton Florida (US): CRC Press. Hal.279-303
Riyanto B. 2005. Pengembangan pelapis edible dari isinglass dan aplikasinya untuk mempertahankan mutu udang masak [tesis]. Bogor (ID). Pascasarjana Institut Pertanian Bogor.
Roy VK, Kumar NS, Gurusubramanian G. 2012. Proteins-structure, properties and their separation by SDS-polyacrilamide gel electrophoresis. Science Vision, 12(4):170-181.
Sadowska M,Kołodziejska I, Niecikowska C. 2003. Isolation of collagen from the
skins of baltic cod (Gadus morhua).Food Chemistry,81(2):257–262.
Safandowska M, Pietrucha K. 2013. Effect of fish collagen modification on its thermal and rheological properties. International Journal of Biological Macromolecule’s 53:32-37.
Sai S, Jongjareonrak A, Rawdkuen S. 2012. Reextraction recovery and characteristics of skin gelatin from farmed giant fish catfish.Food Bioprocess Technology,5:1197-1205