INDUKSI KERAGAMAN GENETIK MELALUI
IRADIASI SINAR GAMMA PADA KALUS EMBRIOGENIK
HASIL KULTUR PROTOPLAS JERUK SIAM
AIDA WULANSARI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis yang berjudul Induksi Keragaman Genetik melalui Iradiasi Sinar Gamma pada Kalus Embriogenik Hasil Kultur Protoplas Jeruk Siam adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2013
Aida Wulansari
ABSTRACT
AIDA WULANSARI. Induction of Genetic Variability through Gamma Rays Irradiation on Embryogenic Callus Derived Protoplast of Tangerine cv. Siam. Under direction of AGUS PURWITO, ALI HUSNI and ENNY SUDARMONOWATI
Tangerine cv. Siam has sweet flavor, easily peeled skin, soft and juicy flesh. However, it has relatively many seeds (15-20 seeds per fruit), so it can not be competed with citrus from other countries. Fruit quality improvement of citrus has been the subject of citrus breeding program. The first step of breeding program is to increase variability, in order to efficient the selection process. Callus derived protoplast which sub cultured several years has a level of variability. The objective of this research was to increase variation of Tangerine cv. Siam through gamma irradiation on callus derived protoplast. Callus was exposed to gamma irradiation at 0, 10, 20, 30, 40, 50, 60, 70, 80, 90 and 100 Gray. Observation on the growth of callus four weeks after irradiation showed variation on morphology and weight of callus. At low doses (10-50 Gray) callus growth were not inhibited, but at high doses (60-100 Gray) callus growth were inhibited. The result of radio sensitivity dose analyzed by Curve Expert 1.4 software was 53.25 Gray. Callus regeneration ability (somatic embryo maturation and germination) were very diverse between irradiated and non-irradiated callus. Gamma irradiation affects the formation of somatic embryos. After four weeks on MW (Morel-Wetmore) medium containing 0.5 mg/l ABA, 50 Gray callus produced more somatic embryos than other doses. After four weeks on MW medium containing 0.5 mg/l GA3, only 75.9% somatic embryos from 50 Gray callus could germinate, less than other doses. All somatic embryos from non-irradiated callus could germinate. The germination of somatic embryos produced 72 regenerated plantlets. Dendogram based on morphological observations of 0 Gray regenerated plantlets showed 40% variability, while of 50 Gray were 47% and that of 60 Gray were 46%. Ten regenerated plantlets were chosen based on its variability and growth (P-2, P-8, 50-4, 50-6, 50-15, 50-24, 60-8, 60-10, 60-11 and 60-23). Dendogram based on morphological observation between 10 regenerated plantlets showed 30% variation. Molecular analysis of the 10 regenerated plantlets using three ISSR primers (ISSR-1, ISSR-2 and ISSR-4) produced 17 bands with nine polymorphic bands (52.94%). Dendogram based on molecular analysis between 10 regenerated plantlets and wild type shoots showed 22% genetic variation. In vitro and ex vitro
grafting between regenerated plantlets and JC rootstock could accelerate optimal growth of plantlets. Application of ex vitro grafting was more efficient than in vitro grafting. Ex vitro grafting did not need acclimatization stage, where as in vitro grafting still need acclimatization stage before transfer to soil.
RINGKASAN
AIDA WULANSARI. Induksi Keragaman Genetik melalui Iradiasi Sinar Gamma pada Kalus Embriogenik Hasil Kultur Protoplas Jeruk Siam. Dibimbing oleh AGUS PURWITO, ALI HUSNI dan ENNY SUDARMONOWATI.
Jeruk termasuk dalam 10 komoditas utama hortikultura yang telah ditetapkan Departemen Pertanian sejak tahun 2000. Salah satu jenis jeruk di Indonesia yang sangat digemari konsumen adalah jeruk siam. Jeruk siam mendominasi 75% dari total perkebunan jeruk di Indonesia. Jeruk siam memiliki rasa yang manis, harum, daging buahnya lunak, mengandung banyak air dan kulitnya tipis sehingga mudah dikupas. Jeruk ini masih mempunyai biji yang relatif banyak (15-20 biji per buah) dan warna kulit yang kurang menarik, sehingga kalah bersaing dengan jeruk produksi negara lain. Peningkatan kualitas buah dapat dilakukan dengan program pemuliaan tanaman. Langkah awal dari pemuliaan tanaman adalah tersedianya keragaman genetik agar proses seleksi dapat dilakukan. Jeruk termasuk tanaman tahunan sehingga peningkatan keragaman genetiknya terkendala oleh periode juvenil yang panjang. Salah satu strategi yang dapat dilakukan untuk mempercepat peningkatan keragaman genetik adalah melalui induksi keragaman genetik secara in vitro atau variasi somaklonal. Kalus yang berasal dari kultur protoplas memiliki tingkat keragaman genetik yang tinggi. Kalus yang digunakan dalam penelitian ini telah berumur 4-5 tahun sejak inisiasi. Penggunaan kalus ini diharapkan dapat meningkatkan keragaman genetik, karena selain kultur protoplas memiliki potensi untuk beragam, penggunaan kalus yang telah berumur lama dalam kultur in vitro memberikan peluang untuk terjadinya variasi somaklonal. Variasi somaklonal dapat lebih ditingkatkan frekuensinya dengan penggunaan mutagen fisik seperti iradiasi sinar gamma.
analisis molekuler terhadap 10 planlet tersebut dengan tiga primer ISSR (ISSR-1, ISSR-2 dan ISSR-4) menghasilkan 17 pita dan 9 pita bersifat polimorfik (52.94%). Dendogram berdasarkan data molekuler menunjukkan tingkat keragaman genetik sebesar 22%. Berdasarkan perbandingan profil pita antara 10 planlet dengan tunas wild type (asal biji), maka penanda ISSR dapat memberikan gambaran keragaman genetik dari kesepuluh planlet dan berpotensi menjadi mutan putatif.
Penyambungan secara in vitro dan secara ex vitro menunjukkan bahwa planlet masih memiliki kemampuan untuk tumbuh setelah penyambungan. Penggunaan teknik penyambungan secara ex vitro lebih efisien dibandingkan penyambungan secara in vitro, karena tidak perlu melakukan tahap aklimatisasi sebelum dipindahkan ke lapang.
@ Hak Cipta milik IPB, tahun 2013 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
INDUKSI KERAGAMAN GENETIK MELALUI
IRADIASI SINAR GAMMA PADA KALUS EMBRIOGENIK
HASIL KULTUR PROTOPLAS JERUK SIAM
AIDA WULANSARI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Pemuliaan dan Bioteknologi Tanaman
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Induksi Keragaman Genetik melalui Iradiasi Sinar Gamma pada Kalus Embriogenik Hasil Kultur Protoplas Jeruk Siam
Nama : Aida Wulansari NRP : A 253100021
Disetujui
Komisi Pembimbing
Dr. Ir. Agus Purwito, M.Sc.Agr Ketua
Dr. Drs. Ali Husni, M.Si Prof (R). Dr. Ir. Enny Sudarmonowati
Anggota Anggota
Mengetahui
Ketua Program Studi Dekan Sekolah Pascasarjana Pemuliaan dan Bioteknologi Tanaman
Dr. Ir. Trikoesoemaningtyas, M.Sc Dr. Ir. Dahrul Syah, M.Sc. Agr
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini dapat diselesaikan. Tesis ini mengangkat topik tentang Induksi Keragaman Genetik melalui Iradiasi Sinar Gamma pada Kalus Embriogenik Hasil Kultur Protoplas Jeruk Siam. Penelitian ini dilaksanakan mulai bulan Oktober 2011 sampai September 2012.
Ucapan terima kasih dan penghargaan yang setinggi-tingginya penulis tujukan kepada :
1. Dr. Ir. Agus Purwito, MSc.Agr, Dr. Drs. Ali Husni,MSi dan Prof. (R) Dr. Enny Sudarmonowati sebagai pembimbing yang telah memberikan arahan, bimbingan dan menyediakan waktunya sejak dari perencanaan dan pelaksanaan penelitian hingga penulisan tesis.
2. Dr. Dewi Sukma, SP., MSi. sebagai penguji luar komisi, atas kritik, saran dan masukannya yang sangat bermanfaat dalam penyusunan tesis ini.
3. Dr. Ir. Trikoesoemaningtyas, MSc sebagai Ketua Mayor Pemuliaan dan Bioteknologi Tanaman Sekolah Pascasarjana IPB dan Dr. Ir. Darda Efendi, MS selaku Sekretaris Mayor Pemuliaan dan Bioteknologi Tanaman Sekolah Pascasarjana IPB.
4. Program Hibah Pasca LPPM IPB yang telah mendanai penelitian ini.
5. Kementerian Negara Riset dan Teknologi yang telah memberikan beasiswa melalui Program Beasiswa Pascasarjana KMNRT tahun 2010.
6. Kepala Pusat Penelitian Bioteknologi LIPI dan Kepala Bidang Biak Sel dan Jaringan yang telah memberikan ijin untuk melanjutkan pendidikan pascasarjana di IPB.
7. Kepala Balai Besar Bioteknologi dan Sumberdaya Genetik Pertanian (BB-Biogen) yang telah memberikan ijin penggunaan fasilitas pada Laboratorium Biologi Molekuler.
8. Teknisi Laboratorium Kultur Jaringan Tanaman (Ibu Juariah) dan Laboratorium Mikroteknik Tumbuhan Dep. AGH IPB (Bp. Joko Mulyono) atas segala bantuannya selama penelitian.
9. Ibunda, Ayahanda, kakak – kakak tercinta serta suami dan ananda tercinta atas semua doa dan dukungannya selama menempuh studi.
10. Karyanti, SP atas kebersamaannya dalam menyelesaikan penelitian ini baik dalam suka maupun duka.
11. Rekan – rekan sejawat PBT angkatan 2010 atas kebersamaannya selama perkuliahan.
Semoga karya tulis ini dapat bermanfaat.
Bogor, Januari 2013
RIWAYAT HIDUP
Penulis dilahirkan di Semarang pada tanggal 15 Januari 1977 dari ayah Sunarto dan ibu Sri Mulyani. Penulis merupakan putri bungsu dari tiga bersaudara. Pendidikan sarjana ditempuh di Fakultas Biologi UGM, lulus pada tahun 2000. Pada tahun 2010, penulis mendapatkan Beasiswa dari Kementrian Negara Riset dan Teknologi untuk melanjutkan program master pada program studi Pemuliaan dan Bioteknologi Tanaman Sekolah Pascasarjana IPB.
DAFTAR ISI
Pertumbuhan Kalus Embriogenik Hasil Kultur Protoplas ... 25Respon Kalus Setelah Iradiasi Sinar Gamma ... 26
Regenerasi Kalus Hasil Iradiasi Sinar Gamma ... 30
Analisis Keragaman Berdasarkan Karakter Morfologi ... 35
Analisis Keragaman Berdasarkan Penanda Molekuler (ISSR) ... 46
DAFTAR TABEL
Halaman
1 Susunan basa delapan primer ISSR ... 20
2 Pengamatan morfologi dan pertumbuhan kalus empat minggu setelah
subkultur (MSK) ... 26
3 Pengaruh iradiasi sinar gamma terhadap jumlah embrio somatik,
jumlah embrio berkecambah serta jumlah planlet ... 35
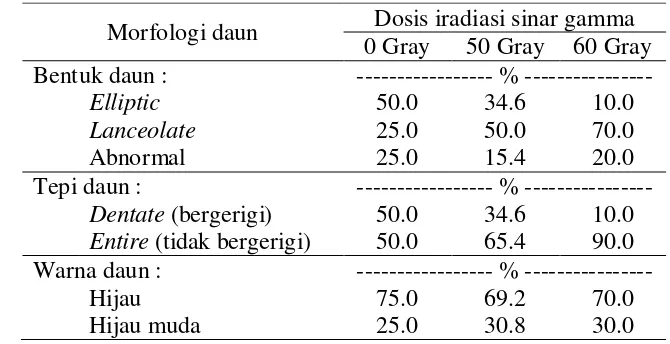
4 Persentase variasi morfologi daun pada planlet ... 37
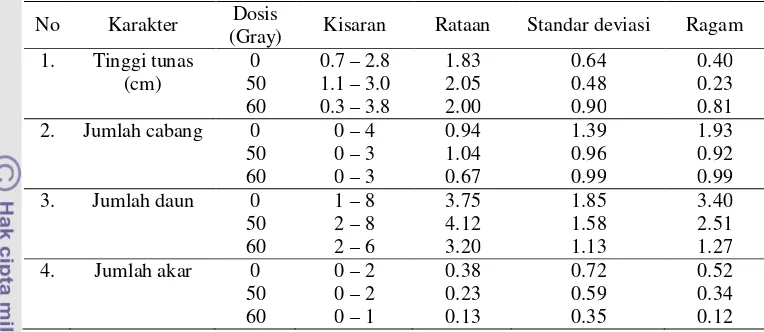
5 Kisaran, nilai rata-rata, ragam dan standar deviasi dari karakter kuantitatif planlet yang dihasilkan ... 38
6 Ukuran dan kerapatan stomata planlet ... 39
7 Tingkat keragaman morfologi 72 planlet berdasarkan analisis gerombol .... 45
8 Jumlah pita hasil amplifikasi tiga primer ISSR ... 47
9 Pertumbuhan planlet hasil penyambungan secara in vitro dan ex vitro
DAFTAR GAMBAR
Halaman
1 Kerangka pemikiran penelitian ... 4
2 Kalus hasil kultur protoplas umur 4-5 tahun sejak inisiasi ... 15
3 Alur penelitian ... 16
4 Kalus awal perlakuan ... 17
5 Batang atas dan batang bawah yang digunakan untuk penyambungan in vitro dan ex vitro ... 23
6 Morfologi kalus empat minggu di media MW tanpa zat pengatur tumbuh ... 25
7 Warna kalus empat minggu setelah iradiasi sinar gamma ... 27
8 Persentase perubahan warna kalus empat minggu setelah iradiasi sinar gamma ... 24
9 Pertambahan berat kalus empat minggu setelah iradiasi sinar gamma ... 28
10 Penentuan dosis radiosensitivitas dengan kurva Gaussian Model berdasarkan persentase pertumbuhan kalu setelah perlakuan iradiasi sinar gamma ... 30
11 Persentase kalus membentuk embrio somatik empat minggu pada media MW yang ditambah 0.5 mgL-1 ABA ... 31
12 Morfologi kalus serta tahapan pendewasaan embrio somatik empat minggu pada media MW yang ditambah 0.5 mgL-1 ABA ... 32
13 Persentase embrio somatik yang berkecambah empat minggu setelah ditanam di media MW yang ditambah 0.5 mgL-1 GA3 ... 33
14 Morfologi embrio somatik yang sudah berkecambah serta morfologi kecambah yang terbentuk ... 34
15 Morfologi daun pada planlet ... 36
16 Tipe dan struktur stomata pada daun planlet jeruk siam ... 39
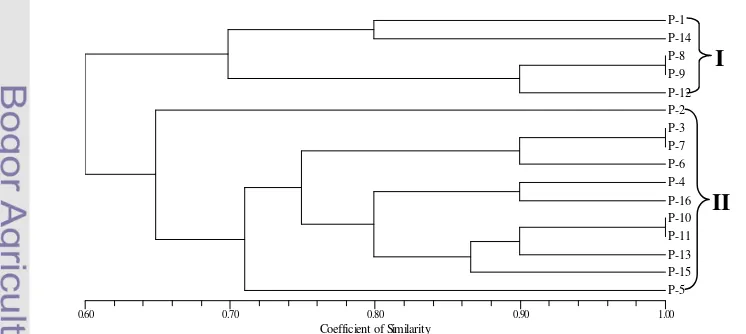
17 Dendogram 16 planlet dari kalus tanpa iradiasi sinar gamma hasil analisis gerombol dengan metode UPGMA ... 40
18 Dendogram 26 planlet dari kalus yang diiradiasi pada dosis 50 Gray hasil analisis gerombol dengan metode UPGMA ... 42
19 Dendogram 30 planlet asal kalus yang diiradiasi pada dosis 60 Gray hasil analisis gerombol dengan metode UPGMA ... 43
21 Dendogram hasil analisis gerombol dengan metode UPGMA terhadap
10 planlet hasil seleksi berdasarkan penanda morfologi ... 45
22 Pola pita 10 planlet hasil seleksi berdasarkan tiga primer ISSR ... 46
23 Dendogram hasil analisis gerombol dengan metode UPGMA terhadap 10 planlet yang dipilih dengan tunas wild type (K) berdasarkan penanda
ISSR ... 48
24 Penyambungan planlet dengan batang bawah JC ... 49
25 Pengamatan anatomi pada daerah pertautan umur satu bulan setelah
DAFTAR LAMPIRAN
Halaman
1 Komposisi media MW ... 75
PENDAHULUAN
Latar Belakang
Jeruk termasuk dalam 10 komoditas utama hortikultura yang telah
ditetapkan Kementerian Pertanian sejak tahun 2000. Produksi jeruk nasional
sekitar 2071.08 juta ton dengan luas areal 73306 Ha pada tahun 2010 (Kementan
2012). Indonesia memiliki tiga jenis jeruk lokal yang komersial, yaitu jeruk siam,
jeruk keprok dan jeruk besar atau pamelo. Ketiga jenis jeruk tersebut memiliki
potensi tinggi karena kemampuan adaptasinya yang baik terhadap beberapa
kondisi iklim di Indonesia. Perkebunan jeruk siam mendominasi 75% dari total
perkebunan jeruk nasional (Ashari & Hanif 2012).
Jeruk siam umumnya dikenal sesuai dengan nama daerah penanamannya,
seperti jeruk siam Pontianak, jeruk siam Banjar, jeruk siam Palembang, jeruk siam
Medan dan lain-lain. Munculnya berbagai jenis tersebut terkait dengan luasnya
penyebaran jeruk siam. Para pekebun di Indonesia lebih memilih varietas ini
karena ukuran buahnya ideal, rasanya manis dan mampu beradaptasi di berbagai
daerah di Indonesia.
Menurut Ladaniya (2008), kriteria jeruk yang digemari konsumen sebagai
konsumsi buah segar selain dari rasanya yang manis juga buahnya memiliki biji
yang sedikit atau tanpa biji (seedless), mudah dikupas dan memiliki warna yang
menarik. Jeruk siam memiliki keunggulan dari rasanya yang manis dan kulitnya
yang tipis, namun masih memiliki biji yang relatif banyak (15 – 20 biji per buah)
serta warna kulit yang kurang menarik, sehingga kalah bersaing dengan jeruk
produksi negara lain.
Peningkatan kualitas jeruk yang sesuai dengan keinginan pasar dapat
dilakukan dengan pemuliaan. Bahan dasar terpenting dalam program pemuliaan
adalah tersedianya keragaman genetik. Keragaman genetik yang luas dapat
mengarah pada program pemuliaan yang efisien. Keragaman genetik dapat
ditingkatkan dengan berbagai cara, yaitu introduksi, eksplorasi, hibridisasi atau
persilangan, mutasi dan transformasi genetik.
Jeruk termasuk tanaman tahunan sehingga peningkatan keragaman
2
yang dapat dilakukan untuk mempercepat peningkatan keragaman genetik adalah
melalui induksi keragaman genetik secara in vitro atau variasi somaklonal.
Keragaman genetik pada teknik in vitro lebih sering terjadi pada kultur
protoplas dibandingkan teknik in vitro yang lainnya, karena adanya peluang fusi
sel secara spontan (Veilleuex et al. 2005). Menurut Predieri (2001), keragaman
genetik melalui variasi somaklonal dapat lebih ditingkatkan frekuensinya bila
dikombinasikan dengan induksi mutasi fisik seperti iradiasi sinar gamma. Iradiasi
dengan sinar gamma banyak digunakan karena memiliki daya tembus yang kuat
sehingga frekuensi mutasinya tinggi dan aplikasinya lebih mudah dibandingkan
mutagen fisik lainnya (Somsri et al. 2009).
Iradiasi sinar gamma terhadap jeruk lokal di Indonesia telah dilakukan
terhadap bibit jeruk keprok Garut, keprok SoE dan jeruk besar (Sutarto et al.
2009). Iradiasi sinar gamma pada jeruk siam secara in vitro belum pernah
dilakukan, sehingga belum ada informasi tentang pengaruh iradiasi sinar gamma
terhadap pertumbuhan dan regenerasi kalus jeruk siam serta tingkat
sensitivitasnya. Perlakuan iradiasi sinar gamma terhadap kalus embriogenik
memberikan keuntungan karena peluang untuk mendapatkan mutan solid lebih
besar sehingga terhindar dari terbentuknya kimera. Mutan solid dapat diperoleh
dari kalus embriogenik karena terdiri atas proembrio yang merupakan sel tunggal.
Peningkatan keragaman genetik jeruk siam melalui variasi somaklonal
pada kalus embriogenik hasil kultur protoplas yang diiradiasi dengan sinar gamma
memberikan peluang keberhasilan yang tinggi, karena sistem regenerasi jeruk
siam melalui embriogenesis somatik telah berhasil dilakukan oleh Husni et al.
(2010), sehingga telah diketahui media terbaik dan konsentrasi zat pengatur
tumbuh yang optimal untuk regenerasi menjadi tanaman. Penyambungan secara
ex vitro (sambung pucuk) antara planlet hasil regenerasi kalus dengan batang
bawah JC (JapanscheCitroen) yang berasal dari biji juga telah berhasil dilakukan
pada planlet jeruk hasil fusi protoplas (Husni 2010) dan planlet jeruk keprok Batu
55 (Merigo 2011) sehingga dapat mempercepat proses adaptasi planlet saat
Tujuan Penelitian
Tujuan penelitian secara umum adalah meningkatkan keragaman genetik
tanaman jeruk siam Pontianak dengan menggunakan kalus hasil kultur protoplas
yang diiradiasi sinar gamma.
Tujuan penelitian secara khusus adalah (1) mendapatkan informasi
tentang respon pertumbuhan dan regenerasi kalus setelah perlakuan iradiasi sinar
gamma serta penentuan dosis radiosensitivitas kalus jeruk siam Pontianak hasil
kultur protoplas, (2) mengevaluasi keragaman planlet mutan putatif secara
morfologi dan secara molekuler.
Hipotesis
1. Iradiasi sinar gamma pada berbagai dosis berpengaruh terhadap pertumbuhan
dan kemampuan regenerasi kalus hasil kultur protoplas.
2. Karakterisasi secara morfologi dan molekuler dapat menunjukkan keragaman
planlet mutan putatif yang diperoleh.
Kerangka Pemikiran
Peningkatan kualitas buah jeruk siam Pontianak yang sesuai dengan
keinginan pasar dapat dilakukan dengan pemuliaan. Bahan dasar pemuliaan yang
terpenting adalah tersedianya keragaman genetik yang luas, sehingga program
pemuliaan menjadi lebih efisien. Keragaman genetik dapat diperluas dengan
berbagai cara, yaitu introduksi, eksplorasi, hibridisasi atau persilangan, mutasi dan
transformasi genetik.
Jeruk termasuk tanaman tahunan sehingga peningkatan keragaman genetik
terkendala oleh periode juvenil yang panjang. Salah satu strategi yang dapat
dilakukan untuk mempercepat peningkatan keragaman genetik adalah melalui
induksi keragaman genetik secara in vitro atau variasi somaklonal yang
dikombinasikan dengan iradiasi sinar gamma. Kombinasi antara teknik in vitro
dengan induksi mutasi sangat menguntungkan, karena teknik in vitro
memungkinkan penyediaan populasi yang besar tanpa memerlukan areal yang
luas sehingga biaya dapat ditekan. Tersedianya populasi yang besar pada
Peningkatan keragaman genetik jeruk siam Pontianak melalui variasi
somaklonal pada kalus embriogenik asal kultur protoplas yang dikombinasikan
dengan perlakuan iradiasi sinar gamma memiliki peluang keberhasilan yang tinggi
karena sistem regenerasi jeruk siam melalui embriogenesis somatik telah
diperoleh dari penelitian sebelumnya (Husni et al. 2010). Skema kerangka
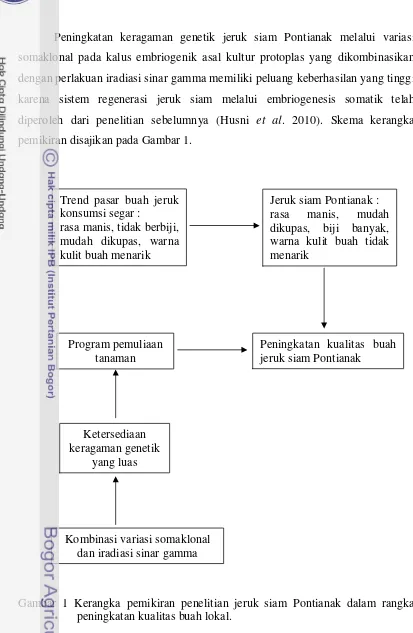
pemikiran disajikan pada Gambar 1.
Gambar 1 Kerangka pemikiran penelitian jeruk siam Pontianak dalam rangka peningkatan kualitas buah lokal.
Trend pasar buah jeruk konsumsi segar :
rasa manis, tidak berbiji, mudah dikupas, warna kulit buah menarik
Jeruk siam Pontianak : rasa manis, mudah dikupas, biji banyak, warna kulit buah tidak menarik
Peningkatan kualitas buah jeruk siam Pontianak
Program pemuliaan tanaman
Ketersediaan keragaman genetik
yang luas
TINJAUAN PUSTAKA
Botani dan Karakteristik Jeruk Siam
Jeruk siam memiliki nama ilmiah Citrus nobilis var. microcarpa Lour. dan
termasuk dalam genus Citrus serta famili Rutaceae. Spesies dalam Rutaceae
secara umum memiliki empat karakteristik utama, yaitu : 1) memiliki kelenjar
minyak ; 2) ovarium/bakal buah terletak menumpang diatas dasar bunga ; 3)
terdapat titik-titik atau bercak berwarna terang pada daun ; dan 4) buah memiliki
plasenta aksil. Famili Rutaceae terbagi lagi menjadi enam sub-famili, salah
satunya adalah Aurantioideae, termasuk didalamnya Citrus (Davies & Albrigo
1994). Taksonomi jeruk sangat rumit, membingungkan dan kontroversial karena
heterogenitas genetik di dalam genusnya, adanya poliembrioni dan lamanya waktu
yang diperlukan untuk seleksi dan rekombinasi (Baig et al. 2009).
Buah jeruk siam memiliki ciri khas yaitu kulitnya tipis, mengkilap dan
melekat pada dagingnya. Ukuran buahnya ideal, tidak terlalu besar dan juga tidak
terlalu kecil. Kulit buahnya berwarna hijau kekuningan dan permukaannya halus.
Jeruk siam yang paling populer di masyarakat adalah jeruk siam Pontianak,
walaupun jeruk siam juga dihasilkan di daerah lainnya seperti Garut, Banjar,
Medan dan Palembang. Banyaknya nama jeruk siam yang muncul di berbagai
daerah berdasarkan tempat tumbuhnya menggambarkan luasnya penyebaran jeruk
ini. Perbedaan antar jeruk siam sendiri tidak jelas, kalaupun ada perbedaan
merupakan akibat dari proses adaptasi terhadap tempat tumbuhnya (Setiawan &
Trisnawati 1999).
Tanaman jeruk siam berbunga sepanjang tahun, tidak mengenal musim,
sehingga buahnya selalu tersedia setiap saat. Tiap kuntum bunga berkelamin
jantan dan betina. Penyerbukannya dibantu oleh serangga, atau dapat pula
merupakan penyerbukan sendiri yaitu putik dibuahi oleh serbuk sari dari bunga
yang sama dalam satu tanaman atau merupakan penyerbukan silang, yaitu putik
dibuahi oleh serbuk sari dari bunga yang berbeda dalam satu tanaman atau dari
tanaman yang lainnya (Ortiz 2002).
Jeruk memiliki reproduksi biologi yang unik, yaitu adanya apomiksis atau
didefinisikan sebagai reproduksi aseksual melalui biji, dan embrio yang terbentuk
bukan hasil fertilisasi gamet. Istilah nucellar embryony atau embrio nuselar pada
biji jeruk merujuk kepada perkembangan embrio dari jaringan maternal yang
disebut nuselus yang terletak di sekeliling kantung embrio. Embrio nuselar terkait
pula dengan istilah poliembrioni (terbentuknya banyak embrio dalam satu biji),
sehingga saat biji jeruk berkecambah akan dihasilkan banyak kecambah (Kepiro
& Roose 2007).
Kultur Protoplas
Dinding sel pada tanaman dapat dihilangkan secara mekanik maupun
secara enzimatis. Proses ini menghasilkan sel telanjang yang disebut protoplas.
Protoplas tersebut dapat bertahan hidup pada media isotonik (Neumann et al.
2009). Isolasi protoplas melalui pemisahan secara mekanik dilakukan dengan cara
memotong jaringan tanaman sehingga protoplas akan keluar dengan sendirinya.
Teknik ini hanya menghasilkan protoplas dalam jumlah yang terbatas. Teknik
degradasi dinding sel secara enzimatis kemudian menggantikan teknik mekanik
karena dapat menghasilkan lebih banyak protoplas (Davey et al. 2010).
Secara enzimatis, jenis dan konsentrasi enzim yang digunakan sangat
mempengaruhi protoplas yang diperoleh. Dinding sel yang masih muda biasanya
terdiri dari pektin dan selulosa, sehingga enzim yang paling baik digunakan
adalah pectinase atau macerozyme dan cellulase. Enzim pectinase atau
macerozyme berfungsi untuk menghancurkan lamela tengah yang tersusun dari
senyawa pektin sehingga sel akan terpisah satu dengan yang lainnya. Proses ini
biasa disebut maserasi sel. Fungsi enzim cellulase adalah menghancurkan dan
melisiskan penebalan primer dari dinding sel yang tersusun atas selulosa (Riyadi
2006).
Protoplas dapat diisolasi dari berbagai tipe eksplan. Protoplas dalam
jumlah banyak hanya dapat diisolasi dari daun yang masih muda dan kalus atau
kultur sel yang sedang aktif pertumbuhannya. Daun yang berasal dari tunas in
vitro akan memberikan hasil isolasi dan kultur protoplas yang lebih konsisten
Isolasi protoplas pada kalus atau kultur sel lebih baik dilakukan pada fase
logaritmik (Liu 2005).
Keberhasilan penggunaan protoplas dalam program pengembangan dan
perbaikan tanaman membutuhkan metode yang efektif dan efisien untuk
regenerasi protoplas menjadi tanaman. Berbagai kajian telah dilakukan untuk
mengidentifikasi faktor-faktor yang terkait dengan genotipe untuk mengetahui
kemampuan regenerasi dari protoplas menjadi tanaman (Wisniewska & Sawka
2008). Regenerasi protoplas melalui jalur embriogenesis somatik menghasilkan
frekuensi pembentukan tanaman yang tinggi. Protokol regenerasi tersebut terdiri
dari tiga komponen penting, yaitu pembelahan protoplas dan efisiensi plating,
perkembangan embrio somatik menjadi planlet serta kemampuan bertahan hidup
setelah dipindahkan ke kondisi ex vitro (Wang et al. 2008).
Embriogenesis Somatik
Istilah embriogenesis somatik menggambarkan proses perkembangan sel
somatik yang menghasilkan suatu struktur bipolar yang secara morfologi sangat
mirip dengan embrio zigotik. Tahapan perkembangannya juga sama dengan
tahapan perkembangan pada embrio zigotik yaitu melalui tahap globular, jantung,
torpedo dan kotiledonari. Induksi embrio somatik juga melibatkan lintasan genetik
yang sama dengan embrio zigotik. Embrio somatik tersebut kemudian tumbuh
menjadi tanaman normal yang menghasilkan bunga dan biji (Neumann et al.
2009; Mujib et al. 2005). Embriogenesis somatik atau aseksual merupakan suatu
fenomena yang secara alami dapat terjadi. Pada genus Citrus selain terbentuk
embrio zigotik, terdapat embrio tambahan yaitu embrio nuselar yang merupakan
perkembangan sel-sel pada jaringan nuselus atau integumen bagian dalam
(Ammirato 1983).
Menurut George et al. (2008), regenerasi tanaman secara in vitro melalui
embriogenesis somatik terdiri atas lima tahap, yaitu : 1) inisiasi kultur
embriogenik, dengan cara mengkulturkan eksplan pada media dengan zat
pengatur tumbuh terutama auksin atau sering juga ditambah sitokinin ; 2)
proliferasi kultur embriogenik, pada media padat atau media cair dengan
pre-maturasi embrio somatik, pada media tanpa zat pengatur tumbuh atau dengan
konsentrasi zat pengatur tumbuh yang lebih rendah, keadaan ini akan
menghambat proliferasi dan merangsang pembentukan embrio somatik dan
perkembangan awal ; 4) pendewasaan atau maturasi embrio somatik, dilakukan
dengan menggunakan media yang ditambahkan ABA atau zat pengatur tumbuh
lain yang dapat menurunkan potensial osmotik ; dan 5) regenerasi tanaman, pada
media tanpa zat pengatur tumbuh.
Induksi embriogenesis somatik pada tanaman jeruk telah berhasil
dilakukan dengan menggunakan berbagai eksplan, seperti jaringan nuselus pada
Citrus sinensis cv. Valencia (Souza et al. 2011), Citrus suhuensis (Agisimanto et
al. 2012) dan embrio muda jeruk siam (Husni et al. 2010), potongan daun pada
Citrus aurantifolia dan Citrus sinensis (Mukhtar et al. 2005), anther pada Citrus
reticulata (Benneli et al. 2010) serta jaringan ovul yang belum dibuahi pada jeruk
manis (Cardoso et al. 2011). Regenerasi tanaman jeruk hasil kultur protoplas
maupun hasil fusi protoplas melalui embriogenesis somatik juga telah berhasil
dilakukan (An et al. 2008; Husni 2010; Grosser & Gmitter 2011).
Penguasaan terhadap sistem regenerasi secara in vitro melalui jalur
embriogenesis somatik sangat menguntungkan untuk studi rekayasa genetika.
Embrio somatik berasal dari satu sel, sehingga perubahan genetik yang terjadi
akibat mutasi maupun transformasi gen akan menghasilkan mutan yang utuh
tanpa terjadi kimera. Embrio somatik juga dapat dengan mudah dan cepat
dilipatgandakan jumlahnya sehingga ketersediaan materi untuk rekayasa genetika
menjadi tidak terbatas (Feher et al. 2003).
Induksi Keragaman Genetik
Langkah awal dari suatu kegiatan pemuliaan adalah memperoleh
keragaman genetik yang luas dari tanaman yang akan dimuliakan. Proses seleksi
akan menjadi lebih efisien apabila suatu populasi memiliki keragaman yang
tinggi. Kegiatan pemuliaan dimulai dengan pemilihan genotipe yang memiliki
karakter yang diinginkan dari berbagai keragaman yang sudah ada atau dengan
membuat keragaman baru dengan cara mutasi jika tidak tersedia plasma nutfahnya
Keragaman genetik dapat diperoleh akibat teknik kultur sel dan jaringan
tanaman, yang disebut keragaman atau keragaman somaklonal. Keragaman
somaklonal yang terjadi seringkali bersifat epigenetik, tidak stabil dan tidak
diwariskan. Keragaman tersebut juga dapat bersifat genetik, stabil dan diwariskan,
sehingga memiliki potensi yang besar dalam program perbaikan tanaman
(Orbovic et al. 2008). Beberapa faktor yang mempengaruhi keragaman
somaklonal adalah latar belakang genetik, sumber eksplan, komposisi media serta
umur kultur. Soedjono (2003) mengemukakan bahwa pada umumnya setiap siklus
regenerasi menghasilkan 1 – 3% keragaman somaklonal, meskipun tingkat
perbedaannya 0 – 100%.
Brar dan Jain (1998) menyatakan bahwa untuk memperoleh keragaman
somaklonal maka dapat dilakukan beberapa pendekatan : 1) induksi dan
pertumbuhan kalus atau suspensi sel pada beberapa siklus; 2) regenerasi tanaman
dari kultur yang telah lama; 3) seleksi pada tanaman regeneran untuk karakter
tertentu seperti toleran terhadap cekaman biotik dan abiotik dengan menggunakan
patho-toksin, herbisida; 4) seleksi pada tanaman varian selama beberapa generasi;
dan 5) multiplikasi tanaman varian yang sudah stabil untuk menghasilkan galur
baru.
Menurut Jain (2001), regenerasi tanaman melalui organogenesis atau
embriogenesis mempunyai potensi untuk terjadinya ketidakstabilan genetik,
terutama bila regenerasi terjadi melalui tahap pembentukan kalus, suspensi sel
atau kultur protoplas. Keragaman somaklonal pada kultur protoplas berbagai
spesies tanaman, telah banyak ditemukan dan diamati. Keragaman somaklonal
yang telah diperoleh dari kultur protoplas antara lain perubahan morfologi daun
dan bunga, fertilitas, peningkatan ketahanan terhadap penyakit dan keragaman
pada produksi metabolit sekunder (Veilleuex et al. 2005).
Induksi Mutasi
Penggunaan teknik kultur jaringan yang dikombinasikan dengan induksi
mutagenik ataupun tanpa induksi mutagenik telah banyak digunakan dengan
tujuan memperbaiki tanaman melalui peningkatan keragaman genetik dan
kultivar baru (Orbovic et al. 2008). Kombinasi antara teknik in vitro dengan
induksi mutasi sangat menguntungkan, karena teknik in vitro memungkinkan
penyediaan populasi yang besar tanpa memerlukan areal yang luas sehingga biaya
dapat ditekan. Tersedianya populasi yang besar untuk mutagenesis merupakan
prasyarat dasar untuk memperoleh varian (Ahloowalia & Maluszynski 2001).
Sumber keragaman untuk pemuliaan tanaman hampir sebagian besar
berasal dari mutasi. Adanya mutasi akan menciptakan keragaman baru, sedangkan
hibridisasi atau persilangan menghasilkan keragaman yang sudah ada dari
tetuanya. Mutasi didefinisikan sebagai perubahan materi genetik yang dapat
diwariskan. Perubahan pada sekuen DNA akan mengakibatkan perubahan kode
genetik. Keseluruhan proses yang menyebabkan timbulnya berbagai macam
mutasi disebut mutagenesis (van Harten 1998). Pemuliaan mutasi dapat digunakan
untuk memperbaiki karakter tertentu pada kultivar yang sudah unggul dengan
tetap mempertahankan ciri genetik dan karakter – karakter unggulnya (Sleper &
Poelhman 2006).
Mutasi dapat terjadi secara spontan atau alami maupun dengan induksi.
Secara alami semua makhluk hidup mengalami mutasi, hanya levelnya saja yang
berbeda. Mutasi spontan adalah mutasi yang terjadi tanpa diketahui penyebabnya,
terjadi secara acak dan tidak diketahui kapan terjadinya. Mutasi ini terjadi sebagai
hasil proses alami di dalam sel seperti kesalahan pada saat replikasi DNA.
Kesalahan replikasi DNA mencapai 1 per 102 gen yang bereplikasi. Namun
karena adanya mekanisme perbaikan, maka laju mutasi akibat kesalahan replikasi
DNA menjadi sekitar 1 per 108 sampai 109 lokus. Mutasi spontan terjadi pada laju
yang sangat rendah dan beragam pada setiap organisme (van Harten 1998).
Mutasi induksi adalah mutasi yang telah diketahui agen penyebabnya.
Laju mutasi induksi lebih tinggi dibandingkan mutasi spontan. Mutagen fisik dan
kimia diketahui dapat meningkatkan laju mutasi ratusan bahkan sampai ribuan
kali dibandingkan mutasi spontan. Laju mutasi yang optimal untuk kegiatan
pemuliaan adalah sekitar 1 per 104 lokus (Broertjes & van Harten 1988; van
Harten 1998).
Penelitian mutagenesis menggunakan mutagen fisik seperti sinar X, sinar
penggunaan mutagen fisik antara lain dosis dapat diukur secara akurat,
reprodusibel dan daya penetrasi yang seragam dan kuat pada sistem multiseluler
terutama bila digunakan sinar gamma (Jain 2005). Faktor kunci dalam iradiasi
bahan tanaman adalah dosis iradiasi, yaitu jumlah energi radiasi yang diserap oleh
bahan tanaman. Unit pengukuran dosis radiasi adalah Gray (Gy). Satu Gy sama
dengan penyerapan 1 J energi per kilogram bahan tanaman. Dosis radiasi dibagi
menjadi 3 kategori : tinggi (> 10 kGy), medium (1 sampai 10 kGy) dan rendah (<
1 kGy). Dosis tinggi digunakan untuk sterilisasi produk makanan, dan dosis
rendah untuk menginduksi mutasi pada biji. Bahan tanaman yang berasal dari
kultur in vitro biasanya digunakan dosis rendah, karena biasanya beratnya hanya
beberapa miligram untuk jaringan dan beberapa mikrogram untuk suspensi sel
(Ahloowalia & Maluszynski 2001).
Tingkat keberhasilan iradiasi dalam meningkatkan keragaman populasi
sangat ditentukan oleh radiosensitivitas tanaman (genotipe) yang diiradiasi karena
tingkat radiosensitivitas antargenotipe dan kondisi tanaman saat diiradiasi sangat
berkeragaman. Radiosensitivitas dapat diukur berdasarkan nilai LD50 (lethal dose
50), yaitu tingkat dosis yang menyebabkan kematian 50% dari populasi tanaman
yang diiradiasi. Dosis optimal dalam induksi mutasi yang menimbulkan
keragaman dan menghasilkan mutan terbanyak biasanya terjadi di sekitar LD50.
Selain LD50, radiosensitivitas juga dapat diamati dari adanya hambatan
pertumbuhan atau Growth Reduction 50 (GR50), yaitu dosis yang menyebabkan
penurunan pertumbuhan 50% pada bahan tanaman hasil iradiasi (Amano 2004).
Analisis Keragaman Genetik
Keragaman genetik tanaman yang terjadi akibat induksi mutasi dapat
diamati secara langsung melalui morfologi tanaman, jaringan tanaman, biokimia
(protein atau isozim), analisis sitologi/histologi atau secara tidak langsung dengan
marka molekuler atau DNA (Brar 2002). Terdapat dua kategori marka atau
penanda yang umum digunakan peneliti, yaitu morfologi dan molekuler,
keduanya merupakan hasil dari adanya perbedaan genotipe atau perbedaan sekuen
Penanda morfologi dapat dengan mudah diidentifikasi, terkait dengan
karakter tertentu namun membutuhkan waktu yang lama dan sangat dipengaruhi
oleh lingkungan. Penanda molekuler bersifat diwariskan dan terkait dengan
karakter tertentu, dapat membedakan perubahan kecil pada tingkat asam nukleat,
cepat dan tidak dipengaruhi oleh lingkungan (McCaskill & Giovannoni 2002).
Menurut Chawla (2002), suatu penanda harus bersifat polimorfik, artinya
penanda tersebut memiliki bentuk yang berbeda, sehingga dapat membedakan
kromosom yang membawa gen mutan dengan kromosom yang membawa gen
normal. Polimorfisme tersebut dapat dideteksi melalui 3 tingkatan, yaitu:
perbedaan fenotipik (morfologi), perbedaan protein yang dihasilkan (biokimia)
atau perbedaan sekuen atau urutan nukleotida pada rantai DNA (molekuler).
Pemilihan teknik molekuler yang tepat, disesuaikan dengan materi genetik
yang digunakan, jenis studi genetik dan tujuan yang ingin dicapai. Selain itu,
ketersediaan alat yang dimiliki suatu laboratorium dan dana yang tersedia
merupakan hal utama yang harus dipertimbangkan sebelum memilih marka yang
sesuai. Tidak ada penanda yang paling unggul penggunaannya diantara penanda
yang ada, masing-masing memiliki kelebihan dan juga kekurangan. Penggunaan
kombinasi beberapa penanda membuat survei genom menjadi lebih lengkap
(Biswas et al. 2010).
Penanda molekuler Inter Simple Sequence Repeat (ISSR) merupakan
penanda yang berkembang lebih akhir dibanding RAPD dan RFLP. ISSR
memiliki reproducibility yang tinggi. Hal ini mungkin karena primer yang
digunakan lebih panjang (16 – 25 mers) daripada RAPD yang reproducibility-nya
rendah. Penanda ISSR itu lebih cepat, lebih murah, memerlukan jumlah DNA
yang sedikit, mampu melakukan pendeteksian genetik polimorfisme tanpa perlu
lebih dahulu mengetahui susunan basa (sekuens) dari genomik tumbuhan.
Susunan basa yang berulang ditemukan secara luas dan menyebar di seluruh
genom serta memiliki polimorfisme yang tinggi (Rahayu & Handayani 2010).
ISSR (Inter Simple Sequence Repeat) merupakan penanda yang banyak
digunakan dan lebih konsisten untuk menganalisis keragaman genetik serta dapat
menunjukkan keterkaitan antara fragmen polimorfik yang teramplifikasi dengan
Penanda ISSR telah banyak digunakan pada tanaman jeruk antara lain
untuk mempelajari hubungan filogenetik pada plasma nutfah jeruk (Fang et al.
1998; Shahsavar et al. 2007; Kumar et al. 2010; Marak & Laskar 2010), untuk
mengidentifikasi bibit zigotik dan nuselar hasil persilangan interspesies (Golein et
al. 2011), untuk membedakan antara aksesi grapefruit dan jeruk besar (Uzun et al.
2010), untuk mengidentifikasi jeruk hasil fusi protoplas (Husni 2010) serta untuk
mengidentifikasi hubungan kekerabatan genetik jeruk Siam di Indonesia
(Agisimanto et al. 2007; Martasari et al. 2012).
Penyambungan (grafting) Tanaman
Penyambungan adalah penggabungan dua bagian tanaman yang berbeda
sehingga menjadi satu tanaman yang utuh dan mampu tumbuh setelah terjadi
regenerasi jaringan pada bekas luka sambungannya. Penyambungan umum
dilakukan untuk memperbaiki kualitas dan kuantitas hasil tanaman khususnya
pada tanaman buah – buahan, tanaman perkebunan dan tanaman hias
(Mangoendidjojo 2003). Penyambungan pada tanaman jeruk sudah umum
dilakukan terutama untuk peningkatan kualitas buah jeruk serta hasil buah per
pohon (Syah et al. 2000; Putri et al. 2006), meningkatkan resistensi terhadap
hama dan penyakit tertentu serta respon terhadap berbagai cekaman lingkungan
tumbuhnya (Susanto et al. 2010).
Menurut Ollitrault (1990), penyambungan ex vitro pada tanaman jeruk
perlu dilakukan sebagai kelanjutan perbanyakan in vitro yang sering kali
membutuhkan waktu yang lama untuk tahap aklimatisasi serta adanya karakter
juvenil pada planlet hasil embriogenesis somatik yang menjadi salah satu
hambatan dalam perbanyakan bibit jeruk. Penyambungan secara ex vitro dapat
mempersingkat dan mengurangi tahapan in vitro seperti induksi perakaran,
hardening dan aklimatisasi karena planlet sebagai batang atas tidak perlu
memiliki akar.
Penyambungan selain dapat dilakukan di lapang atau ex vitro juga dapat
dilakukan secara in vitro dalam kondisi aseptik. Keunggulan penggunaan
sambung mikro (micrografting) adalah dapat mempersingkat waktu penyediaan
dan dapat diproduksi dalam jumlah yang banyak serta rendahnya inkompatibilitas
karena tingkat kompatibilitas sambungan dapat diketahui secara dini (Mathius et
al. 2006).
Penelitian penyambungan ex vitro dan in vitro pada jeruk kalamondin
menunjukkan bahwa penyambungan secara ex vitro memiliki daya tumbuh lebih
baik daripada penyambungan in vitro (Devy etal. 2011). Penyambungan ex vitro
pada planlet jeruk hasil fusi protoplas (Husni 2010) serta planlet hasil
embriogenesis somatik jeruk keprok Batu 55 (Merigo 2011) juga telah berhasil
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan dari bulan Oktober 2011 sampai September 2012.
Kultur in vitro dilaksanakan di Laboratorium Kultur Jaringan Tanaman Fakultas
Pertanian IPB. Iradiasi sinar gamma dilakukan di Pusat Penelitian dan
Pengembangan Teknologi Isotop dan Radiasi, Badan Tenaga Nuklir Nasional
(BATAN), Pasar Jumat, Jakarta. Analisis molekuler dilaksanakan di
Laboratorium Biologi Molekuler Balai Besar Bioteknologi dan Sumberdaya
Genetik Pertanian (BB-Biogen), Kementerian Pertanian, Bogor.
Bahan dan Alat
Eksplan yang digunakan dalam penelitian ini adalah kalus embriogenik
hasil kultur protoplas jeruk siam yang diperoleh dari penelitian sebelumnya oleh
Husni et al (2008). Kalus tersebut telah berumur 4 – 5 tahun sejak inisiasi dan
dilakukan subkultur setiap bulan untuk menjaga viabilitasnya (Gambar 2).
Gambar 2 Kalus hasil kultur protoplas yang berumur 4 – 5 tahun sejak inisiasi. (A) Morfologi kalus, (B) Struktur kalus secara mikroskopis pada perbesaran 10 kali.
Media dasar yang digunakan adalah media MW (Morel dan Wetmore)
(Husni et al. 2010), yang terdiri dari unsur makro MS (Murashige dan Skoog),
unsur mikro MS dan vitamin MW. Zat pengatur tumbuh yang digunakan yaitu
ABA (AbscisicAcid) dan GA3 (Gibberelic Acid). Selain itu, digunakan bahan dan
alat untuk teknik kultur jaringan, analisis stomata dan analisis ISSR.
54
Metode Penelitian
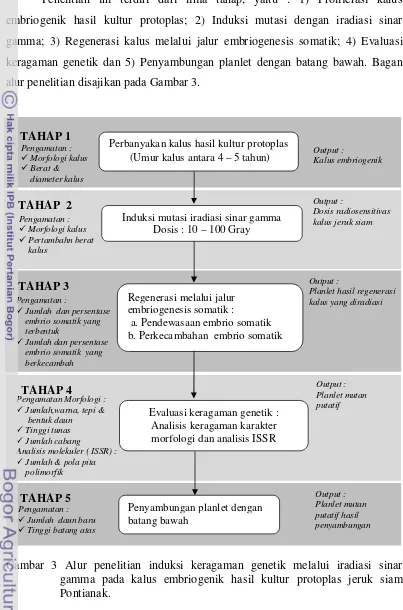
Penelitian ini terdiri dari lima tahap, yaitu : 1) Proliferasi kalus
embriogenik hasil kultur protoplas; 2) Induksi mutasi dengan iradiasi sinar
gamma; 3) Regenerasi kalus melalui jalur embriogenesis somatik; 4) Evaluasi
keragaman genetik dan 5) Penyambungan planlet dengan batang bawah. Bagan
alur penelitian disajikan pada Gambar 3.
Gambar 3 Alur penelitian induksi keragaman genetik melalui iradiasi sinar gamma pada kalus embriogenik hasil kultur protoplas jeruk siam Pontianak.
Regenerasi melalui jalur embriogenesis somatik :
17
1 Proliferasi Kalus Embriogenik Hasil Kultur Protoplas
Tujuan dari tahap ini adalah untuk perbanyakan kalus embriogenik hasil
kultur protoplas yang telah ada. Media dasar yang digunakan merupakan media
modifikasi MS yaitu media MW (Husni et al. 2010). Penanaman dilakukan pada
laminar air flow cabinet. Setiap botol berisi lima kumpulan kalus embriogenik
dengan diameter kalus + 0.5 cm atau berat + 0.5 g. Semua kultur disimpan di
ruang kultur dengan suhu 250C dan penyinaran selama 16 jam per hari.
Perbanyakan kalus dilakukan selama 8 minggu.
Pengamatan dilakukan setiap empat minggu terhadap pertumbuhan atau
proliferasi kalus, meliputi : 1) morfologi kalus (warna dan struktur kalus); 2)
bobot segar kalus (g) dan 3) diameter kalus (cm).
2 Induksi Mutasi dengan Iradiasi Sinar Gamma
Kalus embriogenik hasil perbanyakan pada tahap sebelumnya dengan
berat + 0.5 g disubkultur ke dalam cawan petri dan diradiasi pada gamma
chamber Cobalt-60 dengan perlakuan dosis : 0, 10, 20, 30, 40, 50, 60, 70, 80, 90
dan 100 Gray (laju dosis : 0.648 kGy/jam).
Kalus hasil iradiasi sinar gamma kemudian langsung disubkultur ke media
MW (Husni et al. 2010) tanpa zat pengatur tumbuh. Rancangan percobaan yang
digunakan adalah Rancangan Acak Lengkap (RAL) faktor tunggal. Perlakuannya
adalah 11 taraf dosis iradiasi sinar gamma. Setiap perlakuan terdiri atas 10 botol
(10 ulangan) yang masing-masing botol berisi lima kumpulan kalus (Gambar 4).
Perbedaan setiap perlakuan dianalisis menggunakan uji F pada taraf nyata 5%,
dan uji lanjut DMRT (Duncan Multiple Range Test).
Gambar 4 Kalus pada awal perlakuan. (A) Diameter kalus + 0.5 cm, (B) Tiap botol berisi lima kumpulan kalus.
18
Semua kalus diinkubasi di dalam ruang kultur bersuhu 250C dengan
penyinaran selama 16 jam per hari. Pengamatan dilakukan empat minggu setelah
iradiasi sinar gamma, terhadap morfologi kalus dan pertambahan berat kalus.
Penentuan dosis radiosensitivitas dilakukan dengan pendekatan Growth
Reduction 50 (GR50), yaitu dosis yang menyebabkan penurunan pertumbuhan
50% pada bahan tanaman hasil iradiasi (Amano 2004). Dosis radiosensitivitas
kalus jeruk Siam asal kultur protoplas diperoleh dari analisis data pertumbuhan
kalus dengan menggunakan perangkat lunak Curve Expert 1.4.
3. Regenerasi Kalus melalui Jalur Embriogenesis Somatik
Kalus embriogenik yang telah diberikan perlakuan iradiasi sinar gamma,
kemudian diregenerasikan melalui jalur embriogenesis somatik. Tahapan
embriogenesis somatik pada penelitian ini yaitu :
a. Pendewasaan Embrio Somatik
Kalus embriogenik dari tahap dua yang telah membentuk proembrio
disubkultur ke media pendewasaan embrio somatik yaitu media MW dengan
penambahan 0.5 mgL-1 ABA (Husni et al. 2010). Pengamatan dilakukan setiap
minggu selama empat minggu. Peubah yang diamati adalah persentase kumpulan
kalus yang membentuk embrio somatik dan jumlah embrio somatik yang
terbentuk (fase globular - kotiledon).
b. Perkecambahan Embrio Somatik
Embrio somatik yang telah dewasa (fase kotiledon) kemudian dipindahkan
ke media perkecambahan yaitu media MW dengan penambahan 0.5 mgL-1 GA3
(Husni et al. 2010). Pengamatan dilakukan setiap minggu selama empat minggu.
Peubah yang diamati adalah persentase embrio somatik yang berkecambah dan
jumlah kecambah yang dihasilkan.
4. Evaluasi Keragaman Genetik
Tunas in vitro hasil perkecambahan embrio somatik kemudian disubkultur
setiap empat minggu ke media MW (Husni et al. 2010) tanpa zat pengatur tumbuh
19
genetik dilakukan dengan karakterisasi secara morfologi dan secara molekuler
dengan penanda ISSR.
a. Karakterisasi morfologi Pengamatan dilakukan terhadap :
Tinggi tunas (cm), pengukuran menggunakan mistar dari pangkal batang
hingga pucuk
Jumlah daun, penghitungan berdasarkan jumlah daun yang telah terbuka
penuh
Jumlah cabang Jumlah akar
Bentuk, warna dan tepi daun
Pengamatan terhadap bentuk, warna dan tepi daun dilakukan berdasarkan
deskripsi yang dikeluarkan oleh IPGRI (1999).
Analisis stomata
Sampel yang digunakan adalah daun yang berasal dari planlet yang telah
tumbuh sempurna. Pengamatan stomata dilakukan pada irisan paradermal.
Metode analisis stomata menggunakan sediaan preparat segar (Mulyono
2011). Sampel daun dipotong dengan ukuran 0.2 x 0.2 cm, kemudian
bagian bawah daun ditempelkan pada selotip yang panjangnya + 2 cm.
Daun dikupas secara perlahan dengan menggunakan pisau silet dan sedikit
air, sampai terbentuk lapisan tipis dan terlihat transparan. Lapisan tipis
yang tertinggal pada selotip merupakan lapisan epidermis daun. Kemudian
selotip tersebut diletakkan di atas gelas preparat dan ditutup dengan gelas
penutup, selanjutnya diamati di bawah mikroskop. Pengamatan dilakukan
di bawah mikroskop pada perbesaran 400 kali. Luas bidang pandang
mikroskop pada perbesaran 400 kali adalah 0.19625 mm2. Pengamatan
dilakukan terhadap jumlah stomata dan ukuran stomata. Pengamatan
jumlah stomata pada setiap daun dilakukan pada 3 bidang pandang yang
berbeda. Jumlah stomata setiap perlakuan merupakan rata-rata jumlah
stomata dari 3 daun. Ukuran stomata setiap perlakuan merupakan rata-rata
20
b. Analisis Molekuler dengan Penanda ISSR
Sampel daun diambil dari planlet hasil karakterisasi morfologi. Tahapan
analisis ISSR : isolasi DNA dengan menggunakan metode Doyle dan Doyle
(1990); uji kualitas DNA berdasarkan metode Sambrook et al. (1989) serta
optimasi program PCR dan amplifikasi DNA berdasarkan penelitian Martasari et
al. (2012). Primer ISSR yang digunakan berasal dari penelitian sebelumnya oleh
Husni (2010), sebanyak delapan primer yaitu ISSR-1 sampai ISSR-8 (Tabel 1).
Tabel 1 Susunan basa delapan primer ISSR yang digunakan
No Nama Primer Susunan Basa
1 ISSR-1 5’-CAACACACACACACACA-3’
2 ISSR-2 5’-ACACACACACACACACCA-3’
3 ISSR-3 5’-ACACACACACACACACTG-3’
4 ISSR-4 5’-TAATCCTCCTCCTCCTCC-3’
5 ISSR-5 5’-TCCTCCTCCTCCTCCGC-3’
6 ISSR-6 5’-CGTTCCTCCTCCTCCTCC-3’
7 ISSR-7 5’-GTGTGTGTGTGTGTGTTC-3’
8 ISSR-8 5’-AGAGAGAGAGAGAGAGTC-3’
Isolasi DNA Total
Isolasi DNAdilakukan dengan metode CTAB (Cetyl Trimetyl Ammonium
Bromide). Daun sebanyak 0.5 g dimasukkan ke dalam mortar yang berisi nitrogen
cair, kemudian digerus sampai hancur. Buffer ekstraksi CTAB sebanyak + 700 µ l
ditambahkan ke dalam mortar dan digerus hingga merata. Sampel dipindahkan ke
dalam 1.5 ml microtube menggunakan pipet, kemudian microtube direndam
dalam waterbath bersuhu 650C selama 30 menit. Sampel selanjutnya diinkubasi di
suhu ruang selama 10 menit. Sampel kemudian ditambah CIA (Chloroform :
Isoamylalcohol 24:1) sebanyak + 700 µl dan dibolak-balik secara perlahan hingga
tercampur merata. Sampel disentrifugasi dengan kecepatan 10 000 rpm pada suhu
40C selama 10 – 15 menit. Larutan DNA yang berwarna bening di bagian atas
akan memisah dari larutan chloroform yang tercampur dengan bagian sel yang
21
microtube baru. Isopropanol dingin sebanyak 1x volume sampel ditambahkan ke
dalam microtube dan dibolak-balik secara perlahan. Sampel kemudian diinkubasi
di suhu ruang selama 10 menit, selanjutnya disentrifugasi dengan kecepatan 10
000 rpm pada suhu 40C selama 10 – 15 menit. Fase atas dibuang, dan endapan
DNA di dasar microtube dicuci dengan 70% ethanol. Endapan DNA
dikeringanginkan di suhu ruang selama 15 – 20 menit, kemudian dilarutkan
dengan 50 – 100 µ l air bebas ion untuk dijadikan stok DNA dan disimpan pada
suhu -200C.
Uji Kualitas DNA
Uji kualitas DNA dilakukan dengan menggunakan larutan agarose 0.8%
dan dielektroforesis dalam larutan buffer TAE 1X yang dialirkan arus listrik dari
muatan negatif ke muatan positif selama 50 menit pada voltase 50 volt.
Konsentrasi DNA total dapat diperkirakan berdasarkan hasil elektroforesis yaitu
dengan cara membandingkan DNA total dengan lamda DNA.
Amplifikasi DNA dengan PCR
Reaksi amplifikasi PCR dilakukan menggunakan 25 µ l yang terdiri dari 1
µ l DNA, 2 µ l primer (40 µM), 1 µ l dNTP (10 mM), 0.2 µ l DNA Taq polymerase
(5 unit/µl), 3 µl buffer PCR, 1.5 µl MgCl2 (25 mM) dan 16.3 µl air bebas ion.
Denaturasi awal dilakukan pada suhu 940C selama 3 menit. Tahapan PCR
meliputi 35 siklus, yaitu denaturasi awal pada suhu 940C selama 54 detik,
annealing pada suhu 430C selama 45 detik dan ekstensi pada suhu 720C selama 2
menit. Siklus PCR diakhiri dengan satu siklus ekstensi akhir pada suhu 720C
selama 5 menit (Martasari et al. 2012).
Visualisasi Hasil PCR
Elektroforesis dilakukan untuk mengetahui hasil amplifikasi DNA dengan
menggunakan PCR, dilakukan melalui elektroforesis horizontal dengan 1.8%
agarose yang dilarutkan dalam 100 ml buffer TAE 1X, pada tegangan 57 voltase
22
selama 15 menit dan dibilas dalam H2O selama 10 menit. Visualisasi dilakukan di
atas lampu UV dengan menggunakan alat BiodocAnalyze.
c. Analisis Data Hasil Evaluasi Keragaman Genetik
Data hasil pengamatan morfologi dan molekuler dianalisis dengan
menggunakan program NTSYSpc (Numerical Taxonomy and Multivariate
Analysis System) versi 2.02 (Rohlf 1998).
Karakter morfologi yang diamati, diasumsikan setara dengan jenis primer
pada penanda molekuler, sedangkan sub karakter setara dengan lokus pita pada
penanda molekuler. Data karakter morfologi tersebut diubah menjadi data biner
dengan skoring data. Apabila karakter morfologi tidak dimiliki oleh regeneran
maka diberikan nilai skor 0, sedangkan nilai skor 1 diberikan apabila regeneran
memiliki karakter yang diamati.
Pengamatan pada analisis molekuler (penanda ISSR) dilakukan terhadap
pola pita hasil elektroforesis. Pengamatan ditujukan pada pola pita dengan jarak
migrasi yang sama. Apabila pada jarak migrasi yang sama tidak terdapat pita,
maka diberikan nilai skor 0. Sebaliknya apabila pada jarak migrasi tersebut
terdapat pita, maka diberikan nilai skor 1.
Koefisien kemiripan berdasarkan penanda morfologi, molekuler dan data
gabungan dianalisis berdasarkan SIMQUAL (Similarity for Qualitative Data)
pada program NTSYSpc versi 2.02. Tingkat kemiripan dihitung menggunakan
koefisien Dice. Analisis pengelompokan digunakan SAHN (Sequential
Agglomerative Hierarchical and Nested) – UPGMA (Unweighted Pair-Group
Method with Arithmetic Average), disajikan dalam bentuk dendogram.
5 Penyambungan Planlet dengan Batang Bawah
Tujuan dari tahap ini adalah mengetahui kemampuan planlet untuk
tumbuh setelah dilakukan penyambungan dengan batang bawah secara in vitro
(micrografting) dan secara ex vitro (sambung pucuk).
Penyambungan secara in vitro dilakukan antara planlet dengan batang
bawah JC (Japansche Citroen) yang berasal dari perkecambahan biji secara in
23
tunas regeneran in vitro dengan batang bawah JC yang berasal dari
perkecambahan biji di polibag dan berumur + 9 bulan (Gambar 5).
Gambar 5 Batang atas dan batang bawah yang digunakan untuk penyambungan in vitro dan ex vitro. A. (1) Tunas regeneran sebagai batang atas, (2) Batang bawah JC hasil perkecambahan in vitro; B. Tunas regeneran sebagai batang atas untuk sambung pucuk ex vitro; C. Batang bawah JC hasil perkecambahan biji di polibag / ex vitro
Penyambungan dilakukan terhadap delapan planlet dari tiap dosis iradiasi.
Parameter pengamatannya adalah : 1) tinggi planlet batang atas (cm), 2) jumlah
daun baru yang terbentuk dan 3) persentase kemampuan tumbuh setelah
penyambungan.
(A) (B) (C)
25
HASIL DAN PEMBAHASAN
Pertumbuhan Kalus Embriogenik Hasil Kultur Protoplas
Kalus yang digunakan berasal dari kultur protoplas dan telah berumur 4 –
5 tahun sejak inisiasi. Viabilitas kalus dipelihara dengan melakukan subkultur
setiap empat minggu ke media MW (Morel dan Wetmore) tanpa zat pengatur
tumbuh yang merupakan media optimal untuk pembentukan kalus embriogenik
pada tanaman jeruk siam (Husni et al. 2010). Pengamatan empat minggu setelah
ditanam dalam media tersebut, menunjukkan kalus masih mempunyai
kemampuan proliferasi atau pertumbuhan dengan bertambahnya berat kalus dan
diameter kalus.
Kalus yang dihasilkan dikategorikan embriogenik, karena mengandung
proembrio yang merupakan tahap perkembangan awal dari dua sel sampai delapan
sel sebelum terbentuk globular (Feher et al. 2003). Setiap kalus (berat + 0.5 g)
memiliki 5 – 10 proembrio, sehingga dalam tiap botol yang berisi lima kalus
terdapat sekitar 25 – 50 proembrio. Warna kalus secara umum adalah putih
kekuningan dan bersifat friable atau remah (Gambar 6). Rata – rata pertambahan
berat kalus setelah empat minggu adalah 1.51 g sedangkan rata – rata
pertambahan diameter kalus adalah 0.38 cm. Artinya, bahwa kalus masih mampu
tumbuh hampir dua kali lipat dari ukuran awal saat dilakukan subkultur ke media
MW (Tabel 2).
Gambar 6 (A) Morfologi kalus pada empat minggu pengkulturan di media MW tanpa zat pengatur tumbuh, (B) Pertambahan diameter kalus, (C) Struktur kalus yang terdiri atas proembrio (tanda panah) secara mikroskopis pada perbesaran 20 kali.
26
Tabel 2 Pengamatan morfologi dan pertumbuhan kalus empat minggu setelah subkultur (MSK)
Pengamatan 0 MSK 4 MSK
Warna kalus Putih kekuningan Putih kekuningan
Struktur kalus Remah Remah
Berat kalus (g) + 0.5 2.01
Pertambahan berat kalus (g) - 1.51
Diameter kalus (cm) + 0.5 0.88
Pertambahan diameter kalus (cm) - 0.38
Sifat embriogenik kalus terkait dengan asal protoplas yang diisolasi dari
kalus embriogenik dari jaringan nuselus jeruk siam. Protoplas yang diisolasi dari
kalus embriogenik lebih mudah beregenerasi menjadi tanaman, karena memiliki
potensi morfogenik yang tinggi (Fiuk et al. 2007). Protoplas dapat diisolasi dari
berbagai jaringan atau organ tanaman, namun hasil isolasi protoplas yang terbaik
pada kebanyakan tanaman diperoleh dari kalus embriogenik, seperti pada mawar
(Kim et al. 2003), pohon kamfer atau Cinnamomum camphora L. (Du & Bao
2005), jahe (Guo et al. 2007), jeruk manis (Omar & Grosser 2008) dan pisang
(Dai et al. 2010). Menurut Grosser dan Gmitter (2011), salah satu donor tetua
pada fusi protoplas sebaiknya diisolasi dari kalus embriogenik, agar hasil fusi
protoplas memiliki kemampuan untuk beregenerasi menjadi tanaman.
Respon Kalus Setelah Iradiasi Sinar Gamma
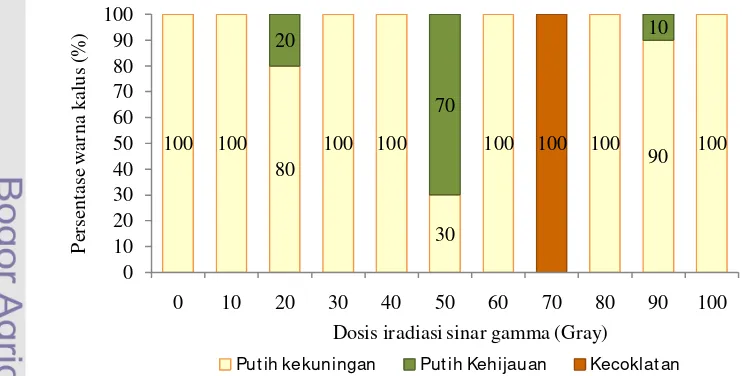
Perbedaan respon kalus pada berbagai taraf dosis dapat diamati pada
minggu keempat setelah iradiasi sinar gamma. Pengamatan terhadap morfologi
kalus menunjukkan bahwa struktur kalus pada semua dosis tidak mengalami
perubahan, yaitu remah dan terdiri atas proembrio. Pengamatan terhadap warna
kalus menunjukkan respon yang beragam. Pada kalus tanpa iradiasi (0 Gray) dan
kalus yang diiradiasi pada beberapa dosis rendah (10, 30 dan 40 Gray) serta pada
beberapa dosis tinggi (60, 80 dan 100 Gray) tidak menunjukkan perubahan warna
27
20, 50 dan 90 Gray (Gambar 7B), sedangkan pada dosis 70 Gray, warna kalus
berubah menjadi kecoklatan (Gambar 7C). Kalus yang diiradiasi pada dosis 50
Gray, menunjukkan persentase tertinggi untuk perubahan warna menjadi putih
kehijauan yaitu 70%. Kalus yang diiradiasi pada dosis 70 Gray menunjukkan
100% berubah menjadi kecoklatan (Gambar 8). Respon yang sama juga
ditunjukkan pada iradiasi sinar gamma terhadap kalus nilam, perubahan warna
kalus menjadi kecoklatan diikuti oleh penurunan pertumbuhan dan kemampuan
regenerasi kalus (Kadir et al. 2007).
Gambar 7 Warna kalus pada empat minggu setelah iradiasi sinar gamma. (A) Putih kekuningan pada dosis 10, 30, 40, 60, 80 dan 100 Gray. (B) Putih kehijauan pada dosis 20, 50 dan 90 Gray.
(C) Kecoklatan pada dosis 70 Gray.
100 100
Put ih kekuningan Put ih Kehijauan Kecoklat an
(A) (B) (C)
28
Peningkatan dosis iradiasi pada umumnya diikuti pula oleh peningkatan
kerusakan sel yang terpapar iradiasi yang ditunjukkan oleh terjadinya perubahan
secara morfologi (van Harten 1998), namun hasil pengamatan pada kalus jeruk
siam hasil kultur protoplas tidak menunjukkan respon tersebut. Perubahan warna
kalus yang terjadi menunjukkan respon yang acak dan tidak membentuk pola
respon tertentu dengan semakin meningkatnya dosis iradiasi. Respon tersebut
diduga karena sel – sel kalus yang berasal dari kultur protoplas memiliki potensi
untuk beragam secara fisiologis maupun secara genetik sehingga respon antara
satu sel dengan sel yang lainnya menjadi beragam pula. Sensitivitas sel atau
jaringan tanaman terhadap iradiasi sinar gamma dipengaruhi oleh banyak faktor,
yaitu fase perkembangan dan kondisi fisiologis sel, volume inti sel, jumlah dan
ukuran kromosom, tingkat ploidi, kadar air serta kadar oksigen sel (Boertjes &
van Harten 1988).
Respon pertambahan berat kalus umur empat minggu setelah iradiasi sinar
gamma menunjukkan kecenderungan yang semakin menurun dengan
meningkatnya dosis iradiasi (Gambar 9). Kalus tanpa iradiasi (0 Gray)
menunjukkan pertambahan berat tertinggi dibandingkan kalus yang diiradiasi.
Semakin tinggi dosis iradiasi, maka semakin sedikit pertambahan berat kalusnya.
0.00
29
Pertambahan berat kalus menunjukkan adanya proliferasi sel – sel kalus
setelah iradiasi sinar gamma. Sel-sel kalus yang diiradiasi pada dosis 10 sampai
50 Gray, masih berproliferasi meskipun tidak sebanyak kalus tanpa iradiasi sinar
gamma. Pada perlakuan dosis tinggi (60-100 Gray), iradiasi menghambat
proliferasi sel-sel kalus meskipun tidak sampai mengakibatkan kematian sel.
Perubahan morfologi dan pertumbuhan kalus setelah iradiasi diduga terkait
dengan perubahan reaksi biokimia dan proses fisiologis sel. Iradiasi sinar gamma
mengakibatkan terjadinya ionisasi melalui rusaknya ikatan atom pada struktur
molekul sehingga molekul melepaskan elektron, berubah muatannya dan menjadi
ion yang akan merusak jaringan secara fisik kemudian mengubah atau
mempengaruhi reaksi biokimia pada sel sehingga berdampak pula terhadap proses
fisiologis sel (Esnault et al. 2010). Kerusakan akibat iradiasi selain diinduksi oleh
interaksi langsung antara iradiasi dengan molekul – molekul sel, juga diinduksi
oleh interaksi tidak langsung antara iradiasi dengan air pada sel yang
mengakibatkan proses radiolisis air dan menghasilkan ROS (Reactive Oxygen
Species) sehingga akan meningkatkan radikal bebas yang bersifat tidak stabil dan
reaktif yang menyebabkan kerusakan pada sel (Kim et al. 2011).
Tingkat kerusakan atau sensitivitas tanaman akibat perlakuan iradiasi sinar
gamma dapat diketahui melalui dosis radiosensitivitas tanaman. Radiosensitivitas
bervariasi tergantung pada spesies dan kultivar tanaman, kondisi fisiologis dan
organ tanaman, serta manipulasi dari materi yang diiradiasi sebelum dan sesudah
perlakuan mutagenik (Predieri 2001). Radiosensitivitas sel atau jaringan eksplan
terhadap iradiasi sinar gamma dapat ditentukan dengan pendekatan Growth
Reduction 50 (GR50) yaitu dosis yang menyebabkan penurunan pertumbuhan 50%
pada bahan tanaman hasil iradiasi (Amano 2004).
Pertumbuhan kalus dapat diamati dari pertambahan beratnya, sehingga
penurunan berat kalus menggambarkan penghambatan pertumbuhannya (Mba et
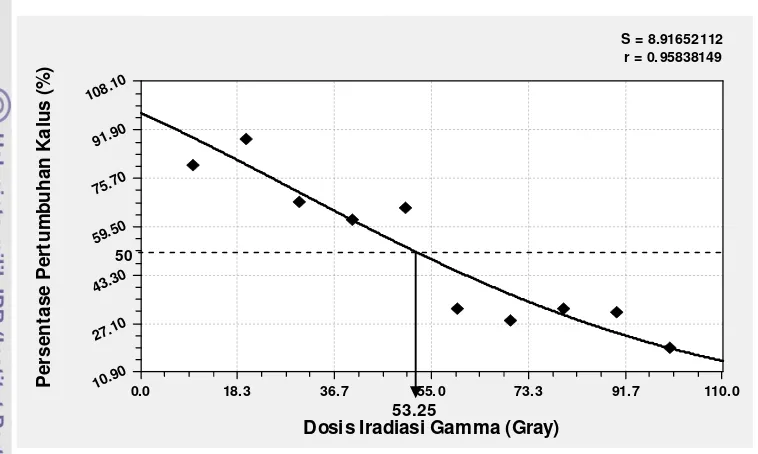
al. 2010). Analisis terhadap data pertumbuhan kalus dengan menggunakan
perangkat lunak Curve Expert 1.4 menghasilkan beberapa model regresi.
Pemilihan model regresi terbaik didasarkan pada kecilnya ragam (S) dan besarnya
koefisien determinasi (r). Gambar 10 menampilkan model regresi terbaik yaitu
30
dosis 53.25 Gray dapat digunakan sebagai dosis referensi atau dosis acuan yang
mengindikasikan kalus masih dapat recovery setelah diiradiasi dan diharapkan
dapat diperoleh banyak keragaman atau mutan.
Gambar 10 Penentuan dosis radiosensitivitas dengan kurva Gaussian Model
berdasarkan persentase pertumbuhan kalus setelah perlakuan iradiasi sinar gamma.
Menurut Boertjes dan van Harten (1988), pada kisaran dosis rendah,
kemampuan tanaman untuk bertahan hidup tinggi namun frekuensi mutasi yang
terjadi rendah, sedangkan pada kisaran dosis tinggi, frekuensi mutasi tinggi
namun kemampuan tanaman untuk bertahan hidup rendah. Mba et al. (2010) juga
menyatakan bahwa pada kisaran dosis radiosensitivitas akan dihasilkan frekuensi
mutasi yang optimal dengan kerusakan yang minimal, dan dapat diperoleh mutan
yang bermanfaat yang dapat langsung digunakan sebagai genotipe harapan yang
lebih unggul atau sebagai sumber tetua yang berpotensi menghasilkan genotipe
unggul.
Regenerasi Kalus Hasil Iradiasi Sinar Gamma
Hasil yang diharapkan dari perlakuan induksi mutasi adalah diperolehnya
mutan yang solid atau utuh dan bersifat stabil. Apabila kalus embriogenik
diiradiasi maka peluang untuk mendapatkan mutan solid sangat besar, karena S = 8.91652112
0.0 18.3 36.7 55.0 73.3 91.7 110.0