PUYUH (
Coturnix coturnix japonica
) SETELAH
PEMBERIAN CAHAYA MONOKROMATIK
KASIYATI
B151070011
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis Umur Masak Kelamin dan Kadar Estrogen Puyuh (Coturnix coturnix japonica) Setelah Pemberian Cahaya Monokromatik adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2009
Kasiyati
KASIYATI. Age of Sexual Maturity and Serum Estrogen Concentrations in the Quail (Coturnix coturnix japonica) Exposed to Monochromatic Light. Under the supervisions of NASTITI KUSUMORINI, HERA MAHESHWARI, and WASMEN MANALU.
Light plays an important role in the avian life. The present study was designed to evaluate the effects of monochromatic light on age of sexual maturity, serum estrogen, cholesterol, triglyseride concentrations, serum and bone calcium contents, the length and weight of the oviduct, and egg quality in the quail. Two hundred and seventy quails were divided into nine treatments of light, with ten replications and three quails in each replication. The treatments were without light, controls with 15 and 25 W, red, green, and blue lights with intensities of 15 and 25 lux. Control treatment used incandescent bulb. The red, green, and blue lights were provided by light emitting diodes (LED). All lights treatments were given for 14 h daily, started from 17.00 to 07.00. Parameters measured were serum estrogen, cholesterol, triglyseride, and calcium concentrations, weights and lengths of the oviduct on weeks 5, 7, and 9, bone calcium contents on weeks 5 and 7, and egg qualities on weeks 6, 7, and 9. A completely randomize design was used to analyze the data followed by orthogonal contrast test. Age of sexual maturity in female avian is indicated as the first ovulation. The result showed that monochromatic light did not affect sexual maturity (P>0.05). Quails exposed to monochromatic light had higher serum estrogen, cholesterol, and triglyseride concentrations, and bone calcium contents (P<0.05). Conversely, serum calcium concentrations were not significantly different between controls and light-treated quails. Quails exposed to monochromatic light had better shell gland development and Hen day egg production even though without significant effect on egg quality. Blue light could be used to stimulate early sexual maturity, and green light could be used to delay sexual maturity.
KASIYATI. Umur Masak Kelamin dan Kadar Estrogen Puyuh (Coturnix coturnix
japonica) Setelah Pemberian Cahaya Monokromatik. Di bawah bimbingan
NASTITI KUSUMORINI, HERA MAHESHWARI, dan WASMEN MANALU.
Penelitian ini bertujuan memanfaatkan cahaya monokromatik untuk memodulasi umur masak kelamin pada unggas yang secara langsung berhubungan dengan kualitas dan kuantitas telur.
Penelitian berlangsung mulai tanggal 25 Maret sampai 28 Mei 2009 dengan menggunakan 270 ekor DOQ (day old quail) betina. Puyuh percobaan yang berumur 2 minggu dibagi secara acak menjadi sembilan kelompok dengan sepuluh kali ulangan. Perlakuan pertama ialah tanpa pencahayaan, perlakuan kedua dan ketiga ialah pencahayaan bohlam lampu pijar warna kuning 15 dan 25 W, perlakuan keempat dan kelima ialah pencahayaan lampu LED warna merah 15 dan 25 lux, perlakuan keenam dan ketujuh ialah pencahayaan lampu LED warna hijau 15 dan 25 lux, serta perlakuan kedelapan dan kesembilan ialah pencahayaan warna biru 15 dan 25 lux. Perlakuan pencahayaan diberikan selama 14 jam per hari, yang dimulai dari pukul 17.00-07.00. Pengambilan sampel darah dimulai pada pukul 08.00 pada akhir minggu ke-5, ke-7, dan ke-9. Dari setiap kelompok percobaan diambil 3 ekor puyuh secara acak untuk pengukuran kadar estrogen, kolesterol, trigliserida, dan kalsium serum, serta profil saluran reproduksi berupa panjang, bobot, dan gambaran histologi saluran reproduksi. Kadar kalsium tulang diukur pada akhir minggu ke-5 dan ke-7. Kualitas telur diperoleh dengan mengukur kadar lemak dan protein telur yang dihasilkan pada minggu ke-6, ke-7, dan ke-9.
Secara umum, pemberian cahaya monokromatik warna biru menyebabkan masak kelamin dini. Puyuh yang menerima cahaya hijau mengalami penundaan umur masak kelamin. Masak kelamin pada unggas betina ditandai dengan ovulasi pertama kali. Pemberian cahaya monokromatik meningkatkan produksi telur, kadar estrogen, kolesterol, dan trigliserida serum, serta kadar kalsium tulang. Profil saluran reproduksi yang meliputi panjang dan bobot saluran telur, serta gambaran histologi saluran telur sangat dipengaruhi oleh pemberian cahaya monokromatik tanpa mengubah kualitas telur. Pertumbuhan dan perkembangan saluran reproduksi diinduksi oleh kehadiran estrogen. Sebaliknya, tidak adanya cahaya menghambat pertumbuhan dan perkembangan saluran telur. Hal ini disebabkan oleh kadar hormon estrogen yang rendah. Kadar kalsium darah tidak menunjukkan adanya perbedaan antara puyuh yang menerima cahaya monokromatik dengan puyuh yang tidak menerima cahaya karena kadar kalsium plasma dipertahankan dalam batas-batas yang konstan. Konsumsi pakan mempengaruhi bobot badan. Bobot badan pada puyuh yang menerima cahaya memiliki rataan yang lebih tinggi dibandingkan dengan puyuh yang tidak menerima cahaya.
@ Hak cipta milik IPB, tahun 2009
Hak cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruhnya karya tulis ini tanpa mencantumkan atau menyebutkan sumber:
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar Institut Pertanian Bogor.
(
Coturnix coturnix japonica
) SETELAH PEMBERIAN
CAHAYA MONOKROMATIK
KASIYATI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu-Ilmu Faal dan Khasiat Obat
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Monokromatik
Nama : Kasiyati
NRP : B151070011
Program Studi : Ilmu-Ilmu Faal dan Khasiat Obat
Disetujui
Dr. Nastiti Kusumorini Ketua
Dr. drh. Hera Maheshwari, M.Sc. Prof. Ir. Wasmen Manalu, Ph.D.
Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu-Ilmu Faal dan Khasiat Obat
Dr. Nastiti Kusumorini Prof. Dr.Ir. Khairil A. Notodiputro, M.S.
Segala puji dan syukur penulis panjatkan pada Allah Bapa atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan pada tanggal 25 Maret dan berakhir pada 28 Mei 2009 ini adalah efek cahaya terhadap profil reproduksi puyuh, dengan judul umur masak kelamin dan kadar estrogen puyuh (Coturnix coturnix japonica) setelah pemberian cahaya monokromatik.
Ungkapan terima kasih penulis persembahkan kepada Dr. Nastiti Kusumorini, Dr.drh. Hera Maheshwari, M.Sc, dan Prof. Wasmen Manalu, Ph.D yang telah memberikan semangat, bimbingan, saran, petunjuk, dan tuntunan yang tulus selama mengikuti pendidikan, persiapan, dan perencanaan penelitian, serta penyusunan karya ilmiah ini. Penulis juga mengucapkan terima kasih kepada Dr. Ir Sumiati, M.Sc sebagai penguji luar komisi yang telah memberikan masukan dan saran untuk perbaikan penulisan karya ilmiah ini.
Terima kasih penulis sampaikan kepada DIRJEN DIKTI atas beasiswa BPPS yang telah diberikan. Terima kasih juga penulis sampaikan kepada Drs. Koen Praseno, SU yang telah memberikan izin pemakaian laboratorium selama penelitian berlangsung.
Penulis juga mengucapkan terima kasih kepada teman-teman satu angkatan, Pak Pudji, Pak Andri, Pak Narno, Ibu Heni, dan Ibu Herna serta
teman-teman IFO 2008. Terima kasih kepada Ibu Ida, Ibu Sri, Pak Wawan, dan Pak Nyono. Terima kasih untuk teman-teman Lab. Biologi Struktur dan Fungsi Hewan, Pak Maryadi, serta Ibu Emilia Sunarti untuk motivasi dan bantuan tenaganya. Tak lupa penulis juga mengucapkan terima kasih kepada Cut, Intan, Adonia, Fika, dan Desly yang telah ikut berpartisipasi dalam penelitian ini.
Ucapan terima kasih untuk keluarga besar di Semarang, untuk suamiku terkasih Eko Budi dan putriku tersayang Tya yang selalu menyertai setiap langkah penulis dengan segenap doa, kesabaran, dan ketulusan.
Penulis dengan rendah hati mohon maaf atas segala kekurangan dalam tesis ini dan semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2009
Penulis dilahirkan di Semarang, Jawa Tengah pada tanggal 26 Mei 1977 dari ayah Trimo dan ibu Ngatipah. Penulis merupakan anak bungsu dari enam bersaudara.
Tahun 1995 penulis lulus dari SMA Sedes Sapientiae Semarang dan pada tahun yang sama penulis menempuh pendidikan sarjana di Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Diponegoro Semarang, dan lulus pada tahun 2000. Tahun 2005 secara resmi diangkat sebagai staf pengajar di almamaternya.
Halaman
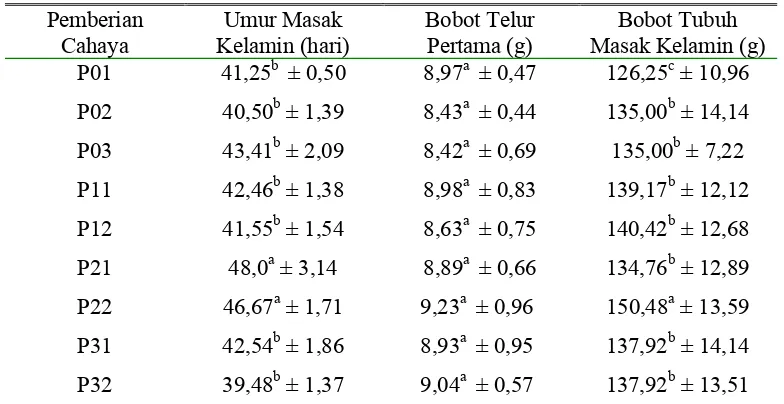
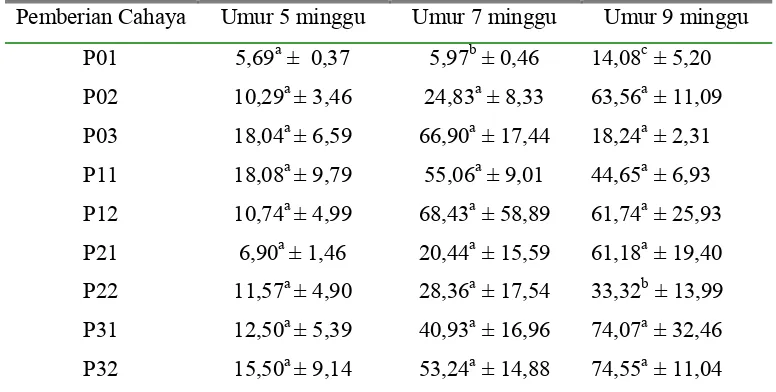
1. Rataan umur masak kelamin (hari), bobot telur pertama (g), dan bobot tubuh masak kelamin (g) pada masing-masing pemberian
cahaya monokromatik………... 51
2. Rataan kadar hormon estrogen (pg/ml) dalam serum pada puyuh umur 5, 7, dan 9 minggu setelah pemberian cahaya
monokromatik………..………. 56
3. Perkembangan panjang saluran telur (cm) pada puyuh umur 5,
7, dan 9 minggu setelah pemberian cahaya monokromatik... 61
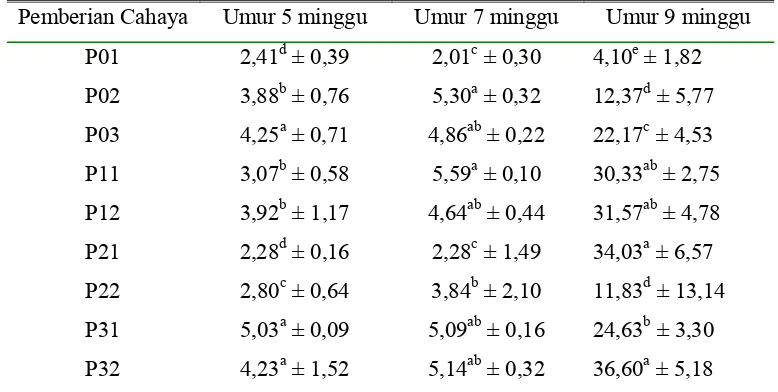
4. Rataan bobot saluran telur (g) pada puyuh umur 5, 7, dan 9
minggu setelah pemberian cahaya monokromatik….…………... 63
5. Rataan kadar kolesterol (mg/dl) dalam serum pada puyuh umur
5, 7, dan 9 minggu setelah pemberian cahaya monokromatik.…. 68
6. Rataan kadar trigliserida (mg/dl) dalam serum pada puyuh umur 5, 7, dan 9 minggu setelah pemberian cahaya
monokromatik………... 69
7. Rataan kadar kalsium (mg/dl) dalam serum pada puyuh umur 5,
7, dan 9 minggu setelah pemberian cahaya monokromatik... 71
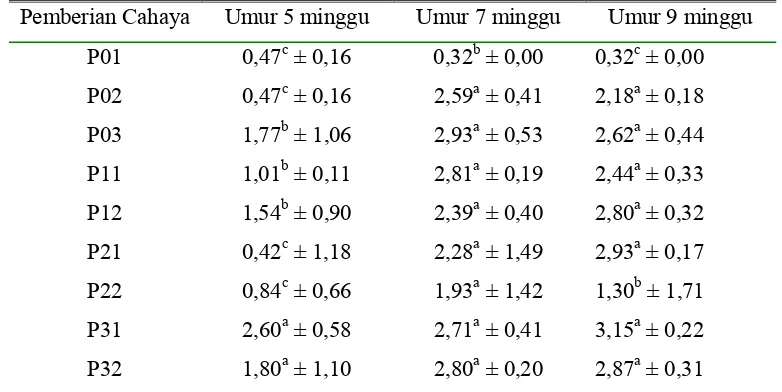
8. Rataan kadar kalsium (%) dalam tulang pada puyuh umur 5, 7,
dan 9 minggu setelah pemberian cahaya monokromatik.………. 73
9. Rataan konsumsi pakan (g) per minggu pada puyuh umur 5, 7,
dan 9 minggu setelah pemberian cahaya monokromatik…..…. 74
10. Rataan bobot badan (g) pada puyuh umur 5, 7, dan 9 minggu
setelah pemberian cahaya monokromatik………. 77
11. Rataan produksi telur Hen Day (%)dan bobot telur (g) setelah
Halaman
1. Karakteristik puyuh betina (A) dan puyuh jantan (B) ... 16
2.
3.
Saluran reproduksi unggas betina secara umum ...
Sintesis hormon seks pada ovarium ..……….
21
27
4.
5.
Anatomi telur dilihat dari potongan melintang telur...
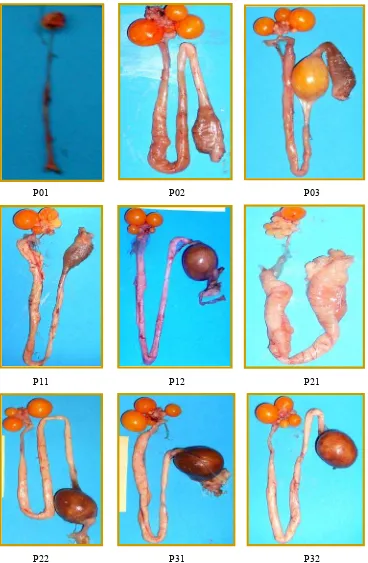
Anatomi saluran telur setelah pemberian cahaya monokromatik………...
29
62
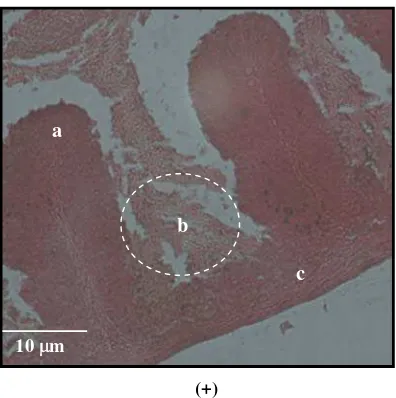
6. Fotomikrografi dinding uterus puyuh pada kelompok yang tidak
diberikan pencahayaaan……… 64
7. Fotomikrografi uterus puyuh pada kelompok kontrol yang
diberikan cahaya 15 (A) dan 25 (B) W...………. 65
8. Fotomikrografi uterus puyuh pada kelompok cahaya merah
15 (A) dan 25 (B) lux...………. 65
9. Fotomikrografi uterus puyuh pada kelompok cahaya hijau
15 (A) dan 25 (B) lux..……… 66
10.
11.
Fotomikrografi uterus puyuh pada kelompok cahaya biru 15 (A) dan 25 (B) lux…..………
Produksi telur setelah pemberian cahaya monokromatik pada minggu ke-5, 6, 7, 8, dan 9...
66
79
12. Kadar protein dan lemak di dalam telur setelah pemberian
cahaya monokromatik……….. 80
Halaman
1. Analisis ragam dan uji lanjut kontras ortogonal pada umur
masak kelamin……… 89
2.
3.
Analisis ragam pada kadar estrogen……….………...
Analisis korelasi pada kadar estrogen dan panjang saluran telur pada puyuh umur 7 minggu………...
91
PENDAHULUAN
Puyuh jepang (Coturnix coturnix japonica) dalam sistem klasifikasi hewan
termasuk ordo Galiformes, famili Phasianidae, genus Coturnix, dan spesies
japonica (Vali 2008). Puyuh memiliki nilai ekonomi penting karena selain
menghasilkan telur, dagingnya pun merupakan sumber diversifikasi protein
hewani. Budi daya puyuh sudah sejak lama dilakukan oleh masyarakat. Jenis
puyuh yang dipelihara dan dibudidayakan untuk dimanfaatkan telurnya adalah
dari jenis Coturnix coturnix japonica karena jenis ini memiliki kemampuan
bertelur yang cukup tinggi. Dibandingkan dengan jenis puyuh lainnya, dalam satu
tahun puyuh jepang mampu menghasilkan telur sekitar 250 butir telur per ekor.
Di samping banyaknya telur yang diproduksi, puyuh betina sudah mulai masak
kelamin pada umur 41 hari sehingga dalam satu tahun mampu berproduksi dan
menghasilkan generasi baru 3-4 kali (Menegristek 2008). Masak kelamin pada
puyuh ditandai dengan keluarnya telur pertama kali.
Nilai gizi telur puyuh tidak kalah dengan telur unggas lain sehingga dapat
menambah variasi dalam penyediaan sumber protein hewani. Secara umum,
kandungan telur puyuh terdiri atas putih telur (albumen) 47,4%; kuning telur
(yolk) 31,9%; dan kerabang serta membran kerabang 20,7%. Kandungan protein
telur puyuh sekitar 13,1%, sedangkan kandungan lemaknya relatif lebih rendah
dibandingkan dengan telur ayam ras dan itik. Kandungan lemak telur puyuh
sekitar 11,1%, sedangkan kandungan lemak telur ayam ras dan itik adalah 11,3%
dan 14,5%. Telur puyuh banyak dipergunakan untuk diet kolesterol karena dapat
mengurangi timbunan lemak, terutama di jantung, sedangkan kebutuhan
proteinnya tetap tercukupi. Saat ini, telur puyuh juga telah banyak dimanfaatkan
sebagai campuran minum jamu atau anggur karena dipercaya memiliki efikasi
menyembuhkan penyakit dan menjadi sumber kekuatan tubuh (Agromedia 2007;
Menegristek 2008).
Seperti halnya budi daya unggas lain secara intensif, memelihara puyuh
dalam skala budi daya memerlukan program pemeliharaan dan tata laksana yang
baik untuk memperoleh hasil optimal dan menguntungkan. Salah satu hal yang
laksana pencahayaan kandang. Sumber cahaya yang diberikan merupakan
penerangan tambahan dan diperoleh dari lampu pijar dengan kekuatan 25-40 W
pada siang hari dan 40-60 W pada malam hari. Cahaya mutlak diperlukan karena
berfungsi sebagai penghangat, penerangan, dan yang paling penting, pada saat
masa produksi, pencahayaan yang baik akan mampu meningkatkan produksi telur
hingga 75%.
Energi cahaya yang berasal dari alam maupun cahaya artifisial dalam
kehidupan hewan merupakan aspek penting yang terlibat di dalam pengaturan
bioritme dan secara langsung memberikan efek pada status kesehatan hewan,
pertumbuhan, temperatur tubuh, tingkah laku reproduksi, neuroanatomi,
neuroendokrin, perubahan fisiologi dalam saluran reproduksi, dan regulasi tingkah
laku seksual sehingga hewan siap melakukan proses perkembangbiakan. Warna,
intensitas cahaya, dan durasi pencahayaan, khususnya pada aves, sangat berperan
dalam pengaturan fungsi biologi, terutama proses metabolisme, homeostasis,
reproduksi, serta tingkah laku (Gewehr et al. 2005). Beberapa observasi telah
dilakukan pada aves dalam kaitannya dengan warna cahaya. Pemberian cahaya
biru menyebabkan aves menjadi tenang, cahaya merah dapat mengurangi
kanibalisme, memacu pertumbuhan bulu sayap, dan memacu masak kelamin, serta
pemberian cahaya hijau akan menstimulasi pertumbuhan. Cahaya merah dengan
panjang gelombang 708-740 nm yang diterima oleh itik jantan dapat
meningkatkan respons fotoseksual, yakni bertambah besar ukuran testis yang
diikuti oleh peningkatan bobot testis. Cahaya merah yang diterima oleh itik betina
akan meningkatkan ukuran dan bobot telur (Lewis dan Moris 2006).
Terdapat dua rute yang dilalui cahaya untuk bisa diterima oleh
fotoreseptor yang terdapat dalam tubuh aves. Rute pertama, sebagian besar cahaya
yang masuk mata akan diterima oleh fotoreseptor retina. Retina memiliki
kemampuan untuk mentransmisikan informasi cahaya yang diterima dalam bentuk
intensitas dan warna cahaya. Kemudian retina akan meneruskan informasi cahaya
melalui dua jalur, yaitu 1). informasi akan diteruskan ke bagian otak yang
responsif untuk penglihatan dan 2). Informasi cahaya masuk ke dalam jalur
retinohipotalamus, selanjutnya signal elektrik diubah menjadi signal kimia dan
bentuk signal kimia ini kemudian akan diteruskan dari nukleus suprakhiasmatik
hipotalamus ke kelenjar pineal dan hipofisis. Rute kedua, cahaya secara langsung
melakukan penetrasi ke dalam tulang tengkorak, menembus jaringan kranial, dan
otak kemudian akan diterima oleh fotoreseptor yang terdapat pada kelenjar pineal
dan fotoreseptor ekstraretina. Rute kedua ini banyak ditempuh oleh cahaya dengan
intensitas rendah (Gunturkun 2000; Lewis dan Moris 2006).
Informasi cahaya yang diterima oleh hipotalamus juga akan mengontrol
sekresi dan pelepasan gonadotropin (GnRH). GnRH selanjutnya ditransport ke
dalam hipofisis anterior lewat sistem sirkulasi portal hipofisis. Kehadiran GnRH
dalam hipofisis anterior akan merangsang pelepasan LH dan FSH. Kedua hormon
inilah yang secara langsung terlibat dalam masak kelamin unggas. FSH akan
merangsang perkembangan, pematangan, dan vaskularisasi folikel ovarium serta
atresi folikel-folikel kecil. Seiring dengan perkembangan folikel, estrogen mulai
diproduksi. Peningkatan konsentrasi estrogen akan merangsang perkembangan
oviduk dalam rangka mensekresikan albumin, sintesis protein, dan lemak kuning
telur (yolk) dalam hati serta peningkatan absorpsi kalsium, vitamin, dan mineral
yang dipergunakan dalam pembentukan telur. Pada tingkat tertentu, pertambahan
ukuran folikel akan menurunkan sintesis estrogen dan meningkatkan sintesis
progesteron. Progesteron yang disekresikan ke dalam darah merupakan umpan
balik positif bagi lepasnya LH dari hipofisis anterior. Terjadinya peningkatan LH
dan progesteron akan merangsang proses ovulasi. Masak kelamin pada unggas
betina ditandai dengan proses ovulasi pertama kali.
Burung puyuh (Coturnix coturnix japonica) merupakan salah satu spesies
unggas yang sangat responsif dalam menerima energi cahaya. Tingkah laku,
masak kelamin, dan bioritme puyuh dapat dimanipulasi dengan pemberian warna
cahaya yang spesifik, terutama untuk panjang gelombang cahaya merah, oranye,
kuning, hijau, dan biru. Berbagai program pencahayaan diberikan pada puyuh
untuk meningkatkan fungsi biologis dan keseimbangan metabolisme dengan
tujuan jangka panjang diharapkan produktivitasnya menjadi lebih baik. Namun,
tanpa memperhatikan aspek pencahayaan, yaitu panjang gelombang, intensitas
cahaya, dan durasi pencahayaan, peningkatan dan perbaikan respons fisiologi
Berdasarkan manfaat cahaya yang begitu kompleks dalam kehidupan aves
maka dilaksakanlah penelitian tentang pemberian cahaya monokromatik dengan
panjang gelombang yang terekspresi dalam warna cahaya merah, hijau, dan biru
dengan intensitas cahaya 15 dan 25 lux serta durasi pencahayaan selama 14 jam
pada puyuh apakah dapat memodulasi umur masak kelamin yang secara langsung
berhubungan dengan kualitas dan kuantitas telur.
Tujuan Penelitian
Penelitian ini bertujuan memanfaatkan cahaya monokromatik untuk
memodulasi umur masak kelamin yang secara langsung berhubungan dengan
kualitas dan kuantitas telur.
Manfaat Penelitian
Hasil yang diperoleh dari penelitian pemberian cahaya monokromatik
dengan warna merah, hijau, dan biru serta intensitas cahaya 15 dan 25 lux selama
14 jam/hari pada puyuh diharapkan dapat menambah informasi tentang kajian
fisiologi hormon reproduksi, umur masak kelamin, dan kualitas telur pada unggas
secara umum. Dalam jangka panjang pemakaian cahaya monokromatik dengan
memperhatikan aspek warna cahaya serta intensitas cahaya dapat
diimplementasikan untuk mendukung usaha budi daya puyuh.
Hipotesis
Hipotesis yang akan diuji adalah cahaya monokromatik dengan warna
merah, hijau, dan biru serta intensitas cahaya 15 dan 25 lux memodulasi umur
Kerangka Pemikiran
Berikut disajikan skema kerangka pemikiran respons fisiologis yang
muncul karena pemberian cahaya monokromatik :
Cahaya Monokromatik
GnRH
1. Estrogen
(+)
2. Progesteron
Keterangan:
No 1 : pertumbuhan folikel meningkatkan sekresi estrogen
No 2 : folikel besar dan matang meningkatkan sekresi progesteron, menekan estrogen Tanda (+) : umpan balik positif progesteron terhadap hipofisis untuk mensekresikan LH Tanda (---) : fototransduksi sinyal cahaya dari retina dan penetrasi langsung dalam tulang tengkorak, jaringan kranial, dan otak yang diterima oleh kelanjar pineal
Fotoreseptor Retina Penetrasi langsung dalam jaringan kulit, tulang tengkorak, dan otak
Kelenjar pineal
Hipotalamus
Serotonin Dopamin
- menenangkan
- konsumsi pakan menurun - pertumbuhan meningkat
Aktivitas harian meningkat Hipofisis
Anterior Posterior
FSH LH Oksitosin
Pertumbuhan, perkembangan &
TINJAUAN PUSTAKA
A. Cahaya Monokromatik
Cahaya merupakan suatu bagian dari fenomena alam yang kompleks yang
disebut sebagai radiasi elektromagnetik. Kompleksitas fenomena alam tersebut
meliputi warna cahaya, persepsi terhadap warna cahaya, adaptasi penglihatan, dan
sensasi penglihatan akan diterima sebagai suatu informasi yang datang dari
lingkungan serta memiliki peran penting dalam kehidupan semua organisme.
Terdapat dua teori yang menjelaskan tentang radiasi elektromagnetik alam, yaitu
teori Maxwell (1862, sebelum elektron ditemukan) dan teori Planck (1900). Teori
Maxwell menyatakan bahwa gelombang cahaya menyebar sebagai listrik dan
magnet yang memiliki kecepatan tertentu serta menghasilkan panjang gelombang
berbeda. Dalam teori Planck dipostulasikan bahwa radiasi merupakan sejumlah
energi yang tidak dapat dibagi yang disebut sebagai quanta dan memiliki panjang
gelombang pendek. Postulasi Planck juga mengungkapkan bahwa panjang
gelombang yang dimiliki oleh energi cahaya (foton) pada cahaya tampak
berhubungan dengan frekuensi radiasi elektromagnetik. Frekuensi radiasi
elektromagnetik merupakan siklus setiap detik dari energi elektron (Lewis dan
Morris 2006).
Radiasi elektromagnetik cahaya dimulai dari sinar kosmik dengan panjang
gelombang 10-18 m, sinar gamma, sinar X, dan sinar ultraviolet dengan panjang
gelombang 4,0-7,8 x 10-7 m, cahaya tampak dengan panjang gelombang 400-780
nm, sinar inframerah, dan gelombang mikro memiliki panjang gelombang di atas
780 nm serta radar televisi dan radio yang dapat ditransmisikan hingga 6.000 km.
Cahaya tampak merupakan porsi kecil dari total spektrum elektromagnetik,
dengan panjang gelombang yang berbeda akan menghasilkan persepsi warna yang
berbeda pula. Cahaya monokromatik merupakan jenis cahaya tampak dengan
frekuensi panjang gelombang tunggal dan jarak antarpanjang gelombang tidak
terlalu besar. Sesuai dengan panjang gelombangnya, spektrum elektromagnetik
cahaya monokromatik memiliki warna-warna tunggal, yaitu merah (630-760 nm),
jingga (590-630 nm), kuning (570-590 nm), hijau (500-570 nm), biru (450-500
intensitas yang sangat rendah maka cahaya merah, kuning, serta jingga dapat
menghasilkan warna cokelat, sedangkan warna biru akan sangat sulit dibedakan
dari warna unggu (Elert 2008).
Cahaya monokromatik yang berasal dari alam sering disebut sebagai
cahaya natural yang memiliki tiga aspek penting, yakni panjang gelombang,
intensitas, dan durasi pencahayaan. Perubahan panjang gelombang dari radiasi
elektromagnetik akan menghasilkan persepsi dan sensasi warna cahaya yang
berbeda. Cahaya monokromatik yang dikategorikan ke dalam cahaya tampak
(visibel) mempunyai frekuensi tunggal dengan kisaran panjang gelombang antara
400-780 nm. Masing-masing warna cahaya mampu menghasilkan efek tingkah
laku, pertumbuhan, dan reproduksi yang berbeda dalam kehidupan hewan.
Perlakuan pemberian cahaya monokromatik artifisial pada kelompok unggas
mampu memberikan respons yang berbeda, misalnya pemberian cahaya biru
menyebabkan unggas menjadi lebih tenang, pemberian cahaya merah dapat
mengurangi kanibalisme antarindividu, memacu pertumbuhan bulu sayap, dan
memacu masak kelamin, serta pemberian cahaya hijau akan menstimulasi
pertumbuhan pada periode anak (Gewehr et al. 2005). Cahaya monokromatik biru
yang diberikan kepada ayam broiler jantan dapat menstimulasi produksi
testosteron dan protein untuk menginduksi pertumbuhan sel-sel otot. Cahaya
monokromatik hijau yang juga diberikan pada ayam broiler akan dapat
menstimulasi pertumbuhan sejumlah sel-sel otot dan tulang, sedangkan cahaya
merah yang diterima oleh ayam broiler akan memacu hipotalamus untuk
mensekresikan GnRH, yang pada tahap selanjutnya kehadiran GnRH akan
merangsang sekresi hormon-hormon reproduksi, seperti FSH, LH, estrogen, dan
progesteron, yang pada akhirnya akan merangsang produksi telur dan
meningkatan fertilitas. Cahaya monokromatik merah dengan panjang gelombang
708-740 nm yang diterima oleh itik jantan dapat meningkatkan respons
fotoseksual, yakni bertambah besar ukuran testis yang diikuti oleh peningkatan
bobot testis, sedangkan cahaya merah yang diterima oleh itik betina akan
meningkatkan ukuran dan bobot telur (Lewis dan Morris 2006).
Intensitas cahaya (iluminasi) merupakan fotometrik kuantitas cahaya yang
hewan merupakan hasil konversi dari pengukuran fotometrik intensitas cahaya
yang diterima oleh manusia. Standar unit pengukurannya adalah lux, yang
diperoleh dari kalibrasi cahaya tampak yang ekivalen dengan 1 lm/m2 (lumen per
meter persegi) atau 0,08 cd/m2 (candela per meter persegi). Durasi pencahayaan
untuk cahaya natural menunjukkan periode (jangka waktu) pencahayaan yang
berkaitan dengan panjang hari (daylength/photoperiod). Panjang hari
dideskripsikan sebagai periode rotasi bumi selama 24 jam, yang terdiri atas
fotoperiode tunggal sebagai siang dan periode tunggal dalam gelap sebagai
malam (scotoperiod). Efek utama yang muncul dari durasi pencahayaan adalah
secara langsung terlibat dalam masak kelamin. Masak kelamin pada unggas betina
berkaitan erat dengan pengeluaran telur, sedangkan pada unggas jantan maturasi
seksual merupakan tahap dimana testis telah tumbuh dan berkembang serta
mampu menghasilkan spermatozoa yang matang (Rodenboorg et al. 2001).
B. Fisiologi Cahaya
Secara umum energi cahaya dalam kehidupan hewan merupakan aspek
penting yang terlibat di dalam pengaturan bioritme. Respons cahaya yang diterima
oleh tubuh hewan secara langsung akan memberikan efek fisiologis terhadap
status kesehatan hewan, pertumbuhan, neuroanatomi yang terkait dengan
neurotransmiter, neuroendokrin, perubahan fisiologi dalam saluran reproduksi,
dan regulasi tingkah laku seksual sehingga hewan siap melakukan proses
perkembangbiakan. Warna cahaya, intensitas cahaya, dan durasi pencahayaan,
khususnya pada unggas, sangat berperan dalam pengaturan fungsi biologi,
terutama proses metabolisme, homeostasis, dan reproduksi.
Bentuk mata aves merupakan hasil dari kebutuhan ekologi dan fisiologi.
Secara umum bentuk mata aves terdiri atas dua jenis, yaitu bentuk mata pipih
(flat) dan bentuk mata tabung (tube). Bentuk mata pipih memberikan kemampuan
fungsional dalam penglihatan menjadi lebih besar dan meminimalkan bobot serta
volume. Lokasi mata ada di sisi kepala, sebelah dekster dan sinester, yang
menyediakan akses penglihatan sentral binokuler yang lebih kecil, tetapi
memberikan efek monokuler bidang pandang yang lebih besar. Jenis mata pipih
oleh aves pemangsa seperti burung hantu dan beberapa jenis penguin. Mata
terletak di bagian depan kepala seperti mata manusia. Bayangan atau gambar yang
dibentuk oleh retina mata lebih besar dan lebih tajam meskipun reseptor pada
retina memiliki rasio konvergensi yang sangat rendah. Optimalisasi reseptor pada
retina akan ditingkatkan dengan intensitas cahaya yang tinggi dan mengubah
resolusinya pada saat menjelang petang (Gunturkun 2000).
Mata aves berukuran relatif besar dengan volume yang hampir memenuhi
bagian kepala dan bobotnya lebih berat jika dibandingkan dengan otak. Struktur
mata aves serupa dengan mata vertebrata yang lain. Cahaya yang datang, masuk,
dan diterima oleh retina mata terlebih dahulu harus melalui empat media optik.
Keempat media optik tersebut adalah kornea, ruang anterior, lensa, dan badan
vitreous dengan struktur transparan serta mampu mentransmisikan panjang
gelombang sampai dengan 310 nm (kisaran cahaya ultraviolet). Di dalam retina
mata, cahaya akan diterima oleh fotoreseptor yang kemudian akan mengkonversi
energi cahaya menjadi impuls listrik melalui proses pemutihan (bleaching) oleh
pigmen visual. Retina mata aves merupakan bagian yang cukup sempurna tetapi
tidak mempunyai vaskularisasi karena berfungsi mencegah pengaburan bayangan
dan pembiasan cahaya. Mata aves dilengkapi dengan pekten, yaitu suatu struktur
yang memiliki fungsi nutritif, berpigmen hitam, kaya akan pembuluh darah, dan
membentuk lipatan-lipatan dari bagian ventral retina sampai ke arah luar nervus
optikus pada bagian lensa mata (Gunturkun 2000).
Retina mata aves terdiri atas dua tipe fotoreseptor yang masing-masing
memiliki sensitivitas terhadap intensitas cahaya tertentu, yaitu sel batang (rod)
dengan pigmen visual rodopsin yang serupa dengan rodopsin mamalia, jumlahnya
lebih berlimpah dan memiliki sensitivitas tinggi dengan panjang gelombang
maksimum yang dapat diterima adalah 507 nm (cahaya biru-hijau). Sel batang
tidak dipakai untuk membedakan warna, namun lebih banyak dipakai pada
kondisi gelap (scotopic) dengan intensitas cahaya yang dapat diterima sebesar 4
cd/m2. Tipe fotoreseptor yang kedua adalah sel kerucut (cone), jumlahnya lebih
sedikit dan sangat berfungsi untuk penglihatan normal pada siang hari (photopic)
cahaya yang dapat diterima oleh sel kerucut adalah 4 cd/m2-44 cd/m2 serta lebih
banyak dipakai untuk membedakan warna (Lewis dan Morris 2006).
Aves memiliki 4 jenis sel kerucut yang masing-masing diselimuti oleh
butiran minyak (oil droplet). Butiran minyak berperan sebagai filter dan penyerap
cahaya dengan panjang gelombang tertentu sehingga cahaya dapat ditransmisikan
serta melindungi mata dari efek sinar UV. Sensitivitas dari tiga jenis sel kerucut
terutama untuk warna-warna dasar sehingga dikenal sebagai sel kerucut biru
(450 nm), sel kerucut hijau (550 nm), dan sel kerucut merah (700 nm). Jika ketiga
warna dasar tersebut datang dan diterima oleh mata secara bersamaan maka otak
akan memberikan persepsi sebagai warna putih. Jenis sel kerucut keempat
merupakan sel kerucut yang membedakan dari mata manusia dan hanya dimiliki
oleh aves, yaitu sel kerucut untuk mendeteksi sinar UV-A (320-400 nm).
Meskipun mata aves memiliki 4 jenis sel kerucut, puncak spektrum
elektromagnetik serupa dengan mata manusia, yaitu 545-575 nm. Pemberian
cahaya monokromatik artifisial pada ayam menunjukkan adanya sedikit
perbedaan terhadap sensitivitas spektrum elektromagnetik pada panjang
gelombang 400-480 nm dan 580-700 nm, yaitu mata ayam sangat responsif
menerima cahaya pada kisaran panjang gelombang tersebut sehingga ayam
mampu menerima cahaya artifisial yang lebih terang daripada manusia (Hart et
al. 1999).
Respons fisiologis dan pengaturan bioritme pada aves akan muncul jika
cahaya yang merupakan radiasi elektromagnetik diubah menjadi informasi dalam
bentuk signal elektrik dalam retina. Terdapat dua rute yang dilalui cahaya untuk
bisa diterima oleh fotoreseptor ekstraretina hipotalamus. Rute pertama, sebagian
besar cahaya yang masuk mata akan diterima oleh fotoreseptor retina. Retina
memiliki kemampuan untuk mentransmisikan informasi cahaya yang diterima
dalam bentuk intensitas dan warna cahaya. Kemudian, retina akan meneruskan
informasi cahaya melalui dua jalur, yaitu 1) informasi cahaya akan diteruskan ke
bagian otak yang bertanggung jawab atas penglihatan dan 2) Informasi cahaya
masuk ke dalam jalur retinohipotalamus, selanjutnya signal elektrik ini diubah
menjadi signal kimia dan diteruskan ke nukleus suprakhiasmatik dalam
hipotalamus akan diteruskan ke hipofisis. Rute kedua, cahaya secara langsung
melakukan penetrasi ke dalam tulang tengkorak, menembus jaringan kranial dan
otak, kemudian akan diterima oleh fotoreseptor kelenjar pineal yang kemudian
juga akan diteruskan ke hipotalamus. Rute kedua ini banyak ditempuh untuk
cahaya dengan intensitas rendah (Lewis dan Morris 2006).
Masuknya informasi cahaya ke dalam kelenjar pineal akan menstimulasi
sintesis, pelepasan, dan metabolisme dopamin. Kehadiran dopamin dalam kelenjar
pineal dapat menekan produksi serotonin-N-asetiltransferase, yaitu suatu jenis
enzim yang mengkatalisis konversi serotonin menjadi melatonin selama periode
”gelap” malam hari. Serotonin-N-asetiltransferase terdistribusi pada beberapa
tempat di dalam tubuh, yaitu otak, hipofisis, retina, traktus gastrointestinalis, dan
testis. Sekresi serotonin, serotonin-N-asetiltransferase, dan melatonin
berhubungan dengan panjangnya malam. Malam yang lebih panjang menstimulasi
durasi sekresi serotonin, serotonin-N-asetiltransferase, dan melatonin menjadi
lebih lama (Maywood 2005). Pada manusia dan rodensia, serotonin dan melatonin
sangat efektif disekresikan dengan intensitas cahaya kurang dari 30 lux dan
panjang gelombang 460-480 nm, sedangkan pada aves dengan intensitas cahaya di
bawah 4 lux akan memacu pelepasan dopamin, meskipun hanya beberapa menit
dan pada tahap selanjutnya akan terjadi stimulasi sekresi serotonin dan melatonin.
Melatonin adalah neurotransmitter yang berperan dalam regulasi bioritme
kehidupan aves. Sintesis melatonin pada kelenjar pineal juga dapat ditekan ketika
retina menerima radiasi elektromagnetik UV-A. Dopamin dan serotonin juga
merupakan neurotransmitter yang memiliki efek saling berlawanan. Dopamin
menyebabkan aves menjadi lebih aktif dan mudah terstimulasi, sebaliknya
serotonin memacu aves untuk bertingkah laku lebih tenang, terlibat dalam kontrol
tidur, dan dapat menekan stres. Siklus harian gelap menjadi terang merupakan
faktor lingkungan yang menstimulasi sekresi neurotransmitter dopamin, serotonin,
dan melatonin. Pelepasan neurotransmitter menstimulasi terjadinya serangkaian
reaksi kimiawi di dalam tubuh yang akhirnya akan terekspresi pada tingkah laku,
aktivitas harian, interaksi sosial, ritme makan, dan ritme istirahat (tidur) (Lewis et
Kehadiran serotonin dalam sistem sirkulasi traktus gastrointestinalis akan
meningkatkan permeabilitas dan aliran darah kapiler gastrointestinalis.
Peningkatan permeabilitas kapiler memudahkan protein dan makromolekul
terdistribusi secara merata dalam cairan interstisial dan plasma sel. Jika protein
maupun makromolekul yang merupakan substrat metabolisme telah terdistribusi
dengan baik maka berbagai proses fisiologis di dalam tubuh akan berjalan lancar
dan proses homeostasis tercapai sehingga pertumbuhan akan meningkat
(Ormsbee dan Fondacaro 2004). Serotonin juga memberikan efek menenangkan
bagi hewan, termasuk aves. Dalam kondisi tenang, aktivitas yang melibatkan kerja
otot skeletal akan berkurang, termasuk dalam hal pengambilan pakan sehingga
energi yang telah terbentuk tidak digunakan untuk aktivitas fisik, namun akan
lebih diarahkan untuk proses pemeliharaan dan pertumbuhan. Peningkatan
serotonin dan melatonin dalam plasma juga menstimulasi pelepasan hormon
kalsitonin dan hormon paratiroid (PTH). Kedua hormon ini terlibat dalam
mobilisasi kalsium untuk pembentukan kerabang telur. Sekresi kalsitonin dan
PTH mencapai puncaknya pada malam hari sehingga kualitas kerabang telur
menjadi lebih baik pada kondisi scotoperiod (kondisi gelap) (Ieda et al. 2000) .
Informasi cahaya yang diterima oleh nukleus suprakhiasmatik
hipotalamus baik melalui rute retinohipotalamus maupun penetrasi langsung pada
tulang kranial dan jaringan otak akan mengontrol sekresi dan pelepasan
gonadotropin (GnRH). Sekresi GnRH akan diterima oleh hipofisis anterior lewat
sistem sirkulasi portal hipofisis. Kehadiran GnRH dalam hipofisis anterior
menstimulasi pelepasan LH dan FSH. Kedua hormon inilah yang secara langsung
terlibat di dalam maturasi seksual aves (Lewis dan Morris 2006). FSH akan
menstimulasi perkembangan, pematangan, dan vaskularisasi folikel ovarium serta
atresi folikel-folikel kecil. Seiring dengan perkembangan folikel, estrogen mulai
disekresikan. Peningkatan konsentrasi estrogen akan menstimulasi perkembangan
oviduk, peningkatan absorpsi kalsium, protein, lemak, vitamin, dan mineral yang
dipergunakan dalam pembentukan telur. Bertambah besarnya ukuran folikel akan
menurunkan produksi estrogen dan meningkatkan produksi progesteron.
Progesteron yang disekresikan ke dalam darah merupakan umpan balik positif
progesteron akan menstimulasi proses ovulasi. Peningkatan LH juga memacu
sintesis androgen yang berfungsi memacu sekresi albumin dalam oviduk dan
mempengaruhi perkembangan tanda-tanda seks sekunder unggas betina (Squires
2003).
Pelepasan GnRH dari hipotalamus juga diinduksi oleh gen fos. Ekspresi
gen fos pada mediobasal hipotalamus akan mengalami peningkatan ketika terjadi
transfer dari hari pendek ke hari panjang. Peningkatan ekspresi gen fos dimulai
pada hari ke dua dan paling lama pada hari ke tiga saat pertama kali dimulainya
hari panjang (18 jam siang). Aktivitas gen fos pada mediobasal hipotalamus
merupakan tanda hipotalamus aves menerima transmisi informasi cahaya
sehingga terjadi sekresi GnRH yang dilanjutkan dengan peningkatan pelepasan
LH (Meddle dan Follett 1997). Sekresi LH dan FSH yang berperan dalam
maturasi seksual juga dikontrol oleh GnIH (gonadotrophin inhibitory hormone).
Sekresi GnIH distimulasi oleh pembesaran folikel. Pertumbuhan dan
perkembangan folikel aves menghasilkan 4-5 folikel besar, folikel yang besar dan
telah mengalami ovulasi akan menstimulasi hipotalamus mensekresikan GnIH.
Kehadiran GnIH pada hipofisis menjadi signal bagi hipofisis untuk mengurangi
dan menghentikan sekresi FSH dan LH (Ciccone et al. 2004).
C. Puyuh (Coturnix coturnix japonica)
Puyuh merupakan jenis aves yang tidak dapat terbang, ukuran tubuhnya
relatif kecil, berkaki pendek, dan tersebar di seluruh dunia, sedangkan cara
hidupnya yang liar menimbulkan kesan bahwa puyuh sulit dipelihara. Di Amerika
Serikat, puyuh yang diternakkan pertama kali pada tahun 1870 berasal dari puyuh
jepang (Coturnix coturnix japonica). Di negara Jepang sendiri, puyuh pertama
kali dipelihara sebagai burung ocehan (song bird) dan burung aduan. Seiring
dengan tingkat kebutuhan manusia akan protein hewani, puyuh kemudian mulai
didomestikasi. Domestikasi puyuh dilakukan pertama kali oleh National Institute
of Genetic, Mishima, sedangkan di Indonesia puyuh jepang baru mulai dikenal
dan dipelihara pada akhir tahun 1979. Sebenarnya, Indonesia sendiri memiliki
berbagai jenis puyuh, tetapi tidak semua dapat dimanfaatkan sebagai penghasil
gemak, termasuk dalam genus turnix yang jauh berbeda dari coturnix; perbedaan
jelas adalah pada jari kakinya. Coturnix memiliki 4 jari, tiga menghadap ke depan
dan satu ke belakang, sedangkan turnix hanya memiliki 3 jari yang menghadap ke
depan. Masyarakat yang menghendaki produksi telur lebih banyak memilih
puyuh jepang untuk dipelihara dan diambil telurnya. Puyuh juga menjadi semakin
populer dan digemari oleh banyak kalangan karena telur dan dagingnya sebagai
bahan makanan yang kandungan gizinya tinggi dan rasanya lezat, beberapa tahun
terakhir puyuh banyak dimanfaatkan sebagai hewan percobaan untuk berbagai
penelitian dalam bidang ilmu pengetahuan (Kim 2000; Menegristek 2008).
Puyuh jepang memiliki kebiasaan hidup berpindah-pindah dari satu tempat
ke tempat lain dan habitat alaminya di hutan belantara. Sifat reproduksinya cepat,
dalam satu tahun mampu menghasilkan 3-4 generasi, sangat menarik untuk
dipelihara dan diternakkan. Karakteristik dari puyuh jepang adalah sebagai
berikut:
• Bentuk badan lebih besar dari jenis puyuh yang lainnya, panjang badan sekitar 19 cm, badan membulat, ekor pendek, paruh pendek, jari kaki
empat buah, tiga jari kakinya ke depan, dan satu jari kaki ke arah
belakang serta warna kaki kekuning-kuningan.
• Pertumbuhan bulu menjadi lengkap setelah berumur dua sampai tiga minggu. Kedua jenis kelamin dapat dibedakan berdasarkan warna bulu,
suara, dan bobot badannya.
• Ciri puyuh jantan dewasa dapat dilihat dari warna (Gambar 1B). Pada bagian bulu kepala sampai ke bagian belakang terdapat warna putih yang
berbentuk garis melengkung tebal, bulu leher, dan dadanya yang
berwarna cokelat muda (cinamon) tanpa ada bercak kehitaman, bulu
punggung berwarna campuran cokelat gelap, abu-abu dengan garis putih,
bulu sayap seperti bulu punggung dengan belang kehitaman, panjang
sayap kira-kira 89 cm. Puyuh jantan muda mulai bersuara atau berkicau
pada umur 5-6 minggu. Selama puncak musim kawin, puyuh jantan akan
berkicau setiap malam dengan suara keras.
puyuh betina berwarna cokelat muda lebih terang (sawo matang) dengan
bercak cokelat tua atau kehitam-hitaman (Gambar 1A).
• Puyuh mencapai masak kelamin (dewasa kelamin) pada umur 41-42 hari
atau enam minggu. Bobot tubuh puyuh betina dewasa mencapai 143
g/ekor, sedangkan bobot badan puyuh jantan dewasa kira-kira 117 g/ekor.
• Puyuh betina mampu menghasilkan telur sebanyak 200-300 butir per
ekor selama satu tahun, dengan bobot 10 g per butir (kira-kira 8% dari
bobot badannya). Kerabang telur berwarna cokelat tua, biru, putih dengan
bintik-bintik hitam, biru atau cokelat yang tersebar di seluruh permukaan
kerabang. Pigmen kerabang telur berupa ooporpirin dan biliverdin.
• Lamanya periode pengeraman telur antara 16-18 hari (Randall dan Bolla 2008; Barnette 2009).
Sudah sejak 20 tahun yang lalu puyuh jepang dijadikan sebagai hewan
model alternatif pengganti rodensia di laboratorium, dengan pertimbangan siklus
hidupnya relatif singkat. Penelitian yang banyak memanfaatkan puyuh sebagai
hewan model adalah penelitian yang berkaitan dengan analisis endokrin,
neurotransmiter, mekanisme saraf yang mengontrol diferensiasi seksual selama
ontogeni hingga dewasa, dan kontrol tingkah laku reproduksi. Aksi hormon dan
neurotransmitter puyuh memiliki kemiripan dengan rodensia, terutama dalam
mengontrol tingkah laku seksual hewan jantan. Kesamaan inilah yang memacu
banyak peneliti memanfaatkan puyuh sebagai hewan model untuk tingkah laku
seksual manusia (Balthazart et al. 1998). Seekor puyuh betina terutama puyuh
jepang sudah mencapai dewasa kelamin pada umur 42 hari dengan menghasilkan
telur. Sifatnya yang mampu menghasilkan keturunan 3-4 generasi per tahun, laju
metabolisme yang cukup tinggi dengan pertumbuhan dan perkembangan yang
relatif cepat merupakan keunggulan yang cukup menguntungkan untuk
menjadikan puyuh sebagai hewan model. Alasan lain pemakaian puyuh sebagai
hewan model adalah kebutuhan luas kandang untuk seekor puyuh hanya sekitar
200 cm2 sehingga akan menghemat ruang percobaan. Kebutuhan konsumsi pakan
per ekor per harinya juga sangat kecil dibandingkan dengan jenis aves lainnya.
menguntungkan karena luka puyuh akibat pembedahan lebih cepat sembuh
(Listiyowati dan Roospitasari 2007).
Puyuh merupakan salah satu spesies unggas yang sangat responsif dalam
menerima energi cahaya. Tingkah laku, masak kelamin, dan bioritme burung
puyuh dapat dimanipulasi dengan pemberian warna cahaya yang spesifik terutama
untuk panjang gelombang cahaya merah, jingga, kuning, hijau, dan biru.
Pemberian cahaya selama 14-16 jam setiap hari pada burung puyuh sangat
dibutuhkan untuk memelihara fertilitas dan produksi telur, sedangkan untuk
produksi daging diperlukan pencahayaan selama 8 jam setiap hari (Randall dan
Bolla 2008).
A. Puyuh betina B. Puyuh jantan
Gambar 1. Karakteristik puyuh betina (A) dan puyuh jantan (B) (www.quailsforafrica.com/coturnix.html)
D. Sistem Reproduksi Aves
Sistem reproduksi hewan betina secara umum terdiri atas dua ovari yang
terletak di sebelah kiri dan di sebelah kanan, tetapi sistem reproduksi pada
sebagian besar aves hanya mempunyai satu ovari dan oviduk fungsional, yaitu
ovari sebelah kiri. Sebenarnya, semua jenis aves ketika memasuki fase embrional
mempunyai ovari dan oviduk sebelah kanan, namun distribusi sel-sel benih (germ
cells) primordial dalam ovarium menjadi asimetris pada hari keempat masa
diinisiasi oleh substansi penghambat Mullerian. Aves yang sampai saat ini masih
memiliki ovari dan oviduk sebelah kanan serta berkembang secara fungsional
adalah falconiformes dan kiwi, sedangkan burung gereja dan merpati sekitar 5%
populasinya memiliki ovari dan oviduk sebelah kanan yang juga berkembang
secara fungsional meskipun dengan ukuran yang asimetris (Johnson 2000).
1. Ovari
Ovari kiri terletak di dalam rongga abdomen sebelah kiri berdekatan
dengan ginjal kiri, yang melekat pada dinding tubuh di bagian ligamen
mesovarium. Ovari terbagi dalam dua bagian, yaitu cortex merupakan bagian
sebelah luar dan medulla merupakan bagian sebelah dalam. Cortex mengandung
folikel dan di dalam folikel terdapat sel-sel telur (ovum). Medulla berisi jaringan
konektif, serabut saraf, dan pembuluh darah. Secara luas, ovari menerima inervasi
saraf simpatik yang membentuk pleksus adrenal-ovari. Ovari memperoleh suplai
darah dari aorta dorsalis yang kemudian membentuk arteri gonadoadrenal. Bahan
kimiawi diangkut oleh sistem vaskularisasi ke dalam ovari melalui beberapa
lapisan, di antaranya theca layer merupakan lapisan terluar yang bersifat
permeabel sehingga memungkinkan cairan plasma bagian dalam menembus
jaringan di sekelilingnya. Lapis kedua berupa lamina basalis yang berfungsi
sebagai filter untuk menyaring komponen cairan plasma yang lebih besar. Lapis
ketiga sebelum sampai pada oosit adalah lapisan perivitellin yang berupa material
protein yang bersifat fibrous. Calon folikel (oosit) dalam membran plasma
berikatan dengan sejumlah reseptor yang akan membentuk endocitic sehingga
terbentuk material penyusun kuning telur (yolk). Sebagian besar material
penyusun kuning telur adalah materi granuler berupa HDL (high density
lipoprotein) dan lipovitelin. Kedua senyawa tersebut akan berikatan dengan ion
dan pada pH tinggi membentuk kompleks fosfoprotein, fosfitin, ion kalsium, dan
ion besi. Kompleks fosfoprotein, fosfitin, ion kalsium, dan ion besi kemudian
membentuk senyawa vitelogenin, yaitu prekursor protein yang disintesis di dalam
hati sebagai respons terhadap estrogen. Komponen vitelogenin lebih mudah larut
dalam darah membentuk kompleks lipid kalsium dan besi. Proses pembentukan
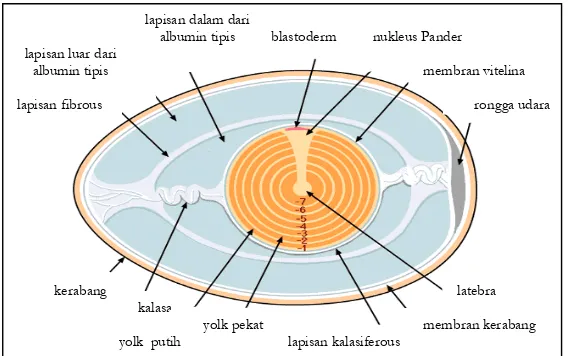
Penyusun utama kuning telur adalah air, lipoprotein, protein, mineral, dan
pigmen. Protein kuning telur dapat diklasifikasikan menjadi dua kelompok, yakni:
1. Livetin, merupakan protein plasma yang terakumulasi pada kuning telur
dan disintesis dalam hati, dan komponennya hampir 60% dari total yolk.
2. Fosfitin dan lipoprotein terdiri atas HDL dan LDL (low density
lipoprotein) atau disebut pula dengan granuler. HDL dan LDL disintesis
dalam hati. Proses sintesisnya dikontrol oleh estrogen. Hasil sintesis
bersama-sama dengan ion kalsium, besi, dan seng membentuk molekul
kompleks yang mudah larut kemudian masuk ke dalam yolk (Klasing
2006; Yuwanta 2004).
Ovum berkembang sejak aves dalam fase embrional. Pada hari kesembilan
masa inkubasi, jumlah oosit mencapai 28.000, pada hari ketujuh belas, jumlah
oosit meningkat kira–kira 680.000, dan ketika menetas, jumlah menurun menjadi
480.000. Ovari anak aves yang belum mencapai dewasa kelamin terdiri atas
sejumlah kecil masa oosit yang berisi sekitar 2.000 oosit yang dapat dilihat
dengan mata telanjang dan hanya 250-500 oosit yang mampu berkembang secara
sempurna menjadi telur yang mengandung kuning telur setelah aves tersebut
dewasa serta mengalami ovulasi sepanjang siklus hidup aves yang didomestikasi,
sedangkan aves yang hidup bebas di alam jumlah sel telur matang serta dapat
diovulasikan lebih sedikit jumlahnya (Hafez 2000).
2. Oviduk
Oviduk sebagian besar aves merupakan saluran paramesonepros kiri yang
berkembang sempurna. Oviduk memiliki sistem vaskularisasi yang baik dan
dinding ototnya hampir selalu bergerak selama proses pembentukan telur. Pada
aves yang belum dewasa, oviduk berukuran kecil, ukurannya akan meningkat
ketika aves mulai produktif dan besarnya selalu mengalami perubahan sejalan
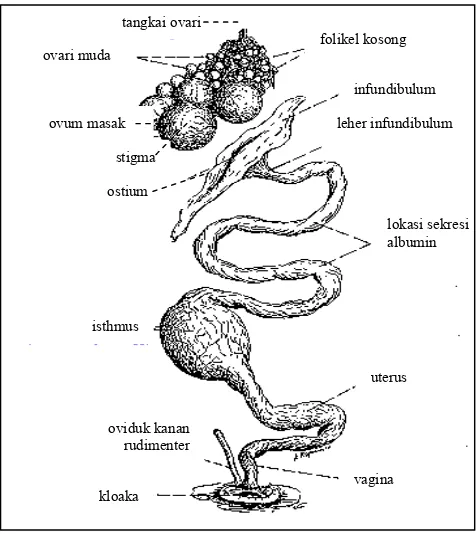
dengan aktivitasnya. Oviduk terdiri atas lima komponen yang fungsional, yaitu
a. Infundibulum (funnel/papilon). Dinding infundibulum sangat tipis dan
sempit, mempunyai kelenjar untuk sekresi protein yang mengelilingi
membran vitellina sehingga sering dikenal sebagai chalaziferous region
yang memberi kontribusi pada pembentukan kalasa. Chalaziferous region
dalam infundibulum berkisar antara 15-30 menit baik untuk ayam, kalkun
maupun puyuh. Perbatasan antara infundibulum dengan magnum disebut
sarang spermatozoa.
b. Magnum, berfungsi sebagai tempat sintesis dan sekresi albumen. Magnum
tersusun atas kelenjar tubuler yang sangat sensibel. Sebagian besar protein
yang menyusun albumin dihasilkan oleh mukosa magnum. Kelenjar
tubuler magnum terdiri atas sel-sel goblet yang akan mensekresikan
ovalbumin, lisosim, ovotransferin, dan ovomusin serta akan disimpan
dalam bentuk granula. Granula akan dilepaskan ketika yolk melewati
magnum. Yolk berada di dalam magnum untuk dibungkus dengan
albumen (putih telur) selama 2-3 jam pada ayam dan kalkun, sedangkan
pada puyuh, yolk akan berada dalam magnum sekitar 2-2,5 jam.
c. Isthmus, merupakan bagian oviduk yang pendek. Isthmus berfungsi
sebagai tempat untuk membentuk membran kerabang atau selaput telur.
Telur berada di bagian isthmus antara 1-1,5 jam baik pada ayam, kalkun
maupun puyuh. Isthmus memiliki karakteristik dindingnya sempit dan
tipis, bagian depan yang berdekatan dengan magnum berwarna putih,
sedangkan 4 cm terakhir dari isthmus mengandung banyak pembuluh
darah sehingga memberikan warna merah.
d. Uterus (glandula pembentuk kerabang) penuh dengan vaskularisasi. Putih
telur yang melewati uterus akan mengalami dehidrasi (plumping)
kemudian diteruskan dengan pembentukan kerabang keras. Lama
mineralisasi kerabang telur antara 18-21 jam pada ayam, 22-24 jam pada
kalkun, sedangkan pada puyuh antara 19-20 jam. Kerabang hampir
seluruhnya tersusun oleh deposit kalsium karbonat dalam matriks protein
dan mukopolisakarida. Sumber utama kalsium karbonat pembentuk
kerabang adalah ion karbonat dalam darah. Karbonat dibentuk dari
pencampuran antara karbondioksida dan air dengan bantuan enzim
karbonik anhidrase. Transport karbonat secara konstan dan berkelanjutan
ke dalam kelenjar kerabang menyebabkan terbentuknya kristal kalsit.
Oviduk tidak akan mampu menyimpan banyak ion kalsium. Kalsium
Dari darah kalsium akan ditransport ke dalam permukaan sel-sel epitelium
lumen kelenjar kerabang. Pada ayam yang berproduksi tinggi, kalsium
yang dapat didepositkan pada kerabang sebutir telur mencapai 2-2,5 g/hari.
Deposisi kalsium dikontrol oleh cahaya. Ketika kondisi gelap pada saat
asupan pakan dan minum normal akan terjadi deposisi kalsium untuk
pembentukan kerabang telur. Untuk kebutuhan pembentukan kerabang
telur, biasanya unggas akan menyimpan kalsium pakan secara periodik
dalam tulang medula. Penyimpanan kalsium pakan akan diinisiasi oleh
peningkatan sekresi estrogen ketika unggas menjelang masak kelamin.
Calbindin-D28k merupakan protein intraseluler yang memiliki
kemampuan mengikat kalsium dengan afinitas tinggi serta memegang
peran penting dalam transport kalsium dalam usus dan kelenjar kerabang.
Produksi protein calbindin-D28k diregulasi oleh vitamin D3. Sintesis
protein calbindin-D28k dalam kelenjar kerabang distimulasi oleh
kehadiran yolk dan adanya aliran kalsium dari darah. Proses akhir dari
pembentukan kerabang telur adalah pigmentasi dan pembentukan kutikula.
Kutikula akan dibentuk di dalam vagina. Warna kerabang telur berasal dari
sel porpirin yang merupakan derivat dari metabolisme hemoglobin. Pada
puyuh, pigmen kerabang telur berasal dari oopororpirin (porpirin) dan
biliverdin. Deposisi pigmen terjadi dua atau tiga jam sebelum oviposisi
yang kemudian diikuti dengan penurunan ooporpirin dalam jaringan
kelenjar kerabang.
e. Vagina, merupakan bagian oviduk menuju kloaka. Di dalam vagina
hampir tidak terjadi sekresi material telur kecuali pembentukan kutikula.
Kutikula adalah lapisan penutup kerabang paling luar, berfungsi
melindungi telur dari serangan bakteri yang berbahaya dan meminimalkan
penguapan air. Telur melewati vagina dengan cepat, yaitu sekitar 3 menit
kemudian akan dikeluarkan (oviposisi) dan 30 menit setelah oviposisi akan
kembali terjadi ovulasi (Woodard et al. 1973; Hafez 2000; Johnson
Gambar 2. Saluran reproduksi ungas betina secara umum (www.iacuc.arizona.edu/poultry/species.html)
Sistem reproduksi aves betina dapat berfungsi dengan baik jika ada
stimulasi hormon FSH (Follicle Stimulating Hormone) dari hipofisis anterior yang
menyebabkan terjadinya perkembangan dan pematangan folikel. Sekresi FSH
secara normal distimulasi oleh periode pencahayaan. Pada kondisi alamiah,
peningkatan sekresi FSH disebabkan oleh bertambah lamanya siang hari.
Perkembangan folikel akan menginisiasi sekresi estrogen dan progesteron.
Estrogen menyebabkan peningkatan kadar kalsium, protein, lemak, vitamin, dan
substansi lainnya dalam darah yang diperlukan untuk pembentukan telur. Estrogen
juga menstimulasi perkembangan tulang pubis dan pembesaran vent (bagian
paling luar dari kloaka) untuk mempersiapkan aves betina bertelur. Progesteron
akan memacu hipofisis anterior untuk mensekresi LH. Kehadiran LH
menyebabkan terjadinya ovulasi, yaitu pelepasan yolk yang sudah matang dari
ovarium ke dalam infundibulum. Pada saat terjadi ovulasi, jika ada sperma yang
membuahi akan dihasilkan telur yang fertil. Sebaliknya, jika tidak ada sperma,
produksi telur tetap akan berlangsung, tetapi telur yang dihasilkan adalah steril
(infertil) (Siswantoro 2007).
tangkai ovari
folikel kosong ovari muda
ovum masak
infundibulum
stigma
ostium
isthmus
oviduk kanan rudimenter
kloaka
vagina uterus
E. Masak Kelamin Puyuh
Secara umum, masak kelamin didefinisikan sebagai suatu fase
perkembangan individu ketika individu tersebut mulai mampu menghasilkan
keturunan. Masak kelamin pada aves betina berkaitan erat dengan pengeluaran
telur. Tercapainya oviposisi pertama merupakan kriteria yang banyak dipakai
sebagai tanda timbulnya umur masak kelamin pada unggas. Kriteria bertelur
pertama kali didahului oleh ovulasi, sedangkan pada unggas jantan, masak
kelamin merupakan tahap ketika testis telah tumbuh dan berkembang serta
mampu menghasilkan spermatozoa yang matang. Tanda-tanda masak kelamin
merupakan perpaduan antara perubahan fisiologis dan morfologis yang
menghasilkan suatu keadaan sehingga hewan mampu bereproduksi (Tamzil,
1995).
Secara umum, terdapat dua faktor yang mempengaruhi umur masak
kelamin pada unggas, yaitu faktor internal berupa genetik dan faktor eksternal
berupa pembatasan pakan serta periode pencahayaan. Pembatasan pakan, baik
dengan pembatasan kuantitas maupun kualitas dapat memperlambat umur masak
kelamin. Pembatasan jumlah pakan yang diberikan pada itik lokal dapat menunda
umur masak kelamin dan menghasilkan bobot telur pertama lebih berat,
sedangkan itik yang mendapat pakan ad libitum mengalami masak kelamin dini
(Tamzil 1995). Penelitian yang telah dilakukan mengenai pembatasan pakan pada
puyuh umur 14 hari sampai dengan masak kelamin menyebabkan terjadinya
penundaan umur masak kelamin, penurunan bobot badan, dan bobot organ
reproduksi saat masak kelamin serta penurunan jumlah folikel dan lemak karkas.
Periode pencahayaan berkaitan dengan lamanya periode terang atau panjang hari.
Pada puyuh betina yang menerima penerangan konstan sejak umur nol hari
selama 16 jam memberikan peningkatan respons masak kelamin, sedangkan
durasi pencahayaan selama 8-12 jam tidak akan meningkatkan respons masak
kelamin. Demikian juga pemberian penerangan selama 16 jam pada puyuh jantan
akan meningkatkan respons masak kelamin, sedangkan pemberian penerangan
selama 8 jam akan menyebabkan regresi testis (Siopes dan Wilson 1980). Pada
ayam yang juga mendapat penerangan konstan sejak umur nol sampai 500 hari
lebih dini, namun jika penerangan diperpanjang hingga 18 jam masak kelamin
akan diperlambat (Moris 1967). Cahaya memiliki peran yang begitu penting
dalam menstimulasi hipotalamus untuk mensekresikan GnRH yang sangat
dibutuhkan untuk menstimulasi hipofisis memproduksi LH. Untuk terjadinya
ovulasi LH sangat diperlukan, sedangkan pertumbuhan dan pembesaran folikel
diperlukan FSH (Johnson 2000).
Ketika puyuh mencapai umur masak kelamin, ovarium dan oviduk
mengalami perubahan-perubahan sekitar 10-12 hari sebelum puyuh dara bertelur
untuk yang pertama kali. Hipofisis anterior akan mensekresikan FSH sehingga
terjadi pertumbuhan, perkembangan, dan pemasakan folikel. Ovarium akan mulai
mensekresikan estrogen, progesteron, dan testosteron (sex steroid). Konsentrasi
estrogen plasma darah yang tinggi memacu perkembangan tulang medular,
merangsang sintesis protein kuning telur, dan pembentukan lipoprotein di dalam
hati (Woodard et al. 1973). Pada saat yang bersamaan, terjadi pembesaran ukuran
oviduk sehingga memungkinkan produksi protein albumin, membran kerabang,
kalsium karbonat kerabang, dan kutikula. Yolk pertama menjadi matang karena
sebagian bahan yolk di dalam hati dialirkan oleh sistem vaskularisasi langsung ke
yolk dalam folikel. Satu atau dua hari kemudian, yolk yang kedua mulai
berkembang dan seterusnya sampai pada saat telur pertama dikeluarkan sekitar
5-10 yolk sedang dalam proses perkembangan. Setiap yolk dewasa menjadi
matang membutuhkan waktu 10-11 hari. Kemudian yolk matang akan dilepaskan
dari ovarium masuk ke dalam oviduk dengan suatu proses yang dikenal sebagai
ovulasi. Ovulasi dirangsang oleh kehadiran hormon LH. Sekresi LH dipicu oleh
peningkatan kadar progesteron dalam darah. Masak kelamin ditandai dengan
ovulasi pertama kali, di mana ovulasi dapat menjadi cepat atau lambat sangat
dipengaruhi oleh pembatasan pakan maupun periode pencahayaan (Suprijatna et
al. 2005).
Folikel-folikel preovulasi sangat potensial dalam menghasilkan steroid
lewat jalur steroidogenik. Lapisan granulosa secara dominan akan mensekresikan
progesteron sebagai prekursor sintesis androstenedion dan testosteron dalam
lapisan teka internal dan sedikit lebih banyak pada sel-sel lapisan granulosa.
pelepasan LH 4-6 jam sebelum ovulasi terjadi. Estrogen disintesis oleh sel-sel
teka eksternal. Produksi steroid oleh sel-sel teka dan granulosa dikontrol oleh aksi
LH lewat signal second messenger cAMP (adenil cyclase). Messenger asam
ribonukleat (mRNA) merupakan reseptor LH yang tereskpresi pada jaringan
granulosa dan teka folikel seluruh hierarki folikel. Peningkatan mRNA sebagai
reseptor LH terjadi ketika fase perkembangan folikel baik pada lapisan teka
maupun lapisan granulosa, kemudian fase pascaovulasi dan ketika terjadi regeresi
folikel. Hierarki folikel merupakan gradasi bobot dan ukuran folikel. Hanya satu
folikel, yaitu folikel yang paling besar dan menjadi matang serta diovulasikan
dalam waktu satu hari. Segera setelah folikel yang paling besar pecah, yolk
mengalami ovulasi kemudian akan diikuti oleh folikel nomor dua terbesar yang
akan tumbuh dan menjadi paling besar kembali, demikian seterusnya pembesaran
folikel terjadi secara berurutan. Jadi, kontrol aliran hormon gonadotropin pada
aves betina sangat berbeda dari mamalia betina. Pada mamalia, aliran
gonadotropin hanya cukup menstimulasi matangnya satu folikel (atau beberapa
folikel pada betina politokus), sedangkan pada unggas betina, aliran hormon
gonadotropik diatur tidak hanya untuk satu folikel yang memiliki ukuran ovulasi
pada saat itu, tetapi juga untuk mempertahankan keberadaan hierarki folikel.
Induksi cAMP oleh LH akan meningkatkan respons lapisan granulosa folikel pada
saat ovulasi berlangsung. Sebaliknya, ikatan FSH pada membran, pembentukan
cAMP yang diinduksi oleh FSH, dan steroidogenesis sangat rendah pada hierarki
folikel. Jadi, ketika ovulasi, sistem cAMP pada sel teka maupun granulosa
memiliki sensitivitas yang tinggi terhadap LH, namun tidak responsif untuk FSH
(Johnson 2000; Nalbandov 1990).
Aktivasi diasilgliserol atau protein kinase C sebagai sistem second
messenger akan menurunkan produksi steroid yang diinduksi oleh LH pada sel-
sel granulosa dan sel-sel teka folikel. Sejumlah faktor fisiologi potensial akan
beraksi lewat protein kinase C yang meliputi faktor pertumbuhan (transforming
growth factor α/TGFα maupun transforming growth factor β/TGFβ), faktor
pertumbuhan epidermal (epidermal growth factor/EGF), dan prostaglandin. Pada
ayam, kehadiran TGFα akan menurunkan produksi steroid yang diinduksi LH di
penurunan atau penghambatan steroid menunjukkan berakhirnya pelepasan
progesteron preovulasi. Produksi faktor-faktor pertumbuhan dan reseptornya
seperti EGF, TGFα, TGFβ, NGF (nerve growth factor), SCF (stem cell factor)
dan IGF-I (insulin growth factor I) ikut terlibat dalam regulasi fungsi ovari, baik
sebagai parakrin maupun autokrin (Johnson 2000). Pada puyuh, EGF kurang
berperan selama diferensiasi folikel, sedangkan TGFβ merupakan modulator
parakrin dan autokrin pada sel-sel granulosa dan oosit yang telah matang
(Nassauw et al. 1996).
Oviposisi merupakan proses pengeluaran telur dari tubuh aves betina.
Proses oviposisi melibatkan relaksasi otot abdominal dan otot sphincter antara
uterus dan vagina serta kontraksi otot pada dinding uterus. Mekanisme oviposisi
pada puyuh dan aves secara umum dikontrol oleh hormon neurohipofisis,
prostaglandin, dan hormon folikel preovulasi maupun pascaovulasi. Hormon
neurohipofisis yang terlibat langsung dalam proses oviposisi adalah oksitosin
yang dimediasi oleh prostaglandin. Pemberian indomethasin, histamin, dan
asetilkolin akan memblokir sintesis oksitosin sehingga menginduksi terjadinya
oviposisi prematur. Pada ayam, hormon neurohipofisis yang terlibat dalam
oviposisi selain oksitosin adalah arginin vasotoksin. Ayam petelur sangat peka
sekali terhadap kedua hormon neurohipofisis ini yang menginduksi kontraksi
uterus sehingga menyebabkan terjadinya oviposisi prematur (Johnson 2000).
Penelitian yang dilakukan oleh Saito et al. (1990) menunjukkan bahwa ovari
ayam juga merupakan sumber arginin vasotoksin. Siklus ovulasi-oviposisi
merupakan siklus ovulasi ovum sampai dengan peletakan telur (oviposisi). Siklus
ovulasi-oviposisi untuk masing-masing spesies aves cukup bervariasi dengan
rentang waktu 24-28 jam. Siklus ovulasi-oviposisi pada ayam, kalkun, dan puyuh
sekitar 24 jam, pada itik Khaki Campbell sekitar 23-24 jam, sebaliknya pada
merpati siklus ini cukup lama, yaitu sekitar 40-44 jam. Oviposisi pada puyuh
terjadi pukul 14.00-19.00, pada ayam pukul 06.00-14.00, dan pada itik pada pukul
02.00-06.00. Pemberian pencahayaan yang konstan pada puyuh akan
menstimulasi pengeluaran jumlah telur yang relatif seragam pada periode 24 jam
secara berurutan, yang dikenal sebagai suatu siklus clutch. Siklus clutch berakhir
Umur masak kelamin sangat dipengaruhi oleh panjang hari (lamanya
penerangan). Beberapa puyuh betina akan mulai bertelur pada umur 35 hari,
namun sebagian besar puyuh bertelur pertama kali pada umur 41-42 hari dan
mencapai puncak produksi telur pada umur 50 hari. Pada kondisi lingkungan yang
sesuai, puyuh akan mampu bertelur sebanyak 250 butir per tahun per ekor. Waktu
yang dibutuhkan untuk membentuk sebutir telur adalah 24 jam yang diawali
dengan keberadaan telur di dalam infundibulum sekitar 15-30 menit, di dalam
magnum 2-2,5 jam, di dalam isthmus 1,5-2 jam, dan di dalam uterus 19-20 jam.
Ovulasi telur berikutnya akan dimulai lagi 15-30 menit setelah oviposisi. Bobot
ovari pada saat bertelur sekitar 6,2 g, sedangkan bobot oviduk 4,9 g. Masak
kelamin puyuh jantan dicapai pada umur 36 hari dengan bobot testis 551 mg pada
saat menghasilkan spermatozoa pertama kali dan bobotnya akan meningkat
sampai 2.500 mg pada puyuh yang produktif. Konsentrasi semen 5,9 juta/mm3
dan volume semen 10 μl/ekor (Woodard et al. 1973). Beberapa perubahan lain
yang mengikuti proses masak kelamin pada unggas, termasuk puyuh, yaitu vent
menjadi besar dan lembab, tulang pinggul (pubis) menjadi lebih tipis, jarak
antartulang pinggul bertambah lebar, jarak antara tulang pinggul dan ujung tulang
dada bertambah lebar serta kulit pada tulang tengkorak menjadi lebih tipis
(Suprijatna et al. 2005). Pelebaran tulang pinggul (PS: pubic spread) pada puyuh
secara cepat terjadi ketika masak kelamin pada umur 38-59 hari dan pertumbuhan
optimal tulang pinggul berlangsung pada umur 49-52 hari. Pada puyuh berumur
21-38 hari yang belum masak kelamin (prepubesence), tulang pinggul belum
mengalami pelebaran, sedangkan pada puyuh berumur 59-84 hari yang sudah
mulai postpubesence sudah tidak terjadi lagi pertumbuhan tulang pinggul
(Satterlee dan Marin 2004).
F. Estrogen
Estrogen merupakan salah satu anggota dari hormon steroid yang
disintesis oleh sel-sel teka eksterna ovari. Semua hormon steroid dibentuk dari
kolesterol. Biosintesis estrogen dikontrol dan diatur melalui mekanisme umpan
balik negatif sekresi FSH dan LH oleh hipofisis, serta GnRH oleh hipotalamus.
metabolisme kalsium untuk pembentukan membran kerabang dan kerabang telur,
biosintesis lemak, induksi reseptor oviduk untuk menstimulasi perkembangan
oviduk, induksi reseptor progesteron yang terekspresi dalam saluran reproduksi
dan ovari, perkembangan tulang pubis serta pertumbuhan bulu (King 2008).
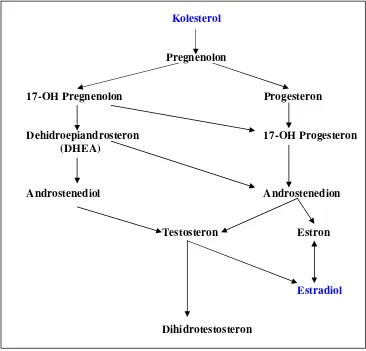
Berikut disajikan skema sintesis hormon seks hewan betina di dalam ovarium
(Gambar 3).
Kolesterol
Pregnenolon
17-OH Pregnenolon Progesteron
Dehidroepiandrosteron 17-OH Progesteron
(DHEA)
Androstenediol Androstenedion
Testosteron Estron
Estradiol
Dihidrotestosteron
Gambar 3. Sintesis hormon seks pada ovarium. Hormon seks disintesis dari kolesterol. Konversi androstenedion menjadi testosteron dan estron pada sel-sel teka eksterna folikel
ovari menghasilkan estradiol (King 2008)
Secara umum terdapat tiga jenis estrogen yang bermakna di dalam plasma
unggas betina, yaitu estradiol-β, estron, dan estriol. Estrogen utama yang
disekresi oleh ovarium adalah estradiol-β. Estron disekresi dalam jumlah kecil,