ANALISIS α
-TOKOFEROL (VITAMIN E) PADA
MINYAK BIJI KELOR (Moringa oleifera Lam.)
SECARA KROMATOGRAFI CAIR KINERJA TINGGI
SKRIPSI
NURUL FITHRIYAH
NIM : 109102000055
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
ii
ANALISIS
α
-TOKOFEROL (VITAMIN E) PADA
MINYAK BIJI KELOR (Moringa oleifera Lam.)
SECARA KROMATOGRAFI CAIR KINERJA TINGGI
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
NURUL FITHRIYAH
NIM : 109102000055
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
iii
Skripsi ini adalah hasil karya saya sendiri,
dan semua sumber baik yang dikutip maupun dirujuk
telah saya nyatakan dengan benar.
Nama : Nurul Fithriyah
NIM : 109102000055
Tanda Tangan :
vi
Nama : Nurul Fithriyah
Program Studi : Farmasi
Judul Skripsi : Analisis α-Tokoferol (vitamin E) Pada Minyak Biji Kelor
(Moringa oleifera Lam.) Secara Kromatografi Cair Kinerja Tinggi
Kelor (Moringa oleifera Lam.) merupakan tanaman yang sering dimanfaatkan sebagai tanaman obat. Salah satu bagian tanaman yang sering digunakan adalah biji dari buahnya. Tokoferol (Vitamin E) merupakan salah satu komponen yang terkandung dalam minyak yang dihasilkan dari biji buah kelor tersebut, yang berkhasiat menghambat proses oksidasi dan pembentukan radikal bebas. Penelitian ini dilakukan untuk menganalisis kandungan vitamin E dalam minyak biji kelor secara Kromatografi Cair Kinerja Tinggi (KCKT). Hasil analisis menunjukkan bahwa variasi metode perolehan minyak (ekstraksi dengan pelarut dan kempa dengan variasi suhu pengeringan sampel) memberikan hasil rendemen
minyak dan kandungan α-tokoferol yang berbeda-beda. Pada metode ekstraksi
yakni maserasi dengan n-heksan menghasilkan minyak dengan jumlah 40,01%, sedangkan metode pengepresan mekanis dengan variasi suhu pengeringan sampel
40 oC, 80 oC dan 120 oC menghasilkan minyak berturut-turut 10%; 7,6%; dan
6,77%. Hasil validasi menggunakan standar α-Tokoferol memberikan linieritas
kurva kalibrasi 0,999991 dengan batas deteksi dan kuantitasi masing-masing 0,06
µg/mL dan 0,2 µg/mL. Uji perolehan kembali α-Tokoferol dalam matriks minyak
biji kelor memberikan hasil 95,8%. Sampel minyak dilarutkan dengan etanol dan THF terlebih dahulu, kemudian dianalisis dengan KCKT menggunakan kolom
fase terbalik LiChosper® C18 (25 cm x 5 µm) dengan fase gerak metanol, volume
penyuntikan 20,0 µL dan kecepatan alir 1,0 mL/menit. Masing-masing sampel
minyak tersebut menghasilkan kadar α-tokoferol berturut-turut: 0,235; 0,37;
0,265; dan 0,265 mg/g. Untuk mengetahui kualitas minyak tersebut dilakukan analisis kandungan minyak dengan GCMS. Hasil menunjukkan bahwa minyak biji kelor terdiri dari asam lemak tidak jenuh berupa asam oleat dan asam-asam lemak jenuh yang dominan yaitu asam palmitat dan asam stearat.
vii
Name : Nurul Fithriyah
Program study : Pharmacy
Tittle : Analysis of α-Tocopherol (vitamin E) On Seeds Oil Moringa
(Moringa oleifera Lam.) By High Performance Liquid Chromatography
Moringa oleifera Lam is a plant mostly used as medical plant. Seed of fruit is the part that coomonly used. Tocopherol (Vitamin E) is one of the components contained in the oil which is produced from the seed of the Moringa fruit, that can inhibit the oxidation process and formation of free radical. The purpose of the present study was to determine vitamin E in the seed oil of moringa with High Performance Liquid Chromatography (HPLC). The analysis showed that the variaous method of oil production, produce variations of oil yield and tocopherol content. Maceration extraction method with n-hexane produces 40,01% of oil, while mechanical pressing method with variations of sample drying temperature 40 °C, 80 °C and 120 °C produce oil 10%; 7,6%; and 6,77%. The result showed
that linearity of standard α-Tocopherol was 0,999991 with the detection and
quantitation limits respectively 0,06 mg/mL and 0.2 mg/mL. The result of recovery value using moringa seed oil matrix was 95,8%. Sample of moringa seed oil dissolved in ethanol and tetrahydrofuran (THF), and then analyzed by HPLC
using a reversed-phase column LiChosper® C18 (25 cm x 5 µm) with methanol as
mobile phase, volume of injection 20,0 µ L and flow rate 1,0 mL/min. Each of the
oil samples contains 0,235; 0,37; 0,265 and 0,265 mg/g α-tocopherol.
Determination of oil quality carried by oil contents analysis by GCMS. Result showed that moringa seed oil is composed by unsaturated fatty acids such as oleic acid and dominated by saturated fatty acids such as stearic acid and palmitic acid.
viii
Esa Allah SWT yang telah melimpahkan berbagai macam nikmat, rahmat dan
hidayah-Nya berupa kesehatan, pemikiran dan ide sehingga penulis dapat
menyelesaikan penelitian dan penulisan skripsi ini. Shalawat serta salam tak lupa
kami haturkan kepada sang revolusioner islam sejati baginda Nabi Besar
Muhammad SAW, beserta keluarga, sahabat dan para pengikutnya hingga akhir
nanti semoga kita senantiasa mendapatkan syafaat dari beliau.
Skripsi ini penulis susun untuk memenuhi salah satu syarat menempuh
ujian akhir guna memperoleh gelas Sarjana Farmasi pada Program Studi Farmasi
Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif
Hidayatullah Jakarta. Adapun judul skripsi ini adalah “Analisis α-Tokoferol
(Vitamin E) Pada Minyak Biji Kelor (Moringa Oleifera Lam.) Secara
Kromatografi Cair Kinerja Tinggi (KCKT)”.
Dalam proses penelitian dan penyusunan skripsi ini penulis menyadari
ada beberapa pihak yang sangat memberikan kontribusinya kepada penulis. Oleh
karenanya penulis mengucapkan rasa terima kasih yang sebesar-besarnya,
khususnya kepada :
1. Prof. Dr. H. Chairul, Apt sebagai Pembimbing I dan Puteri Amelia, M.Farm.,
Apt selaku pembimbing II, yang telah meluangkan waktu, tenaga dan pikiran
serta memberikan ilmu terbaik yang mereka miliki dan dengan sabar
membimbing dan mengajari sehingga penulis dapat menyelesaikan skripsi ini.
2. Kementrian Agama RI selaku pemberi beasiswa, sehingga penulis dapat
mengenyam pendidikan di Universitas Islam Negeri Syarif Hidayatullah
Jakarta.
3. Prof. Dr. (hc) dr. M. K. Tadjudin, Sp. And selaku Dekan Fakultas Kedokteran
dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
4. Drs. Umar Mansur, M.Sc., Apt selaku Ketua Program Studi Farmasi Fakultas
Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah
ix memberikan ilmunya kepada penulis.
6. Ayahanda tercinta H. Nukhin, Spd pemimpin dan penasehat terbaik beserta
Ibunda tercinta Dra. Hj. Sri Jauharoh bidadari yang selalu memberikan kasih
sayang, semangat, dukungan, do’a dan nasihatnya yang tak terhingga yang tak
akan pernah mampu penulis membalas semua itu. Adik-adik penulis, Ahmad
Yusron dan Saidatul Husna yang selalu memberikan keceriaan yang mampu
mengusir kepenatan penulis dalam menyusun skripsi ini.
7. Teman-teman CSS MORA 2009 (Community of Santri Scholar of Ministry Of
Religious Affair), teman-teman Farmasi 2009 khususnya “EDTA-C” serta
teman-teman “PIM LOVERS” terkhusus untuk sahabat-sahabat terbaik Dila,
Dhea, Leli, Fina, Omi, Mila, Fitri, Walida, Fatimah, Lulu, Azizah, Ema,
Neneng, Arif, Dyah, Ainul, Farichah, Nurul, Ferry, dan Zaky yang selalu
menjadi keluarga kedua bagi penulis dan selalu memberikan keceriaan dalam
masa perkuliahan hingga penulisan skripsi ini selesai.
8. Teman-teman UNIQUE IMMERSION terkhusus untuk Uswah Azizah.
9. Laboran yang telah membantu keseharian penulis selama penelitian di
laboratorium LIPI, teh Ana dan teh Lina. Serta operator instrumen bu Indri dan
bu Endah.
10. Serta semua pihak yang telah membantu penulis selama ini yang tidak bisa
disebutkan satu persatu.
Penulis sadar bahwa dalam penulisan skripsi ini masih banyak
kelemahan, kekurangan dan masih jauh dari kesempurnaan. Penulis
mengharapkan kritik dan saran dari pembaca untuk memperbaiki kemampuan
penulis dalam pembuatan skripsi.
Ciputat, 6 September 2013
x
Sebagai sivitas akademik Universitas Islam Negeri (UIN)
Syarif Hidayatullah Jakarta, saya yang bertanda tangan dibawah
ini :
Nama : Nurul Fithriyah
NIM : 109102000055
Program Studi : Farmasi
Fakultas : Fakultas Kedokteran dan Ilmu Kesehatan (FKIK)
Jenis Karya : Skripsi
Demi pengembangan ilmu pengetahuan, saya menyetujui
skripsi/karya ilmiah saya, dengan judul
ANALISIS α-TOKOFEROL (VITAMIN E) PADA MINYAK BIJI KELOR
(Moringa oleifera Lam.) SECARA KROMATOGRAFI CAIR KINERJA
TINGGI (KCKT)
Untuk dipublikasikan atau ditampilkan di internet atau media lain
yaitu digital Library Perpustakaan Universitas Islam Negeri
(UIN) Syarif Hidayatullah Jakarta untuk kepentingan akademik
sebatas sesuai dengan Undang-Undang Hak Cipta.
Dengan demikian persetujuan publikasi karya ilmiah ini
saya buat dengan sebenarnya.
Dibuat di : Ciputat
Pada Tanggal : 6 September 2013
Yang menyatakan,
xi
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... vi
ABSTRACT ... vii
KATA PENGANTAR ... viii
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... x
DAFTAR ISI ... xi
2.1.1 Klasifikasi Tanaman... 5
2.1.2 Nama Daerah ... 5
2.1.3 Sinonim ... 5
2.1.4 Morfologi ... 6
2.1.5 Tempat Tumbuh dan Distribusi Tanaman ... 6
2.1.6 Kandungan Kimia ... 7
2.1.8 Kegunaan/Khasiat ... 8
2.2 Minyak dan Lemak ... 9
2.2.1 Sumber Minyak dan Lemak ... 9
2.2.2 Komposisi minyak dan lemak ... 10
2.2.3 Proses Pengolahan Minyak dari Tanaman ... 11
2.3 Metode Ekstraksi ... 13
2.4 Tokoferol (Vitamin E) ... 14
2.4.1 Tokoferol sebagai Antioksidan ... 15
2.5 Kromatografi Cair Kinerja Tinggi ... 16
2.5.1 Keuntungan KCKT ... 17
2.5.2 Cara Kerja KCKT ... 18
2.5.3 Instrumentasi KCKT ... 18
2.5.4 Analisa dalam KCKT ... 21
2.6 Identifikasi Kandungan Minyak ... 22
xii
3.3 Prosedur Kerja ... 25
3.3.1 Penyiapan simplisia ... 25
3.3.2 Proses perolehan minyak... 25
3.3.3 Pembuatan larutan induk α-tokoferol ... 26
3.3.4 Validasi metode analisa... 27
3.3.5 Analisis α-tokoferol pada minyak biji kelor dengan KCKT ... 28
3.3.6 Analisis kandungan minyak biji kelor ... 29
BAB 4 HASIL DAN PEMBAHASAN ... 30
4.1 Hasil ... 30
4.2 Pembahasan... 39
BAB 5 KESIMPULAN DAN SARAN ... 45
5.1 Kesimpulan ... 45
5.2 Saran ... 45
xiii
Gambar 1. Tanaman kelor (Moringa oleifera Lam.) ... 6
Gambar 2. Struktur kimia trigliserida ... 9
Gambar 3. Struktur kimia tokoferol ... 16
Gambar 4. Diagram Alat dan Komponen KCKT ... 19
Gambar 5. Rendemen minyak yang diperoleh berdasarkan variasi metode ... 31
Gambar 6. Kurva kalibrasi standar α-tokoferol ... 32
Gambar 7. Kadar α-tokoferol yang diperoleh dari masing-masing metode ... 34
Gambar 8. Kromatogram sampel A ulangan 1 ... 34
Gambar 9. Kromatogram sampel A ulangan 2 ... 35
Gamabr 10. Kromatogram sampel B ulangan 1 ... 35
Gambar 11. Kromatogram sampel B ulangan 2 ... 36
Gambar 12. Kromatogram sampel C ulangan 1 ... 36
Gambar 13. Kromatogram sampel C ulangan 2 ... 37
Gambar 14. Kromatogram sampel D ulangan 1 ... 37
Gambar 15. Kromatogram sampel D ulangan 2 ... 38
xiv
Tabel 1. Kandungan kimia tumbuhan yang diisolasi dari Moringa oleifera Lam. ... 7
Tabel 2. Asam lemak jenuh ... 10
Tabel 3. Asam lemak tak jenuh ... 10
Tabel 4. Keterangan nama senyawa tokoferol berdasarkan R1 dan R2 ... 16
Tabel 5. Hasil perolehan minyak ... 30
Tabel 6. Data uji linearitas ... 31
Tabel 7. Data penentuan LOD dan LOQ ... 32
Tabel 8. Uji perolehan kembali ... 33
Tabel 9. Data kadar α-tokoferol dari sampel ... 33
xv
Lampiran 1. Hasil Determinasi Tanaman ... 50
Lampiran 2. Gambar Bahan dan Alat Penelitian ... 51
Lampiran 3. Alur Penelitian ... 53
Lampiran 4. Perhitungan hasil rendemen minyak biji kelor ... 54
Lampiran 5. Pembuatan deret larutan standar ... 55
Lampiran 6. Cara Memperoleh Persamaan Garis Linear ... 56
Lampiran 7. Cara Perhitungan Batas Deteksi dan Batas Kuntitasi... 57
Lampiran 8. Cara Perhitungan Uji Perolean Kembali ... 58
Lampiran 9. Cara Perhitungan Konsentrasi dan Kadar α-Tokoferol ... 59
Lampiran 10. Kandungan Kimia Penyusun Minyak Lemak Hasil GCMS ... 60
Lampiran 11. Data hasil uji statistik ... 62
Lampiran 12. Kromatogram standar α-tokoferol ... 63
Lampiran 13. Kromatogram sampel ... 65
1 UIN Syarif Hidayatullah Jakarta 1.1 LATAR BELAKANG
Tanaman kelor atau Moringa oleifera Lam., merupakan tanaman yang
termasuk dalam familia Moringaceae. Tanaman ini merupakan tanaman yang
kerap kali ditemukan dan dibudidayakan di berbagai negara seperti India, Filipina,
Pakistan, Thailand dan Indonesia sendiri (Promkum et al., 2010). Bagian-bagian
dari tanaman tersebut seperti daun, buah-buahan, bunga dan polong matang dari
pohon ini sering digunakan sebagai sayur-sayuran di negara-negara tersebut.
Selain itu bagian tanaman ini seperti bunga, daun muda dan polong/biji juga
dikenal sebagai tanaman obat tradisional secara turun temurun (Budda et al.,
2011).
Studi sebelumnya telah mendokumentasikan adanya senyawa fenolik,
flavonoid, saponin, terpenoid, proantosianidin dan glikosida jantung pada
polong/biji dari M.oleifera (Sharma et al., 2012). Ekstrak hidro-alkohol
biji/polong dari tanaman yang kerap di sapa kelor ini telah dilaporkan mampu
meningkatkan metabolisme oleh enzim di hati dengan konsumsi oral (Promkum et
al., 2010). Biji M.oleifera juga banyak digunakan untuk pengolahan limbah dan
penjernihan air (Water purification) karena memiliki aktivitas antimikroba. Pada
biji tersebut terkandung minyak yang secara komersial dikenal sebagai “Behen Oil”, konsentrasi minyak pun bervariasi tergantung pada metode ekstraksi yang
digunakan. Minyak tersebut juga telah dilaporkan tahan terhadap ketengikan, hal
tersebut dimungkinkan karena kandungan antioksidan pada minyak tersebut
sehingga minyak tidak mudah teroksidasi dan berbau tengik (Anwar et al., 2006).
Biji (polong) kelor mengandung +38% minyak yang mengandung vitamin E
(0,01%) dan beta karoten (0,014%) (Bhoomika et al., 2007). Biji yang sudah tua
mengandung karbohidrat, metionin, sistein, benzilglukosinolat, moringin,
mono-palmitat and di-oleat trigliserida.
Vitamin E (tokoferol) merupakan salah satu komponen yang terkandung
dalam biji buah kelor. Vitamin E merupakan suatu zat antioksidan yang sangat
UIN Syarif Hidayatullah Jakarta
keseimbangan sel dari radikal bebas dan menghambat proses oksidasi. Radikal
bebas merupakan molekul yang tidak stabil dan sangat berbahaya bagi tubuh
karena dapat menyebabkan perubahan pada sel-sel tubuh yang memicu terjadinya
proses penuaan dini dan penyakit degeneratif seperti kanker. Dengan
kemampuannya sebagai zat antioksidan, vitamin E dapat mengurangi resiko
penyebab berbagai macam penyakit, seperti jantung dan diabetes. Selain itu
vitamin E juga dapat mengurangi resiko terjadinya pembekuan darah, mencairkan
darah beku, mencegah penyumbatan pembuluh darah, menguatkan dinding
pembuluh darah kapiler, meningkatkan pembentukan sel-sel darah merah,
mengurangi kadar gula darah, memperbaiki kerja insulin serta meningkatkan
kekuatan otot dan stamina (Winarsi, 2007).
Sumber vitamin E dapat diperoleh secara alami maupun sintetis. Sumber
vitamin E alami banyak terdapat pada minyak tumbuh-tumbuhan seperti minyak
jagung, minyak kedelai, minyak kacang tanah dan juga biji-bijian lain. Selain
banyak dihasilkan dari tanaman, juga dapat diperoleh dari ikan. Vitamin E
tersusun dari dua senyawa yakni tokoferol dan tokoetrinol yang sama-sama
memiliki aktivitas antioksidan. Tokoferol, terutama α-tokoferol telah diketahui
sebagai antioksidan yang mampu mempertahankan integritas membran. Senyawa
tersebut dilaporkan bekerja sebagai scanvenger radikal bebas oksigen, peroksida
lipid dan oksigen singlet. Berdasarkan jumlah gugus metil pada inti aromatik,
dikenal 4 tokoferol yaitu α, δ, , . Diantara keempat bentuk tokoferol tersebut,
yang paling aktif adalah α-tokoferol. Oleh sebab itu, aktivitas vitamin E diukur
sebagai α-tokoferol (Winarsi, 2007)
Selain variasi metode perolehan minyak, tingkat kekeringan sampel juga
akan menentukan jumlah dan mutu minyak yang dihasilkan. Metode yang akan
digunakan dalam perolehan minyak biji kelor ini menurut Ketaren, S (1986)
menggunakan solvent extraction yakni maserasi dengan n-heksan dan juga kempa
hidrolis dengan variasi suhu pengeringan pada sampel sebelum dikempa.
Analisis vitamin E dapat dilakukan dengan beberapa metode seperti
Kromatografi Lapis Tipis (KLT), Kromatografi Gas (KG) dan Kromatografi Cair
Kinerja Tinggi (KCKT). Pada penelitian ini digunakan metode KCKT karena
UIN Syarif Hidayatullah Jakarta
yang didapatkan jauh lebih tinggi daripada metode lain (KLT, spektrofotometer);
teknik yang digunakan tidak terlalu tergantung pada kemampuan operator, waktu
analisisnya cepat dan cara kerjanya relatif sederhana, selain itu KCKT juga dapat
menganalisis senyawa yang tidak mudah menguap dan termolabil (Ekasari, 2008).
Metode kromatografi cair kinerja tinggi (KCKT) merupakan metode yang
sangat populer untuk menetapkan kadar senyawa obat baik dalam bentuk sediaan
maupun dalam sampel hayati. Hal ini disebabkan karena KCKT merupakan
metode yang memberikan sensitifitas yang tinggi. Selain itu, KCKT memiliki
banyak keuntungan antara lain: cepat, resolusinya baik, mudah pelaksanaannya,
detektor yang sensitif dan beragam sehingga mampu menganalisa berbagai
cuplikan secara kualitatif maupun kuantitatif, kolom dapat digunakan kembali,
mudah memperoleh kembali cuplikan, ideal untuk molekul besar dan ion
(Rohman, 2007).
Berdasarkan hal tersebut di atas, penulis tertarik menggunakan metode
KCKT untuk menganalisis α-tokoferol dari ekstrak minyak biji kelor. Hasil
tersebut diharapkan mampu menjadi dasar untuk penelitian lanjutan mengenai
α-tokoferol pada minyak biji M.oleifera karena sifat α-tokoferol sendiri
merupakan vitamin yang larut minyak/lemak sehingga bisa diketahui seberapa
besar potensi biji kelor tersebut untuk menjadi sumber antioksidan alami baik
untuk dikonsumsi maupun dikomersilkan. Selain itu, untuk mengetahui kualitas
minyak yang dihasilkan dari biji kelor maka akan digunakan alat GCMS untuk
mengetahui komponen-komponen asam lemak penyusun trigliseridanya.
Tujuannya adalah untuk mengetahui seberapa besar potensi minyak tersebut untuk
UIN Syarif Hidayatullah Jakarta
1.2 PERUMUSAN MASALAH
Berdasarkan latar belakang tersebut, maka dibuat rumusan masalah sebagai
berikut:
1. Apakah α-tokoferol yang terkandung pada minyak biji kelor dapat
ditentukan kadarnya menggunakan KCKT ?
2. Apakah proses perolehan minyak (ekstraksi dan kempa dengan variasi
pemanasan biji pada suhu 40 oC, 80 oC dan 120 oC) berpengaruh terhadap
kandungan α-tokoferol dari minyak biji kelor (M.oleifera) ?
3. Bagaimanakah kualitas minyak biji kelor berdasarkan komposisi asam-asam
lemak penyusun trigliseridanya ?
1.3 TUJUAN PENELITIAN
Dari rumusan masalah diatas, tujuan dari penelitian ini adalah sebagai
berikut :
1. Mengidentifikasi keberadaan dan menetapkan kadar α-tokoferol pada
minyak biji kelor menggunakan KCKT.
2. Mengetahui ada dan tidaknya pengaruh proses perolehan minyak terhadap
kandungan α-tokoferol didalamnya.
3. Mengetahui kualitas minyak biji kelor yang berdasarkan komponen
asam-asam lemak penyusun trigliseridanya.
1.4 MANFAAT PENELITIAN
Manfaat yang dapat diambil dari penelitian ini adalah :
1. Menambah khasanah ilmu pengetahuan tentang vitamin E dalam bidang
kesehatan serta referensi bagi penelitian selanjutnya.
2. Memberikan informasi mengenai potensi biji buah M.oleifera sebagai
5 UIN Syarif Hidayatullah Jakarta 2.1 KELOR (Moringa oleifera Lam.)
2.1.1 Klasifikasi Tanaman (USDA, 2013 )
Klasifikasi tanaman kelor adalah sebagai berikut :
Kingdom : Plantae
Sub kingdom : Tracheobionta
Divisio : Spermatophyta
Sub divisio : Magnoliophyta (Angiospermae)
Class : Magnoliopsida (Dicotyledonae)
Sub class : Dilleniidae
Ordo : Capparales
Familia : Moringaceae
Genus : Moringa
Species : Moringa oleifera Lam
2.1.2 Nama Daerah (Local Name)
Di Indonesia tanaman kelor memiliki banyak sebutan, diantaranya limaran,
kelintang (Jawa); Murong (Sumatera); Wona marungga, kelohe, parangge,
kewona (Nusa tenggara); rowe, kelo, wori (Sulawesi); Kanele, oewa herelo
(Maluku). Sedangkan diluar negeri dikenal dengan nama drumstick tree,
horseradish tree, Ben-oil tree, Clarifier tree, Moringa (Inggris); nugge (Kanada);
la ken (Cina); mungna, saijna, shajna (Hindi); Chum ngay (Vietnam); Ma-rum
(Thailand); Malunggay (Pilipina). (DepKes RI,1989 & Rollof A. et al.,2009)
2.1.3 Sinonim
Anoma moringa (L.) Lour., Guilandina moringa L., Hyperanthera moringa
(L.) Vahl, Hyperanthera pterygosperma Oken, Moringa edulis Medic., Moringa
erecta Salisb., Moringa moringa (L.) Small, Moringa myrepsica Thell., Moringa
nux-eben Desf., Moringa octogona Stokes, Moringa oleifera Lour., Moringa
parviflora Noronha, Moringa polygona DC., Moringa pterygosperma Gaertn.,
UIN Syarif Hidayatullah Jakarta 2.1.4 Morfologi
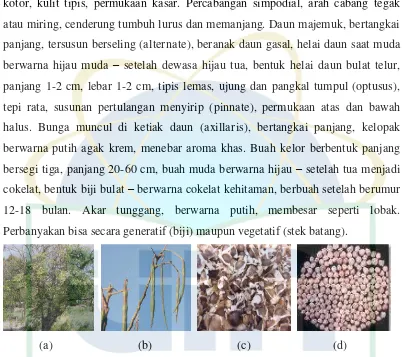
Kelor (M.oleifera) tumbuh dalam bentuk pohon dengan tinggi 7-12 m.
Batang berkayu (lignosus) dengan diameter 10-45 cm, tegak, berwarna putih
kotor, kulit tipis, permukaan kasar. Percabangan simpodial, arah cabang tegak
atau miring, cenderung tumbuh lurus dan memanjang. Daun majemuk, bertangkai
panjang, tersusun berseling (alternate), beranak daun gasal, helai daun saat muda
berwarna hijau muda – setelah dewasa hijau tua, bentuk helai daun bulat telur,
panjang 1-2 cm, lebar 1-2 cm, tipis lemas, ujung dan pangkal tumpul (optusus),
tepi rata, susunan pertulangan menyirip (pinnate), permukaan atas dan bawah
halus. Bunga muncul di ketiak daun (axillaris), bertangkai panjang, kelopak
berwarna putih agak krem, menebar aroma khas. Buah kelor berbentuk panjang
bersegi tiga, panjang 20-60 cm, buah muda berwarna hijau – setelah tua menjadi
cokelat, bentuk biji bulat – berwarna cokelat kehitaman, berbuah setelah berumur
12-18 bulan. Akar tunggang, berwarna putih, membesar seperti lobak.
Perbanyakan bisa secara generatif (biji) maupun vegetatif (stek batang).
(a) (b) (c) (d)
Gambar 1. (a) pohon, (b) buah, (c) biji/polong sebelum dikupas, (d) biji/polong
setelah dikupas.
(Sumber : Navie dan steve, 2010)
2.1.5 Tempat Tumbuh dan Distribusi Tanaman
Tanaman ini tumbuh di dataran rendah maupun dataran tinggi sampai di
ketinggian + 1000 m dpl, banyak ditanam sebagai tapal batas atau pagar di
halaman rumah atau ladang. Spesies ini di budidayakan secara luas sejak dahulu
di Roma, Yunani kuno dan Mesir dan saat ini meluas di seluruh daerah tropis dan
subtropis di dunia karena mempunyai toleransi rentang iklim yang luas. Tanaman
ini juga sangat banyak ditemukan di seluruh bagian dari negeri india dan
UIN Syarif Hidayatullah Jakarta 2.1.6 Kandungan Kimia
Daun kelor kaya asam askorbat, asam amino, sterol, glukosida isoquarsetin,
karoten, ramentin, kaemperol dan kaemferitin. Hasil analisis lain juga melaporkan
adanya kandungan senyawa-senyawa berikut: 75,0 mg/pelembab (moisture), 6,7
mg protein, 1,7 mg lemak (ekstrak eter.), 13,4 mg karbohidrat, 0,9 mg serat dan
2,3% bahan mineral: 440 mg kalsium, 70 mg fosfor, dan besi 7,0 mg/100 g daun.
Daunnya juga mengandung 11.300 IU karoten (prekursor vitamin A), vitamin B,
220 mg vitamin C dan 7,4 mg tokoferol /100g daun. Juga mengandung substansi
estrogenik dan esterase pektin. (Singh G.P et al.,2012)
Tabel 1. Kandungan kimia tumbuhan yang diisolasi dari Moringa oleifera Lam.
Bagian Kandungan Kimia
Akar 4-(α-L-rhamnopiranoksiloksi)-benzilglukosinolat dan
benzilglukosinolat
Batang 4-hidroksimellein, vanillin, -sitosteron, asam oktacosanik dan
-sitosterol
Kulit kayu 4-(α-L-rhamnopiranosiloksi)-benzilglukosinolat
Eksudat gum L-arabinosa, galaktosa,asam glukuronat, L-rhamnosa,
D-mannosa, D-xylosa dan leukoantosianin
Daun Glikosida niazirin, niazirinin dan three mustard oil glycosides,
4-[4’-O-asetil- α -L-rhamnosiloksi) benzil] isothiosianat,
niaziminin A dan B
Bunga yang matang
D-mannosa, D-glukosa, protein, asam askorbat, polisakarida
Keseluruhan biji
Nitril, isotiosianat, tiokarbanat, 0-[β’-hidroksi-γ’-(β’’
-hepteniloksi)]-propilundekanoat, 0-etil-4-[( α
-1-ramnosiloksi)-benzil] karbamat, metil-p-hidroksibenzoat dan -sitosterol
Biji yang tua Crude protein, Crude fat, karbohidrat, metionin, sistein, 4-(α
-L-ramnopiranosiloksi)-benzilglukosinolat, benzilglukosinolat, moringin, mono-palmitat and di-oleic trigliserida
UIN Syarif Hidayatullah Jakarta 2.1.7 Kegunaan/Khasiat
Moringa oleifera Lam telah digunakan untuk berbagai tujuan seperti kuliner
dan pengobatan, dan mendapat julukan sebagai ‘pohon ajaib’. Tumbuh di
berbagai belahan dunia dan dimanfaatkan sebagai sayur-sayuran dan makanan.
Daun dan polongnya memiliki nilai gizi yang cukup tinggi dengan berbagai
macam vitamin dan mineral. Daun dapat dimakan dengan dimasak maupun
dikeringkan, sedangkan buahnya memiliki rasa yang mirip seperti asparagus bisa
di rebus atau di goreng. Akarnya memiliki rasa pedas dan digunakan sebagai
pengganti lobak, namun kulit akar harus dikerok karena mengandung dua alkaloid
dan moringinine yang bersifat toksin.
Beberapa bagian dari tanaman ini juga digunakan sebagai obat tradisional
untuk pengobatan keluhan telinga, mata dan bronkial, infeksi kulit, demam,
radang perut, diare, sifilis dan gangguan syaraf. Misalnya, jus dari daun dipercaya
mampu menstabilkan tekanan darah, bunga-bunga digunakan untuk mengobati
radang, polong digunakan untuk nyeri sendi, dan akar digunakan untuk mengobati
rematik. Tanaman ini memiliki khasiat antibiotik dan juga mampu menjadi
pencegah kanker. Buah dan daun telah digunakan untuk mengatasi malnutrisi,
terutama di kalangan bayi dan ibu menyusui untuk meningkatkan produksi susu
dan juga mengatur ketidakseimbangan hormon tiroid. (Luqman S. et al.,2012).
Kandungan kimia dari berbagai bagian pohon seperti: niazimicin, niaiminin,
berbagai karbamat dan tiokarbamat telah menunjukkan aktivitas antitumor in
vitro. Biji dapat digunakan sebagai biosorben untuk menghilangkan kadmium dari
medium cair dan merupakan salah satu koagulan alami yang paling terkenal dari
semua yang ditemukan sejauh ini. Biji tersebut juga dianggap sebagai antipiretik,
dan dilaporkan menunjukkan aktivitas antimikroba (Luqman S. et al.,2012).
Selain itu biji tersebut juga mengandung 35-40% minyak yang kualitasnya mirip
dengan minyak zaitun yang tidak mudah tengik. (Navie dan steve, 2010)
Studi farmakologi yang dilakukan oleh Bhoomika et al, 2007 juga
menyatakan bahwa tanaman ini mempunyai beberapa efek farmakologi seperti
anti-inlamatory dari ekstrak etanol biji, efek antioksidan pada biji dan daun,
UIN Syarif Hidayatullah Jakarta 2.2 MINYAK DAN LEMAK (Ketaren, S. 1986)
Minyak dan lemak merupakan suatu ester dari gliserol dan asam lemak
dengan stuktur seperti dibawah ini :
CH2– O – C = O
Gambar 2. Struktur kimia trigliserida
Dimana R1, R2 dan R3 adalah rantai alkil dari asam-asam lemak.
2.2.1 Sumber Minyak dan Lemak (Ketaren, S. 1986)
Di alam, minyak atau lemak umumnya terdapat pada binatang dan
tumbuhan. Berbagai bahan pangan seperti daging, ikan, telur, susu, buah-buahan
dan lain-lain mengandung minyak atau lemak yang umumnya dikonsumsi oleh
manusia sehari-hari. Minyak atau lemak tersebut dikenal sebagai minyak atau
lemak tersembunyi (invisible fat), sedangkan minyak atau lemak yang telah
diekstrak dari bahan-bahan tersebut dan telah dimurnikan dikenal sebagai minyak
atau lemak kasat mata (visible fat).
Berdasarkan sumbernya, minyak dan lemak digolongkan sebagai berikut:
1. Sumber dari tanaman (minyak nabati)
a. Biji-bijian palawija, misalnya jagung, kapas, kedelai, dan lainnya.
b. Kulit buah tanaman tahunan, misalnya kelapa sawit, dan lainnya.
c. Biji-bijian dari tanaman tahunan, misalnya kelapa, cokelat, dan lainnnya.
2. Sumber dari hewan (minyak atau lemak hewani)
a. Susu hewan mamalia, misalnya sapi, kambing, dan lainnya.
b. Daging hewan ternak, misalnya lemak sapi, babi, dan lainnya.
UIN Syarif Hidayatullah Jakarta 2.2.2.Komposisi minyak dan lemak
Minyak dan lemak adalah suatu trigliserida yang tersusun dari gliserol dan
asam-asam lemak. Komposisi asam lemak sangat mempengaruhi kualitas
minyak/minyak yang didapat. Asam lemak penyusun trigliserida berupa campuran
dari berbagai macam asam lemak. (Ketaren, S. 1986)
Asam-asam lemak yang terdapat pada minyak atau lemak umumnya
adalah:
Tabel 2. Asam lemak jenuh
Nama sistematik Nama trivial Rumus molekul
Asam butanoat Asam butirat C3H7COOH
Asam heksanoat Asam kaproat C5H11COOH
Asam oktanoat Asam kaprilat C7H15COOH
Asam dekanoat Asam kapart C9H19COOH
Asam dodekanoat Asam laurat C11H23COOH
Asam tetradekanoat Asam miristat C13H27COOH
Asam heksadekanoat Asam palmitat C15H31COOH
Asam oktadekanoat Asam stearat C17H35COOH
Asam ikosanoat Asam arakidat C19H39COOH
Asam dokosanoat Asam behenat C21H43COOH
Asam tetrakosanoat Asam leignoserat C23H47COOH
Tabel 3. Asam lemak tak jenuh
Nama sistematik Nama trivial Rumus molekul
Asam tetrakedatoat-9-ena Asam miristoleat C13H27COOH, Δ9cis
Asam heksadekoat-9-ena Asam palmitoleat C15H29COOH, Δ9cis
Asam oktadekoat-9-ena Asam oleat C17H33COOH,Δ9cis
Asam oktadekoat-9, 12-diena Asam linoleat C17H31COOH,Δ9,Δ1βcis,cis
15-UIN Syarif Hidayatullah Jakarta 2.2.3 Proses Pengolahan Minyak dari tanaman
Ekstraksi adalah suatu cara untuk mendapatkan minyak atau lemak dari
bahan yang diduga mengandung minyak atau lemak. Pengambilan minyak dari
lemak dari jaringan mahluk hidup atau tumbuh-tumbuhan dapat dilakukan dengan
cara rendering, pengepresan secara mekanis dan ekstraksi pelarut (Ketaren 1986).
2.2.3.1 Rendering (Ketaren, S. 1986)
Rendering merupakan suatu cara ekstraksi minyak atau lemak dari bahan
yang di duga mengandung minyak atau lemak dengan kadar air yang tinggi. Pada
semua cara rendering, penggunaan panas adalah suatu hal yang spesifik, yang
bertujuan untuk menggumpalkan protein pada dinding sel bahan dan untuk
memecahkan dinding sel tersebut sehingga mudah ditembus oleh minyak atau
lemak yang terkandung di dalamnya.
Menurut pengerjaannya rendering dibagi dalam dua cara yaitu : 1) wet
rendering dan 2) dry rendering.
1. Wet Rendering
Wet rendering adalah proses rendering dengan penambahan sejumlah air
selama berlangsungnya proses tersebut. Cara ini dikerjakan pada ketel yang
terbuka atau tertutup dengan menggunakan temperatur yang tinggi serta tekanan
3-4 atmosfir. Penggunaan temperatur rendah dalam proses wet rendering
dilakukan jika diinginkan flavor netral dari minyak atau lemak. Bahan yang akan
di ekstraksi ditempatkan pada ketel yang diperlengkapi dengan alat pengaduk,
kemudian air ditambahkan dan campuran tersebut dipanaskan perlahan-lahan
sampai suhu 50 0C sambil diaduk. Minyak yang terekstraksi akan naik keatas dan
kemudian dipisahkan.
2. Dry Rendering
Dry Rendering adalah cara rendering tanpa penambahan air selama proses
berlangsung. Dry rendering dilakukan dalam ketel yang terbuka dan diperlengkapi
dengan steam jacket serta alat pengaduk (agitator). Bahan yang diperkirakan
mengandung minyak atau lemak dimasukkan kedalam ketel tanpa penambahan
air. Bahan tadi dipanasi sambil diaduk. Pemanasan dilakukan pada suhu 220 0F
UIN Syarif Hidayatullah Jakarta
diendapkan pada dasar ketel. Minyak atau lemak yang dihasilkan dipisahkan dari
ampas yang telah mengendap dan pengambilan minyak dilakukan dari bagian atas
ketel.
2.2.3.2 Pengepresan Mekanis (Mechanical Expression) (Ketaren, S. 1986)
Pengepresan mekanis merupakan suatu cara ekstraksi minyak atau lemak,
terutama untuk bahan yang berasal dari biji-bijian. Cara ini dilakukan untuk
memisahkan minyak dari bahan yang berkadar minyak tinggi (30-70 persen).
Pada pengepresan mekanis ini diperlukan perlakuan pendahuluan tersebut
mencakup pembuatan serpih, perajangan dan penggilingan serta tempering atau
pemasakan. Dua cara yang umum dalam pengepresan mekanis, yaitu :
1. Pengepresan Hidraulik (Hydraulic Pressing)
Pada cara hydraulic pressing, bahan dipres dengan tekanan sekitar 2000
pound/inch2 (140,6 kg/cm = 136 atm). Banyaknya minyak atau lemak yang dapat
diekstraksi tergantung dari lamanya pengepresan, tekanan yang dipergunakan,
serta kandungan minyak dalam bahan asal.
2. Pengepresan Berulir (Expeller Pressing)
Cara expeller pressing memerlukan perlakuan pendahuluan yang terdiri dari
proses pemasakan atau tempering. Proses pemasakan berlangsung pada
temperatur 240 0F (115,5 0C) dengan tekanan sekitar 15-20 ton/inch2. Kadar air
minyak atau lemak yang dihasilkan berkisar sekitar 2,5-3,5 persen, sedangkan
bungkil yang dihasilkan masih mengandung minyak sekitar 4-5 persen.
2.2.3.3 Ekstraksi Dengan Pelarut (Solvent Extracion) (Ketaren, S. 1986)
Prinsip dari proses ini adalah ekstraksi dengan melarutkan minyak dalam
pelarut minyak dan lemak. Pada cara ini dihasilkan bungkil dengan kadar minyak
yang rendah yaitu sekitar 1 persen atau lebih rendah, dan mutu minyak kasar yang
dihasilkan cenderung menyerupai hasil dengan cara expeller pressing, karena
sebagian fraksi bukan minyak akan ikut terekstraksi. Pelarut minyak atau lemak
yang biasa dipergunakan dalam proses ekstraksi dengan pelarut menguap adalah
petroleum eter, gasoline karbon disulfida, karbon tetraklorida, benzene dan
UIN Syarif Hidayatullah Jakarta 2.3 METODE EKSTRAKSI (Ketut Ristiasa et al., 2000)
a. Maserasi
Maserasi merupakan cara penyarian sederhana. Maserasi dilakukan dengan
cara merendam serbuk simplisia dalam cairan penyari dengan beberapa kali
pengocokan atau pengadukan pada temperatur ruang (kamar). Cairan penyari akan
menembus dinding sel atau masuk ke dalam rongga sel yang mengandung zat
aktif, zat aktif tersebut akan larut karena adanya perbedaan konsentrasi antara
larutan zat aktif di dalam sel dengan yang di luar sel. Larutan yang lebih pekat (di
dalam sel) didesak keluar sel, masuk ke dalam larutan di luar sel. Peristiwa
tersebut berulang sehingga terjadi keseimbangan konsentrasi antara larutan di luar
sel dan di dalam sel. Keuntungan cara penyarian dengan maserasi adalah cara
pengerjaan dan peralatan yang digunakan sederhana dan mudah diusahakan.
b. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai sempurna
(exhaustive extraction) yang umumnya dilakukan pada temperatur ruangan.
Prinsip perkolasi adalah serbuk simplisia ditempatkan dalam suatu bejana silinder
yang bagian bawahnya diberi sekat berpori. Cairan penyari dialirkan dari atas ke
bawah melalui serbuk tersebut, kemudian melarutkan zat aktif dari sel-sel yang
dilalui sampai mencapai keadaan jenuh.
c. Soklet
Sokletasi merupakan ekstraksi menggunakan pelarut yang selalu baru
umumnya dilakukan alat khusus sehingga terjadi ekstraksi kontinu dengan jumlah
pelarut relatif konstan dengan adanya pendingin balik.
d. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada
temperatur yang lebih tinggi dari temperatur ruangan, yaitu secara umum
UIN Syarif Hidayatullah Jakarta 2.4 TOKOFEROL (VITAMIN E)
Rumus kimia : C29H50O2
Pemerian : Praktis tidak berbau dan tidak berasa. Bentuk alfa
tokoferol dan alfa tokoferol asetat berupa minyak
kental jernih, warna kuning atau kuning kehijauan.
Golongan alfa tokoferol tidak stabil terhadap udara
dan cahaya terutama dalam suasana alkalis. Bentuk
ester stabil terhadap udara dan cahaya, tetapi tidak
stabil dalam suasana alkalis.
Sinonim : 3, 4-dihydro-2, 5, 7, 8-tetramethyl-2-(4,8,12-trimethyl-
terdecyl)-2H-1-benzopiran-6-ol; 2,5,7,8
tetramethyl-2- (4’, 8’, 1β’–trimethyldecyl) -6-chromanol; α
-tochoferol; 5,7,8-trimethyltocol; vitamin antisterilitas;
Eprolin S; Epsilan; Ephynal; Syntopherol; E-vimin;
Evipherol; Etavil; Phytogermine; Profecundin;
Tocopharm; Viprimol; Viteolin; Esorb; Vascuals;
Covitol; Evion.
Kelarutan : tidak larut dalam air, larut dalam etanol, dapat
bercampur dengan eter, dengan aseton, dengan
minyak nabati dan dengan kloroform.
Kegunaan/khasiat : sebagai antioksidan di dalam minyak sayur dan
lemak/minyak, untuk pengobatan defisiensi vitamin
E, dan mencegah degenerasi otot. (Soesilo, 1995)
Vitamin E adalah salah satu fitonutrien penting dalam minyak makan.
Vitamin ini secara alami memiliki 8 isomer yang dikelompokkan dalam 4
tokoferol α, , , δ dan 4 tokotrienol α, , , δ homolog. Suplemen vitamin E yang
ada di pasaran umumnya tersusun atas tokoferol dan tokotrienol yang diyakini
merupakan atioksidan potensial (Winarsi, 2007). Alfa-tokoferol adalah bentuk
vitamin E paling aktif, yang digunakan pula sebagai standar pengukuran vitamin
E dalam makanan. Bentuk sintetik vitamin E mempunyai aktivitas biologik 50%
UIN Syarif Hidayatullah Jakarta
Gambar 3. Struktur kimia tokoferol
R1 R2 Compound
CH3 CH3 α
CH3 H
H CH3
H H δ
Tabel 4. Keterangan nama senyawa berdasarkan R1 dan R2
(sumber : Ruperez et al., 2001)
Menurut Almatsier (2004) ada empat jenis tokoferol yang penting dalam
makanan yaitu α, , , δ tokoferol. Karakteristik kimia utamanya adalah bertindak
sebagai antioksidan dengan adanya gugus fenol pada cincin 6-kromanol.
Tokoferol terdiri atas struktur cincin 6-kromanol dengan rantai samping jenuh
panjang enam belas karbon fitol. Perbedaan antarjenis tokoferol terletak pada
jumlah dan posisi gugus metal struktur cincin.
Takaran yang dianjurkan untuk konsumsi vitamin E adalah; anak-anak: 4-7
mg/hari, wanita dewasa: 15 mg/hari, pria dewasa : 15 mg/hari. Tolerable Upper
Intake Levels (ULs) atau angka tertinggi dari nilai zat gizi yang bila dikonsumsi
tiap hari tidak membahayakan kesehatan untuk dewasa >19 tahun menurut food
and nutrition Board and Institute of medicine (IOM) (2000) adalah 1000 mg/hari,
yang di dapatkan dari suplemen.
2.4.1 Tokoferol sebagai Antioksidan
Vitamin E adalah vitamin larut lemak yang sangat berguna selain sebagai
antioksidan. Yang terpenting dan paling diakui, peran dari vitamin E yaitu
melindungi polyunsaturated fatty acids (PUFAs) seperti asam oleat, asam
UIN Syarif Hidayatullah Jakarta
tubuh sebagai antioksidan alami yang membuang radikal bebas dan molekul
oksigen, yang penting dalam mencegah peroksidasi membran asam lemak tak
jenuh (Burke, 2007).
Tokoferol, terutama α-tokoferol merupakan antioksidan yang mampu mempertahankan integritas membran. Senyawa tersebut dilaporkan bekerja
sebagai scavenger radikal bebas oksigen, peroksida lipid, dan oksigen singlet
(Winarsi, 2007). Menurut Archerio et al. (199β) α-tokoferol merupakan bentuk
suplemen vitamin E yang paling banyak.
Vitamin E atau α-tokoferol merupakan antioksidan yang larut dalam lemak. Sebagai antioksidan vitamin E berfungsi sebagai donor ion hidrogen yang mampu
merubah radikal peroksil (hasil peroksida lipid), menjadi radikal tokoferol yang
kurang reaktif, sehingga tidak mampu merusak rantai asam lemak (Winarsi,
2007). Di samping itu menurut Salonen et al. (1997), vitamin E dan vitamin C dan
karoten atau kombinasinya dapat menghambat peroksida lipid secara in vivo.
Mekanisme antioksidan tokoferol, termasuk transfer satu atom hidrogen dari
grup 6-hidroksil pada cincin kroman, serta inaktivasi singlet oksigen dan spesies
reaktif lainnya. Rantai fitil tokoferol terikat pada membran sel bilayer, sedangkan
cincin kroman yang aktif terletak pada permukaan sel. Struktur yang unik tersebut
menyebabkan tokoferol dapat bekerja secara efektif sebagai antioksidan, dan
dapat diregenerasi melalui reaksi dengan antioksidan lain seperti asam askorbat.
2.5 KROMATOGRAFI CAIR KINERJA TINGGI (KCKT)
Kromatografi cair kinerja tinggi (KCKT) merupakan sistem pemisahan
dengan kecepatan dan efisiensi yang tinggi. Hal ini karena didukung oleh
kemajuan dalam teknologi kolom, sistem pompa tekanan tinggi, dan detektor yang
sangat sensitif dan beragam. KCKT mampu menganalisa berbagai cuplikan secara
kualitatif maupun kuantitatif, baik dalam komponen tunggal maupun campuran
(Soesilo, 1995).
Kegunaan umum KCKT adalah untuk pemisahan sejumlah senyawa
organik, anorganik, maupun senyawa biologis, analisis ketidakmurnian
(impurities) dan analisis senyawa-senyawa yang tidak mudah menguap
senyawa-UIN Syarif Hidayatullah Jakarta
senyawa tertentu seperti asam-asam amino, asam-asam nukleat dan
protein-protein dalam cairan fisiologis, menentukan kadar senyawa-senyawa aktif obat
dan lain-lain.
Metode dalam kromatografi cair dibagi atas dua macam :
a. Kromatografi Cair Retensif
Pemisahan dicapai melalui interaksi antara zat terlarut dengan fase diam.
Tipe ini mencakup fase normal, fase terbalik dan kromatografi ion.
b. Kromatografi Cair Non-retensi
Pemisahan yang dicapai tergantung pada perbedaan besar molekul zat
terlarut dimana terjadi antara zat terlarut dengan pori-pori yang terdapat di
permukaan fase diam.
2.5.1 Keuntungan KCKT
a. Waktu analisa cepat
Waktu yang diperlukan biasanya kurang dari satu jam, seringkali hanya
15-30 menit, untuk analisa yang mudah diperlukan waktu kurang dari 5 menit.
b. Daya pisahnya baik
c. Peka
Kepekaanya sangat tergantung pada jenis detektor dan eluen yang
digunakan
d. Pemilihan kolom dan eluen sangat bervariasi
e. Kolom dapat dipakai kembali
f. Mudah untuk molekul besar dan kecil
g. Mudah untuk memperoleh kembali cuplikan, tidak seperti kebanyakan
detektor pada kromatografi gas, detektor KCKT tidak merusak komponen
zat yang dianalisis, sehingga zat yang telah dielusi dapat dikumpulkan
dengan mudah setelah melewati detektor.
h. Dapat menghitung sampel dengan kadar yang sangat rendah, hal ini sangat
bergantung kepada detektor yang digunakan, namun detektor KCKT dapat
UIN Syarif Hidayatullah Jakarta 2.5.2 Cara Kerja KCKT
Kromatografi merupakan teknik yang mana solut atau zat-zat terlarut
terpisah oleh perbedaan kecepatan elusi, dikarenakan solut-solut ini melewati
suatu kolom kromatografi. Pemisahan solut-solut ini diatur oleh distribusi dalam
fase gerak dan fase diam. Penggunaan kromatografi cair membutuhkan
penggabungan secara tepat dari berbagai macam kondisi operasional seperti jenis
kolom, fase gerak, panjang dan diameter kolom, kecepatan alir fase gerak, suhu
kolom, dan ukuran sampel (Rohman, 2007).
Prinsip kerja KCKT adalah sebagai berikut: dengan bantuan pompa fasa
gerak cair dialirkan melalui kolom ke detektor. Cuplikan dimasukkan ke dalam
aliran fasa gerak dengan cara penyuntikan. Di dalam kolom terjadi pemisahan
komponen-komponen campuran. Karena perbedaan kekuatan interaksi antara
solut-solut terhadap fasa diam. Solut-solut yang kurang kuat interaksinya dengan
fasa diam akan keluar dari kolom lebih dulu. Sebaliknya, solut-solut yang kuat
berinteraksi dengan fasa diam maka solut-solut tersebut akan keluar kolom
dideteksi oleh detektor kemudian direkam dalam bentuk kromatogram, jumlah
peak menyatakan konsentrasi komponen dalam campuran. Komputer dapat
digunakan untuk mengontrol kerja sistem HPLC dan mengumpulkan serta
mengolah data hasil pengukuran HPLC.
2.5.3 Instrumentasi Kromatografi Cair Kinerja Tinggi
Instrumentasi KCKT pada dasarnya terdiri atas delapan komponen pokok
yaitu: wadah fase gerak, sistem penghantaran fase gerak (pompa), alat untuk
memasukkan sampel (injektor), kolom, detektor, wadah penampung buangan fase
gerak, tabung penghubung, dan suatu komputer atau integrator atau perekam.
UIN Syarif Hidayatullah Jakarta
Gambar 4. Diagram Alat dan Komponen KCKT
(Sumber : Harmita, 2006)
1. Wadah Fase Gerak
Wadah fase gerak terbuat dari bahan yang inert terhadap fase gerak. Bahan
yang umum digunakan adalah gelas dan baja anti karat. Daya tampung
wadah harus lebih besar dari 500 mL, yang dapat digunakan selama 4 jam
untuk kecepatan alir yang umumnya 1-2 mL/menit.
2. Pompa
Untuk mengerakkan/mengalirkan fase gerak (eluen) melalui kolom
diperlukan pompa. Pompa harus mampu menghasilkan tekanan 6000 psi pada
kecepatan alir 0,1–10 mL/menit. Tujuan penggunaan pompa atau sistem
penghantaran fase gerak adalah untuk menjamin proses penghantaran fase
gerak berlangsung secara tepat, reprodusibel, konstan, dan bebas dari
gangguan. Pompa ada 2 jenis yaitu pompa volume konstan dan pompa
tekanan konstan. Pompa terbuat dari bahan yang inert terhadap semua pelarut.
Bahan yang umum digunakan adalah gelas baja antikarat dan teflon.
3. Injektor
Injektor berfungsi untuk memasukkan cuplikan (sampel) ke dalam kolom.
Suatu injektor dikatakan ideal bila memenuhi kriteria : mudah digunakan,
reprodusibel, dapat menahan tekanan balik yang tinggi.
4. Kolom
Kolom berfungsi untuk memisahkan masing-masing komponen. Kolom
adalah jantung kromatografi. Berhasil atau gagalnya suatu analisis tergantung
pada pemilihan kolom dan kondisi percobaan yang sesuai. Hal-hal yang perlu
UIN Syarif Hidayatullah Jakarta
pengisi kolom, fase gerak dan tekanan kolom. Kolom dapat dibagi menjadi
dua kelompok :
a. Kolom analitik: diameter khas adalah 2-6 mm. Panjang kolom tergantung
pada jenis kemasan. Untuk kemasan pelikel biasanya panjang kolom
50-100 cm. Untuk kemasan mikropartikel berpori, umumnya 10-30 cm.
b. Kolom preparatif: umumnya memiliki diameter 6 mm atau lebih besar dan
panjang kolom 25-100 cm.
Kolom umumnya dibuat dari stainless steel dan biasanya dioperasikan pada
temperatur kamar, tetapi bisa juga digunakan temperatur lebih tinggi,
terutama untuk kromatografi penukar ion dan kromatografi eksklusi.
5. Detektor
Detektor berfungsi untuk mendeteksi adanya komponen cuplikan dalam
aliran yang keluar dari kolom dan mengukur jumlahnya. Bagian ini
diletakkan sesudah kolom dan dihubungkan dengan pencatat.
Detektor-detektor yang baik memiliki sensitifitas yang tinggi, gangguan (noise) yang
rendah, kisar respons linier yang luas, dan memberi tanggapan/respon untuk
semua tipe senyawa. Jenis detektor yang dapat digunakan antara lain, detektor
spektrofotometri ultraviolet-visibel, detektor photodiobe-array (PDA),
detektor fluoresensi, detektor indeks kimia dan detektor elektrokimia.
6. Integrator/Pengolah Data
Alat pengumpul data seperti komputer, integrator atau rekorder, dihubungkan
dengan detektor. Alat ini akan mengukur sinyal elektronik yang dihasilkan
oleh detektor lalu memplotkannya sebagai suatu kromatogram yang
selanjutnya dapat dievaluasi oleh analis. Integrator berfungsi untuk
menghitung luas puncak. (Gandjar, 2007; Jhonson, 1991)
7. Fase Gerak
Dalam KCKT variasi fase gerak sangat beragam dalam hal kepolaran dan
selektivitasnya terhadap komponen dalam sampel. Fase gerak atau eluen
biasanya terdiri atas campuran pelarut yang dapat bercampur yang secara
keseluruhan berperan dalam daya elusi dan resolusi. Daya elusi dan resolusi
ini ditentukan oleh polaritas keseluruhan pelarut, polaritas fase diam, dan sifat
UIN Syarif Hidayatullah Jakarta
dilakukan dengan cara isokratik (komposisi fase gerak tetap sama selama
elusi) atau dengan cara gradien (komposisi fase gerak berubah-ubah selama
elusi). Elusi gradien digunakan untuk meningkatkan resolusi campuran yang
kompleks (sampel dengan kisaran polaritas yang luas). Terdapat dua
pemisahan dalam KCKT yaitu fase normal dan fase terbalik, berdasarkan
polaritas fase gerak dan fase diam yang digunakan. Untuk fase normal (fase
diam lebih polar daripada fase gerak), kemampuan elusi meningkat dengan
meningkatnya polaritas pelarut. Sementara untuk fase terbalik (fase diam
kurang polar daripada fase gerak), kemampuan elusi menurun dengan
meningkatnya polaritas pelarut. Secara umum eluen yang baik harus
mempunyai sifat murni, tidak bereaksi dengan kolom, dapat melarutkan
cuplikan, selektif terhadap komponen, viskositasnya rendah, harganya relatif
murah, dan dapat memisahkan zat dengan baik. (Gandjar, 2007; Wellings,
2006).
2.5.4 Analisa dalam Kromatografi Cair KinerjaTinggi (Harmita, 2006)
Analisa KCKT dapat dilakukan secara kualitatif dan kuantitatif
2.5.4.1 Analisa Kualitatif
Cara yang terbaik adalah dengan menggunakan metode waktu relatif :
Rist =
Keterangan : tRi = waktu retensi komponen zat
tRst = waktu retensi standar
2.5.4.2 Analisa Kuantitatif
Tahapan analisis kuantitatif adalah sebagai berikut :
a. Membuat spektrum serapan komponen-komponen yang ada dalam
sampel,
b. Mencari panjang gelombang optimum untuk campuran komponen zat
dalam sampel,
c. Mencari fase gerak yang sesuai agar komponen-komponen tersebut
UIN Syarif Hidayatullah Jakarta
Dasar perhitungan kuantitatif untuk suatu komponen yang dianalisis
adalah dengan mengukur luas atau tinggi puncaknya. (Harmita, 2006). Ada
beberapa metode yang dapat digunakan :
a. Baku luar (dengan kurva kalibrasi dan perbandingan luas puncak)
Larutan baku dengan berbagai konsentrasi disuntikkan dan diukur luas
puncaknya, buat kurva kalibrasi antara luas puncak terhadap konsentrasi,
kadar sampel diperoleh dengan cara memplot luas puncak terhadap
konsentrasi. Kadar sampel diperoleh dengan cara memplot luas puncak
sampel pada kurva kalibrasi baku atau dengan perbandingan langsung.
CS =
x Cst
Keterangan : Cs : konsentrasi sampel
Cst : konsentrasi standar
As : luas puncak sampel
Ast : luas puncak standar
Kekurangan metode ini adalah diperlukan baku yang murni serta ketelitian
dalam pengenceran dan penimbangan.
b. Baku dalam
Sejumlah baku dalam ditambahkan pada sampel dan standar. Kemudian
larutan campuran komponen standar dan baku dalam dengan konsentrai
tertentu disunikkan dan di hitung perbandingan luas puncak ke dua zat
tersebut. Buat kurva baku antara perbandingan luas puncak terhadap
konsentrasi komponen standar, kadar sampel diperoleh dengan memplot
perbandingan luas puncak komponen sampel dengan baku dalam pada kurva
standar, keuntungan menggunakan cara ini adalah kesalahan volume injeksi
dieliminer, kesulitan cara ini adalah diperlukan baku dalam yang tepat.
2.6 IDENTIFIKASI KANDUNGAN MINYAK
2.8.1 Gas Chromatography-Mass Spectrometry
Kromatografi gas-spektrometri massa atau sering disebut GC-MS (Gas
Chromatography-Mass Spectrometry) adalah teknik analisis yang
menggabungkan dua metode analisis, yaitu Kromatografi Gas dan Spektrometri
UIN Syarif Hidayatullah Jakarta
secara fisik menjadi bentuk molekul-molekul yang lebih kecil (hasil berupa
kromatogram). Sedangkan spektroskopi massa adalah metode analisis, dimana
sampel yang dianalisis akan diubah menjadi ion gasnya, dan massa dari
ion-ion tersebut dapat diukur berdasarkan hasil deteksi berupa spektrum massa
(Khopkar, 1990). Spektrometri massa merupakan sebuah detektor umum untuk
kromatografi gas, karena setiap senyawa yang dapat melewati kromatografi gas
diubah menjadi ion dalam spektrometri massa. Tujuan dari menggabungkan kedua
instrument ini yaitu agar pengoperasian kromatografi gas dan spektrometri massa
dapat lebih baik lagi tanpa menurunkan kinerja keduanya (Willard et al.,1988).
Pemisahan komponen senyawa dalam GC-MS terjadi di dalam kolom GC
dengan melibatkan dua fase, yaitu fase diam dan fase gerak. Fase diam adalah zat
yang ada didalam kolom sedangkan fase gerak adalah gas pembawa (Helium
ataupun Hidrogen dengan kemurnian tinggi). Proses pemisahan dapat terjadi
karena terdapat perbedaan kecepatan alir dari tiap molekul didalam kolom.
Selanjutnya hasil pemisahan tersebut masuk ke dalam ruang MS yang berfungsi
sebagai detektor (Hermanto, 2009). Instrumen GC-MS terbagi menjadi
bagian-bagian penting pada instrument Gas Chromatography dan bagian-bagian-bagian-bagian penting
pada instrument Mass Spectrometry. Bagian-bagian pada instrument pada Gas
Chromatography terdiri dari:
- Pengatur aliran gas (Gas Flow Controller)
- Tempat injeksi sampel (Injector)
- Tempat terjadinya pemisahan (Kolom)
- Penghubung antara Gas Chromatography dan Mass Spectrometry
(Interface)
Sedangkan bagian-bagian dari Mass Spectrometry terdiri dari:
- Tempat masuk sampel (Interface)
- Sumber Ion (Ion source)
- Pompa vakum (Vacuum pump)
- Penganalisis massa (Mass analyzer)
- Detektor (Electron multiple detector)
24 UIN Syarif Hidayatullah Jakarta 3.1 TEMPAT DAN WAKTU PENELITIAN
Penelitian dilaksanakan mulai bulan Maret hingga Juni 2013 di
Laboratorium Produk Alam, Bidang Botani dan Mikrobiologi - Pusat Penelitian
Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) yang berada di jalan Raya
Jakarta – Bogor Km 46, Cibinong; dan di laboratorium Instrumen, Balai Besar
Industri Agro yang berada di Jl. Ir. H. Juanda No. 11, Bogor 16122; serta di
Laboraturium Forensik Lantai 3 Markas Besar POLRI Kebayoran Baru Jakarta
Selatan.
3.2 BAHAN DAN ALAT
3.2.1 Bahan Uji
Bahan uji yang digunakan adalah biji kelor (Moringa oleifera Lam) yang
sudah masak +1,7 kg dengan spesifikasi kulit warna coklat kehitaman dan isi
berwarna putih kotor dengan bau tidak spesifik dan rasa sepah yang berasal dari
Jepara, Jawa Tengah. Bahan sebelumnya telah dilakukan determinasi dan
authentication specimen di Herbarium Bogoriense, Pusat Penelitian Biologi LIPI,
Bogor, Jawa Barat.
3.2.2 Bahan Kimia
Bahan-bahan yang digunakan dalam penelitian ini adalah n-heksan, Na2SO4
anhidrat, standar α-Tokoferol (> 96%) grade HPLC (Sigma), etanol pro analis
(Merck), Tetrahydrofuran (THF) pro analis (Merck), metanol grade HPLC (J.T.
Baker).
3.2.3 Alat
Timbangan bahan dan timbangan analitik; grinder; rotary evaporator (Eyela
N-1000); oven; seperangkat alat kempa hidrolis (manual); seperangkat instrument
HPLC (Perkin Elmer series 200) yang dilengkapi dengan pompa, kolom
UIN Syarif Hidayatullah Jakarta
pemroses data dan interfase; seperangkat instrumen GCMS (Agilent Technologies
6890 N); labu Erlenmeyer; corong; botol vial; pipet tetes; beaker gelas; dan
alat-alat gelas lainnya.
3.3 PROSEDUR KERJA
Prosedur kerja yang akan dilakukan dalam penelitian ini meliputi :
3.3.1 Penyiapan simplisia
3.3.2 Proses perolehan minyak
3.3.3 Pembuatan larutan induk dan deret standar α-tokoferol
3.3.4 Validasi Metode Analisa α-Tokoferol
3.3.5 Analisis α-tokoferol pada minyak biji kelor dengan KCKT
3.3.6 Analisis kandungan minyak biji kelor dengan GCMS
3.3.1 Penyiapan Simplisia
Penyiapan simplisia biji kelor dilakukan dengan :
1. Buah yang sudah masak dikupas dan dikeluarkan biji-bijinya
2. Kemudian biji dikeringkan dengan udara (kering angin)
3. Kemudian kulit biji dikupas/dibuang kulit arinya
3.3.2 Proses perolehan Minyak
3.3.2.1 Ekstraksi dengan pelarut
1. Ditimbang sebanyak 500 gram biji kelor yang telah dikupas kemudian di
giling menggunakan alat grinder
2. Sampel yang sudah halus dibagi menjadi 3 untuk pengerjaan secara
triplo, masing-masing 130 g sampel halus dimaserasi dengan pelarut
n-heksan sebanyak 170 mL untuk menarik kandungan minyak dari dalam
sampel, maserasi dilakukan berulang (kontinyu) sampai n-heksan
rendaman yang dipisahkan dari sampel jernih/tidak berwarna (kandungan
minyak dalam sampel sudah habis/hampir habis).
3. Selanjutnya ditambahkan Na2SO4 anhidrat untuk menghilangkan sisa air
UIN Syarif Hidayatullah Jakarta
4. Ekstrak n-heksan hasil maserasi kemudian di uapkan dengan Rotary
vacum Evaporator suhu < 40 0C hingga di dapatkan minyak kental dan
sudah tidak ada aroma n-heksan.
5. Minyak yang diperoleh kemudian dihitung rendemen minyaknya,
rendemen minyak didapat berdasarkan berat minyak lemak yang
diperoleh perberat sampel x 100%.
6. Minyak kental yang dihasilkan siap untuk di identifikasi kandungan
α-tokoferolnya menggunakan alat KCKT.
3.3.2.2 Pengepresan Mekanis
1. Sampel biji kelor ditimbang sebanyak 130 g untuk di keringkan di oven
dengan variasi suhu 40 oC, 80 oC dan 120 oC. Pengeringan dilakukan
selama 2 jam dan masing-masing suhu dilakukan secara triplo. Tujuan
pemanasan ini adalah untuk menghilangkan sisa air dalam sampel biji
kelor dan juga untuk memecahkan sel-sel sehingga memudahkan
pengeluaran minyak pada saat dilakukan pengempaan. (Ketaren, S, 1986)
2. Masing-masing sampel yang sudah dioven ditimbang kembali dan
dibandingkan dengan berat awal untuk mengetahui kadar air yang hilang
berdasarkan pengaruh masing-masing suhu.
3. Masing-masing sampel di kempa menggunakan alat kempa hidrolis
manual dan minyaknya ditampung lalu ditimbang dan dihitung rendemen
minyak yang dihasilkan dari masing-masing suhu.
% Rendemen ekstrak
x 100%
4. Minyak yang diperoleh dari pengempaan kemudian diuji kadar
α-tokoferolnya menggunakan alat KCKT.
3.3.3 Pembuatan larutan induk dan deret standar α-tokoferol
α-Tokoferol ditimbang seksama 25 mg lalu dimasukkan ke dalam labu
ukur 50 mL dan dilarutkan dengan etanol sampai tanda batas, dikocok hingga
homogen. Diperoleh konsentrasi larutan induk standar α-tokoferol (larutan A)
sebesar 0,5 mg/mL (500 µg/mL = 500 ppm). Kemudian dilakukan pengenceran
UIN Syarif Hidayatullah Jakarta
standar 500 µg/mL lalu dimasukkan kedalam labu ukur 25 mL dan dilarutkan
dengan etanol:THF (1:1) sampai tanda batas. Dari larutan standar 10 ppm (larutan
B) dilakukan pengenceran (pembuatan deret standar) dengan konsentrasi 0,5; 1; 2;
5 dan 10 µg/mL.
3.3.4 Validasi Metode Analisa α-Tokoferol dalam ekstrak (Harmita, 2006)
a. Uji linieritas dan pembuatan kurva kalibrasi
Seri larutan standar α-tokoferol dengan konsentrasi 0,5-10 µg/mL
masing-masing disuntikkan sebanyak 20 µL ke dalam instrumen KCKT pada
kondisi (fase gerak dan kecepatan alir) terpilih. Dari data pengukuran
dibuat kurva kalibrasi dengan menggunakan persamaan garis regresi linear
(y=a+bx). Linieritas dari kurva kalibrasi dilihat dengan menghitung
koefisien korelasi (r) dari persamaan garis linier.
b. Uji batas deteksi (LOD) dan batas kuantifikasi (LOQ)
LOQ dihitung melalui persamaan garis regresi linier dari kurva kalibrasi,
dengan rumus :
Sedangkan nilai batas deteksi (LOD) diperoleh dengan rumus :
25 mL menggunakan etanol:THF (1:1). Masukkan ke dalam vial kemudian
injeksikan sebanyak 20,0 µL ke alat KCKT dan dicatat luas puncaknya.
UIN Syarif Hidayatullah Jakarta
% recovery = x 100%
a = kadar terukur sampel yang ditambahkan spike
b = kadar rata-rata sampel yang tidak ditambahkan spike
c = penambahan spike
3.3.5 Analisis α-Tokoferol pada minyak biji kelor dengan KCKT
Sampel berupa minyak dari biji buah kelor ditimbang seksama sebanyak
0,25 g dan dilarutkan dengan etanol 10 mL, lalu dicukupkan volumenya hingga 25
mL menggunakan etanol:THF (1:1). Sampel dimasukkan ke dalam vial kemudian
injeksikan sebanyak 20,0 µL ke alat KCKT dan dicatat luas puncaknya.
Percobaan diulang sebanyak dua kali. Berikut ini spesifikasi dan pengkondisian
alat KCKT :
Nama alat : Perkin Elmer series 200
Detektor : Spektrofotometer UV/VIS
Panjang gelombang : 280 nm
Kolom : Kolom LiChosper® C18
Panjang kolom : 25 cm
Diameter kolom : 5 µm
Pelarut pembawa : Metanol Grade HPLC
Suhu kolom : 25 oC
Kecepatan aliran : 1,0 mL/min
Instansi : Laboratorium Instrumen Balai Besar Industri Agro
Kadar α-tokoferol dalam sampel dihitung berdasarkan persamaan kurva
kalibrasi yang telah diperoleh.
Y = a + bx
Y = Luas puncak
X = konsentrasi α-tokoferol µg/mL
Konsentrasi α-tokoferol dalam sampel minyak menjadi :
X =
Sehingga kadar α-tokoferol dihitung dengan rumus :
UIN Syarif Hidayatullah Jakarta 3.3.6 Analisis kandungan minyak biji kelor dengan GCMS
Sebanyak 0,5 g minyak dilarutkan dengan Etil asetat 5 mL lalu disuntikkan
ke alat kromatografi gas. Berikut ini spesifikasi dan pengkondisian alat
Kromatografi Gas :
Nama alat : GC – 6890N Network GC system Agilent
Technologies
Detektor : MS
Kolom : Kolom Kapiler HP-5MS
Bahan pengisi kolom : (5% - phenyl)-Methylpolysiloxane
Panjang kolom : 30 m
Diameter kolom : 0,25 mm
Gas pembawa : Helium
Suhu kolom : 290 oC
Suhu detektor : 250 oC
Suhu injektor : 290 oC
Kecepatan aliran : 1,0 mL/min
30 UIN Syarif Hidayatullah Jakarta 4.1 HASIL PERCOBAAN
1. Perolehan minyak
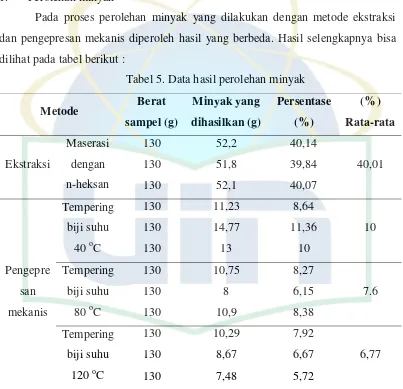
Pada proses perolehan minyak yang dilakukan dengan metode ekstraksi
dan pengepresan mekanis diperoleh hasil yang berbeda. Hasil selengkapnya bisa
dilihat pada tabel berikut :
Tabel 5. Data hasil perolehan minyak
UIN Syarif Hidayatullah Jakarta
Gambar 5. Rendemen minyak yang diperoleh dari masing-masing metode
Keterangan :
A = metode ekstraksi, maserasi dengan n-heksan
B = metode kempa mekanis, suhu pengeringan sampel 40 oC
C = metode kempa mekanis, suhu pengeringan sampel 80 oC
D = metode kempa mekanis, suhu pengeringan sampel 120 oC
2. Validasi metode analisis
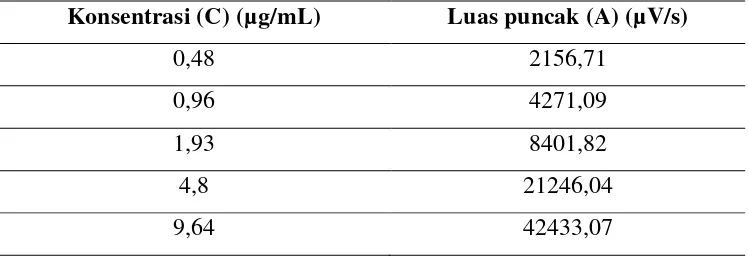
a. Pembuatan kurva kalibrasi dan uji linearitas
Persamaan garis kurva kalibrasi yang didapat yaitu y = 1,7908091 +
4402,4227 x dengan koefisien korelasi (r) : 0,999991. Hasil selengkapnya dapat
dilihat pada Tabel dan Gambar berikut :
Tabel 6. Data uji linearitas
Konsentrasi (C) (µg/mL) Luas puncak (A) (µV/s)
0,48 2156,71
UIN Syarif Hidayatullah Jakarta
Gambar 6. Kurva kalibrasi standar α-tokoferol
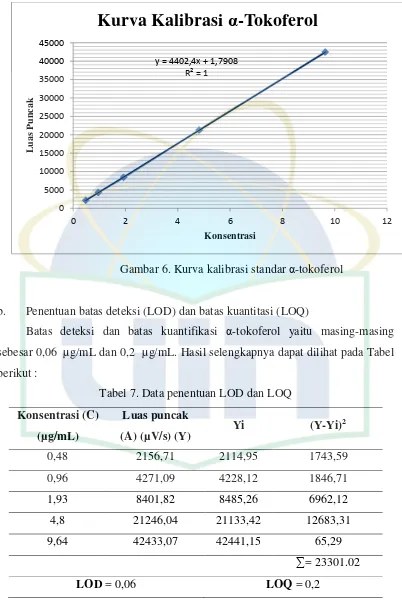
b. Penentuan batas deteksi (LOD) dan batas kuantitasi (LOQ)
Batas deteksi dan batas kuantifikasi α-tokoferol yaitu masing-masing
sebesar 0,06 µg/mL dan 0,2 µg/mL. Hasil selengkapnya dapat dilihat pada Tabel
berikut :
Tabel 7. Data penentuan LOD dan LOQ
Konsentrasi (C)
UIN Syarif Hidayatullah Jakarta
c. Uji perolehan kembali
Hasil rata-rata uji perolehan kembali pada matriks minyak biji kelor adalah
95,8%. Hasil selengkapnya dapat dilihat pada tabel berikut :
Tabel 8. Uji perolehan kembali
No Bobot
3. Analisis α-tokoferol dalam sampel minyak biji kelor
Kadar rata-rata α-tokoferol dari sampel minyak hasil ekstraksi dan dan hasil
kempa berbeda presentasinya. Hasil selengkapya dapat dilihat pada Tabel berikut :
Tabel 9. Data kadar α-tokoferol dari sampel