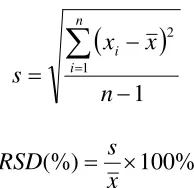ABSTRAK
RESTU SMINAR RAHAYU (MEINAR). Kajian Potensi Biji Kelor (Moringa oleifera) Sebagai Koagulan. Dibimbing oleh LATIFAH K DARUSMAN dan WULAN TRI WAHYUNI
Pengadaan air minum masih menjadi masalah besar bagi beberapa negara. Salah satu penyebab adalah tingginya biaya pengolahan kimia air bersih. Oleh sebab itu, diperlukan ketersediaan material lokal yang cukup murah. Salah satu koagulan alami yang dapat digunakan sebagai pengganti bahan kimia sintetik adalah biji kelor (Moringa oleifera).
Dalam penelitian ini, dengan menggunakan metode uji jar, diperoleh kondisi optimum koagulasi dengan biji kelor ialah pada pH 6 dengan konsentrasi 50 mg/L dan waktu pengenapan 60 menit. Sementara kondisi optimum untuk koagulan biji kelor berkulit adalah pada pH 7 dengan konsentrasi 80 mg/L dan waktu pengenapan 60 menit. Sebelumnya, kondisi koagulasi optimum untuk aluminium klorohidrat (ACH) telah diketahui berturut-turut ialah pH 7, 10 mg/L, dan 10 menit.
Kondisi optimum masing-masing koagulan memberikan respons yang berbeda-beda terhadap penurunan kekeruhan, konsentrasi ion besi, dan ion mangan. Nilai rata-rata penurunan kekeruhan dengan koagulan biji kelor, biji kelor berkulit, dan ACH masing-masing 99,10; 99,07; dan 99,71%. Nilai rata-rata penurunan ion besi untuk ketiga koagulan di atas berturut-turut 98,30; 98,45; dan 98,98%, sedangkan nilai rata-rata penurunan ion mangan berturut-turut 77,87; 81,08; dan 78,65%. Nilai keterulangan yang dihitung sebagai standar deviasi relatif pada proses koagulasi menggunakan ketiga jenis koagulan pada pengukuran ketiga parameter di atas kurang dari 10%.
ABSTRACT
RESTU SMINAR RAHAYU (MEINAR). Study of Potential Kelor Seed (Moringa oleifera) as Coagulant. Under direction of LATIFAH K DARUSMAN and WULAN TRI WAHYUNI.
Adequate access to drinking water is still a huge problem for several countries. One of the reason is the high cost for water’s chemical treatment. Hence, there is a need for low cost and locally available materials. One of the natural coagulants that can be used as an alternative for synthetic chemicals is a seed of Moringa oleifera.
In this research, by using the jar test method, the optimum coagulation condition of M. oleifera seed was obtained at pH 6 with concentration of 50 mg/L and settling time of 60 minutes. The optimum condition of M.oleifera unskinned seeds as a coagulant was at pH 7 with concentration of 80 mg/L and settling time of 60 minutes. Previously, optimum coagulation conditions for aluminium chlorohydrate (ACH) has been obtained at pH 7, 10 mg/L, and 10 minutes, respectively.
1
PENDAHULUAN
Air merupakan sumber daya alam yang diperlukan untuk hajat hidup orang banyak, bahkan oleh semua makhluk hidup. Oleh karena itu, sumber daya air harus dilindungi agar tetap dapat dimanfaatkan dengan baik. Saat ini, masalah utama yang dihadapi meliputi jumlah air yang sudah tidak mampu memenuhi kebutuhan yang terus meningkat dan mutu air untuk keperluan domestik yang makin menurun. Kegiatan industri, domestik, dan kegiatan lain berdampak negatif terhadap sumber daya air, antara lain menurunkan mutunya. Kondisi ini dapat menimbulkan gangguan, kerusakan, dan bahaya bagi semua makhluk hidup yang bergantung pada sumber daya air. Oleh karena itu, diperlukan pengelolaan dan perlindungan sumber daya air secara saksama (Effendi 2003).
Fenomena koagulasi dan flokulasi sangat berperan penting dalam pengolahan air dan limbah. Dalam pengolahan air minum, beberapa senyawa koagulan telah diujicobakan (Bratby 2006). Koagulan yang sering digunakan di antaranya aluminium klorohidrat (ACH), poli(aluminium klorida) (PAC), dan aluminium sulfat (alum), yang tergolong koagulan anorganik. Di samping itu, telah diketahui bahwa monomer dari beberapa koagulan golongan polimer organik sintetik, seperti akrilamida, bersifat merusak jaringan saraf dan karsinogen (Katayon et al. 2006). Selain koagulan anorganik, tersedia pula alternatif lokal sebagai koagulan organik alami dari tanaman yang mudah diperoleh di sekitar kita. Koagulan alami ini biodegradabel dan aman bagi kesehatan manusia.
Kelompok penelitian The Environmental Engineering Group di Universitas Leicester, Inggris, telah lama mempelajari potensi penggunaan koagulan alami dalam proses pengolahan air skala kecil, menengah, dan besar. Penelitian mereka dipusatkan terhadap potensi koagulan dari tepung biji tanaman kelor (Moringa oleifera). Dosis optimum koagulan biji kelor dengan kondisi kekeruhan awal lebih dari 150 NTU (nephelometric turbidity unit) adalah 50–200 mg/L.
Selain biji kelor, bahan alami lainnya dengan potensi koagulan ialah biji asam jawa (Tamarindus indica), yang dapat digunakan pada pengolahan limbah cair industri tahu. Dengan dosis optimum 3000 mg/L, kekeruhan awal sebesar 586 FTU (formazin turbidity units) menurun menjadi 96 FTU pada pH 4 (Enrico 2008).
Biji kelor telah dilaporkan efektif sebagai koagulan untuk menurunkan kekeruhan pada limbah cair kelapa sawit. Biji kelor juga tidak mengandung senyawa toksik sehingga aman bagi kesehatan (Hasbi et al. 2000).
Biji kelor telah dimanfaatkan sebagai koagulan alami untuk menurunkan kekeruhan air lindi di tempat pengolahan akhir (TPA) Benowo, tanpa menurunkan pH (Dwirianti 2007). Selain menurunkan kekeruhan, biji kelor juga efektif menurunkan kadar logam berat. Serbuk biji kelor tanpa kulit ari memberikan efisiensi penurunan logam Cu2+ lebih besar daripada yang berkulit ari (Widarti & Titah 2007). Beberapa penelitian di atas menggunakan biji kelor untuk pengolahan air limbah agar memenuhi persyaratan untuk dibuang ke sungai. Pada penelitian ini diukur efektivitas penurunan kekeruhan, kadar ion besi dan ion mangan oleh biji kelor yang berkulit ari dan yang tidak pada air sungai yang akan digunakan sebagai bahan baku pada instalasi pengolahan air bersih. Ketiganya merupakan parameter penting yang memengaruhi mutu air sungai karena adanya kontaminasi dari proses alam seperti serpihan batu, lumpur, dan hasil oksidasi logam yang berasal dari tanah.
Hasilnya dibandingkan dengan hasil koagulasi menggunakan ACH. Kondisi optimum ACH telah diketahui sebelumnya dari data hasil pengujian berkala laboratorium proses instalasi pengolahan air (IPA) 1 PT. Palyja yang dijadikan acuan pada proses pengolahan air bersih di instalasi tersebut.
Penelitian dilakukan dalam skala laboratorium dengan menggunakan metode uji jar yang juga merupakan simulasi operasional proses pengolahan konvensional (koagulasi, flokulasi, dan sedimentasi). Data yang diperoleh diolah secara statistik untuk melihat ada tidaknya perbedaan hasil dari perlakuan-perlakuan di atas dan dilakukan pengulangan untuk setiap parameter.
TINJAUAN PUSTAKA
Air
1
PENDAHULUAN
Air merupakan sumber daya alam yang diperlukan untuk hajat hidup orang banyak, bahkan oleh semua makhluk hidup. Oleh karena itu, sumber daya air harus dilindungi agar tetap dapat dimanfaatkan dengan baik. Saat ini, masalah utama yang dihadapi meliputi jumlah air yang sudah tidak mampu memenuhi kebutuhan yang terus meningkat dan mutu air untuk keperluan domestik yang makin menurun. Kegiatan industri, domestik, dan kegiatan lain berdampak negatif terhadap sumber daya air, antara lain menurunkan mutunya. Kondisi ini dapat menimbulkan gangguan, kerusakan, dan bahaya bagi semua makhluk hidup yang bergantung pada sumber daya air. Oleh karena itu, diperlukan pengelolaan dan perlindungan sumber daya air secara saksama (Effendi 2003).
Fenomena koagulasi dan flokulasi sangat berperan penting dalam pengolahan air dan limbah. Dalam pengolahan air minum, beberapa senyawa koagulan telah diujicobakan (Bratby 2006). Koagulan yang sering digunakan di antaranya aluminium klorohidrat (ACH), poli(aluminium klorida) (PAC), dan aluminium sulfat (alum), yang tergolong koagulan anorganik. Di samping itu, telah diketahui bahwa monomer dari beberapa koagulan golongan polimer organik sintetik, seperti akrilamida, bersifat merusak jaringan saraf dan karsinogen (Katayon et al. 2006). Selain koagulan anorganik, tersedia pula alternatif lokal sebagai koagulan organik alami dari tanaman yang mudah diperoleh di sekitar kita. Koagulan alami ini biodegradabel dan aman bagi kesehatan manusia.
Kelompok penelitian The Environmental Engineering Group di Universitas Leicester, Inggris, telah lama mempelajari potensi penggunaan koagulan alami dalam proses pengolahan air skala kecil, menengah, dan besar. Penelitian mereka dipusatkan terhadap potensi koagulan dari tepung biji tanaman kelor (Moringa oleifera). Dosis optimum koagulan biji kelor dengan kondisi kekeruhan awal lebih dari 150 NTU (nephelometric turbidity unit) adalah 50–200 mg/L.
Selain biji kelor, bahan alami lainnya dengan potensi koagulan ialah biji asam jawa (Tamarindus indica), yang dapat digunakan pada pengolahan limbah cair industri tahu. Dengan dosis optimum 3000 mg/L, kekeruhan awal sebesar 586 FTU (formazin turbidity units) menurun menjadi 96 FTU pada pH 4 (Enrico 2008).
Biji kelor telah dilaporkan efektif sebagai koagulan untuk menurunkan kekeruhan pada limbah cair kelapa sawit. Biji kelor juga tidak mengandung senyawa toksik sehingga aman bagi kesehatan (Hasbi et al. 2000).
Biji kelor telah dimanfaatkan sebagai koagulan alami untuk menurunkan kekeruhan air lindi di tempat pengolahan akhir (TPA) Benowo, tanpa menurunkan pH (Dwirianti 2007). Selain menurunkan kekeruhan, biji kelor juga efektif menurunkan kadar logam berat. Serbuk biji kelor tanpa kulit ari memberikan efisiensi penurunan logam Cu2+ lebih besar daripada yang berkulit ari (Widarti & Titah 2007). Beberapa penelitian di atas menggunakan biji kelor untuk pengolahan air limbah agar memenuhi persyaratan untuk dibuang ke sungai. Pada penelitian ini diukur efektivitas penurunan kekeruhan, kadar ion besi dan ion mangan oleh biji kelor yang berkulit ari dan yang tidak pada air sungai yang akan digunakan sebagai bahan baku pada instalasi pengolahan air bersih. Ketiganya merupakan parameter penting yang memengaruhi mutu air sungai karena adanya kontaminasi dari proses alam seperti serpihan batu, lumpur, dan hasil oksidasi logam yang berasal dari tanah.
Hasilnya dibandingkan dengan hasil koagulasi menggunakan ACH. Kondisi optimum ACH telah diketahui sebelumnya dari data hasil pengujian berkala laboratorium proses instalasi pengolahan air (IPA) 1 PT. Palyja yang dijadikan acuan pada proses pengolahan air bersih di instalasi tersebut.
Penelitian dilakukan dalam skala laboratorium dengan menggunakan metode uji jar yang juga merupakan simulasi operasional proses pengolahan konvensional (koagulasi, flokulasi, dan sedimentasi). Data yang diperoleh diolah secara statistik untuk melihat ada tidaknya perbedaan hasil dari perlakuan-perlakuan di atas dan dilakukan pengulangan untuk setiap parameter.
TINJAUAN PUSTAKA
Air
2
Menurut Soemirat (2000), di Indonesia air permukaan merupakan salah satu bahan baku air bersih yang sering dipakai karena ketersediaannya. Air minum yang ideal harus jernih, tidak berbau, tidak berwarna, tidak berasa, tidak mengandung kuman patogen dan makhluk hidup lain yang dapat membahayakan kesehatan manusia, tidak mengandung zat kimia yang dapat mengubah fungsi tubuh, tidak meninggalkan endapan pada sistem distribusi, tidak korosif, dan lain-lain. Hal ini mencegah terjadinya serta meluasnya penyakit bawaan air.
Dalam aplikasinya, air yang akan digunakan untuk air bersih atau air minum harus mengalami beberapa tahap pengolahan. Unsur–unsur yang menyebabkan air tersebut belum memenuhi standar perlu dihilangkan atau dikurangi. Teknologi untuk pengolahan air sangat bergantung pada sumber air baku yang mutunya bermacam-macam. Tahapan pengolahan air sederhana meliputi proses koagulasi, flokulasi, sedimentasi, dan filtrasi.
Koagulasi
Proses koagulasi menyebabkan partikel halus bergabung menjadi partikel yang dapat mengenap (Hadyana 2002). Suatu koloid selalu terdiri dari dua fase, yaitu fase pendispersi dan terdispersi. Berdasarkan kelarutannya, koloid ada dua jenis. Koloid dispersi partikelnya tidak dapat larut secara individu dalam medium, yang terjadi hanyalah penyebaran (dispersi) partikel tersebut, sedangkan koloid asosiasi terbentuk dari gabungan partikel kecil yang terlarut dalam medium (Syukri 1999).
Stabilitas koloid merupakan segi penting dalam proses koagulasi untuk menghilangkan koloid. Stabilitas koloid bergantung pada ukuran koloid dan muatan listriknya, dan juga dipengaruhi oleh pendispersinya (dalam hal ini, air) seperti kekuatan ionik dan pH. Beberapa gaya menyebabkan stabilitas partikel: gaya elektrostatik tolak-menolak antarmuatan partikel sejenis, reaksi hidrasi (penggabungan dengan molekul air), dan stabilisasi karena adsorpsi molekul besar.
Secara umum ada dua jenis koloid; pada sistem pengolahan air lebih dikenal sebagai koloid hidrofobik dan hidrofilik. Sulit untuk membedakan keduanya. Biasanya kedua jenis koloid tersebut ada dalam satu sistem dan secara kontinu berada dalam transisi antara hidrofobik dan hidrofilik (Bratby 2006).
Koagulasi mengubah sistem dari keadaan stabil menjadi tidak stabil. Ada beberapa
mekanisme destabilisasi. Pertama, dengan proses kompresi lapisan ganda listrik oleh muatan yang berlawanan. Kedua, dengan mengurangi potensial permukaan yang disebabkan oleh adsorpsi molekul tertentu dengan muatan elektrostatik berlawanan. Ketiga, dengan adsorpsi molekul organik di permukaan partikel yang dapat membentuk jembatan molekul antarpartikel. Terakhir, dengan penggabungan partikel koloid ke dalam senyawa yang terbentuk dari koagulan/flokulan.
Destabilisasi yang terjadi bergantung pada jenis mekanismenya. Bisa saja hanya ada satu mekanisme yang menyebabkan agregasi atau kombinasi dari beberapa mekanisme. Untuk aplikasi praktis di IPA terdapat kombinasi beberapa mekanisme destabilisasi yang disebabkan oleh kompresi lapisan ganda.
Pada sistem pengolahan air, koagulasi terjadi pada unit pengadukan cepat (flash mixing). Koagulan harus tersebar secara cepat dan destabilisasi muatan negatif oleh muatan positif harus terjadi dalam beberapa detik. Proses koagulasi-flokulasi juga dapat menghilangkan sebagian atau seluruh zat terlarut, dan hal ini menjadi fungsi utama dari koagulasi-flokulasi.
Koagulan
Koagulan adalah zat kimia yang menyebabkan destabilisasi muatan negatif partikel di dalam suspensi. Zat ini merupakan donor muatan positif yang digunakan untuk mendestabilisasi muatan negatif pada partikel koloid. Koagulan digunakan untuk mengurangi kekeruhan dan diklasifikasikan menjadi koagulan alami, anorganik, dan polimer organik sintetik (Katayon et al. 2006). Saat ini dalam pengolahan air lazim dipakai garam Al(III) atau Fe(III). Contohnya, alum, PAC, Fe(III) sulfat, dan Fe(III) klorida. Di samping itu, telah diketahui bahwa monomer dari beberapa koagulan polimer organik sintetik, seperti akrilamida, bersifat merusak jaringan saraf dan karsinogen. Sementara itu, koagulan alami biodegradabel dan aman untuk kesehatan manusia (Katayon
et al.2006).
Aluminium Klorohidrat (ACH)
3
Gambar 1 Struktur molekul aluminium klorohidrat.
Secara komersial, ACH dapat diproduksi dengan cara mereaksikan aluminium dengan asam klorida. Bahan baku yang dapat digunakan antara lain aluminium besi, aluminium trihidrat, aluminium klorida, dan aluminium sulfat. Berkaitan dengan bahaya ledakan hidrogen yang dihasilkan oleh reaksi logam aluminium dengan asam klorida, di industri ACH lazim disiapkan dengan mereaksikan aluminium hidroksida dengan asam klorida (Bratby 2006).
Biji Kelor (Moringa oleifera)
Kelor awalnya banyak tumbuh di India. Namun, kini kelor banyak ditemukan di daerah beriklim tropis (Grubben 2004). Kelor tumbuh di daerah panas dan sedikit gersang dengan curah hujan 250–1500 mm. Berikut ini adalah klasifikasi tanaman kelor.
Kingdom : Plantae Divisi : Magnoliophyta Kelas : Magnoliopsida Famili : Moringaceae Genus : Moringa
Spesies : Moringa oleifera
Tanaman tersebut juga dikenal sebagai tanaman “stik-drum” karena bentuk polong buahnya yang memanjang meskipun ada juga yang menyebutnya sebagai ”horseradish” karena rasa akarnya menyerupai lobak.
Kelor termasuk jenis tumbuhan perdu yang dapat memiliki ketinggian batang 7–11 m. Pohon kelor umumnya tumbuh 3–4 m pada tahun pertama. Batang kayunya getas (mudah patah), cabangnya jarang, tetapi berakar kuat. Batangnya berwarna kelabu, daun berbentuk bulat telur dengan ukuran kecil, tersusun majemuk dalam satu tangkai. Pohon kelor mulai berbuah setelah 2 tahun. Bunganya berwarna hijau, keluar sepanjang tahun, dengan aroma semerbak. Pengembang biakan pohon kelor bisa menggunakan biji ataupun menggunakan setek batang. Biji kelor (Gambar 2) berbentuk segi tiga memanjang yang disebut kelantang (Jawa) dan berbau minyak “behen” atau “ben”. Buahnya berbentuk memanjang, berwarna hijau, keras, dengan panjang 30-50 cm (Jonni et al. 2008).
Gambar 2 Biji kelor.
Menghilangkan zat organik dan anorganik dari air baku merupakan hal yang penting sebelum air dikonsumsi oleh manusia. Biji kelor dapat digunakan sebagai adsorben bahan organik, sebagai koagulan pada pengolahan air, dan merupakan zat polimer organik yang tidak berbahaya (Vieira et al. 2009).
Beberapa penelitian menunjukan bahwa efisiensi ekstrak biji akan menurun seiring bertambah lamanya waktu penyimpanan. Penurunan terjadi setelah disimpan 1–5 bulan (Katayon et al. 2006).
Koagulan biji kelor yang dicampur dengan air merupakan protein yang bersifat serupa dengan polielektrolit positif. Biji kelor juga mengandung logam alkali kuat seperti K dan Ca, yang menjadi kutub positif (Duke 1998). Efektivitas koagulasi biji kelor ditentukan oleh kandungan protein kationik dengan bobot molekul sekitar 6.5 kDa. Zat aktif dalam biji kelor adalah 4-(α-L-ramnosiloksi) benzil isotiosianat (Gambar 3) (Muharto et al. 2007).
Gambar 3 Struktur 4(α-L-ramnosiloksi) benzil isotiosianat.
WELL (tt) menyatakan beberapa tingkat konsentrasi sesuai tingkat kekeruhan air baku (Tabel 1).
Tabel 1 Hubungan antara dosis biji kelor dan kekeruhan air baku
Kekeruhan air baku (NTU) Dosis (mg/L)
<50 10–50
50–150 30–100
>150 50–200
Sumber: WELL (tt)
4
2006). Dari ketiga mekanisme tersebut, sulit untuk menentukan mekanisme yang terjadi, karena mungkin berlangsung simultan. Akan tetapi, umumnya mekanisme koagulasi dengan biji kelor adalah adsorpsi dan netralisasi muatan (Sutherland et al. 1990).
Pembentukan ikatan protein bermuatan positif dari biji kelor akan terjadi pada bagian bermuatan negatif dari permukaan partikel. Ini membantu pembentukan muatan negatif dan positif pada permukaan partikel. Pembentukan ikatan partikel dapat ditingkatkan dengan proses pengadukan. Terjadi kejenuhan antarpartikel yang berbeda muatan sehingga flok akan terbentuk.
Untuk digunakan sebagai koagulan dipilih biji kelor yang telah matang di pohon dan baru dipanen setelah kering. Sayap bijinya yang ringan serta kulit bijinya mudah dipisahkan hingga menyisakan biji yang putih. Pada akhir 1950-an, sebuah tim dari University of Bombay, Traancore University, dan Departmen Biokimia di Indian Institute of Science di Bangalore mengidentifikasi enam senyawa kimia dalam biji kelor. Salah satunya adalah 4(α-L-ramnosiloksi) benzil isotiosianat, suatu zat aktif glukosinolat yang mampu mengadsorpsi partikel lumpur, logam, dan sekaligus menetralkan tegangan permukaan partikel-partikel pada air limbah (Muharto et al. 2007).
Parameter Mutu Air
Kekeruhan
Kekeruhan air permukaan dapat disebabkan oleh partikel-partikel koloid dari serpihan batu, lumpur, tanah liat, atau dari hasil oksidasi logam yang berasal dari tanah. Partikel tersebut bisa berasal dari proses erosi, mikroorganisme, atau dari tumbuhan (Drinan 2001).
Menurut Effendi (2003), kekeruhan dinyatakan dalam unit kekeruhan yang setara dengan 1 mg/L SiO2. Peralatan yang pertama
kali digunakan untuk mengukur kekeruhan adalah jackson candler turbidimeter (JCT). Kekeruhan juga lazim diukur dengan metode nefelometri. Satuan kekeruhannya adalah NTU (Sawyer & McCarty 1978). Satuan JCT dan NTU tidak dapat saling dikonversi, tetapi Sawyer dan McCarty (1978) mengemukakan bahwa 40 NTU setara dengan 40 JCT.
Menurut Permenkes No 416/1990 (Lampiran 1) tentang syarat-syarat dan mutu air bersih, batas maksimum untuk parameter kekeruhan adalah 25 NTU. Sementara itu, kekeruhan air sungai sebagai bahan baku air
bersih biasanya berkisar antara 100 dan 500 NTU.
Besi
Besi (Fe) banyak terdapat di dalam tanah, tetapi hanya sedikit yang terlarut dalam air. Besi di dalam air bervalensi +2 atau +3, bergantung pada pH dan kondisi potensial redoks di dalam air. Dalam lingkungan reduktor (potensial elektrode negatif), besi berada dalam bentuk Fe2+, yang larut dalam air dan tidak berwarna (Said & Wahyono 1999). Ketika potensial di dalam air naik, Fe2+ akan teroksidasi menjadi Fe3+ membentuk Fe(OH)3 yang kelarutannya rendah sehingga
akan tersuspensi membentuk kekeruhan, berwarna kuning kecokelatan.
Endapan Fe(OH)3 korosif terhadap pipa
dan akan mengendap pada saluran pipa, sehingga menyumbat dan mengotori bak seng, wastafel, dan kloset. Besi terlarut, di sisi lain, menimbulkan warna, bau, dan rasa dalam air (Faust & Osman 1983). Kadar Fe lebih dari 1 mg/L sesuai dengan Permenkes No 416/1990 mengiritasi mata dan kulit. Apabila kelarutan besi dalam air melebihi 10 mg/L, air akan berbau seperti telur busuk.
Mangan
Mangan di dalam tanah kebanyakan berbentuk mangan dioksida (valensi +4), yang sukar larut di dalam air. Namun, karena dalam kondisi anaerob (potensial elektrode negatif), MnO2 tersebut dapat direduksi menjadi Mn2+
yang larut air.
Mangan yang tinggi di dalam air, terutama untuk air minum, akan teroksidasi oleh oksigen membentuk Mn4+ yang menyebabkan air menjadi keruh, berwarna kecokelatan, dan berbau logam mangan (Sutrisno 2006). Menurut Permenkes No 416/1990 tentang kualitas air bersih, batas maksimum untuk parameter kadar mangan adalah 0,5 mg/L.
Uji Jar
5
flok) dan pengenapan flok yang terbentuk (Singh & Yadava 2003).
Uji jar terdiri dari enam buah wadah yang masing-masing diisi dengan 1000 mL contoh air. Dosis koagulan yang berbeda ditambahkan ke dalam masing-masing wadah untuk menentukan kisaran dosis optimum. Koagulan harus ditambahkan setelah dilakukan pengadukan cepat secara simultan beberapa saat (Hendric 2006).
Spektrofotometri Serapan Atom (AAS)
Spektrofotometri serapan atom telah lama digunakan untuk analisis kuantitatif unsur-unsur logam dalam jumlah renik. Spektrofotometri dirancang menggunakan sistem optik berkas-tunggal atau berkas-ganda (Harvey 2000).
Analisis AAS didasarkan pada penyerapan energi sinar pada panjang gelombang tertentu oleh atom-atom netral dalam keadaan gas dari zat yang dianalisis. Prinsip kerja alat ini adalah nyala api yang mengandung atom-atom netral dari unsur yang dianalisis, yang berada pada keadaan dasarnya, disinari oleh sinar yang dipancarkan sumber sinar. Sebagian intensitas sinar tersebut dengan panjang gelombang tertentu akan diserap oleh atom, sebagian lagi diteruskan ke monokromator lalu berturut-turut ke detektor, amplifier, dan rekorder (Day & Underwood 2002).
Menurut Khopkar (1998), keberhasilan analisis ini bergantung pada proses eksitasi dan cara memperoleh garis resonans yang tepat. Jika sumbernya monokromatis, hukum Lambert menyatakan bahwa proporsi sinar datang yang diserap oleh bahan/medium tidak bergantung pada intensitasnya. Hukum ini tentunya hanya berlaku jika di dalam bahan atau medium tidak ada reaksi kimia atau proses fisis yang dapat dipicu atau diimbas oleh sinar datang. Intensitas sinar yang melewati bahan/medium dapat dituliskan sebagai.
I = T × I0
dengan I adalah intensitas sinar keluar, I0 adalah intensitas sinar datang, dan T adalah transmitans. Jika transmitans dinyatakan dalam persen, maka
%T = (I/I0) × 100 (satuan %)
Hukum Beer lebih lanjut menyatakan bahwa absorbans sinar berbanding lurus dengan konsentrasi dan ketebalan bahan/medium:
A = ε c l
dengan ε adalah absorbsitivitas molar untuk panjang gelombang tertentu, atau koefisien ekstingsi (dalam L mol-1 cm-1), c adalah konsentrasi (mol L-1), dan l adalah ketebalan medium yang dilintasi sinar (cm).
Pada AAS, panjang gelombang garis absorpsi resonans identik dengan garis emisi, karena keserasian transisinya. Untuk itu, diperlukan sumber radiasi yang mengemisikan sinar pada panjang gelombang tepat sama dengan pada proses absorpsinya. Dengan demikian, efek pelebaran puncak dapat dihindarkan. Sumber radiasi tersebut dikenal sebagai lampu katode cekung.
Pengujian Statistika
Menurut Mattjik dan Sumertajaya (2006) hipotesis statistik dibedakan menjadi dua, yaitu hipotesis nol (H0) dan hipotesis
tandingan atau alternatif (H1). Pernyataan
yang ingin ditolak kebenarannya ditetapkan sebagai hipotesis nol, sedangkan pernyataan lawannya ditetapkan sebagai hipotesis tandingan. Dikenal istilah uji satu arah dan dua arah, yang dibedakan dari sifat penolakan hipotesis tersebut.
Perbandingan nilai rerata dua contoh dibagi menjadi dua kategori, yaitu data berpasangan dan tak berpasangan. Data yang diperoleh dari sumber yang sama diolah dengan metode tak berpasangan, sedangkan data dari sumber yang berbeda diolah dengan metode berpasangan.
Presisi
6
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah biji kelor, ACH, HNO3 pekat, NaOH 5 N, HCl
1:1, NH3, CHCl3, H2SO4 2 M, pereaksi
Dragendorff, Mayer, Wagner, bubuk Mg, HCl:etanol (1:1), amil alkohol, FeCl3 10%,
etanol, dietil eter, H2SO4 pekat, anhidrida
asetat. Sementara contoh yang digunakan adalah air sungai yang digunakan sebagai air baku di instalasi pengolahan air bersih.
Alat-alat yang digunakan adalah alat uji jar, AAS NOVA 300 Analytik Jena, turbidimeter HACH 2100AN IS, pH-meter, blender, neraca analitik, alat kaca, corong, kertas saring, penangas, dan shaker.
Metode
Penelitian ini dilakukan dalam beberapa tahap (Lampiran 2). Pertama koagulan disiapkan dari biji kelor dan biji kelor berkulit. Kemudian pH, dosis, dan waktu pengenapan optimum ditetapkan untuk masing-masing koagulan dengan mengukur persen penurunan kekeruhan pada contoh air baku. Setelah diperoleh kondisi optimum, persen penurunan kekeruhan, kadar ion besi dan mangan diukur dan dibandingkan dengan hasil koagulasi menggunakan ACH. Data yang dihasilkan diolah secara statistik untuk melihat perbedaan efektivitas masing-masing koagulan pada kondisi optimumnya.
Pembuatan Koagulan Biji Kelor dan Biji Kelor Berkulit
Biji kelor yang akan digunakan adalah yang telah matang di pohon dan diperoleh dari daerah Pelabuhan Ratu, Sukabumi. Sebagian dikupas dan sebagian lagi dibiarkan dengan kulitnya. Kedua jenis biji kelor masing-masing dihancurkan menggunakan blender yang biasa digunakan untuk kacang-kacangan sampai halus.
Metode Uji Jar
Disiapkan 6 buah gelas piala 1000 mL. Masing-masing diisi 1000 mL contoh air baku, dilrtakan dalam alat uji jar, dan mulai dikocok dengan kecepatan 2,446 × g. Setelah itu, ditambahkan koagulan untuk masing-masing konsentrasi dan dibiarkan 2 menit. Kecepatan lalu diturunkan menjadi 0,0626 × g
dan pengocokan dilanjutkan kembali selama 18 menit. Contoh selanjutnya didiamkan sampai lumpur dan air bersih terpisah. Hasil
koagulasi diambil untuk diukur kekeruhan, kadar mangan, dan kadar besinya.
Penetapan Pengaruh pH
Ke dalam 13 gelas piala 1000 mL dimasukkan contoh air baku yang telah diukur kekeruhannya masing-masing sebanyak 1000 mL. Kemudian ditambahkan NaOH 5 N atau HCL 1:1 sehingga diperoleh variasi pH 1–13. Selanjutnya campuran diaduk dengan kecepatan 2,446 × g selama 2 menit lalu 0,0626 × g selama 18 menit. Contoh didiamkan selama 60 menit hingga terenapkan sempurna, kemudian diambil sebanyak 300 mL dan diukur kekeruhannya menggunakan turbidimeter.
Penetapan pH Optimum
Disiapkan 10 gelas piala 1000 mL yang dibagi menjadi 2 rangkaian masing-masing terdiri dari 5 gelas piala. Rangkaian pertama digunakan untuk koagulan biji kelor dan yang kedua untuk biji kelor berkulit. Ke dalam gelas piala dimasukkan contoh air baku yang telah diukur kekeruhannya sebanyak 1000 mL, kemudian ditambahkan NaOH 5 N atau HCl 1:1 sehingga diperoleh variasi pH (5, 6, 7, 8, 9) untuk setiap rangkaian. Dua gram bubuk biji kelor dan 2 gram bubuk biji kelor berkulit ditambahkan ke dalam masing-masing gelas piala, lalu diaduk dengan kecepatan 2,446 × g selama 2 menit dan dilanjutkan dengan kecepatan 0,0626 × g
selama 18 menit. Setelah itu, contoh didiamkan selama 60 menit hingga terenapkan sempurna, kemudian diambil sebanyak 300 mL dan diukur kekeruhannya menggunakan turbidimeter.
Penetapan Konsentrasi Optimum Koagulan Biji Kelor dan Biji Kelor Berkulit
7
terenapkan sempurna, kemudian diambil sebanyak 300 mL dan diukur kekeruhannya menggunakan turbidimeter.
Penetapan Waktu Pengenapan Optimum Koagulan Biji Kelor dan Biji Kelor Berkulit
Disiapkan 20 gelas piala 1000 mL berisi contoh yang telah diukur kekeruhannya sebanyak 1000 mL. NaOH 5 N atau HCl 1:1 ditambahkan sehingga 10 gelas contoh pH-nya 6 dan 10 lainpH-nya memiliki pH 7. Ke dalam masing-masing contoh dengan pH 6 ditambahkan 50 mg bubuk biji kelor. Sementara ke dalam contoh dengan pH 7 dimasukkan 80 mg bubuk biji kelor berkulit. Campuran diaduk dengan kecepatan 2,446 × g
selama 2 menit lalu 0,0626 × g selama 18 menit. Setelah itu, contoh didiamkan dengan variasi waktu (10, 20, 30, 40, 50, 60, 70, 80, 90, dan 100) menit, kemudian diambil sebanyak 300 mL dan diukur kekeruhannya menggunakan turbidimeter.
Penetapan Konsentrasi Ion Besi, Ion Mangan, dan Kekeruhan Pada Kondisi Optimum
Ke dalam 18 buah gelas piala 1000 mL berisi contoh yang telah diukur kekeruhan, kadar ion besi, dan ion mangannya sebanyak 1000 mL, NaOH 5 N atau HCl 1:1 ditambahkan sehingga 12 gelas piala contoh pH-nya 7 dan 6 lainnya ber-pH 6. Bubuk biji kelor berkulit sebanyak 80 mg dimasukkan ke dalam 6 gelas piala yang memiliki pH 7, 10 mL ACH 1000 mg/L ditambahkan ke dalam 6 buah gelas piala pH 7 lainnya, sementara ke dalam 6 gelas piala contoh dengan pH 6 ditambahkan bubuk biji kelor masing-masing 50 mg. Campuran diaduk dengan kecepatan 2,446 × g selama 2 menit lalu 0,0626 × g
selama 18 menit. Setelah itu, contoh yang ditambahkan biji kelor maupun biji kelor berkulit didiamkan selama 60 menit. Contoh yang ditambahkan ACH hanya didiamkan selama 10 menit. Contoh diambil masing-masing diambil sebanyak 300 mL untuk diukur kekeruhan, kadar ion mangan dan ion besinya. Data yang diperoleh diolah secara statistik untuk menghitung ada tidaknya perbedaan yang nyata antara hasil koagulasi menggunakan koagulan biji kelor maupun biji kelor berkulit dengan menggunakan ACH serta untuk melihat nilai presisi dari masing-masing proses koagulasi serta pengukuran ketiga parameter di atas.
Pengukuran Ion Besi dan Ion Mangan (3500-Fe B dan 3500-Mn B. APHA-AWWA 2005)
Contoh air baku sebelum dan setelah koagulasi dengan berbagai koagulan dipipet masing-masing 100 mL lalu dimasukkan ke dalam Erlenmeyer dan ditambahkan 5 mL HNO3 pekat. Contoh dilumat sampai
volumenya menjadi 25 mL kemudian disaring. Hasil saringan ditampung dalam labu takar 100 mL lalu ditera menggunakan akuabides. Setelah itu, contoh dianalisis kadar ion besi dan ion mangan yang terkandung di dalamnya menggunakan AAS.
Perbandingan Mutu Air Baku Hasil Koagulasi
Data hasil penelitian ini diolah dengan membandingkan nilai rerata dua contoh menggunakan metode tidak berpasangan maupun berpasangan. Perhitungan diawali dengan menghitung variasi dari masing-masing kumpulan data, apakah berbeda nyata atau tidak, dengan menghitung nilai F hitung yang kemudian dibandingkan dengan nilai tabel F melalui persamaan
2 2 B A hit
S
S
F
Apabila variasi data tersebut tidak berbeda nyata, maka nilai t hitung dihitung dengan persamaan
A
B
pool B A hit
n
n
S
X
X
t
1
1
2
1
1
2 2
B A B B A A pooln
n
S
n
S
n
S
dan dibandingkan dengan tabel T (α, nA + nB –
2). Apabila berbeda nyata, maka t hitung dihitung dengan persamaan
A A
B B
B A hit
n
S
n
S
X
X
t
2 2
dan dibandingkan dengan nilai tabel T (α, v). Nilai v dihitung dengan persamaan
2 2 1
2
2
1
22 2 2 B B B A A A B B A A n n S n n S n S n S v Presisi
8
1
1 2
n
x
x
s
n i i%
100
(%)
x
s
RSD
Pengujian Fitokimia Biji Kelor dan Biji Kelor Berkulit
Pengujian Alkaloid
Satu gram contoh dimasukkan ke dalam tabung reaksi kemudian ditambahkan 3 tetes NH3 dan dikocok. Lima mL HCl3
ditambahkan lalu divorteks sampai homogen. Contoh disaring, 5 tetes H2SO4 2M
ditambahkan ke dalam filtrat. Akan terbentuk dua lapisan. Lapisan atas atau lapisan asam dibagi menjadi tiga bagian. Masing-masing bagian ditambahkan pereaksi Dragendorff, Mayer, dan Wagner. Perubahan yang terjadi diamati.
Pengujian Fenolik
Campuran 5 g contoh dan 100 mL akuabides dipanaskan selama 5 menit. Contoh disaring, dan filtrat dibagi tiga, masing-masing untuk uji flavonoid, tanin, dan saponin.
Untuk uji flavonoid, filtrat berturut-turut ditambahkan bubuk Mg, HCl-etanol (1:1), dan 1 mL amil alkohol. Perubahan warna yang terjadi pada lapisan amil alkohol diamati.
Filtrat ditambahkan 3 tetes FeCl3 10% dan
diamati perubahan warnanya dalam uji tanin. Sementara untuk uji saponin, filtrat dikocok kuat dan dilihat apakah terbentuk buih yang stabil.
Pengujian Terpenoid
Contoh diambil sebanyak 1 g, ditambahkan etanol, divorteks sampai homogen, lalu dipanaskan. Saat masih panas contoh disaring. Filtrat dipanaskan kembali sampai kering, lalu ditambahkan 1 mL dietil eter dan dikocok sampai homogen. Setelah itu, 1 mL H2SO4 pekat dan 1 tetes anhidrida
asetat ditambahkan ke dalamnya, dan diamati perubahan warna yang terjadi.
HASIL DAN PEMBAHASAN
Pengujian Fitokimia Biji Kelor dan Biji Kelor Berkulit
Pengujian fitokimia biji kelor dan biji kelor berkulit dilakukan untuk mengetahui senyawa metabolit sekunder yang terdapat di dalam contoh. Hasil pengujian ini secara lengkap dapat dilihat pada Tabel 2.
Tabel 2 Hasil pengujian fitokimia biji kelor dan biji kelor berkulit
Parameter Biji Kelor Biji Kelor Berkulit Alkaloid A. Dragendorff B. Mayer C. Wagner + + + + + + Fenolik A. Flavanoid B. Tanin C. Saponin - - + - - + Terpenoid A. Steroid B. Triterpenoid - - - -
Pengujian alkaloid dalam biji kelor dan biji kelor berkulit menunjukkan hasil yang positif. Contoh direaksikan dengan pereaksi Dragendorff menghasilkan endapan jingga, dengan pereaksi Mayer menghasilkan endapan putih, dan dengan pereaksi Wagner menghasilkan endapan cokelat. Alkaloid merupakan golongan zat tumbuhan sekunder yang terbesar. Pada umumnya alkaloid bersifat basa dengan satu atau lebih atom nitrogen, biasanya sebagai bagian dari sistem siklik. Prekursor alkaloid yang paling umum adalah asam amino (Harborne 1987).
Hasil uji fenolik menunjukkan bahwa dalam contoh biji kelor dan biji kelor berkulit terdapat saponin. Hal itu dibuktikan dengan terbentuknya buih yang stabil setelah contoh diberi perlakuan dan dikocok. Saponin adalah glikosida triterpena dan sterol. Saponin merupakan senyawa aktif permukaan dan bersifat seperti sabun, yang dapat dideteksi berdasarkan kemampuannya membentuk busa (Harborne 1987).
Koagulan alami yang telah dikaji sifat fitokimianya antara lain Bridelia ferruginea
8
1
1 2
n
x
x
s
n i i%
100
(%)
x
s
RSD
Pengujian Fitokimia Biji Kelor dan Biji Kelor Berkulit
Pengujian Alkaloid
Satu gram contoh dimasukkan ke dalam tabung reaksi kemudian ditambahkan 3 tetes NH3 dan dikocok. Lima mL HCl3
ditambahkan lalu divorteks sampai homogen. Contoh disaring, 5 tetes H2SO4 2M
ditambahkan ke dalam filtrat. Akan terbentuk dua lapisan. Lapisan atas atau lapisan asam dibagi menjadi tiga bagian. Masing-masing bagian ditambahkan pereaksi Dragendorff, Mayer, dan Wagner. Perubahan yang terjadi diamati.
Pengujian Fenolik
Campuran 5 g contoh dan 100 mL akuabides dipanaskan selama 5 menit. Contoh disaring, dan filtrat dibagi tiga, masing-masing untuk uji flavonoid, tanin, dan saponin.
Untuk uji flavonoid, filtrat berturut-turut ditambahkan bubuk Mg, HCl-etanol (1:1), dan 1 mL amil alkohol. Perubahan warna yang terjadi pada lapisan amil alkohol diamati.
Filtrat ditambahkan 3 tetes FeCl3 10% dan
diamati perubahan warnanya dalam uji tanin. Sementara untuk uji saponin, filtrat dikocok kuat dan dilihat apakah terbentuk buih yang stabil.
Pengujian Terpenoid
Contoh diambil sebanyak 1 g, ditambahkan etanol, divorteks sampai homogen, lalu dipanaskan. Saat masih panas contoh disaring. Filtrat dipanaskan kembali sampai kering, lalu ditambahkan 1 mL dietil eter dan dikocok sampai homogen. Setelah itu, 1 mL H2SO4 pekat dan 1 tetes anhidrida
asetat ditambahkan ke dalamnya, dan diamati perubahan warna yang terjadi.
HASIL DAN PEMBAHASAN
Pengujian Fitokimia Biji Kelor dan Biji Kelor Berkulit
Pengujian fitokimia biji kelor dan biji kelor berkulit dilakukan untuk mengetahui senyawa metabolit sekunder yang terdapat di dalam contoh. Hasil pengujian ini secara lengkap dapat dilihat pada Tabel 2.
Tabel 2 Hasil pengujian fitokimia biji kelor dan biji kelor berkulit
Parameter Biji Kelor Biji Kelor Berkulit Alkaloid A. Dragendorff B. Mayer C. Wagner + + + + + + Fenolik A. Flavanoid B. Tanin C. Saponin - - + - - + Terpenoid A. Steroid B. Triterpenoid - - - -
Pengujian alkaloid dalam biji kelor dan biji kelor berkulit menunjukkan hasil yang positif. Contoh direaksikan dengan pereaksi Dragendorff menghasilkan endapan jingga, dengan pereaksi Mayer menghasilkan endapan putih, dan dengan pereaksi Wagner menghasilkan endapan cokelat. Alkaloid merupakan golongan zat tumbuhan sekunder yang terbesar. Pada umumnya alkaloid bersifat basa dengan satu atau lebih atom nitrogen, biasanya sebagai bagian dari sistem siklik. Prekursor alkaloid yang paling umum adalah asam amino (Harborne 1987).
Hasil uji fenolik menunjukkan bahwa dalam contoh biji kelor dan biji kelor berkulit terdapat saponin. Hal itu dibuktikan dengan terbentuknya buih yang stabil setelah contoh diberi perlakuan dan dikocok. Saponin adalah glikosida triterpena dan sterol. Saponin merupakan senyawa aktif permukaan dan bersifat seperti sabun, yang dapat dideteksi berdasarkan kemampuannya membentuk busa (Harborne 1987).
Koagulan alami yang telah dikaji sifat fitokimianya antara lain Bridelia ferruginea
9
Pengujian terpenoid terhadap contoh menunjukkan hasil yang negatif baik untuk steroid maupun untuk triterpenoid. Hasil pengujian fitokimia biji kelor dan biji kelor berkulit dapat dilihat pada Lampiran 3.
Penetapan pH Optimum
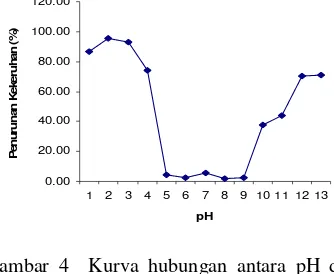
Penelitian ini diawali dengan penetapan pH yang tidak memengaruhi penurunan kekeruhan air pada perlakuan tanpa pemberian koagulan biji kelor. Pengaturan kisaran pH sangat penting dalam proses koagulasi yang optimum (Bratby 1980). Hasil penelitian (Lampiran 4) menunjukkan bahwa pH 5–9 tidak berpengaruh signifikan terhadap penurunan kekeruhan; kekeruhan hanya menurun sebesar 2,00–5,60%. Karena itu, pada penelitian ini pH tersebut dipilih untuk proses optimalisasi, sebab proses koagulasi pada nilai pH kurang dari 5 atau lebih dari 9 akan terjadi tidak hanya karena penambahan koagulan, tetapi juga dipengaruhi oleh pH. Hubungan persen penurunan kekeruhan dengan pH tanpa penambahan koagulan dapat dilihat pada Gambar 5.
0.00 20.00 40.00 60.00 80.00 100.00 120.00
1 2 3 4 5 6 7 8 9 10 11 12 13
pH P e n u ru n a n K e k e ru h a n ( % )
Gambar 4 Kurva hubungan antara pH dan persen penurunan kekeruhan tanpa penambahan koagulan.
Setelah diperoleh rentang pH yang tidak memengaruhi proses koagulasi secara signifikan, dilakukan penetapan pH optimum untuk penurunan kekeruhan contoh menggunakan koagulan biji kelor maupun biji kelor berkulit. Hasil penelitian menunjukkan bahwa pH optimum untuk penurunan kekeruhan menggunakan koagulan biji kelor adalah 6, dengan persentase penurunan kekeruhan sebesar 94,91%. Secara umum, persen penurunan kekeruhan menggunakan biji kelor berkulit pada pH 5–9 relatif sama. pH 7 memberikan persen penurunan terbesar, yaitu sebesar 97,87%, (Gambar
5). 0.00 20.00 40.00 60.00 80.00 100.00 120.00
5 6 7 8 9
pH P e n u ru n a n k e k e ru h a n ( % )
Biji kelor Biji kelor berkulit
Gambar 5 Kurva hubungan antara pH dan persen penurunan kekeruhan padapenetapan pH optimum untukkoagulan biji kelor dan biji kelor berkulit.
Proses koagulasi air baku berkaitan dengan nilai potensial zeta larutan biji kelor dan air baku itu sendiri. Potensial zeta air sintetik adalah −46mV (Rambe 2009). Pada pH tinggi spesies negatif dominan (Bratby 1980).
Bahan koagulan dalam biji kelor adalah protein kationik yang larut dalam air. Potensial zeta larutan 5% biji kelor tanpa kulit sekitar +6 mV (Ndabigenggesere et al. 1995). Hal ini menunjukkan bahwa larutan ini didominasi oleh tegangan positif meskipun merupakan campuran heterogen yang kompleks. Kedua hal di atas menunjukkan bahwa pada pH netral partikel-partikel dalam air bermuatan negatif. Akibatnya, koagulasi partikel tersuspensi dengan biji kelor dipengaruhi oleh proses destabilisasi tegangan negatif koloid oleh polielektrolit kationik.
Penetapan Konsentrasi Optimum
10
80.00 85.00 90.00 95.00 100.0010 20 30 40 50 60 70 80 90 100 200 300 400 500
Konsentrasi koagulan (mg/L)
P e n u ru n a n k e k e ru h a n (% )
Biji kelor Biji kelor berkulit
Gambar 6 Kurva hubungan antara konsentrasi koagulan dan persen penurunan kekeruhan pada penetapan konsentrasi optimum koagulan biji kelor dan biji kelor berkulit.
Penetapan konsentrasi optimum koagulan biji kelor berkulit dilakukan terhadap contoh dengan kekeruhan awal 240,00 NTU. Penambahan koagulan biji kelor berkulit sebesar 80 mg/L mengurangi kekeruhan menjadi 4,06 NTU. Pada saat konsentrasi koagulan ditingkatkan menjadi 90 mg/L, kekeruhan akhir naik menjadi 4,15 NTU (Gambar 6). Hal ini menunjukkan bahwa konsentrasi optimum untuk koagulan biji kelor berkulit adalah 80 mg/L.
Penambahan koagulan biji kelor dalam dosis tertentu meningkatkan jumlah kation yang berfungsi menetralkan muatan negatif dari partikel-partikel koloid. Penambahan ion positif akan mengurangi gaya tolak-menolak sesama koloid. Terjadi destabilisasi sistem koloid yang memungkinkan koloid saling mendekat dan membentuk mikroflok. Mikroflok-mikroflok tersebut cenderung bersatu dan membentuk makroflok karena sudah mengalami destabilisasi dan akhirnya mengendap. Pada konsentrasi koagulan yang tepat, seluruh koloid dapat terikat dan bergabung menjadi flok yang besar.
Gambar 6 menunjukkan bahwa penambahan konsentrasi koagulan biji kelor maupun biji kelor berkulit melebihi jumlah optimum justru akan menurunkan persentase penurunan kekeruhan. Koagulan berlebih dapat menutupi mikroflok sehingga tidak terbentuk makroflok. Mekanismenya adalah polimer-polimer yang berlebih akan menutupi seluruh permukaan partikel koloid sehingga tidak ada tempat untuk rantai akhir menempel dan proses flokulasi tidak terjadi. Keadaan ini dapat menstabilkan kembali partikel koloid.
Data penetapan konsentrasi optimum selengkapnya diberikan di Lampiran 5. Perbedaan dosis optimum antara koagulan biji kelor dan biji kelor berkulit berkaitan dengan kandungan protein dalam biji kelor dan
kulitnya yang menjadi zat aktif untuk proses koagulasi (Pandia & Husin 2005).
Perubahan visual air baku setelah koagulasi dapat dijadikan indikator awal keberhasilan proses tersebut. Perubahan visual yang nyata seperti terlihat pada Gambar 7 dan 8.
Penetapan Waktu Pengenapan Optimum
Selain penetapan pH dan konsentrasi optimum, juga dilakukan penetapan waktu pengenapan (settling time) optimum. Lampiran 6 dan Gambar 9 menunjukkan bahwa waktu pengenapan optimum untuk masing-masing koagulan adalah 60 menit dengan persentase penurunan kekeruhan sebesar 99,00% untuk koagulan biji kelor dan 98,98% untuk koagulan biji kelor berkulit.
91,00 92,00 93,00 94,00 95,00 96,00 97,00 98,00 99,00 100,00
10 20 30 40 50 60 70 80 90 100
Waktu pengenapan (menit)
P e n u ru n a n k e k e ru h a n ( % )
Biji kelor Biji kelor berkulit
Gambar 9 Kurva hubungan antara waktu dan persen penurunan kekeruhan pada penentuan waktu optimum proses pengenapan untuk koagulan biji kelor dan biji kelor berkulit. Gambar 8 Air baku sebelum (a) dan
setelah dikoagulasi (b) dengan biji kelor berkulit.
(a) (b)
Gambar 7 Air baku sebelum (a) dan setelah dikoagulasi (b) dengan biji kelor.
11
Waktu pengenapan yang optimum adalah 60 menit. Namun, mulai menit ke-10 telah diperoleh persen penurunan kekeruhan sebesar 94,17% untuk koagulan biji kelor dan 96,12% untuk biji kelor berkulit. Nilai kekeruhan akhir yang diperoleh berturut-turut 13,30 dan 8,86 NTU. Nilai tersebut telah memenuhi baku mutu air bersih untuk parameter kekeruhan, yaitu 25 NTU (Depkes 1990). Karena itu, pengenapan 10 menit dapat diaplikasikan pada proses koagulasi untuk pengolahan air bersih.
Perbandingan Hasil Koagulasi Biji Kelor dan Biji Kelor Berkulit dengan Koagulan
Anorganik
Secara umum, besi dan mangan dalam air tidak menyebabkan risiko kesehatan yang berarti, tetapi dapat menyebabkan air menjadi berwarna, berasa, dan berbau. Selain itu, dapat timbul masalah pada sistem distribusi air karena penempelan logam tersebut yang membentuk kerak pada pipa (Lin 2007).
Baik besi maupun mangan dalam air biasanya terlarut dalam bentuk senyawaan atau garam bikarbonat, sulfat, hidroksida, dan juga dalam bentuk koloid atau bergabung dengan senyawa organik. Salah satu cara menghilangkan zat besi dan mangan dalam air adalah dengan koagulasi (Said & Wahyono 1999).
Senyawa 4-(α-L-ramnosiloksi)benzil isotiosiana larut dalam air (Goyal et al. 2007). Gugus hidroksil dalam zat aktif tersebut dapat mengikat logam berat. Hidrogen yang semula terikat pada alkohol akan digantikan oleh logam berat yang lebih elektronegatif (Muharto et al. 2007). Biji kelor juga mengandung asam amino sistein yang dapat menangkap logam berat (Muharto et al. 2007).
Air sungai dikoagulasi menggunakan koagulan (a) biji kelor pada pH 6 dengan konsentrasi 50 mg/L serta waktu pengenapan 60 menit, (b) biji kelor berkulit pada pH 7, konsentrasi 80 mg/L, dan waktu pengenapan 60 menit, serta (c) ACH pH 7, konsentrasi 10 mg/L, dan waktu pengenapan 10 menit. Ketiganya merupakan kondisi optimum yang diperoleh dari penelitian sebelumnya.
Hasil koagulasi pada kondisi optimum untuk masing-masing koagulan diukur penurunan kekeruhan, konsentrasi logam besi dan mangannya. Kemudian hasilnya dibandingkan dengan koagulasi menggunakan ACH sebagai koagulan anorganik yang telah diaplikasikan pada proses pengolahan air
bersih di IPA. Pembandingan dilakukan secara statistik dengan menggunakan uji beda nyata.
Uji beda nyata dilakukan dengan menghitung nilai F hitung untuk membandingkan variasi data yang dihasilkan. Selain itu, juga dihitung nilai t hitung dengan metode tidak berpasangan dua arah untuk mengetahui apakah data yang dihasilkan saling berbeda nyata. Uji beda nyata dilakukan pada taraf kepercayaan 95%.
Perbandingan Persen Penurunan Kekeruhan
Kekeruhan akan sangat mengubah estetika maupun dari segi mutu air (Efendi 2003). Cara paling lazim untuk menurunkan kekeruhan adalah dengan pengenapan. Proses pengenapan dapat dipercepat dengan pemberian koagulan (Sutrisno 2006).
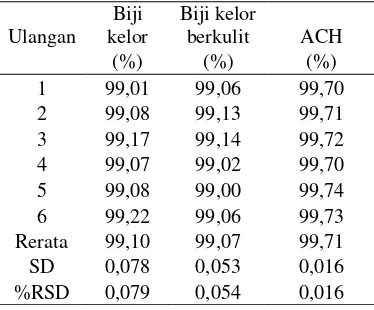
Contoh air baku yang digunakan memiliki kekeruhan awal 380,00 NTU. Tabel 3 memperlihatkan bahwa nilai rerata persen penurunan kekeruhan air baku menggunakan biji kelor, biji kelor berkulit, dan ACH berturut-turut 99,10; 99,07; dan 99,71%.
Tabel 3 Persen penurunan kekeruhan air baku hasil koagulasi
Ulangan Biji kelor
Biji kelor
berkulit ACH
(%) (%) (%)
1 99,01 99,06 99,70
2 99,08 99,13 99,71
3 99,17 99,14 99,72
4 99,07 99,02 99,70
5 99,08 99,00 99,74
6 99,22 99,06 99,73
Rerata 99,10 99,07 99,71
SD 0,078 0,053 0,016
%RSD 0,079 0,054 0,016
12
Perbandingan Persen Penurunan Konsentrasi Ion Besi
Contoh air baku yang digunakan memiliki konsentrasi awal ion besi sebesar 8,63 mg/L. Tabel 4 memperlihatkan nilai rerata persen penurunan konsentrasi ion besi dalam air baku setelah dikoagulasi menggunakan biji kelor, biji kelor berkulit, dan ACH berturut-turut adalah 98,30; 98,45; dan 98,98%.
Tabel 4 Persen penurunan konsentrasi ion besi hasil koagulasi
Ulangan Biji kelor
Biji kelor
berkulit ACH
(%) (%) (%)
1 98,22 98,27 99,11
2 98,25 98,49 98,91
3 98,49 98,37 98,98
4 98,27 98,40 98,98
5 98,33 98,49 99,04
6 98,26 98,69 98,86
Rerata 98,30 98,45 98,98
SD 0,099 0,143 0,092
%RSD 0,101 0,146 0,093
Rerata persen penurunan konsentrasi ion besi dalam air baku yang dikoagulasi menggunakan biji kelor dan ACH memiliki nilai F hitung 1,16, lebih kecil daripada F
tabel. Artinya, variasi kedua kelompok data tersebut tidak berbeda nyata. Sementara itu, nilai t hitung (12,32) yang lebih besar daripada t tabel. Artinya, persen penurunan konsentrasi ion besi dalam air baku hasil koagulasi menggunakan biji kelor dan dengan ACH berbeda nyata.
Koagulan biji kelor berkulit dan ACH memberikan nilai yang serupa. Nilai F hitung
lebih kecil daripada F tabel. Artinya, variasi persen penurunan konsentrasi ion besi dalam air baku hasil koagulasi dengan biji kelor berkulit dan dengan ACH tidak berbeda nyata. Nilai t hitung (7,63) juga lebih besar daripada
t tabel. Artinya, penurunan konsentrasi ion besi dalam air baku hasil koagulasi menggunakan biji kelor berkulit dan dengan ACH berbeda nyata. Perhitungan selengkapnya diberikan pada Lampiran 8.
Berdasarkan APHA-AWWA (2005), nilai %RSD yang dipersyaratkan pada pengukuran logam dalam contoh air menggunakan AAS adalah di bawah 10%. Hasil koagulasi menggunakan ketiga jenis koagulan untuk parameter ion besi memberikan %RSD di bawah 10%. Artinya, ketiga perlakuan memiliki nilai %RSD yang baik dan
memenuhi persyaratan yang ditetapkan dalam APHA-AWWA (2005).
Perbandingan Persen Penurunan Konsentrasi Ion Mangan
Air baku yang digunakan sebagai contoh memiliki konsentrasi awal ion mangan sebesar 0,3143 mg/L. Tabel 4 memperlihatkan rerata persen penurunan konsentrasi ion mangan dalam air baku yang telah dikoagulasi menggunakan biji kelor, biji kelor berkulit, dan ACH berturut-turut sebesar 77,87; 81,08; dan 78,65%.
Tabel 5 Persen penurunan konsentrasi ion mangan hasil koagulasi
Ulangan
Biji kelor
Biji kelor
berkulit ACH
(%) (%) (%)
1 76,49 80,13 79,31
2 78,06 81,63 81,42
3 79,59 81,57 78,68
4 76,70 80,69 78,62
5 78,88 81,01 76,53
6 77,47 81,44 77,34
Rerata 77,87 81,08 78,65
SD 1,220 0,588 1,692
%RSD 1,567 0,725 2,152
Dari hasil koagulasi menggunakan koagulan biji kelor dan dengan ACH, diperoleh nilai F hitung 1,92, lebih kecil daripada F tabel. Artinya, variasi hasil koagulasi menggunakan biji kelor dan ACH tidak berbeda nyata. Sementara itu, nilai t
hitung 0,92 lebih kecil daripada t tabel. Artinya, kadar ion mangan dalam air baku hasil koagulasi menggunakan biji kelor dan dengan ACH tidak berbeda nyata.
Perhitungan hasil koagulasi menggunakan biji kelor berkulit dan dengan ACH menghasilkan nilai F hitung lebih besar daripada F tabel. Artinya, variasi penurunan konsentrasi ion mangan dalam air baku hasil koagulasi biji kelor berkulit dan dengan ACH berbeda nyata. Nilai t hitung 3,35 lebih besar daripada t tabel. Artinya, konsentrasi ion mangan dalam air baku hasil koagulasi dengan biji kelor berkulit dan ACH berbeda nyata. Perhitungan selengkapnya diberikan pada Lampiran 9.
13
SIMPULAN DAN SARAN
Simpulan
Hasil pengujian fitokimia menunjukkan bahwa dalam biji kelor terdapat senyawa alkaloid dan saponin.
Biji kelor berpotensi sebagai koagulan yang efektif. Biji kelor maupun biji kelor berkulit dapat digunakan pada proses koagulasi. Kondisi optimum untuk biji kelor adalah pada pH 6, waktu pengenapan selama 60 menit, dan konsentrasi koagulan 50 mg/L. Sementara kondisi optimum untuk biji kelor berkulit adalah pada pH 7, waktu pengenapan 60 menit, dan konsentrasi 80 mg/L.
Persen penurunan kekeruhan serta konsentrasi akhir ion besi pada air baku hasil koagulasi dengan biji kelor dan biji kelor berkulit berbeda nyata dengan hasil koagulasi menggunakan ACH. Sementara itu, konsentrasi akhir ion mangan hasil koagulasi menggunakan koagulan biji kelor tidak berbeda nyata dengan hasil koagulasi dengan ACH, tetapin berbeda nyata dengan koagulan biji kelor berkulit. Secara keseluruhan, air baku hasil koagulasi menggunakan koagulan biji kelor dan biji kelor berkulit telah memenuhi standar baku air bersih sesuai dengan Permenkes No 426/1990 untuk ketiga parameter yang diukur.
Saran
Perlu dilakukan analisis lanjutan dengan parameter yang lebih lengkap pada air hasil proses koagulasi untuk mengetahui terpenuhi atau tidaknya persyaratan standar baku air bersih. Koagulasi juga perlu diujikan dalam skala yang lebih besar, sehingga bisa diaplikasikan di masyarakat.
DAFTAR PUSTAKA
[APHA-AWWA] American Public Health Association-American Water Work Association. 2005. Standard For The Examination of Water and Waste Water Treatment. Washington DC: American Publich Health Association.
Bratby J. 1980. Coagulation and Floculation in Water and Waste Water Treatment. London: IWA.
Bratby J. 2006. Coagulation and Floculation in Water and Waste Water Treatment. London: IWA.
Candra A. 1998. Penentuan dosis optimum koagulan ferro sulfat-kapur flokulan chemifloc dan besfloc serta bioflokulan limbah cair pabrik tekstil [skripsi]. Bandung: Fakultas Teknologi Industri, Universitas Parahiyangan.
Chandra B. 2007. Pengantar Kesehatan
Lingkungan. Jakarta. Buku Kedokteran EGC.
[Depkes] Departemen Kesehatan. 1999. Peraturan Menteri Kesehatan Republik Indonesia Nomor 416/MENKES/PER/ XI/1990 tentang Daftar Persyaratan Kualitas Air Bersih.
Day RA, Underwood AL. 2002. Analisis Kimia Kuantitatif. Ed ke-6. Sopyan I, Wibi HH, Simarmata L, penerjemah; Jakarta: Erlangga. Terjemahan dari: Quantitative Analysis.
Drinan JE. 2001. Water and Wastewater Treatment A Guide for the Nonengineering Professional. Boca Raton: CRC Pr.
Duke JA. 1998. Handbook of Nuts. Boca Rotan. CRC Pr.
Dwirianti D 2008. Pengolahan lindi TPA Benowo dengan biji Moringa oleifera dan membran mikro-filter [skripsi]. Surabaya: Fakultas Teknik Sipil dan Perencanaan, Institut Teknologi Surabaya.
Enrico B. 2008. Pemanfaatan biji asam jawa (Tamarindus indica) sebagai koagulan alternatif dalam proses penjernihan limbah cair industri tahu [tesis]. Medan: Sekolah Pascasarjana, Universitas Sumatra Utara.
Effendi H. 2003. Telaah Kualitas Air. Yogyakarta: Kanisius.
Faust SD, Osman MA. 1983. Chemistry of Water Treatment.Boston: Butterworth.
Goyal BR, Agrawal BB, Goyal RK, Mehta AA. 2007. Phyto-pharmacology of
KAJIAN POTENSI BIJI KELOR (
Moringa oleifera
)
SEBAGAI KOAGULAN
RESTU SMINAR RAHAYU (MEINAR)
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
13
SIMPULAN DAN SARAN
Simpulan
Hasil pengujian fitokimia menunjukkan bahwa dalam biji kelor terdapat senyawa alkaloid dan saponin.
Biji kelor berpotensi sebagai koagulan yang efektif. Biji kelor maupun biji kelor berkulit dapat digunakan pada proses koagulasi. Kondisi optimum untuk biji kelor adalah pada pH 6, waktu pengenapan selama 60 menit, dan konsentrasi koagulan 50 mg/L. Sementara kondisi optimum untuk biji kelor berkulit adalah pada pH 7, waktu pengenapan 60 menit, dan konsentrasi 80 mg/L.
Persen penurunan kekeruhan serta konsentrasi akhir ion besi pada air baku hasil koagulasi dengan biji kelor dan biji kelor berkulit berbeda nyata dengan hasil koagulasi menggunakan ACH. Sementara itu, konsentrasi akhir ion mangan hasil koagulasi menggunakan koagulan biji kelor tidak berbeda nyata dengan hasil koagulasi dengan ACH, tetapin berbeda nyata dengan koagulan biji kelor berkulit. Secara keseluruhan, air baku hasil koagulasi menggunakan koagulan biji kelor dan biji kelor berkulit telah memenuhi standar baku air bersih sesuai dengan Permenkes No 426/1990 untuk ketiga parameter yang diukur.
Saran
Perlu dilakukan analisis lanjutan dengan parameter yang lebih lengkap pada air hasil proses koagulasi untuk mengetahui terpenuhi atau tidaknya persyaratan standar baku air bersih. Koagulasi juga perlu diujikan dalam skala yang lebih besar, sehingga bisa diaplikasikan di masyarakat.
DAFTAR PUSTAKA
[APHA-AWWA] American Public Health Association-American Water Work Association. 2005. Standard For The Examination of Water and Waste Water Treatment. Washington DC: American Publich Health Association.
Bratby J. 1980. Coagulation and Floculation in Water and Waste Water Treatment. London: IWA.
Bratby J. 2006. Coagulation and Floculation in Water and Waste Water Treatment. London: IWA.
Candra A. 1998. Penentuan dosis optimum koagulan ferro sulfat-kapur flokulan chemifloc dan besfloc serta bioflokulan limbah cair pabrik tekstil [skripsi]. Bandung: Fakultas Teknologi Industri, Universitas Parahiyangan.
Chandra B. 2007. Pengantar Kesehatan
Lingkungan. Jakarta. Buku Kedokteran EGC.
[Depkes] Departemen Kesehatan. 1999. Peraturan Menteri Kesehatan Republik Indonesia Nomor 416/MENKES/PER/ XI/1990 tentang Daftar Persyaratan Kualitas Air Bersih.
Day RA, Underwood AL. 2002. Analisis Kimia Kuantitatif. Ed ke-6. Sopyan I, Wibi HH, Simarmata L, penerjemah; Jakarta: Erlangga. Terjemahan dari: Quantitative Analysis.
Drinan JE. 2001. Water and Wastewater Treatment A Guide for the Nonengineering Professional. Boca Raton: CRC Pr.
Duke JA. 1998. Handbook of Nuts. Boca Rotan. CRC Pr.
Dwirianti D 2008. Pengolahan lindi TPA Benowo dengan biji Moringa oleifera dan membran mikro-filter [skripsi]. Surabaya: Fakultas Teknik Sipil dan Perencanaan, Institut Teknologi Surabaya.
Enrico B. 2008. Pemanfaatan biji asam jawa (Tamarindus indica) sebagai koagulan alternatif dalam proses penjernihan limbah cair industri tahu [tesis]. Medan: Sekolah Pascasarjana, Universitas Sumatra Utara.
Effendi H. 2003. Telaah Kualitas Air. Yogyakarta: Kanisius.
Faust SD, Osman MA. 1983. Chemistry of Water Treatment.Boston: Butterworth.
Goyal BR, Agrawal BB, Goyal RK, Mehta AA. 2007. Phyto-pharmacology of
14
Grubben GJH. 2004. Plant Resources of Tropical Africa 2 Vegetables. Belanda: PROTA Foundation.
Hadyana PA. 2002. Kamus Kimia. Jakarta. Balai Pustaka.
Harborne JB. 1987. Metode Fitokimia. Ed ke-2. Padmawinata K, Soediro I, penerjemah; Bandung: ITB Pr. Terjemahan dari:
Phytochemical Methods.
Harvey D. 2000. Modern Analytical Chemistry. New York: McGraw-Hill.
Hasbi, Purwanto E, Evawani. 2000. Pemanfaatan biji kelor (Moringa oleifera) untuk penurunan tingkat kekeruhan limbah cair pabrik kelapa sawit. Pekanbaru: Lembaga Penelitian Universitas Riau.
Hendric D. 2006. Water Treatment Unit Procesess: Physical and Chemical. Fort Collins: CRC Pr.
[ICH] International Conference on Harmo- niation of Technical Requirements for Registration of Pharmaceuticals for Human Use. 1996. Validation of
Analytical Procedures: Text and
Methodology Q2 (R1) [terhubung berkala]. www.bioforum.org.il [22 Apr 2010].
Jonni MS, Sitorus M, Katharina N. 2008.
Cegah Malnutrisi dengan Kelor.
Yogyakarta: Kanisius.
Katayon S et al. 2006. Preservation of coagulation efficiency of Moringa oleifera
a natural coagulant. Biotechnol Bioprocess Eng. 11: 489-495.
Khopkar SM. 1998. Konsep Dasar Kimia Analitik. Saptorahardjo A, Nurhadi A, penerjemah; Jakarta: UI Pr. Terjemahan dari: Basic Concept of Analytical Chemistry.
Kolawole OM, Oguntoye SO, Agbede O, Olayemi AB. 2006. The efficacy of
Bridelia ferruginea Benth. bark extract in reducing the ciliform load and BOD of domestic wastewater. Ethnobotanical Leaflets 10:228-238.
[Kurita] Kurita Water Industries. 1999. Kurita Handbook of Water Treatment. Ed ke-2. Tokyo: Kurita Water Industries.
Lin SD. 2007. Water and Wastewater Treatment Calculation Manual. Ed ke-2. New York: McGraw-Hill.
Mattjik AA, Sumertajaya IM. 2006.
Perancangan Percobaan dengan Aplikasi SAS dan MINITAB. Bogor: IPB Pr.
Muharto, Kuswytasari ND, Aunurohim. 2007. Biji kelor (Moringa oleifera) sebagai bahan penyerap untuk menurunkan kadar detergen logam berat serta bakteri dalam air jernih. Laporan Penelitian Hibah Bersaing. Surabaya: Institut Teknologi Surabaya.
Ndabigengesere A, Narasiah KS, Talbot BG. 1995. Active agents and mechanism of coagulation of turbid water Using Moringa oleifera. Water Res 29:701-710.
Pandia S, Husin A. 2005. Pengaruh massa dan ukuran biji kelor pada proses penjernihan air. J Teknol Proses 4:26-33.
Rambe AM. 2009. Pemanfaatan biji kelor (Moringa oleifera) sebagai koagulan alternatif dalam proses penjernihan limbah cair industri tekstil [tesis]. Medan: Sekolah Pascasarjana, Universitas Sumatra Utara.
Said NI, Wahyono HD. 1999. Pembuatan filter untuk menghilangkan zat besi dan mangan di dalam air. Jakarta: Balai Pengkajian Bioteknologi.
Sawyer CN, McCarty PL. 1978. Chemistry for Environmental Engineering. Ed Ke-3. New York. McGraw-Hill.
Singh VP, Yadava DN. 2003. Waste Water Treatment and Waste Management. New Delhi: Allied.
Soemirat. 2000. Kesehatan Lingkungan. Yogyakarta. Gajah Mada Univ Pr.
Sutherland JP, Folkard, Grant WD. 1990. Natural coagulant for appropriate water treatment. a novel approach. J. Waterlines
8:30-32.
15
Colombo: Intermediate Technology Publications. hlm 297- 299.
Sutrisno et al. 2006. Teknologi Penyediaan Air Bersih. Jakarta: Rineka Cipta.
Syukri. 1999. Kimia Dasar. Volume Ke-2.
Bandung. ITB Pr.
Vieira AMS, et al. 2009. Use of Moringa oleifera seed as a natural adsorbent for wastewater treatment. Water Air Soil Pollut 206:273-281.
[WELL] Water and Environmental Health at London and Loughborough. [tt]. Water clarification using Moringa oleifera seed coagulant. Loughborough: Loughborough University.
KAJIAN POTENSI BIJI KELOR (
Moringa oleifera
)
SEBAGAI KOAGULAN
RESTU SMINAR RAHAYU (MEINAR)
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
RESTU SMINAR RAHAYU (MEINAR). Kajian Potensi Biji Kelor (Moringa oleifera) Sebagai Koagulan. Dibimbing oleh LATIFAH K DARUSMAN dan WULAN TRI WAHYUNI
Pengadaan air minum masih menjadi masalah besar bagi beberapa negara. Salah satu penyebab adalah tingginya biaya pengolahan kimia air bersih. Oleh sebab itu, diperlukan ketersediaan material lokal yang cukup murah. Salah satu koagulan alami yang dapat digunakan sebagai pengganti bahan kimia sintetik adalah biji kelor (Moringa oleifera).
Dalam penelitian ini, dengan menggunakan metode uji jar, diperoleh kondisi optimum koagulasi dengan biji kelor ialah pada pH 6 dengan konsentrasi 50 mg/L dan waktu pengenapan 60 menit. Sementara kondisi optimum untuk koagulan biji kelor berkulit adalah pada pH 7 dengan konsentrasi 80 mg/L dan waktu pengenapan 60 menit. Sebelumnya, kondisi koagulasi optimum untuk aluminium klorohidrat (ACH) telah diketahui berturut-turut ialah pH 7, 10 mg/L, dan 10 menit.
Kondisi optimum masing-masing koagulan memberikan respons yang berbeda-beda terhadap penurunan kekeruhan, konsentrasi ion besi, dan ion mangan. Nilai rata-rata penurunan kekeruhan dengan koagulan biji kelor, biji kelor berkulit, dan ACH masing-masing 99,10; 99,07; dan 99,71%. Nilai rata-rata penurunan ion besi untuk ketiga koagulan di atas berturut-turut 98,30; 98,45; dan 98,98%, sedangkan nilai rata-rata penurunan ion mangan berturut-turut 77,87; 81,08; dan 78,65%. Nilai keterulangan yang dihitung sebagai standar deviasi relatif pada proses koagulasi menggunakan ketiga jenis koagulan pada pengukuran ketiga parameter di atas kurang dari 10%.
ABSTRACT
RESTU SMINAR RAHAYU (MEINAR). Study of Potential Kelor Seed (Moringa oleifera) as Coagulant. Under direction of LATIFAH K DARUSMAN and WULAN TRI WAHYUNI.
Adequate access to drinking water is still a huge problem for several countries. One of the reason is the high cost for water’s chemical treatment. Hence, there is a need for low cost and locally available materials. One of the natural coagulants that can be used as an alternative for synthetic chemicals is a seed of Moringa oleifera.
In this research, by using the jar test method, the optimum coagulation condition of M. oleifera seed was obtained at pH 6 with concentration of 50 mg/L and settling time of 60 minutes. The optimum condition of M.oleifera unskinned seeds as a coagulant was at pH 7 with concentration of 80 mg/L and settling time of 60 minutes. Previously, optimum coagulation conditions for aluminium chlorohydrate (ACH) has been obtained at pH 7, 10 mg/L, and 10 minutes, respectively.
KAJIAN POTENSI BIJI KELOR (
Moringa oleifera
)
SEBAGAI KOAGULAN
RESTU SMINAR RAHA