EKSTRAK RUMPUT LAUT
Gracilaria verrucosa
SEBAGAI
IMUNOSTIMULAN UNTUK MELAWAN
WHITE SPOT
PADA
UDANG VANAME
Litopenaeus vannamei
AMINATUL ZAHRA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Ekstrak Rumput Laut
Gracilaria verrucosa sebagai Imunostimulan untuk Melawan White Spot pada
Udang Vaname Litopenaeus vannamei adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2017
Aminatul Zahra
RINGKASAN
AMINATUL ZAHRA. Ekstrak Rumput Laut Gracilaria verrucosa sebagai Imunostimulan untuk Melawan White Spot pada Udang Vaname Litopenaeus
vannamei. Dibimbing oleh SUKENDA dan DINAMELLA WAHJUNINGRUM.
Salah satu penyakit yang menyerang udang vaname adalah penyakit White
Spot yang disebabkan oleh White Spot Syndrome Virus (WSSV). Dibutuhkan
upaya untuk mencegah penyebaran dari WSSV pada budidaya udang yang efektif, salah satunya adalah dengan pemberian imunostimulan. Bahan alami yang dapat dijadikan sebagai imunostimulan yang aman dan ramah lingkungan adalah rumput laut G. verrucosa. G.verrucosa memiliki kandungan senyawa polisakarida yang biasanya berisi galaktosa maupun galaktan bersulfat. Senyawa bioaktif dari
G.verrucosa bisa didapatkan dengan cara ekstraksi. Dalam proses ekstraksi
banyak faktor yang dapat mempengaruhi kandungan senyawa hasil ekstraksi diantaranya jenis pelarut. Uji bahan pelarut yang terbaik dalam proses ekstraksi
G.verrucosa perlu dilakukan. Pemberian ekstrak rumput laut G. verrucosa dalam
pakan diharapkan dapat menstimulasi sistem imun udang vaname.
Penelitian ini terdiri atas tiga tahapan. Penelitian tahap satu untuk menguji jenis pelarut yang terbaik terdiri dari tiga perlakuan, yaitu EA (etil asetat), MT (metanol), dan ET (etanol). Penelitian tahap dua yaitu menguji pengaruh dosis ekstrak G. verrucosa dalam pakan yang tepat untuk meningkatkan sistem imun dan resistensi udang vaname terhadap WSSV, terdiri dari enam perlakuan dan masing-masing tiga ulangan, yaitu KN (tanpa ekstrak), KP (tanpa ekstrak + infeksi WSSV), D2 (2 g/kg pakan + infeksi WSSV), D3 (3 g/kg pakan + infeksi WSSV), D4 (4 g/kg pakan + infeksi WSSV), dan D5 (5 g/kg pakan + infeksi WSSV). Penelitian tahap tiga yaitu menguji pengaruh lama pemberian ekstrak
G.verrucosa yang berbeda dalam meningkatkan kinerja produksi dan respons
imun udang vaname (L. vannamei) terhadap serangan penyakit WSSV, terdiri dari lima perlakuan dan tiga ulangan, yaitu CN (0 kali pemberian/bulan), CP (0 kali pemberian/bulan + infeksi WSSV), W1 (1 minggu pemberian/bulan + infeksi WSSV), W2 (2 minggu pemberian/bulan (interval 7 hari) + infeksi WSSV), dan WS (Setiap hari pemberian selama sebulan + infeksi WSSV). Udang vaname dengan bobot 6.07±0.1 g/ekor dipelihara dalam akuarium dengan ukuran 60×30×30 cm3 dengan padat tebar 10 ekor/akuarium. Udang diberi pakan ekstrak secara at satiation sebanyak tiga kali sehari. Parameter uji yang diamati adalah total hemosit (THC), aktifitas fagositosis (AF), diferensial hemosit (DHC), aktifitas phenoloksidase (PO), respiratory burst (RB), kelulushidupan, laju pertumbuhan harian (LPH), rasio konversi pakan (FCR), Nested PCR, histopatologi, dan gejala klinis.
96.67±5.74%, 26.67±5.74%, 43.33±5.74%, 46.67±5.74%, 56.67±5.74%, dan 36.67±5.74%. Perlakuan D2, D3, D4, dan D5 menunjukkan kelangsungan hidup yang lebih tinggi secara signifikan (P<0.05) dibandingkan dengan KP.
Hasil penelitian tahap tiga menunjukkan bahwa respons imun (THC, AF, RB, PO, dan Persentasi hialin) udang yang diberi pakan ekstrak mengalami peningkatan dibanding perlakuan CP maupun CN. Respons imun setelah uji tantang dengan WSSV pada perlakuan (W1, W2, dan WS) juga menunjukkan nilai yang lebih tinggi dibandingkan dengan kontrol, dan respons imun paling tinggi pada perlakuan W2. Kelangsungan hidup setelah uji tantang pada perlakuan CN, CP, W1, W2, dan WS berturut-turut sebesar 100.00±0.00%, 23.33±5.77%, 46.67±5.77%, 60.00±10.00%, dan 40.00±10.00%. Perlakuan W2 menunjukkan kelangsungan hidup yang paling tinggi signifikan (P<0.05) dibandingkan dengan perlakuan lainnya. Kinerja produksi udang (LPH dan Biomassa) pada perlakuan W2 dan WS menunjukkan hasil yang lebih tinggi signifikan (P<0.05) dengan perlakuan lainnya, sedangkan FCR tidak berbeda signifikan (P>0.05) antar semua perlakuan.
Konfirmasi WSSV pada penelitian tahap dua dengan menggunakan nested
PCR menunjukkan hasil bahwa udang (D2, D3, D4, D5, dan KP) positif terinfeksi WSSV. Konfirmasi WSSV pada penelitian tahap tiga dengan menggunakan
nested PCR menunjukkan hasil bahwa udang (W1, W2, WS, dan CP) positif
terinfeksi WSSV. Histologi udang yang terinfeksi WSSV menunjukkan bahwa adanya badan inklusi sedangkan pada udang normal tidak ditemukan. Perubahan gejala klinis secara morfologis pada udang yang terinfeksi WSSV terjadinya perubahan warna kemerahan (discolouration) pada tubuh, kaki renang, dan ekor sedangkan udang normal pada tubuh, kaki renang, dan ekor berwarna putih bersih. Pada udang yang terinfeksi WSSV usus kosong serta hepatopankreas berwarna kekuningan (pucat) sedangkan pada udang normal usus penuh dan hepatopankreas berwarna hitam kecoklatan. Disimpulkan bahwa ekstraksi G. verrucosa dengan pelarut etil asetat menghasilkan senyawa bahan aktif paling tinggi dan pemberian ektrak G. verrucosa pada dosis 4 g/kg pakan dengan lama pemberian selama 2 minggu (interval 7 hari) dapat meningkatkan respons imun dan resistensi terbaik terhadap infeksi WSSV.
SUMMARY
AMINATUL ZAHRA. Extract of Seaweed Gracilaria verrucosa as Immunostimulant to Resist White SpotDiseasein The White Shrimp Litopenaeus
vannamei. Supervised by SUKENDA and DINAMELLA WAHJUNINGRUM.
One of diseases in the white shrimp is white spot disease that caused by White Spot Syndrom Virus (WSSV). Thus, effective effort to prevent WSSV outbreak in shrimp farming is required, and one of which is the administration of immunostimulant. One of herbals that can be used as safety and eco-friendly immunostimulant is seaweed Gracilaria verrucosa. G. verrucosa has polysaccharides compound which has galactose or sulfated galactan. Bioactive compound of G.verrucosa can be obtained by extraction. In the extraction process, there are many factors that can affect the compounds resulted from the extraction, including the type of solvent. Study about the best solvent in G.
verrucosa extractionis needed to do.The administration of seaweed G. verrucosa
extractin diet is expected to stimulate immune system in the white shrimp.
This study consisted of three experiments. The first experiment was aim to determine the effect of different solvent to produce the best compound in extract
G.verrucosa which consisted of three treatments, namely EA (Etil Asetat), MT
(Methanol), and ET (Ethanol).The second experiment was conducted to examine the best dose of G. verrucosa extract through feed ,consist of six treatments in three replicates respectively, namely KN (without extract), KP (without extract + infected WSSV), D2 (2 g/kg feed + infected WSSV) , D3 (3 g/kg feed + infected WSSV), D4 (4 g/kg feed + infected WSSV), and D5 (5 g/kg feed + infected WSSV). The third experiment was conducted to examine the effect of different duration of the G.verrucosa extract administration to improve the production performance and enhance the immune response white shrimp (L. vannamei) against WSSV disease, consisted of five treatments and three replicates, namely CN (0 administration/month), CP (0 administration/ month + infected WSSV), W1 (a week of administration/ month + infected WSSV), W2 (2 weeks of administration/ month (interval 7 days) + infected WSSV), and WS (Every days administration in a month + infected WSSV). White shrimp with initial body weight of 6.07±01 g/shrimp were reared in the 60×30×30 cm3 with density of 10 shrimps/aquarium. White shrimp had been fed medicated feed at satiation three times daily. Test parameters examined were total hemocytes count (THC), phagocytic activity (AF), differential hemocytes (DHC), phenoloksidase activity (PO), respiratory burst (RB), survival rate, daily growth rate (LPH), feed conversion ratio (FCR), nested PCR, histopathology , and clinical symptoms.
The result of first experimet showed that the best solvent for extraction G.
verrucosa was obtained in EA treatment. The result of the second experiment
56.67 ± 5.74%, and 36.67 ± 5.74% respectively. Treatment D2, D3, D4, and D5 showed significantly higher survival (P <0.05) compared with KP.
Result of third experiment showed that the immune response (THC, AF, RB, PO, and the hyalin percentage) shrimp fed medicated feed increased compared to CP and CN. The immune response post-challenge test with WSSV in treatment also showed a higher value compared to the control, and the highest immune response was obtained in treatment W2. Survival post-challenge test in the treatment of CN, CP, W1, W2, and WS were 100.00±0.00%, 23.33±5.77%, 46.67±5.77%, 60.00±10.00%, and 40.00±10.00%, respectively. Treatment W2 showed highest survival (P <0.05) compared with other treatments significantly. Shrimp performance production (LPH, and biomass) showed W2 and WS in the highest significant value (P<0.05) compared with other treatment, while FCR among all treatments was not significantly different (P>0.05).
Confirmation of WSSV at second experiment using nested PCR showed that shrimps (D2, D3, D4, D5, and KP) were positively infected by WSSV. Confirmation of WSSV in third experiment using nested PCR showed that shrimps (W1, W2, WS, and CP) were positively infected by WSSV. Histology of shrimp which infected with WSSV showed the occurence of inclusion bodies whereas not found in normal shrimp. Morphological changes of clinical symptoms in WSSV infected shrimp showed reddish color change (discolouration) on body, swimming legs, and tail while the color of body, the swimming legs, and tail of normal shrimp were pure white. In Empty intestine and yellowish (pale) hepatopancreas were found in WSSV infected shrimp while the intestine is full and the color of hepatopancreasis brownish-black in normal shrimp. It was concluded that the best solvent for extraction G. verrucosa with ethyl acetate and 4 g/kg dose of G. verrucosa extract to enhance immune response and resistance to WSSV infection. Moreover, the duration of G. verrucosa extract administration for 2 weeks (every 7 days) gave the best result on production performance and immune response on white shrimp.
© Hak Cipta Milik IPB, Tahun 2017
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
EKSTRAK RUMPUT LAUT
Gracilaria verrucosa
SEBAGAI
IMUNOSTIMULAN UNTUK MELAWAN
WHITE SPOT
PADA
UDANG VANAME
Litopenaeus vannamei
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2017
PRAKATA
Puji dan syukur penulis ucapkan kehadirat Allah SWT, karena atas berkat dan kasihNya penulis dapat menyelesaikan karya ilmiah dengan judul “Ekstrak Rumput Laut Gracilaria verrucosa sebagai Imunostimulan untuk Melawan White
Spot pada Udang Vaname Litopenaeus vannamei”. Karya ilmiah ini diajukan
sebagai salah satu syarat untuk memperoleh gelar Magister Sains.
Terima kasih kepada Bapak Dr Ir Sukenda, MSc dan Ibu Dr Dinamella Wahjuningrum, S.Si M.Si selaku komisi pembimbing yang sudah memberikan saran dan arahan hingga selesainya karya imiah ini. Terima kasih juga diucapkan kepada Ibu Dr Ir Mia Setiawati, M Si selaku penguji luar komisi dan Ibu Dr Ir Widanarni, M Si selaku ketua program studi Ilmu Akuakultur. Terima kasih penulis ucapkan kepada Ayahanda Drs. Sairi Batubara dan Ibunda Erisda Lubis beserta seluruh keluarga besar yang sudah memberikan doa, nasehat, dan motivasi dalam menyelesaikan studi ini. Ungkapan terima kasih juga diucapkan kepada seluruh pihak, terkhusus teman-teman AKU 2014 yang tidak dapat penulis sebutkan namanya satu persatu yang telah banyak membantu hingga selesainya karya imiah ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2017
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 3
2 BAHAN DAN METODE 3
Waktu dan Tempat 3
Materi Uji 3
Rancangan Penelitian 4
Prosedur Penelitian 4
Parameter Pengamatan 6
Analisis Data 8
3 HASIL DAN PEMBAHASAN 9
Hasil 9
Pembahasan 21
4 SIMPULAN DAN SARAN 26
Simpulan 26
Saran 26
DAFTAR PUSTAKA 27
LAMPIRAN 30
DAFTAR TABEL
1 Hasil uji kuantitif fitokimia ekstrak G. verrucosa 9
2 Kinerja produksi udang (L. vannamei) 20
DAFTAR GAMBAR
1 Total hemosit (THC) udang (L. vannamei) sebelum uji tantang (akhir perlakuan pemberian ekstrak) dan setelah uji tantang 10 2 Aktifitas fagositosis udang (L. vannamei) sebelum uji tantang (akhir
perlakuan pemberian ekstrak) dan setelah uji tantang 10 3 Aktifitas phenoloksidase (PO) udang (L. vannamei) sebelum uji tantang
(akhir perlakuan pemberian ekstrak) dan setelah uji tantang 11
4 Respiratory burst udang (L. vannamei) sebelum uji tantang (akhir
perlakuan pemberian ekstrak) dan setelah uji tantang 12 5 Sel hialin udang (L. vannamei) sebelum uji tantang (akhir perlakuan
pemberian ekstrak) dan setelah uji tantang 12
6 Sel granular udang (L. vannamei) sebelum uji tantang (akhir perlakuan
pemberian ekstrak) dan setelah uji tantang 13
7 Kelulushidupan udang (L. vannamei) sebelum uji tantang (akhir perlakuan pemberian ekstrak) dan setelah uji tantang 13 8 Gejala klinis pada udang vaname setelah uji tantang dengan WSSV 14
9 Histologi udang setelah uji tantang WSSV 14
10 Analisis nested PCR 15
11 Total hemosit (THC) udang (L. vannamei) sebelum uji tantang (akhir perlakuan pemberian ekstrak) dan setelah uji tantang 16 12 Aktifitas fagositosis udang (L. vannamei) sebelum uji tantang (akhir
perlakuan pemberian ekstrak) dan setelah uji tantang 16 13 Aktifitas phenoloksidase (PO) udang (L. vannamei) sebelum uji tantang
(akhir perlakuan pemberian ekstrak) dan setelah uji tantang 17
14 Respiratory burst udang (L. vannamei) sebelum uji tantang (akhir
perlakuan pemberian ekstrak) dan setelah uji tantang 18 15 Sel hialin udang (L. vannamei) sebelum uji tantang (akhir perlakuan
pemberian ekstrak) dan setelah uji tantang 18
16 Sel granular udang (L. vannamei) sebelum uji tantang (akhir perlakuan
pemberian ekstrak) dan setelah uji tantang 19
17 Kelulushidupan udang (L. vannamei) sebelum uji tantang (akhir perlakuan pemberian ekstrak) dan setelah uji tantang 19
1
PENDAHULUAN
Latar Belakang
Salah satu penyakit yang menyerang udang vaname adalah penyakit White
Spot yang disebabkan oleh White Spot Syndrome Virus (WSSV). Virus ini dapat
mengakibatkan total kematian 100% pada 2 sampai 10 hari penyerangan (Wang et al. 2007). Di Indonesia, WSSV menyerang udang di Jawa Barat, Banten, Bali, Lampung, dan Sulawesi Selatan (Rukyani 2000).
Salah satu upaya untuk mencegah serangan WSSV pada budidaya udang yang tidak memberikan dampak kepada kesehatan konsumen dan lingkungan adalah dengan pemberian imunostimulan dari bahan alami yang ramah lingkungan. Imunostimulasi merupakan cara untuk memperbaiki fungsi sistem imun dengan menggunakan bahan yang menginduksi sistem tersebut (Baratawidjaja 2006). Menurut Treves-Brown (2000) imunostimulan merupakan bahan yang bisa meningkatkan resistensi organisme terhadap infeksi patogen. Pemberian imunostimulan secara luas dengan maksud untuk mengaktifkan sistem imun non spesifik sel seperti makrofag pada vertebrata dan hemosit pada avertebrata (Dugger dan Jory 1999). Salah satu bahan alami yang dapat dijadikan sebagai bahan imunostimulan yang aman dan ramah lingkungan adalah rumput laut Gracilaria verrucosa.
G.verrucosa merupakan rumput laut yang memiliki komponen utama kimia
berupa agar dan karagenan (Angka dan Maggy 2000). G.verrucosa dapat digunakan sebagai imunostimulan karena memiliki kandungan senyawa polisakarida (Anggadiredja et al. 2006), yang biasanya berisi galaktosa maupun galaktan bersulfat (Naidu 2000). Polisakarida tersebut memiliki sifat antiviral, antikoagulasi, antitumor dan aktifitas immunomodulatory pada mamalia (Castro
et al. 2006). Polisakarida dari rumput laut dapat menstimulasi sistem imun non
spesifik dalam hal ini fagositosis dan aktifitas respiratory burst melalui mekanisme interaksi molekul dengan permukaan reseptor (receptor-mediated).
Senyawa bioaktif dari G.verrucosa bisa didapatkan dengan cara ekstraksi. Dalam proses ekstraksi suatu bahan tanaman, banyak faktor yang dapat mempengaruhi kandungan senyawa hasil ekstraksi diantaranya jenis pelarut. Setiap pelarut memiliki kepolaran yang berbeda-beda sehingga akan mempengaruhi banyaknya senyawa aktif yang terlarut dalam proses ekstraksi
G.verrucosa. Pelarut heksana, eter, dan kloroform digunakan untuk mengambil
senyawa dengan kepolaran rendah sedangkan pelarut yang lebih polar misalnya metanol, etanol dan etil asetat digunakan untuk mengambil senyawa yang lebih polar (Rusdi 1990). Oleh karena itu perlu dilakukan uji bahan pelarut yang berbeda, yaitu etil asetat, metanol, dan etanol dalam proses ekstraksi G.verrucosa. Hasil uji fitokimia ekstrak kasar rumput laut G. verrucosa menunjukkan kandungan senyawa alkaloid, flavonoid, dan steroid dalam rumput laut
G.verrucosa (Siregar et al. 2012). Senyawa alkaloid, flavonoid, dan steroid
merupakan senyawa bioaktif yang memiliki aktifitas sebagai antivirus dan antioksidan (Angka dan Maggy 2000). Alkaloid sebagai antioksidan telah terbukti sangat ampuh mencegah radikal bebas, singlet oxygen species (O2), liped
2
menetralisir radikal bebas seperti superoxide dan hydroxyl radical. Steroid sebagai antivirus mampu mengganggu replikasi virus(Al Jaber et al. 2011)
Wongprasert et al. (2013) menyatakan sulfated galactan yang diisolasi dari rumput laut Gracilaria fisheri dengan dosis 100-200 µg/mL selama 7 hari dapat meningkatkatkan sistem imun dan aktifitas antiviral pada udang vaname yang diinfeksi dengan WSSV. Sirirustananun et al. (2011) menyatakan bahwa penambahan Gracilaria tenuistipitata pada pakan dengan dosis 0.5 hingga 2.0 g/kg selama 14 hari dapat meningkatkan sistem imun pada udang vaname yang diinfeksi dengan WSSV. Menurut Jasmanindar (2009) penggunaan ekstrak G.
verrucosa dengan dosis 50 µg/g bobot udang dalam meningkatkan sistem
ketahanan udang vaname memberikan hasil dapat meningkatkan resistensi udang vaname terhadap infeksi bakteri Vibrio harveyi hingga 73.3% dan 2 kali pemberian (interval 14 hari) ekstrak G. verrucosa selama 30 hari pemeliharaan mampu memberikan kelangsungan hidup hingga 86.7%.
Pemberian imunostimulan harus memperhatikan dosis optimal yang digunakan (Hai 2015), karena dosis imunostimulan yang tinggi dapat menekan respons imun, dan dosis yang rendah bisa kurang efektif atau tidak cukup untuk memberikan respons imun. Sehingga perlu dilakukan penelitian tentang pemberian ekstrak rumput laut G. verrucosa sebagai imunostimulan pada pakan udang vaname guna menentukan dosis pemberian pakan yang tepat. Durasi periode pemberian imunostimulan untuk mencapai proteksi yang optimal merupakan hal yang penting dalam pemberian imunostimulan (Couso et al. 2003). Menurut Cheng et al. (2004) pemberian imunostimulan secara berkelanjutan diperlukan untuk lebih memberikan kemampuan sistem imun dalam merespons patogen yang masuk kedalam tubuh. Hai (2015) menyatakan dosis dan lama pemberian imunostimulan pada level yang optimal harus dipertimbangkan.
Perumusan Masalah
Salah satu penyakit yang menyerang udang vaname adalah penyakit White
Spot yang disebabkan oleh WSSV. Sehingga dibutuhkan upaya untuk mencegah
infeksi WSSV pada udang yang efektif, salah satunya adalah dengan pemberian imunostimulan. Salah satu bahan alami yang dapat dijadikan sebagai imunostimulan yang aman dan ramah lingkungan adalah rumput laut G.
verrucosa. G.verrucosa memiliki kandungan berupa komponen agar yang di
dalamnya terdapat senyawa polisakarida. Polisakarida pada alga merah biasanya berisi galaktosa maupun galaktan bersulfat. Senyawa bioaktif dari G.verrucosa
3 Tujuan Penelitian
Penelitian ini bertujuan untuk:
1 Menguji jenis pelarut yang berbeda dalam ekstraksi G. verrucosa untuk mendapatkan kandungan senyawa bioaktif yag lebih banyak
2 Menentukan dosis ekstrak G. verrucosa dalam pakan yang tepat untuk meningkatkan sistem imun dan resistensi udang vaname terhadap WSSV 3 Menguji lama pemberian yang berbeda dari dosis yang terbaik untuk
peningkatan kinerja produksi dan meningkatkan sistem imun serta resistensi udang vaname terhadap WSSV.
Manfaat Penelitian
Hasil dari penelitian ini diharapkan dapat memberikan informasi mengenai jenis pelarut yang terbaik dalam ekstraksi G.verrucosa, serta dosis dan lama pemberian ekstrak rumput laut G. verrucosa yang terbaik sebagai imunostimulan untuk peningkatan kinerja produksi dan meningkatkan sistem imun serta resistensi udang vaname terhadap WSSV.
2
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Agustus 2015 sampai Oktober 2015. Analisis fitokimia dilaksanakan di Laboratorium Vicomas, Cibinong, Bogor. Pemeliharaan udang uji dan analisis respons imun dilaksanakan di di Laboratorium Kesehatan Organisme Akuatik, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Konfirmasi WSSV dengan nested PCR dilaksanakan di Balai Penelitian dan Pengembangan Budidaya Air Tawar Bogor.
Materi Uji
Udang uji yang digunakan adalah udang vaname (L. vannamei) yang diambil dari lokasi budidaya udang vaname di Bakauheni, Lampung. Bobot udang vaname yang digunakan berukuran 6.07±0.10 g/ekor. Sebelum perlakuan udang diaklimatisasi selama 2 minggu pada suhu 28 °C dalam bak fiber. Setiap akuarium diisi dengan udang sebanyak 10 ekor.
Imunostimulan yang digunakan adalah G. verrucosa yang telah berumur 1.5 bulan dikumpulkan dari lokasi budidaya rumput laut di Muara Gembong, Bekasi.
G. verrucosa dipilih yang telah berumur 1.5 bulan, karena apabila panen
4
Rancangan Penelitian
Rancangan yang digunakan pada penelitian ini adalah Rancangan Acak Lengkap (RAL). Penelitian ini terdiri atas tiga tahapan. Penelitian tahap satu untuk menguji jenis pelarut yang terbaik terdiri dari tiga perlakuan, yaitu
Perlakuan EA : Etil Asetat Perlakuan MT : Metanol Perlakuan ET : Etanol
Penelitian tahap dua untuk menguji dosis yang tepat terdiri dari enam perlakuan dan masing-masing tiga ulangan, yaitu
Kontrol – (KN) : Tanpa ekstrak G. verrucosa
Kontrol + (KP) : Tanpa ekstrak G. verrucosa + infeksi WSSV
Perlakuan D2 : Dosis ekstrak G. verrucosa 2 g/kg pakan + infeksi WSSV Perlakuan D3 : Dosis ekstrak G. verrucosa 3 g/kg pakan + infeksi WSSV Perlakuan D4 : Dosis ekstrak G. verrucosa 4 g/kg pakan + infeksi WSSV Perlakuan D5 : Dosis ekstrak G. verrucosa 5 g/kg pakan + infeksi WSSV
Penelitian tahap tiga untuk menguji lama pemberian yang tepat terdiri dari lima perlakuan dan tiga ulangan, yaitu
Kontrol - (CN) : 0 kali pemberian/bulan
Kontrol + (CP) : 0 kali pemberian/bulan + infeksi WSSV
Perlakuan W1 : 1 minggu pemberian/bulan (awal pemeliharaan) + infeksi WSSV Perlakuan W2 : 2 minggu pemberian/bulan (interval 7 hari) + infeksi WSSV Perlakuan WS : Setiap hari pemberian selama sebulan+ infeksi WSSV
Prosedur Penelitian
Penelitian tahap I
Rumput laut G. verrucosa dicuci dengan air laut dan air tawar untuk menghilangkan garam dan mikroorganisme yang menempel pada rumput laut. Alga yang telah bersih dikeringkan di udara terbuka (kering udara) tanpa terkena cahaya matahari langsung. Selanjutnya sampel yang sudah kering digiling halus dan diayak menggunakan saringan halus (60 mesh size). Rumput laut yang sudah halus dicampur dalam pelarut.
Ekstraksi dilakukan dengan menambahkan pelarut sesuai dengan perlakuan dengan perbandingan 1:5 (w/v), kemudian dimaserasi selama 24 jam, diendapkan dan kemudian disaring. Filtrat yang diperoleh diuapkan dengan menggunakan
vacum rotary evaporator pada suhu 50 oC hingga diperoleh ekstrak kental.
Ekstrak G. verrucosa yang didapatkan kemudian diuji kandungan sulfat galaktan dan uji fitokimianya secara kualitatif dan kuantitatif untuk mengetahui bahan bioaktif yang terkandung di dalamnya. Untuk kegiatan ekstraksi selanjutnya, pelarut yang digunakan adalah pelarut yang memiliki kandungan bioaktif paling banyak diekstrak dengan pelarut tersebut.
Penelitian tahap II
Persiapan Wadah
5 Sebelum digunakan akuarium disterilisasi menggunakan kaporit sebanyak 100 ppm selama 24 jam, kemudian dibilas dengan air bersih dan dikeringkan. Selanjutnya diisi dengan air laut yang sudah diendapkan selama 24 jam dengan ketinggian air 20 cm, dan diaerasi selama 24 jam.
Pembuatan Pakan Uji
Ekstrak G.verrucosa berdasarkan dosis perlakuan yang telah ditentukan dilarutkan terlebih dahulu dalam 98 mL akuades steril yang sebelumnya telah ditambahkan putih telur sebanyak 2 g sebagai binder. Larutan tersebut dicampurkan secara merata ke dalam pakan udang komersial yang telah disiapkan. Pakan dikeringkan menggunakan oven pada suhu 37 °C.
Pemeliharaan Udang
Udang diberi pakan perlakuan at satiation sesuai dengan perlakuan, 3 kali sehari. Udang dipelihara selama 14 hari dan uji tantang dilakukan pada hari ke-15. Setelah uji tantang, pakan yang diberikan adalah pakan komersial biasa (tanpa ekstrak). Kualitas air selama masa pemeliharaan dipertahankan pada suhu 29 sampai 30 °C, pH 7.8 sampai 8.3; oksigen terlarut 5.8 sampai 7.2 ppm, salinitas 24 sampai 25 ppt, dan TAN 0.11 sampai 0.19 ppm. Adapun persyaratan kualitas air pemeliharaan udang vaname sesuai dengan Boyd (1990) adalah suhu 28 sampai 30 °C, pH 8.0 sampai 9.0, oksigen terlarut 6.0 sampai 10.0 ppm, salinitas 15 sampai 25 ppt, dan TAN ≤ 1 ppm.
Uji Tantang WSSV
Uji tantang WSSV pada udang vaname dilakukan secara injeksi. Udang yang digunakan untuk menginfeksi adalah udang yang telah terinfeksi oleh WSSV dan memperlihatkan gejala klinis adanya bintik putih pada permukaan karapas udang yang sebelumnya telah dilakukan konfirmasi menggunakan nested PCR
(Polymerase Chain Reaction). Sebanyak 1 gram organ udang yang terinfeksi
WSSV digerus sampai halus dan dilarutkan dalam 9 mL PBS (Phosfat Buffer
Saline), kemudian disentrifuse dengan kecepatan 3000 rpm selama 30 menit dan
8000 rpm selama 20 menit. Supernatan yang dihasilkan disaring dengan kertas miliphore 0.45 μm menggunakan filter holder dan syringe (Hameed et al. 1998). Uji penularan WSSV dilakukan melalui injeksi secara intramuskular pada segmen ketiga abdomen dengan 0.1 mL larutan virus yang diencerkan sampai 10-3 dengan PBS. Udang kontrol negatif diinjeksi dengan PBS (Yao et al. 2015).
Pengambilan Hemolim
Sebanyak 0.6 mL hemolim diambil dari pangkal kaki renang, menggunakan
syringe 1 mL berisi 0.4 mL antikoagulan Na-sitrat, kemudian dihomogenkan
6
Penelitian Tahap III
Prosedur penelitian pada tahap III sama dengan prosedur tahap II pada persiapan wadah dan hewan uji, serta pembuatan pakan uji. Dosis ekstrak yang digunakan dalam eksperimen ini yaitu dosis terbaik dalam meningkatkan imunitas udang dan ketahanan terhadap infeksi WSSV. Udang dipelihara selama 28 hari dan diuji tantang pada hari ke-29 sesuai dengan prosedur pada tahap II. Setelah uji tantang, pakan yang diberikan adalah pakan komersial biasa (tanpa ekstrak). Pengambilan hemolim sesuai prosedur pada penelitian tahap II.
Parameter Pengamatan
Konfirmasi Keberadaan WSSV Menggunakan nested PCR
Pemeriksaan virus dengan metode nested PCR dilakukan guna mengkonfirmasi keberadaan virus WSSV pada udang vaname setelah diinfeksi dari setiap ulangan menggunakan metode Kimura et al. (1996).
Histopatologi
Histopatologi diambil dari jaringan hepatopankreas udang pada setiap akhir pengamatan setelah infeksi. Sampel udang digunakan diambil dari perlakuan KP dan KN (masing- masing 2 ekor) untuk mengetahui tingkat kerusakan jaringan yang terjadi akibat WSSV dan pengaruh perlakuan yang diberikan. Hepatopankreas yang diambil dari udang uji difiksasi terlebih dahulu dengan larutan fiksatif Davidson minimal satu hari. Kemudian organ dipotong 3 sampai 5 mm dan 1x1 cm, selanjutnya dilakukan dehidrasi, clearing, impregnasi,
embedding, dan blocking parrafin. Block jaringan selanjutnya diiris menggunakan
mikrotom 5 µm dan diwarnai dengan hematoxylin-eosin. Total Hemosit
Total hemosit dihitung sesuai metode Liu dan Chen 2004. Satu tetes larutan hemolim diletakkan pada hemocytometer dan jumlah sel per mL dihitung.
Total Hemosit = ∑ sel terhitung x 1
Volume kotak besar x Faktor pengencer Diferensial Hemosit
Diferensial Hemosit dihitung sesuai metode Sung et al. 1999. Dihitung dengan cara: hemolim diteteskan pada gelas objek dan dibuat ulasan, dikeringkan dan difiksasi dengan metanol selama 5 menit. Kemudian dikering anginkan dan diwarnai dengan larutan giemsa selama 10 menit, dicuci dengan air mengalir dan dibiarkan kering. Ulasan kemudian diperiksa di bawah mikroskop dengan pembesaran 100 kali. Diferensial hemosit dihitung berdasarkan persentase jenis sel hemosit.
Persentase jenis sel hemosit = Jumlah tiap je nis hemosit
Total hemosit x 100 Aktifitas Fagositosis
7 menit dan diwarnai dengan Giemsa (10%) selama 15 menit. Aktifitas fagositosis diukur berdasarkan presentase sel-sel fagosit yang menunjukkan proses fagositosis (Anderson dan Siwicki 1993).
Aktifitas Fagositik (%) = Jumlah sel fagosit yang melakukan fagositosis
Jumlah sel fagosit x 100 Aktifitas Phenoloksidase (PO)
Untuk mengukur aktifitas phenoloksidase secara spektrofotometer oleh perekaman pembentukan dopachrome yang dihasilkan dari L-dihydroxyphenylalanine (L-DOPA) (Liu dan Chen 2004), hemolim yang diencerkan disentrifugasi pada 700 × g pada 4 oC selama 20 menit; cairan supernatant dibuang dan pellet dibilas, disuspensikan kembali secara perlahan dalam cacodylate-citrate buffer (0.01 M sodium cacodylate, 0.45 M sodium chloride, 0.10 M trisodium citrate, pH 7.0) dan disentrifugasi ulang. Pellet kemudian diresuspended dengan 200 µl cacodylate buffer (0.01 M sodium cacodylate, 0.45 M sodium chloride, 0.01 M calcium chloride, 0.26 M magnesium chloride, pH 7 dan 100 µL aliqout diinkubasi dengan 50 µL trypsin (1 mg/mL) sebagai aktivator selama 10 menit pada 25 sampai 26 oC, 50 µL L-DOPA ditambahkan, diikuti oleh 800 µL cacodylate buffer 5 menit kemudian. Optical
density pada 490 nm diukur menggunakan spektrofotometer Hitachi U-2000.
Optical density aktifitas phenoloksidase udang diekspresikan sebagai
pembentukan dopachrome dalam 50 µL hemolim.
Respiratory Burst (RB)
Respiratory burst dari hemosit diukur berdasarkan reduksi NBT (nitroblue
tetrazolium) sebagai ukuran superoxide anion (O2-) (Cheng et al. 2004). Sebanyak
50 µL campuran hemolim-antikoagulan diinkubasi selama 30 menit dalam suhu ruang. Selanjutnya disentrifugasi dengan kecepatan 3000 rpm selama 20 menit dan supernatan dibuang. Ditambahkan 100 µL NBT dalam larutan HBSS (hank's
buffered saltsolution dengan konsentrasi 0.3%) dan didiamkan selama 2 jam pada
suhu ruang. Kemudian disentrifugasi 3000 rpm selama 10 menit, supernatan dibuang dan ditambahkan 100 µL metanol absolut untuk selanjutnya disentrifugasi 3000 rpm selama 10 menit (supernatan dibuang). Pelet yang terbentuk kemudian dibilas sebanyak 2 kali dengan metanol 70%. Selanjutnya 120 µL KOH (2M) dan 140 µL DMSO (dimethylsulfoxide) ditambahkan untuk melarutkan pelet. Pelet yang larut kemudian dimasukkan ke dalam microplate
untuk diukur densitas optikal (OD) menggunakan microplate reader pada panjang gelombang 630 nm. Respiratory burst dinyatakan sebagai reduksi NBT per 10 µL hemolim.
Gejala Klinis
8
Kelulushidupan
Kelulushidupan dihitung sebelum uji tantang dan 9 hari setelah uji tantang dengan rumus yang digunakan dalam Daniels et al. (2010):
KH (%) = Nt
No x 100 Keterangan:
KH : Kelulushidupan (%)
Nt : Jumlah udang hidup pada akhir penelitian (ekor) No : Jumlah udang hidup pada awal penelitian (ekor) Laju Pertumbuhan Harian
Laju pertumbuhan harian (LPH) dihitung setelah 30 hari perlakuan dengan rumus yang digunakan dalam Daniels et al. (2010):
LPH (%) = ln Wt−ln Wo
t x 100 Keterangan:
LPH : Laju pertumbuhan harian(%)
Wt : Bobot rata-rata udang pada akhir penelitian (g) Wo : Bobot rata-rata udang pada awal penelitian (g) t : Periode penelitian (hari)
Rasio Konversi Pakan
Rasio konversi pakan atau feed conversion ratio (FCR) dihitung setelah pemeliharaan dengan rumus yang digunakan dalam Daniels et al.(2010):
FCR = F Bt−Bo Keterangan :
FCR : Konversi pakan F : Jumlah pakan
Bt : Biomassa udang akhir penelitian (g) Bo : Biomassa udang awal penelitian (g)
Analisis Data
Analisis data dilakukan dengan dua metode yaitu analisis ragam (analysis of
variance/ANOVA) pada selang kepercayaan 95% (α=0,05) dan analisis deskriptif.
ANOVA digunakan untuk analisis data total hemosit, aktifitas fagositosis, diferensial hemosit, aktifitas phenoloksidase, respiratory burst, kelulushidupan, laju pertumbuhan spesifik, dan rasio konversi pakan. Apabila terdapat perbedaan antar perlakuan maka analisis dilanjutkan dengan uji Duncan menggunakan
software SPSS 17. Sedangkan analisis deskriptif digunakan untuk analisis data
9
3
HASIL DAN PEMBAHASAN
Hasil
Hasil penelitian masing-masing tahap, yaitu penelitian tahap satu, dua, dan tiga disajikan sebagai berikut:
Penelitian tahap I
Senyawa bahan aktif paling banyak seperti phenol, vanilin, phytol, ester, sulfat, dan galaktosa pada G. verrucosa terdapat pada perlakuan bahan pelarut etil asetat. Hasil uji kuantitatif fitokimia ekstrak G. verrucosa disajikan pada Tabel 1. Tabel 1 Hasil uji kuantitatif fitokimia ekstrak G. verrucosa
Jenis Bahan Aktif Hasil Analisis (mL/L) Metode Etil Asetat Metanol Etanol
Phenol 1.22 1.23 0.12 HPLC
Vanilin 4.55 2.01 1.41 HPLC
Phytol 18.00 10.00 15.00 HPLC
Ester 26.00 19.00 15.00 HPLC
Kandungan Sulfat 36.00 25.00 20.00 Spektrofotometri
Kandungan Galaktosa 39.00 34.00 32.00 HPLC
Penelitian tahap II
Parameter uji yang diukur pada penelitian tahap dua, yaitu respons imun dan konfirmasi WSSV disajikan pada hasil berikut.
Respons Imun
Respons imun (total hemosit, diferensial hemosit, aktifitas fagositosis, aktifitas phenoloksidase, dan respiratory burst) yang diukur pada awal, sebelum, dan setelah uji tantang WSSV disajikan pada hasil berikut.
Total Hemosit
10
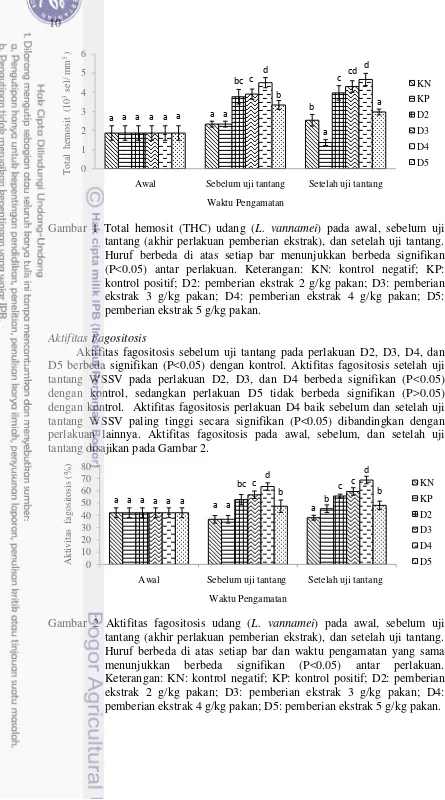
Gambar 1 Total hemosit (THC) udang (L. vannamei) pada awal, sebelum uji tantang (akhir perlakuan pemberian ekstrak), dan setelah uji tantang. Huruf berbeda di atas setiap bar menunjukkan berbeda signifikan (P<0.05) antar perlakuan. Keterangan: KN: kontrol negatif; KP: kontrol positif; D2: pemberian ekstrak 2 g/kg pakan; D3: pemberian ekstrak 3 g/kg pakan; D4: pemberian ekstrak 4 g/kg pakan; D5: pemberian ekstrak 5 g/kg pakan.
Aktifitas Fagositosis
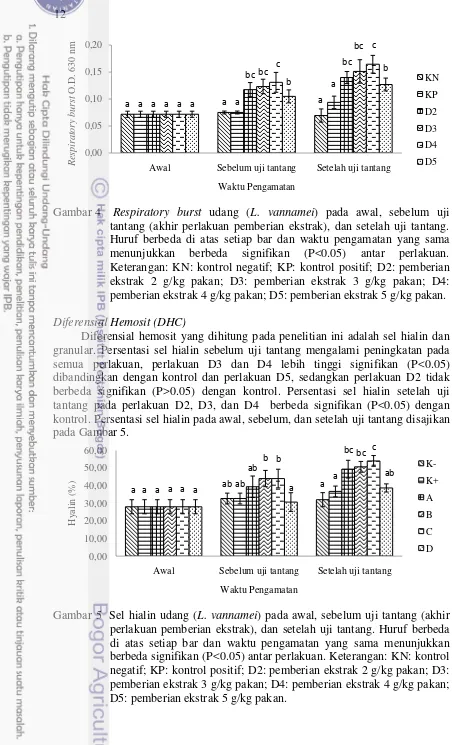
Aktifitas fagositosis sebelum uji tantang pada perlakuan D2, D3, D4, dan D5 berbeda signifikan (P<0.05) dengan kontrol. Aktifitas fagositosis setelah uji tantang WSSV pada perlakuan D2, D3, dan D4 berbeda signifikan (P<0.05) dengan kontrol, sedangkan perlakuan D5 tidak berbeda signifikan (P>0.05) dengan kontrol. Aktifitas fagositosis perlakuan D4 baik sebelum dan setelah uji tantang WSSV paling tinggi secara signifikan (P<0.05) dibandingkan dengan perlakuan lainnya. Aktifitas fagositosis pada awal, sebelum, dan setelah uji tantang disajikan pada Gambar 2.
Gambar 2 Aktifitas fagositosis udang (L. vannamei) pada awal, sebelum uji tantang (akhir perlakuan pemberian ekstrak), dan setelah uji tantang. Huruf berbeda di atas setiap bar dan waktu pengamatan yang sama menunjukkan berbeda signifikan (P<0.05) antar perlakuan. Keterangan: KN: kontrol negatif; KP: kontrol positif; D2: pemberian ekstrak 2 g/kg pakan; D3: pemberian ekstrak 3 g/kg pakan; D4: pemberian ekstrak 4 g/kg pakan; D5: pemberian ekstrak 5 g/kg pakan.
a a
Awal Sebelum uji tantang Setelah uji tantang
T
Awal Sebelum uji tantang Setelah uji tantang
11
Aktifitas Phenoloksidase (PO)
Aktifitas phenoloksidase mengalami peningkatan sebelum maupun setelah uji tantang. Aktifitas phenoloksidase pada perlakuan D2, D3, dan D4 berbeda signifikan (P<0.05) dibandingkan dengan kontrol pada sebelum dan setelah uji tantang, sedangkan pada perlakuan D5 tidak berbeda signifikan (P>0.05) dengan KP. Aktifitas phenoloksidase paling tinggi baik sebelum dan setelah uji tantang adalah pada perlakuan D4 yang berbeda signifikan (P<0.05) dengan perlakuan lainnya. Aktifitas phenoloksidase pada awal, sebelum, dan setelah uji tantang disajikan pada Gambar 3.
Gambar 3 Aktifitas phenoloksidase (PO) udang (L. vannamei) pada awal, sebelum uji tantang (akhir perlakuan pemberian ekstrak), dan setelah uji tantang. Huruf berbeda di atas setiap bar dan waktu pengamatan yang sama menunjukkan berbeda signifikan (P<0.05) antar perlakuan. Keterangan: KN: kontrol negatif; KP: kontrol positif; D2: pemberian ekstrak 2 g/kg pakan; D3: pemberian ekstrak 3 g/kg pakan; D4: pemberian ekstrak 4 g/kg pakan; D5: pemberian ekstrak 5 g/kg pakan.
Respiratory Burst (RB)
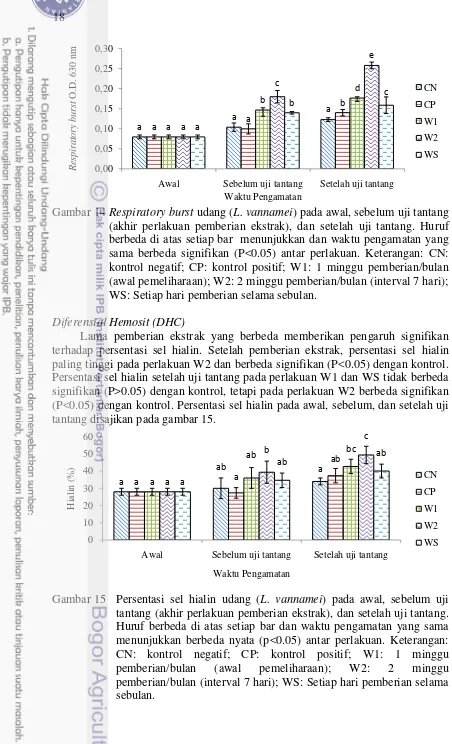
Respiratory burst setelah dan sebelum uji tantang mengalami peningkatan
dibandingkan pada awal pengukuran. Respiratory burst pada perlakuan D2, D3, D4, dan D5 sebelum dan setelah uji tantang berbeda signifikan (P<0.05) dengan kontrol. Respiratory burst memiliki nilai tertinggi pada perlakuan D4, dimana sebelum dan setelah uji tantang berbeda signifikan (P<0.05) dengan kontrol dan perlakuan D5, sedangkan dengan perlakuan D2 dan D3 tidak berbeda signifikan (P>0.05). Respiratory burst pada awal, sebelum, dan setelah uji tantang disajikan pada Gambar 4.
Awal Sebelum uji tantang Setelah uji tantang
12
Gambar 4 Respiratory burst udang (L. vannamei) pada awal, sebelum uji tantang (akhir perlakuan pemberian ekstrak), dan setelah uji tantang. Huruf berbeda di atas setiap bar dan waktu pengamatan yang sama menunjukkan berbeda signifikan (P<0.05) antar perlakuan. Keterangan: KN: kontrol negatif; KP: kontrol positif; D2: pemberian ekstrak 2 g/kg pakan; D3: pemberian ekstrak 3 g/kg pakan; D4: pemberian ekstrak 4 g/kg pakan; D5: pemberian ekstrak 5 g/kg pakan.
Diferensial Hemosit (DHC)
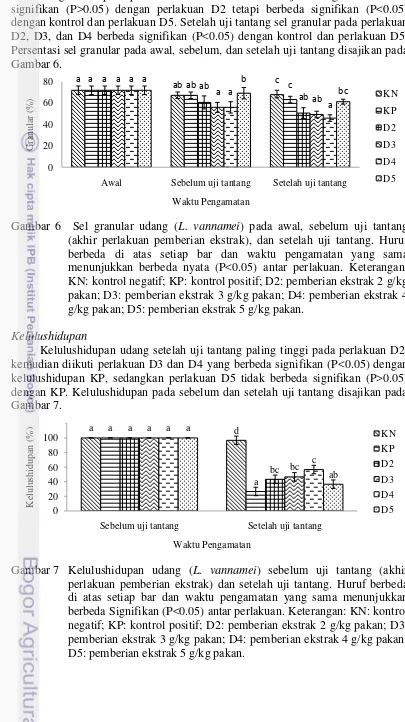
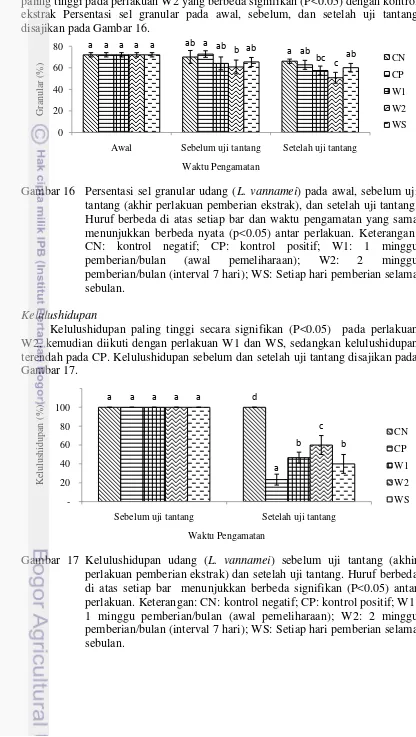
Diferensial hemosit yang dihitung pada penelitian ini adalah sel hialin dan granular. Persentasi sel hialin sebelum uji tantang mengalami peningkatan pada semua perlakuan, perlakuan D3 dan D4 lebih tinggi signifikan (P<0.05) dibandingkan dengan kontrol dan perlakuan D5, sedangkan perlakuan D2 tidak berbeda signifikan (P>0.05) dengan kontrol. Persentasi sel hialin setelah uji tantang pada perlakuan D2, D3, dan D4 berbeda signifikan (P<0.05) dengan kontrol. Persentasi sel hialin pada awal, sebelum, dan setelah uji tantang disajikan pada Gambar 5.
Gambar 5 Sel hialin udang (L. vannamei) pada awal, sebelum uji tantang (akhir perlakuan pemberian ekstrak), dan setelah uji tantang. Huruf berbeda di atas setiap bar dan waktu pengamatan yang sama menunjukkan berbeda signifikan (P<0.05) antar perlakuan. Keterangan: KN: kontrol negatif; KP: kontrol positif; D2: pemberian ekstrak 2 g/kg pakan; D3: pemberian ekstrak 3 g/kg pakan; D4: pemberian ekstrak 4 g/kg pakan; D5: pemberian ekstrak 5 g/kg pakan.
a a a a a
Awal Sebelum uji tantang Setelah uji tantang
R
Awal Sebelum uji tantang Setelah uji tantang
13 Sel granular pada perlakuan D3 dan D4 sebelum uji tantang tidak berbeda signifikan (P>0.05) dengan perlakuan D2 tetapi berbeda signifikan (P<0.05) dengan kontrol dan perlakuan D5. Setelah uji tantang sel granular pada perlakuan D2, D3, dan D4 berbeda signifikan (P<0.05) dengan kontrol dan perlakuan D5. Persentasi sel granular pada awal, sebelum, dan setelah uji tantang disajikan pada Gambar 6.
Gambar 6 Sel granular udang (L. vannamei) pada awal, sebelum uji tantang (akhir perlakuan pemberian ekstrak), dan setelah uji tantang. Huruf berbeda di atas setiap bar dan waktu pengamatan yang sama menunjukkan berbeda nyata (P<0.05) antar perlakuan. Keterangan: KN: kontrol negatif; KP: kontrol positif; D2: pemberian ekstrak 2 g/kg pakan; D3: pemberian ekstrak 3 g/kg pakan; D4: pemberian ekstrak 4 g/kg pakan; D5: pemberian ekstrak 5 g/kg pakan.
Kelulushidupan
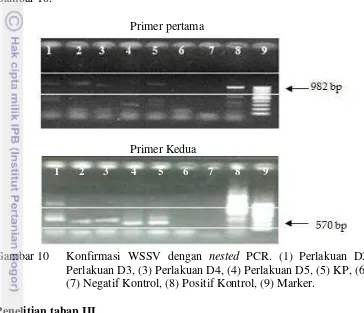
Kelulushidupan udang setelah uji tantang paling tinggi pada perlakuan D2, kemudian diikuti perlakuan D3 dan D4 yang berbeda signifikan (P<0.05) dengan kelulushidupan KP, sedangkan perlakuan D5 tidak berbeda signifikan (P>0.05) dengan KP. Kelulushidupan pada sebelum dan setelah uji tantang disajikan pada Gambar 7.
Gambar 7 Kelulushidupan udang (L. vannamei) sebelum uji tantang (akhir perlakuan pemberian ekstrak) dan setelah uji tantang. Huruf berbeda di atas setiap bar dan waktu pengamatan yang sama menunjukkan berbeda Signifikan (P<0.05) antar perlakuan. Keterangan: KN: kontrol negatif; KP: kontrol positif; D2: pemberian ekstrak 2 g/kg pakan; D3: pemberian ekstrak 3 g/kg pakan; D4: pemberian ekstrak 4 g/kg pakan; D5: pemberian ekstrak 5 g/kg pakan.
a
Awal Sebelum uji tantang Setelah uji tantang
Gr
Sebelum uji tantang Setelah uji tantang
14
Konfirmasi WSSV
Konfirmasi WSSV dengan pengamatan gejala klinis, histologi, dan nested
PCR disajikan sebagai berikut.
Gejala Klinis
Pengamatan gejala klinis pada penelitian ini dilakukan untuk mengamati perubahan yang terjadi akibat adanya infeksi WSSV terhadap udang uji. Perubahan gejala klinis udang diamati setiap hari setelah uji tantang meliputi perubahan secara morfologis dan nafsu makan. Perubahan gejala klinis secara morfologis pada udang yang terinfeksi WSSV terjadinya perubahan warna kemerahan (discolouration) pada tubuh, kaki renang, dan ekor sedangkan udang normal pada tubuh, kaki renang, dan ekor berwarna putih bersih. Pada udang yang terinfeksi WSSV usus kosong serta hepatopankreas berwarna kekuningan (pucat) sedangkan pada udang normal usus penuh dan hepatopankreas berwarna hitam kecoklatan. Penurunan nafsu makan pada udang terinfeksi WSSV juga terjadi pada hari pertama setelah uji tantang. Gambaran gejala klinis pada udang disajikan pada Gambar 8.
Gambar 8 Gejala klinis pada udang vaname setelah uji tantang dengan WSSV. (A) Udang normal dan (B) Udang terinfeksi WSSV.
Histologi
Histologi hepatopankreas pada udang yang diinfeksi WSSV menunjukkan adanya perbedaan dengan udang normal. Histologi hepatopankreas udang yang terinfeksi WSSV terlihat adanya badan inklusi, sedangkan pada udang normal tidak terlihat adanya badan inklusi (Gambar 9).
15
Analisis nested PCR
Konfirmasi keberadaan WSSV pada udang eksperimen diuji dengan menggunakan analisis nested PCR. Sampel dikumpulkan dari perlakuan yang menunjukkan gejala klinis (sampel D2, D3, D4, D5 dan KP) berupa tubuh kemerahan, hepatopankreas berwarna pucat, dan usus kosong serta perlakuan KN yang diinjeksi dengan PBS. Penelitian tahap satu menunjukkan bahwa 5 sampel (sampel D2, D3, D4, D5 dan KP) yang diuji positif terinfeksi WSSV, sementara perlakuan KN yang diuji menunjukkan udang tidak terinfeksi WSSV. Hasil konfirmasi WSSV pada penelitian tahap satu dengan nested PCR disajikan pada Gambar 10.
Primer pertama
Primer Kedua
Gambar 10 Konfirmasi WSSV dengan nested PCR. (1) Perlakuan D2, (2) Perlakuan D3, (3) Perlakuan D4, (4) Perlakuan D5, (5) KP, (6) KN, (7) Negatif Kontrol, (8) Positif Kontrol, (9) Marker.
Penelitian tahap III
Parameter uji yang diukur pada penelitian tahap tiga, yaitu respons imun, konfirmasi WSSV, dan kinerja produksi disajikan pada hasil berikut.
Respons Imun
Total Hemosit
Total hemosit sebelum dan setelah uji tantang menunjukkan bahwa pemberian ekstrak pada perlakuan W1, W2, dan WS berbeda signifikan (P<0.05) dengan kontrol. Perlakuan W2 berbeda secara signifikan (P<0.05) dengan perlakuan WS tetapi tidak berbeda signifikan (P>0.05) dengan perlakuan W1. Total hemosit pada awal, sebelum, dan setelah uji tantang disajikan pada Gambar 11.
16
Gambar 11 Total hemosit (THC) udang (L. vannamei) pada awal, sebelum uji tantang (akhir perlakuan pemberian ekstrak), dan setelah uji tantang. Huruf berbeda di atas setiap bar dan waktu pengamatan yang sama menunjukkan berbeda signifikan (P<0.05) antar perlakuan. Keterangan: CN: kontrol negatif; CP: kontrol positif; W1: 1 minggu pemberian/bulan (awal pemeliharaan); W2: 2 minggu pemberian/bulan (interval 7 hari); WS: Setiap hari pemberian selama sebulan.
Aktifitas Fagositosis
Aktifitas fagositosis setelah pemberian ekstrak pada perlakuan W1, W2, dan WS berbeda signifikan (P<0.05) dengan kontrol. Setelah uji tantang, aktifitas fagositosis paling tinggi pada perlakuan WS diikuti dengan perlakuan W1 dan W2 dimana berbeda signifikan (P<0.05) dengan kontrol. Aktifitas fagositosis pada awal, sebelum, dan setelah uji tantang disajikan pada Gambar 12.
Gambar 12 Aktifitas fagositosis udang (L. vannamei) pada awal, sebelum uji tantang (akhir perlakuan pemberian ekstrak), dan setelah uji tantang. Huruf berbeda di atas setiap bar dan waktu pengamatan yang sama menunjukkan berbeda signifikan (P<0.05) antar perlakuan. Keterangan: CN: kontrol negatif; CP: kontrol positif; W1: 1 minggu pemberian/bulan (awal pemeliharaan); W2: 2 minggu pemberian/bulan (interval 7 hari); WS: Setiap hari pemberian selama sebulan.
Awal Sebelum uji tantang Setelah uji tantang
T
Awal Sebelum uji tantang Setelah uji tantang
17
Aktifitas Phenoloksidase (PO)
Aktifitas phenoloksidase setelah pemberian ekstrak pada perlakuan W1, W2 , dan WS berbeda signifikan (P<0.05) dengan kontrol, kemudian perlakuan WS berbeda signifkan (P<0.05) dengan perlakuan W1 dan W2. Setelah uji tantang, aktifitas phenoloksidase paling tinggi pada perlakuan WS yang berbeda signifikan (P<0.05) dengan perlakuan lainnya, diikuti dengan perlakuan W1 dan WS yang berbeda signifikan (P<0.05) dengan kontrol. Aktifitas phenoloksidase pada awal, sebelum, dan setelah uji tantang disajikan pada Gambar 13.
Gambar 13 Aktifitas phenoloksidase (PO) udang (L. vannamei) pada awal, sebelum uji tantang (akhir perlakuan pemberian ekstrak), dan setelah uji tantang. Huruf berbeda di atas setiap bar dan waktu pengamatan yang sama menunjukkan berbeda nyata (p<0.05) antar perlakuan. Keterangan: CN: kontrol negatif; CP: kontrol positif; W1: 1 minggu pemberian/bulan (awal pemeliharaan); W2: 2 minggu pemberian/bulan (interval 7 hari); WS: Setiap hari pemberian selama sebulan.
Respiratory Burst (RB)
Lama pemberian ekstrak yang berbeda memberikan pengaruh yang signifikan terhadap respiratory burst, dimana setelah pemberian ekstrak selama 2 minggu memberikan hasil paling tinggi yang berbeda signifikan (P<0.05) dengan perlakuan lainnya. Respiratory burst setelah uji tantang berbeda signifikan (P<0.05) antara semua perlakuan dan yang paling tinggi pemberian selama 2
Awal Sebelum uji tantang Setelah uji tantang
18
Gambar 14 Respiratory burst udang (L. vannamei) pada awal, sebelum uji tantang (akhir perlakuan pemberian ekstrak), dan setelah uji tantang. Huruf berbeda di atas setiap bar menunjukkan dan waktu pengamatan yang sama berbeda signifikan (P<0.05) antar perlakuan. Keterangan: CN: kontrol negatif; CP: kontrol positif; W1: 1 minggu pemberian/bulan (awal pemeliharaan); W2: 2 minggu pemberian/bulan (interval 7 hari); WS: Setiap hari pemberian selama sebulan.
Diferensial Hemosit (DHC)
Lama pemberian ekstrak yang berbeda memberikan pengaruh signifikan terhadap persentasi sel hialin. Setelah pemberian ekstrak, persentasi sel hialin paling tinggi pada perlakuan W2 dan berbeda signifikan (P<0.05) dengan kontrol. Persentasi sel hialin setelah uji tantang pada perlakuan W1 dan WS tidak berbeda signifikan (P>0.05) dengan kontrol, tetapi pada perlakuan W2 berbeda signifikan (P<0.05) dengan kontrol. Persentasi sel hialin pada awal, sebelum, dan setelah uji tantang disajikan pada gambar 15.
Gambar 15 Persentasi sel hialin udang (L. vannamei) pada awal, sebelum uji tantang (akhir perlakuan pemberian ekstrak), dan setelah uji tantang. Huruf berbeda di atas setiap bar dan waktu pengamatan yang sama menunjukkan berbeda nyata (p<0.05) antar perlakuan. Keterangan: CN: kontrol negatif; CP: kontrol positif; W1: 1 minggu pemberian/bulan (awal pemeliharaan); W2: 2 minggu pemberian/bulan (interval 7 hari); WS: Setiap hari pemberian selama sebulan.
Awal Sebelum uji tantang Setelah uji tantang
Resp
Awal Sebelum uji tantang Setelah uji tantang
19 Persentasi sel granular setelah pemberian ekstrak dan uji tantang yang paling tinggi pada perlakuan W2 yang berbeda signifikan (P<0.05) dengan kontrol. ekstrak Persentasi sel granular pada awal, sebelum, dan setelah uji tantang disajikan pada Gambar 16.
Gambar 16 Persentasi sel granular udang (L. vannamei) pada awal, sebelum uji tantang (akhir perlakuan pemberian ekstrak), dan setelah uji tantang. Huruf berbeda di atas setiap bar dan waktu pengamatan yang sama menunjukkan berbeda nyata (p<0.05) antar perlakuan. Keterangan: CN: kontrol negatif; CP: kontrol positif; W1: 1 minggu pemberian/bulan (awal pemeliharaan); W2: 2 minggu pemberian/bulan (interval 7 hari); WS: Setiap hari pemberian selama sebulan.
Kelulushidupan
Kelulushidupan paling tinggi secara signifikan (P<0.05) pada perlakuan W2, kemudian diikuti dengan perlakuan W1 dan WS, sedangkan kelulushidupan terendah pada CP. Kelulushidupan sebelum dan setelah uji tantang disajikan pada Gambar 17.
Gambar 17 Kelulushidupan udang (L. vannamei) sebelum uji tantang (akhir perlakuan pemberian ekstrak) dan setelah uji tantang. Huruf berbeda di atas setiap bar menunjukkan berbeda signifikan (P<0.05) antar perlakuan. Keterangan: CN: kontrol negatif; CP: kontrol positif; W1: 1 minggu pemberian/bulan (awal pemeliharaan); W2: 2 minggu pemberian/bulan (interval 7 hari); WS: Setiap hari pemberian selama sebulan.
Awal Sebelum uji tantang Setelah uji tantang
Gr
Sebelum uji tantang Setelah uji tantang
20
Konfirmasi WSSV Menggunakan Nested PCR
Hasil penelitian ini menunjukkan bahwa 4 sampel (sampel W1, W2, W3, dan CP) yang diuji positif terinfeksi WSSV, sementara perlakuan CP yang diuji menunjukkan udang tidak terinfeksi WSSV.Hasil konfirmasi WSSV pada penelitian tahap dua dengan nested PCR disajikan pada Gambar 18.
Primer pertama
Primer Kedua
Gambar 18 Konfirmasi WSSV dengan nested PCR. (1) Perlakuan W1, (2) Perlakuan W2, (3) Perlakuan WS, (4) CP, (5) CN, (6) Negatif Kontrol, (7) Positif Kontrol, (8) Marker.
Kinerja Produksi
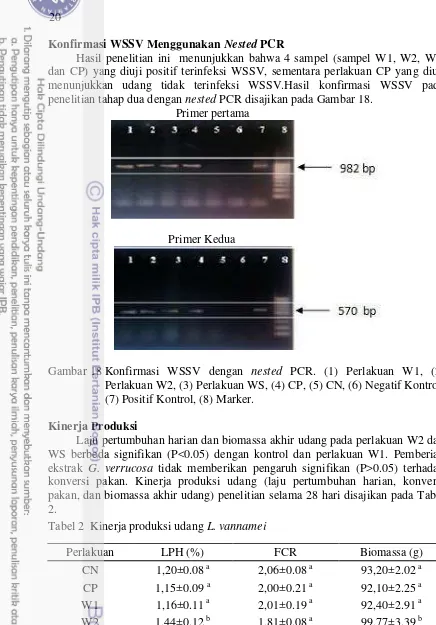
Laju pertumbuhan harian dan biomassa akhir udang pada perlakuan W2 dan WS berbeda signifikan (P<0.05) dengan kontrol dan perlakuan W1. Pemberian ekstrak G. verrucosa tidak memberikan pengaruh signifikan (P>0.05) terhadap konversi pakan. Kinerja produksi udang (laju pertumbuhan harian, konversi pakan, dan biomassa akhir udang) penelitian selama 28 hari disajikan pada Tabel 2.
Tabel 2 Kinerja produksi udang L. vannamei
Perlakuan LPH (%) FCR Biomassa (g)
CN 1,20±0.08 a 2,06±0.08 a 93,20±2.02 a
CP 1,15±0.09 a 2,00±0.21 a 92,10±2.25 a
W1 1,16±0.11 a 2,01±0.19 a 92,40±2.91 a
W2 1,44±0.12 b 1,81±0.08 a 99,77±3.39 b
WS 1,39±0.11 b 1,85±0.08 a 98,50±3.10 b
21 Pembahasan
Senyawa bahan aktif paling tinggi (phenol, vanilin, phytol, ester, sulfat, dan galaktosa) pada ekstrak G. verrucosa terdapat pada perlakuan bahan pelarut etil asetat. Hal ini menunjukkan kepolaran senyawa aktif pada G. verrucosa
mendekati kepolaran etil asetat dibandingkan dengan metanol dan etanol. Martin
et al. (1990) menyatakan bahwa kelarutan suatu zat terlarut di dalam pelarut
tergantung pada tingkat kepolaran pelarut dan zat terlarut atau komponen polar akan larut dalam pelarut polar serta komponen non polar akan larut dalam pelarut non polar. Ekstrak G. verrucosa dengan pelarut EA memberikan pengaruh terhadap kandungan bahan aktif pada rumput laut. Kandungan bahan aktif ini akan mempengaruhi sistem imun pada udang, karena bahan aktif pada ekstrak
G.verrucosa akan berikatan dengan hemosit melalui mekanisme interaksi molekul
dengan permukaan reseptor pada udang yang berperan penting dalam sistem imun.
Hasil penelitian menunjukkan bahwa pemberian ekstrak G.verrucosa dapat meningkatkan total hemosit pada udang. Hemosit merupakan sel yang memainkan peran sentral dalam pertahanan kekebalan krustasea, karena berperan penting dalam respons imun seluler maupun humoral (Xu et al. 2014). Perubahan jumlah hemosit merupakan salah satu indikator stres dan status kesehatan pada udang. Selain itu, hemosit juga terlibat dalam sintesis dan pelepasan molekul penting, seperti α-2-macroglobulin (α2M), aglutinin dan peptida antibakteri sebagai reaksi pertahanan tubuh pada krustasea (Rodriguez dan Moullac 2000).
Peningkatan total hemosit penelitian tahap dua terjadi pada udang yang diberi pakan ekstrak G.verrucosa pada perlakuan D2, D3, D4, dan D5, peningkatan ini signifikan (P<0.05) dibandingkan dengan kontrol. Hal ini mengindikasikan bahwa ekstrak G.verrucosa mampu merangsang pembentukan sel-sel hemosit pada udang. Pada penelitian Jasmanindar (2009) pemberian ekstrak G.verrucosa pada udang vaname yang diinfeksi dengan V.harveyi mampu meningkatkan total hemosit. Peningkatan total hemosit setelah uji tantang terjadi pada perlakuan D2, D3, dan D4, sedangkan pada perlakuan D5 dan KP mengalami penurunan. Peningkatan total hemosit ini mengindikasikan bahwa meningkatnya reaksi pertahanan pada tubuh udang karena adanya partikel asing yang masuk ke dalam tubuh udang, yaitu WSSV. Partikel asing yang masuk ke dalam tubuh udang, akan dikenali oleh reseptor sel hemosit hingga menghasilkan respons seluler seperti intracellular signaling cascade, fagositosis, enkapsulasi, dan agregasi nodular (Rodriguez dan Moullac 2000). Pada penelitian tahap tiga peningkatan hemosit setelah pemberian ekstrak dan setelah uji tantang juga terjadi, dan peningkatan paling tinggi terjadi pada pemberian selama 2 minggu. Hal ini mengindikasikan pemberian selama 2 minggu (interval 7 hari) memberikan reaksi pertahanan tubuh paling tinggi karena adanya partikel asing yang masuk ke dalam tubuh udang.
22
ekstrak pada perlakuan D2, D3, dan D4 berbeda signifikan (P<0.05) dengan KP. Salah satu respons imun seluler pada udang dalam menanggapi benda asing adalah melalui mekanisme fagositosis. Pada beberapa penelitian peningkatan aktifitas fagositosis pada udang juga terjadi setelah uji tantang sebagai mekanisme pertahanan udang (Jasmanindar 2009, Febriani et al. 2013). Selama proses fagositosis, partikel virus akan dikenali oleh reseptor pada permukan sel, kemudian ditelan oleh sel yang melakukan penyusunan kembali cytoskeleton untuk pembentukan fagosom. Pembentukan pertama, fagosom mengalami pematangan (maturasi) oleh pembelahan dan fusi dengan lisosom, dan menjadi fagolisosom yang matang. Virus yang berada di dalam fagolisosom akan dihancurkan oleh kondisi pH yang rendah, proses hidrolisis, dan radikal (Xu et al.
2014).
Phenoloksidase merupakan enzim yang berperan dalam proses melanisasi. Enzim ini dihasilkan melalui sistem proPO (prophenoloksidase) yang dapat diaktifkan oleh adanya imunostimulan. Reaksi melanisasi merupakan respons umum terhadap patogen (agen asing) yang masuk ke dalam tubuh avertebrata, dimana melanin merupakan racun bagi mikroorganisme (Soderhall dan Cerenius 1992). Melanisasi merupakan reaksi pertahanan pada avertebrata melawan organisme patogen yang masuk tubuh udang (Sritunyalucsana et al. 2001). Aktivasi sistem prophenoloxidae menghasilkan produksi melanin, pigmen coklat gelap yang bertanggung jawab dalam beberapa proses, diantaranya untuk menginaktivasi partikel asing, dan melindungi penyebarannya pada tubuh inang, dan memperbaiki kerusakan kutikula. Sistem proPO berperan penting dalam pengenalan benda asing termasuk fagositosis, melanisasi, produksi reaktan sitotoksik, enkapsulasi partikel, serta pembentukan nodul dan kapsul.
Aktifitas phenoloksidase mengalami peningkatan sebelum maupun setelah uji tantang. Aktifitas phenoloksidase penelitian tahap dua pada perlakuan D2, D3, dan D4 berbeda signifikan (P<0.05) dibandingkan dengan kontrol pada sebelum dan setelah uji tantang, sedangkan pada perlakuan D5 tidak berbeda signifikan (P>0.05) dengan KP. Aktifitas phenoloksidase penelitian tahap tiga setelah pemberian ekstrak pada perlakuan D2, D3, dan D4 berbeda signifikan (P<0.05) dengan kontrol. Setelah uji tantang, aktifitas phenoloksidase paling tinggi pada perlakuan D4 yang berbeda signifikan (P<0.05) dengan perlakuan lainnya, diikuti dengan perlakuan D2 dan D3 yang berbeda signifikan (P<0.05) dengan KP. Peningkatan aktifitas phenoloksidase setelah uji tantang juga sejalan dengan peningkatan total hemosit dan aktifitas fagositosis. Total hemosit berhubungan erat dengan perangsangan aktivasi proPO untuk menghasilkan aktifitas phenoloksidase. Aktifitas phenoloksidase menunjukkan adanya kemampuan udang vaname dalam mengenali benda asing yang masuk ke dalam tubuhnya (Garcia-Carreno et al. 2008) dan adanya aktifitas pertahanan tubuh udang (Costa
et al. 2009).
Fagositosis adalah salah satu respons yang paling umum dalam perlindungan seluler. Selama proses fagositosis, partikel atau mikroorganisme yang masuk ke dalam sel yang kemudian membentuk digestive vacuole yang disebut fagosom. Mekanisme penghapusan partikel oleh sel fagosit yang melibatkan pelepasan enzim degradatif ke dalam fagosom (oxygen dependent
killing mechanism) dan menghasilkan ROIs (reactive oxygen intermediates)
23 (2006) bahwa polisakarida dari rumput laut dapat menstimulasi sistem imun non spesifik dalam hal ini fagositosis dan aktifitas respiratory burst melalui mekanisme interaksi molekul polisakarida dengan permukaan reseptor (receptor
mediated).
Respiratory burst setelah dan sebelum uji tantang mengalami peningkatan
dibandingkan pada awal pengukuran. Respiratory burst penelitian tahap dua pada perlakuan D2, D3, D4, dan D5 sebelum dan setelah uji tantang berbeda signifikan (P<0.05) dengan kontrol. Respiratory burst memiliki nilai tertinggi pada perlakuan D4, yaitu sebelum dan setelah uji tantang berbeda signifikan (P<0.05) dengan kontrol dan perlakuan D5, sedangkan dengan perlakuan D2 dan D3 tidak berbeda signifikan (P>0.05). Lama pemberian ekstrak yang berbeda memberikan pengaruh yang signifikan terhadap respiratory burst, dimana setelah pemberian ekstrak selama 2 minggu (interval 7 hari) memberikan hasil paling tinggi yang berbeda signifikan (P<0.05) dengan perlakuan lainnya. Peningkatan respiratory
burst berkorelasi dengan peningkatan aktifitas fagositosis. Beberapa penelitian
juga menunjukkan aktifitas fagositosis berkaitan erat dengan respiratory burst
(Jasmanindar 2009, Sirirustananun et al. 2011)
Persentasi sel hialin penelitian tahap dua sebelum uji tantang mengalami peningkatan pada semua perlakuan, perlakuan D3 dan D4 lebih tinggi signifikan (P<0.05) dibandingkan dengan KP dan perlakuan D5, sedangkan perlakuan D2 tidak berbeda signifikan (P>0.05) dengan KP. Persentasi sel hialin setelah uji tantang pada perlakuan D2, D3, dan D4 berbeda signifikan (P<0.05) dengan kontrol dan perlakuan D5. Lama pemberian ekstrak yang berbeda memberikan pengaruh signifikan terhadap persentasi sel hialin. Setelah pemberian ekstrak, persentasi sel hialin paling tinggi pada perlakuan W2 dan berbeda signifikan (P<0.05) dengan kontrol. Persentasi sel hialin setelah uji tantang pada perlakuan W1 dan WS tidak berbeda signifikan (P>0.05) dengan CP, tetapi pada perlakuan W2 berbeda signifikan (P<0.05) dengan CP. Peningkatan sel hialin ini juga sejalan dengan peningkatan aktifitas fagositosis, dimana sel hialin sangat berhubungan dengan aktifitas fagositosis. Sel hialin melakukan fungsi dalam imunitas sebagai fagositosis (Thornqvist et al. 1994). Sel hialin juga terlibat dalam proses koagulasi dan pembentukan kutikula (Hose et al. 1992)
Sel granular mengalami penurunan sebelum dan setelah uji tantang jika dibandingkan dengan awal. Penelitian tahap dua pada perlakuan D3 dan D4 sebelum uji tantang tidak berbeda signifikan (P>0.05) dengan perlakuan D2 tetapi berbeda signifikan (P<0.05) dengan KP dan perlakuan D5. Setelah uji tantang sel granular pada perlakuan D2, D3, dan D4 berbeda signifikan (P<0.05) dengan KP dan perlakuan D5. Persentasi sel granular penelitian tahap tiga setelah pemberian ekstrak dan uji tantang yang paling tinggi pada perlakuan W2 yang berbeda signifikan (P< 0.05) dengan CP. Sel granular ini juga berperan dalam fagosistosis, dimana berkorelasi dengan kapasitasnya dalam intracellular killing. Sel ini berfungsi dalam menyimpan dan melepaskan sistem proPO maupun sebagai
cytoxicity (Johansson dan Söderhäll 1985).
Parameter imun pada penelitian tahap dua seperti total hemosit (THC), diferensial hemosit (DHC), aktifitas fagositosis, aktifitas phenoloksidase (PO),
dan respiratory burst (RB) pada perlakuan D5 tidak berbeda signifikan (P>0.05)
24
imunostimulan bisa menyebabkan imunosuppresif.Dosis yang terlalu tinggi tidak mampu meningkatkan respons imun, bahkan menghambat respons imun. Tidak ada korelasi positif antara efek imunostimulan dengan dosis yang digunakan. Perlakuan D4 memberikan respons imun yang paling baik dibandingkan dengan perlakuan lainnya, sedangkan perlakuan D2 dan D3 mampu memicu sistem imun tetapi kurang efektif jika dibandingkan dengan perlakuan D4. Pemberian imunostimulan harus memperhatikan dosis optimal yang digunakan (Anderson 1992), karena dosis imunostimulan yang tinggi dapat menekan mekanisme pertahanan, dan dosis yang rendah bisa kurang efektif atau tidak cukup untuk memberikan respons imun.
Parameter imun yang paling tinggi pada penelitian tahap tiga seperti total hemosit (THC), diferensial hemosit (DHC), aktifitas fagositosis, aktifitas phenoloksidase (PO), dan respiratory burst (RB) adalah pada perlakuan W2(2 minggu), kemudian diikuti dengan perlakuan W1 (7 hari), dan WS (setiap hari). Lama pemberian ekstrak G. verucossa yang terlalu rendah dan sering kurang efektif untuk meningkatkan sistem imun pada udang. Lama pemberian selama 2 minggu (interval 7 hari) selama sebulan memberikan hasil terbaik untuk meningkatkan sistem imun pada udang. Durasi periode pemberian imunostimulan untuk mencapai proteksi yang optimal merupakan hal yang penting dalam pemberian imunostimulan (Couso et al. 2003). Sirirustananun et al. (2011) menyatakan bahwa pemberian ekstrak G.tenuistipitata selama 14 hari mengalami peningkatan tertinggi pada total hemosit, respiratory burst, dan superoxide
dismutase pada udang vaname dibandingkan dengan pemberian 7, 21, 28, dan 35
hari. Respons imun adalah repons fisiologi yang diregulasi untuk mempertahankan kondisi homeostatis. Penelitian Sirirustananun et al. (2011) menyatakan bahwa pemberian ekstrak selama 7-28 hari lebih efektif meningkatkan respons imun pada udang, dan mengindikasikan pemberian ekstrak dalam jangka panjang (35 hari) menyebabkan regulasi yang negatif untuk mencapai kondisi homeostatis dan penurunan kemampuan untuk memperbaiki respons imun. Perlakuan W2 mengindikasikan bahwa pemberian ekstrak G.
verrucosa dengan dosis 4 g/kg pakan selama 14 hari (interval 7 hari) selama
sebulan mencapai kondisi homeostatis pada udang vaname.
Perubahan gejala klinis secara morfologis pada udang yang terinfeksi WSSV terjadinya perubahan warna kemerahan (discolouration) pada tubuh, kaki renang, dan ekor sedangkan udang normal pada tubuh, kaki renang, dan ekor berwarna putih bersih. Menurut Lightner (2011) udang yang menunjukkan gejala klinis WSSV berupa perubahan warna tubuh menjadi coklat kemerahan akibat perluasan kutikula dan kromatofor. Pada udang yang terinfeksi WSSV usus kosong serta hepatopankreas berwarna kekuningan (pucat) sedangkan pada udang normal usus penuh dan hepatopankreas berwarna hitam kecoklatan. Menurut Soetrisno (2004), infeksi ringan untuk WSSV menunjukkan gejala nafsu makan dari udang akan menurun terlihat dari usus yang kosong, infeksi ringan ini akan diikuti pola kematian yang terus meningkat. Pada infeksi selanjutnya udang banyak berwarna merah dan bertubuh lunak walaupun beberapa masih ada yang tubuhnya masih keras.