PROFIL DARAH AYAM BROILER YANG DIBERI RANSUM
MENGANDUNG AFLATOKSIN DENGAN
PENAMBAHAN METIONIN
SKRIPSI
NOVIA ELISABETH GUNAWAN
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
RINGKASAN
NOVIA ELISABETH GUNAWAN. D24063557. 2010. Profil Darah Ayam Broiler
yang Diberi Ransum Mengandung Aflatoksin dengan Penambahan Metionin.
Skripsi. Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Dr. Ir. Jajat Jachja F. A., M. Agr. Pembimbing Anggota : Dr. Ir. Idat Galih Permana, M. Sc. Agr.
Indonesia memiliki iklim tropis dengan suhu dan kelembaban tinggi sehingga menjadi kondisi yang sangat baik untuk pertumbuhan kapang. Hal ini menimbulkan salah satu masalah yang sering dihadapi dalam bidang pakan yaitu adanya cemaran
kapang. Kapang menghasilkan toksin yang dapat berbahaya bagi ternak yang
mengonsumsi pakan tersebut.
Aflatoksin adalah mikotoksin yang dihasilkan oleh kapang Aspergillusflavus dan Aspergillus parasiticus. Jika termakan ternak akan menimbulkan masalah kesehatan bagi ternak. Pengaruh aflatoksin yang telah diteliti pada broiler yaitu pada performa, organ dalam dan pada parameter darah. Penambahan suplemen dan aditif seperti antioksidan, vitamin, asam amino mengandung sulfur dan lainnya telah dilakukan untuk mengatasi efek negatif dari aflatoksin. Penelitian ini ditujukan untuk melihat pengaruh pemberian metionin ke dalam ransum yang terkontaminasi aflatoksin terhadap profil darah dan nilai IgY (imunoglobulin Y) pada broiler.
Penelitian ini dilaksanakan pada bulan April sampai dengan Juli 2010 bertempat di Laboratorium Ilmu dan Teknologi Pakan, Laboratorium Nutrisi Ternak Unggas, Laboratorium Terpadu Fakultas Peternakan, Institut Pertanian Bogor dan pabrik pakan Indofeed. Terdapat dua periode yang diamati pada penelitian ini yaitu periode starter dan finisher. Penelitian ini menggunakan RAL pola faktorial 3x3 dengan 4 ulangan dimana faktor A adalah level metionin (0%, 0,25%, dan 0,35% untuk periode starter ; 0%, 0,20%, dan 0,30% untuk periode finisher) dan faktor B adalah level aflatoksin (0 ppb, 150 ppb, dan 300 ppb). Adapun parameter yang diukur yaitu hemoglobin, hematokrit, eritrosit, leukosit diferensiasi leukosit dan IgY.
Hasil penelitian ini ada yang menunjukkan terjadinya interaksi, perbedaan nyata dan perbedaan tidak nyata pada parameter yang diamati. Interaksi terjadi pada nilai eritrosit dan IgY broiler periode starter. Perbedaan yang nyata karena pengaruh penambahan DL-metionin dapat dilihat pada nilai leukosit periode finisher dan perbedaan nyata karena pengaruh level aflatoksin dapat dilihat pada nilai leukosit broiler starter serta nilai heterofil pada periode starter. Parameter lainnya menunjukkan perbedaan yang tidak nyata.
ABSTRACT
Blood Profile of Broiler Chicken Fed with Aflatoksin Diet and Methionine Additive
Gunawan, N. E., J. Jachja and I. G. Permana
Tropical climate inIndonesia have high temperature and humidity that supports the growth of fungi. It causes one of the common feed problem in Indonesia, in example fungal contaminations. Fungi produces a toxin that will give a harmfull effect for the livestock. Aflatoxin is a mycotoxin that produces by Aspergillus flavus and Aspergillus parasiticus. It makes a health problem to livestock. The effects of aflatoxin that found on farm animal such as a variation in organ’s weight and the decrease of some hematology parameters. The use of additives and supplements in diets were developed in order to minimize the effects of aflatoxin. The aim of this research was to evaluate the effect of methionine addition in diet that contaminated with aflatoxin on blood profile and IgY (immunoglobulin Y) of broiler. The experiment was arrange with factorial completely randomized design with three level of methionine (0%, 0.25%, and 0.35% for starter; 0%, 0.20%, and 0.30% for finisher), three level of aflatoxin (0 ppb, 150 ppb and 300 ppb) and four replicates. Parameters that measured were hemoglobin, hematocrit, erythrocyte, leucocyte, leucocyte differentiation and IgY. The result of this research was showed an interaction, segnificant difference and no significant difference. In starter period, there are interaction effects on erythrocytes and IgY, while leukocytes was influenced by the level of methionine and heterophils was influenced by the level of aflatoxin. For finisher period, only leucocyte that has a different value due to aflatoxin’s level.
PROFIL DARAH AYAM BROILER YANG DIBERI RANSUM
MENGANDUNG AFLATOKSIN DENGAN
PENAMBAHAN METIONIN
NOVIA ELISABETH GUNAWAN D24063557
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
Judul : Profil Darah Ayam Broiler yang Diberi Ransum Mengandung Aflatoksin dengan Penambahan Metionin
Nama : Novia Elisabeth Gunawan
NIM : D24063557
Menyetujui,
Pembimbing Utama, Pembimbing Anggota,
(Dr. Ir. Jajat Jachja F. A., M.Agr) (Dr. Ir. Idat Galih Permana, M.Sc.Agr)
NIP. 19480902 197412 1 001 NIP. 19670506 199103 1 001
Mengetahui: Ketua Departemen,
Ilmu Nutrisi dan Teknologi Pakan
(Dr.Ir.Idat Galih Permana, M.Sc.Agr) NIP. 19670506 199103 1 001
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 20 November 1989 di Samarinda,
Kalimantan Timur. Penulis merupakan anak ketiga dari tiga bersaudara dari
pasangan Boyke Gunawan dan Wenny Simon.
Penulis menyelesaikan pendidikan dasar di SD Katolik 2 W. R. Soepratman
Samarinda pada tahun 2001. Selanjutnya penulis meneruskan pendidikan di SLTP
Negeri 1 Samarinda dan lulus pada tahun 2003. Kemudian melanjutkan pendidikan
di SMA Negeri 1 Samarinda dan lulus pada tahun 2006.
Penulis diterima di Institut Pertanian Bogor pada tahun 2006 melalui jalur
Undangan Seleksi Masuk IPB (USMI) dan mulai mengikuti perkuliahan di
Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, dari tahun
KATA PENGANTAR
Puji syukur penulis panjatkan kepada Tuhan karena atas berkat dan kasihNya
setiap hari maka penulis dapat memulai dan menyelesaikan skripsi ini. Skripsi ini
mungkin tidak sempurna, namun rasa senang dan syukur yang besar tetap penulis
rasakan atas skripsi ini. Bantuan dari berbagai pihak, dukungan dari keluarga dan
penyertaan Tuhan memungkinkan terbentuknya skripsi ini.
Beberapa waktu yang lalu kita dihadapkan pada masalah cemaran yang
terjadi pada pakan dan bahan pakan ternak yang dapat menimbulkan permasalahan
kesehatan. Aflatoksin merupakan salah satunya yang berbahaya, tidak hanya pada
ternak namun juga manusia, dan sampai saat ini masih belum didapatkan cara
menghilangkannya. Berbagai macam penelitian telah dilakukan dan menghasilkan
cara pencegahan dan pengurangan terhadap efek toksin bagi ternak, yaitu dengan
penambahan bahan-bahan aditif tertentu dalam pakan. Penelitian ini juga merupakan
salah satu percobaan untuk mengatasi masalah aflatoksin dimana bahan yang
ditambahkan yaitu asam amino sintetis, DL-metionin.
Masih ada beberapa hal dalam penelitian ini yang perlu diperdalam dan
dilanjutkan agar bisa menyumbangkan hasil yang lebih baik terhadap permasalahan
mengenai aflatoksin. Namun harapan penulis, semoga hasil penelitian dalam skripsi
ini dapat ikut membantu dan membuka pemahaman kita semua dan bagi mereka
yang ingin meneliti tema yang sama. Sekali lagi penulis mengucapkan terima kasih.
Bogor, Januari 2011
DAFTAR ISI
Ayam Pedaging (Broiler)...………... 3
Jagung...………….……...……... 4
Perbanyakan Kultur Aspergillus flavus... 16
Transfer Kapang Aspergillus flavus ke Jagung... 17
Pembuatan Ransum...………….……....…… 18
Pembuatan Ransum... 27
Profil Darah... 28
Hemoglobin... 28
Hematokrit... 29
Eritrosit... 30
Leukosit... 32
Diferensiasi Leukosit... 33
IgY... 35
MCV dan MCHC... 36
Performa dan Organ Dalam... 38
KESIMPULAN DAN SARAN... 40
Kesimpulan... 40
Saran... 40
UCAPAN TERIMA KASIH... 41
DAFTAR PUSTAKA...……..……...………...….…. 42
DAFTAR TABEL
Nomor Halaman
1. Kebutuhan Nutrisi Broiler...………. 3
2. SNI Bahan Pakan Jagung... 5
3. Nilai Hematologis Darah Ayam Broiler...………... 10
4. Persentase Leukosit Berdasarkan Umur Ayam... 12
5. Komposisi Ransum Periode Starter (0-3 minggu)... 18
6. Komposisi Ransum Periode Finisher (3-6 minggu)... 19
7. Kandungan Nutrien dan Aflatoksin Ransum Periode Starter (0-3 minggu)... 20
8. Kandungan Nutrien dan Aflatoksin Ransum Periode Finisher (3-6 minggu)... 21
9. Nilai Hemoglobin (g %) Broiler Periode Starter dan Finisher yang Mendapat Perlakuan... 28
10.Nilai Hematokrit (%) Broiler Periode Starter dan Finisher yang Mendapat Perlakuan... 29
11.Nilai Leukosit (103/mm3) Broiler Periode Starter dan Finisher yang Mendapat Perlakuan... 32
12.Nilai Diferensiasi Leukosit Broiler Periode Starter dan Finisher yang Mendapat Perlakuan... 34
13.Nilai IgY (µg/ml) Broiler Periode Starter dan Finisher yang Mendapat Perlakuan... 36
DAFTAR GAMBAR
Nomor Halaman
1. Jagung yang terserang Aspergillus flavus...……. 4
2. Aspergillus flavus...……..……...…. 6
3. Diferensiasi Leukosit... 12
4. Tahapan Perbanyakan Kultur Aspergillus flavus... 16
5. Tahapan Transfer Kapang Aspergillus flavus ke Jagung... 17
6. Nilai Eritrosit Periode Starter (0-3 minggu)... 30
DAFTAR LAMPIRAN
Nomor Halaman
1. ANOVA Pengaruh Perlakuan Terhadap Nilai Hemoglobin
Broiler Periode Starter (0-3 minggu)... 46 2. ANOVA Pengaruh Perlakuan Terhadap Nilai Hematokrit
Broiler Periode Starter (0-3 minggu)... 46 3. ANOVA Pengaruh Perlakuan Terhadap Nilai Eritrosit Broiler
Periode Starter (0-3 minggu)... 47 4. ANOVA Pengaruh Perlakuan Terhadap Nilai Leukosit Broiler
Periode Starter (0-3 minggu)... 47 5. ANOVA Pengaruh Perlakuan Terhadap Nilai IgY Broiler
Periode Starter (0-3 minggu)... 48 6. ANOVA Pengaruh Perlakuan Terhadap Nilai MCV Broiler
Periode Starter (0-3 minggu)... 48 7. ANOVA Pengaruh Perlakuan Terhadap Nilai MCHC Broiler
Periode Starter (0-3 minggu)... 49 8. ANOVA Pengaruh Perlakuan Terhadap Nilai Limfosit Broiler
Periode Starter (0-3 minggu)... 49 9. ANOVA Pengaruh Perlakuan Terhadap Nilai Heterofil Broiler
Periode Starter (0-3 minggu)... 50 10.ANOVA Pengaruh Perlakuan Terhadap Nilai Monosit Broiler
Periode Starter (0-3 minggu)... 50 11.ANOVA Pengaruh Perlakuan Terhadap Nilai Eosinofil Broiler
Periode Starter (0-3 minggu)... 51
12.ANOVA Pengaruh Perlakuan Terhadap Nilai Hemoglobin
Broiler Periode Finisher (3-6 minggu)... 51 13.ANOVA Pengaruh Perlakuan Terhadap Nilai Hematokrit
Broiler Periode Finisher (3-6 minggu)... 52 14.ANOVA Pengaruh Perlakuan Terhadap Nilai Eritrosit Broiler
Periode Finisher (3-6 minggu)... 52 15.ANOVA Pengaruh Perlakuan Terhadap Nilai Leukosit Broiler
Periode Finisher (3-6 minggu)... 53 16.ANOVA Pengaruh Perlakuan Terhadap Nilai IgY Broiler
Periode Finisher (3-6 minggu)... 53 17.ANOVA Pengaruh Perlakuan Terhadap Nilai MCV Broiler
Periode Finisher (3-6 minggu)... 54 18.ANOVA Pengaruh Perlakuan Terhadap Nilai MCHC Broiler
19.ANOVA Pengaruh Perlakuan Terhadap Nilai Limfosit Broiler
Periode Finisher (3-6 minggu)... 55 20.ANOVA Pengaruh Perlakuan Terhadap Nilai Heterofil Broiler
Periode Finisher (3-6 minggu)... 55 21.ANOVA Pengaruh Perlakuan Terhadap Nilai Monosit Broiler
Periode Finisher (3-6 minggu)... 56 22.ANOVA Pengaruh Perlakuan Terhadap Nilai Eosinofil Broiler
Periode Finisher (3-6 minggu)... 56 23.Uji Duncan Interaksi Perlakuan Terhadap Nilai Eritrosit
Broiler Periode Starter (0-3 minggu)... 57 24.Kontras Ortogonal Pengaruh Level Metionin Terhadap Nilai
Leukosit Broiler Periode Starter (0-3 minggu)... 57 25.Uji Duncan Interaksi Perlakuan Terhadap Nilai IgY Broiler
Periode Starter (0-3 minggu)... 58 26.Kontras Ortogonal Pengaruh Level Aflatoksin Terhadap Nilai
Heterofil Broiler Periode Starter (0-3 minggu)... 58 27.Kontras Ortogonal Pengaruh Level Aflatoksin Terhadap Nilai
Leukosit Broiler Periode Finisher (3-6 minggu)... 59 28.Nilai Hematologi Broiler yang Diberi Ransum Komersil dan
PENDAHULUAN
Latar Belakang
Jagung merupakan bahan pakan sumber energi utama dalam ransum unggas.
Penggunaan jagung dalam pakan unggas bisa mencapai 70% (Amrullah, 2004). Oleh
karena itu, jika jagung tercemar oleh bahan asing maka akan menurunkan kualitas
pakan dan membahayakan bagi ternak.
Masalah di bidang pakan yang sering dihadapi di Indonesia salah satunya
adalah adanya cemaran kapang. Kondisi Indonesia yang beriklim tropis dengan suhu
dan kelembaban yang tinggi mempercepat terjadinya penurunan kualitas bahan baku
pakan dan pertumbuhan kapang selama penyimpanan. Ahmad et al. (1999) telah
memeriksa cemaran kapang pada ransum unggas dan hasil pemeriksaan
menunjukkan bahwa Aspergillus spp. merupakan pencemar utama pada pakan dan
bahan penyusun pakan, dengan Aspergillus flavus adalah pencemar terbesar (43%).
Sudjadi et al. (1999) menyatakan bahwa sampel kacang yang dikumpulkan dari
sawah, gudang petani, kolektor, distributor dan pasar, telah terkontaminasi A. flavus
dengan kisaran 60-80% dengan kandungan aflatoksin 40-4100 ppb.
Jagung merupakan bahan penyusun pakan yang paling banyak dicemari
kapang. Purwoko et al. (1991) melaporkan adanya cemaran A. flavus dan A.
parasiticus serta kandungan aflatoksin pada 34 sampel jagung dari peternakan dan
pabrik pakan di wilayah Bogor dan Jakarta. Hampir seluruh sampel tersebut
tercemari A. flavus dan hanya tujuh sampel yang tercemari A. parasiticus. Cemaran
akibat aflatoksin B1 mencapai 91%, sisanya adalah aflatoksin G.
Aflatoksin adalah produk metabolit sekunder yang dihasilkan oleh A. flavus
dan A. parasiticus (Bryden, 1999). Ada 4 tipe aflatoksin yang umum ditemui, yaitu
aflatoksin B1, B2, G1 dan G2 (B = blue fluorescence; G = green fluorescence)
(Lillehoj, 1986). Aflatoksin B1 merupakan yang paling berbahaya bagi kesehatan.
Tempat metabolisme utama aflatoksin adalah organ hati, namun ada juga di
dalam darah dan organ lainnya. Tubuh akan berusaha mengurangi efek racun dari
aflatoksin dan akan dikeluarkan oleh tubuh melalui cairan empedu, susu, telur, dan
air seni. Bila aflatoksin tidak dapat dikeluarkan dari tubuh maka akan terjadi
perubahan patologis dan menimbulkan beberapa gejala seperti keturunan lahir cacat
Aflatoksin pada hewan dapat menyebabkan bobot organ dalam bervariasi
(pembesaran hati, limpa, ginjal, fatty liver syndrome), pengurangan bursa fabricius
dan timus, perubahan tekstur dan warna organ (hati dan tenggorokan), anemia,
pendarahan, imunosupresi, kerusakan kulit, dan penurunan efisiensi breeding (Riley
dan Norred 1996). Beberapa parameter darah juga terpengaruh oleh aflatoksin jika
termakan pada level tertentu. Leeson et al. (1995) menyatakan bahwa parameter darah yang terpengaruh yaitu penurunan signifikan pada hemoglobin, hematokrit,
eritrosit dan MCV (Mean Corpuscular Volume).
Metionin merupakan asam amino yang mengandung sulfur. Penambahan
suplemen seperti antioksidan, vitamin, asam amino bersulfur dan lainnya telah
dilakukan untuk mengatasi efek dari aflatoksin. Peningkatan protein dalam ransum
juga diduga dapat melindungi dari efek aflatoksin (Leeson et al., 1995). Pada penelitian ini dilakukan percobaan pengaruh penambahan metionin dalam ransum
yang mengandung jagung yang terkontaminasi aflatoksin.
Tujuan
Penelitian ini bertujuan untuk mendapatkan informasi mengenai pengaruh
pemberian metionin pada level berbeda terhadap profil darah dan imunoglobulin Y
(IgY) ayam broiler yang diberikan ransum terkontaminasi aflatoksin dalam batas
TINJAUAN PUSTAKA
Ayam Pedaging (Broiler)
Broiler atau ayam pedaging adalah jenis unggas yang telah mengalami seleksi
gen selama bertahun-tahun sehingga hanya dalam waktu produksi 35 sampai 40 hari
sudah layak dikonsumsi. Dalam Kartasudjana (2005) dikatakan bahwa ayam broiler
merupakan ayam-ayam muda jantan atau betina yang umumnya dipanen pada umur
sekitar 5-6 minggu dengan bobot badan antara 1,2-1,9 kg/ ekor dan bertujuan sebagai
sumber daging. Kebutuhan nutrisi broiler dapat dilihat pada Tabel 1.
Tabel 1. Kebutuhan Nutrisi Broiler
Nutrien Periode
strain Ross memiliki keunggulan dan karakteristik sendiri dibanding strain lainnya yaitu memiliki FCR lebih efisien, laju pertumbuhan lebih cepat, daya hidup lebih
bagus dan fokus pengembangan genetik pada kekuatan kaki sebagai penyeimbang
berat badan.
Faktor pendukung pertumbuhan ayam adalah kualitas dan kuantitas makanan,
suhu dan manajemen pemeliharaannya (Rasyaf, 2003). Selain itu, kecepatan
pertumbuhan ayam sangat dipengaruhi oleh mutu makanan, suhu lingkungan, sistem
perkandangan dan pengendalian penyakit. Pakan yang tercemar kontaminan seperti
jamur akan menjadi tidak palatabel bagi ayam dan jika ternyata beracun akan
menimbulkan masalah kesehatan bagi ayam. Di dalam SNI ransum broiler tahun
1995 terdapat batasan kadar afllatoksin yaitu sebesar 50 ppb untuk broiler periode
starter dan 60 ppb untuk broiler periode finisher.
Jagung
Jagung termasuk bahan makanan yang utama digunakan dalam pakan ternak.
Jagung digemari karena disukai dan sesuai untuk semua jenis ternak. Jagung
digunakan sebagai sumber energi utama karena nilai energi dan nutrien tercernanya
cukup tinggi dibanding biji-bijian lainnya. Menurut Tillman et al. (1983), di dalam biji-bijian, karbohidrat terutama terdapat dalam bentuk pati. Pati jagung terdiri atas
amilosa (27%) dan amilopektin (83%). Pati biji jagung terdapat di beberapa tempat
seperti endosperm (84,4%), lembaga (8,2%) dan tudung biji (5,3%) sedangkan
protein jagung terdapat dalam lembaga (8,5 %) dan endosperma (8,6 %). Jagung
terutama digunakan sebagai penyusun ransum ternak unggas. Penggunaan jagung
dalam ransum broiler bisa mencapai 70 % (Amrullah, 2004).
Gambar 1. Jagung yang Terserang Aspergillus flavus
Indonesia sebagai negara tropis memiliki lingkungan yang cocok untuk
pertumbuhan dan perkembangan berbagai macam mikroba. Mikotoksin seperti
aflatoksin banyak didapat pada tanaman yang ditanam di Indonesia. Jagung dan
kacang tanah merupakan bahan yang sering terserang Aspergillus flavus yang merupakan kapang penghasil aflatoksin seperti terlihat pada Gambar 1. Menurut
Sauer dan Tuite (1986), suhu dan kelembaban merupakan dua faktor penting yang
menentukan berkembangnya Aspergillus flavus dan kemampuannya memproduksi aflatoksin. Karena faktor lingkungan yang mendukung, tidak jarang ditemui jagung
dengan kadar aflatoksin tinggi dari hasil panen petani-petani di Indonesia. Kondisi
lingkungan dan iklim, varietas jagung dan kerusakan oleh serangga merupakan faktor
yang mempengaruhi konsentrasi aflatoksin pada jagung (Plumlee, 2004). Berikut
merupakan standar kualitas jagung bahan pakan menurut SNI nomor 01-4483-1998.
Tabel 2. SNI Bahan Pakan Jagung
Komposisi Jumlah kandungan
Kadar air Maks 14%
Kadar Protein Kasar Min 7,5%
Kadar Serat Kasar Maks 3%
Kadar Abu Maks 2%
Kadar Lemak Min 3%
Mikotoksin
1) Aflatoksin (maksimum) Maks 50 ppb
2) Okratoksin (maksimum) Maks 5 ppb
Butir Pecah Maks 5%
Warna Lain Maks 5%
Benda Asing Maks 2%
Kepadatan Min 700 kg/cm3
Sumber : Direktorat Jendral Peternakan, 2009
Aflatoksin
Kapang merupakan jenis mikroba yang sering mencemari tanaman pangan
terutama serealia dan kacang-kacangan. Kapang dapat menghasilkan mikotoksin
yang berbahaya bagi kesehatan ternak. Kapang yang umum ditemui adalah
berbahaya bagi kesehatan manusia karena menghasilkan aflatoksin sebagai produk
metabolit sekundernya.
Aflatoksin adalah molekul kecil yang tidak suka terhadap air, tahan perlakuan
fisik, biologi dan kimia serta tahan terhadap suhu tinggi. Ada 4 tipe aflatoksin yang
umum ditemui (Lillehoj, 1986), yaitu aflatoksin B1, B2, G1 dan G2 (B = blue
fluorescence; G = green fluorescence). Tipe aflatoksin yang berbeda memiliki suhu
dan waktu pertumbuhan yang berbeda pula (Diener dan Davis, 1986). Aflatoksin B1
merupakan tipe yang paling berbahaya bagi kesehatan. Kebanyakan strain
Aspergillus flavus hanya menghasilkan afaltoksin B namun terdapat juga strain Aspergillus flavus dan Aspergillus parasiticus yang tidak memproduksi aflatoksin (Plumlee, 2004).
Gambar 2. Aspergillus flavus
Sumber: Brown (2009)
Cemaran Aspergillus flavus saat budidaya dipengaruhi beberapa faktor, antara lain, suhu tanah, lengas tanah, kandungan unsur hara dalam tanah serta hama dan
penyakit. Kelembaban udara tinggi (90-98%) dan suhu tanah 17-42oC menyebabkan
Aspergillus flavus menjadi lebih kompetitif. Plumlee (2004) mengatakan bahwa pertumbuhan kapang dan produksi aflatoksin dipertinggi oleh kadar air lebih dari
15%, kelembaban di atas 75%, suhu yang hangat dan kecukupan oksigen. Cemaran
aflatoksin pada jagung bergantung pada kondisi lingkungan dan perlakuan pasca
panen. Kandungan aflatoksin total pada jagung pipil lebih tinggi daripada pada
jagung tongkol. Menurut Diener dan Davis (1986), kontaminasi terjadi saat
Bila pakan yang tercemar aflatoksin termakan oleh ternak (unggas dan
ruminansia) maka aflatoksin akan masuk ke tubuh ternak dan terakumulasi pada
organ terutama hati dan ginjal. Aflatoksin yang termakan akan mengalami proses
biotransformasi enzimatis pada organ seperti hati dan ginjal sebagai respon tubuh
ternak untuk mengeluarkan toksin tersebut dari tubuh (Leeson et al., 1995). Dijelaskan oleh Plumlee (2004) mengenai mekanisme kerja aflatoksin dimana
produk hasil epoksidasi (salah satu proses biotransformasi enzimatis) aflatoksin B1
akan berikatan dengan komponen sel seperti asam nukleat, organel sel dan protein
kemudian memecah proses anabolis dan katabolis tubuh. Hal ini menyebabkan
kerusakan fungsi organ, karsinogenesis, imunosupresi, mutagenesis dan
teratogenesis.
Metionin
Umumnya hewan tidak mampu mensintesa asam-asam amino seperti pada
tanaman, sehingga dalam pakannya harus tersedia asam-asam amino yang
dibutuhkannya. Cheeke (2005) menyebutkan bahwa asam amino dibedakan menjadi
asam amino esensial dan asam amino non esensial. Asam amino esensial tidak dapat
disintesis tubuh ternak sedangkan asam amino non esensial dapat disintesis untuk
memenuhi kebutuhan. Sangat sulit untuk membuat patokan kebutuhan asam amino
esensial secara umum dari satu spesies ke spesies lainnya karena terdapat perbedaan
kualitatif dan kuantitatif kebutuhan asam amino dalam makanan. Unggas, seperti
halnya tikus dan anjing, memerlukan 10 asam amino yang esensial.
Asam amino metionin merupakan salah satu asam amino yang esensial dalam
hidup ternak. Asam amino metionin termasuk ke dalam golongan asam amino yang
mengandung sulfur selain sistin dan sistein (Tillman et al., 1983). Asam amino metionin sangat diperlukan untuk kecepatan pertumbuhan dan hidup pokok semua
hewan. Apabila terjadi kekurangan protein akan menekan laju pertumbuhan ternak,
efisiensi konversi pakan, respon imun dan efisiensi reproduksi. Defisiensi metionin
pada ransum yang mengandung jagung atau bungkil kedelai maka akan
mengakibatkan laju pertumbuhan yang rendah, serta penurunan bobot dan produksi
telur (Shane, 2005). Plumlee (2004) menyatakan bahwa pemberian metionin yang
rendah dalam ransum akan menyebabkan peningkatan hepatokarsinogenesis dan
maka akan bersifat racun dan berakibat buruk bagi ternak. D’ Mello (2003)
mneuliskan bahwa metionin adalah asam amino yang paling menekan pertumbuhan
jika diberikan berlebihan pada ternak.
Hasil penelitian Nahrowi et al. (2007) menunjukkan bahwa konsumsi metionin yang berlebih pada ayam petelur (432 mg/hari/ekor) menyebabkan
penurunan performa ayam. Hasil yang terbaik didapat dari ayam yang
mengkonsumsi metionin sebanyak 388,8 mg/hari/ekor dengan total kandungan
metionin dalam pakan sebesar 0,38%, selain itu juga pada ayam yang mendapat
suplementasi metionin 0,05% pada air minum. Peubah yang diamati mendapat hasil
terbaik yaitu produksi hen-day, FCR, berat telur, berat albumin dan berat kerabang. Asam amino metionin memiliki sifat glikogenik (menghasilkan glukosa saat
proses metabolisme) dan lipotropik (memecah lemak dalam tubuh ketika proses
metabolisme). Piliang dan Djojosoebagio (2006) mengatakan bahwa sifat glikogenik
metionin meningkatkan pembentukan glukosa dan glikogen. Karena itu, pemberian
metionin dapat meningkatkan jumlah energi bruto dalam tubuh ayam karena energi
bruto yang dibuang melalui ekskreta diturunkan.
Asam amino yang terdapat pada tumbuhan dan hewan pada umumnya
memiliki bentuk isomer L. DL-metionin (Dekstro-Levo-Methionine) merupakan
salah satu jenis asam amino sintetis yang berbentuk serbuk. DL-metionin merupakan
sumber asam amino komersial yang memiliki tingkat kemurnian 99%. Ketika
digunakan, DL-metionin bisa memenuhi kebutuhan metionin pada ransum (NRC,
1998). D’ Mello (2003) mengatakan bahwa DL-metionin merupakan hasil produksi
melalui sintesis kimia yang mencampurkan isomer D dan L. Asam amino D tidak
digunakan oleh ternak untuk sintesis protein maupun keperluan metabolik lain. Oleh
karena itu, D-metionin akan diubah oleh tubuh menjadi L-metionin sebelum dapat
digunakan.
Penambahan DL-metionin ke dalam ransum diharapkan dapat mengurangi
efek negatif dari aflatoksin. Metionin diharapkan bekerja sebagai bahan pengikat
atau inaktivator aflatoksin. Inaktivator berperan untuk mengikat atau mengubah
mikotoksin selama proses pencernaan sehingga menghalangi mikotoksin
pengikat memiliki kemampuan untuk mengikat substansi kimia sehingga merintangi
penyerapan aflatoksin di saluran pencernaan.
Darah
Darah terdiri dari sel-sel yang terdapat dalam plasma. Sel darah terdiri dari 3
macam, yaitu sel darah merah (erythrocyte), sel darah putih (leukocyte) dan kepingan
darah (thrombocytes atau platelets) (Dellman dan Brown, 1992).
Fungsi darah menurut Rastogi (2007) yaitu:
1. Membawa nutrien yang telah diserap saluran pencernaan menuju ke berbagai
jaringan tubuh,
2. Membawa oksigen dari paru-paru ke seluruh jaringan tubuh,
3. Membawa karbon dioksida dari jaringan tubuh ke paru-paru,
4. Membawa produk buangan dari berbagai jaringan menuju ginjal untuk
diekskresikan,
5. Berperan penting dalam pengendalian suhu dengan cara mendistribusikan panas
ke seluruh bagian tubuh,
6. Memiliki kapasitas buffer yang menjaga keseimbangan asam-basa tubuh agar
tetap normal,
7. Mencegah terjadinya kehilangan darah yang berlebih sewaktu terluka melalui
kerja trombosit darah,
8. Menjaga keseimbangan air tubuh dengan menukarkan air antara darah dengan
cairan jaringan,
9. Memberi perlindungan bagi tubuh melawan infeksi dan antibodi,
10. Membawa hormon untuk didistribusikan ke berbagai bagian tubuh,
11. Berperan untuk suplai metabolit kimia dan esensial.
Ternak yang sehat akan memiliki profil darah yang normal. Ada dua faktor
yang dapat menyebabkan terjadinya perubahan profil darah yaitu faktor internal dan
eksternal. Faktor internal antara lain kesehatan, stres, status gizi, suhu tubuh,
pertambahan umur dan siklus estrus sedangkan faktor eksternal seperti perubahan
suhu lingkungan dan infeksi kuman (Guyton dan Hall, 1996). Infeksi kuman salah
satunya adalah ditandai dengan jumlah leukosit yang meningkat (Frandson, 1992).
Tabel 3. Nilai Hematologis Darah Ayam Broiler
Profil darah Satuan Sumber 1) Sumber 2)
Eritrosit 106/mm3 2,5-3,2 2,0-3,2
Hemoglobin g/100ml 6,5-9,0 7,3-10,9
Hematokrit % 30,0-33,0 24,0-43,0
Leukosit 103/mm3 20,0-30,0 16,0-40,0
Heterofil % 25,0-30,0 9,0-56,0
Limfosit % 55,0-60,0 24,-84,0
Monosit % 10,0 0-30,0
Eosinofil % 3,0-8,0 0-7,0
Sumber : 1) Swenson (1984)
2) Mangkoewidjojo dan Smith (1988)
Mikotoksin adalah racun yang dihasilkan oleh golongan cendawan.
Mikotoksin yang termakan oleh ayam sampai pada batas tertentu akan menimbulkan
gejala, salah satunya yaitu melemahnya sistem pertahanan tubuh ayam atau sering
disebut imunosupresi. Dari sekitar 300 jenis mikotoksin yang telah terdeteksi dari
100.000 spesies jamur, setidaknya ada 4 jenis mikotoksin yang bersifat imunosupresi
pada ayam, yaitu aflatoksin, ochratoksin, fumonisin dan trichothecenes (T2).
Aflatoksin dapat menyebabkan pengecilan bursa fabricius, limpa maupun thymus. Aflatoksin juga dapat merusak sel limfosit B, mengganggu fungsi fagosit sel-sel
fagositik serta menurunkan aktivitas fungsional dari komplemen. Ocratoksin
mengakibatkan atropi thymus, menghambat fungsi fagositosis sel-sel heterofil
fagositik dan menyebabkan penipisan sel limfosit T dan B. Atropi organ limfoid dan
kerusakan makrofag juga diakibatkan oleh adanya fumonisin sedangkan
trichothecenes mengakibatkan nekrosis jaringan limfoid dan sumsum tulang
belakang. Plumlee (2004) menuliskan salah satu gejala klinis dari paparan aflatoksin
kronis yaitu terjadinya anemia pada ternak.
Hemoglobin
Hemoglobin adalah senyawa yang berasal dari ikatan komplek antar protein
globin maka terbentuk hemoglobin (Rastogi, 2007). Hemoglobin merupakan
petunjuk kecukupan oksigen. Kandungan oksigen yang rendah dalam darah
menyebabkan peningkatan produksi hemoglobin dan eritrosit (Swenson, 1984).
Hematokrit
Persentase sel darah merah dalam 100 ml darah dinamakan hematokrit atau
packed cell volume (PCV). Rastogi (2007) mengatakan bahwa nilai hematokrit biasanya tiga kali dari nilai hemoglobin dan dituliskan dalam bentuk persen. Nilai
hematokrit yang rendah mengindikasikan anemia atau overhidrasi sedangkan nilai
hematokrit yang tinggi menandakan polisitemia atau dehidrasi.
Sel Darah Merah (Eritrosit)
Eritrosit adalah sel darah merah yang membawa hemoglobin ke dalam
sirkulasi. Eritrosit pada unggas intinya terletak di tengah dan berbentuk oval.
Erittrosit dibentuk di sumsum tulang dan dalam jumlah sedikit di limpa (Swenson,
1984). Eritrosit dipengaruhi oleh konsentrasi hemoglobin dan hematokrit, selain itu
juga dipengaruhi oleh umur, bangsa, jenis kelamin, aktivitas, nutrien, produksi telur,
volume darah, panjang hari, faktor iklim dan suhu lingkungan.
Sel Darah Putih (Leukosit)
Leukosit merupakan sel darah putih dengan jumlah lebih sedikit daripada
eritrosit (Swenson, 1984). Peningkatan nilai leukosit dari jumlah normal menandakan
terjadinya infeksi sedangkan penurunan leukosit menandakan depresi sumsum
tulang, yang diakibatkan oleh infeksi viral atau reaksi toksik terhadap agen kimia
(Ratogi, 2007). Nilai diferensiasi leukosit berdasarkan umur ayam dapat dilihat pada
Tabel 4.
Leukosit dibagi menjadi granulosit (bergranula dalam sitoplasmanya) seperti
heterofil, eosinofil dan basofil serta agranulosit seperti limfosit dan monosit.
Menurut Frandson (1992), masa hidup sel darah putih berbeda-beda mulai dari
beberapa jam untuk granulosit, bulanan pada monosit dan tahunan pada limfosit.
a) Eosinofil; b) Neutrofil/ Heterofil; c) Basofil
d) Monosit; e) Limfosit
Gambar 3. Diferensiasi Leukosit Sumber: Fakhrizal (2009)
Tabel 4. Persentase Leukosit Berdasarkan Umur Ayam
Umur Persentase (%)
Heterofil Eosinofil Basofil Limfosit Monosit
0 hari 72,4 2,5 1,1 15,9 8,8
3 hari 52,7 1,6 0,67 38,7 6,4
8 hari 50 0,25 0 48,3 1,5
10 hari 26,7 1,7 0,64 68,6 2,3
1 minggu 24 0 0 75 1
2 minggu 20,6 3,1 1,9 66 8,1
6 minggu 26 0 1 69 3
Sumber: Hodges (1997)
Neutrofil
Neutrofil atau juga dikenal dengan nama heterofil pada unggas mengandung
granula yang memberikan warna tidak merah dan tidak biru, sitoplasmanya
mengambil sedikit warna sehingga inti terlihat lebih jelas. Heterofil pada ayam
biasanya bulat berdiameter 10-15 µm dengan sifat inti polimorfik dan lobus
bervariasi (Frandson, 1992).
Monosit
Sel ini bersifat fagositik, yang berarti kemampuan menerkam material asing
selain menghancurkan partikel asing dan jaringan mati juga mengolah bahan asing
sedemikian rupa sehingga bahan asing tadi akan membangkitkan tanggap kebal.
Limfosit
Limfosit adalah leukosit yang merupakan bagian terbesar dalam darah unggas
(Swenson, 1984). Limfosit dibentuk di sumsum tulang belakang, tetapi sebagian
dibentuk dari sel prekusor yang berasal dari sumsum tulang, di dalam kelenjar limfe,
timus dan limpa. Tizard (1987) menyatakan bahwa limfosit memiliki fungsi
kompleks dengan fungsi utama memproduksi antibodi (limfosit B) atau sebagai sel
efektor khusus ketika menanggapi antigen yang melekat pada makrofag (limfosit T).
Adanya infeksi dan stres dapat mempengaruhi jumlah limfosit (Swenson, 1984).
Eosinofil
Eosinofil terlihat sebagai granula berwarna merah di dalam sitoplasma. Sel
ini berjumlah tidak banyak namun dapat meningkat saat tubuh terkena penyakit
kronis seperti terinfeksi parasit atau saat reaksi alergi (Frandson, 1992). Fungsi
utamanya adalah untuk toksifikasi terhadap protein asing yang masuk ke tubuh
melalui paru-paru dan saluran pencernaan serta racun yang dihasilkan bakteri dan
parasit.
Basofil
Jumlah basofil dalam sirkulasi darah hanya sedikit. Sel ini ditandai dengan 2
lobus dan mempunyai granula intrasitoplasmik berwarna ungu (Kresno, 2001).
Leukosit darah yang kaya basofil melepaskan histamin pada reaksi serupa dengan
reaksi sel mast. Saat ada rangsangan alergen, sel-sel tersebut dapat melepaskan
berbagai mediator yang mengakibatkan reaksi anafilaktik.
Sistem Imun
Sistem imun dalam tubuh memberikan respons dan melindungi tubuh
terhadap unsur-unsur patogen. Respon imun sangat bergantung terhadap kemampuan
sistem imun untuk mengenali molekul asing (antigen) yang terdapat pada patogen
potensial dan kemudian membangkitkan reaksi yang tepat untuk menyingkirkan
sumber antigen tersebut. Proses pengenalan antigen dilakukan oleh unsur utama
sistem imun yaitu limfosit, yang kemudian diikuti fase efektor yang melibatkan
Imunoglobulin merupakan substansi pertama yang diidentifikasi sebagai
molekul dalam serum yang mampu menetralkan sejumlah mikroorganisme penyebab
infeksi. Imunoglobulin terdiri dari molekul-moluekul protein yang memiliki struktur
dan sifat biologik yang sama tetapi memiliki perbedaan dalam susunan asam amino
yang membentuknya. Imunoglobulin (Ig) dibentuk oleh sel limfosit B (Kresno,
2001). Imunoglobulin pada manusia dibagi menjadi 5 jenis yaitu IgM (µ), IgD ( ),
IgG ( ), IgA ( ), IgE ( ). Unggas memiliki imunoglobulin (Ig) dengan tipe IgM, IgY
dan IgA. Penamaan IgY sering dipakai pada unggas untuk menggantikan IgG (Glick,
2000). IgG dalam serum kadarnya sekitar 75% dan IgE kadarnya rendah yang
meningkat pada reaksi alergi (Kresno, 2001). IgY diproduksi setelah IgM pada
respon antibodi primer dan merupakan isotipe utama yang diproduksi pada respon
MATERI DAN METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan April 2010 hingga Juli 2010 yang
bertempat di Laboratorium Ilmu dan Teknologi Pakan, Laboratorium Terpadu,
Kandang Percobaan Unggas, Departemen Ilmu Nutrisi dan Teknologi Pakan
Fakultas Peternakan dan Laboratorium Fisiologi Departemen Fisiologi dan
Farmakologi FKH, Institut Pertanian Bogor.
Materi
Bahan-bahan yang digunakan dalam penelitian ini antara lain yaitu kultur
Aspergillus flavus yang dibiakkan dalam jagung. Selain itu digunakan 720 ekor broiler strain Ross Jumbo 747, ransum dengan level aflatoksin dan metionin yang berbeda, vaksin ND dan vaksin Gumboro serta bahan pendukung lainnya.
Peralatan yang digunakan yaitu kawat ose, plastik tahan panas kapasitas 5 kg,
karet gelang, autoclave, freezer, terpal, plastik penutup, sarung tangan, masker, peralatan pembersih kandang, selang, hygrometer, timbangan, koran, tempat pakan
dan air minum, sekat pembatas, pemanas, lampu, kawat dan peralatan pengambilan
darah yaitu kapas, syringe 3 ml serta tabung yang sudah berisi anti-koagulan.
Metode
Metode penelitian dibagi menjadi beberapa tahapan. Tahapan pertama yaitu
persiapan ransum yang meliputi perbanyakan kultur Aspergillus flavus dan transfer kapang Aspergillus flavus ke dalam jagung yang akan dipakai untuk membuat ransum. Skema prosesnya dapat dilihat pada Gambar 4 dan Gambar 5. Kultur
Aspergillus flavus merupakan koleksi yang terdapat di Laboratorium Ilmu dan Teknologi Pakan, Fakultas Peternakan. Tahapan selanjutnya yaitu pembuatan ransum
penelitian dan persiapan kandang diikuti dengan tahap pemeliharaan ayam broiler di
Perbanyakan Kultur Aspergillus flavus
Diagram alur metode perbanyakan kultur Aspergillus flavus disajikan pada Gambar 4.
Gambar 4. Tahapan Perbanyakan Kultur Aspergillus flavus PDA (Potato Dextrose Agar) ditimbang sebanyak 0,975 g untuk 5 tabung
Erlenmeyer
Ditambahkan aquades yang telah disterilkan (1 liter aquades untuk 39 g PDA)
Dipanaskan dan diaduk agar homogen
Diambil 5 ml agar untuk setiap tabung, ditutup kapas
Autoclave (1210C, 45 menit)
Media agar miring
Kultur Aspergillus flavus dioles di atas media agar
Ditutup kapas dan parafilm
Transfer Kapang Aspergillus flavus ke Jagung
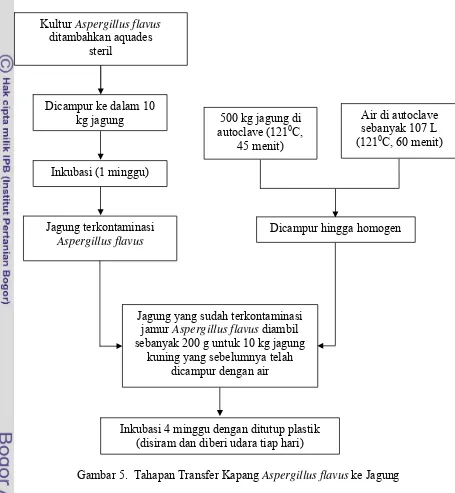
Diagram alur metode transfer kapang Aspergillus flavus ke dalam jagung disajikan pada Gambar 5.
Gambar 5. Tahapan Transfer Kapang Aspergillus flavus ke Jagung Kultur Aspergillus flavus
ditambahkan aquades steril
Dicampur ke dalam 10 kg jagung
Inkubasi (1 minggu)
Jagung terkontaminasi Aspergillus flavus
500 kg jagung di autoclave (1210C,
45 menit)
Air di autoclave sebanyak 107 L (1210C, 60 menit)
Dicampur hingga homogen
Jagung yang sudah terkontaminasi jamur Aspergillus flavus diambil sebanyak 200 g untuk 10 kg jagung
kuning yang sebelumnya telah dicampur dengan air
Pembuatan Ransum
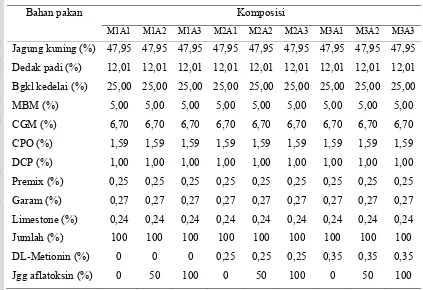
Ransum yang dibuat meliputi ransum periode starter dan finisher. Ransum yang dibuat ada 9 macam yaitu tiga level aflatoksin dengan tiga dosis DL-metionin
di setiap levelnya. Komposisi bahan pakan ransum starter dan finisher diperlihatkan pada Tabel 5 dan 6. Pencampuran ransum dilakukan dengan menggunakan mixer dari bahan yang paling halus dan berjumlah sedikit. Selanjutnya pakan dibuat pellet dan crumble.
Tabel 5. Komposisi Ransum Periode Starter (0-3 minggu)
Bahan pakan Komposisi
M1A1 M1A2 M1A3 M2A1 M2A2 M2A3 M3A1 M3A2 M3A3
Jagung kuning (%) 47,95 47,95 47,95 47,95 47,95 47,95 47,95 47,95 47,95
Dedak padi (%) 12,01 12,01 12,01 12,01 12,01 12,01 12,01 12,01 12,01
Bgkl kedelai (%) 25,00 25,00 25,00 25,00 25,00 25,00 25,00 25,00 25,00
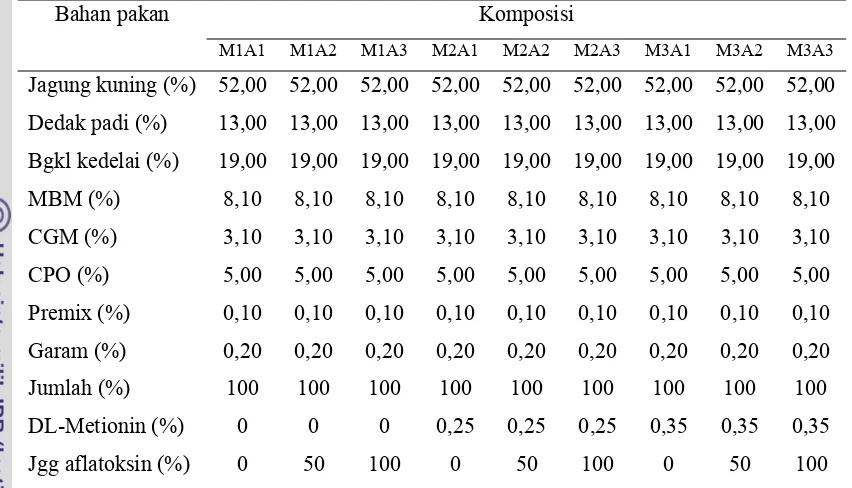
Tabel 6. Komposisi Ransum Periode Finisher (3-6 minggu)
Bahan pakan Komposisi
M1A1 M1A2 M1A3 M2A1 M2A2 M2A3 M3A1 M3A2 M3A3
Jagung kuning (%) 52,00 52,00 52,00 52,00 52,00 52,00 52,00 52,00 52,00
Dedak padi (%) 13,00 13,00 13,00 13,00 13,00 13,00 13,00 13,00 13,00
Bgkl kedelai (%) 19,00 19,00 19,00 19,00 19,00 19,00 19,00 19,00 19,00
Keterangan: Hasil Analisis Laboratorium Ilmu dan Teknologi Pakan, Fakultas Peternakan IPB (2010); M1A1= ransum basal + 0% metionin + 0 ppb aflatoksin, M1A2= ransum basal + 0% metionin + 150 ppb aflatoksin, M1A3= ransum basal + 0% metionin + 300 ppb aflatoksin, M2A1= ransum basal + 0,20% metionin + 0 ppb aflatoksin, M2A2= ransum basal + 0,20% metionin + 150 ppb aflatoksin, M2A3= ransum basal + 0,20% metionin + 300 ppb aflatoksin, M3A1= ransum basal + 0,30% metionin + 0 ppb aflatoksin, M3A2= ransum basal + 0,30% metionin + 150 ppb aflatoksin, M3A3= ransum basal + 0,30% metionin + 300 ppb aflatoksin.
Penambahan DL-metionin pada periode starter yaitu sebesar 0, 0,25% dan 0,35%, sedangkan pada periode finisher sebesar 0, 0,20% dan 0,30%. Nilai kandungan nutrien ransum starter dan finisher yang meliputi hasil analisis proksimat, kandungan aflatoksin dan kandungan asam amino ransum diperlihatkan pada Tabel 7
dan 8.
Persiapan Kandang
Kandang yang dipakai untuk pemeliharaan terlebih dahulu dibersihkan
dengan disapu, disikat dan dibilas dengan detergen dan air. Kemudian setelah kering
kandang diberi sekat-sekat, dipasang papan nomor dan dikapur. Kandang dipasang
tirai lalu ke dalam setiap sekat ditaburkan sekam dan dipersiapkan tempat pakan dan
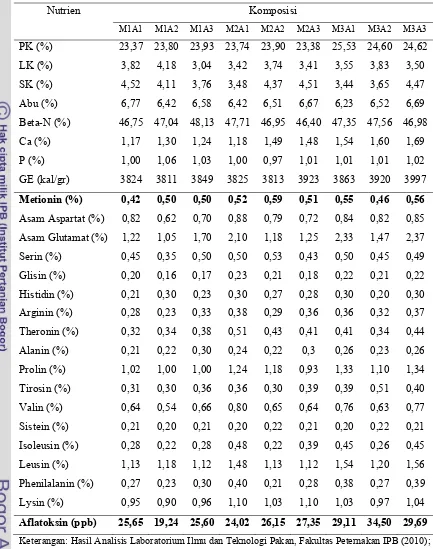
Tabel 7. Kandungan Nutrien dan Aflatoksin Ransum Periode Starter (0-3 minggu) Nutrien Komposisi
M1A1 M1A2 M1A3 M2A1 M2A2 M2A3 M3A1 M3A2 M3A3
PK (%) 23,37 23,80 23,93 23,74 23,90 23,38 25,53 24,60 24,62
LK (%) 3,82 4,18 3,04 3,42 3,74 3,41 3,55 3,83 3,50
SK (%) 4,52 4,11 3,76 3,48 4,37 4,51 3,44 3,65 4,47
Abu (%) 6,77 6,42 6,58 6,42 6,51 6,67 6,23 6,52 6,69
Beta-N (%) 46,75 47,04 48,13 47,71 46,95 46,40 47,35 47,56 46,98
Ca (%) 1,17 1,30 1,24 1,18 1,49 1,48 1,54 1,60 1,69
P (%) 1,00 1,06 1,03 1,00 0,97 1,01 1,01 1,01 1,02
GE (kal/gr) 3824 3811 3849 3825 3813 3923 3863 3920 3997
Metionin (%) 0,42 0,50 0,50 0,52 0,59 0,51 0,55 0,46 0,56
Aflatoksin (ppb) 25,65 19,24 25,60 24,02 26,15 27,35 29,11 34,50 29,69
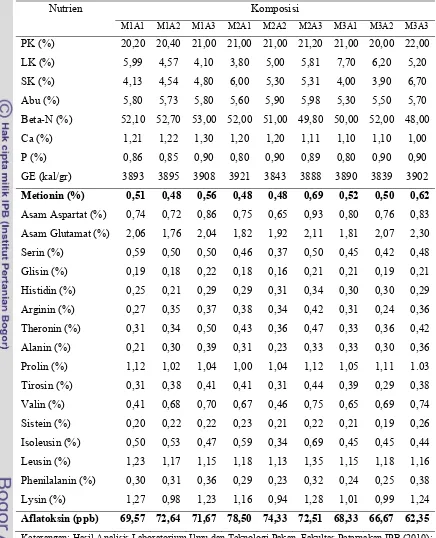
Tabel 8. Kandungan Nutrien dan Aflatoksin Ransum Periode Finisher (3-6 minggu)
Nutrien Komposisi
M1A1 M1A2 M1A3 M2A1 M2A2 M2A3 M3A1 M3A2 M3A3
PK (%) 20,20 20,40 21,00 21,00 21,00 21,20 21,00 20,00 22,00
LK (%) 5,99 4,57 4,10 3,80 5,00 5,81 7,70 6,20 5,20
SK (%) 4,13 4,54 4,80 6,00 5,30 5,31 4,00 3,90 6,70
Abu (%) 5,80 5,73 5,80 5,60 5,90 5,98 5,30 5,50 5,70
Beta-N (%) 52,10 52,70 53,00 52,00 51,00 49,80 50,00 52,00 48,00
Ca (%) 1,21 1,22 1,30 1,20 1,20 1,11 1,10 1,10 1,00
P (%) 0,86 0,85 0,90 0,80 0,90 0,89 0,80 0,90 0,90
GE (kal/gr) 3893 3895 3908 3921 3843 3888 3890 3839 3902
Metionin (%) 0,51 0,48 0,56 0,48 0,48 0,69 0,52 0,50 0,62
Phenilalanin (%) 0,30 0,31 0,36 0,29 0,23 0,32 0,24 0,25 0,38
Lysin (%) 1,27 0,98 1,23 1,16 0,94 1,28 1,01 0,99 1,24
Aflatoksin (ppb) 69,57 72,64 71,67 78,50 74,33 72,51 68,33 66,67 62,35
Pemeliharaan
DOC yang baru datang ditimbang dan dibagi ke dalam 9 perlakuan dan 4
ulangan sehingga setiap sekat berisi DOC sebanyak 20 ekor. Pada awal masuk, DOC
diberikan larutan gula kemudian dilanjutkan pemberian Vita Stress ke dalam air minum selama tiga hari pertama dan setiap setelah penimbangan. Pemeliharaan
dilakukan selama 42 hari. Ransum starter diberikan mulai dari DOC hingga ayam berumur 21 hari dilanjutkan dengan pemberian ransum finisher mulai umur 22 hari hingga umur 42 hari. Ayam diberi pakan dan minum secara ad libitum. Sisa ransum yang tidak habis kemudian ditimbang dan dicatat. Pengukuran pertambahan bobot
badan dilakukan setiap minggu.
Pencegahan terhadap penyakit dilakukan melalui vaksinasi. Vaksinasi ND
(newcastle disease) dilakukan saat ayam berumur 3 hari dengan tetes mata dan saat
berumur 21 hari melalui oral (ditambahkan ke dalam air minum). Sedangkan
vaksinasi IBD atau gumboro dilakukan secara oral (ditambahkan ke dalam air
minum) saat ayam berumur 10 hari.
Pengambilan Darah
Darah diambil dari seekor ayam secara acak dalam masing-masing perlakuan
dan setiap ulangan. Pengambilan darah pada ayam dilakukan melalui vena jugularis. Pengambilan darah dilakukan pada periode starter dan finisher, yaitu saat ayam
berumur 20 hari dan 41 hari, sebelum pemberian ransum yaitu pada pagi hari antara
pukul 08.00-10.00 WIB.
Analisa profil darah meliputi kadar hemoglobin, hematokrit, butir darah
merah (BDM) dan butir darah putih (BDP) dilakukan di Laboratorium Fisiologi,
Departemen Fisiologi dan Farmakologi, FKH. Analisa kadar hemoglobin dilakukan
dengan menggunakan metode Sianomethemoglobin. Analisa hematokrit dengan
menggunakan metode mikrohematokrit, sedangkan BDM dan BDP dihitung dengan
menggunakan hemositometer.
Rancangan Percobaan
Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap
(RAL) pola faktorial 3x3 dengan 3 level faktor A dan 3 level faktor B. Faktor A
adalah level metionin dan faktor B adalah level aflatoksin. Perlakuan ransum yang
M1= tanpa penambahan DL-metionin
M2= penambahan 0,25% DL-metionin
M3= penambahan 0,35% DL-metionin
A1= level aflatoksin ransum 0 ppb
A2= level aflatoksin ransum 150 ppb
A3= level aflatoksin ransum 300 ppb
Perlakuan ransum finisher yang diberikan adalah sebagai berikut: M1= tanpa penambahan DL-metionin
M2= penambahan 0,20% DL-metionin
M3= penambahan 0,30% DL-metionin
A1= level aflatoksin ransum 0 ppb
A2= level aflatoksin ransum 150 ppb
A3= level aflatoksin ransum 300 ppb
Model matematika yang digunakan adalah :
Yijk = µ + αi + βj +(αβ) ij + εijk
Keterangan :
Yijk = Nilai pengamatan perlakuan ke-i, perlakuan ke-j, dan ulangan ke-k
µ = Rataan umum
αi = Pengaruh perlakuan ke-i
βj = Pengaruh perlakuan ke-j
(αβ) ij = Pengaruh interaksi perlakuan ke-I dan perlakuan ke-j
εij = Error perlakuan ke-i, perlakuan ke-j, dan ulangan ke-k
Data yang diperoleh dari penelitian ini dianalisa dengan menggunakan sidik
ragam (Analysis of Variance), Jika berbeda nyata dilanjutkan dengan Uji Kontras
Ortogonal (Steel dan Torrie, 1991).
Peubah yang Diamati
1. Hemoglobin (g%)
2. Hematokrit (PCV) (%) 3. Eritrosit(juta/mm3) 4. Leukosit(ribu/mm3)
5. Diferensiasi leukosit (%)
7. MCV (Mean Corpuscular Volume)(fl)
PCV x 10
∑ eritrosit
8. MCHC (Mean Corpuscular Hemoglobin Concentration)(%)
Hb x 100
∑ PCV
Analisa Laboratorium
Penghitungan Jumlah Hematokrit
Pengisian pipa mikrokapiler dilakukan dengan memiringkan tabung yang
berisi sampel darah dengan menempatkan ujung mikrokapiler yang bertanda (merah
atau biru). Pipa diisi sampai mencapai 4/5 bagian kemudian ujung pipa disumbat
dengan “crestaseal” dan pipa mikrokapiler tersebut diletakkan di sentrifuge selama 5
menit dengan kecepatan 12.000 rpm. Nilai hematokrit ditentukan dengan mengukur
% volume eritrosit (lapisan merah) dari darah dengan menggunakan alat baca
mikrohematokrit (microcapillary hematocrit reader).
Penghitungan Jumlah Eritrosit
Sampel darah dihisap menggunakan pipet eritrosit hingga tanda tera 0,5 atau
1,0 dengan aspirator pada pipet. Ujung pipet dibersihkan dengan menggunakan tisu,
lalu larutanan pengencer Rees dan Ecker dihisap hingga tanda 101. Kemudian pipet
diputar dengan membentuk angka 8. Setelah homogen, cairan yang tidak terkocok
pada ujung pipet dibuang dengan menempelkan ujung pipet ke kertas tisu. Setelah itu
diteteskan satu tetes ke dalam himocytometer, usahakan jangan sampai ada udara yang masuk. Setelah itu cairan didiamkan beberapa saat agar mengendap, lalu
perhitungan dapat dimulai.
Untuk menghitung eritrosit dalam hemocytometer, digunakan kotak eritrosit yang berjumlah 25 buah dengan mengambil bagian sebagai berikut: satu kotak pojok
kanan atas, satu kotak pojok kiri atas, satu kotak di tengah, satu kotak pojok kiri
bawah dan satu kotak pojok kanan bawah. Untuk mengetahui eritrosit dalam 1 mm3
misalnya jumlah eritrosit yang terhitung adalah sebanyak a, maka a dikalikan 5000.
Penghitungan Jumlah Leukosit
Sampel darah dihisap menggunakan pipet leukosit hingga tanda tera 0,5 atau
1,0 dengan aspirator. Ujung pipet dibersihkan dengan menggunakan tisu, lalu
laruatan pengencer Rees & Ecker dihisap hingga tanda 11. Kemudian diputar dengan
membentuk angka 8. Setelah homogen, cairan yang tidak terkocok pada ujung pipet
dibuang dengan menempelkan ujung pipet ke kertas tisu. Setelah itu teteskan satu
tetes kedalam himocytometer, usahakan jangan sampai ada udara yang masuk. Setelah itu biarkan cairan beberapa saat agar mengendap, lalu perhitungan dapat
dimulai.
Untuk menghitung leukosit dalam hemocytometer, digunakan 5 buah kotak besar yang di dalamnya berisi 25 buah kotak kecil dengan mengambil bagian sebagai
berikut satu kotak pojok kanan atas, satu kotak pojok kiri atas, satu kotak di tengah,
satu kotak pojok kiri bawah dan satu kotak pojok kanan bawah. Untuk mengetahui
leukosit dalam 1 mm3 misalnya jumlah leukosit yang terhitung adalah sebanyak b,
maka b dikalikan 200.
Jumlah Leukosit = b x 200
Setelah itu, pembuatan preparat ulas yaitu, diambil dua buah gelas objek yang
sudah dibersihkan dengan alkohol. Darah diambil dan diteteskan pada bagian ujung
gelas objek yang pertama, lalu bagian ujung depan gelas objek yang kedua
ditempelkan pada darah tadi dengan membentuk sudut 30o dan darah disebar
sepanjang sudut sepanjang gelas objek. Setelah darah menyebar, dengan hati-hati
gelas objek kedua didorong dengan cepat hingga didapat ulasan darah yang tipis.
Preparat dikeringkan udara dan diwarnai dengan cara dimasukkan ke dalam metanol
selama 5 menit lalu dikeringkan dan dimasukkan ke dalam larutan zat warna Giemsa
selama 30 menit. Setelah itu diagkat dan dicuci dengan air mengalir lalu dikeringkan
dengan udara terbuka.
Penghitungan ulas darah dibawah mikroskop dengan pembesaran 100 kali.
Penghitungan deferensiasi leukosit ini, berdasarkan hasil pengamatan dengan
menghitung jumlah heterofil (butir/mm3), basofil (butir/mm3), eosinofil (butir/mm3),
Heterofil : granula netral, halus, inti berbentuk batang
Basofil : granula biru tua, besar-besar
Eosinofil : granula merah, besar-besar
Limfosit : inti bulat, biru tua, sitoplasma sedikit, biru muda
Monosit : inti berlekuk, biru tua, sitoplasma banyak, biru muda
Imunoglobulin.
Imunoglobulin dihitung menggunakan metode Enzyme Linked Immunosorbent Assay (ELISA). Prinsip dasar ELISA adalah analisis interaksi antara antigen dan antibodi yang teradsorbsi secara pasif pada permukaan fase padat dengan
menggunakan konjugat antibodi atau antigen yang dilabel enzim. Enzim ini akan
bereaksi dengan substrat dan menghasilkan warna. Warna yang timbul dapat
ditentukan secara kualitatif dengan pembacaan nilai absorbansi (OD) pada ELISA
plate reader.
Siapkan larutan tween 10% sebanyak 500 µl dan dilarutkan ke dalam 500 ml
aquades untuk mencuci tabung sample. Masing-masing sampel dimasukkan ke dalam
gelas erlenmeyer dan dilarutkan dengan larutan metanol 70%, lalu dikocok dan
didiamkan sampai mengendap. Setelah itu disaring dengan menggunakan kertas
saring whatman. Setelah sample disaring, sample dianalisa secara ELISA.
Penghitungan Jumlah Hemoglobin
Langkah yang dilakukan yaitu Reagen Drabkins dipipet dengan tepat
sebanyak 5 ml dan dimasukkan ke dalam tabung reaksi 1 dan 2. Kemudian, ke dalam
tabung ke 2 ditambahkan 0,02 ml darah. Pipet dibilas agar tidak ada darah yang
tertinggal dengan cara mengisap dan meniupkan cairan yang ada dalam tabung reaksi
ke 2. Lalu larutan dicampurkan dengan baik dan dibiarkan paling sedikit 10 menit
pada suhu kamar agar terbentuk sianmethemoglobin dengan baik. Terakhir dilakukan
HASIL DAN PEMBAHASAN
Pembuatan Ransum
Rancangan awal yang diinginkan pada penelitian ini yaitu perlakuan level
aflatoksin sampai dengan 300 ppb dan jumlah metionin yang kurang, cukup dan
berlebih di dalam ransum unggas baik periode starter maupun finisher. Namun jika dilihat hasil analisis ransum yang telah dibuat (Tabel 7 dan 8), ternyata tidak sesuai
dengan rancangan. Level metionin ransum pada kedua periode rata-rata hampir sama
pada semua perlakuan. Hal ini bisa disebabkan karena kurangnya kehati-hatian
ketika mencampur pakan, adanya DL-metionin yang terbawa angin, tumpah maupun
tertinggal di mesin. Sedangkan level aflatoksin pakan yaitu pada periode starter berkisar antara 19,24-34,50 ppb dan pada finisher antara 62,35-78,50 ppb. Masing-masing perlakuan memiliki level aflatoksin faktual yang berbeda-beda dan acak jika
dibandingkan dengan rancangan awal. Hal ini dikarenakan beberapa penyebab, salah
satunya yaitu kemungkinan adanya penurunan karena pengaruh pengolahan. Level
aflatoksin yang didapat susah untuk mencapai level yang diinginkan jika
menggunakan metode kontaminasi kapang ke dalam jagung.
Ternyata untuk menumbuhkan kapang dan menghasilkan level aflatoksin
yang tinggi tidak mudah karena kapang membutuhkan kondisi lingkungan tertentu
untuk pertumbuhannya. Diener dan Davis (1986) menyebutkan bahwa tidak semua
isolat dan strain A. flavus dan A. parasiticus menghasilkan aflatoksin ketika berada di lapangan atau di laboratorium. Sebagai contoh yaitu hasil cemaran aflatoksin B1
yang ditemukan di Lampung paling tinggi yaitu 32,2 ppb dan di Jawa Timur sebesar
134,2 ppb (Bahri et al., 2005). Selain itu, kapang membutuhkan suhu, kelembaban dan oksigen yang cukup untuk pertumbuhannya. Walaupun setiap hari jagung yang
diinokulasi kapang diberikan udara namun pada penelitian ini kecukupan oksigen
sulit untuk didapat karena jagung yang dikontaminasi tersebut ditutup dengan plastik
untuk meminimalisir terkontaminasi oleh bahan atau mikroorganisme lain juga agar
spora kapang tidak bebas berterbangan. Penelitian lain mengenai aflatoksin pada
umumnya menggunakan aflatoksin murni agar levelnya dalam pakan lebih tinggi dan
dapat diatur namun pada penelitian ini aflatoksin murni tidak dapat digunakan karena
harganya sangat mahal. Ransum yang seharusnya memiliki level aflatoksin minimal
telah terkontaminasi. Hal tersebut bisa terjadi selama pembuatan ransum dan
penyimpanan karena diletakkan di tempat yang sama.
Profil Darah
Darah adalah jaringan khusus yang berperan dalam sirkulasi (Dellman dan
Brown, 1992). Fungsi utama darah yaitu mempertahankan homeostasis tubuh. Perlakuan penambahan DL-metionin ke dalam pakan yang mengandung aflatoksin
akan dilihat pengaruhnya terhadap profil darah broiler. Sampel darah yang diambil
adalah pada periode starter dan finisher. Pengamatan profil darah meliputi eritrosit, hemoglobin, hematokrit, leukosit dan diferensiasi leukosit.
Hemoglobin
Penambahan DL-metionin ke dalam pakan yang mengandung aflatoksin
diharapkan dapat bekerja mendetoksifikasi aflatoksin dalam tubuh ternak. Nilai
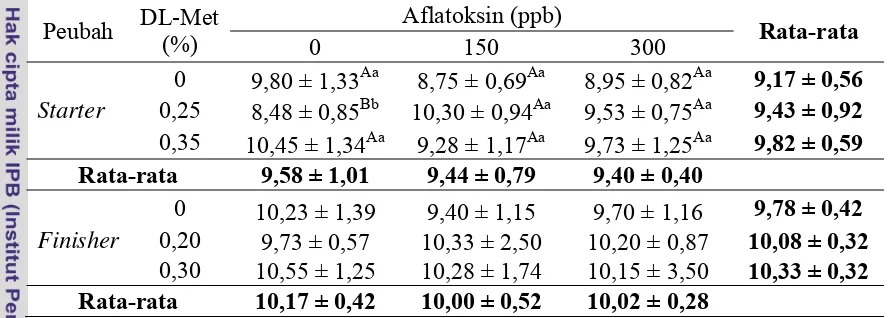
hemoglobin broiler periode starter dan finisher yang telah mendapat pakan perlakuan dapat dilihat pada Tabel 9. Jumlah hemoglobin yang normal menurut
Mangkoewidjojo dan Smith (1988) adalah 7,3-10,9 g/100 ml sedangkan menurut
Swenson (1984) berkisar antara 6,5-9,0 g/100 ml.
Tabel 9. Nilai Hemoglobin (g %) Broiler Periode Starter dan Finisher yang
Nilai hemoglobin dalam penelitian ini masih berada di dalam kisaran normal
meskipun dalam nilai yang minimum. Level aflatoksin berada di bawah batas aman
menurut SNI yaitu sebesar 50 ppb (starter) dan 60 ppb (finisher). Hasil penelitian
menunjukkan bahwa tidak terlihat adanya interaksi antara level aflatoksin dan
penambahan DL-metionin dalam pakan. Perlakuan tidak memberikan pengaruh yang
Nilai hemoglobin yang tidak berbeda ini berarti bahwa penambahan DL-metionin
maupun aflatoksin tidak mengganggu nilai hemoglobin. Hal ini terjadi karena level
aflatoksin yang memang masih dalam batas aman, sejalan dengan Leeson et al. (1995), yaitu penurunan hemoglobin baru terjadi pada level aflatoksin sebesar 1,25
ppm. Korelasi (R2) antara jumlah hemoglobin dengan eritrosit menunjukkan nilai
yang kecil yaitu 35,44% pada periode starter dan 15,49% pada periode finisher. Hal ini menunjukkan bahwa nilai eritrosit ayam pada penelitian ini hanya sedikit
dipengaruhi oleh jumlah hemoglobinnya.
Hematokrit
Nilai hematokrit yaitu persentase eritrosit (berdasarkan volume) terhadap
total darah. Persentase hematokrit pada ayam normal yaitu 24% - 43% dan 30% -
33% (Mangkoewidjojo dan Smith (1988) dan Swenson (1984)). Nilai hematokrit
broiler yang mendapat perlakuan dapat dilihat pada Tabel 10.
Tabel 10. Nilai Hematokrit (%) Broiler Periode Starter dan Finisher yang Mendapat Perlakuan
Pada periode starter nilai hematokrit broiler pada penelitian ini masih berada di dalam kisaran normal, namun pada periode finisher rataan nilai hematokrit sedikit di bawah kisaran normal. Akan tetapi, hasil sidik ragam tidak menunjukkan adanya
pengaruh nyata perlakuan terhadap nilai hematokrit dan tidak terjadi pengaruh
interaksi pada kedua periode tersebut. Hasil penelitian Aravind et al. (2003) menunjukkan penurunan hematokrit terjadi pada level aflatoksin 168 ppb. Korelasi
antara nilai hematokrit dan eritrosit pada periode starter dan finisher adalah sebesar 17,56% dan 54,11%. Hal ini berarti bahwa nilai hematokrit pada kedua periode
Kenaikan jumlah eritrosit akan diikuti dengan kenaikan hematokrit dan
biasanya akan meningkatkan volume darah total (Guyton dan Hall, 1996). Tung et al. (1975) memperkirakan bahwa mekanisme penurunan nilai hematokrit saat terjadi
aflatoksikosis terkait dengan destruksi pada eritrosit. Hasil penelitian ini
menunjukkan tidak ada pengaruh terhadap nilai hematokrit dari level aflatoksin dan
metionin.
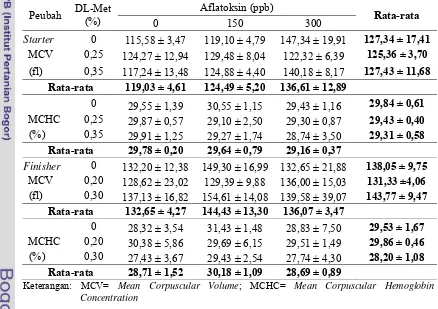
Eritrosit
Hasil sidik ragam menunjukkan terjadinya interaksi antara level metionin dan
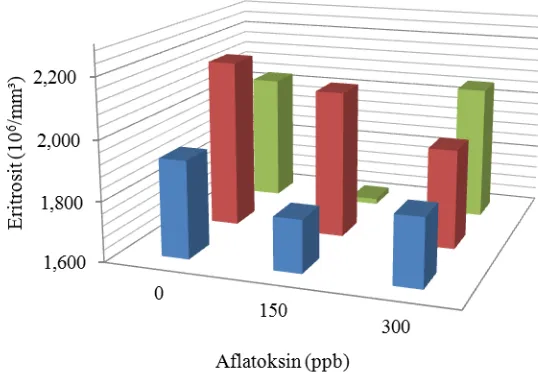
aflatoksin terhadap jumlah eritrosit pada broiler periode starter. Namun nilai eritrosit pada periode finisher tidak menunjukkan terjadinya interaksi. Gambaran nilai eritrosit pada periode starter dan finisher dapat dilihat pada Gambar 6 dan 7.
Gambar 6. Nilai Eritrosit Periode Starter (0-3 minggu)
Gambar 6 menunjukkan bahwa nilai eritrosit broiler yang diberi pakan tanpa
penambahan DL-metionin tidak berbeda dengan yang diberi pakan dengan
penambahan DL-metionin 0,35%. Hal ini menunjukkan bahwa penambahan
metionin yang berlebih tidak mempengaruhi eritrosit selama level aflatoksin berada
dalam batas normal. Namun pada level aflatoksin 300 ppb terjadi penurunan nilai
eritrosit yang signifikan. Penambahan 0,25% DL-metionin menunjukkan penurunan
pada level aflatoksin 150 ppb dan peningkatan eritosit pada level aflatoksin yang
lebih tinggi yaitu 300 ppb. Pada level aflatoksin 300 ppb, penambahan DL-metionin
0,25% signifikan lebih tinggi dari pada tanpa penambahan DL-metionin maupun
penambahan sebesar 0,35% DL-metionin pada pakan.
Kisaran normal eritrosit menurut Mangkoewidjojo dan Smith (1988) adalah
2,0-3,2 x 106/mm3. Guyton dan Hall (1996) menyebutkan bahwa ketinggian dan
kontak tubuh dengan oksigen akan mempengaruhi jumlah pembentukan eritrosit.
Semakin dewasa umur ayam maka eritrosit semakin meningkat. Produksi sel darah
merah diatur oleh salah satu hormon eritropoietin yang dihasilkan ginjal. Selain itu
eritrosit dipengaruhi juga oleh aktivitas, nutrisi, produksi telur, bangsa, panjang hari,
suhu lingkungan dan faktor iklim. Ketebalan dan diameter eritrosit dipengaruhi oleh
status nutrisi dan spesies hewan (Swenson, 1984).
Perlakuan tanpa penambahan metionin dan penambahan 0,35%
DL-metionin pada level aflatoksin 300 ppb periode starter memiliki jumlah eritrosit yang di bawah normal, begitu pula dengan beberapa perlakuan pada periode finisher. Gambar 7 menunjukkan nilai eritrosit pada periode finisher. Tidak ada pengaruh interaksi yang terjadi pada periode finisher dan tidak terjadi perbedaan yang nyata terhadap nilai eritrositnya walaupun terdapat beberapa perlakuan yang nilainya
berada di bawah kisaran normal. Nilai eritrosit yang lebih kecil pada periode finisher ini berbanding dengan rataan bobot ginjal ayam hasil penelitian, dimana terjadi
peningkatan bobot ginjal pada ayam periode finisher. Hal ini dikarenakan level aflatoksin pakan yang memang di atas batas SNI sehingga mengganggu kerja ginjal
Leukosit
Leukosit berperan dalam sistem kekebalan tubuh ternak. Tabel 11
menunjukkan jumlah leukosit yang terdapat dalam darah broiler hasil penelitian pada
periode starter dan finisher.
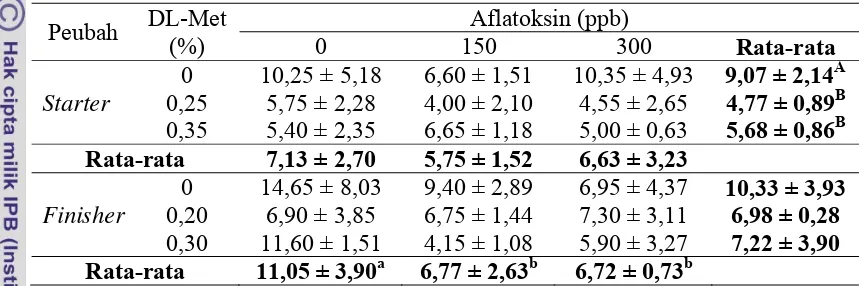
Tabel 11. Nilai Leukosit (103/mm3) Broiler Periode Starter dan Finisher yang Mendapat Perlakuan
Keterangan: Superskrip yang berbeda pada kolom yang sama menunjukkan perbedaan sangat nyata (P<0.01). Superskrip yang berbeda pada baris yang sama menunjukkan perbedaan nyata (P<0.05). huruf kapital menunjukkan perbedaan pada faktor A dan huruf kecil menunjukkan perbedaan pada faktor B.
Pada periode starter, penambahan DL-metionin 0,25% dan 0,35% nyata menurunkan nilai leukosit. Namun kandungan aflatoksin tidak berpengaruh terhadap
nilai leukosit. Pada periode finisher, level aflatoksin dalam ransum menurunkan leukosit darah. Pakan yang terkontaminasi aflatoksin menunjukkan penurunan yang
nyata terhadap jumlah leukosit pada darah broiler. Hal ini disebabkan karena level
aflatoksin dalam pakan periode finisher yang melebihi batas aman menurut SNI. Pengaruh penambahan DL-metionin dan interaksi tidak terlihat pada periode ini.
Jumlah leukosit ayam kedua periode pada semua perlakuan rendah. Menurut
Mangkoewidjojo dan Smith (1988) dan Swenson (1984) jumlah leukosit normal
yaitu antara 16,00-40,00 ribu/mm3 dan 20,00-30,00 ribu/mm3. Hal ini terjadi diduga
karena beberapa faktor seperti strain ayam yang dipakai, kondisi ayam yang tidak
baik atau karena faktor luar seperti lingkungan. Namun, jika dibandingkan antara
ayam yang mendapat perlakuan dengan ayam yang diberi ransum komersil dan
dipelihara pada saat bersamaan, ternyata ayam yang diberikan ransum komersil juga
memiliki jumlah leukosit yang berada di bawah kisaran pada literatur yaitu sebesar
ayam broiler yang diberikan ransum komersil dan dipelihara pada tempat dan waktu
yang sama dengan ayam perlakuan dapat dilihat pada Lampiran.
Diferensiasi Leukosit
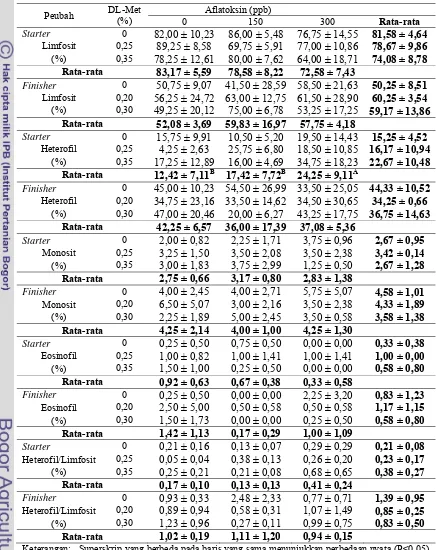
Data nilai diferensiasi leukosit periode starter dan finisher ayam broiler yang mendapat perlakuan dapat dilihat pada Tabel 12. Secara umum dapat dilihat bahwa
nilai limfosit periode starter lebih tinggi daripada finisher dan kebalikannya dapat dilihat bahwa nilai heterofil periode starter lebih kecil daripada finisher. Hal tersebut menyebabkan rata-rata rasio heterofil limfosit pada periode finisher lebih besar.
Heterofil. Heterofil dan makrofag adalah sel yang terutama menyerang dan
menghancurkan bakteri, virus dan bahan-bahan merugikan lain yang menyerbu
masuk ke dalam tubuh (Guyton dan Hall, 1996). Hasil sidik ragam terhadap nilai
heterofil broiler periode starter menunjukkan hasil yang signifikan (P<0,05) pada level aflatoksin yang berbeda sedangkan pada periode finisher tidak berbeda nyata. Level aflatoksin yang lebih tinggi menyebabkan peningkatan heterofil yang
signifikan namun masih berada di dalam kisaran normal. Kisaran normal heterofil
menurut Swenson (1984) yaitu 25% - 30%. Hampir semua nilai heterofil pada
periode starter berada di bawah kisaran normal, berbeda dengan periode finisher yang justru berada di atas normal. Nilai heterofil yang meningkat di atas normal ini
karena level aflatoksin pada periode finisher yang sudah melebihi batas menurut
SNI. Campbell (1995) mengatakan bahwa heterofilia sering dikaitkan dengan
penyakit infeksius yang disebabkan oleh bakteri, fungi (seperti Aspergillus spp.) dan klamidia.
Limfosit. Persentase normal limfosit yaitu 24% - 84% (Mangkoewidjojo dan Smith,
1988). Nilai limfosit hasil penelitian ini sebagian besar masih berada di dalam
kisaran normal. Hasil sidik ragam tidak menunjukkan adanya pengaruh penambahan
DL-metionin dan level aflatoksin serta interaksi keduanya pada kedua periode
perlakuan. Limfosit berperan dalam merespon antigen dan pengembangan imunitas.
Pembentukan limfosit terutama terjadi di berbagai organ limfogen seperti kelenjar
limfe, limpa, timus, tonsil dan berbagai kantong jaringan limfoid di tubuh (Guyton
perlu meningkatkan sel-sel ini sehingga jumlahnya dalam darah masih berada dalam
batas normal.
Tabel 12. Nilai Diferensiasi Leukosit Broiler Periode Starter dan Finisher yang Mendapat Perlakuan
Rasio heterofil limfosit. Rasio ini berguna dalam menunjukkan tingkat stres yang
terjadi pada broiler. Rasio ini pada periode starter masih berada pada angka normal sedangkan pada periode finisher hampir semua berada di atas normal, yang berarti bahwa terjadi tingkat stres yang tinggi pada ayam. Stres pada ayam ini dapat
disebabkan karena kebutuhan nutrien yang tidak tercukupi dan juga karena berbagai
faktor lingkungan.
Eosinofil. Persentase eosinofil normal menurut Swenson (1984) yaitu 3% - 8%.
Eosinofil merupakan sel fagosit lemah dan masih diragukan fungsinya dalam
pertahanan tubuh terhadap infeksi umum jika dibandingkan dengan heterofil.
Namun, eosinofil akan banyak diproduksi pada penderita infeksi parasit (Guyton dan
Hall, 1996). Nilai eosinofil ayam pada kedua periode tidak menunjukkan perbedaan
yang nyata yang menandakan tidak terjadinya infeksi parasit pada ayam perlakuan.
Penambahan aflatoksin maupun metionin tidak menimbulkan pengaruh terhadap
nilai sel darah ini.
Monosit. Monosit adalah sel imatur dengan sedikit kemampuan untuk melawan
bahan-bahan infeksius. Namun, saat masuk ke jaringan kadang diameternya akan
membesar menjadi makrofag, yang mempunyai kemampuan hebat dalam memberantas agen penyakit. Kisaran normal monosit yaitu 0% - 30%
(Mangkoewidjojo dan Smith, 1988). Hasil penelitian ini menunjukkan bahwa pada
persentase monosit tidak ada perbedaan yang signifikan dan masih berada di dalam
kisaran normal.
Basofil. Basofil dan sel mast sangat berperan pada beberapa tipe reaksi alergi.
Basofil tidak terdapat pada darah broiler yang telah mendapat perlakuan baik pada
periode starter maupun finisher. Hal ini menunjukkan bahwa level aflatoksin dan penambahan DL-metionin tidak memicu pembentukan sel darah ini. Aflatoksin
dalam pakan tidak menyebabkan reaksi alergi pada ayam.
IgY
Nilai imunoglobulin Y (IgY) pada broiler periode starter dan finisher berdasarkan hasil penelitian dipaparkan pada Tabel 13. Pengaruh level aflatoksin dan