HASIL HIDROLISIS BROMELIN DAN
PROTEASE Bacillus thuringiensis
ENI KUSUMANINGTYAS
F261110121
Oleh
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
CIPTA
Dengan ini saya menyatakan bahwa disertasi berjudul peptida bioaktif susu kambing dan susu kuda hasil hidrolisis bromelin dan protease Bacillus thuringiensis
adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan atau tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2016
THENAWIDJAJA SUHARTONO, RAPHAELLA WIDIASTUTI dan HARSI DEWANTARI KUSUMANINGRUM.
Selain merupakan sumber nutrisi, susu merupakan sumber senyawa bioaktif dalam bentuk protein alamiahnya maupun peptida yang dapat berfungsi sebagai antihipertensi, antimikroba, antioksidan, antitrombotik dan imunomodulator. Berbagai protein susu dapat menjadi peptida bioaktif setelah melalui hidrolisis oleh enzim-enzim protease yang dapat diperoleh dari pencernaan hewan, tanaman maupun mikroorganisme.
Berbeda dengan susu sapi, potensi susu kambing dan susu kuda sebagai sumber peptida bioaktif belum banyak diketahui. Beberapa penelitian yang pernah dilakukan sebelumnya adalah hidrolisis susu kambing menggunakan enzim gastrointestinal manusia yang menghasilkan peptida antibakteri untuk menghambat pertumbuhan bakteri Eschericia coli, Bacillus cereus, Staphylococcus aureus dan
Listeria monocytogenes, sedangkan kombinasi protease netral dan alkali menghasilkan peptida antioksidan. Penelitian peptida bioaktif susu kuda belum pernah dilaporkan. Tujuan dari penelitian ini adalah: (1) mendapatkan fraksi peptida antibakteri dan antioksidan dari susu kambing dan susu kuda (2) mendapatkan informasi sekuen asam amino peptida bioaktif terpilih melalui analisis dan studi bioinformatik. Pada penelitian ini enzim bromelin dan protease
Bacillus thuringiensis digunakan untuk menghidrolisis protein susu kambing dan susu kuda Sumbawa. Hidrolisat difraksinasi menggunakan membran molecular weight cut off 30, 10 dan 3 kDa. Pengujian antibakteri fraksi peptida dilakukan menggunakan bakteri Escherichia coli, Salmonella Typhimurium, Staphylococcus aureus dan Listeria monocytogenes. Pengujian antioksidan dilakukan menggunakan [2, 2’-azino-bis (3-ethylbenzthiazoline-6-sulphonic acid)] (ABTS) dan 2,2-diphenyl-1-picrylhydrazyl (DPPH). Prediksi sifat fisikokimia dan struktur peptida dianalisis menggunakan PepDraw serta kombinasi PEP-FOLD dan RasWin. Penghitungan indeks terapi, kecenderungan profil dan optimasi sekuen peptida antimikroba dianalisis menggunakan SPLIT.
Hasil penelitian ini menunjukkan bahwa hidrolisat susu kambing dan susu kuda Sumbawa dan hasil fraksinasinya mampu menghambat semua bakteri uji dan dapat menetralisasi radikal ABTS dan DPPH. Hidrolisis susu dengan bromelin menghasilkan fraksi peptida yang bersifat bakteriostatik dan paling aktif terhadap
L. monocytogenes. Hasil perlakuan dengan protease B. thuringiensis cenderung bersifat bakterisidal dan lebih aktif terhadap bakteri Gram negatif. Fraksi <3 kDa hasil hidrolisis susu kuda Sumbawa dengan protease Bacillus thuringiensis selama 30 menit mempunyai aktivitas antioksidan tinggi sekaligus antibakteri tertinggi dengan minimum bactericidal concentration (MBC) terhadap Escherichia coli dan
Salmonella Typhimurium 0.035 µg protein/mL. Aktivitas antioksidan 1 µg protein/mL fraksi <3 kDa terhadap radikal ABTS adalah 82%, hampir setara dengan 12.5 µg/mL vitamin C (85%) dan terhadap radikal DPPH adalah 22%, lebih tinggi daripada 4 µg/mL vitamin C (20%).
antibakteri yang pernah dilaporkan sebelumnya yang aktif terhadap bakteri Gram positif. Peptida LVNELTEFAK dan HPYFYAPELLYYANK dari fraksi <3 kDa hasil hidrolisis susu kuda Sumbawa dengan protease Bacillus thuringiensis selama 30 menit mempunyai indeks terapi prediksi (IT) tinggi yaitu 28.69 dan 64.75, mengindikasikan efektivitas dan spesifitasnya sebagai peptida antibakteri. Kedua peptida tersebut juga diprediksi dapat membentuk heliks yang penting untuk interaksi dengan membran sel bakteri. Kecenderungan profil peptida tersebut lebih mirip peptida antimikroba dibandingkan dengan peptida toksin yang menguatkan bahwa kedua peptida dapat berfungsi sebagai peptida antibakteri. Berdasarkan hasil tersebut maka fraksi <3 kDa hasil hidrolisis susu kuda Sumbawa dengan protease
Bacillus thuringiensis paling berpotensi sebagai antibakteri dan antioksidan dan HPYFYAPELLYYANK adalah peptida yang paling berpotensi sebagai peptida antimikroba.
hydrolyzed by bromelain and protease Bacillus thuringiensis. Supervised by MAGGY THENAWIDJAJA SUHARTONO, RAPHAELLA WIDIASTUTI dan HARSI DEWANTARI KUSUMANINGRUM.
Beside its function as source of nutrition, milk is also a source of bioactive compounds both native protein or peptide, which able act as antihypertension, antimicrobial, antioxidant, antithrombotic and immunomodulator. Some milk proteins are able to be bioactive peptides through hydrolysis by protease enzymes from animal gastrointestinal, plant or microorganisms.
Different with cow milk, potency of goat and horse milk as source of bioactive peptides have not been widely explored. Some research which had been conducted were hydrolysis of goat milk using human gastrointestinal enzymes producing antibacterial peptide to inhibit bacteria Eschericia coli, Bacillus cereus Staphylococcus aureus and Listeria monocytogenes, while combination of neutral and alkali proteases produced antioxidant peptide. Research about bioactive peptide from horse milk has not been reported. The aims of this study were (1) to obtain antibacterial and antioxidant peptide fraction from goat and horse milk and (2) to obtain information about amino acid sequent from selected bioactive peptide through analysis and bioinformatics study.
In this research bromelain and protease of Bacillus thuringiensis enzymes were applied to hydrolyse goat and Sumbawa horse milk. Hydrolysates were fractionated using molecular weight cut off membrane 30, 10 and 3 kDa. Antibacterial assay of peptide fractions were conducted using bacteria Escherichia coli, Salmonella Typhimurium, Staphylococcus aureus dan Listeria monocytogenes. Antioxidant assays were done using [2, 2’-azino-bis
(3-ethylbenzthiazoline-6-sulphonic acid)] (ABTS) dan 2,2-diphenyl-1-picrylhydrazyl (DPPH). Prediction of physicochemical and peptide structure were analysed using PepDraw and combination of PEP-FOLD and RasWin. Calculation of therapeutic index, preference profiles and optimization of antimicrobial peptide sequences were analysed using SPLIT.
Result of this study showed that goat and Sumbawa horse milk hydrolysates and their fractions were able to be inhibit all bacteria assayed and to neutralize ABTS and DPPH radicals. Hydrolysis milk by bromelain produced bacteriostatic peptide fractions and most active to L. monocytogenes. Milk treatment by Bacillus thuringiensis protease tend to produce bactericidal peptide fractions and more active to Gram negative bacteria. Fraction <3 kDa from Sumbawa horse milk hydrolyzed by Bacillus thuringiensis protease for 30 minutes has both high antioxidant activity and the highest antibacterial activity with minimum bactericidal concentration (MBC) to Escherichia coli dan Salmonella Typhimurium 0.035 µg protein/mL. Antioksidant activity of 1 µg protein/mL fraction <3 kDa to ABTS radical was 82% almost similar with 12.5 µg/mL vitamin C (85%) and to DPPH radical was 22%, higher than 4 µg/mL vitamin C (20%).
of Sumbawa horse milk hydrolyzed by Bacillus thuringiensis protease for 30 minutes had high therapeutic index prediction (TIpred) 28.69 and 64.75, indicated their effectivity and specificity as antibacterial peptides. Both peptide were also predicted to be able to form helix which important for interaction with bacterial membrane. Preference profile of the peptides more similar to antimicrobial peptide compare to toxin peptide, suggested that both peptides are able to be antibacterial peptide. Based on the results, fraction <3 kDa from Sumbawa horse milk hydrolyzed by Bacillus thuringiensis protease is the most potent as antibacterial and antioxidant, and peptide HPYFYAPELLYYANK is the most potent as antimicrobial peptide.
©Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah dan pengutipan tersebut tidak merugikan kepentingan IPB
ENI KUSUMANINGTYAS
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor
Pada Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji Luar Komisi Ujian tertutup
1. Prof. Dr. Drh. Dondin Sajuthi, MST, PhD
2. Raymond R. Tjandrawinata, MS, MBA, 3-PhD
Penguji Luar Komisi Ujian terbuka
1. Prof. Dr. Drh. Dondin Sajuthi, MST, PhD
NIM : F261110121
Disetujui oleh Komisi Pembimbing,
Prof. Dr. Ir. Maggy Thenawidjaja Suhartono Ketua
Dr. Raphaella Widiastuti, BSc Dr. Ir. Harsi Dewantari Kusumaningrum
Anggota Anggota
Diketahui oleh
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Pangan,
Dr. Ir. Harsi Dewantari Kusumaningrum Dr. Ir. Dahrul Syah, M.Sc. Agr
Puji syukur penulis panjatkan kehadirat Allah SWT yang telah memberikan hidayah dan karunianya sehingga disertasi ini dapat diselesaikan. Disertasi ini berjudul “Peptida bioaktif susu kambing dan susu kuda hasil hidrolisis bromelin dan protease Bacillus thuringiensis”, sebagai salah satu syarat untuk mencapai gelar Doktor pada Program Studi Ilmu Pangan, Sekolah Pasca Sarjana Institut Pertanian Bogor.
Disertasi ini dapat diselesaikan dengan bantuan berbagai pihak, oleh karena itu penulis menyampaikan terimakasih yang sebesar-besarnya kepada: Komisi pembimbing Prof. Dr. Ir Maggy Thenawidjaja Suhartono, Dr Raphaella Widiastuti, BSc dan Dr. Ir. Harsi Dewantari Kusumaningrum yang telah memberikan bimbingan, waktu, tenaga, dukungan selama penelitian maupun penyelesaian disertasi ini. Penulis juga mengucapkan terimakasih kepada Penguji Luar Komisi Ujian Tertutup dan Terbuka Prof. Dr. Drh Dondin Sajuthi, MST.PhD dan Raymond R Tjandrawinata, MS.MBA,PhD atas saran dan masukannya sehingga memperdalam kajian disertasi ini
Terimakasih penulis sampaikan kepada Rektor IPB, Dekan Pascasarjana IPB, Dekan Fakultas Teknologi Pertanian, Ketua Program Studi dan staf pengajar Ilmu Pangan yang telah mengizinkan penulis untuk melakukan studi S3.
Ucapan terimakasih juga penulis sampaikan kepada Kepala Balai Besar Penelitian Veteriner dan Badan Litbang Pertanian yang telah memberikan izin dan dukungan baik materi dan non materi kepada penulis untuk melanjutkan studi S3. Rekan-rekan dari Balai Besar Penelitian Veteriner atas bantuan dan dukungannya selama penelitian berlangsung, kepada teman-teman seperjuangan dari S2 dan S3 Ilmu Pangan terutama angkatan 2011 dan 2012 atas motivasi dan dukungannya. Ungkapan terimakasih juga penulis sampaikan kepada segenap keluarga tercinta E Wahyuwidodo, Naila A Widodo dan seluruh keluarga besar Bpk Hadisiwanto dan Harijuwono Utomo atas do’a, segala dukungan dan motivasinya. Akhirnya karya ini saya persembahkan untuk Ibunda dan Ayahanda (Alm) yang telah membimbing dan mendidik dengan segenap kasih sayangnya hingga penulis bisa sampai tahap ini.
Akhir kata, penulis menyadari disertasi ini masih jauh dari sempurna, semua saran dan kritik akan diterima dengan tangan terbuka. Semoga disertasi ini bermanfaat untuk pengembangan ilmu dan pengetahuan.
PENDAHULUAN
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Tujuan Umum 3
Tujuan Khusus 3
Manfaat Hasil Penelitian 3
Ruang Lingkup Penelitian 3
Kebaruan (Novelty) 4
TINJAUAN PUSTAKA
Susu Kambing dan Susu Kuda 4
Protein dan Peptida Bioaktif Susu 5
Hidrolisis Protein 8
Bromelin 9
Protease Bacillus sp 10
Karakteristik Peptida Antibakteri dan Antioksidan 10
Analisis Bioinformatik dan Pemodelan 12
METODE PENELITIAN
Waktu dan Tempat Penelitian 13
Bahan dan Alat 13
Tahapan Penelitian 13
Persiapan susu, enzim dan skrining hidrolisat 14
Persiapan susu 14
Penentuan kadar protein 14
Ekstraksi dan penentuan aktivitas enzim 14 Hidrolisis susu kambing dan susu kuda Sumbawa 15
Skrining peptida antibakteri 15
Pengujian aktivitas antibakteri 15
Pengujian aktivitas antioksidan 16
Fraksinasi dan Uji Bioaktivitas Fraksi Peptida 16 Fraksinasi peptida menggunakan membran molecular weight cut off dan uji bioaktivitas fraksi 17 Uji hemolisis hidrolisat dan fraksi peptida 17 Karakterisasi Fraksi Peptida Terpilih 18
Analisis peptida dengan sodium dodecyl sulphate
polyacrilamide gel electrophoresis (SDS-PAGE) 18 Karakterisasi peptida dengan high
performance liquid chromatography (HPLC) 18 Analisis Bioinformatik Peptida Terpilih 18
Sekuensing dan identifikasi peptida dengan
liquid chromatography mass spectrometry-mass
spectrometry (LCMS-MS) 19
Bioaktivitas Peptida Hasil Fraksinasi 21 Aktivitas antibakteri fraksi peptida hasil hidrolisis susu
kambing dan susu kuda Sumbawa dengan enzim bromelin 21 Aktivitas antibakteri fraksi peptida hasil hidrolisis susu
kambing dan susu kuda Sumbawa dengan protease
B. thuringiensis 24
Hasil uji antioksidan fraksi peptida hasil hidrolisis
Susu kambing dan susu kuda Sumbawa dengan bromelin 27 Hasil uji antioksidan fraksi peptida hasil hidrolisis
Susu kambing dan susu kuda Sumbawa dengan protease
B. thuringiensis 28
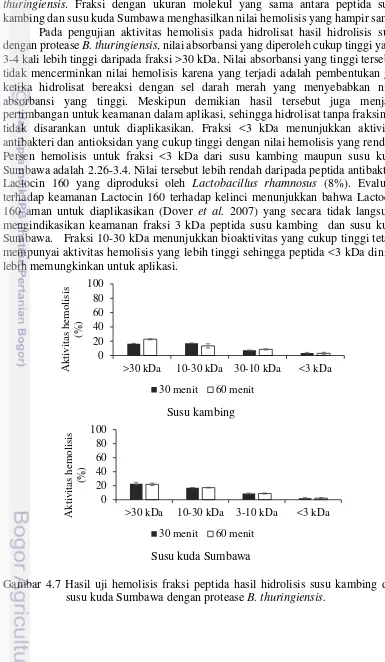
Hasil uji hemolisis fraksi peptida hasil hidrolisis
susu kambing dan susu kuda Sumbawa dengan bromelin 32 Hasil uji hemolisis fraksi peptida hasil hidrolisis susu kambing dan susu kuda Sumbawa dengan protease B. thuringiensis 33
Hasil Analisis dan Karakterisasi Peptida Terpilih dengan SDS-PAGE
dan HPLC 34
Fraksi peptida hasil hidrolisis susu kambing
dengan bromelin 34
Fraksi peptida hasil hidrolisis susu kuda Sumbawa dengan
Protease B. thuringiensis 36
Hasil Analisis Sekuen Peptida Terpilih dan Pemodelan 37 Hasil analisis sekuen peptida hasil hidrolisis susu kambing
dengan bromelin 37
Hasil analisis sekuen peptida hasil hidrolisis susu
kuda Sumbawa dengan protease B. thuringiensis 39 Hasil pemodelan peptida terpilih dan hubungannya dengan
aktivitas antibakteri 42
SIMPULAN DAN SARAN
Simpulan 46
Saran 46
DAFTAR PUSTAKA 47
DAFTAR TABEL
2.1 Komposisi susu beberapa mamalia 4
2.2 Peptida antibakteri dari hasil hidrolisis enzimatik susu sapi 7 2.3 Peptida hasil hidrolisis enzimatik protein susu sebagai antioksidan 7 2.4 Enzim proteolitik untuk hidrolisis protein susu 8 4.1 Hasil skrining aktivitas antibakteri dari hidrolisis susu kambing
Hidrolisis susu kambing dengan protease B. thuringiensis 25 4.4 Minimum bactericidal concentration (MBC) fraksi peptida hasil
hidrolisis susu kuda Sumbawa dengan protease B. thuringiensis 25 4.5 Prediksi sifat fisikokimia peptida hasil sekuensing fraksi <10 kDa
susu kambing yang dihidrolisis dengan bromelin selama 60 menit 39 4.6 Prediksi sifat fisikokimia paptida hasil sekuensing fraksi <3 kDa susu kuda Sumbawa yang dihidrolisis dengan protease B. thuringiensis
selama 30 menit 40
4.7 Perbandingan sifat fisiko kimia peptida LVNELTEFAK
Sebelum dan sesudah modifikasi 45
4.8 Perbandingan sifat fisiko kimia peptida HPYFYAPELLYYANK
sebelum dan sesudah modifikasi 45
DAFTAR GAMBAR
3.1 Tahapan penelitian 13
3.2 Persiapan susu, enzim dan skrining hidrolisat 14 3.3 Fraksinasi dan uji bioaktivitas fraksi peptida 17 3.4 Analisis dan karakterisasi peptida dengan SDS-PAGE
dan HPLC 18
3.5 Analisis bioinformatik peptida terpilih 19 4.1 Hasil uji antibakteri fraksi peptida hasil hidrolisis susu
kambing dengan enzim bromelin 22
4.2 Hasil uji antibakteri fraksi peptida hasil hidrolisis susu
Kuda Sumbawa dengan enzim bromelin 23
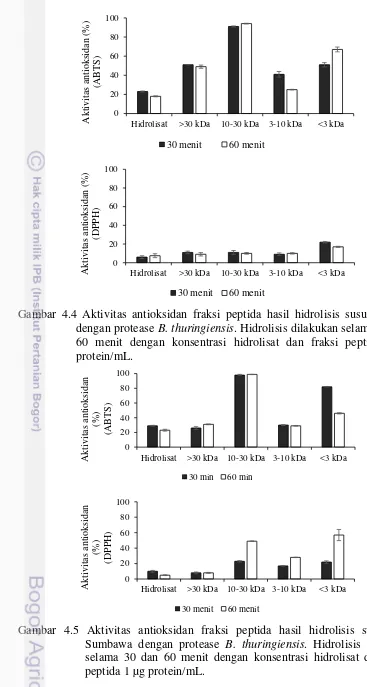
4.3 Aktivitas antioksidan fraksi peptida hasil hidrolisis susu
kambing dan susu kuda Sumbawa dengan bromelin 27 4.4 Aktivitas antioksidan fraksi peptida hasil hidrolisis
susu kambing dengan protease B. thuringiensis 29 4.5 Aktivitas antioksidan fraksi peptida hasil hidrolisis susu
kuda Sumbawa dengan protease B. thuringiensis 29 4.6 Hasil uji hemolisis fraksi peptida susu kambing dan
susu kuda Sumbawa yang dihidrolisis dengan bromelin 32 4.7 Hasil uji hemolisis fraksi peptida susu kambing dan
susu kuda Sumbawa yang dihidrolisis dengan protease
B. thuringiensis 33
4.8 SDS-PAGE susu kambing 34
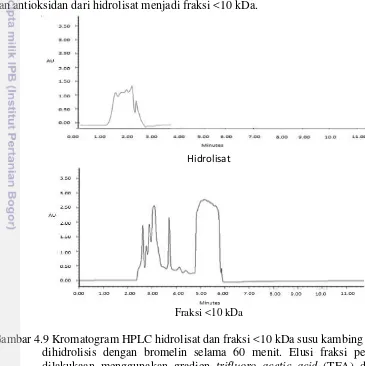
4.9 Kromatogram HPLC hidrolisat dan fraksi <10 kDa susu kambing yang dihidrolisis dengan bromelin
selama 60 menit 35
4.10 Kromatogram HPLC hidrolisat dan fraksi <3 kDa susu kuda Sumbawa yang dihidrolisis dengan
4.13 Prediksi struktur peptida VLVLDTDYK susu kambing 42
4.14 Prediksi struktur peptida LVNELTEFAK 43
4.15 Prediksi struktur peptida HPYFYAPELLYYANK 43 4.16 Kecenderungan profilpeptida LVNELTEFAK
1 PENDAHULUAN
Latar Belakang
Selain merupakan sumber nutrisi yang penting bagi anak mamalia, susu dapat digunakan untuk meningkatkan kesehatan. Selain susu sapi, susu kambing dan susu kuda sudah biasa dikonsumsi masyarakat Indonesia. Populasi kambing di Indonesia cukup besar bahkan masuk dalam 10 besar populasi kambing dunia (Azis 2010) yang juga menandakan potensinya sebagai penghasil susu. Kambing perah yang biasa dipelihara dan cukup adaptif dengan lingkungan Indonesia adalah kambing Peranakan Etawa (PE), Saanen dan persilangan antara PE dan Saanen (PESA) atau ada yang menyebut dengan Sapera. Kualitas susu kambing PE berdasarkan kadar protein dan berat jenis lebih baik daripada susu kambing Saanen maupun PESA meskipun produksi susu kambing PE lebih rendah daripada produksi susu kambing Saanen dan PESA (Zuriyati et al. 2011). Untuk susu kuda Sumbawa, meskipun produksinya masih sedikit tetapi telah digunakan untuk terapi berbagai penyakit gangguan pencernaan, asma dan hipertensi. Berdasarkan studi pendahuluan yang telah dilakukan, aktivitas antibakteri susu kuda Sumbawa lebih tinggi daripada susu kuda yang berasal dari kota lain di Indonesia.Aktivitas tersebut diduga berhubungan dengan jenis makanan susu kuda Sumbawa yang berasal dari alam liar hutan Sumbawa. Meskipun susu kambing dan susu kuda sudah dikenal di Indonesia, tetapi pemanfaatannya sebagai sumber peptida bioaktif belum diteliti secara mendalam.
Peptida bioaktif yang terkandung dalam susu dapat berfungsi sebagai antihipertensi, antibakteri, antitrombotik, opioid, antioksidan dan imunomodulator. Salah satu kelebihan peptida bioaktif adalah satu peptida dapat berfungsi ganda sebagai contoh, peptida dari kasein susu sapi dapat berfungsi sebagai antimikroba sekaligus sebagai penghambat angiotensin-converting enzyme (ACE) dan sebagai antioksidan (Lopez-Exposito et al. 2007).
Komponen bioaktif protein susu tidak selalu ada dalam keadaan alamiahnya. Beberapa diantaranya dapat berupa prekursor atau peptida yang hanya akan aktif apabila telah dihidrolisis dari protein alamiahnya. Hidrolisis terhadap protein susu dapat dilakukan menggunakan enzim-enzim proteolitik dari berbagai sumber, diantaranya adalah enzim pencernaan hewan seperti tripsin, kimotripsin dan pepsin, protease dari tanaman seperti bromelin dan papain atau oleh enzim bakteri atau jamur misalnya alkalase dari Bacillus licheniformis.
Penelitian terhadap peptida bioaktif susu kambing dan susu kuda yang pernah dilaporkan adalah aktivitasnya sebagai antibakteri dan antioksidan. Peptida dari protein whey susu kambing hasil hidrolisis dengan enzim gastrointestinal manusia diketahui mampu menghambat pertumbuhan bakteri Escherichia coli K12,
Bacillus cereus RT INF01, Listeria monocytogenes dan Staphylococcus aureus
mempunyai aktivitas antibakteri terhadap Bacillus cereus, Staphylococcus aureus,
Enterococcus faecalis, dan Escherichia coli (Nazzaro et al. 2010).
Mengingat masing-masing enzim mempunyai spesifitas yang berbeda-beda maka hidrolisis protein susu menggunakan enzim yang berbeda akan menghasilkan potongan peptida dengan bioaktivitas yang berbeda pula. Penggunaan enzim bromelin dan protease Bacillus thuringiensis pada penelitian ini akan membuka peluang untuk memperoleh peptida dengan aktivitas yang berbeda dari yang diperoleh pada penelitian sebelumnya. Protease yang akan digunakan pada penelitian ini adalah bromelin yang merupakan protease dari tanaman dan protease dari Bacillus thuringiensis yang diisolasi dari susu kuda. Bromelin dapat diisolasi dari berbagai varietas buah nanas dan aktif baik dalam kondisi murni maupun masih dalam bentuk jus buah. Bromelin aktif pada suhu 37-60 oC dengan kisaran pH
4-9.8. Karakteristik tersebut memungkinkan penggunaan ekstrak kasar enzim bromelin untuk menghidrolisis protein susu pada berbagai kondisi lingkungan.
Hidrolisis enzimatik terhadap protein tidak selalu menghasilkan peptida yang diinginkan secara maksimal, oleh karena itu diperlukan skrining, fraksinasi dan purifikasi. Fraksinasi peptida dalam hidrolisat dapat dilakukan menggunakan membran filtrasi. Metode tersebut mempunyai kelebihan dibandingkan dengan metode lain yaitu memerlukan waktu yang lebih pendek, lebih mudah digunakan untuk skala yang besar dan lebih murah dibandingkan dengan teknik kromatografi (Muro et al. 2013). Ultrafiltrasi menggunakan membran dengan molecular weight cut off (MWCO) dapat memisahkan peptida yang diinginkan berdasarkan berat molekul, menghilangkan garam dan protein yang tidak terhidrolisis (Vandanjon et al. 2007).
Peptida yang telah dipisahkan dengan proses filtrasi dapat dipurifikasi dan disekuensing untuk mengetahui susunan asam aminonya dan dianalisis lebih lanjut. Analisis bioinformatik terhadap sekuen peptida yang diperoleh dapat digunakan untuk membantu memilah peptida yang aktif secara fisiologis, mengembangkan dan memodifikasi peptida yang tersedia untuk kepentingan sintesis sehingga diperoleh peptida dengan aktivitas dan selektifitas yang tinggi (Cantisani et al. 2013). Seleksi terhadap peptida aktif juga dapat lebih murah apabila dilakukan analisis bioinformatik lebih dahulu.
Perumusan Masalah
Bakteri patogen termasuk di dalamnya bakteri yang bertanggungjawab terhadap foodborne disease masih menjadi masalah besar di Asia khususnya Indonesia bahkan di negara maju seperti Amerika karena menimbulkan kerugian ekonomi dengan morbiditas dan mortalitas yang tinggi, lebih dari 55 ribu masuk rumah sakit dengan kurang lebih 1350 kematian setiap tahunnya (Scallan et al., 2011). Selain itu, oksidasi lemak juga masih menjadi masalah besar dalam industri pangan karena terbentuknya off-flavor yang tidak diinginkan dan potensinya untuk menjadi produk yang toksik. Beberapa produk antioksidan sintetik yang biasa digunakan seperti butylated hydroxyanisole (BHA) butylated hydroxytoluene
dituntut adanya penemuan antibakteri dan antioksidan baru khususnya yang bersifat alami termasuk di dalamnya golongan peptida.
Penelitian tentang peptida bioaktif terutama yang dapat berfungsi sebagai antimikroba dan antioksidan yang berasal dari susu sapi sudah banyak dilakukan, namun eksplorasi peptida bioaktif susu dari sumber lain seperti susu kambing dan susu kuda masih sangat kurang. Ketersediaan susu kambing dan susu kuda terutama kuda Sumbawa di Indonesia memberikan peluang pemanfaatannya untuk mendapatkan peptida yang berfungsi sebagai antibakteri dan antioksidan. Kemungkinan bahwa satu peptida mempunyai fungsi ganda menjadikan peptida bioaktif menjadi sesuatu yang sangat potensial untuk dikembangkan dan diaplikasikan. Berdasarkan potensi tersebut hasil penelitian ini diharapkan dapat diperoleh peptida yang dapat berfungsi sebagai antibakteri dan antioksidan dari bahan alami.
Fraksi dari hasil hidrolisis protein dengan bioaktivitas tinggi seringkali mengandung peptida-peptida dengan berbagai tingkat bioaktivitas. Eksperimen laboratorium untuk skrining dan menguji bioktivitas masing-masing peptida akan memerlukan biaya yang mahal dan waktu lama. Analisis dan studi bioinformatik dapat digunakan untuk membantu skrining peptida dengan bioaktivitas tinggi. Pengujian lebih lanjut terhadap bioaktivitas dapat dilakukan hanya pada peptida-peptida yang diprediksi sangat berpotensi sehingga biaya, tenaga dan waktu yang diperlukan menjadi lebih sedikit.
Tujuan Penelitian
Tujuan Umum
Penelitian ini bertujuan untuk mendapatkan peptida antibakteri dan antioksidan dari susu kambing dan susu kuda melalui hidrolisis enzimatik yang teridentifikasi dan terkarakterisasi dengan baik.
Tujuan khusus
(1) mendapatkan fraksi peptida antibakteri dan antioksidan dari susu kambing dan susu kuda
(2) mendapatkan informasi sekuen asam amino peptida bioaktif terpilih melalui analisis dan studi bioinformatik
Manfaat Hasil Penelitian
(1) Hasil penelitian ini dapat digunakan untuk pemanfaatan lebih lanjut susu kambing dan susu kuda
(2) Peptida antibakteri dan antioksidan dari susu kambing dan susu kuda dapat dikembangkan sebagai ingredien dan pangan fungsional berbasis peptida (3) Data sekuen dan struktur peptida dapat digunakan sebagai informasi dasar
untuk pengembangan peptida antibakteri dan antioksidan
Ruang Lingkup Penelitian
thuringiensis, fraksinasi bertingkat menggunakan membran molecular weight cut off (MWCO), uji aktivitas antibakteri dan antioksidan masing-masing hidrolisat dan fraksi peptida, sekuensing terhadap fraksi peptida aktif dan studi bioinformatik terhadap peptida yang diperoleh.
Kebaruan (Novelty)
(1) Bromelin dan protease Bacillus thuringinesis pada penelitian ini merupakan hasil isolasi dari nanas Bogor dan kultur Bacillus thuringiensis hasil isolasi pertama kali dari susu kuda Bogor.
(2) Fraksi peptida dengan aktivitas antibakteri dan antioksidan yang berasal dari susu kambing dan susu kuda yang dihidrolisis dengan enzim bromelin dan protease Bacillus thuringiensis
(3) Temuan sekuen asam amino dan prediksi karakter peptida bioaktif terpilih yang mempunyai aktivitas antibakteri dan antioksidan
2 TINJAUAN PUSTAKA
Susu Kambing dan Susu Kuda
Susu merupakan sumber nutrisi penting yang dicirikan dengan keseimbangan profil asam aminonya. Kandungan protein susu masing-masing spesies berbeda tergantung pada fisiologi dan struktur yang dibutuhkan anak mamalia sehingga masing-masing spesies mempunyai komposisi yang berbeda (Potocnik et al. 2011). Komposisi susu beberapa spesies mamalia seperti terlihat pada Tabel 2.1
Tabel 2.1 Komposisi susu beberapa mamalia Komponen
susu
Rata-rata kandungan komponen dalam susu (g/kg) (min-maks) (g/kg)
2011). Susu kuda Sumbawa yang ada di Indonesia mengandung protein 18-19 g/kg (Yuniati and Sahara 2012), lebih rendah daripada rata-rata protein susu kuda yang dilaporkan oleh Potocnik et al. (2011).
Susu kambing diproduksi secara global kurang lebih 13 % dari total produksi 5 spesies dominan yaitu sapi, kerbau, kambing, domba serta unta dan mayoritas diproduksi oleh India (26,3 %), Bangladesh (14,3 %), Perancis (3,8 %) dan Jerman (3,3 %) (Barlowska et al. 2011). Di Indonesia, populasi kambing mencapai 16,6 juta pada tahun 2010 dan meningkat menjadi 18,5 juta pada tahun 2013 (BPS 2014). Meskipun produksi susu masih didominasi oleh susu sapi, tetapi produksi susu kambing di Indonesia masih bisa ditingkatkan lagi, demikian pula pemanfaatan susu kambing sebagai sumber peptida bioaktif juga masih sangat kurang.
Meskipun produksi dan konsumsi susu kuda di Indonesia maupun secara global masih rendah, tetapi susu kuda sudah lama digunakan untuk terapi berbagai penyakit seperti hipertensi, diabetes, asma, hiperkolesterolemia dan penyakit yang disebabkan gangguan pencernaan. Susu kuda telah dikonsumsi secara rutin oleh kurang lebih 30 juta orang terutama dari Negara Turki, Bashkir, Kazakhs, Kyrygys, Mongols, Yakuts dan Uzbekistan (Potocnik et al. 2011). Rusia dan Mongolia menggunakan minuman fermentasi dari susu kuda yang terkenal yaitu Koumiss sebagai terapi untuk pengobatan penyakit pencernaan dan kardiovaskular (Lozovich 1995; Levy 1998). Di Indonesia, susu kuda Sumbawa dilaporkan mengandung mikroorganisme alamiah seperti Lactobacillus dan Leuconostoc yang dapat menghambat pertumbuhan Escherichia coli, Salmonella Typhimurium, dan
Staphylococcus sureus 29213 (Sujaya et al. 2008). Fraksinasi susu kuda Sumbawa menunjukkan bahwa fraksi protein whey yang larut dalam aseton dapat menghambat pertumbuhan Streptococcus agalactiae dan Steptococcus pyogenes
(Detha et al. 2013).
Protein dan Peptida Bioaktif Susu
Protein susu dibagi dalam dua kategori yaitu protein tidak larut (kelompok kasein) dan protein terlarut ( protein whey). Kelompok kasein terdiri dari beberapa tipe yaitu : αs1-, αs2-, β-, K- and γ- kasein, sementara protein whey terdiri dari beta-laktoglobulin, alfa-laktalbumin, laktoferin, imunoglobulin, serum albumin, glikomakropeptida, enzim dan faktor pertumbuhan (McGregor dan Poppitt 2013).
Kasein merupakan komponen terbesar dalam susu terutama susu sapi yang mengandung kurang lebih 80 % dan 20-45 % pada susu manusia. Kandungan α -kasein susu kambing jauh lebih kecil dibandingkan dengan susu sapi, sebaliknya,
β-kasein menjadi protein mayoritas dan menjadikan susu kambing lebih mudah dicerna dan asam aminonya diserap lebih efisien dibandingkan dengan susu sapi (Jandal 1996).
Susu kuda mempunyai komposisi yang berbeda dengan susu kambing (Mori
et al. 2012). Total protein dan kasein susu kuda juga lebih rendah daripada ruminansia seperti sapi, kambing dan domba tetapi mempunyai kandungan laktosa lebih tinggi (Potocnik et al. 2011). Kandungan protein whey sekitar 40 % jauh lebih tinggi daripada susu ruminansia (≤ 20 %) sehingga dikategorikan sebagai
dan dipengaruhi oleh kondisi fisiologi induk kuda, siklus panas dan kehamilan, selain faktor genetik induk, individu hewan, tahap laktasi, frekuensi laktasi, kesehatan hewan, umur induk dan tipe makanan.
Kasein relatif bersifat hidrofobik yang menyebabkannya menjadi kurang larut dalam air. Misel kasein tergabung dalam interaksi hidrofobik dan bergabung dengan ion kalsium dengan sisi hidrofilik pada permukaan dan dikelilingi oleh К -kasein yang berfungsi menjaga stabilitas misel (Heinrich dan Kulozik 2011).
Kasein terbagi dalam 4 tipe utama yaitu: αs1-, αs2-, β-, and К-kasein. Keempat tipe kasein tersebut terfosforilasi pada residu seril spesifik dan pada К-kasein
terglikosilasi. К-kasein dapat terhidrolisis oleh enzim kimosin antara Phe-105 dan Met-106 menghasilkan dua polipeptida yaitu bagian hidrofobik N-terminal para-К
-kaseinpolipeptida К-kasein (residu 1-105) dan bagian hidrofilik terfosforilasi serta terglikosilasi C-terminal polipeptida К-kasein (residu 106–169) yang dikenal sebagai kaseinomakropeptida (CMP). CMP bersifat heterogen dan mengandung sisi modifikasi postranslasi (glikosilasi dan fosforilasi) dari К-kasein. Tiga varian
genetik CMP pada susu yang berasal dari prekursor К-kasein yang telah
teridentifikasi yaitu К-kasein A, B dan E dan varian A dan B merupakan yang paling sering dijumpai dalam susu sapi (Malkoski 2001). Kasein mengandung asam amino esensial histidin, metionin, fenilalanin lebih banyak dibandingkan whey dan beberapa asam amino non esensial seperti arginin, asam glutamat, prolin, serin dan tirosin (Hall et al. 2003). Protein whey merupakan molekul globuler dan mengandung lebih banyak branced chain amino acid (BCAA) seperti leusin, isoleusin dan valin dibandingkan dengan kasein (Hall et al. 2003). Konsentrasi
whey dalam susu tergantung pada tipe whey, sumber susu (sapi, kambing atau domba), waktu pengambilan (musim), tipe makanan, tahap laktasi dan pemrosesan (Pintado et al. 2001).
Pemecahan protein susu akan menghasilkan peptida-peptida yang beberapa diantaranya bersifat bioaktif. Peptida bioaktif merupakan fragmen spesifik dari protein yang mempunyai pengaruh positif terhadap beberapa fungsi dan kondisi tubuh dalam hal kesehatan. Peptida bioaktif derivat dari protein susu biasanya berupa fragmen yang mengandung 2-20 residu asam amino, meskipun beberapa laporan menyatakan peptida bioaktif mengandung lebih dari 20 asam amino, dan beberapa diantaranya dapat bersifat multifungsi (Korhonen 2009; Ryan et al. 2011). Beberapa peptida yang diperoleh dari hasil pemecahan protein susu sapi dan berfungsi sebagai antibakteri telah dilaporkan (Tabel 2.2). Laporan tentang peptida antibakteri dari susu sapi sudah sangat banyak, namun data tersebut belum diimbangi oleh data peptida dari susu kambing dan susu kuda.
enzim proteolitik yang digunakan. Secara umum tidak ditemukan adanya hubungan antara derajad hidrolisis dengan aktivitas antioksidan pada hidrolisat protein whey. Aktivitas antioksidan lebih cenderung berhubungan dengan karakteristik sekuen asam amino dari peptida dan sekuen tersebut sangat tergantung pada spesifitas protease (Pihlanto 2006).
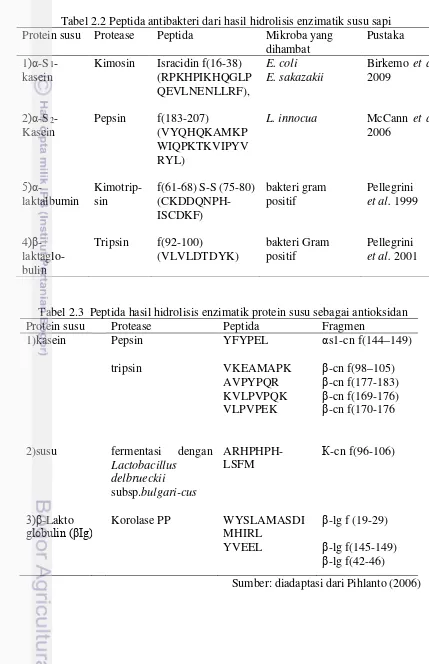
Tabel 2.2 Peptida antibakteri dari hasil hidrolisis enzimatik susu sapi Protein susu Protease Peptida Mikroba yang
dihambat
Pustaka
1)α-S1
-kasein
Kimosin Isracidin f(16-38) (RPKHPIKHQGLP
Tabel 2.3 Peptida hasil hidrolisis enzimatik protein susu sebagai antioksidan
Protein susu Protease Peptida Fragmen
Hidrolisis Protein
Peptida bioaktif tidak selalu ada dalam keadaan alamiahnya. Beberapa diantaranya dapat berupa prekursor protein atau peptida yang hanya akan aktif apabila telah dihidrolisis dari protein alamiahnya melalui proses hidrolisis enzimatik pada proses pencernaan, fermentasi atau pengolahan. Hidrolisis adalah pemecahan ikatan dalam molekul dengan penambahan elemen air sedangkan hidrolisis enzimatik akan melibatkan enzim dalam prosesnya. Hidrolisis enzimatik merupakan metode yang paling umum yang digunakan untuk memecah protein sehingga diperoleh peptida bioaktif (Korhonen 2009).
Enzim-enzim tersebut memecah protein pada sisi tertentu yang menentukan sekuen, panjang dan bioktifitas peptida yang dihasilkan. Hidrolisis terhadap protein dalam susu dapat dilakukan menggunakan enzim-enzim proteolitik dari berbagai sumber (Tabel 2.4).
Tabel 2.4 Enzim proteolitik untuk hidrolisis protein susu
Enzim Asal Karakteristik Target Pustaka
1)enzim
Pada beberapa kasus, kombinasi enzim-enzim tersebut efektif untuk mendapatkan peptida bioaktif (Korhonen 2009). Oleh karena itu, optimasi untuk produksi peptida dapat dilakukan melalui pemilihan enzim dan kondisi hidrolisis seperti pengaturan pH dan suhu reaksi (Wang et al. 2013).
Bromelin
Bromelin merupakan enzim protease yang terdapat pada tanaman nanas, famili Bromeliaceae dengan berat molekul 8-28 kDa. Bromelin kasar diperoleh dengan mengekstraksi tangkai (stem) atau buah (fruit) nanas. Kelebihan bromelin dibandingkan dengan protease tanaman yang lain adalah enzim ada pada awal perkembangan buah tetapi konsentrasinya meningkat dengan cepat dan tetap tinggi sampai buah matang meskipun ada sedikit penurunan aktifitas proteolitik (Maurer 2001). Apabila dibandingkan dengan protease dari buah lain seperti fig dan papaya, ficin dan papain hanya ditemukan ketika buah masih hijau dan aktivitas proteasenya menghilang setelah buah masak (Bartholomew 2003).
Berdasarkan sumbernya bromelin dibedakan menjadi stem bromelin dan
fruit bromelin. Ekstrak kasar bromelin mempunyai pH optimum 4,5 – 9,8 tergantung asal dan varietas nanas (Bhattacharyya 2008). Valles et al (2007) dan Jutamongkon et al. (2010) melaporkan bahwa bromelin mempunyai aktivitas yang baik pada suhu 37-60 oC.
Bromelin merupakan enzim endopeptidase dan dikelompokkan dalam protease sistein. Walaupun demikian berbeda dengan protease sistein yang lain, bromelin mempunyai geometri dan dan reaktifitas sisi aktif yang berbeda yang disebabkan oleh Cys-25 yang berfungsi sebagai high saddle point yang membagi sisi aktif menjadi dua sisi lengkungan yang mengakibatkan bromelin lebih sulit diinaktivasi oleh inhibitor seperti E-64 sebagaimana sistein protease yang lain (Ritonja 1989). Analisis struktur kimia menunjukkan bahwa sisi aktif bromelin terletak pada Leu-13. Sedangkan Pro-12 berfungsi untuk mengontrol sisi samping leusin (Sawano et al. 2008). Hasil analisis tersebut berbeda dengan mekanisme protease sistein pada umumnya yaitu sisi aktif ada pada sistein. Bromelin menghidrolisis protein pada sisi karbonil dari lisin, alanin, tirosin dan glisin. pH optimum sangat tergantung dari asal substrat, tipe dan konsentrasi bufer serta keberadaan agen pereduksi. (Godfrey 1983; Stellmach 1988.)
Beberapa metode ekstraksi dapat dilakukan untuk mengisolasi bromelin dari tangkai atau buah nanas. Isolasi bromelin menggunakan metode presipitasi seperti amonium sulfat atau etanol pada dasarnya adalah mengkonsentrasikan molekul target. Konsentrasi sangat perlu untuk menurunkan volume sehingga lebih mudah untuk purifikasi lebih lanjut. Presipitasi amonium sulfat dilakukan dengan menambahkan NH4(SO4)2 pada ekstrak yang telah didinginkan 0 oC sampai dengan
kelarutan yang diinginkan (20 %, 40 %, 60 %, 80 % and 100 %). Pada masing-masing tahap dilakukan sentrifugasi untuk mendapatkan endapan yang dilarutkan kembali dalam bufer fosfat. Untuk presipitasi etanol dilakukan dengan mendinginkan etanol sampai 0 oC dan diteteskan dalam ekstrak kasar sampai
lebih sesuai untuk isolasi bromelin berdasarkan waktu proses dan kekuatan ion yang diperlukan untuk purifikasi lebih lanjut (Soares et al. 2011). Untuk ekstraksi menggunakan aseton dilakukan dengan melarutkan jus buah nanas yang telah difilter dengan aseton 50 % (v/v) untuk fraksi pertama dan 66 % (v/v) untuk fraksi kedua selanjutnya disentrifugasi untuk mendapatkan presipitat enzim (Rowan et al. 1990).
Protease Bacillus sp.
Selain berasal dari tanaman, protease juga dapat dihasilkan oleh mikroba seperti bakteri, kapang dan khamir. Produksi enzim yang dihasilkan oleh mikroba telah lama didominasi oleh protease yang dihasilkan oleh Bacillus sp. dan telah banyak digunakan dalam industri. Protease dari genus Bacillus terutama dihasilkan oleh Bacillus subtillis dan Bacillus licheniformis yang termasuk dalam alkalin protease. Bacillus penghasil protease dapat diiisolasi dari tanah, misalnya Bacillus sp. N-40 (Sevinc dan Demirkan 2011), dari sedimentasi air laut yaitu halotoleran
Bacillus licheniformis (Suganthi et al. 2013) atau dari susu misalnya Bacillus sp.
MPTK 712 (Kumar et al. 2012)
Protease dari Bacillus sp. termasuk dalam golongan protease serin yang dikarakterisasikan dengan aktivitas yang bagus pada suhu dan pH tinggi. Protease serin atau endopeptidase serin merupakan enzim yang memecah protein menjadi peptida dengan serin sebagai sisi aktif enzim. Aktivitas serin protease dapat dihambat oleh phenylmethylsulfonyl fluoride (PMSF) dan
diisopropylfluorophosphate. Protease yang dihasilkan oleh Bacillus sp. biasanya mempunyai berat molekul 25-46 kDa dan dapat distabilisasi dengan Ca2+ dengan titik isoelektrik yang tinggi. Larut dalam deterjen dan tetap aktif pada pH 7,5-11 dan suhu 37-70 oC (Ferrero et al. 1996; Jellouli et al 2011; Vijayaraghavan et al. 2014).
B. thuringiensis memproduksi protease alkali yang menunjukkan aktivitas proteolitik pada berbagai kondisi kultur (Agastya et al. 2013). Zhang et al. (2015) juga mengidentifikasi dan mengkarakterisasi thermolysin like protease dari B. thuringiensis yang memungkinkan untuk digunakan dalam terapi dan aplikasi bioteknologi.
Karakteristik Peptida Antibakteri dan Antioksidan
Karakteristik peptida ditentukan oleh susunan dan panjang asam amino dalam rantai peptida (Tidona et al. 2009). Ukuran peptida antibakteri bervariasi dari 2 sampai 100 asam amino (Brogden 2005; Pushpanathan 2013). Studi mengenai sekuen (RW)n pada peptida antimikroba menunjukkan bahwa semakin panjang rantai asam amino semakin meningkat pula daya bunuh peptida terhadap bakteri gram positif dan gram negatif tetapi meningkat pula kemampuan hemolitiknya (Liu
et al. 2007).
antibakteri yaitu sisi kation dan sisi nonpolar. Sisi kation biasanya mengandung arginin (R), lisin (K) dan histidin (H) yang bertanggungjawab terhadap interaksi peptida dengan sisi negatif membran atau dinding sel bakteri termasuk lipopolisakarida (Brown et al. 2006). Untuk sisi non polar, peptida antibakteri sering mengandung prolin (P), fenilalanin (F) dan triptofan (W) dan diduga sebagai
lipophilic anchor yang menginduksi kerusakan membran (Tam et al. 2002). Dari kombinasi sisi kation dan non polar tersebut nampaknya kombinasi R dan W yang paling sering ditemukan (Liu et al. 2007), seperti pada indolicidin yang diisolasi dari granula neutrofil sapi mempunyai sekuen H-ILPWKWPWWPWRR-NH2
(Staubitz et al. 2001). Analisis hubungan antara aktivitas peptida antibakteri seri (RW)n-NH2 dengan model sistem membran menunjukkan bahwa kombinasi RW merupakan elemen penentu aktivitas. Semakin panjang rantai RW, semakin efektif membunuh bakteri gram positif dan negatif tetapi semakin besar pula aktivitas hemolitiknya (Liu et al 2007). Sementara itu, untuk kombinasi KW, peningkatan rantai KW (dari (KW)1 ke (KW)4) akan meningkatkan aktivitas bakterisidal dan sitotoksisitas. Walaupun demikian, ketika sekuen KW bertambah (KW)5 aktivitas bakterisidal menurun tetapi sitotoksisitas naik seiring dengan meningkatnya hidrofobisitas dan self-agregation (Gopal et al. 2013).
Peptida anion mengandung banyak aspartat dan glutamat, sedangkan peptida kationik mengandung banyak lisin dan arginin. Peptida anion yang membentuk komplek dengan zinc atau peptida kationik tinggi sering bersifat lebih aktif daripada peptida netral (Brogden 2005). Peptida antibakteri dengan hidrofobisitas tinggi menunjukkan self-association yang kuat. Muatan positif berfungsi untuk meminimalkan asosiasi melalui distribusi muatan positif pada kedua sisi terminal. Keseimbangan antara hidrofobisitas dengan distribusi muatan akan memberikan efisiensi terhadap aktivitas antibakteri (Yin et al. 2012).
Sifat asam–basa ditentukan oleh residu terminal bebas dan kelompok ion di bagian lateral dari residu dalam rantai. Reaktifitas dari gugus terminal berguna untuk deteksi dan kuantifikasi peptida bioaktif tersebut. Beberapa peptida mempunyai daerah rantai peptida yang overlapping yang menghasilkan fungsi yang berbeda. Daerah tersebut diduga sebagai “strategic zone” yang sebagian terlindungi dari pemecahan lebih lanjut oleh enzim proteolitik. Salah satu contoh “strategic zone” adalah sekuen 60-70 dari β-kasein sapi dan manusia. Sekuen tersebut terlindungi dari proteolisis karena hidrofobisitasnya yang tinggi dan kehadiran residu prolin. Asam amino prolin dapat berfungsi untuk membantu mempertahankan rigiditas formasi peptida (Tidona et al. 2009) melalui kemampuannya untuk mempertahankan sudut torsi tertentu pada rantai peptida sehingga peptida tidak mudah mengalami kerusakan. Hidrofobisitas yang tinggi dan residu prolin juga melindungi peptida dari pemecahan lebih lanjut ketika kontak dengan enzim protease maupun asam dalam saluran pencernaan (Baeriswyl dan Heinis 2013).
Tyr–His–Tyr, Xaa–Xaa–Trp/Tyr dan Xaa–Xaa–Cys(SH) mempunyai aktivitas sinergi yang kuat dengan antioksidan fenolik, mempunyai aktivitas radical scavenging yang tinggi dan sekaligus aktivitas peroxynitrite scavenging activity
yang tinggi. Untuk aktivitas antioksidan tryptophan dan tyrosin kemungkinan disebabkan oleh kemampuan gugus fenol dan indol sebagai penyedia hidrogen.
Analisis Bioinformatik dan Pemodelan
Bioinformatik merupakan cabang ilmu yang menggabungkan ilmu komputer, statistik, matematika dan teknik untuk menginterpretasikan data biologi. Bioinformatik berguna untuk mengolah data hasil eksperimen berupa sekuen nukleotida atau asam amino berdasarkan database yang telah ada untuk memprediksi hubungan struktur dan fungsi gen, protein atau peptida. Aplikasi bioinformatik pada sekuen DNA dapat digunakan untuk memprediksi gen tertentu dan posisi gen tersebut dalam genom (Mathe et al. 2002). Pada protein, bioinformatik dapat digunakan dalam identifikasi protein, karakterisasi, homologi, prediksi struktur dan fungsi (Persson 2000). Bioinformatik juga dapat digunakan dalam pencarian makanan fungsional terutama peptida bioaktif pada makanan. Penggalian genom spesifik untuk karakterisasi therapheutic ingredient tertentu pada makanan memungkinkan penemuan ingredien tersebut pada sumber yang makanan baru dalam waktu yang lebih cepat (Khaldi 2012).
Sebelum bioinformatik berkembang, penemuan obat dan protein fungsional dilakukan melalui pengujian trial and error dan memerlukan waktu, tenaga serta biaya yang mahal. Seiring dengan perkembangannya, pencarian dan penemuan protein atau peptida fungsional dapat dilakukan lebih cepat. Pada pencarian peptida bioaktif, kesamaan sekuen peptida pada bank data dapat memperpendek indentifikasi dan seleksi peptida bioaktif yang baru (Doytchinova et al. 2004; Gonzales et al. 2011). Misalnya pada peptida antimikroba, hubungan sifat antimikroba dengan tampilan peptida antimikroba sebelumnya yang sudah ada dalam literatur akan dikomputasikan dan dibandingkan dengan peptida yang baru ditemukan untuk mendapatkan perkiraan aktivitasnya (Amaral et al. 2012).
Perkembangan komputasi dan teknik visualisasi terutama 3 dimensi dari senyawa aktif juga telah mengantarkan pada penemuan hubungan antara struktur dan fungsi senyawa tersebut. Sebelumnya, senyawa dengan aktivitas biologi tertentu ditemukan dari hasil skrining secara acak dan kebetulan. Penemuan teknik visualisasi 3 dimensi memungkinkan prediksi struktur dan fungsi senyawa bioaktif menjadi lebih akurat tanpa harus melalui rangkaian eksperimen yang mahal (Breda
3 METODE PENELITIAN
Waktu dan Tempat penelitian
Penelitian ini dilaksanakan pada bulan Oktober 2013 sampai Maret 2015. Tempat penelitian dilaksanakan di Laboratorium Balai Penelitian Veteriner Bogor.
Bahan dan Alat
Bahan utama yang digunakan pada penelitian ini adalah susu kambing dan susu kuda sebagai sumber peptida. Susu kambing peranakan etawah (PE) diperoleh dari peternakan kambing di Fakultas Peternakan Institut Pertanian Bogor dengan pakan berupa hijauan rumput dan konsentrat, sedangkan susu kuda diperoleh langsung dari peternak kuda di Desa Penyaring, Kecamatan Mojo Utara Kabupaten Sumbawa Besar, Nusa Tenggara Barat (pakan berupa rumput asli Sumbawa). Buah nanas Bogor sebagai sumber bromelin dan Bacillus thuringiensis sebagai sumber protease. Isolat bakteri uji yaitu Staphylococcus aureus ATCC 25923, Salmonella Typhimurium ATCC 13311,Escherichia coli ATCC 25922, dan Listeria monocytogenes ATCC 15313. Uji antioksidan menggunakan ABTS [2, 2’- azino-bis (3-ethylbenzthiazoline-6-sulphonic acid), DPPH (2,2- diphenyl-1-picrylhydrazyl), mikroplate dan mikroplate reader. Fraksinasi dan pemurnian peptida menggunakan membran filter molecular weightcut-off (MWCO) 30, kDa, 10 kDa dan 3 kDa. Untuk HPLC (high performance liquid chromatography) digunakan kolom C-18. Analisis dan identifikasi asam amino menggunakan LC-MS/MS (liquid chromatography-mass spectrometry-mass spectrometry). Analisis sekuen peptida dilakukan menggunakan PepDraw, PEP-FOLD, RasWin dan SPLIT.
Tahapan Penelitian
Tahapan penelitian seperti terlihat pada diagram alir penelitian pada Gambar 3.1.
Gambar 3.1 Tahapan penelitian
Susu Kambing dan susu Kuda Sumbawa
Tahap I
Persiapan susu, enzim, hidrolisat dan skrining awal aktivitas antibakteri dan antioksidan
Tahap II
Fraksinasi dan uji lanjut aktivitas antibakteri dan antioksidan fraksi peptida
Tahap III
Karakterisasi peptida terpilih Tahap IV
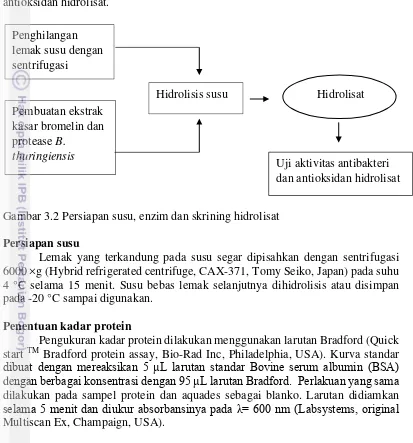
Persiapan Susu, Enzim dan Skrining Hidrolisat
Penelitian tahap ini meliputi persiapan susu, enzim bromelin dan protease
Bacillus thuringiensis yang digunakan untuk hidrolisis protein susu kambing dan susu kuda Sumbawa, hidrolisat dan skrining awal aktivitas antibakteri dan antioksidan hidrolisat.
Gambar 3.2 Persiapan susu, enzim dan skrining hidrolisat
Persiapan susu
Lemak yang terkandung pada susu segar dipisahkan dengan sentrifugasi 6000 ×g (Hybrid refrigerated centrifuge, CAX-371, Tomy Seiko, Japan) pada suhu 4 °C selama 15 menit. Susu bebas lemak selanjutnya dihidrolisis atau disimpan pada -20 °C sampai digunakan.
Penentuan kadar protein
Pengukuran kadar protein dilakukan menggunakan larutan Bradford (Quick start TM Bradford protein assay, Bio-Rad Inc, Philadelphia, USA). Kurva standar
dibuat dengan mereaksikan 5 μL larutan standar Bovine serum albumin (BSA)
dengan berbagai konsentrasi dengan 95 μL larutan Bradford. Perlakuan yang sama dilakukan pada sampel protein dan aquades sebagai blanko. Larutan didiamkan
selama 5 menit dan diukur absorbansinya pada λ= 600 nm (Labsystems, original
Multiscan Ex, Champaign, USA).
Ekstraksi dan penentuan aktivitas enzim
Bromelin diekstrak dengan menghancurkan buah nanas muda tanpa kulit menggunakan food processor. Jus yang diperoleh selanjutnya disaring menggunakan kertas saring whatman 41 (Sigma- Aldrich, USA), ditambahkan aseton (Sigma-Aldrich, USA) dengan perbandingan 1:1 (v/v) dan disimpan pada suhu 4 °C semalam. Larutan disentrifugasi (micro ultracentrifuge CS 150 NX, Hitachi, Japan) pada suhu 4 °C 6000 ×g selama 15 menit. Endapan kemudian dicampur dengan phosphate buffer saline (PBS) pH 7.4 dengan perbandingan 1:1 (w/v) (Rowan et al. 1990).
Bacillus thuringiensis ditumbuhkan dalam media Luria bertani broth yang mengandung 0.05 % susu skim. Inkubasi dilakukan pada suhu 37 oC selama 24 jam.
Penghilangan lemak susu dengan sentrifugasi
Pembuatan ekstrak kasar bromelin dan protease B.
thuringiensis
Hidrolisis susu
Uji aktivitas antibakteri dan antioksidan hidrolisat
Sel bakteri dipisahkan dengan sentrifugasi 3500 ×g selama 15 menit. Presipitasi enzim dilakukan menggunakan amonium sulfat menurut Rowan et al. (1990). Supernatan diambil kemudian ditambah dengan amonium sulfat 50 % dan diinkubasi pada suhu 4 oC selama semalam. Selanjutnya dilakukan sentrifugasi pada 10.000 ×g selama 15 menit. Supernatan dibuang, endapan yang diperoleh dikering anginkan dan disimpan pada suhu -20 oC sebelum digunakan atau
dilarutkan dalam PBS pH 7.4 dengan perbandingan 1:2 apabila langsung digunakan untuk menghidrolisis protein susu.
Penentuan aktivitas enzim dilakukan menggunakan metode Bergmeyer &
Grassel (1983) dengan mereaksikan 250 μL kasein (Oxoid, UK) dengan konsentrasi 2% (w/v) dengan 50 μL enzim dan 250 μL PBS 0.05 M pH 7. Campuran reaksi diinkubasi pada suhu 37°Cselama 10 menit kemudian ditambahkan 500 μL TCA (Sigma-Aldrich, USA) 0.2 M. Larutan diinkubasi kembali pada suhu 37 °C selama 10 menit, disentrifugasi 2000 ×g (centrifuge MRX-152, Tomy Seiko, Japan) selama 10 menit. Supernatan 375 μL dicampurkan dengan 1250 μL Na2CO3 0.4 M dan
ditambahkan 250 μL pereaksi Folin ciolcateau (Merck, Damstardt, Germany) dengan pengenceran 1:2 (v/v) dan diinkubasi pada suhu 37 °C selama 20 menit. Absorbansi diukur dengan spektrofotometer (LKB-Novaspec II,
Pharmacia-Biotech) pada λ 578 nm. Aquades digunakan sebagai blangko dan sebagai standar
digunakan larutan tirosin (Sigma-Aldrich, USA) 5 mM. Satu unit aktivitas
didefinisikan sebagai jumlah enzim yang dapat menghasilkan satu μmol tirosin permenit pada kondisi pengujian.
Hidrolisis susu kambing dan susu kuda Sumbawa
Hidrolisis dilakukan dengan mereaksikan susu dengan enzim bromelin dan protease Bacillus thuringiensis. Hidrolisis protein susu dengan enzim bromelin dilakukan dengan waktu 10 menit, 20 menit, 30 menit, 60 menit pada pH 5 dan 6. Untuk protease Bacillus thuringiensis, hidrolisis dilakukan pada suhu 55 oC pH 7
(Josephine et al. 2012) dan 55 oC pada pH 11 selama 30 dan 60 menit (Ferrero et
al. 1996). Reaksi dihentikan dengan pemanasan 90 oC selama 5 menit. Selanjutnya masing-masing peptida hasil hidrolisis disentrifugasi pada 14.000 ×g selama 15 menit sehingga terbentuk tiga lapisan, diambil bagian tengah yang bening
kemudian difiltrasi menggunakan membran 0,45 μm.
Skrining peptida antibakteri
Skrining dilakukan menggunakan metode skrining menurut Lopez-Exposito et al. (2007) yaitu dengan mencampurkan 50 μL peptida dengan 50 μL mikroba uji 106 CFU/mL dalam mikroplate. Selanjutnya 10 μL campuran tersebut
diteteskan pada media Mueller Hinton agar dan diinkubasi pada suhu 37 oC selama
24 jam. Perlakuan diulang sebanyak tiga kali ulangan. Pengamatan dilakukan dengan melihat besarnya penghambatan pertumbuhan bakteri uji pada tempat penetesan.
Pengujian aktivitas antibakteri
Pengujian dilakukan menggunakan modifikasi metode Clancy dan Nguyen
(1997) dengan mencampurkan 100 μL bakteri uji 106 CFU/mL dengan 100 μL
ditumbuhkan pada media Mueller Hinton agar dan diinkubasi kembali pada suhu 37 oC selama 24 jam. Setelah itu, jumlah koloni yang tumbuh dihitung. Penentuan
nilai Minimum bactericidal concentration (MBC) dilakukan menggunakan metode mikrodilusi pada berbagai konsentrasi peptida. Nilai MBC adalah konsentrasi peptida terendah yang tidak menunjukkan adanya pertumbuhan bakteri selama 24 jam dan inkubasi 24 jam selanjutnya.
Pengujian aktivitas antioksidan
Pengujian antioksidan dilakukan berdasarkan metode Thaipong et al.
(2006) menggunakan [2, 2’-azino-bis (3-ethylbenzthiazoline-6-sulphonic acid)] (ABTS) (Sigma-Aldrich, USA) dan 2,2-diphenyl-1-picrylhydrazyl (DPPH) (Sigma-Aldrich, USA). Larutan stok ABTS dibuat dengan melarutkan ABTS dalam deionized water sehingga diperoleh konsentrasi 7.4 mM. Larutan stok potassium persulfat (Sigma-Aldrich, USA) dibuat dengan konsentrasi 2.6 mM. Untuk larutan yang direaksikan dibuat dengan mencampurkan larutan stok ABTS dengan larutan stok potassium persulfat dengan perbandingan 1:1 (v/v). Reaksi oksidasi dilakukan dalam kondisi gelap selama 16-18 jam. Selanjutnya larutan diencerkan dengan deionized water sehingga diperoleh absorbansi 1.1±0.02 pada
panjang gelombang 405 nm. Sebanyak 100 μL peptida sebelum atau setelah fraksinasi dengan konsentrasi 0.1 mg protein/mL dicampurkan dengan 200 μL
radikal ABTS dalam mikroplate dan diletakkan pada suhu ruangan selama 10 menit. Pengukuran absorbansi dilakukan pada λ 405 nm (Labsystems, original Multiscan Ex, Champaign, USA). Untuk standar antioksidan digunakan vitamin C p.a. pada berbagai konsentrasi.
Pengujian menggunakan DPPH dilakukan berdasarkan kombinasi metode Thaipong et al. (2006) dan Clarke (2013).dengan menambahkan etanol 96% pada
DPPH sehingga diperoleh absorbansi 1.1 ±0.05 pada λ=540 nm. Sebanyak 100 μL
hidrolisat dan fraksi peptida dengan konsentrasi 0.1 mg protein/mL ditambahkan
dengan 200 μL DPPH, dibiarkan selama 30 menit dan absorbansi campuran diukur
pada λ 540 nm (Labsystems, original Multiscan Ex, Champaign, USA). Untuk standar antioksidan digunakan vitamin C p.a pada berbagai konsentrasi.
Aktivitas antioksidan pada uji ABTS dan DPPH dihitung berdasarkan persamaan:
Aktivitas antioksidan (% ) : A blangko – A sampel x 100% A blangko
Keterangan :
A blangko : absorbansi hasil reaksi larutan ABTS/DPPH dan deionized water
A sampel : selisih absorbansi antara sampel (hasil reaksi peptida dan ABTS/DPPH) dan kontrol peptida)
Fraksinasi dan Uji Bioaktivitas Fraksi Peptida
Pada tahap ini dilakukan fraksinasi hidrolisat menggunakan membran
Gambar 3.3 Fraksinasi dan uji bioaktivitas fraksi peptida
Fraksinasi peptida menggunakan membran molecular weight cut off (MWCO) dan uji bioaktivitas fraksi
Filtrasi peptida hasil hidrolisis dilakukan menggunakan membran MWCO untuk hidrolisat bromelin dan 30, 10, dan 3 kDa (Millipore Corp) untuk hidrolisat.
Peptida hasil hidrolisis dituangkan ke dalam ependorf berisi membran yang selanjutnya disentrifugasi pada 14.000 ×g selama 10, 15 atau 20 menit menurut ukuran membran. Peptida yang telah terpisah masing-masing dimasukkan ke tabung ependorf yang baru dan disimpan dalam -20 oC sampai digunakan.
Masing-masing fraksi peptida diuji kembali aktivitasnya sebagai antibakteri dan antioksidan.
Uji hemolisis hidrolisat dan fraksi peptida
Uji hemolisis dilakukan berdasarkan metode Lorenzon et al. (2012) dan Nguyen et al. (2011). Sel darah merah ayam dicuci dengan 0.01 M Tris-HCl (pH 7.4) yang mengandung 0.15 M NaCl (Tris-salin) kemudian disentrifugasi pada 1000 ×g (Microspin 12, Biosan, EU) supernatan dibuang dan pelet dicuci lagi sebanyak 2 kali. Suspensi 0.1% sel darah merah dibuat dengan melarutkan kembali sel darah merah dengan larutan Tris-salin. Sebanyak 100 μL hidrolisat atau fraksi peptida dengan konsentrasi 0.1 mg protein/mL ditambahkan dengan 100 μL sel darah merah 0.1%, diinkubasi selama 2 jam pada suhu 37 °C, kemudian disentrifugasi pada 2000 ×g (Microspin 12, Biosan, EU) selama 5 menit.
Supernatan dipisahkan dan diambil 100 μL, dimasukkan ke dalam mikroplate.
Absorbansi (Abs) diukur pada panjang gelombang 540 nm (Labsystems, original Multiscan Ex, Champaign, USA). Triton X-100 1% (Sigma- Aldrich, USA) digunakan sebagai kontrol positif untuk lisis 100% dan Tris-salin sebagai kontrol negatif. Pengujian dilakukan dengan 3 kali ulangan. Persen hemolisis ditentukan dengan penghitungan sebagai berikut:
Nilai Abs reaksi peptida dengan sel darah merah - nilai Abs kontrol sel darah merah x 100% Nilai Abs reaksi (Triton X-100) dengan sel darah merah
Hidrolisat
Fraksinasi dengan membran MWCO 30, 10 dan 3 kDa
Uji aktivitas antibakteri, antioksidan dan hemolisis Fraksi >30 kDa
Fraksi 10-30 kDa
Fraksi 3-10 kDa
Karakterisasi Fraksi Peptida Terpilih
Pada tahap ini, dilakukan karakterisasi peptida terpilih dengan HPLC dan analisis peptida dengan SDS-PAGE. Profil kromatogram dan hasil SDS-PAGE memberikan gambaran tentang hidrofobisitas dan berat molekul peptida dalam hidrolisat maupun hasil fraksinasi dari peptida terpilih
Gambar 3.4 Analisis dan karakterisasi peptida dengan SDS-PAGE dan HPLC
Analisis peptida dengan sodium dodecyl sulfate polyacrylamide gel
electrophoresis (SDS-PAGE)
Profil peptida hasil hidrolisis dianalisis menggunakan sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE) menggunakan precast gradiend polyacrylamide gel electrophoresis 4-20% (Any kDTM Mini-Protean® TGX gel, BioRad Laboratories Inc) dan pewarnaan coomassie blue (Sigma-Aldrich, USA) untuk hidrolisat dan silver (Sigma-(Sigma-Aldrich, USA) untuk peptida dengan berat molekul rendah.
Karakterisasi fraksi peptida dengan high performance liquid chromatography
(HPLC)
Karakterisasi peptida dalam hidrolisat dilakukan menggunakan HPLC (Waters, Massachuset, USA) berdasarkan metode McCann et al. (2005). Sampel hidrolisat dimasukkan ke dalam kolom HPLC C-18 (5 μm, 4.6 x 250 mm, Xterra, Waters, Massachuset, USA). Elusi hidrolisat dilakukan dengan menggunakan gradient acetonitrile (ACN) (Sigma-Aldrich, USA) dan trifuoroacetic acid (TFA) (Sigma- Aldrich, USA) yang terdiri dari larutan A 0.1% TFA (v/v) dalam air tanpa ion (deionized water) dan larutan B 0.1% (v/v) TFA dalam ACN. Sistem HPLC diseimbangkan dengan 95% larutan A selama 5 menit, diikuti gradient 5-45% (v/v) larutan B selama 20 menit untuk mengelusi peptida dan kemudian diseimbangkan kembali dengan 95% (v/v) larutan A selama 5 menit. Absorbansi diukur pada panjang gelombang 215 nm.
Analisis Bioinformatik Peptida Terpilih
Pada tahap ini dilakukan sekuensing dan analisis bioinformatik sekuen peptida teripilih. Analisis bioinformatik memberikan prediksi karakteristik dan struktur peptida.
Fraksi terpilih Karakterisasi fraksi peptida dengan HPLC
Analisis fraksi peptida dengan SDS-PAGE
Gambar 3.5 Analisis bioinformatik peptida terpilih
Sekuensing dan identifikasi peptida dengan liquid chromatography mass
spectrometry-mass spectrometry (LCMS-MS)
Gel yang mengandung pita peptida yang dikehendaki dari hasil elektroforesis dipotong dan dikirim ke Proteomic International Pty Ltd, Broadway, Netlands, Western Australia untuk dianalisis susunan asam aminonya. Sampel peptida didigesti dengan tripsin menurut Bringans et al. (2007). Peptida dianalisis menggunakan electrospray ionisation mass spectrometry menggunakan Agilent 1260 Infinity HPLC system [Agilent] coupled to an Agilent 6540 mass spectrometer
[Agilent]. Peptida yang telah didigesti dimasukkan ke dalam kolom C18 column
300 SB, 5 cm [Agilent] dan dipisahkan dengan gradient linier air deion:
acetonitrile: 0.1% asam format (v/v). Spektrum dianalisis untuk mengidentifikasi peptida dari protein tertentu menggunakan Mascot sequence matching software [Matrix Science] dan Ludwig NR database.
Analisis bioinformatik sekuen peptida terpilih
Penghitungan teoritis fisiko kimia dan struktur primer dianalisis menggunakan Pepdraw dalam www.expasy.org, struktur peptida dianalisis menggunakan PEP-FOLD dalam http://bioserv.rpbs.univ-paris-diderot.fr/PEP-FOLD/ dan RasWin Molecular Graphic (http//www.rasmol.org). Indeks terapi
prediksi dianalisis dengan SPLIT 4.0 dalam
http://split4.pmfst.hr/split/dserv1/?akcija=run, ditentukan berdasarkan rasio
hemolysis concentration 50% (HC50) dan minimum inhibitory concentration
(MIC) dan kecenderungan profil peptida antimikroba dianalisis menggunakan program SPLIT 3.5 yang tersedia dalam http://split.pmfst.hr/split. Optimasi aktivitas antimikroba dengan kemungkinan modifikasi peptida dilakukan menggunakan SPLIT 4.0 dalam http://split4.pmfst.hr/mutator/.
4. HASIL DAN PEMBAHASAN
Pada penelitian ini dilakukan hidrolisis terhadap susu kambing dan susu kuda Sumbawa. Hidrolisis berfungsi untuk memecah protein dan mengaktifkan fungsi fisiologis peptida yang terkandung di dalamnya. Susu kambing sebelum hidrolisis tidak dapat menghambat pertumbuhan bakteri uji yang digunakan, sedangkan susu kuda Sumbawa, aktivitas antibakteri masih sangat rendah dengan
Sekuen asam amino
Data sifat fisiko-kimia, struktur dan fungsi
Pepdraw (www.expasy.org)
PEP-FOLD (http://bioserv.rpbs.univ-paris- diderot.fr/PEP-FOLD/)
RasWin Molecular Graphic (http//www.rasmol.org) SPLIT 3.5 dan 4.0 dalam
penghambatan pertumbuhan pada skrining awal kurang dari 25%. Aktivitas antioksidan juga sulit untuk diukur karena warna susu yang keruh mempengaruhi pembacaan absorbansi. Peningkatan bioktivitas sangat dipengaruhi oleh enzim, substrat (asal susu) dan kondisi hidrolisis seperti pH suhu dan waktu hidrolisis. Pengaruh faktor-faktor tersebut dapat dilihat pada hasil yang akan dipaparkan selanjutnya. Hidrolisat susu kambing maupun susu kuda Sumbawa mempunyai bioaktivitas yang berbeda antara yang dihidrolisis oleh bromelin dan protease B. thuringiensis.
Hasil Skrining Uji Antibakteri Hidrolisat Peptida
Hasil skrining antibakteri hidrolisat peptida dari susu kambing menunjukkan bahwa aktivitas terbaik dari hidrolisat hasil hidrolisis susu kambing dengan enzim bromelin adalah hasil hidrolisis pada pH 6 selama 60 menit, dan untuk hidrolisis dengan protease Bacillus thuringiensis adalah hidrolisis pada pH 11 selama 30 dan 60 menit (Tabel 4.1).
Tabel 4.1 Hasil skrining aktivitas antibakteri dari hidrolisis susu kambing dengan enzim bromelin dan protease B. thuringiensis
Aktivitas antibakteri hasil hidrolisis susu kuda kambing dengan enzim
Bakteri uji Bromelin Protease B. thuringiensis
10 min 20 min 30 min 60 min 30 min 60 min
Hasil skrining antibakteri hidrolisat peptida dari susu kuda Sumbawa menunjukkan hasil yang sama dengan hidrolisat peptida susu kambing. Aktivitas antibakteri terbaik ditunjukkan oleh hasil hidrolisis susu kuda Sumbawa dengan bromelin pada pH 6 selama 60 menit dan hasil hidrolisis dengan protease B. thuringiensis pada pH 11 selama 30 dan 60 menit (Tabel 4.2).
Tabel 4.2 Hasil skrining aktivitas antibakteri dari hidrolisis susu kuda Sumbawa dengan enzim bromelin dan protease B. thuringiensis
Aktivitas antibakteri hasil hidrolisis susu kuda Sumbawa dengan enzim
Bakteri uji
Bromelin Protease B. thuringiensis 10 min 20 min 30 min 60 min 30 min 60 min Catatan: -: tidak ada hambatan pertumbuhan; +: 25% terhambat; + +: 50% terhambat;
Bromelin biasa digunakan untuk memproduksi peptida bioaktif (Salampessy et al. 2010) dan aktivitas antibakteri peptida yang dihasilkan tergantung dari waktu hidrolisis. Hidrolisis protein Actinopyga lecanora sejenis mentimun laut mempunyai aktivitas antibakteri yang cukup baik terhadap
Pseodomonas sp., P aeruginosa dan E coli setelah hidrolisis selama 7 jam (Ghanbari et al. 2012). Pada penelitian ini waktu hidrolisis hanya sampai 60 menit dan menghasilkan hidrolisat dengan aktivitas tertinggi dibandingkan dengan hasil hidrolisis 10, 20 dan 30 menit. Ada kemungkinan aktivitas antibakteri masih dapat meningkat apabila waktu hidrolisis diperpanjang.
Hasil hidrolisis susu kambing maupun susu kuda Sumbawa yang dihidrolisis dengan bromelin pada pH 6 selama 60 menit dan protease B. thuringiensis pada pH 11 selama 30 dan 60 menit menunjukkan aktivitas antibakteri yang lebih baik dibandingkan dengan hidrolisat yang lain. Hasil tersebut menunjukkan bahwa kondisi hidrolisis seperti enzim, substrat, waktu hidrolisis, suhu dan pH berpengaruh pada hidrolisat dan peptida yang dihasilkan maupun bioaktivitasnya. Selanjutnya hidrolisat terpilih difraksinasi lebih lanjut untuk memperkirakan ukuran peptida yang aktif sebagai antibakteri dan antioksidan.
Bioaktivitas Peptida Hasil Fraksinasi
Aktivitas antibakteri fraksi peptida hasil hidrolisis susu kambing dan susu kuda Sumbawa dengan enzim bromelin
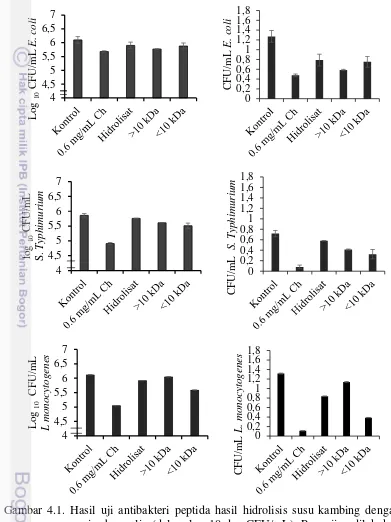
Hasil uji aktivitas antibakteri fraksi peptida hasil hidrolisis susu kambing dengan bromelin pada pH 6 selama 60 menit berdasarkan hasil penghitungan koloni seperti terlihat pada Gambar 4.1. Hasil pengujian antibakteri menunjukkan bahwa peptida sebelum dan sesudah fraksinasi dapat menghambat pertumbuhan E. coli, S. Typhimurium dan L. monocytogenes (Gambar 4.1).
Pada E. coli, fraksi >10 kDa menunjukkan penghambatan yang lebih baik dibandingkan dengan peptida sebelum fraksinasi maupun fraksi <10 kDa. Untuk S. Typhimurium dan L. monocytogenes, fraksinasi dapat meningkatkan aktivitas antibakterinya. Penghambatan tertinggi terjadi pada L. monocytogenes fraksi <10 kDa. Pada L. monocytogenes, aktivitas hidrolisat lebih tinggi daripada fraksi >10 kDa dan aktivitas tertinggi pada fraksi <10 kDa. Berdasarkan hasil tersebut kemungkinan peptida yang aktif sebagai antimikroba banyak terkandung pada fraksi <10 kDa, sehingga ketika dipisahkan maka aktivitas fraksi >10 kDa lebih rendah dibandingkan dengan hidrolisat yang merupakan campuran fraksi <10 kDa dan >10 kDa.
sitoplasma. Peptida yang bekerja dengan mempengaruhi permeabilitas membran dapat terjadi dengan cara membuat pori atau dengan cara melarutkannya (bekerja seperti halnya deterjen) (Mihajlovic dan Lazaridis, 2010). Mekanisme lain adalah peptida antibakteri masuk ke dalam sitoplasma dan menghambat fungsi intraseluler seperti menghambat sintesis DNA, RNA dan reaksi enzimatis tanpa mengganggu stabilitas membran (Jenssen et al., 2006).
Gambar 4.1. Hasil uji antibakteri peptida hasil hidrolisis susu kambing dengan enzim bromelin (dalam log 10 dan CFU/mL). Pengujian dilakukan pada konsentrasi hidrolisat dan fraksi peptida 0.5 mg protein/mL. Kontrol adalah bakteri uji tanpa perlakuan peptida, Ch: antibiotik
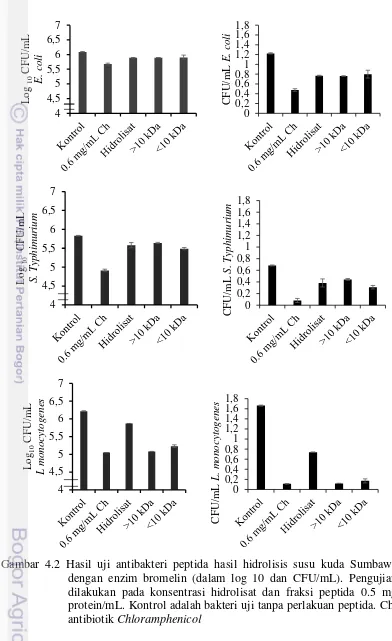
Pengujian terhadap fraksi peptida dari susu kuda Sumbawa menunjukkan hasil yang hampir sama (Gambar 4.2).