ISOLASI DAN KARAKTERISASI BAKTERI METANOTROF
ENDOFIT DAN FILOSFER TANAMAN PADI
NINDYA SAPUTRI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Isolasi dan Karakterisasi Bakteri Metanotrof Endofit dan Filosfer Tanaman Padi adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Maret 2015
Nindya Saputri
ABSTRAK
NINDYA SAPUTRI. Isolasi dan Karakterisasi Bakteri Metanotrof Endofit dan Filosfer Tanaman Padi. Dibimbing oleh IMAN RUSMANA dan ALINA AKHDIYA.
Lahan basah dan sawah menghasilkan emisi metan yang tinggi, yaitu sebesar 43% dan melepaskannya ke atmosfer. Oksidasi CH4 oleh bakteri metanotrof di lahan sawah dapat mencapai 80% dari total CH4 yang diproduksi bakteri metanogen. Bakteri metanotrof dapat hidup baik di tanah sawah maupun di dalam tanaman padi. Isolasi bakteri metanotrof endofit yang telah dilakukan dari bagian filosfer, batang, dan akar padi menggunakan media agar Nitrat Mineral Salt + 1% metanol menghasilkan 18 isolat bakteri metanotrof. Aktivitas soluble metan monooksigenase (sMMO) 18 isolat bakteri metanotrof yang diperoleh diuji dengan metode kolorimetrik meggunakan larutan o-dianisidin. Berdasarkan hasil uji tersebut, empat isolat diantaranya (isolat MF 1.1, MF 1.4, MEB 2.3 dan MEA 2.3) menunjukkan aktivitas enzim sMMO.
Kata kunci: Bakteri metanotrof, metan, sMMO
ABSTRACT
NINDYA SAPUTRI. Isolation and Characterization Endophytic and Phylosphere Methanotrophic Bacteria in Paddy Plant. Supervised by IMAN RUSMANA and ALINA AKHDIYA.
Wetlands and paddy fields produce methane emissions up to 43% of total methane emission. CH4 oxidation by methanotrophs in paddy fields can reach 80% of the total CH4 produced by methanogenic bacteria. Methanotrophic bacteria could be found in soil of rice fields and in paddy plant. Isolation of endophytic methanotrophs has been done from the phylosphere, stems, and roots of paddy plant using Nitrate Mineral Salt + 1% methanol media. As many as 18 isolates of methanotrophic bacteria were successfully isolated. Activity of soluble methane monooxygenases (sMMO) of 18 bacterial isolates were tested by colorimetric method solution of o-dianisidin. Based on this test, four isolates of MF 1.1, MF 1.4, 2.1 MEB, MEB 2.3 and 2.3 MEA isolates showed sMMO enzyme activity.
Kata kunci: Methane, methanotrophic bacteria, sMMO
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Biologi
ISOLASI DAN KARAKTERISASI BAKTERI METANOTROF
ENDOFIT DAN FILOSFER TANAMAN PADI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas
segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan April 2014 ini ialah Isolasi dan Karakterisasi Bakteri Metanotrof Endofit dan Filosfer Tanaman Padi.
Terima kasih penulis ucapkan kepada Bapak Dr Ir Iman Rusmana, MSi dan Ibu Dr Alina Akhdiya, MSi selaku pembimbing karya ilmiah serta Ibu Dr Ir Sulistijorini, Msi selaku penguji karya ilmiah. Penulis juga mengucapkan terima kasih kepada staf Laboratorium Mikrobiologi Departemen Biologi IPB.
Terima kasih kepada mama dan ayah terkasih, Aab, keluarga besar penulis, keluarga Wapemala, Biologi 47, OWA 13, dan keluarga Arundina.
Bogor, Maret 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 1
METODE 2
Waktu dan Tempat 2
Bahan dan Alat 2
Pengambilan Sampel 2
Isolasi, Pemurnian, dan Pengkulturan Bakteri Metanotrof 2
Metanotrof Filosfer 2
Metanotrof Endofit 2
Uji Aktivitas soluble Methane Monooxygenase (sMMO) 3
Karakterisasi Fenotipe 3
HASIL DAN PEMBAHASAN 3 SIMPULAN 6 SARAN 7
DAFTAR PUSTAKA 7
DAFTAR TABEL
1 Jumlah koloni bakteri metanotrof endofit dan filosfer yang tumbuh
pada media isolasi 4
2 Populasi bakteri metanotrof pada bagian filosfer, internal akar, dan
batang 5
PENDAHULUAN
Latar Belakang
Padi merupakan tanaman yang sangat penting dan sebagai sumber makanan pokok bagi sebagian besar masyarakat Indonesia. Akan tetapi penanaman padi secara intensif dapat menimbulkan dampak yang kurang menguntungkan bagi lingkungan antara lain peningkatan emisi gas metan di lahan sawah. Sebesar 43% dari emisi metan ke atmosfer berasal dari lahan basah dan sawah (Wild 1995).
Intergovermental Panel on Climate Change, IPCC (1992) menyatakan
bahwa metan merupakan gas rumah kaca yang menempati urutan ketiga setelah CO2 dan Chloro fluorocarbon (CFC) dalam kontribusinya terhadap pemanasan
global. Sebanyak 1,3 ppmv metan di atmosfer menyebabkan peningkatan 1,3⁰ C suhu global. Namun dalam jumlah yang sama, peningkatan emisi gas metan menimbulkan efek yang jauh lebih besar dibandingkan CO2 karena potensi permolekul gas metan dalam pemanasan global 20 kali lebih besar dari pada CO2 (Pearce 2003).
Gas metan dapat dimetabolisme oleh bakteri metanotrof karena bakteri ini memiliki sistem enzim spesifik yaitu metan monooksigenase (MMO) yang mampu menambahkan satu atom oksigen ke dalam molekul metan untuk membentuk senyawa metanol. Oksidasi metan tahap pertama oleh enzim MMO menghasilkan metanol, kemudian metanol dehidrogenase mengkatalis reaksi oksidasi metanol menjadi formaldehid. Reaksi selanjutnya yaitu oksidasi formaldehid menjadi format oleh formaldehid dehidrogenase. Asimilasi formaldehid dapat terjadi melalui dua lintasan utama, yaitu lintasan serin atau lintasan ribulosa monophosphat (RuMP) (White 1995). Lahan sawah yang tergenang dan banyak mengandung metan menyebabkan perbedaan gradien konsentrasi air di sekitar akar dengan ruang antar sel pada akar sehingga CH4 terlarut terdifusi ke dalam jaringan-jaringan pembuluh tanaman (Wiryaningtyas 2011). Bakteri metanotrof dapat hidup di tanah sawah maupun di dalam tanaman padi sebagai endofit dan filosfer. Bakteri endofit merupakan mikroorganisme simbiotik yang hidup di dalam jaringan tanaman dan tidak menimbulkan efek negatif pada tanaman inangnya (Mano dan Morisaki 2008). Umumnya bakteri endofit masuk ke dalam jaringan tanaman melalui akar, stomata dan lentikula (Mano et al. 2007). Bakteri metanotrof endofit padi menggunakan CH4 yang berdifusi ke dalam jaringan pembuluh tanaman padi untuk pertumbuhannya.
Kemampuan bakteri metanotrof dalam mengoksidasi CH4 dapat dimanfaatkan dan diaplikasikan untuk menurunkan emisi gas metan di lahan sawah. Oleh karena itu perlu dilakukan isolasi dan seleksi bakteri metanotrof endofit dan filosfer yang memiliki kemampuan tinggi dalam mereduksi gas metan di lahan sawah.
Tujuan
2
METODE
Waktu dan Tempat
Penelitian ini dilaksanakan mulai bulan April sampai bulan September 2014 di Laboratorium Mikrobiologi Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Bahan dan Alat
Media isolasi yang digunakan adalah Nitrat Mineral Salts (NMS) dan agar. NMS dengan komposisi MgSO4.7H2O 1.0 g/L, CaCl2.6H2O 0.2 g/L, KNO3 1.0 g/L, KH2PO4 0.272 g/L, Na2HPO4.12H2O 0.717 g/L, NH4Cl 4.0 mg/L, Na2EDTA 0.5 g/L, FeSO4.7H2O 0.2 g/L, H3BO3 0.03 g/L, CoCl2.6H2O 0.02 g/L, ZnSO4.7H2O 0.01 g/L, MnCl2.4H2O 3.0 mg/L, Na2MoO4.2H2O 3.0 mg/L, NiCl2.6H2O 2.0 mg/L, CaCl2.2H2O 1.0 mg/L, dan Bacto agar 20 g/L. Alat yang digunakan adalah autoklaf, inkubator, mikroskop Olympus CX 21 Japan, gelas objek, Laminar Air Flow Cabinet, kamera digital (Optilab Camera Microscope),
cawan petri, dan peralatan laboratorium lain yang umum digunakan.
Pengambilan Sampel
Sampel tanaman padi diambil dari sawah di Desa Situgede, Kecamatan Dramaga, Bogor, Jawa Barat. Tanaman padi varietas (Ciherang) umur 2 bulan dicabut, kemudian dimasukkan ke dalam kantong plastik steril dan segera dibawa ke laboratorium untuk diisolasi bakteri endofitnya.
Isolasi, Pemurnian, dan Pengkulturan Bakteri Metanotrof
Metanotrof Filosfer
Isolasi bakteri metanotrof dilakukan dengan metode isolasi langsung dengan teknik cawan sebar pada agar NMS + 1% metanol (v/v). Bakteri filosfer diisolasi dari daun yang telah dicuci dengan air steril selanjutnya direndam dalam larutan garam fisiologis (NaCl 0,85%). Rendaman tersebut diaduk dengan vortex selama 5 menit lalu diinkubasi sambil dikocok di atas shaker. Setelah inkubasi selama 30
menit, sebanyak 1 ml cairan perendam diinokulasikan ke dalam 50 ml media NMS. Sebagian cairan rendaman (100 μl) disebarkan pada media NMSA + 1% metanol.
Metanotrof Endofit
3 digerus secara aseptis. Sebanyak 100 μl cairan hasil gerusan batang dan akar masing-masing disebarkan pada media agar NMS + 1% metanol. Inkubasi dilakukan selama 10-14 hari pada suhu ruang.
Bakteri yang tumbuh pada media isolasi dimurnikan menggunakan metode gores kuadran pada media yang sama. Isolat murni yang diperoleh selanjutnya diperbanyak agar miring NMS + 1% metanol dan disimpan dalam lemari pendingin sebagai biakan kerja.
Uji Aktivitas soluble Methane Monooxygenase (sMMO)
Masing-masing isolat ditumbuhkan pada media agar NMS dan NMS + 1µM CuSO4 dengan cara ditotolkan. Media yang telah diinokulasi tersebut diinkubasi pada suhu ruang (29°C-30ºC) selama 10-14 hari. Tutup cawan dibuka dan ditaburi kristal naftalena sebelum cawan berisi koloni dipasangkan kembali pada posisi terbalik. Cawan dibiarkan pada posisi tersebut selama 15 menit sebelum permukaan koloninya disemprot dengan larutan ortodianisidin (5 mg/ml). Cawan berisi koloni ditutup kembali dengan cawan penutup yang baru dan dibiarkan selama 15 menit pada posisi normal sebelum diamati. Koloni isolat yang warnanya berubah menjadi ungu setelah perlakuan ini menunjukkan adanya aktivitas sMMO (Graham et al. 1992).
Karakterisasi Fenotipe
Karakterisasi fenotipe isolat terpilih yang dilakukan secara terbatas meliputi morfologi koloni, morfologi sel, dan reaksi Gram. Metode pewarnaan Gram dilakukan pada waktu 3 minggu setelah penggoresan. Isolat bakteri dioles tipis pada kaca objek kemudian difiksasi panas dengan cara didekatkan dengan sumber api pada bunsen selama 30 detik. Olesan yang sudah difiksasi, ditetesi dengan zat warna kristal violet selama 1 menit kemudian dibilas dengan akuades. Selanjutnya diteteskan zat pewarna iodium Gram selama 2 menit kemudian dibilas dengan akuades dan ditetesi alkohol 95% hingga pucat. Selanjutnya dilakukan pewarnaan dengan safranin selama 30 detik. Olesan bakteri dibilas dengan akuades dan sisa-sisa air yang menempel dikeringkan dengan kertas serap. Preparat diamati menggunakan mikroskop pada perbesaran 100x10. Isolat yang teramati kemudian dipotret dengan menggunakan kamera digital (Optilab Camera Microscope).
HASIL DAN PEMBAHASAN
Hasil Isolasi Bakteri Metanotrof Endofit dan Filosfer Padi
4
untuk menghasilkan energi dan sebagai sumber karbonnya. Selain kedua senyawa tersebut, kelompok bakteri ini juga mampu menggunakan senyawa metil, format, formaldehid, dan metilamin (Hanson dan Hanson 1996).
Bagian internal akar menghasilkan 58 koloni, bagian internal batang 236 koloni, dan bagian filosfer 160 koloni (Tabel 1). Hasil isolasi ini menunjukkan bahwa selain di dalam tanah atau lumpur sawah, bakteri metanotrof juga menghuni bagian internal tanaman dan filosfer padi. Keberadaan bakteri metanotrof di dalam jaringan-jaringan tanaman padi tersebut didukung oleh tersedianya gas metan sebagai sumber karbon dan energi untuk pertumbuhan bakteri ini. Wiryaningtyas (2011) menyatakan bahwa pada pembuluh aerenkim daun, batang, dan akar padi terjadi pertukaran gas dari dalam tanah ke udara. Perbedaan gradien konsentrasi air di sekitar akar dengan ruang antar sel pada akar menyebabkan CH4 terlarut terdifusi ke dalam jaringan-jaringan pembuluh. Proses oksidasi metan pada bakteri metanotrof dikatalisis oleh enzim metan monoksigenase (MMO). Enzim ini mampu memutus ikatan O-O. Satu atom oksigennya akan berikatan dengan metan membentuk metanol, sedangkan atom oksigen yang lain akan direduksi menjadi H2O. Terdapat dua jenis enzim metan monoksigenase, yaitu enzim metan monoksigenase terlarut (sMMO) dan enzim metan monoksigenase terikat membran (pMMO).
Morfologi koloni-koloni bakteri pada media isolasi bervariasi dan dapat dikelompokkan menjadi 6 (A, B, C, D, E, dan F) berdasarkan warna dan elevasinya (Tabel 1). Warna-warna koloni disebabkan oleh pigmen bakteri yang hidup dalam koloni-koloni tersebut. Sebagian bakteri metanotrof tidak menghasilkan pigmen, sedangkan sebagian lainnya mampu menghasilkan pigmen antara lain pigmen kuning atau kecoklatan (Hanson dan Hanson 1996), pink muda (Eller dan Frenzel 2001) serta oranye kemerahan (Holt et al. 2000).
Tabel 1 Jumlah koloni bakteri metanotrof endofit dan filosfer yang tumbuh pada media NMS + 1% metanol
Sampel Morfologi Koloni Jumlah
Total
Keterangan: A: Pink, bundar, tepian licin, elevasi cembung
B: Pink muda, bundar, tepian licin, elevasi cembung
C: Kuning, bundar, tepian licin, elevasi seperti tombol D: Krem, bundar, tepian licin, elevasi cembung E: Putih, bundar, tepian licin, elevasi cembung
F: Putih, tak beraturan menyebar,tepian tak beraturan, elevasi timbul
5 (Tabel 2).
Tabel 2 Populasi bakteri metanotrof pada bagian filosfer, internal akar, dan batang
Keterangan: A: Pink, bundar, tepian licin, elevasi cembung
B: Pink muda, bundar, tepian licin, elevasi cembung
C: Kuning, bundar, tepian licin, elevasi seperti tombol D: Krem, bundar, tepian licin, elevasi cembung E: Putih, bundar, tepian licin, elevasi cembung
F: Putih, tak beraturan menyebar,tepian tak beraturan, elevasi timbul Tabel 3 Isolat bakteri metanotrof padi endofit dan filosfer yang diperoleh
Sampel Total Kode Isolat
Filosfer 7 MF 1.1, MF 1.5, MF 1.4, MF 2.2, MF 2.4, MF 1.2, MF 2.3 Batang 7 MEB 1.3, MEB 1.2, MEB 2.5, MEB 2.3,
MEB 2.4, MEB 1.4, MEB 2.2 Akar 4 MEA 1.3, MEA 2.3, MEA 1.1, MEA 2.1
Bakteri metanotrof merupakan bagian dari kelompok bakteri metilotrof (Hanson 1998). Diantara anggota bakteri metilotrof, terdapat kelompok bakteri berwarna pink yang disebut bakteri Pink-Pigmented Facultative Methylotrophic
(PPFM). Kelompok bakteri berwarna pink tersebut dilaporkan seringkali terisolasi
dari bagian tanaman terutama dari permukaan daun (Corpe dan Rheem 1989). Tingginya persentase perolehan bakteri dengan pigmen pink (kelompok A dan B)
dari area filosfer diduga berkaitan dengan tingginya populasi bakteri PPFM dan metanotrof pada permukaan sampel daun yang digunakan sebagai bahan isolasi.
Aktivitas sMMO Isolat bakteri metanotrof
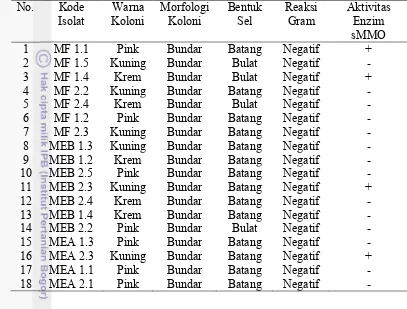
Uji kualitatif aktivitas sMMO terhadap 18 isolat yang diperoleh pada media NMS dengan dan tanpa penambahan 1µM CuSO4 menunjukkan 4 isolat diantaranya (MF 1.1, MF 1.4, MEB 2.3 dan MEA 2.3) warna koloninya berubah menjadi ungu setelah dipapar dengan naftalena dan disemprot dengan O-dianisidin (Tabel 4). Enzim sMMO mampu mengkatalisis reaksi naftalena menjadi naftol (Graham et al. 1992). Warna ungu pada koloni yang telah dipapar
6
Tabel 4 Hasil uji kualitatif aktivitas enzim sMMO isolat bakteri metanotrof endofit dan filosfer padi
No. Kode
Densitas bakteri metanotrof pada bagian filosfer, internal akar dan batang padi, berturut-turut ialah 40.0x102 CFU/cm2 luas daun, 29.5x102 CFU/cm ruas batang dan 7.25x102 CFU/cmruas akar. Isolasi bakteri metanotrof dari bagian internal akar dan batang serta filosfer menghasilkan 18 isolat yang menghasilkan pigmen dan memiliki morfologi koloni yang berbeda. Berdasarkan warna dan elevasi koloninya, isolat-isolat tersebut terdiri atas 6 kelompok yaitu: (A) pink,
bundar, tepian licin, elevasi cembung, (B) pink muda, bundar, tepian licin, elevasi
7 SARAN
Perlu dilakukan uji kualitatif oksidasi metan dan karakterisasi molekular serta fisiologis terhadap isolat bakteri metanotrof endofit dan filosfer yang diperleh pada penelitian ini.
DAFTAR PUSTAKA
Bouwman AF, Sombroek WG. 1990. Inputs to climate change by soil and agriculture related activities. Soil on A Warmer Earth 20: 15-30.
Conrad R, Rothfus F. 1991. Methane oxidation in the soil surface layer of flooded rice fields and the effect of ammonium. Biol Fertil Soil 12: 28-32.
Corpe WA, Rheem S. 1989. Ecology of the methylotrophic bacteria on living leaf surfaces. FEMS Microbiol Ecol 62:243-249.
Eller G. Frenzel P. 2001. Changes in activity and community structure of methane-oxidizing bacteria over the growth period of rice. Appl Environ Microbiol 67 (6): 2395-2403.
Graham DW, Korich DG, Leblanc RP, Sinclair NA, Arnold RG. 1992. Applications of a colorimetric plate assay for soluble methane monooxygenase activity. Appl Environ Microbiol 58(7): 2231-2236.
Hanson RS. 1998. Ecology of methylotrophic bacteria. Di dalam: Burlage RS, Atlas R, Stahl D, Geesey G, Sayler G, editor. Techniques in Microbial Ecology. Oxford (GB): Oxford University Press. Hlm 137-162.
Hanson RS, Hanson TE. 1996. Methanotrophic bacteria. J Microbiol Reviews
60(2): 439-471.
Hapsary W. 2008. Isolasi dan Karakterisasi Bakteri Metanotrof Asal Sawah di Bogor dan Sukabumi [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Holt JG, Krieg NR, Sneath PHA, Staley JT, Williams ST. 1994. Bergey’s Manual
of Determinative Bacteriology. Edisi ke-9. Baltimore (US): William &
Wilkins.
[IPCC] Intergovernmental Panel on Climate Change. 1992. The Suplementary Report to The IPCC Scientific in Hougton JT, Callendar BA, Varney SK,
editor. Cambridge (GB): Cambridge University Press.
Mano H, Tanaka F, Nakamura C, Kaga H, Morisaki H. 2007. Culturable
endophytic bacterial flora on the maturing leaves and roots of rice plants (Oryza sativa) cultivated in a paddy field. Microbes and Environments 22:
175-185.
Mano H, Morisaki H. 2008. Minireview: Endophytic bacteria in the rice plant.
Microbes and Environments 23: 109-117.
Pearce P. 2003. Essential Science Pemanasan Global Panduan Bagi Pemula Tentang Perubahan Iklim Bumi. Jakarta (ID): Erlangga.
White D. 1995. The Physiology and Biochemistry of Prokaryotes. New York
(US): Oxford University Press.
Wild A. 1995. Soils and The Environment: An Introduction. Cambridge (GB):
Cambridge University Press.
8
RIWAYAT HIDUP
Penulis dilahirkan di Sumedang Jawa Barat pada tanggal 12 Januari 1992 dari ayahanda Andang Suparman dan ibunda Ening Yuningsih. Penulis merupakan anak kedua dari empat bersaudara. Tahun 2010 penulis lulus dari SMA Negeri Situraja Sumedang dan berhasil masuk Departemen Biologi FMIPA IPB melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama masa perkuliahan, penulis aktif sebagai anggota divisi Observasi Wahana Alam Himpunan Mahasiswa Biologi (OWA Himabio) selama dua periode pada tahun 2011-2013. Selain itu penulis juga aktif pada kegiatan UKM Bulutangkis IPB pada tahun 2010-2013. Penulis menjadi asisten praktikum mata kuliah Biologi Dasar Tingkat Persiapan Bersama IPB tahun ajaran 2013/2014 dan 2014/2015. Asisten mata kuliah Fisiologi Tumbuhan pada tahun ajaran 2013/2014. Tahun 2012 penulis melaksanakan studi lapang di Taman Nasional Gunung Gede Pangrango dengan judul Bakteri Filosfer Penghasil Senyawa Bioaktif Anti Xanthomonas oryzae pv. oryzae Penyebab Penyakit Hawar Daun