KARAKTERISASI FAG LITIK Photobacterium damselae
ASAL LINGKUNGAN PERAIRAN
NOVIANTY
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Karakterisasi Fag litik Photobacterium damselae Asal Lingkungan Perairan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
NOVIANTY. Karakterisasi Fag Litik Photobacterium damselae Asal Lingkungan Perairan. Dibimbing oleh SRI BUDIARTI dan IMAN RUSMANA.
Photobacterium damselae salah satu bakteri patogen yang menginfeksi hewan (khususnya ikan) dan manusia. Patogenisitas bakteri tersebut dikontrol melalui terapi antibiotik, tetapi aplikasi antibiotik yang berkelanjutan menimbulkan resistensi bakteri. Hasil beberapa penelitian melaporkan Photobacterium damselae sudah resisten terhadap antibiotik. Fag litik adalah terapi alternatif yang dapat digunakan untuk mengatasi bakteri-bakteri patogen. Fag litik dapat melisiskan sel bakteri. Tujuan dari penelitian ini adalah mendapatkan fag litik Photobacterium damselae serta mengkarakterisasi fag litiknya. Fag litik Photobacterium damselae diisolasi dari berbagai sumber perairan yaitu Danau IPB, sungai Cidepit, dan sungai Ciparigi Bogor.
Bakteri inang untuk fag litik terlebih dahulu direidentifikasi secara morfologi dan karakterisasi fisiologis dengan menggunakan KIT API 20E, uji patogenisitas dengan menggunakan agar darah, dan uji resistensi antibiotik. Isolasi dan pemurnian fag litik dilakukan berdasarkan metode agar dua lapis. Keberadaan fag litik ditandai dengan adanya plak. Fag litik hanya ditemukan pada sungai Cidepit dan Ciparigi Bogor. Pada titik ketiga pengambilan sampel di sungai Cidepit didapatkan isolat pertama fag F A91 yang menunjukkan morfologi cloudy
plaque, berdiameter 0.3 mm dengan konsentrasi 3 x 104 PFU mL-1. Pada titik pertama pada sungai Ciparigi didapatkan dua isolat fag. Fag F A92 memiliki
morfologi clear plaque berdiameter 3 mm dengan konsentrasi 11 x 105 PFU mL-1. Berbeda dengan morfologi F A93 yaitu turbid plaque berdiameter 1 mm dan
konsentrasinya 62 x 106 PFU mL-1. F A91 dengan ciri cloudy plaque merupakan
fag lisogenik sehingga tidak digunakan. Clear plaque (F A92) dan turbid plaque
(F A93) merupakan fag litik. Hasil pasase menunjukkan bahwa F A92 dan F A93
merupakan fag yang identik (F A9). Berdasarkan uji kisaran inang fag F A9 spesifik terhadap Photobacterium damselae.
Pengamatan morfologi fag pada Transmission Electron Microscope (TEM)
F A9 termasuk famili Myoviridae. Morfologi kepala ikosahedral berdiameter 30 nm dan ekor kontraktril dengan panjang 60 nm. Analisis SDS-PAGE protein
fag F A9 pada gel poliakrilamida menunjukkan 4 pita protein. Berat molekul protein secara berurutan adalah 109.06, 30.58, 17.08, dan 14.96 kDa.
SUMMARY
NOVIANTY. Characterization Lytic Phage of Photobacterium damselae from Water Environment. Supervised by SRI BUDIARTI and IMAN RUSMANA.
Photobacterium damselae is one of pathogenic bacteria infecting animal (particulary fish) and human. Its pathogenity was controled by antibiotic therapy, but continous application of antibiotics can induce bacterial resistant. Some researches reported that Photobacterium damselae was resistant to antibiotics. Lytic bacteriophage could be an alternative therapy to reduce bacterial patogens by lyse mechanisms of the bacterial cells. The aims of this study were to obtaine lytic phage of Photobacterium damselae and to characterize the phage. Lytic phages of Photobacterium damselae were isolated from water of IPB lake, Cidepit river, and Ciparigi river.
Host bacterium for lytic phage was identified based on morphological and physiological characterization, pathogenity test using blood agar, and antibotic resistant test. Isolation and purification of lytic phage were done using double layer method. Presence of lytic phage was indicated by a plaque formation on double layer agar. Lytic phage were obtained from Cidepit and Ciparigi river Bogor. Lytic phage isolated from Cidepit river (F A91) had cloudy plaque
morphology with 0.3 mm in diameter and phage concentration 3 x 104 PFU mL-1. However in Ciparigi river was obtained two isolates of lytic phage i.e F A92 and
F A93 phages. F A92 phage had clear plaque morphology with 3 mm in diameter
and phage concentration 11 x 105 PFU mL-1. While F A93 phage had turbid
plaque with 1 mm in diameter and phage concentration 62 x 106 PFU mL-1. Based on formation of plaque, phage F A91 was espected as a lysogenic phage
while phage F A92 and F A93 were lytic phages. F A92 and F A93 were identic
phages (F A9). Host determination showed phage F A9 was spesific to Photobacterium damselae.
Based on viral morphology of phage on Transmission Electron Microscope (TEM) phage F A9 (F A92 dan F A93) was grouped into Myoviridae family. The
phage had icosahedral head (30 nm in diameter) and contractile tail (60 nm in lenght). SDS-PAGE analysis of phage F A9 proteins, showed four bands of proteins with molecule weight of 109.06 kDa, 30.58 kDa, 17.08 kDa, and 14.96 kDa respectively.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
KARAKTERISASI FAG LITIK Photobacterium damselae
ASAL LINGKUNGAN PERAIRAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah S.W.T atas segala karuniaNya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan November 2013 hingga Mei 2014 ini ialah Karakterisasi Fag Litik Photobacterium damselae Asal Lingkungan Perairan.
Ucapan terima kasih penulis sampaikan kepada ibu Dr dr Sri Budiarti selaku ketua komisi pembimbing dan bapak Dr Ir Iman Rusmana, MSi selaku anggota komisi pembimbing yang telah banyak memberikan bimbingan dan bantuan, saran, nasihat, waktu konsultasi, solusi dari setiap permasalahan yang dihadapi penulis selama melaksanakan penelitian dan penyusunan karya ilmiah, serta bahan-bahan yang dibutuhkan dalam penelitian ini. Selain itu penulis juga mengucapkan terima kasih kepada ibu Dr Drh Sri Murtini MSi selaku penguji luar komisi pada ujian tesis dan ibu Prof Dr Anja Meryandini, MS selaku Ketua Program Studi Mikrobiologi IPB atas motivasi selama studi dan masukan pada saat ujian sidang tesis. Kepada Kementerian Pendidikan dan Kebudayaan Indonesia melalui program Beasiswa Unggulan DIKTI 2012 atas kepercayaanya telah memberikan beasiswa selama menempuh pendidikan di pascasarjana IPB.
Penulis mengucapkan terima kasih kepada bapak Prof Dr Suharsono, MSi selaku Kepala Pusat Penelitian Sumber daya hayati dan Bioteknologi (PPSHB) IPB yang telah memberikan izin untuk menggunakan fasilitas laboratorium PPSHB IPB. Terima kasih kepada ibu Dewi Asnita, teteh Fitri, dan bapak Fras selaku teknisi di laboratorium Bioteknologi Hewan dan Biomedis dan laboratorium Biologi Tumbuhan PPSHB IPB, ibu Heni dan bapak Jaka selaku teknisi di laboratorium Mikrobiologi, IPB. Terima kasih juga kepada mbak Ita selaku peneliti di laboratorium TEM dan Histologi, Lembaga Eijkman Jakarta. Ucapan terima kasih tak terhingga juga penulis ucapkan kepada kedua orang tua tercinta, bapak Imron (alm) dan ibu Yusro, serta adik Darmawan atas doa, kasih sayang, dukungan, serta semangat yang diberikan. Kepada ibu Prof Dr Badia Perizade, MBA selaku Rektor Universitas Sriwijaya, ibu Dr Hary Widjajanti, MSi, bapak Dr Munawar, MSi, ibu Dra Muharni, MSi, bapak Prof Dr Zulkifli Dahlan, DEA, dan bapak Dr Indra Yustian, MSi penulis ucapkan terima kasih atas rekomendasi dan motivasi yang telah diberikan sehingga penulis dapat melanjutkan pendidikan di Pascasarjana IPB.
Terima kasih kepada teman-teman seperjuangan tim fag (Anik dan Rachmi), teman-teman satu laboratorium (Tini, Ika, Lia, Fathin, Yeni, Leni, mbak Ira, mbak Debby, kak Dedy, Bob, Dewi, dan Kurratayun) atas bantuan, dukungan, dan semangat. Terima kasih untuk kebersamaan, pengalaman teruntuk Vita dan teman-teman Pascasarjana Mikrobiologi 2012, teman-teman satu daerah (kak Erwin, mbak Ike, Lina, Wulan, dan Hari) dan teman-teman Wisma Melati Babakan, serta seluruh pihak yang telah memberikan doa dan dukungannya, penulis ucapkan terima kasih.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL xi
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xi
PENDAHULUAN 1
Latar Belakang 1 Perumusan Masalah 2 Tujuan Penelitian 2 Manfaat Penelitian 2 Ruang Lingkup penelitian 2
TINJAUAN PUSTAKA 2
Karakterisasi Photobacterium damselae 2
Patogenisitas Photobacterium damselae 3
Fag Litik 3
Aplikasi Fag Litik 5
METODE 5
Kerangka Penelitian 5
Waktu dan tempat penelitian 6
Prosedur penelitian 6 HASIL DAN PEMBAHASAN 9
Hasil 9
Pembahasan 14
SIMPULAN DAN SARAN 17
Simpulan 17 Saran 17 DAFTAR PUSTAKA 17
LAMPIRAN 23
DAFTAR TABEL
1 Karakterisasi Fisologis Isolat Photobacterium damselae 9
2 Uji Resistensi Photobacterium damselae terhadap Antibiotik 10
3 Isolasi Fag Litik Photobacterium damselae 11
4 Karakteristik Plak dan Konsentrasi (PFU.mL-1) Fag Litik Photobacterium damselae (F A9) 12
5 Kisaran Inang Fag Litik F A9 12
DAFTAR GAMBAR
1 Diagram Alur Penelitian 62 Photobacterium damselae pada Agar Darah 10
3 Morfologi Plak 11
4 Morfologi Fag Litik F A9 13
5 Profil Protein F A9 melalui SDS-PAGE 13
DAFTAR LAMPIRAN
1 Komposisi Bufer Saline Magnesium (SM) 23PENDAHULUAN
Latar Belakang
Photobacterium damselae merupakan salah satu bakteri patogen. Bakteri ini berhabitat di lingkungan perairan, terutama laut. Umumnya Photobacterium damselae menginfeksi ikan. Keberadaan bakteri ini sangat merugikan bagi petani ikan hias maupun ikan konsumsi. Dilaporkan Hawke (1996) bakteri ini menyebabkan kerugian yang besar mencapai 1 juta US Dollar pada petani ikan di Lousiana.
Beberapa penelitian melaporkan Photobacterium damselae juga patogen terhadap udang, mamalia air, dan manusia. Kasus infeksi Photobacterium damselae pada manusia dapat melalui air, memegang hewan yang telah terinfeksi
bakteri ini, dan makanan laut yang dikonsumsi (Tang dan Wong 1999; Goodell et al. 2004; Alvarez et al. 2006; Aigbivhalu dan Maraqa 2009). Gejala klinis yang
timbul akibat Photobacterium damselae adalah infeksi jaringan melalui luka, namun dapat juga gangguan pencernaan (Shin et al. 1996).
Faktor virulen Photobacterium damselae berupa produk seluler yaitu eksotoksin damselin. Eksotoksin ini disebarkan pada lingkungan perairan (Fouz et al. 2000). Eksotoksin yang dihasilkan Photobacterium damselae menyebabkan septikimia hemoragik dan nekrosis. Beberapa kasus pada manusia yang terinfeksi Photobacterium damselae akan mengalami kegagalan fungsi organ dan menyebabkan kematian akibat komplikasi organ (Rivas et al. 2013).
Penanggulangan Photobacterium damselae diatasi dengan pemberian antibiotik, seperti tetrasiklin, kloromfenikol, gentamisin, amikasin, cepalotin, ciprofloksasin, kolistin, ceftriakson, penisilin, dan ampisilin (Shin et al. 1996; Fraser et al. 1997; Asato dan Kanaya 2004). Pemberian antibiotik untuk mereduksi Photobacterium damselae tidak efektif lagi karena bakteri tersebut telah resisten. Fag litik memiliki aktivitas bakterisida sehingga bisa dijadikan alternatif dalam upaya mengatasi bakteri-bakteri patogen yang telah resisten terhadap antibiotik (Merril et al. 1996).
2
Perumusan Masalah
Photobacterium damselae merupakan bakteri patogen yang menginfeksi ikan (termasuk ikan konsumsi), mamalia air, dan manusia. Infeksi bakteri ini menyebabkan septikmia hemoragik dan necrocis fasciitis berakibat pada kematian. Penanggulangan yang biasa dilakukan adalah menggunakan antibiotik. Penggunaan antibiotik yang berkelanjutan menimbulkan resistensi bakteri, oleh karena itu diperlukan metode alternatif. Metode alternatif yang dapat diterapkan adalah menggunakan fag litik. Fag litik memiliki aktivitas bakterisida karena kemampuan untuk melisiskan sel bakteri, spesifitas inang tinggi, dan non toksik.
Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan fag litik Photobacterium damselae serta mengkarakterisasinya.
Manfaat Penelitian
Hasil penelitian ini diharapkan memberikan informasi awal mengenai karakter fag litik Photobacterium damselae yang berpotensi untuk dikembangkan sebagai agen biokontrol dan terapi fag.
Ruang Lingkup Penelitian
Ruang lingkup dalam penelitian ini meliputi reidentifikasi bakteri inang fag, isolasi, pemurnian dan titrasi fag, pengamatan morfologi fag dengan menggunakan Transmission Electrone Microscope (TEM), dan analisis berat molekul protein fag.
TINJAUAN PUSTAKA
Karakteristik Photobacterium damselae
Photobacterium damselae merupakan bakteri Gram negatif dan dapat hidup pada kadar garam yang tinggi (halofilik). Bakteri ini termasuk bakteri patogen dari famili Vibrioceae. Pertama kali diisolasi dari damselfish (Chromis punctipinnis) (Austin dan Austin 1993). Ada dua subsepesies Photobacterium damselae yaitu subspesies piscidia (lebih dikenal Pasteurella piscicida) dan subspesies damselae (lebih dikenal Vibrio damselae). Kedua subspesies ini memiliki virulensi berupa aktivitas hemolitik (eksotoksin damselin). Subspesies piscidia hanya patogen terhadap ikan, namun subspesies damselae selain patogen terhadap hewan laut juga mammalia air, dan manusia (Love et al. 1981).
3 subspesies damselae bisa tumbuh pada suhu 25 °C sampai 37 °C dan memiliki aktivitas hemolitik pada agar darah (Osorio et al. 2000). Kedua subspesies ini memiliki motilitas rendah dan menggunakan glukosa sebagai sumber karbon. Karakterisasi fisiologisnya akan menunjukkan hasil positif pada uji oksidase, katalase, sitrat, dan gelatin.
Patogenisitas Photobacterium damselae
Produk ekstraseluler yang dihasilkan bakteri patogen berperan untuk pengambilan nutrisi dari lingkungan sekitar dan penetrasi serta bertahan di dalam sel inang (Bakopoulos et al. 2003). Produk ekstraseluler tersebut merupakan salah satu faktor virulensi, seperti protease, hemolisin, dan siderofor. Faktor virulensi Photobacterium damselae terdapat pada lapisan kapsular polisakarida, berupa produk ekstraseluler (eksotoksin) yang memiliki kemampuan mengikat besi (Fe) (Magarinos et al. 1992). Photobacteriumdamselae dapat menghindari mekanisme pertahanan bakteri inang melalui pertahanan intraseluler dalam sel non fagosit (Magarinos et al 1996).
Faktor virulensi utama Photobacterium damselae adalah eksotoksin damselin. Damselin memiliki aktivitas hemolitik dan menyebabkan sitolisis terhadap beberapa tipe eritrosit, termasuk ikan. Kreger (1984) melaporkan aktivitas sitolitik ekstraseluler yang diproduksi subspesies damselae menyebabkan penyakit pada uji in vivo terhadap tikus. Clarridge dan Zighelboim-Daum (1985) melaporkan dua fenotip hemolitik yang menunjukkan aktivitas hemolisis yang berbeda. Fenotip LZ menyebabkan zona hemolisis yang lebih besar dibanding fenotip SZ pada agar darah. Penelitian Rivas et al. (2011) melaporkan terdapat plasmid baru (pPHDD1) yang mengkodekan hemolisin damselin (Hly A-dly) pada subspesies damselae dan menunjukkan aktivitas hemolitik lebih tinggi.
Pemberian antibiotik tidak dapat mengontrol efek fatal akibat infeksi Photobacterium damselae (Clarridge dan Zighelboim-Daum 1985; Fraser et al. 1997; Yamane et al.2004). Pembedahan dan amputasi merupakan langkah terakhir yang dilakukan untuk menyelamatkan pasien yang terinfeksi Photobacterium damselae (Goodell et al. 2004). Beberapa pasien yang diinfeksi Photobacterium damselae akan mengalami kegagalan fungsi organ beberapa jam dari gejala awal yang ditunjukkan. Pada tahun 1984 dilaporkan seorang tangan pasien terluka akibat memegang ikan lele, beberapa jam kemudian area sekitar luka tampak mengeluarkan nanah. Penyebaran toksin yang cepat menyebabkan pasien tersebut meninggal setelah mengalami komplikasi. Necrosis fasciitis yang disebabkan subspesies damselae memiliki efek mortalitas yang lebih tinggi (Perez-Tirse et al. 1993; Yuen et al. 1993).
Fag Litik
4
sebagai terapi alternatif untuk mengatasi resistensi bakteri terhadap antibiotik. Fag adalah virus yang menginfeksi bakteri. Fag dapat ditemukan pada semua habitat bakteri dan arkea, termasuk semua ekosistem yang terdapat di bumi (Ashelford et al. 2003; Breitbart dan Rohwer 2005).
Struktur fag secara lengkap dapat dilihat dengan menggunakan mikroskop elektron. Semua fag terdiri dari asam inti yang dilindungi oleh kapsid. Kapsid memiliki banyak bentuk, yaitu ikosahedral heksagonal, bentuk filamen dengan struktur komplek kepala dan ekor (Carter dan Sauders 2007). Fag dikelompokkan ke dalam ordo Caudovirales yang memiliki DNA utas ganda dan merupakan fag berekor. Caudovirales memiliki kapsid berbentuk ikosahedral dan serabut ekor untuk berinteraksi dengan inang. Terdapat tiga famili fag dalam ordo Caudovirales yaitu Myoviridae, Siphoviridae, dan Podoviridae. Fag juga diklasifikasikan ke dalam kelompok fag polihedral, filamentous, dan pleomorfik (PFP) (Ackermann 2003).
Berdasarkan siklus hidupnya, fag dikelompokkan menjadi fag litik dan lisogenik. Fag litik memiliki keunggulan dibandingkan fag lisogenik. Fag litik memiliki aktivitas bakterisida yaitu dapat melisiskan sel bakteri. Menurut Tortora et al. (2006) reproduksi fag litik terdiri atas 5 tahap, yaitu tahap adsorpsi, tahap penetrasi, tahap sintesis, tahap pematangan, dan tahap lisis. Fag litik akan bereplikasi di dalam sel inang membentuk sejumlah fag baru kemudian melisiskan sel inang dan progeni fag akan menginfeksi sel inang lainnya.
Tahap adsorpsi diawali dengan pelekatan fag pada sel inang melalui reseptor khusus pada permukaan sel. Proses pelekatan ini bersifat spesifik yang berarti bahwa reseptor dan fag bersifat seperti pasangan, setelah pelekatan fag pada sel berperan dalam pelepasan partikel fag matang (Snyder et al. 2003).
Tahapan pematangan dimulai dengan pengemasan asam inti yang baru disintesis di dalam selubung protein. Saat tahapan ini titer fag yang aktif di dalam sel meningkat secara drastis meskipun virion belum terlihat berada di luar sel. Pada akhir proses pematangan virion matang keluar dengan mengakibatkan lisis sel inang. Jumlah virion yang dilepaskan disebut ukuran ledakan (burn size). Siklus replikasi fag berlangsung selama 20-60 menit (Madigan et al. 2000). Proses lisis terjadi dimulai dari gen fag akan mengkodekan suatu protein untuk membuat lubang pada membran sel inang yaitu protein holin. Holin akan menyebabkan gangguan pada membran kemudian gen fag juga akan mengkodekan protein endolisin (enzim muralitik) yang mampu merusak dinding sel inang dan akhrinya mengakibatkan lisisnya sel inang (Grundling et al. 2001).
5 efek samping, terutama jika diaplikasikan pada hewan dan manusia. Ini disebabkan karena tidak adanya reseptor fag pada sel eukariotik (Proctor dan Fuhrman 1990; Lederberg 1996).
Aplikasi Fag Litik
Aplikasi fag litik sebagai agen antibakteri pertama kali digunakan pada awal tahun 1920, diikuti dengan penemuan bakteriologis Inggris Fredrick Twort tahun 1915 dan juga ilmuwan Kanada Prancis Felix D’Herelle tahun 1917. Penemuan
D’Herelle adalah adanya mikroba yang antagonis terhadap bakteri dan
mengakibatkan lisis serta kematian sel bakteri. Dua tahun sebelumnya, Fredrick Twort menemukan hal yang sama, tetapi dia tidak pernah mempertimbangkan terapi fag (Travis 2010; Ryan et al 2011).
Terapi fag merupakan metode alternatif untuk mengatasi penyakit infeksi sebagai solusi mengatasi patogen yang telah resisten terhadap antibiotik. Terapi fag diaplikasikan pada manusia untuk pertama kalinya oleh Bruynoghe dan Maisin pada tahun 1921. Fag diinjeksikan pada pasien yang diinfeksi Staphylococcus. Selama 48 jam berhasil menurunkan panas (Abedon et al. 2011).
Beberapa penelitian juga menunjukkan fag diaplikasikan sebagai biokontrol pencemaran air dan makanan. Di Bangladesh fag spesifik E.coli patogen telah digunakan untuk sanitasi air dalam bentuk tablet pada air minum (Ochman dan Selander 1984). Fag litik spesifik E. coli O157 (O’Flynn et al. 2004), fag spesifik Salmonella dan Campylobacter Goode et al. 2003), fag spesifik Yersinia enterocolitica (Strauch et al. 2001), fag spesifik Lactococcus garviae dan Pseudomonas plecoglossicida (Park dan Nakai 2000) telah diaplikasikan dalam mengatasi pencemaran makanan oleh bakteri patogen. Aplikasi fag juga diterapkan pada hewan yang diinfeksi bakteri, misalnya; fag PlyG yang melindungi mencit terhadap infeksi Bacillus antrachis (Schuch et al. 2002). Fag spesifik Streptococcus pneumoniae yang menginfeksi tikus (Jado et al. 2003).
Beberapa lembaga seperti EPA (Environmental Protection Agency), USDA (United State Depaprtment of Agriculture), dan FDA (Food and Drug Administration) telah mengizinkan aplikasi fag sebagai biokontrol pada makanan dan lingkungan. Produk fag yang diaplikasikan merupakan koktail fag dan fag tunggal. Bakteri target dari produk koktail fag seperti Listeria monocytogenes. Produk ini digunakan sebagai agen sterilisasi untuk makanan (ListShieldTM dan LISTEXTM P100). Produk lain adalah untuk mengatasi patogen pasca panen seperti Xanthomonas campestris pv. vesicatoria dan Pseudomonas syringae pv. tomato(Omnilytics’ AgriphageTM) (Lu dan Koeris 2011).
METODE
Kerangka Penelitian
6
Gambar 1 Diagram alir penelitian
Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan November 2013 sampai dengan Mei 2014. Penelitian bertempat di Laboratorium Bioteknologi Hewan, Pusat Antar Studi (PAU) IPB dan Laboratorium TEM Eijkman Jakarta.
Prosedur penelitian Reidentifikasi Bakteri Inang
Bakteri inang diisolasi dari feses penderita diare di Kecamatan Cigudeg Kabupaten Bogor. Reidentifikasi bakteri inang dilakukan melalui pewarnaan Gram dan karakterisasi fisiologis menggunakan KIT API 20E (Biomeurex). Spesies yang telah direidentifikasi diuji patogenitasnya pada agar darah dan diuji resistensi terhadap antibiotik. Antibiotik yang digunakan adalah antibiotik generik sebanyak delapan jenis yaitu; ampisilin, amoksisilin, ciprofloksasin, tetrasiklin, eritromisin, amoksisilin-asam klavulanat, azithromisin, dan cefotaksime. Sebanyak 200 µL kultur Photobacterium damselae dengan OD600 nm = 0.4
ditambahkan ke dalam 15 mL media nutrient agar (NA) (Oxoid) bersuhu 55 °C kemudian dituangkan ke dalam cawan dan dibiarkan memadat. Setelah dingin, diletakkan kertas cakram, kemudian diteteskan 10 µL antibiotik uji. Dibiarkan
Reidentifikasi bakteri inang
Isolasi Fag : a. Pengambilan Sampel Fag Litik b. Pemurnian dan Titrasi Fag litik
Penentuan Kisaran Inang Fag Litik
Pengamatan Morfologi Fag litik melalui TEM
7 selama 10 menit untuk antibiotik berdifusi. Inkubasi pada suhu 37 °C selama 24 jam, diamati zona bening yang terbentuk dan diukur diameter zona hambatnya.
Pengambilan Sampel Fag
Sampel fag litik berasal dari air Danau IPB, sungai Cidepit, dan sungai Ciparigi, Bogor. Metode pengambilan sampel purposive sampling. Titik pengambilan sampel sebanyak 3 titik dengan jarak 5 m dari setiap titik pengambilan sampel. Sebanyak 10 mL sampel air diambil menggunakan gayung. Selanjutnya disimpan dalam botol steril.
Isolasi Fag
Sampel fag litik disaring berdasarkan metode Pitt dan Gaston (1995) yang dimodifikasi. Sebanyak 4.5 mL sampel dicampurkan dengan kultur Photobacterium damselae OD600nm = 1 (108 CFU mL-1) sebanyak 0.5 mL dan
ditambahkan 5 mL Nutrien broth (NB) (DifcoTM). Campuran diinkubasi di dalam Waterbath shaker (Certomat WR) selama 24 sampai 48 jam pada suhu 37 °C. Kultur tersebut kemudian disentrifugasi (IEC Clinical Centrifuge 215, US) pada kecepatan 402.48 x g selama 20 menit. Sebanyak 5 mL supernatan diambil dengan syringe dan disaring dengan membran filter berpori 0.22 μm (Nylon syringe filter). Supernatan yang telah disaring disimpan dalam tabung steril.
Keberadaan fag dalam sampel diuji dengan menggunakan metode agar dua lapis atau DLA (Double layer Agar). Sebanyak 100 μL sampel fag diencerkan menggunakan bufer Saline Magnesium (SM) (Lampiran 1). Pengenceran sampel fag dimulai dari 10-1 sampai dengan 10-8. Setiap serial pengenceran sampel fag
agar (1.5% agar)lapisan bawah agar. Diinkubasi pada suhu 37 °C selama 24 jam dan diamati plak yang terbentuk (Atterbury et al. 2007).
Pemurnian dan Titrasi Fag
8
Penentuan Kisaran Inang fag
Penentuan kisaran inang fag dilakukan dengan menguji stok fag menggunakan spesies bakteri inang yang berbeda-beda. Bakteri inang yang digunakan adalah Salmonella P38, Salmonella 84, Enteropathogenic Escherichia coli (EPEC K 1.1), Proteus mirabilis, dan Bacillus pumilus. Bakteri-bakteri tersebut merupakan koleksi bakteri patogen Dr dr Sri Budiarti. Uji penentuan kisaran inang dilakukan berdasarkan modifikasi Hansen et al. (2007). Stok fag diencerkan dimulai dari 10-1 sampai dengan 10-8. Masing-masing pengenceran diambil sebanyak 200 μL ditambahkan ke dalam 400 μL kultur bakteri yang berumur 24 jam dan diinkubasi 30 menit, selanjutnya ditambahkan 5 mL soft agar kemudian dihomogenkan dan dituang ke cawan yang berisi hard agar. Agar dibiarkan mengeras pada suhu kamar dan diinkubasi pada suhu 37 °C selama 24 jam. Terbentuknya plak mengiindikasikan fag memiliki kisaran inang luas, sebaliknya tidak terbentuknya plak mengindikasikan fag memiliki kisaran inang sempit.
Pengamatan Morfologi Fag dengan Transmission Electron Microscope
(TEM)
Sebanyak 10 µL stok fag diteteskan pada grid (400 mesh), ditunggu selama 20 detik, selanjutnya dikeringkan dengan kertas saring. Sebanyak 5 μL uranil asetat 2% diteteskan ke atas grid ditunggu selama 1 menit. Grid dikeringkan dengan menggunakan kertas saring dan dibiarkan selama 20 menit agar benar-benar kering (Carey et al. 2006). Selanjutnya grid diletakkan pada holder mikroskop elektron. Spesimen diamati dengan menggunakan mikroskop elektron transmisi model JEOL JEM-1010 yang dioperasikan 80kV pada perbesaran 10000x-100000x.
Analisis Berat Molekul Protein Fag
9 (4 bagian sampel dan 1 bagian buffer sampel). Campuran dihomogenkan, lalu diinkubasi selama 24 jam. Selanjutnya dipanaskan dalam air mendidih selama 5 menit, lalu dimasukkan ke dalam sumur sebanyak 60 μL. Elektroforesis dijalankan dengan arus 20 mA dan tegangan 50 volt selama 3.5 jam.
Elektroforesis diakhiri pada saat pewarna sampel mencapai batas 0.5 cm hingga 1 cm dari bagian bawah gel. Visualisasi pita-pita protein yang terdapat pada gel
akrilamid dilihat melalui pewarnaan dengan menggunakan pewarna perak (Lampiran 2).
HASIL DAN PEMBAHASAN
Hasil
Reidentifikasi Bakteri Inang
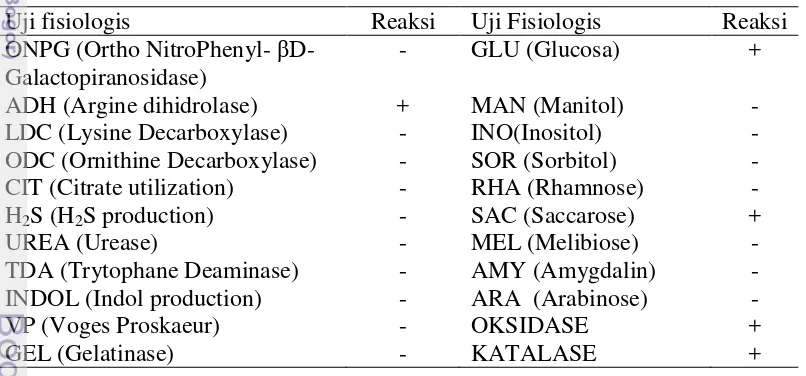
Pewarnaan Gram menunjukkan bakteri inang termasuk bakteri Gram negatif dan berbentuk batang pendek. Berdasarkan karakterisasi fisiologis bakteri inang pada API 20E (Tabel 1) menunjukkan 98.7 % identik Photobacterium damselae. Reaksi positif hanya pada uji ADH (Argine dihidrolase), GLU (glukosa), SAC (Saccarose), oksidase, dan katalase sedangkan uji fisiologis lainnya menunjukkan reaksi negatif.
Tabel 1 Karakterisasi fisiologis isolat Photobacterium damselae
Uji fisiologis Reaksi Uji Fisiologis Reaksi
ONPG (Ortho NitroPhenyl- βD -Galactopiranosidase)
- GLU (Glucosa) +
ADH (Argine dihidrolase) + MAN (Manitol) -
LDC (Lysine Decarboxylase) - INO(Inositol) -
ODC (Ornithine Decarboxylase) - SOR (Sorbitol) -
CIT (Citrate utilization) - RHA (Rhamnose) -
H2S (H2S production) - SAC (Saccarose) +
UREA (Urease) - MEL (Melibiose) -
TDA (Trytophane Deaminase) - AMY (Amygdalin) -
INDOL (Indol production) - ARA (Arabinose) -
VP (Voges Proskaeur) - OKSIDASE +
GEL (Gelatinase) - KATALASE +
- : tidak terjadi reaksi; + : ada reaksi
Pengujian patogenisitas Photobacterium damselae pada agar darah
menunjukkan aktivitas α hemolisis (melisiskan sebagian sel darah merah). α hemolisis ditandai dengan isolat bakteri yang diinokulasikan pada agar darah
10
Gambar 2 Photobacterium damselae pada agar darah menunjukkan aktivitas
α- hemolisis ( )
Berdasarkan interpretasi diameter zona hambat CSLI (2007 dan 2012) menunjukkan bahwa Photobacterium damselae telah resisten terhadap 6 jenis antibiotik yang digunakan, yaitu ampisilin, amoksisilin, tetrasiklin, eritromisin, azitromisin, dan cefotaksime. Dua jenis antibiotik lainnya yaitu ciprofloksasin dan asam klavulanat-amoksisilin masih sensitif terhadap Photobacterium damselae (Tabel 2).
Tabel 2 Uji resistensi Photobacterium damselae terhadap beberapa jenis antibiotik
* Berdasarkan CLSI (Clinical and Laboratory Standars Institute) 2007 & 2012
Isolasi fag
Fag litik Photobacterium damselae diisolasi dari air Danau IPB, sungai Cidepit, dan Ciparigi masing-masing sebanyak tiga titik pengambilan sampel. Hasil isolasi menunjukkan hanya dua lokasi yang terdapat fag, dan dari tiga titik pengambilan sampel hanya satu titik saja didapatkan fag litik (Tabel 3). Fag litik ditemukan pada titik pengambilan sampel ketiga di sungai Cidepit sedangkan pada sungai Ciparigi ditemukan pada titik pengambilan sampel pertama.
11
Tabel 3 Isolasi fag litik Photobacterium damselae No Lokasi Sampel Titik pengambilan sampel
1 2 3
1 Danau IPB - - -
2 Sungai Cidepit - - +
3 Sungai Ciparigi + - -
- : tidak ada fag litik; + : ada fag litik
Fag yang terdapat didalam sampel ditandai dengan adanya plak. Ada 3 morfologi dan ukuran plak yang berbeda (Gambar 3). Ketiga jenis plak tersebut adalah cloudy plak, turbid plak, dan clear plak. Selanjutnya plak-plak tersebut dimurnikan untuk mendapatkan isolat murni fag litik.
Gambar 3 Morfologi plak; a) cloudy plak, b) turbid plak, c) clear plak
Isolat fag pertama berasal dari sungai Cidepit (F A9) yang memiliki morfologi cloudy plak (samar-samar) dengan diameter 0,3 mm. Plak yang
terbentuk tidak kelihatan jelas. Pada sungai Ciparigi didapatkan dua isolat fag F A91 morfologi plaknya clear (jelas) dengan diameter 3 mm sedangkan F A92
menunjukkan morfologi turbid berdiameter 1 mm. Turbid dan cloudy plak hampir sama namun turbid plak masih kelihatan area lisisnya sel bakteri oleh fag walaupun tidak keseluruhan. Hasil titrasi (PFU mL-1) ketiga isolat fag litik berbeda-beda. Turbid plak memiliki konsentrasi tertinggi yaitu 62 x 106 (PFU mL-1), konsentrasi clear plak 11 x 105 (PFU mL-1), dan konsentrasi cloudy plak hanya 3 x 104 (PFU mL-1) (Tabel 4).
b
a
12
Tabel 4 Karakteristik plak dan konsentrasi (PFU mL-1) fag litik Photobacterium damselae (F A9)
Kisaran Inang Fag
Pengujian kisaran inang fag (Tabel 5) menunjukkan bahwa fag litik F A9 hanya dapat menginfeksi Photobacterium damselae, tetapi tidak dapat menginfeksi Salmonella P38, Salmonella 84, Proteus mirabillis,EPECK 1.1, dan Bacillus pumilus. Ini mengindikasikan bahwa F A9 memiliki kisaran inang sempit (spesifik hanya terhadap Photobacterium damselae).
Tabel 5 Kisaran inang fag litik F A9
Isolat fag litik Bakteri inang*
1 2 3 4 5 6
F A9 - - - - + -
* 1) Salmonella P38, 2) Salmonella 84, 3) EPEC K 1.1, 4) Proteus mirabilis, 5) Photobacterium damselae, 6) Bacillus pumilus; + : terbentuk plak; - : tidak
terbentuk plak.
Pengamatan Morfologi Fag dengan Transmission Electron Microscope
(TEM)
Morfologi fag F A9 dilakukan dengan menggunakan Transmision Electron Microscope (TEM) model JEOL JEM-1010 yang dioperasikan 80kV. Perbesaran yang digunakan adalah 50000 kali menggunakan pewarnaan negatif uranil asetat 2%. Morfologi F A9 menunjukkan kepala berbentuk ikosahedral dan ekor kontraktril (Gambar 4). Ukuran kepala berdiameter 30 nm dan panjang ekor 60 nm. Berdasarkan karakteristik tersebut, menurut International Committee on Taxonomy of Viruses (ICTV) fag F A9 termasuk famili Myoviridae. Famili Myoviridae merupakan famili fag berekor dari ordo Cudovirales. Famili Myoviridae terdiri atas spesies fag terbanyak kedua setelah famili Siphoviridae.
No Lokasi sampel Isolat fag
Karakteristik plak fag litik Konsentrasi fag litik (PFU mL-1) Morfologi
plak
Diameter plak (mm)
1 Sungai Cidepit F A91 cloudy plak 0,3 3 x 104
2 Sungai Ciparigi F A92 clear plak 3 11 x 10
5
13
Gambar 4 Morfologi fag F A9 dengan pewarnaan negatif uranil asetat 2% dan perbesaran 50000 kali :a) kepala; b) ekor kontraktil. Bar: 100 nm
Analisis Berat Molekul Protein Fag
Hasil SDS-PAGE yang diberi pewarna perak menunjukkan dalam suspensi fag F A9 terdapat protein dengan berat molekul yang bervariasi (Sumur ke-3, Gambar 5). Berat molekul protein masing-masing 109.06 kDa, 30.58 kDa, 17.01 kDa, dan 14.96 kDa. Keempat pita protein ini dapat mengindikasikan protein penyusun F A9.
95
17.01
Gambar 5 Profil protein F A9 melalui SDS-PAGE; 1) protein marker, 2) kontrol (Akuabides), 3) F A9
kDa 1 2 3
109.06
30.58
14.96
10 17 28 34 43 55 72
130 180
a
14
Pembahasan
Pewarnaan Gram merupakan tahapan awal dalam identifikasi bakteri berdasarkan karakeristik morfologi selnya. Prinsip dasar pewarnaan Gram adalah adanya pewarna tanding (safranin) dan karakteristik komponen penyusun dinding sel sehingga bakteri dapat dikelompokkan menjadi bakteri Gram positif dan bakteri Gram negatif (Pelczar dan Chan 2005). Photobacterium damselae termasuk bakteri Gram negatif. Hasil uji karakterisasi fisiologis pada API 20E digunakan untuk mengidentifikasi bakteri sampai pada spesies. API 20E biasa digunakan untuk identifikasi bakteri Gram negatif Enterobacteraceae dan bakteri Gram negatif non fermentatif (Shayegani et al. 1978).
Kemampuan untuk melisiskan darah merah (hemolitik) merupakan indikasi patogenisitas suatu bakteri. Pada agar darah Photobacterium damselae menunjukkan aktivitas α-hemolisis (Gambar 2). α-hemolisis merupakan salah satu
faktor virulensi Photobacterium damselae. Berdasarkan hasil penelitian Rivas et al. (2011) strain dari Photobacterium damselae memiliki dua aktivitas
hemolitik yang berbeda yaitu β hemolisis (large hemolytic halo, medium
hemolytic halo, dan small hemolytic halo) dan α-hemolisis (no hemolytic halo).
α-hemolisis ditandai adanya perubahan warna agar darah menjadi hijau keabu-abuan. Perubahan warna agar darah tersebut disebabkan hemoglobin yang terkandung di dalam darah diubah menjadi metahemoglobin. Fe2+ dioksidasi menjadi Fe3+. Ini juga disebabkan Photobacterium damselae memiliki kemampuan untuk mengikat besi (Fe). Osorio et al. (2010) melaporkan 10 gen Photobacterium damselae subspesies damselae yang diisolasi dari manusia mengkode penggunaan heme dan hemoglobin sebagai sumber besi.
Hasil pengujian Photobacterium damselae terhadap antibiotik (Tabel 2) menunjukkan bakteri ini telah resisten terhadap antibiotik yang digunakan. Hasil yang sama juga dilaporkan oleh Zanneti etal. (2001) dan Vaseeharan et al. (2005) bahwa Photobacterium damselae sudah resisten terhadap amoksisilin, ampisilin, tetrasiklin, dan eritromisin, namun Hundenborn et al. (2013) melaporkan ciprofloksasin masih efektif terhadap Photobacterium damselae. Antibiotik yang masih sensitif ini nantinya bisa digunakan sebagai kombinasi bersama fag litik.
Fag litik dapat menjadi alternatif dalam upaya mengatasi resistensi antibiotik bakteri patogen. Fag litik Photobacterium damselae didapatkan dari lingkungan perairan sungai Ciparigi Bogor (Tabel 3). Menurut Ashelford et al. (2003) kepadatan fag pada lingkungan perairan diperkirakan 2.5 x 108 partikel per milliliter. Fag tersebut sangat berperan penting dalam pengaturan kelimpahan dan penyebaran inangnya (Carter dan Saunders 2007). Fag litik Photobacterium damselae tidak ditemukan pada danau IPB mengindikasikan bahwa tidak terdapatnya bakteri ini. Keberadaan fag sangat dipengaruhi keberadaan inang. Melimpahnya populasi inang fag berimplikasi pada melimpahnya fag. Photobacterium damselae merupakan bakteri halofilik. Tidak didapatkannya fag litik pada danau IPB mengindikasikan lingkungan danau tersebut tidak cocok untuk Photobacterium damselae terutama salinitasnya rendah sedangkan salinitas pada sungai lebih tinggi dibandingkan pada danau.
15 yang terbentuk mengindikasikan satu koloni bakteri inang yang lisis oleh virus. Pertumbuhan inang merupakan faktor yang dapat mempengaruhi pembentukan plak dan faktor primer yang mempengaruhi produksi fag (Taj et al. 2013). Pertumbuhan inang yang tidak merata akan mempengaruhi kemampuan infeksi fag dari satu sel ke sel lainnya (Los et al. 2008).
Adsorpsi merupakan tahapan awal untuk infeksi fag ke dalam sel inangnya. Waktu adsorpsi fag berbeda-beda sehingga bisa mempengaruhi pada pembentukkan plak. Penambahan ion Ca2+ atau Mg2+ pada media tumbuh fag tidak hanya menstabilkan koil DNA yang terdapat dalam kapsid dan meningkatkan absorpsi tetapi juga mengatur efisiensi penetrasi DNA fag ke dalam sel bakteri. Setelah absorpsi (DNA diinjeksikan), kation divalen berperan selama translokasi DNA fag melewati membran sel dan menjaga stabilisasi DNA pada tahapan injeksi (Sechaud et al. 1988).
Waktu lisis juga dapat mempengaruhi pembentukan plak. Waktu lisis berkaitan dengan sintesis lisozim (Hadas et al. 1997) sehingga sering
memunculkan morfologi dan ukuran plak yang terbentuk, berbeda-beda (Gallet et al. 2011). Kuo et al. (1966) melaporkan konsentrasi agar juga berperan dalam
pembentukan plak. Konsentrasi agar yang menunjukkan ukuran plak terbesar adalah 0.6 % sampai 0.8 %. Ukuran plak dapat diperbesar dengan penambahan antibiotik dan gliserol pada media tumbuh fag (Santos et al. 2009).
F A91 memiliki morfologi plak cloudy. Plak ini mengindikasikan bahwa
fag tersebut merupakan fag lisogenik. Fag lisogenik sewaktu-waktu akan mengalami tahapan lisis. Lisisnya sel bakteri pada fag lisogenik akan membentuk plak yang tidak jelas (samar-samar). Lisis ini dapat terjadi karena beberapa faktor, diantaranya faktor genetik dan lingkungan (sinar ultraviolet) (Clokie dan Kropinski 2009). Dibandingkan fag litik, fag lisogenik tidak dapat digunakan untuk mengatasi bakteri patogen sehingga F A91 tidak dapat digunakan.
Fag F A92 dan F A93 yang memiliki morfologi clear plak dan turbid plak.
Morfologi plak tersebut mengindikasikan fag yang diisolasi adalah fag litik. Clear dan turbid plak dapat melisiskan sel bakteri. Diindikasikan bahwa F A92 dan F
A93 adalah fag yang identik (F A9).Ini berdasarkan hasil pasase sebanyak 5 kali
menunjukkan adanya perubahan morfologi plak. Clear plak berubah menjadi turbid plak begitu juga sebaliknya. Fenomena tersebut biasa terjadi karena adanya adaptasi fag. Clear plak diameternya lebih besar daripada turbid plak (Tabel 4). Ini mengindikasikan efek lisis clear plak lebih tinggi dibandingkan turbid plak. Fag dengan efek lisis yang tinggi akan menghasilkan konsentrasi titer fag yang lebih rendah. Konsentrasi clear plak (F A92) lebih rendah dibandingkan turbid
plak (F A93) yang memiliki efek lisis lebih rendah (Tabel 4). Konsentrasi titer fag
ditentukan berdasarkan banyaknya plak yang terbentuk (plaque forming unit
(PFU mL-1)) (Tortora et al. 2006).
16
(Tabel 5). Diduga situs penempelan fag F A9 terdapat pada bagian polisakarida Photobacterium damselae sebagai reseptornya.
Kisaran inang berkaitan erat dengan kecocokan pada reseptor. Setiap fag memiliki reseptor yang bervariasi, variasi dari reseptor-reseptor ini yang berperan besar terhadap spesifitas inang fag (Prescott et al. 2002). Reseptor menentukan adsorpsi partikel-partikel fag terhadap sel-sel bakteri pada tahap awal infeksi (Topley dan Wilson 1990). Pada fag berekor protein khusus terdapat pada bagian tail spikes dan serabut ekor. Protein ini menempel pada struktur spesifik pada permukaan luar bakteri inang. Flagelin, asam teikoat, polisakarida kapsular (antigen-K), lipopolisakarida (antigen-O), dan membran protein spesifik yang digunakan sebagai situs penempelan (Thompson et al. 2010).
Morfologi fag seperti bagian kepala (kapsid), ekor, dan asam inti tampak melalui pengamatan menggunakan mikroskop elektron dengan pewarnaan negatif. Pewarna negatif yang biasa digunakan adalah uranil asetat dan phospotungstate. Penggunaan uranil asetat lebih menguntungkan dibandingkan phospotungstate. Selain morfologi tampak lebih jelas, grid fag dapat disimpan dalam waktu puluhan tahun (Clokie dan Kropinski 2009). Fag F A9 memiliki morfologi yang identik dengan famili Myoviridae (Gambar 4). Myoviridae merupakan famili fag berekor kontraktil dengan asam inti terdiri atas DNA utas ganda. Secara morfologi F A9 identik dengan fag T4 yang juga termasuk Myoviridae. Kepala ikosahedral dan ekor T4 terdiri atas selubung kontraktil. Ekor sangat berperan dalam proses
injeksi DNA fag ke dalam sel bakteri inang (Leiman et al. 2010). Ukuran fag F A9 lebih kecil dibandingkan anggota Myoviridae lain yang telah dilaporkan.
Kapsid dan ekor fag terdiri atas protein. Protein-protein tersebut bervariasi dan memiliki fungsi yang berbeda-beda. Fungsi tersebut meliputi perlindungan fag terhadap ketahanannya dilingkungan dan berperan pada proses replikasi sampai menyebabkan lisisnya sel inang. Melalui SDS-PAGE dapat diketahui berat molekul protein pada fag yang bervariasi. Variasi berat molekul protein tersebut mengindikasikan protein-protein penyusun fag.
Belum ada laporan penelitian sebelumnya mengenai berat molekul fag litik Photobacterium damselae. Hasil analisa SDS-PAGE menunjukkan berat molekul protein fag F A9 (Sumur ke-3, Gambar 5) yang bervariasi ini berbeda dengan berat molekul protein penyusun fag lainnya pada famili Myoviridae yang pernah dilaporkan. T4 protein penyusun kapsidnya adalah gp23 dengan berat molekul proteinnya sebesar 43.5 kDa, protein pembungkus ekor (gp18) berat molekul proteinnya 71.20 kDa, dan protein tabung ekor (gp19) dengan berat molekul proteinnya 18. 5 kDa. Anggota fag Myoviridae lainnya seperti P2 dan P4 protein penyusun kapsidnya (gpN) berat molekulnya 36.7 kDa, berat molekul protein pembungkus ekor (gFI) lebih kecil yaitu 43.1 kDa, dan protein tabung ekor (gFII) sebesar 18.9 kDa. Protein penyusun kapsid (gp23) pada fag Mu berat molekulnya 44 kDa, berat molekul protein pembungkus ekor (gp22) 56.9 kDa, dan berat molekul penyusun tabung ekor (Tub) 22.3 kDa. Pada fag P1 protein penyusun kapsidnya (gpT) 33 kDa, protein pembungkus ekor (gpL) 53 kDa, dan protein tabung ekor (gpM) 12.8 kDa (Korol dan Tovkoch 2012).
17 diduga merupakan protein penyusun kapsid dan berat molekul fag F A9 109.06 kDa diduga merupakan protein pembungkus ekor. Dugaan ini juga berdasarkan data kisaran berat molekul penyusun kapsid pada Myoviridae 33 kDa-44 kDa dan kisaran berat molekul protein pembungkus ekor 43 kDa-72 kDa (Korol dan Tovkoch 2012). Meskipun ukuran protein pada F A9 lebih besar dari kisaran berat molekul protein untuk protein pembungkus ekor, diasumsikan juga terdiri atas bagian protein pada lempengan dasar fag F A9.
SIMPULAN DAN SARAN
Simpulan
Fag litik Photobacterium damselae (F A9) didapatkan dari air sungai Ciparigi, Bogor. F A9 termasuk famili Myoviridae yang memiliki morfologi kepala ikosahedral berdiameter 30 nm, ekor kontraktril dengan panjang 60 nm. Hasil analisis SDS-PAGE menunjukkan 4 pita protein dengan berat molekul protein masing-masing 109.06 kDa, 30.58 kDa, 17.01 kDa, dan 14.96 kDa. Keempat pita protein ini dapat mengindikasikan protein-protein penyusun F A9. Kemampuan F A9 melisiskan Photobacterium damselae yang telah resisten terhadap antibiotik dan memiliki spesifitas inang yang tinggi berpotensi untuk dapat dikembangkan sebagai agen biokontrol dan terapi fag.
Saran
Penelitian lebih lanjut perlu dilakukan untuk mengkarakterisasi kestabilan fag litik Photobacterium damselae dan menganalisis protein fag litik Photobacterium damselae yang berperan dalam melisiskan sel bakteri.
DAFTAR PUSTAKA
Abedon ST, Sarah JK, Bob GB, Elizabeth MK. 2011. Phage treatment of human infections. Landes Bioscience. 2:6-85. doi:10.4161/bact.1.2.15845.
Ackermann HW. 2003. Bacteriophage observations and evolution. Res Microbiol. 154:245-251.
Aigbivhalu L, Maraqa N. 2009. Photobacterium damsela wound infection in a14-year- old surfer. J South Med. 102:425–426. doi:10.1097/SMJ.0b013e 31819b9491.
Alvarez JR, Lamba S, Dyer KY, Apuzzio JJ. 2006. An unusual case of urinary tract infection in a pregnant woman with Photobacterium damsela. Infect Dis Obstet Gynecol. 80682:1–3.
18 Salmonella colonization of broiler chickens. Appl Environ Microbiol. 73(14):4543–4549. doi:10.1128/AEM.00049-07.
Austin B, Austin DA. 1993. Vibrionaceae representatives. In: Laird LM, Ed. Bacterial Fish Pathogens. 3rd ed. Ellis Horwood. Chichester Pr. pp.265-294.
Bakopoulos V, Pearson M, Volpatti D, Gousmani L, Adams A, Galeotti M, Dimitriadis GJ. 2003. Investigation of media formulations promoting differential antigen expression by Photobacterium damselae ssp. piscicida and recognition by seabass, Dicentrarchus labrax (L.), immune sera. J Fish Diseases.26:1-13.
Bielke L, Higgins S, Donoghue A, Donoghue D, Hargis BM. 2007. Salmonella host range of bacteriophages that infect multiple genera. Poult Sci.86:2536 -2540.
Bradford MM. 1976. A rapid and sensitive methode for the quantification of
microgram quantities of protein in utilizing the of protein-dye binding. J Anal Biochem. 72:248-254.
Breitbart M, Rohwer F. 2005. Here a virus, there a virus, everywhere the same virus?. Trends in Microbiology. 13:278-284.
Budiarti S, Pratiwi HR, Rusmana I. 2011. Infectivity of lytic phage to
Enteropathogenic Escherichia coli from diarrheal patients in Indonesia. J US-China Med Sci. 8(5):273-282.
Carrillo CL, Atterbury, A.El-Shibiny PL, Connerton E, Dillon, Scott AIF, Connerton. 2005. Phage therapy to reduce Campylobacter jejuni colonization of broiler chickens. Appl Environ Microbiol. 71:6554-6563. doi:10.1128/AEM.71.11.6554–6563.2005.
Carey GVS, Bilington C, Cornelius AJ, Heinemann, JA. 2006. Isolation and characterization of phages infecting Salmonella spp. FEMS Microbiol Lett. 258:182-186. doi:10.1111/j.1574-6968.2006.00217.x.
Carter J, Saunders V. 2007. Virology, Principles and Applications. England (GB): Wiley.
[CLSI] Clinical and Laboratory Standars Institute (US). 2007. Performance Standars for Antimicrobials Suspectibility Testing: Seventeenth- Informational supplement. US. 26(3):1-182.
[CLSI] Clinical and Laboratory Standars Institute (US). 2012. Performance Standars for Antimicrobials Suspectibility Testing: Twenty–Second informational supplement. US. 32(3):1-188.
Clarridge EJ, Zinghelboim-Daum S. 1985. Isolation and characterization of two hemolytic phenotypes of Vibrio damsela associated with a fatal wound infection. J Clin Microbiol. 21(3):302-306.
19 Fouz B, Larsen JL, Nielsen B, Barja JL, Toranzo AE. 1992. Characterization of Vibrio damsela strains isolated from turbot Scophthalmus maximus in Spain. Dis Aquat Organ. 12:155-166.
Fouz B, Toranzo AE, Milán M, Amaro C. 2000. Evidence that water transmits the disease caused by the fish pathogen Photobacterium damselae subsp. damselae. J Appl Microbiol. 88:531-535.
Fraser SL, Purcell BK, Delagdo B, Baker AE, Whelen AC. 1997. Rapidly fatal infection due to Photobacterium (Vibrio) damsela. Clin Infect Dis. 25: 935–936. doi:10.1086/597647.
Gallet R, Kannoly S, Ing NW. 2011. Effects of phage traits on plaque formation. BMC Microbiology. 11:181-185.
Goode G, Allen VM, Barrow PA. 2003. Reduction of experimental Salmonella and Campylobacter contamination of chicken skin by application of lytic phages. Appl Environ Microbiol. 69:5032–5036. doi: 10.1128/AEM.69.8.5032–5036.2003.
Goodell KH, Jordan MR, Graham R, Cassidy C, Nasraway SA. 2004. Rapidly advancing necrotizing fasciitis caused by Photobacterium (Vibrio) damsela: a hyper aggressive variant. Cri Care Med. 32:278–281. doi:10.1097/ 01.CCM.0000104920.01254.82.
Goodridge L, Gallaccio A, Griffiths MW. 2003. Morphological, host range, and genetic characterization of two coliphages. Appl Environ Microbiol. 69:5364–5371.
Grundling A, Manson MD, Young R. 2001. Holins kill without warning. Proc Natl Acad Sci. 98:9348–9352.
Hadas H, Einav M, Fishov I, Zaritsky A. 1999. Bacteriophage T4 development depends on the physiology of its host Escherichia coli. Microbiology. 143: 179–185.
Hansen VM, Rosenquist H, Baggesen DL, Brown S, Christensen BB. 2007. Characterization of Campylobacter phages including analysis of host range by selected Campylobacter Penner serotypes. BMC Microbiology. 7:90–98. Hawke JP. 1996. Importance of siderophore in the pathogenesis and virulence of
Photobacterium damselae subsp piscidia in hybrid-striped bass (Morone saxatalis Morone chrysops). [Dissertation]. Louisiana (US): Louisiana State University.
Hundenborn J, Thurig S, Kommerell S, Haag H, Nolte O. 2013. Severe wound infection with Photobacterium damselae ssp. damselae and Vibrio harveyi, following a laceration injury in marine environment. J Hindawi. 2013:1-7. doi.org/10.1155/2013/610632.
Iswadi. 2012. Efektivitas isolat fage litik Shigella sp. [Tesis]. Bogor (ID): Insitut Pertanian Bogor.
Jado I, Lopez R, Garcia E, Fenoll A, Casal J, Garcia P. 2003. Phage lytic enzymes as therapy for antibiotic-resistant Streptococcus pneumoniae infection in a murine sepsis model. J AntimicrobChemother. 52:967–973.
Jee EH, Gomez DK, Ji HK, Choresca CH, Sang PS, Gun WB, Park SE. 2009. Isolation of Photobacterium damselae subsp. damselae from zebra shark Stegostoma fasciatum. Korean J Vet Res.49(1):35-38.
20
Korol NA, Tovkoch FI. 2012. Identification of the major proteins of the virions of bacteriophage ZF40 Pectobacterium carotovorum. Mikopobion. 74(4):64-69.
Kreger AS. 1984. Cytolytic activity and virulence of Vibrio damsela. Infect immun. 44(2):326-331.
Kuo TT, Huang TC, Yang SE. 1966. Factors influencing the assay of the bacteriophage of Xanthomonas oryzae by plaque count. Bot Bull Acad Sin. 8:30-36.
Lederberg J. 1996. Smaller fleas add in finitum: therapeutic bacteriophage redux. Proc Natl Acad Sci US.93:3167–3168.
Leiman PG, Arisak F, van Raaij MJ, Kostyuchenko VA, Aksyuk AA, Kanamaru S, Rosmann MG. 2010. Morphogenesis of the T4 tail and tail fibers. Virology Journal. 7:355-382.
Love MD, Teebken-Fisher JE, Hose JJ, Farmer III, Hickman FW, Fanning GR. 1981. Vibrio damsela, a marine bacterium, causes skin ulcers on the damselfish Chromis punctipinnis. Science. 214:1139-1140.
Lu TK, Koeris MS. 2011. The next generation of bacteriophage therapy. Current Opinion in Microbiology.14:524–531.
Los JM, Golec P, Wegrzyn G, Wegrzyn A, Łos M. 2008. Simple method for
plating Escherichia coli bacteriophages forming very small plaques or no plaques under standard conditions. Appl Environ Microbiol.74:5113–5120. Madigan MT, Martinko JM, Jack P. 2012. Brock Biology of Microorganisms.
Thirteen edition. New Jersey (US): Prentice Hall.
Magarinos B, Romalde JL, Bandin I, Fouz B, Toranzo AE. 1992. Phenotypic, antigenic, and molecular characterization of Pasteurella piscida strains isolated from fish. Appl Environ Microbiol. 58:3316–3322.
Magarinos B, Toranzo AE, Romalde JL. 1996. Phenotypic and pathobiological characteristics of Pasteurella piscicida. Annu Rev Fish Dis. 6:41–64.
McLaughlin MR, Balaa MF, Sims J, King R. 2006. Isolation of Salmonella phages from swine effluent lagoons. J Environ Qual. 35:522-528.
Merril CR, Biswas B, Carlton R, Jensen NC, Creed GJ, Zullo S, Adhya S. 1996. Long-circulating phage as antibacterial agents. Proc Natl Acad. Sci.USA. 93:3188-3192.
Ochman H, Selander RK. 1984. Standard reference strains of Escherichia coli from natural populations. J Bacteriol.157:690-693.
O’Flynn G, Ross RP, Fitzgerald GF, Coffey A. 2004. Evaluation of a cocktail of three bacteriofages for biocontrol of Escherichia coli O157:H7. Appl Environ Microbiol. 70:3417-3424.doi:10.1128/AEM.70.6.3417–3424.2004. Osorio CR, Romalde JL, Barja JL, Toranzo AE. 2000. Presence of
phospholipase-D (dly) gene coding for damselysin production is not aprerequisite for pathogenicity in Photobacterium damselae subsp. damselae. Microb Pathog. 28:119– 126.doi:10.1006/mpat.1999.0330.
Park SC, Nakai T. 2003. Bacteriopahge control of Pseudomonas plecoglossicida infection in Plecoglossus altivelis. Dis Aquat Organ.53:33-39.
21 Perez-Tirse J, Levine JF, Mecca M. 1993. Vibrio damsela cause of fulminant septicemia. Arch Intern Med. 153:1838–1840.doi: 10.1001/archinte.1993.004101501 28012.
Pitt TL, Gaston MA. 1995. Bacteriophage typing. Methods in Molecular Biology. 46:15-26. isolates of Photobacterium damselae: existence of hutA pseudo-genes. Arch Microbiol.183:347–358. doi: 10.1007/s00203-005-0779-4.
Rivas AJ, Balado M, Lemos LM, Osorio CR. 2011. The Photobacterium damselae subsp. damselae hemolysins damselysin and HlyA are encoded within a new virulence plasmid. Infect Immun. 79(11):4617-4627. bacteriophage therapy How delivery routes, formulation, concentration and timing influence the success of phage therapy. J Pharmacy and Pharmacology.63:1253–1264.
Santos SB, Carvalho CM, Sillankorva S, Nicolau A, Ferreira EC, Azeredo J. 2009. The use of antibiotics to improve phage detection and enumeration by the double-layer agar technique. BMC Microbiology. 9:148.doi: 10.1186/1471-2180-9-148.
Sartika D. 2012. Efektivitas dan Keamanan In Vivo Fag Litik FR38 dari Limbah Domestik dalam Menurunkan Cemaran Salmonella P38 Indigenous pada Sosis, Susu, dan Air. [Disertasi]. Bogor (ID): Insitut Pertanian Bogor. Schuch R, Nelson D, Fischetti VA. 2002. A bacteriolytic agent that detects and
kills Bacillus anthracis. Nature. 418:884–889. doi:10.1038/nature01026. Sechaud L, Cluzel PJ, Rousseau M, Baumgartner A, Accolas JP. 1988.
Bacteriophages of Lactobacilli. Biochimie.70:401–410.
Shayegani M, Maupin PS, McGlynn DM. 1978. Evaluation of the API 20E system for identification of nonfermentative Gram-negative bacteria. J Clin Microbiol. 7:539-545.
22
Strauch E, Kaspar H, Schaudinn C, Dersch P, Madela K, Gewinner, Hertwig S, Wecke J, Appel B. 2001. Characterization of enterocoliticin, a fage tail-like bacteriocin, and its effect on pathogenic Yersinia enterocolitica strains. Appl Environ Microbiol.67:5634-5642. doi: 10.1128/AEM.67.12.5634-5642.2001. Taj MK, Xiu LJ, Taj I, Hassan TM, Samreen Z, Yunlin W. 2013. Different phase Esherichia coli effect on T4 bacteriophages lysis and production. IJANS. 2:73-76.
Tang WM, Wong JWK. 1999. Necrotizing fasciitis caused by Vibrio damsela. Orthopedics.22:443–444.
Thompson, JE. 2010. The K5 lyase KflA combines a viral tail spike structure with a bacterial polysaccharide lyase mechanism. J Biol Chem. 285(31): 23963-23969.
Topley WWC, Wilson GS. 1990. Principles of Bacteriology, Virology and Immunity. London (GB). B.C. Decker.
Tortora GJ, Funke BR, Case CL. 2006. Microbiology: an Introduction. ninth edition. New York (US): Benjamin Cummings.
Travis J. 2010. Al World’S A Phage viruses that eat bacteria abound-and surprise.
Science News. 164(2):26-28.
Vaseeharan B, Ramasamy P, Murugan T, Chen JC. 2005. In vitro susceptibility of antibiotics against Vibrio spp. and Aeromonas spp. isolated from Penaeus monodon hatcheries and ponds. Int J Antimicrob Agents. 26:285-291.doi:10.1016/j.ijantimicag.2005.07.005.
Viazis S, Akhtar M, Feirtag J, Brabban AD, Diez-Gonzalez F. 2010. Isolation and characterization of lytic bacteriophages against enterohaemorhagic Escherichia coli. J Appl Microbiol.110:1323-1331.
Yamane K, Asato J, Kawade N, Takahashi H, Kimura B, ArakawaY. 2004. Two cases of fatal necrotizing fasciitis caused by Photobacterium damsela in Japan. J Clin Microbiol. 42:1370-1372. doi: 10.1128/JCM.42.3.1370-1372. 2004.
Yang H, Li L, Shiru J, Shuaxiang L. 2010. Isolation and characterization of a virulent phage AB1 of Acinetobacter baumannii. BMC Microbiology.10:131. doi:10.1186/1471-2180-10-131140.
Yuen KY, Ma L, Wong SSY, Ngi WF. 1993. Fatal necrotizing fasciitis due to Vibrio damsela. Scand J Infect Dis. 25:659–661. doi:10.3109/0036554930900 8557.
23
LAMPIRAN
Lampiran 1 Komposisi bufer Saline Magnesium (SM)
Lampiran 2 Prosedur pewarnaan silver stain dan komposisi larutan yang digunakan
Gel diendapkan ke dalam larutan fiksasi selama 2 jam Gel dicuci dengan lautan washing solution selama 2 detik
Bilas dengan ddH2O selama 10 menit
Gel direndam dalam larutan sensitif selama 1 menit Bilas dengan ddH2O selama 20 detik
Gel diinkubasi ke dalam kulkan dengan penambahan 0,1% AgNO3
Selama 20 detik
Bilas dengan ddH2O selama 30 menit
Dibilas dengan larutan developing sampai pewarnaan cukup Tambahkan stop solution selama 5 detik
Bilas dengan ddH2O selama 5 detik
No Jenis Bahan Jumlah
1 NaCl 5,8 g
2 MgSO4.7H2O 2 g
3 Tris-Cl 50 ml
4 Gelatin 5 ml
24
RIWAYAT HIDUP
Penulis dilahirkan di Palembang 5 November 1987 sebagai anak pertama dari dua bersaudara pasangan Imron (alm) dan Yusro SPd PGSD. Pendidikan sarjana ditempuh di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sriwijaya, lulus tahun 2009. Pada tahun 2012, penulis mendapatkan Beasiswa Unggulan Dikti untuk melanjutkan studi di ProGram Studi Mikrobiologi pada ProGram Pascasarjana IPB. Hasil penelitian ini
dengan judul “Lytic bacteriophage for Photobacterium damselae isolated from
water environment” telah diterbitkan dalam jurnal International Journal of