IDENTIFIKASI PERBEDAAN GENETIK DAN KANDUNGAN
SENYAWA MINYAK ATSIRI DARI KAPULAGA (Amomum
cardamomum) MERAH DAN PUTIH
VADIA KARTIKA RIENDYANI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Identifikasi Perbedaan Genetik dan Kandungan Senyawa Minyak Atsiri dari Kapulaga (Amomum cardamomum) Merah dan Putih adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
VADIA KARTIKA RIENDYANI. Identifikasi Perbedaan Genetik dan Kandungan Senyawa Minyak Atsiri dari Kapulaga (Amomum cardamomum) Merah dan Putih. Dibimbing oleh DJAROT SASONGKO HAMI SENO dan EDY DJAUHARI PURWAKUSUMAH.
Informasi genetik dari tanaman kapulaga merah dan putih dapat dikembangkan untuk mendapatkan bibit unggul sebagai obat. Tujuan penelitian ini adalah mengidentifikasi perbedaan kapulaga lokal berbuah merah dan putih. Identifikasi dilakukan secara genetik melalui teknik RAPD-PCR. Perbedaan kandungan senyawa pada kedua jenis kapulaga dilakukan dengan analisis FTIR dan GCMS terhadap kandungan minyak atsirinya. Hasil RAPD menunjukkan kedua kapulaga memiliki perbedaan bobot molekul dan bersifat polimorfik karena menunjukkan keragaman fragmen pita DNA. Isolasi minyak atsiri kapulaga merah memiliki rendemen yang lebih besar (0.28%) daripada kapulaga putih (0.20%). Hasil FTIR menunjukkan bahwa kedua tanaman kapulaga terdapat pada spektrum IR dalam rentang bilangan gelombang yang sama, sehingga dapat dikatakan bahwa FTIR tidak dapat mengidentifikasi perbedaan kapulaga merah dan putih. GCMS mengidentifikasi adanya perbedaan antara kapulaga merah dan putih. Hasil GCMS menunjukkan adanya 17 senyawa yang hanya dimiliki oleh kapulaga merah dan 12 senyawa yang hanya dimiliki oleh kapulaga putih.
Kata kunci: FTIR, GCMS, Minyak atsiri kapulaga, RAPD-PCR
ABSTRACT
VADIA KARTIKA RIENDYANI. Identification the Differences of Genetic dan the Compounds of Essential Oil Content between Cardamom (Amomum cardamomum) Red and White. Supervised by DJAROT SASONGKO HAMI SENO and EDY DJAUHARI PURWAKUSUMAH.
The genetic information of red and white cardamom can be developed to get the seeds as a medicine. The purpose of this study is to identify the differences in red and white cardamom. The differences matter in both types of cardamom are done by analysis of FTIR and GCMS of the essential oil content. RAPD results showed both cardamom have different molecular weights and they are polymorphic because it shows the diversity the fragments of DNA bands. Isolation of red cardamom essential oil has a greater yield (0.28%) than white cardamom (0.20%). FTIR results showed that both the cardamom plants found in the IR spectrum in the same range of wave numbers, so FTIR can not identify differences in red and white cardamom. GCMS to identify the difference between red and white cardamom. GCMS results indicate the presence of 17 compounds which only the red cardamom and 12 compounds were only owned by white cardamom.
IDENTIFIKASI PERBEDAAN GENETIK DAN KANDUNGAN
SENYAWA MINYAK ATSIRI DARI KAPULAGA (Amomum
cardamomum) MERAH DAN PUTIH
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
VADIA KARTIKA RIENDYANI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Identifikasi Perbedaan Genetik dan Kandungan Senyawa Minyak Atsiri dari Kapulaga (Amomum cardamomum) Merah dan Putih
Nama : Vadia Kartika Riendyani NIM : G84090002
Disetujui oleh
Dr Djarot Sasongko HS, MS Pembimbing I
Drs Edy Djauhari PK, MSi Pembimbing II
Diketahui oleh
Dr Ir I Made Artika, MAppSc Ketua Departemen
PRAKATA
Puji syukur penulis ucapkan kepada Allah SWT atas segala nikmat dan karunia-Nya, sehingga penulis dapat menyelesaikan karya ilmiah ini. Karya
ilmiah yang berjudul “Identifikasi Perbedaan Genetik dan Kandungan Minyak Atisiri dari Kapulaga (Amomum cardamomum) Merah dan Putih” ini telah dilakukan sejak bulan April hingga Desember 2013.
Ucapan terima kasih penulis sampaikan kepada Dr Djarot Sasongko Hami Seno, MS dan Drs Edy Djauhari Purwakusumah, MSi selaku pembimbing. Terima kasih penulis ucapkan kepada Dr Laksmi Ambarsari, MS dan Popi Asri Kurniatin SApt, MSi dalam memberikan ilmu, saran, serta arahannya dalam penyelesaian penelitian ini. Terima kasih kepada pihak laboratorium penelitian Biokimia IPB, pihak laboratorium Biologi Molekuler BB-Biogen, pihak Laboratorium Terpadu Departemen Biologi IPB, pihak Laboratorium Genetika Molekuler Fakultas Peternakan IPB, pihak Pusat Studi Biofarmaka, pihak kebun Biofarmaka IPB, pihak MABES POLRI, dan pihak laboratorium Genetika Molekuler Fakultas Pertanian IPB atas peran, bantuan, kerja sama, kritik, dan sarannya dalam penelitian ini
Terima kasih penulis ucapkan kepada ayah, ibu, serta seluruh keluarga, atas segala doa, bantuan, semangat, dan kasih sayangnya. Terima kasih kepada Azra Zahrah Nadhirah Ikhwani selaku rekan dalam pelaksanaan penelitian ini serta teman-teman dari Biokimia yang telah membantu penulis dalam menyelesaikan penelitian. Terima kasih juga penulis ucapkan kepada komunitas Milanisti Indonesia Bogor dan Pusat atas saran dan bantuannya dalam penyelesaian penelitian dan skripsi ini.
Penulis menyadari masih terdapat kekurangan dalam penulisan karya ilmiah ini. Oleh karena itu, saran serta kritik yang membangun sangat penulis harapkan demi perbaikan di kemudian hari. Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
PENDAHULUAN 1
METODE 1
Bahan 2
Alat 3
Prosedur Analisis Data 3
HASIL 5
PEMBAHASAN 10
SIMPULAN DAN SARAN 15
Simpulan 15
Saran 16
DAFTAR PUSTAKA 16
LAMPIRAN 19
DAFTAR TABEL
1. Uji kuantitas DNA kapulaga merah dan kapulaga putih 6 2. Senyawa khas pada kapulaga merah dan kapulaga putih 9
DAFTAR GAMBAR
1. Tanaman kapulaga 1
2. Elektroforegram hasil kualitatif DNA kapulaga merah dan putih 6 2. Elektroforegram hasil RAPD-PCR kapulaga merah dan putih 7 3. Spektrum FTIR kapulaga merah dan kapulaga putih 8 4. Spektrogram GC senyawa utama pada minyak atsiri kapulaga merah dan putih 10
DAFTAR LAMPIRAN
1. Diagram Alir Penelitian 192. Sekuens Primer yang Digunakan pada RAPD-PCR 19
3. Hasil Perhitungan Rendemen Kapulaga Merah dan Putih 20
4. Spektrum Massa Kapulaga Merah 21
5. Spektrum Massa Kapulaga Putih 21
6. Hasil GCMS Senyawa pada Kapulaga Merah 22
PENDAHULUAN
Indonesia memiliki berbagai jenis tanaman yang dapat dibudidayakan sebagai bahan baku obat yang tersebar di berbagai daerah, namun belum dapat dimanfaatkan secara optimal. Menurut Badan Penelitian dan Pengembangan Kehutanan tahun 2007, di hutan Indonesia terdapat lebih dari 1200 jenis tanaman obat-obatan, namun hanya sekitar 180 jenis tanaman obat yang dikembangkan untuk bahan baku dalam industri obat-obatan atau farmasi. Salah satu tanaman yang dapat dibudidayakan karena berpotensi sebagai tanaman obat adalah kapulaga (Prasetyo 2009).
Tanaman kapulaga yang dibudidayakan di Indonesia adalah jenis tanaman kapulaga lokal (Amomum cardamomum) dan kapulaga sabrang (Elettaria cardamomum) yang berasal dari India. Keduanya termasuk ke dalam suku jahe-jahean atau Zingiberaceae (Suryadinata 2008). Kapulaga merupakan tanaman herbal yang membentuk rumpun, seperti jahe dan dapat mencapai ketinggian 1-5 meter. Kapulaga tumbuh bergerombol, membentuk banyak anakan. Batangnya semu yang tersusun oleh pelepah daun, berbentuk silindris, dan berwarna hijau. Daunnya tunggal, tersebar, pertulangan daunnya menyirip, dan letak daunnya berseling (Prasetyo 2009). Buah kapulaga lokal tersusun rapat burupa tandan yang terdiri atas 5-18 buah setiap tandan, berbentuk bulat, beruang tiga, setiap buah terdapat 14-16 biji. Ukuran dan warna kulit buah berbeda menurut jenisnya. Kapulaga merah kulit buah berwarna putih kemerahaan, sedangkan kapulaga putih buahnya berbulu halus (Suryadinata 2008).
Kapulaga selama ini dikenal sebagai rempah untuk masakan dan juga lebih banyak digunakan untuk campuran jamu (Nasution 2013). Kapulaga memiliki banyak manfaat khususnya sebagai bahan obat-obatan (Agusta 2000; Sastrohamidjojo 2002). Tanaman kapulaga mengandung minyak atsiri yang dapat digunakan untuk mengobati berbagai penyakit, seperti batuk, radang tenggorokan, sakit perut, rematik, penurun panas, dan penambah stamina (Babu 2012). Kapulaga dapat digunakan sebagai afrodisiaka, yaitu untuk meningkatkan libido dan mengobati impotensi (Prasetyo 2004). Selain itu kapulaga dapat digunakan untuk mencegah tulang keropos, khususnya wanita (Fachriyah 2007).
Gambar 1 Tanaman kapulaga a) kapulaga putih; b) kapulaga merah; c) buah kapulaga putih; d) buah kapulaga merah
a b
c
2
Perbedaan antara tanaman kapulaga merah dan putih secara genetik dapat dilakukan dengan menggunakan teknik marka molekuler RAPD (Random Amplified Polymorphic DNA), yaitu marka berbasis DNA menggunakan prinsip kerja mesin Polymerase Chain Reaction (PCR) yang mampu mengamplifikasi sekuen DNA tertentu secara in vitro (Pharmawati 2009). Teknik RAPD memiliki beberapa keunggulan, yaitu relatif sederhana, tidak membutuhkan latar belakang pengetahuan mengenai genom yang akan dianalisis (Pinarka 2009), dan cocok digunakan untuk sampel yang banyak (Indah 2008). Teknik RAPD cukup menggunakan primer acak dan pengerjaannya relatif cepat (Septimayani 2002).
Minyak atsiri merupakan salah satu hasil metabolisme tanaman. Isolasi minyak atsiri dari bahan alam seperti buah kapulaga dilakukan melalui destilasi uap (Sudjadi 2008). Komponen minyak atsiri dapat dianalisis melalui analisis GCMS untuk mengetahui komposisi minyak atsirinya. Kelebihan analisis ini adalah sensitivitas dan efisiensi pemisahannya tinggi, dapat digunakan untuk menganalisis komponen volatil, serta tidak memerlukan standar eksternal (Prasetya 2006). Analisis spektroskopi FTIR dilakukan untuk melihat perbedaan gugus yang ada di antara dua sampel (Ammawath 2010). Metode ini banyak digunakan karena cepat, relatif murah, dan dapat digunakan untuk mengidentifikasi gugus fungsional dalam suatu senyawa (Kopka 2006; Marwati 2007).
Penelitian mengenai kapulaga lokal Selama ini hanya berkisar pada kandungan minyak atsiri kapulaga lokal secara umum saja. Penelitian mengenai informasi genetika tanaman kapulaga lokal dengan buah berwarna merah dan putih belum pernah dilakukan. Berdasarkan penelitian Fachriyah 2007, minyak atsiri kapulaga lokal secara umum memiliki kandungan utama yaitu 1.8sineol, -pinena, α-pinena, α-terpineol, dan humulen, namun kandungan minyak atsiri kapulaga merah dan putih belum diidentifikasi sebelumnya. Perbedaan fenotipe yang terlihat antara kapulaga merah dan putih dapat dijadikan acuan dalam melakukan penelitian ini untuk mengidentifikasi perbedaan antara kedua kapulaga terhadap DNA dan minyak atsirinya.
Penelitian ini bertujuan untuk mengidentifikasi perbedaan tanaman kapulaga lokal merah dan putih dari Desa Pamijahan, Leuwiliang, Kabupaten Bogor dan ditanam kembali di Kebun Cikabayan Biofarmaka IPB secara genetik dan perbedaan kandungan minyak atsirinya. Penelitian ini bermafaat untuk membandingkan kapulaga merah dan putih baik dari genetik maupun kandungan minyak atsirinya sehingga dapat dimanfaatkan sebagai tanaman obat.
METODE
Bahan
3 adalah agarosa, bufer TBE 0.5×, EtBr, loading dye 6×, dan marker 1 kb plus DNA ladder. Bahan untuk PCR adalah buffer complete 10×, dNTPs, Taq DNA polimerase, dan primer OPA. Bahan yang digunakan untuk isolasi minyak atsiri kapulaga adalah air, buah kapulaga, dan petroleum eter. Bahan yang digunakan untuk uji kandungan minyak atsiri adalah pelat KBr dan minyak atsiri kapulaga.
Alat
Alat yang digunakan untuk isolasi DNA hingga visualisasi DNA adalah mortar, tube Eppendorf, tabung sentrifus, sentrifus Beckman Coulter AllegraTM 64R Centrifuge, pH meter, penangas air, pipet mikro, pipet Mohr, bulp, sudip, inkubator, tabung mikro, kertas saring, neraca analitik Scaltec, spektrofotometer nanodrop, perangkat elektroforesis, parafilm, alat untuk dokumentasi hasil pengamatan elektroforesis UV (AlphaImager EP). gelas piala, coler box, sumpit, labu Erlenmeyer, freezer, gelas ukur. Alat yang digunakan untuk identifikasi kandungan senyawa minyak atsiri kapulaga adalah botol kecil, perangkat destilasi uap, perangkat FTIR, dan perangkat GCMS.
Prosedur Penelitian Isolasi DNA (Doyle & Doyle 1990)
Sebanyak 200 mg sampel (daun) digerus bersama nitrogen cair hingga terbentuk serbuk kering. Serbuk dimasukkan ke dalam tabung Eppendorf 2 mL dan ditambahkan 0.75 mL bufer CTAB (4% b/v CTAB, 1.4 M NaCl, 50 mM EDTA, 100 mM Tris-HCl pH 8.0, 1% v/v -merkaptoetanol, akuades steril). Tube yang telah berisi sampel dan bufer tersebut diinkubasi pada suhu 60 oC selama 1 jam. Selanjutnya ke dalam tube ditambahkan 0.75 mL kloroform isoamilalkohol (CI) dengan volume 24:1. Campuran tersebut disentrifus dengan kecepatan 10000 rpm, suhu 4 oC selama 20 menit. Supernatan yang didapatkan ditambah C:I sebanyak 0.75 mL dan disentrifus dengan kondisi sama. Supernatan dipindahkan ke dalam tube Eppendorf 1.5 mL, kemudian ditambah dengan 0.75 mL isopropanol dan disentrifus pada kecepatan 10000 rpm, suhu 4 oC selama 10 menit. Pelet yang didapatkan dicuci dengan etanol 70%. Etanol 70% dibuang dan pelet dikeringanginkan selanjutnya disuspensikan dengan bufer TE (10 mM Tris-HCl pH 8.0 dan 0.1 mM EDTA). Sampel disimpan pada -20 oC sebagai stok DNA.
Uji Kualitas DNA (Sambrook and Russel 2001)
Gel agarosa 1% untuk elektroforesis dibuat dengan dilarutkannya agarosa 0.25 g dalam 25 mL larutan TBE 0.5×. Kemudian dipanaskan hingga larut dan
didinginkan pada suhu kamar hingga hangat. Selanjutnya ditambahkan 5 μL EtBr
4
Uji Kuantitas DNA (Desjardins & Conklin 2010)
Hasil isolasi DNA tanaman kapulaga selanjutnya dilakukan kuantifikasi untuk melihat konsentrasi dan kemurniannya menggunakan spektrofotometer nanodrop pada panjang gelombang 260 nm dan 280 nm. Kemurnian DNA ditetapkan berdasarkan nilai perbandingan A260/A280 dengan satuan ng/μL. Pengukuran pada panjang gelombang 280 nm dilakukan untuk mengetahui adanya kontaminasi protein, sedangkan pada panjang gelombang 230 nm untuk mengetahui kontaminasi polisakarida dan fenol. Lubang optik dibersihkan terlebih dahulu dengan tisu. Blanko yang digunakan adalah larutan TE. Selanjutnya sebanyak 2 µL larutan TE dimasukkan ke dalam lubang optik. Setelah itu lubang optik dibersihkan kembali sebelum sampel dimasukkan. Sebanyak 2 µL sampel DNA dimasukkan ke dalam lubang optik. hasil ditampilkan di layar komputer.
Amplifikasi DNA dengan RAPD-PCR (Williams 1990)
Pembuatan mix PCR dilakukan pada tube PCR 0.2 mL dengan komposisi
antara lain β μL buffer complete 10×, β μL dNTPs 10 mM, 1γ.075 μL MW, β μL
sampel DNA (50 ng), 0.1β5 μL Taq DNA polimerase, dan 0.8 μL primer acak
RAPD 10 μM sehingga volume total menjadi β0 μL. Primer yang digunakan adaa primer OPA 11-15. Campuran tersebut kemudian dihomogenisasi dengan diketuk-ketuk selama beberapa saat kemudian dimasukkan ke dalam mesin PCR. Program suhu yang digunakan pada PCR terdiri atas dua tahap siklus. Tahap pertama berlangsung selama satu kali siklus dengan suhu 92°C selama 2 menit untuk denaturasi awal, 92°C selama 3 menit 30 detik untuk penyempurnaan proses denaturasi DNA, 35°C selama 1 menit untuk penempelan primer, dan 7 menit untuk tahapan perpanjangan rantai. Program suhu yang digunakan pada siklus berikutnya adalah 92°C selama 1 menit untuk denaturasi DNA, 35°C selama 1 menit untuk penempelan primer, 72°C selama 2 menit untuk tahapan perpanjangan rantai hingga sebanyak 44 kali siklus, serta 72°C selama 7 menit terakhir untuk memastikan DNA yang diamplifikasi terdenaturasi seluruhnya.
Elektroforesis Hasil Amplifikasi (Sambrook 2001)
Elektroforesis hasil amplifikasi dilakukan menggunakan gel agarosa 1.5%. Sebelum dilakukan elektroforesis, hasil amplifikasi dicampurkan dengan loading buffer terlebih dahulu dengan perbandingan 1:5. Marker yang digunakan adalah 100 bp plus DNA ladder sebanyak 1 µL. Elektroforesis dialiri tegangan listrik 80 volt selama 90 menit. Hasil elektroforesis diamati dengan bantuan lampu UV dalam transluminator. Hasil amplifikasi dilihat dengan membandingkan ukuran pita yang muncul pada lajur pertama (kapulaga merah) dan kedua (kapulaga putih) dengan marker. Perbedaan pita yang muncul menandakan bahwa kedua kapulaga tersebut memunculkan perbedaan genetik.
Isolasi Minyak Atsiri Kapulaga (Fachriah 2007)
5 minyak atsiri tanaman kapulaga yang didapat dari destilasi dengan 250 gram buah kapulaga.
Uji Kandungan Senyawa berdasarkan Gugus Fungsi dengan FTIR (Mark 1996)
Minyak atsiri yang diperoleh dari proses destilasi uap dianalisis menggunakan FTIR untuk mengetahui senyawa-senyawa yang terkandung di dalamnya berdasarkan perbedaan gugus fungsinya. Sebanyak 0.02 mL sampel dimasukkan ke dalam wadah sampel FTIR lalu dicampurkan dengan 200 mg KBr untuk dijadikan pelet. Sampel kemudian dimasukkan ke dalam wadah FTIR lalu dibuat menjadi pelet dengan menggunakan handpress. Hasilnya lalu diamati melalui pola yang muncul pada program komputer. Hasil FTIR dibaca dengan membandingkan spektrum yang muncul dengan rentang spektrum gugus fungsi yang ada pada literatur.
Uji Kandungan Senyawa Minyak Atsiri Kapulaga dengan GCMS (Mark 1996)
Minyak atsiri yang diperoleh dari proses destilasi uap dianalisis menggunakan GCMS kromatografi gas GC-17A (Shimadzu) yang ditandem dengan spektrometer massa MS QP 5050A. Sebanyak 0.4 µL minyak atsiri kapulaga merah dan putih dinjeksikan ke injection system dan melewati kolom Agilent 19091S-436 HP-5MS silika 60 m x 0.25mm x 0.25µm), Suhu kolom 150 o
C-330 oC, suhu awal sebesar 250 oC, pembawa gas helium, tekanan 24.14 psi, split ratio 100:1, total flow 101.4 mL/menit, dan waktu running selama 30 menit.
Komponen dibaca pada detektor dan direkam dalam recorder sehingga didapatkan pembacaan berupa peak area yang menunjukkan persentase area dari komponen yang dianalisis. Masing-masing puncak dari hasil kromatografi dilihat spektrum massanya lalu dianalisis kandungan senyawanya dengan cara membandingkan spektrum tersebut dengan pustaka senyawa beserta gugusnya yang ada pada program GCMS Data Analysis Agilent Technology. Senyawa teridentifikasi dengan melihat persen kemiripan senyawa tersebut dengan pustaka senyawa pada program GCMS jika persentase kemiripannya di atas 90%.
HASIL
Kualitas DNA Kapulaga Lokal Merah dan Putih
6
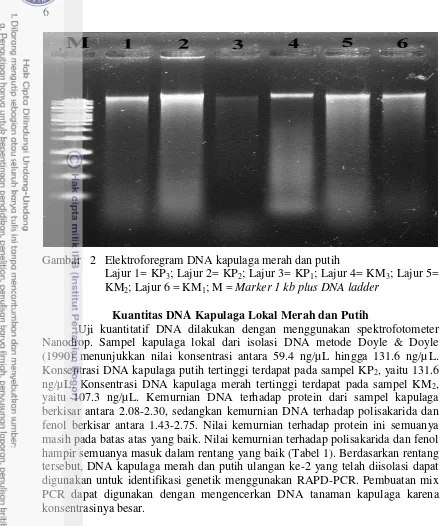
Gambar 2 Elektroforegram DNA kapulaga merah dan putih
Lajur 1= KP3; Lajur 2= KP2; Lajur 3= KP1; Lajur 4= KM3; Lajur 5= KM2; Lajur 6 = KM1; M = Marker 1 kb plus DNA ladder
Kuantitas DNA Kapulaga Lokal Merah dan Putih
Uji kuantitatif DNA dilakukan dengan menggunakan spektrofotometer Nanodrop. Sampel kapulaga lokal dari isolasi DNA metode Doyle & Doyle (1990) menunjukkan nilai konsentrasi antara 59.4 ng/µL hingga 131.6 ng/µL. Konsentrasi DNA kapulaga putih tertinggi terdapat pada sampel KP2, yaitu 131.6 ng/µL. Konsentrasi DNA kapulaga merah tertinggi terdapat pada sampel KM2, yaitu 107.3 ng/µL. Kemurnian DNA terhadap protein dari sampel kapulaga berkisar antara 2.08-2.30, sedangkan kemurnian DNA terhadap polisakarida dan fenol berkisar antara 1.43-2.75. Nilai kemurnian terhadap protein ini semuanya masih pada batas atas yang baik. Nilai kemurnian terhadap polisakarida dan fenol hampir semuanya masuk dalam rentang yang baik (Tabel 1). Berdasarkan rentang tersebut, DNA kapulaga merah dan putih ulangan ke-2 yang telah diisolasi dapat digunakan untuk identifikasi genetik menggunakan RAPD-PCR. Pembuatan mix PCR dapat digunakan dengan mengencerkan DNA tanaman kapulaga karena konsentrasinya besar.
Tabel 1 Uji kuantitas DNA kapulaga merah dan putih Sampel Konsentrasi DNA
(ng/µl) A260 A280 A(260/280) A(260/230)
KP 1 65.8 1.316 0.595 2.21 2.75
KP 2 131.6 2.631 1.264 2.08 2.11
KP 3 69.3 1.386 0.650 2.13 1.93
KM 1 59.4 1.188 0.546 2.18 1.80
KM 2 107.3 2.147 1.011 2.12 1.80
KM 3 60.9 1.218 0.530 2.30 1.43
a
P: Putih; M: Merah b
7
Amplifikasi DNA dengan RAPD-PCR (Polymerase Chain Reaction)
Proses amplifikasi DNA dilakukan dengan proses RAPD-PCR. Teknik ini menggunakan primer acak yang nukleotidanya hanya berkisar 10 basa. Primer yang digunakan adalah OPA 11-15. Lajur 1 menunjukkan 5 pita DNA yang teridentifikasi dengan bobot molekul 1.400 bp, 1.100 bp, 1.000 bp, 700 bp, dan 600 bp. Lajur 2 menunjukkan 6 pita yang teridentifikasi dengan bobot molekul 1.700 bp, 1.300 bp, 1.100 bp, 1.000 bp, 900 bp, dan 400 bp. Lajur 3 menunjukkan 7 pita yang teridentifikasi dengan bobot molekul 1.700 bp, 1.300 bp, 1.200 bp, 1.000 bp, 700 bp, 600 bp, dan 390 bp. Lajur 4 menunjukkan 5 pita yang teridentifikasi dengan bobot molekul 1.250 bp, 1.100 bp, 1.150 bp, 900 bp, dan 650 bp. Lajur 5 menunjukkan 4 pita yang teridentifikasi dengan bobot molekul 1.650 bp, 1.200 bp, 1.000 bp, dan 700 bp. Lajur 6 menunjukkan 4 pita yang teridentifikasi dengan bobot 1.150 bp, 1.000 bp, 800 bp, dan 650 bp. Lajur 7 menunjukkan 6 pita yang teridentifikasi dengan bobot molekul 1.650 bp, 1.250 bp, 1.150 bp, 1.000 bp, 850 bp, dan 550 bp. Lajur 8 menunjukkan 3 pita yang teridentifikasi dengan bobot molekul 1.600 bp, 1.000 bp, dan 650 bp. Lajur 9 menunjukkan 4 pita yang teridentifikasi dengan bobot molekul 1.650 bp, 1.100 bp, 800 bp, dan 700 bp . Lajur 10 menunjukkan 3 pita yang teridentifikasi dengan bobot molekul 1.550 bp, 1.350 bp, dan 875 bp.
Pita DNA yang teridentifikasi pada kapulaga merah adalah 26 pita sedangkan yang teridentifikasi pada kapulaga putih adalah 21 pita (Gambar 2). Hasil amplifikasi DNA dengan primer OPA 11-15 menunjukkan bahwa antara kapulaga merah dan putih memiliki perbedaan jumlah pita dan perbedaan bobot molekul. Perbedaan jumlah pita pada masing-masing jalur dengan bobot molekul berbeda menyebabkan kapulaga merah dan putih bersifat polimorfik.
Gambar 3 Elektroforegram RAPD-PCR kapulaga merah dan putih a)
Lajur 1, 3, 5, 7, 9 = sampel KM2; Lajur 2, 4, 6, 8, 10 = sampel KP2 b)
L1-2 = OPA-11; L3-4 = OPA-12; L5-6 = OPA-13; L7-8 = OPA-14; L9-10 = OPA-15; M = Marker 100 bp plus DNA ladder
8
Isolasi Minyak Atsiri dengan Metode Destilasi Uap
Isolasi kapulaga dilakukan dengan metode destilasi uap. Isolasi kapulaga dilakukan dua kali ulangan dengan menggunakan 250 gram buah kapulaga merah dan 250 gram buah kapulaga putih. Kapulaga merah menghasilkan minyak atsiri sebanyak 0.28%, sedangkan kapulaga putih menghasilkan minyak atsiri sebanyak 0.20%.
Uji Kandungan Senyawa dengan FTIR
FTIR (Fourier Transform Infrared) merupakan metode awal untuk proses identifikasi struktur molekul suatu senyawa berdasarkan gugus fungsinya dengan cara membandingkan spektrum FTIR yang ingin diidentifikasi dengan rentang bilangan gelombang pada kisaran munculnya spektrum dari metode Mark 1996. Berdasarkan hasil spektrum FTIR pada gambar 3, kapulaga putih dan kapulaga merah memiliki spektrum yang tidak berbeda nyata. Kedua kapulaga terdeteksi pada bilangan gelombang yang relatif sama, yaitu berkisar antara 3000-3500 cm-1 yang menunjukkan ikatan O-H asam karboksilat dan N-H amina; bilangan gelombang antara 2700-3000 cm-1 yang menunjukkan ikatan regang CH alkana, -C≡C-H alkuna, atau C=C-H alkena; bilangan gelombang 1300-1500 cm-1 yang menunjukkan ikatan lentur C-H alkana; serta pada bilangan gelombang 800-1000 cm-1 yang menunjukkan ikatan C=C-H alkena. Hasil FTIR antara kapulaga merah dan putih menunjukkan bahwa kedua kapulaga ini tidak memiliki perbedaan gugus fungsi sehingga kandungan minyak atsirinya perlu diuji lebih lanjut menggunakan metode GCMS.
Gambar 4 Spektrum FTIR kapulaga merah (spektrum biru) dan kapulaga putih (spektrum merah)
Uji Kandungan Senyawa Minyak Atsiri Kapulaga dengan GCMS
9 dalam minyak atsiri kapulaga merah teridentifikasi 41 puncak, namun sekitar 33 puncak yang persen kemiripan senyawanya di atas 90% bila dibandingkan dengan pustaka senyawa pada program GCMS. Senyawa kimia yang terkandung dalam minyak atsiri kapulaga putih teridentifikasi sebanyak 49 puncak, namun hanya sekitar 28 puncak yang persen kemiripan senyawanya dengan pustaka senyawa pada program GCMS di atas 90% Senyawa dengan persen kemiripan di bawah 90% yang banyak teridentifikasi pada kapulaga putih dapat diidentifikasi sebagai noise, sehingga tidak dapat dinyatakan sebagai komponen senyawa yang terkandung pada minyak atsiri kapulaga putih.
Kapulaga merah memiliki 17 kandungan senyawa yang tidak teridentifikasi pada kapulaga putih, sedangkan kapulaga putih memiliki 12 kandungan senyawa yang tidak teridentifikasi pada kapulaga merah (Tabel 2). Perbedaan kandungan ini sebagian besar dapat dilihat dari adanya perbedaan bentuk (isomer) dari suatu senyawa, seperti kandungan khas kapulaga merah adalah trans-sabinena, sedangkan kapulaga putih mengandung n-sabinena.
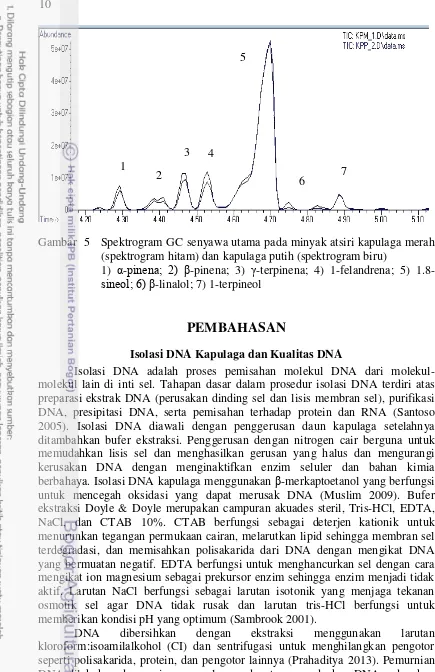
Kapulaga merah dan putih memiliki tujuh senyawa utama yang diperlihatkan dari hasil spektrogram kromatografi gas lalu dianalisis dengan spektrometri massa. Kedua spektrum menunjukkan kandungan senyawa utama pada kedua kapulaga yang merupakan kandungan metabolit sekunder khas golongan Zingibereceae. Tujuh senyawa tersebut secara berurutan dari nomor 1 hingga 7 adalah yaitu α-pinena, -pinena, 1-felandrena, 1.8-sineol, -linalol, dan 1-terpineol (Gambar 6). Senyawa-senyawa ini merupakan senyawa khas yang terdapat pada minyak atsiri kapulaga lokal secara umum. Hasil ini menunjukkan bahwa GCMS dapat mengidentifikasi perbedaan kandungan minyak atsiri kapulaga merah dan putih serta dapat mengidentifikasi kandungan utama yang dimiliki kedua kapulaga tersebut.
Tabel 2 Senyawa Khas pada Kapulaga Merah dan Putih Senyawa Khas pada Kapulaga
7. 3-sikloheksena 7. 2-metil-5-(1-metiletil)-carvacrol
10
Gambar 5 Spektrogram GC senyawa utama pada minyak atsiri kapulaga merah (spektrogram hitam) dan kapulaga putih (spektrogram biru)
1) α-pinena; β) -pinena; 3) -terpinena; 4) 1-felandrena; 5)
1.8-sineol; 6) -linalol; 7) 1-terpineol
PEMBAHASAN
Isolasi DNA Kapulaga dan Kualitas DNA
Isolasi DNA adalah proses pemisahan molekul DNA dari molekul-molekul lain di inti sel. Tahapan dasar dalam prosedur isolasi DNA terdiri atas preparasi ekstrak DNA (perusakan dinding sel dan lisis membran sel), purifikasi DNA, presipitasi DNA, serta pemisahan terhadap protein dan RNA (Santoso 2005). Isolasi DNA diawali dengan penggerusan daun kapulaga setelahnya ditambahkan bufer ekstraksi. Penggerusan dengan nitrogen cair berguna untuk memudahkan lisis sel dan menghasilkan gerusan yang halus dan mengurangi kerusakan DNA dengan menginaktifkan enzim seluler dan bahan kimia berbahaya. Isolasi DNA kapulaga menggunakan -merkaptoetanol yang berfungsi untuk mencegah oksidasi yang dapat merusak DNA (Muslim 2009). Bufer ekstraksi Doyle & Doyle merupakan campuran akuades steril, Tris-HCl, EDTA, NaCl, dan CTAB 10%. CTAB berfungsi sebagai deterjen kationik untuk menurunkan tegangan permukaan cairan, melarutkan lipid sehingga membran sel terdegradasi, dan memisahkan polisakarida dari DNA dengan mengikat DNA yang bermuatan negatif. EDTA berfungsi untuk menghancurkan sel dengan cara mengikat ion magnesium sebagai prekursor enzim sehingga enzim menjadi tidak aktif. Larutan NaCl berfungsi sebagai larutan isotonik yang menjaga tekanan osmotik sel agar DNA tidak rusak dan larutan tris-HCl berfungsi untuk memberikan kondisi pH yang optimum (Sambrook 2001).
DNA dibersihkan dengan ekstraksi menggunakan larutan kloroform:isoamilalkohol (CI) dan sentrifugasi untuk menghilangkan pengotor seperti polisakarida, protein, dan pengotor lainnya (Prahaditya 2013). Pemurnian DNA dilakukan dengan isopropanol yang dapat mengendapkan DNA sedangkan kontaminan yang lain tetap larut. Penggunaan Na-asetat pada pemurnian DNA
1
2
3 4 5
11 berfungsi untuk membantu memekatkan dan mengendapkan DNA. Pencucian DNA dengan etanol 70% bertujuan untuk memisahkan senyawa lain yang masih menempel pada DNA (Surzycki 2000). DNA dilarutkan di dalam MW (Mollecular Water) karena DNA stabil dalam bentuk larutan (Sambrook 2001). Sampel DNA teresuspensi tersebut kemudian disimpan pada -20 oC sebagai stok DNA (Brown 2003; Kumar 2011)..
Metode Doyle & Doyle yang telah dimodifikasi menghasilkan DNA yang dapat dilihat dari munculnya pita DNA genom pada gel agarosa 1.5%. DNA genom keseluruhan kapulaga ini memiliki ukuran bobot molekul sekitar 2000-12000 bp (Gambar 2). Konsentrasi DNA genom yang tinggi diharapkan dapat menghasilkan intensitas pita yang tinggi. Gambar 2 menunjukkan pita DNA dapat terlihat dengan jelas namun masih terdapat smear. Hal ini dapat terjadi karena masih terdapat kontaminan yang belum hilang pada hasil isolasi DNA tanaman kapulaga. Selain kontaminan, tanaman kapulaga juga mengandung komponen bioaktif atau metabolit sekunder yang dapat memengaruhi kualitas hasil isolasi DNA suatu tumbuhan dan sulit dipisahkan dari suatu tanaman (Kheyrodin 2011; Babu 2012; Prahaditya 2013).
Kuantitas DNA Genom
Kuantitas DNA dapat diukur menggunakan spektrofotometer nanodrop. Prinsip spektrofotometer ini berdasarkan hukum Lambert-Beer yang menyatakan bahwa konsentrasi larutan standar berbanding langsung dengan absorbansi cahaya. Spektrofotometer dapat digunakan untuk uji kuantitatif karena jumlah sinar yang diserap oleh partikel di dalam larutan juga bergantung pada jenis dan jumlah partikel (Bintang 2010). Kemurnian DNA dilihat dari perbandingan absorbansi DNA dengan absorbansi komponen polifenol dan proteinnya (Desjardins 2010). Perbandingan A260/230 yang baik berkisar antara 1.5-2.1. Perbandingan A280/260 yang baik berkisar antara 1.8-2.0 (Sambrook 2001).
Hasil uji kuantitas DNA menunjukkan bahwa konsentrasi yang didapat cukup tinggi dan murni dari pengaruh komponen fenolik dan protein. Konsentrasi DNA merupakan parameter penting dalam uji kuantitatif. Sampel yang dipilih adalah sampel KP2 dan KM2 karena memiliki konsentrasi DNA dan kemurnian yang paling baik dibandingkan dengan hasil ulangan lainnya. Konsentrasi DNA yang dimiliki oleh kapulaga merah dan putih ulangan kedua termasuk dalam rentang baik, sehingga dapat dikatakan bahwa komponen selain DNA (pengotor seperti RNA, protein, komponen fenolik, dan metabolit sekunder) tidak mengganggu kuantitas DNA kapulaga merah dan DNA kapulaga putih serta tidak mengganggu proses PCR.
Identifikasi Genetik Kapulaga Merah dan Putih
12
terbatas sehingga sangat membantu dalam analisis keragaman organisme yang belum diketahui latar belakang genomnya (Suryanto 2003).
DNA genom (sampel) dalam mix reaction akan menjadi cetakan DNA untuk penempelan primer. Primer secara acak akan menempel pada sekuen DNA genom yang komplementer sehingga akan diperpanjang oleh taq polimerase dan teramplifikasi membentuk suatu pola. Proses RAPD-PCR dilakukan pada kondisi optimum PCR, yaitu memiliki satu siklus awal untuk adaptasi dan 44 siklus selanjutnya. Adaptasi perlu dilakukan karena DNA berasal dari DNA genom berbobot molekul yang tinggi untuk memudahkan proses PCR. Faktor lain yang berpengaruh pada proses amplifikasi adalah panjang primer, komposisi basa primer, konsentrasi ion Mg2+, suhu hibridisasi, dan jumlah siklus termal (Prana 2003; Suryanto 2003; Prihatin 2013).
Hasil RAPD-PCR mengidentifikasi pita DNA yang muncul dengan variasi jumlah yang ditunjukkan. Total pita yang muncul pada kapulaga merah lebih banyak daripada pita yang muncul pada kapulaga putih dengan bobot molekul
yang bervariasi. Kapulaga merah dan putih bersifat polimorfik. Polimorfik dapat
terjadi apabila antara kedua sampel menunjukkan perbedaan fragmen DNA berupa pita-pita terputus pada hasil elektroforesis antara kapulaga merah dan putih. Pita-pita yang terputus ini menunjukkan adanya perbedaan lokus pada kedua kapulaga sehingga dapat menunjukkan perbedaan genetik (Sharma 2008).
Keragaman makhluk hidup dapat terjadi pada tingkat gen.
Keanekaragaman gen dapat terjadi pada satu jenis makhluk hidup sehingga mengakibatkan variasi antara individu sejenis yang disebabkan oleh pengaruh gen. Perbedaan gen menyebabkan perbedaan sifat genotip dan fenotip suatu tanaman, contohnya kapulaga lokal. Kapulaga di Jawa Tengah hanya memiliki buah berwarna putih, sedangkan buah kapulaga di Jawa Barat berwarna merah dan putih. Hal ini dapat disebabkan oleh perbedaan gen yang menyebabkan perbedaan fenotip buah kapulaga tersebut (Sanjaya 2002). Perbedaan genetik yang terjadi pada kedua kapulaga tersebut juga dapat disebabkan oleh faktor lingkungan. Perbedaan media, cahaya, suhu, kelembapan, dan unsur hara pada masing-masing daerah tanam dapat menyebabkan perubahan materi genetik yang
mempengaruhi kondisi tanaman tersebut (Weeden1992 dalam Pharmawati 2009).
Perbedaan genetik yang terjadi antara kapulaga merah dan putih ini menunjang hasil fenotip kedua kapulaga yang menunjukkan adanya perbedaan morfologi berupa bentuk dan warna pada buah dan pangkal tanaman kapulaga. Penelitian ini merupakan penelitian awal dalam melihat perbedaan genetik antara kapulaga merah dan putih, sehingga belum diteliti lebih lanjut. Penelitian ini mengacu pada penelitian sebelumnya yang menggunakan tanaman kunyit dan temulawak dengan primer OPA 11-15 dan menghasilkan pita terbanyak serta dapat mengidentifikasi tingkat polimorfisme kedua tanaman tersebut (Prihatin 2013).
Isolasi Minyak Atsiri Kapulaga dengan Metode Destilasi Uap
13 untuk bersaing dengan tanaman lain. Senyawa metabolit sekunder tanaman kapulaga terdapat pada minyak atsirinya (Arniputri 2007).
Metabolit sekunder dapat disintesis melalui jalur asam mevalonat. Komponen minyak atsiri pada tanaman kapulaga merupakan golongan terpenoid (turunan isoprena), seperti sineol, terpineol, dan bisabolol. Mekanismenya dimulai dari pembentukan isoprena yang berasal dari asam asetat melalui asam mevalonat. Asam asetat diaktifkan oleh koenzim A lalu berkondensasi menghasilkan asam asetoasetat. Senyawa yang dihasilkan berkondensasi dengan asetil koenzim A menghasilkan rantai karbon bercabang. Isoprena yang terbentuk kemudian dapat bergabung membentuk mono-, di-, dan politerpenoid (Lenny 2006).
Minyak atsiri suatu tanaman mempunyai komponen kimia tertentu yang prinsipnya akan memberi aktivitas spesifik bagi tanaman tersebut (Mulyani 2009). Minyak atsiri mudah menguap pada suhu kamar, mempunyai rasa getir, serta berbau wangi sesuai dengan bau tanaman penghasilnya (Mutaqin 2013). Minyak atsiri larut dalam pelarut organik dan tidak larut dalam air. Komponen kimia minyak atsiri yang terdapat pada tanaman dapat dipengaruhi oleh jenis tanaman dan lingkungan tempat tumbuh, dan metode isolasi yang dilakukan (Arniputri 2007; Suryadinata 2008).
Isolasi minyak atsiri buah kapulaga dilakukan dengan metode destilasi uap. Metode ini mengacu pada penelitian sebelumnya mengenai minyak atsiri buah kapulaga lokal yang dilakukan oleh Prasetyo 2009. Destilasi atau penyulingan dengan uap merupakan metode paling sederhana dan tepat yang digunakan untuk mengambil minyak atsiri dari bahan baku kayu, kulit batang, buah, maupun biji yang relatif keras. Kelebihan metode ini adalah uap dapat masuk merata ke bahan, suhu dapat dipertahankan hingga 100oC, lama waktu destilasi relatif lebih singkat, rendemen minyak lebih besar, dan mutunya lebih baik dibanding dengan minyak hasil sistem destilasi air (Prasetyo 2009).
Minyak atsiri dari kapulaga lokal putih yang dihasilkan berwarna jernih kekuningan dengan rendemen sebesar 0.2%, sedangkan minyak atsiri dari kapulaga lokal merah yang dihasilkan juga berwarna jernih kekuningan dengan rendemen sebesar 0.28%. Hasil rendemen ini lebih kecil daripada yang dilaporkan Stahl dan Haris yaitu sebesar 2-8%, lebih kecil dari yang dilaporkan oleh Fachriyah 2007, yaitu rendemen kapulaga lokal sebesar 1.2%. Hal ini dapat disebabkan oleh varietas dan tingkat kemasakan pada saat panen. Buah yang terlalu masak cenderung membelah ketika dikeringkan sehingga minyaknya mudah menguap, sedangkan buah yang belum masak kandungan minyaknya rendah (Fachriyah 2007). Selain itu, kulit buah dan biji dari tanaman kapulaga berpengaruh terhadap pembentukan minyak atsiri kapulaga. Jika kulit dan biji dipisahkan dari buahnya akan memengaruhi hasil rendemen minyak atsiri kapulaga sehingga hasilnya akan berkurang (Fachriyah 2007; Prasetyo 2009).
Kandungan Minyak Atsiri Kapulaga dengan FTIR
14
FTIR memiliki keunggulan, yaitu resolusinya tinggi dan dapat digunakan untuk mengidentifikasi berbagai fase sampel (Ammawath 2010; Kusumastuti 2011). Metode ini banyak digunakan karena cepat, murah, sederhana dalam mengidentifikasi gugus fungsional, dan spektrum inframerah yang dihasilkan oleh suatu senyawa adalah khas (Marwati 2007; Wibowo 2008).
Spektrum FTIR terdeteksi pada daerah antara 400-4000 cm-1 yang merupakan daerah yang khusus untuk identifikasi gugus fungsional (Mark 1996). Kapulaga merah dan kapulaga putih memiliki spektrum yang tidak berbeda nyata dilihat dari spektrumnya. Hal ini menunjukkan bahwa kedua kapulaga memiliki senyawa utama dengan gugus fungsi yang sama. FTIR merupakan analisis awal untuk mengetahui perbedaan gugus fungsi kandungan senyawa secara umum, sehingga walaupun ada senyawa berbeda dengan gugus fungsi yang sama (isomer), senyawa tersebut tidak dapat dideteksi melalui analisis ini, sehingga dapat dikatakan bahwa analisis FTIR tidak dapat digunakan untuk membedakan kandungan senyawa antara kapulaga merah dan putih.
Kandungan Minyak Atsiri Kapulaga dengan Metode GCMS
GCMS (gas chromatography mass spectrometry) merupakan metode pemisahan senyawa organik yang menggunakan dua metode analisis yaitu kromatografi gas (GC) untuk menganalisis jumlah senyawa secara kuantitatif dan spektrometri massa (MS) untuk menganalisis struktur molekul senyawa analat (Sosialsih 2002; Kopka 2006). Kelebihan penggunaan metode GCMS adalah tidak memerlukan standar eksternal, dapat digunakan untuk identifikasi senyawa baru, serta karena sensitivitas dan efisiensi pemisahannya tinggi, GCMS banyak digunakan untuk menganalisis komponen volatil seperti flavor, minyak esensial, dan komponen non-volatil (Prasetya 2006).
Hasil GCMS dapat menunjukkan bahwa lebih banyak senyawa yang teridentifikasi pada kapulaga merah daripada kapulaga putih, sedangkan pada kapulaga putih terdapat banyak senyawa yang tidak dapat teridentifikasi (persen kemiripan dengan pustaka senyawa pada program GCMS di bawah 90%). Hal ini didukung pula oleh bobot minyak atsiri yang diperoleh dari penyulingan buah kapulaga merah yang lebih besar daripada putih. Penelitian mengenai kapulaga merah dan putih belum dilakukan sebelumnya sehingga literatur yang diperoleh hanya kandungan utama kapulaga lokal saja (Fachriyah 2007).
Hasil spektrogram menunjukkan tujuh puncak utama yang muncul pada kapulaga merah maupun kapulaga putih, yaitu α-pinena, -pinena, -terpinena, 1-felandrena, 1.8-sineol, -linalol, dan 1-terpineol. Selain itu, Senyawa yang ada pada kedua kapulaga adalah α-thujena, terpinena, trans bisabolena, dan -bisabolena yang merupakan golongan terpenoid (monoterpena). Monoterpena merupakan gabungan dari dua isoprena (C5H8). Minyak atsiri yang terkandung pada kedua kapulaga merupakan senyawa khas yang disintesis melalui jalur asam mevalonat karena sebagian besar menghasilkan metabolit sekunder golongan terpenoid (Lenny 2006). Hal ini sesuai dengan yang dikemukakan Fachriyah 2007 mengenai komponen minyak atsiri kapulaga lokal yang terdeteksi adalah sebanyak lima puncak pada proses GCMS yaitu α-pinena, -pinena, p-simena, 1,8-sineol, dan 1-terpineol yang termasuk ke dalam golongan monoterpena.
15 kapulaga putih, sedangkan kapulaga putih memiliki 12 senyawa yang tidak teridentifikasi pada kapulaga merah. Senyawa khas pada kapulaga merah tersebut sebagian besar merupakan golongan monoterpena, seperti -mirsena, trans-sabinena, carvacrol, dan p-isopropilfenol, serta golongan seskuiterpena, seperti α -bisabolol, bicyclogermacrene, dan trans- β-caryopyllene yang terbentuk dari tiga isoprena. Kapulaga putih mengandung senyawa khas dari golongan monoterpena, seperti sabinena, cis- -terpinena, kamfor, dan 2-metil-5-(1-metiletil)-carvacrol. Kandungan senyawa monoterpena seperti carvacrol dapat digunakan untuk antibakteri, melancarkan pencernaan, mencegah adanya gangguan pernafasan, dan mencegah kanker prostat (Kristiani 2008; Warsinah 2011). Fungsi sesquiterpena seperti bicyclogermacrene dapat digunakan sebagai antifungi dan obat untuk menurunkan ketegangan syaraf (Lenny 2006; Kristiani 2008; Warsinah 2011).
Perbedaan kandungan senyawa yang diidentifikasi antara kapulaga merah dan putih sebagian besar terlihat dari perbedaan bentuknya (isomer). Perbedaan kandungan senyawa dapat terjadi karena adanya perbedaan genetik yang terkandung pada kedua kapulaga. Setiap tanaman memiliki gen-gen khas yang dapat menyandi protein tertentu sehingga menghasilkan senyawa metabolit sekunder yang khas. Metabolit sekunder dihasilkan pada saat terbatasnya zat gizi dalam media pertumbuhan (Sosialsih 2002). Zat gizi yang terbatas menyebabkan terakumulasinya induser enzim metabolit sekunder sehingga terlepasnya gen-gen tertentu untuk menyintesis metabolit sekunder. Metabolit sekunder bersifat spesifik pada tiap organisme karena dapat merangsang aktivitas enzim tertentu yang terlibat dalam jalur biosintesis sehingga dapat meningkatkan produksi metabolit tersebut. Metabolit sekunder mempunyai gen yang memiliki kode berbeda-beda (Lenny 2006).
Perbedaan fenotip yang terlihat dari kapulaga merah dan putih menunjukkan adanya perbedaan gen sehingga yang terlihat adanya perbedaan warna. Perbedaan genetik yang dilihat dari hasil amplifikasi DNA kedua kapulaga tersebut memengaruhi kandungan metabolit sekundernya. Perbedaan susunan gen atau adanya mutasi gen menyebabkan perbedaan protein yang disintesis sehingga menghasilkan kandungan metabolit yang berbeda-beda. Perbedaan kandungan senyawa metabolit sekunder pada kedua kapulaga juga dapat dipengaruhi oleh faktor fisik (suhu, cahaya, dan kelembaban) serta faktor stres lingkungan (logam berat dan sinar UV) (Warsinah 2011).
SIMPULAN DAN SARAN
Simpulan
16
lebih banyak daripada kapulaga putih. Hal ini didukung oleh bobot minyak atsiri kapulaga merah yang lebih besar daripada kapulaga putih. Kandungan senyawa minyak atsiri utama yang terdapat pada kedua kapulaga, yaitu α-pinena, -pinena, -terpinena, 1-phelandrena, 1.8-sineol, -linalol, dan 1-terpineol. Perbedaan kedua kapulaga ini dapat dilihat dari senyawa khas yang dimiliki masing-masing kapulaga. Kapulaga merah memiliki 17 senyawa khas yang tidak dimiliki oleh kapulaga putih, sedangkan kapulaga putih memiliki 12 senyawa khas yang tidak dimiliki oleh kapulaga merah. Penelitian ini menunjukkan bahwa perbedaan genetik tanaman kapulaga merah dan putih sejalan dengan perbedaan kandungan senyawa minyak atsirinya.
Saran
Perlu dilakukan penelitian lebih lanjut untuk mengidentifikasi perbedaan genetik antara kedua kapulaga dengan cara mengidentifikasi gen yang muncul menggunakan metode PCR lainnya, seperti SSR. Penelitian mengenai aktivitas tanaman kapulaga merah dan putih juga perlu dilakukan.
DAFTAR PUSTAKA
Agusta A. 2000. Minyak Atsiri Tumbuhan Tropik Indonesia. Bandung: Institut Teknologi Bandung.
Ammawath, Wanna, Yaakob. 2010. A rapid method for determination of
commercial -carotene in RBD palm olein by Fourier Transform Infrared Spectroscopy. J Food Ag-Ind. 3 (04): 443-452.
Arniputri RB, Amalia TS, Muji R. 2007. Identifikasi komponen utama minyak atsiri temu kunci (Kaemferia pandurata Roxb.) pada ketinggian tempat yang berbeda. J Biodiversitas. 8 (2): 135-137.
Babu KN, Jayakumar VN, Divakaran M, Venugopal MN, Sudarsh MR, Radhakrishnan VV, Backiyarani S, Narayanaswami M, Peter KV, Parthasarathy VA. 2012. Genetic diversity and phylogenetic relationship among small cardamom (Elettaria cardamomum Maton.) cultivars and related genera using DNA markers. J Mol Bio. 1 (1): 47-56.
Bintang M. 2010. Biokimia Teknik Penelitian. Jakarta: Erlangga.
Brown TA. 2003. Pengantar Kloning Gen. Muhammad SA, penerjemah. Yogyakarta: Yayasan Essentia Medika. Terjemahan dari: Gene Cloning an Introduction.
Desjardins P, Conklin D. 2010. NanoDrop microvolume quantitation of nucleic acids. JOVE. 45: e2585.
Doyle JJ, Doyle JL. 1990. Isolation of plant DNA from fresh tissue. Focus. 12 (1): 871-877.
Fachriyah E, Sumardi. 2007. Identifikasi minyak atsiri biji kapulaga (Amomum cardamomum). J Sains Matematika 10(2): 83-87.
17 Kheyrodin H, Ghazvinian K. 2011. DNA purification and isolation of genomic DNA from bacterial species by plasmid purification system. African J Agricul Res. 7: 433-442.
Kopka J. 2006. Gas chromatography–mass spectrometry. Di dalam: Li Y, Kong D, Wu H. Analysis and evaluation of essential oil components of cinnamon barks using GC–MS and FTIR spectroscopy. JICP. 4(1):269-278.
Kristiani PE. 2008. Kajian morfologi dan kimia kayu akway (Drymis sp) sebagai afrodisiak endemik Papua [tesis]. Bogor: Institut Pertanian Bogor.
Kumar NS, Gurusubramanian G. 2011. Random amplified polymorphic DNA (RAPD) markers and its applications. J Sci Vis. 11(3): 116-124.
Kusumastuti A. 2011. Pengenalan pola gelombang khas dengan interpolasi. J Matematika Terapan. 2(1): 10-11. Metode Khelasi Menggunakan Asam Sitrat. Bogor: Balai Besar Penelitian dan Pengembangan Pascapanen Pertanian.
Mulyani S, Susilowati, dan Maslan MH. 2009. Analisis GCMS dan daya antibakteri minyak atsiri Citrus amblycarpa (Hask) Osche. Majalah Farmasi Indonesia. 20 (3): 127-132.
Muslim A. 2009. Isolasi Propotoplasma pada Kultur Jaringan [skripsi]. Bandung: Institut Pertanian Bogor.
Mutaqin A, Endah S, Lia D. 2013. Identifikasi hasil reaksi adisi nukleofilik sianida pada gugus karbonil sitronelal menggunakan pereaksi kalium sianida. JKK. 2(1): 38-41.
Nasution IK, Bambang S, Wahyunanto AN. 2013. Uji kinerja alat pemurni minyak atsiri daun cengkeh (Clove Leaf Oil) berbasis membran kitosan-selulosa. J Keteknikan Pertanian Tropis dan Biosistem. 2(1): 9-14.
Pinarkara E. 2009. RAPD analysis of seized marijuana (Cannabis sativa L.) in Turkey. J Med. Mol Bio. (2):25-32.
Prahaditya D. 2013. Analisis keragaman genetika tanaman kunyit dan temulawak secara Random Amplified Polymorphic DNA-Polymerase Chain Reaction (RAPD-PCR) menggunakan primer OPA-OPD 6-10 [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Prana TK, Hartati NS. 2003. Identifikasi Sidik Jari DNA Talas (Colocasia esculante L. Schott) Indonesia dengan RAPD. J Nat Ind. 9(5):107-112. Pharmawati M. 2009. Optimalisasi Ekstraksi DNA dan PCR-RAPD pada
Grevillea spp. J Bio. 8(1):12 -16.
Prasetya NBA, Ngadiwiyana. 2006. Identifikasi senyawa penyusun minyak kulit batang kayu manis (Cinnamomum cassia) Menggunakan GCMS. JSKA 9(1): 1-4.
Prasetyo. 2004. Budidaya kapulaga sebaga tanaman sela pada tegakan sengon. J Pertanian. 6(1):22-31.
18
Prihatin NA. 2013. Pola keragaman tanaman kunyit (Curcuma longa L.) dan temulawak (Curcuma xanthorrhiza Roxb) asal Pulau Jawa dengan PCR-RAPD [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Sambrook J, Russel DW. 2001. Molecular Cloning: A Laboratory Manual. 3rd Ed. New York (US): Cold Spring Harbor Laboratory Press.
Sanjaya L, Wattimena GA, Guharja E, Muhammad Y, Aswindinoor H, Stam P. 2002. Keragaman ketahanan aksesi Capsicum terhadap antraknose (Colletotrichum capsici) berdasarkan penanda RAPD. J Bioteknologi Pertanian. 7(2): 37-42.
Santoso PJ. 2005. Modified CTAB-based on DNA isolation procedure for fruit crops. J Stigma. 14(1): 1-4.
Sastrohamidjojo H. 2002. Kimia Minyak Atsiri. Yogyakarta: Universitas Gajah Mada.
Septimayani I. 2002. Studi keragaman genetik 16 aksesi blewah (Cucumis melo L.) dengan metode Random Amplified Polymorphic DNA (RAPD). J Gen. (2)1:23-29.
Sharma A, Namdeo AG, Mahadik KR. 2008. Molecular markers: new in plant genome analysis. J Pharmacology. 2 (3): 23-31.
Sosialsih L. 2002. Penambahan vitamin e dan detergen terhadap sifat fisik dan daya antibakteri pasta gigi minyak atsiri daun sirih [skripsi]. Bogor: Institut Pertanian Bogor.
Sudjadi. 2008. Bioteknologi Kesehatan. Yogyakarta (ID): Kanisius.
Suryadinata C. 2008. Pemisahan minyak atsiri buah kapulaga (Amomum cardamomum) secara kromatografi lapis tipis dan aktivitasnya terhadap Malassezia furfur in vitro [artikel ilmiah]. Semarang: Universitas Diponegoro.
Suryanto D. 2003. Melihat keanekargaman organisme melalui beberapa teknik genetika molekular. USU Digital Library [terhubung berkala]. http://www.library.usu.ac.id/modules.php [22 November 2013].
Surzycki S. 2000. Basic Techniques in Molecular Biology. New York (US): Springer.
Warsinah. 2011. Identifikasi senyawa antifungi dari kulit batang kecapi (Sandoricum koetjape) dan aktivitasnya terhadap Candida albicans [Artikel Ilmiah]. 16 (3): 165 – 173.
Wibowo WA, Catur EW, Much A, Sofjan F. 2008. Rancang bangun pengatur cermin sebagai komponen gerak interferometer pada spektroskopi FTIR. J Fis. 9(3): 79-87.
19
LAMPIRAN
Lampiran 1 Diagram alir penelitian
Lampiran 2 Sekuen primer yang digunakan pada RAPD-PCR
Primer Sekuen Primer (5'-3')
OPA-11 CAATCGCCGT
OPA-12 TCGGCGATAG
OPA-13 CAGCACCCAC
OPA-14 TCTGTGCTGG
OPA-15 TTCCGAACCC
Sampel Tanaman Kapulaga merah dan
Isolasi DNA Tanaman Kapulaga
Isolasi Minyak Atsiri Kapulaga
Uji Kuantitas dan Kualitas DNA Kapulaga
RAPD-PCR
Analisis Perbedaan
Genetik Kapulaga Merah dan
Putih
Uji FTIR
Uji GCMS
Perbedaan Genetik dan Perbedaan Kandungan Senyawa Kapulaga
20
Lampiran 3 Hasil perhitungan rendemen kapulaga merah dan kapulaga putih - Kapulaga Merah
a) Ulangan 1
Rendemen (v/b) = Volume minyak atsiri . 100% Bobot Buah kapulaga
Rendemen (v/b) = 0.7031 mL . 100% 250 gram
Rendemen (v/b) = 0.2812%
b) Ulangan 2
Rendemen (v/b) = Volume minyak atsiri . 100% Bobot Buah kapulaga
Rendemen (v/b) = 0.6281 mL . 100% 250 gram
Rendemen (v/b) = 0.2512%
- Kapulaga Putih
c) Ulangan 1
Rendemen (v/b) = Volume minyak atsiri . 100% Bobot Buah kapulaga
Rendemen (v/b) = 0.54672 mL . 100% 250 gram
Rendemen (v/b) = 0.2187%
d) Ulangan 2
Rendemen (v/b) = Volume minyak atsiri . 100% Bobot Buah kapulaga
Rendemen (v/b) = 0.5103 mL . 100% 250 gram
21 Lampiran 4 Spektrogram kapulaga merah
22
Lampiran 6 Hasil GCMS senyawa pada kapulaga merah Waktu
4.529 1-phellandrene 44627 94
4.699 1.8-cineole 75885 99
4.750 -Terpinene 44682 97
4.835 Trans-Sabinene 76038 97
4.894 Linalool 76038 97
5.005 2-Cyclohexene 76221 92
5.132 Trans-p-mentha-2,8-dienol 70822 64
5.217 p-mentha-E-2,8(9)-dien-1-ol 71295 91
5.395 Bicyclo[2.2.1]heptan-2-one 71526 98
5.463 D-terpineol 75960 78
5.548 3-Cyclohexene 75490 97
5.633 3-Cyclohexene-1-methanol 75546 91
5.744 Bicyclo[3.1.1]hept-2-ene-2-carboxaldehide
66795 96
5.786 p-Isopropylphenol 43905 97
5.905 Acetaldehyde 70860 50
6.474 Phenol, Carvacrol 66492 91
8.080 TRANS Β- Caryophyllene 192116 99
8.505 1,4,7,-Cycloundecatriene 192211 99
8.895 -Bisabolene 191370 99
9.006 bicyclogermacrene 192078 95
9.142 - Sesquiphellandrene 191352 93
9.227 Trans- -Bisabolene 192038 95
9.541 -Bisabolene 191371 78
10.068 -Bisabolene 242135 94
10.272 Germacrene 191434 41
10.306 Champacol 241924 99
10.578 Champacol 241926 66
11.181 3-Cyclohexen-1-ol 241831 97
11.325 5,7-Dimethyloctahydrocoumarin 242303 49
11.393 α-Bisabolol 242119 95
11.665 α-Santalol 235534 93
11.826 Octadecane 332725 95
12.565 2-Naphthoic Acid 229022 64
17.603 Tricosane 519103 98
21.316 Tricosane 519106 97
24.246 Tricosane 519106 98
23 Lampiran 7 Hasil GCMS senyawa pada kapulaga putih
Waktu
4.529 1-phellandrene 44627 94
4.699 1.8-cineole 75885 98
4.750 -Terpinene 44682 97
4.826 Cis- -Terpinene 75695 95
4.894 Linalool 76038 97
5.005 p-menth-2-en-1-ol 75992 91
5.132 Bicyclo[3.1.1]hept-3-en-2-ol 71310 46
5.217 2-Cyclohexen-1-ol 71594 96
5.251 1-Terpineol 76041 97
5.395 1,7,7-trimethyl-Camphor 71108 98
5.463 D-Terpineol 75960 78
5.548 3-Cyclohexen-1-ol 75497 97
5.633 3-Cyclohexene-1-methanol 75546 91
5.744 4-bromo-2-chlorophenyl 615728 64
5.778 3-(1-methylethyl)- Cumenol 43890 94
6.024 2-Cyclohexen-1-ol 76221 22
6.067 2-Cyclohexen-1-one-Carvon 66682 76
6.474 2-methyl-5-(1-methylethyl)-Carvacrol 66492 90 6.772 5-Ethyl-2-methylteneetyrahydrpyran 31522 59
7.468 [1,1'-Bicyclopentyl]-2-one 71062 72
7.528 Trans-Carveol 70854 30
7.579 Spiro[4.5]decan-6-one 71058 25
8.224 (R)-Nitro-1,5-p-menthadiene 132576 43
8.369 Vulgarole 212766 43
8.887 -Bisabolene 191370 98
9.133 -esquiphellandrene 191355 97
9.227 Trans- -Bisabolene 192038 76
9.533 -Bisabolene 191371 70
11.393 Bicyclo[7.7.0]hexadec-1(9)-ene 236223 55
9.703 1-Phenylcyclohexylamine 119067 27
10.059 -Bisabolene 191369 91
10.883 Diepi-.alpha.-cedreni 191572 92
10.994 2,2-Diethyl-2,3-dihydrobenzofuran-4,7-dione
195920 90
24
RIWAYAT HIDUP
Penulis dilahirkan di Pekanbaru pada tanggal 16 November 1991 dari pasangan Ferry Rudyana, SE, MH dan Endang Suryani, SP. Penulis merupakan putri pertama dari dua bersaudara. Penulis menyelesaikan pendidikan menengah atas di SMAN 3 Pekanbaru tahun 2009. Penulis meneruskan pendidikan melalui jalur undangan USMI pada tahun 2009 di Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.