LAJU PELEPASAN UREA DARI
ONGGOK-
g
-POLIAKRILAT DAN BIODEGRADASINYA
FAHMIY AYATILLAH
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Laju Pelepasan Urea dari Onggok-g-poliakrilat dan Biodegradasinya adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
FAHMIY AYATILLAH. Laju Pelepasan Urea dari Onggok-g-poliakrilat dan Biodegradasinya. Dibimbing oleh MUHAMAD FARID dan MOHAMMAD KHOTIB.
Onggok adalah hasil samping dari pembuatan tepung tapioka dari singkong. Onggok mengandung pati sebanyak 73% yang berpotensi menjadi bahan baku pembenah tanah, yaitu hidrogel untuk mengendalikan laju pelepasan urea. Onggok dikopolimerisasi cangkok dengan Na-akrilat, inisiator amonium persulfat, dan penaut-silang N,N-metilena-bis-akrilamida menghasilkan hidrogel onggok-g-poliakrilat. Pembengkakan hidrogel dalam air dan dalam larutan urea 1 M berturut-turut adalah sebesar 250 dan 203 g/g. Banyaknya urea yang dapat diisikan ke dalam hidrogel pada larutan urea 1 M adalah sebesar 99 %. Laju pelepasan urea dari hidrogel pada air mengikuti pola sigmoid, yaitu model Richards dengan koefisien korelasi sebesar 0.997. Hidrogel ini dapat menghambat pelepasan urea dalam air sebesar 8.2 kali dibandingkan dengan penggunaan urea secara konvensional. Biodegradasi 0.11 g hidrogel dalam 250 g tanah menghasilkan CO2 sebanyak 754 mg selama 29 hari sehingga onggok-g-poliakrilat dapat digunakan di tanah selama lebih dari sebulan.
Kata kunci: biodegradasi, hidrogel, laju pelepasan urea, onggok-g-poliakrilat, pembenah tanah
ABSTRACT
FAHMIY AYATILLAH. Urea Release Rate from Onggok-g-polyacrylate and Its Biodegradation. Supervised by MUHAMAD FARID and MOHAMMAD KHOTIB.
Onggok is a byproduct of tapioca production from cassava. Onggok contains 73% of starch which is potential to be transformed into soil conditioner, i.e. hydrogel to control urea release rate. Onggok was copolymerized by grafting with Na-acrylate, ammonium persulfate as initiator, and N,N-methylene-bis-acrylamide as cross-linker to produce onggok-g-polyacrylate hydrogel. Swelling of the hydrogel in water and 1 M urea solution were 250 and 203 g/g, respectively. The amount of urea that could be loaded into the hydrogel 1 M urea solution was 99%. Urea release rate from hydrogel in water followed a sigmoidal pattern, i.e. Richards model with correlation coefficient of 0.997. This hydrogel could inhibit the urea release in water 8.2 times higher compared with conventional urea application. Biodegradation of 0.11 g of hydrogel in 250 g of soil produced 754 mg of CO2 in 29 days so that it can be used in soil for more than 1 month.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
LAJU PELEPASAN UREA DARI
ONGGOK-
g
-POLIAKRILAT DAN BIODEGRADASINYA
FAHMIY AYATILLAH
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Laju Pelepasan Urea dari Onggok-g-poliakrilat dan Biodegradasinya
Nama : Fahmiy Ayatillah NIM : G44090036
Disetujui oleh
Drs Muhamad Farid, MSi Pembimbing I
Mohammad Khotib, SSi, MSi Pembimbing II
Diketahui oleh
Prof Dr Dra Purwantiningsih Sugita, MS Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tak lupa shalawat serta salam selalu tercurah kepada Nabi Muhammad shalallahu ‘alaihi wassalam yang telah banyak memberikan inspirasi di dalam hati penulis. Tema yang dipilih dalam penelitian yang dilaksanakan dari bulan Mei sampai Desember 2013 ini ialah hidrogel, dengan judul Laju Pelepasan Urea dari Onggok-g-poliakrilat dan Biodegradasinya. Penelitian ini bertempat di Laboratorium Terpadu Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Bapak Muhamad Farid dan Bapak Mohammad Khotib selaku pembimbing. Di samping itu, penghargaan penulis sampaikan kepada seluruh sivitas kimia IPB dan para staf Laboratorium Terpadu IPB terutama Kak Sujono atas bantuannya selama penelitian. Penghargaan juga penulis sampaikan kepada Bapak Ahmad Munfadlil (Ayah) dan Ibu Sahrul Kulmiati (Ibu) yang selalu mendukung dan sabar, Syifa Asatyas (kakak) yang selalu memotivasi, serta Kafi Kalam (adik) yang selalu menolong penulis. Ucapan terima kasih juga penulis sampaikan kepada seluruh mahasiswa Kimia IPB angkatan 46 terutama Rahmawati (rekan penelitian), Pebry, Ilham, Agy, Reza, dan Muhali yang selalu menemani penulis.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
METODE 3
Alat dan Bahan 3
Langkah Kerja 3
Analisis dan Preparasi Tanah 3
Sintesis Onggok-g-poliakrilat 4
Pencirian Onggok-g-poliakrilat 5
HASIL DAN PEMBAHASAN 6
Kopolimerisasi Cangkok Poliakrilat pada Onggok 6 Pelepasan Urea dari Hidrogel Onggok-g-poliakrilat 8
Biodegradasi Onggok-g-poliakrilat 10
SIMPULAN DAN SARAN 12
Simpulan 12
Saran 13
DAFTAR PUSTAKA 13
DAFTAR TABEL
1 Komposisi kimia onggok tapioka 1
2 Pembengkakan dan pengisian urea pada onggok-g-poliakrilat 8 3 Perbandingan bobot CO2 teoretis dan hasil percobaan 12
DAFTAR GAMBAR
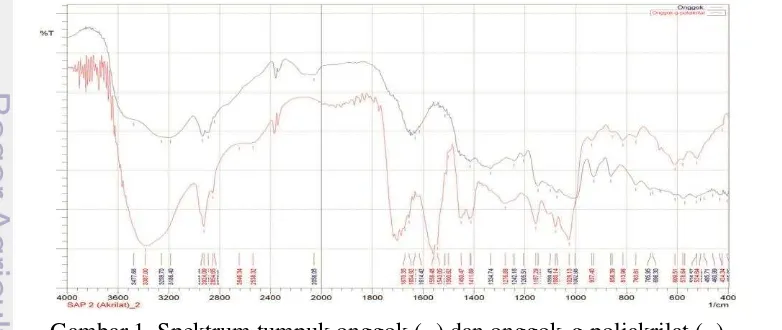
1 Spektrum tumpuk onggok dan onggok-g-poliakrilat 7 2 Keadaan fisik onggok dan onggok-g-poliakrilat 8 3 Ikatan hidrogen dan perbandingan volume ruang 3 dimensi hidrogel
dalam media air dan larutan urea 8
4 Reaksi kondensasi DMAB-urea 9
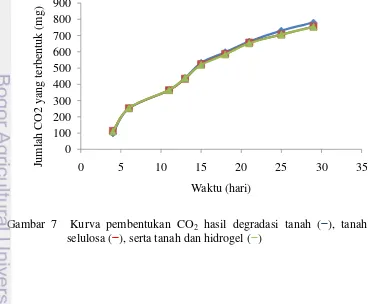
5 Kurva pelepasan urea dari hidrogel ke media air 9 6 Ikatan glikosidik pada amilosa dan amilopektin 10 7 Kurva pembentukan CO2 hasil degradasi tanah, tanah dan selulosa,
serta tanah dan hidrogel 11
DAFTAR LAMPIRAN
1 Bagan alir penelitian 17
2 Data pembengkakan hidrogel dalam air 18
3 Data pembengkakan hidrogel dalam larutan urea 1 M 19 4 Data jumlah urea awal saat pengisian urea ke dalam hidrogel 20 5 Data jumlah urea yang bersisa (tidak terisi ke hidrogel) saat pengisian
urea ke dalam hidrogel 21
6 Data jumlah urea yang terisi ke hidrogel 22
7 Data pelepasan urea dari hidrogel pada media air 23 8 Data kadar air tanah basah, kadar air tanah kering, dan pH tanah 26
9 Data kadar C tanah 27
10 Data kadar N tanah 28
11 Data biodegradasi blangko 29
12 Data biodegradasi selulosa 31
13 Data biodegradasi hidrogel 32
14 Data perhitungan kadar C hidrogel 33
1
PENDAHULUAN
Singkong (Manihot utilissima) atau disebut juga ubi kayu atau ketela pohon merupakan salah satu sumber karbohidrat yang melimpah di Indonesia. Singkong digunakan sebagai bahan baku pada industri makanan, farmasi, dan tekstil. Indonesia menghasilkan 2.4 juta ton singkong pada tahun 2011 (BPS 2012). Pada industri pangan, umumnya pengolahan singkong digolongkan menjadi 3, yaitu fermentasi singkong (tape atau peuyem), singkong yang dikeringkan (gaplek), dan tepung singkong atau tepung tapioka.
Industri tepung tapioka menghasilkan tepung, limbah padat, limbah cair, dan ampas. Limbah padat kulit singkong dapat dimanfaatkan sebagai pupuk dan pakan ternak, limbah cair dapat dimanfaatkan untuk pengairan sawah dan dapat diolah menjadi minuman nata de cassava, sedangkan ampas tapioka (onggok) dapat digunakan sebagai bahan baku pada industri saus, campuran kerupuk, obat nyamuk bakar, dan pakan ternak (BI 2005). Limbah onggok yang dihasilkan dari pengolahan tepung tapioka berkisar 5–15% (Haroen 1993).
Komponen terbanyak onggok adalah pati, yaitu sekitar 72.82% (Tabel 1). Dilihat dari tingginya kadar pati, onggok dapat dimanfaatkan sebagai bahan baku hidrogel. Hidrogel dapat berfungsi sebagai pembenah tanah (soil conditioner). Pembenah tanah ditambahkan untuk memperbaiki mutu fisis tanah dan kemampuan tanah dalam menyediakan nutrisi bagi tanaman (SSSA 2013). Cara penggunaannya adalah dengan mencampurkan hidrogel dalam tanah sebelum tanah tersebut digunakan untuk menanam, atau dengan ditaburkan di atas tanah yang telah ditanami.
Pembenah tanah biasanya digunakan untuk tanah yang telah rusak karena pencemaran atau pengelolaan yang tidak tepat, atau untuk tanah yang tidak sesuai dengan tanaman yang akan ditanam (Schulte dan Kelling 1998). Seiring berjalannya waktu, tanah dapat mengalami pengompakan sehingga akar tanaman sulit tumbuh. Akses air, udara, dan nutrisi juga akan terganggu. Penggunaan pembenah tanah dapat membuat tanah menjadi lebih gembur dan halus sehingga suplai kebutuhan tanaman dapat terpenuhi. Pembenah tanah juga berfungsi menambah kemampuan tanah dalam menahan air (water holding capacity) dan menukar kation (cation exchange capacity). Selain itu, pembenah tanah dapat menyediakan nutrisi bagi tanaman melalui bantuan mikroorganisme tanah yang akan mengurai pembenah tanah organik, atau dengan melepaskan muatan nutrisi pada pembenah tanah tersebut (DeJong-Hughes et al. 2001; Anah 2010).
2
Menurut asalnya, pembenah tanah dibedakan menjadi 2 jenis, yaitu organik dan anorganik. Contoh pembenah tanah organik adalah jerami, serbuk gergaji, dan hidrogel, sedangkan contoh pembenah tanah anorganik adalah kapur, vermikulit, perlit, dan pasir (Davis dan Whiting 2013).
Hidrogel lazim dijadikan pembenah tanah karena tidak saja dapat mengubah sifat fisis tanah, tetapi juga dapat diisi dengan nutrisi bagi tanaman seperti urea. Hidrogel adalah polimer bertaut-silang yang terbentuk dari monomer hidrofilik, sehingga dapat menyerap air di dalam ruang tiga dimensinya melalui ikatan hidrogen (Kabiri et al. 2003). Bahan organik yang dahulu sering digunakan sebagai hidrogel adalah poliakrilamida, tetapi menurut hasil penelitian Woodrow et al. (2008), poliakrilamida komersial biasanya mengandung akrilamida kurang dari 0.05% (b/b). Selain itu, poliakrilamida dapat terdepolimerisasi menjadi monomernya, yaitu akrilamida. Akrilamida bersifat karsinogen dan dapat mencemari tanaman. Oleh karena itu, karbohidrat digunakan sebagai bahan baku alternatif untuk hidrogel, salah satunya adalah pati dari onggok.
Hidrogel dapat dikembangkan untuk mengendalikan pelepasan pupuk di dalam tanah. Penggunaan pupuk secara konvensional dinilai kurang efisien karena sekitar 40–70% pupuk tidak diserap oleh tanaman, tetapi terbawa ke lingkungan dan mencemarinya, salah satu dampaknya adalah terjadinya eutrofikasi (Sutedjo 1987). Umumnya petani juga memberikan pupuk secara berlebih dengan tujuan meningkatkan produksi tanaman. Pemberian pupuk yang berlebihan dengan kandungan N seperti urea pada padi dapat merusak tanaman (Wahid 2003). Penelitian Lokhande dan Varadarajan (1992) menunjukkan bahwa penggunaan hidrogel dapat mengurangi konsumsi air irigasi dan tingkat kematian tanaman, serta meningkatkan pertumbuhan tanaman dan retensi pupuk di tanah.
3
METODE
Alat dan Bahan
Alat-alat yang digunakan antara lain neraca analitik, saringan 100 mesh, penangas air, penyaring vakum, corong Büchner, pengaduk bermagnet, labu leher tiga, mantel pemanas, radas penentuan kadar N cara Kjeldahl, vorteks, pH-meter, wadah kedap udara bervolume 2 L, spektrofotometer inframerah transformasi Fourier (FTIR) Prestige-21 Shimadzu, perangkat lunak Curve Expert 1.4, spektrofotometer ultraviolet-tampak (UV-Vis) 1700 Pharmaspec dan Spectronic 20D+, indikator pH universal, radas uji pelepasan urea, dan alat-alat kaca. Bahan-bahan yang digunakan adalah onggok (dari persediaan di Lab Terpadu IPB), aseton, gas N2, asam akrilat (AA), NaOH 40%, amonium persulfat (APS), N,N-metilena-bis-akrilamida (MBA), metanol, etanol, tanah organik komersial (Setia Tani Group®), K2Cr2O7 1 N, H2SO4 pekat, campuran selen, larutan campuran H3BO3 (10 mL hijau bromokresol (BCG) 0.1% dan 2 mL merah metil (MM) 0.1% yang telah dilarutkan dalam alkohol 95%, kemudian 2 mL campuran ditambahkan ke dalam 500 mL H3BO3 2% b/v), HCl 0.1 M, Ba(OH)2 0.05 M, Na2B4O7 0.05 M, urea, dan larutan p-dimetilaminobenzaldehida (2 g DMAB dilarutkan dalam 100 mL etanol 99% kemudian dicampur 10 mL HCl pekat).
Langkah Kerja
Tahap penelitian terdiri dari 4 garis besar, yaitu analisis tanah serta sintesis, pencirian, dan biodegradasi onggok-g-poliakrilat (Lampiran 1).
Analisis dan Preparasi Tanah
Penentuan Kadar Air Tanah Basah (Balittan 2005)
Cawan porselen dikeringkan dalam oven pada suhu 105 oC selama 30 menit, kemudian didinginkan dalam desikator dan ditimbang. Prosedur tersebut diulangi hingga didapatkan bobot konstan. Sebanyak 5 g contoh tanah dimasukkan ke dalam cawan porselen kering tersebut, kemudian dikeringkan dalam oven pada suhu 105 °C selama 3 jam, didinginkan dalam desikator, dan ditimbang. Prosedur ini juga diulangi hingga didapatkan bobot konstan. Bobot yang hilang setelah pemanasan adalah bobot air.
Kadar air (%) =bobot awal-bobot akhir
bobot awal ×100% Penentuan Kadar Air Tanah Kering (modifikasi Balittan 2005)
Prosedur ini sama seperti penentuan kadar air tanah basah, tetapi tanah yang digunakan kering-udara dan waktu pengeringan dalam oven 24 jam.
Kadar air (%) =bobot awal-bobot akhir
4
Penentuan Kadar C Tanah (Balittan 2005)
Sebanyak 0.1 g contoh tanah kering-udara dimasukkan ke dalam erlenmeyer dan ditambahkan 10 mL K2Cr2O7 1 N, kemudian dikocok hingga tercampur rata. Segera setelah itu, 20 mL H2SO4 pekat ditambahkan dan dikocok hingga tercampur rata, kemudian didiamkan selama 30 menit pada ruang gelap agar K2Cr2O7 mengoksidasi C organik pada tanah. Campuran lalu dipindahkan ke labu takar 100 mL, ditera dengan akuades untuk menghentikan reaksi tersebut, dan dibiarkan selama 24 jam. Setelah itu, campuran disaring dengan kertas saring, dan filtrat ditentukan kadarnya dengan spektrometer 20D+ pada panjang gelombang 561 nm. Standar berupa larutan glukosa diperlakukan sama dengan sampel, kemudian diencerkan hingga didapatkan konsentrasi 3, 30, 150, dan 300 ppm. Penentuan Kadar Nitrogen Tanah (Kjeldahl)
Destruksi. Sebanyak 0.1 g contoh tanah kering-udara dimasukkan ke dalam labu kjeldahl, kemudian berturut-turut ditambahkan 2 g serbuk campuran selen dan 10 mL H2SO4 pekat. Campuran lalu didestruksi dengan pemanasan menggunakan api bunsen hingga larutan berubah warna menjadi jernih kehijauan (sekitar 2 jam).
Distilasi. Larutan yang telah didestruksi dimasukkan ke dalam labu distilasi, ditambahkan 150 mL akuades dan 50 mL NaOH 40 %, kemudian segera dipasang pada radas distilasi. Pada erlenmeyer penampung ditambahkan 20 mL larutan asam borat (yang telah mengandung MM dan BCG). Ujung pipa kondensor harus selalu tercelup pada larutan asam borat. Larutan asam borat akan berubah warna dari merah menjadi biru. Distilasi dihentikan saat volume distilat mencapai 100 mL atau terdengar letupan dalam labu (sekitar 10 menit).
Titrasi. Bagian dalam pipa kondensor dan ujung pipa kondensor dibilas menggunakan sedikit akuades, bilasan tersebut dialirkan ke dalam erlenmeyer penampung. Larutan dalam erlenmeyer lalu dititrasi menggunakan HCl 0.1 N. Titik akhir tercapai saat larutan berubah warna dari biru ke merah, kemudian dititrasi perlahan sampai didapat warna merah yang konstan. Analisis ini dilakukan triplo. Penentuan kadar N organik blangko dilakukan tanpa tanah.
Kadar N (%) = mLsampel-mLblangko × NHCl×BEN
mgsampel ×100%
Penentuan pH Tanah (Balittan 2005)
Sebanyak 5 g contoh tanah dimasukkan ke dalam botol bertutup, kemudian ditambahkan 50 mL akuades, dikocok selama 30 menit, dan didiamkan selama 30 menit. pH suspensi tanah diukur dengan pH-meter yang telah dikalibrasi dengan larutan bufer pH 4.0, 7.0, dan 10.0. Pembacaan pH dianggap stabil apabila pH tidak berubah 0.1 satuan per 30 detik (atau 0.02 satuan per 5 detik).
Sintesis Onggok-g-poliakrilat
Sebanyak 7.5 g onggok dimasukkan ke dalam labu leher tiga, kemudian ditambahkan 75 mL akuades. Campuran diaduk dan dipanaskan hingga suhu 90 o
5 suhu diturunkan hingga 35 oC. Sebanyak 22.5 mL AA yang ditambahkan NaOH 40% hingga pH-nya menjadi 4.83, 0.03 g MBA yang dilarutkan dalam 4 mL akuades, dan 0.3 g APS yang dilarutkan dalam 4 mL akuades, selanjutnya berturut-turut dimasukkan ke dalam labu leher tiga, masing-masing diaduk selama 5 menit. Suhu reaksi lalu ditingkatkan menjadi 70–75 oC, dan campuran didiamkan selama 3 jam. Gel yang terbentuk kemudian direndam dalam 200 mL metanol selama 12 jam, disaring dengan saringan 100 mesh, lalu direndam kembali dalam 200 mL etanol selama 30 menit, disaring dengan saringan 100 mesh, dan direfluks dalam 200 mL aseton selama 1 jam pada suhu 70 oC. Gel kemudian dikeringkan dalam oven pada suhu 60 oC selama 1–2 hari atau sampai mengeras, lalu dihaluskan hingga mencapai ukuran < 100 mesh.
Pencirian Onggok-g-poliakrilat
Penentuan Kadar Air (AOAC 2007)
Prosedur ini sama seperti penentuan kadar air tanah basah, tetapi contoh yang digunakan adalah 2.5 g onggok-g-poliakrilat dan waktu pengeringan dalam oven 5 jam.
Analisis Gugus Fungsi Menggunakan FT-IR
Sebanyak 10 mg sampel ditambahkan 100 mg KBr, kemudian dihomogenkan. Campuran tersebut dikeringkan dalam oven pada suhu 60 oC selama 12 jam, kemudian dibuat pelet dan diletakkan dalam preparat sampel. Contoh dipayar dengan spektrofotometer FT-IR pada bilangan gelombang 450– 4000 cm-1.
Penentuan Kadar C (Balittan 2005)
Prosedur ini sama dengan penentuan kadar C tanah, tetapi sampel yang digunakan sebanyak 0.05 g.
Pengukuran Daya Serap Air (Swelling) (Hekmat et al. 2009; Wu et al. 2012) Sebanyak 0.1 g sampel direndam dalam 100 mL akuades pada suhu kamar selama 24 jam. Kemudian hidrogel yang telah menyerap air dipisahkan dari air yang tidak terserap dengan saringan 100 mesh dan ditimbang bobotnya. Kapasitas penyerapan air (Qeq) dihitung menggunakan persamaan berikut.
Qeq =bobot akhir-bobot awal bobot awal
Pengukuran Muatan (Loading) Urea (Modifikasi Zheng et al. 2009; Modifikasi Anah 2010)
6
digunakan adalah larutan urea 0, 50, 100, 250, dan 500 ppm. Standar juga direaksikan dengan DMAB dan diukur absorbansnya.
Pengukuran Pelepasan Urea pada Medium Air (Modifikasi Zheng et al.
2009)
Hidrogel yang telah terisi urea dimasukkan ke dalam 1 L akuades tanpa pengadukan. Sebanyak 3 mL larutan dicuplik setelah 30 menit, 45 menit. 1, 2, 3, 6, 10, 12, 19, dan 24 jam. Setiap cuplikan direaksikan dengan DMAB dan diukur konsentrasinya dengan metode spektroskopi seperti pada pengukuran muatan urea dalam hidrogel.
Analisis Biodegradasi (ASTM 2003)
Hidrogel dimasukkan ke dalam 250 g tanah yang tidak dikeringudarakan, kemudian diletakkan di dalam wadah kedap udara. Sebanyak 50 mL Ba(OH)2 0.05 M dalam gelas piala 150 mL dan 50 mL akuades dalam gelas piala 100 mL diletakkan di dalam wadah kedap udara tersebut. Hidrogel yang dikubur akan terurai membentuk CO2 yang akan ditangkap oleh Ba(OH)2 dan bereaksi membentuk endapan BaCO3. Wadah digoyang perlahan untuk menghancurkan endapan BaCO3 yang terbentuk pada permukaan Ba(OH)2 agar tidak menghalangi penangkapan CO2 oleh Ba(OH)2. Sisa Ba(OH)2 dititrasi oleh HCl 0.05 M menggunakan indikator fenolftalein untuk menentukan banyaknya CO2 yang terbentuk. Setiap kali titrasi, Ba(OH)2 dan akuades diganti dengan yang segar. Selama pergantian larutan tersebut, wadah dibiarkan terbuka 15 menit hingga 1 jam agar terjadi sirkulasi oksigen.
HASIL DAN PEMBAHASAN
Kopolimerisasi Cangkok Poliakrilat pada Onggok
Kopolimerisasi cangkok adalah pencangkokan suatu polimer pada polimer tulang punggung yang berbeda (Odian 2004). Kopolimerisasi cangkok pada penelitian ini dilakukan secara radikal. Polimer tulang punggung yang digunakan adalah pati dari onggok, sedangkan polimer yang dicangkokkan adalah poliakrilat. Umumnya, pati tergelatinisasi pada suhu 60–70 oC (OSU 2012), sehingga untuk memastikan pati onggok tergelatinisasi, onggok dipanaskan pada suhu 90 o
C dalam air. Gelatinisasi adalah proses rusaknya ikatan antarmolekul pati seperti ikatan hidrogen antargugus –OH pada molekul pati oleh air dan panas sehingga air dapat memasuki ruang antarmolekul pati, berinteraksi dengan molekul pati, dan melarutkannya (Belitz 2009). Dengan tergelatinisasinya pati ini, luas permukaan pati yang akan bereaksi dengan akrilat akan lebih besar.
7 ruang 3 dimensi yang lebih besar pada hidrogel sehingga lebih banyak air dapat masuk ke dalamnya.
Gas O2 yang berada dalam sistem akan membentuk peroksida jika terkena radikal. Peroksida ini akan menghambat kopolimerisasi dan membentuk homopolimer. Untuk mencegah hal tersebut, gas N2 dialirkan ke dalam sistem untuk mengusir O2. Gas N2 bersifat lembam sehingga tidak akan mengganggu kopolimerisasi (Kurniadi 2010). Berbeda dengan Amroni (2011) yang memasukkan inisiator APS di tahap awal, penelitian ini memasukkan inisiator pada tahap akhir. Penambahan APS di tahap awal bertujuan mencegah terbentuknya homopolimer dari akrilamida. Penambahan APS di tahap akhir pada penelitian ini dimaksudkan untuk menghomogenkan onggok, Na-akrilat, dan penaut-silang MBA sebelum APS menginisiasi kopolimerisasi, sehingga diharapkan pembentukan homopolimer dapat dicegah. Pada saat homogenisasi tersebut, suhu sistem diturunkan menjadi 35 oC agar tidak terjadi reaksi di antara molekul-molekul tersebut. Setelah APS dimasukkan ke dalam sistem, suhu ditingkatkan kembali hingga 70 oC karena APS akan membentuk radikal pada suhu 60–65 oC (Lanthong et al. 2006; An et al. 2007; Hua dan Wang 2008; Rui et al. 2009). MBA dapat berperan sebagai penaut-silang karena memiliki 2 gugus fungsi dan memiliki kemiripan struktur dengan monomer yang digunakan (Fitriyanto 2013). Dengan adanya penaut-silang ini, kelunakan hidrogel dapat dikurangi sehingga tidak mudah hancur atau larut dalam pelarutnya. Pencucian dengan metanol dan etanol bertujuan mengikat air, sedangkan refluks dengan aseton bertujuan menghilangkan homopolimer yang ada pada produk.
Pencangkokan mengubah gugus fungsi dan penampakan warna. Spektrum onggok-g-poliakrilat memunculkan peningkatan serapan pada 3387 cm-1 yang menunjukkan ulur –OH gugus karboksilat dari poliakrilat, dan pada 2924 cm-1 yang menunjukkan ulur −C−H dari poliakrilat. Selain itu, muncul serapan baru pada 1670 dan 1558 cm-1, keduanya menunjukkan ulur –C=O karboksilat dari poliakrilat, serta pada 1450 dan 1411 cm-1 yang keduanya menunjukkan ulur
−C−H alkana dari poliakrilat (Gambar 1) (Silverstein et al. 2005). Penampakan onggok berwarna putih, sedangkan onggok-g-poliakrilat berwarna putih kekuningan (Gambar 2).
8
Pelepasan Urea dari Hidrogel Onggok-g-poliakrilat
Onggok-g-poliakrilat memiliki ruang 3 dimensi yang dapat menampung molekul cairan seperti air dan larutan urea. Gugus –C=O dan –NH pada urea dapat berikatan hidrogen dengan hidrogel sehingga 1 molekul urea dapat membentuk lebih banyak ikatan hidrogen dengan hidrogel daripada 1 molekul air. Akibatnya, ruang 3 dimensi yang ditempati oleh larutan urea lebih kecil dibandingkan dengan jika hanya air yang mengisi (Gambar 3). Hal ini menyebabkan pengisian larutan urea pada hidrogel akan menghasilkan pembengkakan yang lebih kecil daripada pengisian dengan air (Tabel 2, Lampiran 2−3).
Pembengkakan dalam air ini lebih kecil daripada hasil penelitian Amroni (2011) yang mencapai 1040.08 g/g. Walaupun Amroni menggunakan akrilamida, proses saponifikasi mengubah –NH2 pada poliakrilamida menjadi −OH sehingga hasilnya dapat dibandingkan dengan penelitiaan ini. Perbedaan hasil pembengkakan mungkin disebabkan oleh penambahan APS pada penelitian ini yang dilakukan di akhir, sedangkan Amroni (2011) menambahkannya di awal.
Gambar 2 Keadaan fisik onggok (a) dan onggok-g-poliakrilat (b)
Gambar 3 Ikatan hidrogen dan perbandingan volume ruang 3 dimensi hidrogel dalam media air (A) dan larutan urea (B)
Tabel 2 Pembengkakan dan pengisian urea pada onggok-g-poliakrilat Pembengkakan Pengisian
urea pada hidrogel dalam air dalam larutan
urea 1 M
9 Penambahan APS di akhir dapat membentuk lebih banyak homopolimer daripada jika APS ditambahkan di awal. Adanya homopolimer dapat mengurangi pembengkakan.
Efisiensi pengisian urea dalam hidrogel sangat tinggi: hampir semua urea dalam larutan terserap (Lampiran 4−6). Pengisian urea dengan metode perendaman dalam penelitian ini lebih besar daripada dengan metode pencampuran urea saat kopolimerisasi berlangsung seperti yang dilakukan oleh Varina (2012). Banyaknya urea yang berhasil diisikan ke dalam onggok-g-poliakrilat pada penelitian tersebut hanya sebesar 48.06%. Tidak seperti pembengkakan dalam media garam, urea dapat dengan mudah memasuki hidrogel karena tidak berkontribusi pada tonisitas (Silverthorn 2012). Tonisitas adalah ukuran gradien tekanan osmosis 2 larutan yang dipisahkan oleh membran semipermeabel (Sperelakis 2011). Garam seperti NaCl tidak dapat masuk ke dalam hidrogel karena NaCl berkontribusi pada tonisitas. Jika hidrogel dimasukkan ke dalam larutan garam hipertonik, maka air akan keluar dari ruang 3 dimensi hidrogel untuk menyamakan konsentrasi garam pada bagian luar dan dalam hidrogel. Hasil penelitian Rui et al. (2009) menunjukkan bahwa pada berbagai konsentrasi larutan urea, tingkat pembengkakan hidrogel hampir sama karena urea tidak memiliki muatan sehingga tidak memengaruhi gaya tolak elektrostatik dari –COO–.
Setelah hidrogel diisi urea, urea yang dilepaskan oleh hidrogel tersebut ke media air diukur selama 1 hari. Urea yang keluar dari hidrogel direaksikan dengan DMAB untuk membentuk produk kondensasi berwarna kuning yang dapat dideteksi secara spektroskopi (Gambar 4).
Gambar 5 menunjukkan kurva pelepasan urea terhadap waktu. Kurva tersebut menunjukkan pola sigmoid. Model kurva sigmoid yang paling mendekati kurva tersebut ialah model Richards. Persamaan tersebut dapat mendekati kurva pelepasan urea dengan baik, dengan koefisien korelasi sebesar 0.9971.
Gambar 5 menunjukkan bahwa setelah 24 jam, pelepasan urea mendekati datar. Banyaknya urea yang dilepaskan selama 24 jam pertama ialah 12.14%.
Gambar 4 Reaksi kondensasi DMAB-urea
10
Berdasarkan pola tersebut, urea diprediksi akan keluar seluruhnya pada hari ke-35. Banyaknya urea yang terlarut selama 24 jam pada penggunaan secara konvensional tanpa pengadukan ialah 100%. Dengan demikian, kemampuan hidrogel dalam menghambat pelepasan urea ialah sekitar 8.2 kali selama 24 jam, dibandingkan dengan tanpa hidrogel (Lampiran 7). Dengan berkurangnya laju pelepasan urea dalam air, dapat dipastikan bahwa laju pelepasan urea dalam tanah (leaching) juga akan berkurang dibandingkan dengan tanpa hidrogel, karena laju pelepasan urea dalam tanah lebih lambat daripada dalam air. Hal ini disebabkan oleh adanya interaksi pupuk dengan tanah, yaitu proses absorpsi dan desorpsi berulang urea oleh hidrogel dan tanah sehingga memperlambat laju pelepasan dalam tanah (Rui et al. 2009).
Metode pengisian urea saat kopolimerisasi yang dilakukan oleh Varina (2012) memberikan hasil yang lebih baik. Selama 24 jam pertama, hidrogel melepaskan urea sebanyak 0.25%, atau dengan kata lain, pelepasan urea dapat dihambat sebesar 392 kali selama 24 jam dibandingkan dengan tanpa hidrogel.
Biodegradasi Onggok-g-poliakrilat
Pada jejaring onggok-g-poliakrilat yang tertaut-silang, proses biodegradasi dimulai pada rantai tulang punggung pati dari onggok, sebab polisakarida ini mudah diurai di alam (Wolfenden et al. 1998). Pati atau amilum adalah karbohidrat yang mengandung banyak glukosa, yang terhubung dengan ikatan glikosidik. Pada amilosa maupun amilopektin, glukosa dihubungkan oleh ikatan
α-(1,4)-glikosidik, sedangkan pada amilopektin, ikatan α-(1,6)-glikosidik membentuk titik percabangan (Gambar 6).
Ikatan α-glikosidik dapat terhidrolisis secara spontan dengan laju 2×10-15 detik-1 pada suhu ruang (Wolfenden et al. 1998). Hidrolisis ini dapat dipercepat oleh enzim α-amilase, yang dihasilkan oleh mikrob. Kapang yang dapat menghasilkan α-amilase antara lain Aspergillus niger, A. oryzae, Thermomyces lanuginosus, dan Penicillium expansum (Aunstrup 1979; Arnesen et al. 1998; Doyle et al. 1998). Bakteri yang dapat menghasilkan α-amilase antara lain Bacillus cereus, B. circulans, B. subtilis, B. licheniformis, dan Clostridium thermosulfurogenes (Siggens 1987; El-Banna et al. 2007; Hyun dan Zeikus 1985).
Media degradasi adalah tanah karena pada aplikasinya nanti, hidrogel ini akan digunakan di tanah. Tanah yang digunakan memiliki kadar air basah 57.97%,
11 nisbah C:N 19.48, dan pH 7.45 (Lampiran 8−10). Kadar air tanah berpengaruh pada biodegradasi karena air dapat berperan sebagai media pertumbuhan mikrob di tanah. Semakin lembap (kadar air tinggi), semakin banyak mikrob yang akan terkandung dalam tanah. Tanah yang digunakan memiliki kelembapan yang tinggi sehingga mikrob diperkirakan dapat tumbuh dengan baik di tanah ini.
Karbon berperan sebagai sumber energi dan untuk pembentukan sel mikrob, sedangkan nitrogen berperan dalam pembentukan sel dan produksi enzim untuk degradasi. Nisbah C:N pada tanah yang optimum untuk biodegradasi berkisar antara 15:1 dan 30:1 (Haug 1993). Jika nisbah C:N terlalu kecil (N terlalu banyak), maka akan terbentuk banyak NH3 yang bersifat racun bagi mikrob. Pembentukan NH4+ yang bersifat asam juga akan menurunkan pH sehingga berada di bawah pH optimum untuk pertumbuhan bakteri. Sebaliknya, jika nisbah C:N terlalu besar (N terlalu sedikit), maka pertumbuhan mikrob dan produksi enzim pendegradasi akan terhambat. Tanah yang digunakan pada penelitian ini cocok sebagai media pendegradasi karena memiliki nisbah C:N pada rentang optimum.
Keasaman tanah juga berpengaruh pada biodegradasi karena mikrob pendegradasi memiliki pH optimum untuk pertumbuhan. Umumnya, pH optimum mikrob berada di sekitar 7. Berdasarkan keasamannya, tanah ini juga cocok untuk dijadikan media biodegradasi karena memiliki pH di sekitar 7.
Gambar 7 menunjukkan pembentukan CO2 yang merupakan hasil degradasi masih terus meningkat selama 29 hari. Belum seluruh sampel terdegradasi atau belum seluruh karbon teroksidasi menjadi CO2 (Tabel 3). Waktu yang dibutuhkan agar seluruh selulosa dan onggok-g-poliakrilat terdegradasi belum dapat ditentukan karena bobot CO2 hasil percobaan adalah campuran hasil oksidasi C tanah, C selulosa, dan C onggok-g-poliakrilat sehingga masih perlu dikurangi CO2 dari blangko. Selisih CO2 sampel nomor 2 dan 3 dengan sampel nomor 1 (blangko) bernilai negatif sehingga hasil degradasi selulosa dan onggok-g-poliakrilat belum dapat ditentukan dalam 29 hari. Belum semua C terdegradasi sehingga onggok-g-poliakrilat berpotensi untuk digunakan lebih dari 29 hari.
12
Bobot CO2 yang dihasilkan blangko paling besar, sedangkan tanah + hidrogel menghasilkan CO2 paling kecil, padahal jumlah karbon terbanyak dimiliki oleh sampel tanah + selulosa. Hal ini mungkin dijelaskan sebagai berikut. Saat awal inkubasi, selulosa dan hidrogel terdegradasi dan menghasilkan CO2 lebih banyak daripada blangko (Lampiran 11−13). Sebelum menjadi CO2, selulosa dan hidrogel terdegradasi menjadi bentuk yang lebih kompleks daripada CO2, misalnya glukosa. Hasil degradasi ini kemudian bercampur dengan tanah dan meningkatkan nisbah C:N tanah (Zhang et al. 2013). Nisbah C:N yang terlalu tinggi ini akan menghambat pertumbuhan mikrob dan pembentukan enzim karena kekurangan N sehingga pada hari-hari berikutnya, sampel tanah yang mengandung selulosa dan hidrogel berbalik menghasilkan CO2 yang jumlahnya lebih sedikit daripada blangko.
Tabel 3 menunjukkan bahwa CO2 yang terbentuk selama 29 hari dari sampel tanah yang mengandung selulosa dan hidrogel hampir sama, padahal jumlah selulosa 10 kali lebih banyak (Lampiran 14−15). Kemungkinan hal ini disebabkan hidrogel mengandung penaut-silang MBA yang mengandung nitrogen. Saat terdegradasi, nitrogen dari MBA menambah kadar N pada tanah sehingga nisbah C:N tanah menurun. Dengan demikian, mikrob pada sampel tanah + hidrogel dapat bekerja lebih baik daripada mikrob pada sampel tanah + selulosa. Selain itu, hidrogel (onggok-g-poliakrilat yang telah diisi akuades) memiliki kadar air yang tinggi sehingga meningkatkan kelembapan tanah dan menyebabkan mikrob dapat hidup dengan lebih baik.
SIMPULAN DAN SARAN
Simpulan
Onggok-g-poliakrilat telah berhasil dibuat melalui kopolimerisasi cangkok Na-akrilat pada onggok dengan inisiator APS dan penaut-silang MBA. Hidrogel ini dapat membengkak dalam air dan larutan urea 1 M berturut-turut sebesar 250 dan 203 g/g. Penambahan APS di akhir menghasilkan pembengkakan yang lebih kecil daripada penambahan APS di awal. Penambahan APS di akhir juga menghasilkan pelepasan urea yang lebih cepat. Penambahan urea saat kopolimerisasi juga dapat memperlambat pelepasan urea dibandingkan dengan pengisian urea dengan cara perendaman. Pada larutan urea 1 M, pengisian urea
Tabel 3 Perbandingan bobot CO2 teoretis dan hasil percobaan
No. Sampel Bobot (g)
13 pada hidrogel mencapai 99%. Jumlah urea yang dapat diisi ke hidrogel dengan metode perendaman ini lebih banyak daripada dengan metode penambahan urea saat kopolimerisasi. Laju pelepasan urea dari hidrogel dalam air dapat didekati menggunakan kurva sigmoid model Richards dengan koefisien korelasi sebesar 0.997. Banyaknya urea yang dilepaskan selama 24 jam adalah 12%. Pengisian urea pada hidrogel dapat menghambat pelepasan urea dalam air sebesar 8.2 kali. Banyaknya CO2 yang terbentuk dari 0.11 g hidrogel pada 250 g tanah adalah 754 mg, tetapi nilai itu masih merupakan total CO2 hasil degradasi hidrogel dan senyawa C organik dalam tanah.
Saran
Untuk mendapatkan hasil pelepasan urea yang lebih lambat, penambahan urea saat kopolimerisasi lebih baik digunakan untuk aplikasi di pertanian. Uji pelepasan urea dari hidrogel dalam tanah (leaching) perlu dilakukan untuk mendapatkan pola pelepasan urea yang lebih sesuai untuk aplikasi. Waktu untuk uji biodegradasi sebaiknya diperpanjang untuk menentukan kapan onggok-g-poliakrilat akan terdegradasi sempurna, sehingga dapat ditentukan pola degradasinya.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemist. 2007. Official Methods of AOAC Intrnational. Rev ke-2. Vol ke-1. Maryland (US): AOAC Int.
[ASTM] American Society for Testing and Materials. 2003. ASTM D5988-03: Standard test method for determining aerobic biodegradation in soil of plastic materials or residual plastic materials after composting. Annual Book of ASTM Standards. Philadelphia (US): ASTM.
Amroni M. 2011. Sintesis superabsorben melalui kopolimerisasi pencangkokan dan penautan-silang onggok dengan akrilamida [skripsi]. Bogor (ID): Institut Pertanian Bogor.
An L, Zhang J, Wang A. 2007. Utilization of starch and clay for preparation of superabsorbent composite. J Res Tech. 98(2):327−332. doi: 10.1016/j. biortech.2005.12.026.
Anah L. 2010. Proses pembuatan material komposit hidrogel dengan pupuk organik secara sistem pelepasan terkendali (controlled release). Laporan Akhir Kegiatan Program Insentif Peneliti dan Perekayasa LIPI Tahun 2010. Bogor (ID): LIPI.
Arnesen S, Eriksen SH, Olsen J, Jensen B. 1998. Increased production of alpha amylase from Thermomyces lanuginosus by the addition of Tween-80. Enzyme Microb Technol. 23(3-4):249-252. doi: 10.1016/S0141-0229.
14
[Balittan] Balai Penelitian Tanah. 2005. Analisis Kimia Tanah, Tanaman, Air, dan Pupuk. Bogor (ID): Balittan.
[BI] Bank Indonesia. 2005. Pengolahan Tepung Tapioka. Pola Pembiayaan Usaha Kecil (PPUK). Jakarta (ID): BI.
[BPS] Badan Pusat Statistik. 2012. Tanaman Pangan [Internet]. [diunduh 2013 Sep 11]. Tersedia pada: http://www.bps.go.id/ tnmn_pgn.php.
Belitz HD, Grosch W, Schieberle P. 2009. Food Chemistry. Ed ke-4. New York (US): Springer.
Davis JG, Whiting D. 2013. Choosing a Soil Amendment. Fact Sheet No. 7.235. Colorado State University Extension [internet]. [diunduh 2013 Sep 11]. Tersedia pada: http://www.ext.colostate.edu/ pubs/garden/07235.html. DeJong-Hughes J, Moncrief JF, Voorhees WB, Swan JB. 2001. Soil Compaction:
Causes, Effects and Control. WW-03115. University of Minnesota Extension [Internet]. [diunduh 2013 Okt 28]. Tersedia pada: http://www. extension.umn.edu/distribution/cropsystems/components/3115s01.html#sect ion1.
Doyle EM, Noone AM, Kelly CT, Quigley TA, Fogarty WM. 1998. Mechanisms
of action of the maltogenic α-amylase of Byssochlamys fulva. Enzyme Microb Technol. 22(7):612-616. doi: 10.1016/S0141-0229(97)00267-6. El-Banna TE, Abd-Aziz AA, Abou-Dobara MI, Ibrahim RI. 2007. Production and
immobilization of α-amylase from Bacillus subtilis. Pak J Biol Sci. 10(12):2039-2047. doi: 10.3923/pjbs.2007.2039.2047.
Fitriyanto E. 2013. Sintesis dan pencirian superabsorben onggok-g-asam akrilat [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Haroen U. 1993. Pemanfaatan onggok dalam ransum dan pengaruhnya terhadap performa ayam broiler [tesis]. Bogor (ID): Institut Pertanian Bogor.
Haug RT. 1993. The Practical Handbook of Compost Engineering. Boca Raton (US): Lewis.
Hekmat A, Barati A, Frahani EV, Afraz A. 2009. Synthesis and analysis of swelling and controlled release behaviour of anionic sIPN acrylamide based hydrogels. World Aca Sci, Eng & Technol. 56:96-100. doi: 10.1.1.193.4184. Hua S, Wang A. 2008. Synthesis, characterization and swelling behaviors of
sodium alginate-g-poly(acrylic acid)/sodium humate superabsorbent. Carbohydr Polym. 75:79-84. doi: 10.1016/j.carbpol.2008.06.013.
Hyun HH, Zeikus JG. 1985. General biochemical characterization of thermostable extracellular β-amylase from Clostridium thermosulfurogenes. Appl Environ Microbiol. 49(5):1162-1167. doi: 0099-2240/85/051162-06$02.00/0
Kabiri K, Omidian H, Hashemi SA, Zohuriaan-Mehr MJ. 2003. Synthesis of fast-swelling superabsorbent hydrogels: effect of crosslinker type and concentration on porosity and absorption rate. European Polym J. 39(7):1341-1348. doi: 10.1016/S0014-3057(02)00391-9.
Kurniadi T. 2010. Kopolimerisasi grafting monomer asam akrilat pada onggok singkong dan karakterisasinya [tesis]. Bogor (ID): Institut Pertanian Bogor. Lanthong P, Nuisin R, Kiatkamjornwong S. 2006. Graft copolymerization,
15 Lokhande HT, Varadarajan PV. 1992. A new guargum-based superabsorbent polymer synthesized using gamma radiation as a soil additive. Biores Technol. 42(2):119-122. doi: 10.1016/0960-8524(92)90070-E.
Mittal H, Mishra SB, Mishra AK, Kaith BS, Jindal R, Kalia S. 2013. Preparation of poly(acrylamide-co-acrylic acid)-grafted gum and its flocculation and biodegradation studies. Carbohydr Polym. 98:397-404. doi: 10.1016/j. carbpol.2013.06.026.
Nie H, Liu M, Zhan F, Guo M. 2004. Factors on the preparation of carboxymethylcellulose hydrogel and its degradation behavior in soil. Carbohydr Polym 58:185-189. doi:10.1016/j.carbpol.2004.06.035.
[OSU] Oregon State University. 2012. Starch. Oregon State University [Internet]. [diunduh 2013 Des 15]. Tersedia pada: http://food.oregonstate.edu/learn/ starch.html.
Odian G. 2004. Principles of Polymerization. Ed ke-4. Toronto (US): Wiley. Rui L, Yuan H, Xi G, Zhou Q. 2009. Synthesis of wheat straw-g-poly(acrylic
acid) superabsorbent composites and release of urea from it. Carbohydr Polym. 77(2):181-187. doi: 10.1016/j.carbpol.2008.12.018.
[SSSA] Soil Science Society of America. 2013. Glossary of Soil Science Terms. Soil Science Society of America [Internet]. [diunduh 2013 Okt 28]. Tersedia pada: https://www.soils.org/ publications/soils-glossary#.
Sari N. 2011. Sintesis polimer superabsorben onggok tapioka-akrilamida: pengaruh konsentrasi inisiator dan penaut-silang. Bogor (ID): Institut Pertanian Bogor.
Schulte EE, Kelling KA. 1998. Organic Soil Conditioners. A2305. University of Winconsin Extension [Internet]. [diunduh 2013 Sep 11]. Tersedia pada: http://www.soils.wisc.edu/ extension/pubs/A2305.pdf.
Siggens K. 1987. Molecular cloning and characterization of the β-amylase gene from Bacillus circulans. Mol Microbiol. 1(3):86-91. doi: 10.1111/j.1365-2958.1987.tb00531.x.
Silverstein RM, Webster FX, Kiemle DJ. 2005. Spectrometric Identification of Organic Compounds. Ed ke-7. Toronto (US): Wiley.
Silverthorn DU. 2012. Human Physiology: An Integrated Approach. Ed ke-6. New Jersey (US): Pearson Education.
Sperelakis N. 2011. Cell Physiology Source Book. Ed ke-4. Massachusetts (US): Academic Pr.
Sutedjo MM. 1987. Pupuk dan Cara Pemupukan. Jakarta (ID): Rineka Cipta. Varina DR. 2012. Sintesis superabsorben onggok-poliakrilat yang diperkaya
dengan urea [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Wahid AS. 2003. Peningkatan efisiensi pupuk nitrogen pada padi sawah dengan metode bagan warna daun. J Litbang Pertanian. 22(4):156-161.
Wolfenden R, Lu X, Young G. 1998. Spontaneous hydrolysis of glycosides. J Am Chem Soc. 120(27):6814-6815. doi: S0002-7863(98)01305-5.
Woodrow JE, Seiber JN, Miller GN. 2008. Acrylamide release resulting from sunlight irradiation of aqueous polyacrylamide/iron mixtures. J Agric Food Chem. 56(8):2773-2779. doi: 10.1021/jf703677v.
16
based on flax yarn waste. Carbohydr Polym. 87(4):2519-2525. doi: 10. 1016/j.carbpol.2011.11.028.
Zhang Y, Wu F, Liu L, Yao J. 2013. Synthesis and urea sustained-release behavior of an eco-friendly superabsorbent based on flax yarn wastes. Carbohydr Polym. 91(1):277-283. doi: 10.1016/j.carbpol.2012.08.041. Zheng T, Liang Y, Ye S, He Z. 2009. Superabsorbent hydrogels as carriers for the
17 Lampiran 1 Bagan alir penelitian
Sintesis onggok-g-poliakrilat
Pencirian onggok-g-poliakrilat
Gugus fungsi Kadar C
Pembengkakan di air
Pembengkakan di larutan urea Kapasitas pengisian urea
Biodegradasi onggok-g-poliakrilat
Kadar C
pH Kadar air
(basah) Kadar air
(kering) Analisis
tanah
Biodegradasi Kadar air
18
Lampiran 2 Data pembengkakan hidrogel dalam air Bobot
hidrogel0 (g)
Bobot saringan
(g)
Bobot saringan + hidrogelt (g)
Bobot hidrogelt
(g)
Pembengkakan terpisah rerata 0.1126 3.9180 30.6704 26.7524 236.5879
249.8507 0.1064 3.5186 31.5077 27.9891 262.0555
0.1063 3.9644 30.7423 26.7779 250.9087 Perhitungan bobot hidrogelt (setelah membengkak):
Whidrogelt = Wsaringan+hidrogelt − Wsaringan = 30.6704 g − 3.9180 g
= 26.7524 g Perhitungan pembengkakan:
Pembengkakan = Whidrogelt – Whidrogel0
Whidrogel0
= 26.7524 g – 0.1126 g 0.1126 g = 236.5879
Rerata pembengkakan = 236.5879 + 262.0555 + 250.9087 3
19 Lampiran 3 Data pembengkakan hidrogel dalam larutan urea 1 M
Bobot
Perhitungan pembengkakan hidrogel di larutan urea: Pembengkakan = Whidrogelt – Whidrogel0
Rerata pembengkakan = 198.5923 + 214.6032 + 198.5923 3
20
Lampiran 4 Data jumlah urea awal saat pengisian urea ke dalam hidrogel Standar & sampel [Urea(aq)]
(ppm) A A terkoreksi
Urea(aq) awal (Pengenceran 1000×) 98.8 0.772 0.223
21 Lampiran 5 Data jumlah urea yang bersisa (tidak terisi ke hidrogel) saat pengisian
urea ke dalam hidrogel
Standar & sampel [Urea(aq)]
(ppm) A A terkoreksi
Sisa urea(aq) (pengenceran 10×) 96.2 0.758 0.226
22
Lampiran 6 Data jumlah urea yang terisi ke hidrogel
ureaaq yang terisi ke hidrogel = ureaaq awal - sisa ureaaq = 98760.7 - 962.144 mg L = 76671.0 mg L
%Urea yang terisi ke hidrogel = ureaaq yang terisi ke hidrogel ureaaq awal
× 100%
= 76671.0 mg
L
23 Lampiran 7 Data pelepasan urea dari hidrogel pada media air
Standar ppm A A terkoreksi Perhitungan konsentrasi urea(s) pada menit ke-360 (pengenceran 10×):
24
Perhitungan konsentrasi urea(s) pada menit ke-360: ureaaq sebenarnya = ureaaq × fp
= 53.5543 mg L × 10 = 535.5434 mg L
Perhitungan bobot urea(s) yang dilepaskan pada menit ke-360: Wureas = ureaaq sebenarnya ×Vureaaq
= 535.5434 mg L × g
103 mg × 1 mL = 0.5355 g
Persamaan kurva pelepasan urea dari hidrogel pada media air
Persamaan Koefisien Nilai
y= a
Banyaknya urea yang dilepaskan selama 24 jam pertama: = bobot urea menit ke-1440
bobot total urea × 100% =
0.7224 g
5.9507 g × 100% = 12.14%
Penghambatan hidrogel terhadap pelepasan urea dibandingkan dengan penggunaan urea secara konvensional:
= bobot urea terlarut pada penggunaan secara konvensional bobot urea yang keluar dari hidrogel
= 100%
25 lanjutan Lampiran 7
Peramalan waktu urea akan keluar seluruhnya dari hidrogel: Waktu (menit)
Bobot urea(s) (g)
∆Waktu
(mnt)
∆Bobot
urea(s) (g)
∆Bobot urea(�)
∆Waktu
(g mnt-1)
Rerata ∆Bobot urea (�)
∆Waktu
(g mnt-1) 600 (pengenceran 10×) 0.6445
1.1640×10-4
720 (pengenceran 10×) 0.6672 120 0.0228 1.8960×10-4 1140 (pengenceran 10×) 0.6926 420 0.0254 6.0422×10-5 1440 (pengenceran 10×) 0.7224 300 0.0298 9.9176×10-5
= bobot total urea rerata∆Bobot ∆Waktuurea(s)
26
Lampiran 8 Data kadar air tanah basah, kadar air tanah kering, dan pH tanah Sampel Perhitungan kadar air tanah kering:
27 Lampiran 9 Data kadar C tanah
Perhitungan ppm C hidrogel:
Atanah = 0.0019 × Ctanah + 0.0145 Ctanah = Atanah– 0.0145
0.0019 = 0.5467 – 0.0145
0.0019 = 275.1862 mg L Perhitungan %C tanah:
%Ctanah = Ctanah × Vlarutan Wtanah × fk = 275.1862
mg
L × 100 mL 0.0981 g × 10
3 mg
g
× 100% (100 - 10.80) = 28.05%
y= 0.0019x+ 0.0145 R= 0.9937
0.00 0.10 0.20 0.30 0.40 0.50 0.60 0.70
0 50 100 150 200 250 300 350
Absor
ba
ns
28
Lampiran 10 Data kadar N tanah Ulangan Bobot
tanah (g)
Volume HCl (mL) Kadar N (%)
0 t ∆ terpisah rerata
Blangko 14.00 14.05 0.05
1.4395 A 0.1026 15.90 17.10 1.20 1.7945
B 0.1012 14.80 15.80 1.00 1.5029 C 0.1019 14.00 14.70 0.70 1.0212 Perhitungan kadar N tanah:
Kadar N = VHCl– Vblangko × HCl × 0.014
Wtanah × fk
= 1.20 – 0.05 mL × 0.1020 N × 0.014
0.1026 g ×
100% (100 - 10.80) = 1.79%
Rerata kadar N = 1.7945 + 1.5029 + 1.0212 % 3
= 1.44 %
Nisbah C:N = kadar C kadar N =
28.05%
29 Lampiran 11 Data biodegradasi blangko
Hari
30
lanjutan Lampiran 11
mmolBa(OH)2 = MBa(OH)2 × VBa(OH)2 = 0.0510 M × 100 mL = 5.1024 mmol mmolHCl = MHCl × VHCl
= 0.0846 M × 50.0 + 18.2 mL = 5.7689 mmol
Ba(OH)2 berlebih + CO2 BaCO3 + H2O + Ba(OH)2 sisa Ba(OH)2 sisa + 2HCl BaCl2 + 2H2O
mmolBa(OH)
2 sisa =
mmolHCl 2 =
5.7689 mmol
2 = 2.8844 mmol mmolCO2 = mmolBa(OH)2 berlebih– mmolBa(OH)2 sisa
= 5.1024 mmol – 2.8844 mmol = 2.2180 mmol
mgCO
2 = mmolCO2 × MrCO2
31 Lampiran 12 Data biodegradasi selulosa
Hari ke-
Ba(OH)2∙8H2O Volume HCl
Konsentrasi HCl (M)
Konsentrasi HCl (mmol)
Konsentrasi Ba(OH)2
(mmol)
CO2 Bobot
(g)
Volume (mL)
Konsentrasi
(M) 0 t ∆
Konsentrasi (mmol)
Bobot (mg)
Bobot kumulatif
(mg) 4 1.5960 100 0.0506 10.2 50.0 39.8 0.0846 4.9484 5.0590 2.5848 113.7043 113.7043
0.0 18.7 18.7
6 1.5826 100 0.0502 0.5 50.0 49.5 0.0621 3.7256 5.0165 3.1537 138.7306 252.4349 0.0 10.5 10.5
32 Lampiran 13 Data biodegradasi hidrogel
Hari ke-
Ba(OH)2∙8H2O Volume HCl
Konsentrasi HCl (M)
Konsentrasi HCl (mmol)
Konsentrasi Ba(OH)2
(mmol)
CO2 Bobot
(g)
Volume (mL)
Konsentrasi
(M) 0 t ∆
Konsentrasi (mmol)
Bobot (mg)
Bobot kumulatif
(mg) 4 1.6532 100 0.0524 1.0 50.0 49.0 0.0846 5.4982 5.2403 2.4912 109.5870 109.5870
0.0 16.0 16.0
6 1.6044 100 0.0509 0.0 50.0 50.0 0.0621 3.5890 5.0856 3.2911 144.7750 254.3619 0.0 7.8 7.8 0.0621
33 Lampiran 14 Data perhitungan kadar C hidrogel
Perhitungan ppm C hidrogel:
Ahidrogel = (0.0019 × Chidrogel) + 0.0145 Chidrogel = Ahidrogel – 0.0145
0.0019 = 0.4921 – 0.0145
0.0019 = 246.9801 mg L Perhitungan %C hidrogel:
%Chidrogel = Chidrogel × Vlarutan Whidrogel × fk = 246.9801
mg
L × 100 mL 0.0717 g × 10
3 mg
g
× 100% (100 - 19.11) = 42.58%
y= 0.0019x+ 0.0145 R= 0.9937
0.00 0.10 0.20 0.30 0.40 0.50 0.60 0.70
0 50 100 150 200 250 300 350
Absor
ba
ns
34
Lampiran 15 Jumlah CO2 teoretis Perhitungan bobot CO2 teoretis tanah:
WC = %C × Wsampel = 28.05% × 250 g × 1000 mg g = 70118.16 mg
WCO2 MrCO2 =
WC ArC
WCO2 = WC
ArC × MrCO2
= 70118.16 mg
12.01 mg mmol × 44.01 mg
35
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 26 Agustus 1991 dari Bapak Ahmad Munfadlil dan Ibu Sahrul Kulmiati. Penulis merupakan anak kedua dari 3 bersaudara. Penulis menyelesaikan studi di SMA Negeri 1 Cikarang Utara pada tahun 2009 dan pada tahun yang sama diterima di Institut Pertanian Bogor (IPB) melalui jalur USMI pada Program Studi Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.