SINTASAN DAN PERTUMBUHAN LARVA UDANG VANAME
YANG DIBERI MANNANOLIGOSAKARIDA (MOS) DENGAN
DOSIS BERBEDA MELALUI ARTEMIA
HESTI IRISSANTI
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul “Sintasan dan Pertumbuhan Larva Udang Vaname yang Diberi Mannanoligosakarida (MOS) dengan Dosis Berbeda Melalui Artemia” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
ABSTRAK
HESTI IRISSANTI. Sintasan dan Pertumbuhan Larva Udang Vaname yang Diberi Mannanoligosakarida (MOS) dengan Dosis Berbeda Melalui Artemia. Dibimbing oleh WIDANARNI dan MUNTI YUHANA.
Penelitian ini bertujuan untuk menguji efektivitas pemberian prebiotik mannanoligosakarida (MOS) melalui artemia terhadap sintasan dan pertumbuhan larva udang vaname. Perlakuan dimulai pada stadia mysis 1 hingga postlarva 11 selama 21 hari dengan kepadatan awal 15 ekor/L dan bobot rata-rata 0,560±0,045 mg/ekor yang dipelihara dalam toples dengan volume air 2 liter. Prebiotik yang digunakan adalah MOS yang berasal dari dinding sel yeast jenis Saccharomyces cerevisiae dalam bentuk sediaan serbuk. Pemberian prebiotik melalui pengkayaan artemia dilakukan dengan 4 perlakuan yaitu K (kontrol, tanpa prebiotik MOS), A (prebiotik MOS 6 ppm), B (prebiotik MOS 12 ppm) dan C (prebiotik MOS 24 ppm) dengan masing-masing 3 ulangan. Hasil penelitian menunjukkan bahwa pemberian prebiotik MOS melalui pengkayaan artemia dapat meningkatkan sintasan larva udang vaname. Pemberian prebiotik dengan dosis 6 ppm (perlakuan A) menghasilkan nilai sintasan tertinggi (92,67±12,70 %) dengan pertumbuhan yang tidak berbeda dibanding perlakuan lain dan kontrol.
Kata kunci : Artemia, larva udang vaname, prebiotik MOS, sintasan
ABSTRACT
HESTI IRISSANTI. Survival and Growth of White Shrimp Larvae Fed by Mannan Oligosaccharides (MOS)-enriched Artemia in Different Dosages. Supervised by WIDANARNI and MUNTI YUHANA.
This study aimed to determine the effectiveness of dietary enrichment of prebiotic mannan oligosaccharides (MOS) through Artemia on survival and growth rate of white shrimp larvae. The treatment of MOS-enriched Artemia was began on stage mysis 1 to postlarva 11 for 21 days with initial density of 15 shrimp larvae/L and an average body weight of 0,560±0,045 mg/larvae. The larvae were cultured in a jar with total water volume of 2 liters. Prebiotics used was MOS derived from yeast cell wall types Saccharomyces cerevisiae as powder. Dietary enrichment of prebiotic through Artemia consisted of four treatments: K (control, without prebiotic MOS), A (prebiotic MOS 6 ppm), B (prebiotic MOS 12 ppm) and C (prebiotic MOS 24 ppm) with 3 replicates for each treatment. The results showed that prebiotics MOS through Artemia enrichment increased the survival of white shrimp larvae. Dietary prebiotics with a dose of 6 ppm (A treatment) showed the highest survival rate (92,67±12,70 %) however with no growth difference than any other treatments and control.
SINTASAN DAN PERTUMBUHAN LARVA UDANG VANAME
YANG DIBERI MANNANOLIGOSAKARIDA (MOS) DENGAN
DOSIS BERBEDA MELALUI ARTEMIA
HESTI IRISSANTI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan
pada
Departemen Budidaya Perairan
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Sintasan dan Pertumbuhan Larva Udang Vaname yang Diberi Mannanoligosakarida (MOS) dengan Dosis Berbeda Melalui Artemia
Nama : Hesti Irissanti NIM : C14110014
Program Studi : Teknologi dan Manajemen Perikanan Budidaya
Disetujui oleh
Dr Ir Widanarni, MSi Dr Munti Yuhana, SPi MSi Pembimbing I Pembimbing II
Diketahui oleh
Dr Ir Sukenda, M.Sc Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga penulis dapat menyelesaikan penulisan skripsi yang berjudul
“Sintasan dan Pertumbuhan Larva Udang Vaname yang Diberi Mannanoligosakarida (MOS) dengan Dosis Berbeda Melalui Artemia”.
Ucapan terima kasih penulis sampaikan karena tanpa adanya kerja sama antara penulis dan semua pihak yang telah memberikan berbagai masukan yang bermanfaat, penyelesaian skripsi ini akan sulit dilakukan. Oleh karena itu, penulis mengucapkan terima kasih kepada:
1. Dr Ir Widanarni, MSi dan Dr Munti Yuhana, SPi MSi selaku dosen pembimbing skripsi yang telah banyak memberi saran dan dukungan dalam pelaksanaan penelitian dan penyusunan skripsi ini;
2. Prof Dr Ir Daniel Djokosetiyanto, DEA dan Dr Sri Nuryati, SPi MSi selaku dosen penguji tamu dan komisi pendidikan departemen atas saran bagi perbaikan skripsi;
3. Seluruh dosen dan staf Departemen Budidaya Perairan yang telah memberikan ilmu dan bantuan yang bermanfaat selama masa perkuliahan; 4. Warga Laboratorium Kesehatan Ikan, Bapak Ranta, kakak S2 yang telah
banyak membantu selama pelaksanaan penelitian;
5. Orang tua tercinta, Ayahanda (Bambang Hadi Doso M), Ibunda (Siti Subaidah), Kakak tersayang (Aditya dan Rian) serta Ahmadan Maulana Hermawan atas segala doa, kasih sayang, motivasi, semangat dan dukungan kepada penulis;
6. Teman-teman Laboratorium Kesehatan Ikan 48 (Kak Dian, Kak Yanti, Adel, Dhyla, Mal, Iqbal, Mulyati, Ridhana, Hana, Mae, Mita, Syifa, Risma, Yuri, Kak Dinda, Kewel, Jani, Adit) atas bantuan dan dukungan selama penelitian; 7. Teman-teman BDP 48 (khususnya Bianingrum, Naufal, Faaza, Mukhlis,
Fajri, Khaeruddin, Anna, Winy, Furqon, Riska, Sulistyowati, Fariz) yang tidak bisa disebutkan disebutkan satu per satu namanya atas semangat, kebersamaan dan kenangannya, serta semua pihak yang tidak bisa disebutkan satu persatu atas segala bantuan yang telah diberikan.
8. Serta seluruh keluarga besar BDP angkatan 47, 48, 49, dan 50 atas segala dukungan dan doanya.
Semoga skripsi ini bermanfaat bagi masyarakat dan seluruh pihak yang membutuhkan.
Bogor, Agustus 2015
DAFTAR ISI
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 2
METODE ... 2
Waktu dan Tempat ... 2
Materi Uji ... 2
Penyiapan Prebiotik ... 2
Penyiapan Artemia ... 2
Pengujian Prebiotik secara In vivo ... 3
Persiapan Wadah dan Media Pemeliharaan ... 3
Persiapan Hewan Uji ... 3
Persiapan Pakan Uji ... 3
Rancangan Percobaan ... 3
Parameter Pengamatan ... 4
Sintasan ... 4
Laju Pertumbuhan Harian ... 4
Pertumbuhan Panjang Mutlak ... 5
Perhitungan Kelimpahan Bakteri / Total Viable Bacterial Count (TBC) ... 5
Kualitas air ... 5
Analisis Data ... 5
HASIL DAN PEMBAHASAN ... 5
Hasil ... 5
Sintasan ... 5
Laju Pertumbuhan Harian (LPH) ... 6
Kelimpahan Bakteri / Total Viable Bacterial Count (TBC) ... 7
Kualitas Air ... 8
Pembahasan ... 8
KESIMPULAN ... 9
DAFTAR PUSTAKA ... 9
LAMPIRAN ... 12
DAFTAR TABEL
1 Rancangan perlakuan pemberian prebiotik MOS melalui pengkayaan artemia pada larva udang vaname ... 4 2 Kelimpahan bakteri selama pemeliharaan larva udang vaname ... 7 3 Hasil pengukuran kualitas air selama pemeliharaan larva udang vaname ... 8
DAFTAR GAMBAR
1 Nilai sintasan larva udang vaname pada akhir perlakuan ... 6 2 Laju pertumbuhan harian larva udang vaname pada akhir perlakuan ... 6 3 Pertumbuhan panjang mutlak larva udang vaname pada akhir perlakuan ... 7
DAFTAR LAMPIRAN
1 Penghitungan bakteri dengan metode hitungan cawan ... 12 2 Analisis statistik sintasan larva udang vaname selama pemeliharaan ... 12 3 Analisis statistik laju pertumbuhan harian larva udang vaname selama
pemeliharaan ... 13 4 Analisis statistik pertumbuhan panjang mutlak larva udang vaname selama
1
PENDAHULUAN
Latar BelakangUdang vaname (Litopenaeus vannamei) merupakan komoditas introduksi yang mempunyai nilai ekonomis tinggi serta mampu berperan sebagai penghasil devisa negara. Udang vaname mulai dibudidayakan di Indonesia sejak tahun 2000 setelah menurunnya produksi udang windu P. monodon (Haryanti et al. 2005). Sejalan dengan produksi udang vaname yang terus naik, volume ekspor udang vaname selama lima tahun terakhir juga menunjukkan peningkatan (DJPB 2014). Permintaan global terhadap udang vaname yang semakin meningkat memacu pembudidaya mengoptimalkan produksi dengan cara mengaplikasikan sistem budidaya intensif dengan harapan didapatkannya periode budidaya yang singkat dengan hasil yang maksimal. Sistem budidaya seperti ini dapat menekan kinerja pertumbuhan komoditas yang dibudidayakan akibat dari padat tebar tinggi yang berdampak pada rendahnya kualitas air, meningkatnya stres, infeksi bakteri dan parasit (Aktas et al. 2014). Beberapa jenis masalah yang timbul yaitu merebaknya Taura Syndrome Virus (TSV) pada tahun 2005, kemudian Infectious Myonecrosis Virus (IMNV) pada tahun 2007 dan akhirnya White Spot Syndrome Virus (WSSV) juga menyerang udang vaname. Agar produksi udang dapat terus meningkat, maka kontrol terhadap penyakit harus menjadi prioritas utama yaitu dengan berbagai upaya penanggulangan penyakit yang telah dilakukan antara lain penggunaan antibiotik, vaksin, immunostimulan dan transfer gen anti virus (Subaidah et al. 2014).
Metode kontrol penyakit menggunakan antibiotik telah lama diterapkan dalam bidang budidaya, tetapi pemberian antibiotik dalam jangka waktu yang lama dan dosis rendah dapat mengakibatkan bakteri terseleksi (Hilman 2001), munculnya patogen yang resisten terhadap antibiotik (Tendencia dan Pena 2001) dan residunya dapat membahayakan bagi konsumen (Reed et al. 2004). Penggunaan antibiotik di Eropa, Amerika dan beberapa negara lain telah dilarang dan telah dibatasi penggunaannya akibat dari efek negatif yang ditimbulkan (Cabello 2006). Salah satu alternatif yang dapat digunakan adalah penggunaan prebiotik untuk pencegahan penyakit dan menjaga kesehatan organisme budidaya serta dianggap lebih aman dan ramah lingkungan. Hasil penelitian sebelumnya menunjukkan bahwa penggunaan prebiotik dapat memperbaiki kinerja pertumbuhan dan meningkatkan imunitas pada hewan akuatik (Mazlum et al. 2011; Sang et al. 2011; Dimitroglou et al. 2010).
2
yang lebih sering digunakan sebagai suplemen tambahan untuk ikan dan krustasea (Sang et al. 2011). Pada ikan rainbow trout (Oncorhynchus mykiss), penggunaan MOS dapat meningkatkan panjang dan kepadatan mikrovili usus sehingga meningkatkan area penyerapan dan kemampuan penyerapan nutrisi pada usus serta mengatur bakteri pada usus (Dimitroglou et al. 2009). Penambahan MOS juga secara signifikan meningkatkan bobot tubuh dan laju pertumbuhan harian pada juvenil lobster (Panulirus ornatus) (Sang dan Fotedar 2010).
Sumber paling umum yang dapat digunakan untuk menghasilkan MOS adalah dari Saccharomyces cerevisae karena mengandung gula mannosa yang tinggi mencapai 45% dari keseluruhan dinding selnya (Turner et al. 2000). Mannosa tersebut berperan dalam menghambat proses penempelan mikroba merugikan pada saluran pencernaan serta dapat merangsang sistem kekebalan. Informasi mengenai aplikasi dan penggunaan prebiotik MOS masih terbatas, sehingga hal tersebut menjadi dasar dilakukannya penelitian ini.
Tujuan Penelitian
Penelitian ini bertujuan untuk menguji efektivitas pemberian mannanoligosakarida (MOS) melalui artemia terhadap sintasan dan pertumbuhan larva udang vaname.
METODE
Waktu dan TempatPenelitian ini dilakukan pada bulan Februari - April 2015 di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Materi Uji
Penyiapan Prebiotik
Prebiotik yang digunakan adalah BIO-MOS (Alltech Inc., KY USA) mengandung mannanoligosakarida (MOS) yang berasal dari dinding sel yeast jenis Saccharomyces cerevisiae dengan komposisi minimal 30% protein kasar, minimal 1,4% lemak kasar dan maksimum 13% serat kasar. MOS ditimbang menggunakan timbangan digital sesuai dosis perlakuan.
Penyiapan Artemia
3
menggunakan selang aerasi yang dialirkan ke luar wadah. Penetasan artemia dilakukan setiap hari dengan jumlah yang disesuaikan dengan kebutuhan larva untuk semua perlakuan.
Pengujian Prebiotik secara In vivo
Persiapan Wadah dan Media Pemeliharaan
Wadah yang digunakan pada penelitian ini berupa toples kaca dengan volume 2 L sebanyak 12 buah. Sebelum digunakan, toples dicuci terlebih dahulu menggunakan sabun dan dikeringkan selama 24 jam untuk selanjutnya diisi air tawar dan didesinfeksi dengan klorin 30 ppm selama 24 jam. Kemudian toples dibilas menggunakan air tawar hingga bersih. Air laut yang akan digunakan disimpan dalam tandon dan didesinfeksi dengan klorin 30 ppm selama 48 jam. Kemudian setiap toples diisi air laut tersebut dengan volume 2 liter dan disusun ke dalam bak fiber ukuran 2 x 1 x 0,5 m3 yang telah diisi air tawar sebanyak 100 liter. Setiap toples diberi aerasi dan kode perlakuan secara acak. Selanjutnya dipasang 4 buah heater pada tiap sudut bak fiber untuk menjaga suhu air pada media pemeliharaan dalam wadah toples.
Persiapan Hewan Uji
Hewan uji yang digunakan pada penelitian ini adalah larva udang vaname (Litopenaeus vannamei) yang berasal dari PT. Biru Laut Khatulistiwa, Kalianda, Lampung dan dipelihara sejak stadia naupli 5 dengan bobot rata-rata 0,016±0,001 mg/ekor dan padat penebaran 100 ekor/L. Pada stadia naupli 5, prebiotik MOS diberikan langsung ke media pemeliharaan larva sebanyak satu kali sehari sesuai dosis perlakuan hingga mencapai stadia zoea 3.
Persiapan Pakan Uji
Pakan yang digunakan pada penelitian ini adalah pakan alami berupa artemia yang telah diperkaya dengan prebiotik MOS sesuai konsentrasi perlakuan dan dilakukan pada wadah yang berbeda. Selain itu, larva tetap diberi pakan berupa Chaetocerros sp. Pengkayaan artemia dilakukan dengan cara menambahkan prebiotik MOS ke dalam media pemeliharaan artemia dan direndam selama 4 jam dengan kepadatan 100 individu/ml. Selanjutnya artemia dipanen dengan cara disaring menggunakan plankton net untuk langsung diberikan pada larva dan selebihnya disimpan pada lemari pendingin untuk digunakan selama 24 jam (Widanarni et al. 2013).
Rancangan Percobaan
4
Tabel 1 Rancangan perlakuan pemberian prebiotik MOS melalui pengkayaan artemia pada larva udang vaname
Perlakuan Keterangan
K : Kontrol (tanpa prebiotik MOS)
A : Prebiotik MOS 6 ppm
B : Prebiotik MOS 12 ppm
C : Prebiotik MOS 24 ppm
Perlakuan pemberian prebiotik melalui artemia dimulai pada stadia mysis 1 hingga postlarva 11 selama 21 hari dengan kepadatan awal 15 ekor/L dan bobot rata-rata 0,560±0,045 mg/ekor. Frekuensi pemberian artemia dilakukan sebanyak 6 kali sehari yaitu pada pukul 02.00; 06.00; 10.00; 14.00; 18.00; dan 22.00 WIB. Pada stadia mysis 1 hingga mysis 3 artemia diberikan sebanyak 3-4 ekor/larva dan pada stadia postlarva 1 hingga postlarva 11 artemia diberikan sebanyak 8-10 ekor/larva (Nimrat et al. 2011). Chaetocerros sp. diberikan sekali sehari dengan kepadatan 105 sel/ml. Penyifonan dan pergantian air sebanyak 5%-10% setiap 3 hari sekali dilakukan secara rutin untuk menjaga kualitas air.
Parameter Pengamatan
Sintasan
Sintasan atau tingkat kelangsungan hidup adalah persentase jumlah udang yang hidup pada akhir masa pemeliharaan dibandingkan dengan jumlah udang pada awal pemeliharaan. Sintasan larva udang vaname dihitung menggunakan rumus (Effendie 1997):
Keterangan :
SR = Sintasan atau kelangsungan hidup (%)
Nt = Jumlah udang pada akhir pemeliharaan (ekor) No = Jumlah udang pada awal pemeliharaan (ekor)
Laju Pertumbuhan Harian
Laju pertumbuhan spesifik atau Specific Growth Rate (SGR) merupakan persentase pertambahan bobot setiap hari selama pemeliharaan. Laju pertumbuhan harian dihitung pada akhir perlakuan berdasarkan rumus (Huissman 1987):
[√ ]
Keterangan :
SGR = Laju pertumbuhan harian (%)
5
Pertumbuhan Panjang Mutlak
Pertumbuhan panjang mutlak merupakan selisih antara panjang akhir dan panjang awal selama pemeliharaan. Pertumbuhan panjang mutlak dihitung menggunakan rumus (Effendie 1997):
Keterangan :
L = Pertumbuhan panjang mutlak (mm) Lt = Panjang akhir perlakuan (mm) Lo = Panjang awal perlakuan (mm)
Perhitungan Kelimpahan Bakteri / Total Viable Bacterial Count (TBC)
Perhitungan kelimpahan bakteri dilakukan pada awal dan akhir perlakuan dengan metode hitungan cawan. Sampel udang sebanyak 3 ekor dari masing-masing pelakuan dihomogenisasi dalam 0,9 ml Phosphate Buffer Saline (PBS) steril. Pengamatan yang dilakukan yaitu kelimpahan bakteri / Total Viable Bacterial Count (TBC) menggunakan media Sea Water Complete (SWC) agar. Prosedur penghitungan kelimpahan bakteri dengan metode hitungan cawan yang dilakukan menurut Madigan et al. (2003) seperti disajikan pada Lampiran 1.
Kualitas air
Pengukuran kualitas air dilakukan secara rutin selama penelitian. Parameter kualitas air yang diukur adalah suhu, salinitas, pH dan DO. Parameter salinitas, pH dan DO diukur setiap minggu sekali dan parameter suhu diukur setiap hari.
Analisis Data
Penelitian ini menggunakan rancangan percobaan berupa Rancangan Acak Lengkap (RAL). Data yang diperoleh diolah menggunakan software Microsoft Excel 2010 dan dianalisis menggunakan SPSS versi 17.0, kemudian diuji lanjut untuk berbeda nyata menggunakan uji Duncan.
HASIL DAN PEMBAHASAN
HasilSintasan
6
Keterangan :
*Huruf yang berbeda menunjukkan hasil berbeda nyata (P<0,05)
** K (kontrol, tanpa prebiotik MOS), A (prebiotik MOS 6 ppm), B (prebiotik MOS 12 ppm), dan C (prebiotik MOS 24 ppm)
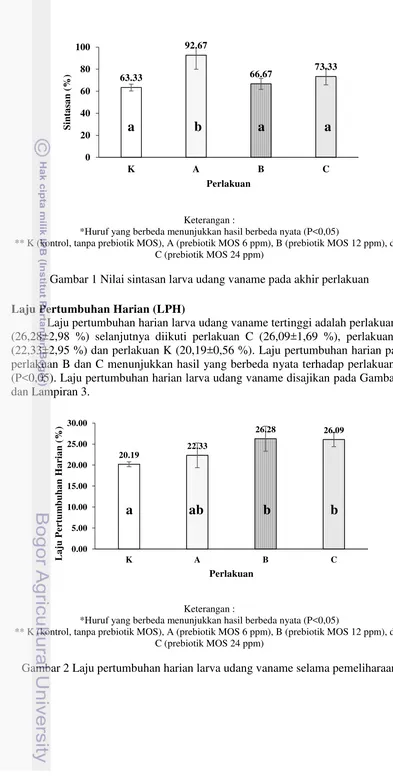
Gambar 1 Nilai sintasan larva udang vaname pada akhir perlakuan
Laju Pertumbuhan Harian (LPH)
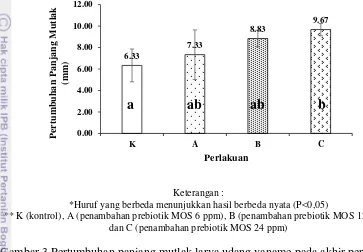
Laju pertumbuhan harian larva udang vaname tertinggi adalah perlakuan B (26,28±2,98 %) selanjutnya diikuti perlakuan C (26,09±1,69 %), perlakuan A (22,33±2,95 %) dan perlakuan K (20,19±0,56 %). Laju pertumbuhan harian pada perlakuan B dan C menunjukkan hasil yang berbeda nyata terhadap perlakuan K (P<0,05). Laju pertumbuhan harian larva udang vaname disajikan pada Gambar 2 dan Lampiran 3.
Keterangan :
*Huruf yang berbeda menunjukkan hasil berbeda nyata (P<0,05)
** K (kontrol, tanpa prebiotik MOS), A (prebiotik MOS 6 ppm), B (prebiotik MOS 12 ppm), dan C (prebiotik MOS 24 ppm)
7
Pertumbuhan panjang mutlak larva udang vaname tertinggi terdapat pada perlakuan C (9,67±0,58 mm) selanjutnya diikuti perlakuan B (8,83±0,76 mm), perlakuan A (7,33±2,31 mm) dan perlakuan K (6,33±1,53 mm). Nilai pertumbuhan panjang mutlak larva udang vaname pada perlakuan C menunjukkan hasil yang berbeda nyata (P<0,05) terhadap perlakuan K. Nilai pertumbuhan panjang mutlak larva udang vaname disajikan pada Gambar 3 dan Lampiran 4.
Keterangan :
*Huruf yang berbeda menunjukkan hasil berbeda nyata (P<0,05)
** K (kontrol), A (penambahan prebiotik MOS 6 ppm), B (penambahan prebiotik MOS 12 ppm), dan C (penambahan prebiotik MOS 24 ppm)
Gambar 3 Pertumbuhan panjang mutlak larva udang vaname pada akhir perlakuan
Kelimpahan Bakteri / Total Viable Bacterial Count (TBC)
Pada awal pemeliharaan, jumlah bakteri pada larva udang vaname di semua perlakuan relatif sama kemudian terjadi peningkatan untuk semua perlakuan pada akhir pemeliharaan. Pada akhir perlakuan, total bakteri tertinggi terdapat pada perlakuan C sebesar 2,36x109 CFU/larva, selanjutnya diikuti oleh perlakuan B sebesar 2,00x109 CFU/larva, perlakuan A sebesar 1,56x109 CFU/larva dan terendah pada perlakuan K sebesar 6,00x107 CFU/larva. Jumlah kelimpahan bakteri pada larva udang vaname sebelum dan setelah perlakuan disajikan pada Tabel 2.
Tabel 2 Kelimpahan bakteri pada larva udang vaname selama pemeliharaan
Perlakuan TBC (CFU/larva)
Keterangan : K (kontrol, tanpa prebiotik MOS), A (prebiotik MOS 6 ppm), B (prebiotik MOS 12 ppm), dan C (prebiotik MOS 24 ppm)
8
Kualitas Air
Parameter kualitas air yang diamati yaitu suhu, salinitas, pH dan DO. Berikut ini merupakan kisaran nilai kualitas air selama pemeliharaan larva udang vaname (Tabel 3).
Tabel 3 Hasil pengukuran kualitas air selama pemeliharaan larva udang vaname
Parameter Satuan Perlakuan
SNI-01-6144-2006
Keterangan : K (kontrol, tanpa prebiotik MOS), A (prebiotik MOS 6 ppm), B (prebiotik MOS 12 ppm), dan C (prebiotik MOS 24 ppm)
Pembahasan
Hasil pengamatan selama pemeliharaan menunjukkan bahwa sintasan larva udang vaname paling tinggi terdapat pada perlakuan A (92,67±12,70 %), selanjutnya diikuti perlakuan C (73,33±7,57 %), perlakuan B (66,67±5,03 %) dan perlakuan K (63,33±3,06 %). Sintasan pada perlakuan A berbeda nyata (P<0,05) terhadap semua perlakuan. Nilai sintasan perlakuan A yang lebih tinggi dibandingkan kontrol diduga karena pengaruh penggunaan prebiotik MOS. Hal ini sesuai dengan penelitian Daniels et al. (2010) yang menunjukkan bahwa pemberian prebiotik MOS melalui pengkayaan artemia dapat meningkatkan sintasan larva lobster Eropa (Homarus gammarus). Hasil tersebut juga telah dibuktikan terhadap hewan akuatik lain seperti pada udang Penaeus semisulcatus (Genc et al. 2007), rainbow trout Oncorhynchus mykiss (Staykov et al. 2007) dan cobia Rachycentron canadumlarvae (Salze et al. 2008).
9
menyebabkan meningkatnya sistem imun pada semua perlakuan tetapi sistem imun yang berlebihan juga dapat merugikan sehingga dapat menurunkan sintasan seperti terdapat pada perlakuan B dan C. Penambahan MOS juga secara signifikan meningkatkan bobot tubuh dan laju pertumbuhan harian pada juvenil lobster (Panulirus ornatus) (Sang dan Fotedar 2010).
Hasil perhitungan kelimpahan bakteri pada akhir pemeliharaan menunjukkan bahwa jumlah sel bakteri tertinggi terdapat pada perlakuan C yaitu sebesar 2,36x109 CFU/larva, selanjutnya diikuti oleh perlakuan B sebesar 2,00x109 CFU/larva, perlakuan A sebesar 1,56x109 CFU/larva dan jumlah sel bakteri terendah pada perlakuan K sebesar 6,00x107 CFU/larva. Kelimpahan bakteri pada stadia postlarva udang sebesar 108 CFU/g (Pangastuti 2008). Menurut Andrews et al. (2009) efek positif MOS yang diekstrak dari dinding sel yeast, dapat meningkatkan pertumbuhan bakteri lactic acid pada usus. Penambahan prebiotik mengakibatkan meningkatnya jumlah sel bakteri pada saluran pencernaan sehingga diduga dapat menstimulir pertumbuhan bakteri. Hasil yang didapatkan oleh Daniels et al. (2010) menunjukkan bahwa penambahan prebiotik MOS pada larva lobster Eropa (Homarus gammarus) menunjukkan bahwa populasi bakteri gastrointestinal (GI) yang lebih stabil dibandingkan dengan perlakuan tanpa pemberian MOS.
Selama masa pemeliharaan, kualitas air di semua perlakuan secara umum masih berada pada kisaran optimal untuk menunjang kebutuhan hidup dan pertumbuhan larva udang vaname (SNI-01-6144-2006). Hal tersebut dapat diasumsikan bahwa perbedaan sintasan, laju pertumbuhan harian dan pertambahan panjang larva udang vaname tidak disebabkan oleh kualitas air.
KESIMPULAN
Pemberian mannanoligosakarida (MOS) melalui pengkayaan artemia dapat meningkatkan sintasan pada larva udang vaname. Pemberian mannanoligosakarida (MOS) dengan dosis 6 ppm (perlakuan A) menghasilkan nilai sintasan tertinggi (92,67±12,70 %) dan pertumbuhan yang tidak berbeda dibanding perlakuan lain dan kontrol. Perlu dilakukan penelitian lanjutan mengenai dosis optimal terhadap larva udang vaname pada skala semi lapang di hatchery.
DAFTAR PUSTAKA
Aktas M, Ciger O, Genc E, Genc MA, Cavdar N. 2014. Effect of mannan oligosaccharide and serotonin on molting, growth, body composition and hepatopancreas histology of white leg shrimp Litopenaeus vannamei. Tuskish Journal of Fisheries and Aquatic Sciences. 14: 205-211.
10
oligosaccharide, yeast extract, protein hydrolysate and chlorella. J. Aquaculture Research. 41: 61–69.
Antarini AAN. 2011. Sinbiotik antara probiotik dan prebiotik. Jurnal Ilmu Gizi (ID). 2(2): 148-155.
Cabello FC. 2006. Heavy use of prophylactic antibiotics in aquaculture: a growing problem for human and animal health and for the environment. Environ. Microbial. 8(7): 1137-1144.
Daniels CL, Merrifield DL, Boothroyd DP, Davies SJ, Factor JR, Arnold KE. 2010. Effect of dietary Bacillus spp. and mannan oligosaccharides (MOS) on European lobster (Homarus gammarus L.) larvae growth performance, gut morphology and gut microbiota. Aquaculture. 304: 49-57.
Dimitroglou A, Merrifield DL, Moate R, Davies SJ, Spring P, Sweetman J, et al. 2009. Dietary mannan oligosaccharide supplementation modulates intestinal microbial ecology and improves gut morphology of rainbow trout, Oncorhynchus mykiss (Walbaum). J Anim Sci. 87: 3226-3234. Dimitroglou A, Merrifield DL, Spring P, Sweetman J, Moate R, Davies SJ. 2010.
Effects of mannan oligosaccharide (MOS) supplementation on growth performance, feed utilisation, intestinal histology and gut microbiota of gilthead sea bream (Sparus aurata). Aquaculture. 300: 182-188. DJPB [Direktorat Jenderal Perikanan Budidaya]. 2014. Udang Vaname dan
Udang Windu Masih Andalan Ekspor Indonesia. Kementerian Kelautan dan Perikanan.
Effendie MI. 1997. Metode Biologi Perikanan. Bogor (ID): Yayasan Dewi Sri Bogor.
Fujaya Y. 2004. Fisiologi Ikan: Dasar Pengembangan Teknologi Perikanan. Jakarta: Rineka Cipta.
Genc MA, Aktas M, Genc E, Yilmaz E. 2007. Effects of dietary mannan oligosaccharide on growth, body composition and hepatopancreas histology of Penaeus semisulcatus (de Haan 1844). Aquaculture Nutrition. 13: 156-161.
Haryanti, Wardana BK, Permana GN, Moria SB. 2005. Pemeliharaan larva Litopenaeus vannamei melalui aplikasi bakteri probiotik Alteromonas sp. BY-9. Aquacultura Indonesiana. 6(3): 93-99.
Hilman K. 2001. Bacteriological aspects of the use of antibiotic and their alternatives in the feed of nonruminant animal. In: P.C Garnsworthy, J. Wiseman, (Eds.), Recent Advances in Animal Nutrition,
Mazlum Y, Yılmaz E, Genc MA, Guner O. 2011. A preliminary study on the use of mannan oligosaccharides (MOS) in freshwater crayfish, Astacus leptodactylus Eschscholtz, 1823 juvenile diets. Aquacult Int. 19: 111-119.
11
Pacific white shrimp Litopenaeus vannamei larvae and postlarvae. Animal Feed Science and Technology. 169: 244-258.
Pangastuti A. 2008. Analisis komunitas bakteri selama tahapan perkembangan larva udang putih Litopenaeus vannamei [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Reed LA, Siewicki TC, Shah JC. 2004. Pharmacokinetics of oxytetracycline in the white shrimp, Litopenaeus setiferus. Aquaculture. 232:11-28. Ringo E, Olsen RE, Gifstad TO, Dalmo RA, Amlund H, Hemre GI, Bakke AM.
2010. Prebiotics in aquaculture: a review. Aquaculture Nutrition. 16: 117-136.
Salze G, McLean E, Schwarz MH, Craig SR. 2008. Dietary mannan oligosaccharide enhances salinity tolerance and gut development of larval cobia. Aquaculture. 274: 148–152.
Sang HM, Fotedar R. 2010. Effects of mannan oligosaccharide dietary supplementation on performances of the tropical spiny lobsters juvenile (Panulirus ornatus, Fabricius 1798). Fish Shellfish Immunol. 2: 483-489.
Sang HM, Fotedakar R, Filer K. 2011. Effects of dietary mannan oligosaccharide on the survival, growth, immunity and digestive enzyme activity of freshwater crayfish, Cherax destructor Clark (1936). Aquacult Nutr. 17: 629-635.
SNI [Standar Nasional Indonesia]. 2006. Produksi Benih Udang Windu Penaues monodon Kelas Benih Sebar. Jakarta (ID): Badan Standarisasi Nasional.
Staykov Y, Spring P, Denev S, Sweetman J. 2007. Effect of a mannan oligosaccharide on the growth performance and immune status of rainbow trout (Oncorhynchus mykiss). Aquac. Int. 15: 153–161. Subaidah S, Carman O, Sumantadinata K, Sukenda, Alimuddin. 2014. Daya
Tahan Udang Vaname Terhadap Infeksi IMNV (infectious myonecrosis virus) Setelah Pemberian Hormon Pertumbuhan Rekombinan. Seminar Nasional Perikanan UGM 30 Agustus 2014. Jogjakarta.
Tendencia EA, Pena LD. 2001. Antibiotic resistance of bacteria from shrimp ponds. Aquaculture. 195: 193-204.
Turner JL, Dritz PAS, Minton JE. 2000. Alternative to conventional microbials in swine diets. Prof Anim Sci. 17: 217-226.
Widanarni, Hadiroseyani Y, Sutanti A. 2013. Pengaruh pemberian probiotik Vibrio SKT-b dengan dosis berbeda melalui Artemia terhadap pertumbuhan pascalarva udang windu Penaeus monodon. Jurnal Akuakultur Indonesia (ID). 12(1): 86-93.
12
LAMPIRAN
Lampiran 1 Penghitungan bakteri dengan metode hitungan cawan
Untuk memenuhi persyaratan statistik, cawan yang dipilih untuk penghitungan koloni adalah yang mengandung antara 30-300 koloni. Berikut ini merupakan langkah metode hitungan cawan:
1. Eppendorf diisi dengan PBS sebanyak 0,9 ml
2. Sampel suspensi bakteri dihomogenkan hingga kekeruhannya merata menggunakan vortex
3. Sampel suspensi bakteri diencerkan dengan metode pengenceran serial 4. Pengenceran serial suspensi bakteri (no. 2) dilakukan dengan cara 0,1 ml
dimasukkan ke 0,9 ml PBS di eppendorf pertama, dihomogenkan menggunakan vortex, kemudian diambil 0,1 ml sampel menggunakan mikropipet secara aseptik dari eppendorf pengencer pertama dan dimasukkan ke dalam tabung pengencer kedua dan seterusnya hingga tabung terakhir 5. Disiapkan cawan petri berisi media agar SWC yang telah diberi kode sesuai
dengan kode eppendorf pengencer yang akan disebar
6. Dilakukan metode penyebaran yaitu mikropipet 0,05 ml sampel dari eppendorf pada pengenceran tertentu, lalu disebar pada media agar dengan menggunakan batang penyebar secara aseptik
7. Kemudian diinkubasi pada suhu ruang selama 24 jam
8. Jumlah koloni yang tumbuh (30-300 koloni) dihitung dan dikalikan dengan faktor pengencernya. Kelimpahan bakteri dihitung dengan menggunakan rumus (Madigan et al. 2003):
∑
Lampiran 2 Analisis statistik sintasan larva udang vaname selama pemeliharaan
ANOVA
Jumlah Kuadrat Derajat Bebas Kuadrat Tengah Nilai F Nilai P
13
Lampiran 3 Analisis statistik laju pertumbuhan harian larva udang vaname selama pemeliharaan
ANOVA
Jumlah Kuadrat Derajat Bebas Kuadrat Tengah Nilai F Nilai P
Perlakuan 76,250 3 25,417 5,083 0,029
Galat 40,000 8 5,000
Total 116,250 11
Uji Duncan
Perlakuan N α = 0,05
1 2
K 3 20,3333
A 3 22,3333 22,3333
B 3 26,0000
C 3 26,3333
Sig. 0,305 0,069
Lampiran 4 Analisis statistik pertumbuhan panjang mutlak larva udang vaname selama pemeliharaan
ANOVA
Jumlah Kuadrat Derajat Bebas Kuadrat Tengah Nilai F Nilai P
Perlakuan 21,896 3 7,299 1,212 0,366
Galat 48,167 8 6,021
Total 70,063 11
Uji Duncan
Perlakuan N α = 0,05
1 2
K 3 6,333
A 3 7,333 7,333
B 3 8,667 8,667
C 3 9,667
14
RIWAYAT HIDUP
Penulis dilahirkan di Situbondo, Jawa Timur pada tanggal 6 April 1993 sebagai anak ketiga dari tiga bersaudara oleh pasangan bapak Bambang Hadi Dosomardi dan ibu Siti Subaidah. Penulis menyelesaikan pendidikan sekolah menengah atas di SMAN 1 Situbondo, Jawa Timur dan lulus pada tahun 2011. Pada tahun yang sama, penulis diterima di Institut Pertanian Bogor Departemen Budidaya Perairan, Fakultas Perikanan dan Kelautan melalui jalur SNMPTN Undangan.
Penulis mendapat kesempatan untuk melaksanakan Praktik Lapang Akuakultur di Balai Besar Penelitian dan Pengembangan Budidaya Laut (BBPPBL) Gondol, Bali dengan judul Pembenihan Ikan Kerapu Cantik Hasil Persilangan Ikan Kerapu Macan dan Kerapu Batik pada tanggal 23 Juni 2014 hingga 2 Agustus 2014. Penulis juga pernah menjadi asisten praktikum Dasar-dasar Mikrobiologi Akuatik tahun ajaran 2013/2014 dan asisten praktikum Manajemen Kesehatan Organisme Akuatik tahun ajaran 2014/2015.
Beberapa pengalaman organisasi dan kegiatan kepanitiaan kampus yang penulis pernah ikuti diantaranya: Anggota Divisi Pengembangan Olah Raga dan Seni HIMAKUA IPB 2012, Anggota Divisi Publik Relation HIMAKUA IPB 2013, Kepada Divisi Dana Usaha kegiatan Aquaculture Festival HIMAKUA IPB 2014, Bendahara 2 kegiatan IPB Art Contest (IAC) 2014.
Tugas akhir penulis dalam menyelesaikan pendidikan tinggi di Institut Pertanian Bogor untuk mendapatkan gelar Sarjana Perikanan ini berjudul