KARAKTERISASI PROTEIN PROTOKSIN DAN
ENZIM KITINASE YANG DIHASILKAN OLEH
ISOLAT LOKAL
Bacillus thuringiensis
MAISYA ZAHRA AL BANNA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
RINGKASAN
MAISYA ZAHRA AL BANNA. Karakterisasi protein protoksin dan enzim kitinase yang dihasilkan oleh isolat lokal Bacillus thuringiensis. Dibimbing oleh NISA RACHMANIA MUBARIK dan YADI SURYADI.
Kajian mengenai B. thuringiensis banyak terfokus pada protein protoksin, namun potensinya sebagai penghasil enzim kitinolitik tidak banyak dieksplorasi. Kemampuan B. thuringiensis dalam menghasilkan enzim kitinase sering dikaitkan dengan peningkatan toksisitas galur terhadap serangga uji. Penelitian ini bertujuan untuk memproduksi kitinase, mengukur aktivitasnya, dan melakukan karakterisasi dari kitinase isolat lokal B. thuringiensis Lot II dan B. thuringiensis 47, dibandingkan dengan isolat B. thuringiensis subsp. pakistani.
Pengamatan pertumbuhan isolat B. thuringiensis terlebih dahulu diamati menggunakan media selektif, demikian juga dengan pengukuran produksi protoksin selama 36 jam inkubasi. Konsentrasi protein protoksin diukur dengan metode Bradford. Hasil menunjukkan kultur memasuki fase stasioner pada jam ke-21, sementara itu produksi protoksin tertinggi diperoleh pada jam ke-24. Selanjutnya dilakukan pengamatan pertumbuhan, produksi protoksin dan enzim kitinase pada media produksi kitinase yang mengandung 0,3% koloidal kitin. Uji aktivitas enzim ditentukan berdasarkan metode Splinder, yang diamati setiap 3 jam selama 36 jam inkubasi. Pengamatan morfologi isolat dilakukan dengan pewarna Coommasie Brilliant Blue G250 menggunakan mikroskop cahaya.
Tiga isolat B. thuringiensis menunjukkan kecenderungan untuk mengalami kenaikan jumlah sel (CFU/ml) sejak awal inokulasi. Pertumbuhan logaritmik B. thuringiensis Lot II dan B. thuringiensis 47 pada jam ke-33, sementara itu penurunan jumlah sel terjadi pada interval jam ke-54 dan 72, sedangkan isolat B. thuringiensis subsp. pakistani terjadi sampai dengan jam ke-36. Produksi protoksin isolat B. thuringiensis Lot II dan B. thuringiensis 47 memproduksi protoksin sejak awal inkubasi, meskipun dalam konsentrasi yang sangat rendah, sedangkan protoksin isolat B. thuringiensis subsp. pakistani terdeteksi mulai jam ke-3. Ketiga isolat lokal menghasilkan protein protoksin tertinggi pada jam ke-36 waktu inkubasi.
Enzim kitinase dihasilkan isolat B. thuringiensis Lot II pada jam ke-12 dengan nilai 0,026 U/ml, sedangkan B. thuringiensis 47 dan B. thuringiensis subsp. pakistani pada jam ke-9 dengan nilai aktivitas berturut-turut 0,00700 U/ml dan 0,00025 U/ml. Aktivitas kitinase isolat B. thuringiensis Lot II dan 47 optimum menghasilkan kitinase pada jam ke-21 dengan nilai 0,115 U/ml dan 0,058 U/ml, sedangkan isolat B. thuringiensis subsp. pakistani optimum pada jam ke-24 dengan nilai 0,049 U/ml. Penurunan produksi enzim kitinase terjadi setelah melewati waktu optimum, yaitu sampai akhir waktu inkubasi pada jam ke-36
Pemekatan enzim menggunakan amonium sulfat diperoleh aktivitas kitinase tertinggi B. thuringiensis Lot II diperoleh pada pemekatan enzim 80% dengan nilai 0,013 U/ml, 50% untuk isolat B. thuringiensis 47 dengan nilai 0,17 U/ml, serta pemekatan enzim 20% dengan nilai 0,017 U/ml untuk isolat B. thuringiensis subsp. pakistani. Konsentrasi protein tertinggi diperoleh pada
pemekatan amonium sebanyak 60% sebesar 0,522 mg/ml untuk isolat B. thuringiensis Lot II dan 0,693 mg/ml untuk B. thuringiensis 47. Sedangkan
pemekatan enzim mencapai 80% akan menghasilkan protein berkonsentrasi 0,336 mg/ml untuk isolat B. thuringiensis subsp. pakistani. Berdasarkan perhitungan aktivitas spesifik kitinase hasil pemekatan, diperoleh nilai tertinggi sebesar 0,2330 U/ml (30%) untuk B. thuringiensis Lot II, 0,1220 U/ml (40%) pada isolat B. thuringiensis 47, dan 0,1735 U/ml (20%) untuk B. thuringiensis subsp. pakistani. Puncak aktivitas spesifik kitinase hasil pemekatan selanjutnya digunakan untuk mengukur berat molekul protein enzim menggunakan SDS-PAGE. Hasil pengukuran berat molekul protein setiap isolat menggunakan SDS PAGE menunjukkan terdapatnya kandidat pita yang diduga merupakan pita protein protoksin dengan berat molekul 129,99 dan 130,04 kDa, serta protein kitinase pada berat molekul 71 kDa.
ABSTRACT
MAISYA ZAHRA AL BANNA. Characterization of protoxin protein and chitinase enzyme from indigenous isolates Bacillus thuringiensis. Supervised by NISA RACHMANIA MUBARIK and YADI SURYADI.
Bacillus thuringiensis secreted exochitinase activity when grown in a medium containing chitin. Chitinase and protoxin protein play a important role in the pathogenicity of Bacillus thuringiensis to insect pest. This research was aimed to determined characterization of B. thuringiensis subsp. pakistani indigenous isolates, B. thuringiensis Lot II, and B. thuringiensis 47 to produce chitinase enzyme and protoxin protein. Optimum production of chitinase from B. thuringiensis subsp. pakistani was obtained at 24th hours, pH 7.5, and 40oC.
B. thuringiensis Lot II was optimum at 21th hour, pH 6,0, and 50oC. B. thuringiensis 47 was optimum at 21st hour, pH 5,0, and 35 oC. Ammonium
sulphate was used for precipitation of chitinase protein. The highest spesific activity of chitinase was obtained on ammonium sulphate at saturation 20% for B. thuringiensis subsp. pakistani, 30% for B. thuringiensis Lot II and 40% for
B. thuringiensis 47. The highest production of protoxin protein from B. thuringiensis subsp. pakistani and B. thuringiensis 47 was obtained at 36th
hour, whereas B. thuringiensis Lot II at 33rd hour. The molecule weight of chitinase molecule was determined by Sodium Dodecyl Sulfate Solution Polyacrilamide Gel Electrophoresis (SDS-PAGE). Molecular weight of chitinase of B. thuringiensis subsp. pakistani, B. thuringiensis Lot II and 47 estimated at 71,15 kDa. The weight of protoxin protein molecule all isolates estimated 129,99 and 130,04 kDa.
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa tesis yang berjudul Karakterisasi Protein Protoksin dan Enzim Kitinase yang Dihasilkan oleh Isolat Lokal Bacillus thuringiensis adalah karya saya dengan arahan dari komisi pembimbing dan
belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir tesis ini.
Bogor, Oktober 2012
Maisya Zahra Al Banna
@Hak Cipta Milik IPB, Tahun 2012
Hak cipta Dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencamtumkan atau menyebutkan sumbernya.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB 2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya
KARAKTERISASI PROTEIN PROTOKSIN DAN
ENZIM KITINASE YANG DIHASILKAN OLEH
ISOLAT LOKAL
Bacillus thuringiensis
MAISYA ZAHRA AL BANNA
Tesis sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Mikrobiologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Karakterisasi Protein Protoksin dan Enzim Kitinase yang Dihasilkan oleh Isolat Lokal Bacillus thuringiensis
Nama : Maisya Zahra Al Banna NIM : G351090201
Disetujui Komisi Pembimbing
Dr. Nisa Rachmania Mubarik, M.Si. Ketua
Ir. Yadi Suryadi, M.Si. Anggota
Diketahui,
Ketua Program Studi/ Mayor Mikrobiologi
Dr. Gayuh Rahayu
Dekan Sekolah Pascasarjana IPB
Dr. Ir. Dahrul Syah, MSc.Agr.
PRAKATA
Segala puji bagi Allah SWT, Tuhan alam semesta, pujian memenuhi nikmat-nikmat-Nya dan mencukupi tambahan (nikmat)-Nya. Rasa syukur penulis panjatkan hingga karya ilmiah ini dapat terselesaikan. Penelitian ini berjudul “Karakterisasi protein protoksin dan enzim kitinase yang dihasilkan oleh isolat lokat Bacillus thuringiensis”.
Ucapan terima kasih penulis haturkan kepada Ibu, Ayah dan Kak Zia yang senantiasa memberi dukungan dan doa. Terima kasih kepada pembimbing tesis yang diketuai oleh Ibu Dr. Nisa Rachmania Mubarik, M.Si dan Bapak Ir. Yadi Suryadi M.Sc. Ucapan terima kasih disampaikan kepada Ibu Dr. Suryani M.Sc selaku penguji dari luar komisi pembimbing untuk kritik, saran dan kesempatan bagi penulis dalam memperbaiki penulisan karya ilmiah ini. Terima kasih disampaikan kepada Bapak Dr. Ence Darmo Jaya Supena atas saran dan diskusi yang diberikan. Teman seperjuangan dari mayor Mikrobiologi, Eca, Dian, Kae’ yang senantiasa membantu dan memberikan semangat. Semoga hasil penelitian ini bermanfaat, dan mencari ilmu merupakan pekerjaan yang tidak pernah selesai.
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 1 Juli 1986 sebagai anak kedua dari pasangan Bapak Miftachul Arifin, SH, dan Ibu Hanizar Hasyim.
DAFTAR ISI
Halaman
DAFTAR TABEL ………... xiv
DAFTAR GAMBAR……….... xv
DAFTAR LAMPIRAN……… xvi
PENDAHULUAN Latar Belakang………..……... 1
Tujuan Penelitian……….……… 3
Manfaat Penelitian………...………… 3
TINJAUAN PUSTAKA Bacillus thuringiensis………..……… 5
Protein Protoksin……….……… 6
Kitin………. 8
Kitinase……….... 9
BAHAN DAN METODE Tempat dan Waktu………..… 13
Bahan………...…… 13
Pertumbuhan dan Peremajaan Isolat B.thuringiensis…….……… 13
Pengamatan Morfologi Isolat B. thuringiensis………. 13
Pengukuran Pertumbuhan dan Produksi Protein Protoksin Isolat pada Media Selektif B. thuringiensis……...……… 13
Pengukuran Pertumbuhan dan Produksi Protein Protoksin Isolat pada Media Produksi Kitinase………...……….. 14
Pengukuran Konsentrasi Protein Protoksin Isolat B. thuringiensis……. 14 Pengukuran Aktivitas Enzim Kitinase Isolat B. thuringiensis………... 15
Karakterisasi Ekstrak Kasar Kitinase………... 15
Pengukuran Konsentrasi Protein………. 15
Pemekatan Ekstrak Kasar Enzim Kitinase………... 16
HASIL
Morfologi Isolat B. thuringiensis…….………... 19
Kurva Pertumbuhan, Produksi Protoksin dan Enzim Kitinase Isolat B. thuringiensis……….………... 19
Karakterisasi Ekstrak Kasar Kitinase……….…………. 23
Penentuan Berat Molekul Protein B. thuringiensis…..………...……... 26
PEMBAHASAN………..…………...……… 29
SIMPULAN………... 35
DAFTAR PUSTAKA………..………... 37
DAFTAR TABEL
Halaman 1 Tipe dan spesifikasi protein delta endotoksin... 7 2 Bakteri dan karakteristik kitinase yang dihasilkan... 10 3 Peranan kitinase pada beberapa organisme... 11 4 Aktivitas kitinase dan konsentrasi protein isolat B. thuringiensis setelah
dilakukan pemekatan ekstrak kasar kitinase menggunakan amonium
sulfat……….………. 27
5 Aktivitas spesifik kitinase isolat B. thuringiensis setelah dilakukan
pemekatan ekstrak kasar kitinase menggunakan amonium sulfat…….…... 27 6 Perbandingan produksi protein protoksin dan enzim kitinase dari
DAFTAR GAMBAR
DAFTAR LAMPIRAN
Halaman 1 Kurva standar N-asetil-glukosamin (NAG)... 45 2 Kurva standar bovine serum albumin (BSA)... 45
3 Kurva penanda berat molekul protein kitinase... 45
PENDAHULUAN Latar Belakang
Bakteri Bacillus thuringiensis termasuk Gram positif yang berpotensi dikembangkan sebagai bioinsektisida. Formula komersial produk insektisida pertama kali dikembangkan pada tahun 1950 kemudian semakin intensif dikembangkan pada tahun 1960. Ketika tanaman transgenik dikembangkan sekitar tahun 1996 dan diikuti dengan peningkatan luas daerah tanam, maka potensi B. thuringiensis sebagai bioinsektisida menjadi semakin banyak digunakan. Potensi tersebut erat kaitannya dengan kemampuan B. thuringiensis dalam membentuk protein insektisidal berupa protoksin dan protein sitolitik. Keunggulan formulasi B. thuringiensis sebagai bioinsektisida dibandingkan dengan pestisida kimia ialah toksisitas dan kespesifikan yang tinggi terhadap serangga target (Kumar et al. 2008).
Bioinsektisida berbahan aktif B. thuringiensis yang digunakan untuk lahan pertanian di Indonesia sebagian besar diimpor dari berbagai negara, diantaranya Dipel yang diproduksi dari Amerika Serikat, serta Thuricide dari Swiss. Di lain
sisi, kelimpahan populasi B. thuringiensis yang cukup tinggi di habitat tanah akan memperbesar kesempatan perolehan isolat berpotensial.
Muharsini et al. (2003) telah mengisolasi B. thuringiensis dari sampel tanah Provinsi Jawa Barat, Yogyakarta dan Sulawesi Selatan. Letak geografis dan kondisi tanah dilaporkan mempengaruhi germinasi endospora. Lokasi pengambilan sampel pada dataran tinggi menunjukkan populasi B. thuringiensis yang lebih tinggi dibandingkan dengan dataran rendah. Khudra (2011) berhasil mengisolasi isolat potensial B. thuringiensis dari beberapa lokasi pengambilan sampel yaitu Lampung, Kalimantan Timur dan Bali, dua isolat yang diperoleh tersebut digunakan dalam penelitian ini.
banyak dieksplorasi Potensi toksisitas protoksin isolat lokal B. thuringiensis terhadap hama ulat grayak juga telah dilakukan oleh Khudra (2011) dan Sukmawaty (2012), namun studi mengenai karakteristik berupa berat molekul protoksin tidak dilakukan, demikian pula dengan aktivitas kitinolotik isolat lokal tersebut.
Distribusi kitin yang luas di alam dan cukup mudah ditemukan pada beberapa jenis mahluk hidup seperti komponen penyusun dinding sel cendawan, saluran pencernaan serangga bahkan selubung mikrofilaria nematoda akan mendorong pemanfaatan enzim yang dapat memecah kitin tersebut. Sampson dan Gooday (1998), Wiwat et al. (2000) serta Suero et al. (2011) menemukan bahwa kombinasi perlakuan antara isolat kitinolitik dan protoksin B. thuringiensis menunjukkan nilai konsentrasi letal yang lebih tinggi sehingga toksisitasnya meningkat. Aktivitas kitinolitik dan protoksin B. thuringiensis dapat memicu lisis sitoplasma serta pembengkakan mikrofili usus serangga.
Aktivitas anticendawan B. thuringiensis diketahui memberikan efek antagonis terhadap cendawan patogen (Ramirez et al. 2004, Usharani & Gowda 2011). Cendawan patogen Sclerotium rolfsii dihambat pertumbuhannya mencapai 100% pada media pertumbuhan yang mengandung kitinase. Selain S. rolfsii, kitinase B. thuringiensis juga dapat menghambat Fusarium oxysporum, Aspergillus flavus, dan Beauveria bassiana.
Tujuan Penelitian
Penelitian ini bertujuan untuk memproduksi protein protoksin dan enzim kitinase dari dua isolat lokal B. thuringiensis, serta melakukan karakterisasi dari kitinase dan protoksin isolat tersebut. Isolat B. thuringiensis subsp. pakistani digunakan sebagai isolat pembanding dalam penelitian ini.
Manfaat Penelitian
TINJAUAN PUSTAKA
Bacillus thuringiensis
Bacillus thuringiensis pertama kali diisolasi oleh Ishiwata pada tahun 1901
dari larva ulat sutera, yang kemudian diberi nama sebagai isolat Bacillus sotto. Tahun 1991, Berliner berhasil mengisolasi Bacillus dari larva ngengat Mediterania, dan menamai isolat tersebut sebagai B. thuringiensis. Bakteri B. thuringiensis digunakan sebagai insektisida pada tahun 1950 di Amerika Serikat. Produk komersial pertama diberi nama Thurincide yang dipreparasi dari
isolat B. thuringiensis subsp. kurstaki. Dulmage menemukan isolat B. thuringiensis subsp. kurstaki (HD-1) yang lebih aktif, yang dikomersialkan
dengan nama Dipel. Tahun 1970, penggunaan B. thuringiensis di bidang pertanian mengalami penurunan sebagai akibat komersialisasi pestisida kimia. Kemajuan bioteknologi mulai mempengaruhi perkembangan penelitian B. thuringiensis, pada tahun 1980 telah dihasilkan produk kloning yang memiliki aktivitas insektisidal yang lebih tinggi dibanding dengan isolat B. thuringiensis tipe liar (Cetinkaya 2002).
Bakteri B. thuringiensis sebagai Gram positif dapat membentuk endospora, serta menghasilkan kristal protein pada fase stasioner selama masa pertumbuhan. Beberapa jenis toksin yang dihasilkan antara lain ialah kristal
protein insektisida, vegetatif insektisida protein, serta beta eksotoksin (β-eksotoksin). Kristal protein atau yang dikenal juga sebagai protoksin bersifat
insektisidal sintetik. Galur B. thuringiensis yang akan dikomersialisasi harus bebas dari kandungan β–eksotoksin (Schnepe et al. 1998, Perchat et al. 2005, Innes & Bouwer 2009).
Protein Protoksin
Protein protoksin atau disebut juga protein Cry terdiri dari atas domain. Domain I terdiri atas 7 α-heliks, α-heliks ke-5 berada di tengah bersifat hidrofobik dan dikelilingi 6 α-heliks ampifatik lainnya. Domain I berfungsi dalam proses insersi dan pembentukan pori pada membran pencernaan serangga. Domain II terdiri atas 3 lipatan-β yang antiparalel, domain ini terlibat dalam pengikatan toksin pada reseptor. Domain III merupakan lipatan β-sandwich yang terpilin, domain ini berperan dalam sejumlah kunci penting dalam proses biokimia, integritas struktur protein, pengikatan reseptor, penetrasi membran, dan fungsi pori (Gambar 1) (Schnepf et al. 1998).
Gambar 1 Struktur protoksin (protein Cry). Domain I ditunjukkan dengan warna biru. Domain II ditunjukkan dengan warna jingga. Domain III ditunjukkan dengan warna hijau (http://bioquest.org).
Penelitian Frankenhuyzen (2009) menunjukkan terdapat holotipe protoksin B. thuringiensis yang mampu membunuh 71 spesies ordo Lepidoptera, 23 spesies
menjadi peptida toksin berukuran kecil (60 – 70 kDa) dan akan bereaksi di dalam usus serangga. Mekanisme sama terjadi pada Diptera dan Coleoptera, perbedaan terletak pada toksin yang tidak disintesis menjadi peptida lebih kecil namun toksin akan tetap disimpan sebagai protoksin (Bradley et al. 1994).
Tabel 1 Tipe dan spesifikasi protein delta endotoksin Tipe Protein
CryI kurstaki HD-1 Lepidoptera Hofte & Whiteley (1989) aizawai Bobrowski et al. (2002) sotto
entomocidus berliner
CryII kurstaki HD-263 Lepidoptera Hofte & Whiteley (1989) kurstaki HD-1 Diptera Bobrowsky et al. (2002) CryIII san diego Coleoptera Hofte & Whiteley (1989)
CryIV israelensis Diptera Hofte & Whiteley (1989)
morissoni
Gambar 2 Mekanisme kerja protein protoksin (Soberon & Bravo 2007).
Kitin
Gambar 3 Struktur kimia dari kitin (http://www.scottsminthonline.com). Kitin yang terdapat pada ekosistem perairan laut diperkirakan dihasilkan sebanyak 1011 ton per tahun. Kondisi tersebut menyebabkan terbentuknya senyawa tidak larut berupa karbon dan nitrogen. Produksi kitin banyak diperoleh pada daerah perairan, umumnya dihasilkan dari proses dekomposisi sisa-sisa cangkang invertebrata. Pengolahan limbah cangkang secara konvensional dilakukan melalui proses pembakaran dan penimbunan dalam tanah. Pembakaran limbah cangkang memiliki resiko mencemari lingkungan karena dapat membentuk karbondioksida dan karbonmonoksida, sedangkan penimbunan di tanah dapat meningkatkan potensi terbentuknya amonia selama proses degradasi (Bhattacharya et al. 2007, Gohel 2006).
Kitinase
Enzim kitinase dapat dihasilkan dari tumbuhan, serangga, serta mikroorganisme. Tumbuhan menghasilkan kitinase sebagai protein pertahanan terhadap serangan patogen ataupun serangan hama. Mikroorganisme yang telah banyak diidentifikasi sebagai penghasil enzim kitinase berasal dari kelompok Streptomyces, Serratia, Vibrio, Actinomycetes dan Bacillus. Kitinase telah banyak
diisolasi dari berbagai macam bakteri (Tabel 2). Kelompok serangga menggunakan kitinase untuk membantu proses pergantian lapisan kutikula, sedangkan mikroorganisme menggunakan kitinase untuk mendegradasi makromolekul yang mengandung N-asetilglukosamin, yang kemudian akan digunakan sebagai sumber nutrisi (Tabel 3) ( Mathur et al. 2011).
Tabel 2 Bakteri dan karakteristik kitinase yang dihasilkan
Bakteri Karakteristik
Referensi penghasil kitinase pH
optimum
Suhu optimum
Berat Molekul ( C ) (kDa)
Sanguibacter sp. 4,6 37 57-58,8 Yong et al. (2005) Bacillus sp. termofil 6,5 60 80,8 Dai et al. (2011) Vibrio sp. 6,0 45 98 Park et al. (2000) Streptomyces sp. 5,0 30 20 Kim et al. (2002) Enterobacter sp. 5,5 45 60 Dahiya et al. (2005) Micrococcus sp. 8,0 35 33 Annamalai et al.
Tabel 3 Peranan kitinase pada beberapa organisme (Gohel 2006)
Organisme Peranan Kitinase
Bakteri Mineralisasi kitin. Berperan juga dalam nutrisi dan parasitisme.
Cendawan Berperan dalam fisiologi pembelahan sel, diferensiasi dan peran nutrisi yang berhubungan dengan aktivitas
mikoparasitik.
Protozoa Parasit malaria menghasilkan kitinase dalam jumlah yang banyak untuk penetrasi matriks peritrofik yang
mengandung kitin dari pencernaan nyamuk.
Manusia Aktivitas kitotriosidase membantu dalam pertahanan terhadap infeksi nematoda. Selain itu, aktivitas enzimatiknya sangat tinggi pada serum pasien yang menderita gangguan lipid lisosomal, sarkoidosis, dan thalassemia.
Hewan Tingkat kitinase yang tinggi pada kambing dan serum darah berfungsi dalam sekresi renal yang rendah, sehingga taraf enzim tetap rendah pada kasus ketidaknormalan produksi lisosim.
Khamir Subunit α dari toksin yang disekresikan oleh
Kluyveromyces lactis mempunyai aktivitas kitinase yang
diperlukan untuk subunit gamma untuk bisa masuk ke dalam sel yang sensitif. Kitinase mempunyai peranan yang penting dalam pemisahan sel sepanjang perkecambahan khamir kitinous Saccharomyces cerevisiae. Kitinase Saccharomyces cerevisiae juga digunakan sebagai
BAHAN DAN METODE Tempat dan Waktu
Penelitian ini dilaksanakan di Laboratorium Mikrobiologi, Departemen Biologi, IPB, dari bulan Oktober 2011 – Mei 2012.
Bahan
Isolasi untuk memperoleh isolat B. thuringiensis dilakukan oleh Khudra (2011) pada 15 sampel tanah yang diperoleh dari tiga lokasi berbeda, yaitu Lampung, Kalimantan Timur, dan Bali. Hasil isolasi kemudian diseleksi, dan didapatkan 453 koloni bakteri yang menunjukkan ciri-ciri morfologi kelompok Bacillus. Dari total isolat yang diperoleh, hanya dua isolat (11,3%) yang menunjukkan ciri koloni, morfologi mirip B. thuringiensis serta memiliki kristal protein. Dua isolat tersebut ialah B. thuringiensis Lot II dan 47. Isolat yang digunakan ialah B. thuringiensis subsp. pakistani, B. thuringiensis Lot II dan B. thuringiensis 47 yang disimpan pada koleksi kultur IPBCC, Departemen Biologi, FMIPA, IPB.
Pertumbuhan dan Peremajaan Isolat
Isolat B. thuringiensis subsp. pakistani, B. thuringiensis Lot II dan B. thuringiensis 47 diremajakan dengan cara digores kuadran pada media Nutrient
Agar (NA) dan diinkubasi pada suhu 37oC selama 24 jam. Pengamatan Morfologi Isolat B. thuringiensis
Biakan bakteri dibuat preparat dengan cara mengoleskan satu ose biakan pada objek gelas dan diwarnai dengan larutan Commasie Briliant Blue (0,25% Commasie Briliant Blue G250, 50% etanol, dan 7% asam asetat) selama tiga
menit, kemudian dibilas dengan air mengalir, dan diamati di bawah mikroskop cahaya dengan minyak emersi (Fadel et al. 1988).
Pengukuran Pertumbuhan Isolat dan Produksi Protein Protoksin pada Media Selektif B. thuringiensis
K2HPO4.3H2O 0,5 g, Mg2SO4.7H2O 0,2 g, CaCl2.2H2O 0,08 g, MnSO4.4H2O 0,05
g, pH 7,0. Kultur cair bakteri diinokulasikan sebanyak 10% dari total volume media produksi dengan jumlah sel 107 sel/ml pada media pertumbuhan, kemudian diinkubasi pada suhu 37oC dengan kecepatan agitasi 120 rpm. Inkubasi dilakukan selama 36 jam, dan setiap 3 jam sampel diambil dan diukur absorbansi pada panjang gelombang (λ) 590 nm untuk mengukur pertumbuhan, serta konsentrasi protoksinnya.
Pengukuran Pertumbuhan Isolat dan Produksi Enzim Kitinase
B. thuringiensis pada Media Produksi Kitinase
Isolat B. thuringiensis ditumbuhkan pada media produksi kitinase (g/L) : MgSO4.7H2O 0,1 g, K2HPO4 1,0 g, NaCI 1,0 g, ekstrak khamir 7,0 g, koloidal
kitin 3,0 g, pH 7,0. Kultur cair bakteri diinokulasikan sebanyak 10% dari total volume media produksi dengan jumlah sel 107 sel/ml pada media pertumbuhan, kemudian diinkubasi pada suhu 37oC dengan kecepatan agitasi 120 rpm (Nurdebyandaru et al. 2010). Inkubasi dilakukan selama 36 jam, dan setiap 3 jam sampel diambil dan diukur absorbansi pada panjang gelombang (λ) 590 nm untuk mengukur pertumbuhan bakteri, serta aktivitas enzim kitinasenya.
Pengukuran Konsentrasi Protein Protoksin Isolat B. thuringiensis
Pengukuran Aktivitas Enzim Kitinase Isolat B. thuringiensis
Aktivitas enzim kitinase diukur dengan menggunakan metode Spindler (Nurdebyandaru et al. 2010). Kultur cair disentrifugasi dengan kecepatan 8.400 g, 10 menit, suhu 4oC. Supernatan yang dihasilkan mengandung ekstrak kasar enzim kitinase. Ekstrak kasar enzim kitinase diambil sebanyak 0,45 ml dan dicampurkan dengan 0,9 ml substrat koloidal kitin 0,3%, serta 0,45 ml bufer fosfat pH 7,0 0,2 M, kemudian diinkubasi pada suhu 37oC selama 30 menit. Setelah inkubasi, reaksi dihentikan pada suhu 100oC selama 10 menit dan disentrifugasi pada kecepatan 8.400 g, 5 menit. Supernatan yang dihasilkan direaksikan menggunakan reagen Schales yang mengandung 0,5 M natrium karbonat dan 1,5 mM kalium ferisianida, absorbansi diukur pada panjang gelombang 420 nm. Sebagai kontrol, ekstrak kasar enzim direaksikan terpisah dari substrat koloidal kitin dan bufer fosfat. Setelah reaksi dihentikan pada 100oC, ekstrak kasar enzim dicampurkan dengan larutan berisi substrat koloidal kitin dan
bufer fosfat. Aktivitas kitinase dihitung berdasarkan kurva standar N-asetil-glukosamin (NAG). Satu unit aktivitas enzim kitinase didefinisikan
sebagai jumlah enzim yang membebaskan N-asetil glukosamin (NAG) sebesar 1 µmol per menit (Lampiran 1).
Karakterisasi Ekstrak Kasar Kitinase menggunakan 0,2 M bufer glisin NaOH. Kestabilan enzim kitinase terhadap suhu diketahui dengan mengukur aktivitas enzim kitinase selama waktu inkubasi tertentu pada suhu dan pH optimumnya masing-masing.
Pengukuran Konsentrasi Protein
Dari masing-masing seri pengenceran BSA, diambil sebanyak 0,1 ml larutan dan ditambahkan dengan 5 ml reagen Bradford, kemudian di kocok dengan vorteks dan diinkubasi pada suhu 37oC selama 15 menit. Larutan sampel diberikan perlakuan yang sama. Absorbansi diukur pada panjang gelombang (λ) 595 nm, dan akuades sebagai larutan blanko (Lampiran 2).
Pemekatan Ekstrak Kasar Enzim Kitinase
Ekstrak kasar kitinase dipekatkan menggunakan amonium sulfat pada kisaran saturasi 20%-80% (Karossi & Pudjiraharti 2010). Enzim yang telah ditambahkan amonium sulfat, disimpan semalam pada suhu 4oC. Kemudian disentrifugasi pada kecepatan 10.000 g, 15 menit, 4oC. Endapan yang terbentuk merupakan enzim hasil pemekatan, dan dilarutkan menggunakan 0,2 M bufer fosfat pH 7,0, kemudian diukur aktivitas kitinasenya.
Pendugaan Berat Molekul Ekstrak Kasar Kitinase dan Protoksin
Berat molekul ekstrak kasar kitinase dan protoksin ditentukan menggunakan SDS PAGE, berdasarkan metode Laemli (Bollag & Edelstein 1999). Konsentrasi gel pemisah (separating gel) sebanyak 10% dan 4% gel penahan (stacking gel) untuk menduga berat molekul protein kitinase, sedangkan berat molekul protein protoksin digunakan konsentrasi gel pemisah sebanyak 12,5% dan 4% gel penahan.
Sampel didenaturasi dengan cara dipanaskan pada suhu 100oC selama 10 menit, dan dielektrofororesis pada 65 volt, 20 A selama 180 menit. Gel diwarnai menggunakan pewarna perak nitrat. Pewarnaan perak nitrat dilakukan dengan cara merendam gel dalam larutan fiksasi yang mengandung 25% metanol dan 12% asam asetat selama 60 menit, direndam dalam 50% etanol selama 20 menit, dan diganti dengan 30% etanol selama 2 X 20 menit. Larutan diganti dengan larutan pengembang yang terdiri dari 5% natrium karbonat, 0,05% formalin, dan 0,0004% natrium tiosulfat, lalu dicuci dengan akuabides. Larutan perak nitrat ditambahkan selama 30 menit, kemudian dicuci kembali dengan larutan campuran natrium karbonat, formaldehida, dan larutan fiksasi.
HASIL Morfologi Isolat B. thuringiensis
Tiga isolat B. thuringiensis memiliki ciri koloni berwarna putih, berukuran 5 mm, tepian bergelombang, dengan permukaan kasar. Pengamatan ciri morfologi menggunakan pewarna Coomassie Brilliant Blue (CBB) menunjukkan ketiga isolat memiliki bentuk sel batang (basil) dengan panjang berkisar 5 µm (Gambar 4).
(a) (b)
(c)
Gambar 4 Morfologi isolat (a) B. thuringiensis subsp. pakistani, (b) B. thuringiensis Lot II dan (c) B. thuringiensis 47, yang
diwarnai dengan pewarna Coomassie Briliant Blue (CBB). Endospora ditunjukkan dengan tanda panah.
Kurva Pertumbuhan dan Produksi Protoksin serta Kitinase Isolat
B. thuringiensis
Pola pertumbuhan dan produksi protein protoksin dari isolat B. thuringiensis subsp. pakistani diamati dengan menggunakan media selektif
B. thurigiensis tanpa koloidal kitin.
5 µm 5 µm
Pertumbuhan isolat B. thuringiensis subsp. pakistani pada media selektif yang diamati setiap 3 jam selama 36 jam pengamatan menunjukkan terdapat fase logaritmik yang terjadi sampai dengan jam ke-15, selanjutnya mengalami penurunan jumlah sel sampai dengan akhir pengamatan. Produksi protein protoksin mulai dihasilkan pada jam ke-3, dengan konsentrasi protein protoksin tertinggi diperoleh pada jam ke-24 dengan nilai 0,807 mg/ml. Protein protoksin disekresikan dalam jumlah tinggi pada saat jumlah sel menurun (Gambar 5). Perhitungan aktivitas kitinase tidak dilakukan pada media selektif ini karena tidak terdapatnya koloidal kitin untuk menginduksi sekresi enzim tersebut.
Gambar 5 Pertumbuhan dan produksi protein protoksin isolat pembanding, B. thuringiensis subsp. pakistani, pada media selektif.
(a)
(b)
(c)
Pengamatan pertumbuhan digunakan untuk mengetahui fase pertumbuhan bakteri dalam waktu 36 jam inkubasi. Isolat B. thuringiensis memasuki fase logaritmik yang ditandai dengan meningkatnya jumlah sel (CFU/ml) (Gambar 6). Pertumbuhan logaritmik isolat B. thuringiensis subsp. pakistani terjadi sampai dengan jam ke-36, sedangkan B. thuringiensis Lot II dan B. thuringiensis 47 pada jam ke-33, sementara itu penurunan jumlah sel terjadi pada interval jam ke-54 dan 72. Selama pengamatan pertumbuhan sel, dilakukan pula pengukuran protein protoksin pada setiap isolat. Produksi protoksin yang dimulai sejak pertumbuhan logaritmik selanjutnya mengalami penurunan produksi setelah melewati jam ke-36, penurunan produksi protoksin terjadi dalam interval jam ke-54 dan 72.
Protein protoksin isolat B. thuringiensis subsp. pakistani dihasilkan pada jam ke-3 dengan konsentrasi protein 0,0014 mg/ml. Isolat B. thuringiensis Lot II dan 47 menghasilkan protoksin lebih cepat, yaitu pada jam ke-0 dengan konsentrasi protoksin berturut-turut 0,0005 mg/ml dan 0,0014 mg/ml, meskipun dalam jumlah yang sangat kecil. Konsentrasi protein protoksin ketiga isolat
tertinggi diperoleh pada ke-36, dengan nilai berturut-turut 0,511 mg/ml, 0,470 mg/ml dan 0,177 mg/ml untuk B. thuringiensis subsp. pakistani, B.
thuringiensis Lot II dan 47. Konsentrasi protein protoksin dari setiap isolat B. thuringiensis akan menurun seiring dengan bertambahnya waktu inkubasi kultur.
Kemampuan isolat B. thuringiensis dalam menghasilkan enzim kitinase juga diamati bersamaan dengan pengamatan pertumbuhan dan produksi protein protoksin.
Aktivitas kitinase dari setiap isolat menunjukkan waktu optimum berbeda
Gambar 7 Aktivitas kitinase isolat B. thuringiensis.
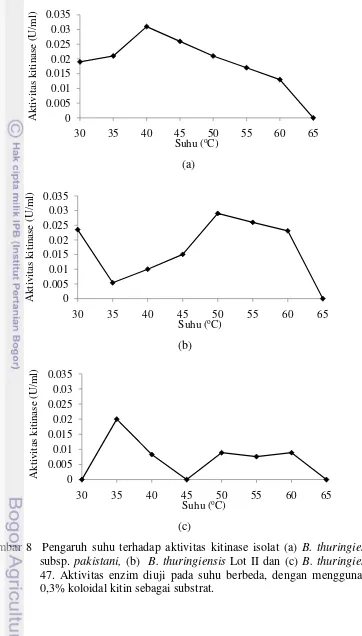
Karakterisasi Ekstrak Kasar Kitinase
Suhu Optimum. Ekstrak kasar kitinase diuji aktivitasnya pada kisaran suhu 30o– 65oC, untuk mengetahui suhu optimumnya, dan pada kisaran pengujian pH 4,0 – 8,5, untuk mengetahui pH optimum dengan menggunakan koloidal kitin sebagai substrat. Pengaruh suhu terhadap aktivitas kitinase diuji pada kondisi netral (pH 7,0) (Gambar 8). Aktivitas kitinase setiap isolat aktif pada sebagian besar titik pengujian suhu, kecuali pada suhu 65oC. Aktivitas kitinase optimum pada suhu 40oC untuk isolat B. thuringiensis subsp. pakistani, dengan nilai 0,031 U/ml. Selanjutnya isolat B. thuringiensis Lot II optimum pada suhu 50oC dengan nilai 0,029 U/ml, sedangkan B. thuringiensis 47 optimum pada suhu 35oC dengan nilai 0,02 U/ml.
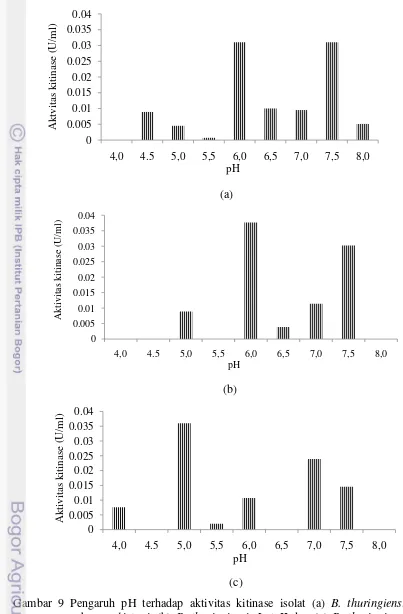
pH Optimum. Pengaruh pH terhadap aktivitas kitinase diamati dengan menggunakan tiga bufer berbeda, yaitu bufer asam sitrat, bufer fosfat dan glisin NaOH (Gambar 9). Aktivitas kitinase optimum pada suhu pH 6,0 dam 7,5 untuk isolat B. thuringiensis subsp. Pakistani dengan nilai 0,031 U/ml. Selanjutnya isolat B. thuringiensis Lot II optimum pada pH 6,0 dengan nilai 0,0377 U/ml, sedangkan
Pendugaan Berat Molekul Protein
Sebelum pendugaan berat molekul protein menggunakan SDS-PAGE, terlebih dahulu dilakukan pemekatan protein isolat dengan larutan garam amonium sulfat. Pemekatan enzim dilakukan berdasarkan prinsip salting out, yang bertujuan untuk menghilangkan kandungan air pada protein enzim. Hasil pemekatan protein selanjutnya diukur konsentrasi protein, aktivitas kitinase serta aktivitas spesifiknya.
Aktivitas kitinase isolat B. thuringiensis subsp. pakistani tertinggi diperoleh pada pemekatan enzim menggunakan amonium sulfat sebanyak 20% dengan nilai 0,017 U/ml. Isolat B. thuringiensis Lot II pada pemekatan 80% dengan nilai aktivitas kitinase ialah 0,013 U/ml, sedangkan isolat B. thuringiensis 47 pada 50% pemekatan isolat dengan nilai 0,170 U/ml. Jika dibandingkan dengan kontrol, sebagian besar konsentrasi protein dari setiap isolat meningkat seiring dengan proses pemekatan dibandingkan dengan kontrol. Konsentrasi protein isolat B. thuringiensis subsp. pakistani tertinggi diperoleh pada pemekatan 80%, dengan nilai 0,336 mg/ml. Protein isolat B. thuringiensis Lot II dan B. thuringiensis 47 tertinggi diperoleh pada pemekatan 60% dengan konsentrasi
protein berturut-turut 0,522 mg/ml dan 0,693 mg/ml (Tabel 4). Hasil perhitungan aktivitas spesifik kitinase yang menunjukkan bahwa isolat B. thuringiensis subsp. pakistani memiliki aktivitas spesifik tertinggi pemekatan 20% dengan nilai 0,1735
mg/ml. Isolat B. thuringiensis Lot II tertinggi pada pemekatan 30% dengan nilai 0,2330 mg/ml, sedangkan B. thuringiensis 47 pada pemekatan 40% dengan nilai 0,1220 mg/ml (Tabel 5).
Tabel 4 Aktivitas kitinase dan konsentrasi protein isolat B. thuringiensis setelah dilakukan pemekatan ekstrak kasar kitinase menggunakan amonium sulfat
Keterangan : B. thuringiensis subsp. pakistani (Bt P), B. thuringiensis Lot II (Bt LII),
B. thuringiensis 47 (Bt 47) dan (*) sebagai kontrol (sebelum pemekatan).
Tabel 5 Aktivitas spesifik kitinase isolat B. thuringiensis setelah dilakukan pemekatan ekstrak kasar kitinase menggunakan amonium sulfat
Keterangan : B. thuringiensis subsp. pakistani (Bt P), B. thuringiensis Lot II (Bt LII),
B. thuringiensis 47 (Bt 47), dan (*) sebagai kontrol (sebelum pemekatan).
Pita protein hasil elektroforesis yang diduga merupakan pita protein kitinase (Gambar 10). Berat molekul protein kitinase B. thuringiensis berada pada
kisaran 71 kDa, hasil elektroforesis menunjukkan pita protoksin isolat B. thuringiensis subsp. pakistani, B. thuringiensis Lot II dan B. thuringiensis 47
juga diperoleh pada kisaran berat molekul 71 kDa. Perlakuan pemekatan protein menggunakan amonium sulfat sangat mempengaruhi konsistensi pita protein kitinase. Hal ini terlihat pada pita protein kitinase isolat B. thuringiensis Lot II dan B. thuringiensis 47 yang diperoleh setelah protein dipekatkan terlebih dahulu,
sedangkan pita protein kitinase B. thuringiensis subsp. pakistani tetap terlihat pada ekstrak kasar kitinase maupun pada sampel protein setelah dipekatkan.
Penambahan Aktivitas kitinase (U/ml) Konsentrasi Protein (mg/ml) Amonium
Sulfat (%) Bt P Bt Lot II Bt 47 Bt P Bt Lot II Bt 47
0* 0,0120 0,0064 0,0082 0,01330 0,0190 0,0160
20 0,0170 0,0032 0,0067 0,0980 0,1000 0,1040
30 0,0002 0,0070 0,0001 0,0200 0,0300 0,0250
40 0,0014 0,0040 0,0070 0,0190 0,0690 0,0570
50 0,0090 0,0001 0,0170 0,1470 0,1590 0,2340
60 0,0032 0,0056 0,0070 0,1790 0,5220 0,6930
70 0,0027 0,0034 0,0015 0,3190 0,5100 0,4000
80 0,0027 0,0130 0,0011 0,3360 0,1900 0,6180
Berat molekul protein protoksin isolat B. thuringiensis dibandingkan antara pita protein dari protoksin kasar dengan protein protoksin yang dicuci menggunakan larutan pencuci 0,14 M NaCI dan 0,01% Triton X-100. Perlakuan pencucian tersebut bertujuan untuk menghilangkan enzim protease yang dapat mempengaruhi konsistensi protein protoksin.
Berat molekul protein protoksin B. thuringiensis berada pada kisaran
130 kDa, hasil elektroforesis menunjukkan pita protoksin isolat B. thuringiensis subsp. pakistani, B. thuringiensis Lot II dan B. thuringiensis 47
diperoleh pada kisaran berat molekul antara 129,99 – 130,04 kDa (Gambar 11). Pita protein protoksin ditemukan pada sampel protein kasar maupun protein hasil pencucian. Pencucian protein mempengaruhi keberadaan enzim protease yang memiliki berat molekul pada kisaran 25 – 30 kDa.
Gambar 10 Hasil migrasi protein kitinase menggunakan SDS-PAGE yang diwarnai dengan larutan perak nitrat. Sumur 1 merupakan penanda protein (fosforilase-b 97 kDa, albumin 66 kDa, ovalbumin 45 kDa, karbonat anhidrase 30 kDa, tripsin inhibitor 20,1 kDa, alfa laktabumin 14,4 kDa). Sumur 2, 3, 4 merupakan enzim ekstrak kasar kitinase dari isolat B. thuringiensis subsp. pakistani, B. thuringiensis Lot II, B. thuringiensis 47. Sumur 5, 6, 7 merupakan enzim kitinase B. thuringiensis subsp. pakistani, B. thuringiensis Lot II, B. thuringiensis 47, hasil pemekatan menggunakan amonium sulfat. Pita protein kitinase ditunjukkan dengan tanda panah hitam.
97 kDa 66 kDa
45 kDa 30 kDa 20,1 kDa 14,4 kDa
Gambar 11 Hasil migrasi protein protoksin menggunakan SDS-PAGE yang diwarnai dengan larutan perak nitrat. Sumur 1 merupakan penanda protein (marker precision plus protein dual color 250 kDa – 25
kDa). Sumur 2, protoksin kasar isolat B. thuringiensis subsp. pakistani. Sumur 3, protoksin isolat B. thuringiensis subsp. pakistani + larutan pencuci. Sumur 5, protoksin kasar isolat B. thuringiensis Lot II. Sumur 6, protoksin isolat B. thuringiensis
Lot II + larutan pencuci. Sumur 8, protoksin kasar isolat B. thuringiensis 47. Sumur 9, protoksin isolat B. thuringiensis 47 +
larutan pencuci. Pita protein protoksin ditunjukkan dengan tanda panah hitam.
PEMBAHASAN
Bakteri B. thuringiensis dapat membentuk kristal protein yang disebut protoksin. Rosas-Garcia (2009) memaparkan, kristal protein disekresikan ke luar lingkungan pertumbuhan setelah terjadi pelisisan dinding sel pada akhir sporulasi,
dengan jumlah mencapai 20 – 30% berat kering sel bersporulasi. Kultur B. thuringiensis akan mengalami pelisisan dan sekresi sel, serta larutnya
endospora, badan parasporal dan protoksin ke dalam media.
pada media selektif tidak menunjukkan sekresi enzim kitinase karena tidak terdapatnya koloidal kitin yang berperan sebagai induser enzim tersebut.
Perbedaan produksi protoksin yang dihasilkan pada dua media berbeda tersebut dapat disebabkan karena adanya perbedaan komposisi pada masing-masing media, seperti yang dijelaskan oleh Black dan Snyman (1991) dan didukung oleh Montiel et al. (2001), Shojaaddini et al. (2010), serta Mazmira et al. (2012). Komposisi sumber karbon mempengaruhi durasi terjadinya fase eksponensial yang menyebabkan lambatnya sel mencapai fase stasioner, sintesis endospora dan produksi toksin. Selain itu, perbedaan struktur kimia antara sumber karbon berupa glukosa pada media selektif dan kitin pada media produksi kitinase akan mempengaruhi kecepatan hidrolisisnya oleh kultur bakteri. Dengan demikian, glukosa yang memiliki struktur kimia lebih sederhana akan lebih cepat dihidrolisis oleh bakteri dibandingkan dengan struktur kompleks pada kitin.
Selain sumber karbon, sumber nitrogen berupa amonium sulfat yang dibuktikan oleh Yussof et al. (2003 ) dapat meningkatkan produksi protoksin, kandungan amonium sulfat dapat ditemukan pada media selektif yang digunakan dalam penelitian ini. Selanjutnya ditambahkan Anderson dan Jayaraman (2003), terdapat hubungan antara sintesis kristal protein dan biomassa sel, kemudian oleh Vu et al. (2007) dan Brar et al. (2009), sedikitnya endospora yang dihasilkan selama pertumbuhan akan menyebabkan rendahnya sintesis protoksin.
Jika dikaitkan antara pertumbuhan kultur dan produksi protoksin pada media produksi kitinase terlihat bahwa produksi protoksin meningkat selama fase logaritmik berlangsung, selanjutnya penurunan produksi protoksin diikuti dengan penurunan jumlah sel, yaitu pada interval jam ke-54 dan 72. Hal ini berbeda dengan pendapat Montiel et al. (2001) yang menyatakan setiap sel akan memproduksi endospora dan protoksin selama masa sporulasi. Penyebab terjadinya perbedaan waktu antara produksi protein protoksin dan sporulasi dijelaskan oleh Cetinkaya (2002) sebagai akibat dari ekspresi gen Cry yang menyandikan protein protoksin. Mekanisme dari ekspresi gen Cry dibagi menjadi dua jenis, yaitu ekspresi gen yang terjadi selama sporulasi independent) dan ekspresi gen yang tidak tergantung pada sporulasi
pertumbuhan vegetatif dan juga fase stasioner, namun ekspresi gen pada pertumbuhan fase stasioner akan lebih kecil dibandingkan dengan ekspresi pada fase vegetatif.
Produksi enzim kitinase yang teramati menunjukkan kemampuan isolat lokal B. thuringiensis dalam mensekresikan enzim kitinase. Secara umum, aktivitas kitinase optimum pada jam ke-21 dan jam ke-24. Jika dikaitkan dengan pola pertumbuhan isolat, terlihat bahwa kitinase disekresikan sel selama pertumbuhan logaritmik. Sekresi kitinase selama fase pertumbuhan tersebut disebabkan keberadaan koloidal kitin sebagai induser sekaligus berperan sebagai satu-satunya sumber karbon pada media pertumbuhan, sehingga bentuk respon terhadap kondisi media tersebut ialah dihasilkannya kitinase untuk mendegradasi komponen kitin dalam media.
Pengaruh pH terhadap aktivitas kitinase B. thuringiensis, dari penelitian yang dilaporkan oleh Liu et al. (2002) diketahui bahwa kondisi asam dan basa dapat mengakibatkan penurunan aktivitas kitinase. Kemudian oleh Vu et al. (2009), penurunan aktivitas terjadi pada kondisi asam dan basa, namun optimum pada kondisi netral. Terdapat hasil yang berbeda dalam penelitian ini, yang ditunjukkan pada pengujian kondisi netral menghasilkan aktivitas enzim yang lebih rendah.
Pemekatan enzim yang dilakukan dalam penelitian ditentukan menggunakan prinsip salting out. Pemekatan enzim menyebabkan meningkatnya konsentrasi protein yang terkandung dalam enzim ekstrak kasar, namun menurunkan aktivitas enzim kitinase. Ward dan Swiatek (2005) menyatakan purifikasi protein menggunakan amonium sulfat sebagai metode yang kurang efektif. Hal ini disebabkan fraksinasi menggunakan amonium sulfat dapat meningkatkan jumlah protein (yield) yang dihasilkan, namun tidak meningkatkan kemurnian protein. Sedangkan penurunan aktivitas kitinase setelah dilakukan pemekatan dapat disebabkan enzim pekat tidak didialisis terlebih dahulu, sehingga garam organik yang ikut terendap bersama protein akan mempengaruhi aktivitas enzim.
memiliki berat molekul sekitar 70 kDa. Namun, hasil yang diperoleh dalam penelitian ini, isolat lokal B. thuringiensis subsp. pakistani memiliki protoksin dengan berat molekul 130 kDa. Selanjutnya Cetinkaya (2002) menyebutkan perbedaan profil protein yang muncul dari galur yang sama disebabkan kemampuan B. thuringiensis dalam menghasilkan dua bentuk badan inklusi kristal yang berbeda, sehingga menghasilkan profil protein berbeda pula. Selain itu, faktor lingkungan dapat mempengaruhi ekspresi gen Cry itu sendiri. Dengan demikian tidak menutup kemungkinan ditemukan dua macam tipe gen Cry pada satu galur B. thuringiensis yang sama.
Kaitan antara protease dan protoksin dikemukakan oleh Oppert (1999). Selama memasuki awal sporulasi akan terjadi peningkatan produksi protease pada kultur B. thuringiensis. Protease indegenus B. thuringiensis berasal dari kelompok sistein, metalo dan serin. Aktivitas proteolitik indegenus ini dapat mempengaruhi aktivasi protoksin serta spesifikasi protoksin terhadap serangga target, dilain sisi dapat mengakibatkan hidrolisis kristal protein sehingga mempengaruhi stabilitas protoksin. Inkubasi protoksin dalam bufer alkalin serta pemberian larutan Triton X-100 dapat mengurangi pengaruh aktivitas proteolitik pada protoksin (Vu et al. 2009). Kondisi alkalin akan menginisiasi pembengkakan toksin B. thuringiensis, serta menginduksi pemecahan protease yang akhirnya akan melepaskan kristal protoksin.
Karakteristik kitinase isolat lokal B. thuringiensis yang diperoleh dari penelitian ini cukup prospektif untuk dikembangkan lebih lanjut. Hasil penelitian Ramirez et al. (2004) menunjukkan kitinase yang dihasilkan B. thuringiensis dapat menyebabkan efek antagonis terhadap Sclerotium rolfsii pada saat pH enzim diturunkan dari 8,4 menjadi 5,8. Sebagai pembanding pada hasil penelitian ini ialah aktivitas kitinase pada kondisi asam (pH 5,0) tertinggi ditemukan pada isolat B. thuringiensis 47, dengan demikian kitinase yang dihasilkan oleh isolat 47 dapat
dijadikan sebagai agens biokontrol cendawan. Sedangkan pada kondisi basa, aktivitas kitinase dapat ditemukan tertinggi pada isolat B. thuringiensis 47 dan B. thuringiensis Lot II, Bansode dan Bajekal (2006) menyatakan membran
periotrofik serangga bersifat basa, dengan demikian aktivitas kitinase yang optimum pada kondisi basa dapat berpotensi dijadikan sebagai biokontrol serangga. Sementara itu, terdapatnya dua puncak aktivitas kitinase pada pengujian pH 6,0 dan 7,5 dijelaskan oleh Barboza-Corona et al. (2003) sebagai akibat dari sel mensekresikan enzim kitinase dalam dua bentuk konformasi molekul yang berbeda.
Rendahnya aktivitas kitinase yang dihasilkan B. thuringiensis banyak dilaporkan dalam beberapa penelitian, sehingga aplikasi pada skala lapangan akan mengalami kesulitan. Peningkatan aktivitas kitinase dapat dilakukan melalui pendekatan rekayasa genetika melalui peningkatan galur, seperti yang diteliti oleh Sirichotpakorn et al. (2001), Barboza-Corona et al. (2003), Hu et al. (2009), Driss et al. (2011). Bila ditinjau dari produksi protoksin Ghribi et al. (2006) menambahkan bahwa upaya pengembangan protoksin sebagai bioinsektisida mengalami kesulitan pada beberapa faktor, diantaranya ialah kemampuan sel dalam beradaptasi pada cekaman abiotik, ketersediaan oksigen, serta represi regulasi sintesis protein oleh sumber karbon..
Hasil penelitian oleh Khudra (2011) melaporkan bahwa isolat lokal
B. thuringiensis subsp. pakistani, B. thuringiensis Lot II dan isolat B. thuringiensis 47 memiliki aktivitas toksisitas terhadap ulat grayak
SIMPULAN
Pertumbuhan tiga isolat lokal B. thuringiensis pada media produksi kitinase dan protoksin menunjukkan isolat B. thuringiensis subsp. pakistani memproduksi protoksin pada jam ke-3, isolat B. thuringiensis Lot II dan Isolat B. thuringiensis 47 memproduksi protoksin sejak awal inkubasi. Enzim kitinase
DAFTAR PUSTAKA
Anderson RKI, Jayaraman K. 2003. Influence of carbon and nitrogen sources on the growth and sporulation of Bacillus thuringiensis var galleriae for biopesticides production. Chem Biochem Eng 17:225-231
Annamalai N, Giji S, Arumugam M, Balasubramanian T. 2010, Purification and characterization of chitinase from Micrococcus sp. AG84 isolated from marine environment. J Microbiol Res 4:2822-2827.
Arora N, Ahmad T, Rajagopal R, Bhatnagar RK. 2003. A constituvely expressed 36 kDa exochitinase from Bacillus thuringiensis HD-1. Biochem Biophys Res Commun 1:620-625.
Atlas R M. 1946. Handbook of microbiological media. London: CRC Pr.
Bansode VJ, Bajekal SS. 2006. Characterization of chitinase from microorganisms isolated from Lonar Lake. Indian J Biotechnol 5:357 – 363.
Barboza-Corona JE et al.. 2003. Cloning, sequencing, and expression of the chitinas gene chiA74 from Bacillus thuringiensis. J Appl Environ Microbiol 69:1023 – 1029.
Barboza-Corona JE, Reyes-Rios DM, Salcedo-Hernandez, Bideshi DK. 2008. Molecular and biochemical characterization of an endochitinase (ChiA-HD73) from Bacillus thuringiensis subsp. kurstaki HD-73. Mol Biotechnol 39:28-37.
Bhattacharya D, Nagpur A, Gupta RK. 2007. Bacterial chitinase : properties and potential. Critic Rev Biotechnol 27:21-28.
Black KG, Snyman SJ. 1991. Biomass yield and insecticidal activity of a local Bacillus thuringiensis isolate in six fermentation media. Proceedings of The South African Sugar Technology Association, Juni 1991. hlm 77-79. http://www.openagricola.nul.usda.gov [4 September 2012].
Bollag DM, Edelstein SJ. 1991. Protein methods. Washington : John Wiley Publication.
Bobrowski VL, Pasquali G, Bodanese-Zanettini MH, Pinto LM, Fiuza LM. 2002. Characterization of two Bacillus thuringiensis isolate from South Brazil and their toxicity against Anticarsia gemmitalis (Lepidoptera: Noctuidae). Biol Control 25:129-135.
Bradley D, Harkey MA, Kim MK, Biever KD, Bauer LS. 1994. The insectisidal Cry1B crystal protein of Bacillus thuringiensis ssp. thuringiensis has dual specificity to coleopteran and lepidopteran larvae. J Invert Pathol 65:162 – 173.
Brar SK, Verma M, Tyagi RD, Valero JR, Surampali RY. 2009. Entomotoxicity, protease and chitinase activity of Bacillus thuringiensis fermented wastewater sludge with a high solids content. J Biores Technol 100:4317-4325.
Brzezinska MS, Porczyk EL, Donderski W. 2007. Chitinolytic activity of bacteria and fungi isolated from shrimp exoskeleton. Int J Ocean Hydrobiol 36:101-111.
Cetinkaya FC. 2002. Isolation of Bacillus thuringiensis and investigation of its crystal protein genes. http://library.iyte.edu.tr/biyoteknoloji/T000120. [25 Juni 2012].
Dahiya N, Tewari R, Tiwari RP. 2005.Chitinase from Enterobacter sp. NRG4: its purification, characterization and reaction pattern. J Biotech 8:134-145. Dai DH, Hu WL, Huang GR, Li W. 2011. Purification and characterization of a
novel extracellular chitinase from thermophilic Bacillus sp. Hu1. Afr J Biotechnol 10:2476 – 2485.
De La Vega et al. 2006. Purification and characterization of an exochitinase from Bacillus thuringiensis subsp. aizawai and it action against phytophatogenic fungi. Can J Microbiol 52:651-657.
Driss F, Awad MK, Zouari N, Jaoua S. 2005. Molecular characterization of a novel chitinase from Bacillus thuringiensis subsp. kurstaki. J Appl Microbiol 99:945 – 953.
Driss F. et al. 2011. Integration of a recombinant chitinase into Bacillus thuringiensis parasporal insecticidal crystal. Curr Microbiol 62:281-288.
Fadel A, Sharif N, Alaeddinoglu G. 1988. Arapid and simple method for staining of the crystal protein of Bacillus thuringiensis. J Mikrobiol Indones 3: 227-229
Frankenhuyzen KV. 2009. Insecticidal activity of Bacillus thuringiensis crystal proteins. J Invert Pathol 101:1 – 16.
Ghribi D, Zouari N, Trabelsi H, Jaoua S. 2006. Improvement of Bacillus thuringiensis delta-endotoxin production by overcome of carbon catabolite repression through adequate control of aeration. Enzyme Microb Technol 40:614-622.
Hofte H, Whiteley HR. 1989. Insecticidal crystal proteins of Bacillus thuringiensis. Microbiol Rev 53:242–255.
Hu SB et al. 2009. Efficient constitutive expression of chitinase in the mother cell Bacillus thuringiensis and its potential to enhance the toxicity of Cry1Ac protoxin. Appl Microbiol Biotechnol 82:1157-1167.
Innes TC, Bouwer G. 2009. An improved bioassay for the detection of Bacillus thuringiensis of β-exotoxin. J Invert Pathol 101:137 – 139.
Kamenek LK, Kamenek DV, Terpilowski MA, Gouli VV. 2012. Antifungal action of Bacillus thuringiensis delta-endotoxin against pathogenic fungi related to Phytophthora and Fusarium. J Agric Technol 8:191-203. Karossi AT, Pudjiraharti S. 2010. Isolasi enzim horseradish peroksidase dari
kultur sel daun Armoracia lapatifolia dengan cara fraksinasi menggunakan amonium sulfat. JKTI 12:20-25.
Kim KJ, Yang YJ, Kim JG. 2002. Purification and characterization of chitinase from Sterptomyces sp. M-20. J Biochem Mol Biol 36:185-189.
Khudra IA. 2011. Isolasi bakteri Bacillus thuringiensis dari tanah dan pengujian toksisitasnya terhadap ulat grayak (Sphodoptera litura) [skripsi]. Bogor : Institut Pertanian Bogor.
Kumar S, Chandra A, Pandey KC. 2008. Bacillus thuringiensis transgenic crop: An environment friendly insect-pest management strategy. J Environ Biol 29:641-653.
Liu M et al. 2002. Chitinolytic activities in Bacillus thuringiensis and their synergistic effects on larvacidal activity. J Appl Microbiol 93:374-379. Liu D, Cai J, Xie CC, Liu C, Chen YH. 2009. Purification and partial
characterization of a 36 kDa chitinase from Bacillus thuringiensis subsp. colmeri, and its biocontrol potential. Enzyme Microb Technol 46:252 – 258.
Mathur A et al. 2011. Isolation of Bacillus producing chitinase from soil : production and purification of chito-oligosaccharides from chitin extracted from fresh water crustaceans and antimicrobial activity of chitinase. Rec Res Sci Technol 3:1-6.
Muharsini S, Wardhana AH, Rijzaani H, Amirhusein B. 2003. Karakterisasi isolat Bacillus thuringiensis dari beberapa daerah di Jawa dan Sulawesi Selatan untuk kontrol biologi lalat Myasis Chrysomya bezziana. JITV 8:256-263. Montiel M, Tyagi RD, Valero JR. 2001. Wastewater treatment sludge as a raw material for the production of Bacillus thuringiensis based biopesticides. J Water Res 35:3807 – 3816.
Nurdebyandaru N, Mubarik NR, Prawasti TS. 2010. Chitinolytic bacteria isolated from chili rhizospere : chitinase characterization and application as biocontrol for Aphis gossypii. Microbiol Indones 4:103 – 107.
Okay S, Ozcengiz G. 2011. Molecular cloning, characterization and homologous expression of an endochitinase gene from Bacillus thuringiensis serovar morrisini. Turk J Biol 35:1-7.
Oppert B. 1999. Protease interaction with Bacillus thuringiensis insecticidal toxin. Arch Insect Biochem Physiol 42:1-12.
Osir EO, Vundla WRM. 1999. Characterization of the delta-endotoxin of a Bacillus thuringiensis isolate active againts tsetse, Glossina morsitans¸ and a stem borer, Chilo patellus. Biocont Sci Technol 9:247-258.
Park HS, Lee JH, Lee HK. 2000. Purification and characterization of chitinase from a marine bacterium, Vibrio sp. 98CJ11027. J Microbiol 38:224-229. Perchat S et al. 2005. Bacillus cereus produce several nonproteinaceous
insecticidal exotoxin. J Invert Pathol 90:131 – 133
Ramirez AR, Abarca BIE, Uscanan GA, Jones PMH, Barboza-Corona JE. 2004. Antifungal activity of Bacillus thuringiensis chitinase and its potential for the biocontrol of phytopathogenic fungi in soybean seeds. J Food Microbiol Safety 69:131-134.
Regev A et al. 1996. Synergistic activity of a Bacillus thuringiensis delta endotoxin and a bacterial endochitinase against Spodoptera litura larvae. Appl Environ Microbiol 62:3581-3586.
Rosso ML, Delecluse A. 1997. Contribution of the 65 kDa protein encoded by the cloned gene cry19A to the musquitocidal activity of Bacillus thuringiensis subsp. jegathesan. Appl Environ Microbiol 63:4449-4455.
Rusmana I, Hadioetomo RS. 1994. Isolasi Bacillus thuringiensis Berl. dari peternakan ulat sutera dan toksisitasnya terhadap larva Crocidolomia bonotalis Zell dan Spodoptera litura F. Hayati 1:21-23.
Sa LP, Ja CS. 2007. Three-dimensional structure of Bacillus thuringiensis toxin: a review. Acta Biol Colomb 12:19-32.
Saleem F, Shakoori AR. 2009. Characterization of Cry2A type gene(s) from Pakistani isolates of Bacillus thuringiensis toxic to Lepidopteran and Dipteran Insect. Pakistan J Zool 42:181-193.
Sampson MN, Gooday GW. 1998. Involvement of chitinase Bacillus thuringiensis during pathogenesis in insect. Microbiology 14:2189 – 2194.
Schnepe E et al. 1998. Bacillus thuringiensis and its pesticidal crystal proteins. J Microbiol Mol Biol Rev 62:775 – 806.
Shojaaddini M, Moharramipour S, Khodabandeh M, Talebi AA. 2010.
Development of a cost effective medium for production of Bacillus thuringiensis bioinsecticides using food barley. J Plant Protect
Res 59:9-14
Sirichotpakorn N, Rongnoparut P, Choosang K, Panbangred W. 2001.
Coexpressin of chitinase and the cry11Aa1 toxin genes in Bacillus thuringiensis serovar israelensis. J Invert Pathol 76:160 – 169.
Soberon M, Bravo A. 2008. Avoiding insect resistanceto Cry toxin from Bacillus thuringiensis. http://www.nbiap.vt .edu /news /2008 /artspdf/may0803.pdf [13 Juli 2012].
Suero MR, Alfaro GV, Bernal JS, Ramirez-Lepe M. 2011. Synergistic effect of chitinase and Bacillus thuringiensis spore-toxin complex against Aedes aegypti larva. Can Entomol 143:157-164.
Sukmawaty E. 2012. Efektivitas protoksin Bacillus thuringiensis subsp. aizawai, konidia Baeuveria bassioana dan campurannya terhadap ular grayak Spodoptera litura F [tesis]. Bogor : Institut Pertanian Bogor.
Tenorio-Sanchez SA, Rojas-Avelizapa, Ibarra JE, Rojaz Avelizapa LI, Cruz-Camarillo R. 2010. Characterization of a Bacillus thuringiensis strain isolated from a highlu polychlorinated biphenyls contaminated soil. Technology 3:52-63.
Usharani TR, Gowda TKS. 2011. Cloning of chitinase gene from Bacillus thuringiensis. Indian J Biotechnol 10:264-269.
Vu KD, Yan S, Tyagi RD, Valero JR, Surampali RY. 2009. Induced production of chitinase to enhance entomotoxicity of Bacillus thuringiensis employing strach industry wastewater as a substrat. J Biores Technol 100:5260-5269.
Vu KS, Tyagi RD, Surampali RY, Valero JR. 2007. A comparison of sludge solids and solids-enriched starch industry wastewater as potential raw material for the production of Bacillus thuringiensis based biopesticides. http://www.bvsde.paho.org/bvsaar/cdlodos/pdf/acomparisonofsludge110 1.pdf [ 25 Juni 2012].
Ward W, Swiatek, 2009. Protein purification. Cur Anal Chem 5:1-21.
Wiwat C, Thaithanin S, Pantuwatana S, Bhumiratana A. 2000. Toxicity of chitinase-producing Bacillus thuringiensis ssp kurstaki HD-1 (G) toward Plutella xylostella. J Invert Pathol 76:270-277.
Wu Y, Lei CF, Liu PM, Gao MY. 2011. Novel Bacillus thuringiensis delta-endotoxin active against Locusta migratoria manilensis. J Appl Environ Microbiol 77: 3277 – 3233.
Xavier R, Nagarathinam P, Gopalakrishnan, Murugan V, Jayaraman K. 2007. Isolation of Lepidopteran active native Bacillus thuringiensis strains through PCR panning. Asia Pac J Mol Biol Biotechnol 15:61-67.
Yong T et al. 2005. Purification and characterization of an extracellular chitinase produced by bacterium C4. Ann Microbiol 55:213-218.
Yussof MW, Mazmira MM, Mei CC. 2003. Effect of ammonium sulphate on the sporulation of Bacillus thuringiensis subsp. aizawai SN2 ( a local isolate) during batch fermentation. J Teknol 39:53-60.
Lampiran 1 Kurva standar N-Asetil-Glukosamin (NAG)
Lampiran 2 Kurva standar bovine serum albumin (BSA)
Lampiran 3 Kurva penanda berat molekul protein kitinase
Lampiran 4 Kurva penanda berat molekul protein protoksin
y = -1.499x + 2.178 R² = 0.941
0 0.5 1 1.5 2 2.5 3
0 0.2 0.4 0.6 0.8 1
A
bsor
bans
i
ABSTRACT
MAISYA ZAHRA AL BANNA. Characterization of protoxin protein and chitinase enzyme from indigenous isolates Bacillus thuringiensis. Supervised by NISA RACHMANIA MUBARIK and YADI SURYADI.
Bacillus thuringiensis secreted exochitinase activity when grown in a medium containing chitin. Chitinase and protoxin protein play a important role in the pathogenicity of Bacillus thuringiensis to insect pest. This research was aimed to determined characterization of B. thuringiensis subsp. pakistani indigenous isolates, B. thuringiensis Lot II, and B. thuringiensis 47 to produce chitinase enzyme and protoxin protein. Optimum production of chitinase from B. thuringiensis subsp. pakistani was obtained at 24th hours, pH 7.5, and 40oC.
B. thuringiensis Lot II was optimum at 21th hour, pH 6,0, and 50oC. B. thuringiensis 47 was optimum at 21st hour, pH 5,0, and 35 oC. Ammonium
sulphate was used for precipitation of chitinase protein. The highest spesific activity of chitinase was obtained on ammonium sulphate at saturation 20% for B. thuringiensis subsp. pakistani, 30% for B. thuringiensis Lot II and 40% for
B. thuringiensis 47. The highest production of protoxin protein from B. thuringiensis subsp. pakistani and B. thuringiensis 47 was obtained at 36th
hour, whereas B. thuringiensis Lot II at 33rd hour. The molecule weight of chitinase molecule was determined by Sodium Dodecyl Sulfate Solution Polyacrilamide Gel Electrophoresis (SDS-PAGE). Molecular weight of chitinase of B. thuringiensis subsp. pakistani, B. thuringiensis Lot II and 47 estimated at 71,15 kDa. The weight of protoxin protein molecule all isolates estimated 129,99 and 130,04 kDa.