EKSPRESI HETEROLOG ENDO-β-XILANASE DARI Bacillus
pumilus BCRS-01 PADA Escherichia coli
ARIF SETIAWAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Ekspresi Heterolog
endo-β-xilanase dari Bacillus pumilus BCRS-01 pada Escherichia coli adalah benar karya saya dengan arahan dari komisi pembimbing Prof Dr Ir Antonius Suwanto, MSc serta Prof Dr Anja Meryandini, MS dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2016
Arif Setiawan
P051130251
RINGKASAN
ARIF SETIAWAN. Ekspresi Heterolog Endo-β-Xilanase dari Bacillus pumilus
BCRS-01 pada Escherichia coli. Dibimbing oleh ANTONIUS SUWANTO dan ANJA MERYANDINI.
Xilanase adalah kelompok enzim glikosil hidrolase yang mampu menghidrolisis xilan pada dinding sel tanaman. Endo-β-xilanase merupakan salah satu enzim utama yang mampu memecah ikatan β-1,4-glikosida dari rantai utama xilan yang menghasilkan xilooligosakarida (XOs) dan monomer xilosa. Cairan rumen sapi memiliki bakteri penghasil xilanase. Tujuan penelitian ini adalah untuk memperoleh bakteri penghasil xilanase dari cairan rumen sapi dan melakukan ekspresi secara heterolog gen xynA pengkode endo-β-xilanase pada
Escherichia coli.
Sebanyak 29 isolat bakteri penghasil xilanase telah berhasil diisolasi dari cairan rumen sapi pada media padat selektif yang mengandung substrat birchwood xylan. Isolat bakteri BCRS-01 adalah isolat terpilih yang mampu menghasilkan aktivitas xilanase tertinggi. Hasil identifikasi berdasarkan gen pengkode 16S rRNA, isolat BCRS-01 memiliki kemiripan 99% dengan Bacillus pumilus (nomor akses NR043241). Xilanase kasar dari BCRS-01 memiliki aktivitas optimum pada suhu 55oC dan pH 7. Karakterisasi selanjutnya, xilanase memiliki stabilitas pH yang luas dari pH 4-10. Inkubasi xilanase selama 60 menit pada pH 4 dan 10 memperlihatkan aktivitas tertinggal sebanyak 60% dan 40% secara berurutan. Pada pengujian stabilitas suhu, juga memperlihatkan aktivitas stabil pada suhu 25-50oC serta memiliki aktivitas tertinggal sebesar 80% dan 50% ketika diinkubasi pada suhu 50oC selama 30 dan 60 menit. Aktivitas xilanase dihambat kuat oleh ion-ion Ca2+ dan Cu2+ pada konsentrasi 10 mM, serta juga sedikit dihambat ion Mn2+ pada konsentrasi 1 mM. Oleh karena itu, xilanase ini berpotensi digunakan sebagai bahan tambahan dalam pembuatan pakan unggas di industri pakan ternak.
Sekuen DNA gen xynA pengkode endo-β-xilanase telah berhasil diamplifikasi dan diperbanyak ke dalam vektor ekspresi pET-15by yang dikendalikan oleh T7 promoter. Protein rekombinan juga berhasil diekspresikan pada Escherichia coli BL21 (DE3) pLysS. Bobot molekul protein diperkirakan berukuran 26.7 kDa menggunakan SDS-PAGE. Protein rekombinan endo-β -xilanase menunjukkan aktivitas enzim sebesar 56 U mL-1 dengan menggunakan substrat birchwoodxylan yang diinkubasi selama 10 menit pada suhu 55oC.
SUMMARY
ARIF SETIAWAN. Heterologous Expression of Endo-β-xylanase from Bacillus pumilus strain BCRS-01 in Escherichia coli. Supervised by ANTONIUS SUWANTO and ANJA MERYANDINI.
Xylanases are glycoside hydrolase family 11 which depolymerise xylan in the plant cell wall, the most excessive form of hemicellulose. Endo-β-xylanases (EC 3.2.1.8) are most important to breakdown β-1,4-glicoside bond of xylan to produce disaccaride xyloolygosaccaride (XOs) and xylose (monomer). Bovine rumen fluids have potential to obtain endo-β-xylanase produced of bacteria. The objectives of this study were to obtain xylanase producing bacteria and to express
xynA gene encoding endo-β-xylanase from bacterium in Escherichia coli.
Twenty nine isolate bacteria have been succesfully isolated from bovine rumen fluid in agar medium containing birchwood xylan. Isolate BCRS-01 bacterium was previously screened for the high production of xylanase. Based on 16S rRNA gene sequence analysis, BCRS-01 showed high similarity (99%) to
Bacillus pumilus (accession number NR043241). The crude xylanase had optimal activity at 55oC, pH 7.0. Furthermore, the crude xylanase exhibited broad pH stability from 4.0 to 10.0 and remained more than 60% and 40% of its activity after incubation at pH 4.0 until 10.0, respectively for 60 min. It also showed a stability at temperature 25-50oC since it retained 80% and 50% of its activity when incubated at 50oC or 30 and 60 min, respectively. The xylanase activity was strongly inhibited by Ca2+ and Cu2+ at concentration 10 mM, and as little as 1 mM for Mn2+. Therefore, this xylanase has potentially used as additive feeds in animal feed industry.
The DNA sequence xynA gene encoded endo-β-xylanase was amplified and cloned into the expression vector pET-15by under the control of T7 promoter. The recombinant protein had succesfully expressed in Escherichia coli BL21 (DE3) pLysS. A protein recombinant of approximately, 26.7 kDa was observed on the SDS-PAGE analysis. Crude extract of recombinant endo-β-xylanase demonstrated activity of enzyme at 56 U mL-1 using birchwood xylan as a substrate at 55oC for 10 min.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi
EKSPRESI HETEROLOG ENDO-β-XILANASE DARI Bacillus
pumilus BCRS-01 PADA Escherichia coli
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah Subhanahu wa Ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian ini adalah mengenai Ekspresi gen endo-β-xilanase secara heterolog dari Bacilluspumilus BCRS-01 ke Escherichiacoli.
Terima kasih kepada Rektor IPB, Dekan SPs IPB yang telah memberikan izin dan kesempatan kepada penulis untuk mengikuti pendidikan program Magister di Sekolah Pascasarjana IPB. Terima kasih kepada Direktur Jenderal Pendidikan Tinggi (DIKTI), Kementerian Pendidikan dan Kebudayaan Republik Indonesia yang telah memberikan dukungan dana kuliah pada program beasiswa BPPDN calon Dosen tahun 2013-2015, serta kepada Ketua Program Studi Bioteknologi IPB beserta staf atas semua bantuan administrasi.
Terima kasih penulis ucapkan kepada Bapak Prof Dr Ir Antonius Suwanto MSc dan Ibu Prof Dr Anja Meryandini MS selaku pembimbing, serta Ibu Dr Ir Utut Widyastuti, MSi yang telah memberi saran pada saat ujian. Di samping itu, penghargaan penulis sampaikan kepada Ibu Esti Puspitasari dan Ludovika Jessica Virginia beserta staf dan teknisi R&D Bioteknologi PT Wilmar Benih Indonesia Cikarang, yang telah membantu selama pengumpulan data, beserta teman seperjuangan Albert Sembiring, SSi, MSi, Natalia Lusianingsih SSi, MSi, Retno Tri Astuti, SSi, MSi dan Jekmal Malaoe SSi, MSi di Laboratorium Bioteknologi, rekan-rekan mahasiswa S2 Bioteknologi (BTK’ers) angkatan 2013, serta pihak lain yang tidak dapat disebut nama satu persatu atas dukungan dan kebersamaannya selama menempuh perkuliahan.
Ucapan terima kasih khusus penulis sampaikan kepada keluarga besar penulis. Terima kasih yang sangat dalam kepada ayahanda (Bapak Abdul Razak) dan Ibunda (Ibu Wiji Astutik) yang telah berjasa membesarkan, mendidik dan membentuk karakter penulis, kepada kakak dan adik serta keluarga besar, penulis ucapkan terima kasih atas dukungan, segala doa dan kasih sayang yang telah diberikan.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2016
DAFTAR ISI
DAFTAR TABEL xi
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 3
2 TINJAUAN PUSTAKA 3
Enzim Xilanase 3
Aplikasi Enzim Xilanase 5
Teknologi DNA Rekombinan 7
Ekspresi Gen dan Sistem Ekspresi Protein Rekombinan 9
3 METODE PENELITIAN 14
Waktu dan Tempat Penelitian 14
Bahan 14
Alat 14
Prosedur Penelitian 15
4 HASIL DAN PEMBAHASAN 22
Skrining Bakteri Penghasil Xilanase dan Aktivitas Xilanase 22 Identifikasi dan Pohon Filogenetik Isolat BCRS-01 22 Pengaruh pH dan Suhu terhadap Aktivitas Xilanase BCRS-01 24 Pengaruh Ion Logam terhadap Aktivitas Xilanase BCRS-01 25 Spesifisitas Substrat dan Kinetika Enzim Xilanase 26 Amplikon Gen xynA Pengkode Endo-β-xilanase BCRS-01 27 Perbandingan Sekuen Asam Amino xynA BCRS-01, ARA dan
ATCC 7061 27
Kloning dan Ekspresi Gen xynA Pengkode Endo-β-xilanase di E. coli 28
Pembahasan 30
5 SIMPULAN 32
DAFTAR PUSTAKA 32
LAMPIRAN 38
DAFTAR TABEL
1 Komposisi gel SDS-PAGE 21
2 Hasil BLAST isolat BCRS-01 berdasarkan gen pengkode 16S rRNA 23 3 Pengaruh ion logam terhadap aktivitas xilanase 25 4 Uji aktivitas enzim kasar xilanase terhadap berbagai substrat 26
DAFTAR GAMBAR
1 Mekanisme hidrolisis xilan oleh xilanase 5
2 Sistem ekspresi protein rekombinan di pET 11
3 Konstruksi vektor ekspresi 12
4 Pengaruh penggunaan kodon dalam proses translasi 13
5 Peta plasmid vektor kloning pGEM-T Easy 18
6 Peta plasmid vektor ekspresi pET-15by 20
7 Zona bening di sekitar koloni bakteri penghasil xilanase pada media
agar yang mengandung substrat birchwood xylan 22
8 Amplikon gen pengkode 16S rRNA pada 0.8% gel agarosa 23 9 Konstruksi pohon filogenetik isolat BCRS-01 berdasarkan gen
pengkode 16S rRNA 24
10 Pengaruh pH terhadap aktivitas xilanase BCRS-01 pada pH 7 24 11 Pengaruh suhu terhadap aktivitas xilanase BCRS-01 pada pH 7 25 12 Amplikon gen xynA pada 1% gel agarosa menggunakan PCR 26 13 Estimasi bobot molekul (MW) dan titik isoelektrik (pI) protein
rekombinan XynA menggunakan software ExPASy 27 14 Perbandingan sekuen asam amino gen xynA pengkode endo-β-xilanase
dari B. pumilus BCRS-01 dengan strain ARA dan ATCC 7061 27 15 Verifikasi plasmid rekombinan pGEM-xynA pada 1% gel agarosa 28
16 Konstruksi plasmid rekombinan pET-15by -xynA 29
17 Ekspresi protein rekombinan XynA pada SDS-PAGE 29
DAFTAR LAMPIRAN
1 Urutan basa nitrogen plasmid rekombinan pET-15by-xynA 38 2 Struktur model 3 dimensi protein xynA B. pumilus BCRS-01 38
1
PENDAHULUAN
Latar Belakang
Di Indonesia, industri kelapa sawit menghasilkan biomassa dalam jumlah yang besar setiap tahun. Produk samping agro-industri seperti palm kernel meal
atau PKM merupakan biomassa yang dapat menjadi sumber alternatif yang murah dan berkelanjutan untuk memproduksi pakan ternak. Produksi pembuatan pakan ternak merupakan sektor agribisnis penting yang dapat mencapai lebih dari 600 juta ton atau kira-kira 200 juta US dolar di dunia (Polizeli et al. 2005; Kallel et al.
2014). Dalam proses pembuatan pakan ternak, xilanase merupakan enzim yang digunakan sebagai bahan tambahan untuk membuat pakan khususnya ternak non ruminansia seperti unggas dan babi (Nagar et al. 2012; Barekatain et al. 2013). Peranan xilanase adalah untuk meningkatkan ketersediaan nutrisi pakan (Tan 2001; Qiu et al. 2010; Zang dan Sang 2015) bagi ternak serta dapat mengurangi masalah kesehatan karena serat tanaman yang sulit dicerna (Kulkarni et al. 1999).
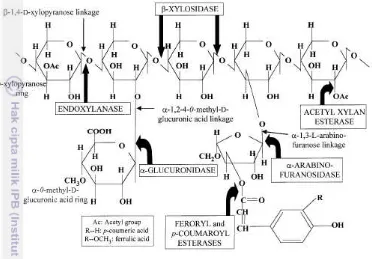
Pada dinding sel tanaman, xilan adalah hemiselulosa dan heteropolimer polisakarida yang paling banyak setelah selulosa (Dhiman et al. 2008). Heteropolimer ini memiliki rantai dasar D-xilopiranosa yang dihubungkan dengan
ikatan β-1,4-glikosida (Anthony et al. 2003) dan terdapat cabang manosa, arabinosa, asam glukoronat serta gugus asetil. Hidrolisis xilan merupakan tahapan paling penting dalam pemanfaatan lignoselulosa yang melimpah (Saha 2003). Enzim hemiselulase secara umum digunakan dalam bentuk campuran (cocktail) yang terdiri atas berbagai enzim hidrolitik untuk memecah hemiselulosa (Bhalla et al. 2014). Salah satu kelompok enzim hemiselulase adalah xilanase. Xilanase adalah kelompok enzim glikosil hidrolase yang berfungsi menghidrolisis kompleks xilan. Xilanase terdiri atas berbagai macam enzim seperti endo-β
-xilanase, β-xilosidase, α-glukuronidase, α-arabinofuranosidase dan esterase. Endo-1,4-β-xilanase (EC 3.2.1.8) merupakan enzim utama untuk mendegradasi
xilan yang secara acak menghidrolisis ikatan β-1,4-glikosida menghasilkan xilooligosakarida (XOs) dan xilosa (Collins et al. 2005).
Xilanase banyak dihasilkan oleh fungi dan bakteri. Fungi yang menghasilkan xilanase antara lain Aspergillus (Betini et al. 2009), Trichoderma
(Gomes et al. 1992), Rhizopus (Bakir et al. 2001) dan Penicillium (Belancic et al.
1995; Cui et al. 2009). Xilanase dari fungi telah banyak dikomersilkan untuk industri, namun baru-baru ini bakteri lebih disukai untuk produksi xilanase. Bakteri lebih menguntungkan karena pertumbuhannya yang cepat sehingga tingkat produksi enzim biasanya lebih tinggi (Shanti dan Roymon 2014). Karakter xilanase yang dihasilkan oleh fungi atau bakteri menunjukkan aktivitas optimum yang berbeda misalnya pH netral terdapat pada bakteri atau sedikit lebih asam terdapat pada fungi dengan suhu mesofil (rata-rata antara 40-55oC) (Collins et al. 2005; Wang et al. 2012).
2
diperlukan xilanase dengan karakter pH dan suhu optimum untuk proses fermentasi. Beberapa enzim komersial seperti Allzym VegProPT memiliki aktivitas optimum pada pH 5.5 dan suhu 65oC, Xilanase GS35 (pH 4.5 dan suhu 40oC), Sumizyme X Shin Nihon (pH 5 dan suhu 55oC) dan Roxazyme G2 G/L (pH 5 dan suhu 40oC). Oleh karena itu, penelitian ini penting dilakukan untuk memperoleh xilanase yang dapat diaplikasikan langsung sebagai bahan tambahan pembuatan pakan ternak.
Sumber mikroba penghasil xilanase yang paling diminati adalah dari ternak ruminansia. Ternak ruminansia dapat menghasilkan enzim xilanase yang merupakan sekresi dari bakteri rumen. Flint dan Bayer (2008) menyebutkan bahwa xilanase yang diperoleh dari rumen paling diminati karena efisiensinya dalam menghidrolisis polisakarida tanaman. Pada rumen sapi terdapat sisa-sisa makanan yang tidak tercerna secara sempurna dan banyak mengandung hemiselulosa yang merupakan sumber potensial untuk memperoleh bakteri xilanolitik. Xilanase yang dihasilkan oleh bakteri memiliki keragaman metabolisme yang tinggi sehingga banyak digunakan secara luas untuk memproduksi xilanase di industri (Bajaj dan Singh 2010).
Beberapa penelitian xilanase yang dihasilkan oleh bakteri telah berhasil diklon dan dikarakterisasi enzimnya. Bakteri Pseudobutyrivibrio xylanivorans
Mz5T dari rumen sapi telah diklon dan memiliki aktivitas optimum pada suhu 38oC dan pH 5.6 (Cepeljnik et al. 2004). Mohana et al. (2008) menyebutkan bahwa xilanase Burkholderia sp. juga memiliki aktivitas optimum pada pH 8.6 dan suhu 50oC, serta Acinetobacter junii (Lo et al. 2010) pada pH 7.0 dan suhu 60oC. Xilanase Bacillus pumilus asal tanah telah diklon dan diekspresikan secara heterolog pada Escherichia coli dengan aktivitas optimum pada pH 6.6 dan suhu 50oC (Yasinok et al. 2008; Qu dan Shao 2011).
Pada penelitian ini, pencarian bakteri mesofilik penghasil xilanase yang berasal dari cairan rumen sapi berguna untuk memperoleh xilanase mesofil. Suhu pada cairan rumen sapi dapat mencapai antara 35-40oC (mesofil), meskipun demikian xilanase yang berasal dari lingkungan ini biasanya aktif pada suhu diatas 50oC (termofil). Banyak xilanase khususnya endoxilanase termofil memiliki struktur yang homolog dengan mesofil. Termostabilitas xilanase termofil disebabkan karena adanya tambahan jembatan disulfida, adanya residu N-terminal prolin yang menghasilkan konformasi bebas, ikatan garam dan adanya rantai samping hidrofobik (Turunen et al. 2001). Hakulinen et al. (2003) menyatakan bahwa perbandingan urutan dan struktur enzim xilanase termofil dengan mesofil sebagai berikut:
1. Pada struktur primer, persentase residu arginin yang tinggi sehingga meningkatkan interaksi kutub dan rasio treonin/serin yang tinggi dapat meningkatkan termostabilitas xilanase termofil;
2. Pada struktur sekunder, α-helix memiliki banyak asam aspartat dan arginin pada xilanase termofil dan β-sheet lebih panjang dibandingkan xilanase mesofil.
Perumusan Masalah
3 makanan yang tidak tercerna secara sempurna yang banyak mengandung hemiselulosa salah satunya xilan yang tinggi pada tanaman. Akan tetapi secara alami bakteri penghasil xilanase tidak mudah untuk menghasilkan enzim xilanase dalam jumlah besar. Untuk memenuhi kebutuhan enzim tersebut, teknik rekombinasi DNA merupakan salah satu teknik yang dapat digunakan untuk memperbaiki produksi xilanase. Galur bakteri rekombinan yang dihasilkan akan memproduksi enzim fungsional dari gen target sekaligus dapat meningkatkan produktivitas enzim.
Tujuan Penelitian
Tujuan penelitian ini adalah untuk melakukan isolasi bakteri penghasil xilanase asal rumen sapi dan ekspresi gen xynA pengkode endo-β-xilanase secara heterolog pada E. coli.
Manfaat Penelitian
Hasil dari penelitian ini dapat dimanfaatkan dalam proses rekayasa produksi enzim. Harapan selanjutnya akan diperoleh xilanase yang dapat menyediakan nutrisi seperti gula sederhana dalam pakan sehingga dapat mengurangi gangguan pencernaan pada ternak ayam dan bebek.
2
TINJAUAN PUSTAKA
Enzim Xilanase
Klasifikasi
Xilanase termasuk dalam kelompok enzim hidrolase yang menghidrolisis xilan. Enzim xilanase disebut juga dengan 1,4-β-D-xilan xilanohidrolase (Rahman 2005). Berdasarkan Nomenclature Committee of The International Union of Biochemistry and Molecular Biology (NC-IUBB) enzim ini termasuk ke dalam golongan E.C.3.2.1. Angka di depan kode tersebut menunjukkan bahwa xilanase termasuk ke dalam golongan hidrolase, yang berarti enzim ini memerlukan air dalam memecah ikatan C-O, C-N, O-P dan C-S. Angka 3.2 menunjukkan bahwa enzim ini termasuk ke dalam sub golongan enzim glikosilasi. Berdasarkan kesamaan sekuen asam aminonya, xilanase secara umum diklasifikasikan ke dalam dua famili glikosil hidrolase, yaitu: famili 10 dan famili 11 (Henrissat 1991). Sisi aktif famili 10 berpusat disekitar daerah conserved residu asam glutamat (Tull et al. 1991).
Menurut polizeli (2005) enzim xilanase terdiri atas lima macam enzim, yaitu:
4
xilanohidrolase; β-xilanase; β-1,4-xilan xilanohidrolase; endo-1,4-β
-xilanase; β-D-xilanase.
b. β-D-xilosidase (EC 3.2.1.37) ata nama lainnyaμ xilobiase; β-xilosidase; ekso-1,4-β-xilosidase; β-D-xilopiranosidase; β-xilosidase; ekso-1,4-xilosidase; ekso-1,4-β-D-xilosidase; 1,4-β-D-xilan xilohidrolase.
c. Asetilxilan esterase (EC 3.1.1.6) atau nama lainnya: C-esterase; ester asetat hidrolase; kloroesterase; p-nitrofenil asetat esterase; citrus asetilesterase.
d. α-arabinofuranosidase (EC 3.2.1.55) atau α-L-arabinofuranosidase berperan dalam pemutusan α-L-arabinan yang mengandung ikatan (1,3)-arabinoxilan dan/atau (1,5)-arabinogalaktan, menghasilkan α-arabinosida. e. α-glukuronidase (EC 3.2.1.139) atau nama lainnya: glikogenase; α
-amilase; endoamilase, Taka-amilase A; 1,4-α-D-glukan glukanohidrolase.
Sifat
Endoxilanase yang masuk ke dalam glikosil hidrolase famili 10 secara umum mempunyai berat molekul yang lebih besar (lebih dari 40 kDa) bila dibandingkan dengan glikosil hidrolase famili 11 yang mempunyai berat molekul sekitar 20 kDa. Mikroba yang menghasilkan xilanase dari famili 10 biasanya juga mempunyai aktivitas selulase. Hal ini tidak terjadi pada mikroba penghasil xilanase dari famili 11. Ukuran yang kecil dan bentuk yang padat dari xilanase famili 11 membuatnya mudah masuk ke jaringan serat selulosa tanpa harus merusak serat sehingga enzim ini sangat cocok digunakan dalam biobleaching
(Oakley et al. 2003).
Menurut Tuncer dan Ball (1999), enzim endoxilanase yang dihasilkan oleh
Themomonospora fusca mempunyai aktivitas yang relatif stabil pada kisaran pH 6.5-9.5. Kulkarni et al. (1999) melaporkan bahwa enzim xilanase dari Bacillus sp. C-59-2 memiliki aktivitas pada pH optimum berkisar antara 6-8, sedangkan aktivitas enzim xilanase yang diisolasi dari Bacillus sp. TAR C-125 dan alkalofilik Bacillus sp. NCL-86-6-10 optimal pada pH 9-10.
Gupta et al. (2000) melaporkan telah berhasil mengisolasi mikroba alkalofilik obilgat, Bacillus sp. NG-27, yang dapat memproduksi xilanase yang optimal bekerja pada suhu 70oC dan pH 8.4 serta dapat mempertahankan aktivitasnya sampai 70% pada pH 11.
Aktivitas
Xilanase termasuk ke dalam kelompok enzim penghidrolisis senyawa polimer. Endo-β-xilanase (E.C.3.2.1.8) mampu menghidrolisis bermacam-macam xilan dan menghasilkan xilooligosakarida berantai pendek. Dekker (1983) menyatakan bahwa hidrolisis xilan merupakan hasil kerjasama enzim endo-β -1,4-D-xilanase dan eksoglikosidase sepertiμ β-D-xilosidase, β-L-arabinosidase, dan β -D-glukoronidase. Hidrolisis sempurna dari berbagai xilanase ini dapat dilihat dari jumlah D-xilosa, L-arabinosa, dan asam D-glukoronat yang dihasilkan.
Polizeli (2005) menyatakan bahwa setiap enzim pendegradasi xilan yakni endo-β-1,4-xilanase, β-D-xilosidase, asetilxilan esterase, arabinase, dan α -glukoronidase, mempunyai mekanisme hidrolisis xilan yang berbeda namun bekerja secara sinergis. Endo-1,4-β-xilanase menghidrolisis xilan menjadi
5 menjadi xilosa. Asetilxilan esterase memutuskan O-asetil dari posisi 2 atau 3 pada
β-D-xilopiranosil. Arabinase memutuskan L-arabinosa yang tersubstitusi pada
posisi 2 atau 3 dari β-D-xilopiranosil. α-Glukoronidase menghidrolisis asam
glukoronik dengan β-D-xilanopiranosil (Gambar 1).
Gambar 1 Mekanisme hidrolisis xilan oleh xilanase (Beg et al. 2001) Aktivitas enzim xilanase dapat diukur antara lain dengan menggunakan metode Bailey maupun Miller. Aktivitas xilanase pada metode ini ditentukan dengan mengukur gula pereduksi yang dihasilkan dari hidrolisis xilan dengan bantuan asam dinitrosalisilat (DNS). DNS merupakan senyawa aromatik yang akan bereaksi dengan gula pereduksi dan membentuk asam-3-amino-5-nitrosalisilat. Senyawa ini dapat diukur dengan menggunakan spektrofotometer
dengan =540 nm (Bailey et al. 1992).
Aplikasi Enzim Xilanase
Aplikasi xilanase komersial dapat dimanfaatkan antara lain dalam industri kertas pada proses pemutihan bubur kertas (Ruiz-Arribas et al. 1995), pembuatan roti, pemanis rendah kalori (xilitol) dan bioetanol (Helianti et al. 2007), karena memiliki aktivitas spesifik, termostabilitas tinggi, aktif pada kisaran pH dan spesifisitas substrat yang luas (Bhalla et al. 2014). Kebanyakan xilanase komersial dihasilkan oleh fungi seperti Trichoderma, Aspergillus, Penicillium,
Aureobasidium, Talaromyces sp. dan bakteri Bacillus (Li et al. 2000). a. Xilanase dalam produksi xilitol
6
diproduksi dari xilan. Xilan banyak diperoleh dari limbah pertanian dan industri makanan. Dengan demikian, pengembangan proses hidrolisis secara enzimatis juga merupakan prospek baru untuk penanganan limbah hemiselulosa (Richana dan Lestina 2003).
b. Xilanase dalam proses pembuatan kertas
Xilanase digunakan pada pembuatan kertas untuk menghilangkan hemiselulosa dalam proses biobleaching. Penggunaan enzim dalam industri ini sebagai pengganti penggunaan senyawa kimia, sehingga pencemaran racun limbah kimia dapat dihindari. Bahan baku kayu yang digunakan dalam proses pembuatan kertas setelah melalui proses digester dan pencucian, sebenarnya masih dalam keadaan kotor (derajat putihnya rendah). Untuk menghasilkan kertas yang bermutu tinggi perlu dilakukan proses pemutihan. Proses pemutihan bertujuan untuk menghilangkan lignin, hemiselulosa penyebab warna cokelat dan zat ekstraktif yang tersisa dari hasil pencucian dan penyaringan (Richana dan Lestina 2003).
Hidrolisis hemiselulosa dapat melepaskan ikatan antara kromofor dan lignin, namun penghilangan xilan tidaklah disarankan karena akan mengurangi hasil pulp, dan jika dilakukan secara ekstrim maka penghilangan xilan akan mengurangi kekuatan pulp. Xilanase melarutkan lignin dengan cara menghidrolisis xilan yang merupakan penyususn utama hemiselulosa serta membuka struktur pulp selulosa sehingga struktur lignin tersebut terbuka dan lebih mudah larut (Polizeli et al.
2005). Kertas yang dihasilkan menggunakan xilanase memiliki kualitas kecerahan yang lebih tinggi, lebih lentur, dan permukaannya lebih halus (Rifaat et al. 2005)
Penggunaan xilanase sebagai biobleaching non kimia untuk menghasilkan
craft pulp memerlukan aktivitas atau reaksi yang memodifikasi residu xilan pada
craft pulp. Salah satu metode untuk memperkirakan aktivitas xilanase pada craft pulp adalah dengan mengukur pelepasan kadar gula tereduksi dari pulp yang diikuti oleh hidrolisis secara enzimatis. Walaupun demikian, sampai saat ini belum ada keterangan yang jelas yang menunjukkan korelasi antara pelepasan gula reduksi selama perlakuan enzimatis dengan peningkatan pulp bleaching
(Morris et al. 1998).
c. Xilanase dalam pembuatan pakan ternak
Van paridon et al. (1992) telah melakukan penelitian pemanfaatan xilanase untuk campuran makanan ayam boiler, dengan melihat pengaruhnya terhadap bobot badan yang dicapai dan efisiensi konversi makanan serta hubungannya dengan viskositas pencernaan, hal yang yang sama juga dilakukan oleh Bedord dan Classen (1992). Para peneliti diatas melaporkan bahwa campuran makanan ayam boiler dengan xilanase ternyata mampu memperbaiki penyerapan gizi, sehingga meningkatan pencapaian berat dan efisiensi konversi makanan.
d. Xilanase dalam produksi roti
7
Teknologi DNA Rekombinan
Kloning Gen
Istilah kloning menjadi lebih populer setelah lahirnya domba dolly yang merupakan hasil kloning (reproduktif) dari induknya. Sejak itu kloning menjadi istilah yang sangat populer dipakai oleh kalangan ilmuan untuk menjelaskan duplikasi material biologis walaupun diperoleh dengan proses yang berbeda. Dalam pengertian umum sebuah klon adalah suatu cetakan yang identik dari suatu organisme, organ, sel tunggal, maupun makromolekul DNA (Helianti 2010).
Terdapat 5 komponen umum yang dibutuhkan untuk melakukan kloning gen adalah vektor kloning DNA, fragmen DNA target yang akan diklon, enzim restriksi, enzim ligase dan bakteri inang yang kompeten. Vektor kloning adalah molekul DNA yang dapat membawa DNA asing (target) ke dalam sel inang, bereplikasi didalam sel, dan menghasilkan cetakan dari dirinya sendiri dan DNA asing yang dibawanya. Karakter substansial yang harus dimiliki oleh sebuah vektor DNA diantaranya adalah dapat melakukan propagasi didalam sel inang, mempunyai multiple cloning untuk memasukkan DNA asing/target ke dalamnya, dan mempunyai gen marker (gen tahan antibiotik atau gen reporter) yang memungkinkan untuk menyeleksi bakteri rekombinan yang mengandung plasmid dengan DNA asing (Helianti 2010).
Terdapat berbagai macam vektor yang biasa digunakan dalam rekayasa genetika. Diantaranya adalah plasmid, faga, kosmid, Bacterial Artificial Chromosomes (BAC) dan Yeast Artificial Chromosomes (YAC). Plasmid adalah molekul DNA sirkular yang terdapat bebas dalam sel bakteri. Di dalam sel, posisinya terpisah dengan kromosom dan plasmid mempunyai gen-gen ori (origin of replication) sehingga mampu mereplikasi sendiri tanpa harus tergantung pada kromosom (Muladno 2002).
Plasmid memiliki beberapa kelebihan yang dapat digunakan sebagai vektor kloning. Rangkaian basa yang lengkap pada banyak plasmid sudah diketahui, karena itu, lokasi situs pemotongan yang tepat oleh enzim restriksi untuk menyisipkan DNA asing sudah dapat dipetakan. Plasmid berukuran lebih kecil daripada kromosom inang sehingga mudah dipisahkan dari kromosom tersebut, dan DNA yang diinginkan mudah dilepaskan lewat pemotongan plasmid dengan enzim yang spesifik untuk enzim restriksi yang ke dalamnya disisipkan potongan asli DNA (Murray et al. 2003).
Faga adalah turunan dari virus yang menginfeksi bakteri, bisa berasal dari faga ataupun faga M13. Faga biasanya mempunyai molekul DNA linear yang ke dalamnya dapat disisipkan DNA asing pada beberapa situs enzim restriksi. DNA kimera dikumpulkan setelah faga berkembang lewat siklus lisisnya dan menghasilkan partikel faga yang matang serta infektif. Kelebihan utama pada vektor faga adalah kemampuannya untuk menerima fragmen DNA dengan panjang 10-20 kb, sementara plasmid hanya mampu menerima potongan DNA dengan panjang sekitar 6-10 kb (Murray et al. 2003).
8
sudah dikeluarkan, maka lebih banyak DNA kimera yang dapat dikemas ke dalam kepala faga. Tidak jarang kosmid membawa sisipan DNA kimerik yang panjangnya 35-50 kb. Bahkan potongan DNA yang lebih besar dapat disatukan ke dalam BAC dan YAC. Vektor ini menerima dan memperbanyak sisipan DNA yang panjangnya beberapa ratus kb atau lebih (Murray et al. 2003).
Enzim restriksi atau endonuklease restriksi adalah enzim yang memotong DNA pada rangkaian DNA spesifik di dalam molekul. Keberadaannya pada suatu bakteri tertentu akan membatasi pertumbuhan virus bakteri yang disebut bakteriofaga. Enzim restriksi memotong DNA dari sumber apapun menjadi potongan yang pendek dengan cara yang spesifik menurut rangkaiannya. Enzim defensif ini melindungi DNA bakteri yang menjadi inang dari DNA yang berasal dari organisme asing terutama organisme yang infektif. Meskipun demikian, enzim tersebut hanya terdapat pada sel yang juga mempunyai enzim pendamping yang melakukan metilasi DNA inang sehingga membuatnya menjadi substrat yang tidak sesuai untuk dicernakan oleh enzim restriksi (Murray et al. 2003).
Enzim restriksi diberi nama menurut bakteri yang merupakan asal enzim tersebut diisolasi. Misalnya EcoRI berasal dari E. coli, dan BamHI dari B. amyloliquefaciens. Tiga huruf pertama pada enzim restriksi terdiri dari huruf pertama yang menyatakan genus (E), dan dua huruf berikutnya yang menyatakan spesies (co). Tiga huruf ini dapat diikuti dengan simbol strain (R) dan angka romawi (I) untuk menunjukkan urutan penemuan. Setiap enzim akan mengenali dan memotong rangkaian DNA untai ganda yang spesifik, yaitu rangkian dengan panjang 4-7 pb. Potongan DNA ini akan menghasilkan ujung tumpul (blunt end) atau ujung lengket (sticky-end) menurut mekanisme pemotongan yang dilakukan oleh enzim tersebut (Murray et al. 2007).
Jika nukleotida didistribusikan secara acak dalam suatu molekul DNA tertentu, kita akan dapat menghitung frekuensi pemotongan bagian DNA oleh enzim tertentu. Untuk setiap posisi dalam molekul DNA terdapat empat kemungkinan yaitu A, C, G, dan T. Oleh karena itu enzim restriksi yang mengenali rangkaian 4 pb akan memotong rata-rata sekali setiap 256 pb (44), sedangkan enzim lainnya yang mengenali rangkaian 6 pb akan memotong sekali setiap 4096 pb (46). Potongan tertentu DNA mempunyai susunan linear yang khas untuk berbagai enzim, dengan demikian dapat dibuat peta restriksi. Jika DNA dicerna dengan enzim restriksi tertentu, ujung semua ragmennya akan mempunyai rangkaian DNA yang sama. Fragmen yang dihasilkan dapat diisolasi dengan elektroforesis pada agarosa atau poliakrilamida. Perlakuan ini merupakan tahap yang esensial dalam proses kloning (Murray et al. 2003).
Enzim ligase menyambungkan kedua ujung fragmen DNA dengan membentuk ikatan fosfodiester antara kedua fragmen tersebut. Pada umumnya enzim ligase yang digunakan dalam rekayasa genetika adalah enzim yang dimurnikan dari E. coli yang telah diinfeksi oleh faga T4. Enzim ini dikenal dengan nama T4 DNA ligase (Brown 2010).
9 asing dengan berbagai macam teknik yang telah diuji coba, serta telah banyak diketahui informasinya (Mc Kane dan Kandel 1996).
E. coli dalam keadaan normal sulit mengakomodasi DNA dari luar. Bakteri harus mengalami perlakuan fisika atau kimia, untuk meningkatkan kemampuannya dalam mengambil DNA di lingkungan. Sel yang telah mengalami perlakuan ini disebut sel yang bersifat kompeten (Brown 1991).
Ekspresi Gen dan Sistem Ekspresi Protein Rekombinan
Salah satu fungsi dasar yang harus dijalankan oleh DNA sebagai materi genetik adalah fungsi fenotipik. Artinya, DNA harus mampu mengatur pertumbuhan dan diferensiasi individu organisme sehingga dihasilkan suatu fenotipe tertentu. Fenotipe organisme sangat ditentukan oleh hasil interaksi protein-protein didalam sel. Setiap protein tersusun dari sejumlah asam amino dengan urutan tertentu, dan setiap asam amino pembentukannya disandi oleh urutan basa nitrogen didalam molekul DNA. Rangkaian proses ini, mulai dari DNA hingga terbentuknya asam amino, dikenal sebagai dogma sentral biologi molekuler (Susanto 2002).
Perubahan urutan basa di dalam molekul DNA menjadi urutan basa molekul RNA dinamakan transkripsi, sedangkan penerjemahan urutan basa RNA menjadi urutan asam amino suatu protein dinamakan translasi. Jadi, proses transkripsi dan translasi dapat dilihat sebagai tahap-tahap ekspresi urutan basa DNA. Namun, tidak semua urutan basa DNA akan diekspresikan menjadi urutan asam amino. Urutan basa DNA yang pada akhirnya menyandi urutan asam amino disebut sebagai gen. Dengan demikian, secara kimia gen adalah urutan basa nitrogen tertentu pada molekul DNA yang dapat diekspresikan melalui tahap-tahap transkripsi dan translasi menjadi urutan asam amino tertentu (Susanto 2002).
Translasi, atau sintesis protein, berlangsung di dalam ribosom, suatu struktur organel yang banyak terdapat di dalam sitoplasma. Ribosom terdiri dari dua subunit, besar dan kecil, yang akan menyatu selama inisiasi translasi dan terpisah ketika translasi telah selesai. Ukuran ribosom sering dinyatakan atas dasar laju pengendapannya selama sentrifugasi sebagai satuan yang disebut Svedberg (S). Pada kebanyakan prokariot ribosom mempunyai ukuran 70S, sedangkan pada eukariot biasanya sekitar 80S. Tiap ribosom mempunyai dua tempat pengikatan tRNA, yang masing-masing dinamakan tapak aminoasil (tapak A) dan tapak peptidil (tapak P).
10
Menurut Karp (2008), gen yang mengkode jalur metabolik enzim pada bakteri biasanya dikelompokkan bersama dalam kromosom menjadi kompleks fungsional tertentu yang disebut operon. Semua gen pada operon dikoordinasikan dan dikontrol oleh suatu mekanisme yang pertama kali dijelaskan pada tahun 1961 oleh Francois Jacob dan Jacques Monod dari Patteur Institute di Paris. Secara umum operon bakteri terdiri atas:
- Gen struktural: adalah gen yang mengkode enzim itu sendiri. Gen struktural pada operon biasanya terletak berdampingan satu sama lain, dan RNA polimerase berpindah dari satu gen struktural ke gen struktural yang lain, mengubah gen-gen tersebut menjadi mRNA tunggal. Perpanjangan mRNA ini kemudian diterjemahkan ke dalam berbagai enzim spesifik dalam jalur metabolik.
- Promoter: adalah daerah dimana RNA polimerase terikat pada DNA sebagai awal dari proses transkripsi.
- Operator: adalah daerah yang terletak berdekatan atau tumpang tindih dengan promoter, dan merupakan tempat perlekatan protin yang disebut represor. Represor adalah contoh dari protein regulator yaitu protein yang mengenali sekuen spesifik tertentu dan berikatan dengan sekuen tersebut dengan afinitas tinggi.
- Gen regulator: gen yang mengkode protein represor. Kunci pada ekspresi operon berada pada represor. Bila represor mengikat operator, promoter tidak dapat berikatan dengan polimerase dan transkripsi tidak terjadi.
Aktivitas xilanase yang digunakan pada industri kertas diharapkan bebas dari aktivitas selulase, oleh sebab itu, Biely (1985) mengatakan bahwa tujuan dari kloning gen xilanase adalah (i) untuk mengkonstruksi produser yang menghasilkan sistem xilanolitik yang bebas dari enzim selulolitik; (ii) memperbaiki karakteristik industrial mikroorganisme dengan memasukkan gen xilanase dan xilosidase.
Sejumlah gen xilanase telah dikloning baik secara heterologous maupun
homologous. Pada kloning heterologous menggunakan E. coli sebagai inang aktivitas xilanase sering mengalami penurunan yang disebabkan oleh adanya modifikasi pasca-translasi dan adanya akumulasi xilanase rekombinan di dalam sel (Kulkarni et al. 1999). Untuk menghindari hal tersebut, teknik overekspresi banyak dilakukan dengan menggunakan promoter kuat pada vektor yang digunakan.
Pada tahun 1998, Chen dan Westpheling telah berhasil melakukan kloning gen xilanase dari Streptomyces coelicolor yang mempunyai kemiripan 99% dengan gen xynB dari Streptomyces lividans. Daerah promoter gen ini ditentukan dengan cara transcriptional fusion antara daerah upstream gen xynB dari S.
11
Sistem Ekspresi pET
Vektor ekspresi pET dikembangkan untuk melakukan klon dan ekspresi protein rekombinan pada E. coli. Gen target yang diklon dalam plasmid pET dikendalikan oleh sinyal kuat transkripsi bakteriofaga T7. Ekspresi diinduksi oleh T7 RNA polimerase dalam sel inang. T7 RNA polimerase paling selektif dan aktif ketika diinduksi dan hampir dikonversi untuk ekspresi gen target oleh sel; beberapa jam setelah induksi, produk yang diinginkan terdiri lebih dari 50% protein total sel. Meskipun sistem ini sangat kuat, dengan menurunkan konsentrasi induser berfungsi untuk menurunkan tingkat ekspresi. Penurunan tingkat ekspresi dapat meningkatkan yield beberapa protein target. Manfaat lain yang penting dari sistem ini adalah kemampuannya untuk mempertahankan gen target disaat tidak diinduksi. Pada umumnya, kloning gen target menggunakan inang yang tidak mengandung gen pengkode polimerase T7 RNA, sehingga menghilangkan ketidakstabilan plasmid karena produksi protein bersifat racun bagi sel inang. Ketika menggunakan sel inang yang bukan untuk ekspresi, ekspresi protein target
mungkin diawali dengan menginfeksi sel inang dengan CE6, sebuah faga yang membawa gen T7 RNA polimerase dikendalikan ƤL dan promotor ƤI, atau dengan memasukkan plasmid ke sel inang untuk mengekspresikan gen pengkode T7 RNA polimerase yang berada di kromosom dan ekspresi gennya dikendalikan oleh lacUV5. Pada kasus kedua, ekspresi gen diinduksi dengan penambahan IPTG ke dalam biakan bakteri. Dua jenis promotor T7 dan beberapa sel inang yang berbeda dalam menekan ekspresi basal, memberikan fleksibilitas yang baik dan mampu untuk mengoptimalkan ekspresi berbagai gen target (Novagen 2003).
12
untuk merepresi gen dalam operon lac. Ketika IPTG ditambahkan, hal ini untuk menginduksi pelepasan protein lacI (represor) dan mengekspresikan gen target. Selanjutnya, T7 RNA polimerase mengenali promoter T7/lac untuk mentranskripsi gen dan akan menghasilkan protein rekombinan (Gambar 2).
Setelah gen dikloning, protein dapat diproduksi dalam jumlah besar dengan relatif lebih mudah. Ekspresi gen yang menghasilkan protein untuk produksi skala besar membawa masalah serius dibandingkan di laboratorium. Banyaknya salinan gen di dalam sel menghasilkan protein yang lebih tinggi. Jadi kloning gen ke dalam plasmid high copy number biasanya menghasilkan protein lebih tinggi. Namun, plasmid high copy sering tidak stabil, terutama dalam biakan bakteri yang digunakan dalam industri. Meskipun terdapat gen resistensi antibiotik pada sebagian plasmid, hal ini adalah sebuah metode untuk mempertahankan plasmid dalam biakan. Salah satu solusi untuk mencegah hilangnya plasmid adalah dengan mengintegrasikan gen asing ke dalam kromosom sel inang (Clarck dan Pazdernik 2009).
Konstruksi Vektor Ekspresi
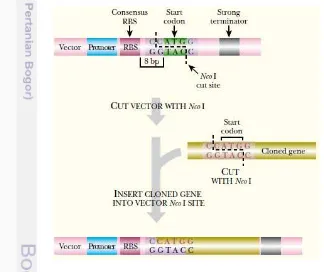
Ribosom bakteri mengikat mRNA dengan mengenali situs pengikatan ribosom (RBS) (juga dikenal sebagai urutan Shine-Dalgarno). RBS berpasangan dengan urutan AUUCCUCC pada subunit kecil ribosom 16S rRNA. Konsensus RBS adalah urutan UAAGGAGG yang diikat kuat. Umumnya, ini menyebabkan inisiasi pada translasi lebih efisien. Selain itu, RBS harus berada pada jarak yang dekat dengan kodon start AUG untuk mengoptimalkan translasi.
Gambar 3 Konstruksi vektor ekspresi (Clark dan Padzernik 2009)
13 RBS ditambah kodon start ATG yang terletak (8 pb) pada bagian hilir RBS. Gen yang telah diklon dimasukkan ke sebuah situs pengklonan yang tumpang tindih dengan kodon start ATG. Situs pemotongan enzim NcoI sangat cocok karena situs pengenalan (C/CATGG) mengandung urtan ATG. Oleh karena itu memungkinkan untuk menyisipkan gen target sehingga ATG gen target tepat persis dengan ATG dalam vektor ekspresi (Gambar 3). Gen yang diekspresikan dipotong dengan NcoI pada ujung 5'-ATG dan dengan enzim restriksi lain yang cocok di ujung 3'-end.
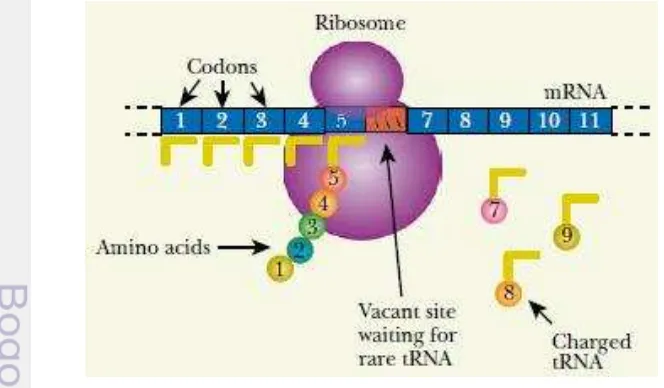
Pengaruh Penggunaan Kodon (CodonUsage)
Ketika gen dari satu organisme diekspresikan dalam sel inang yang berbeda terdapat beberapa masalah yaitu penggunaan kodon (codon usage). Kode genetik dapat mengartikan lebih dari satu kodon yang berbeda dan dapat mengkodekan asam amino yang sama. Jadi meskipun protein memiliki urutan asam amino tetap, terdapat penggunaan kodon lain yang cocok. Pada prakteknya, organisme yang berbeda memiliki kodon yang berbeda untuk asam amino yang sama. Sebagai contoh, asam amino lisin dikodekan oleh kodon AAA atau AAG. Pada E. coli, AAA digunakan 75% lebih banyak digunakan dan AAG hanya 25%. Sebaliknya,
Rhodobacter menggunakan AAG 75% lebih banyak, meskipun E. coli dan
Rhodobacter termasuk kelompok bakteri Gram negatif. Kodon dibaca oleh tRNA. Ketika sel menggunakan kodon yang jarang digunakan, sel memiliki tingkat tRNA lebih rendah dalam membaca kodon jarang. Oleh karena itu, jika gen dengan banyak kodon AAA dimasukkan ke dalam sel yang jarang menggunakan kodon AAA yang mengkode asam amino lisin, tRNA yang sesuai mungkin dalam jumlah sedikit sehingga sintesis protein berlangsung lambat (Clark dan Padzernik 2009).
Bakteri lebih menyukai satu kodon untuk mengkode asam amino tertentu dibandingkan kodon lainnya untuk asam amino yang sama. Pada Gambar 4, ribosom menghentikan proses translasi yang disebabkan karena menunggu tRNA lisin yang membawa antikodon UUU. E. coli tidak menggunakan kodon ini dan memiliki keterbatasan persediaan tRNA ini (Clark dan Padzernik 2009).
14
Dalam mengoptimalkan produksi protein, penggunaan kodon harus diperhatikan. Meskipun membutuhkan tambahan pekerjaan, urutan DNA sebuah gen mungkin diubah sehingga mengubah banyak kodon berlebihan. Hal ini dilakukan oleh sintesis buatan urutan DNA dari keseluruhan rekayasa gen. Gen yang telah dioptimasi kodonnya untuk inang yang baru mungkin menunjukkan peningkatan 10 kali lipat dalam memproduksi protein (Clark dan Pazdernik 2009). Hal ini disebabkan proses elongasi rantai polipeptida oleh ribosom pada saat sintesis protein berlangsung lebih cepat. Pendekatan ini telah berhasil digunakan untuk memproduksi protein Cry yang bersifat racun bagi serangga. Protein rekombinan ini berasal dari bakteri tanah Bacillusthuringiensis, yang telah diklon ke dalam tanaman transgenik jagung dan kapas untuk membunuh serangga utama
Ostrinianubilialis (Koziel et al. 1993).
3
METODE
Waktu dan Tempat
Penelitian dilaksanakan pada Oktober 2014 sampai Juni 2015. Tempat penelitian dilaksanakan di Laboratorium Bioteknologi, PT. Wilmar Benih Indonesia Cikarang Jawa Barat.
Bahan
Reagen DNS, substrat Birchwood xylan (Sigma), xilosa (Sigma), reagen Bradford, Bovine Serum Albumin (BSA), bufer (sodium asetat, sodium fosfat, Tris-HCl, Glisin-NaOH, KCl-NaOH), media Luria Bertani (LB), dan agar. Bahan yang digunakan untuk penelitian molekuler adalah E. coli strain DH5α dan strain BL21 (DE3) pLysS (Invitrogen), isopropil-β-D-tiogalaktopiranosida (IPTG), 5-bromo-kloro-3-indol-β-D-galaktopiranosida (X-Gal), Wizard® Genomic DNA Purification Kit (Promega), QIAquick® Extraction kit (Qiagen), QIAprep SpinMiniprep kit (Qiagen), enzim restriksi NotI dan SacI (New England Biolabs, NEB), T4 DNA ligase (NEB), vektor pGEM-T Easy (promega) dan vektor ekspresi pET-15by (Novagen).
Alat
Alat-alat yang umum digunakan antara lain alat-alat gelas, shaker incubator
(ThermoScientific), heating block (Grant Bio), Magnetic stirrer (Velp Scientifica),
vortex mixer (Ika® Genius 3), sentrifuga (Thermo Scintifica) dan microtube
(Axigen), millipore (Hartech), freezer -20oC dan -80oC (ThermoScientific), elektroforesis DNA, gel documentation UV XR+ (BioRad), thermal cycler PCR
15 yang berbeda lalu dicampur dalam satu botol steril. Isolasi bakteri penghasil xilanase dilakukan dengan mencampurkan 5 mL (1%) sampel ke dalam 45 mL 0.85% (b v-1) NaCl, lalu 100 µL hasil pengenceran berseri dari pengenceran 10-1 sampai 10-8 disebar secara merata ke dalam media selektif padat (spread plate) yang mengandung (b v-1): 0.1% tripton, 0.1% ekstrak khamir, 0.02% MgSO4,
0.1% (NH4)2SO4, 0.14% KH2PO4, dan substrat 0.5% birchwood xylan (Sigma)
1.5% bakto agar, lalu diinkubasi pada suhu 37oC selama 24 jam (Viet et al. 1991). Bakteri penghasil xilanase ditandai dengan terbentuknya zona bening disekitar koloni yang menghasilkan xilanase ekstraseluler. (Nawel et al. 2011). Enzim dipanen dengan sentrifugasi 6000 rpm, pada suhu 4oC selama 15 menit. Fraksi ekstraseluler pada supernatan adalah enzim kasar xilanase dan diukur aktivitas enzimnya.
Uji Aktivitas Enzim Kasar Xilanase
Aktivitas xilanase ditentukan dengan menghitung kadar xilosa atau gula tereduksi yang dihasilkan menggunakan metode 3,5-asam dinitrosalisilat (DNS) (Miller 1959). Xilosa yang terbentuk dihitung berdasarkan kurva standar xilosa. Satu unit (U) aktivitas xilanase didefinisikan sebagai sejumlah enzim yang dibutuhkan untuk melepaskan 1 µmol xilosa per menit.
Isolasi DNA Kromosom Bakteri
Satu isolat bakteri yang memiliki aktivitas xilanase tertinggi diisolasi DNA genomnya menggunakan wizard genomic DNA purification kit (Promega). Isolat bakteri diinokulasikan ke dalam 5 ml media Luria bertani (LB) cair dan diinkubasi selama 16 jam dengan kecepatan 200 rpm pada suhu 37oC. Kultur bakteri dituang kedalam tabung mikrosentrifuga 1.5 mL dan disentrifugasi dengan kecepatan 13.000 rpm selama 3 menit. Supernatan dibuang dan pelet sel diresuspensi dengan 600 µ L Nuclei Lysis Solution, kemudian diinkubasi pada suhu 80oC selama 5 menit. Campuran didinginkan pada suhu ruang, lalu ditambah 3 µ L RNase
16
Pelet sel yang diperoleh dibuang dan supernatan yang mengandung DNA genom dipindah ke dalam tabung mikrosentrifuga 1.5 mL baru yang berisi 600 µL isopropanol. Campuran dihomogenkan dengan membolak-balikan tabung dan disentrifugasi dengan kecepatan 10.000 rpm selama 2 menit. Supernatan dibuang dan pelet DNA ditambah dengan ethanol 70% untuk pencucian. Sentrifugasi dilakukan untuk mendapatkan DNA, dengan kecepatan 10.000 rpm selama 2 menit. DNA yang diperoleh dikeringkan pada suhu 40oC selama 10 menit, kemudian ditambah 25 µ L Nuclease Free Water (NFW) untuk mengelusi DNA dan diinkubasi pada suhu 65oC selama 1 jam. Konsentrasi DNA kromosom yang diperoleh dapat diukur menggunakan Nano Drop 2000.
Analisis Gen Pengkode 16S rRNA
DNA kromosom bakteri diamplifikasi gen pengkode 16S rRNAnya untuk menentukan jenisnya. Amplifikasi daerah 16S rRNA dilakukan dengan menggunakan ThermalCyclerPCR (Marchesi et al. 1998). Komposisi reaksi PCR (total volume reaksi 50 µ L): 1 µ L DNA kromosom bakteri (100 ng µ L-1) sebagai templat, 25 µL 2x GoTaq Green PCR mastermix (Promega), 1 µL (10 picomol)
primer 63F (5’-CAGGCCTAACACATGCAAGTC-3’), primer 1387R (5 -GGGCGGAA/TGTGTACAGGC-3’) dan 13 µL dH2O. Program PCR untuk
reaksi PCR adalah pra-denaturasi pada suhu 95oC selama 5 menit, siklus amplifikasi sebanyak 25 siklus yang terdiri dari suhu denaturasi 95oC selama 30 detik; penempelan 56oC selama 30 detik; pemanjangan 72oC selama 75 detik dan diakhiri pasca-PCR 72oC selama 5 menit. Produk PCR dimigrasikan pada 0.8% (b v-1) gel agarosa selama 60 menit pada 80 V. Visualisasi pita gel dilihat pada Gel Doc UV XR+ (BIORAD). Selanjutnya satu pita pada gel agarosa dilakukan tahapan purifikasi.
Purifikasi DNA dan Sekuensing
17 selama 10 menit untuk menghilangkan etanol. Sebanyak 25 µ L Nuclease Free Water (NFW) ditambahkan ke dalam kolom untuk mengelusi DNA dan diinkubasi pada suhu 50oC selama 5 menit. Kolom ditempatkan ke dalam tabung mikrosentrifuge steril. Sentrifugasi dilakukan pada kecepatan 12.000 rpm selama 1 menit. Cairan dalam tabung mikrosentrifuga merupakan DNA murni dan disimpan pada suhu -20oC.
Gen pengkode 16S rRNA dilakukan sekuensing menggunakan Applied Biosystems Hitachi 3130 Genetic Analyzer. Hasil sekuensing dianalisis menggunakan software Geneious dan dibandingkan dengan sekuen 16S rRNA pada GenBank dengan tool BLAST (Basic Local Alignmet Search Tools) menggunakan server online (www.ncbi.nlm.nih.gov.) untuk menentukan jenis bakteri.
Karakterisasi Enzim Kasar Xilanase
Penentuan pH optimum terhadap aktivitas xilanase diukur dengan menginkubasi enzim dalam berbagai bufer dengan rentang pH 4-11 yang mengandung substrat 1% birchwood xylan selama 10 menit pada suhu 50oC. Berbagai larutan bufer pH yang digunakan adalah Na-Asetat pH 4, 5, 6; Na-Fosfat pH 6, 7, 8; Tris-HCl pH 8, 9; glisin-NaOH pH 9, 10; KCl-NaOH 10, 11; dengan konsentrasi 100 mM. Stabilitas enzim pada berbagai pH diuji dengan menginkubasi enzim pada berbagai pH 4-11 selama 30 dan 60 menit pada 4oC. Suhu optimum aktivitas xilanase ditentukan dengan prosedur pH optimum aktivitas xilanase sebelumnya selama 10 menit pada pH optimumnya dengan rentang suhu 25-70oC. Termostabilitas enzim diuji dengan menginkubasi enzim pada rentang suhu 25-70oC selama 30 dan 60 menit. Pada stabilitas pH dan suhu, enzim direaksikan dengan substrat birchwood xylan dalam bufer Na-fosfat pada kondisi optimum. Aktivitas enzim sisa (residual enzyme activities) dihitung dengan membandingkan aktivitas masing-masing perlakuan dengan aktivitas maksimal xilanase yang diukur .
Pengaruh ion logam Cu2+, Fe2+, Ca2+, Mg2+, Mn2+, Zn2+, Na2+, EDTA (konsentrasi 1 dan 10 mM) pada aktivitas enzim xilanase diuji setelah pra-inkubasi enzim dalam berbagai macam ion logam selama 30 menit dan pada pH optimumnya dengan konsentrasi akhir 100 mM. Aktivitas relatif enzim dihitung dengan membandingkan aktivitas perlakuan dan tanpa adanya tambahan ion logam.
Spesifisitas substrat pada aktivitas xilanase diuji menggunakan berbagai substrat antara lain beecwood xylan (Sigma), carboxymethyl cellulose (CMC: Fluka), palm kernel meal (PKM) dan Locus Bean Gum (LBG: Sigma). Aktivitas enzim ditentukan dengan mengukur gula tereduksi dari masing-masing substrat. Spesifik substrat ditunjukkan sebagai persentase relatif yang dibandingkan dengan
birchwood xylan.
Isolasi Gen xynA Pengkode Endo-β-xilanase
DNA genom bakteri terpilih digunakan sebagai cetakan untuk amplifikasi gen xynA pengkode endo-β-xilanase menggunakan sepasang primer
18
Biolabs/NEB), 5 µL bufer High Fidelity (1x) (NEB), 5 µ L dNTP mix (1x), 10 picomol primer dan dH2O sampai volume total 25 µL. PCR dilakukan pada suhu
pra-denaturasi 98oC 30 detik, diikuti dengan 30 siklus; denaturasi 98oC 10 detik, penempelan 51oC 1 menit, pemanjangan 72oC selama 1 menit dan diakhiri dengan pasca-PCR 72oC selama 5 menit. Hasil PCR dimigrasikan pada gel agarosa 1% selama 60 menit 100 V. Pita gen yang diinginkan dipotong dan dimurnikan menggunakan QIAquick Extraction Purification Kit (Qiagen). Hasil pemurnian gen xynA disekuensing menggunakan Applied Biosystem ABI Prism 3130 Genetic Analyzer. Geneious software digunakan untuk analisis data hasil sekuensing. Sekuen DNA hasil sekuensing dianalisis kemiripannya dengan sekuen gen
endo-β-xilanase pada GenBank dengan tool BLASTp (untuk protein).
Kloning Gen xynA Pengkode Endo-β-xilanase
Gen xynA yang telah diisolasi, diligasikan pada vektor kloning pGEM-T
Easy (Promega) menggunakan enzim T4 ligase (NEB). Reaksi ligasi yang digunakan adalah 35 ng insert/fragmen hasil PCR (xynA), 25 ng vektor pGEM-T
Easy, bufer T4 ligase 1x (NEB), dan 400 U enzim T4 DNA ligase, dan dH2O
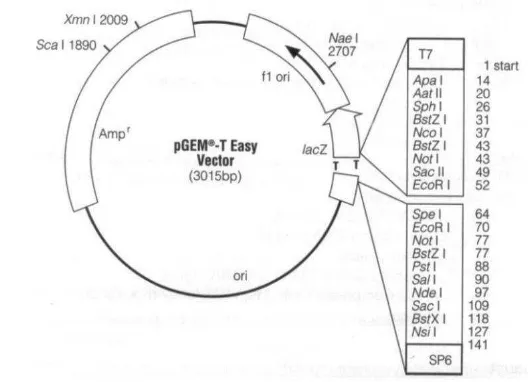
sampai volume total 10 µL, lalu diinkubasi pada suhu 16oC selama 16 jam. Peta plasmid pGEM-T Easy disajikan pada Gambar 5.
Gambar 5 Peta plasmid vektor kloning pGEM-T Easy
Transformasi Plasmid Rekombinan ke E. coli DH5α
Sebelum dilakukan transformasi, E.coli DH5α harus dipersiapkan menjadi
kompeten sel agar mempunyai efisiensi yang tinggi dalam menerima DNA dari luar pada proses transformasi. Kultur E. coli DH5α dari stok digores pada media LB agar, dan diinkubasi ±16 jam pada suhu 37oC. Koloni tunggal E. coli DH5α
dari cawan diinokulasi ke dalam 10 ml media LB cair lalu diinkubasi pada
incubator shaker dengan kecepatan 200 rpm pada suhu 37oC selama 16 jam sebagai starter. Sebanyak 2% kultur starter diinokulasi kedalam 100 mL media LB cair lalu diinkubasi pada 200 rpm dengan suhu 37oC sampai nilai OD600 nm=
19 kemudian pelet yang mengandung sel diresuspensi dengan 1 mL CaCl2 solution
(20 mM CaCl2; 80 mM MgCl2). Sentrifugasi dilakukan dengan kecepatan 2500 x
g selama 1 menit suhu 4oC kemudian supernatan dibuang. Pelet yang diperoleh ditambah dengan 100 µL 0.1 M CaCl2 dan 40 µL gliserol 50%. Keseluruhan
proses pembuatan sel kompeten dilakukan dalam keadaan dingin (on ice).
Hasil ligasi ditransformasikan ke dalam sel kompeten E. coli DH5α dengan
metode dengan metode heat-shock atau kejut panas (Sambrook dan Russell 2001).
Sebanyak 10 L hasil ligasi dimasukkan ke kompeten sel tersebut, resuspensi dengan tangan sampai tercampur sempurna, diinkubasi dalam es selama 30 menit. Kemudian segera diinkubasi dalam waterbath pada suhu 42oC selama 1 menit dan diinkubasi kembali dalam es selama 2 menit. Setelah itu ditambahkan medium LB
sebanyak 800 L dan diinkubasi dalam shaker inkubator 200 rpm, 37oC selama satu jam. Setelah itu, sel disentrifugasi 2500 rpm selama 10 menit, sebanyak 800
L supernatan dibuang, dan sisanya diresuspen kembali dengan pelet dan ditumbuhkan pada media LB agar yang mengandung ampisilin (konsentrasi akhir 100 µg mL-1) 0.1 mM isopropil-β-D-tiogalaktopiranosida (IPTG), 80 µg mL-1 5-bromo-kloro-3-indolil-β-D-galaktopiranosida (X-Gal) yang diinkubasi semalam pada suhu 37oC. Setelah itu dilakukan seleksi koloni putih-biru. Koloni putih diverifikasi dengan PCR koloni menggunakan primer FM13 (5’-CGCCAGGGTT TTCCCAGTCACGAC-3’) dan RM13 (5’
-TCACACAGGAAACAGCTATGAC-3’). Hasil PCR dimigrasikan ke dalam 1% gel agarosa pada tegangan 100 V selama 60 menit. Koloni yang diduga positif (koloni putih) lalu di ambil dan dikultur dalam media LB-ampisilin cair untuk melakukan isolasi plasmid.
Isolasi Plasmid Rekombinan
20
Konstruksi Vektor Ekspresi pET-15by dan Ekspresi Gen xynA
Plasmid pET-15by (Novagen) digunakan sebagai vektor ekspresi gen xynA
pada E. coli BL21 (DE3) pLysS. Peta vektor ekspresi pET-15by disajikan pada Gambar 6.
Gambar 6 Peta plasmid vektor ekspresi pET-15by
Primer gen xynA didesain dengan menambahkan situs restriksi
(F_ATG-SacIμ 5’-ATTGAGCTCATGAATTTGAGAAGATTGAGGC-3’ dan R3End-NotI:
5’-ATTGCGGCCGCTTAGTTGCCAATAAACAGCT-3’). Gen xynA yang terligasi pada plasmid pGEM-T Easy dipotong menggunakan enzim restriksi SacI dan NotI (NEB). Fragmen yang diperoleh dimurnikan dan diligasi ke dalam vektor pET-15by yang mengandung hexahistidine tagged dengan enzim T4 ligase, lalu diinkubasi pada suhu 16oC selama 16 jam. Hasil ligasi ditransformasikan ke dalam sel kompeten E. coli BL21 (DE3) pLysS. E. coli transforman disebar pada media LB agar yang mengandung ampisilin 100 µg mL-1, kloramfenikol 35 µg mL-1, 0.1 mM IPTG dan diinkubasi semalaman pada suhu 37oC. Verifikasi transforman dilakukan dengan PCR koloni menggunakan primer T7. Koloni transforman positif ditumbuhkan pada media LB cair (ampisilin dan kloramfenikol) untuk mengisolasi plasmid. Plasmid hasil isolasi disekuensing menggunakan primer T7.
Satu klon E. coli BL21 (DE3) pLysS rekombinan open reading frame
(ORF) pET-15by-xynA telah berhasil diperoleh. Koloni tunggal E. coli
21 pada suhu 37oC, lalu diinduksi 0.5 mM IPTG setelah sel mengalami fase eksponensial pada OD600: 0.5. Setelah diinduksi, kultur diinkubasi selama 16 jam
pada suhu 30oC dan digoyang dengan kecepatan 200 rpm. Kultur bakteri dipanen dengan sentrifugasi dingin selama 15 menit. Pelet sel dipecah menggunakan sonikator dengan menambahkan 5 mL (10% volume produksi) 100 mM bufer Na-fosfat pH 7 pada pelet dan diresuspensi. Suspensi sel disonikasi selama 2x5 menit dan disentrifus dengan 13.000 rpm pada suhu 4oC selama 15 menit. Supernatan yang mengandung enzim endo-β-xilanase diukur aktivitas enzimnya.
AnalisisBobot Molekul Protein dengan SDS-PAGE
Sampel xilanase kasar (B. pumilus BCRS-01) dan rekombinan (E. coli) dipisahkan berdasarkan bobot molekul protein menggunakan metode sodium dodesil sulfat-poliakrilamida gel elektroforesis (SDS-PAGE) (Laemmli 1970). Elektroforesis gel poliakrilamida yang dikombinasikan dengan suatu deterjen sodium dodesil sulfat (SDS) digunakan untuk memisahkan dan menentukan jumlah dan ukuran (berat molekul) rantai subunit protein.
Tabel 1 Komposisi gel SDS-PAGE
Elektroforesis SDS-PAGE dilakukan dengan menambahkan 24 µL sampel protein ke dalam 6 µL bufer sampel dengan perbandingan 4:1 (v v-1) dan 0.5 µL
marker protein (low range BIORAD) ke dalam 6 µL bufer sampel, lalu dipanaskan pada suhu 100ºC selama 10 menit untuk denaturasi protein. Kemudian didinginkan pada suhu ruang. Sampel dimasukkan ke dalam sumur gel dengan volume 30 µL, sedangkan volume marker protein yang digunakan sebanyak 6 µL. Elektroforesis dilakukan pada tegangan 15 mA selama ± 2 jam dalam 1x bufer elektroforesis. Kemudian gel diwarnai menggunakan larutan pewarna (Coomassie Brilliant Blue CBB R-250) selama 30 menit. Pelunturan warna (destaining) pada gel dilakukan dengan larutan peluntur secara berulang kali sampai diperoleh pita protein berwarna biru dengan latar gel bening.
22
4
HASIL DAN PEMBAHASAN
Skrining Bakteri Penghasil Xilanase dan Aktivitas Xilanase
Hasil skrining yang dilakukan terhadap 29 isolat bakteri cairan rumen sapi pada media birchwood xylan Agar menunjukkan bahwa 20 isolat bakteri menghasilkan zona bening disekitar koloni, sedangkan 9 isolat bakteri lainnya tidak membentuk zona bening. Bakteri penghasil xilanase menghasilkan zona bening di sekitar koloni (Gambar 7). Zona bening merupakan hasil dari hidrolisis xilan dalam media padat oleh xilanase ekstraseluler.
Gambar 7 Zona bening di sekitar koloni bakteri penghasil xilanase pada media padat selektif
Berdasarkan hasil uji aktivitas, diperoleh sebanyak 7 isolat bakteri memiliki aktivitas xilanase yang tinggi sedangkan 13 isolat bakteri lainnya memiliki aktivitas xilanase yang rendah. Aktivitas xilanase 7 isolat bakteri BCRS 01, 04, 12, 16, 18, 20 dan 28 yaitu 140, 33.1, 47.9, 29.2, 38.9, 29.4, dan 30.6 U mL-1 pada suhu 50oC selama 10 menit menggunakan substrat 1% birchwood xylan dalam bufer 100 mM Na-fosfat pH 7.0. Isolat bakteri BCRS-01 memiliki aktivitas tertinggi yang dipilih untuk didentifikasi secara molekuler, selanjutnya dikarakterisasi xilanase yang dihasilkannya.
Identifikasi dan Filogenetik Isolat BCRS-01
23
Gambar 8 Amplikon gen pengkode 16S rRNA pada 0.8% gel agarosa; (M)
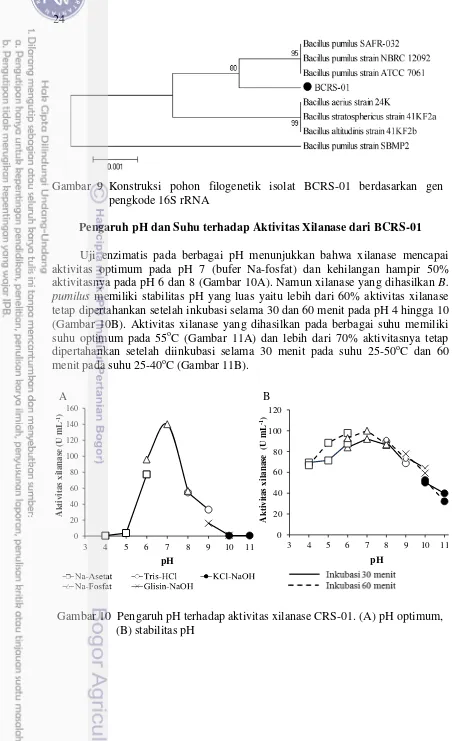
Marker 1 Kb, (1) BCRS-01, (2) kontrol negatif, (3) kontrol positif Pada tabel 2, pencarian kemiripan sekuen gen pengkode 16S rRNA hasil BLAST dari data GenBank menunjukkan bahwa isolat BCRS-01 memiliki kemiripan 99% dengan Bacillus pumilus. Dari data tersebut kemudian dibuat pohon filogenetik untuk menggambarkan hubungan kekerabatan.
Tabel 2 Hasil BLAST isolat BCRS-01 berdasarkan gen pengkode 16S rRNA Nomer NR074977.1 Bacillus pumilus strain SAFR-032 16S
ribosomal RNA gene, complete sequence
0.0 99
NR112637.1 Bacillus pumilus strain NBRC 12092 16S ribosomal RNA gene, partial sequence
0.0 99
NR043242.1 Bacillus pumilus strain ATCC 7061 16S ribosomal RNA gene, partial sequence
0.0 99
NR118439.1 Bacillus aerius strain 24K 16S ribosomal RNA gene, partial sequence
0.0 99
NR042336.1 Bacillus stratosphericus strain 41KF2a 16S ribosomal RNA gene, partial sequence
0.0 99
NR042337.1 Bacillus altitudinis strain 41KF2b 16S ribosomal RNA gene, partial sequence
0.0 99
NR118381.1 Bacillus pumilus strain SBMP2 16S ribosomal RNA gene, partial sequence
0.0 99
Hasil analisis pohon filogenetik menunjukkan bahwa isolat BCRS-01 memiliki kekerabatan yang dekat dengan B. pumilus strain NBRC 12092 (NR1126371), ATCC 7061 (NR043242) danSAFR-032 (NR074977) dengan nilai bootstrap sebesar 95%. Nilai tersebut memperlihatkan tingginya tingkat kepercayaan terhadap cabang yang terbentuk. Skala 0.001 menunjukkan jarak evolusi pada panjang cabang dan angka pada cabang menunjukkan nilai bootstrap
(Gambar 9).
2000
1000 pb
24
Gambar 9 Konstruksi pohon filogenetik isolat BCRS-01 berdasarkan gen pengkode 16S rRNA
Pengaruh pH dan Suhu terhadap Aktivitas Xilanase dari BCRS-01
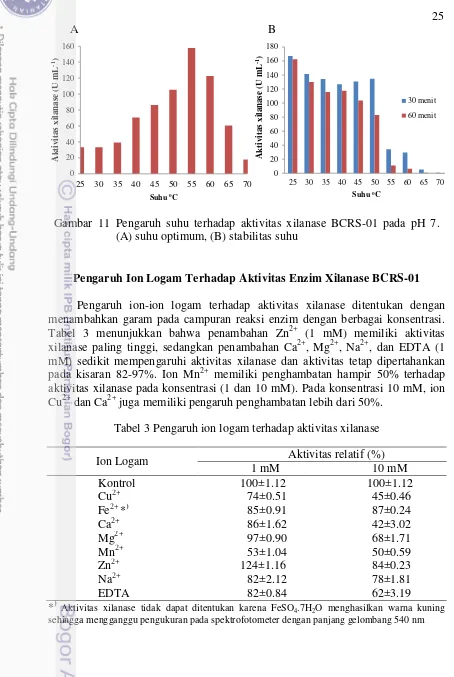
Uji enzimatis pada berbagai pH menunjukkan bahwa xilanase mencapai aktivitas optimum pada pH 7 (bufer Na-fosfat) dan kehilangan hampir 50% aktivitasnya pada pH 6 dan 8 (Gambar 10A). Namun xilanase yang dihasilkan B. pumilus memiliki stabilitas pH yang luas yaitu lebih dari 60% aktivitas xilanase tetap dipertahankan setelah inkubasi selama 30 dan 60 menit pada pH 4 hingga 10 (Gambar 10B). Aktivitas xilanase yang dihasilkan pada berbagai suhu memiliki suhu optimum pada 55oC (Gambar 11A) dan lebih dari 70% aktivitasnya tetap dipertahankan setelah diinkubasi selama 30 menit pada suhu 25-50oC dan 60 menit pada suhu 25-40oC (Gambar11B).
25
Pengaruh Ion Logam Terhadap Aktivitas Enzim Xilanase BCRS-01
Pengaruh ion-ion logam terhadap aktivitas xilanase ditentukan dengan menambahkan garam pada campuran reaksi enzim dengan berbagai konsentrasi. Tabel 3 menunjukkan bahwa penambahan Zn2+ (1 mM) memiliki aktivitas xilanase paling tinggi, sedangkan penambahan Ca2+, Mg2+, Na2+, dan EDTA (1 mM) sedikit mempengaruhi aktivitas xilanase dan aktivitas tetap dipertahankan pada kisaran 82-97%. Ion Mn2+ memiliki penghambatan hampir 50% terhadap aktivitas xilanase pada konsentrasi (1 dan 10 mM). Pada konsentrasi 10 mM, ion Cu2+ dan Ca2+ juga memiliki pengaruh penghambatan lebih dari 50%.
Tabel 3 Pengaruh ion logam terhadap aktivitas xilanase
Ion Logam Aktivitas relatif (%) sehingga mengganggu pengukuran pada spektrofotometer dengan panjang gelombang 540 nm
26
Spesifisitas Substrat dan Kinetika Enzim Xilanase
Aktivitas xilanase dari B. pumilus BCRS-01 memiliki spesifisitas enzim terhadap beechwood xylan sedikit lebih rendah dibandingkan birchwood xylan
(aktivitas relatif 86%). Xilanase B. pumilus BCRS-01 tidak mampu memecah substrat LBG dan CMC (tidak memiliki aktivitas), sedangkan pada PKM memiliki aktivitas xilanase yang kecil (aktivitas relatif 2%). Selain itu, xilanase ini tidak memiliki aktivitas selulase sehingga merupakan kandidat baik untuk proses pemutihan bubur kertas (pulp biobleaching process).
Tabel 4 Uji aktivitas enzim kasar xilanase terhadap berbagai substrat pada pH 7 suhu 55oC
Substrat 1% (b v-1) Aktivitas relatif (%)
Birchwood xylan 100±0.12
Beechwood xylan 85±1.27
Locus Bean Gum (LBG) 0
Palm Kernel Meal (PKM) 2±1.55
Carboxymethyl Cellulose (CMC) 0
Amplikon Gen xynA Pengkode Endo-β-xilanase dari BCRS-01
Hasil amplifikasi PCR gen xynA dari DNA kromosom isolat BCRS-01 dengan primer F_ATG-xynA dan R_3End-xynA menghasilkan produk berukuran ±700 pb (Gambar 12).
Gambar 12 Amplikon gen xynA pada 1% gel agarosa menggunakan PCR; (M) Marker 100 pb, (1) sampel DNA kromosom isolat BCRS-01, (2) kontrol negatif
Gen ini diprediksi akan menghasilkan protein rekombinan dengan berat molekul 25.47 kDa serta memiliki titik isoelektrik (pI) 9 menggunakan software
ExPASy (Gambar 13).
1000
500
27
Gambar 13 Estimasi bobot molekul (MW) dan titik isoelektrik (pI) protein rekombinan XynA menggunakan software ExPASy
Perbandingan Sekuen Asam Amino XynA BCRS-01, ARA dan ATCC 7061
Gen xynA yang diperoleh dari BCRS-01 memiliki ukuran 687 pb yang mengkodekan residu 228 asam amino. Untuk menganalisis homologi sekuen dan melihat perbedaan antara asam amino dengan strain B. pumilus lainnya, dilakukan penyejajaran menggunakan ClustalW. Hasil alignment seperti yang terlihat dalam Gambar 14.
Gambar 14 Perbandingan sekuen asam amino XynA dari B. pumilus strain ARA (ADK27486) dan ATCC 7061 (EDW20924); asam amino yang
conserved ditunjukkan dengan tanda bintang