KARAKTERISASI ENZIM DAN KLONING GEN PENYANDI
MANANASE DARI Bacillus subtilis ASAL TEMPE
EVAN GUSTIN OETOMO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesisKarakterisasi Enzim dan Kloning Gen Penyandi Mananase dari Bacillus subtilis Asal Tempe adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juli 2012
ABSTRACT
EVAN GUSTIN OETOMO. Enzyme Characterization and Cloning of Mannanase Gene from Bacillus subtilis Isolated from Tempe. Under direction of ANTONIUS SUWANTO and MAGGY THENAWIDJAJA SUHARTONO.
Nutrition value and characteristics of tempe are primarily derived from enzymatic activities derived from complex microorganisms community during its fermentation. As a rich source of bacterial diversity, tempe could be explored for its potential to yield enzyme, such as mannanase. This study was intended to isolate mannanase producing bacteria derived from a number of tempe samples from Java (Bogor, Surabaya, Malang, Kediri, Lamongan, and Wonogiri); characterize its enzyme; and clone its mannanase gene into E. coli. Crude enzyme from each isolate was prepared for characterization. Showed the highest specific activity (0,41 U/mg protein), isolate N mannanase was further characterized. N-mannanase crude enzyme showed optimum activity at 60oC and pH 5.0. This enzyme has better activity in palm kernel meal (PKM) as its substrate with average activity 1.13 U/ml compared to soybean meal (SBM) (0.43 U/ml) and copra meal (CM) (0.48 U/ml). This enzyme was also stable at 60oC for 4 hours, in wide range of pH (4-10) for 1 hour, and various metal ions. SDS-PAGE and Zymogram analysis showed that this mannanase has molecular weight approximately 39.8 kilodalton. Isolate N was identified having 98% similarity with Bacillus subtilis (Genebank access JN644507) employing 16S rRNA sequence analysis. The B. subtilis N-mannanase gene was successfully isolated and cloned into E.coli. Recombinant’s mannanase activity was detected in E. coli intra- (8.82 U/ml) and extracellular (6.39 U/ml) extracts.
RINGKASAN
EVAN GUSTIN OETOMO. Karakterisasi Enzim dan Kloning Gen Penyandi Mananase dari Bacillus subtilis Asal Tempe. Dibimbing oleh ANTONIUS SUWANTO dan MAGGY THENAWIDJAJA SUHARTONO.
Tempe merupakan makanan tradisional hasil fementasi yang sangat populer di Indonesia dan kaya akan nutrisi serta komponen-komponen aktif lainnya yang bermanfaat bagi kesehatan. Beberapa penelitian mengenai manfaat konsumsi tempe bagi kesehatan tubuh manusia telah dilaporkan. Dalam review tentang tempe oleh Babu et al. (2009) dan Agranoff (2001) disebutkan bahwa tempe dapat mencegah anemia, diare, mengandung vitamin B12, senyawa antioksidan, mengurangi resiko penyakit jantung, osteoporosis, dan kanker. Keberadaan semua senyawa-senyawa aktif tersebut pada tempe tidak terlepas dari kegiatan enzim yang dihasilkan oleh komunitas mikroorganisme yang berperan dalam fermentasi.
Pada pembuatan tempe, komunitas mikroorganisme yang berperan sangat banyak. Disebutkan dalam Agranoff (2001) bahwa ada sekitar 45 galur Rhizopus, 200 spesies bakteri, dan 20 spesies yeast yang pernah diisolasi dari berbagai sampel tempe yang ada di Jawa, Sumatra, dan Bali. Berbagai spesies mikroorganisme tersebut saling bekerja sama dalam menghasilkan produk tempe yang berkualitas. Dari sekian banyak bakteri yang berperan dalam pembuatan tempe belum pernah dilaporkan tentang adanya bakteri penghasil mananase pada sampel tempe. Penelitian ini bertujuan untuk melakukan isolasi bakteri penghasil mananase dari contoh tempe yang ada di Pulau Jawa; mengkarakterisasi enzim mananasenya; dan mengkloning gen penyandi mananase ke dalam E. coli.
Secara garis besar penelitian ini diawali dengan melakukan screening bakteri penghasil mananase dari beberapa contoh tempe di Pulau Jawa. Satu isolat dengan aktivitas spesifik mananase tertinggi dipilih untuk dikarakterisasi lebih lanjut. Isolat ini diberi kode sebagai isolat N. Enzim mananase isolat N ini kemudian diproduksi dan dikarakterisasi lebih lanjut. Karakterisasi yang dilakukan meliputi profil pH, suhu, spesifitas substrat, ketahanan terhadap berbagai ion logam, suhu, dan pH, serta profil protein menggunakan SDS PAGE dan zymogram. Setelah itu, isolat N ini diidentifikasi berdasarkan sekuen 16S rRNAnya. Gen mananase dari isolat N ini kemudian diisolasi dan dilakukan kloning menggunakan pGEMT-easy ke dalam E. coli TOP10.
yang cukup luas; stabil terhadap berbagai ion logam; dan memiliki berat molekul protein sebesar 39,8 kDa. Gen mananase dari B. subtilis N ini telah berhasil diisolasi dan dikloning ke dalam E. coli (SEGO1). Aktivitas mananase dari SEGO1 terdapat pada cairan ekstra- (6,39 U/ml) maupun intraselulernya (8,82 U/ml).
© Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
KARAKTERISASI ENZIM DAN KLONING GEN PENYANDI
MANANASE DARI Bacillus subtilis ASAL TEMPE
EVAN GUSTIN OETOMO
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
For my parents, sister, and grandparents
for your unconditional love and sincerity…
For my colleagues in Biotechnology class 2010
and BIA St. Vincentius
Judul Tesis : Karakterisasi Enzim dan Kloning Gen Penyandi Mananase dari Bacillus subtilis Asal Tempe
Nama : Evan Gustin Oetomo
NIM : P051100021
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. Antonius Suwanto, M.Sc. Prof. Dr. Ir. Maggy T. Suhartono Ketua Anggota
Diketahui
Ketua Program Studi Bioteknologi Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Suharsono, DEA Dr. Ir. Dahrul Syah, M.Sc.Agr.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas karunia-Nya sehingga tesis berjudul Karakterisasi Enzim dan Kloning Gen Penyandi Mananase dari Bacillus subtilis Asal Tempe ini telah dapat diselesaikan dengan baik. Karya ilmiah ini disusun dalam rangka penelitian akhir sebagai syarat untuk memperoleh gelar Magister Sains di Program Studi Bioteknologi, Sekolah Pascasarjana, Institut Pertanian Bogor.
Terima kasih dan penghargaan setinggi-tingginya penulis sampaikan kepada Prof. Dr. Ir. Antonius Suwanto, M.Sc. dan Prof. Dr. Ir. Maggy Thenawidjaja Suhartono selaku pembimbing yang telah memberikan arahan dan bimbingan sehingga penulis dapat menyusun karya ilmiah ini dengan sebaik-baiknya. Ucapan terima kasih yang sebesar-besarnya juga penulis sampaikan kepada R&D PT. Wilmar Benih Indonesia, Cikarang yang telah memberikan kesempatan kepada penulis untuk melakukan penelitian bersama mereka.
Tiada gading yang tak retak, demikian pula halnya karya tulis ini tidaklah sempurna. Masih banyak hal yang dapat digali dan dikembangkan dari sebuah topik penelitian sederhana ini. Oleh karena itu, penulis mengharapkan adanya masukan dan kritik yang membangun demi peningkatan kualitas penelitian ini. Semoga penelitian ini bermanfaat.
Bogor, Juli 2012
RIWAYAT HIDUP
Penulis dilahirkan di Surakarta pada tanggal 19 Januari 1987 dari pasangan Herryanto Oetomo dan Sri Utami. Penulis merupakan anak pertama dari dua bersaudara.
DAFTAR ISI
3.2.1. Screening Bakteri Penghasil Mananase ... 14
3.2.2. Persiapan soybean meal (SBM), palm kernel meal (PKM), dan copra meal (CM) ... 15
3.2.3. Pengaruh Suhu Terhadap Aktivitas Mananase Ekstraseluler ... 15
3.2.4. Pengukuran Kadar Protein ... 16
3.2.5. Karakterisasi enzim mananase ... 16
3.2.5.1. Penentuan pH optimum Bufer ... 16
3.2.5.2. Spesifisitas Substrat ... 17
3.2.5.3. Pengujian Pengaruh Ion Logam ... 17
3.2.5.4. Pengujian Kestabilan Enzim terhadap Suhu... 17
3.2.5.5. Pengujian Kestabilan Enzim terhadap pH ... 17
3.2.5.6. Analisis Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis (SDS PAGE) dan Zymogram ... 18
3.2.6. Ekstraksi Genom Bakteri ... 19
3.2.7. Analisis Sekuen rRNA 16S ... 20
3.2.8. Isolasi Gen Mananase ... 21
3.2.9. Ligasi ke Dalam pGEMT-easy ... 21
3.2.10. Transformasi ... 21
3.2.11. Pengujian Aktivitas Mananase Intraseluler... 22
IV HASIL DAN PEMBAHASAN ... 23
4.1. Screening Bakteri Penghasil Mananase ... 23
4.2. Pengujian Pengaruh Suhu Terhadap Aktivitas Mananase ... 24
4.3. Penentuan pH Optimum Bufer Mananase Isolat N ... 25
4.4. Spesifisitas Substrat ... 26
4.5. Pengaruh Ion Logam terhadap Aktivitas Mananase Isolat N ... 26
4.7. Kestabilan Mananase Isolat N pada Berbagai pH ... 28
4.8. Identifikasi Bakteri Berdasarkan 16S rRNA ... 29
4.9. Kloning Gen Mananase B. subtilis N ... 29
4.10. Perbandingan Aktivitas Mananase B. subtilis N dengan SEGO1 .. 31
4.11. SDS PAGE dan Zymogram ... 31
V KESIMPULAN DAN SARAN ... 33
5.1 Kesimpulan ... 33
5.2 Saran ... 33
DAFTAR PUSTAKA ... 34
DAFTAR TABEL
Halaman
1. Komposisi gel pemisah dan penahan untuk sepasang gel elektroforesis protein ... 18 2. Komposisi gel pemisah dan penahan untuk sepasang gel zymogram .... 19 3. Indeks mananolitik isolat A, D, E, dan N ... 23 4. Perbandingan aktivitas unit mananase B. subtilis N dengan SEGO1
DAFTAR GAMBAR
Halaman
1. Diagram alir pembuatan tempe ... 7
2. Struktur manan ... 9
3. Cara kerja enzim β-mananase Thermonospora fusca dalam menghidrolisis substrat manan ... 11
4. Kenampakan zona bening yang dihasilkan oleh isolat A, D, E, dan N ketika ditumbuhkan pada media agar mengandung LBG 0,3% (24 jam, 37oC) ... 23
5. Aktivitas spesifik mananase ekstraseluler isolat N ... 25
6. Isolat N sebelum dan setelah diwarnai dengan congo red 0,1% ... 25
7. Aktivitas mananase isolat N pada berbagai pH bufer ... 26
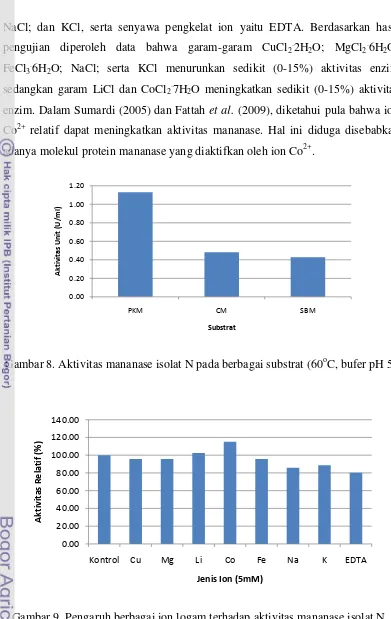
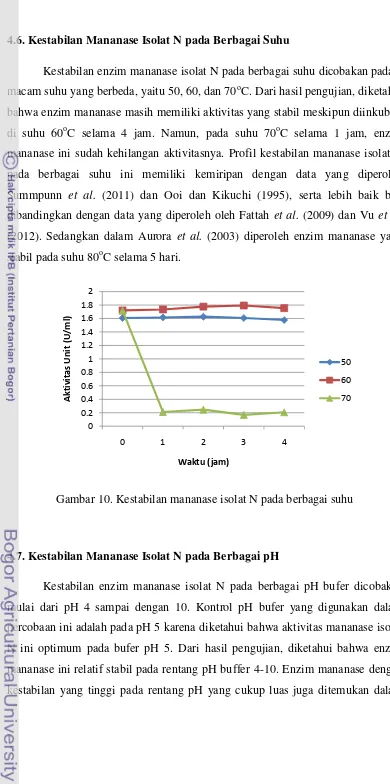
8. Aktivitas mananase isolat N pada berbagai substrat (60oC, buffer pH 5) 27 9. Pengaruh berbagai ion logam terhadap aktivitas mananase isolat N ... 27
10.Kestabilan mananase isolat N pada berbagai suhu ... 28
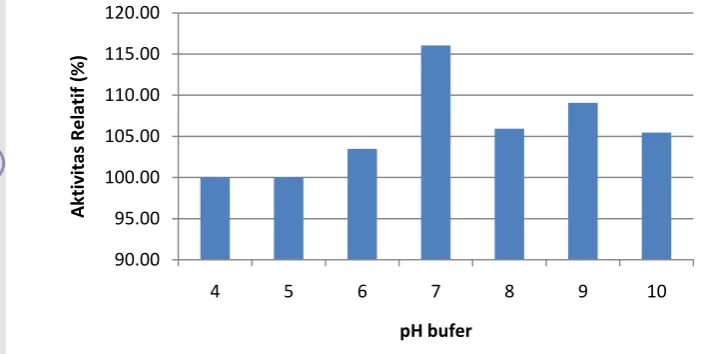
11.Stabilitas mananase isolat N pada berbagai rentang pH ... 29
12.Hasil elektroforesis produk PCR gen mananase menggunakan primer Man-CHF dan Man-CHR ... 30
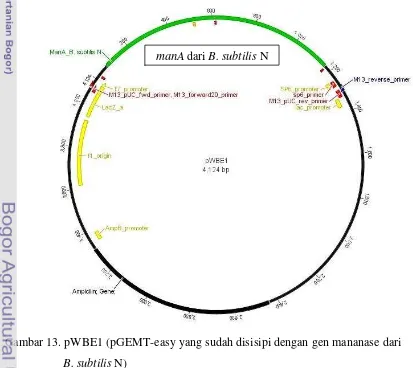
13.pWBE1 (pGEMT-easy yang sudah disisipi dengan gen mananase dari B. subtilis N) ... 30
DAFTAR LAMPIRAN
Halaman
BAB I
PENDAHULUAN
1.1. Latar Belakang
Tempe merupakan makanan tradisional hasil fementasi yang sangat populer di Indonesia dan kaya akan nutrisi serta komponen-komponen aktif lainnya yang bermanfaat bagi kesehatan. Akhir-akhir ini konsumsi tempe terus meningkat tidak hanya di Indonesia tapi juga di Amerika dan Eropa. Bahkan saat ini beberapa negara sudah memproduksi sendiri tempe untuk tujuan konsumsi (Babu et al. 2009).
Beberapa penelitian mengenai manfaat konsumsi tempe bagi kesehatan tubuh manusia telah dilaporkan. Dalam review tentang tempe oleh Babu et al. (2009) dan Agranoff (2001) disebutkan bahwa tempe dapat mencegah anemia, diare, mengandung vitamin B12, senyawa antioksidan, mengurangi resiko penyakit jantung, osteoporosis, dan kanker. Senyawa aktif di dalam tempe dan bermanfaat bagi kesehatan yang paling banyak diteliti saat ini adalah dari golongan isoflavonoid dan fenol (Shi et al. 2002; Shetty et al. 2007). Keberadaan semua senyawa-senyawa aktif tersebut pada tempe tidak terlepas dari kegiatan enzim yang dihasilkan oleh komunitas mikroorganisme yang berperan dalam fermentasi.
Peran mikroorganisme dalam menghasilkan berbagai enzim yang bermanfaat dalam kehidupan manusia telah dikenal cukup luas dan pengembangannya terus berlangsung hingga saat ini. Penggalian potensi mikroorganisme yang mampu menghasilkan enzim yang bermanfaat dalam kehidupan manusia (enzyme bioprospecting) merupakan salah satu kegiatan yang penting dalam penelitian di bidang mikroorganisme dan enzim. Salah satu penelitian yang menarik untuk dikembangkan saat ini adalah bioprospecting mikroorganisme yang menghasilkan enzim mananase.
utama β-1,4-manan, galaktomanan, glukomanan, dan galaktoglukomanan. Struktur utama manan ini terbentuk melalui polimerisasi manosa dengan ikatan β -1,4; polimerisasi manosa dengan glukosa membentuk glukomanan; dan dapat pula
tersubstitusi dengan gugus samping galaktosil melalui ikatan α-1,6 membentuk
struktur galaktomanan. Manan sendiri dapat ditemukan pada biji dan dinding sel berbagai tanaman, termasuk tanaman kacang-kacangan. Dalam penelitian oleh Hsiao et al. (2006) dilaporkan mengenai kandungan β-manan yang berupa galaktomanan dalam pakan ternak yang berasal dari kedelai. Penggunaan enzim mananase bersama dengan dua jenis enzim yang lain dilaporkan dapat memecah galaktomanan secara sempurna menghasilkan manosa dan galaktosa (Fattah et al. 2009). Mananase juga cukup menarik perhatian karena fungsi dan aplikasinya pada berbagai industri, termasuk teknologi pangan, seperti pemrosesan biji kopi, alga laut, dan bahan nabati lainnya. Enzim ini dapat digunakan untuk menghidrolisis manan yang memiliki berat molekul tinggi dan pada industri pakan, mananase dapat digunakan untuk meningkatkan kecernaan dari pakan ternak. Mananase juga dapat diaplikasikan pada bidang lain seperti industri tekstil dan pulp biobleaching (Rattanasuk & Cairns 2009).
al. 2006). β-manan diketahui dapat menstimulasi sistem ketahanan tubuh unggas sehingga mengakibatkan pemborosan energi dalam tubuhnya (Dale et al. 2008). Dalam Wu et al. (2005), disebutkan bahwa β-manan juga secara signifikan mengurangi pertumbuhan serta meningkatkan ratio pakan : daging pada ternak. Pemanfaatan enzim β-mananase telah dilaporkan dapat memperbaiki berbagai kekurangan tersebut serta meningkatkan ketersediaan energi dan protein bagi pertumbuhan unggas.
Selain SBM, palm kernel meal (PKM) dan copra meal (CM) juga telah dimanfaatkan secara luas sebagai pakan ternak. PKM dan CM merupakan limbah dari proses ekstraksi minyak inti kelapa sawit dan kelapa. Diketahui melalui beberapa penelitian bahwa kandungan manan dalam PKM adalah sekitar 20-40% (Yopi et al. 2006), sedangkan pada CM sekitar 25-30% (Sundu & Dingle 2003). Pemanfaatan enzim mananase pada PKM dan CM juga diharapkan dapat memberikan efek yang menguntungkan bagi pertumbuhan ternak, seperti halnya pada SBM.
Beberapa penelitian yang telah dilakukan menyebutkan bahwa enzim mananase dapat dihasilkan oleh khamir, kapang dari golongan Trichoderma dan Aspergillus (Fattah et al. 2009), serta bakteri terutama dari golongan Bacillus (Phothichitto et al. 2006; Mabrouk & Ahwany 2008; Xu et al. 2009). Enzim β -mananase komersial yang sejauh ini telah dipasarkan dihasilkan oleh Bacillus lentus (Wu et al. 2005). Pada pembuatan tempe, komunitas mikroorganisme yang berperan sangat banyak. Disebutkan dalam Agranoff (2001) bahwa ada sekitar 45 galur Rhizopus, 200 spesies bakteri, dan 20 spesies khamir yang pernah diisolasi dari berbagai sampel tempe yang ada di Jawa, Sumatra, dan Bali. Berbagai spesies mikroorganisme tersebut saling bekerjasama dalam menghasilkan produk tempe yang berkualitas. Beberapa contoh bakteri yang memiliki peran penting dalam proses pembuatan tempe adalah Brevibacterium epidermides, Micrococcus luteus, Microbacterium arborescens yang berperan dalam pembentukan antioksidan
faktor II (6,7,4’ trihydroxy isoflavon); Klebsiella pneumoniae dan Citrobacter
yang berperan dalam pembentukan rasa pahit pada tempe dan dapat dikulturkan telah diteliti dalam Barus et al. (2008). Bakteri tersebut antara lain Bacillus sp, Klebsiella sp, Brevundimonas sp, Pseudomonas putilda, dan Acinetobacter sp. Komunitas bakteri yang sangat beragam pada tempe ini, terutama dari golongan Bacillus, memiliki potensi untuk diteliti dan dikembangkan kemampuan menghasilkan enzim mananasenya.
Produksi enzim untuk skala industri umumnya menggunakan mikroorganisme yang sudah direkayasa sehingga dapat memproduksi enzim yang diinginkan dalam jumlah besar. Tahapan awal yang diperlukan untuk melakukan proses rekayasa tersebut adalah mengisolasi gen penyandi enzim dan kemudian dilakukan kloning. Salah satu mikroorganisme yang umum digunakan dalam proses kloning adalah E. coli. Dalam laporan penelitian terdahulu seperti Fu et al. (2010) dan Summpunn et al. (2011) telah berhasil dilakukan kloning gen penyandi mananase ke dalam E. coli.
1.2. Tujuan
BAB II
TINJAUAN PUSTAKA
2.1. Tempe Kedelai
Tempe merupakan salah satu produk fermentasi kedelai oleh kapang Rhizopus oligosporus. Jenis makanan ini sudah diproduksi sejak beberapa abad yang lalu di Indonesia dan hingga sekarang masih menjadi salah satu bahan pangan yang utama sekaligus sumber protein yang murah bagi masyarakatnya. Berbeda dengan produk olahan fermentasi kedelai lainnya, produksi tempe hanya tersebar di beberapa negara, termasuk Malaysia, Belanda, Kanada, dan Amerika. Namun, Indonesia sampai saat ini masih merupakan produsen sekaligus konsumen utama tempe. Konsumsi tempe per kapita di Indonesia diperkirakan sebesar 15 gram/orang/hari. Produksi tempe saat ini sudah dapat dibuat dalam skala industri, tetapi mayoritas masih diusahakan dalam skala rumah tangga atau industri kecil (Hutkins 2006; Babu et al. 2009).
Wang yang secara khusus mempelajari mikrobiologi dan hal-hal teknis terkait produksi tempe (Hutkins 2006).
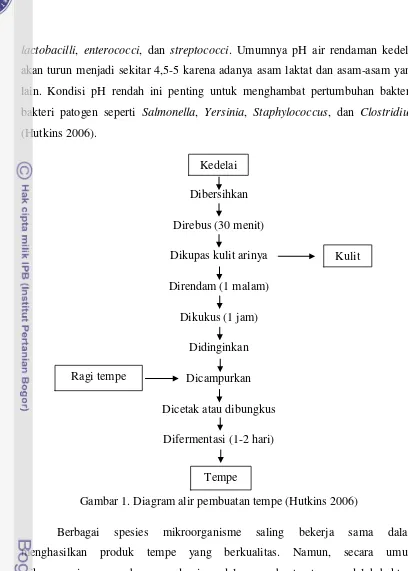
Proses pembuatan tempe cukup sederhana. Meskipun beberapa modifikasi mungkin dilakukan terkait skala produksi, kondisi geografis dan iklim, serta subyektivitas produsen, tetapi secara umum alur produksi tempe dapat dijelaskan seperti dalam gambar 1. Tempe dikategorikan sebagai solid state fermentation, karena secara umum bentuknya merupakan kacang kedelai yang terjalin satu sama lain oleh miselia kapang yang tumbuh di antara masing-masing bijinya. Meskipun saat ini berbagai jenis bahan lain dari golongan kacang dan serealia dapat dibuat menjadi tempe, hingga saat ini tempe dengan bahan baku kacang kedelai masih merupakan yang paling umum.
Beberapa penelitian mengenai manfaat konsumsi tempe bagi kesehatan tubuh manusia telah dilaporkan. Dalam review tentang tempe oleh Babu et al. (2009) dan Agranoff (2001) disebutkan bahwa tempe dapat mencegah anemia, diare, mengandung vitamin B12, senyawa antioksidan, mengurangi resiko penyakit jantung, osteoporosis, dan kanker. Senyawa aktif di dalam tempe dan bermanfaat bagi kesehatan yang paling banyak diteliti saat ini adalah dari golongan isoflavonoid dan fenol (Shi et al. 2002; Shetty et al. 2007).
lactobacilli, enterococci, dan streptococci. Umumnya pH air rendaman kedelai akan turun menjadi sekitar 4,5-5 karena adanya asam laktat dan asam-asam yang lain. Kondisi pH rendah ini penting untuk menghambat pertumbuhan bakteri-bakteri patogen seperti Salmonella, Yersinia, Staphylococcus, dan Clostridium (Hutkins 2006).
Gambar 1. Diagram alir pembuatan tempe (Hutkins 2006)
Berbagai spesies mikroorganisme saling bekerja sama dalam menghasilkan produk tempe yang berkualitas. Namun, secara umum mikroorganisme yang berperan dominan dalam pembuatan tempe adalah bakteri-bakteri asam laktat dan kapang Rhizopus oligosporus. Bakteri asam laktat berperan pada saat perendaman kedelai dan banyak spesies bakteri lain juga memiliki peran penting dalam proses pembuatan tempe, seperti Brevibacterium epidermides, Micrococcus luteus, Microbacterium arborescens yang berperan
dalam pembentukan antioksidan faktor II (6,7,4’ trihydroxy isoflavon); Klebsiella
pneumoniae dan Citrobacter freundii yang berperan dalam sintesa vitamin B12; Kedelai
Kulit
Ragi tempe
serta berbagai jenis bakteri lain yang berperan dalam pembentukan flavor dan aroma tempe. Komunitas bakteri yang berperan dalam pembentukan rasa pahit pada tempe dan dapat dikulturkan telah diteliti dalam Barus et al. (2008). Bakteri tersebut antara lain Bacillus sp, Klebsiella sp, Brevundimonas sp, Pseudomonas putilda, dan Acinetobacter sp.
Selama fermentasi oleh kapang R. oligosporus terjadi beberapa perubahan biokimia pada biji kedelai. Selama proses fermentasi, kira-kira sepertiga kandungan lipid dan seperempat kandungan protein pada kedelai didegradasi. Hasil hidrolisis lemak terutama dalam bentuk mono- dan digliserida, asam lemak bebas, dan sedikit gliserol bebas. Hampir semua asam lemak bebas yang terdapat di tempe dioksidasi oleh R. oligosporus sebagai sumber energi dan karbon yang utama. Sebaliknya, dari hasil hidrolisis protein hanya 10% asam amino dan peptida yang dioksidasi oleh R. oligosporus, 25% diubah menjadi biomassa, dan sisanya tetap berada di tempe. Kandungan nitrogen terlarut juga meningkat empat kali lipat, dari sekitar 0,5% menjadi 2%. Enzim-enzim penghidrolisa polisakarida juga dihasilkan oleh R. oligosporus dan dapat mendegradasi pektin, selulosa, serta komponen serat lainnya (Hutkins 2006).
2.2. Soybean, Palm Kernel, dan Copra Meal
Tidak ada masalah yang cukup berarti dalam pemanfaatan SBM, PKM, dan CM pada hewan ternak ruminansia. Namun, tidak demikian halnya bila ketiga komoditi tersebut digunakan pada hewan ternak non-ruminansia, misalnya saja
golongan unggas. Salah satu yang menjadi perhatian utama adalah keberadaan β
-manan dalam ketiga komoditi tersebut. Struktur β-manan merupakan polimer manosa dengan ikatan β-1,4. Apabila polimernya tersusun antara manosa dan glukosa juga dengan ikatan β-1,4 maka dinamakan glukomanan, contohnya adalah Konjac, sedangkan glukomanan yang memiliki gugus samping galaktosa melalui
ikatan α-1,6 disebut galaktoglukomanan (Rattanasuk & Cairns 2009). Manan yang
terdapat pada golongan kacang-kacangan dan kelapa berasal dari golongan galaktomanan (Phothichitto et al. 2006).
Gambar 2. Struktur manan: A. galaktomanan, B. glukomanan (Zhang et al. 2008)
Keberadaan β-manan dalam pakan dilaporkan dapat secara signifikan
mengurangi pertumbuhan serta meningkatkan ratio pakan : daging pada ternak unggas (Wu et al. 2005). Hal ini dapat terjadi karena setidaknya tiga alasan utama,
yaitu: β-manan dapat menyebabkan penurunan sekresi insulin sehingga
mengakibatkan pengurangan kemampuan absorbsi glukosa dalam tubuh; β-manan
merupakan komponen yang sangat viscous, dan kemungkinan berefek tidak
menguntungkan bagi saluran pencernaan; β-manan dilaporkan dapat memicu
dalam tubuhnya. Sistem ketahanan tubuh unggas dapat terpicu karena β-manan memiliki sifat yang dikenal sebgai PAMP (pathogen associated molecular
pattern). Hal ini disebabkan β-manan merupakan salah satu penyusun lapisan
permukaan dinding mikroorganisme, sehingga dikenali oleh sistem kekebalan
tubuh dan dianggap sebagai serangan patogen. Selain itu β-manan sendiri juga
dapat menyebabkan perkembangan macrophage dan monocytes dalam saluran pencernaan, sehingga menyebabkan gejala-gejala penyakit dan mengakibatkan penurunan pemanfaatan nutrisi. Penambahan enzim mananase dalam pakan ternak dapat mengurangi efek-efek negatif tersebut dan meningkatkan performa ternak unggas (Anderson et al. 2008; Dale et al. 2008; Wu et al. 2005).
2.3. Enzim Mananase
Hemiselulosa merupakan polisakarida kedua yang paling melimpah setelah selulosa. Manan dan Xilan adalah dua komponen utama penyusun hemiselulosa. Heteroxilan umumnya ditemukan pada rumput-rumputan, biji sereal, dan kayu keras, sedangkan heteromanan banyak ditemukan pada kayu lunak, endosperma kopra, kelapa sawit, kopi, dan locust bean gum (Kensch 2008). Manan juga ditemukan pada berbagai jenis biji-bijian dan berperan penting dalam ketahanan secara mekanik dan penyerapan air selama proses perkecambahan (Kansoh & Nagieb 2004).
Enzim mananase (β-D-mananase atau 1,4-β-D-mananmanohydrolase) merupakan enzim yang dapat menghidrolisis ikatan 1,4-β-D-manosida dari rantai
utama β-1,4-manan, galaktomanan, glukomanan, dan galaktoglukomanan
D-manosa membutuhkan dua enzim lain yaitu α-galaktosidase dan β-manosidase.
Kedua enzim ini dapat membantu memotong ikatan α-1,6-D-galaktosil dan β
-1,4-D-manopiranosil (Fattah et al. 2009).
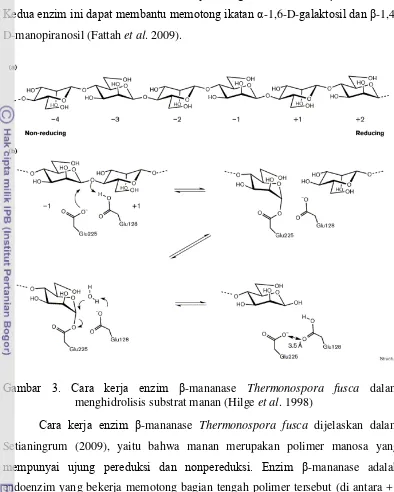
Gambar 3. Cara kerja enzim β-mananase Thermonospora fusca dalam
menghidrolisis substrat manan (Hilge et al. 1998)
Cara kerja enzim β-mananase Thermonospora fusca dijelaskan dalam
Setianingrum (2009), yaitu bahwa manan merupakan polimer manosa yang
mempunyai ujung pereduksi dan nonpereduksi. Enzim β-mananase adalah
endoenzim yang bekerja memotong bagian tengah polimer tersebut (di antara +1 dan -1). Situs aktif mananase adalah asam glutamat nomor 128 dan 225. Asam
amino glutamat nomor 128 (Glu 128) pada enzim β-mananase bertindak sebagai
tersebut kemudian diserang oleh molekul air. Setelah terpotong, senyawa manooligosakarida lepas.
Mananase cukup menarik perhatian karena fungsi dan aplikasinya pada berbagai industri, termasuk teknologi pangan, seperti pemrosesan biji kopi, alga laut, dan bahan nabati lainnya. Enzim ini dapat digunakan untuk menghidrolisis manan yang memiliki berat molekul tinggi dan pada industri pakan, mananase dapat digunakan untuk meningkatkan kecernaan dari pakan ternak. Mananase juga dapat diaplikasikan pada bidang lain seperti industri tekstil dan pulp biobleaching (Rattanasuk & Cairns 2009).
Beberapa penelitian yang telah dilakukan menyebutkan bahwa enzim mananase dapat dihasilkan oleh khamir, kapang dari golongan Trichoderma dan Aspergillus (Fattah et al. 2009), serta bakteri terutama dari golongan Bacillus (Phothichitto et al. 2006; Mabrouk & Ahwany 2008; Xu et al. 2009). β-mananase yang dihasilkan oleh sumber-sumber yang berbeda akan menghidrolisa substrat manan dengan cara yang berbeda dan dengan tingkat hidrolisa yang berbeda pula.
Produksi β-mananase menggunakan mikroorganisme merupakan cara yang lebih
menjanjikan karena biaya produksinya lebih rendah, hasilnya lebih banyak, dan kondisinya lebih mudah dikontrol.
2.4. Pasar Enzim Dunia
Menurut Pipimm (2007), perkiraan kasar pasar dunia bagi enzim industrial pada tahun 2007 sekitar 95.000 ton. Diperkirakan pertumbuhan pasar meningkat setiap tahun sekitar 10-15%. Di seluruh dunia pada tahun itu diperkirakan ada 25 industri penghasil enzim. Di dunia barat, hampir separuh dari seluruh produk enzim berada di Denmark, disusul Belanda sekitar 20%, Amerika Serikat 12%. Sisanya diproduksi di Jepang, Jerman, Prancis, Swiss, Irlandia, dan Inggris. Produksi enzim di Rusia, Cina, maupun India juga semakin meningkat signifikan tetapi belum seberapa dibanding dengan di negara-negara yang disebut sebelumnya.
BAB III
BAHAN DAN METODE
3.1. Bahan
Sampel tempe yang digunakan berasal dari daerah Jawa timur (Surabaya, Lamongan, Kediri, Malang), Jawa Tengah (Wonogiri), dan Jawa Barat (Bogor).
3.2. Metode
3.2.1. Screening Bakteri Penghasil Mananase (Sumardi et al. 2005, dengan modifikasi)
Sebanyak 25 gram masing-masing sampel tempe dilumatkan secara aseptis, dimasukkan ke dalam 225 ml NaCl 0,85% steril. Dari suspensi tersebut diambil 500 µl dan dilakukan pengenceran berseri hingga 10-9. Larutan dari tingkat pengenceran 10-7, 10-8, dan 10-9 diambil sebanyak 100 µl dan disebar pada media yang mengandung 0,3% Locust Bean Gum (LBG). Selain LBG, media yang digunakan memiliki komposisi (w/v) 0,2% ekstrak khamir, 0,2% tryptone, 0,14% KH2PO4, 0,02% MgSO4.7H2O, 0,1% (NH4)2SO4, dan 2% agar. Cawan diinkubasi pada suhu 37oC selama 24 jam dan koloni-koloni bakteri yang tumbuh dipilih yang memiliki zona bening di sekitar koloninya dan kenampakan koloninya berbeda kemudian dimurnikan pada media yang baru. Replika ini ditumbuhkan kembali pada suhu 37oC selama 24 jam. Zona bening yang dihasilkan kemudian diamati dan diukur indeks mananolitiknya (Farias et al. 2010). Untuk memperjelas zona bening yang dihasilkan, dapat digunakan larutan pewarna congo red 0,1%. Setelah pewarnaan, dilakukan pencucian menggunakan NaCl 0,1 M untuk menghilangkan sisa zat warna pada media.
3.2.2. Persiapan Soybean Meal (SBM), Palm Kernel Meal (PKM), dan Copra Meal (CM)
SBM yang digunakan diperoleh dari Surabaya, PKM dan CM berasal dari PT. Wilmar Benih Indonesia, Cikarang. Ketiganya akan digunakan sebagai substrat untuk menguji aktivitas enzim ekstrak kasar yang dihasilkan oleh isolat bakteri. Sebelum digunakan sebagai substrat, SBM, PKM, maupun CM digiling terlebih dahulu menggunakan blender kering dan diseragamkan ukurannya menggunakan ayakan 425 mikron (setara dengan ukuran 40 mesh).
3.2.3. Pengaruh Suhu Terhadap Aktivitas Mananase Ekstraseluler (Sumardi et al. 2006, dengan modifikasi)
diperoleh akan digunakan sebagai suhu optimum reaksi enzim-substrat dalam percobaan-percobaan selanjutnya.
3.2.4. Pengukuran Kadar Protein (Novagen, USA)
Pengukuran kadar protein dilakukan dengan menggunakan kit dari Novagen (USA). Sampel enzim ekstrak kasar diambil sebanyak 25 µl kemudian ditambahkan ke dalam 200 µl larutan asam bicinchoninat dan 4 µl CuSO4 4%, divortex, diinkubasi pada suhu 60oC selama 15 menit. Absorbansi larutan diukur menggunakan spektrofotometer pada panjang gelombang 562 nm. Dibuat juga blanko dengan menggunakan akuades. Standar yang digunakan adalah Bovine Serum Albumine (BSA). Aktivitas spesifik enzim didefinisikan sebagai besarnya aktivitas unit enzim per miligram protein.
3.2.5. Karakterisasi Enzim Mananase (Sumardi et al. 2006, dengan modifikasi)
3.2.5.1. Penentuan pH Optimum Bufer
3.2.5.2. Spesifisitas Substrat (Sumardi 2005)
Sebanyak 0,1 gram substrat kompleks (PKM, SBM, dan CM) masing-masing dimasukkan ke dalam tabung mikro kemudian ditambahkan 900 µl bufer dengan pH optimum yang telah diketahui dari percobaan sebelumnya dan 100 µl enzim. Campuran enzim-subtrat kemudian direaksikan pada suhu optimumnya selama 1 jam. Kadar gula reduksi yang dihasilkan diukur menggunakan DNS seperti yang telah dijelaskan sebelumnya.
3.2.5.3. Pengujian Pengaruh Ion Logam (Sumardi 2005)
Pengaruh ion logam dilakukan dengan menambahkan larutan garam (CuCl2.2H2O; LiCl; CoCl2.7H2O; MgCl2.6H2O; FeCl3.6H2O; NaCl; KCl; dan senyawa pengkelat logam, yaitu EDTA) pada campuran reaksi enzim-substrat dengan komposisi 850 µl substrat LBG 0,55%, 100 µl enzim, dan 50 µl ion logam (100 mM) kemudian direaksikan pada pH bufer dan suhu optimum enzim. Kadar gula reduksi yang dihasilkan diukur menggunakan DNS seperti yang telah dijelaskan sebelumnya.
3.2.5.4. Pengujian Kestabilan Enzim terhadap Suhu
Enzim mananase diinkubasi pada suhu 50, 60, dan 70oC dengan waktu sampling setiap 1 jam sekali selama 4 jam. Selanjutnya enzim dicampur substrat dengan komposisi 900 µl substrat LBG 0,55% dan 100 µl enzim, kemudian direaksikan pada pH bufer dan suhu optimumnya selama 1 jam dan kadar gula reduksi yang dihasilkan diukur dengan metode DNS.
3.2.5.5. Pengujian Kestabilan Enzim terhadap pH
3.2.5.6. Analisis Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis (SDS PAGE) dan Zymogram
Elektroforesis dilakukan dengan menggunakan piranti Mini Protean II (Biorad, USA). Berat molekul protein diukur dengan standar berat molekul rendah terdiri atas fosforilase b (otot kelinci) 97,4 kDa, serum albumin (BSA) 66,2 kDa, ovalbumin (putih telur) 45,0 kDa, karbonat anhidrase (bovine) 31,0 kDa, tripsin inhibitor (kedelai) 21,5 kDa, dan lysozyme (putih telur) 14,4 kDa.
Elektroforesis protein menggunakan gel pemisah (8% poliakrilamid) dan gel penahan (4% poliakrilamid). Setelah gel dipasang di piranti elektroforesis, bufer elektroforesis dituangkan ke tempatnya. Sebelum dicampurkan ke dalam sumur, sampel dan standar protein masing-masing dicampur dengan 5X bufer sampel di dalam tabung mikro dengan perbandingan 1:1 (10 µl sampel : 10 µl bufer). Sampel protein beserta bufer tersebut kemudian dipanaskan pada suhu 95oC selama 5 menit. Kemudian sebanyak 20 µl campuran tersebut dimasukkan ke sumur pada gel penahan.
Tabel 1. Komposisi gel pemisah dan penahan untuk sepasang gel elektroforesis protein
Komposisi Gel pemisah (ml) Gel penahan (ml)
Akuades 4,8 1,54
Bufer Tris-HCl 1,5 M pH 8,8 2,5 -
Bufer Tris-HCl 0,5 M pH 6,8 - 0,625
SDS 10% 0,05 0,025
Akrilamid 30% 2,66 0,67
Ammonium persulfat 10% 0,1 0,05
TEMED 0,01 0,01
menggunakan larutan pencuci. Larutan pencuci diganti dengan yang baru setiap kali dirasa warna larutan mulai menjadi pekat. Hal ini dilakukan sampai pita protein muncul dan cukup jelas untuk diamati.
Pengujian zymogram cara kerjanya sama dengan yang dilakukan pada saat elektroforesis untuk SDS PAGE, hanya saja komposisi gel yang digunakan dalam zymogram mengandung substrat LBG yang berfungsi untuk mendeteksi lokasi enzim mananase berada. Setelah running zymogram selesai, jarak migrasi bromofenol biru diukur dan gel zymogram kemudian direnaturasi untuk menghilangkan SDS (denaturan) menggunakan Triton X-100 2,5%. Dalam melakukan renaturasi, mula-mula gel direndam 3 kali dalam larutan Triton X-100 2,5%, masing-masing selama 20 menit dan diinkubasi bergoyang dengan kecepatan 30 rpm. Setelah itu, gel diinkubasi dalam pH bufer dan suhu optimumnya selama 1 jam. Untuk memunculkan pita protein mananase, gel diwarnai dengan larutan congo red 0,1% selama 20 menit pada suhu ruang kemudian dicuci dengan larutan NaCl 1 M.
Tabel 2. Komposisi gel pemisah dan penahan untuk sepasang gel zymogram
Komposisi Gel pemisah (ml) Gel penahan (ml)
Akuades 2,8 1,54
Ammonium persulfat 10% 0,1 0,05
TEMED 0,01 0,01
3.2.6. Ekstraksi Genom Bakteri (Promega, USA)
diambil sebanyak 1 ml dan disentrifugasi 16.000 g selama 2 menit. Supernatan yang diperoleh kemudian dibuang dan pelet bakteri dilarutkan dalam 480 µl EDTA 50 mM. Setelah itu ditambahkan dengan 120 µl lysozyme dan diinkubasi pada suhu 37oC selama 45 menit. Campuran kemudian disentrifugasi 16.000 g selama 2 menit dan supernatannya dibuang. Endapan yang diperoleh kemudian diresuspensi dengan 600 µl larutan lisis nukleus dan diinkubasi pada 80oC selama 5 menit. Setelah suhu campuran tersebut kembali pada suhu ruang, ditambahkan dengan 3 µl RNAse dan diinkubasi pada suhu 37oC, selama 30 menit. Campuran tersebut kemudian ditambahkan dengan 200 µl larutan presipitasi protein dan diinkubasi di dalam es selama 5 menit kemudian dilakukan sentrifugasi pada 16.000 g selama 3 menit. Supernatan yang diperoleh kemudian dipindahkan ke tabung mikro baru yang berisi 600 µl isopropanol, kemudian disentrifugasi kembali pada 16.000 g selama 2 menit dan supernatannya dibuang. Pelet yang diperoleh kemudian ditambahkan dengan 600 µ l etanol 70%, disentrifugasi 16.000 g selama 2 menit dan supernatannya dibuang. Kali ini, pelet yang diperoleh dikering anginkan selama 15 menit, kemudian ditambahkan dengan 50 µl larutan bufer rehidrasinya.
3.2.7. Analisis Sekuen rRNA 16S (Marchesi et al. 1998)
3.2.8. Isolasi Gen Mananase (Summpunn et al. 2011)
Larutan DNA genom bakteri yang sudah diencerkan menjadi 100 ng/µl kemudian dicoba untuk diisolasi gen mananasenya menggunakan PCR. Primer yang digunakan adalah Man-CHF (5’-GTACGCCATATGTTTAAGAAACATAC GATCTCTTTGC-3’) dan Man-CHR (5’-GTACGCCTCGAGTTCAACGATTGG CGTTAAAGAATC-3’). Kondisi PCR yang digunakan adalah denaturasi awal pada 98oC selama 30 detik dilanjutkan dengan 29 siklus yang terdiri dari denaturasi 98oC (10 detik), annealing pada 52oC (30 detik), dan extension pada 72oC (30 detik), dan extension akhir pada 72oC selama 5 menit.
3.2.9. Ligasi ke Dalam pGEMT-easy (Promega, USA)
Setelah diperoleh gen mananase, gen ini kemudian diligasikan ke dalam vektor kloning yaitu pGEMT-easy. Konsentrasi vektor yang digunakan adalah 50 ng/µl. Ligasi dilakukan dengan bantuan enzim T4 DNA ligase. Campuran vektor dan insert kemudian diinkubasi pada suhu 16oC selama 1 malam.
3.2.10. Transformasi (Promega, USA)
pada suhu 37oC, selama 1 malam. Koloni transforman yang tumbuh kemudian diambil dan dimurnikan pada media yang baru. Untuk memastikan bahwa bakteri transforman tersebut membawa gen mananase yang diinginkan maka dilakukan verifikasi menggunakan PCR koloni. Primer yang digunakan adalah M13 forward dan M13 reverse. Kondisi PCR yang digunakan adalah denaturasi awal pada 95oC selama 5 menit dilanjutkan dengan 29 siklus yang terdiri dari denaturasi 95oC (30 detik), annealing pada 50oC (30 detik), dan extension pada 72oC (2 menit), dan extension akhir pada 72oC selama 5 menit.
3.2.11. Pengujian Aktivitas Mananase Intraseluler (Sumardi et al. 2005, dengan modifikasi)
BAB IV
HASIL DAN PEMBAHASAN
4.1. Screening Bakteri Penghasil Mananase
Dalam penelitian ini digunakan sampel tempe dari beberapa daerah di pulau Jawa, yaitu: Bogor, Wonogiri, Surabaya, Malang, Kediri, dan Lamongan. Dari proses screening diperoleh tujuh isolat bakteri yang memiliki aktivitas mananase berdasarkan zona bening yang dihasilkan di sekitar koloninya. Dari ketujuh bakteri tersebut kemudian dimurnikan dan dipilih empat isolat yang diduga memiliki aktivitas mananase paling bagus ditandai dengan zona bening yang jelas dan besar di sekeliling koloninya. Keempat isolat tersebut diberi kode A, D, E, dan N. Zona bening yang besar mengindikasikan konsentrasi enzim yang dihasilkan oleh bakteri juga tinggi (Farias et al. 2010). Namun, tidak dijelaskan mengenai kualitas enzim yang dihasilkan tersebut. Oleh karena itu, keempat isolat tersebut diuji aktivitas enzim yang dihasilkannya terlebih dahulu sebelum dipilih isolat terbaik untuk dikarakterisasi lebih lanjut.
Tabel 3. Indeks mananolitik isolat A, D, E, dan N
Isolat Diameter
4.2. Pengujian Pengaruh Suhu Terhadap Aktivitas Mananase
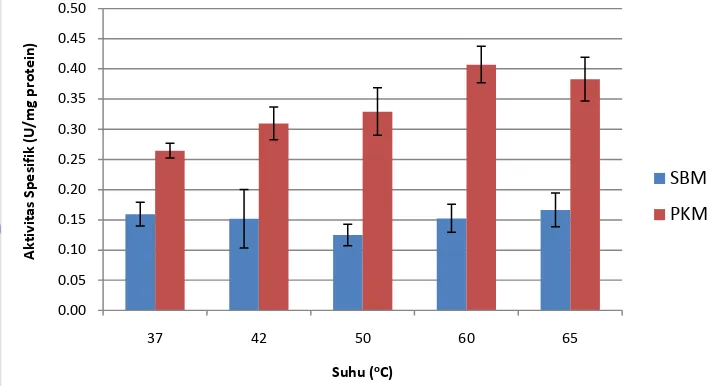
Keempat isolat tersebut kemudian ditumbuhkan pada media cair mengandung LBG 0,3% untuk diproduksi enzim mananasenya. Supernatan yang diperoleh kemudian diuji aktivitas mananasenya menggunakan pereaksi dinitrosalisilat (DNS). Pengujian pengaruh suhu dilakukan menggunakan dua substrat yang berbeda, yaitu Palm kernel meal (PKM) dan Soybean meal (SBM). Hal ini sekaligus bertujuan sebagai percobaan awal untuk melihat apakah enzim mananase yang dihasilkan memiliki potensi untuk diaplikasikan pada substrat kompleks atau tidak. Suhu yang digunakan ada lima yaitu 37, 42, 50, 60, dan 65oC. Suhu 50, 60, dan 65oC mewakili pengujian untuk enzim golongan termofilik, sedangkan 37 dan 42oC dari golongan mesofilik. Pemilihan suhu 37 dan 42oC ini juga didasarkan pada proses fermentasi tempe dan suhu optimum pertumbuhan beberapa bakteri asam laktat, karena mungkin saja suhu optimum enzim tidak berbeda jauh dengan suhu optimum pertumbuhannya.
Berdasarkan hasil pengujian diketahui bahwa isolat E memiliki aktivitas unit yang paling tinggi (0,35 U/ml) (Lampiran 2) dibandingkan isolat yang lain, sedangkan untuk aktivitas spesifik yang paling tinggi dimiliki oleh isolat N (0,41 U/mg protein). Oleh karena itu, isolat N dipilih untuk dikarakterisasi lebih lanjut. Isolat N memiliki aktivitas unit dan spesifik tertinggi pada suhu 60oC dengan substrat PKM.
0.00
Gambar 5. Aktivitas spesifik mananase ekstraseluler isolat N
Gambar 6. Isolat N sebelum dan setelah diwarnai dengan congo red 0,1%
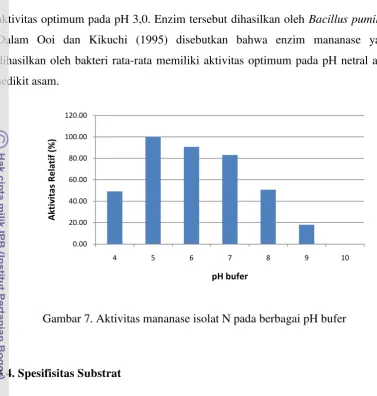
4.3. Penentuan pH Optimum Bufer Mananase Isolat N
aktivitas optimum pada pH 3,0. Enzim tersebut dihasilkan oleh Bacillus pumilus. Dalam Ooi dan Kikuchi (1995) disebutkan bahwa enzim mananase yang dihasilkan oleh bakteri rata-rata memiliki aktivitas optimum pada pH netral atau sedikit asam.
Gambar 7. Aktivitas mananase isolat N pada berbagai pH bufer
4.4. Spesifisitas Substrat
Enzim mananase dari isolat N diujikan pada beberapa macam substrat yang mengandung manan, yaitu PKM, SBM, dan copra meal (CM). Hasil pengujian menunjukkan enzim mananase ini bekerja paling baik pada substrat PKM dengan rata-rata aktivitas sebesar 1,13 U/ml pada kondisi reaksi 60oC dan bufer pH 5. Tingginya aktivitas mananase pada substrat PKM diduga disebabkan kandungan manan yang lebih tinggi pada PKM (30-35%) dibandingkan CM (25-30%) (Sundu & Dingle 2003) dan SBM (1-2%) (Hsiao et al. 2006).
4.5. Pengaruh Ion Logam terhadap Aktivitas Mananase Isolat N
NaCl; dan KCl, serta senyawa pengkelat ion yaitu EDTA. Berdasarkan hasil pengujian diperoleh data bahwa garam-garam CuCl2.2H2O; MgCl2.6H2O; FeCl3.6H2O; NaCl; serta KCl menurunkan sedikit (0-15%) aktivitas enzim sedangkan garam LiCl dan CoCl2.7H2O meningkatkan sedikit (0-15%) aktivitas enzim. Dalam Sumardi (2005) dan Fattah et al. (2009), diketahui pula bahwa ion Co2+ relatif dapat meningkatkan aktivitas mananase. Hal ini diduga disebabkan adanya molekul protein mananase yang diaktifkan oleh ion Co2+.
Gambar 8. Aktivitas mananase isolat N pada berbagai substrat (60oC, bufer pH 5)
4.6. Kestabilan Mananase Isolat N pada Berbagai Suhu
Kestabilan enzim mananase isolat N pada berbagai suhu dicobakan pada 3 macam suhu yang berbeda, yaitu 50, 60, dan 70oC. Dari hasil pengujian, diketahui bahwa enzim mananase masih memiliki aktivitas yang stabil meskipun diinkubasi di suhu 60oC selama 4 jam. Namun, pada suhu 70oC selama 1 jam, enzim mananase ini sudah kehilangan aktivitasnya. Profil kestabilan mananase isolat N pada berbagai suhu ini memiliki kemiripan dengan data yang diperoleh Summpunn et al. (2011) dan Ooi dan Kikuchi (1995), serta lebih baik bila dibandingkan dengan data yang diperoleh oleh Fattah et al. (2009) dan Vu et al. (2012). Sedangkan dalam Aurora et al. (2003) diperoleh enzim mananase yang stabil pada suhu 80oC selama 5 hari.
Gambar 10. Kestabilan mananase isolat N pada berbagai suhu
4.7. Kestabilan Mananase Isolat N pada Berbagai pH
penelitian oleh Ooi dan Kikuchi (1995), Summpunn et al. (2011), dan Vu et al. (2012).
Gambar 11. Kestabilan mananase isolat N pada berbagai rentang pH
4.8. Identifikasi Bakteri Berdasarkan 16S rRNA
Sebelum dilakukan identifikasi, terlebih dahulu dilakukan ekstraksi genom bakteri. Berdasarkan identifikasi terhadap sekuen 16S rRNAnya, diketahui bahwa isolat N memiliki 98% kemiripan dengan Bacillus subtilis. (Genebank access JN644507). Primer yang digunakan dalam percobaan ini adalah 63f dan 1387r berdasarkan Marchesi et al. (1998).
4.9. Kloning Gen Mananase B. subtilis N
Isolat B. subtilis N ini kemudian dicoba untuk diisolasi gen mananasenya menggunakan PCR dan primer Man-CHF dan Man-CHR (Summpunn et al. 2011). Hasil amplifikasi PCR berupa open reading frame gen mananase sepanjang 1.086 pasang basa, menyandikan 362 asam amino, dan perkiraan berat molekulnya adalah 41 kDa. Setelah gen mananase dari B. subtilis N berhasil diisolasi, maka gen ini kemudian diligasikan pada vektor kloning yaitu pGEMT-easy. Hasil ligasi vektor dengan gen mananase (pWBE1) (Gambar 13) ini kemudian ditransformasikan ke dalam E. coli TOP10. Untuk memastikan bahwa
proses transformasi sudah berjalan dengan benar, maka koloni transforman yang tumbuh diambil dan dilakukan PCR koloni. Untuk selanjutnya E. coli transforman ini disebut sebagai SEGO1 (E. coli TOP10 yang membawa pWBE1).
Gambar 12. Hasil elektroforesis produk PCR gen mananase menggunakan primer Man-CHF dan Man-CHR.
Gambar 13. pWBE1 (pGEMT-easy yang sudah disisipi dengan gen mananase dari B. subtilis N)
100 bp N
500 bp
1000 bp + 1100 bp
4.10. Perbandingan Aktivitas Mananase B. subtilis N dengan SEGO1
SEGO1 kemudian ditumbuhkan untuk produksi enzim mananase dan dibandingkan aktivitasnya dengan B. subtilis N. Hasil perbandingan aktivitas mananase tersaji dalam Tabel 4. Dari data tersebut dapat terlihat bahwa SEGO1 dapat menghasilkan enzim mananase dengan aktivitas yang tidak berbeda jauh bila dibandingkan dengan yang dihasilkan oleh B. subtilis N. Aktivitas mananase juga ditemukan pada cairan intraseluler SEGO1. Hal ini diduga disebabkan masih kurangnya kemampuan SEGO1 untuk mengeluarkan enzim mananase yang sudah diekspresikan dari dalam selnya. Rekayasa mikroorganisme agar menghasilkan enzim mananase dengan aktivitas yang tinggi telah dilakukan beberapa peneliti seperti Summpunn et al. (2011), Vu et al. (2012), dan Yoon et al. (2008). Mikroorganisme yang umumnya digunakan adalah bakteri atau khamir. Karakterisasi enzim mananase yang dihasilkan oleh mikroorganisme rekombinan tersebut juga telah dilakukan.
Tabel 4. Perbandingan aktivitas unit mananase B. subtilis N dengan SEGO1 pada substrat LBG 0,55%
Sampel Aktivitas Unit (U/ml)
B. subtilis N ekstraseluler 7,66
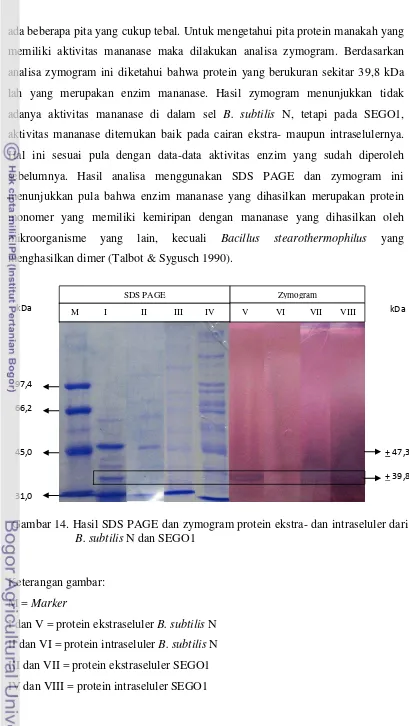
ada beberapa pita yang cukup tebal. Untuk mengetahui pita protein manakah yang memiliki aktivitas mananase maka dilakukan analisa zymogram. Berdasarkan analisa zymogram ini diketahui bahwa protein yang berukuran sekitar 39,8 kDa lah yang merupakan enzim mananase. Hasil zymogram menunjukkan tidak adanya aktivitas mananase di dalam sel B. subtilis N, tetapi pada SEGO1, aktivitas mananase ditemukan baik pada cairan ekstra- maupun intraselulernya. Hal ini sesuai pula dengan data-data aktivitas enzim yang sudah diperoleh sebelumnya. Hasil analisa menggunakan SDS PAGE dan zymogram ini menunjukkan pula bahwa enzim mananase yang dihasilkan merupakan protein monomer yang memiliki kemiripan dengan mananase yang dihasilkan oleh mikroorganisme yang lain, kecuali Bacillus stearothermophilus yang menghasilkan dimer (Talbot & Sygusch 1990).
Gambar 14. Hasil SDS PAGE dan zymogram protein ekstra- dan intraseluler dari B. subtilis N dan SEGO1
Keterangan gambar: M = Marker
I dan V = protein ekstraseluler B. subtilis N II dan VI = protein intraseluler B. subtilis N III dan VII = protein ekstraseluler SEGO1 IV dan VIII = protein intraseluler SEGO1
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Sejumlah bakteri penghasil mananase telah berhasil diisolasi dari sejumlah contoh tempe di Pulau Jawa. Salah satu dari bakteri terpilih dengan aktivitas mananase tertinggi memiliki 98% kemiripan dengan Bacillus subtilis. Bakteri ini menghasilkan mananase dengan aktivitas spesifik sebesar 0,41 U/mg protein pada substrat palm kernel meal. Enzim ini diketahui bekerja optimum pada suhu 60oC dan bufer pH 5. Selain itu, enzim mananase ini diketahui paling baik bekerja pada substrat palm kernel meal dibandingkan dengan soybean meal maupun copra meal. Karakteristik lain yang berhasil diketahui dari mananase ini adalah stabil pada suhu 60oC selama 4 jam; stabil pada rentang pH yang cukup luas selama 1 jam; stabil terhadap berbagai ion logam; dan memiliki berat molekul protein sebesar 39,8 kDa. Gen mananase dari B. subtilis N ini telah berhasil diisolasi dan dikloning ke dalam E. coli (SEGO1). Aktivitas mananase dari SEGO1 terdapat pada cairan ekstra- (6,39 U/ml) maupun intraselulernya (8,82 U/ml).
5.2. Saran
DAFTAR PUSTAKA
Agranoff J, editor. 2001. The Complete Handbook of Tempe. Jakarta: Indonesian Tempe Foundation.
Anderson DM, Hsiao HY, Dale NM. 2008. Identification of an Inflammatory Compound for Chicks in Soybean Meal-II. Poultry Science Forum.
Aurora DD, Lestari Y, Meryandini A. 2003. Identifikasi Bakteri Penghasil Mannanase Serta Karakterisasi Enzimnya. Jurnal Mikrobiologi Indonesia 8 (1): 31-33.
Babu PD, Bhakyaraj R, Vidhyalakshmi R. 2009. A Low Cost Nutritious Food
“Tempeh” - A Review. W J of Dairy & Food Sciences 4 (1): 22-27.
Barus T, Suwanto A, Wahyudi AT, Wijaya H. 2008. Role of Bacteria in Tempe Bitter Taste Formation: Microbiological and Molecular Biological Analysis Based on 16S rRNA Gene. J of Microbiol Indonesia 2 (1): 17-21. Britzman DG. 2011. Soybean Meal An Excellent Protein Source for Poultry
Feeds. American Soybean Association: Technical Bulletin
Dale NM, Anderson DM, Hsiao HY. 2008. Identification of an Inflammatory Compound for Chicks in Soybean Meal. Poultry Science Forum.
Farias DF, Carvalho AFU, Oliveira CC, Sousa NM, Rocha-Bezerra LCB, Ferreira PMP, Lima GPG, Hissa DC. 2010. Alternative Method for Quantification of Alfa-amylase Activity. Braz J Biol 70 (2): 405-407
Fattah AFA, Hashem AM, Ismail AMS, Refai MAE. 2009. Purification and Some
Properties of β–mannanase from Aspergillus oryzae NRRL 3448. J of
Applied Sciences Research 5 (12): 2067-2073.
Fu, Xiaoyu, Huang X, Liu P, Lin L, Wu G, Li C, Feng C, Hong Y. 2010. Cloning and Characterization of a Novel Mannanase from Paenibacillus sp. BME-14. J Microbiol Biotechnol 20 (3): 518-524.
Helianti I. 2006. Extremozim; Biomaterial Menarik dan Menggiurkan. http://www.berita-iptek.com/index.php?option=com_content&view= article&id=79:extremozim-biomaterial-menarik-dan-menggiurkan&catid =34:biologi&Itemid=58 (11 Feb 2011)
Hilge M, Gloor S, Winterhalter K, Zimmermn W, Piontek K. 1998. High
Resolution Native and Complex Structures of Thermostable β-mannanase
from Thermonospora fusca Substrate Specificity in Glycosyl Hydrolase Family 5. Structure 6: 1433-1444.
Hsiao HY, Anderson DM, Dale NM. 2006. Levels of β-mannan in Soybean Meal.
Hutkins RW. 2006. Microbiology and Technology of Fermented Foods. USA: Blackwell Publishing.
Kansoh AL, Nagieb ZA. 2004. Xylanase and Mannanase Enzymes from Streptomyces galbus NR and Their Use in Biobleaching of Softwood Kraft Pulp. Antonie van Leeuwenhoek 85: 103-114.
Kensch O. 2008. Mannanase Engineering for Fiber Degradation. www.direvo.com/ media/SCM%20mannanase_081202.pdf (15 Des 2010)
Mabrouk MEM, Ahwany AMDE. 2008. Production of β–mannanase by Bacillus
amylolequifaciens 10A1 Cultured on Potato Peels. African J of Biotechnol 7 (8): 1123-1128.
Marchesi JR, Sato T, Weightman AJ, Martin TA, Fry JC, Hiom SJ, Wade WG. 1998. Design and Evaluation of Useful Bacterium-Specific PCR Primers That Amplify Genes Coding for Bacterial 16S rRNA. Applied and Environmental Microbiol 64 (2): 795-799.
Ooi T, Kikuchi D. 1995. Purification and Some Properties of β-mannanase from Bacillus sp. W J Microbiol biotechnol 11:310-314.
Phothichitto K, Nitisinprasert S, Keawsompong S. 2006. Isolation, Screening, and Identification of Mannanase Producing Microorganisms. Katersart J 40: 26-38.
[PIPIMM] Pusat Informasi Produk Industri Makanan dan Minuman. 2007. Tips Memilih Enzim sebagai Ingridien Pangan. http://pipimm.org/?pilih =news&aksi=lihat&id=35 (11 Feb 2011).
Rattanasuk S, Cairns MK. 2009. Chryseobacterium indologenes, Novel Mannanase-producing Bacteria. Songklanakarin J of Science and Technology 31 (4), 395-399.
Ravindran V. 2011. Poultry Feed Availability and Nutrition in Developing Countries. Poultry Development Review: 1-3
[Reportlinker]. 2009. World Enzymes Market. http://www.reportlinker.com/ p0148002/World-Enzymes-Market.html (11 Feb 2011).
Setianingrum K. 2009. Pemurnian dan Karakterisasi Mananase Ekstraseluler Streptomyces purpurascens [tesis]. Bogor: Sekolah Pascasarjana IPB.
Shetty K, Paligath G, Pometto AL, Levin RE, editor. 2007. Functional Foods and Biotechnology. USA: CRC Press, Taylor & Francis Group.
Sumardi. 2005. Isolasi, Karakterisasi, dan Produksi β-Mannanase Ekstraseluler dari Geobacillus stearothermophilus L-07 [disertasi]. Bogor: Sekolah Pascasarjana IPB.
Sumardi, Suwanto A, Suhartono MT, Purwadaria T. 2005. Isolation and Characterization of Mannanolytic Thermophilic Bacteria from Palm Oil Shell and Their Mannanase Enzyme Production Properties. Biotropia 25: 1-10.
Sumardi, Suwanto A, Suhartono MT, Purwadaria T. 2006 Purification and
Characterization of Extracellular β-Mannanase from a Thermophilic
Bacterium, Geobacillus stearothermophilus L-07. Jurnal Mikrobiologi Indonesia 11 (2): 57-62.
Summpunn P, Chaijan S, Isarangkul D, Wiyakrutta S, Meevootisom V. 2011.
Characterization, Gene Cloning, and Heterologous Expression of β
-Mannanase from a Thermophilic Bacillus subtilis. The J of Microbiol 49 (1): 86-93.
Sundu B, Dingle J. 2003. Use of Enzymes to Improve The Nutritional Value of Palm Kernel Meal and Copra Meal. Proc. Quensland Poult. Sci. Symp. Australia 11 (14): 1-15.
Talbot G, Sygusch J. 1990. Purification and Characterization of Thermostable β
-Mannanase and α-Galactosidase from Bacillus stearothermophilus.
Applied and Environmental Microbiol. 56 (11): 3505-3510.
Titapoka S, Keawsompong S, Haltrich D, Nitisinprasert S. 2008. Selection and Characterization of Mannanase-producing Bacteria Useful for the Formation of Prebiotic Manno-oligosaccharides from Copra Meal. World J Microbiol Biotechnol 24: 1425-1433.
Vu, Thi TH, Dinh TQ, Thi TD, Sy LTN. 2012. Cloning, High-Level Expression, Purification, and Properties of a Novel Endo-β-1,4-Mannanase from Bacillus subtilis G1 in Pichia pastoris. J. Microbiol. Biotechnol. 22 (3): 331-338.
Wu G, Bryant MM, Voitle RA, Roland DA Sr. 2005. Effects of β-Mannanase in
Corn-Soy Diets on Commercial Leghorns in Second-Cycle Hens. Poultry Science 84: 894-897.
Xu B, Duan L, Tang XH, Li JJ, Mu YL, Yang YJ, Huang Z. 2009. Characterization of 6 Bacillus subtilis β–mannanases and Their Genes. African J of Biotechnol 8 (18): 4316-4324.
Yopi, Purnawan A, Thontowi A, Hermansyah H, Wijanarko A. 2006. Preparasi Mannan dan Mannanase Kasar dari Bungkil Kelapa Sawit. Jurnal Teknologi No. 4 Tahun XX: 312-319.
LAMPIRAN
Lampiran 1. Prosedur pembuatan reagen yang digunakan dalam penelitian 5X buffer sampel SDS PAGE
0,6 ml 1 M Tris-HCl pH 6,8 (konsntrasi akhir 60 mM), 5 ml 50% gliserol (25%),
2 ml 10% SDS (2%), 0,5 ml β-merkaptoetanol (14,4 mM), 1 ml 1% bromofenol
biru (0,1%), dan 0,9 ml akuades.
Larutan pewarna gel SDS PAGE
Sebanyak 150 ml metanol, 50 ml asam asetat glasial, dan 0,5 g coomassie brilliant blue R-250 dilarutkan sampai 500 ml dengan akuades.
Larutan pencuci gel SDS PAGE
Sebanyak 150 ml metanol dan 50 ml asam asetat glasial dilarutkan sampai 500 ml dengan akuades.
Congo red 0,1%
Sebanyak 0,1 g congo red dilarutkan dalam 100 ml akuades
Pereaksi dinitrosalisilat (DNS)
y = 4E-05x - 0.0047
0 1000 2000 3000 4000 5000 6000
Aktivitas unit isolat A, D, E, dan N pada berbagai suhu dengan substrat
Aktivitas spesifik isolat A, D, E, dan N pada berbagai suhu dengan substrat SBM dan PKM
Aktivitas mananase isolat N pada berbagai pH pH Aktivitas mananase isolat N pada substrat yang berbeda
substrat
Kestabilan mananase isolat N pada kondisi penambahan berbagai macam
Kestabilan mananase isolat N terhadap suhu Aktivitas Unit (U/ml)