Streptomyces
sp. ASAL INDONESIA
Oleh:
Aprilia Naomi
G 34102052
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
APRILIA NAOMI. Produksi Xilooligosakarida dari Xilan Tongkol Jagung dengan
Menggunakan Xilanase Streptomyces sp. asal Indonesia. Dibimbing oleh ANJA
MERYANDINI dan TITI C. SUNARTI.
Produksi xilanase dari tiga isolat asli Indonesia dapat diinduksi dengan xilan tongkol jagung. Streptomyces sp. yang digunakan ialah isolat 234P-16, isolat SKK1-8, dan isolat 45I-3. Aktivitas xilanase isolat SKK1-8 dan isolat 45I-3 dengan menggunakan media dari xilan tongkol jagung lebih tinggi dibandingkan dengan media dari xilan
oatspelt pada konsentrasi xilan yang sama. Aktivitas xilanase ketiga isolat lebih tinggi pada substrat xilan tongkol jagung pada konsentrasi substrat 1% dibandingkan pada
konsentrasi 0.5% dan 1.5%. Xilanase yang dihasilkan oleh Streptomyces sp. digunakan
untuk menghidrolisis xilan sehingga menghasilkan xilooligosakarida. Hasil hidrolisis xilan oleh xilanase dapat diperlihatkan dengan pembentukan gula sederhana, perubahan
derajat polimerasi (DP), dan analisis dengan Thin Layer Chromatography (TLC). Produk
hidrolisis xilan berupa xilooligosakarida rantai panjang dihasilkan oleh isolat 234P-16 dengan DP yang berkisar antara 83.13 hingga 20.24 pada media xilan dari oatspelt dan xilan dari tongkol jagung manis. Isolat SKK1-8 mampu menghidrolisis xilan menjadi xilooligosakarida rantai pendek dengan DP yang berkisar antara 12.01 hingga 2.12, sedangkan isolat 45I-3 antara 5.75 hingga 2.12 pada media xilan dari oatspelt dan xilan dari tongkol jagung. Analisis produk hidrolisis xilan secara kualitatif dengan metode TLC, menunjukkan bahwa produk hidrolisis mengandung beragam xilooligosakarida.
ABSTRACT
APRILIA NAOMI. Production of Xilooligosaccharide from Corncob Xylan Using
Xilanase from Indonesian Streptomyces sp. Under the direction of ANJA MERYANDINI
and TITI C. SUNARTI.
Production of xylanase from three local isolates could be induced with xylan
from corncob. The strains of Streptomyces sp. which used in this research are 234P-16
strain, SKK1-8 strain, and 45I-3 strain. Xylanases from strain SKK1-8 and strain 45I-3 showed the higher activity with corncob xylan than oatspelt xylan. The highest xylanase activities for three strains produced from corncob xylan substrate with 1% concentration
than 0.5% and 1.5%. Xylanase which produced by Streptomyces sp. is used for
Streptomyces
sp. ASAL INDONESIA
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
Pada Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Oleh:
Aprilia Naomi
G 34102052
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : PRODUKSI XILOOLIGOSAKARIDA DARI XILAN TONGKOL
JAGUNG DENGAN MENGGUNAKAN XILANASE
Streptomyces
sp.
ASAL INDONESIA
Nama : Aprilia Naomi
NIM : G34102052
Menyetujui:
Pembimbing I
Pembimbing II
Dr. Anja Meryandini, MS
Dr. Ir. Titi C. Sunarti, M.Si.
NIP. 131663016
NIP. 131956683
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Prof. Dr. Ir. Yonny Koesmaryono, M.S.
NIP. 131473999
segala karunia dan penyertaan-Nya penulis dapat menyelesaikan penelitian dan penulisan karya ilmiah ini. Tema yang dipilih dalam penelitian ini ialah tentang enzim mikrob, dengan judul Produksi Xilooligosakarida dari Xilan Tongkol Jagung dengan
Menggunakan Xilanase Streptomyces sp.asal Indonesia.
Penelitian ini dilaksanakan mulai bulan November 2005 hingga Juni 2006 bertempat di Laboratorium Pengawasan Mutu, Teknologi Kimia, Bioindustri Departemen Teknologi Industri Pertanian FATETA IPB serta Laboratorium Mikrobiologi Departemen Biologi FMIPA IPB.
Penulis ingin menyampaikan ucapan terima kasih yang mendalam kepada Ibu Dr. Anja Meryandini, MS. selaku pembimbing I, Ibu Dr. Ir. Titi C. Sunarti, M.Si. selaku pembimbing II serta Ibu Dr. Ir. Lisdar A. Manaf selaku perwakilan komisi pendidikan dan penguji kelayakan skripsi atas bimbingan, saran, dan masukannya yang sangat berharga kepada penulis. Ucapan terima kasih juga penulis sampaikan kepada ibu Dr. Ir.
Yulin Lestari yang telah mengizinkan pemakaian ketiga isolat Streptomyces pada
penelitian ini.
Penghargaan tak ternilai penulis sampaikan kepada papa dan mama tercinta, adik-adik, serta seluruh keluarga, atas segala dukungan, doa dan kasih sayangnya. Ucapan terima kasih juga penulis sampaikan kepada Mbak Heni, Pak Jaka, Pak Endang, dan Bu Kokoy selaku teknisi Laboratorium Mikrobiologi; Pak Sugi, Pak Edi, Pak Gun, Bu Ega, Bu Sri selaku teknisi laboratorium Teknologi Industri Pertanian FATETA IPB; teman-teman seperjuanganku Fery Mutia, Sita, Hendro, Fredy, Dewi, Vitria, Desi, Tika T, Ary, Mia, Nirli, Dila, Tika W, Batara, Achi, Mbak Wulan, Bu It, Mas Oji, Mas Prima, Bu Nunuk, Mbak Elsi, seluruh rekan-rekan Biologi angkatan 39 serta semua pihak yang telah membantu dalam penelitian ini, terima kasih atas persahabatan dan kerjasamanya.
Semoga karya ilmiah ini bermanfaat bagi semua pihak untuk kemajuan ilmu pengetahuan.
Bogor, Oktober 2006
Aprilia Naomi
RIWAYAT HIDUP
DAFTAR TABEL……… vi
DAFTAR GAMBAR………... …….. vi
DAFTAR LAMPIRAN……… vi
PENDAHULUAN Latar Belakang……….... 1
Tujuan………... 2
Waktu dan Tempat………... . 2
BAHAN DAN METODE Bahan dan Alat……….…………...……… 2
Metode……… 2
Penyiapan Bahan………... 2
Ekstraksi Xilan………. 2
Peremajaan Isolat dan Penyiapan Inokulum………. 2
Penentuan Waktu Produksi Optimum dan Aktivitas Xilanase Harian………... 2
Pengaruh Konsentrasi Xilan Tongkol Jagung terhadap Aktivitas Xilanase... 3
Hidrolisis Xilan menggunakan Xilanase……… 3
Analisis Produk Hidrolisis Xilanase dengan Thin Layer Chromatography.……...….. 3
HASIL DAN PEMBAHASAN Hasil……….. 3
Komposisi Kimia Tongkol Jagung ……..………... 3
Ekstraksi Xilan……….. 3
Penentuan Waktu Optimum Produksi dan Aktivitas Xilanase Harian………. 3
Pengaruh Konsentrasi Xilan Tongkol Jagung terhadap Aktivitas Xilanase... 4
Perubahan Derajat Polimerasi (DP) pada Produk Hasil Hidrolisis Xilanase…………. 5
Analisis Produk Hidrolisis Xilan dengan Thin Layer Chromatography………... 6
Pembahasan………... 6
SIMPULAN………. 8
SARAN.……… ………... 9
DAFTAR PUSTAKA………... 9
LAMPIRAN………11
DAFTAR TABEL
Halaman
1 Perubahan derajat polimerasi pada produk hasil hidrolisis xilanase isolat 234P-16... 5
2 Perubahan derajat polimerasi pada produk hasil hidrolisis xilanase isolat SKK1-8... 5
3 Perubahan derajat polimerasi pada produk hasil hidrolisis xilanase isolat 45I-3…... 6
DAFTAR GAMBAR Halaman 1 Kurva aktivitas xilanase ketiga isolat dari media produksi xilan oatspelt yang diuji pada pH dan suhu optimum masing-masing enzim dengan substrat 0.5% xilan oatspelt... 4
2 Perbandingan aktivitas xilanase ketiga isolat pada konsentrasi 0.5% substrat xilan yang berbeda... 4
3 Pengaruh konsentrasi xilan tongkol jagung terhadap aktivitas xilanase isolat 234P-16...…. 4
4 Pengaruh konsentrasi xilan tongkol jagung terhadap aktivitas xilanase isolat SKK1-8... 4
5 Pengaruh konsentrasi xilan tongkol jagung terhadap aktivitas xilanase isolat 45I-3…... 4
DAFTAR LAMPIRAN Halaman 1 Komposisi media agar-agar xilan dan media produksi xilanase (Ruiz-arribas et al. 1995)…... 12
2 Prosedur karakterisasi bahan baku..………... 12
3 Penentuan gula pereduksi metode DNS (Miller 1959)………...……….... 14
4 Penentuan aktivitas xilanase ...………... 14
5 Prosedur analisis total gula metode Fenol-H2SO4 (Apriyantono et al. 1989)………. 14
6 Aktivitas xilanase harian isolat 234P-16... 15
7 Aktivitas xilanase harian isolat SKK1-8………... 15
8 Aktivitas xilanase harian isolat 45I-3…... 15
9 Hasil TLC sampel hidrolisis isolat 234P-16……….……….. 16
10 Hasil TLC sampel hidrolisis isolat SKK1-8……….……….. 17
PENDAHULUAN
Latar Belakang
Tongkol jagung merupakan salah satu limbah padat yang dihasilkan industri pengolahan jagung. Limbah tersebut banyak
mengandung bahan berlignoselulosa
(berserat) yang memiliki potensi besar sebagai bahan baku industri (Widyani 2002).
Bahan berlignoselulosa terdiri atas
hemiselulosa, selulosa, dan lignin. Tongkol jagung mengandung 40% selulosa, 36% hemiselulosa, dan 16% lignin (Irawadi 1999). Penggunaan mikrob pada limbah berlignoselulosa dapat memicu disintesisnya
enzim ekstraselular yang mampu
mendegradasi bahan berlignoselulosa
menjadi fraksi penyusunnya (Richana et al.
2000).
Hemiselulosa terdiri atas xilan, mannan, galaktan, dan arabinan (Beg et al. 2001). Hemiselulosa dapat larut dalam larutan alkali tetapi tidak larut dalam larutan
asam. Xilan merupakan komponen
hemiselulosa terbesar penyusun dinding sel
tanaman (Kulkarni et al. 1999). Xilan
terdapat dihampir semua tumbuhan tahunan baik itu kayu keras maupun kayu lunak. Kayu keras mengandung 20-25% xilan sedangkan kayu lunak mengandung 7-12%
xilan (Wang et al. 2003). Limbah-limbah
pertanian seperti tongkol jagung, jerami padi, ampas tebu, dedak gandum, dan biji kapas juga banyak mengandung xilan
(Richana et al. 2000). Kandungan xilan
dalam tongkol jagung mencapai 40 g/100 g
tongkol (Yang et al. 2005). Xilan
merupakan komponen tertinggi pada tongkol jagung dibandingkan xilan pada limbah hasil pertanian lainnya (Agustina 2002).
Rantai utama xilan yaitu gugus xilosil
-1,4 D-xilopiranosida dengan jumlah
monomer 150 hingga 200 unit. Rantai
samping xilan berupa gugus asetil,
arabinosil, dan glukorosil (Saha 2003).
Xilanase merupakan enzim
ekstraselular yang berperan dalam hidrolisis xilan. Xilanase disekresikan dalam media yang mengandung xilan murni atau residu xilan. Induksi xilanase dapat dipicu oleh komponen lignoselulosa seperti gandum,
gabah, dan tongkol jagung (Beg et al. 2001).
Sistem enzim xilanolitik terdiri atas
-1,4-endoxilanase, -xilosidase,
-L-arabinofuranosidase, -glukoronidase, asetil xilan esterase, dan asam fenolat esterase
(Beg et al. 2001). Xilanase dapat
diklasifikasikan berdasarkan substrat yang
dihidrolisis, yaitu -xilosidase, eksoxilanase,
dan endoxilanase. -xilosidase memiliki
kemampuan menghidrolisis xilooligosakarida rantai pendek menjadi xilosa. Eksoxilanase mampu memutus rantai polimer xilosa (xilan) pada ujung reduksi, menghasilkan xilosa sebagai produk utama dan sejumlah
xilooligosakarida rantai pendek.
Endoxilanase mampu memutus ikatan -1,4 pada bagian dalam rantai xilan secara teratur (Richana 2002). Xilanase dihasilkan oleh berbagai mikrob seperti cendawan dan bakteri (Beg et al. 2001). Salah satu bakteri penghasil xilanase yang potensial yaitu
Streptomyces (Ruiz-arribas et al. 1995) dari
kelompok Aktinomiset (Rahman et al.
2003).
Aplikasi xilanase semakin
berkembang dalam bidang industri. Pada industri pulp dan kertas, xilanase digunakan untuk mengurangi penggunaan bahan kimia pemutih kertas (Ruiz-arribas et al. 1995). Pada industri makanan, kombinasi xilanase dengan selulase dan pektinase digunakan untuk menjernihkan jus (Beg et al. 2001).
Xilanase juga digunakan untuk
menghidrolisis xilan menjadi gula xilosa yang banyak digunakan penderita diabetes
(Kulkarni et al. 1999) dan xilooligosakarida
sebagai dietary fiber (Yoon et al. 2005). Xilooligosakarida adalah oligomer-oligomer gula dari unit xilosa dengan derajat
polimerisasi 2 hingga 20 (Vazquez et al.
2001). Produksi xilooligosakarida dari xilan biasanya dilakukan dengan hidrolisis secara
enzimatik (Yang et al. 2005). Produk
hidrolisis xilan ini telah banyak
dikembangkan sebagai zat pemanis atau zat
aditif pada makanan (Chen et al. 1997),
sebagai komponen-komponen prebiotik
(Vazquez et al. 2001, Yang et al. 2004),
penstimulasi metabolisme Bifidobacteria
sebagai flora normal sistem pencernaan
manusia (Yang et al. 2005), dan dietary
fiber (Vazquez et al. 2001).
adalah 50 0C, sedangkan xilanase isolat
234P-16 adalah 90 0C (Hendarwin 2005).
Tujuan
Penelitian ini bertujuan memproduksi xilooligosakarida dari xilan tongkol jagung varietas Hawaii menggunakan xilanase
Streptomyces sp. asal Indonesia yaitu isolat, 234P-16, SKK1-8, dan 45I-3.
Waktu dan Tempat
Penelitian ini dilaksanakan mulai bulan November 2005 sampai dengan Juni 2006 di Laboratorium Pengawasan Mutu,
Laboratorium Teknologi Kimia,
Laboratorium Bioindustri Departemen
Teknologi Industri Pertanian FATETA IPB,
serta Laboratorium Mikrobiologi
Departemen Biologi FMIPA IPB.
BAHAN DAN METODE
Bahan dan Alat
Bahan yang digunakan ialah tongkol jagung manis varietas Hawaii, tiga isolat
Streptomyces sp. (234P-16 asal Padang, SKK1-8 asal Sukabumi, dan 451-3 asal Kalimantan yang merupakan koleksi isolat Dr. Ir. Yulin Lestari). Bahan kimia yang digunakan yaitu larutan NaOCl 1%, NaOH 15%, HCl 95%, etanol 95%, media
pertumbuhan bakteri, media produksi
xilanase (Lampiran 1), dan pelarut serta
bahan visualisasi Thin Layer
Chromatography.
Alat-alat yang digunakan berupa hammer mill dengan saringan 40 mesh,
oven, inkubator bergoyang (Eberbach,
USA), sentrifuse (Jouan, Perancis),
spektrofotometer (Spectronic 20, USA),
Thin Layer Chromatography silika gel (plate
60 F254 (Merck, Darmstadt, Germany), dan
peralatan laboratorium lainnya.
Metode
Penyiapan Bahan
Tongkol jagung dipotong kecil hingga berukuran 2 x 2 cm dan dikeringkan di bawah sinar matahari selama tujuh hari. Selanjutnya tongkol jagung tersebut digiling hingga menjadi tepung berukuran 40 mesh dan dilakukan analisis komposisi kimia yang meliputi kadar air, abu, protein, lemak, serta komponen serat kasar (lignin, selulosa, dan hemiselulosa) (Lampiran 2).
Ekstraksi Xilan
Tepung tongkol jagung direndam dalam larutan NaOCl 1% selama 5 jam pada suhu ruang, kemudian tepung tongkol
jagung dibilas dengan akuades dan disaring untuk diambil bagian padatannya, yaitu tongkol jagung yang terdelignifikasi, yang kemudian dikeringkan dalam oven pada
suhu 50 0C selama 48 jam. Selanjutnya
dianalisis komposisi kimia yang meliputi kadar air, kadar lignin, dan bobot kering hemiselulosa-selulosa.
Padatan yang diperoleh dari proses delignifikasi direndam dalam larutan NaOH 15% selama 24 jam pada suhu ruang, kemudian disaring. Filtrat yang mengandung xilan diukur pH-nya lalu diasamkan dengan menggunakan HCl hingga pH 4.5-5.0 kemudian disentrifugasi selama 30 menit
dengan kecepatan 4000 rpm pada suhu 4 0C.
Endapan yang mengandung xilan
diendapkan dengan penambahan etanol 95% kemudian disentrifugasi selama 30 menit
dengan kecepatan 4000 rpm pada suhu 4 0C
untuk memperoleh xilan.
Selanjutnya dilakukan pemurnian
dengan purifikasi. Xilan dibilas dengan akuades kemudian disentrifugasi kembali
dengan kecepatan 6000 rpm pada suhu 4 0C
selama 30 menit. Endapan yang diperoleh dilarutkan dalam NaOH 4% kemudian disentrifugasi dengan kecepatan 4000 rpm pada suhu 4 0C selama 30 menit. Filtrat diasamkan kembali dengan HCl 6 N hingga pH 4.5-5.0 kemudian disentrifugasi dengan kecepatan 4000 rpm pada suhu 4 0C selama 30 menit untuk memperoleh endapan yang merupakan xilan murni. Xilan kemudian dikeringkan dan diayak hingga berukuran 80 mesh.
Peremajaan Isolat dan Penyiapan
Inokulum
Ketiga isolat Streptomyces sp.
diremajakan dalam media agar-agar xilan
oatspelt (Lampiran 1) selama 5 hari pada suhu ruang hingga siap digunakan sebagai inokulum.
Penentuan Waktu Produksi Optimum dan Aktivitas Xilanase Harian
Sebanyak dua inokulum Streptomyces
dengan diameter masing-masing 1 cm yang
diambil dengan menggunakan cockborer
diinokulasikan ke dalam media produksi (Lampiran 1) pada Erlenmeyer 500 ml, diinkubasi dengan agitasi 140 rpm selama 10-12 hari pada suhu ruang.
diukur aktivitasnya pada pH dan suhu optimum masing-masing enzim ketiga isolat (Hendarwin 2005) sehingga didapatkan waktu produksi enzim optimum.
Aktivitas xilanase diukur sebagai pembentukan gula pereduksi (Lampiran 3)
dengan menggunakan metode DNS
berdasarkan Miller (1959) dengan standar xilosa 0.15-0.75 mg/ml (Lampiran 4). Satu unit aktivitas xilanase didefinisikan sebagai jumlah enzim yang menghasilkan 1 µmol xilosa dalam waktu 1 menit.
Pengaruh Konsentrasi Xilan Tongkol Jagung terhadap Aktivitas Xilanase
Sebanyak dua inokulumisolat dengan
diameter masing-masing 1 cm yang diambil
dengan menggunakan cockborer
diinokulasikan ke dalam 100 ml media produksi xilan tongkol jagung masing-masing dengan konsentrasi 0.5%, 1.0%,
1.5% xilan tongkol jagung dalam
Erlenmeyer 500 ml, diinkubasi dengan agitasi 140 rpm selama 10-12 hari pada suhu ruang. Pengukuran aktivitas xilanase dilakukan pada kondisi pH dan suhu
optimum dengan substrat xilan oatspelt.
Hidrolisis Xilan menggunakan Xilanase
Xilan oatspelt dan xilan tongkol
jagung dihidrolisis dengan xilanase ekstrak kasar dari masing-masing isolat. Xilanase ekstrak kasar ini diperoleh dari isolat yang ditumbuhkan pada media produksi xilan
oatspelt dan xilan tongkol jagung hingga hari produksi optimum xilanase. Inkubasi dilakukan pada pH dan suhu optimum. Sebanyak 1 ml sampel hasil hidrolisis xilanase tiap jam selama 5 jam dari substrat 0.5% xilan oatspelt, 0.5% xilan tongkol jagung, 1% xilan tongkol jagung, dan 1.5% xilan tongkol jagung diambil dan diamati peningkatan gula pereduksi dengan metode DNS (Miller 1959), sedangkan kandungan total gula diukur dengan metode fenol asam
sulfat (Apriyantono et al. 1989)
menggunakan xilosa sebagai standar
(Lampiran 5). Derajat polimerasi dihitung berdasarkan perbandingan antara total gula dengan gula pereduksi yang dihasilkan.
Analisis Produk Hidrolisis Xilanase
dengan Thin Layer Chromatography
(TLC)
Sebanyak 2 µl sampel hasil hidrolisis diteteskan di atas lempeng TLC, kemudian dicelupkan dalam larutan etil asetat dan 65% isopropanol (2 :8 v/v) sebagai pelarut (Stahl
1969). Visualisasi spot dilakukan dengan
menggunakan larutan yang terdiri atas
0.5 ml anisaldehida, 5 ml H2SO4, dan 90 ml
etanol 95% (Stahl 1969). Sebagai standar digunakan xilosa, arabinosa, manosa, dan glukosa.
HASIL
Komposisi Kimia Tongkol Jagung
Dari hasil analisis yang telah
dilakukan, tongkol jagung varietas Hawaii mengandung 7.04% air (b.b), 1.67% abu (b.k), 1.82% protein (b.k), 4.68% lemak (b.k), 40.65% serat kasar (b.k), dan 44.14%
karbohidrat (by difference) (b.k). Komposisi
serat tongkol jagung sebelum delignifikasi yaitu lignin sebesar 16.14% (b.k), selulosa 60.04% (b.k), dan hemiselulosa 18.11% (b.k)
Ekstraksi Xilan
Perolehan tepung tongkol jagung setelah delignifikasi yaitu sebesar 81% dengan kadar lignin sebesar 15.2% (b.k), selulosa 41.88% (b.k), dan hemiselulosa 30.18% (b.k). Secara fisik, perubahan warna terlihat. Mula-mula dengan penambahan larutan NaOCl 1% tepung berwarna kuning. Semakin lama perendaman, warna kuning menjadi semakin tua hingga akhirnya menjadi coklat muda.
Selama proses ekstraksi dalam larutan NaOH 15% selama 24 jam, tepung berwarna coklat tua kehitaman. Filtrat NaOH yang mengandung ekstrak xilan setelah diasamkan dengan HCl hingga pH 4.5-5 menghasilkan cairan kental berwarna coklat susu. Selama pengeringan, xilan basah yang semula berwarna coklat susu semakin lama semakin tua warnanya. Endapan xilan yang diperoleh berwarna kuning agak kecoklatan. Setelah dihaluskan, tepung xilan menjadi berwarna putih kekuningan. Secara keseluruhan rendemen xilan yang diperoleh yaitu sebanyak 7.5% dari tepung tongkol jagung.
Penentuan Waktu Optimum Produksi dan Aktivitas Xilanase Harian
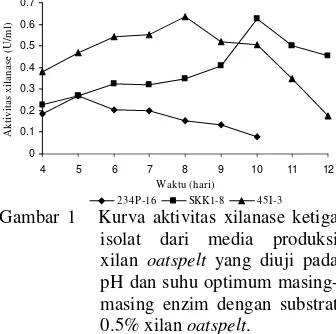
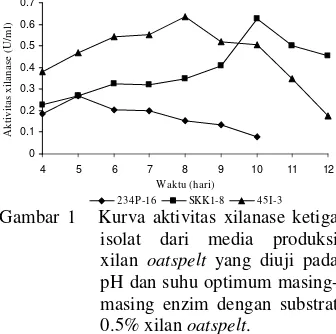
Produksi xilanase pada substrat xilan
oatspelt oleh ketiga isolat mencapai optimum masing-masing pada saat umur biakan mencapai hari ke-5 dengan aktivitas
0.27 U/ml (234P-16), hari ke-10 dengan
aktivitas 0.625U/ml (SKK1-8), dan hari
ke-8 dengan aktivitas 0.634 U/ml (45I-3)
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7
4 5 6 7 8 9 10 11 12
Waktu (hari) A k ti v it a s x il a n a se ( U /m l)
234P-16 SKK1-8 45I-3 Gambar 1 Kurva aktivitas xilanase ketiga
isolat dari media produksi xilan oatspelt yang diuji pada pH dan suhu optimum masing-masing enzim dengan substrat 0.5% xilan oatspelt.
Xilanase ketiga isolat pada media
produksi xilan oatspelt menunjukkan
aktivitas yang lebih tinggi pada substrat
xilan oatspelt dibandingkan pada substrat
xilan tongkol jagung (Gambar 2).
Gambar 2 Perbandingan aktivitas xilanase ketiga isolat pada konsentrasi 0.5% substrat xilan yang berbeda
Pengaruh Konsentrasi Xilan Tongkol Jagung terhadap Aktivitas Xilanase
Isolat 234P-16 mencapai aktivitas optimum yaitu pada saat umur biakan mencapai hari ke-5 dengan aktivitas 0.123 U/ml pada konsentrasi 0.5% xilan tongkol
jagung, aktivitas 0.947 U/ml pada
konsentrasi 1.0% xilan tongkol jagung, serta aktivitas 0.297 U/ml pada konsentrasi 1.5% xilan tongkol jagung (Gambar 3, Lampiran 6).
Gambar 3 Pengaruh konsentrasi xilan
tongkol jagung (0.5%, 1%, dan 1.5%) terhadap aktivitas xilanase isolat 234P-16
Isolat SKK1-8 mencapai optimum yaitu pada saat umur biakan mencapai hari
ke-10 dengan aktivitas 2.879 U/ml (0.5%),
5.478 U/ml (1%), dan 3.588 U/ml (1.5%) (Gambar 4, Lampiran 7).
0 1 2 3 4 5 6
4 5 6 7 8 9 10 11 12
Hari ke-A k ti v it a s (U /m l)
0.50% 1.00% 1.5%
Gambar 4 Pengaruh konsentrasi xilan
tongkol jagung (0.5%, 1%, dan 1.5%) terhadap aktivitas xilanase isolat SKK1-8
Isolat 45I-3 mencapai optimum yaitu pada saat umur biakan mencapai hari ke-8 dengan aktivitas 11.14 U/ml (0.5%), 11.47 U/ml (1.0%), dan 10.94 U/ml (1.5%) (Gambar 5, Lampiran 8).
0 2 4 6 8 10 12
4 5 6 7 8 9 10 11 12
Hari ke-A k ti v it as ( U /m l)
0.50% 1.00% 1.50%
Gambar 5 Pengaruh konsentrasi xilan
tongkol jagung (0.5%, 1%, dan 1.5%) terhadap aktivitas xilanase isolat 45I-3 0 0.2 0.4 0.6 0.8 1
4 5 6 7 8 9 10
Hari ke-A k ti v it a s (U /m l)
0.50% 1.00% 1.50%
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7
isolat 234P-16 isolat SKK1-8 isolat 45I-3
Jenis Substrat Xilan
A k ti v it as X il an as e (U /m l)
Oatspelt Xilan jagung
Aktivitas xilanase pada ketiga konsentrasi xilan tongkol jagung dicapai pada umur biakan yang sama untuk masing-masing isolat, namun berbeda tingkat aktivitasnya. Pada konsentrasi 1% substrat dari xilan tongkol jagung, aktivitas xilanase ketiga isolat (Gambar 3,4,5) lebih tinggi dibandingkan pada konsentrasi 0.5% dan 1.5%.
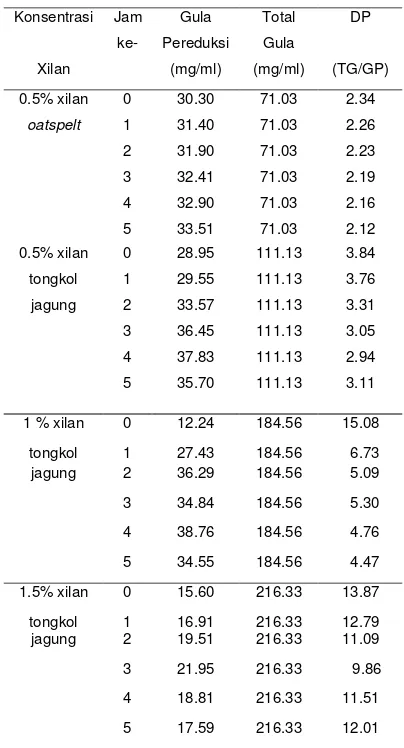
Perubahan Derajat Polimerasi (DP) pada Produk Hasil Hidrolisis Xilanase
Xilanase ketiga isolat
memperlihatkan kenaikan kadar gula
pereduksi selama perlakuan inkubasi di suhu optimumnya hingga 5 jam masa inkubasi
baik pada media xilan oatspelt maupun pada
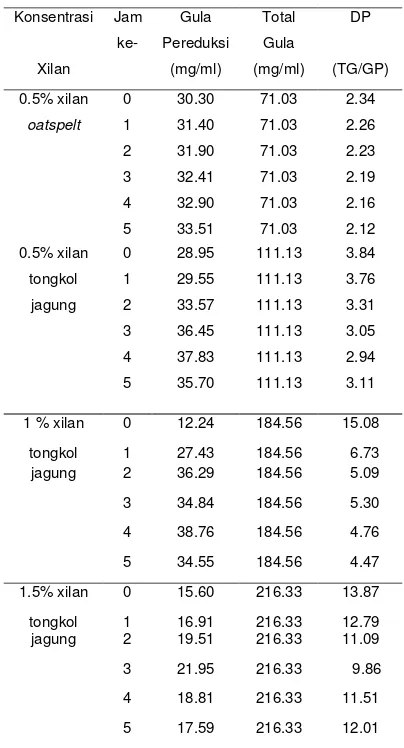
media xilan tongkol jagung (Tabel 1, 2, 3). Derajat polimerasi sampel hasil hidrolisis xilanase dari substrat xilan tongkol jagung lebih besar dibandingkan substrat
xilan oatspelt pada konsentrasi substrat yang
sama untuk isolat 234P-16 dan SKK1-8 (Tabel 1,2).
Tabel 1 Perubahan derajat polimerasi pada produk hasil hidrolisis xilanase isolat 234P-16
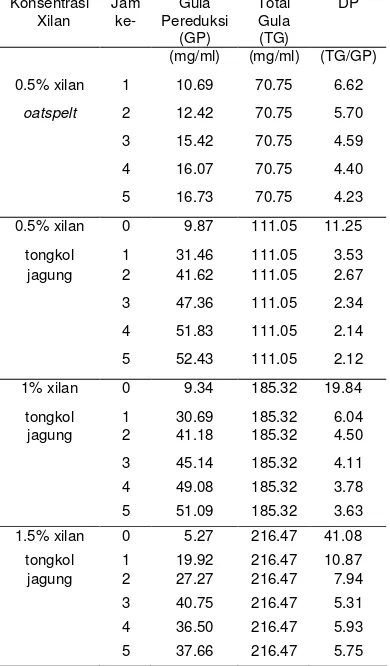
Tabel 2 Perubahan derajat polimerasi pada produk hasil hidrolisis xilanase isolat SKK1-8
Konsentrasi Jam
ke- Gula Pereduksi Total Gula DP
Xilan (mg/ml) (mg/ml) (TG/GP)
0.5% xilan 0 30.30 71.03 2.34
oatspelt 1 31.40 71.03 2.26
2 31.90 71.03 2.23
3 32.41 71.03 2.19
4 32.90 71.03 2.16
5 33.51 71.03 2.12
Konsentrasi Xilan Jam ke- Gula Pereduksi (GP) Total Gula (TG) DP
(mg/ml) (mg/ml) (TG/GP)
0.5% xilan 0 1.52 71.04 46.74
oatspelt 1 2.25 71.04 31.57
2 3.11 71.04 22.92
3 3.35 71.04 21.21
4 3.44 71.04 20.65
5 3.51 71.04 20.24
0.5% xilan 0 1.28 111.46 87.08
tongkol 1 1.72 111.46 64.80
jagung 2 1.86 111.46 59.92
3 1.74 111.46 64.06
4 1.34 111.46 83.18
5 1.34 111.46 83.18
1% xilan 0 2.05 184.79 90.14
tongkol 1 2.91 184.79 63.51
jagung 2 3.40 184.79 54.35
3 4.28 184.79 43.18
4 4.81 184.79 38.42
5 5.09 184.79 36.31
1.5% xilan 0 0.80 216.14 270.18
tongkol 1 1.49 216.14 145.06
jagung 2 1.61 216.14 134.25
3 2.36 216.14 91.58
4 2.58 216.14 83.78
5 2.95 216.14 73.27
1 % xilan 0 12.24 184.56 15.08
tongkol 1 27.43 184.56 6.73
jagung 2 36.29 184.56 5.09
3 34.84 184.56 5.30
4 38.76 184.56 4.76
5 34.55 184.56 4.47
1.5% xilan 0 15.60 216.33 13.87
tongkol 1 16.91 216.33 12.79
jagung 2 19.51 216.33 11.09
3 21.95 216.33 9.86
4 18.81 216.33 11.51
5 17.59 216.33 12.01
0.5% xilan 0 28.95 111.13 3.84
tongkol 1 29.55 111.13 3.76
jagung 2 33.57 111.13 3.31
3 36.45 111.13 3.05
4 37.83 111.13 2.94
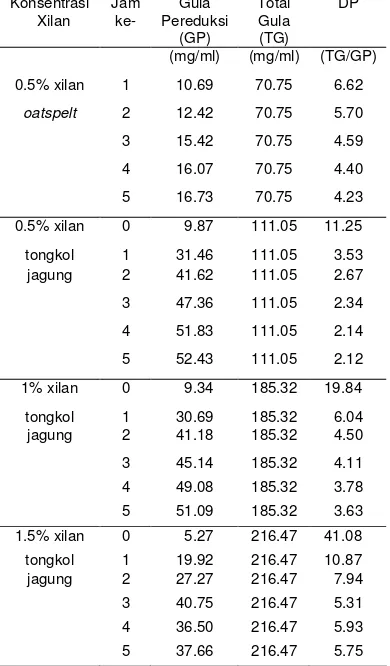
Tabel 3 Perubahan derajat polimerasi pada produk hasil hidrolisis xilanase isolat 45I-3
Analisis Produk Hidrolisis Xilan dengan Thin Layer Chromatography
Hasil Thin Layer Chromatography
(Lampiran 9, 10, 11) memperlihatkan bahwa nilai retention factor (Rf) sampel hidrolisis
baik dengan menggunakan xilan oatspelt
maupun xilan tongkol jagung tidak berbeda jauh. Namun berdasarkan gambaran dan
nilai Rf hasil Thin Layer Chromatography
memperlihatkan bahwa sampel hasil
hidrolisis berada di antara xilosa dan glukosa sebagai standar.
PEMBAHASAN
Xilan dari tongkol jagung diperoleh melalui tahapan delignifikasi, ekstraksi, dan purifikasi.
Delignifikasi merupakan proses
penghilangan lignin sebelum proses
ekstraksi sehingga hanya komponen xilan saja yang terdapat di dalam bahan. Prinsip
dari perlakuan ini adalah pemecahan ikatan kovalen antara lignin dengan karbohidrat melalui pelarutan lignin dalam pelarut yang sesuai, yang dalam hal ini NaOCl 1%. NaOCl merupakan oksidator kuat yang mengandung ion-ion hipoklorit yang mampu memecah ikatan karbon dalam struktur lignin (Lehninger 1982, Girindra 1993). Perendaman tongkol jagung dalam larutan
NaOCl 1% selama 5 jam pada suhu 28 0C
mampu menurunkan kandungan lignin bahan sebesar 0.94% (derajat delignifikasi 5.28%). Proses delignifikasi tidak dapat menghilangkan lignin secara keseluruhan. Hal ini disebabkan karena lignin terikat secara kovalen baik pada selulosa maupun hemiselulosa (Agustine 2005). Delignifikasi
berlangsung pada suhu 28 0C dikarenakan
sifat hemiselulosa yang tidak tahan panas. Kadar selulosa setelah delignifikasi diketahui menjadi rendah dibandingkan sebelum delignifikasi yaitu dari 60.04% menjadi 41.88%. Hal tersebut disebabkan karena mikrofibril selulosa dalam suatu matriks hidrofobik dibungkus secara fisik (Agustine 2005) sehingga menyebabkan selulosa ikut terlarut bersama lignin yang
hilang. Kadar hemiselulosa setelah
delignifikasi menjadi meningkat dari
18.11% menjadi 30.18%. Hal ini
disebabkan karena selama proses
delignifikasi, terjadi pula pelarutan
komponen-komponen lain selain
hemiselulosa oleh larutan NaOCl. Xilan ikut larut juga dalam pelarut namun jumlahnya lebih sedikit daripada selulosa, karena xilan relatif tahan pada kondisi
delignifikasi menggunakan NaOCl
(Anggraini 2003). Xilan merupakan komponen utama dari hemiselulosa sehingga karena xilan yang ikut hilang bersama terlarutnya lignin sedikit menyebabkan presentase hemiselulosa setelah delignifikasi meningkat (Pratiwi 2006).
Tahapan selanjutnya adalah pelarutan hemiselulosa dengan menggunakan pelarut alkali yaitu NaOH 15% (Widyani 2002). Selama proses ekstraksi, terjadi pemutusan
ikatan karbon yang terdapat pada
hemiselulosa. Akan tetapi pada
kenyataannya, komponen selulosa juga ada yang ikut larut bersama hemiselulosa. Secara umum dapat dikatakan bahwa hasil yang diperoleh dari ekstraksi dalam NaOH ini masih berupa campuran dari tipe hemiselulosa yang berbeda seperti mannan atau glikan yang berbobot molekul tinggi dan sebagian material lain ikut terendapkan
Konsentrasi Xilan Jam ke- Gula Pereduksi (GP) Total Gula (TG) DP
(mg/ml) (mg/ml) (TG/GP)
0.5% xilan 1 10.69 70.75 6.62
oatspelt 2 12.42 70.75 5.70
3 15.42 70.75 4.59
4 16.07 70.75 4.40
5 16.73 70.75 4.23
0.5% xilan 0 9.87 111.05 11.25
tongkol 1 31.46 111.05 3.53
jagung 2 41.62 111.05 2.67
3 47.36 111.05 2.34
4 51.83 111.05 2.14
5 52.43 111.05 2.12
1% xilan 0 9.34 185.32 19.84
tongkol 1 30.69 185.32 6.04
jagung 2 41.18 185.32 4.50
3 45.14 185.32 4.11
4 49.08 185.32 3.78
5 51.09 185.32 3.63
1.5% xilan 0 5.27 216.47 41.08
tongkol 1 19.92 216.47 10.87
jagung 2 27.27 216.47 7.94
3 40.75 216.47 5.31
4 36.50 216.47 5.93
5 37.66 216.47 5.75
sehingga dapat mengkontaminasi xilan. Oleh karena itu, masih harus dilakukan pemurnian untuk memperoleh fraksi yang homogen (Anggraini 2003). Filtrat NaOH
yang mengandung xilan kemudian
diasamkan dengan HCl hingga pH 4.5-5.0. Metode asidifikasi ini dilakukan berdasarkan sifat xilan yang tidak larut dalam larutan asam (Vazquez et al. 2001, Yang et al. 2004). Endapan xilan dipisahkan dengan menambahkan etanol 95%. Bobot kering xilan yang diperoleh sebanyak 7.5% dari keseluruhan bahan. Hal ini sesuai dengan
yang dilaporkan oleh Beg et al. (2001),
Subramaniyan & Prema (2002), dan Wang
et al. (2003) yaitu bahwa kandungan xilan
yang terdapat pada kayu lunak (softwood)
seperti tongkol jagung sekitar 7-12% bobot kering kayu.
Enzim memiliki spesifitas yang
amat tinggi terhadap substratnya.
Penggunaan media yang berbeda dapat menyebabkan perbedaaan produksi enzim.
Perbedaan tersebut mempengaruhi
pertumbuhan mikrob (White 1995, Agustine
2005, Rawashdeh et al. 2005). Sistem
enzim xilanolitik memperlihatkan bahwa biasanya lebih dari satu xilanase diproduksi oleh masing-masing mikrob. Sistem multienzim tersebut memperkirakan bahwa beberapa xilanase mungkin memiliki fungsi khusus untuk menunjukkan efektivitas dari hidrolisis xilan (Ruiz-arribas et al. 1995).
Xilan dari tongkol jagung dapat
digunakan sebagai media penginduksi
xilanase karena xilanase dapat diinduksi oleh media yang mengandung residu xilan atau xilan murni, xilooligosakarida, xilosa, dan residu lignoselulosa (Beg et al. 2001). Limbah berserat dapat pula menginduksi xilanase (Irawadi 1991).
Struktur kimia xilan sangat bervariasi sesuai jenis tumbuhan dan hal tersebut sesuai dengan bervariasinya xilanase yang diproduksi masing-masing isolat (Li et al. 1993). Hasil penelitian menunjukkan bahwa ketiga isolat memiliki kurva produksi xilanase yang berbeda-beda dan perbedaan aktivitas xilanase pada substrat xilan dengan
menggunakan xilan oatspelt dan xilan
tongkol jagung. Aktivitas xilanase pada ketiga konsentrasi xilan tongkol jagung dicapai pada umur biakan yang sama untuk
masing-masing isolat, namun berbeda
tingkat aktivitasnya (Lampiran 6, 7, 8). Aktivitas xilanase isolat SKK1-8 (Gambar 1,4) dan 45I-3 (Gambar 1,5) lebih tinggi
pada substrat xilan tongkol jagung
dibandingkan pada xilan oatspelt pada
konsentrasi xilan yang sama, sedangkan aktivitas xilanase isolat 234P-16 lebih tinggi
pada substrat xilan oatspelt dibandingkan
pada xilan tongkol jagung pada konsentrasi xilan yang sama (Gambar 1, 3). Hal ini disebabkan karena terdapat keragaman fisiologi diantara ketiga isolat dalam memanfaatkan xilan sebagai sumber karbon. Pada konsentrasi 1% substrat dari xilan tongkol jagung, aktivitas xilanase ketiga isolat (Gambar 3,4,5) lebih tinggi dibandingkan pada konsentrasi 0.5% dan 1.5%. Penurunan aktivitas pada konsentrasi substrat 1.5 % terjadi karena meningkatnya
kepekatan media yang menghambat
interaksi enzim-substrat, disamping terjadi alih fungsi substrat dimana substrat yang berlebih dapat menjadi inhibitor bagi kerja enzim (Lehninger 1989, Irawadi 1999). Produksi xilanase juga dapat turun karena adanya akumulasi gula terlarut pada media kultur. Akumulasi pentosa bersama dengan
turunnya aktivitas xilanase selama
pertumbuhan pada konsentrasi media xilan yang semakin meningkat menunjukkan bahwa konsentrasi gula-gula mempengaruhi regulasi enzim (Mountfort & Asher 1989).
Peningkatan gula pereduksi ketiga isolat terjadi selama lima jam masa inkubasi xilanase pada suhu optimumnya. Selama lima jam masa inkubasi, xilanase ketiga isolat mampu menghidrolisis xilan menjadi fraksi-fraksi penyusunnya. Xilan mudah
dihidrolisis karena struktur xilan yang amorf
sehingga lebih mudah dihidrolisis oleh enzim.
Besarnya jumlah gula selama
perlakuan lima jam masa inkubasi dapat diketahui dengan metode penentuan total gula. Total gula dapat berupa oligosakarida (dalam hal ini xilooligosakarida) maupun monosakarida. Total gula ditetapkan berdasarkan metode fenol dengan prinsip
bahwa gula sederhana, oligosakarida,
polisakarida, dan turunannya dapat bereaksi dengan fenol dalam asam sulfat pekat menghasilkan warna oranye yang stabil (Apriyantono et al. 1989).
Tingginya nilai gula total yang
dihasilkan, sementara nilai gula
pereduksinya rendah menunjukkan bahwa produk hasil hidrolisis masih berupa oligosakarida. Hal ini dapat dilihat dari nilai derajat polimerasi xilan isolat 234P-16 pada
media xilan oatspelt maupun xilan tongkol
Produk hidrolisis xilan oleh xilanase juga dapat diketahui dengan melihat nilai derajat polimerasinya. Derajat polimerasi
(DP) merupakan suatu nilai yang
menunjukkan seberapa besar rantai polimer yang menyusun monomernya. Nilai Derajat polimerasi xilan dari tongkol jagung (kayu
lunak) berkisar antara 70-130 (Kulkarni et
al. 1999, Beg et al. 2001). Dengan semakin
meningkatnya nilai gula pereduksi, nilai derajat polimerasi semakin turun. Nilai DP yang turun menunjukkan bahwa semakin banyak polisakarida yang terdepolimerisasi menjadi senyawa-senyawa dengan rantai yang lebih pendek dari polisakaridanya. Nilai DP dengan menggunakan xilanase isolat SKK1-8 dan 45I-3 lebih kecil daripada isolat 234P-16. Xilanase isolat 45I-3 dan SKK1-8 lebih mampu menghidrolisis xilan menjadi xilooligosakarida rantai pendek (Tabel 2, 3).
Setelah lima jam masa inkubasi, produk hidrolisis berupa xilooligosakarida rantai panjang dihasilkan oleh isolat 234P-16 dengan nilai DP antara 20.24 hingga 83.13 pada media xilan oatspelt dan media xilan tongkol jagung. Besarnya nilai DP xilooligosakarida rantai panjang yaitu 20, sedangkan DP xilooligosakarida rantai
pendek seperti xilobiosa, xilotriosa,
xilotetraosa, dan xilopentosa berkisar antara
2-20 (Chen et al. 1997, Vazquez et al.
2001).
Produk hidrolisis xilan oleh xilanase juga dapat diketahui secara kualitatif dengan
Thin Layer Chromatography (TLC). Berdasarkan gambaran dan nilai Rf hasil TLC (Lampiran 9,10,11) memperlihatkan bahwa sampel berada di antara xilosa dan
xilan sebagai standar, yang dapat
memungkinkan sampel-sampel tersebut
merupakan xilooligosakarida. Semua
gambar sampel pada plate menunjukkan bahwa hasil hidrolisis yang terbentuk dapat berupa manosa, glukosa, arabinosa, dan xilooligosakarida. Residu yang dekat dengan spot xilan menunjukkan bahwa bobot molekul pada sampel masih berat, sehingga dapat dikatakan bahwa produk
hidrolisis tersebut adalah senyawa
oligosakarida. Gambar hasil TLC tersebut
menunjukkan kesesuaian dengan nilai
kisaran DP masing-masing isolat. DP yang dihasilkan oleh isolat 234P-16 (83.13-20.24) dan SKK1-8 (12.01-2.12), dan 45I-3 (5.75-2.12) menunjukkan bahwa gambar hasil TLC isolat 234P-16 memiliki rata-rata Rf=0.74 yang lebih rendah dibandingkan
rata Rf oleh isolat SKK1-8 yaitu rata-rata Rf=0.77 dan rata-rata-rata-rata Rf oleh isolat 45I-3 yaitu rata-rata Rf=0.78. Semakin besar nilai DP berarti xilan yang terdegradasi lebih sedikit yang memungkinkan bobot molekul pada sampel tersebut masih berat sehingga menghasilkan nilai Rf yang kecil. Dari hasil TLC (Lampiran 9, 10, 11), dapat dilihat bahwa spot sampel hasil hidrolisis xilan dari
tongkol jagung (sampel 6-11) lebih
mengembang dibandingkan dengan spot hidrolisis dari xilan oatspelt (sampel 0-5).
Hal ini menunjukkan bahwa xilan oatspelt
lebih seragam dibandingkan dengan xilan dari tongkol jagung (Pratiwi 2006).
Hidrolisis xilan oleh xilanase
merupakan hasil kerjasama sistem enzim xilanolitik. Aktivitas endo- -1,4-xilanase
bekerja aktif mendepolimerisasi xilan
melalui hidrolisis secara acak ikatan tulang punggung -1,4 pada bagian dalam rantai
xilan menjadi xilooligosakarida (Kluepfel et
al. 1991, Haki & Rakshit 2003). Xilanase
isolat 234P-16 memiliki aktivitas
eksoxilanase pada substrat xilan tongkol jagung sehingga dapat menghidrolisis xilan menghasilkan sejumlah xilosa. Xilanase yang dihasilkan oleh isolat SKK1-8 dan 45I-3 memiliki aktivitas endo- -1,4-xilanase pada substrat xilan tongkol jagung sehingga
dapat menghidrolisis xilan menjadi
xilooligosakarida rantai pendek. Hasil
hidrolisis oleh xilanase endohidrolitik adalah
dengan terdapatnya xilooligosakarida.
SIMPULAN
Ketiga isolat Streptomyces sp. yaitu 45I-3, SKK1-8, dan 234P-16 mampu
tumbuh dan menghasilkan xilanase
ekstraseluler pada media xilan tongkol jagung. Aktivitas xilanase isolat 45I-3 dan
SKK1-8 lebih tinggi diinduksi pada
konsentrasi substrat 1% dibandingkan pada konsentrasi substrat 0.5% dan 1.5% media xilan tongkol jagung.
Xilanase yang dimiliki ketiga isolat ini mampu menghidrolisis xilan menjadi fraksi-fraksi penyusun xilan diantaranya
xilooligosakarida rantai pendek dan
xilooligosakarida rantai panjang.
Xilooligosakarida rantai pendek dihasilkan oleh isolat 45I-3 dan SKK1-8, sedangkan xilooligosakarida rantai panjang dihasilkan oleh isolat 234P-16.
SARAN
Xilan dari tongkol jagung merupakan substrat alternatif yang dapat digunakan
untuk menghasilkan xilooligosakarida.
Diperlukan penelitian selanjutnya mengenai teknik pemisahan produk-produk hasil hidrolisis xilanase Streptomyces sp.
DAFTAR PUSTAKA
Agustina SW. 2002. Penetapan Kadar
Xilan Dari Beberapa Limbah Industri Pertanian dengan Menggunakan Metode Kromatografi Cair Kinerja Tinggi [Skripsi]. Jakarta: Fakultas Farmasi Universitas Pancasila.
Agustine W. 2005. Penentuan Kondisi
Optimum Pertumbuhan dan Produksi Xilanase Isolat AQ [Skripsi]. Bogor:
Fakultas Matematika dan Ilmu
Pengetahuan Alam, Institut Pertanian Bogor.
Anggraini F. 2003. Kajian Ekstraksi dan Hidrolisis Xilan dari Tongkol Jagung (Zea mays L.) [Skripsi]. Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Apriyantono A, Fardiaz D, Puspitasari NL, Sedarnawati. 1989. Analisis Pangan. Institut Pertanian Bogor. Bogor. Beg QK, Kapoor M, Mahajan L, Hoondal
GS. 2001. Microbial xylanases and their industrial applications: a review.
Appl Microbiol Biotech 56: 326-338. Chen C, Chen JL, Lin TY. 1997.
Purification and characterization of
xylanase from Trichoderma
longibrachiatum for xilooligosakarida
production. Enzyme Microb Technol
21: 91-96.
Girindra A. 1993. Biokimia I. Jakarta: Gramedia Pustaka Utama.
Haki GD, Rakshit SK. 2003. Developments in industrially important thermostable
enzymes: a review. Bioresource
Technol 89: 17-34.
Hendarwin T. 2005. Keragaman Karakter
Xilanase dari Tiga Isolat Streptomyces Asal Indonesia [Skripsi]. Bogor:
Fakultas Matematika dan Ilmu
Pengetahuan Alam, Institut Pertanian Bogor.
Irawadi, TT. 1999. Kajian hidrolisis enzimatik limbah lignoselulosa dari industri pertanian. Tek Ind Pert 3: 20-25.
Kluepfel D, Daigneault N, Morosoli R, Shareck F. 1991. Purification and characterization of a new xylanase
(xylanase C) produced by Streptomyces
lividans 66. Appl Environ Microbiol
50:626-631.
Kulkarni NA, Shendye, Rao M. 1999. Molecular and biotechnologycal aspect
of xylanases. FEMS Microbiol Rev 23:
411-456.
Lehninger A. 1982. Dasar-Dasar Biokimia.
Volume ke-1. Suhartono MT,
penerjemah; Jakarta: Erlangga.
Terjemahan dari Principles of
Biochemistry.
Li X, Zhang Z, Jeffrey FDD, Karl-Erik LE, Lars GL. 1993. Purification and characterization of a new xylanase
(APX-II) from fungus Aureobasidium
pullulans Y-2311-1. Appl. and Environ Microbiol 59: 3212-3218.
Miller GI. 1959. Dinitrosalisilic assay.
Anal chem 31: 426-428.
Mountfort DO, Asher RA. 1989. Production of xylanase by the ruminal anaerobic fungus Neocallimastix frontalis. Appl. and Environ Microbiol 55:1016-1022.
Pratiwi FMR. 2006. Produksi Xilanase dari
Streptomyces sp. pada Substrat Xilan Tongkol Jagung [Skripsi]. Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Rahman S, Sugitani N, Hatsu M,
Takamizawa K. 2003. A role of xylanase, a-arabinofuranosidase, and xylosidase in xylan degradation. Can J Microbiol 49: 58-64.
Richana N, Lestari P, Thontowi A, Rosminik. 2000. Seleksi isolat bakteri lokal penghasil xilanase. J Microbiol Indones 5: 54-56.
Richana N. 2002. Produksi dan prospek enzim xilanase dalam pengembangan bioindustri di Indonesia. Bul Agrobio 5: 29-36.
Ruiz-Arribas A, Abalos JMF, Shanchez P, Garda AL, Santamaria RJ. 1995.
Overproduction, purification, and
biochemical characterization of a
xylanases (xys1) from Streptomyces
halstedii JM8. Appl Environ Microbiol
61(6): 2414-2419.
Rawashdeh R, Saadoun I, Mahasneh A. 2005. Effect of cultural conditions on
xylanase production by Streptomyces
utilize tomato pomace. Afr J Biotechnol
4(3): 251-256.
Saha BC.2003. Hemicellulose
bioconversion. J Ind Microbiol
Biotechnol 30: 279-291.
Stahl E. 1969. Thin Layer Chromatography.
Second Edition. Springer-verlag. New York.
Subramaniyan S, Prema P. 2002.
Biotechnology of microbial xylanases: enzymology, molecular biology, and
application. Critical Rev in Biotech
22(1): 33-64.
Vazquez MJ, Alonso JL, Dominguez H, Parajo JC. 2001. Xilooligosaccharides:
manufacture and applications. Trends
Food Sci Technol 11: 387-393.
Wang SL, Yen YH, Shih IL, Chang AC. 2003. Production xylanases from rice
bran by Streptomyces actuosus A-151.
Enzyme Microb Technol 33: 917-925.
White D. 1995. The Physiology and
Biochemistry of Prokaryotes. New York: Oxford University.
Widyani, IGA. 2002. Ekstraksi Xilan dari Tongkol Jagung dan Kulit Ari Kedelai
[Skripsi]. Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor. Yang R, Xu S, Wang Z, Yang W. 2005.
Aqueous extraction of corncob xylan and production of xylooligosaccharides.
Swiss Soc Food Sci Technol 38: 677-682.
Yoon KY, Woodams EE, Hang YD. 2005. Enzymatic production of pentoses from hemicellulose fraction of corn residues.
Lampiran 1 Komposisi media agar-agar xilan dan media produksi xilanase (Ruiz-Arribas et al.1995)
Lampiran 2 Prosedur karakterisasi bahan baku 1 Kadar Air (AOAC 1984)
Contoh sebanyak 2 g dimasukkan ke dalam cawan aluminium yang telah diketahui
bobotnya, kemudian dikeringkan di dalam oven bersuhu 100-1050 C sampai bobot konstan.
Setelah itu didinginkan di dalam desikator dan ditimbang.
2 Kadar Abu (AOAC 1984)
Contoh sebanyak 3-5 g dimasukkan ke dalam cawan porselin yang telah diketahui
bobotnya, kemudian diabukan dalam furnace pada suhu 6000 C selama kurang lebih 4 jam atau
sampai diperoleh abu berwarna putih. Setelah itu cawan didinginkan dalam desikator sampai suhu ruang dan ditimbang.
3 Kadar Protein Metode Kjeldahl (Apriyantono et al. 1989)
Sebanyak 0.1-0.5 g sampel dimasukkan ke dalam labu kjeldahl 30 ml dan ditambahkan 1
g CuSO4, 1 g Na2SO4, 2.5 ml H2SO4, dan beberapa butir batu didih. Kemudian, didihkan selama 60-90 menit sampai cairan jernih. Setelah itu didinginkan, dipipet isinya dan dimasukkan ke dalam labu destilasi dan ditambah 15 ml NaOH 50 %, kemudian dibilas dengan air suling. Destilasi dilakukan dengan mencampurkan 25 ml HCI 0.02 N ditambah 2-4 tetes indikator (campuran 2 bagian metal merah 0.2% dalam alkohol dan 1 bagian metal biru 0.02 dalam alkohol) ke dalam labu erlenmeyer 125 ml yang diletakkan di bawah kondensor dengan ujungnya terendam dalam labu larutan HCI. Hasil destilasi diencerkan sampai 25 ml dan dititrasi dengan NaOH 0.02 N sampai berwarna hijau.
Kadar protein = % N x faktor konversi (6.25)
4 Kadar Lemak Metode Ekstraksi Soxhlet (Apriyantono et al. 1989)
Sebanyak ± 5 g sampel yang telah ditepungkan dibungkus dengan kertas saring,
dimasukkan ke dalam labu soxhlet, lalu ditambahkan heksan secukupnya dan direfluks selama 5-6 jam. Kemudian, labu lemak yang berisi lemak hasil ekstraksi dan pelarut dipanaskan pada
oven dengan suhu 1050 C, setelah itu didinginkan dalam desikator dan ditimbang beratnya.
Bahan Media agar-agar xilan oatspelt (% b/v) Media produksi (% b/v)
Ekstrak khamir 1 1
Sukrosa 10.3 10.3
Oatspelt xylan 0.5 0.5
Agar-agar 1.5 -
Akuades 100 100
Bobot awal-bobot akhir
Kadar air = x 100%
Bobot contoh
Bobot abu
Kadar abu = x 100%
Bobot contoh
(ml HCI – ml blanko) x NHCI x 14.007 x 100
Kadar N =
mg sampel
Berat lemak
Kadar lemak = x 100%
Berat sampel
5 Kadar Serat Kasar (AOAC 1980)
Contoh sebanyak 5 g sampel dimasukkan ke dalam erlenmeyer 500 ml kemudian
ditambahkan 100 ml H2SO4 0.325 N dan dididihkan selama kurang lebih 30 menit.
Ditambahkan lagi 50 ml NaOH 1.25 N dan dididihkan selama 30 menit. Dalam keadaan panas disaring dengan kertas Whatman No.40 setelah diketahui bobot keringnya. Kertas saring yang digunakan dicuci berturut-turut dengan air panas, 25 ml H2SO4, dan etanol 95%. Kemudian
dikeringkan di dalam oven bersuhu 100-1100 C sampai bobotnya konstan. Kertas saring
didinginkan dalam desikator dan ditimbang.
6 Kadar Lignin (AOAC 1982)
Sampel sebanyak 1 g ditimbang dalam erlenmeyer 250 ml kemudian ditambahkan
H2SO4 20 ml. Selanjutnya didiamkan selama 2 jam dan dikocok perlahan-lahan. Sampel
kemudian ditambahkan akuades sebanyak 250 ml, dipanaskan dalam waterbath pada suhu 1000
C selama 3 jam. Selanjutnya dilakukan penyaringan dengan menggunakan kertas saring yang telah diketahui bobotnya (A). Erlenmeyer dan corong dibilas dengan akuades sebanyak 3 kali. Kertas saring beserta residu diovenkan pada suhu 1050 C selama 1-2 jam. Kertas saring didinginkan dan ditimbang bobotnya (B). Kertas saring dengan residu diabukan dengan muffle
furnace pada suhu 6000 C selama 3-4 jam. Kemudian didinginkan dan ditimbang (C).
Keterangan :
A = bobot kertas saring dan residu setelah dioven (g) B = bobot kertas saring (g)
C = bobot abu (g)
7 Kadar Hemiselulosa Metode Van Soest (Apriyantono et al. 1989)
Sampel sebanyak A g dan B g masing-masing dimasukkan ke dalam gelas piala
berukuran 500 ml. Sampel A g ditambahkan dengan 50 ml larutan NDS dan sampel B g ditambahkan dengan 50 ml larutan ADS lalu dipanaskan selama 1 jam di atas penangas listrik. Selanjutnya masing-masing sampel tersebut dicuci menggunakan pompa vakum dan gelas G-3 (C g dan D g). Sampel dalam gelas G-3 dikeringkan dengan menggunakan oven, didinginkan dengan eksikator dan ditimbang sebagai E g dan F g.
Kadar hemiselulosa = % NDF - % ADF
8 Kadar Selulosa Metode Van Soest (Apriyantono et al. 1989)
Residu ADF (F g) yang berada pada gelas G-3 diletakkan diatas nampan yang berisi air
setinggi 1 cm kemudian ditambahkan H2SO4 72% setinggi ¼ bagian gelas G-3 dan dibiarkan selama 3 jam sambil diaduk-aduk. Selanjutnya sampel tersebut dicuci menggunakan aseton dan air panas serta disaring menggunakan pompa vakum dan gelas G-3. Sampel dalam gelas G-3 dikeringkan dengan menggunakan oven, didinginkan dengan eksikator dan ditimbang sebagai H g.
Bobot endapan kering
Kadar serat kasar = x 100%
Bobot contoh
B – A - C
Kadar lignin = x 100%
Bobot contoh
E - C
% NDF = x 100%
A F - D
%ADF = x 100%
B
H - F
Kadar selulosa (%) = x 100%
Lampiran 3 Penentuan gula pereduksi metode DNS (Miller 1959)
Komposisi reagen Dinitrosalisilic Acid (DNS)
NaOH …….………. . 10 g KNa Tartrat……….. 182 g
Na2SO3……… .0.5 g
Dinitrosalisilic Acid (DNS)………. 10 g Akuades………... 1000 ml Penentuan Gula Pereduksi
Penentuan gula pereduksi dilakukan dengan menggunakan metode DNS yang melibatkan terukurnya gula pereduksi oleh larutan DNS. Metode DNS tersebut yaitu ekstrak kasar enzim 100 µl ditambahkan substrat 1 ml dan buffer 900 µl. Campuran tersebut dimasukkan ke dalam
waterbath untuk diinkubasi selama 30 menit sesuai suhu optimum xilanase masing-masing isolat.
Setelah itu ditambahkan DNS sebanyak 3 ml, dilanjutkan pemanasan pada suhu 100 0C selama 15
menit. Tahap terakhir yaitu mengukur Optical Density (OD) warna yang dihasilkan akibat
pencampuran gula pereduksi dengan larutan DNS pada spektrofometer dengan = 540 nm.
Pembuatan Kurva Standar untuk Gula Pereduksi dengan Metode DNS
Standar xilosa yang digunakan 0.15-0.75 mg/ml. Larutan stok xilosa dibuat dengan cara melarutkan sebanyak 10 mg xilosa dalam akuades 10 ml sehingga konsentrasinya menjadi 1 mg/ml. Larutan stok xilosa diambil 0 ml, 0.3 ml, 0.5 ml, 0.7 ml, 0.9 ml, 1.1 ml, 1.3 ml, dan 1.5 ml, masing-masing ditempatkan pada tabung reaksi. Masing-masing larutan xilosa yang telah ditempatkan pada tabung reaksi ditambahkan akuades hingga volume larutan xilosa ditambah akuades pada tabung reaksi adalah 2 ml. Pada setiap tabung reaksi kemudian ditambahkan larutan DNS sebanyak 3 ml. Selanjutnya larutan dipanaskan dalam air mendidih selama 15 menit. Setelah dingin, larutan diukur menggunakan spektrofotometer pada = 540 nm.
Lampiran 4 Penentuan aktivitas xilanase
Bahan Jumlah Kontrol Sampel Blanko
Substrat 1 ml Ya Ya Ya
Buffer pH optimum 900 µl Ya Ya -
Enzim 100 µl Ya (setelah DNS) Ya (sebelum DNS) -
DNS 3 ml Ya Ya (setelah inkubasi) Ya
Akuades 1 ml - - Ya
Aktivitas xilanase dihitung dengan rumus : 1 unit Aktivitas xilanase ~ 1µ mol xilosa/menit
Keterangan
Csp : Kadar xilosa sampel
Ckt : Kadar xilosa kontrol
T : Waktu inkubasi (30 menit)
BM Xilosa : 150.13
Lampiran 5 Prosedur analisis total gula metode Fenol-H2SO4 (Apriyantono et al. 1989)
Penentuan Total Gula
Penentuan total gula dilakukan dengan cara mengambil 2 ml sampel hidrolisis dipipet ke
dalam tabung reaksi, ditambahkan 1 ml larutan fenol 5%, dikocok, dan ditambahkan 5 ml H2SO4
pekat. Selanjutnya larutan dibiarkan selama 10 menit, dikocok, dan diukur menggunakan spektrofotometer pada = 490 nm. Nilai absorbansi yang dihasilkan kemudian dimasukkan ke dalam persamaan linear dari kurva standar total gula.
(Csp-Ckt) x f. pengenceran x 1000 Aktivitas xilanase (U/ml) =
T x BM xilosa
Penentuan Kurva Standar Total Gula
Larutan stok diambil 0 ml, 0.2 ml, 0.4 ml, 0.6 ml, 0.8 ml, 1.0 ml, 1.2 ml, dan 1.4 ml, masing-masing ditempatkan pada tabung reaksi. Masing-masing larutan xilosa yang telah ditempatkan pada tabung reaksi ditambahkan akuades hingga volume larutan xilosa ditambah akuades pada tabung reaksi adalah 2 ml. Pada setiap tabung reaksi kemudian ditambahkan 1 ml larutan fenol 5% dan 5 ml H2SO4 pekat. Selanjutnya larutan didiamkan hingga dingin. Setelah dingin, larutan diukur menggunkan spektrofotometer pada = 490 nm.
Lampiran 6 Aktivitas xilanase harian isolat 234P-16
Media Aktivitas Xilanase (U/ml)
Hari ke-
4 5 6 7 8 9 10
0.5% oatspelt 0.19 0.27 0.20 0.20 0.15 0.14 0.08
0.5% xilan tongkol jagung
0.05 0.15 0.12 0.07 0.09 0.09 0.006
1.0% xilan tongkol jagung
0.16 0.95 0.94 0.63 0.23 0.25 0.35
1.5% xilan tongkol jagung
0.15 0.30 0.29 0.23 0.13 0.16 0.15
Lampiran 7 Aktivitas xilanase harian isolat SKK1-8
Media Aktivitas Xilanase (U/ml)
Hari ke-
4 5 6 7 8 9 10 11 12
0.5% oatspelt 0.23 0.27 0.32 0.32 0.35 0.41 0.63 0.50 0.45
0.5% xilan tongkol jagung
0.71 0.84 0.89 0.91 0.83 1.02 2.88 1.00 0.85
1.0% xilan tongkol jagung
2.17 2.45 3.54 3.54 2.23 4.11 5.48 2.05 2.14
1.5% xilan tongkol jagung
0.82 1.19 1.56 1.99 1.08 2.12 3.59 1.96 0.45
Lampiran 8 Aktivitas xilanase harian isolat 45I-3
Media Aktivitas Xilanase (U/ml)
Hari ke-
4 5 6 7 8 9 10 11 12
0.5% oatspelt 3.79 4.67 5.42 5.51 6.34 5.18 5.06 3.45 1.76
0.5% xilan tongkol jagung
1.88 2.98 5.80 9.08 11.14 9.02 5.84 8.54 8.49
1.0% xilan tongkol jagung
2.47 3.89 3.80 10.54 11.47 8.22 3.40 3.78 3.25
1.5% xilan tongkol jagung
Lampiran 9 Hasil TLC sampel hidrolisis isolat 234P-16
Keterangan gambar :
A : standar xilan 0 : sampel xilan o.s jam ke-0 6 : sampel xilan tongkol jagung jam ke-0
B : standar xilosa 1 : sampel xilan o.s jam ke-1 7 : sampel xilan tongkol jagung jam ke-1
C : standar arabinosa 2 : sampel xilan o.s jam ke-2 8 : sampel xilan tongkol jagung jam ke-2
D : standar manosa 3 : sampel xilan o.s jam ke-3 9 : sampel xilan tongkol jagung jam ke-3
E : standar glukosa 4 : sampel xilan o.s jam ke-4 10 : sampel xilan tongkol jagung jam ke-4
5 : sampel xilan o.s jam ke-5 11 : sampel xilan tongkol jagung jam ke-5
o.s : oatspelt
A B C D E 0 1 2 3 4 5 6 7 8 9 10 11
Rf: 0.00 0.78 0.72 0.76 0.73 0.74 0.74 0.75 0.75 0.75 0.75 0.72 0.72 0.73 0.73 0.74 0.74
Lampiran 10 Hasil TLC sampel hidrolisis isolat SKK1-8
Keterangan gambar :
A : standar xilan 0 : sampel xilan o.s jam ke-0 6 : sampel xilan tongkol jagung jam ke-0
B : standar xilosa 1 : sampel xilan o.s jam ke-1 7 : sampel xilan tongkol jagung jam ke-1
C : standar arabinosa 2 : sampel xilan o.s jam ke-2 8 : sampel xilan tongkol jagung jam ke-2
D : standar manosa 3 : sampel xilan o.s jam ke-3 9 : sampel xilan tongkol jagung jam ke-3
E : standar glukosa 4 : sampel xilan o.s jam ke-4 10 : sampel xilan tongkol jagung jam ke-4
5 : sampel xilan o.s jam ke-5 11 : sampel xilan tongkol jagung jam ke-5
o.s : oatspelt
A B C D E 0 1 2 3 4 5 6 7 8 9 10 11
Lampiran 11 Hasil TLC sampel hirolisis isolat 45I-3
Keterangan gambar :
A : standar xilan 0 : sampel xilan o.s jam ke-0 6 : sampel xilan tongkol jagung jam ke-0
B : standar xilosa 1 : sampel xilan o.s jam ke-1 7 : sampel xilan tongkol jagung jam ke-1
C : standar arabinosa 2 : sampel xilan o.s jam ke-2 8 : sampel xilan tongkol jagung jam ke-2
D : standar manosa 3 : sampel xilan o.s jam ke-3 9 : sampel xilan tongkol jagung jam ke-3
E : standar glukosa 4 : sampel xilan o.s jam ke-4 10 : sampel xilan tongkol jagung jam ke-4
5 : sampel xilan o.s jam ke-5 11 : sampel xilan tongkol jagung jam ke-5
o.s : oatspelt
A B C D E 0 1 2 3 4 5 6 7 8 9 10 11
Rf: 0.00 0.84 0.76 0.80 0.77 0.77 0.78 0.78 0.78 0.78 0.78 0.77 0.77 0.76 0.77 0.78 0.78
PRODUKSI XILOOLIGOSAKARIDA DARI XILAN
TONGKOL JAGUNG DENGAN MENGGUNAKAN XILANASE
Streptomyces
sp. ASAL INDONESIA
Oleh:
Aprilia Naomi
G 34102052
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Menggunakan Xilanase Streptomyces sp. asal Indonesia. Dibimbing oleh ANJA MERYANDINI dan TITI C. SUNARTI.
Produksi xilanase dari tiga isolat asli Indonesia dapat diinduksi dengan xilan tongkol jagung. Streptomyces sp. yang digunakan ialah isolat 234P-16, isolat SKK1-8, dan isolat 45I-3. Aktivitas xilanase isolat SKK1-8 dan isolat 45I-3 dengan menggunakan media dari xilan tongkol jagung lebih tinggi dibandingkan dengan media dari xilan
oatspelt pada konsentrasi xilan yang sama. Aktivitas xilanase ketiga isolat lebih tinggi pada substrat xilan tongkol jagung pada konsentrasi substrat 1% dibandingkan pada
konsentrasi 0.5% dan 1.5%. Xilanase yang dihasilkan oleh Streptomyces sp. digunakan
untuk menghidrolisis xilan sehingga menghasilkan xilooligosakarida. Hasil hidrolisis xilan oleh xilanase dapat diperlihatkan dengan pembentukan gula sederhana, perubahan
derajat polimerasi (DP), dan analisis dengan Thin Layer Chromatography (TLC). Produk
hidrolisis xilan berupa xilooligosakarida rantai panjang dihasilkan oleh isolat 234P-16 dengan DP yang berkisar antara 83.13 hingga 20.24 pada media xilan dari oatspelt dan xilan dari tongkol jagung manis. Isolat SKK1-8 mampu menghidrolisis xilan menjadi xilooligosakarida rantai pendek dengan DP yang berkisar antara 12.01 hingga 2.12, sedangkan isolat 45I-3 antara 5.75 hingga 2.12 pada media xilan dari oatspelt dan xilan dari tongkol jagung. Analisis produk hidrolisis xilan secara kualitatif dengan metode TLC, menunjukkan bahwa produk hidrolisis mengandung beragam xilooligosakarida.
ABSTRACT
APRILIA NAOMI. Production of Xilooligosaccharide from Corncob Xylan Using
Xilanase from Indonesian Streptomyces sp. Under the direction of ANJA MERYANDINI
and TITI C. SUNARTI.
Production of xylanase from three local isolates could be induced with xylan
from corncob. The strains of Streptomyces sp. which used in this research are 234P-16
strain, SKK1-8 strain, and 45I-3 strain. Xylanases from strain SKK1-8 and strain 45I-3 showed the higher activity with corncob xylan than oatspelt xylan. The highest xylanase activities for three strains produced from corncob xylan substrate with 1% concentration
than 0.5% and 1.5%. Xylanase which produced by Streptomyces sp. is used for
PRODUKSI XILOOLIGOSAKARIDA DARI XILAN
TONGKOL JAGUNG DENGAN MENGGUNAKAN XILANASE
Streptomyces
sp. ASAL INDONESIA
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
Pada Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Oleh:
Aprilia Naomi
G 34102052
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ASAL INDONESIA
Nama : Aprilia Naomi
NIM : G34102052
Menyetujui:
Pembimbing I
Pembimbing II
Dr. Anja Meryandini, MS
Dr. Ir. Titi C. Sunarti, M.Si.
NIP. 131663016
NIP. 131956683
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Prof. Dr. Ir. Yonny Koesmaryono, M.S.
NIP. 131473999
PRAKATA
Puji syukur penulis panjatkan kepada Allah Bapa Yang Maha Pengasih karena atas segala karunia dan penyertaan-Nya penulis dapat menyelesaikan penelitian dan penulisan karya ilmiah ini. Tema yang dipilih dalam penelitian ini ialah tentang enzim mikrob, dengan judul Produksi Xilooligosakarida dari Xilan Tongkol Jagung dengan
Menggunakan Xilanase Streptomyces sp.asal Indonesia.
Penelitian ini dilaksanakan mulai bulan November 2005 hingga Juni 2006 bertempat di Laboratorium Pengawasan Mutu, Teknologi Kimia, Bioindustri Departemen Teknologi Industri Pertanian FATETA IPB serta Laboratorium Mikrobiologi Departemen Biologi FMIPA IPB.
Penulis ingin menyampaikan ucapan terima kasih yang mendalam kepada Ibu Dr. Anja Meryandini, MS. selaku pembimbing I, Ibu Dr. Ir. Titi C. Sunarti, M.Si. selaku pembimbing II serta Ibu Dr. Ir. Lisdar A. Manaf selaku perwakilan komisi pendidikan dan penguji kelayakan skripsi atas bimbingan, saran, dan masukannya yang sangat berharga kepada penulis. Ucapan terima kasih juga penulis sampaikan kepada ibu Dr. Ir.
Yulin Lestari yang telah mengizinkan pemakaian ketiga isolat Streptomyces pada
penelitian ini.
Penghargaan tak ternilai penulis sampaikan kepada papa dan mama tercinta, adik-adik, serta seluruh keluarga, atas segala dukungan, doa dan kasih sayangnya. Ucapan terima kasih juga penulis sampaikan kepada Mbak Heni, Pak Jaka, Pak Endang, dan Bu Kokoy selaku teknisi Laboratorium Mikrobiologi; Pak Sugi, Pak Edi, Pak Gun, Bu Ega, Bu Sri selaku teknisi laboratorium Teknologi Industri Pertanian FATETA IPB; teman-teman seperjuanganku Fery Mutia, Sita, Hendro, Fredy, Dewi, Vitria, Desi, Tika T, Ary, Mia, Nirli, Dila, Tika W, Batara, Achi, Mbak Wulan, Bu It, Mas Oji, Mas Prima, Bu Nunuk, Mbak Elsi, seluruh rekan-rekan Biologi angkatan 39 serta semua pihak yang telah membantu dalam penelitian ini, terima kasih atas persahabatan dan kerjasamanya.
Semoga karya ilmiah ini bermanfaat bagi semua pihak untuk kemajuan ilmu pengetahuan.
Bogor, Oktober 2006
Aprilia Naomi
DAFTAR ISI
Halaman
DAFTAR TABEL……… vi
DAFTAR GAMBAR………... …….. vi
DAFTAR LAMPIRAN……… vi
PENDAHULUAN
Latar Belakang……….... 1 Tujuan………... 2 Waktu dan Tempat………... . 2
BAHAN DAN METODE
Bahan dan Alat……….…………...……… 2 Metode……… 2
Penyiapan Bahan………... 2 Ekstraksi Xilan………. 2 Peremajaan Isolat dan Penyiapan Inokulum………. 2 Penentuan Waktu Produksi Optimum dan Aktivitas Xilanase Harian………... 2 Pengaruh Konsentrasi Xilan Tongkol Jagung terhadap Aktivitas Xilanase... 3 Hidrolisis Xilan menggunakan Xilanase……… 3
Analisis Produk Hidrolisis Xilanase dengan Thin Layer Chromatography.……...….. 3
HASIL DAN PEMBAHASAN
Hasil……….. 3 Komposisi Kimia Tongkol Jagung ……..………... 3 Ekstraksi Xilan……….. 3 Penentuan Waktu Optimum Produksi dan Aktivitas Xilanase Harian………. 3 Pengaruh Konsentrasi Xilan Tongkol Jagung terhadap Aktivitas Xilanase... 4 Perubahan Derajat Polimerasi (DP) pada Produk Hasil Hidrolisis Xilanase…………. 5
Analisis Produk Hidrolisis Xilan dengan Thin Layer Chromatography………... 6
Pembahasan………... 6
SIMPULAN………. 8
SARAN.……… ………... 9
DAFTAR PUSTAKA………... 9
LAMPIRAN………11
1 Perubahan derajat polimerasi pada produk hasil hidrolisis xilanase isolat 234P-16... 5
2 Perubahan derajat polimerasi pada produk hasil hidrolisis xilanase isolat SKK1-8... 5
3 Perubahan derajat polimerasi pada produk hasil hidrolisis xilanase isolat 45I-3…... 6
DAFTAR GAMBAR Halaman 1 Kurva aktivitas xilanase ketiga isolat dari media produksi xilan oatspelt yang diuji pada pH dan suhu optimum masing-masing enzim dengan substrat 0.5% xilan oatspelt... 4
2 Perbandingan aktivitas xilanase ketiga isolat pada konsentrasi 0.5% substrat xilan yang berbeda... 4
3 Pengaruh konsentrasi xilan tongkol jagung terhadap aktivitas xilanase isolat 234P-16...…. 4
4 Pengaruh konsentrasi xilan tongkol jagung terhadap aktivitas xilanase isolat SKK1-8... 4
5 Pengaruh konsentrasi xilan tongkol jagung terhadap aktivitas xilanase isolat 45I-3…... 4
DAFTAR LAMPIRAN Halaman 1 Komposisi media agar-agar xilan dan media produksi xilanase (Ruiz-arribas et al. 1995)…... 12
2 Prosedur karakterisasi bahan baku..………... 12
3 Penentuan gula pereduksi metode DNS (Miller 1959)………...……….... 14
4 Penentuan aktivitas xilanase ...………... 14
5 Prosedur analisis total gula metode Fenol-H2SO4 (Apriyantono et al. 1989)………. 14
6 Aktivitas xilanase harian isolat 234P-16... 15
7 Aktivitas xilanase harian isolat SKK1-8………... 15
8 Aktivitas xilanase harian isolat 45I-3…... 15
9 Hasil TLC sampel hidrolisis isolat 234P-16……….……….. 16
10 Hasil TLC sampel hidrolisis isolat SKK1-8……….……….. 17
PENDAHULUAN
Latar Belakang
Tongkol jagung merupakan salah satu limbah padat yang dihasilkan industri pengolahan jagung. Limbah tersebut banyak
mengandung bahan berlignoselulosa
(berserat) yang mem