OKSIDA (N
2O) YANG DIISOLASI
DARI TANAH SAWAH
RATNA SETYANINGSIH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
2
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi Karakterisasi dan Uji Aktivitas Bakteri Denitrifikasi Pereduksi Dinitrogen Oksida (N2O) yang Diisolasi dari Tanah Sawah adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi.
Bogor, April 2011
ABSTRACT
RATNA SETYANINGSIH. Characterization and Activity Assay of Nitrous Oxide (N2O) Reducing Denitrifier Isolated from Rice Soils. Under direction of IMAN RUSMANA, PRIHASTO SETYANTO and ANTONIUS SUWANTO.
Nitrous oxide (N2O) is one of the main greenhouse gases and rice fields are among major contributors of this ozone depleting agent. Soil denitrifiers possessing high N2O reduction activity are important for controlling N2O emission. Nitrous oxide reduction is the last step of denitrification process. The aim of this study was to isolate denitrifying bacteria from rice soils possessing high ability of N2O reduction and potential in reducing N2O emission.
Soil samples were collected from 6 locations of rice fields in Bogor (West Java) and Tangerang (Banten), Indonesia. Bacteria were isolated through enrichment culture supplemented with NO3-. Measurement of growth and N2O reduction activity were conducted by growing bacterial isolates in medium with N2O as a sole terminal electron acceptor. Physiological characterization and identification were performed using API 20NE while molecular identification was conducted based on 16S rRNA gene sequence. nosZ gene was analyzed by cloning and sequencing. N2O emission activity was carried out using rice soil slurry experiment.
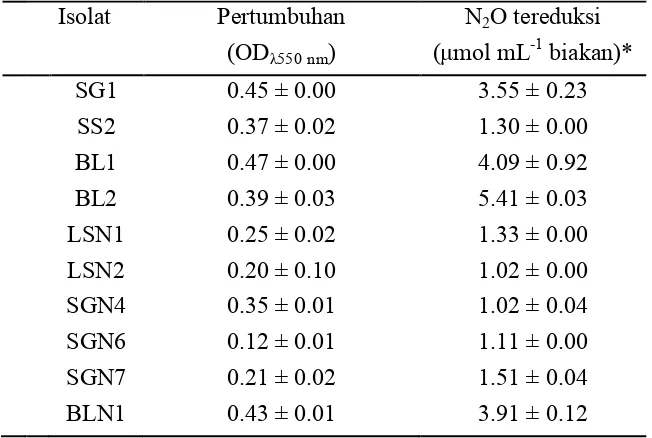
It was found that 10 isolates of denitrifying bacteria could grow on N2O. The bacterial growth indicated by optical density (OD) increased up to 0.12-0.47. During 5 days incubation, isolate BL1, BL2 and BLN1 reduced N2O up to 4.09, 5.41 and 3.91 µmol mL-1 bacterial cultures respectively. BL1, BL2 and BLN1 grew well in medium supplemented with 900, 1380 and 1979 µM N2O but did not grow well with 88 µM N2O in medium during 10 hours, this facts indicated that the isolates consumed N2O during their growth. Maximum growth rate (µmax) using N2O and Monod constant (Ks) of BL1, BL2 and BLN1 were 0.21 h-1 and 102.3 µM h-1, 0.23 h-1 and 213.3 µM h-1, 0.18 h-1 and 172.4 µM h-1 respectively. N2O reduction rate of BL1, BL2 and BLN1 were 0.26, 0.28 and 0.43 µmol mL-1 h-1 respectively. N2O reduction proceeded along with growth. Based on the API 20NE assay, 3 isolates showed different physiological characteristics on hydrolysis of esculine and P-nitrophenyl-β-D-galactopyranoside and also for the assimilation of potassium gluconate and trisodium citrate. From its physiological characteristics, BLN1 was identified as Ochrobactrum anthropi with 99.9% similarity, while BL1 and BL2 were not identified. Based on their 16S rRNA
4
RINGKASAN
RATNA SETYANINGSIH. Karakterisasi dan Uji Aktivitas Bakteri Denitrifikasi Pereduksi Dinitrogen Oksida (N2O) yang Diisolasi dari Tanah Sawah. Di bawah bimbingan IMAN RUSMANA, PRIHASTO SETYANTO dan ANTONIUS SUWANTO.
Perubahan iklim yang disebabkan oleh gas-gas rumah kaca merupakan masalah global yang penting selama beberapa dekade terakhir ini. Pengurangan emisi gas-gas rumah kaca menjadi kajian pokok dalam banyak pertemuan tingkat internasional yang berkaitan dengan perubahan iklim. Pengurangan emisi dilakukan di berbagai sektor termasuk pertanian. Lahan pertanian termasuk sawah merupakan salah satu sumber emisi gas-gas rumah kaca seperti metana (CH4) dan dinitrogen oksida (N2O). Sebagai negara agraris dengan sebagian besar penduduk mengkonsumsi beras sebagai bahan makanan pokok, masalah emisi gas-gas rumah kaca dari lahan sawah di Indonesia menjadi penting terutama upaya pencegahannya.
Gas dinitrogen oksida (N2O) merupakan salah satu gas rumah kaca yang juga dapat menyebabkan kerusakan lapisan ozon di stratosfer. Gas ini memiliki potensi pemanasan global 298 kali lebih besar dibandingkan dengan CO2. Masa tinggal N2O di atmosfer selama 114 tahun, jauh lebih tinggi dari pada CH4 dengan masa tinggal selama 12 tahun. Konsentrasi N2O di atmosfer meningkat dari 314 ppb pada tahun 1998 menjadi 319 ppb pada tahun 2005.
Lebih dari sepertiga emisi total N2O berasal dari aktivitas manusia (antropogenik). Lahan pertanian termasuk sawah merupakan sumber N2O antropogenik terbesar. Emisi N2O dari lahan pertanian sebesar 2.8 TgN per tahun atau 15.82% dari total emisi N2O. Emisi N2O dari lahan pertanian meningkat dengan adanya peningkatan penggunaan pupuk nitrogen, fiksasi gas dinitrogen dari udara dan pengendapan senyawa-senyawa nitrogen.
Emisi N2O dari tanah berasal dari N2O yang diproduksi dalam tanah. Produksi N2O dalam tanah terutama melalui dua proses mikrobiologis yaitu denitrifikasi dan nitrifikasi. Beberapa faktor lingkungan seperti ketersediaan oksigen (O2) dan N serta kandungan bahan organik dan air tanah mempengaruhi produksi N2O yang berakibat berpengaruh pula terhadap emisi N2O. Selain faktor lingkungan, komunitas mikroba dalam tanah mempengaruhi pula produksi dan emisi N2O.
Komunitas bakteri merupakan salah satu faktor yang berpengaruh terhadap tingkat emisi N2O dari suatu ekosistem. Oleh karena itu, salah satu usaha yang dapat dilakukan untuk menurunkan emisi N2O adalah dengan memodifikasi komposisi komunitas atau dominansi bakteri di lingkungan tersebut. Penambahan isolat bakteri yang memiliki aktivitas mereduksi N2O tinggi diharapkan dapat menurunkan tingkat emisi N2O.
mereduksi N2O juga berbeda-beda dan dipengaruhi oleh faktor lingkungan terutama O2.
Meskipun penelitian tentang bakteri denitrifikasi yang memiliki kemampuan mereduksi N2O telah banyak dilakukan, namun belum ada penelitian yang mengarah kepada pemanfaatan bakteri denitrifikasi untuk menurunkan produksi dan emisi N2O. Bakteri yang memiliki aktivitas tinggi mereduksi N2O eksogen berpotensi untuk mengurangi N2O di lingkungan. Penelitian ini dilakukan untuk pengembangan isolat bakteri denitrifikasi asal tanah sawah di Indonesia yang memiliki aktivitas tinggi dalam mereduksi N2O untuk menurunkan emisi N2O dari lahan sawah.
Tujuan dari penelitian ini adalah mendapatkan isolat-isolat bakteri denitrifikasi dari tanah sawah yang memiliki kemampuan tinggi mereduksi N2O dan berpotensi menurunkan emisi N2O. Tujuan tersebut dicapai melalui beberapa tahap kegiatan penelitian yaitu: 1) mengisolasi bakteri denitrifikasi dari tanah sawah yang memiliki kemampuan mereduksi N2O 2) mengukur pertumbuhan dan aktivitas reduksi N2O 3) mengidentifikasi isolat-isolat 4) menganalisis gen nosZ penyandi enzim N2O reduktase dan 5) menguji kemampuan isolat terpilih dalam menurunkan emisi N2O di tanah sawah.
Penelitian berlangsung mulai September 2007 sampai dengan Juli 2010. Sampel tanah sawah diambil dari enam lokasi yang berada di Kabupaten Bogor, Kota Bogor dan Kota Tangerang. Penelitian sebagian besar dilakukan di Laboratorium Mikrobiologi Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor (IPB), Bogor. Sebagian penelitian dilaksanakan di Microbial Ecology Laboratories, Department of Biological Sciences, University of Essex, United Kingdom. Gas N2O diukur menggunakan kromatografi gas di Laboratorium Bioteknologi Tanah Departemen Ilmu Tanah dan Sumber Daya Lahan IPB dan Laboratorium Balai Penelitian Lingkungan Pertanian, Jakenan, Pati. Sekuensing dilakukan di Research and Development Center Biotechnology Department PT Charoen Pokphand Indonesia dan 1st BASE Pte Ltd Singapura.
Sampel tanah sawah digunakan sebagai sumber isolat. Bakteri diisolasi dari biakan pengkayaan mengandung NO3- selanjutnya dilakukan uji oksidatif/fermentatif. Isolat yang bersifat oksidatif digunakan untuk penelitian tahap selanjutnya yaitu uji reduksi NO3- dan akumulasi NO2- untuk memastikan bahwa bakteri yang diisolasi adalah bakteri denitrifikasi. Selanjutnya bakteri diseleksi berdasarkan pertumbuhan dan aktivitas reduksi N2O. Bakteri yang memiliki aktivitas tinggi mereduksi N2O selanjutnya diukur kinetika pertumbuhannya menggunakan N2O dan kecepatannya mereduksi N2O. Tahap berikutnya adalah karakterisasi dan identifikasi bakteri secara morfologis, fisiologis dan molekuler serta analisis molekuler gen nosZ penyandi enzim N2O reduktase. Tahap terakhir adalah uji penurunan emisi N2O menggunakan tanah sawah.
6
banyak selama 5 hari adalah BL2, BL1 dan BLN1 yang masing-masing mereduksi N2O sebesar 5.41, 4.09 dan 3.91 µmol mL-1 biakan.
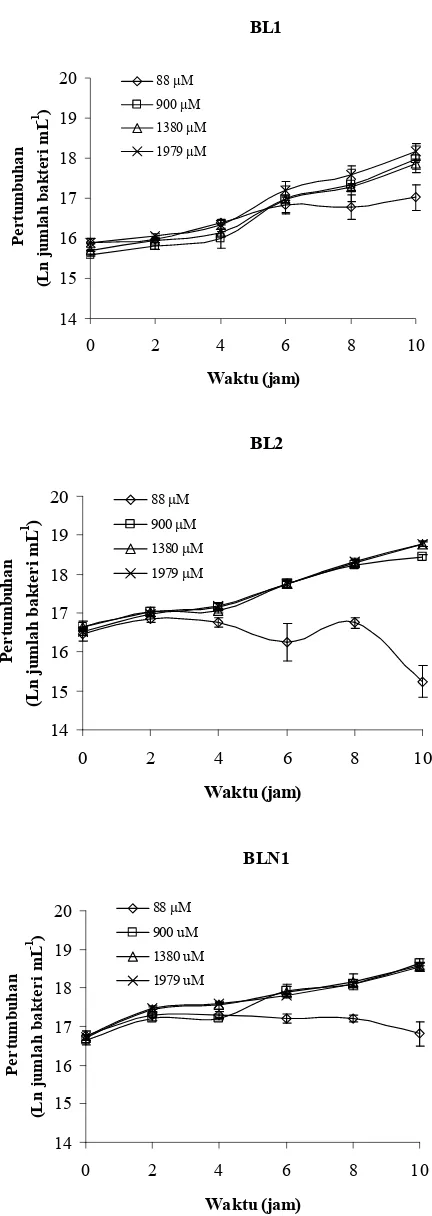
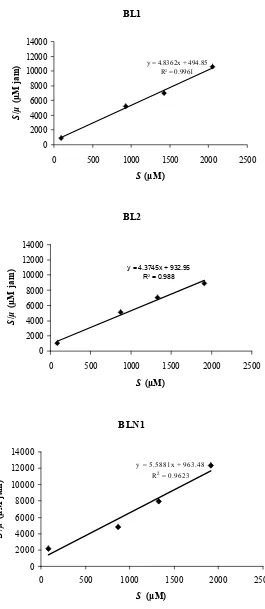
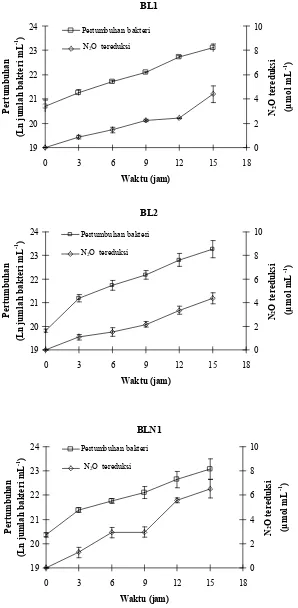
Tiga isolat yang diuji lebih lanjut yaitu BL1, BL2 dan BLN1 tumbuh baik dalam biakan dengan konsentrasi N2O terlarut dalam medium sebesar 900, 1380 dan 1979 µM tetapi tidak tumbuh baik dalam biakan dengan konsentrasi N2O 88 µM yang menunjukkan bahwa bakteri tumbuh menggunakan N2O. Kecepatan pertumbuhan maksimum menggunakan N2O (µmax) dan konstanta Monod (Ks) dari isolat BL1 sebesar 0.21 jam-1 dan 102.3 µM jam-1, BL2 0.23 jam-1 dan 213.3 µM jam-1, BLN1 0.18 jam-1 dan 172.4 µM jam-1. Isolat BL1, BL2 dan BLN1 memiliki kecepatan reduksi N2O masing-masing sebesar 0.26, 0.28 dan 0.43 µmol mL-1 jam-1. Reduksi N2O berlangsung seiring dengan pertumbuhan.
Isolat BL2 memiliki perbedaan bentuk koloni dengan BL1 dan BLN1. Berdasarkan uji menggunakan API 20NE, di antara ketiga isolat terdapat perbedaan sifat fisiologis dalam hal hidrolisis eskulin dan P-nitrofenil-β-D-galaktopiranosida serta asimilasi potasium glukonat dan trisodium sitrat. Identifikasi berdasarkan sifat-sifat fisiologis memberikan hasil bahwa isolat BLN1 memiliki kemiripan 99.9% dengan Ochrobactrum anthropi sedangkan isolat BL1 dan BL2 tidak teridentifikasi. Berdasarkan analisis 16S rRNA, isolat BL1, BL2 dan BLN1 masing-masing memiliki kemiripan sebesar 99, 95 dan 98% dengan Ochrobactrum anthropi ATCC 49188. Dengan demikian tiga isolat yang ditemukan dapat disebut sebagai bakteri O. anthropi BL1, Ochrobactrum sp. BL2 dan O. anthropi BLN1. Analisis terhadap gen nosZ belum memberikan hasil yang diharapkan.
Penambahan isolat BLN1 dapat mengurangi konsentrasi N2O yang terlarut dalam air permukaan dari 31.12 menjadi 12.94 nmol L-1 pada jam ke-6 setelah penambahan 0.6 mmol NO3-. Emisi N2O ke udara tidak dipengaruhi penambahan isolat BLN1.
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
8
KARAKTERISASI DAN UJI AKTIVITAS BAKTERI
DENITRIFIKASI PEREDUKSI DINITROGEN
OKSIDA (N
2O) YANG DIISOLASI
DARI TANAH SAWAH
RATNA SETYANINGSIH
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Departemen Biologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Disertasi : Karakterisasi dan Uji Aktivitas Bakteri Denitrifikasi Pereduksi Dinitrogen Oksida (N2O) yang Diisolasi dari Tanah Sawah
Nama : Ratna Setyaningsih
NIM : G361060041
Disetujui
Komisi Pembimbing
Dr. Ir. Iman Rusmana, M.Si Ketua
Dr. Ir. Prihasto Setyanto, M.Sc. Prof. Dr. Ir. Antonius Suwanto M.Sc.
Anggota Anggota
Mengetahui
Ketua Program Studi Biologi Dekan Sekolah Pascasarjana
Dr. Ir. Dedy Duryadi Solihin, DEA Dr. Ir. Dahrul Syah, M.Sc.Agr
10
Penguji pada Ujian Tertutup : Dr. Nisa Rachmania Mubarik, M.Si
Dr. Rahayu Widyastuti, M.Sc
Penguji pada Ujian Terbuka : Dr. rer. nat. Sarjiya Antonius
PRAKATA
Puji Tuhan atas kasih dan pertolonganNya sehingga karya ilmiah ini dapat diselesaikan. Penelitian yang dilaksanakan dari September 2007 sampai Juli 2010 ini berjudul Karakterisasi dan Uji Aktivitas Bakteri Denitrifikasi Pereduksi Dinitrogen Oksida (N2O) yang Diisolasi dari Tanah Sawah.
Terima kasih penulis ucapkan kepada Bapak Dr. Ir. Iman Rusmana, M.Si., Bapak Dr. Ir. Prihasto Setyanto, M.Sc dan Bapak Prof. Dr. Ir. Antonius Suwanto, M.Sc. selaku pembimbing yang telah memberikan banyak bimbingan dan arahan. Selain itu juga terima kasih kepada Dr. Nisa Rachmania Mubarik M.Si. dan Dr. Rahayu Widyastuti M.Sc. sebagai penguji pada ujian tertutup serta Dr. rer. nat. Sarjiya Antonius dan Dr. Ibnul Qayim sebagai penguji pada ujian terbuka. Ungkapan terimakasih juga penulis sampaikan kepada Rektor Universitas Sebelas Maret Surakarta yang telah memberikan tugas belajar serta Institut Pertanian Bogor (IPB) yang telah memberikan kesempatan kepada penulis untuk menempuh studi di Program Doktor Sekolah Pascasarjana. Juga ucapan terima kasih penulis sampaikan kepada Direktorat Jenderal Pendidikan Tinggi Departemen Pendidikan Nasional atas biaya pendidikan dan penelitian melalui Beasiswa Bantuan Program Pascasarjana dan Program Sandwich. Selain itu penulis menyampaikan penghargaan kepada Prof. David B. Nedwell yang telah memberikan bimbingan dan ijin penelitian selama penulis melaksanakan penelitian yang merupakan bagian dari disertasi melalui Program Sandwich di Microbial Ecology Laboratories, Department of Biological Sciences, University of Essex, Colchester, United Kingdom. Ungkapan terima kasih juga penulis sampaikan kepada orang tua serta kakak-kakak dan adik yang telah memberikan dukungan doa, serta teman-teman di Laboratorium Mikrobiologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam IPB atas kerjasamanya.
Bogor, April 2011
12
RIWAYAT HIDUP
Penulis dilahirkan di Surakarta pada tanggal 14 Juli 1966 sebagai anak ketiga dari empat bersaudara pasangan Bapak Sihiman dan Ibu Koesmarsini. Pendidikan sarjana ditempuh di Jurusan Biologi Lingkungan Fakultas Biologi Universitas Gadjah Mada Yogyakarta, lulus tahun 1992. Selanjutnya dari universitas yang sama penulis mendapatkan gelar Magister Sains Program Studi Biologi pada tahun 2001. Penulis melanjutkan pendidikan Program Doktor di Sekolah Pascasarjana Institut Pertanian Bogor sejak tahun 2006.
DAFTAR ISI
Enzim-enzim dan Gen-gen yang Berperan dalam Proses Denitrifikasi... 26
Reduksi N2O... 30
Keanekaragaman dan Penyebaran Bakteri Denitrifikasi... 32
Faktor-faktor yang Mempengaruhi Emisi N2O dari Tanah... 34
14
Kinetika Pertumbuhan Bakteri Menggunakan N2O... 53
Kecepatan Reduksi N2O dan Pertumbuhan... 57
Karakter dan Identitas Bakteri... 59
Gen nosZ... 62
N2O di Udara... 64
N2O di Air Permukaan... 65
PEMBAHASAN... 67
SIMPULAN DAN SARAN Simpulan... 78
Saran... 78
DAFTAR PUSTAKA... 80
LAMPIRAN... 93
DAFTAR TABEL
Halaman
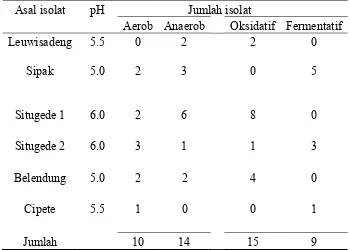
1 Jumlah isolat bakteri yang didapatkan dari tanah sawah di daerah
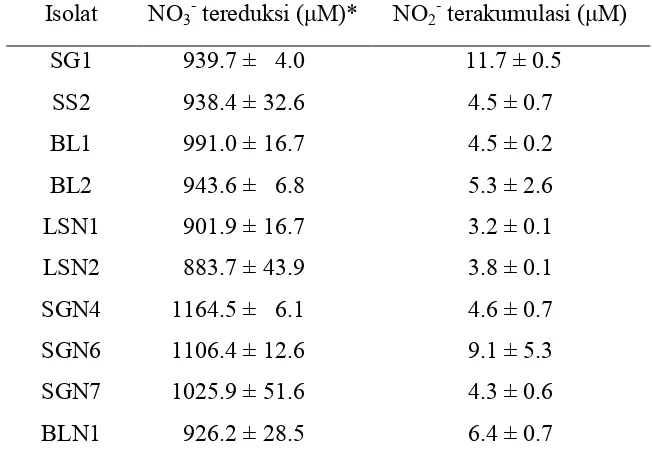
Bogor dan Tangerang ... 51 2 Kemampuan isolat-isolat bakteri mereduksi NO3- dan mengakumulasi
NO2pada inkubasi selama 3 hari ... 52 3 Pertumbuhan isolat-isolat bakteri dan reduksi N2O setelah diinkubasi
selama 5 hari... 53 4 Kecepatan pertumbuhan maksimum (µmax) dan konstanta Monod (Ks)
isolat BL1, BL2 dan BLN1 ... 55 5 Kecepatan reduksi N2O (vred), kecepatan pertumbuhan spesifik (µ) dan
waktu generasi (g) isolat BL1, BL2 dan BLN1... 57 6 Karakter fisiologis isolat BL1, BL2 dan BLN1 berdasarkan API 20NE. 60 7 Perbandingan hasil identifikasi menggunakan API 20NE dan sekuen
16S rRNA dari isolat BL1, BL2 dan BLN1 ... 61 8 Emisi N2O tanpa dan dengan penambahan isolat BLN1 setelah
penambahan 0.6 mmol NO3-... 65 9 Peningkatan konsentrasi N2O di air permukaan tanpa dan dengan
16
DAFTAR GAMBAR
Halaman
1 Transformasi N yang menghasilkan N2O yaitu jalur (1) denitrifikasi,
(2) reduksi NO3- disimilatif menjadi NH4+ (DNRA) dan (3) nitrifikasi. 25 2 Transformasi nitrogen oleh mikroba ... 26 3 Organisasi dan tempat terjadinya rantai pemindahan elektron pada
P. stutzeri ... 27 4 Bagan alir penelitian ... 37 5 Uji penurunan emisi N2O menggunakan sedimen tanah sawah... 49 6 Pola pertumbuhan isolat BL1, BL2 dan BLN1 dalam biakan dengan
konsentrasi N2O terlarut 88, 900, 1380 dan 1979 µM ... 54 7 Plot Hanes dari isolat BL1, BL2 dan BLN1 yang ditumbuhkan
menggunakan N2O ... 56 8 Pertumbuhan dan aktivitas reduksi N2O isolat BL1, BL2 dan BLN1... 58 9 Koloni isolat BL1, BL2 dan BLN1 yang ditumbuhkan di permukaan
medium denitrifikasi agar-agar ... 59 10 Gel agarosa yang menunjukkan pita potongan DNA dari gen penyandi
16S rRNA hasil amplifikasi PCR menggunakan primer 63F dan
1387R... 61 11 Pohon filogenetik dari potongan gen penyandi 16S rRNA (700 basa)
isolat BL1, BL2 dan BLN1 serta beberapa bakteri anggota filum
Proteobacteria... 62 12 Gel agarosa yang menunjukkan pita potongan DNA hasil amplifikasi
PCR menggunakan primer nosZ661fF dan nosZ1773R... 63 13 Banyaknya N2O di udara tanpa dan dengan penambahan isolat BLN1
setelah penambahan 0.6 mmol NO3-... 65 14 Konsentrasi N2O di air permukaan tanpa dan dengan penambahan
DAFTAR LAMPIRAN
Halaman
1 Sampel tanah, biakan pengkayaan, medium dan tabung untuk seleksi pertumbuhan dan kemampuan mereduksi N2O, dan uji emisi
N2O menggunakan tanah sawah... 94
2 Bahan kimia untuk analisis, bufer dan medium ... 96
3 Kurva standar.. ... 98
4 Jenis dan tekstur tanah sampel... 100
5 Uji API 20NE... 101
6 Hasil BLASTN sekuen 16S rRNA... 102
7 Urutan basa dari pita potongan DNA yang diduga sebagai gen nosZ. Pita merupakan hasil PCR dengan suhu penempelan 56 °C... 106
8 Hasil BLASTX urutan basa dari pita potongan DNA yang diduga sebagai gen nosZ. Pita merupakan hasil PCR dengan suhu penempelan 56 °C... 108
9 Hasil kloning... 110
10 Hasil BLASTX urutan basa dari pita potongan DNA yang diduga sebagai gen nosZ. Pita merupakan hasil kloning... 111
11 Analisis varian... 113
18
PENDAHULUAN
Latar Belakang
Perubahan iklim yang disebabkan oleh gas-gas rumah kaca merupakan
masalah global yang penting selama beberapa dekade terakhir ini. Pengurangan
emisi gas-gas rumah kaca menjadi kajian pokok dalam banyak pertemuan tingkat
internasional yang berkaitan dengan perubahan iklim. Pengurangan emisi
dilakukan di berbagai sektor termasuk pertanian. Lahan pertanian termasuk sawah
merupakan salah satu sumber emisi gas-gas rumah kaca seperti metana (CH4) dan dinitrogen oksida (N2O). Sebagai negara agraris dengan sebagian besar penduduk mengkonsumsi beras sebagai bahan makanan pokok, masalah emisi gas-gas
rumah kaca dari lahan sawah di Indonesia menjadi penting terutama upaya
pencegahannya.
Selain merupakan gas rumah kaca, N2O dapat merusak lapisan ozon di stratosfer (Conrad 1996). Gas ini memiliki potensi pemanasan global 298 kali
lebih besar dibandingkan dengan CO2. Masa tinggal N2O di atmosfer selama 114 tahun, jauh lebih tinggi dari pada CH4 dengan masa tinggal selama 12 tahun. Konsentrasi N2O di atmosfer meningkat dari 314 ppb pada tahun 1998 menjadi 319 ppb pada tahun 2005 (Forster dan Ramaswamy 2007).
Lebih dari sepertiga emisi total N2O berasal dari aktivitas manusia (antropogenik) (IPCC 2007). Lahan pertanian merupakan sumber N2O antropogenik terbesar. Emisi N2O dari lahan pertanian sebesar 2.8 TgN per tahun atau 15.82 % dari total emisi N2O (Denman dan Brasseur 2007). Emisi N2O dari lahan pertanian meningkat dengan adanya peningkatan penggunaan pupuk
nitrogen (N) (Freney 1997).
Emisi N2O dari tanah berasal dari N2O yang diproduksi dalam tanah. Produksi N2O dalam tanah terutama melalui dua proses mikrobiologis yaitu denitrifikasi dan nitrifikasi. Jika tanah dalam keadaan kering atau teraerasi, N2O dihasilkan terutama melalui proses nitrifikasi. Sebaliknya jika tanah dalam kondisi
basah atau kurang aerasi, denitrifikasi merupakan proses utama yang
(Mathieu et al. 2006). Jika pori tanah 35-60% terisi air, emisi N2O terutama dihasilkan melalui proses nitrifikasi. Emisi N2O melalui proses nitrifikasi dapat mencapai 81% pada tanah dengan 60% pori terisi air (Bateman dan Baggs 2005).
Di sawah, kondisi tergenang dan kering secara bergantian memacu terbentuknya
N2O melalui denitrifikasi (Garcia dan Tiedje 1981) maupun nitrifikasi (Byrnes et al. 1993).
Beberapa faktor lingkungan seperti ketersediaan oksigen (O2), nitrogen, bahan organik dan kandungan air tanah mempengaruhi produksi N2O yang berakibat berpengaruh pula terhadap emisi N2O (Dobbie dan Smith 2001; Włodarczyk et al. 2004; Zhao et al. 2009). Selain faktor lingkungan, komunitas mikroba dalam tanah mempengaruhi pula produksi dan emisi N2O (Chèneby 1998; Holtan-Hartwig et al. 2000)
Holtan-Hartwig et al. (2000) membandingkan emisi N2O dari tiga tempat yang ada di Jerman, Swedia dan Finlandia. Secara in situ, emisi N2O dari lahan di Swedia lebih rendah (4.0 kg N2O-N ha-1 th-1) dibandingkan dengan Jerman (14.6 kg N2O-N ha-1 th-1) dan Finlandia (8.3 kg N2O-N ha-1 th-1). Hasil pengukuran terhadap tanah dari tiga tempat tersebut yang telah diseragamkan kondisinya di
laboratorium menunjukkan bahwa tanah yang berasal dari Swedia memiliki rasio
Vmax reduksi NO3- : Vmax reduksi N2O lebih rendah (0.3) dibandingkan sampel tanah dari Jerman (2.0) dan Finlandia (1.0). Tanah yang lebih sedikit
mengemisikan N2O memiliki rasio Vmax reduksi NO3- : Vmax reduksi N2O lebih kecil. Rasio Vmax reduksi NO3- : Vmax reduksi N2O di tanah ditentukan oleh komposisi komunitas mikroba terutama bakteri dalam tanah tersebut.
Komunitas bakteri merupakan salah satu faktor yang berpengaruh terhadap
besarnya emisi N2O dari suatu ekosistem. Dengan demikian, memodifikasi komposisi komunitas bakteri merupakan salah satu usaha yang diharapkan dapat
menurunkan emisi N2O. Penambahan isolat bakteri yang memiliki aktivitas mereduksi N2O tinggi diharapkan dapat menekan produksi N2O sehingga menurunkan tingkat emisinya.
20
adalah Pseudomonas stutzeri (Carlson dan Ingraham 1983), Azospirillum brasilense (Tibelius dan Knowles 1984), Paracoccus denitrificans (Snyder et al. 1987), P. aeruginosa (Snyder et al. 1987), Rhodobacter sphaeroides (Itoh et al. 1989) serta Bradyrhizobium japonicum (Sameshima-Saito et al. 2006). Di antara
bakteri yang memiliki kemampuan mereduksi N2O, tidak semuanya dapat mereduksi N2O yang ada di luar selnya (eksogen) (Zumft 1997). Beberapa galur
pereduksi N2O lebih efisien menggunakan N2O yang dihasilkannya sendiri (endogen) untuk pertumbuhan (Bazylinski et al. 1986) dibandingkan menggunakan N2O eksogen. Ketahanan dan tingkat kemampuan bakteri mereduksi N2O juga berbeda di antara galur yang berbeda (Snyder et al. 1987) dan dipengaruhi oleh faktor lingkungan terutama O2 (Watahiki et al. 1983).
Meskipun penelitian tentang bakteri denitrifikasi yang memiliki
kemampuan mereduksi N2O telah banyak dilakukan, namun masih belum ada penelitian yang mengarah kepada pengembangan potensi dan pemanfaatan isolat
bakteri denitrifikasi untuk menurunkan emisi N2O. Bakteri yang memiliki aktivitas tinggi mereduksi N2O eksogen berpotensi untuk mengurangi N2O di lingkungan. Penelitian ini dilakukan untuk mendapatkan isolat bakteri
denitrifikasi asal tanah sawah yang memiliki aktivitas tinggi dalam mereduksi
N2O sehingga akan dapat dimanfaatkan sebagai inokulum untuk menurunkan emisi N2O dari lahan sawah.
Tujuan
Tujuan dari penelitian ini adalah mendapatkan isolat-isolat bakteri
denitrifikasi dari tanah sawah yang memiliki kemampuan tinggi mereduksi N2O dan berpotensi menurunkan emisi N2O. Tujuan tersebut dicapai melalui beberapa tahap kegiatan penelitian yaitu: 1) mengisolasi bakteri denitrifikasi dari tanah
Hipotesis
Di antara bakteri-bakteri yang hidup di sawah terdapat bakteri denitrifikasi
yang memiliki kemampuan tinggi mereduksi N2O. Bakteri-bakteri tersebut dapat diisolasi dan diidentifikasi serta dapat digunakan sebagai inokulum untuk
menurunkan emisi N2O dari tanah sawah.
Manfaat Penelitian
Penelitian ini memberikan informasi awal tentang isolat-isolat bakteri
denitrifikasi asal sawah yang memiliki kemampuan mereduksi N2O, karakter dan identitasnya. Isolat-isolat bakteri ini, melalui studi lebih lanjut dapat dimanfaatkan
22
TINJAUAN PUSTAKA
Gas Rumah Kaca
Energi radiasi matahari dipancarkan ke bumi terutama dalam bentuk
radiasi dengan panjang gelombang pendek misalnya ultraviolet. Kurang lebih
sepertiga energi dipantulkan oleh bagian atas atmosfer sedangkan sekitar dua
pertiganya diserap permukaan bumi. Bumi memantulkan energi radiasi yang
diterimanya sebagian besar dalam bentuk radiasi infra merah. Radiasi termal yang
dipancarkan oleh bumi diserap oleh atmosfer dan dipancarkan kembali ke bumi,
sehingga menimbulkan efek rumah kaca. Secara alami tanpa efek rumah kaca
suhu bumi akan berada di bawah 0 °C (Le Treut dan Somerville 2007).
Aktivitas manusia menghasilkan emisi empat macam gas-gas rumah kaca
utama yaitu CO2, CH4, N2O dan halokarbon yang mengandung fluorin, klorin dan bromin. Gas-gas tersebut terakumulasi di atmosfer sehingga konsentrasinya
meningkat sejalan dengan waktu. Peningkatan konsentrasi CO2 disebabkan oleh penggunaan bahan bakar fosil, alat pengatur suhu ruang dan penebangan hutan.
Peningkatan CH4 antara lain sebagai hasil kegiatan pertanian dan penimbunan bahan organik, sedangkan emisi N2O meningkat oleh penggunaan pupuk N dan pembakaran bahan bakar fosil. Halokarbon misalnya klorofluorokarbon
(chlorofluorocarbon=CFC) yang digunakan sebagai bahan pendingin selain
merupakan gas rumah kaca juga dapat merusak ozon (Forster dan Ramaswamy
2007).
Gas-gas rumah kaca memiliki kekuatan radiatif (radiative forcing=RF).
Kekuatan radiatif bernilai positif menyebabkan pemanasan bumi (Forster dan
Ramaswamy 2007). Peningkatan kekuatan radiatif atmosfer bumi menyebabkan
perubahan iklim secara cepat sehingga dapat mengganggu aktivitas manusia dan
ekosistem alami (Schlesinger 2003).
N2O di Atmosfer
Pada satu abad terakhir ini, aktivitas manusia secara dramatis
meningkatkan emisi dan pelepasan N reaktif ke atmosfer bumi, yaitu sebanyak
atmosfer oleh adanya tiga gas N utama yaitu N2O, amonia (NH3) dan NOx (nitrik oksida (NO) + nitrogen dioksida (NO2)). Aktivitas manusia meningkatkan pasokan N ke pantai dan laut lepas, menurunkan ketersedian O2 dan emisi N2O. Meskipun demikian pertanian merupakan sumber N2O antropogenik terbesar
(Denman dan Brasseur 2007).
Dinitrogen oksida memiliki nilai RF positif di urutan keempat terbesar di
antara gas-gas rumah kaca yang memiliki masa tinggal lama (longlife greenhouse
gases=LLGHGs) setelah CO2, CH4 dan CFC-12. Nilai RF N2O sebesar +0,16 Watt m-2 sedangkan nilai total RF dari LLGHGs sebesar +2,63 Watt m-2 (Forster dan Ramaswamy 2007). Selain merupakan gas rumah kaca, N2O memiliki efek merusak lapisan ozon (O3) di stratosfer. Sebagian besar (90%) O3 berada di stratosfer (ketinggian 10-50 km) sedangkan sisanya (10%) di troposfer (0-10 km).
O3 menyerap kuat radiasi ultraviolet terutama pada panjang gelombang antara 200-290 nm. Panas yang diserap oleh O3 menyebabkan suhu maksimum di ketinggian 50 km (Fraser 1997). Kerusakan O3 di stratosfer disebabkan oleh emisi uap air dan N oksida dari pesawat jet supersonik, reaksi-reaksi kimia yang terjadi
di stratosfer, difusi klorofluorometan yang digunakan untuk alat pendingin dan
difusi N2O dari troposfer (Knowles 1982).
Jalur-jalur Pembentukan N2O
Lebih kurang sebesar 90% gas N2O secara global dihasilkan dari proses biotik (Paul dan Clark 1996). Mikroba terutama bakteri berperan penting dalam
menghasilkan N2O, salah satunya melalui proses denitrifikasi. Menurut Zumft (1997) transformasi N lengkap pada jalur denitrifikasi adalah NO3- → NO2- → NO → N2O → N2. Denitrifikasi tidak lengkap merupakan proses reduksi NO3- yangberakhir pada N2O. Pada umumnya hal tersebut terjadi jika tidak ada enzim
N2O reduktase. Snyder et al. (1987) melaporkan bahwa bakteri yang kehilangan aktivitas enzim N2O reduktase tidak dapat mereduksi N2O sehingga N2O merupakan hasil akhir denitrifikasi.
Gas N2O juga dihasilkan sebagai hasil antara proses nitrifikasi. Nitrifikasi terdiri dari dua tahap proses yang melibatkan dua kelompok mikroba. Kelompok
24
mengoksidasi NO2- menjadi NO3- (Paul dan Clark 1996). Penelitian terhadap bakteri nitrifikasi Nitrosomonas sp. memberikan hasil bahwa jika nitrifikasi terjadi pada konsentrasi O2 lebih rendah dari yang dibutuhkan, produksi NO2 -sedikit dan akan banyak dihasilkan N2O. Gejala yang sama ditunjukkan oleh
bakteri Nitrosolobus, Nitrospira dan Nitrosococcus. Dalam proses oksidasi NH4+ menjadi NO2-, hidroksilamin (NH2OH) merupakan hasil antara. Pada
Nitrosomonas, radikal nitroksil (HNO) dihasilkan sebagai hasil antara oksidasi NH2OH menjadi NO2-. Diduga, HNO akan terdekomposisi secara spontan menjadi N2O (Goreau et al. 1980; Roswall 1981).
Jalur lain yang dapat menghasilkan N2O adalah reduksi NO3- disimilatif menghasilkan NH4+ (dissimilatory nitrate reduction to ammonium=DNRA). Dalam proses DNRA, NO3- direduksi menjadi NO2- dan selanjutnya NO2 -direduksi menjadi NH4+ dengan N2O sebagai hasil samping (Kelso 1997) (Gambar 1). Terdapat dua jalur DNRA. Jalur pertama adalah reduksi NO3- disimilatif yang berpasangan dengan aliran elektron dari bahan organik untuk
mereduksi NO3- melalui reaksi fermentasi dan proses ini pada umumnya terjadi di lingkungan dengan NO3- terbatas dan kaya akan C labil (karbon yang bersifat mudah dirombak). Jalur DNRA yang kedua adalah khemolitoautotrofik, reduksi
NO3- berpasangan dengan oksidasi sulfur (S) dalam bentuk tereduksi (Stark dan Richards 2008). Proses DNRA dapat menjadi sumber emisi N2O di lingkungan yang berada dalam keadaan tergenang pada waktu yang lama (Włodarczyk et al.
Gambar 1 Transformasi N yang menghasilkan N2O yaitu jalur (1) denitrifikasi, (2) reduksi NO3- disimilatif menghasilkan NH4+ (DNRA) dan (3) nitrifikasi (dimodifikasi dari Kelso 1997).
Denitrifikasi pada Bakteri
Nitrogen merupakan salah satu unsur utama penyusun sel. Di alam, N
berada dalam bentuk-bentuk yang memiliki bilangan oksidasi berbeda.
Denitrifikasi merupakan bagian dari siklus transformasi N di alam (Gambar 2).
Nitrogen masuk ke lingkungan kehidupan (biosfer) melalui fiksasi N2 dan keluar dari biosfer melalui proses denitrifikasi (Zumft 1997).
Pada proses denitrifikasi, bakteri menggunakan N oksida sebagai penerima
elektron terakhir untuk bioenergetik seluler dalam keadaan anaerob, mikroaerofil
atau bahkan dalam kondisi aerob. Denitrifikasi merupakan proses transformasi
secara disimilatif, berhubungan dengan konservasi energi. Pemindahan elektron
secara enzimatik berpasangan dengan sintesis adenosine triphosphate (ATP) melalui translokasi proton dan pembentukan potensial membran. Terjadinya
denitrifikasi dalam sel dipicu oleh kondisi lingkungan dengan tekanan O2 rendah dan tersedianya N oksida (Zumft 1997).
Meskipun denitrifikasi pada umumnya berlangsung dalam kondisi anaerob
dan aktivitas enzim-enzim denitrifikasi dihambat oleh O2, beberapa bakteri dapat melakukan proses denitrifikasi dalam kondisi aerob. Pseudomonas stutzeri SU2
26
mereduksi NO3- menghasilkan N2 tanpa akumulasi NO2- selama 92 jam pada kondisi konsentrasi O2 di lingkungan 92% dan NO3- yang tereduksi sebanyak 99.24% (Su et al. 2001a). Pada kondisi yang sama Pseudomonas stutzeri NS-2 dan Pseudomonas stutzeri SM-3 mereduksi NO3- menghasilkan N2 hampir tanpa
akumulasi NO2- selama 20 jam (Su et al. 2001b). Thiosphaera pantotropha LMD 82.5 dapat melakukan seluruh proses denitrifikasi dalam kondisi aerob (Van Niel
1992). Pada Thauera mechernichensis DSM12266 reduksi NO3- terjadi dalam keadaan aerob tetapi N2O terbentuk dalam kondisi anaerob (Scholten et al. 1999).
Gambar 2 Transformasi nitrogen oleh mikroba (Francis et al. 2007). DNRA: dissimilatory nitrate reduction to ammonium (reduksi NO3- disimilatif menghasilkan NH4+), Annamox: anaerobic ammonium oxidation (oksidasi amonium anaerob).
Enzim-enzim dan Gen-gen yang Berperan dalam Proses Denitrifikasi
Selama proses denitrifikasi yang melibatkan empat tahap reduksi secara
(Nos) (Lalucat et al. 2006). Enzim-enzim tersebut terdapat di membran sitoplasma
atau periplasma (Gambar 3).
Denitrifikasi diawali oleh proses reduksi NO3-. Ada dua tipe enzim yang mengkatalisis proses ini, yaitu NO3- reduktase respiratif terikat membran (Nar)
dan NO3- reduktase periplasmik (Nap). Nar terekspresi hanya pada kondisi pertumbuhan anaerob dan dapat mereduksi klorat. Sedangkan Nap disintesis dan
aktif dalam kondisi ada oksigen dan tidak dapat mereduksi klorat (Zumft 1997).
Gambar 3 Organisasi dan tempat terjadinya rantai pemindahan elektron pada P. stutzeri. Komponen rantai respirasi aerob konstitutif terdiri dari
Nar menghasilkan kekuatan mendorong proton (proton motif force=PMF)
yang memungkinkan terjadinya sintesis ATP (Moreno-Vivián 1999). Enzim ini
pada Pseudomonas stutzeri terdiri dari tiga subunit yaitu α, β dan γ. Subunit α (NarG) merupakan pusat katalitik, terdiri dari molibdenum dan dua kofaktor
28
dalam subunit β (NarH) berperan dalam pemindahan elektron dari kelompokan
quinol di membran sel. Subunit γ (NarI) terletak di membran dan merupakan
protein sitokrom b yang mengandung dua gugus heme tipe b (Lalucat et al. 2006).
Pada Pseudomonas aeruginosa narG, narH dan narI merupakan bagian dari
operon narK1K2GHJI (Schreiber et al. 2007). Pada Pseudomonas stutzeri terdapat
tambahan gen narC yang bersama-sama dengan narK menyandi protein yang
diduga merupakan pembawa (Lalucat et al. 2006). Selain itu terdapat gen-gen pengendali untuk Nar yaitu anr, dnr dan narXL (Härtig et al. 1999; Schreiber et al. 2007). Aktivitas Nar dihambat oleh azida, klorat, sianida dan tiosianat (Moreno-Vivián 1999).
Nap hanya dimiliki oleh bakteri Gram negatif (Philippot 2005). Peran
fisiologis Nap adalah membuang kekuatan pereduksi yang berlebihan dan
menghasilkan NO2- untuk denitrifikasi aerob (Zumft 1997). Nap tersusun dari subunit katalitik NapA yang mengandung kofaktor molibdopterin dan [4Fe-4S]
serta subunit NapB yang mengandung dua heme tipe c. Kompleks NapAB terletak
di periplasmik, menerima elektron dari NapC yang terikat membran. NapC
mengandung empat heme tipe c dan diduga berperan dalam pemindahan elektron
antara quinol dan Nap (Bedmar et al. 2005; Philippot 2005; Lalucat et al. 2006).
Gen-gen penyandi Nap pada beberapa bakteri tergabung dalam operon
napEDABC. Produk napD adalah protein yang dapat larut dan diasumsikan berperan dalam pematangan NapB. Sedangkan napE menyandi protein
transmembran yang belum diketahui fungsinya (Bedmar et al. 2004). Aktivitas Nar maupun Nap dikendalikan oleh NO3- melalui protein sensor narX dan narQ (Stewart 2003).
Reduksi NO2- menjadi NO merupakan tahap yang menentukan untuk terjadinya jalur denitrifikasi. NO yang dihasilkan dapat digunakan sebagai
substrat hanya oleh NO reduktase dan harus segera dikeluarkan dari sel karena
NO bersifat toksik bahkan pada konsentrasi yang sangat rendah (Baker et al. 1998). Enzim NO2- reduktase (Nir) terletak di periplasma. Aktivitas reduksi NO2- pada bakteri denitrifikasi terjadi oleh dua metaloenzim. Kedua enzim tersebut
berbeda dalam hal struktur dan senyawa-senyawa logam prostetik yang
mengandung heme c dan d1 sebagai kofaktor esensial, disandi oleh nirS. Yang kedua merupakan NO2- reduktase yang mengandung tembaga (Cu) pada sisi aktifnya, disandi oleh nirK. Dua jenis enzim tersebut tidak pernah ditemukan dalam sel yang sama (Lalucat et al. 2006). nirS merupakan bagian dari kelompok
gen-gen (operon) nirSTBMCFDLGH penyandi NO2- oksida reduktase sedangkan nirK merupakan gen tunggal (Bedmar et al. 2005). nirT menyandi sitokrom
tetraheme, nirB menyandi sitokrom diheme dan nirM menyandi pemberi elektron (sitokrom c551) untuk nirS. Sedangkan nirMCFDLGH merupakan motif yang dikenali untuk regulator FNR di daerah promotor (Lalucat et al. 2006).
Reduksi NO menjadi N2O dikatalisis oleh dua tipe NO reduktase (Nor), enzim yang terikat ke membran sitoplasma. Tipe pertama memiliki rantai lebih
pendek, menerima elektron dari sitokrom c, disebut cNor. Sedangkan tipe kedua
yang memiliki rantai lebih panjang menerima elektron dari quinol, disebut qNor
(Bedmar et al. 2005; Lalucat et al. 2006). Gen-gen norC dan norB masing-masing
menyandi subunit II yang mengandung sitokrom c dan subunit I yang mengandung sitokrom b dari cNor. Bradyrhizobium japonicum memiliki gen-gen
penyandi Nor yang tergabung dalam norCBQDE. norQ menyandi protein pengikat ATP atau guanosine triphosphate (GTP) sedangkan produk norD belum
diketahui fungsinya. norE menghasilkan protein yang memiliki kemiripan 60% dengan sitokrom c oksidase tipe aa3 (Bedmar et al. 2005). Gen-gen norCB dari Paracoccus dilengkapi oleh norQDEF untuk pematangan NO reduktase (Baker et al. 1998). Pada denitrifikasi yang bersifat aerob atau mikroaerofil, ekspresi Nor dihambat konsentrasi oksigen tinggi (Zumft 1997).
Enzim yang berperan pada tahap terakhir denitrifikasi adalah N2O reduktase (Nos). Nos dari P. stutzeri lebih intensif dipelajari dari pada Nos bakteri lain. Enzim ini merupakan enzim dimer yang terletak di periplasma dan
ada dalam beberapa bentuk. Bentuk I dapat diisolasi dalam keadaan anaerob,
berwarna ungu. Bentuk II berwarna merah muda, didapatkan jika Nos diisolasi
dalam kondisi aerob. Bentuk II memiliki aktivitas rendah, juga kandungan Cu
rendah, diduga karena oksigen mempengaruhi pusat katalitik. Bentuk I berubah
menjadi bentuk III yang berwarna biru jika ditionit ditambahkan. Bentuk IV dapat
30
secara katalitik. Bentuk V didapatkan dari Pseudomonas stutzeri mutan MK402
yang tidak dapat membentuk pusat katalitik. Setiap subunit enzim, yang disandi
oleh nosZ, mengandung dua pusat Cu. Ion logam yang terkandung paling sedikit
enam ion Cu setiap subunit. Kedua pusat tersebut adalah CuA yang merupakan sisi
masuknya elektron, dan CuZ yaitu sisi untuk mengikat substrat (Lalucat et al. 2006). Demaneche et al. (2009) menemukan ada dua tipe kelompok gen-gen
penyandi N2O reduktase yaitu nosRZDFYLX dan nosRZDFYL. nosZ merupakan gen struktural untuk enzim N2O reduktase yang mengandung Cu. nosR menyandi komponen regulator yang penting untuk transkripsi nosZ. nosDFY merupakan gen
untuk pematangan, produknya antara lain terlibat dalam perolehan dan proses
penggabungan Cu membentuk N2O reduktase yang aktif secara katalitik. Selain itu terdapat nosL penyandi NosL yang merupakan kaperon Cu (Lalucat et al. 2006). Sedangkan nosX menyandi komponen periplasmik (Demaneche et al. 2009). Aktivitas N2O reduktase dihambat oleh asetilen, karbon monoksida (CO), azida dan sianida (Kristjansson dan Hollocher 1980).
Beberapa faktor dapat mempengaruhi ekspresi gen-gen denitrifikasi.
Ekspresi gen-gen penyandi NO3- reduktase, NO2- reduktase (sitokrom cd1) dan N2O reduktase dipengaruhi oleh perbedaan tingkat O2 dan ketersediaan N oksida (Körner dan Zumft 1989). Ekspresi gen-gen norB dan nirS dari Pseudomonas mandelii tidak sensitif terhadap perubahan pH pada kisaran 6-8 tetapi menurun pada pH 5. Gen-gen tersebut tertunda induksi dan ekspresi maksimumnya pada
suhu di bawah 30 °C (Saleh-Lakha 2009). Aktivitas enzim-enzim denitrifikasi di
tanah kering menurun sekitar 16-29% setelah 7 hari inkubasi. Aktivitas
enzim-enzim akan kembali ke kondisi semula jika tanah dilembabkan kembali (Smith
dan Parsons 1985).
Reduksi N2O
Konversi N2O menjadi N2 merupakan tahap akhir dari jalur denitrifikasi. Beberapa bakteri denitrifikasi dapat tumbuh menggunakan N2O sebagai satu-satunya penerima elektron terakhir. Beberapa penelitian menunjukkan bahwa
aeruginosa galur P2 tumbuh baik menggunakan N2O eksogen sedangkan galur PAO1 dan P1 hanya menunjukkan sedikit pertumbuhan menggunakan N2O eksogen.
Bakteri-bakteri yang telah diketahui dapat tumbuh menggunakan dan
mereduksi N2O eksogen adalah Pseudomonas stutzeri JM300 dan Paracoccus denitrificans ATCC 19367 (Carlson dan Ingraham 1983). Galur yang
berbeda-beda dari Pseudomonas aeruginosa memiliki tanggapan berbeda terhadap N2O eksogen. Galur P2 tumbuh baik menggunakan N2O eksogen jika NO3- atau NO2 -(2-10 mM) ditambahkan di medium. Untuk galur PAO1 dan P1, N2O eksogen hanya sedikit berpengaruh terhadap hasil sel dan pertumbuhan, dengan
penambahan NO3- di medium. N2O eksogen tidak secara langsung menghambat pertumbuhan tetapi juga tidak secara signifikan digunakan untuk pertumbuhan.
Nampaknya NO3-, NO2- atau produk metabolismenya dapat menstimulasi galur P2 (tetapi tidak pada PAO1 dan P1) untuk tumbuh pada N2O eksogen. Ketiga galur tersebut menggunakan N2O endogen secara efisien untuk pertumbuhannya (Bazylinski et al. 1986).
Dalam biakan denitrifikasi Pseudomonas sp.220 terjadi akumulasi N2O jika O2 ditambahkan dengan tekanan 0.05 atm, karena reduksi N2O dihambat oleh O2 sebelum terjadinya penghambatan O2 terhadap reduksi NO2- (Watahiki et al. 1983). Meskipun pada umumnya enzim N2O reduktase memiliki korelasi negatif paling kuat terhadap tingkat konsentrasi O2 di lingkungannya dibandingkan dengan enzim-enzim denitrifikasi lainnya seperti pada penelitian Morley et al. (2008), tetapi N2O reduktase dari Thiosphaera pantotropha (Paracoccus denitrificans GB17) tetap aktif mereduksi N2O meskipun dalam biakan terdapat O2. Kedua gas yaitu N2O dan O2 direduksi secara bersamaan (Bell dan Ferguson 1991).
Dalam tanah, N2O dapat mengalami reduksi sebelum teremisikan. Reduksi N2O menjadi N2 oleh aktivitas N2O reduktase merupakan proses yang dominan dibandingkan dengan reduksi N2O menjadi NH3 oleh aktivitas nitrogenase. Potensi reduksi N2O oleh tanah tergantung kepada konsentrasi N2O dan O2, ukuran agregat tanah serta suhu. Agregat yang besar lebih banyak mengkonsumsi
32
menjadi penerima elektron dalam kondisi suboksik, bahkan jika respirasi aerob
masih aktif. Respirasi N2O dan respirasi O2 terjadi dalam mikrohabitat yang terpisah. Kecepatan respirasi lebih tinggi pada suhu 20 °C dibandingkan pada 5
°C (Vieten 2008). Aktivitas N2O reduktase mereduksi N2O juga terjadi di sedimen
laut, danau air tawar dan danau salin-alkalin (Miller et al. 1986).
Keanekaragaman dan Penyebaran Bakteri Denitrifikasi
Bakteri yang memiliki kemampuan melakukan proses denitrifikasi
memiliki sifat fisiologis beraneka ragam. Sebagian besar bakteri denitrifikasi
merupakan organisme heterotrof aerob (Zumft 1997). Bakteri Alcaligenes sp. yang diisolasi dari tanah merupakan bakteri denitrifikasi heterotrof yang sekaligus
memiliki kemampuan nitrifikasi (Castignetti dan Hollocher 1982).
Di antara bakteri denitrifikasi terdapat bakteri penambat N2. Bradyrhizobium japonicum merupakan bakteri penambat N2 yang memiliki enzim-enzim untuk reduksi NO3-, NO2-, NO dan N2O. NO3- reduktase berupa NO3- reduktase periplasmik (Bedmar et al. 2005). Bradyrhizobium japonicum yang bersimbiosis dengan tanaman kedelai dan membentuk bintil akar dapat
mereduksi N2O di sekitar akar kedelai (Sameshima-Saito et al. 2006). Azospirillum brasilense yang diisolasi dari rizoplen tanaman sorgum memiliki kemampuan menambat N2, denitrifikasi maupun nitrifikasi (Kundu et al. 1987).
Thioalkalivibrio denitrificans ALJD adalah bakteri denitrifikasi yang bersifat alkalifil, autotrof obligat, pengoksidasi belerang dan dapat tumbuh secara
anaerob dengan proses denitrifikasi. Bakteri ini dapat menggunakan NO2- dan N2O, tetapi tidak dapat menggunakan NO3- sebagai penerima elektron selama pertumbuhan anaerob pada senyawa belerang tereduksi. NO3- hanya digunakan sebagai sumber N. Dalam biakan sekali unduh (batch) pada pH 10, pertumbuhan
berlangsung cepat dengan menggunakan N2O sebagai penerima elektron dan tiosulfat sebagai pemberi elektron. Pertumbuhan menggunakan NO2- hanya dapat berlangsung setelah memperpanjang waktu adaptasi biakan terhadap peningkatan
konsentrasi NO2- (Sorokin et al. 2001).
dengan atau tanpa cahaya, menggunakan NO3-. Bakteri yang ditumbuhkan pada kondisi denitrifikasi, memiliki kandungan bakterioklorofil dan karotenoid
setengah dari kandungan senyawa-senyawa tersebut dalam sel yang ditumbuhkan
tanpa NO3-. Sintesis polipeptida yang merupakan bagian dari kompleks penerima
cahaya mengalami tekanan oleh NO3-, sedangkan aktivitas enzim-enzim denitrifikasi mengalami peningkatan. Jumlah ATP yang dihasilkan selama
denitrifikasi mencukupi kebutuhan sel sehingga ATP yang dihasilkan melalui
fotosintesis menjadi kurang efektif (Michalski dan Nicholas 1984).
Bakteri denitrifikasi memiliki penyebaran pertumbuhan di banyak
lingkungan. Komposisi komunitas bakteri dipengaruhi oleh beberapa hal misalnya
jenis pupuk yang ditambahkan ke tanah (Enwall et al. 2005). Di daerah pantai, komposisi komunitas denitrifikasi dipengaruhi oleh lokasi geografis dan kondisi
biokimia sedimen terutama konsentrasi NO3- dan O2 (Liu et al. 2003a). Komposisi komunitas bersama dengan faktor lingkungan berpengaruh terhadap
aktivitas denitrifikasi (Rich et al. 2003).
Lim et al. (2005) mengisolasi bakteri denitrifikasi dari tempat pengolahan
limbah dan banyak mendapatkan bakteri dari anggota filum Proteobacteria terutama dari kelas Gammaproteobacteria (Aeromonas, Klebsiella, Enterobacter)
dan Betaproteobacteria (Acidoverax, Burkholderia dan Commamonas). Selain itu
juga banyak didapatkan bakteri anggota Firmicute (Bacillus). Dari tanah sawah yang memiliki aktivitas denitrifikasi kuat banyak ditemukan bakteri anggota ordo
Burkholderiales dan Rhodocyclales (Ishii et al. 2009). Manucharova et al. (2000) mengamati adanya suksesi bakteri denitrifikasi di tanah yang terjadi antara
Myxobacteria dengan Bacillus (B. cereus, B. circulans dan B. polymyxa).
Sekuen nirS yang didapatkan dari sedimen pantai memiliki kemiripan tertinggi dengan nirS dari Alcaligenes faecalis (kemiripan 80-94%) dan P. stutzeri
34
memiliki kemiripan tertinggi dengan nosZ dari Rhizobiaceae yang merupakan anggota Alphaproteobacteria (Rich et al. 2003).
Faktor-faktor yang Mempengaruhi Emisi N2O dari Tanah
Emisi N2O dari tanah dipengaruhi oleh faktor-faktor lingkungan yang dapat saling berinteraksi mempengaruhi emisi N2O. Oksigen merupakan faktor
yang berkaitan erat dengan produksi N2O. Oksigen menghambat proses denitrifikasi pada tingkat yang berbeda di antara enzim-enzim denitrifikasi.
Reduksi N2O menjadi N2 lebih mudah terhambat oleh O2 dibandingkan reduksi NO3- menjadi N2O sehingga rasio N2O/N2 turun dengan adanya penurunan konsentrasi O2. Adanya O2 menurunkan aktivitas dan memperlambat dimulainya sintesis N2O reduktase relatif terhadap NO3- reduktase sehingga meningkatkan rasio N2O/N2 (Włodarczyk et al. 2004).
Emisi N2O dipacu oleh aplikasi pupuk N dan peningkatan emisi sejalan dengan bertambahnya dosis pupuk (Zhao et al. 2009). Aplikasi pupuk N meningkatkan produksi N2O melalui proses denitrifikasi maupun nitrifikasi (Estavillo et al. 2002). Berdasarkan penelitian Skiba et al. (1993) perbedaan jenis
pupuk yaitu (NH4)2SO4 dan KNO3 tidak secara signifikan mempengaruhi besarnya emisi N2O. Menurut Estavillo et al. (2000) enzim N2O reduktase dapat mengalami penghambatan atau sedikit diproduksi jika pupuk diaplikasikan
sehingga menyebabkan peningkatan produksi N2O.
Terdapat korelasi erat antara emisi N2O dengan kandungan bahan organik tanah (Włodarczyk et al. 2004). Berdasarkan hasil penelitiannya, Akiyama dan Tsuruta (2003) menyatakan bahwa aplikasi pupuk kotoran hewan meningkatkan
emisi N2O lebih besar dibandingkan urea. Emisi N2O dari tanah yang dipupuk dengan kotoran ayam adalah sebesar 184 mg N m-2 sedangkan dari tanah yang
dipupuk dengan urea sebesar 44.8 mg N m-2. Sedangkan penelitian Steven dan Laughlin (2002) memberikan hasil bahwa penambahan kotoran sapi pada saat
dapat diketahui bahwa di tanah hutan tropis kecepatan proses DNRA lebih besar
dari pada denitrifikasi.
Emisi N2O di tanah meningkat dengan peningkatan water-filled pore space (WFPS) yaitu pada WFPS 60, 80 dan 95% setelah penambahan pupuk N.
Peningkatan WFPS mengurangi terjadinya difusi O2 ke dalam agregat tanah menyebabkan kondisi anareob tanah. Pada kondisi anaerob N2O akan terbentuk
melalui denitrifikasi (Dobbie dan Smith 2001). Air dalam tanah memberikan
kondisi yang baik untuk pertumbuhan dan aktivitas mikroba tanah. Selain itu air
merupakan medium pergerakan substrat yang digunakan oleh mikroba (Pathak
1999).
Emisi N2O di Sawah
Sawah merupakan salah satu sumber N2O karena sifat tanah, kandungan air dan aktivitas mikrobanya yang bervariasi selama musim tanam (Hou et al. 2000). Sawah pada umumnya merupakan ekosistem yang tergenang pada saat
musim tanam dan berada dalam keadaan kering pada masa persiapan sebelum
musim tanam berikutnya (Forés dan Comin 1992). Pada keadaan tergenang,
sawah memiliki dua lapisan. Lapisan pertama yaitu lapisan permukaan yang
teroksidasi (aerob), pada umumnya berkedalaman beberapa milimeter sampai 1-2
cm. Kedalaman lapisan teroksidasi tergantung banyaknya bahan organik, karena
dengan banyaknya bahan organik aktivitas respirasi mikroba tinggi sehingga O2 banyak dikonsumsi. Selain itu, kedalaman lapisan aerob juga ditentukan oleh
struktur tanah yang mempengaruhi kecepatan difusi O2 ke lumpur sawah. Di bawah lapisan aerob adalah lapisan tereduksi (anaerob). Daerah peralihan
aerob-anaerob juga terdapat di sekitar perakaran. Jika pupuk NH4+ diaplikasikan ke lapisan permukaan, NH4+ akan mengalami nitrifikasi dan NO3- atau NO2- yang
terbentuk kemudian berdifusi turun dan selanjutnya mengalami denitrifikasi di
lapisan anaerob, menghasilkan N2O atau N2 (Garcia dan Tiedje 1981).
Perlakuan penggenangan dan pengeringan secara bergantian memberikan
lingkungan yang sesuai untuk denitrifikasi. Mineral N yang tersedia cukup di
36
selama periode kering secara cepat lepas melalui denitrifikasi jika tanah digenangi
kembali, dan proses ini dipacu oleh dekomposisi bahan organik (Garcia dan
Tiedje 1981). Penggenangan terputus juga memacu terbentuknya N2O melalui nitrifikasi, yaitu pada kondisi tanah sedang teroksidasi, terlebih jika ketersediaan
mineral N tinggi (Byrnes et al. 1993). Emisi N2O dari sawah yang tergenang secara terputus di tengah musim tanam dapat mencapai 993 g N ha-1 musim-1,
lebih besar dibandingkan N2O yang diemisikan dari sawah yang digenangi secara kontinyu yaitu 341 g N ha-1 musim-1 (Akiyama et al. 2005). Pada saat pengeringan kemungkinan emisi N2O juga meningkat karena reduksi N2O menjadi N2 terhambat. N2O yang terjebak di antara partikel tanah yang berada dalam keadaan basah maupun N2O yang terlarut dalam air, sebelum mengalami reduksi menjadi N2 dapat lepas ke udara pada saat pengeringan (Drury et al. 1992; Majumdar 2003). Akar tanaman padi yang rapat dapat mengurangi lepasnya N2O ke udara (Buresh et al. 1993).
Sistem penggenangan sangat menentukan nilai potensial redoks (Eh) tanah. Potensial redoks dapat mencapai +300 mV sebelum lahan digenangi. Nilai Eh akan menurun setelah lahan digenangi 5-10 cm dan dapat mencapai -200 mV
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian berlangsung mulai September 2007 sampai dengan Juli 2010
dengan beberapa tahap percobaan (Gambar 4). Sampel tanah sawah diambil dari
enam lokasi yang berada di Kabupaten Bogor, Kota Bogor dan Kota Tangerang,
pengambilan dilakukan di dua titik pada setiap lokasi. Penelitian sebagian besar
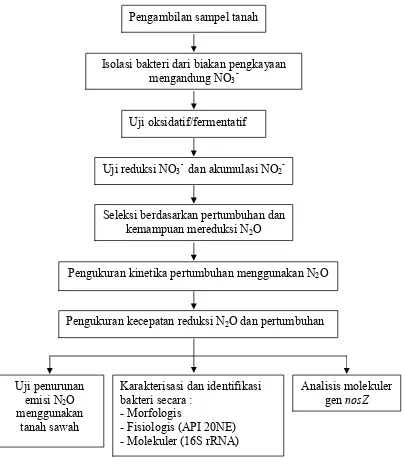
Gambar 4 Bagan alir penelitian. Pengambilan sampel tanah
Isolasi bakteri dari biakan pengkayaan mengandung NO3
-Uji oksidatif/fermentatif
Uji reduksi NO3- dan akumulasi NO2
-Seleksi berdasarkan pertumbuhan dan kemampuan mereduksi N2O
Pengukuran kinetika pertumbuhan menggunakan N2O
Pengukuran kecepatan reduksi N2O dan pertumbuhan
Uji penurunan emisi N2O menggunakan
tanah sawah
Karakterisasi dan identifikasi bakteri secara :
- Morfologis
- Fisiologis (API 20NE) - Molekuler (16S rRNA)
38
dilakukan di Laboratorium Mikrobiologi Departemen Biologi, Fakultas
Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor (IPB), Bogor.
Sebagian penelitian dilaksanakan di Microbial Ecology Laboratories, Department
of Biological Sciences, University of Essex, United Kingdom. Gas N2O diukur
menggunakan kromatografi gas di Laboratorium Bioteknologi Tanah Departemen
Ilmu Tanah dan Sumber Daya Lahan IPB dan Laboratorium Balai Penelitian
Lingkungan Pertanian, Jakenan, Pati. Sekuensing dilakukan di Research and Development Center Biotechnology Department PT Charoen Pokphand Indonesia dan 1st BASE Pte Ltd Singapura.
Bahan
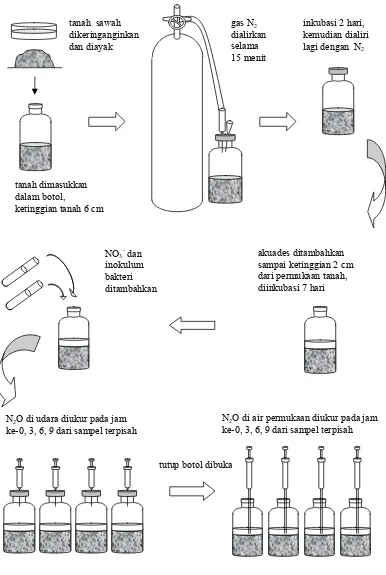
Sampel tanah diambil menggunakan siring tanpa jarum yang ujungnya
dipotong. Panjang siring 5 cm dengan diameter 1 cm. Setelah berisi tanah, ujung
siring ditutup rapat dengan plastik sampai kedap udara untuk menghindari
masuknya oksigen (Lampiran 1a). Untuk keperluan isolasi, sampel dari dua titik
pengambilan sampel dicampur. Sebelum digunakan sebagai sumber isolat, tanah
diukur pHnya. Komposisi medium denitrifikasi yang digunakan adalah sebagai
berikut (g L-1): NaNO3 2.55; CH3COONa.3H2O 2.72; K2HPO4 0.80; KH2PO4 0.30; NH4Cl 0.40; MgSO4.7H2O 5.20 dan larutan yang berisi unsur-unsur hara mikro 2 ml. Larutan unsur-unsur hara mikro mengandung (g L-1): NaEDTA 50; ZnCl2 1.41; CaCl2 5.50; MnCl2.4H2O 5.06; FeCl3.6H2O 4.86; (NH)4Mo7O24.4H2O 1.10; CuSO4.5H2O 1.57; CoCl2.6H2O 1.61 (Barford et al. 1999). Medium disterilisasi dengan suhu 121 °C selama 20 menit. Medium yang digunakan untuk
pemeliharaan isolat dan uji aktivitas tidak menggunakan larutan unsur-unsur hara
mikro seperti yang digunakan untuk isolasi tetapi medium ditambah ekstrak
khamir 3 g L-1.
Isolasi Bakteri
Biakan pengkayaan dibuat menggunakan 30 ml medium denitrifikasi cair
(Lampiran 1b). Kondisi anaerob dibuat dengan mengalirkan gas N2 ke medium dalam botol biakan selama 10 menit.
Satu gram tanah sampel dibuat menjadi suspensi dengan menambahkan 4
mL akuades steril. Satu mililiter suspensi tanah dimasukkan ke dalam botol serum
yang telah berisi medium steril dengan menggunakan siring steril. Inkubasi
dilakukan pada suhu ruang (28-30°C) selama 5-7 hari. Pertumbuhan bakteri
ditandai dengan kekeruhan medium dan dihasilkannya gas yang dapat dilihat
sebagai gelembung-gelembung di permukaan medium. Satu lup cairan biakan
digoreskan ke permukaan medium agar-agar di cawan petri dan diinkubasi secara
aerob maupun anaerob. Inkubasi anaerob dilakukan dengan menempatkan biakan
dalam cawan anaerob. Koloni bakteri yang terpisah digoreskan kembali ke
permukaan medium agar-agar yang baru. Bakteri hasil isolasi disimpan di
medium agar-agar miring dalam tabung reaksi pada suhu 4 °C sebelum digunakan
untuk perlakuan berikutnya.
Pembuatan Inokulum
Inokulum dibuat dengan menumbuhkan isolat bakteri pada medium
denitrifikasi cair dengan konsentrasi NO3- setengah dari konsentrasi NO3- yang digunakan untuk membuat medium pemeliharaan biakan. Biakan yang digunakan
sebagai inokulum berada pada fase eksponensial dengan optical density (OD) 0.6
pada spektrofotometer (panjang gelombang 550 nm) atau turbiditas 80 pada
nephelometer. Sebelum diinokulasikan, biakan inokulum disentrifugasi 4500 x g
selama 10 menit kemudian sel yang didapatkan disuspensikan ke dalam akuades
steril dengan volume yang sama dengan volume awal. Selanjutnya suspensi
disentrifugasi lagi, sel yang didapatkan disuspensikan lagi dengan akuades steril.
Inokulum ditambahkan sebanyak 2% dari medium yang digunakan dalam
perlakuan.
Uji Oksidatif/Fermentatif
Uji oksidatif/fermentatif dilakukan untuk memilih bakteri yang bersifat
oksidatif karena bakteri denitrifikasi pada umumnya bersifat oksidatif dan juga
40
NH4+. Medium yang digunakan mengandung (g 100 mL-1) : pepton 2; NaCl 0.5; K2HPO4 0.03; biru brom timol 0.003; agar 0.3; glukosa 1, pH 7 (Hugh dan Leifson 1953). Sebanyak 5 mL medium dituang ke dalam tabung reaksi
berpenutup ulir dengan volume 12 mL, kemudian isolat bakteri diinokulasikan
secara tusukan. Di atas biakan dituangkan parafin cair untuk membuat kondisi
anaerob. Inkubasi dilakukan pada suhu ruang selama 7 hari. Kelompok bakteri
fermentatif akan menghasilkan asam sehingga warna hijau medium menjadi
kuning.
Pengukuran Reduksi NO3-
Bakteri ditumbuhkan dalam medium denitrifikasi cair tanpa NO3- dalam botol serum bertutup karet. Kondisi anaerob dibuat dengan mengalirkan gas N2 ke dalam medium selama 10 menit. Inokulum ditambahkan ke 40 mL medium yang mengandung NO3- 1500 µM dalam botol serum. Inkubasi dilakukan pada suhu ruang selama 3 hari. Pada hari ketiga diukur kadar NO3- dengan metode brusin (APHA 1975). Uji ini dilakukan untuk memastikan bahwa bakteri hasil isolasi
merupakan bakteri pereduksi NO3- karena reduksi NO3- merupakan tahap awal dari denitrifikasi dan untuk mengetahui kemampuan isolat mereduksi NO3-. Percobaan dilakukan dengan dua ulangan.
Biakan cair umur 3 hari ditambah 1 tetes HgCl2 0.1% untuk mematikan dan menggumpalkan sel. Satu mililiter bagian cair diambil dan diencerkan dua
puluh kali. Dua mililiter hasil pengenceran ditambah 0.2 mL brusin 0.5%
(Lampiran 2a) kemudian dihomogenkan menggunakan vorteks. Selanjutnya 4 mL
asam sulfat (H2SO4) pekat ditambahkan, dihomogenkan kembali. Campuran didinginkan sampai berwarna kuning. Pengukuran dilakukan dengan
spektrofotometer Bausch-Lomb Spectronic 20 pada panjang gelombang 420 nm.
Pengukuran Akumulasi NO2
-Sampel untuk pengukuran NO2- diambil dari biakan yang sama untuk pengukuran NO3-. Lima mililiter biakan cair umur 3 hari yang telah ditambah HgCl2 0.1% dicampur dengan 0.1 mL sulfanilamida (C6H8N2O2S) 1% (Lampiran
2b) kemudian dihomogenkan dengan vorteks. Selanjutnya 0.1 mL
N-1-naftiletilendiamina (NED)(C6H12Cl2N2) 0.1% ditambahkan dan dihomogenkan
kembali. Campuran biakan, sulfanilamida dan NED didiamkan sampai berwarna
ungu kemerahan. Pengukuran dilakukan dengan spektrofotometer Bausch-Lomb
Spectronic 20 pada panjang gelombang 540 nm (APHA 1975). Untuk
menghitung konsentrasi NO2- dibuat kurva standar antara konsentrasi NO2- (0, 0.2, 0.4, 0.6, 0.8, 1.0 mg L-1) dengan nilai absorbansi (Lampiran 3b).
Seleksi Berdasarkan Pertumbuhan dan Kemampuan Mereduksi N2O
Medium cair tanpa NO3- disiapkan dalam tabung reaksi bertutup karet Kondisi anaerob dibuat dengan mengalirkan gas N2 selama 10 menit ke medium dalam tabung biakan. Gas N2O ditambahkan ke udara di atas medium dalam botol (headspace) sehingga konsentrasi N2O di headspace sebesar 3.54 µmol ml-1. Biakan diinkubasi selama 5 hari pada suhu ruang (28-30 °C) (Lampiran 1c). Pada
awal dan akhir perlakuan dilakukan pengukuran optical density (OD) dan konsentrasi N2O di headspace. Pengukuran OD dilakukan menggunakan spektrofotometer Bausch-Lomb Spectronic 20 pada panjang gelombang 550 nm
sedangkan pengukuran konsentrasi N2O dilakukan dengan kromatografi gas Shimadzu 14B electron capture detector (ECD). Suhu kolom, injektor dan detektor pada kromatografi masing-masing 75, 100 dan 340 °C. Konsentrasi gas
standar yang digunakan 9.45 ppm. Untuk pengukuran N2O, gas diambil dari headspace menggunakan siring, selanjutnya disuntikkan ke kromatografi gas.
Tekanan dan suhu ruang pada saat pengukuran dicatat. Medium steril digunakan
sebagai kontrol. Percobaan dilakukan dengan dua ulangan. Konversi konsentrasi
gas ke molar dihitung dengan Hukum Gas Ideal (rumus 1):
42
dengan P menyatakan tekanan (atm), V menyatakan volume (L), n menunjukkan mol, T menunjukkan suhu (K) sedangkan R adalah konstanta gas (0.08206 L atm/mol K) (Reger et al. 2009).
Pengukuran Kinetika Pertumbuhan Menggunakan N2O
Bakteri ditumbuhkan di medium denitrifikasi cair tanpa NO3- dalam
tabung reaksi dengan kondisi anaerob. Gas N2O 10% disuntikkan ke headspace dengan empat tingkat konsentrasi masing-masing 1, 20, 40 dan 60% dari volume
headspace sehingga N2O yang terlarut dalam medium terhitung masing-masing sebesar 88, 900, 1380 dan 1979 µM pada keadaan kesetimbangan. Percobaan
dilakukan dengan tiga ulangan.
N2O yang terlarut dalam medium dihitung dengan rumus 2.
S = α x H x volume medium (2) volume headspace
dengan S adalah N2O terlarut (µmol), α menyatakan kelarutan N2O dalam air pada suhu tertentu (cm3 N2O cm-3 H2O) sedangkan H menyatakan banyaknya N2O yang ada di headspace (µmol). Kelarutan N2O dalam air pada suhu 30°C sebesar 0.530 cm3 N2O cm-3 H2O (Carter 1993).
Setelah penambahan inokulum, OD diamati setiap 2 jam menggunakan spektrofotometer Fisher Electrophotometer 11 pada panjang gelombang 525 nm.
Kurva standar dibuat antara OD dengan jumlah bakteri. Jumlah bakteri dihitung
dengan metode hitungan cawan. Kecepatan pertumbuhan spesifik atau µ (jam-1) dihitung dengan rumus 3.
µ=(∆lnN)/∆t (3)
dengan N merupakan jumlah sel sedangkan t menunjukkan waktu (jam). Kecepatan pertumbuhan maksimum dan konstanta Monod dihitung berdasarkan
µ = µ max S (4) Ks + S
dengan µmax (jam-1) menyatakan kecepatan pertumbuhan maksimum, S
menyatakan konsentrasi substrat awal (µM) sedangkan Ks adalah konstanta Monod (µM jam-1) yang berhubungan dengan arah kesetimbangan reaksi
pertumbuhan mikroba (Stainer et al. 1976; El Hassan et al. 1985; Liu et al. 2003b). Untuk mempermudah penghitungan µmax dan Ks digunakan transformasi linier dari persamaan Monod, yaitu dengan persamaan Hanes (Wilson dan Walker
2000) (rumus 5). Plot Hanes yang menempatkan konsentrasi substrat S di sumbu
S = Km + S (5) µ µmax µmax
x dan S/µ di sumbu y menghasilkan garis lurus dengan kemiringan 1/ µmax. Perpotongan dengan sumbu x adalah Ks sedangkan perpotongan dengan sumbu y adalah Ks/ µmax.
Pengukuran Kecepatan Reduksi N2O dan Pertumbuhan
Bakteri ditumbuhkan di medium denitrifikasi dalam tabung reaksi dengan
suasana anaerob. Gas N2O ditambahkan ke headspace sehingga konsentrasi awal N2O terlarut dalam medium terhitung sebesar 12.75 mM. Inkubasi dilakukan di atas pemutar (roller) pada suhu 30 °C. Setiap 3 jam, konsentrasi N2O di headspace diukur menggunakan kromatografi gas Shimadzu 14A ECD. Pengukuran konsentrasi N2O dilakukan dengan mengambil udara dari headspace menggunakan siring kemudian disuntikkan ke kromatografi. Suhu kolom, injektor
dan detektor masing-masing 35, 200 dan 340 °C. Konsentrasi gas yang digunakan
1000 ppm. Pertumbuhan diamati secara turbidimetrik menggunakan nephelometer
EEL unigalvo DS29. Turbiditas dikonversi ke jumlah bakteri dengan pembuatan
kurva standar (Lampiran 3c). Percobaan dilakukan dengan tiga ulangan.
Kecepatan reduksi N2O dihitung dengan rumus 7.