TINGKAT ENKAPSULASI PARASITOID Eriborus
argenteopilosus (Cameron) PADA INANG Crocidolomia pavonana
(Fabricius) YANG DIBERI ENAM JENIS PAKAN
YUNIAN ASIH ANDRIYARINI
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRAK
YUNIAN ASIH ANDRIYARINI. Tingkat Enkapsulasi Parasitoid Eriborus argenteopilosus (Cameron) pada Inang Crocidolomia pavonana (Fabricius) yang Diberi Enam Jenis Pakan. Dibimbing oleh ENDANG SRI RATNA.
Crocidolomia pavonana (Fabricius) (Lepidoptera: Crambidae) merupakan salah satu hama penting pada tanaman kubis-kubisan. Kehilangan hasil akibat serangan C. pavonana dapat mencapai 100%. Eriborus argenteopilosus (Cameron) (Hymenoptera: Ichneumonidae) adalah endoparasitoid C. pavonana yang relatif dominan ditemukan di lapang. Namun kinerja parasitoid tersebut kurang maksimal akibat adanya respon pertahanan inang berupa kemampuan enkapsulasi di dalam tubuh larva C. pavonana. Penelitian ini bertujuan membandingkan tingkat enkapsulasi parasitoid E. argenteopilosus pada inang C. pavonana yang diberi enam jenis pakan. Pakan yang digunakan antara lain caisin, brokoli, kubis, pakchoi, lobak dan sawi. Persentase enkapsulasi ditentukan
dengan melakukan pembedahan larva C. pavonana yang telah terparasit E. argenteopilosus pada 48 JSP, telur dan larva yang terenkapsulasi dihitung. Data
pendukung didapat dari kebugaran inang yang meliputi panjang pupa, bobot pupa, dan fekunditas/betina. Hasil penelitian menunjukkan bahwa persentase enkapsulasi tertinggi 81% terdapat pada inang yang diberi perlakuan pakchoi yang tidak berbeda nyata dengan perlakuan caisin (69%). Persentase enkapsulasi terendah 43% terdapat pada inang yang diberi perlakuan sawi. Pupa inang yang memiliki ukuran terpanjang dengan bobot terberat terdapat pada perlakuan caisin sebesar 10.4 mm dan 55.8 mg yang berbeda nyata dengan pupa terpendek dan teringan dijumpai pada perlakuan sawi dan lobak sebesar 9.2-9.3 mm dan 42.7-45.8 mg. Fekunditas/betina tertinggi terdapat pada perlakuan brokoli sebesar 290 telur/betina. Hasil tersebut menunjukkan bahwa ada kecenderungan inang yang memiliki pupa berukuran lebih panjang dan bobot yang lebih berat menghasilkan tingkat enkapsulasi yang relatif lebih tinggi. Hal ini berarti bahwa kualitas jenis pakan mempengaruhi kebugaran dan kemampuan enkapsulasi inang C. pavonana.
TINGKAT ENKAPSULASI PARASITOID Eriborus
argenteopilosus (Cameron) PADA INANG Crocidolomia pavonana
(Fabricius) YANG DIBERI ENAM JENIS PAKAN
YUNIAN ASIH ANDRIYARINI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Skripsi : Tingkat Enkapsulasi Parasitoid Eriborus argenteopilosus (Cameron) pada Inang Crocidolomia pavonana (Fabricius) yang Diberi Enam Jenis Pakan.
Nama Mahasiswa : Yunian Asih Andriyarini
NIM : A34080020
Disetujui oleh
Dosen Pembimbing
Endang Sri Ratna, Ph.D. NIP. 19580120 198203 2 001
Diketahui oleh
Ketua Departemen Proteksi Tanaman
Dr. Ir. Abdjad Asih Nawangsih, M.Si. NIP 19650621 198910 2 001
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 28 Juni 1990 di Sragen, Jawa Tengah. Penulis merupakan anak keempat dari empat bersaudara, dari pasangan (Alm) Bapak Agus Priyono dan Ibu Hartatik. Pendidikan dasar diselesaikan pada tahun 2002 di SD Negeri 4 Sragen. Pendidikan menengah pertama diselesaikan pada tahun 2005 di SMP Negeri 5 Sragen, dan pendidikan menengah atas diselesaikan pada tahun 2008 di SMA Negeri 1 Sragen. Penulis diterima sebagai mahasiswa program studi Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor melalui jalur USMI (Undangan Seleksi Masuk IPB) pada kurikulum berbasis mayor-minor di tahun 2008. Penulis merupakan penerima beasiswa PPA (Peningkatan Prestasi Akademik) dari tahun 2008-2012.
Selama menjadi mahasiswa penulis aktif dalam organisasi PMSB (Paguyuban Mahasiswa Sragen Bogor) dan menjadi pengurus di HIMASITA (Himpunan Mahasiswa Proteksi Tanaman) pada divisi Bisnis dan Kewirausahaan periode 2010/2011. Penulis pernah menjuarai Lomba Karikatur dalam acara “Lets Fight Against Drugs” di tingkat TPB sebagai juara II. Selain itu beberapa PKM (Program Kreativitas Mahasiswa) yang diikuti oleh penulis lolos dan didanai oleh DIKTI. Pada tahun 2011 lolos PKM-P dan didanai DIKTI dengan judul “Pengujian Biji Jarak (Ricinus communis), Mahoni (Swietenia mahagoni), dan Bintaro (Cerbera odollam) terhadap Tikus sawah (Rattus argentiventer) dan Tikus Rumah (Rattus rattus diardii) sebagai Rodentisida Nabati”, sementara di tahun 2012 penulis lolos PKM-P dengan judul “Pemanfaatan Cangkang Telur sebagai Penginduksi Ketahanan Tanaman Tomat terhadap Layu Bakteri Ralstonia solanacearum dan Bercak Coklat Alternaria solani” dan PKM-K dengan judul “Kutejau (Cookies Teh Hijau): Cara Unik Menikmati Teh Hijau sebagai Kudapan yang Lezat dan Menyehatkan”, sebagai ketua pelaksana.
PRAKATA
Puji Syukur penulis panjatkan kehadirat Allah SWT karena atas limpahan berkah, rahmat, dan hidayah-Nya penulis dapat menyelesaikan skripsi yang berjudul “Tingkat Enkapsulasi Parasitoid Eriborus argenteopilosus (Cameron) pada Inang Crocidolomia pavonana (Fabricius) yang Diberi Enam Jenis Pakan”. Penelitian dan penulisan skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor (IPB).
Penulis menyadari bahwa terselesaikannya penelitian dan skripsi ini tidak terlepas dari bantuan banyak pihak. Oleh karena itu, dalam kesempatan ini penulis mengucapkan terimakasih kepada:
1. Endang Sri Ratna, Ph.D selaku dosen pembimbing yang telah memberikan bimbingan dan arahan kepada penulis.
2. Ir. Ivonne Oley Sumarauw, M.Si selaku dosen penguji tamu yang telah banyak memberikan arahan dan saran yang membangun kepada penulis. 3. Ir. Djoko Prijono, MAgrSc yang telah banyak memberikan arahan kepada
penulis.
4. Ibu tercinta Hartatik yang senantiasa memberikan kasih sayang, nasehat, doa, motivasi dan dorongan, Alm Ayah Agus Priyono yang senantiasa menjadi inspirasi, serta kakak-kakak (Hari Purnomo, Prihananto, Melita Andriyani) yang menjadi penyemangat bagi penulis.
5. Rekan-rekan di Laboratorium Fisiologi dan Toksikologi Serangga: Yuke Nur Aprilianti, Miranti Christi Arifin, Anita Widyawati, Rizky Irawan SP, Yan Yanuar Syahroni, Dian Fitria SP, Elsa Dwi Juliana SP, dan Herma Amalia M.Si.
6. Sahabatku Ismawati SP, R Tia Santiani Heryana, dan Nurul Afriyanti SP, serta teman-teman PTN 45 yang telah banyak memberikan dorongan dan semangat.
7. Teman-teman Wisma Amany atas dorongan dan semangatnya.
8. Pak Ucup, Pak Saodik, Pak Agus, Pak Dede, Pak Endang, Pak Karto serta seluruh pihak yang telah membantu kelancaran penelitian.
Semoga penelitian ini bermanfaat bagi perkembangan ilmu pengetahuan, khususnya di bidang pertanian.
Bogor, Desember 2012
DAFTAR ISI
Enkapsulasi : Reaksi Pertahanan Inang terhadap Parasitoid ... 6
Implikasi Enkapsulasi dalam Pengendalian Hayati ... 8
Pengaruh Pakan terhadap Kebugaran dan Kemampuan Enkapsulasi Inang ... 8
Pengamatan Enkapsulasi E. argenteopilosus ... 11
Pengamatan Kebugaran Inang C. pavonana pada Enam Jenis Pakan 12
Pengolahan Data ... 12
HASIL DAN PEMBAHASAN ... 13
Perbandingan Tingkat Enkapsulasi Parasitoid E. argenteopilosus pada Inang C. pavonana yang Diberi Perlakuan Enam Jenis Pakan . 13
Kebugaran Inang C. pavonana pada Enam Jenis Pakan ... 15
DAFTAR TABEL
Halaman 1 Perbandingan tingkat enkapsulasi parasitoid E. argenteopilosus pada
inang C. pavonana dengan enam jenis pakan ... 13 2 Kebugaran C. pavonana pada enam jenis pakan ... 16 3 Komposisi nutrisi enam jenis pakan ... 18
PENDAHULUAN
Latar Belakang
Eriborus argenteopilosus merupakan endoparasitoid soliter yang banyak ditemukan pada hama Crocidolomia pavonana (Sathe 1987; Sembel 2010). Parasitoid ini dapat hidup pada inang lain yaitu Spodoptera litura (Sathe 1987) dan Helicoverpa armigera (Bilapate et al 1988; La Daha 1997). Tingkat parasitisasi E. argenteopilosus pada inang C. pavonana relatif rendah yang hanya mencapai 7.23% (Othman 1982). Rendahnya tingkat parasitisasi diduga
disebabkan oleh sistem pertahanan yang dimiliki C. pavonana, yaitu berupa kemampuan mengenkapsulasi yang cukup tinggi hingga 80% (Sahari 1999).
Enkapsulasi merupakan suatu respon pertahanan yang umum dilakukan oleh
serangga inang terhadap endoparasitoid dan organisme asing lainnya (Strand dan
Pech 1995; Blumberg 1997).
C. pavonana dikenal sebagai ulat titik tumbuh pada tanaman kubis, menyerang secara berkelompok dan mempunyai sifat makan rakus (Soeroto et al. 1994). Kerusakan tanaman oleh hama ini dapat menyebabkan kehilangan hasil
hingga mencapai 100% (Sastrosiswojo 1996). C. pavonana sering ditemukan menyerang berbagai tanaman yang tergolong dalam famili brassicaceae contohnya
selain kubis adalah brokoli, kubis bunga, sawi, dan lobak (Kalshoven 1981).
Besarnya tingkat kerusakan tanaman ini tidak sebanding dengan rendahnya
tingkat parasitisasi larva, sehingga menyebabkan hama C. pavonana cukup sulit untuk dikendalikan di lapangan. Informasi mengenai kemampuan enkapsulasi
C. pavonana pada berbagai tanaman inang belum banyak dilaporkan, sehingga perlu diteliti lebih lanjut.
Tujuan Penelitian
Penelitian ini bertujuan membandingkan tingkat enkapsulasi parasitoid
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai jenis pakan
inang C. pavonana yang mempunyai kandungan nutrisi paling sesuai dalam kaitannya dengan kemampuan mengenkapsulasi parasitoid E. argenteopilosus (tingkat enkapsulasi terendah), sehingga dapat membantu kegiatan konvervasi
alami untuk meningkatkan keefektifan pengendalian hayati serangga hama di
TINJAUAN PUSTAKA
Parasitoid Eriborus argenteopilosus (Cameron)
Eriborus argenteopilosus (Cameron) (Hymenoptera: Ichneumonidae) adalah sejenis tabuhan yang memarasit larva C. pavonana (Sathe 1987). Inang lain dari parasitoid ini adalah larva Helicoverpa armigera (Bilapate et al 1988; La Daha 1997) dan Spodoptera litura (Sathe 1987). Telur parasitoid E. argenteopilosus berwarna putih dan bentuknya menyerupai biji kacang buncis (Othman 1982).
Panjang telur berkisar antara 0.31-0.42 mm dan lebar 0.07-0.11 mm (Sahari
1999). Masa inkubasi telur berkisar antara 32-36 jam (Hadi 1985).
Larva E. argenteopilosus berwarna putih kekuning-kuningan (Hadi 1985). Larva terdiri atas lima instar (Sathe 1990). Bentuk larva parasitoid instar I dan II
termasuk tipe caudate dicirikan tubuh memanjang tidak bertungkai, ruas tubuh jelas dan ruas abdomen terakhir berbentuk mengerucut menyerupai ekor. Larva
instar lanjut termasuk tipe hymenopteriform (Clausen 1940). Larva tidak bertungkai, mandibel jelas dan ujung abdomen membulat. Lama stadium larva
parasitoid bergantung pada jenis atau umur larva inang (Othman 1982). Stadium
larva berkisar antara 9-10 hari pada inang C. pavonana (Hadi 1985) atau 9 hari pada inang Spodoptera litura (Sathe 1990). Stadium larva yang berkembang pada inang C. pavonana berumur 2, 3, 4, dan 5 hari berturut-turut 10-12 hari, 9-13 hari, 8-13 hari, dan 7-9 hari (Othman 1982). Sebelum menyelesaikan instar akhir, larva
parasitoid E. argenteopilosus keluar dari tubuh inang, kemudian menyelimuti tubuhnya dengan kokon. Di dalam kokon, larva memasuki fase pra pupa yang
berlangsung sekitar 1-2 hari dan dilanjutkan dengan pembentukan pupa. Pupa
berwarna coklat tua dengan panjang berkisar antara 7-9 mm dan lebar 2-3 mm
(Othman 1982). Stadium pupa pada inang C. pavonana berkisar antara 7-9 hari (Hadi 1985) sedangkan pada inang S. litura stadium pupa ± 6 hari (Sathe 1990).
Imago parasitoid E. argenteopilosus memiliki toraks hitam dan abdomen berwarna coklat kemerahan. Parasitoid betina dicirikan dengan keberadaan
ovipositor yang relatif panjang. Ukuran tubuh parasitoid betina umumnya lebih
besar dibandingkan dengan jantan. Panjang tubuh dan rentang sayap imago betina
mm dan 9.0-12.0 mm (Othman 1982). Nisbah kelamin jantan: betina adalah 1.16:
1 hasil perkembangan pada C. pavonana (Hadi 1985) dan 1:1.07 pada S. litura (Sathe 1990). Imago jantan biasanya muncul 1-3 hari lebih awal dari imago
betina. Kopulasi terjadi segera setelah betina muncul dari pupa, dan periode
pra-oviposisi memerlukan waktu kurang dari 24 jam (Sathe 1990). Parasitoid betina
umumnya meletakkan telur pada inang C. pavonana instar I, II, dan III. Rata-rata lama hidup imago betina 13.3 hari dan jantan 6.7 hari (Hadi 1985). Imago
parasitoid yang diberi pakan madu 10% di laboratorium dapat hidup selama 15.1
hari, sedangkan imago yang tidak diberi pakan hanya bertahan hingga 2 hari
(Sathe 1990). Keperidian imago betina mencapai 317-453 butir telur (Hadi 1985).
Crocidolomia pavonana (Fabricius)
Ulat krop kubis Crocidolomia pavonana (Fabricius) (Lepidoptera: Crambidae) merupakan salah satu hama penting pada tanaman sayuran
brassicaceae seperti kubis, brokoli, kubis bunga, sawi, dan lobak (Kalshoven
1981). Hama C. pavonana tersebar di daerah Afrika, India, dan Asia Tenggara termasuk Indonesia yang meliputi Sumatera Utara, Sumatera Selatan, Jawa Barat,
Jawa Tengah, Jawa Timur, Bali, Nusa Tenggara Barat, Sulawesi Selatan, dan
Sulawesi Utara (Soeroto et al. 1994).
Telur C. pavonana diletakkan secara berkelompok dan berderet saling tumpang tindih di permukaan bawah daun. Saat diletakkan, telur berwarna hijau
kemudian setelah dua hari berubah menjadi kuning kehijauan, coklat kemerahan,
dan sebelum menetas berwarna hitam kelabu (Korinus 1995). Periode inkubasi
telur rata-rata 4 hari pada suhu 26-33.2 °C dengan persentase penetasan 92.4%
(Othman 1982).
Larva C. pavonana berkembang melalui empat instar (Prijono dan Hassan 1992). Setiap instar memerlukan waktu perkembangan berturut-turut 2, 2, 1.5,
dan 3.2 hari, sehingga stadium perkembangan larva rata-rata 8.7 hari pada suhu
25-28 °C dan kelembaban nisbi 60-70%. Larva instar empat dicirikan dengan
corak tubuh berwarna hijau dan garis memanjang berwarna keputihan pada setiap
sisi lateral. Pada setiap ruas terdapat tiga bintik hitam dan seta pada setiap sisinya.
pada saat akan menjadi pupa (Othman 1982). Larva berkepompong di dalam
tanah. Pupa berwarna coklat kekuningan kemudian berubah menjadi coklat tua.
Lama stadium pupa berlangsung 10 hari pada suhu 26-32.2 °C dan kelembaban
nisbi 54.1-87.8% (Othman 1982).
Imago C. pavonana dibedakan antara jantan dan betina dengan tanda dua bercak putih pada sayap depan (Othman 1982). Selain itu, imago jantan mudah
dikenali dengan adanya rambut-rambut coklat tua pada tepi anterior sayap depan.
Tubuh imago jantan umumnya lebih panjang (11.4 mm) dibandingkan imago
betina (9.6 mm) (Prijono dan Hassan 1992). Di laboratorium, imago betina yang
diberi pakan tambahan madu lebah 10% dapat meletakkan 60-598 butir telur
yang tersusun dalam 2-21 kelompok telur. Lama inkubasi telur berlangsung 3-10
hari pada suhu 16-22.5 °C dan kelembaban nisbi 60-80% (Othman 1982).
Hubungan Parasitoid - Inang
Pengendalian hayati merupakan sistem pengendalian yang memanfaatkan keberadaan musuh alami di lapang dan menjadi inti dari program PHT. Salah satu musuh alami yang digunakan sebagai agen biologis dalam mengendalikan hama di lapangan adalah parasitoid (Rehman dan Powell 2010). Kehidupan parasitoid di lapangan dipengaruhi oleh beberapa faktor biotik dan abiotik. Keberadaan inang merupakan faktor biotik yang diperlukan parasitoid untuk berkembang dan melangsungkan siklus hidupnya (Nelly dan Yaherwandi 2006). Keberhasilan parasitoid untuk mendapatkan inang dilalui dengan empat tahapan pencarian
inang, yaitu: 1) penemuan habitat inang, 2) penemuan individu inang, 3) penerimaan inang oleh parasitoid, dan 4) kesesuaian hidup parasitoid di dalam
tubuh inang (Doutt 1959). Van Alpen dan Vet (1986) mengemukakan bahwa dalam posisi penemuan inang, parasitoid menggunakan tiga mekanisme yaitu: 1) menandai adanya vibrotaksis (gerakan inang), 2) dengan perabaan oleh ovipositor dan 3) perabaan oleh antena. Berbagai interaksi seperti genetik, faktor pembelajaran dan pengkondisian memiliki peranan penting pada perilaku pemilihan inang yang dilakukan oleh parasitoid (Rehman dan Powell 2010). Sementara menurut Strand dan Pech (1995) kesesuaian parasitoid-inang dapat
menyerang inang, kecukupan akan kebutuhan untuk perkembangan parasitoid dan
menghindari penyisihan oleh sistem kekebalan inang, 2) kemampuan inang untuk
bereaksi melawan penyerangan parasitoid.
Enkapsulasi : Reaksi Pertahanan Inang terhadap Parasitoid
Keberhasilan parasitisme berkaitan erat dengan kesesuaian sistem
pertahanan tubuh internal inang terhadap serangan parasitoid (Strand dan Pech
1995). Enkapsulasi merupakan suatu respon pertahanan yang umum dilakukan
oleh serangga inang terhadap endoparasitoid dan organisme asing lainnya (Strand
dan Pech 1995; Blumberg 1997). Menurut Gupta (1991) dan Chapman (1998)
proses enkapsulasi dimulai dengan terjadinya kontak antara benda asing yang cukup besar seperti telur atau larva parasitoid dengan sel-sel darah granulosit atau koagulosit yang mengakibatkan sel-sel darah tersebut pecah dan melepaskan faktor-faktor pengenal (recognition factor) yang terdiri dari zat yang mirip mukopolisakarida, senyawa fenol, dan fenoloksidase (juga terdapat dalam cairan darah) serta enzim-enzim (diproduksi oleh sel-sel oenositoid). Faktor pengenal tersebut merangsang sel-sel plasmatosit menempel dan memipih pada permukaan telur atau larva parasitoid membentuk kapsul. Kapsul yang terbentuk mempunyai tiga lapisan: 1) lapisan bagian dalam yang terdiri dari sel-sel plasmatosit (ketebalan 10 sel) yang mengalami nekrosis setelah memproduksi melanin, 2) lapisan tengah yang terdiri dari sel-sel plasmatosit yang memipih (ketebalan 20 sel) sel-sel ini dihubungkan oleh desmosom, dan 3) lapisan bagian luar yang terdiri atas sel-sel plasmatosit yang tidak termodifikasi (ketebalan 5 sel).
Dalam enkapsulasi seluler, sel-sel darah inang (hemosit) mengelilingi dan
menempel pada permukaan benda yang menginvasi, membentuk kapsul
multiseluler seperti amplop yang mengelilinginya (Blumberg 1997). Gotz (1986)
mengemukakan bahwa pada rangkaian enkapsulasi seluler proses enkapsulasi
dibagi menjadi 10 tahap yang berurutan dimana hampir tiap-tiap tahap dilengkapi
dalam 15 menit. Keseluruhan proses berakhir antara 1 dan 3 hari. Kapsul yang
berkembang secara penuh disusun oleh beberapa tipe hemosit, di antaranya adalah
prohemosit, plasmatosit, oenositoid, thrombositoid dan granular hemosit. Sel-sel
hemosit total dari spesies serangga yang diberikan (Gotz dan Boman 1985;
Vinson 1990). Dalam proses enkapsulasi sel-sel bagian dalam yang berperan
membentuk kapsul yang membungkus parasitoid akan mengalami melanisasi,
sehingga pada akhirnya melanin akan terakumulasi pada permukaan benda yang
dienkapsulasi (Gotz dan Boman 1985).
Pada serangga Lepidoptera, sel granulosit dan plasmatosit berperan di
dalam formasi kapsul, sedangkan oenositoid dan granulosit dilaporkan
mempunyai aktivitas enzim fenoloksidase yang berperan di dalam melanisasi
kapsul. Melanin ini pada dasarnya dibentuk selama oksidase dan polimerase fenol,
yaitu tirosin dan dopa oleh enzim yang disebut fenoloksidase (Nappi 1975).
Menurut Van den Bosch (1964) parasitoid yang mengalami enkapsulasi ada
kemungkinan mati karena kekurangan nafas, kelaparan atau penghambatan secara
fisik. Parasitoid yang dienkapsulasi secara parsial dapat bertahan hidup dan
mungkin melanjutkan untuk berkembang secara normal. Dalam laporan lain
disebutkan bahwa beberapa larva parasitoid dari kelompok Hymenoptera mampu
menghindari proses enkapsulasi karena gerakan larva yang aktif. Pada Tachinidae
(Diptera) terdapat sistem saluran pernafasan yang berhubungan dengan sistem
trakhea inangnya sehingga kebutuhan oksigen dapat terpenuhi. Selain itu benda
asing dapat terhindar dari proses enkapsulasi karena mempunyai sifat-sifat
permukaan yang menyerupai jaringan ikat dari inangnya sehingga tidak
menimbulkan respon dari sel-sel darah (Woodring 1985; Chapman 1998).
Beberapa spesies Ichneumonidae dan Braconidae (Hymenoptera) mengandung polydnavirus pada bagian kaliks dari ovarinya yang dapat menghambat terjadinya proses enkapsulasi (Strand dan Noda 1991; Lavine dan Beckage 1995; Strand dan Pech 1995). Selain itu kapsul yang terbentuk saat enkapsulasi dapat dirusak oleh senyawa racun yang dikeluarkan oleh imago
parasitoid pada saat meletakkan telur. Racun tersebut dapat merusak susunan
kapsul sehingga telur parasitoid dapat terbebas dan melanjutkan
Implikasi Enkapsulasi dalam Pengendalian Hayati
Parasitoid E. argenteopilosus merupakan agens hayati yang sangat potensial untuk dikembangkan sebagai agens pengendali C. pavonana karena hampir selalu ditemui di pertanaman sayuran, namun tingginya tingkat enkapsulasi menyebabkan E. argenteopilosus kurang efektif dijadikan sebagai cara pengendalian hama C. pavonana di lapangan (Hadi 1985; Nelly dan Yaherwandi 2006). Chapman (1998) mengemukakan bahwa proses fagositosis dan enkapsulasi terhadap telur dan larva parasitoid merupakan contoh reaksi pertahanan diri inang.
Kegagalan parasitoid dalam menekan populasi inang sering disebabkan oleh
proses fagositosis maupun proses enkapsulasi tersebut.
Tingginya kecepatan enkapsulasi sangat menentukan terjadinya peledakan
serangga hama di lapangan, yang secara tidak langsung menunjukkan
ketidakefektifan parasitoid. Kemampuan serangga inang di dalam menghambat
perkembangan parasitoid melalui enkapsulasi telah banyak dipelajari
di laboratorium. Hal ini sangat berguna dalam meramalkan potensi parasitisasi
di lapangan dan juga dapat menjelaskan penyebab kegagalan inundasi atau
introduksi parasitoid. Tingginya enkapsulasi merupakan kendala yang sangat
mengganggu di dalam perbanyakan parasitoid di laboratorium (Blumberg 1997).
Van den Bosch (1974 dalam Hadi 1985) menyebutkan bahwa salah satu penyebab turunnya efektivitas parasitoid Bathyplectes curculionis (Hymenoptera: Ichneumonidae) dalam mengendalikan hama Hypera bruneipennis (Coleoptera: Curculionidae) adalah terjadinya enkapsulasi pada telur parasitoid.
Pengaruh Pakan terhadap Kebugaran dan Kemampuan Enkapsulasi Inang
terutama kuantitas protein dan asam amino yang sangat mendukung dalam proses reproduksi, serta pertumbuhan dan perkembangan serangga secara optimal (Chapman 1998).
Selain itu pakan juga mempengaruhi sistem pertahanan yang dimiliki oleh inang. Sistem pertahanan merupakan hal penting yang dibutuhkan inang ketika terjadi penyerangan oleh parasitoid. Inang membutuhkan pakan yang berkualitas untuk mendapatkan sistem pertahanan yang efektif dalam melakukan perlawanan terhadap serangan parasitoid. Kandungan nutrisi yang berbeda-beda pada pakan seperti protein, gula, asam lemak, kadar air, dan komponen lain seperti senyawa tanin dan fenolik lainnya merupakan faktor yang berpengaruh terhadap pertahanan yang dimiliki oleh inang (Haukioja 2003, 2005). Klemola (2009) menjelaskan bahwa kualitas pakan inang merupakan salah satu faktor yang menentukan sistem pertahanan yang dimiliki oleh inang. Pakan yang berkualitas tinggi memiliki kecenderungan bahwa sistem pertahanan yang dimiliki inang tersebut juga baik.
BAHAN DAN METODE
Tempat dan Waktu
Penelitian dilakukan di Laboratorium Fisiologi dan Toksikologi Serangga, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian dimulai dari bulan Januari sampai Agustus 2012.
Perbanyakan Tanaman Pakan
Tanaman pakan yang digunakan untuk pemeliharaan larva C. pavonana
adalah brokoli (Brassica oleracea var. italica), kubis (B. oleracea var. capitata), caisin (B. rapa cv caisin), pakchoi (B. rapa cv pakchoy), sawi (B. chinensis,), dan lobak (Raphanus sativus var. hortensis). Benih dari tiap jenis tanaman pakan disemai pada baki bersekat yang mempunyai 50 lubang tanam. Tiap lubang yang telah berisi media tanam diletakkan satu biji benih dan pupuk majemuk Dekastar. Setiap baki berisi satu jenis tanaman, sehingga jumlah keseluruhan enam baki. Keenam baki persemaian tersebut diletakkan di luar ruangan dan disiram setiap hari. Benih yang tidak tumbuh disulam serta gulma yang tumbuh disiangi. Kegiatan menyemai tanaman dilakukan sebulan dua kali untuk persediaan pakan. Tanaman semai dapat dipindah tanam ke polibag setelah memiliki daun kurang lebih empat helai. Penyiraman dilakukan tiap hari dan tidak dilakukan penyemprotan pestisida pada tanaman.
Pemeliharaan Inang C. pavonana
Serangga uji C. pavonana yang digunakan pada penelitian ini didapatkan dari hasil perbanyakan Laboratorium Fisisologi dan Toksikologi Serangga, Departemen Proteksi Tanaman. Pada dasarnya pemeliharaan inang C. pavonana
dipindahkan dalam kurungan plastik berbentuk tabung (tinggi 37 cm, diameter 20 cm). Imago diberi pakan larutan madu 10% (madu:air = 1:9 v/v) yang diserapkan pada kapas dan digantung didalam kurungan. Untuk tempat peletakan telur, digunakan daun pancingan dari keenam jenis pakan yang diletakkan ke dalam tabung film yang sudah diisi dengan air. Daun pancingan diambil setiap hari dan diganti dengan daun yang baru.
Persiapan Parasitoid E. argenteopilosus
Imago parasitoid E. argenteopilosus dikoleksi dari pertanaman brokoli di daerah Ciloto, Jawa Barat. Imago parasitoid di lapangan ditangkap dengan menggunakan jaring serangga dan dipelihara dalam kurungan plastik berbentuk tabung (tinggi 37 cm, diameter 20 cm) yang di tempatkan dalam ruangan bersuhu 26 ⁰C. Imago tersebut diberi pakan larutan madu 10% yang diserapkan pada kapas dan digantungan di dalam kurungan.
Pengamatan Enkapsulasi E. argenteopilosus
Parasitoid E. argenteopilosus betina dan larva inang C. pavonana instar II adalah serangga yang digunakan dalam percobaan ini. Larva dipaparkan pada imago betina parasitoid di dalam sebuah tabung reaksi. Larva terparasit ditandai dengan adanya perilaku peletakkan telur oleh parasitoid pada tubuh larva. Larva yang telah diparasit diambil satu persatu dan dipindahkan ke dalam cawan petri yang telah diberi daun pakan untuk tiap jenis perlakuan (caisin, brokoli, kubis, pakchoi, lobak, dan sawi). Jumlah larva terparasit terdiri atas 10 larva dan 10 ulangan untuk setiap perlakuan. Pakan tersebut diganti setiap hari. Setelah 48 jam pemarasitan, larva perlakuan dibedah diatas objek gelas yang telah ditetesi larutan fisiologis Ringer untuk diamati kejadian enkapsulasi telur dan larva di dalam tubuh inang. Pengamatan dilakukan di bawah mikroskop stereo. Persentase enkapsulasi dihitung dengan menggunakan rumus sebagai berikut :
∑ telur dan larva parasitoid terenkapsulasi
Pengamatan Kebugaran Inang C. pavonana pada Enam Jenis Pakan
Pengamatan kebugaran yang dilakukan meliputi penimbangan bobot pupa, pengukuran panjang pupa dan fekunditas betina. Telur C. pavonana hasil dari pemeliharaan di laboratorium diletakkan dalam cawan petri (diameter 11 cm) yang dialasi kertas tissu dan ditempatkan dalam ruangan bersuhu 26 °C. Setiap larva yang berumur seragam diberi perlakuan jenis pakan dan masing-masing dimasukkan ke dalam kotak pemeliharaan. Daun pakan diganti setiap hari hingga terbentuk pupa. Pupa diukur panjang dan bobot tubuhnya. Pengukuran dan penimbangan pupa dilakukan pada hari keempat setelah menjadi pupa. Jumlah pupa contoh diambil 10 ulangan untuk setiap jenis perlakuan pakan.
Sisa pupa yang ada pada kotak pemeliharaan dipindahkan ke dalam kurungan plastik berbentuk tabung (tinggi 37 cm, diameter 20 cm). Pupa yang berhasil eklosi menjadi ngengat, dipindahkan dan dipasangkan (jantan dan betina) di dalam kurungan imago yang lebih kecil (tinggi 29 cm, diameter 12 cm) dengan dilengkapi pakan larutan madu 10%. Fekunditas imago ditentukan dengan menghitung jumlah telur yang menetas hasil peletakan telur selama 14 hari. Pengamatan tersebut dilakukan 5 kali ulangan.
Pengolahan Data
Penelitian ini didesain dengan metode rancangan acak lengkap (RAL). Data diolah menggunakan program SAS for windows versi 9.0 dan perlakuan yang memberikan pengaruh nyata diuji lanjut dengan Duncan multiple range test
HASIL DAN PEMBAHASAN
Perbandingan Tingkat Enkapsulasi Parasitoid E. argenteopilosus pada Inang
C. pavonana yang Diberi Perlakuan Enam Jenis Pakan
Hasil pengamatan enkapsulasi menunjukkan bahwa tingkat enkapsulasi tertinggi terdapat pada inang C. pavonana yang diberi pakan pakchoi yaitu sebesar 81%, yang tidak berbeda nyata dengan tingkat enkapsulasi pada larva
C. pavonana yang diberi pakan caisin (69%) dan berbeda nyata bila dibandingkan dengan larva C. pavonana yang diberi perlakuan pakan lain yaitu brokoli, kubis, lobak dan sawi (Tabel 1). Urutan tingkat enkapsulasi dari yang terbesar hingga
terkecil yaitu pada perlakuan pakan pakchoi, caisin, kubis, brokoli, lobak, dan
sawi (Tabel 1).
Tabel 1 Perbandingan tingkat enkapsulasi parasitoid E. argenteopilosus pada inang C. pavonana dengan enam jenis pakan
Jenis pakan Tingkat enkapsulasi (%)a
Caisin 69 ± 22.8ab
Secara umum tingkat enkapsulasi pada enam jenis pakan menunjukkan persentase yang cukup besar karena rata-rata di atas 50%, kecuali sawi yang hanya memiliki tingkat enkapsulasi sebesar 43%. Bervariasinya persentase tingkat enkapsulasi ini menunjukkan bahwa jenis pakan memberikan pengaruh terhadap sistem pertahanan yang dimiliki inang. Klemola (2009) menjelaskan bahwa kualitas pakan inang merupakan salah satu faktor yang menentukan sistem pertahanan yang dimiliki oleh inang. Pakan yang berkualitas tinggi memiliki kecenderungan bahwa sistem pertahanan yang dimiliki inang tersebut juga baik.
terhadap serangan parasitoid. Sistem kekebalan tubuh pada serangga sebagian ditentukan secara genetik, namun dapat juga dipengaruhi oleh faktor-faktor lain seperti kuantitas dan kualitas pakan serta kepadatan populasi (Reeson et al. 1998; Adamo et al. 2001; Cotter et al. 2004). Enkapsulasi adalah salah satu bentuk sistem pertahanan yang dimiliki oleh C. pavonana, yang merupakan suatu respon pertahanan yang umum dilakukan oleh serangga inang terhadap endoparasitoid dan organisme asing lainnya (Strand dan Pech 1995; Blumberg 1997).
Pada proses enkapsulasi, sel darah (hemosit) merupakan komponen utama yang berperan. Semakin banyak jumlah sel darah dalam tubuh inang akan semakin membantu dalam sistem pertahanan yang dimiliki (Strand dan Pech 1995). Di dalam enkapsulasi seluler, sel-sel darah inang mengelilingi dan menempel pada permukaan benda yang menginvasi, membentuk kapsul multiseluler seperti amplop yang mengelilinginya (Blumberg 1997). Gotz dan Boman (1985), serta Vinson (1990) mengungkapkan bahwa kapsul yang berkembang secara penuh disusun oleh beberapa tipe sel darah, diantaranya adalah prohemosit, plasmatosit, oenositoid, thrombositoid dan granular hemosit. Sementara itu Strand dan Noda (1991) mencatat terdapat empat tipe sel darah yang terdapat dalam tubuh larva Pseudoplusia includens yang diparasit oleh
Microplitis demolitor, yaitu granulosit, plasmatosit, oenositoid, dan prohemosit. Dari sekian banyak tipe sel darah serangga yang terlibat dalam enkapsulasi, granulosit dan plasmatosit diduga paling berperan dalam enkapsulasi karena lebih dari 90% total darah serangga yang bersikulasi adalah granulosit dan plasmatosit. Pada pengamatan enkapsulasi ini jenis pakan diduga berpengaruh terhadap komposisi sel darah yang berperan dalam proses enkapsulasi di dalam tubuh inang. Pakan yang berkualitas tinggi menyebabkan jumlah sel darah semakin banyak, sehingga tingkat enkapsulasi parasitoid akan semakin tinggi.
C. pavonana enkapsulasi semakin lama berubah warna menjadi coklat karena mengalami melanisasi. Pada enkapsulasi yang belum terlalu lama (≤ 18 jam) warna kapsul yang terlihat adalah coklat terang, semakin lama warna berubah menjadi coklat tua dan akhirnya menghitam (Sahari 1999).
a b c
Gambar 1 Larva E.argenteopilosus (a) tidak terenkapsulasi, (b) terenkapsulasi, (c) terenkapsulasi dan mengalami melanisasi.
Berdasarkan hasil pengamatan di bawah mikroskop, sebagian besar larva parasitoid yang terenkapsulasi telah mengalami melanisasi. Hal ini menunjukkan bahwa sistem pertahanan yang dimiliki inang C. pavonana cukup kuat dan efektif dalam melakukan perlawanan terhadap parasitoid E. argenteopilosus. Parasitoid yang mengalami enkapsulasi ada kemungkinan mati karena kekurangan nafas,
kelaparan atau penghambatan secara fisik. Parasitoid yang dienkapsulasi secara
parsial dapat bertahan hidup dan mungkin melanjutkan untuk berkembang secara
normal (Van den Bosch 1964).
Kebugaran Inang C. pavonana pada Enam Jenis Pakan
Pengamatan kebugaran inang C. pavonana yang dilakukan meliputi penimbangan bobot pupa, pengukuran panjang pupa dan fekunditas betina. Hasil penelitian menunjukkan bahwa ukuran pupa terpanjang terdapat pada inang
diberi makan brokoli (10.1 mm), dan berbeda nyata bila dibandingkan dengan panjang pupa C. pavonana yang diberi pakan kubis, pakchoi, lobak dan sawi (Tabel 2).
Untuk bobot pupa, secara umum sebanding dengan hasil panjang pupa, terdapat kecenderungan bahwa semakin panjang ukuran pupa C. pavonana maka semakin berat pula bobot yang dimiliki. Bobot pupa terbesar terdapat pada perlakuan C. pavonana yang diberi pakan caisin (55.8 mg), hasil ini juga tidak berbeda nyata dengan perlakuan C. pavonana yang diberi pakan brokoli (53.8 mg) dan berbeda nyata bila dibandingkan perlakuan pakchoi, lobak, kubis, dan sawi dengan bobot yang berkisar anatara 42.7 mg – 50.2 mg.
Fekunditas/betina untuk semua jenis perlakuan pakan secara umum tidak
berbeda nyata satu sama lain. Fekunditas/betina terbanyak terdapat pada
C. pavonana yang diberi pakan brokoli yaitu sebanyak 290 butir telur, diikuti lobak, kubis, caisin, pakchoi, dan sawi dengan jumlah peneluran berturut-turut 266, 262, 256, 232, dan 215 butir telur (Tabel 2).
Tabel 2 Kebugaran C. pavonana pada enam jenis pakan
Jenis pakan
fekunditas/betina dihitung selama masa oviposisi (14 hari) pada masing-masing jenis pakan
Hasil dari pengamatan ini menunjukkan bahwa jenis pakan berpengaruh
terhadap kebugaran inang C. pavonana yaitu dalam hal panjang pupa, bobot pupa, dan fekunditas/betina. Pakan berkualitas tinggi akan memberikan tampilan
morfologi yang baik dari pupa yang dihasilkan oleh inang C. pavonana, selain itu jumlah peneluran/betina juga akan semakin banyak. Hal ini mengindikasikan
bahwa nutrisi yang dibutuhkan inang untuk berkembang baik dapat dipenuhi oleh
dan senyawa pada tanaman pakan berpengaruh besar terhadap bentuk morfologi
dan kebugaran inang. Serangga yang memakan tanaman berkualitas rendah atau
kekurangan nutrisi akan mengalami hambatan pada perkembangannya,
ditunjukkan dengan ukuran tubuh yang lebih kecil dan masa perkembangan yang
lebih lama dibandingkan serangga pada tanaman dengan nutrisi yang lengkap
(Stadler dan Mackauer 1996).
Kajian Pengaruh Pakan terhadap Kebugaran Inang dan Kemampuan
Enkapsulasi C. pavonana
Kualitas pakan dan sistem pertahanan merupakan dua hal yang berhubungan erat yang menentukan keberhasilan inang dalam mengatasi serangan parasitoid. Inang C. pavonana mendapatkan nutrisi secara langsung dari pakan, selain digunakan untuk tumbuh dan berkembang nutrisi tersebut juga digunakan untuk memperkuat sistem pertahanan yang dimiliki. Ada kecenderungan bahwa pakan yang berkualitas tinggi dapat mendukung perkembangan dan kebugaran inang dengan baik, kemudian kebugaran yang baik akan menciptakan suatu sistem pertahanan yang efektif. Hal ini diindikasikan dengan tingginya tingkat enkapsulasi E. argenteopilosus pada perlakuan jenis pakan tertentu.
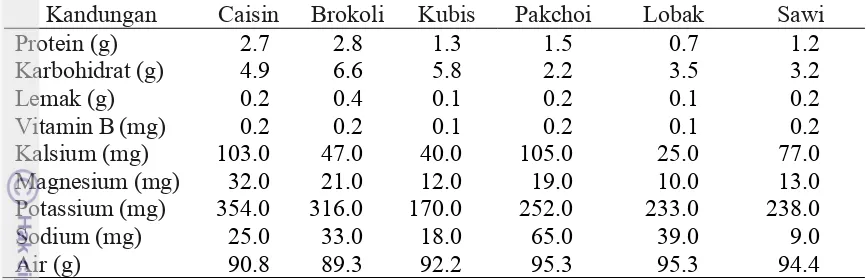
Komposisi nutrisi keenam jenis pakan (per 100 g bagian yang dapat dimakan) ditunjukkan pada Tabel 3 (USDA NNDSR 2012). Brokoli dan caisin memiliki kandungan protein yang cukup tinggi, hal tersebut diduga sebagai faktor yang menyebabkan inang C. pavonana mampu menghasilkan pupa dengan kebugaran yang baik. Selain itu kandungan protein yang tinggi juga dapat mendukung reproduksi C. pavonana. Chapman (1998) mengemukakan bahwa kuantitas protein dan asam amino sangat mendukung dalam proses reproduksi, serta pertumbuhan dan perkembangan serangga secara optimal. Hasil pengamatan pupa diperkuat dengan pengamatan secara visual yang menunjukkan bahwa pupa
yang berhasil menjadi imago dengan persentase terbesar ada pada perlakuan
pakan caisin. Persentase mencapai 100% dan imago terbentuk dalam kondisi yang
Tabel 3 Komposisi nutrisi enam jenis pakan (per 100 g bagian yang dapat dimakan)a
Kandungan Caisin Brokoli Kubis Pakchoi Lobak Sawi Protein (g) 2.7 2.8 1.3 1.5 0.7 1.2
Sumber : USDA NNDSR 2012
Fekunditas betina hasil perlakuan pakan menunjukkan bahwa jumlah
terbanyak terdapat pada perlakuan pakan brokoli. Hal ini disebabkan oleh
kandungan nutrisi di tiap pakan yang berbeda-beda. Keseimbangan komposisi
nutrisi yang dibutuhkan oleh setiap serangga berbeda-beda dan komposisi nutrisi
yang tepat akan mendukung pertumbuhan serangga secara optimum (Gullan dan
Cranston 1994; Chapman 1998). Menurut Chapman (1998) larva Bombyx sp. memerlukan senyawa-senyawa esensial seperti asam amino untuk membentuk
protein, asam lemak linoleat atau linolenat, sterol, vitamin B, dan beberapa unsur
mineral seperti natrium, kalium, kalsium, klorida, zat besi, seng, dan mangan
untuk mendukung pertumbuhannya.
Sementara Chippendale (1978) mengemukakan bahwa D-glukosa dengan
konsentrasi 3.3% mampu mendukung pertumbuhan larva Diatrea grandiosella (Lepidoptera: Pyralidae) secara optimum dan normal, sedangkan pada konsentrasi
5% menghambat pertumbuhan serangga tersebut. Karbohidrat merupakan sumber
energi untuk beberapa serangga (Ross et al.1982), namun konsentrasi karbohidrat yang tinggi dapat menghambat reaksi enzimatik termasuk reaksi glikolisis dan
Jenis pakan juga mempengaruhi sistem pertahanan serangga C. pavonana
yaitu kemampuan dalam mengenkapsulasi parasitoid E.argenteopilosus. Darah (hemolimfa) pada serangga mengandung banyak air, protein (asam amino), serta bahan-bahan mineral lain seperti magnesium, potassium, sodium, kalsium, zink, mangan, dan besi (Chapman 1998). Kandungan potassium, sodium dan mineral lain yang cukup tinggi pada pakan caisin dan pakchoi diduga sebagai faktor yang dapat meningkatkan kualitas hemolimfa, sehingga tingkat enkapsulasi yang dihasilkan cukup tinggi. Protein yang terkandung pada hemosit juga diketahui berperan penting dalam proses enkapsulasi. Kandungan nutrisi pakan yang berbeda-beda seperti protein, gula, asam lemak, kadar air, dan komponen lain seperti senyawa tanin dan fenolik lainnya merupakan faktor yang berpengaruh terhadap pertahanan yang dimiliki oleh inang (Haukioja 2003, 2005). Inang dan jenis pakan yang berbeda akan menghasilkan sistem pertahanan yang berbeda pula. Parasitoid E. argenteopilosus pada inang C.pavonana yang diberi pakan brokoli memiliki tingkat enkapsulasi yang lebih tinggi dibandingkan pada larva inang S. litura dan H. armigera yang masing-masing diberi pakan daun talas dan jagung muda (Anindhita 2000).
Selain nutrisi pakan inang, terdapat faktor lain yang mempengaruhi tingkat
enkapsulasi, yaitu keberadaan polydnavirus (PDV) pada imago
E. argenteopilosus. Beberapa spesies Ichneumonidae dan Braconidae (Hymenoptera) mengandung polydnavirus pada bagian kaliks dari ovarinya yang dapat menghambat proses enkapsulasi (Strand dan Noda 1991; Lavine dan Beckage 1995; Strand dan Pech 1995). Telur-telur parasitoid yang bebas PDV dari ovari betina dengan cepat akan terenkapsulasi dan terbunuh oleh sel darah inang, sedangkan telur yang mengandung PDV dapat mempertahankan diri dari enkapsulasi (Salt 1968 dalam Beckage 1998). Strand (1994) mengemukakan bahwa parasitoid Microplitis demolitor yang membawa PDV saat memarasit larva
KESIMPULAN DAN SARAN
Kesimpulan
Persentase enkapsulasi telur parasitoid E. argenteopilosus tertinggi terdapat pada larva C. pavonana yang diberi perlakuan pakan pakchoi (81%) dan caisin (69%). Pakan berpengaruh terhadap kebugaran inang yang dapat menentukan
keberhasilan enkapsulasi. Ukuran pupa inang C. pavonana terpanjang dan bobot terberat terdapat pada perlakuan caisin (10.4 mm dan 55.8 mg). Inang yang
memiliki ukuran pupa lebih panjang dan bobot pupa lebih berat cenderung
menghasilkan tingkat enkapsulasi yang relatif lebih tinggi. Semakin baik kualitas
pakan inang, maka tingkat enkapsulasi semakin tinggi.
Saran
Perlu dilakukan penelitian lebih lanjut mengenai pengaruh kualitas pakan
DAFTAR PUSTAKA
[USDA NNDSR 2012] USDA's National Nutrient Database for Standard Reference. 2012. Nutrition Facts [internet]. New York (US): Conde Nast Publications; [diunduh 2012 Jul 27]. Tersedia pada: http://nutritiondata .self.com/facts/ vegetables-and-vegetable-products.
Adamo SA, Jensen M, Younger M. 2001. Changes in lifetime immunocompetence in male and female Gryllus texensis (formerly G
-integer): trade-offs between immunity and reproduction. Animal Behaviour.
62: 417–425.
Anindhita K. 2000. Oviposisi, enkapsulasi dan keberhasilan hidup parasitoid
Eriborus argenteopilosus (Cameron) (Hymenoptera: Ichneumonidae) pada inang Crocidolomia binotalis (Zell.) (Lepidoptera: Pyralidae), Spodoptera litura (Fabr.) dan Helicoverpa armigera (Hubn.) (Lepidoptera: Noctuidae) [skripsi]. Bogor (ID): Fakultas Pertanian, Institut Pertanian Bogor.
Beckage NE. 1998. Parasitoid and Polydnavirus. Biological Science. 48(4): 305-310.
Bernays EA, Chapman RF. 1994. Host-Plant Selection by Phytophagous Insect.
New York (US): Chapman & Hall.
Bilapate GG, Mokat RB, Lovaker RC, Bagade DN. 1988. Population ecology of
Heliothis armigera (Hubner) and its parasites pulses. Journal of Maharashtra Agriculture University. 13(3): 299-302.
Blumberg D. 1997. Commentary: Parasitoid encapsulation as a defense mechanism in Coccoidea (Homoptera) and its importance in biological control. Biological Control. 8: 225-236.
Chapman RF. 1998. The Insects Structure and Function. 4th ed. Cambridge (UK): Cambridge University Press.
Chippendale GM. 1978. The function of carbohydrates in insect life processes. Di dalam: Rockstein M, editor. Biochemistry of Insect. London (UK): Academic Press.
Clausen CP. 1940. Entomophagous Insect. New York (US): McGraw-Hill Book Company Inc.
Doutt RL. 1959. The biology of parasitic Hymenoptera. Annual Review of Entomology. 4: 161-182.
Fathpour H, Dahlman DL. 1995. Polydnavirus of Microplitis croceippes prolongs the larval period and changes hemolymph protein content of the host,
Heliothis virescens. Archives of Insect Biochemistry and Physiology. 28: 131-145.
Gotz P, Boman HG. 1985. Insect immunity. Di dalam: GA Kerkut, LI Gilbert, editors. Comprehensive Insect Physiology, Biochemistry and Pharmacology. Oxford (UK): Pergamon. 3: 453-485.
Gotz P. 1986. Encapsulation in Arthropods. Di dalam: M Brehelin, editor.
Immunity in Invertebrates. Germany: Springer-Verlag. hlm 153-170.
Gullan PJ, Cranston PS. 1994. The Insect: An Outline of Entomology. London: Chapman dan Hall.
Gupta AP. 1991. Insect immunocytes and other hemocytes: roles in cellular and humoral immunity. Di dalam Gupta AP, editor. Immunology of Insect and Other Arthropods. Florida: Boca Raton Press. hlm 19-118.
Hadi S. 1985. Biologi dan perilaku Inareolata sp. (Hymenoptera: Ichneumonidae), parasitoid larva pada hama kubis Crocidolomia binotalis
Zell. (Lepidoptea: Noctuidae) [tesis]. Bogor (ID): Fakultas Pertanian, Institut Pertanian Bogor.
Haukioja E. 2003. Putting the insect into the birch-insect interaction. Oecologia.
136: 161–168.
Haukioja E. 2005. Plant defenses and population fluctuations of forest defoliators: mechanism-based scenarios. Annales Zoologici Fennici. 42: 313–325.
Kalshoven LGE. 1981. The Pest of Crops in Indonesia. Laan PA van der, penerjemah. Jakarta (ID): Ichtiar Baru-van Hoeve. Terjemahan dari: De Plagen van Cultuurgewassen in Indonesie.
Klemola N. 2009. Trophic interactions and cyclic population dynamics of the autumnal moth: the importance of hymenopteran parasitoids [thesis]. Finland: Department of Biology, University of Turku.
La Daha. 1997. Ekologi Heliothis armigera (Hubner) (Lepidoptera: Noctuidae) pada pertanaman tomat [disertasi]. Bogor (ID): Fakultas Pertanian, Institut Pertanian Bogor.
Lavine MD, Beckage NE. 1995. Polydnaviruses: Potent mediators of host insect immune dysfunction. Parasitology Today. 11: 368-378.
Nappi AJ. 1975. Parasite encapsulation in insect. Di dalam: K Maramorosch, RE Shope, editors. Invertebrate Immunity. New York (US): Academic Press. hlm 293-326.
Nelly N, Yaherwandi. 2006. Struktur populasi Eriborus argenteopilosus Cameron (Hymenoptera: Ichneumonidae) parasitoid Crocidolomia pavonana
Fabricius (Lepidoptera: Pyralidae) pada beberapa tipe lansekap: implikasinya terhadap keefektifan parasitoid sebagai agens pengendalian hayati di lapangan. [Laporan Penelitian Hibah Bersaing XIII, DP2M Dikti]. Padang (ID): Fakultas Pertanian, Universitas Andalas Padang.
Othman N. 1982. Biology of Crocidolomia binotalis Zell. (Lepidoptera: Pyralidae) and Its Parasites from Cipanas Area, West Java [a report of training course research]. Bogor (ID): SEAMEO BIOTROP.
Price PW, Bouton CE, Gross P, McPheron BA, Thompson JN, Weis AE. 1980. Interactions among three trophic levels: influence of plants on interactions between insect herbivores and natural enemies. Annual Reviews of Ecology and Systematics 11: 41–65.
Prijono D, Hassan E. 1992. Life cycle and demography of Crocidolomia binotalis
Zeller (Lepidoptera: Pyralidae) on broccoli in the laboratory. Indonesian Journal Tropical Agriculture. 4(1): 18-24.
Reeson AF, Wilson K, Gunn A, Hails RS, Goulson D. 1998. Baculovirus resistance in the noctuid Spodoptera exempta is phenotypically plastic and responds to population density. Proceedings of the Royal Society of London B. 265: 1787–1791.
Rehman A, Powell W. 2010. Host selection behaviour of aphid parasitoids (Aphidiidae: Hymenoptera). Journal of Plant Breeding and Crop Science. 2(10): 299-311.
Rizki RM, Rizki TM. 1984. Selective destruction of a host blood cell type by a parasitoid wasp. Proceedings of The National Academy of Science. 81: 6154-6158.
Sahari B. 1999. Studi enkapsulasi parasitoid Eriborus argenteopilosus Cameron (Hymenoptera: Ichneumonidae) dan implikasinya pada inang Crocidolomia binotalis Zeller (Lepidoptera: Pyralidae) dan Spodoptera Litura Fabricius (Lepidoptera: Noctuidae) [skripsi]. Bogor (ID): Fakultas Pertanian, Institut Pertanian Bogor.
Sastrosiswojo S. 1996. Sistem pengendalian hama terpadu dalam menunjang agribisnis sayuran. Di dalam: AS Duriat, RS Basuki, RM Sinaga, Y Hilman, Z Abidin, editor. Prosiding Seminar Ilmiah Nasional Komoditas Sayuran; 1995 Okt 24; Lembang. Lembang (ID): Balai Penelitian Tanaman Sayuran Lembang. hlm 69-81.
Sathe TV. 1987. New records of natural enemies of Spodoptera litura Fabricius in Kolhapur, India. Current-Science. 56(20): 1083-1084.
Sathe TV. 1990. The biology of Diadegma argenteopilosa (Cameron) (Hymenoptera: Ichneumonidae) an internal parasitoid of Spodoptera litura
(Fab). Entomologist. 109(1): 2-7.
Schoonhoven LM, Jermy T, Van Loon JJA. 1998. Insect-Plant Biology: From Physiology to Evolution. London: Chapman & Hall.
Sembel DT. 2010. Pengendalian Hayati Hama-hama Serangga Tropis dan Gulma. Yogyakarta (ID): CV Andi Offset.
Soeroto, Hikmat A, Cahyaniati. 1994. Pengelolaan Organisme Pengganggu Tumbuhan secara Terpadu pada Tanaman Kubis. Jakarta (ID): Dirjen Pertanian Tanaman Pangan, Direktorat Bina Perlindungan Tanaman.
Stadler B, Mackauer M. 1996. Influence of plant quality on interactions between the aphid parasitoid Ephedrus californicus (Hymenoptera: Aphidiidae) and its host, Acyrthosiphon pisum (Homoptera: Aphididae). Canadian Entomologist. 128: 27-39.
Strand MR, Noda T. 1991. Alteration in haemocytes of Pseudoplusia includens
after parasitism by Microplitis demolitor. Journal of Insect Physiology. 37(11): 839-850.
Strand MR. 1994. Microplitis demolitor polydnavirus infect and expresses inspesific morphotypes of Pseudoplusia includens haemocytes. Journal of General Virology. 75: 3007-3020.
Van Alpen JJM, Vet LEM. 1986. An evolutionary approach to host finding and section. Di dalam: J Waage, D Greathead, editors. Insect Parasitoids. London (UK): Academic Press. hlm 23-61.
Van den Bosch R. 1964. Encapsulation of the eggs of Bathyplectes curculionis (Thomson) (Hymenoptera: Ichneumonidae) in larvae of Hypera brunneipennis (Boheman) and Hypera postica (Gyllenhal) (Coleoptera: Curculionidae). Journal of Insect Pathology. 6: 343-367.
Vinson SB. 1990. How parasitoids deal with the immune system of their host : An overview. Archives of Insect Biochemistry and Physiology. 13: 3-27.
Woodring JP. 1985. Circulatory system. Di dalam: Blum MS, editor.
ABSTRAK
YUNIAN ASIH ANDRIYARINI. Tingkat Enkapsulasi Parasitoid Eriborus argenteopilosus (Cameron) pada Inang Crocidolomia pavonana (Fabricius) yang Diberi Enam Jenis Pakan. Dibimbing oleh ENDANG SRI RATNA.
Crocidolomia pavonana (Fabricius) (Lepidoptera: Crambidae) merupakan salah satu hama penting pada tanaman kubis-kubisan. Kehilangan hasil akibat serangan C. pavonana dapat mencapai 100%. Eriborus argenteopilosus (Cameron) (Hymenoptera: Ichneumonidae) adalah endoparasitoid C. pavonana yang relatif dominan ditemukan di lapang. Namun kinerja parasitoid tersebut kurang maksimal akibat adanya respon pertahanan inang berupa kemampuan enkapsulasi di dalam tubuh larva C. pavonana. Penelitian ini bertujuan membandingkan tingkat enkapsulasi parasitoid E. argenteopilosus pada inang C. pavonana yang diberi enam jenis pakan. Pakan yang digunakan antara lain caisin, brokoli, kubis, pakchoi, lobak dan sawi. Persentase enkapsulasi ditentukan
dengan melakukan pembedahan larva C. pavonana yang telah terparasit E. argenteopilosus pada 48 JSP, telur dan larva yang terenkapsulasi dihitung. Data
pendukung didapat dari kebugaran inang yang meliputi panjang pupa, bobot pupa, dan fekunditas/betina. Hasil penelitian menunjukkan bahwa persentase enkapsulasi tertinggi 81% terdapat pada inang yang diberi perlakuan pakchoi yang tidak berbeda nyata dengan perlakuan caisin (69%). Persentase enkapsulasi terendah 43% terdapat pada inang yang diberi perlakuan sawi. Pupa inang yang memiliki ukuran terpanjang dengan bobot terberat terdapat pada perlakuan caisin sebesar 10.4 mm dan 55.8 mg yang berbeda nyata dengan pupa terpendek dan teringan dijumpai pada perlakuan sawi dan lobak sebesar 9.2-9.3 mm dan 42.7-45.8 mg. Fekunditas/betina tertinggi terdapat pada perlakuan brokoli sebesar 290 telur/betina. Hasil tersebut menunjukkan bahwa ada kecenderungan inang yang memiliki pupa berukuran lebih panjang dan bobot yang lebih berat menghasilkan tingkat enkapsulasi yang relatif lebih tinggi. Hal ini berarti bahwa kualitas jenis pakan mempengaruhi kebugaran dan kemampuan enkapsulasi inang C. pavonana.
PENDAHULUAN
Latar Belakang
Eriborus argenteopilosus merupakan endoparasitoid soliter yang banyak ditemukan pada hama Crocidolomia pavonana (Sathe 1987; Sembel 2010). Parasitoid ini dapat hidup pada inang lain yaitu Spodoptera litura (Sathe 1987) dan Helicoverpa armigera (Bilapate et al 1988; La Daha 1997). Tingkat parasitisasi E. argenteopilosus pada inang C. pavonana relatif rendah yang hanya mencapai 7.23% (Othman 1982). Rendahnya tingkat parasitisasi diduga
disebabkan oleh sistem pertahanan yang dimiliki C. pavonana, yaitu berupa kemampuan mengenkapsulasi yang cukup tinggi hingga 80% (Sahari 1999).
Enkapsulasi merupakan suatu respon pertahanan yang umum dilakukan oleh
serangga inang terhadap endoparasitoid dan organisme asing lainnya (Strand dan
Pech 1995; Blumberg 1997).
C. pavonana dikenal sebagai ulat titik tumbuh pada tanaman kubis, menyerang secara berkelompok dan mempunyai sifat makan rakus (Soeroto et al. 1994). Kerusakan tanaman oleh hama ini dapat menyebabkan kehilangan hasil
hingga mencapai 100% (Sastrosiswojo 1996). C. pavonana sering ditemukan menyerang berbagai tanaman yang tergolong dalam famili brassicaceae contohnya
selain kubis adalah brokoli, kubis bunga, sawi, dan lobak (Kalshoven 1981).
Besarnya tingkat kerusakan tanaman ini tidak sebanding dengan rendahnya
tingkat parasitisasi larva, sehingga menyebabkan hama C. pavonana cukup sulit untuk dikendalikan di lapangan. Informasi mengenai kemampuan enkapsulasi
C. pavonana pada berbagai tanaman inang belum banyak dilaporkan, sehingga perlu diteliti lebih lanjut.
Tujuan Penelitian
Penelitian ini bertujuan membandingkan tingkat enkapsulasi parasitoid
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai jenis pakan
inang C. pavonana yang mempunyai kandungan nutrisi paling sesuai dalam kaitannya dengan kemampuan mengenkapsulasi parasitoid E. argenteopilosus (tingkat enkapsulasi terendah), sehingga dapat membantu kegiatan konvervasi
alami untuk meningkatkan keefektifan pengendalian hayati serangga hama di
TINJAUAN PUSTAKA
Parasitoid Eriborus argenteopilosus (Cameron)
Eriborus argenteopilosus (Cameron) (Hymenoptera: Ichneumonidae) adalah sejenis tabuhan yang memarasit larva C. pavonana (Sathe 1987). Inang lain dari parasitoid ini adalah larva Helicoverpa armigera (Bilapate et al 1988; La Daha 1997) dan Spodoptera litura (Sathe 1987). Telur parasitoid E. argenteopilosus berwarna putih dan bentuknya menyerupai biji kacang buncis (Othman 1982).
Panjang telur berkisar antara 0.31-0.42 mm dan lebar 0.07-0.11 mm (Sahari
1999). Masa inkubasi telur berkisar antara 32-36 jam (Hadi 1985).
Larva E. argenteopilosus berwarna putih kekuning-kuningan (Hadi 1985). Larva terdiri atas lima instar (Sathe 1990). Bentuk larva parasitoid instar I dan II
termasuk tipe caudate dicirikan tubuh memanjang tidak bertungkai, ruas tubuh jelas dan ruas abdomen terakhir berbentuk mengerucut menyerupai ekor. Larva
instar lanjut termasuk tipe hymenopteriform (Clausen 1940). Larva tidak bertungkai, mandibel jelas dan ujung abdomen membulat. Lama stadium larva
parasitoid bergantung pada jenis atau umur larva inang (Othman 1982). Stadium
larva berkisar antara 9-10 hari pada inang C. pavonana (Hadi 1985) atau 9 hari pada inang Spodoptera litura (Sathe 1990). Stadium larva yang berkembang pada inang C. pavonana berumur 2, 3, 4, dan 5 hari berturut-turut 10-12 hari, 9-13 hari, 8-13 hari, dan 7-9 hari (Othman 1982). Sebelum menyelesaikan instar akhir, larva
parasitoid E. argenteopilosus keluar dari tubuh inang, kemudian menyelimuti tubuhnya dengan kokon. Di dalam kokon, larva memasuki fase pra pupa yang
berlangsung sekitar 1-2 hari dan dilanjutkan dengan pembentukan pupa. Pupa
berwarna coklat tua dengan panjang berkisar antara 7-9 mm dan lebar 2-3 mm
(Othman 1982). Stadium pupa pada inang C. pavonana berkisar antara 7-9 hari (Hadi 1985) sedangkan pada inang S. litura stadium pupa ± 6 hari (Sathe 1990).
Imago parasitoid E. argenteopilosus memiliki toraks hitam dan abdomen berwarna coklat kemerahan. Parasitoid betina dicirikan dengan keberadaan
ovipositor yang relatif panjang. Ukuran tubuh parasitoid betina umumnya lebih
besar dibandingkan dengan jantan. Panjang tubuh dan rentang sayap imago betina
mm dan 9.0-12.0 mm (Othman 1982). Nisbah kelamin jantan: betina adalah 1.16:
1 hasil perkembangan pada C. pavonana (Hadi 1985) dan 1:1.07 pada S. litura (Sathe 1990). Imago jantan biasanya muncul 1-3 hari lebih awal dari imago
betina. Kopulasi terjadi segera setelah betina muncul dari pupa, dan periode
pra-oviposisi memerlukan waktu kurang dari 24 jam (Sathe 1990). Parasitoid betina
umumnya meletakkan telur pada inang C. pavonana instar I, II, dan III. Rata-rata lama hidup imago betina 13.3 hari dan jantan 6.7 hari (Hadi 1985). Imago
parasitoid yang diberi pakan madu 10% di laboratorium dapat hidup selama 15.1
hari, sedangkan imago yang tidak diberi pakan hanya bertahan hingga 2 hari
(Sathe 1990). Keperidian imago betina mencapai 317-453 butir telur (Hadi 1985).
Crocidolomia pavonana (Fabricius)
Ulat krop kubis Crocidolomia pavonana (Fabricius) (Lepidoptera: Crambidae) merupakan salah satu hama penting pada tanaman sayuran
brassicaceae seperti kubis, brokoli, kubis bunga, sawi, dan lobak (Kalshoven
1981). Hama C. pavonana tersebar di daerah Afrika, India, dan Asia Tenggara termasuk Indonesia yang meliputi Sumatera Utara, Sumatera Selatan, Jawa Barat,
Jawa Tengah, Jawa Timur, Bali, Nusa Tenggara Barat, Sulawesi Selatan, dan
Sulawesi Utara (Soeroto et al. 1994).
Telur C. pavonana diletakkan secara berkelompok dan berderet saling tumpang tindih di permukaan bawah daun. Saat diletakkan, telur berwarna hijau
kemudian setelah dua hari berubah menjadi kuning kehijauan, coklat kemerahan,
dan sebelum menetas berwarna hitam kelabu (Korinus 1995). Periode inkubasi
telur rata-rata 4 hari pada suhu 26-33.2 °C dengan persentase penetasan 92.4%
(Othman 1982).
Larva C. pavonana berkembang melalui empat instar (Prijono dan Hassan 1992). Setiap instar memerlukan waktu perkembangan berturut-turut 2, 2, 1.5,
dan 3.2 hari, sehingga stadium perkembangan larva rata-rata 8.7 hari pada suhu
25-28 °C dan kelembaban nisbi 60-70%. Larva instar empat dicirikan dengan
corak tubuh berwarna hijau dan garis memanjang berwarna keputihan pada setiap
sisi lateral. Pada setiap ruas terdapat tiga bintik hitam dan seta pada setiap sisinya.
pada saat akan menjadi pupa (Othman 1982). Larva berkepompong di dalam
tanah. Pupa berwarna coklat kekuningan kemudian berubah menjadi coklat tua.
Lama stadium pupa berlangsung 10 hari pada suhu 26-32.2 °C dan kelembaban
nisbi 54.1-87.8% (Othman 1982).
Imago C. pavonana dibedakan antara jantan dan betina dengan tanda dua bercak putih pada sayap depan (Othman 1982). Selain itu, imago jantan mudah
dikenali dengan adanya rambut-rambut coklat tua pada tepi anterior sayap depan.
Tubuh imago jantan umumnya lebih panjang (11.4 mm) dibandingkan imago
betina (9.6 mm) (Prijono dan Hassan 1992). Di laboratorium, imago betina yang
diberi pakan tambahan madu lebah 10% dapat meletakkan 60-598 butir telur
yang tersusun dalam 2-21 kelompok telur. Lama inkubasi telur berlangsung 3-10
hari pada suhu 16-22.5 °C dan kelembaban nisbi 60-80% (Othman 1982).
Hubungan Parasitoid - Inang
Pengendalian hayati merupakan sistem pengendalian yang memanfaatkan keberadaan musuh alami di lapang dan menjadi inti dari program PHT. Salah satu musuh alami yang digunakan sebagai agen biologis dalam mengendalikan hama di lapangan adalah parasitoid (Rehman dan Powell 2010). Kehidupan parasitoid di lapangan dipengaruhi oleh beberapa faktor biotik dan abiotik. Keberadaan inang merupakan faktor biotik yang diperlukan parasitoid untuk berkembang dan melangsungkan siklus hidupnya (Nelly dan Yaherwandi 2006). Keberhasilan parasitoid untuk mendapatkan inang dilalui dengan empat tahapan pencarian
inang, yaitu: 1) penemuan habitat inang, 2) penemuan individu inang, 3) penerimaan inang oleh parasitoid, dan 4) kesesuaian hidup parasitoid di dalam
tubuh inang (Doutt 1959). Van Alpen dan Vet (1986) mengemukakan bahwa dalam posisi penemuan inang, parasitoid menggunakan tiga mekanisme yaitu: 1) menandai adanya vibrotaksis (gerakan inang), 2) dengan perabaan oleh ovipositor dan 3) perabaan oleh antena. Berbagai interaksi seperti genetik, faktor pembelajaran dan pengkondisian memiliki peranan penting pada perilaku pemilihan inang yang dilakukan oleh parasitoid (Rehman dan Powell 2010). Sementara menurut Strand dan Pech (1995) kesesuaian parasitoid-inang dapat
menyerang inang, kecukupan akan kebutuhan untuk perkembangan parasitoid dan
menghindari penyisihan oleh sistem kekebalan inang, 2) kemampuan inang untuk
bereaksi melawan penyerangan parasitoid.
Enkapsulasi : Reaksi Pertahanan Inang terhadap Parasitoid
Keberhasilan parasitisme berkaitan erat dengan kesesuaian sistem
pertahanan tubuh internal inang terhadap serangan parasitoid (Strand dan Pech
1995). Enkapsulasi merupakan suatu respon pertahanan yang umum dilakukan
oleh serangga inang terhadap endoparasitoid dan organisme asing lainnya (Strand
dan Pech 1995; Blumberg 1997). Menurut Gupta (1991) dan Chapman (1998)
proses enkapsulasi dimulai dengan terjadinya kontak antara benda asing yang cukup besar seperti telur atau larva parasitoid dengan sel-sel darah granulosit atau koagulosit yang mengakibatkan sel-sel darah tersebut pecah dan melepaskan faktor-faktor pengenal (recognition factor) yang terdiri dari zat yang mirip mukopolisakarida, senyawa fenol, dan fenoloksidase (juga terdapat dalam cairan darah) serta enzim-enzim (diproduksi oleh sel-sel oenositoid). Faktor pengenal tersebut merangsang sel-sel plasmatosit menempel dan memipih pada permukaan telur atau larva parasitoid membentuk kapsul. Kapsul yang terbentuk mempunyai tiga lapisan: 1) lapisan bagian dalam yang terdiri dari sel-sel plasmatosit (ketebalan 10 sel) yang mengalami nekrosis setelah memproduksi melanin, 2) lapisan tengah yang terdiri dari sel-sel plasmatosit yang memipih (ketebalan 20 sel) sel-sel ini dihubungkan oleh desmosom, dan 3) lapisan bagian luar yang terdiri atas sel-sel plasmatosit yang tidak termodifikasi (ketebalan 5 sel).
Dalam enkapsulasi seluler, sel-sel darah inang (hemosit) mengelilingi dan
menempel pada permukaan benda yang menginvasi, membentuk kapsul
multiseluler seperti amplop yang mengelilinginya (Blumberg 1997). Gotz (1986)
mengemukakan bahwa pada rangkaian enkapsulasi seluler proses enkapsulasi
dibagi menjadi 10 tahap yang berurutan dimana hampir tiap-tiap tahap dilengkapi
dalam 15 menit. Keseluruhan proses berakhir antara 1 dan 3 hari. Kapsul yang
berkembang secara penuh disusun oleh beberapa tipe hemosit, di antaranya adalah
prohemosit, plasmatosit, oenositoid, thrombositoid dan granular hemosit. Sel-sel
hemosit total dari spesies serangga yang diberikan (Gotz dan Boman 1985;
Vinson 1990). Dalam proses enkapsulasi sel-sel bagian dalam yang berperan
membentuk kapsul yang membungkus parasitoid akan mengalami melanisasi,
sehingga pada akhirnya melanin akan terakumulasi pada permukaan benda yang
dienkapsulasi (Gotz dan Boman 1985).
Pada serangga Lepidoptera, sel granulosit dan plasmatosit berperan di
dalam formasi kapsul, sedangkan oenositoid dan granulosit dilaporkan
mempunyai aktivitas enzim fenoloksidase yang berperan di dalam melanisasi
kapsul. Melanin ini pada dasarnya dibentuk selama oksidase dan polimerase fenol,
yaitu tirosin dan dopa oleh enzim yang disebut fenoloksidase (Nappi 1975).
Menurut Van den Bosch (1964) parasitoid yang mengalami enkapsulasi ada
kemungkinan mati karena kekurangan nafas, kelaparan atau penghambatan secara
fisik. Parasitoid yang dienkapsulasi secara parsial dapat bertahan hidup dan
mungkin melanjutkan untuk berkembang secara normal. Dalam laporan lain
disebutkan bahwa beberapa larva parasitoid dari kelompok Hymenoptera mampu
menghindari proses enkapsulasi karena gerakan larva yang aktif. Pada Tachinidae
(Diptera) terdapat sistem saluran pernafasan yang berhubungan dengan sistem
trakhea inangnya sehingga kebutuhan oksigen dapat terpenuhi. Selain itu benda
asing dapat terhindar dari proses enkapsulasi karena mempunyai sifat-sifat
permukaan yang menyerupai jaringan ikat dari inangnya sehingga tidak
menimbulkan respon dari sel-sel darah (Woodring 1985; Chapman 1998).
Beberapa spesies Ichneumonidae dan Braconidae (Hymenoptera) mengandung polydnavirus pada bagian kaliks dari ovarinya yang dapat menghambat terjadinya proses enkapsulasi (Strand dan Noda 1991; Lavine dan Beckage 1995; Strand dan Pech 1995). Selain itu kapsul yang terbentuk saat enkapsulasi dapat dirusak oleh senyawa racun yang dikeluarkan oleh imago
parasitoid pada saat meletakkan telur. Racun tersebut dapat merusak susunan
kapsul sehingga telur parasitoid dapat terbebas dan melanjutkan
Implikasi Enkapsulasi dalam Pengendalian Hayati
Parasitoid E. argenteopilosus merupakan agens hayati yang sangat potensial untuk dikembangkan sebagai agens pengendali C. pavonana karena hampir selalu ditemui di pertanaman sayuran, namun tingginya tingkat enkapsulasi menyebabkan E. argenteopilosus kurang efektif dijadikan sebagai cara pengendalian hama C. pavonana di lapangan (Hadi 1985; Nelly dan Yaherwandi 2006). Chapman (1998) mengemukakan bahwa proses fagositosis dan enkapsulasi terhadap telur dan larva parasitoid merupakan contoh reaksi pertahanan diri inang.
Kegagalan parasitoid dalam menekan populasi inang sering disebabkan oleh
proses fagositosis maupun proses enkapsulasi tersebut.
Tingginya kecepatan enkapsulasi sangat menentukan terjadinya peledakan
serangga hama di lapangan, yang secara tidak langsung menunjukkan
ketidakefektifan parasitoid. Kemampuan serangga inang di dalam menghambat
perkembangan parasitoid melalui enkapsulasi telah banyak dipelajari
di laboratorium. Hal ini sangat berguna dalam meramalkan potensi parasitisasi
di lapangan dan juga dapat menjelaskan penyebab kegagalan inundasi atau
introduksi parasitoid. Tingginya enkapsulasi merupakan kendala yang sangat
mengganggu di dalam perbanyakan parasitoid di laboratorium (Blumberg 1997).
Van den Bosch (1974 dalam Hadi 1985) menyebutkan bahwa salah satu penyebab turunnya efektivitas parasitoid Bathyplectes curculionis (Hymenoptera: Ichneumonidae) dalam mengendalikan hama Hypera bruneipennis (Coleoptera: Curculionidae) adalah terjadinya enkapsulasi pada telur parasitoid.
Pengaruh Pakan terhadap Kebugaran dan Kemampuan Enkapsulasi Inang
terutama kuantitas protein dan asam amino yang sangat mendukung dalam proses reproduksi, serta pertumbuhan dan perkembangan serangga secara optimal (Chapman 1998).
Selain itu pakan juga mempengaruhi sistem pertahanan yang dimiliki oleh inang. Sistem pertahanan merupakan hal penting yang dibutuhkan inang ketika terjadi penyerangan oleh parasitoid. Inang membutuhkan pakan yang berkualitas untuk mendapatkan sistem pertahanan yang efektif dalam melakukan perlawanan terhadap serangan parasitoid. Kandungan nutrisi yang berbeda-beda pada pakan seperti protein, gula, asam lemak, kadar air, dan komponen lain seperti senyawa tanin dan fenolik lainnya merupakan faktor yang berpengaruh terhadap pertahanan yang dimiliki oleh inang (Haukioja 2003, 2005). Klemola (2009) menjelaskan bahwa kualitas pakan inang merupakan salah satu faktor yang menentukan sistem pertahanan yang dimiliki oleh inang. Pakan yang berkualitas tinggi memiliki kecenderungan bahwa sistem pertahanan yang dimiliki inang tersebut juga baik.