STUDI HISTOPATOLOGI ORGAN OTAK DAN PARU-PARU
HAMSTER DAN MENCIT YANG DIINFEKSI
Coxiella burnetii
ROSITA
B04070188
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul kajian histopatologi organ otak dan paru-paru pada hamster dan mencit yang dinfeksi Coxiella burnetti adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2013
ABSTRAK
ROSITA. Studi Histopatologi Organ Otak dan Paru-Paru Hamster dan Mencit yang Diinfeksi Coxiella burnetii. Dibimbing oleh AGUS SETIYONO dan MAWAR SUBANGKIT.
Penelitian ini bertujuan adalah untuk mengetahui lesio histopatologi otak dan paru-paru hamster dan tikus yang diinfeksi bakteri Coxiella burnetii dengan pewarnaan Hematoksilin Eosin (HE) dan imunohistokimia (IHK). Sebanyak 3 kelompok hewan percobaan, terdiri dari kelompok I (Hamster A), kelompok II (Hamster B), dan kelompok III (mencit). Kelompok I diinfeksi dengan bakteri Coxiella burnetii, dipelihara selama 7 hari kemudian dieutanasi menggunakan diazepam sebanyak 0,25 ml dan otak dan paru-paru diambil untuk menjadi sampel pertama. Limpa kelompok ini diekstraksi dan diinfeksikan ke grup II. Prosedur ini diulang dari kelompok II dengan kelompok III. Hasil penelitian menunjukkan lesio berupa infiltrasi sel-sel radang, kongesti, hemoragi, edema, dan nekrosis pada otak ketiga kelompok hewan dengan tingkat keparahan yang berbeda. Lesio pada organ paru-paru menunjukkan infiltrasi sel-sel radang, kongesti, hemoragi, emfisema, dan edema. Pewarnaan IHK menunjukkan hasil positif pada hamster dan mencit.
Kata kunci : Coxiella burnetii, paru-paru, otak
ABSTRACT
ROSITA. Histopathology Study of Hamster’s and Mice’s Brain and Lung which were Infected with Coxiella burnetii. Supervised by AGUS SETIYONO and MAWAR SUBANGKIT.
This study aims were to describe histopathological lesions of the brain and lungs of hamster and mice were infected with bacterium Coxiella burnetii using Hematoxylin Eosin (HE) staining and immunohistochemistry (IHC) technique. A total of 3 groups of experimental animals, consists of group I (hamster A), group II (hamster B), and group III (mice). Group I infected with bacterium Coxiella burnetii, maintained for 5 days then were euthanazied by 0.25 ml diazepam and colected brain and lungs to be the first sample. Spleen of this group was extracted and infected to group II. This procedure was repeated from group II to group III. The results showed lesions in the form of infiltration of inflammatory cells, congestion, hemorrhage, edema, and necrosis of the brain in all three groups of animals with different levels of severity. Lesions in the lung organ showed infiltration of inflammatory cells, congestion, hemorrhage, emphysema, and edema. IHK staining showed positive results in both brain and lungs whether hamsters or mice.
STUDI HISTOPATOLOGI ORGAN OTAK DAN PARU-PARU
HAMSTER DAN MENCIT YANG DIINFEKSI
Coxiella burnetii
ROSITA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
Judul Penelitian : Studi Histopatologi Organ Otak dan Paru-Paru Hamster dan Mencit yang Diinfeksi Coxiella burnetii
Nama : Rosita
NRP : B04070188
Disetujui, Dosen Pembimbing
drh. Agus Setiyono, MS. Ph.D. APVetdrh. Mawar Subangkit
Diketahui,
Wakil Dekan Fakultas Kedokteran Hewan
drh. Agus Setiyono, MS. Ph D. APVet
Pembimbing I Pembimbing II
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahuwata’ala atas
segala karunia-Nya sehingga tugas akhir ini dapat diselesaikan. Judul penelitian adalah Studi Histopatologi Organ Otak dan Paru-Paru Hamster dan Mencit yang
Diinfeksi Coxiella burnetii. Penelitian ini mulai dilaksanakan pada bulan Juli
2012.
Terimakasih penulis ucapkan kepada Bapak drh. Agus Setiyono, MS, Ph.D, APVet dan Bapak drh. Mawar Subangkit, MSi selaku dosen pembimbing skripsi yang memberikan semangat kepada penulis. Terima kasih penulis haturkan kepada Bapak Prof. Dr. drh. Muhammad Agus Setiadi selaku dosen pembimbing akademik yang telah memberikan banyak pengarahan dan nasehatnya. Ucapan terima kasih penulis ucapkan kepada Bapak Sholeh, Bapak Kasnadi, serta seluruh staf Patologi yang memberikan banyak bantuan selama penulis melakukan penelitian.UngkapanterimakasihjugadisampaikankepadaBapak Abd. Rasid SP dan Almh. Rahmatia, dan abang Adi yang telah memberikan kasih sayang serta bantuan materinya kepada penulis. Terima kasih kepada group Khanza, Mba Tania, El Fattah Catfish Group, Mba Ani, Mba Ana, Bapak dan Ibu Ciledug, An-Nahl, Gianuzzi 44, teman-teman sepenelitian, serta seluruh pihak yang telah membantu penulis selama ini.
Penulis menyadari bahwa penulisan skripsi ini tidak luput dari kekurangan, untuk itu penulis berterima kasih atas saran dan kritik yang membangun dari seluruh pihak. Semogaskripsiinibermanfaat.
Bogor, September 2013
DAFTAR ISI
DAFTAR GAMBAR i
DAFTAR TABEL i
PENDAHULUAN 1
Latar belakang 2
Tujuan penelitian 2
Manfaat Penelitian 2
MATERI DAN METODE 2
Waktu dan tempat penelitian 2
Bahan dan alat 2
Prosedur penelitian 2
Penginfeksian hewan coba 2
Pemilihan organ 3
Dehidrasi 3
Pembuatan blok embedding 3
Prosedur trimming 4
Pewarnaan imunohistokimia 4
Deparafinisasi 4
Prosedur imunohistokimia 4
HASIL DAN PEMBAHASAN 5
Hasil 5
Gambaran histopatologi otak setelah diinfeksi dengan bakteri C.burnetii 7
Gambaran histopatologi paru-paru setelah diinfeksi dengan bakteri
C. burnetii. 9
SIMPULAN DAN SARAN 11
Simpulan 11
Saran 11
DAFTAR PUSTAKA 11
DAFTAR TABEL
DAFTAR GAMBAR
1. Hasil pengamatan organ otak dan paru-paru pada hamster dan mencit
setelah diinfeksi C. burnetii
6
2. Hasil pengamatan imunohistokimia pada organ otak dan paru-paru 7
1. Perbandingan histopatologi organ otak setelah diinfeksi C. burnetti
dengan pewarnaan HE
6
2. Perbandingan histopatologi organ paru-paru setelah diinfeksi C. burnetti
dengan pewarnaan HE
6
3. Organ paru-paru pada kelompok I setelah diinfeksi bakteri C. burnetii
dengan pewarnaan HE
7
4. Hasil pengamatan organ otak mencit dengan pewarnaan HE 8
5. Histopalogi otak mencit 9
6. Hasil pewarnaan IHK pada organ paru-paru 10
PENDAHULUAN
Latar belakangQ fever merupakan penyakit zoonosis yang disebabkan oleh bakteri Coxiella burnetii (C. burnetii). Penyakit ini pertama kali ditemukan di daerah Queensland, Australia (Jennifer et al 2002). Manusia biasanya tertular Q fever setelah kontak dengan hewan yang terinfeksi. Selain itu, penularan Q fever dapat diperantarai oleh paparan lingkungan yang terkontaminasi Q fever. Penularan dapat terjadi melalui beberapa cara, yaitu kontak langsung dengan hewan terinfeksi, pangan berasal dari hewan ternak yang terinfeksi seperti daging, susu, produk ternak lainnya maupun oleh partikel debu yang terkontaminasi agen penyebab Q fever.
Q fever telah menjadi masalah kesehatan masyarakat di berbagai negara seperti Amerika, Perancis, Inggris, Italia, Jerman, Spanyol, Kanada, Jepang, Australia, Thailand, Taiwan, dan Malaysia. Menurut Angelakis dan Raoult 2010, penyebaran Q fever ada di seluruh dunia kecuali New Zealand. Sejak tahun 1999-2004, dilaporkan terjadi 18 kasus Q fever pada hewan domba, kambing, kucing, anjing dan hewan liar di 12 negara di dunia.
Mencit merupakan hewan laboratorium yang sering digunakan untuk penelitian. Menurut Andoh 2007, mencit memiliki tingkat kematian tinggi dan kerentanan yang baik terhadap infeksi C. burnetii sedangkan Proreshnaya et al 1960 menyatakan hamster dapat digunakan dalam kasus-kasus yang membutuhkan isolasi dari jaringan terinfeksi dan untuk mendapatkan antigen C. burnetii fase I. Penelitian tentang infeksi C. burnetii dapat dilakukan dengan pengamatan histopatologi. Pengamatan lesio histopatologi merupakan salah satu cara untuk mendiagnosa infeksi suatu penyakit. Selain melakukan pengamatan lesio organ, cara lain untuk melakukan identifikasi terhadap penyakit ini adalah dengan melakukan pewarnaan imunohistokimia (IHK).
C. burnetii memiliki dua fase antigen yang berbeda, yaitu fase I dan fase II. C. burnetii fase I diperoleh di alam dengan tingkat virulensi tinggi sedangkan C. burnetii yang mengekspresikan antigen fase II kurang menular dan ditemukan
setelah passage di sel kultur. Perbedaan fase ini diperoleh dari karakteristik
biokimia termasuk komposisi lipopolisakarida bakteri (OIE 2007).
Rute inhalasi merupakan rute utama penyebab infeksi C. burnetii pada manusia. Sementara rute pencernaan dianggap sebagai penyebab lain infeksi C. burnetii pada manusia (konsumsi produk hasil peternakan). Kebanyakan kasus
infeksi C. burnetii menunjukkan gejala asymptomatic atau gejala nonspecific
flu-like illness. Organ otak dan paru merupakan organ yang dapat mengalami lesio akibat infeksi C. butnetii (Babudieri 1959). Bakteri C. butnetii masuk ke organ otak dan paru melalui pembuluh darah. Menurut Marrie et al 1988, Q fever akut meyebabkan pneumoni, hepatitis, dan encepalitis.
Limpa merupakan organ pertahanan yang berperan pada proses peradangan, khususnya peradangan yang bersifat sistemik. Ekstrak limpa dapat diinfeksikan pada telur berembrio. Metode ini membantu dalam kasus-kasus yang membutuhkan isolasi dari jaringan terkontaminasi dengan beberapa bakteri atau untuk memperoleh fase I antigen Coxiella dari sel fase II (Fournier et al 1998).
imunohistokimia metode peroksidase, yaitu antigen yang ada pada jaringan berikatan dengan antibodi yang spesifik.
Menurut Polak dan Noorden 2003, terdapat dua metode dasar identifikasi antigen dalam jaringan dengan imunohistokimia, yaitu metode langsung (direct method) dan tidak langsung (indirect method). Metode langsung (direct method) merupakan metode pewarnaan satu langkah karena hanya melibatkan antibodi primer, yaitu antibodi yang terlabel. Metode tidak langsung (indirect method) menggunakan dua jenis antibodi, yaitu antibodi primer (tidak berlabel) dan antibodi sekunder (berlabel). Antibodi primer bertugas mengenali antigen yang diidentifikasi pada jaringan (first layer), sedangkan antibodi sekunder akan berikatan dengan antibodi primer (second layer).
Penambahan substrat yang berisi kromogen dan H2O2 akan memunculkan
endapan berwarna coklat dan H2O. Endapan coklat merupakan hasil penguraian
substrat (kromogen dan H2O2) oleh enzim peroksidase. Warna coklat yang
muncul menandakan reaksi positif, yang artinya di dalam jaringan terdapat antigen. Apabila di jaringan tersebut tidak terdapat antigen, maka tidak akan muncul warna coklat. Pelabelan antibodi sekunder diikuti dengan penambahan substrat berupa kromogen. Kromogen merupakan suatu gugus fungsi senyawa kimiawi yang dapat membentuk senyawa berwarna bila bereaksi dengan senyawa tertentu (Ramos 2005).
Metode Avidin Biotin Complex (ABC) adalah metode analisis imunohistokimia menggunakan afinitas terhadap molekul avidin-biotin oleh tiga enzim peroksidase. Situs pengikatan beberapa biotin dalam molekul avidin tetravalen bertujuan untuk amplifikasi dan merespon sinyal yang disampaikan oleh antigen target. Metode ini lebih sensitif dibandingkan metode tidak langsung.
Tujuan
Penelitian ini bertujuan untuk mengetahui lesio histopatologi organ otak dan organ paru-paru hamster dan mencit yang diinfeksi bakteri C. burnetii dengan pewarnaan Hematoksilin Eosin (HE) dan IHK.
Manfaat
Mendapatkan data informasi dasar infeksi C. burnetii pada hamster dan mencit khususnya organ otak dan paru-paru.
METODE
Waktu dan Tempat Penelitian
Bahan dan Alat
Hewan coba yang digunakan pada penelitian adalah hamster berumur 4-5 minggu dengan jenis kelamin jantan sebanyak 6 ekor dan mencit berumur 4 minggu sebanyak 5 ekor dengan jenis kelamin jantan. Total hewan coba yang digunakan berjumlah 11 ekor. Bahan lain yang digunakan adalah Coxiella
burnetii strain Nine Mile, Phosphate Buffered Saline (PBS), Buffered Neutral
Formalin (BNF)10%, etanol (70%, 80%, 90%, absolut), xylene, parafin, entelan, pewarna Hematoksilin Eosin (HE), antibodi primer anti-C. burnetii, pewarna imunohistokimia, diazepam, dan aquades.
Alat-alat yang digunakan pada penelitian ini adalah kandang dan syringe. Pada tahap nekropsi, peralatan yang digunakan adalah styrofoam, skalpel, gunting, pinset, dan pot plastik. Peralatan tambahan lainya adalah peralatan untuk pembuatan slide histopatologi dan untuk melakukan pengamatan, yaitu mikroskop cahaya dan alat foto micrograph.
Penginfeksian Hewan Coba
Hewan coba dibagi menjadi tiga kelompok. Kelompok I (hamster A, passage I) terdiri dari 3 ekor hamster, kelompok II (hamster B, passage II) terdiri dari 3 ekor hamster, dan kelompok III (mencit dari hamster B passage II) terdiri dari 5 ekor mencit. Kelompok I diinjeksi dengan bakteri C. burnetii strain Nine Mile secara intraperitoneal (i,p.), kemudian dipelihara selama 7 hari. Setelah dipelihara, hewan coba tersebut dieutanasi menggunakan diazepam dengan dosis 0,25 ml,
lalu dilakukan nekropsi. Diazepam merupakan tergolong sedativa yang dapat
digunakan untuk eutanasi pada hewan coba. Setelah pemanenan, organ paru-paru dan otak dipisahkan untuk dijadikan sample kelompok hewan I. Limpa pada kelompok hewan I digerus dan diambil ekstraknya. Ekstrak limpa ditambahkan dengan larutan PBS. Larutan PBS tersebut kemudian disentrifuse untuk diambil ekstraknya. Ekstrak yang telah diambil kemudian diinjeksikan ke kelompok II sebanyak 0,4 ml. Kelompok ini dipelihara selama 7 hari lalu dipanen. Setelah pemanenan, organ paru-paru dan otak dipisahkan untuk dijadikan sample untuk kelompok II. Organ limpa pada kelompok ini kemudian diambil dan diproses seperti pada kelompok I. Setelah itu, ekstrak limpa yang sudah jadi diinfeksikan lagi ke kelompok III. Hewan coba kelompok III kemudian dipelihara selama 7 hari lalu dipanen. Organ otak dan paru-paru pada kelompok ketiga dipisahkan
untuk dijadikan sample untuk kelompok III. Metode ini disebut passage. Organ
otak dan paru-paru yang telah dipisahkan dari ketiga kelompok tersebut dibuat menjadi slide histopatologi. Kemudian kedua organ ini dikaji secara histopatologi dengan melihat tanda-tanda infeksi dan tanda-tanda peradangan.
Pemilihan organ
Dehidrasi
Dehidrasi adalah pengambilan air dari dalam jaringan secara perlahan-lahan dengan menggunakan alkohol dengan konsentrasi bertingkat. Adapun tahapan dehidrasinya adalah dengan etanol 70%, 80%, 90%, 95%, absolut 1, absolut 2, organ direndam masing-masing 2 jam pada cairan etanol 70% sampai tahap absolut 2. Kemudian organ tersebut direndam dengan xylol 1 dan xylol 2 masing-masing selama 40 menit. Setelah itu, sampel diinfiltrasi dengan parafin 1 dan 2 selama 30 menit pada suhu 60° C.
Pembuatan blok embedding
Embedding adalah proses pembuatan-blok organ dengan menggunakan parafin.
Embedding dimulai dengan menyiapkan cetakan yang ukurannya sesuai dengan
sampel jaringan. Cetakan diisi dengan parafin dari larutan tissue embedding control. Organ dari parafin II diambil lalu dimasukkan pada cetakan dengan posisi bagian yang akan dipotong pada bagian bawah, sebelumnya bagian dalam cetakan parafin diberi gliserin untuk mempermudah melepaskan parafin. Pada satu cetakan dapat diisi beberapa organ. Cetakan dapat didinginkan pada cold plate untuk mencegah terjadinya pembekuan pada parafin bagian atas. Cetakan dapat diinkubasi dalam air dingin setelah parafin membeku sehingga blok paraffin dapat
dikeluarkan dari dalam cetakan. Blok parafin dapat langsung di-trimming untuk
mempermudah pemotongan dengan microtom.
Prosedur trimming
Trimming adalah penipisan organ untuk mendapatkan bagian organ yang
bagus. Tujuan trimming untuk memudahkan larutan fiksasi masuk sampai pada
bagian terdalam dari slide. Prosedur trimming diawali dengan mengeluarkan
organ terpilih dari dalam fiksator atau larutan penyimpan. Organ dipotong di atas alas yang lembut pada bagian yang diinginkan dengan dua mata pisau. Setelah itu dilanjutkan dengan pemotongan dengan mikrotom. Ukuran ketebalan sampel
3-5 μm. Kemudian, dilekatkan pada gelas objek yang telah coating dan disimpan
dalam inkubator.
Pewarnaan Hematoksilin-Eosin (HE)
Deparafinisasi
Slide yang telah disiapkan direndam di dalam xylol sebanyak tiga kali dengan masing-masing waktu 5 menit. Kemudian tahap berikutnya adalah rehidrasi menggunakan alkohol bertingkat (absolut, 96%, 80%, 70%) masing-masing selama 5 menit lalu dibilas dengan menggunakan aquades selama 5 menit.
Prosedur imunohistokimia(IHK)
Langkah pertama, slide dipanaskan menggunakan antigen retrieval selama 30 menit dengan suhu 95°C lalu dilarutkan dalam citric acid kemudian ditambahkan PBS. Setelah itu diaplikasikan blocking endogenous peroxida, menggunakan
H2O2 0,3% (Dako, Inc) selama 30 menit pada suhu ruang. Slide selanjutnya dicuci
dengan Phosphate Buffered Saline (PBS) sebanyak 3 kali selama 5 menit.
Kemudian diaplikasikan Blocking Normal Serum, blocking ini dilakukan menggunakan serum FBS 1 % (Sigma USA) selama 30 menit pada suhu ruang. Slide kemudian dicuci dengan PBS selama 5 menit sebanyak 3 kali. Slide preparat yang telah di-blocking diinkubasi dengan antibodi primer Rabbit anti-C. burnetii
antibody selama satu malam pada suhu 4°C. Slide yang telah diinkubasi tersebut
dicuci lagi sebanyak 3 kali selama 5 menit dengan menggunakan PBS kemudian ditetesi dengan antibodi sekunder berlabel biotin kemudian diinkubasi selama 30 menit pada suhu ruang. Kemudian slide tersebut dicuci selama 5 menit sebanyak 3 kali menggunakan PBS. Setelah slide dicuci, lalu ditetesi Streptavidin (USA) Horseradish peroxidase (HRP), didiamkan selama 30 menit pada suhu ruang. Slide dicuci lagi dengan PBS, kemudian diaplikasi dengan kromogen untuk HRP yaitu diaminobenzidine (DAB) lalu dibilas dengan aquades. Setelah itu dilakukan counter straining menggunakan hematoksilin sebanyak 10 kali celupan, kemudian
dicuci dengan aquades lalu proses ini diakhiri dengan mounting (penutupan
sediaan dengan cover glass) menggunakan entelan dan diperiksa dibawah mikroskop cahaya.
HASIL DAN PEMBAHASAN
Hasil
Hasil pengamatan pada organ otak dan paru-paru menunjukkan nilai yang berbeda. Pada organ otak kelompok I (Hamster A) terjadi peradangan dengan tingkat keparahan ringan. Hal ini ditandai dengan peningkatan jumlah limfosit dan sel mikroglia. Pada kelompok II (Hamster B) menunjukkan adanya peradangan dengan derajat sedang. Hal ini ditandai dengan adanya nekrosis ringan pada beberapa titik lokasi pada otak. Pada kelompok III (Mencit) menunjukkan peradangan dengan tingkat keparahan yang jelas. Hal ini dapat dilihat dengan adanya perdarahan yang tersebar ringan sampai nekrosis sedang.
menunjukkan kerusakan dengan derajat keparahan jelas. Hal ini ditandai dengan pendarahan ringan yang tersebar dan adanya nekrosis sedang. Pada kelompok III (Mencit) menunjukkan kerusakan parah, hal ini ditandai dengan persebaran limfosit dan makrofag yang banyak serta hemoragi yang parah. Hasil selengkapnya disajikan pada Tabel I.
Tabel 1 Hasil pengamatan organ otak dan paru-paru pada hamster dan mencit setelah diinfeksi C. burnetii
No Organ Kelompok
I (Hamster A) II (Hamster B) III (Mencit)
1. Otak 1 2 3
2. Paru-paru 2 3 4
Ket 0 : tidak ada kerusakan; 1 : ringan, 2: sedang; 3: jelas 4 : parah
1, Ringan : peradangan ringan, terdiri dari sedikit peningkatan jumlah limfosit dan makrofag; 2, sedang : peradangan sedang, ditandai dengan akumulasi limfosit dan makrofag yang tersebar, kadang-kadang disertai dengan nekrosis ringan; 3 jelas : ditandai peradangan yang terdiri dari infiltrasi makrofag dan akumulasi limfosit dengan hiperemia dan perdarahan dan tersebar ringan sampai nekrosis sedang; 4 parah : peradangan berat, ditandai dengan akumulasi makrofag dan limfosit dengan hiperemi dan perdarahan serta nekrosis parah.
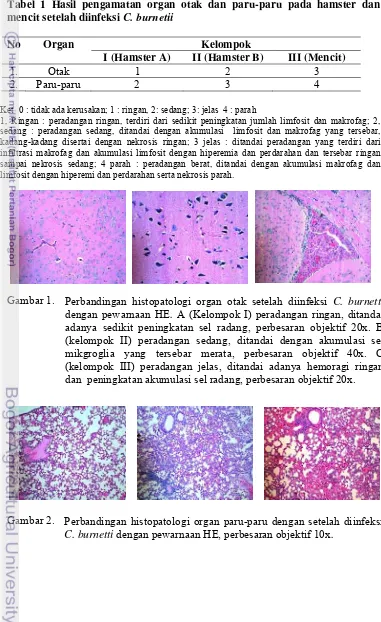
Gambar 1.
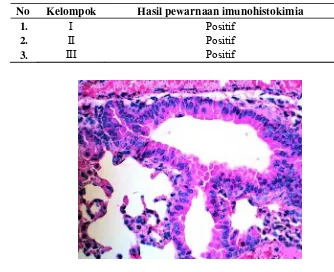
Gambar 2. Perbandingan histopatologi organ paru-paru dengan setelah diinfeksi
C. burnetti dengan pewarnaan HE, perbesaran objektif 10x.
Perbandingan histopatologi organ otak setelah diinfeksi C. burnetti
dengan pewarnaan HE. A (Kelompok I) peradangan ringan, ditandai
adanya sedikit peningkatan sel radang, perbesaran objektif 20x. B (kelompok II) peradangan sedang, ditandai dengan akumulasi sel mikgroglia yang tersebar merata, perbesaran objektif 40x. C (kelompok III) peradangan jelas, ditandai adanya hemoragi ringan dan peningkatan akumulasi sel radang, perbesaran objektif 20x.
A (Kelompok I) dengan peradangan sedang, ditandai adanya peningkatan sel radang. B (kelompok II) dengan peradangan yang jelas, ditandai dengan infitrasi sel radang yang tersebar merata. C (kelompok III) dengan peradangan yang parah, ditandai adanya hemoragi parah.
Tabel 2 Hasil pewarnaan imunohistokimia pada organ otak dan paru-paru
Gambar 3.
Gambaran Histopatologi otak setelah diinfeksi dengan bakteri C. burnetti
Hasil pengamatan pada organ otak kelompok I menunjukkan peradangan ringan, terlihat adanya infiltrasi sel radang, dan limfosit. Sel radang merupakan sel-sel yang memegang peran penting dalam proses peradangan. Peradangan merupakan mekanisme pertahanan aktif tubuh yang terdiri dari leukosit atau granulosit (polimorfonuklear). Keberadaan sel radang menunjukkan adanya agen patogen. Bakteri yang menginfeksi melepaskan eksotoksin atau endoktoksin yang spesifik (Underwood 1999).
Selain lesio tersebut, ditemukan pula lesio berupa kongesti dan edema. Kongesti merupakan suatu keadaan dimana darah berakumulasi atau tertimbun di dalam pembuluh darah yang melebar. Kongesti yang bertambah parah mengakibatkan penumpukkan deoksihemoglobin. Statis darah yang tidak mengandung oksigen dalam waktu lama mengakibatkan hipoksia berat yang menyebabkan kematian sel (Mitchell 2006). Menurut Gilbert et al 2010, infeksi C. burnetii menyebabkan kongesti pada pembuluh darah otak.
No Kelompok Hasil pewarnaan imunohistokimia
1. I Positif
2. II Positif
3. III Positif
Organ paru-paru pada kelompok I setelah diinfeksi bakteri
C. burneti dengan pewarnaan HE, perbesaran objektif 40x. Tanda
Sel mikroglia merupakan sel makrofag pada otak. Akumulasi sel mikroglia pada otak menunjukkan adanya respon pertahanan akibat inflamasi.
Gambar 4. Hasil pengamatan organ otak mencit dengan pewarnaan HE, perbesaran objektif 40x. Keterangan, A : Sel mikroglia. B : edema di sekitar kongesti pembuluh darah. C : kongesti pada otak
Edema merupakan akumulasi abnormal cairan dalam parenkim otak. Edema dapat terjadi setelah adanya akumulasi darah berlebihan pada pembuluh darah otak (kongesti). Edema dibagi menjadi dua, yaitu edema vasogenik dan edema sitotoksik. Edema vasogenik merupakan proses keluarnya cairan yang berasal dari pembuluh darah dan terakumulasi di sekitar sel. Sitotoksik edema didefinisikan sebagai cairan yang terakumulasi dalam sel sebagai akibat dari cedera sel (Marmarou 2004). Menurut Price dan Wilson 1995, edema dapat terjadi akibat peningkatan tekanan hidrostatik dan penurunan permiabilitas paru-paru. Tekanan hidrostatik yang tinggi mengakibatkan cairan masuk ke dalam ruang interstisial. Oleh karena itu, kongesti dan edema cenderung terjadi bersama-sama.
Hasil pengamatan pada organ otak kelompok II menunjukkan peradangan sedang, terlihat adanya nekrosis ringan serta infiltrasi limfosit dan sel mikroglia. Menurut Bernit et al 2002, infeksi C. burnetti pada sistem syaraf pusat (SSP)
menyebabkan encephalitis (radang pada otak). Selain lesio tersebut, ditemukan
Gambar 5. Histopatologi otak mencit dengan pewarnaan HE, perbesaran objektif 40x. Tanda panah menunjukkan nekrosis sedang.
Gambaran histopatologi paru-paru setelah diinfeksi dengan bakteri C. burnetii.
Hasil pengamatan pada organ paru-paru menunjukkan peradangan dengan derajat yang lebih parah jika dibandingan dengan organ otak. Lesio yang tejadi pada organ paru-paru terlihat sangat jelas berupa infiltrasi sel radang, neutrofil, dan limfosit pada pembendungan pembuluh darah. Hasil pengamatan pada kelompok I menunjukkan derajat keparahan sedang, hal ini ditandai dengan infiltrasi sel radang, neutrofil, dan limfosit serta nekrosis ringan pada epitel bronkhiolus. Selain lesio berupa tanda-tanda radang, organ paru-paru kelompok I menunjukkan lesio berupa kongesti dan edema.
Menurut Steven dan Vincent 2000, proses inflamasi meliputi induksi aktivasi komplemen, aktivitas kemotaktik neutrofil, dan peningkatan respon neutrofil pada pembuluh darah perifer. Infeksi C. burnetii dapat menyebabkan pneumoni (Maurin dan Raoult 1999). Pneumonia merupakan gejala klinis yang sering timbul akibat infeksi C. burnetii (Baranda et al 1985; Tellez et al 1988).
Hasil pengamatan pada organ paru-paru pada kelompok II menunjukkan adanya hemoragi dengan derajat keparahan sedang, infiltrasi sel radang dengan derajat keparahan tinggi, infiltrasi limfosit yang terlihat jelas. Selain itu terlihat lesio berupa empisema. Jika dibandingkan dengan kelompok I, derajat keparahan pada kelompok II menunjukkan derajat yang lebih tinggi. Hal ini dapat diakibatkan antigen C. burnetii mulai mengalami perubahan fase dari fase II ke fase I. Pada kelompok III, organ paru-paru menunjukkan lesio berupa hemoragi dengan tingkat keparahan yang tinggi. Selain itu, terjadi lesion berupa empisema dan edema dengan derajat keparahan tinggi serta perlekatan alveol paru-paru. Menurut Gilbert et al 2010, infeksi C. burnetii dapat menyebabkan edema pada paru-paru.
dinding alveolar. Empisema terjadi disebabkan adanya peradangan bronkhus dan bronkhiolus. Peradangan pada saluran ini menyebabkan obstruksi, akibatnya dinding bronkhiolus melemah dan alveolus pecah sehingga terjadi empisema (Price dan Wilson 1995). Infeksi bakteri pada paru-paru dapat menyebabkan Chronic Obstructive Pulmonary Disease (COPD). COPD adalah penyakit paru-paru yang meliputi emfisema, bronkhitis kronis, dan bronkhiektasis (dilatasi kronik dari bronkus yang ditandai dengan ekspektorasi materi mukopurulen). COPD merupakan salah satu masalah kesehatan utama masyarakat di seluruh dunia (Sumito 2009). Enzim protease dapat menyebabkan terjadinya empisema paru-paru. Ketidakseimbangan antara enzim protease dan antiprotease berperan penting dalam pengembangan COPD. Ketidakseimbangan ini dapat terjadi karena induksi berlebihan enzim protease oleh sel radang atau karena sintesis antiprotease berkurang atau peningkatan kerusakan antiprotease. Studi COPD awalnya berfokus pada neutrofil elastase (NE), protease yang dihasilkan oleh neutrofil, atau protease yang memiliki kapasitas untuk menghidrolisis elastin dan merangsang sekresi lendir (Saskia 2011).
Gambar 6. Hasil pewarnaan IHK organ paru-paru mencit yang positif terinfeksi bakteri C. burnetii, perbesaran objektif 10x.
Menurut Andoh et al 2007, infeksi C. burnetii pada mencit yang mengalami immunodefesiensi sel T dan B menunjukkan lesio pada organ paru-paru berupa akumulasi makrofag, hemoragi, dan nekrosis. Immunodefesiesi terjadi akibat kerusakan limpa. Limpa berfungsi menghasilkan sel-sel pertahanan (sel T dan sel B). Akibat kerusakan ini limpa tidak mampu menghasilkan sel-sel pertahanan sehingga mencit mengalami immunodefisiensi. Infeksi Pausterella multosida juga dapat menyebabkan hemoragi pada paru-paru. Lesio menunjukkan adanya infiltrasi sel polimorfonuklear pada awal infeksi dan sel mononuklear pada akhir infeksi. Terjadi perubahan struktur pada epitel alveol, septa alveol, dan kapiler endotelium paru-paru (Ezhil et al 2010).
pertukaran gas. Hal ini dapat mengakibatkan terjadinya komplikasi persisten dan fibrosis jaringan interstisial (Scott et al 2005).
SIMPULAN DAN SARAN
Simpulan
Infeksi C. burnetii menyebabkan infiltrasi sel radang, kongesti, hemoragi,
edema, dan nekrosis organ otak hamster dan mencit dengan tingkat keparahan yang berbeda. Demikian juga ditemukan lesio berupa infiltrasi sel radang, kongesti, hemoragi, emfisema, dan edema pada organ paru-paru hamster dan mencit dengan tingkat keparahan yang berbeda. Pewarnaan IHK pada organ otak dan paru-paru menunjukkan hasil positif immunoreaktif baik pada hamster maupun mencit.
Saran
Perlu dilakukan penelitian lanjutan untuk mengetahui lesio yang terjadi pada organ lainnya akibat infeksi C. burnetii.
DAFTAR PUSTAKA
Andoh M, Guoquan Z, Kasi E , Heather R, Brad R, James E. 2007. Infect. Immun (7) 3245.
Angelakis E dan Raoult D. 2010. Vet. Microbiol. (140) 297–309.
Babudieri, B. 1959. Q fever : a zoonosis. Adv. Vet. Sci. 5:81 Baranda M, Corral C, and Aguirre E. 1985. Q fever in the Basque country: 1981–
1984. Rev. Infect. Dis (7) 700–701.
Bernit E, Pouget J, Janbon F, Dutronc, H., Martinez, P., Brouqui, P., Raoult, D., 2002. Neurological involvement in acute Q fever. A report of 29 cases and review of the literature. Arch. Intern. Med (162) 693–700.
Ezhil P, Sivakumar P, Kumar A , Nem S. 2010. Cytokine profiles, apoptosis and pathology of experimental Pasteurella multocida serotype A1 infection in mice. Elsevier Ltd. Res. Vet. Science (89) 332–339
Fournier PE, Marrie TJ, Raoult D. 1988. Diagnosis of Q Fever. J Clin Microbiol (36) 1823-1834
Gilbert J, Dyanna M, Joshua S, Adrianne M, James B, Timothy V, Stephen A, Robert F. 2010. Clin. Microbiol (48) 3428.
Jennifer H, James E. Herbert A. 2002. Q Fever. Zoonoses upd (221) 796-799 Marmarou A. 2004. The pathophysiology of brain edema and elevated intracranial pressure. Clev. Clin. J. Med. (71) 6-8.
Marrie T J, Durant J C. Williams E M, Waag D M. 1988. Exposure to parturient cats is a risk factor for acquisition of Q fever in Maritime Canada. J. Infect. Dis. 158:101–108.
Maurin M and Raoult. 1999. Q fever. Can Microbiol Rev (12) 518-553
Office Internationale Epizooticae (OIE). 2007. [internet]. [diacu 12 mei 2012].
Tersedia dari http://www.oie.int Proreshnaya, T L, Rapoport L P, Evdoshenko V G, and Kichatov E A. (1960). ZH
Microbiol Epidemiol Immu (31), 1613–1618.
Polak. J. M dan Noorden. V. S. 2003. Introduction to Immunocytochemistry. 3rd
edision. BIOS Scientific Publishers Ltd. Oxford, UK.
Price S A dan Wilson L M. 1995. Patofisiologi konsep klinis proses-proses penyakit. Edisi ke-4. Jakarta. A Mosby imprint of Mosby-Year Book, Inc.
Ramos J A. 2005. Tech Aspect of Immunohistochemistry. Vet Pathol (42) 405–
426. Tellez A, Sainz C, C. Echevarria, S. De Carlos, M. V. Fernandez, P. Leon, and R. Brezina. 1988. Q fever in Spain: acute and chronic cases 1981–1985. Rev Infect Dis (10) 198-202. Saskia B. 2011. The pathogenesis of lung emphysema: lessons learned from
murine models. Ede, Netherlands. Printed by: GVO | Ponson & Looijen B.V.,. Scott C W, Lisa M C, Lisa N H, Michael T B, Jay W T, John M M, Nadine D,
Mario M, Maureen A S, Craig R T et al. 2005. Gene expression changes during the development of acute lung injury role of transforming growth factor. Am J Resp Crit Care (172) 1399-1411. Steven R K and Vincent F G. 2000. Agricultural Lung Diseases Health Perspect (4) 705-712 Sumito I, Hidenori N,Yoko S, Shuichi A, Noriaki T, Makoto S, Hiroaki T and Isao K. 2009. Effect Of Antibiotic Therapy On The Inflammatory Responses
During Streptococcal Pneumonia In Emphysematous Mice. Exp J (8) 50-57
RIWAYAT HIDUP
Penulis dilahirkan di Polewali Mandar, Sulawesi Barat pada tanggal 3 November 1988. Penulis merupakan anak kedua dari pasangan Bapak Abd. Rasid. SP dan Almh. Rahmatia. Penulis menempuh pendidikan Taman Kanak-Kanak tahun 1996, kemudian melanjutkan pendidikan sekolah dasar di SDN 007 Sidodadi, Polewali Mandar, Sulawesi Barat hingga lulus tahun 2001. Setelah itu penulis melanjutkan pendidikan di SMP Negeri 3 Polewali, Polewali Mandar, Sulawesi Barat hingga tahun 2004, kemudian melanjutkan ke SMA Negeri 1 Polewali, Polewali Mandar, Sulawesi Barat sampai tahun 2005 namun penulis pindah ke SMA 1 Mamuju, Sulawesi Barat dikarenakan mengikuti orang tua dan lulus tahun 2007. Penulis melanjutkan pendidikan ke Fakultas Kedokteran Hewan (FKH), Institut Pertanian Bogor (IPB) melalui jalur SPMB pada tahun 2007.
Selama menjadi mahasiswi penulis aktif di beberapa lembaga kemahasiswaan, diantaranya menjadi sekertaris divisi Media Islami DKM An-Nahl pada tahun 2009, staf KAMMI komisariat IPB pada tahun 2008-2009, Bendahara umum Dewan Perwakilan Mahasiswa (DPM) FKH IPB pada tahun 2009-2010, dan Sekertaris umum Badan Eksekutif Mahasiswa (BEM) FKH IPB pada tahun 2010-2011. Selain itu, penulis juga pernah menjadi asisten mata kuliah Pendidikan Agama Islam pada tahun 2011-2012 dan penulis pernah menjadi delegasi IPB untuk mengikuti ADIC (Aceh Development Internasional Converence) 2011 di Malaysia pada tahun 2011.