ABSTRACT
Agarwood is one of the valuable Non Timber Forest Products (NTFPs) that contain resin with a specific fragrance, and is often used as raw materials of perfumes, pharmaceuticals, cosmetics, incense, preservatives as well as religious activities. Overexploitation of agarwoodhas resulted in scarcity of agarwood in the nature leading to the lossesof treesof superior genotypes. This scarcity has led agarwoodto be included into the CITES Appendix II list in which a quota system is imposed for trading activities. However, this quota still does not distinguish clearly between natural or cultivatedagarwood, opening opportunities for illegal trading practices. It is therefore necessary to provide an effective attemptsto control of the origin of. Nowdayas, the use of DNA markers gains significant importance in the forensic activities such as verification of the origin of timber and plant materials. This tool is difficult to be manipulated. Therefore, a study was carried with aims to 1) cross amplify
Aquilariacrassna microsatellite primers into other agarwood species (transferability study), and 2) to infer the origin of agarwoodbeing traded in the market. Materials for research were populations of agarwood from natural and planted forests and agarwood pieces of unknown origin. A.crassna microsatellite primers were used, namely 6pa18 (180-210 bp), 10pa17 (152-156 bp), 16pa17 (143-155 bp), and 71pa17 (152-224 bp). Results showed thatagarwood samples from both natural forests and plantations could cross amplify with expected fragment size ranges.Resultshowedthatgenetic diversity (He)
in the planted forest was 0.5443 a slighty higher than that of natural forest (He=0.4642).
Information on the level of genetic diversities can be used as scientific basis for conservation program. Cluster analysis showed different groupings of agarwood originated from plantations and natural forests. Futher analysis showed that agarwoodtimbers with unclear origins clustered intoagarwoodgroupd from natural forests indicatingcommon existence of traded natural agarwood.
Keywords: agarwood, cross amplification, microsatellite, CITES, genetic diversity.
1
BAB I
PENDAHULUAN
1.1 Latar Belakang
Gaharu merupakan salah satu Hasil Hutan Bukan Kayu (HHBK) yang
memiliki kandungan damar wangi, berasal dari pohon atau bagian pohon
penghasil gaharu, sebagai akibat dari proses infeksi yang terjadi secara alami atau
buatan pada pohon gaharu.Adanya kandungan damar yang wangi dalam gaharu
ini, gaharu sering digunakan sebagai bahan baku industri parfum, obat-obatan,
kosmetik, dupa, pengawet, serta untuk keperluan kegiatan agama.
Gaharu dikenal berasal dari marga tumbuhan Aquilaria dan
Gyrinops.Menurut Soehartono dan Mardiastuti (2003) saat ini di Indonesia
diketahui terdapat 6 jenis Aquilaria yang dapat menghasilkan gaharu, yaitu
A.beccariana, A. filaria, A. hirta, A. malaccensis,A.cumingiana, dan A.
microcarpa.
Perdagangan gaharu di Indonesia tercatat telah dimulai sejak abad
ke-5.Cina merupakan pembeli terbesar untuk produk-produk gaharu.Perdagangan
gaharu berlanjut pada masa pemerintahan Belanda (dari abad ke-18 sampai
permulaan abad ke-19) dan berlangsung hingga sekarang (Soehartono dan
Mardiastuti 2003).
Eksploitasi gaharu yang disertai pembalakan hutan mengakibatkan
kelangkaan pohon gaharu dan hilangnya pohon (genotipe) unggul. Akibat
kelangkaan tersebut menurut Balitbanghut (2006) semua jenis Aquilaria, dan
Gyrinops ditempatkan pada CITES Apendiks II (Lampiran I),konsekuensinya
yaitupenjualan ekspor dan impor gaharu ditentukan kuota dan harus mendapat izin
dari CITES. Akan tetapi, kuota ini tidak membedakan gaharu alam atau budidaya
sehingga mendorong praktek penebangan liar.Oleh karena itu, perlu dilakukan
usaha pengendalian asal-usul kayu gaharu agar tetap terjaga kelestariannya.Hal ini
meningkatkanpengendalian perdagangan gaharu komersial di semua negara yang
berpartisipasi.
Pengendalian perdagangan internasionaldenganmetode deteksi tradisional
seperti cahaya mikroskop, gagal untuk membedakan antara gaharu legal dan
gaharu dari hutan alam dan hutan tanaman serta kepentingan pengendalian
perdagangan gaharu internasional diperlukan metode identifikasi alternatif yang
dapat diandalkan dan sulit dimanipulasi, misalnya dengan marka DNA.
1.2Tujuan
Tujuan dari penelitian ini adalah :
1. Melakukan amplifikasi silang penanda mikrosatelit dari jenis Aquilaria crassna
ke jenis gaharu lainnya
2. Menduga asal usul kayu gaharu yang saat ini diperdagangkan di pasaran.
1.3Manfaat Penelitian
Hasil dari penelitian ini diharapkan dapat memberikan informasi dasar
tentang kelayakan metode DNA untuk menduga asal-usul kayu dan jenis-jenis
gaharu yang diperdagangkan sehingga dapat digunakan untuk pengendalian
3
BAB II
TINJAUAN PUSTAKA
2.1 Deskripsi Singkat Gaharu
Soehartono dan Mardiastuti (2003) menyatakan bahwa gaharu merupakan
nama perdagangan untuk kayu yang berasal dari pohon margaAquilaria (sebagian
besar berasal dari A.malaccensis). Pohon-pohon tersebut seringkali terkena infeksi
oleh parasit yang berupa jamur dan mulai menghasilkan resin yang harum dan
bewarna gelap di bagian kayu teras. Kayu yang mengandung resin ini dikenal
dengan nama gaharu. Di pasar internasional, gaharu dikenal dengan
namaagarwood, aloeswood atau oudh.
Aswoko (2009) menjelaskan bahwa gaharu adalah sejenis kayu dengan
berbagai bentuk dan warna yang khas, memiliki kandungan damar wangi, berasal
dari pohon atau bagian pohon penghasil gaharu, sebagai akibat dari proses infeksi
yang terjadi secara alami atau buatan pada pohon Aquilaria sp. (Thymelaeaceae).
Kerajaan : Plantae
Ordo : Malvales
Famili : Thymelaeaceae
Genus : Aquilaria
Secara morfologi, tinggi pohon gaharu dapat mencapai 40 meter dengan
diameter batang mencapai 60 cm. Kulit batang licin, berwarna putih atau
keputih-putihan, dan kadang beralur. Bentuk daunnya lonjong agak memanjang dengan
ukuran 5 – 8 cm, lebar 3 – 4 cm, berujung runcing, dan berwarna hijau mengkilap
(Sumarna2002 dalam Aswin 2007).Adapun morfologi pohon gaharu disajikan
pada Gambar 1.
Gambar 1 Morfologi pohon gaharu (Adinugroho 2010)
Produksi gubal gaharu memerlukan pohon gaharu dan mikroba untuk
reaksi pertahanan pohon terhadap infeksi patogen melalui pelukaan pada batang,
cabang, atau ranting atau pengaruh fisik lainnya. Infeksi patogen mengakibatkan
keluarnya resin yang terdeposit pada jaringan kayu. Lama kelamaan jaringan kayu
ini akan mengeras dan berubah warnanya menjadi coklat sampai kehitaman,
bagian ini menjadi berat dan berbau wangi (Hou 1960 dalam Aswin 2007).
Penyebaran gaharu dimulai dari Iran, India, Vietnam, Malaysia, Sumatera,
Kalimantan, Serawak dan Filipina. Di Indonesia daerah penyebaran gaharu antara
lain terdapat di kawasan Sumatera, Kalimantan, Sulawesi, Maluku, Papua, Nusa
Tenggara, dan Jawa. Secara ekologis jenis-jenis gaharu di Indonesia tumbuh pada
daerah dengan ketinggian 0 – 2400 meter di atas permukaan laut. Gaharu yang
berkualitas baik umumnya tumbuh pada daerah yang beriklim panas dengan suhu
28–34ºC, kelembaban 60 – 80%, dan curah hujan 1000 – 2000 mm/tahun
(Sumarna 2002 dalam Aswin 2007).
Meningkatnya perdagangan gaharu telah mengakibatkan populasi gaharu
di Indonesia mendekati kepunahan. Hal tersebut memicu upaya melestarikan
Aquilaria di alam, antara lain dengan memasukkan A.malaccensiske dalam
Apendiks II CITES(CITES 1994 dalam Soehartono dan Maardiastuti 2003).James
et al. (1994) menjelaskan penetapan tersebut disebabkan oleh populasi tanaman
penghasil gaharu semakin menyusut di alam karena para pengusaha gaharu tidak
dapat mengenali dengan tepat tanaman yang sudah mengandung gaharu dan siap
dipanen.
2.2 CITES
CITES (Convention on International Trade in Endangered Species of Wild
Fauna and Flora) atau konvensi perdagangan internasional tumbuhan dan satwa
liar spesies terancam merupakan perjanjian internasional antarnegara yang
disusun berdasarkan resolusi sidang anggota World Conservation Union (IUCN)
tahun 1963. Konvensi ini bertujuan melindungi tumbuhan dan satwa liar terhadap
perdagangan internasional spesimen tumbuhan dan satwa liar yang
mengakibatkan kelestarian spesies tersebut terancam(Anonim 2010a).
Jenis-jenis satwa dan tumbuhan yang berada dalam pengawasan CITES
dikelompokkan dalam tiga kelompok yang dinamakan Apendiks.Tiga apendiks
5
tumbuhan dan satwa liar yang dilarang dalam segala bentuk perdagangan
internasional. Apendiks I sedikitnya berisi 800 spesies seperti macan tutul, gajah
sumatera, harimau sumatera, dan semua spesies badak termasuk badak jawa dan
badak sumatera,Apendiks II; daftar spesies yang tidak terancam kepunahan, tapi
mungkin terancam punah bila perdagangan terus berlanjut tanpa adanya
pengaturan. Apendiks II berisi sekitar 32.500 spesies.Apendiks III; daftar spesies
tumbuhan dan satwa liar yang dilindungi di negara tertentu dalam batas-batas
kawasan habitatnya, dan suatu saat peringkatnya bisa dinaikkan ke dalam
Apendiks II atau Apendiks I. Dalam apendiks III berisi sekitar 300 spesies.
CITES merupakan satu-satunya perjanjian global dengan fokus
perlindungan spesies tumbuhan dan satwa liar. Keikutsertaan bersifat sukarela dan
negara-negara yang terikat dengan konvensi disebut para pihak (parties).
Walaupun CITES mengikat para pihak secara hukum, CITES bukan pengganti
hukum di masing-masing negara. Pada tahun 2002 hanya terdapat 50% para pihak
yang bisa memenuhi satu atau lebih persyaratan dari 4 persyaratan utama yang
harus dipenuhi: (1) keberadaan otoritas pengelola nasional dan otoritas keilmuan,
(2) hukum yang melarang perdagangan tumbuhan dan satwa liar yang dilindungi
CITES, (3) sanksi hukum bagi pelaku perdagangan, dan (4) hukum untuk
penyitaan barang bukti (Anonim 2010a).
Indonesia tergabung dalam CITES pada tanggal 28 Desember 1978 dan
konvensi ini secara resmi mulai diberlakukan sejak tanggal 28 maret 1979 melalui
Keputusan Presiden No. 43/1978 tanggal 15 Desember 1978. Indonesia
merupakan Negara ke-48 yang tergabung dalam CITES. Selama menjadi anggota
Konvensi, Indonesia secara aktif telah memberikan masukan terhadap
perubahan-perubahan peraturan di dalam Konvensi tersebut (Soehartono dan Mardiastuti
2003).
2.3 Deoksiribonukleat Acid (DNA)
DNA merupakan persenyawaan kimia yang paling penting pada makhluk
hidup, yang membawa keterangan genetik dari sel khususnya atau dari makhluk
hidup dalam keseluruhannya dari satu generasi ke generasi berikutnya. Semua
makhluk hidup kecuali beberapa virus mempunyai DNA. Di dalam sel, bagian
DNA juga ditemukan di dalam mitokondria, plastid, dan sentriol. Menurut studi
dari foto sinar-X oleh Rosalind Franklin dikemukakan bahwa molekul DNA
mempunyai struktur seperti spiral. Berdasarkan foto yang diambil oleh Franklin
tersebut, Watson dan Crick dalam bulan April 1953 mengambil kesimpulan
bahwa (Suryo 2008) :
a) Deretan polinukleotida DNA mempunyai bentuk sebagai spiral teratur
b) Spiral itu mempunyai diameter kira-kira 20 Amstrong, dan lebar spiral tersebut
tetap
c) Mengingat bahwa molekul DNA sangat padat, maka spiral DNA terdiri dari
dua buah spiral yang mengandung dua deretan polinukleotida
Suryo (2008) menjelaskan baha dua buah pita polinukleotida yang
berbentuk double helix dalam molekul DNAdihubungkan oleh atom H yang
sangat lunak. Jika suatu larutan yang mengandung DNA dipanaskan atau dibubuhi
alkali yang kuat, maka ikatanhydrogen itu menjadi lebih labil dan putus. Dua pita
spiral dari molekul DNA akan membuka, proses ini dinamakan denaturasi DNA.
Jika larutan tersebut kemudian didinginkan kembali atau dinetralisir secara
perlahan-lahan, maka terbentuklah pasangan-pasangan basa itu kembali. Peristiwa
ini dinamakan renaturasi.
2.4 Keragaman Genetik
Finkeldey (2005)menyatakan bahwa keragaman genetik merupakan
perbedaan gen yang terkandung dalam individu suatu populasi dan berhubungan
dengan kemampuan beradaptasi suatu individu dalam mengalami perubahan
selama proses perkembangan. Keragaman genetik dapat diwariskan kepada
keturunannya dan terjadi karena adanya rekombinasi genetik sebagai akibat
adanya persilangan-persilangan dan adanya mutasi.
Jenis-jenis pohon memperlihatkan keragaman dalam sifat-sifatnya.Dalam
suatu jenis pohon dapat dijumpai beberapa keragaman yaitu keragaman geografis
(antar provenansi), keragaman lokal (antar tempat tumbuh), keragaman antar
pohon, dan keragaman dalam pohon.Ada dua sebab utama yang menimbulkan
keragaman, yaitu perbedaan lingkungan dan perbedaan struktur genetik.
Keragaman genetik dari suatu keturunan merupakan hasil dari perkembangbiakan
7
Penanda genetik merupakan alat yang sangat penting untuk mempelajari
sistem genetika pohon hutan. Beberapa manfaat penting dari penanda genetik
adalah sebagai alat pembantu dalam identifikasi klon, identifikasi hibrid,
pengukuran variasi genetik di dalam dan antar populasi, penelitian sistem
reproduksi yang mencakup sistem perkawinan dan aliran gen, pembuktian
pengaruh seleksi dan identifikasi QTL (Quantitative Trait Loci). Terdapat banyak
jenis penanda genetik yang telah diidentifikasi. Beberapa penanda genetik yang
banyak digunakan dalam genetika hutan, yaitu polimorfisme morfologi,
sifat-sifatwarna, produksi metabolisme sekunder, isoenzim, dan penanda DNA
(Finkeldey 2005).
Penanda (marka) dapat digolongkan atas tiga, yaitu marka morfologis,
marka sitologi, dan marka molekuler. Penanda morfologi adalah penanda yang
berdasarkan bentukorgan-organ tanaman yang mudah diamati.Penanda morfologi
digunakan dalamdeskripsi taksonomi karena lebih mudah, lebih cepat, sederhana,
dan lebih murah.Akan tetapi, penanda ini dapat dimodifikasi oleh lingkungan
sehingga dianggaptidak stabil (Wulandari 2008).Penanda ini mudah dilihat oleh
mata dan telah banyak digunakan sejak awal genetika.Contohnya adalah warna,
rambut daun, serta ukuran atau bentuk organ tertentu. Walaupun mudah dan
masih dipakai (biasanya digunakan untuk mengontrol berhasilnya suatu
persilangan), penanda morfologi dapat dimodifikasi oleh pengaruh lingkungan
sehingga dianggap tidak stabil (Aritonang et al. 2007).
Menurut Asiedu (1989) dalam Aritonanget al. (2007), penanda sitologi
adalah penanda yang digunakan untuk membantu pemuliaan tanaman melalui
ukuran kromosom, rasio tangan kromosom dan pola pita teknik-teknik pewarnaan
kromosom.Penggunaan penanda sitologi khususnya pola pita kromosom
dimungkinkan pada spesies-spesies tanaman yang mempunyai kromosom dengan
ukuran yang lebihbesar, misalnya pada tanaman gandum.
Aritonang et al. (2007) menjelaskan bahwa penanda molekuler adalah
penanda yang dihasilkan dari DNA atau RNA jadi penanda biokimia, yang
sebenarnya juga molekul, tidak termasuk didalamnya. Penanda molekuler bersifat
9
Surahman (2007) menjelaskan bahwa proses PCR pada prinsipnya
melibatkan tiga langkah yang diulangi dalam beberapa siklus, yaitu :
1) Denaturasi termal dengan meningkatkan suhu pada tabung reaksi
2) Primer Anneling, yaitu tahap dimana primer akan berpasangan dengan sekuen
DNA cetakan (template) yang sudah dalam bentuk ss-DNA pada suhu 35-60oC
3) Ekstensi Primer, pada tahap ini suhu ditingkatkan kembali sampai 75oC yang
merupakan suhu optimum untuk kerja tag DNA polymerase yangakan memulai
reaksi pada ujung 3’-hidroksil dari primer.
Finkeldey (2005) menjelaskan bahwa sekuensi pendek berulang
non-kodon asam amino yang biasanya terdiri atas 3 pasang dapat ditemukan pada
DNA dari kebanyakan hewan dan tumbuhan. Sekuensi seperti itu biasanya
memiliki polimorfisme yang tinggi, dalam arti bahwa banyak tipe berbeda dapat
diamati dalam populasi. Polimorfisme seperti itu dapat dipelajari menggunakan
metoda PCR bila dapat ditentukan secara khusus primer-primer yang cocok
dengan daerah sasaran.
2.6 Mikrosatelit
Boer (2007) menjelaskan DNA mikrosatelit merupakan rangkaian pola
nukleotida antara dua sampaienam pasang basa yang berulang secara berurutan.
DNA mikrosatelit biasadigunakan sebagai penanda genetik untuk menguji
kemurnian galur, studifilogenetik, lokus pengendali sifat kuantitatif dan
forensik.DNA mikrosatelit diamplifikasi menggunakan teknik
PCRdenganbeberapa pasang primer mikrosatelit. DNA produk PCRdideteksi
menggunakanteknik elektroforesis gel poliakrilamida (PAGE) yang dilanjutkan
denganpewarnaan perak.
Mikrosatelit juga dikenal dengan simple sequence repeats (SSRs) yaitu
kelas terkecil dari sekuen berulang. Sekuen yang berulang sering sederhana,
terdiri dari dua, tiga atau empat nukleotida (di-, tri-, dan tetranukleotida berulang).
Salah satu contoh umum mikrosatelit adalah dinukleotida berulang (CA)n, dimana
n menunjukkan jumlah total nukleotida berulang/repeats yang berada pada
kisaran 10 dan 100(Nasoetion 2004).
Finkeldey (2005) menjelaskan bahwa mikrosatelit telah diidentifikasi pada
DNA plastid (DNAcp dan DNAmt) dan juga pada DNA inti. Mikrosatelit
dan sistem perkawinan dari suatu jenis, karena mikrosatelit sering menunjukkan
variasi yang luas. Identifikasi dan karakterisasi lokus gen mikrosatelit
membutuhkan waktu yang sangat lama. Meskipun demikian, banyak penelitian
yang menggunakan lokus mikrosatelit, misalnya Eucalyptus spp, Shorea spp, dan
Dipterocarpus lainnya, dan juga pada Swietenia bumilis, serta Meliaceae jenis
11
BAB III
METODE PENELITIAN
3.1 Tempat dan Waktu
Penelitiandilaksanakan di Laboratoriumbagian Silvikultur, Departemen
Silvikultur Fakultas Kehutanan Institut Pertanian Bogor. Waktu penelitian ini
yaitu pada bulan Agustus 2010 – Agustus 2011.
3.2 Alat dan Bahan
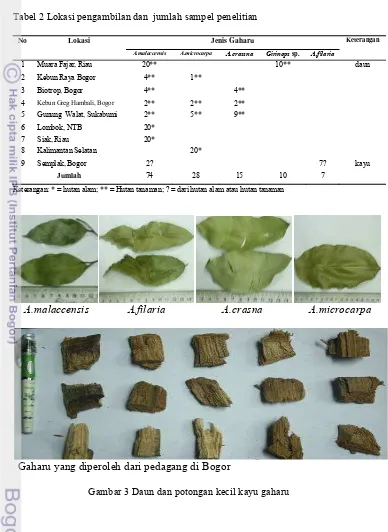
Bahan tanaman yang digunakan dalam penelitian ini yaitu daun dan potongan
kecil kayu gaharu (Gambar 3). Alat yang digunakan dalam penelitian ini terdiri
dari peralatanuntukekstraksiatau isolasi DNA, PCR, elektroforesis,
mikrosetelit,pewarnaan gel dan pengolahan data.Primer yang digunakan untuk
kegiatan teknik mikrosatelit pada penelitian ini terdiri atasempat primer spesifik
untuk nuklear (Eurlings et al. 2009).Primer tersebut digunakan Eurlings untuk
mengamplifikasi gaharu dari jenis A.crassna.Keempat primer tersebut adalah
6pa18, 10pa17,16pa17, dan 71pa17.Deskripsi alat dan bahan serta sampel
penelitian yang digunakan dalam penelitian disajikan pada Tabel 1 dan 2.Adapun
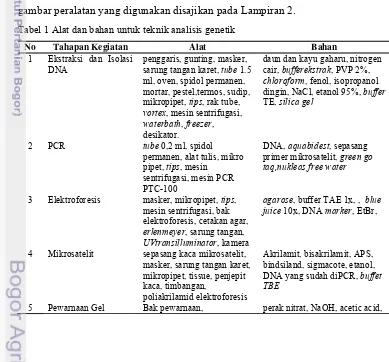
gambar peralatan yang digunakan disajikan pada Lampiran 2.
Tabel 1 Alat dan bahan untuk teknik analisis genetik
No Tahapan Kegiatan Alat Bahan
1 Ekstraksi dan Isolasi DNA
penggaris, gunting, masker, sarung tangan karet, tube 1.5 ml, oven, spidol permanen, mortar, pestel,termos, sudip, mikropipet, tips, rak tube, vortex, mesin sentrifugasi, waterbath, freezer, desikator.
daun dan kayu gaharu, nitrogen cair, bufferekstrak, PVP 2%, chloroform, fenol, isopropanol dingin, NaCl, etanol 95%, buffer TE, silica gel
2 PCR tube 0,2 ml, spidol permanen, alat tulis, mikro pipet, tips, mesin
sentrifugasi, mesin PCR PTC-100
DNA, aquabidest, sepasang primer mikrosatelit, green go taq,nukleas free water
3 Elektroforesis masker, mikropipet, tips, mesin sentrifugasi, bak elektroforesis, cetakan agar, erlenmeyer, sarung tangan, UVtransilluminator, kamera
agarose, buffer TAE 1x, , blue juice 10x, DNA marker, EtBr,
4 Mikrosatelit sepasang kaca mikrosatelit, masker, sarung tangan karet, mikropipet, tissue, penjepit kaca, timbangan,
poliakrilamid elektroforesis
Akrilamit, bisakrilamit, APS, bindsiland, sigmacote, etanol, DNA yang sudah diPCR, buffet TBE
No Tahapan Kegiatan Alat Bahan
shaker,masker, sarung tangan, kamera
etanol 95%, aquades, formaldehyde 6 Analisis Data Foto mikrosatelit, notebook,
softwere POPGENE versi 1.31, NTSYS versi 2.0., dan Minitab versi 14
Tabel 2 Lokasi pengambilan dan jumlah sampel penelitian
No Lokasi Jenis Gaharu Keterangan
A.malaccensis A.microcarpa A.crassna Girinops sp. A.filaria
1 Muara Fajar, Riau 20** 10** daun
2 Kebun Raya Bogor 4** 1**
3 Biotrop, Bogor 4** 4**
4 Kebun Greg Hambali, Bogor 2** 2** 2**
5 Gunung Walat, Sukabumi 2** 5** 9**
6 Lombok, NTB 20*
7 Siak, Riau 20*
8 Kalimantan Selatan 20*
9 Semplak, Bogor 2? 7? kayu
Jumlah 74 28 15 10 7
Keterangan: * = hutan alam; ** = Hutan tanaman; ? = dari hutan alam atau hutan tanaman
A.malaccensis A.filaria A.crasna A.microcarpa
Gaharu yang diperoleh dari pedagang di Bogor
13
3.3 Prosedur Penelitian
Tahapan penelitian mengikuti alur seperti pada Gambar 4.
Gambar 4 BaganAlur Penelitian
3.3.1 Pengambilan Sampel Daun
Sampel pada penelitian ini yaitu daun dan kayu dari pohon gaharu.Sampel
daun gaharu diambil dari hutan alam dan hutan tanaman.Sampel dari hutan alam
diambil dari Propinsi Riau, Kabupaten Lombok, dan Propinsi Kalimantan
Selatan.Sedangkan sampel kayu diambil dari toko kayu gaharu Semplak, Bogor,
Jawa Barat.
3.3.2 Ekstraksi DNA
Ekstraksi DNA dari daun dan kayugaharudilakukan dengan menggunakan
metode CTAB (Cetyl Trimethyl Ammonium Bromide). Sampel daun 2 x 2 cm
digerus dengan menggunakan nitrogen cair di dalam pestel yang bersih,
sedangkan pada sampel kayu dibor untuk mendapatkan serbuk kayu. Hasil
gerusan daun dan serbuk kayu selanjutnya dipindahkan ke dalam tube 1,5 ml, lalu
ditambahkan 500µl larutan buffer ekstrak (Tris-HCl, EDTA, NaCl, CTAB,
aquades, dll) dan 100 µl PVP 1%. Fungsi buffer ekstrak dan PVP adalah
mempercepat proses penghancuran.
Tahapan selanjutnya dilakukan proses inkubasi di dalam waterbath selama
1 jam pada suhu 65oC-70oC. Selama inkubasi setiap 15 menit diangkat dan Pemilihan Populasi Hutan Alam dan
Tanaman Gaharu untuk Penelitian
Pengambilan Sampel
Amplifikasi Silang
(Ekstraksi atau Isolasi DNA, Elektroforesis, PCR, Mikrosatelit dan Pewarnaan Gel)
Analisis Keragaman Genetik Gaharu Hutan Alam dan Tanaman
dikocok. Jika proses inkubasi telah selesai maka tube diangkat dan didinginkan
kurang lebih 15 menit. Untuk mengikat DNA ditambahkan kloroform 500 µl,
selanjutnya campuran tersebut dikocok agar menjadi homogen dan disentrifuse
pada kecepatan 10.000 rpm selama 10 menit. Proses sentrifugasi dilakukan untuk
memisahkan bahan-bahan kimia atau fase organik dari fase air berupa supernatan.
Langkah selanjutnya yaitu fase air dipisahkan dari fase organik dengan
menggunakan mikro pipet kemudian fase air dipindahkan ke dalam tube baru.
Kegiatan selanjutnya adalah penambahan isopropanol dingin 500 µl dan
NaCl 300 µl, lalu disimpan dalam freezer selama 45 menit sampai 1 jam. Hasil
pengendapan disentrifugasi pada kecepatan 10.000 rpm selama 10 menit dan
cairan dalam tube dibuang. Kegiatan selanjutnya adalah proses pencucian DNA
dengan menambahkan etanol 95% sebanyak 300 mikroliter, lalu disentrifugasi
pada kecepatan 10.000 rpm selama 10 menit dan cairan dalam tube dibuang
kembali dan dilakukan secara hati-hati. Proses tersebut dilakukan 2 kali. Pellet
DNA yang ada di tube dikeringkan dengan cara disimpan di dalam desikator
secara terbalik agar silicagel di dalam desikator dapat menyerap cairan yang ada
dalam tube selama ± 15 menit.
3.3.3 Elektroforesis
Selama proses pengeringan pellet DNA, disiapkan agarose 1% (0,33 gram
agarose dalam 33 ml TAE). Untuk proses elektroforesis, ditambahkan TE 50 μl
pada pellet DNA lalu sentrifugasi, diambil 3 μl DNA ditambahkan 2 μl BJ (Blue
Juice) 10 X dan running/elektroforesis selama kurang lebih 30 menit. Hasil
elektroforesis kemudian direndam dalam larutan Etidium Bromida (EtBr) 10 μl
per 200 ml aquades selama 15 menit dan selanjutnya difoto pada UV
transiluminator.
3.3.4 PCR (Polymerase Chain Reaction) Mikrosatelit
Sebelum melakukan amplifikasi PCR, DNA hasil ekstraksi diencerkan
dengan aquabidest. Perbandingan antara DNA dan aquabidest tergantung dari
resolusi pita DNA genomik dari hasil ekstraksi, misalnya pengenceran 100x
artinya 99 μl aquabides dan 1 μl DNA hasil ekstraksi. Primer yang digunakan
15
Tabel 3 Primer mikrosatelit Eurlings et al. (2009)
Locus Primer sequence (50–30) Repeat Size range
(bp)
Number of alleles
TA (OC)
6pa18 F: TGAGGCGTGAGTGAGATATTGATT R: CCTTCCTCTCTTCTTACCTCACCA
(CA)8 180–210 7 50
10pa17 F: ACACACTGTTATGGTCTACAGCTT R: CGCCATCTCATAATATTCTAATGTA
(CA)12 152–156 3 50
16pa17 F: AGTGAACAACTTGACTAGGCTTG R: GCTGAACACAACAAGATATCACC
(CA)19 143–155 6 59
71pa17 F: AGCAAACAGTGGGATAAGGTC R: AGAAAGGAGGCGAAACGAAT
(CA)15 152–224 15 54
Komposisi bahan untuk reaksi PCR mikrosatelit terdiri atas Nukleas free
water, Green go taq, primer forward dan reverse, DNA isolasi. Reaksi PCR
mikrosatelit tersebut dilakukan dengan menggunakan mesin PTC-100
Progammable Thermal Cycler (MJ Research, Massachussetts, USA). Komposisi
bahan untuk reaksi PCR Mikrosatelit dapat dilihat pada Tabel 4.
Tabel 4 Komponen Bahan yang Digunakan dalam Reaksi PCR.
No. Nama Bahan 1 Sampel Reaksi X Sampel Reaksi 1. Nucleas free water 2,5 μl X x 2,5 μl
2. Green Go Taq 7,5 μl X x 7,5 μl
3. Primer 1,5 μl X x 1,5 μl
4. Cetakan DNA 2 μl X x 2μl
3.3.5 Pembuatan Gel Poliakrilamid 3.3.5.1 Persiapan plate kaca pendek
Langkah awal adalah membersihkanplate hingga bersih menggunakan tissue
dan ethanol 95%, kemudian meneteskan 50 µl SigmaCote pada plate
menggunakan pipet mikro. Untuk meratakan SigmaCote pada seluruh permukaan
plate disapu menggunakan tissue, penyapuandilakukan secara merata untuk
memastikan permukaan kaca telah terolesi SigmaCote. Kemudian bilas kelebihan
SigmaCote dengan cara mencuci plate menggunakan ethanol 95% dan
tissue.Karena sisa-sisa SigmaCotebisa menyebabkan penghambatan ketika
pewarnaan
3.3.5.2 Persiapan plate kaca panjang
Langkah awal adalah membersihkanplate hingga bersih menggunakan tissue
dan ethanol 95%, kemudian meneteskan 50 µlBind Silanc pada plate
permukaan plate digunakan tissue. Menyapu kaca secara merata untuk
memastikan permukaan kaca telah terolesi Bind Silanc.
3.3.5.3Perakitan lapisan plate kaca
Plate kaca panjang dan pendek yang telah siap dirakit dengan bagian yang
dilapisi oleh SigmaCote dan BindSiland diletakkan di dalam rakitan, seperti yang
tertera pada gambar5.
Gambar5Contoh perakitan kaca poliakrilamid
3.3.5.4Pembuatan larutan poliakrilamida
Pembuatan satu kaca gel akrilamit diperlukan bahan sesuai yang tertera
pada tabel 5.
Tabel 5Komposisi pembuatan gel Poliakrilamid
Bahan 6% 8%
Akrilamid 5,7 gram 7,6 gram
Bisakrilamid 0,3 gram 0,4 gram
TBE (1x) 10 ml 10 ml
TEMED 50 µl 50 µl
APS 500 µl 500 µl
Aquades 60 ml 60 ml
Akrilamid, bisakrilamid, TBE (1x), dan aquades dicampur dalam
erlenmeyer dan distirrel selama 15 menit, kemudian pada menit ke-10
dimasukkan temed. Pada menit ke 14 dimasukkan APS, dan pada menit ke-15
memasukkan larutan ke dalam pasangan kaca yang sudah dipersiapkan, kemudian
menunggu sampai larutan memadat.
3.3.6 Loading Sampel
Kegiatan elektroforesis dilakukan pada 350 V, 40mA, 80 W selama 75
menit. Buffer untuk running (TBE 1x) mengandung 18mM Triz-HCl, 8.9 mM
asam borat dan 2 mM Na2EDTA.
17
Pewarnaan dilakukan setelah kegiatan elektroforesis selesai. Pewarnaan ini
terdiri dari empat bak perendaman, secara berurutan bak satu sampai dengan
empat tertera pada tabel 6.
Tabel 6 Bahan pewarnaan DNA mikrosatelit
Bak Bahan larutan pewarna Lama perendaman
1 bilas ke bak 2 selama 10 detik Silbernitrat 0,5 gram
Formaldehyde 0,6 ml
4
Aquades 500 ml
Sampai terlihat pita DNA NaOH 7,5 gram
Formaldehyde 1 ml
3.4 Analisis Data
Hasil dari kegiatan analisis mikrosatelit pada daun dan kayu gaharu difoto
dan dianalisis dengan melakukan skoring pola pita yang muncul (Gambar 6).
Hasil interpretasi foto kemudian dianalisis dengan menggunakan software
POPGENE 32 versi 1.31 (Yeh, 1999) dan NTSys Ver 2.0 (Rohlf, 2008). Selain
itu, digunakan juga Minitab versi 14 untuk memastikan besarnya panjang fragmen
(bp) dari DNA hasil amplifikasi.
Gambar 6 Cara skoring DNA mikrosatelit
Hartati (2007) menjelaskan bahwa POPGEN versi 1.32 digunakan untuk
menghitung distribusi keragaman genetik dan jarak genetik berdasarkan frekuensi
asumsi Hardy-Weinberg (HW). Jarak genetik digunakan untuk analisis gerombol
menggunakan metode UPGMA (unweighted pair group with arithmatic avarage)
pada Ntsys yang menghasilkan dendogram hubungan kekerabatan.
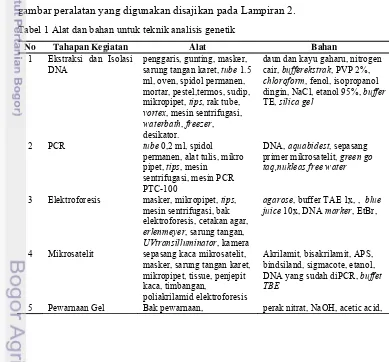
Hasil analisis dengan software Minitab versi 14 didapatkan persamaan
hubungan antara panjang pita DNA hasil amplifikasi pada foto dengan panjang
fragmen. Hasil perhitungan dengan persamaan dari Minitab versi 14 disajikan
pada Tabel 7,sedangkan grafik hubungan antara panjang foto mikrosatelit dan
bahwa rentang panjang DNA teramplifikasi pada bp yang hampir sama dengan
bp penelitian Eurling et al. (2009). Penggunaan persamaan bp dimaksudkan untuk
memastikan pita DNA mikrosatelit yang diskoring berada pada posisi yang benar.
Tabel 7 Hasil pendugaan panjang DNA hasil amplifikasi Jenis bp : panjang fragmen
19
BAB IV
HASIL DAN PEMBAHASAN
4.1Amplifikasi Silang Penanda Mikrosatelit
Penggunaan primer-primer mikrosatelit jenis A.crassna (6pa18,
10pa17,16pa17, dan 71pa17)dapat mengamplifikasi silang pada gaharu jenis
lainnya (sampel penelitian :A.malaccensis, A.microcarpa, A.crassna, Gyrinops sp
dan A.filaria). Hasil amplifikasi silang mikrosatelit disajikan pada Gambar
8.Berdasarkan gambar tersebut dapat dilihat bahwa hasil amplifikasi silang
menunjukkan panjang fragmen yang berbeda-beda sesuai Eurlings et al. (2009).
Gambar 8 Hasil amplifikasi silang mikrosatelit
Amplifikasi silang penanda mikrosatelit dari gaharu jenis A.crassna berhasil
dilakukan dengan kisaran panjang fragmen (bp) yang diharapkan.Syarat utama
terjadinya amplifikasi DNA dengan satu jenis primer adalah apabila primer
tersebut mempunyai urutan basa nukleotida yang merupakan komplemen dari
kedua untai cetak DNA pada posisi yang berlawanan (Hartati et al.2007).Adapun komposisi lokus polimorfik disajikan dalam Tabel 8 dan 9.
Tabel 8 Komposisi lokus polimorfik untuk masing-masing primer
Primer Panjang fragmen (bp) Keterangan Size range (bp) 6pa18 A158, A164, A180, A186, A196 Polimorfik 180–210
10pa17 A152, A153, A154 Polimorfik 152–156
16pa17 A143, A145, A147 Polimorfik 143–155
71pa17 A158, A186, A206, A210, A216, A224 Polimorfik 152–224 Tabel 9Panjang fragmen hasil amplifikasi silang tiap jenis gaharu
Allele (bp)
- = ada dalam A.crassna (Eurlings et al. 2009), tidak ada dalam penelitian Φ = tidak ada dalam A.crassna (Eurlings et al. 2009), ada dalam penelitian √ =ada dalam A.crassna (Eurlings et al. 2009) dan penelitian
Tabel 8memperlihatkan bahwa hasil amplifikasi silang berada pada kisaran
panjang fragmen (bp) yang diharapkan.Berdasarkan Tabel 8 tersebut penulisan
alel didasarkan pada panjang panjang fragmen, misalnya untuk A. malacensis
alelnya dapat ditulis A143, A145, A153, A164, dan A186, begitu juga dengan jenis yang
lainnya. Pada Tabel 8 juga dapat dilihat adanya shared alelle, yaitu alel yang
ditemukan pada beberapa jenis gaharu yang diteliti. Fragmen ini dapat ditemui
pada base pair 143, 145, 153,158, 164, 180, 186, dan 216.Selanjutnya hasil
scoring genotype dari populasi yang diteliti berdasarkan jenis secara lengkap
disajikan pada Lampiran 3 sampai 10.
4.2Keragaman Genetik dalam Populasi Gaharu
Secara umum variasi genetik dapat diukur dengan dua parameter, yaitu
dalam populasi dan antar populasi. Peubah yang digunakan untuk mencirikan
variasi genetik dalam populasi yaitu Presentase Lokus Polimorfik (PLP), dan
rata-rata jumlah alel per lokus (A/L), dan variasi genetik (He) (Finkeldey 2005). Hasil
analisis mikrosatelit pada daun dan kayu gaharu disajikan pada Tabel 10.Adapun
hasil analisis dari PopGene disajikan pada Lampiran 11.
Tabel 10 Variasi genetik dalam populasi gaharu alam dan tanaman
No Populasi N PLP
N = Jumlah total individu; PLP = Persentase Lokus Polimorfik; Na = Jumah alel yang diamati; Na = Jumah alel efektif (Kimura and Crow (1964); He = Diferensiasi genetik Nei (1973)/Heterozigositas harapan
Secara umum nilai keragaman genetik (He) gaharu alam dan tanaman tidak
berbeda jauh, yaitu sebesar 0.5443 (hutan tanaman) dan 0.4642 (hutan alam). Hal
21
biji atau cabutan yang diambil dari alam.Akan tetapi, akhir-akhir ini beberapa
gaharu hasil budidaya sudah dikembangkan dengan menggunakan teknik kultur
jaringan sebagai akibat semakin langkanya gaharu di hutan alam.Penambahan zat
pengatur tumbuh ke dalam media kultur, sumber eksplan yang digunakan serta
sub kultur dapat mempengaruhi terjadinya variasi somaklonal pada tanaman hasil
kultur jaringan (Azwin2007). Hal ini bisa menyebabkan keragaman genetik
berubah pada suatu populasi,sehingga dapat memberikan peluang dalam
membedakan struktur genetik gaharu hasil budidaya dengan hasil gaharu dari
alam.
Tabel 10menampilkankeragaman genetik (He) gaharu di dalam populasi
berkisar antara 0,3988 - 0,5672 dan persentase lokus polimorfik yaitu sebesar
100%.Nilai He tersebut tergolong masih tinggi.Hal ini sesuai dengan penelitian
Rambey (2011) yang menyatakan bahwa keragaman genetikmindi besar sebesar
0,439 dan mindi kecil sebesar 0,373 masih tergolong tinggi. Keragaman genetik
beberapatanaman kehutanan disajikan dalam Tabel 11.Selain itu, Harada et al.
(2003) menyatakan He sebesar 0.322 pada Avicennia marina (Forsk.) di Vietnam
termasuk tinggi yang digunakan sebagai pusat keragaman genetik.Harada et al.
(2006) juga menyatakan bahwa He sebesar 0.244 tergolong pada keragaman
genetik yang rendah.Pada Tabel 11 dapat dilihat bahwa rata-rata keragaman geneti
tanaman kehutanan adalah sebesar 0.4123.Nilai tersebut jika dibandingkan dengan
kergaman genetik gaharu (sampel penelitian) memiliki nilai yang lebih rendah,
sehingga dapat dikatakan bahwa keragaman genetik gaharu masih tergolong
tinggi.
Tabel 11 Keragaman genetik (He) beberapa jenis tanaman kehutanan
No Jenis Sumber He(*)
8 Gaharu (sampel penelitian) 0.4988
Populasi yang mempunyai keragaman terendah (Tabel 10) adalah A.
malaccensis dari hutan alam, sedangkan yang mempunyai keragaman tertinggi
adalah A.crassna dari hutan tanaman. Rendahnya keragaman genetik dari jenisA.
malaccensisini mungkin disebabkan oleh kelangkaannya di alam (jarang
ditemukan/kerapatan rendah) jika dibandingkan dengan jenis gaharu yang
lainnya.Hal ini sesuai dengan Mahfudz (2010) yang menyatakan bahwa
keragaman Mebau yang mengalami eksploitasi lebih awal memiliki keragaman
genetik yang rendah.Finkeldey (2005) juga menyatakan bahwa jenis dalam
populasi yang mempunyai kerapatan rendah mempunyai variasi genetik rata-rata
yang lebih rendah bila dibandingkan dengan jenis dalam populasi dengan
kerapatan tinggi.Salah satu hal yang menyebabkan kelangkaan ini misalnya
pemanenan berlebihan, karena jenis A. malaccensis merupakan penghasil gaharu
berkualitas terbaik dengan nilai jual yang tinggi (Sukandar 2009).
Nilai variasi genetik gaharu dari hutan tanaman dan hutan alam dapat
digunakan untuk kepentingan aktivitas pemuliaan pohon dan konservasi
sumberdaya genetik serta penelusuran asal-usul tanaman.Hal ini disebabkan
karena kemampuan suatu jenis pohon hutan untuk beradaptasi pada berbagai
kondisi lingkungan sangat tergantung pada keragaman genetik dan multiplisitas
individual pohon dalam populasi.
4.3Keragaman Genetik antar Populasi semua Jenis Gaharu
Peubah yang digunakan untuk mencirikan variasi genetik antar populasi
menurut Finkeldey (2005) yaitu pembagian variasi genetik (Fst atau Gst), jarak
genetik, dan analisis klaster/kelompok.Salah satu peubah yang digunakan untuk
mencirikan variasi genetik antar populasi adalah jarak genetik. Jarak genetik
mengukur perbedaan struktur genetik antar dua populasi pada suatu lokus gen
tertentu.
Perbedaan genetik dari dua atau lebih populasi pada umumnya dianalisis
dengan sebuah matrik dimana elemen-elemennya berupa jarak genetik dan
pasangan kombinasi dari masing-masing populasi (Finkeldey2005).Adapun jarak
23
Tabel 12 Jarak genetik populasi gaharu
Pop 1 2 3 4 5 6 7 8 9
8 0.1238 0.1836 0.3459 0.0012 0.0299 0.0922 0.0745 **** 9 0.1238 0.1836 0.3459 0.0012 0.0299 0.0922 0.0745 0.0000 **** Keterangan: 1). A. malaccensis (HT); 2). A. microcarpa (HT); 3). A. crassna (HT); 4). Gyrinops sp (HA); 5). A. malaccensis (HA “LOMBOK”); 6). A. malaccensis (HA “RIAU”); 7). A. microcarpa (HA “KALIMANTAN”); 8). Kayu A. malaccensis; 9). Kayu A. filaria
Hasil analisis jarak genetik pada Tabel 11 menunjukkan bahwa populasi
yang memiliki jarak genetik yang paling besar adalah populasi A. crassna (hutan
tanaman) dengan A. malaccensis (hutan alam “Riau”) dengan nilai jarak genetik
yaitu 0,3613. Jarak genetik yang besar ini mengindikasikan bahwa hubungan
kekerabatan kedua populasi ini cukup jauh. Sedangkan populasi dengan jarak
genetik terdekat adalah antara kayu A. malaccensis dengan kayu A. filaria yaitu
0,0000.
Selain dari jarak genetik, peubah lain yang dapat digunakan untuk
mencirikan variasi genetik antar populasi adalah analisis gerombol/kelompok atau
dendogram jarak genetik antar populasi.Berdasarkan analisis nilai jarak genetik
dihasilkan dendrogram jarak genetik antar populasi yang digunakan untuk melihat
kekerabatan antar populasi seperti terlihat pada Gambar9.Adapun tampilan hasil
dendrogram Ntsys disajikan pada Lampiran 12.
Gambar 9 Dendogram pengelompokan gaharu hutan alam dan hutan tanaman (Nei’s 1972) hutan
tanaman
Gambar 9memperlihatkan bahwa populasi nuklear daun gaharu tanaman
dengan gaharu alam berpisah membentuk dua klaster yang berbeda.Pengklasteran
mengindikasikan bahwa dalam satu klaster memiliki struktur genetik yang hampir
sama (penghomogenan), sehingga antara klaster yang satu dengan yang lainnya
memiliki struktur genetik yang berbeda. Hal ini memberikan peluang untuk
kegiatan diskriminasi kayu gaharu alam dengan kayu gaharu budidaya atau
tanaman.
Hartati et al. (2007) menyatakan bahwa proses evolusi dan adaptasi suatu
populasi pada lingkungan spesifik yang merupakan habitatnya akan menyebabkan
masing-masing populasi mengembangkan karakter dan ciri spesifik secara
morfologis dan genetik yang berbeda dengan populasi lainnya.Berdasarkan hasil
dendogram, secara garis besar pengelompokan tidak berhubungan dengan posisi
geografisnya. Artinya pengelompokan tidak menunjukkan bahwa semakin dekat
jarak geografisnya suatu populasi maka jarak genetik antar populasi tersebut
semakin dekat, akan tetapi populasi-populasi yang berdekatan mempunyai
kecenderungan untuk membentuk satu sub kelompok,
4.4 Pendugaan Kayu Gaharu dengan Asal-usul Tidak Jelas
Secara biologis selain daun, benih dan kambium, kayu juga menyimpan
materi genetik berupa DNA. Informasi genetik pada tanaman kehutanan tersebar
pada tiga genom yaitu inti sel (nuklear), mitokondria dan kloroplas. DNA
kloroplas telah digunakan untuk studi filogenetik pada beberapa tanaman, seperti
pada Dipterocarpaceae (Kamiya et al. 2005), serta studi ekologi dan sejarah
evolusi tanaman (Heuertz et al. 2004).
Baru-baru ini DNA kloroplas juga telah digunakan sebagai alat identifikasi
dan forensik kayu (asal daerah kayu) untuk mendukung kegiatan sertifikasi kayu
(Deguilloux et al. 2004). Penanda mikrosatelit juga telah digunakan untuk lacak
balak pada jenis kayu ramin (Smulders et al. 2008). Pendugaan asal – usul kayu
gaharu yang tidak jelas dapat dilihat dari pengelompokan/klaster dendogram
25
Gambar 10 Dendogram pendugaan asal-usul kayu gaharu(Nei’s 1972)
Dendogram Gambar 10memperlihatkan bahwa potongan kayu gaharu
mengelompok dengan gaharu yang berasal dari hutan alam, sehingga kayu gaharu
dengan asal-usul tidak jelas tersebut memiliki struktur genetik yang sama dengan
gaharu dari alam. Hal ini dapat disimpulkan bahwa secara umum kayu gaharu
yang diperdagangkan masih berasal dari hutan alam, walaupun semua jenis
gaharu sudah termasuk kedalam daftar CITES Apendiks II.
Menurut Soehartono dan Mardiastuti (2003), para pengumpul gaharu kini
cenderung mengabaikan pendekatan tradisional untuk mencari gaharu.Dari hasil
wawancara yang dilakukan oleh Soehatono dan Mardiastuti, terungkap bahwa
pada saat ini hanya 42% dari pengumpul gaharu yang masih menggunakan
metode tradisional untuk mencari gaharu.Karena pendapatan dari gaharu
menurun, para pengumpul gaharu cenderung untuk mencari gaharu
sebesar-besarnya untuk menutupi kerugian.Oleh karena itu, tekanan terhadap populasi
gaharu di alam terus berlangsung dan bahkan meningkat sepanjang waktu.
Menanggapi tentang kelestarian perdagangan di masa depan, Soehartono
dan Mardiastuti (2003) menjelaskan bahwa 56,6% pengumpul gaharu dari
Kalimantan percaya bahwa aktivitas mereka dapat terus berlanjut dan mereka
percaya bahwa pengawasan tradisional (adat) dalam mengumpulkan gaharu
semestinya dilakukan. Untuk menjawab ide ini, WWF Kayan Mentarang (1994)
dalam Soehartono dan Mardiastuti (2003) memprakarsai pengaktifan kembali
Berdasarkan hasil penelitian, DNA kayu gaharudapat diekstraksi dan
diamplifikasi dengan penanda mikrosatelit. Kegiatan ekstraksi DNA dari kayu
sebelumnya sudah berhasil dilakukan (Deguilloux et al. 2002).Selain dari kayu,
kegiatan esktraksi DNA pada kulit biji yang keras juga sudah berhasil dilakukan
(Godoy and Jordano 2001).Jika DNA kayu berhasil diekstraksi, maka dengan
metode PCR bagian-bagian tertentu DNA dapat selanjutnya diamplifikasi hingga
cukup untuk keperluan analisis variasi genetik. Atas dasar hal tersebut banyak
penelitian yang menggunakan DNA kayu untuk lacak balak kayu (Finkeldey et al.
2007; Lowe 2007).
Penggunaan empat primer dalam penelitian ini mampu memperlihatkan
pemisahan/klaster antara hutan alam dan tanaman. Dari keempat primer tersebut
penggunaan satu primer yang mampu memperlihatkan pemisahan hutan alam dan
tanaman dengan lebih tajam (Gst= 0,965)adalah primer 10pa17 (Gambar 11). Pada
Gambar 11 dapat dilihat adanya klasterisasi populasi hutan alam dan tanaman.
Namun hasil yang lebih baik akan didapatkan jika menggunakan primer lebih dari
satu. Penggunaan satu primer ini bisa dimanfaatkan jika memerlukan waktu yang
singkat untuk mengetahui keragaman genetik pada suatu populasi.
Gambar 11 Dendogram klaster/pemisahan hutan alam dan tanaman dengan primer 10pa17.
Siregar (2000) menyatakan bahwa keragaman genetik dibagi menjadi
keragaman di dalam populasi dan antar populasi dan masing-masing mempunyai
beberapa ukuran. Hasil-hasil penelitian terbaru memperlihatkan bahwa
penggunaan penanda genetik ini sangat efektif untuk membedakan jenis-jenis
yang berkerabat atau hibrid, dimana metode anatomi kayu sangat sulit untuk
membedakannya. Jika perbedaan pola variasi genetik antar populasi telah
27
Pengembangan metode penanda genetika molekuler untuk lacak balak pada kayu
jati sebelumnya telah berhasil dilakukan untuk memverifikasi aliran kayu jati pada
Perhutani (Siregar et al. 2008) dan aliran kayu meranti pada IUPHHK-HA di
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Amplifikasi silang penanda mikrosatelit dari jenis Aquilaria crassna ke jenis
gaharu lainnya dapat dilakukan. Analisis genetikmenunjukkan nilai
keragaman genetik (He) dalam populasi gaharu sebesar 0.5443 (hutan
tanaman) dan 0.4642 (hutan alam).
2. Berdasarkan dendogram, pendugaan asal-usul kayu gaharu dapat dikatakan
bahwa sampel potongan kayumengelompok dengan gaharu yang berasal dari
hutan alam. Hal ini mengindikasikan bahwa secara umum kayu gaharu yang
diperdagangkan masih berasal dari hutan alam, walaupun semua jenis
gaharu sudah termasuk ke dalam daftar CITES Appendix II.
5.2 Saran
Perlu dilakukan penelitian marka DNA lanjutan tentang gaharu, misalnya
i
KERAGAMAN GENETIK GAHARU BUDIDAYA DAN ALAMI
BERDASARKAN PENANDA MIKROSATELIT
LASWI IRMAYANTI
DEPARTEMEN SILVIKULTUR
FAKULTAS KEHUTANAN
INSTITUT PERTANIAN BOGOR
DAFTAR PUSTAKA
Adinugroho WC. 2010. Mengenal pohon gaharu.http://wahyukdephut.wordpress. com/2010/02/23/mengenal-pohon–gaharu-aquilaria-microcarpa/[19 November 2010]
Alamendah. 2010. Konferensi CITES ke-15 (CoP15 Species) Qatar. http://alamen dah.wordpress.com/2010/03/12/konferensi-cites-ke-15-cop15-species-qatar/[20November 2010]
Anonim.2010a. Cites. http://id.wikipedia.org/wiki/CITES#Latarbelakang[20 November 2010]
. 2010b. Reaksi berantai polymerase.http://id.wikipedia.org/wiki/Reaksi berantai polymerase [19 November 2010]
Aritonang KV, Siregar IZ, Yunanto T. 2007. Manual Analisis Genetik Tanaman Hutan di Laboratorium Silvikultur Fakultas Kehutanan Institut Pertanian Bogor.Bogor : Fakultas Kehutanan IPB
Aswin. 2007. Evaluasi stabilitas genetik tanaman gaharu (Aquilaria malaccensis Lamk.) hasil kultur in vitro[Tesis]. Bogor: Fakultas Kehutanan IPB
Aswoko G. 2009. Wahana gaharu.http:// wahanagaharu.blokspot. com/2009/02/ spesifikasi-klasifikasi-gaharu.html [30 Januari 2011]
[Balitbanghut] Badan Penelitian dan Pengembangan Kehutanan.2006. Budidaya Gaharu dan rekayasa produksinya [Leaflet]. Bogor: Pusat Penelitian dan Pengembangan Hutan dan Konservassi Alam
Barden A, NAwang AnakT, MullikenM, Song. 2000. Heart of the matter: Agarwood use andtrade and CITES implementation for Aquilaria malaccensis. TRAFFIC report.
Boer D. 2007.Keragaman dan struktur genetik populasi jati Sulawesi Tenggara berdasarkan marka Mikrosatelit [Disertasi]. Bogor: Institut Pertanian Bogor
Deguilloux MF, Pemonge MH, Petit RJ. 2004. DNA based control of Oak wood geographic origin in the context of cooperage industry. Ann. For. Sci. 61: 97-104
Eurlings MCM, Van Beek HH, Gravendeel B. 2009. Polymorphic microsatellites for forensic identification of agarwood (Aquilaria crassna). FSI-197 30:34
30
Finkeldey R. 2005. Pengantar Genetika Hutan Tropis. Djamhuri E, Siregar IZ,
Siregar UJ, Kertadikara AW, penerjemah.Gottingen: Institute of Forest Genetics and Forest Tree Breeding. Terjemahan dari : An Introduction to Tropical Forest Genetic
Finkeldey R, Rachmayanti Y, Nuroniah H, Nguyen NP, Cao C, Gailing O. 2007. Identification of the timber origin of tropical species by molecular genetic markers – the case of dipterocarps. In: Proceedings of the international workshop “Fingerprinting methods for the identification of timber origins”, October 8-9 2007, Germany
Godoy JA, Jordano P. 2001. Seed dispersal by animals: exact identification of source trees with endocarp DNA microsatellites. Mol. Ecol. 10: 2275-2283
Harada K, Giang LH, Hong PN, Tuan MS. 2003. Genetic variation of Avicennia marina (Forsk) Vierh.(Avicenniaceae) in Vietnam revealed by microsatellite and AFLP markers.Genes Genet.Syst 78 : 399-407
Harada K, Giang LH, Geada GL, Hong PN, Tuan MS, Lien NTH, Ikeda S. 2006.Genetic variation of two mangrove species in Kandelia (Rhizophoraceae) in Vietnam and surrounding area revealed by microsatellite markers.Int. J. Plant Sci 167(2) : 291-298
Hartati D, Rimbawanto A, Taryono, Sulistyaningsih, Widyatmoko. 2007. Pendugaan keragaman genetic di dalam dan antar provenan Pulai (Alstonia scholaris (L.) R. Br.) menggunakan penanda RAPD. Jurnal Pemuliaan Tanaman Hutan 2 : 89-98
Heuertz M, Fineschi S, Anzidei M, Pastorelli R, Salvini D, Paule L, Lacoste LN, Hardy OJ, Vekemans X, and Vendramin GG. 2004. Chloroplast DNA variation and postglacial recolonization of common ash (Fraxinus excelsior L.) in Europe. Molecular Eology 13: 3437-3452.
James C, Akiko I. 1994. The Use and Trade of Agarwood in Japan: 1-21.
Kamiya K, Harada K, Tachida H, Ashton PS. 2005. Phylogenetic of PgiC gen in Shorea and its closely related genera (Dipterocarpaceae) the dominant trees in Southeast Asian tropical rain forest. Am. J. Bot. 92 (5): 775-788
Lee SL, Tani N, Ng KKS, Tsumura Y. 2004.Isolation and characterization of microsatellite loci for an important tropical tree Shorea leprosula (Dipterocarpaceae) and their applicability to S.parvifolia. Molecular Ecology Notes 4: 222-225
methods for the identification of timber origins”, October 8-9 2007, Germany
Mahfudz, Na’iem, Sumardi, EB Hardiyanto. 2011. Variasi genetik dalam dan antar populasi alam Merbau (Intsia bijuga O.Ktze) di Papua dan Maluku.Jurnal Pemuliaan Tanaman Hutan.Edisi Juli 2011, Vol.5 No.1
Mulyadiana A. 2010. Keragaman genetik Shorea leavis Ridl.Di Kalimantan berdasarkan penanda mikrosatelit [Skripsi].Bogor : Fakultas Kehutanan Institut Pertanian Bogor
Nasoetion M. 2004. Marka molekuler. http://psb-psma.org/content/blog/2423-marka-molekuler [11 Desember 2010]
Rambey R. 2011. Pengetahuan Lokal Sistem Agroforestri Mindi (Melia azedarach L.) (Studi Kasus di Desa Selaawi, Kecamatan Talegong, Kabupaten Garut, Propinsi Jawa Barat) [Tesis]. Bogor: Program Pasca Sarjana Institut Pertanian Bogor
Rohlf FJ. 1998. Numerical Taxonomy and Analysis System (NTSYSpc) Version 2.0. New York: Department of Ecology and Evolution Sate University of New York.
Soehartono T, Mardiastuti A. 2003. Pelaksanaan Konvensi CITES di Indonesia. Jakarta:Japan International Coorperation Agency (JICA)
Siregar IZ. 2000. Genetic aspects of the reproductive system of Pinus merkusii Jungh.et de Vriese in Indonesia. [dissertation]. Göttingen. Faculty of Forest Sciences and Forest Ecology, Georg-August University of Göttingen.147 p.
Siregar IZ, Siregar UJ, Karlinasari L. dan Yunanto T. 2008. Pengembangan Penanda Genetika Molekuler untuk Lacak Balak (Studi Kasus pada Jati). Laporan Akhir Hibah Bersaing. Bogor :LPPM Institut Pertanian Bogor
Smulders MJM, Van ‘T Westende WPC, Diway B, Esselink GD, Van Der Meer PJ and Koopman WJM. 2008. Development of microsatellite markers in Gonystylus bancanus (Ramin) useful for tracing and tracking of wood of this protected species. Molecular Ecology Resources 8: 168 –171
Sukandar. 2009. Pengembangan HHBK Jenis Gaharu (Aquilaria malaccenis) di Provinsi Kepulauan Bangka Belitung. Workshoop HHBK. Dinas Kehutanan Propinsi Bangka Belitung
32
Suryo. 2008. Genetika. Yogyakarta : Fakultas Biologi Universitas Gadjah Mada
Ujino T, Kawahara T, Tsumura Y, Nagamitsu T, Yoshimaru H, Wickneswari R. 1998. Development and Polymorphisme of Simpel Sequence Repeat DNA Marker ForShorea curtisii and Other Dipterocarpaceae Species. Heredity 81 : 422-428
Wulandari Y. 2008. Analisis keragaman genetik kayu afrika (Maesopsis eminii Engl.) berdasarkan penanda Random Amplified Polymorphik DNA (RAPD) [Skripsi]. Bogor: Fakultas Kehutanan IPB
Yeh FC, Yang R. 1999. POPGENE Version 1.31 : User Guide Centre for International Forestry Research: Universitas of Alberta
LASWI IRMAYANTI
DEPARTEMEN SILVIKULTUR
FAKULTAS KEHUTANAN
INSTITUT PERTANIAN BOGOR
iii
LASWI IRMAYANTI. Keragaman
GenetikGaharuBudidayadanAlamiBerdasarkanPenandaMikrosatelit.Dibimbin goleh ISKANDAR Z. SIREGAR
RINGKASAN
Gaharu merupakan salahsatuHasilHutanBukanKayu (HHBK) yang memiliki kandungan damar wangidengan keharuman yang khas,sehinggabanyakdigunakan sebagai bahan baku industri parfum, obat-obatan, kosmetik, dupa, pengawet serta untuk keperluan ritual keagamaan. Eksploitasi gaharu yang berlebihanmengakibatkan kelangkaan dan hilangnya pohon (genotipe) unggul. Kelangkaan ini menyebabkan gaharu masuk kedalam daftar CITES Apendiks II, dengankonsekuensinyayaitupenjualan ekspor dan impor gaharu diaturolehkuota.Akan tetapi, kuotainitidak membedakan gaharu alami atau budidayasehingga masihmendorong terjadinyapraktek penebangan liar.Olehkarenaituperludilakukanupayapengendalian yang
efektfterhadapasal-usulkayugaharu.Akhir-akhirinipenggunaanpenanda DNA menjadipentinguntukmemverifikasiasal-usulkayudanbahantanamankarenasifatnya yang
sulitdimanipulasisehinggaperludiujicobapadakayugaharu.Penelitianinibertujuanuntuk 1) melakukanamplifikasisilang primer mikrosatelitAquilariacrassnakejenisgaharulainnya, dan 2) mendugaasalusulkayugaharuyang diperdagangkan di pasaran.Bahanpenelitianyaitupopulasigaharudarihutanalamdantanamansertakayugaharu
yang tidakdiketahuiasal-usulnya.Primer mikrosatelitA.crassna yang
digunakandalamamplifikasi DNA gaharuadaempatmacam, yaitu 6pa18 (180-210 bp), 10pa17 (152-156 bp), 16pa17 (143-155 bp), dan 71pa17 (152-224 bp).Berdasarkanhasilpengamatandidapatkanbahwasemuajenissampelgaharubaikdarihutan alammaupunhutantanamandapatmengamplifikasisilangpadarentangukuranfragmen DNA
yang diharapkan.Analisisgenetikmenunjukkannilaikeragamangenetik (He)
dalampopulasigaharusebesar He=0.5443 (hutantanaman), dan He=0.4642 (hutanalam).
Nilaikeragamangenetiktersebutdapatdigunakansebagaiinformasiilmiahuntukupayapengko
nservasiangaharu.PadadendrogramNtsys (analisisklaster) terlihatadanyapengelompokangaharuasalhutantanamandanhutanalam,
dimanasampelpotongan kayu gaharu dengan asal-usul tidak jelas mengelompokke gaharudari hutanalam. Hal inimengindikasikanbahwakayu gaharu yang diperdagangkan masih berasal dari hutan alam.
ABSTRACT
Agarwood is one of the valuable Non Timber Forest Products (NTFPs) that contain resin with a specific fragrance, and is often used as raw materials of perfumes, pharmaceuticals, cosmetics, incense, preservatives as well as religious activities. Overexploitation of agarwoodhas resulted in scarcity of agarwood in the nature leading to the lossesof treesof superior genotypes. This scarcity has led agarwoodto be included into the CITES Appendix II list in which a quota system is imposed for trading activities. However, this quota still does not distinguish clearly between natural or cultivatedagarwood, opening opportunities for illegal trading practices. It is therefore necessary to provide an effective attemptsto control of the origin of. Nowdayas, the use of DNA markers gains significant importance in the forensic activities such as verification of the origin of timber and plant materials. This tool is difficult to be manipulated. Therefore, a study was carried with aims to 1) cross amplify
Aquilariacrassna microsatellite primers into other agarwood species (transferability study), and 2) to infer the origin of agarwoodbeing traded in the market. Materials for research were populations of agarwood from natural and planted forests and agarwood pieces of unknown origin. A.crassna microsatellite primers were used, namely 6pa18 (180-210 bp), 10pa17 (152-156 bp), 16pa17 (143-155 bp), and 71pa17 (152-224 bp). Results showed thatagarwood samples from both natural forests and plantations could cross amplify with expected fragment size ranges.Resultshowedthatgenetic diversity (He)
in the planted forest was 0.5443 a slighty higher than that of natural forest (He=0.4642).
Information on the level of genetic diversities can be used as scientific basis for conservation program. Cluster analysis showed different groupings of agarwood originated from plantations and natural forests. Futher analysis showed that agarwoodtimbers with unclear origins clustered intoagarwoodgroupd from natural forests indicatingcommon existence of traded natural agarwood.
Keywords: agarwood, cross amplification, microsatellite, CITES, genetic diversity.
ii
KERAGAMAN GENETIK GAHARU BUDIDAYA DAN ALAMI
BERDASARKAN PENANDA MIKROSATELIT
Oleh :
LASWI IRMAYANTI E44070003
Skripsi
Sebagaisalahsatusyaratuntukmemperoleh gelar Sarjana Kehutanan padaFakultasKehutanan
InstitutPertanian Bogor
DEPARTEMEN SILVIKULTUR
FAKULTAS KEHUTANAN
INSTITUT PERTANIAN BOGOR
JudulSkrips i
: Keragaman
GenetikGaharuBudidayadanAlamiBerdasarkanPenandaMikrosa telit
Nama : LaswiIrmayanti
NIM : E44070003
Menyetujui Pembimbing,
Prof. Dr. Ir. Iskandar Z. Siregar ,M.For.Sc. NIP. 19660320 199002 1 001
Mengetahui,
KetuaDepartemenSilvikultur Fakultas Kehutanan IPB
Dengan ini saya menyatakan bahwa skripsi yang berjudul “Keragaman GenetikGaharuBudidayadanAlamiBerdasarkanPenandaMikrosatelit” adalah benar-benar hasil karya sendiri dengan bimbingan dosen pembimbing yang belum pernah digunakan sebagai karya pada perguruan tinggi atau lembaga manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, November 2011
viii RIWAYAT HIDUP
Penulis dilahirkan di Tuban, Jawa Timur pada tanggal 23 Agustus 1988, putri dari pasangan Jayus dan Rupi’in. Penulis merupakan anak pertama dari dua bersaudara.
Pendidikan dasar diselesaikan pada tahun 2001 di SDN Sumurcinde I.Pendidikan lanjutan menengah pertama diselesaikan pada tahun 2004 di SMP Negeri 1 Soko. Padatahun 2007, penulis lulus dari SMA Negeri 2 Tuban, dimana pada tahun yang sama lulus seleksi masuk IPB jalur Undangan Seleksi Masuk IPB (USMI). Penulis diterima sebagai mahasiswa di Departemen Silvikultur dengan sistem Mayor-Minor.
Selama menuntut ilmu di IPB, penulis aktif di beberapa organisasi kemahasiswaan yakni pada periode tahun 2007/2008 sebagai staf FORCES (Forum for Scientific Studies), aktif di Himpro TGC (Tree Grower Community) divisi Scientific Improvement 2008-2010, dan HMI (Himpunan Mahasiswa Islam) periode 2009/2010 sebagai bendahara umum. Penulis pernah menjadi asisten program TPB IPB (Tingkat Persiapan Bersama) pada mata kuliah Fisikatahun 2009/2010, untuk program Sarjana pada mata kuliah: Silvikultur (2010), Genetika Hutan (2010-2011), dan Pemuliaan Pohon (2010). Selain itu, penulis juga pernah menjadi asisten PPH (Praktek Pengelolaan Hutan) di Hutan Pendidikan Gunung Walat pada bulanJuli 2011.
Selama perkuliahan, penulis mengikuti PPEH (Praktek Pengenalan Ekosistem Hutan)yang dilaksanakan di Pangandaran–Gunung Sawal. PPH (Praktek Pengelolaan Hutan) dilaksanakan di Hutan Pendidikan Gunung Walat (HPGW) Sukabumi. PKP (Praktek Kerja Profesi) dilaksanakan di PT Arutmin Indonesia Tambang Batulicin, Kalimantan Selatan pada periode Februari – April 2011. Guna memperoleh gelar Sarjana Kehutanan IPB, penulis menyelesaikan
skripsi dengan judul Keragaman Genetik GaharuBudidayadanAlamiBerdasarkanPenandaMikrosatelitdibawahbimbinganPro
Pujisyukurpenulispanjatkanataskehadirat Allah SWT yang telahmemberikanrahmatdanhidayah-Nya,
sehinggapenulisdapatmenyelesaikanpenulisan skripsiini. Sholawat dan salam semoga tercurah kepada Rasulullah SAW, suri tauladan yang telah memberikan petunjuk kepada seluruh umat manusia.
Skripsiinimerupakansalahsatusyaratuntukmendapatkan gelar Sarjana Kehutanan di Fakultas KehutananInstitutPertanian Bogor. Skripsi ini berjudul “Keragaman GenetikGaharuBudidayadanAlamiBerdasarkanMetodeMikrosatelit”.
Penulisanskripsi ini diharapkandapatmembukawacanakeilmuandalambidangkehutananterutamamenge
naikeragamangenetikgaharu, baikgaharupadahutantanamanmaupunhutanalam, sertadapatbergunabagisemuapihak yang berkepentingan.
Penulismengucapkanterimakasihkepadasemuapihak yang membantudalam menyelesaikanskripsi ini. Penulis menyadari bahwa skripsi ini masih banyak kekurangan. Oleh karena itu dengan kerendahan hati, penulis meminta maaf dan mengharapkan kritik serta saran yang membangun demi masukan dan perbaikan untuk penelitian yang akan datang.
Bogor, November 2011
x UCAPAN TERIMA KASIH
Puji dan syukur penulis panjatkan kehadirat Allah SWT karena berkat rahmat dan hidayah-Nya penulis dapat menyelesaikan skripsi ini. Selama melakukan penelitian dan penulisan skripsi ini, penulis banyak dibantu oleh berbagai pihak. Untuk itu penulis mengucapkan terima kasih kepada :
1. Prof.Dr. Ir Iskandar Z. Siregar, M.For.Sc. selakudosenpembimbingatas bimbingan dan ilmunya yang telah diberikan.
2. RestiMeilaniS.Hut, M.Si selaku dosen
pengujidanDr.ArumSekarWulandariselakuketuasidang
3. Bapak tercinta Jayus dan Emak tercinta Rupi’indan Adik tersayang Taman Agung yang telah menyemangati dan mendoakan penulis.
4. Tedi Yunanto, S.Hut. M.Si, Fifi Gus Dwiyanti, S.Hut dan Elviana, S.Hut yang telah membantu penulis selama penelitian
5. Teman-teman di Laboratorium Genetik Silvikultur (Asep Mulyadiana, S.Hut, Azizah, Eka Perdanawati, Mira Novianti, Ridahati Rambey S.Hut, M.Si, Dr. Ir. Yulianti, MS, dan Dra. Dida Syamsuwida MSc)
6. Sahabat-sahabat terbaik penulis di Silvikultur 44 (Hendra Prasetya, Lilik Sugirahayu,Nifa Hanifa, Nurunnajah, Anindita Kusumaningrum, Yuniar Safitri, danCyntia Yuni Ardanari), 45 dan 46 terimakasih atas do’a dan dukungannya, sertateman-teman yang tidakbisasayasebutkansatu per satu. 7. Keluarga Besar HMI Komisariat Fakultas Kehutanan IPB (Alex Yungan,
Wira Ari Ardana, DindaHidayanti, Sri Handayani, danNiaWidyastuti)
8. Teman-temanwismaAr-Riyadh (Lili Suryani, Ririn Masrina, Sri Lestari, Yunita Fatmah Sujati, Gita, Nurzakiyah, Maya Wulan ArinidanFitriani Rahayu)terimakasihatasbantuandandukungannya
9. Keluarga Besar Ikatan Pelajar Mahasiswa Ronggolawe Tuban (IPMRT) 10. Civitas akademik Fakultas Kehutanan atas kekeluargaannya
11. Seluruh civitas akademik Institut Pertanian Bogor
Penulis berharap karya ini dapat bermanfaat dan berguna bagi semua pihak dan mohon maaf atas segala kekurangannya.
KATA PENGANTAR ... ix DAFTAR ISI ... x DAFTAR TABEL ... xii DAFTAR GAMBAR ... xiii DAFTAR LAMPIRAN ... xiv BAB I.PENDAHULUAN ... 1 1.1 Latar Belakang ... 1 1.2 Tujuan Penelitian ... 2 1.3 Manfaat Penelitian ... 2 BAB II. TINJAUAN PUSTAKA ... 3
2.1DeskripsiSingkatGaharu ... 3 2.2Cites ... 4 2.3Deoksiribonukleat Acid (DNA) ... 5 2.4KeragamanGenetik ... 6 2.5PCR (Polymerase Chain Reaction) ... 8 2.6Mikrosatelit ... 9 BAB III. METODE PENELITIAN ... 11 3.1 Waktu dan Tempat Penelitian ... 11 3.2 Alat dan Bahan ... 11 3.3 Prosedur Penelitian ... 13 3.3.1 Pengambilan Sampel Daun ... 13 3.3.2 Ekstraksi DNA ... 13 3.3.3 Elektroforesis ... 14 3.3.4 PCR ... 14 3.3.5 Pembuatan Gel Poliakrilamid ... 15 3.4 Analisis Data ... 17 BAB IV.HASIL DAN PEMBAHASAN ... 19
xii 4.3Keragaman Genetik antarPopulasiJenisGaharu ... 22 4.4Pendugaan Kayu Gaharu dengan Asal-usul tidak Jelas ... 24 BAB V KESIMPULAN DAN SARAN ... 28 DAFTAR PUSTAKA ... 29 LAMPIRAN ... 33
xiv DAFTAR GAMBAR
1
BAB I
PENDAHULUAN
1.1 Latar Belakang
Gaharu merupakan salah satu Hasil Hutan Bukan Kayu (HHBK) yang
memiliki kandungan damar wangi, berasal dari pohon atau bagian pohon
penghasil gaharu, sebagai akibat dari proses infeksi yang terjadi secara alami atau
buatan pada pohon gaharu.Adanya kandungan damar yang wangi dalam gaharu
ini, gaharu sering digunakan sebagai bahan baku industri parfum, obat-obatan,
kosmetik, dupa, pengawet, serta untuk keperluan kegiatan agama.
Gaharu dikenal berasal dari marga tumbuhan Aquilaria dan
Gyrinops.Menurut Soehartono dan Mardiastuti (2003) saat ini di Indonesia
diketahui terdapat 6 jenis Aquilaria yang dapat menghasilkan gaharu, yaitu
A.beccariana, A. filaria, A. hirta, A. malaccensis,A.cumingiana, dan A.
microcarpa.
Perdagangan gaharu di Indonesia tercatat telah dimulai sejak abad
ke-5.Cina merupakan pembeli terbesar untuk produk-produk gaharu.Perdagangan
gaharu berlanjut pada masa pemerintahan Belanda (dari abad ke-18 sampai
permulaan abad ke-19) dan berlangsung hingga sekarang (Soehartono dan
Mardiastuti 2003).
Eksploitasi gaharu yang disertai pembalakan hutan mengakibatkan
kelangkaan pohon gaharu dan hilangnya pohon (genotipe) unggul. Akibat
kelangkaan tersebut menurut Balitbanghut (2006) semua jenis Aquilaria, dan
Gyrinops ditempatkan pada CITES Apendiks II (Lampiran I),konsekuensinya
yaitupenjualan ekspor dan impor gaharu ditentukan kuota dan harus mendapat izin
dari CITES. Akan tetapi, kuota ini tidak membedakan gaharu alam atau budidaya
sehingga mendorong praktek penebangan liar.Oleh karena itu, perlu dilakukan
usaha pengendalian asal-usul kayu gaharu agar tetap terjaga kelestariannya.Hal ini
meningkatkanpengendalian perdagangan gaharu komersial di semua negara yang
berpartisipasi.
Pengendalian perdagangan internasionaldenganmetode deteksi tradisional
seperti cahaya mikroskop, gagal untuk membedakan antara gaharu legal dan
gaharu dari hutan alam dan hutan tanaman serta kepentingan pengendalian
perdagangan gaharu internasional diperlukan metode identifikasi alternatif yang
dapat diandalkan dan sulit dimanipulasi, misalnya dengan marka DNA.
1.2Tujuan
Tujuan dari penelitian ini adalah :
1. Melakukan amplifikasi silang penanda mikrosatelit dari jenis Aquilaria crassna
ke jenis gaharu lainnya
2. Menduga asal usul kayu gaharu yang saat ini diperdagangkan di pasaran.
1.3Manfaat Penelitian
Hasil dari penelitian ini diharapkan dapat memberikan informasi dasar
tentang kelayakan metode DNA untuk menduga asal-usul kayu dan jenis-jenis
gaharu yang diperdagangkan sehingga dapat digunakan untuk pengendalian