KARAKTERISASI BIOKIMIA DAN MEKANISME SELULAR
PLANTARISIN DARI
Lactobacillus plantarum
U10 SEBAGAI
INHIBITOR PERTUMBUHAN
Salmonella typhi
SOGANDI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Karakterisasi Biokimia dan Mekanisme Selular Plantarisin dari Lactobacillus plantarum U10 sebagai Inhibitor Pertumbuhan Salmonella typhi adalah benar karya saya dengan arahan dari pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor dan Lembaga Ilmu Pengetahuan Indonesia
.
Bogor, Juni 2015
Sogandi
RINGKASAN
SOGANDI. Karakterisasi Biokimia dan Mekanisme Selular Plantarisin dari
Lactobacillus plantarum U10 sebagai Inhibitor Pertumbuhan Salmonella typhi. Dibimbing oleh I MADE ARTIKA dan APON ZAENAL MUSTOPA.
Demam tifoid merupakan infeksi sistemik yang disebabkan oleh Salmonella enterica serotipe typhi (S. typhi). Demam tifoid merupakan masalah yang serius untuk negara berkembang. Indonesia menempati urutan ketiga sebagai negara dengan kasus demam tifoid terbanyak setelah India dan Pakistan dengan banyak kasus 180 untuk setiap 100.000 penduduk pertahun. Selama ini pengobatan yang umum dilakukan adalah dengan menggunakan antibiotik. Namun, telah dilaporkan adanya resistensi S. typhi terhadap antibiotik dan berbagai obat
(multidrug resistance), sehingga diperlukan alternatif pengobatan lain yang tidak menginduksi resistensi pada S. typhi. Salah satu alternatif yang dapat digunakan adalah peptida antimikroba. Plantarisin memiliki potensi sebagai alternatif pengobatan demam tifoid. Oleh karena itu penelitian ini bertujuan untuk mengoptimasi produksi plantarisin, pemurnian, mengkarakterisasi serta mengetahui mekanisme aksi plantarisin yang dihasilkan oleh L. plantarum U10 sebagai inhibitor pertumbuhan bakteri S. typhi.
Pemurnian plantarisin U10 menggunakan presipitasi amonium sulfat 80% dilanjutkan dengan filtrasi gel kromatografi dan penentuan bobot molekul menggunakan SDS-PAGE 16% serta pengukuran aktivitas antibakteri terhadap S. typhi menggunakan metode difusi agar. Karakterisasi plantarisin terhadap suhu dilakukan dengan pemanasan hingga 121 ºC. Karakterisasi plantarisin terhadap kondisi asam dan basa dilakukan dengan mengkondisikan pada pH 2-12 yang diinkubasi selama 2 jam. Karakterisasi terhadap enzim proteolitik dengan menambahkan 1 mg/ml enzim proteinase-K, katalase, pepsin dan lisozim. Karakterisasi surfktan dengan menambahkan 1% (v/v) SDS, urea, triton X-100, PMSF, dan EDTA lalu diinkubasi 37 ºC selama 2 jam. Mekanisme aksi penghambatan plantarisin terhadap S. typhi ditentukan dengan menghitung jumlah koloni yang tumbuh setelah diberikan plantarisin. Perubahan morfologi sel bakteri
S. typhi setelah diberi perlakuan plantarisin diamati melalui mikroskop elektron dengan pembesaran 10.000 kali. Deteksi gen penyandi plantarisin dilakukan dengan teknik PCR menggunakan primer spesifik.
Plantarisin U10 yang dihasilkan bersifat stabil pada rentang pH yang lebar (2.0-12.0), tahan terhadap pemanasan sampai 121 ºC selama 15 menit, stabil terhadap surfaktan dan dapat didegradasi oleh enzim proteolitik. Produksi maksimum plantarisin U10 didapatkan setelah inkubasi selama 20 jam dengan
yield 33.25% dan aktivitas maksimum 800 AU/mL. Pemurnian plantarisin menghasilkan dua pita dengan bobot molekul berkisar 4.5 dan 9.8 kDa. Analisis morfologi sel menggunakan SEM (Scanning Electron Microscopy)menunjukkan adanya perbedaan morfologi permukaan sel antara yang diberi perlakuan plantarisin dengan tanpa perlakuan. Plantarisin U10 diketahui memiliki empat gen penyandi plantarisin yaitu plnA, plnJK, plnF, dan plnW.
SUMMARY
SOGANDI. Biochemical Characterization and Cellular Mechanism of Plantaricin from Lactobacillus plantarum U10 as Growth Inhibitor for Salmonella typhi
Supervised by I MADE ARTIKA and APON ZAENAL MUSTOPA.
Typhoid fever is a systemic infection caused by Salmonella enterica serotype Typhi (S. typhi). Typhoid fever is a serious problem for developing countries. Indonesia ranks as the third country with highest number of typhoid fever cases after India and Pakistan. There were 180 case out of every 100,000 people per year. The treatment of typoid fever case usually using antibiotics. However, the existence of multidrug resistance of S. typhi has been reported. Thus, we need other treatment alternatives that do not induce resistance in S. typhi. One of the alternative for typhoid treatment is the antimicrobial peptides such as plantaricin. Plantaricin has potential as an alternative treatment of typhoid fever. Therefore, this study aimed to optimize plantaricin production, purification, characterization and mechanism of action determination as inhibitors of bacterial growth of S. typhi.
Plantaricin U10 were purified using 80% ammonium sulfate precipitation followed by gel filtration chromatography and molecular weight determination was conducted using SDS-PAGE 16%. The measurement of antibacterial activity against S. typhi was perform using agar well diffusion assay. The effect of temperature on plantaricin activity was tested by incubating cell-free supernatants at 121 ºC. The effect of pH on the activity of plantaricin was tested by adjusting cell-free supernatants from pH 2.0 to 12.0 followed by incubation for 2 h at 37 °C. The proteolitic enzyme characerization was done by adding 1 mg/ml proteinase-K, catalase, pepsin and lysozyme. Surfactan characterization was done by adding 1% (v/v) SDS, urea, triton X-100, PMSF, EDTA followed by incubation for 2 h at 37 °C. Plantaricin mechanism of inhibitory action against S. typhi is determined by counting the colonies that grow after plantaricin treatment. Changes in cell morphology of S. typhi bacteria after plantaricin treatment were observed through an electron microscope with a magnification of 10,000 times. The detection of plantaricinn encoding gene was performed by PCR method using specific primers. Plantaricin U10 was stable in a wide range of pH (2.0-12.0), and stable at high temperature (121 ºC); stable against surfactants and can be degraded by proteolytic enzymes. Maximum production of plantaricin U10 is obtained after incubation for 20 hours with 33.25% of yield and maximum activity at 800 AU/mL. The purification of plantaricin produced two bands with molecular weights ranging from 4.5 and 9.8 kDa. Cell morphology analysis using SEM (Scanning Electron Microscopy) showed morphological differences between the cell surface treated by plantaricin and the one without the treatment. Plantaricin U10 gene was known to have four plantaricin gene namely plnA, plnJK, plnF, and plnW.
© Hak Cipta Milik IPB dan LIPI, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB dan LIPI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biokimia
KARAKTERISASI BIOKIMIA DAN MEKANISME SELULAR
PLANTARISIN DARI
Lactobacillus plantarum
U10 SEBAGAI
INHIBITOR PERTUMBUHAN
Salmonella typhi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Karakterisasi Biokimia dan Mekanisme Selular Plantarisin dari
Lactobacillus plantarum U10 sebagai Inhibitor Pertumbuhan
Salmonella typhi
Nama : Sogandi NRP : G851130241
Disetujui oleh Komisi Pembimbing
Dr I Made Artika, M.App, Sc Ketua
Dr Apon Zaenal Mustopa, MSi Anggota
Diketahui oleh
Ketua Program Studi Biokimia
Prof Dr drh Maria Bintang, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala rahmat dan karuniaNya, sehingga penulis dapat menyelesaikan tesis yang berjudul
Karakterisasi Biokimia dan Mekanisme Selular Plantarisin dari Lactobacillus plantarum U10 sebagai Inhibitor Pertumbuhan Salmonella typhi yang telah dilaksanakan sejak bulan September 2014 sampai April 2015 di Laboratorium Rekayasa Genetika Terapan dan Desain Protein, Pusat Penelitian Bioteknologi-Lembaga Ilmu Pengetahuan Indonesia (LIPI).
Terima kasih, penghargaan, dan apresiasi penulis ucapkan kepada Dr I Made Artika, M.App, Sc sebagai pembimbing utama dan Dr A. Zaenal Mustopa, M.Si sebagai pembimbing kedua atas arahan, bimbingan, perhatian, nasihat, motivasi dan masukkannya selama penelitian serta dalam penyusunan tesis ini.
Terimakasih kepada Prof Dr drh Maria Bintang, MS selaku ketua program studi S2 Biokimia. Penulis juga mengucapkan terima kasih kepada Dr Ir Bambang Sunarko sebagai Kepala Pusat Penelitian Bioteknologi LIPI yang sudah mengijinkan penulis untuk melakukan penelitian di Laboratorium Aplikasi Rekayasa Genetika dan Desain Protein, Pusat Penelitian Bioteknologi-Lembaga Ilmu Pengetahuan Indonesia (LIPI).
Penelitian ini didanai oleh LIPI melalui mekanisme hibah bersaing kompetitif LIPI 2014. Tidak lupa juga terima kasih penulis ucapkan kepada keluarga, teman-teman Laboratorium Aplikasi Rekayasa Genetika dan Desain Protein, Bioteknologi-LIPI, teman-teman SPs IPB program studi Biokimia 2013/2014 yang selalu mendukung penulis.
Penyusunan tesis ini tentunya tidak terlepas dari kekurangan. Oleh karena itu, penulis mengharapkan adanya saran dan kritik yang bersifat membangun untuk menyempurnakan penyusunan tesis ini. Semoga hasil penelitian ini dapat bermanfaat bagi kemajuan ilmu pengetahuan.
Bogor, Juni 2015
DAFTAR ISI
DAFTAR GAMBAR vi
DAFTAR TABEL vi
DAFTAR LAMPIRAN vii
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Hipotesis 2
2 METODOLOGI 3
Waktu dan Tempat 3
Bahan 3
Alat 3
Prosedur Penelitian 3
3 HASIL DAN PEMBAHASAN 8
Pengukuran Biomassa dan Produksi Bakteriosin 8
Karakterisasi Plantarisin U10 10
Purifikasi Plantarisin U10 13
Aktivitas Inhibisi 15
Mekanisme Aksi Plantarisin 16
Deteksi Gen Penyandi Plantarisin 17
4 SIMPULAN DAN SARAN 18
Simpulan 18
Saran 18
5 DAFTAR PUSTAKA 19
LAMPIRAN 25
DAFTAR GAMBAR
1 Produksi bakteriosin selama pertumbuhan L. plantarum U10 9 2 Persentase inhibisi dan konsentrasi protein plantarisin U10
terhadap S. typhi ATCC25241 10
3 Aktivitas plantarisin U10 setelah diperlakukan dengan
berbagai suhu dan variasi waktu pemanasan 11
4 Aktivitas plantarisin U10 setelah diperlakukan dengan
berbagai kondisi pH 12
5 Aktivitas plantarisin U10 setelah diperlakukan dengan
berbagai enzim dan surfaktan 12
6 Profil fraksinasi pemurnian plantarisin U10 dengan Sephadex-G50 14 7 Profil pemisahan plantarisin U10 dengan SDS-PAGE 15 8 Mekanisme aksi plantarisin U10 terhadap S. typhi ATCC25241 16 9 Perubahan morfologi sel yang disebabkan oleh plantarisin U10 17
DAFTAR TABEL
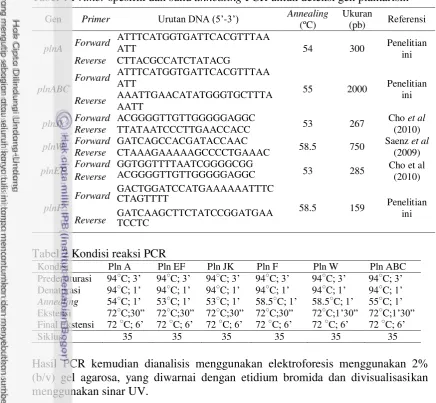
1 Primer spesifik dan kondisi PCR untuk deteksi gen plantarisin 8
2 Kondisi reaksi PCR 8
3 Ringkasan pemurnian plantarisin U10 15
vii
DAFTAR LAMPIRAN
1 Tabel Penggunaan Padatan Ammonium Sulfat (% penjenuhan) 26 2 Komposisi Media Nutrien Broth 27 3 Komposisi Median Nutrient Agar 27
4 Kandungan Media MRS 27
5 Komposisi Gel SDS-PAGE (akrilamid 16%) 27 6 Komposisi Larutan Elektroforesis SDS-PAGE 28
7 Komposisi Reagen BCA Assay 28
8 Komposisi bufer fosfat (pH 7.2) 28
9 Komposisi Larutan Silver Staining 29
10 Contoh Perhitungan AU 29
11 Komposisi Buffer TBE 500 mL 10x 29 12 Komposisi Mix Dream Taq PCR (10 µ L) 30 13 Hasil deteksi gen penyandi plantarisin 30 14 Pengukuran OD 600 nm saat mekanisme aksi plantarisin U10 31 15 Jumlah koloni bakteri (CFU) saat mekanisme aksi 31 16 Log CFU saat mekanisme aksi 32
17 Karakterisasi suhu plantarisin U10 32
18 Karakterisasi pH plantarisin U10 33
19 Karakterisasi terhadap Enzim dan Surfaktan 33 20 Kadar protein selama pertumbuhan U10 33
21 Kurva standar BSA saat pertumbuhan U10 34
22 Persentase inhibisi plantarisin terhadap S. typhi ATCC25241 34 23 Absorbansi 280 nm hasil pemurnian Sephadex-G50 35
24 Kurva standar Rf SDS-PAGE 35
25 Perhitungan Bobot Molekul Protein 36
26 Uji t OD 600 nm perlakuan dan kontrol 37 27 Uji t Log CFU bakteri S. typhi perlakuan dan kontrol 38 28 ANOVA dan uji Duncan karakterisasi suhu, pH, enzim 39
dan surfaktan terhadap aktivitas bakteriosin
29 ANOVA dan uji Duncan konsentrasi protein selama pertumbuhan 40
1 PENDAHULUAN
Latar Belakang
Penyakit demam tifoid merupakan suatu penyakit sistemik akut yang disebabkan oleh infeksi bakteri Salmonella typhi. Penyakit ini menjadi masalah kesehatan dunia terutama negara berkembang. Perkiraan jumlah kasus demam tifoid di dunia lebih dari 21.6 juta kasus dengan angka kematian sebesar 216.000 jiwa, serta lebih dari 90% terjadi di Asia. Diperkirakan kasus demam tifoid di Indonesia adalah 180 kasus dari setiap 100.000 penduduk pertahun, dan umumnya terjadi pada anak usia 5-15 tahun (Ochiai et al. 2008). Jumlah kasus demam tifoid dan paratifoid pada tahun 2009 di rumah sakit adalah 80.850 penderita rawat inap dengan 1.013 jiwa diantaranya meninggal dunia. Sedangkan pada tahun 2010 penderita demam tifoid dan paratifoid adalah 41.081 kasus pada penderita rawat inap dengan 276 jiwa diantaranya meninggal dunia (Depkes RI 2010).
Pengobatan demam tifoid umumnya dengan menggunakan berbagai macam antibiotik misalnya ampisilin, kloramfenikol, dan tetrasiklin. Selain itu dapat juga dengan menggunakan fluoroquinolones (ciprofloxacin), dan generasi ketiga sefalosporin (ceftriaxone, cefotaxime) (WHO 2003). Namun, telah dilaporkan adanya resistensi bakteri S. typhi terhadap berbagai obat antibiotik (multi drug resistance). Di Indonesia telah dilaporkan terdapat 37.5 % strain S. typhi yang mengalami multidrug resistance (Yanagi et al. 2009). Dari tahun 1999-2011 resistensi bakteri S. typhi terhadap antibiotik ciprofloxacin mengalami peningkatan dengan jumlah 3.800 kasus di tahun 2011 (US. Health Department, 2013). Oleh karena itu, diperlukan alternatif lain untuk mengatasi demam tifoid yang tidak menginduksi terjadinya resistensi pada S. typhi.
Salah satu cara menanggulangi demam tifoid adalah dengan senyawa peptida yang memiliki sifat antimikroba. Peptida antimikroba ini dianggap sebagai antibiotik endogen yang berasal dari tumbuhan dan hewan. Secara umum, peptida antimikroba berfungsi untuk menghalau mikroorganisme lain dan mencegah terjadinya infeksi (Cederlund et al. 2011). Efektivitas penghambatan pertumbuhan bakteri S. typhi telah diketahui dari beberapa penelitian diantaranya adalah penggunaan daun beluntas (Ardiansyah, 2005) dan cacing tanah (Nurwati, 2006).
Pemanfaatan sumber daya alam berbasis lokal (Indegenous Indonesia) untuk menangani demam tifoid sudah mulai dikembangkan. Diantaranya adalah pemanfaatan bakteri asam laktat (BAL) yang sudah berhasil diisolasi dari makanan fermentasi buah durian yaitu tempoyak, merupakan makanan khas Indonesia yang terdapat di Sumatera dan Kalimantan yang mengandung bakteri L. plantarum (Tiwari et al. 2008; Hata et al. 2010; Sankar et al. 2012).
L. plantarum U10 hasil isolasi dari makanan fermentasi tempoyak memiliki potensi untuk menghambat bakteri patogen E. coli (NBRC 14237), S. aureus
(NBRC 13276), S.typhi (P2KIM colection), Bacillus subtilis (BTCC 612), dan
Listeria monocytogenesis (BTCC B693) (Urnemi et al. 2010). Plantarisin juga mampu menghambat pertumbuhan fungi (Smaoi et al. 2010). Patricia et al. (2011), melaporkan adanya peptida antimikroba Snakin hasil isolasi tanaman kentang (Solanum tuberosum) yang juga memiliki aktivitas penghambatan terhadap bakteri Gram positif dan negatif. Selain itu Fujimura et al. (2010) juga melaporkan adanya peptida antimikroba AMP1 hasil isolasi dari tanaman bambu
(Phyllostachys pubescens) yang memiliki aktivitas penghambatan terhadap bakteri S. typhi, E. coli, dan S. aureus.
Plantarisin yang dihasilkan oleh L. plantarum U10 telah berhasil diisolasi. Namun, karakteristik dan mekanisme penghambatan terhadap bakteri S. typhi
serta gen penyandi peptida antibakteri dari plantarisin belum diketahui. Oleh karena itu, optimasi produksi, purifikasi dan karakterisasi dari plantarisin U10 perlu dilakukan guna mengetahui mekanisme aksi dari penghambatan plantarisin U10 terhadap S. typhi. Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah tentang karakteristik dari plantarisin L. plantarum U10 dan dapat memberikan sumbangan ilmu pengetahuan khususnya untuk mengatasi penyakit demam tifoid yang disebabkan oleh bakteri S. typhi.
Perumusan Masalah
Kejadian resistensi S. typhi terhadap antibiotik membutuhkan strategi lain untuk mengatasi demam tifoid tanpa menyebabkan resistensi. Plantarisin dari L. plantarum U10 diharapkan dapat menjadi antibakteri alternatif, namun metode purifikasi, karakterisasi dan mekanisme aksi dari plantarisin U10 belum diketahui. Oleh karena itu, perlu dilakukan penelitian mengenai purifikasi, karakterisasi, dan mekanisme aksi plantarisin U10 agar dapat digunakan sebagai antibakteri terhadap S. typhi.
Tujuan Penelitian
Penelitian ini bertujuan memurnikan plantarisin, mengkarakterisasi terhadap suhu, pH, enzim dan surfaktan terhadap kestabilan aktivitas dan mengetahui mekanisme aksi penghambatan plantarisin dari L. plantarum U10 sebagai peptida antibakteri terhadap S. typhi.
Hipotesis
3
2 METODOLOGI
Waktu dan Tempat
Penelitian dilakukan pada September 2014 - April 2015 di Laboratorium Rekayasa Genetika Terapan dan Desain Protein, Pusat Penelitian Bioteknologi-LIPI, Cibinong.
Bahan
Bahan yang digunakan dalam penelitian ini adalah Lactobacillus plantarum
U10 (koleksi Pusat Penelitian Bioteknologi LIPI Cibinong), MRS (media de Man, Rogosa, Sharpe) (Oxoid), pepton bakteriologis (Oxoid), bakteri S. typhi
ATCC25241, sodium klorida (NaCl) (Merck), NaOH (Merck), natrium azida (Merck), amonium sulfat (Merck), buffer potassium fosfat, silver stain kit
(Fermentas), imidazole (Bio Basic Inc.), tris-aminometana (Merck), kloramfenikol (Gold Bio), sephadex-G50 (GE Healtcare), urea (MP Biomedicals), HCl (Merck), NaOH (Merck), tris-HCl (Bio Basic Inc.), merkaptoetanol (MP Biomedicals), EDTA (Ethylenediaminetetraacetic acid) (Bio-Rad), Triton-X (MP Biomedicals), gliserol (Sigma), proteinase-K (Invitrogen), katalase (Invitrogen), pepsin (Sigma), lisozim (Sigma), BCA protein assay kit (PierceTM 23225), TBC (tetrazolium blue chloride) (Sigma), sukrosa (Caisson Labs), Sodium Dodesil Sulfat (SDS) (Sigma), metanol (Merck), etanol (Merck), asam asetat glasial (Merck), TEMED (Sigma), akrilamid (Bio Basic Inc), amonium persulfat (APS) (MP Biomedicals), alkohol teknis, DNA Leader Gene Ruler 1 kb (Thermo Scientific), SpectraTM Multicolor Low Range Protein Ladder (Thermo Scientific), dan akuades steril.
Alat
Alat yang digunakan dalam penelitian ini adalah sentrifus (Hermle), set elektroforator SDS PAGE (ATTO), shaker inkubator (N-Biotek Inc.), inkubator (Firlabo), rocker (N-Biotek Inc.) Laminar Air Flow (ESCO), pH meter (Eutech Instruments), neraca analitik (ACIS), microplate 96-well (Apogent), ELISA
reader (Thermo multiscan ex), stirer (Cimarec), magnetic stirer (Scienceware), vorteks (Barnstead), capsulefuge (Tomy), mikropipet (Gilson), tip (Axygen), tabung sentrifus (Corning), dan alat-alat gelas lainnya (Pyrex).
Prosedur Penelitian Optimasi Pertumbuhan L. plantarum U10
Optimasi pertumbuhan plantarisin dilakukan dengan menambahkan sebanyak 1% bakteri L. plantarum U10 dari total media pertumbuhan MRS broth
AU = Sampel mL � ⁄n
Keterangan :
n = faktor pengenceran
sampel berupa supernatant hasil pertumbuhan dari L. plantarum U10 yang telah mengalami pengenceran berseri dari 2 kali pengenceran sampai tidak terbentuk lagi zona bening yang dihasilkan. Hasil pengenceran yang masih menghasilkan zona bening adalah nilai dari faktor pengenceran (n).
Uji Aktivitas Plantarisin terhadap Bakteri Uji
Aktivitas penghambatan antibakteri dievaluasi secara kualitatif dan kuantitatif. Pengukuran aktivitas antibakteri secara kualitatif dilakukan berdasarkan metode difusi agar (Arief et al. 2013). Strain bakteri uji yang digunakan adalah S. typhi ATCC25241. Sebanyak 25 µ L sampel diteteskan kedalam sumuran (diameter 6 mm) pada media nutrient agar yang telah mengandung 108 CFU/mL bakteri uji. Bakteri uji yang digunakan merupakan kultur segar yang telah ditumbuhkan pada media nutrient broth (NB) selama satu malam. Kemudian petri diinkubasi pada suhu 37 ºC selama 6 jam. Aktivitas inhibisi diamati dengan adanya zona bening setiap dua jam, dan diameter dari zona bening diukur. Zona bening yang terbentuk di sekitar area sumur menandakan bahwa plantarisin mampu menghambat bakteri S. typhi ATCC25241. Aktivitas inhibisi terhadap bakteri indikator dilakukan secara kuantitatif menggunakan metode uji micro dilution (EUCAST 2003). Sehari sebelum digunakan, isolat bakteri indikator ditumbuhkan dalam media NB 5 mL pada suhu 37 ºC selama ±16 jam. Sebanyak 50 µ L sampel ditambahkan pada microplate96 well yang telah mengandung 100 µ L suspensi bakteri dengan konsentrasi 5 x 105 CFU/mL kemudian diinkubasi pada suhu 37 ºC, 150 rpm selama 24 jam. Setelah 24 jam ditambahkan 50 µL TBC (tetrazolium blue chloride) (2.5 mg/mL) kemudian diinkubasi pada suhu 37 ºC selama 30 menit. Absorbansi dibaca pada panjang gelombang 540 nm (Kregiel et al. 2008). Rumus perhitungan persentase inhibisi adalah sebagai berikut:
% ��ℎ����� = �� �� �� ��� − �� �� �� ��
� �� �� �� � %
Isolasi dan Purifikasi Plantarisin (Xie et al. 2011 modifikasi)
5
Supernatan hasil pengendapan disentrifugasi dengan kecepatan 12.000 g selama 15 menit pada suhu 4 °C sehingga didapatkan presipitat bakteriosin. Pelet diresuspensi menggunakan buffer Tris HCl 10 mM pH 7.4 (Xie et al. 2011). Aktivitas inhibisi pelet diuji menggunakan metode difusi agar. Permunian protein lebih lanjut dilakukan menggunakan kolom filtrasi gel dengan Sephadex G-50 (GE Healtcare, Sweden). Pelet dimasukkan dalam kolom filtrasi gel, kemudian dielusi menggunakan eluen buffer fosfat pH 7.2 dengan kecepatan laju alir 1 mL/menit. Seluruh tahap ini dilakukan pada suhu 4 °C. Hasil fraksi ditampung dalam tabung penampung, kemudian dilakukan uji aktivitas dengan metode difusi agar dan micro dilution. Beberapa fraksi yang memiliki aktivitas inhibisi yang tinggi ditentukan bobot molekulnya dengan Sodium Dedosyl Sulfate Polyacrilamide Gel Electrophoresis (SDS PAGE).
Karakterisasi Plantarisin
Uji Kestabilan pH (Xie et al. 2011)
Supernatan bebas sel diuji dengan pH gradien 2-12 (dengan rentang 2) menggunakan NaOH 1N atau HCl 1N, kemudian diinkubasi pada suhu 37 °C selama 2 jam. Setelah diinkubasi semua sampel dinetralkan menjadi pH 6.5. Aktivitas penghambatannya terhadap bakteri S. typhi ATCC25241 diuji menggunakan metode difusi agar (Arief et al. 2013).
Uji Kestabilan Suhu (Xie et al. 2011)
Supernatan bebas sel pH 6.5 dan diberi perlakuan dengan katalase diuji dalam beberapa suhu pemanasan, yaitu 40, 60, 80, 100°C masing-masing selama 10, 30, dan 60 menit sedangkan suhu 121 °C selama 15 menit. Setelah diinkubasi selama 2 jam semua sampel diuji aktivitas penghambatannya terhadap bakteri S. typhi ATCC25241 menggunakan metode difusi agar.
Uji Kestabilan Enzim (Xie et al. 2011)
Supernatan bebas sel ditambahkan dengan masing-masing (1 mg/mL) enzim proteinase-K, katalase, pepsin, dan lisozim. Kemudian diinkubasi selama 60 menit pada suhu 37 oC (Savadogo et al., 2004). Aktivitas enzim pada plantarisin dihentikan dengan pemanasan pada 80 °C selama 5 menit. Aktivitas penghambatan plantarisin terhadap S. typhi ATCC25241 diuji menggunakan metode difusi agar.
Uji Kestabilan Surfaktan (Xie et al. 2011)
Supernatan bebas sel diuji aktivitasnya terhadap penambahan masing-masing (1% v/v) SDS, urea, Triton X-100, PMSF dan EDTA yang diinkubasi pada suhu 37 °C selama 2 jam. Selanjutnya, aktivitas penghambatan plantarisin U10 terhadap S. typhi ATCC25241 diuji menggunakan metode difusi agar.
Karakterisasi Bobot Molekul (Laemmli 1970)
selesai, dilakukan pewarnaan gel menggunakan silver staining kit (Fermentas
Silver Stain Kit). Gel hasil elektroforesis lalu dicuci dengan akuades steril selama 5 menit sebanyak 2 kali, kemudian dilakukan fiksasi menggunakan fixing solution 1 selama 60 menit dilanjutkan dengan gel fixing 2 dan dicuci menggunakan aquades steril selama 20 detik sebanyak 2 kali. Gel disensitifkan dengan larutan
sensitizer selama 1 menit dan dicuci dengan akuades steril selama 20 detik sebanyak 2 kali. Kemudian direndam dalam larutan yang mengandung Etanol : asam asetat : air (3:1:6) selama 15 menit sebanyak 2 kali. Pewarnaan dilakukan dengan merendam gel pada larutan stain selama 20 menit, kemudiaan dicuci selama 20 detik dengan akuades steril sebanyak 2 kali. Pita pada gel terbentuk setelah merendam gel pada larutan developer selama 5-10 menit atau hingga pita muncul. Setelah pita protein muncul, reaksi dihentikan dengan menambahkan larutan stop selama 10 menit.
Pita-pita protein yang muncul dan hasil SDS-PAGE dihitung retardation faktor (Rf) dengan menggunakan rumus (Cavalli et al. 2006):
Rf = jarak pergerakan pita protein dari tempat awaljarak pergerakan marker dari tempat awal
Berdasarkan nilai Rf, berat molekul dihitung dengan persamaan regrasi logaritma dengan rumus: y = ( a x Ln(X)) + b. Persamaan ini diperoleh dari grafik antar Log BM sebagai ordinat dan Rf sebagai absis. Berdasarkan kurva kalibrasi maka dapat dihitung BM masing-masing pita protein.
Keterangan : y : berat molekul X : nilai Rf sampel a : nilai koefisien b : nilai konstanta
Penentuan Konsentrasi Protein (Pierce Biotechnology 2013)
Penetuan konsentrasi protein menggunakan bicinchoninic acid (BCA) kit dengan BSA (bovine serum albumin) sebagai standar protein. Konsentrasi BSA yang digunakan sebagai standar yaitu 2000 g/ml, 1500 g/ml, 1000 g/ml, 750
g/ml, 500 g/ml, 250 g/ml, 125 g/ml, dan 25 g/ml. Working reaction dibuat dengan mencampurkan reagen A dan B dengan perbandingan 50 : 1. Selanjutnya sampel dan working reaction dimasukkan dalam microplate 96-well dengan perbandingan sampel : reagen (1 : 20). Microplate 96-well kemudian diinkubasi pada suhu 37 °C selama 30 menit, kemudian hasil reaksi dibaca pada panjang gelombang 540 nm dengan menggunakan ELISA reader.
Mekanisme Aksi (Xie et al. 2011)
7
dilakukan setiap 2 jam untuk melihat OD, dan jumlah koloni yang tumbuh (CFU/mL) setelah diberikan plantarisin.
SEM (Scanning Electron Microscopy) (Hyo et al. 2012)
Analisis perubahan morfologi sel dilakukan untuk mengetahui perubahan struktur sel setelah diberi perlakuan plantarisin U10 yang meliputi kerusakan morfologi sel dan struktur bakteri, seperti kerusakan dinding sel. Mekanisme aksi dari plantarisin U10 terhadap S. typhi ATCC25241 dilakukan dengan mensuspensikan plantarisin U10 ke dalam kultur sel S. typhi ATCC25241 kemudian diinkubasi pada suhu 37 ºC. Larutan disentrifugasi 10 000 g, supernatan dibuang, kemudian pelet ditambahkan dengan glutaraldehid 2% dan direndam beberapa jam selanjutnya disentrifugasi dan supernatan dibuang. Pelet direndam kembali dengan larutan tannin acid 2% beberapa jam, selanjutnya disentrifugasi kembali dan pelet direndam dengan larutan cocodylate buffer selama 20 menit. Larutan disentrifugasi kembali, pelet ditambahkan osmium tetra oksida 1% dan direndam selama 1 jam. Larutan disentrifugasi, supernatan dibuang, dan pellet ditambahkan alkohol 70%, 80%, dan 95% masing-masing 20 menit. Larutan disentrifugasi kembali, alkohol dibuang, ditambahkan butanol dan direndam 20 menit, kemudian disentrifugasi, butanol dibuang. Kemudian oleskan apusan sel diatas potongan bujur sangkar cover slip (slip glas) dan dikeringkan dengan butanol. Slip glas yang telah diolesi dengan sel tersebut diletakkan pada stub alumunium untk dilapisi dengan emas menggunakan ion coater selama 1 jam pada kondisi vakum. Kemudian diamati dengan alat Scanning Electron Microscope tipe JEOL seri JSM-5310 LV dengan pembesaran 10.000 kali.
Isolasi Genom (Zhu et al. 1993)
DNA genom dari L. plantarum U10 diisolasi dalam skala kecil. Sebanyak 5 mL kultur ditumbuhkan di media MRS broth (Oxoid) pada suhu 37 ºC. Lalu disentrifugasi pada 10.000 g selama 10 menit. Pelet yang terbentuk diresuspensi dengan 500 µ L buffer TE (10 mM Tris-HCl pH 8.0, 1 mM EDTA) yang mengandung 60 mg/mL lisozim dan kemudian diinkubasi pada 37 oC selama 60 menit. Larutan ditambahkan 200 µL SDS 10%, 100 µ L 5M natrium klorida dan 80 µ L CTAB 10%. Campuran kemudian diinkubasi pada 68 ºC selama 30 menit, ditambahkan kloroform 1 : 1 (v/v). Lalu disentrifugasi 13.000 rpm selama 10 menit. Supernatan dikumpulkan dan ditambahkan etanol 1 : 1 (v/v) kemudian disentrifugasi pada 13.000 rpm selama 10 menit. Pelet DNA akan terendap di dasar tabung, supernatan dibuang secara perlahan agar pelet tidak ikut terbuang. Pelet yang mengandung DNA dilarutkan dalam 30 µL buffer yang mengandung 27 µ L ddH2O
dan 3 µ L RNAse dan disimpan dalam -20 ºC. DNA yang diperoleh dielektroforesis menggunakan gel agarosa 0.8% pada tegangan 100 V selama 45 menit serta diukur absorbansinya pada panjang gelombang 260 dan 280 nm. DNA yang diperoleh digunakan sebagai cetakan untuk mendeteksi gen plantarisin dengan primer spesifik.
Deteksi Gen Penyandi Plantarisin
Tabel 1 Primer spesifik dan suhu annealing PCR untuk deteksi gen plantarisin
plnW Forward GATCAGCCACGATACCAAC 58.5 750 Saenz et al (2009)
Tabel 2 Kondisi reaksi PCR
Kondisi Pln A Pln EF Pln JK Pln F Pln W Pln ABC
Hasil PCR kemudian dianalisis menggunakan elektroforesis menggunakan 2% (b/v) gel agarosa, yang diwarnai dengan etidium bromida dan divisualisasikan menggunakan sinar UV.
3 HASIL DAN PEMBAHASAN
Pengukuran Kerapatan Sel dan Produksi Bakteriosin
L. plantarum U10 dapat tumbuh dengan baik dalam media MRS broth
dengan suhu 37 ○C (Mahrous et al. 2013). Komposisi media MRS broth terdiri atas pepton (10 g/L), meat extract (8 g/L), dan yeast extract (4 g/L) sebagai sumber vitamin serta asam amino esensial yang mendukung pertumbuhan bakteri, glukosa (20 g/L) sebagai sumber karbon, mangan sulfat (0.05 g/L) dan magnesium sulfat (0.2 g/L) sebagai sumber kation, triamonium sitrat (2 g/L), dipotasium hidrogen fosfat (2 g/L), dan sorbitan mono oleat (1 mL) (Sharpe et al.
1966).
9
akhir kultivasi pada periode yang sama. Kondisi asam yang terjadi disebabkan oleh adanya asam-asam organik diantaranya asam laktat yang merupakan metabolit primer bakteri asam laktat. L. plantarum U10 merupakan bakteri asam laktat homofermentatif yang hanya menghasilkan asam laktat dari proses fermentasi karbohidrat (Kuipers et al. 2000).
Produksi plantarisin U10 dimulai pada fase eksponensial awal dan mencapai nilai maksimum (800 AU/mL) setelah inkubasi 20 jam (fase stasioner) yaitu saat OD optimal (3.6). Hasil penelitian ini sejalan dengan beberapa penelitian sebelumnya yang telah dilakukan pada plantarisin LB-B1 (Xie et al. 2011), plantarisin MG (Gong et al. 2010), bakteriosin La-14 (Todorov et al. 2011), plantarisin ST194BZ (Todorov et al. 2005), dan plantarisin ST71KS (Martinez et al. 2013).
Gambar 1 Produksi bakteriosin selama pertumbuhan L. plantarum U10. ─●─
kerapatan sel (OD 600 nm); ─▲─ perubahan pH media; █ aktivitas unit plantarisin U10 (AU/mL).
Menurut Boe (1996), meningkatnya jumlah sel menyebabkan jumlah bakteriosin yang diproduksi akan meningkat, kemudian menurun setelah mencapai akhir fase stasioner. Sedangkan penurunan aktivitas terjadi setelah fase stasioner ini dikarenakan terdegradasinya plantarisin U10 oleh enzim proteolitik yang dikeluarkan selama proses pertumbuhan (Gong et al. 2010). Peningkatan kerapatan sel yang terbentuk mengakibatkan peningkatan asam laktat yang dihasilkan. Hal ini menyebabkan penurunan pH supernatan yang dihasilkan (Vuyst dan Leroy, 2007). Hal ini juga terjadi pada bakteriosin ST13BR yang dihasilkan oleh L. plantarum ST13BR (Todorov et al. 2004).
Konsentrasi protein ditentukan dengan uji asam bicinchoninat
(BCA-bicinchoninic acid assay). BCA merupakan metode yang banyak digunakan untuk menentukan konsentrasi protein. BCA mudah digunakan, sensitifitasnya tinggi, dan toleran terhadap senyawa pengganggu. Uji ini didasarkan pada dua reaksi kimia. Reaksi pertama adalah reduksi ion Cu2+ menjadi ion Cu+ oleh ikatan peptida dalam kondisi alkali (reaksi biuret). BCA dikenal sebgai reaksi biuret karena bentuk kompleksnya serupa dengan senyawa biuret organik (NH2
Reaksi kedua adalah satu ion Cu+ yang terbentuk pada langkah awal dikelat dengan dua molekul BCA sehingga menghasilkan kompleks warna yang berwarna ungu (Huang, 2010). Warna yang terbentuk menunjukkan absorbansi linier yang kuat pada 562 nm dengan meningkatnya konsentrasi protein. Warna ungu memungkinkan dapat diukur pada setiap gelombang antara 540 - 570 nm. Reagen BCA 100 kali lebih sensitif dibanding reagen biuret (Olsen BJ dan Markwell J, 2007).
Gambar 2 Persentase inhibisi plantarisin U10 terhadap S. typhi ATCC25241 dan konsentrasi protein (mg/mL) yang dihasilkan selama pertumbuhan L. plantarum U10.─■─ persen inhibisi; ▓ konsentrasi protein.
Konsentrasi protein mengalami peningkatan selama masa pertumbuhan L. plantarum U10. Dimulai pada fase eksponensial dengan konsentrasi awal 1.36 mg/mL dan mencapai konsentrasi tertinggi pada lama inkubasi 20 jam (12.06 mg/mL) dengan persentase inhibisi terhadap S. typhi ATCC25241 sebesar 57.80%. Persentase inhibisi semakin meningkat seiring dengan bertambahnya konsentrasi protein yang terbentuk, dan menurun setelah inkubasi 20 jam (Gambar 2).
Karakterisasi Plantarisin U10
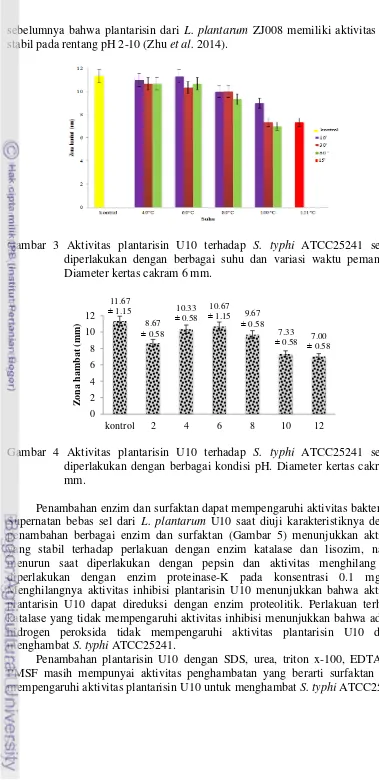
Plantarisin yang dihasilkan dari L. plantarum U10 mempunyai sifat stabil terhadap pemanasan, hal ini ditunjukkan oleh kemampuannya mempertahankan aktivitas penghambatan terhadap bakteri S. typhi ATCC25241 setelah dipanaskan hingga suhu 121 ºC selama 15 menit. Sejalan dengan pernyataan Hata et al. (2010) yang menyatakan bahwa plantarisin ASM1 stabil pada pemanasan 90 °C selama 15 menit yang menunjukkan zona hambat hampir sama jika dibandingkan dengan bakteriosin yang tidak dipanaskan (Gambar 3). Hasil serupa juga telah dilaporkan pada bakteriosin yang dihasilkan oleh L. plantarum F1 dan L. brevis
OG1 dengan pemanasan 100 °C selama 30 menit dan 121 °C selama 15 menit (Ogunbanwo et al. 2003; Todorov dan Dicks, 2005; Todorov et al. 2007).
11
sebelumnya bahwa plantarisin dari L. plantarum ZJ008 memiliki aktivitas yang stabil pada rentang pH 2-10 (Zhu et al. 2014).
Gambar 3 Aktivitas plantarisin U10 terhadap S. typhi ATCC25241 setelah diperlakukan dengan berbagai suhu dan variasi waktu pemanasan. Diameter kertas cakram 6 mm.
Gambar 4 Aktivitas plantarisin U10 terhadap S. typhi ATCC25241 setelah diperlakukan dengan berbagai kondisi pH. Diameter kertas cakram 6 mm.
Penambahan enzim dan surfaktan dapat mempengaruhi aktivitas bakteriosin. Supernatan bebas sel dari L. plantarum U10 saat diuji karakteristiknya dengan penambahan berbagai enzim dan surfaktan (Gambar 5) menunjukkan aktivitas yang stabil terhadap perlakuan dengan enzim katalase dan lisozim, namun menurun saat diperlakukan dengan pepsin dan aktivitas menghilang saat diperlakukan dengan enzim proteinase-K pada konsentrasi 0.1 mg/mL. Menghilangnya aktivitas inhibisi plantarisin U10 menunjukkan bahwa aktivitas plantarisin U10 dapat direduksi dengan enzim proteolitik. Perlakuan terhadap katalase yang tidak mempengaruhi aktivitas inhibisi menunjukkan bahwa adanya hidrogen peroksida tidak mempengaruhi aktivitas plantarisin U10 dalam menghambat S. typhi ATCC25241.
11.33
Penambahan EDTA dan PMSF dapat meningkatkan aktivitas bakteriosin karena EDTA memiliki aktivitas antimikroba terutama terhadap bakteri Gram negatif dengan cara mengganggu struktur membran luar dan memberi akses kepada molekul hidrofobik untuk masuk ke dalam membran sitoplasma (Hamouda dan Beker, 2000). Aktivitas yang sama juga ditunjukkan oleh bakteriosin L171 (Kumari et al. 2012), bakteriosin AMA-K (Todorov et al. 2007), dan bakteriosin yang dihasilkan dari susu sapi (Sankar et al. 2012) yang aktivitasnya stabil terhadap surfaktan dan enzim proteolitik.
Triton x-100 dan SDS sama-sama termasuk jenis detergen. Namun, sifat kedua detergen tersebut berbeda. SDS tergolong ke dalam detergen yang bersifat ionik sedangkan triton x-100 tergolong ke dalam detergen non-ionik (Chae et al.
2010). SDS merupakan detergen yang mampu mengganggu ikatan kovalen protein sehingga protein terdenaturasi dan kehilangan konformasi asli serta fungsi dari protein tersebut. Uji sensitivitas bakteriosin terhadap enzim proteolitik menunjukkan tingkat kesensitifan yang cukup berarti terhadap bakteri uji. Hasil uji lanjut menggunakan uji Duncan, diameter zona hambat bakteriosin dengan perlakuan enzim proteolitik terhadap S. typhi ATCC25241 menunjukkan hasil yang berbeda nyata dengan kontrol.
Gambar 5 Aktivitas plantarisin U10 terhadap S. typhi ATCC25241 setelah diperlakukan dengan berbagai enzim dan surfaktan. Diameter kertas cakram 6 mm.
Karakterisasi bakteriosin terhadap enzim katalase bertujuan untuk memastikan bahwa komponen aktif yang menghambat bakteri uji adalah komponen bakteriosin yang terkandung di dalam supernatan dan bukan oleh komponen antimikroba lainnya, terutama hidrogen peroksida (H2O2). Bakteri
asam laktat memproduksi hidrogen peroksida dalam kondisi pertumbuhan yang aerob dan karena berkurangnya produksi katalase selular, pseudokatalase atau peroksidase. Bakteri asam laktat mengekskresikan H2O2 tersebut sebagai alat
13
penghambatan terhadap bakteri uji. Hal tersebut berarti bahwa komponen aktif yang menunjukkan aktivitas pada uji antagonistik dari bakteriosin U10 dengan perlakuan enzim katalase kemungkinan memang berasal dari bakteriosin.
Pepsin (EC 3.4.23) adalah suatu enzim yang berguna untuk memecah molekul protein menjadi molekul yang lebih kecil yaitu pepton dan proteosa. Enzim ini dihasilkan oleh sel-sel utama lambung dalam bentuk pepsinogen, yaitu calon enzim yang belum aktif. Pepsinogen ini kemudian diubah menjadi pepsin yang aktif dengan adanya HCl. Enzim pepsin menghidrolisis ikatan peptida protein pada sisi karboksil tirosin, fenilalanin, triptofan, dan leusin (Keil, 1992).
Enzim pepsin hanya dapat menginaktifkan sebagian aktivitas bakteriosin U10 diduga karena pengaruh pH 6.5 dari bakteriosin itu sendiri yang dapat menurunkan kerja enzim pepsin. Enzim pepsin menjadi kurang aktif karena berada pada pH 6.5. Oleh karena itu, seharusnya bakteriosin tidak dikondisikan pada pH 6.5 terlebih dahulu atau masih berada pada kondisi pH asam ketika perlakuan dengan enzim pepsin. Hal tersebut dimaksudkan agar tidak mengganggu aktivitas enzim pepsin untuk menghidrolisis komponen protein di dalam bakteriosin U10. Setelah itu, perlu dilakukan pengkondisian bakteriosin U10 dengan perlakuan enzim pepsin pada pH netral sebelum dilakukan uji antagonistik terhadap bakteri uji untuk menghindari pengaruh komponen asam dari campuran keduanya.
Penurunan diameter zona bening yang dihasilkan oleh plantarisin setelah diberi perlakuan enzim proteinase-K terhadap S. typhi menunjukkan bahwa aktivitas bakteriosin U10 dapat didegradasi oleh enzim proteinase-K, karena enzim proteinase-K memotong pada residu asam amino aromatik dan alanin (Keil, 1992). Dapat didegradasinya aktivitas plantarisin oleh enzim proteolitik mengindikasikan bahwa komponen tersebut adalah protein alami seperti yang telah dilaporkan pada bakteriosin dari L. plantarum ST194BZ (Todorov dan Dicks, 2005) dan bakteriosin PPK34 (Abrams et al, 2011).
Purifikasi Plantarisin
Supernatan yang diperoleh dari hasil kultivasi L. plantarum U10 sebanyak 300 mL dengan inkubasi selama 20 jam masih mengandung banyak protein lain selain plantarisin, sehingga harus dilakukan purifikasi lebih lanjut salah satunya menggunakan teknik presipitasi protein dengan ammonium sulfat. Tahap ini merupakan salah satu cara pengendapan protein dengan memanfaatkan perbedaan kelarutan. Efek pengendapan protein disebabkan oleh perubahan kecenderungan berdisosiasi gugus-gugus dalam protein. Bila konsentrasi garam netral yang ditambahkan ke dalam suatu protein dinaikan terus, maka kelarutan protein menjadi berkurang, dan sampai pada konsentrasi garam yang sangat tinggi maka protein akan mengalami pengendapan (Bintang, 2010). Sebelum dilakukan presipitasi dengan ammonium sulfat, supernatan dikondisikan pada pH 6.5. Hal ini dimaksudkan agar dapat memaksimumkan aktivitas antimikroba dari bakteriosin yang terbentuk dan juga diharapkan dapat mengurangi bahkan menghilangkan aktivitas antimikroba dari asam organik. Supernatan juga dipanaskan terlebih dahulu pada suhu 121 ○C selama 15 menit sebelum diendapkan dengan tujuan sebagai seleksi terhadap peptida yang tahan panas.
ammonium sulfat sebaiknya magnetic stirrer tidak boleh terlalu cepat agar tidak menimbulkan gelembung dan panas. Menurut Tokuyasu et al. (1996) pengendapan protein dengan ammonium sulfat merupakan cara terbaik untuk menjaga protein pada saat penyimpanan, selain itu amoium sufat juga memiliki kelarutan yang tinggi di air, tidak toksik, tidak mengganggu enzim, dan harganya murah.
Ekstrak bakteriosin menunjukkan jenis protein yang hidrofobik karena posisi endapan protein yang terpresipitasi berada melayang di bagian atas supernatan. Hal ini juga didukung oleh Abo-Amer (2007) yang menyatakan bahwa plantarisin AA135 mempunyai karakteristik protein yang hidrofobik. Selain itu, kebanyakan bakteriosin yang dihasilkan oleh bakteri asam laktat adalah berukuran kecil, tahan panas, termasuk peptida kationik dan mempunyai sifat hidrofobik (Jack et al. 1995; Savadogo et al. 2006). Bagian hidrofobik di dalam molekul bakteriosin merupakan hal yang diperlukan untuk aktivitasnya dalam menghambat bakteri sensitif karena inaktivasi mikroorganisme oleh bakteriosin tergantung pada interaksi hidrofobik antara sel-sel bakteri dengan molekul-molekul bakteriosin (Parada et al. 2007).
Gambar 6 Profil fraksinasi pemurnian plantarisin U10 dengan Sephadex-G50
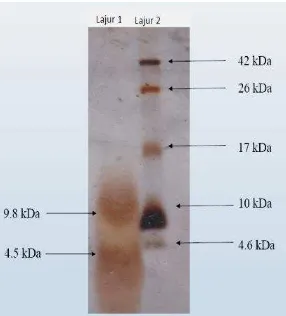
eluen buffer fosfat 0.2 M pH 7.2 pada panjang gelombang 280 nm. Hasil pengendapan dilanjutkan dengan filtrasi gel menggunakan Sephadex-G50 (Gambar 6) yang didapatkan 6 sampel fraksi dengan fraksi II (f10 & f11) yang memiliki aktivitas penghambatan tertinggi yang kemudian dilanjutkan dengan analisis SDS-PAGE 16%. SDS bersama merkaptoetanol digunakan untuk merusak struktur tiga dimensi protein. Hal ini terjadi akibat reduksi ikatan disulfida membentuk gugus sulfidril yang dapat mengikat SDS sehingga protein bermuatan negatif dan bergerak kearah kutub positif. Migrasi protein di dalam gel poliakrilamid ditentukan oleh muatan molekul dan juga dipengaruhi oleh ukuran molekul, sehingga dihasilkan pita-pita yang terbentuk menunjukkan keberadaan protein dan ukuran bobot molekulnya. Gambar 7 menunjukkan pita dari plantarisin U10 dengan ukuran berkisar 9.8 dan 4.5 kDa. Menurut Todorov (2009) bakteriosin kelas IIb memiliki bobot molekul ≤ 10 kDa dan bersifat tahan panas, plantarisin U10 juga menunjukkan aktivias yang stabil terhadap pemanasan 121
○C selama 15 menit (Gambar 3) oleh karena itu plantarisin U10 diperkirakan
termasuk dalam bakteriosin kelas II.
15
Gambar 7 Profil pemisahan plantarisin U10 dengan SDS-PAGE dan pewarnaan menggunakan Silver staining kit.
Tabel 3 Ringkasan pemurnian plantarisin U10
Tahapan Volume
Penentuan aktivitas inhibisi terhadap hasil pemurnian protein fraksinasi
Sephadex-G50 dilakukan secara kualitatif dengan metode difusi agar (Arief et al.
2013) dan secara kuantitatif menggunakan Tetrazolium Blue Chloride (TBC) dengan microdillution assay berdasarkan EUCAST (2003). Bakteri indikator yang digunakan adalah Salmonella typhi ATCC 25241 (Gram negatif) yang merupakan patogen yang menginfeksi saluran pencernaan dan penyebarannya melalu air maupun makanan (WHO 2003).
Aktivitas bakteriosin hasil pemurnian menggunakan Sephadex G50 terhadap bakteri indikator S. typhi ATCC25241 menunjukkan bahwa zona bening yang terbentuk adalah 2 mm dan termasuk dalam kategori lemah. Pan et al. (2009) menyatakan, terdapat tiga kategori aktivitas antimikrob yaitu lemah dengan diameter zona hambat 0 – 3 mm, baik dengan diameter zona hambat 3 – 6 mm, dan kuat dengan diameter lebih dari 6 mm. Penelitian sebelumnya juga menyatakan bahwa plantarisin memiliki aktivitas antimikroba yang lemah, namun memiliki aktivitas terhadap berbagai strain Gram positif dan negatif (Holo et al.
2001).
et al. 2013). Formazan yang dihasilkan berbanding lurus dengan jumlah sel yang aktif, sehingga dapat digunakan untuk mengukur viabilitas sel secara kuantitatif (Kregiel et al. 2008).
Mekanisme Aksi Plantarisin
Penambahan supernatan bebas sel dari L. plantarum U10 di jam ke-4 (fase eksponensial) dari pertumbuhan S. typhi ATCC25241 mengakibatkan terhambatnya pertumbuhan bakteri indikator (Gambar 8). Hal ini menunjukkan bahwa mekanisme aksi dari plantarisin U10 adalah bakterisidal yang dibuktikan dengan penurunan jumlah sel bakteri yang hidup dalam media (dari 2.2 x 108 CFU/mLmenjadi 3.1 x 106 CFU/mL).
Gambar 8 Mekanisme aksi plantarisin U10 terhadap S. typhi ATCC25241. ■ jumlah Log CFU/mL S. typhi dengan penambahan plantarisin; □ tanpa penambahan plantarisin; ▲ OD600 dengan penambahan plantarisin dan
∆ tanpa penambahan plantarisin. Tanda panah menunjukkan waktu penambahan plantarisin.
Mekanisme aksi yang serupa juga telah dilaporkan dari penelitian lain, seperti plantarisin LB-B1 (Xie et al. 2011), bakteriosin ST4Sa (Todorov, 2009) dan bakteriosin La-14 (Todorov et al. 2011). Umumnya, bakteriosin yang dihasilkan oleh bakteri Gram-positif tidak memiliki efek bakterisidal pada spesies Gram-negatif. Namun, dalam beberapa kasus, aktivitas bakteriosin terhadap beberapa bakteri Gram-negatif menunjukan hasil yang positif (Wang et al. 2014) dan Abo-amer et al (2007) juga melaporkan bahwa bakteriosin dari L. plantarum
dapat menghambat bakteri S. typhimurium, Pseudomonas aeruginosa, dan E. coli.
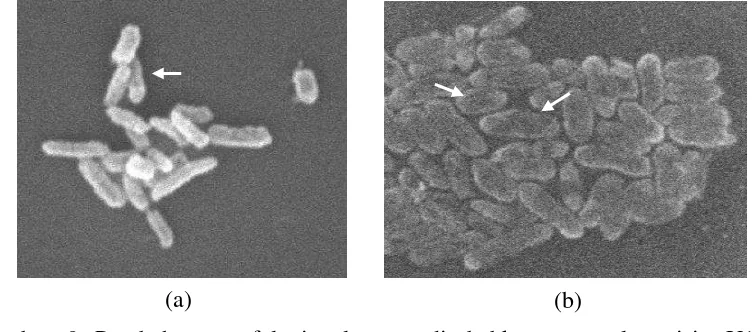
17
Gambar 9 Perubahan morfologi sel yang disebabkan oleh plantarisin U10 menggunakan SEM dengan pembesaran 10.000 kali. (a): tanpa perlakuan plantarisin U10, bentuk sel bulat utuh, (b): dengan perlakuan plantarisin U10 setelah 24 jam, permukaan sel tampak terkoyak dan mengalami lisis.
Analisa perubahan morfologi sel bakteri oleh plantarisin dilakukan secara mikroskopis dengan menggunakan SEM dengan perbesaran 10.000 kali dan voltase 20 kV. Gambar 9(a) menunjukkan sel S. typhi yang tidak diberi perlakuan plantarisin (kontrol) tampak bulat dan masih utuh sedangkan pada Gambar 9(b) menunjukkan permukaan sel yang sobek dan pecah akibat penambahan plantarisin dalam suspensi bakteri. Garcia et al. (2010) menyatakan bahwa bakteriosin akan menempel pada membran sel sehingga permeabilitas membran akan terganggu dan kemudian akan terbentuk pori sehingga akan mengakibatkan ketidakseimbangan proton dan menyebabkan sel pecah dan mati.
Deteksi Gen Penyandi Plantarisin
Isolasi yang telah dilakukan berhasil untuk mendapatkan DNA genom dari
L. plantarum U10. Deteksi gen menggunakan 6 pasang primer untuk mengamplifikasi sekuen plantarisin yaitu: PlnA_F/R, PlnEF_F/R, PlnJK_F/R, PlnF_F/R, PlnW_F/R, dan PlnABC_F/R, (Tabel 1). Hasil deteksi gen penyandi plantarisn menghasilkan pita dengan ukuran ± 300 bp utuk PlnA, ± 267 bp untuk PlnJK, ± 159 bp untuk PlnF, dan ± 750 bp untuk PlnW (Lampiran 13). Hasil deteksi gen penyandi plantarisin dapat dilihat Tabel 4.
Tabel 4 Deteksi gen plantarisin L. plantarum U10
gen plnA plnEF plnJK plnF plnW plnABC
Hasil deteksi + - + + + -
Hasil deteksi gen penyandi plantarisin dengan primer spesifik terdapat empat gen plantarisin yang berhasil dideteksi pada L. plantarum U10 dengan salah satunya adalah gen plnJK yang merupakan gen penyandi plantarisin JK yang merupakan bakteriosin kelas IIb dengan karakteristik tahan terhadap pemanasan (Todorov et al. 2009). Gen plnA adalah gen yang menyandikan plantarisin A dan merupakan induser atau feromon yang dapat memicu pengekspresian gen plantarisin lainnya (Rizzello et al. 2013). Sedangkan gen
plnW adalah gen penyandi yang biasanya ditemukan pada bakteriosin dengan karakteristik lantibiotik dengan menggandung gugus lantionin (Hollo et al. 2011).
4 SIMPULAN DAN SARAN
Simpulan
L. plantarum U10 yang diisolasi dari tempoyak dapat menghasilkan plantarisin U10 dan telah berhasil dikarakterisasi. Plantarisin U10 yang berhasil dimurnikan dengan bobot molekul berkisar 4.5 dan 9.8 kDa, tahan terhadap panas, stabil di rentang pH yang luas namun sensitif terhadap enzim proteolitik. Produksi maksimum plantarisin U10 (800 AU/mL) adalah saat fase awal stasioner (20 jam) dan memiliki mekanisme aksi bakterisidal dengan melisis sel bakteri S. typhi
ATCC25241. Hasil ini memberikan landasan teoritis untuk aplikasi penggunaan plantarisin U10 sebagai antibakteri alami.
Saran
19
5 DAFTAR PUSTAKA
Abo-Amer A. 2007. Characterization of a bacteriocin-like inhibitory substance produced by Lactobacillus plantarum isolated from egyptian home-made yogurt. J. Sci. Asia . 33: 313-319.
Abrams D, Barbosa J, Albano H, Silva J, Gibbs P, Teixeira P. 2011. Characterization of PPK34 a bacteriocin produced by Pediococcus pentosaceus
strain K34 isolated from “Alheira”. Food Control. 22: 940-946.
Ardiansyah, 2005. Daun Beluntas Sebagai Bahan Antibakteri dan Antioksidan. http://www.beritaiptek.com/zberita-beritaiptek-2005-05-31-Daun-Beluntas-Sebagai-Bahan-Antibakteri-dan-Antioksidan.shtml. [24 April 2006].
Arief I, Jakaria, Suryati T, Wulandari Z, Andreas E. 2013. Isolation and characterization of plantaricin produced by Lactobacillus plantarum strains (IIA-1A5, IIA-1B1, IIA-2B2). Media Peternakan. 36(2): 91-100.
Boe. 1996. Evaluation of optimum production production for bacteriocin from
Lactobacillus sp. JB 42 isolation from kimchi. J Microbiol Biotech. 6: 63-67. Bintang M. 2010. Biokimia, Teknik Penelitian. Erlangga. Jakarta.
Cederlund A, Gudmundur H, Brigitta Agerbeth. 2011. Antimicrobial Peptides Important in Innate Immunity. The FEBS Journal. Doi: 10.1111/j.1742-4658.2011.08302.x
Chae P, Rasmussen S, Rana R, Gotfryd K, Chandra R, Goren M. 2010. Maltoseneopentyl glycol (MNG) amphiphiles for solubilization, stabilization and crystallization of membrane proteins. Nat Methods. 7:1003-8.
Cho GS, Huch M, Hanak A, Holzepfel WH, Franz CMAP. 2010. Genetic analysis of plantaricin EFI locus of Lactobacillus plantarum PCS20 reveals an unusual plantaricin E gene sequence a resul of mutation. International Journal of Food Microbiology. 141:117-124.
Depkes RI. 2010. Profil Kesehatan Indonesia. Jakarta: Departemen Kesehatan Republik Indonesia.
Drider D, Fimland G, Hechard Y, McMullen M, Prevost H. 2006. The Continuing Story of Class IIa Bacteriocins. Microbiol Mol Biol Rev. 70:564-582.
[EUCAST] European Committee for Antimicrobial Susceptibility Testing. 2003. Determination of minimum inhibitory concentration (MICs) of antibacterial agents by broth dilution. Clinical Microbiology and Infection. 9(8):1-7.
Fujimura M, Ideguchi M, Minami Y, Watanabe K, Tadera K. 2010. Amino acid sequence and antimicrobial activity of chitin-binding peptides, Pp-AMP 1 and Pp-AMP 2, from Japanese bamboo shoots (Phyllostachys pubescens).
Bioscience, Biotechnology and Biochemistry. 69(3).642–645.
Garcia P, Rodriguez L, Rodriguez A, Martinez B. 2010. Food Biopreservation: promising strategies using bacteriocins bacteriophages and endolysins. Spain (ES). F Sci Tech. 21: 373-382.
Gong H, Meng X, Wang H. 2010. Plantaricin MG active against Gram-negative bacteria produced by Lactobacillus plantarum KLDS1.0391 isolated from jiaoke, a traditional fermenteed cream from China. Food control . 21: 89-96. Hamouda T, Beker JR. 2000. Antimicrobial mechanism of action of surfactant
Hata T, Tanaka R, Ohmomo S. 2010. Isolation and characterization of plantaricin ASM1: a new bacteriocin produced by Lactobacillus plantarum A-1.
International Journal of food Microbiology.137:94-99.
Holo H, Jeknic Z, Daeschel M, Stevanovic S, Nes IF. 2011. Plantaricin W from
Lactobacillus plantarum belongs to a new family of two-peptide lantibiotics. Microbiology. (147): 643-651.
Huang T, Long M, Huo B. 2010. Competitive binding to cuprous ions of protein and BCA in the bicinchoninic acid protein assay. Open Biomed Eng J. 4:271-278. doi:10.2174/1874120701004010271.
Hyo Y, Yamada S, Ishimatsu M, Fukutsuji K, Harada T. 2012. Antimicrobial
effects of burow’s solution on Staphylococcus aureus and Pseudomonas aeruginosa. Med Mol Morphol. 45:66-71.
Jack RW, Ray B, Tagg JR. 1995. Bacteriocin of gram positive bacteria. Microbiol. Rev. 59: 1416-1429.
Keil B. 1992. Specificity of proteolysis. Springer Verlag Berlin Heidelberg NewYork.335.
Kregiel D, Berlowska J, Ambroziak W. 2008. Succinate dehydrogenase activity assay in situ with blue tetrazolium salt in Crabtree-positive Saccharomyces cerevisiae strain. Food Technol Biotechnol. 46: 376-380.
Kumari A, Neffise A, Mustafa A. 2012. Purification and partial characterization of bacteriocin produced by Lactococcus lactis ssp. lactis LL171. World J Microbiol Biotechnol. 28:1647–1655. doi 10.1007/s11274-011-0971-4.
Laemmli, U. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227: 680-685.
Mahrous H, Abeer M, Mongy M, El-Batal AI, Hamza HA. 2013. Study Bacteriocin Production and Optimization Using New Isolates of Lactobacillus spp. Isolated from Some Dairy Products under Different Culture Conditions.
Food and Nutrition Sciences. 4:3 42-356. doi:10.4236/fns.2013.43045.
Martinez RC, Monica W, Nicola IT, Jean GL, Todorov SD, Bernadett DG. 2013. Biochemical, antimicrobial and molecular characterization of a noncytotoxic bacteriocin produced by Lactobacillus plantarum ST71KS. Food Microbiology. 34: 376-381.
McAuliffe ORM, Ross R, Hill C, Breeuwer P, Abee T. 2001. Lacticin 3147, a broad-spectrum bacteriocin which selectively dissipates the membrane potential. Appl. Environ. Microbiol. 64: 439-445.
Moussa SH, Ahmed AT, Ahmed AH, Farouk A. 2013. Tetrazolium/formazan test as an efficient method to determine fungal chitosan antimicrobial activity.
Journal of Mycology. 1-7. Doi:10.1155/2013/753692.
Nurwati, R. 2006. Pengaruh Serbuk Cacing Tanah (Lumbricus rubellus) terhadap Pertumbuhan Bakteri Salmonella thypi dengan Metode Sumuran [Skripsi]. Surakarta : Universitas Muhammadiyah Surakarta.
21
Ogunbanwo ST, Sanni AI, Onilude AA. 2003. Characterization of bacteriocin produced by Lactobacillus plantarum F1 and Lactobacillus brevis OG1.
African Journal of Biotechnology. 2(8): 219-227.
Pan XF, Chen T, Wu H, Tang, Zhou Z. 2009. The acid, bile tolerance, and antimicrobial property of Lactobacillus acidophilus NIT. J. Food Control. 20: 598-602.
Parada JL, Caron CR, Medeiros AB, Soccol CR. 2007. Bacteriocin from lactic acid bacteria: purification, properties and use as biopreservatives. Bracilli. Arch. J. Biol. Technol. 50 (3): 521-542.
Patrıcia B P, Rafael P Sarto,Osmar N S, Octavio L F, Maria F G. 2011.
Antibacterial Peptides from Plants: What They Are and How They Probably Work [ulas balik]. Biochemistry Research International. doi:10.1155/2011/250349
Pierce Biotechnology. 2013. PierceTM BCA Protein Assay Kit. Rockford [US]: Thermo Fisher Scientific.
Kuipers OP, Buist G, Kok J. 2000. Currentstrategies for improving food bacteria.
Res.Microbiol 151:815-822.
Ray B, Bhunia A. 2007. Fundamental Food Microbiology. 4th Edition. CRC Press, Boca Raton, London, New York, Washington, D.C.
Rizzello CG, Pasquale F, Raffaella DC, Maria Calasso, dan Marco G. 2013. Quorum-sensing regulation of constitutive plantaricin by Lactobacillus plantarum strains under a model system for vegetables and fruits. Applied and Environmental Microbiology. (2): 777.
Sankar N, Priyanka V, Reddy P. 2012. Purification and Characterization of Bacteriocin Produced by Lactobacillus Planarum Isolated from Cow Milk. Intl. J. Microbiol Res. 3 (2):133-137. Doi: 10.5829/idosi.ijmr. 2012.3.2.62182. Saenz Y, Novarro L, Bezares R, Diez L, Zragaza M, Larrea F, and Torres C.
2009. Genetic diversity of plantaricin locus among oenological Lactobacillus plantarum strains. International Journal of food Microbiology. 134: 176-183. Sang Y, Blecha F. 2008. Antimicrobial peptides and bacteriocins: alternatives to
traditional antibiotics [ulas balik]. Animal Health Research Reviews 9 (2): 227-235.
Savadogo A, Cheik A, Imael HN, Traore SA. 2004. Antimicrobial activities of lactic acid bacteria strain isolated from Burkina Faso fermented milk. Pakistan J. Nutr. 3 (3): 174-179.
Sharpe ME, Fryer TF, Smith DG. (1966) Identification of the Lactic Acid Bacteria in Identification Method for Microbiologists Part A (Gibbs B. M. and Skinner F. A. eds.) London and New York. Academic Press: 65-79.
Smaoi S, Elleuch L, Bejar W. 2010. Inhibition of fungi and Gram-negative bacteria by bacteriocin BacTN635 produced by Lactobacillus plantarum
sp.TN635. Biochem Biotechnol. 162: 1132-1146.doi: 10.1007/s12010-009-8821-7.
Smith PK .1985. Measurement of protein using bicinchoninic acid. Anal. Biochem
Tiwari S, Srivastava S. 2008. Purification and characterization of plantaricin LR14: a novel bacteriocin produced by Lactobacillus plantarum LR/14.
Microbiol Biotechnol 79: 759-767.doi:10.1007/s00253-008-1482-6.
Todorov S. 2009. Bacteriocin from Lactobacillus plantarum production, genetic, organization and mode of action. Brazilian J Microbiol 40: 209-221.
Todorov S, Dicks L. 2005. Characterization of bacteriocins produced by Lactic acid bacteria isolated from spoiled black olives. Journal Basic Microbiol. 45: 312–322.
Todorov S, Furtado DN, Saad SM, Franco BD. 2011. Bacteriocin production and resistance to drugs are advantageous features for Lactobacillus acidophilus La-14, a potential probiotic strain. New microbiologica. 34: 357-370.
Todorov S, Nyati H, Meincken M, Dick L. 2007. Partial characterization of bacteriocin AMA-K, produced by Lactobacillus plantarum AMA-K isolated from naturally fermented milk from Zimbabwe. J Gen Appl Microbio. 18:656– 664.
Todorov S, Reenen A, Dicks L. 2004. Optimization of bacteriocin production by
Lactobacillus plantarum ST13BR, a strain isolated from barley beer. J Gen Appl Microbio. 50: 149-157.
Tokuyasu K, Ono H, Hayasi, Mori Y. 1996. Purification and characterization of extracellular chitin deacetylase from Colletotricum lindemuthianum. Biosc. Biotech. Biochem. 10: 1598-1603.
Torkar KG, Matijasic B. 2003. Partial characterization of bacteriocins produced by Bacillus cereus isolates from milk and milk products. Food Technol. Biotechnol. 41 (2): 121-129.
Urnemi, A Zaenal M, M Ridwan. 2010. Potensi bakteri asam laktat dari lempok durian dalam menghasilkan bakteriosin sebagai biopreservatif pangan. Di dalam: Hernaman I, Tanuwiria UH, Hendronoto A, Yurmiati LH, Sulistyati M, Hidayati YA, Herlina L, Indrijani H, Sujana E, Putranto WS, Islami RZ, Widiawati Y, Sofjan O, Syamsul JA, editor. Sistem Produksi Berbasis Ekosistem Lokal. Seminar Nasional Peternakan Berkelanjutan; 2010 November 4; Bandung, Indonesia. Bandung (ID): Universitas Padjajaran: 679-685.
U.S Departement of Health and Human Services. 2013. Antibiotic Resistance Threats in the United State. New York [NY]: Departement of Health and Human Services.
Vuyst LD, Leroy F. 2007. Bacteriocins from lactic acid bacteria: production, purification, and food applications. J. Mol. Microbiol. Biotechnol. 13: 194–199. Wang G, Feng G, Snyder AB, Manns C, Churey J. 2014. Bactericidal thurincin H
causes unique morphological changes in Bacillus cereus F4552 without affecting membrane permeability. FEMS Microbiol Lett. 357: 69-76.
[WHO] World Health Organization. 2003. The diagnosis, treatment and prevention of typhoid fever. Geneva: World Healt Organization.
Xie Y, An H, Hao Y, Qin Q, Huang Y, Luo Y, Zhang L. 2011. Characterization of an anti-Listeria bacteriocin produced by Lactobacillus plantarum LB-B1 isolated from koumiss, a traditionally fermented dairy product from China.
23
Yanagi et al. 2009. Emergence of fluoroquinolone-resistant strains of Salmonella enterica in Surabaya, Indonesia. Diagnostic Microbiology and Infectious Disease. 64: 422-426.
Zhu H, Qu F, Zhu LH. 1993. Isolation of genomic DNAs from plants, fungi and bacteria using benzyl chloride. Nucl Acids Res. 21: 5279-5280.
Zhu X, Zhao Y, Sun Y, and Gu Q. 2014. Purification and characteritation of plantaricin ZJ008, a novel bacteriocin against Staphylococcus spp. from
Lampiran 1 Tabel Penggunaan Padatan Ammonium Sulfat (% penjenuhan)
Awal
% 20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100
Konsentrasi Akhir dari Padatan Ammonium Sulfat (gram)/100 mL
0 10.6 13.4 16.4 19.4 22.6 25.8 29.1 32.6 36.1 39.8 43.6 47.6 51.6 55.9 60.3 65.0 69.7
5 7.9 10.8 13.7 16.6 19.7 22.9 26.2 29.6 33.1 36.8 40.5 44.4 48.4 52.6 57.0 61.5 66.2
10 5.3 8.1 10.9 13.9 16.9 20.0 23.3 26.6 30.1 33.7 37.4 41.2 45.2 49.3 53.6 58.1 62.7
15 2.6 5.4 8.2 11.2 14.1 17.2 20.4 23.7 27.1 30.6 34.3 38.1 42.0 46.0 50.3 54.7 59.2
20 0 2.7 5.5 8.3 11.3 14.3 17.5 20.7 24.1 27.6 31.2 34.9 38.7 42.7 46.9 51.2 55.7 25 0 2.7 5.6 8.6 11.3 14.6 17.9 21.1 24.5 28.0 31.7 35.5 39.5 43.6 47.8 52.2
30 0 2.8 5.6 8.6 11.7 14.8 18.1 21.4 24.9 28.5 32.3 36.2 40.2 44.5 48.8
35 0 2.8 5.6 8.7 11.8 15.1 18.4 21.8 25.8 29.6 32.9 36.9 41.0 45.3
40 0 2.9 5.8 8.9 12.0 15.3 18.7 22.2 26.3 29.6 33.5 37.6 41.8
45 0 3.0 5.9 9.0 12.3 15.6 19.0 22.6 26.3 30.2 34.2 38.3
50 0 3.0 6.0 9.2 12.5 15.9 19.0 23.5 26.8 30.8 34.8
55 0 3.1 6.1 9.3 12.7 16.1 20.1 23.5 27.3 31.2
60 0 3.1 6.2 9.5 12.9 16.8 20.1 23.9 27.9
65 0 3.2 6.3 9.7 13.2 16.8 20.5 24.4
70 0 3.2 6.5 9.9 13.4 17.1 20.9
75 0 3.3 6.6 10.1 13.7 17.4
80 0 3.4 6.7 10.3 13.9
85 0 3.4 6.8 10.5
90 0 3.4 7.0
95 0 3.5
Lampiran 2 Komposisi Media Nutrien Broth
Lampiran 3 Komposisi Media Nutrient Agar
Bahan Komposisi (% b/v)
Lampiran 4 Kandungan Media MRS OXOID CM0359
Komposisi Gram/liter
Difotasium dihidrogen fosfat 2.0
Sodium asetat 3H2O 5.0
Triamonium sitrat 2.0
Magnesium sulfat 7H2O 0.2
Magnesium sulfat 4H2O 0.05
pH 6.2 ± 0.2 @25 °C
Lampiran 5 Komposisi Gel SDS-PAGE (akrilamid 16%)
Komposisi Separating Gel Stacking Gel
Lampiran 6 Komposisi Larutan Elektroforesis SDS-PAGE
Larutan Komposisi Stok Konsentrasi Akhir
Bufer separating
Lampiran 7 Komposisi Reagen BCA Assay
Reagen A Reagen B Standar BSA
Lampiran 8 Komposisi bufer fosfat (pH 7.2)
29
Lampiran 9 Komposisi Larutan Silver Staining
Larutan Komposisi Stok Konsentrasi Akhir
Fiksasi gel Pencuci gel Etanol absolut
Akuades
Lampiran 10 Contoh Perhitungan AU
AU = Sample mL � ⁄n
Lampiran 11 Komposisi Buffer TBE 500 mL Tris (hidroksildiamin) aminometan : 5.4 g
Boric Acid : 2.75 g