EFIKASI VAKSIN DNA KHV GP-11 PADA IKAN KOI
Cyprinus carpio haematopterus SKALA LABORATORIUM
SEKAR AYU CHAIRUNNISA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK
CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul“Efikasi vaksin DNA KHV GP-11 pada ikan koi Cyprinus carpio haematopterus skala laboratorium” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dan tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2016
Sekar Ayu Chairunnisa
RINGKASAN
SEKAR AYU CHAIRUNNISA. Efikasi Vaksin DNA KHV GP-11 pada Ikan Koi (Cyprinus carpio haematopterus) Skala Laboratorium. Dibimbing oleh SRI NURYATI, ALIMUDDIN dan SRI MURTINI.
Koi herpesvirus (KHV) merupakan salah satu patogen penting bagi ikan mas dan ikan koi. Penyakit tersebut sebelumnya dikenal sebagai carp intersititial nephritis and gill necrosis (CNGV) di Israel, dan kemudian menyebar luas ke berbagai belahan dunia. Penyakit ini bersifat sangat virulen dan telah menyebabkan kerugian ekonomi yang besar dalam industri budidaya baik pada budidaya ikan koi maupun ikan mas sehingga memberikan dampak sosial yang signifikan di beberapa negara di seluruh dunia. KHV di Indonesia pertama kali terjadi pada awal Maret 2002 kemudian dengan cepat menyebar dan menimbulkan kerugian ekonomi yang besar pada industri budidaya. Beberapa upaya penanggulangan penyakit KHV terus dilakukan, salah satunya adalah dengan meningkatkan sistem kekebalan tubuh dengan menggunakan vaksin DNA. Pengembangan aplikasi vaksin DNA terhadap infeksi KHV masih terus dilakukan, salah satunya dengan menggunakan vaksin DNA KHV GP-11. GP-11 merupakan ORF 81 virus KHV yang memiliki sifat imunogenik. Vaksin DNA KHV GP-11 merupakan vaksin DNA penyandi glikoprotein dari KHV yang diapit oleh promoter berupa keratin ikan flounder Jepang. Oleh karena itu penelitian mengenai aplikasi vaksin DNA KHV GP-11 perlu dilakukan untuk menguji efikasi dari vaksin tersebut sebagai upaya dalam meningkatkan kelangsungan hidup ikan koi (C. carpio haematopterus) akibat infeksi koi herpesvirus (KHV).
Ikan uji yang digunakan dalam penelitian ini adalah ikan koi (rata-rata bobot tubuh: ± 18 - 20 gram) berumur 3 bulan yang diperoleh dari Balai Besar Perikanan Budidaya Air Tawar (BBPBAT) Sukabumi, Jawa Barat. Konfirmasi status kesehatan ikan uji dilakukan selama masa aklimatisasi dan konfirmasi ikan terbebas dari KHV dilakukan menggunakan metode
Polymerase Chain Reaction (PCR). Perlakuan dosis yang digunakan adalah GP-11 2,5 μ g/100 μ l (A), GP-11 7,5 μ g/100 μ l (B), GP-11 12,5 μ g/100 μ l
(C), dan GP-25 12,5 μ g/100 μ l(D). Perlakuan kontrol yang digunakan yaitu kontrol negatif (K-) dan kontrol positif (K+). Parameter uji meliputi
kelangsungan hidup (KH), kelangsungan hidup relatif (RPS), gejala klinis, aktivitas fagositik (AF), total sel darah putih (SDP), diferensial leukosit (DL), dan titer antibodi.
(hpv) dan mengalami penurunan sejak 35 hpv hingga 7 hari pascainfeksi (56 hpv). Secara umum nilai AF perlakuan vaksinasi lebih tinggi dibandingkan dengan kontrol. Jumlah SDP teramati mengalami peningkatan pada semua perlakuan mulai awal pengamatan hingga 42 hpv dan mengalami penurunan pada semua perlakuan pada 7 hari pascainfeksi (56 hpv). Secara umum jumlah SDP perlakuan vaksinasi lebih tinggi dibandingkan dengan kontrol. Titer antibodi pascavaksinasi pada penelitian ini secara umum teramati berfluktuasi baik pada perlakuan tanpa uji tantang maupun perlakuan dengan uji tantang. Titer antibodi pada kedua perlakuan menunjukkan nilai yang positif terbentuk pada 7 - 14 hpv (ditandai dengan persinggungan nilai absorbansi CV berkisar 0,14 nm). Nilai absorbansi pada 21 - 28 hpv teramati menurun dan menunjukkan nilai positif kembali pada 35 dan 42 hpv. Respons pembentukan antibodi pada pengamatan 56 - 77 hpv menunjukkan hasil yang berbeda pada kedua perlakuan, di mana perlakuan tanpa uji tantang pada 56 hpv (7 hpi) teramati terus meningkat sedangkan pada perlakuan dengan uji tantang teramati menurun pada 56 hpv (7 hpi). Secara umum aplikasi vaksin DNA KHV GP-11 dengan dosis 7,5 μ g/100 μ l
dan 12,5 μ g/100 μ l mampu meningkatkan kelangsungan hidup ikan, sehingga vaksin ini layak untuk diaplikasikan.
SUMMARY
SEKAR AYU CHAIRUNNISA. Efficacy of GP-11 KHV DNA vaccine in
Cyprinus carpio haematopterus at laboratory scale. Supervised by SRI NURYATI, ALIMUDDIN and SRI MURTINI.
Koi herpesvirus (KHV) is considered as one of the most important pathogen of koi and common carp. This disease known as carp interstitial nephritis and gill necrosis virus (CNGV) in Israel, and then spread around the world. This disease is highly virulent and caused huge economic losses to the aquaculture industry both on the koi and common carp, thus providing a significant social impact in several countries around the world. The KHV outbreaks in Indonesia occurred in early March 2002, then quickly spread and cause great economic losses to the aquaculture industry. Various efforts are continuously made to control the KHV diseases and one of the methods is enhancing the immune system using the DNA vaccine. The development of DNA vaccine applications against KHV infection has been still developed, one of the solution is using DNA vaccines KHV GP-11 GP-11 has immunogenic properties of ORF 81 KHV virus. KHV DNA vaccine GP-11 is a DNA vaccine encoding the glycoprotein of KHV with Japanese flounder keratin promoter. Therefore, the study on the application of DNA vaccines KHV GP-11 should be carried out to examine the efficacy of the vaccine as an effort to improve the survival of koi carp (C. carpio haematopterus) due to infection of KHV.
The experimental fish used in this study was Cyprinus carpio haematopterus (average body weight: ± 18 - 20 g) at 3-month-old that obtained from Main Center of Freshwater Aquaculture, Sukabumi, West Java. Screening of experimental fish health status was performed during acclimatization period and confirmation of the fish which were free of KHV was done through polymerase chain reaction (PCR). Treatment dosage used were GP-112,5 μ g/100 μ l (A), GP-11 7,5 μ g/100 μ l (B), GP-11 12,5 μ g/100 μ l (C), and GP-25 12,5 μ g/100 μ l (D). Control treatments used were
negative control (K-) and positive control (K+). Parameters observed were
survival (SR), relative percent survival (RPS), clinical signs, number of leukocytes (NL), leukocyte differential count (DL), phagocytic activity (PA), and antibody titer.
decreased in all treatments at 7 dpi (56 dpv). In general, the number of leukocytes value of vaccinated fish were higher compared to control. Antibody titers in both treatments showed positive values formed in 7-14 HPV (marked by the intersection of the absorbance value CV range of 0.14 nm). Absorbance value at 21-28 HPV was observed to decline and showed a positive value at 35 and 42 HPV. The formation of antibody response to the observation of 56 - 77 HPV showed different results in the second treatment, wherein the treatment without challenge test at 56 HPV (7 hpi) observed rising while on the treatment with challenge test showed decreased in 56 HPV (7 hpi). In general, the application of DNA vaccines KHV GP-11
at a dose of 7,5 μ g/100 μ l and 12.5 μ g/100 μ l can improve the survival of
fish, so the vaccine has a potency to be applied.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa
mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
EFIKASI VAKSIN DNA KHV GP-11 PADA IKAN KOI
Cyprinus carpio haematopterus
SKALA LABORATORIUM
SEKAR AYU CHAIRUNNISA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
Pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala limpahan rahmat dan karunia-Nya sehingga tesis yang berjudul “Efikasi vaksin DNA KHV GP-11 pada ikan koi (Cyprinus carpio haematopterus) skala laboratorium” ini berhasil diselesaikan. Tesis ini ditulis berdasarkan hasil penelitian yang dilaksanakan pada bulan Desember 2014 sampai Februari 2016 bertempat di Balai Besar Perikanan Budidaya Air Tawar (BBPBAT) Sukabumi.
Penulis menyadari bahwa terselesaikannya tesis ini tidak lepas dari segala bantuan dan dukungan dari berbagai pihak, baik ide, tenaga, moril maupun materil. Penulis menyampaikan rasa terima kasih yang mendalam pada Dr. Sri Nuryati SPi MSi, Dr. Alimuddin SPi MSc dan Dr. Drh. Sri Murtini MSi sebagai komisi pembimbing atas waktu dan bimbingannya mulai dari penyusunan proposal, pelaksanaan penelitian hingga penulisan tesis. Penulis juga menyampaikan rasa terima kasih kepada Dr. Ir. Widanarni, MSi sebagai penguji luar komisi dan perwakilan dari Program Studi Ilmu Akuakultur yang memberikan saran dan semangat selama ujian tesis.
Terima kasih penulis sampaikan pula pada Direktorat Jendral Pendidikan Tinggi (DIKTI), Kementerian Riset dan Teknologi (KEMENRISTEK) atas penyediaan Beasiswa Freshgraduate Tahun 2013 sehingga penulis dapat melanjutkan studi di Sekolah Pascasarjana, Institut Pertanian Bogor.
Terima kasih juga penulis sampaikan kepada Lembaga Pengelola Dana Pendidikan (LPDP), Kementerian Keuangan (KEMENKEU) atas penyediaan Beasiswa Tesis-Disertasi Periode II Tahun 2015 sehingga penulis dapat menyelesaikan penelitian.
Terima kasih penulis sampaikan kepada kepala Balai Besar Perikanan Budidaya Air Tawar (BBPBAT) Sukabumi karena telah memberikan fasilitas selama penelitian dan terima kasih juga penulis sampaikan kepada seluruh staf Laboratorium Kesehatan dan Genetika Ikan atas bimbingan dan semangatnya dari awal hingga akhir penelitian.
Terima kasih penulis ucapkan kepada kepala Balai Uji Strandar Karantina Ikan, Pengendalian Mutu dan Keamanan Hasil Perikanan (BUSKI-PM) Cipayung karena telah memberikan ijin kepada penulis untuk melakukan kegiatan magang guna mendapatkan keperluan penelitan dan terima kasih juga penulis sampaikan kepada seluruh staf Laboraturium Kultur Sel yang telah banyak membimbing dalam proses kegiatan magang.
Terima kasih juga penulis sampaikan kepada Dr Murjani, Dr Taukhid, dan Dr Agus Sunarto atas segala masukan serta arahan baik dalam proses penelitian maupun dalam proses penulisan tesis.
Terima kasih dan penghargaan yang tinggi penulis persembahkan kepada kedua orang tua, Bapak Eko Kudo Wiyono dan Ibu Wiwien Satwiyani, Kakak Kemas Alpani dan Tomy Herdianto, Adik Vinita Noviani dan Rizky serta seluruh keluarga penulis atas doa, bantuan dan dukungan selama menjalani masa studi.
Akmal Aonullah SPi MSi, Rifqi Tamamdusturi SPi MSi, Nurin Dalilah Ayu Destianigrum SPi, Aisyah Lukmini SPi MSi, Fitria Nawir SPi MSi, Yunarty SPi MSi, Artin Indrayanti SPi MSi, Rahmat Hidayat SPi MSi, Novianto Poernomoe SPi MSi), rekan-rekan UNDIP yang melanjutkan studi di IPB (Yusrianti Purwandari SPi, Linuwih Aluh Prastiti SPi, Liya Try Khikmawati SPi, Aulia Al-bayyinah SPi MSi, Mulkan Nuzapril SPi, Lukman Guam Hakim SPi MSi, Ganang Prasetyo SPi, Budhi Agung Prasetyo SPi MSi, Kukuh Prakoso SPi, Andi Sagita SPi), rekan-rekan bunda lestari (Noviati R Khasanah SPi, Enggar Yustisi Arini SSi, Srimani Puspadewi SSi, Fikriyatul Falashifah SSi) serta pihak-pihak yang tidak dapat disebutkan satu persatu dalam lembaran ini.
Semoga karya ilmiah ini bermanfaat untuk kemajuan ilmu pengetahuan, khususnya perikanan budidaya.
Bogor, Juli 2016
DAFTAR ISI
2 METODE PENELITIAN...3
Waktu dan Tempat Penelitian...3
Rancangan Penelitian...3
Materi Uji...3
Pengadaan Ikan Uji...3
Vaksin DNA KHV...4
Prosedur Penelitian...4
Perbanyakan Vaksin DNA KHV GP-11...4
Produksi Antibodi Poliklonal Anti-Ikan Koi...4
Vaksiansi Melalui Metode Injeksi...5
Pemeliharaan Ikan Uji Pascavaksinasi...5
Uji Ekspresi mRNA...5
Pengadaan Isolat KHV...6
Uji Tantang...6
Deteksi KHV dengan Metode PCR...7
Parameter Uji...7
Analisis Data...9
3 HASIL DAN PEMBAHASAN...10
Kelangsungan Hidup Masa Uji Tantang...10
Pola Kematian Ikan Uji...10
Gejala Klinis...11
Uji Ekspresi mRNA...12
Aktivitas Fagositik...13
Jumlah Sel Darah Putih Total...13
Diferensial Leukosit...14
Titer Antibodi...17
Pembahasan...18
4 SIMPULAN DAN SARAN...23
Simpulan...23
Saran...23
DATAR PUSTAKA...23
LAMPIRAN...27
DAFTAR TABEL
1. Perlakuan dosis vaksin 5
2. Kelangsungan hidup danrelative percent survival(RPS) ikan koi pascauji
tantang 10
DAFTAR GAMBAR
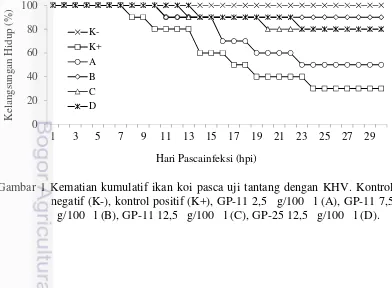
1. Kematian kumulatif ikan koi pasca uji tantang dengan KHV. Kontrol negatif (K-), kontrol positif (K+), GP-11 2,5 μ g/100 μ l(A), GP-11 7,5
μ g/100 μ l (B), GP-11 12,5 μ g/100 μ l (C), GP-25 12,5 μ g/100 μ l (D) 10 2. Elektroforegram hasil konfirmasi awal status kesehatan ikan uji bebas
KHV menggunakan metode PCR. Marker DNA (M), 1-4 (sampel ikan 1-4), kontrol negatif (N), kontrol positif KHV (P). Tanda kepala panah di sebelah kanan gambar menunjukkan posisi DNA KHV produk
amplifikasi PCR (296 bp) 10
3. Gejala klinis ikan uji yang terinfeksi KHV. Ikan sehat (A),hemorrhage
pada permukaan (B), sirip geripis (C), dannecrosispada insang (D) 11 4. Elektroforegram hasil validasi kematian ikan selama masa uji tantang
menggunakan metode PCR. Marker DNA (M), GP-11 2,5 μ g/100 μ l
(A), GP-11 7,5 μ g/100 μ l (B), GP-11 12,5 μ g/100 μ l (C), control negatif ikan tidak terinfeksi KHV (K-), kontrol ikan positif ikan terinfeksi KHV (K+), GP-25 12,5 μ g/100 μ l (D), kontrol positif KHV
(P), dan kontrol negatif tanpa DNA template (N). Tanda kepala panah di sebelah kanan gambar menunjukkan posisi DNA KHV produk
amplifikasi PCR (296 bp) 12
5. Ekspresi gen GP-11 pada ikan koi yang telah divaksin (A), dan produk
PCR menggunakan primer β-actin ikan koi (B). Marker DNA 100 bp ladder (M), dosis vaksin 7,5 μ g/100 μ l pada 24 jam pascavaksinasi (1),
dosis vaksin 12,5 μ g/100 μ l pada 24 jam pascavaksinasi (2), dosis
vaksin 2,5 μ g/100 μ lpada 14 hpv (3), dosis vaksin 7,5 μ g/100 μ l pada
14 hpv (4), dosis vaksin 2,5 μ g/100 μ l pada 28 hpv (5), dosis vaksin 7,5
μ g/100 μ l pada 28 hpv (6), ikan kontrol tanpa perlakuan vaksinasi (7),
kontrol negatif PCR (8), plasmid GP-11 (9). Tanda kepala panah di sebelah kanan gambar menunjukkan target produk amplifikasi PCR
(200 bp) 12
6. Aktivitas fagositik selama masa pemeliharaan pascavaksinasi dan masa pemeliharaan pascainfeksi dengan KHV. Kontrol negatif (K-), kontrol positif (K+), GP-11 2,5 μ g/100 μ l (A), GP-11 7,5 μ g/100 μ l (B), GP-11 12,5 μ g/100 μ l (C), dan GP-25 12,5 μ g/100 μ l (D). Tanda panah
7. Jumlah sel darah putih (SDP) total selama masa pemeliharaan pascavaksinasi dan pascainfeksi dengan KHV. Kontrol negatif (K-), kontrol positif (K+), GP-11 2,5 μ g/100 μ l (A), GP-11 7,5 μ g/100 μ l
(B), GP-11 12,5 μ g/100 μ l (C), dan GP-25 12,5 μ g/100 μ l (D). Tanda
panah menunjukkan waktu injeksi untuk uji tantang KHV 14 8. Jenis leukosit ikan koi yang teridentifikasi (ditunjukkan oleh tanda
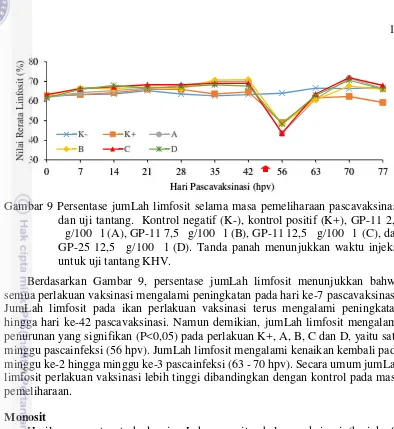
panah): limfosit (A), monosit (B), neutrofil (C), dan trombosit (D). Tanda garis pada ujung gambar menunjukkan garis skala (Bar: 6 µm) 14 9. Persentase jumlah limfosit selama masa pemeliharaan pascavaksinasi
dan uji tantang. Kontrol negatif (K-), kontrol positif (K+), GP-11 2,5
μ g/100 μ l (A), GP-11 7,5 μ g/100 μ l (B), GP-11 12,5 μ g/100 μ l (C),
dan GP-25 12,5 μ g/100 μ l (D). Tanda panah menunjukkan waktu
injeksi untuk uji tantang KHV 15
10. Persentase jumlah monosit selama masa pemeliharaan pascavaksinasi dan uji tantang. Kontrol negatif (K-), kontrol positif (K+), GP-11 2,5
μ g/100 μ l (A), GP-11 7,5 μ g/100 μ l (B), GP-11 12,5 μ g/100 μ l (C),
dan GP-25 12,5 μ g/100 μ l (D). Tanda panah menunjukkan waktu
injeksi untuk uji tantang KHV 15
11. Persentase jumlah neutrofil selama masa pemeliharaan pascavaksinasi dan masa pemeliharaan pascauji tantang dengan KHV. Kontrol negatif (K-), kontrol positif (K+), GP-11 2,5 μ g/100 μ l(A), GP-11 7,5 μ g/100 μ l (B), GP-11 12,5 μ g/100 μ l (C), dan GP-25 12,5 μ g/100 μ l (D). Tanda panah menunjukkan waktu injeksi untuk uji tantang KHV 16 12. Persentase jumlah trombosit selama masa pemeliharaan pascavaksinasi
dan masa pemeliharaan pascauji tantang dengan KHV. Kontrol negatif (K-), kontrol positif (K+), GP-11 2,5 μ g/100 μ l(A), GP-11 7,5 μ g/100 μ l (B), GP-11 12,5 μ g/100 μ l (C), dan GP-25 12,5 μ g/100 μ l (D). Tanda panah menunjukkan waktu injeksi untuk uji tantang KHV 17 13. Respons antibodi spesifik ikan koi pada masa pemeliharaan
pascavaksinasi tanpa uji tantang. (K-) kontrol negatif, (K+) kontrol positif, (A) GP-11 2,5 μ g/100 μ l, (B) GP-11 7,5 μ g/100 μ l, (C) GP-11 12,5 μ g/100 μ l, dan (D) GP-25 12,5 μ g/100 μ l 18 14. Respons antibodi spesifik ikan koi pada masa pemeliharaan
pascavaksinasi dengan uji tantang. (K-) kontrol negatif, (K+) kontrol positif, (A) GP-11 2,5 μ g/100 μ l, (B) GP-11 7,5 μ g/100 μ l, (C) GP-11 12,5 μ g/100 μ l, dan (D) GP-25 12,5 μ g/100 μ l. Tanda panah
menunjukkan pengamatan pada masa uji tantang 18
DAFTAR LAMPIRAN
1. Visualisasi hasil deteksi keberadaan antibodi poliklonal anti-ikan koi
pada kelinci 28
1
1 PENDAHULUAN
Latar Belakang
Salah satu patogen penting bagi ikan mas (Cyprinus carpio) dan koi (Cyprinus carpio haematopterus) adalah koi herpesvirus (KHV). Penyakit tersebut sebelumnya dikenal sebagai carp intersititial nephritis and gill necrosis (CNGV) di Israel (Ronen et al. 2003; Pikarsky et al. 2004). Infeksi KHV pertama kali dilaporkan terjadi di Israel (Perelberget al. 2003), Amerika Serikat (Hedricket al. 2000) dan Jerman (Bretzinger et al. 1999) sejak tahun 1998. Virus ini telah menyebar luas ke berbagai belahan dunia meliputi Inggris, Belgia, Belanda, Denmark, Austria, Italia, Luxemburg, Swiss, Afrika Selatan, Perancis, Polandia (Pokorovaet al. 2005; Haenanet al. 2004; Lio-Po 2011), Czech Republic (Novotny
et al.2010), Iran (H Rahmati-Holasooet al. 2016), Jepang (Sanoet al. 2004), Korea (Cho et al. 2005), Taiwan (Tu et al. 2004), Thailand (Tandavanitj et al. 2005), Singapura (Lio-Po 2011) dan Indonesia (Sunartoet al. 2002).
Virus KHV memiliki genom DNA beruntai ganda yang sangat besar (Davison 2010) sekitar 295 kbp dan diduga mampu untuk mengkodekan 156 protein yang berbeda (Hutoranet al. 2005). KHV merupakan penyakit yang sangat menular dan telah menyebabkan kerugian ekonomi yang besar dalam industri budidaya baik pada budidaya ikan koi maupun pada budidaya ikan mas sehingga memberikan dampak sosial yang signifikan di beberapa negara di seluruh dunia (Sunarto et al.
2014; Pearson 2004). Awal terjadinya wabah penyakit ini diperkirakan menyebabkan kerugian ekonomi pada industri budidaya di Israel hingga mencapai US$ 3 juta/tahun (Perelberg et al. 2003) dan di Indonesia mencapai US$ 10-15 juta/tahun (Sunarto dan Cameron 2005). Wabah KHV umumnya terjadi selama musim semi dan musim gugur, namun ketika suhu air tinggi seperti pada musim panas ataupun rendah pada musim dingin wabah tersebut tidak terjadi (Yuasaet al. 2008).
2
Pengembangan aplikasi vaksin DNA terhadap infeksi KHV masih terus dilakukan, salah satunya dengan menggunakan vaksin DNA KHV GP-11. GP-11 merupakan vaksin DNA yang menggunakan sekuens gen dari ORF 81 virus KHV yang memiliki sifat imunogenik. Vaksin DNA KHV GP-11 merupakan vaksin DNA penyandi glikoprotein dari KHV yang diapit oleh promoter berupa keratin ikanflounderJepang (Alimuddinet al. tidak dipublikasikan). Promoter keratin ini diketahui aktif di berbagai jaringan (Yazawaet al.2005) dan ORF 81 virus KHV diketahui memiliki sifat imunogenik (Zhouet al.2014b). Promoter keratin diisolasi dari ikanflounder JepangParalichthys olivaceus yang memiliki panjang fragmen 1288 pasang basa. Promoter keratin ikan flounder Jepang diketahui memiliki aktivitas ekspresinya hampir di berbagai jaringan. Hasil pengujian oleh Yazawaet al.(2005) pada ikan zebra, menunjukkan bahwa promoter keratin mampu bersifat tidak spesifik pada jaringan tertentu (ubiquitous) dan dapat aktif kapan saja tanpa perlu adanya induksi (house-keeping).
Penelitian sebelumnya mengenai vaksin DNA terhadap ikan mas (C. carpio) telah dilakukan oleh Nuryati et al. (2010a) menggunakan vaksin DNA KHV GP-25 yang merupakan vaksin DNA penyandi glikoprotein dari KHV dengan promoter
berupa β-aktin. Pengujian secara laboratoris telah dilakukan terhadap vaksin DNA KHV GP-25 dan mampu menghasilkan kelangsungan hidup ikan mas berkisar antara 60,7% - 96,67% pada uji tantang menggunakan KHV selama 30 hari, sehingga vaksin tersebut berpotensi efektif digunakan sebagai vaksin KHV. Pada penelitian ini, vaksin DNA KHV GP-11 dengan promoter berupa keratin, diuji efikasinya pada ikan koi dan membandingkannya dengan vaksin DNA KHV GP-25.
Perumusan Masalah
Infeksi koi herpesvirus (KHV) diketahui telah menyebabkan kematian massal pada budidaya ikan koi (C. carpio haematopterus) dan ikan mas (C. carpio). Virus ini bersifat sangat virulen dan memiliki tingkat mortalitas tinggi dalam waktu yang singkat. Berbagai upaya penanggulangan penyakit KHV terus dikembangkan, salah satunya dengan meningkatkan sistem kekebalan tubuh ikan melalui proses vaksinasi dengan menggunakan vaksin DNA KHV GP-11. Vaksinasi ini dilakukan dengan cara memasukkan plasmid yang mengandung potongan DNA virus ke dalam tubuh sehingga sel tubuh akan mentranskripsi dan mentranslasi protein virus yang merupakan protein asing bagi tubuh. Protein asing tersebut akan menginduksi kekebalan tubuh yang akan menetralkan virus KHV yang menginfeksi. Teknik vaksinasi bisa dilakukan dengan berbagai cara, diantaranya melalui injeksi, oral dan perendaman. Injeksi dipilih karena merupakan metode pemberian vaksin yang paling efektif.
Tujuan Penelitian
3 Manfaat Penelitian
Penelitian ini diharapkan dapat menambah alternatif pencegahan infeksi virus KHV dengan menggunakan vaksin DNA. Manfaat lainnya bagi kegiatan budidaya diharapkan dengan penanganan yang tepat dapat meningkatkan kelangsungan hidup dan produktivitas budidaya ikan koi.
2 METODE
Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Desember 2014 sampai dengan Februari 2016 bertempat di Laboratorium Kesehatan Organisme Akuatik dan Laboratorium Genetika Ikan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor, Laboratorium Mikrobiologi Medik, Fakultas Kedokteran Hewan, Institut Pertanian Bogor serta Laboratorium Karantina Ikan dan Laboratorium Genetika Ikan, Balai Besar Perikanan Budidaya Air Tawar (BBPBAT) Sukabumi.
Rancangan Penelitian
Penelitian ini bertujuan untuk menguji vaksin DNA KHV GP-11 dengan cara menginjeksikan secara intramuskuler pada ikan koi berumur 3 bulan dengan bobot tubuh berkisar antara 18 - 20 gram sebanyak 270 ekor. Vaksin DNA KHV diinjeksikan menggunakan 4 dosis yang berbeda dengan 1 kontrol negatif dan 1 kontrol positif. Rancangan yang digunakan pada penelitian ini adalah rancangan acak lengkap dengan 6 perlakuan dan 3 kali ulangan.
Materi Uji Pengadaan Ikan Uji
Ikan uji diperoleh dari Balai Besar Perikanan Budidaya Air Tawar (BBPBAT) Sukabumi, Jawa Barat. Ikan dipelihara dalam akuarium (60 × 40 × 40 cm3) dengan volume air 48 liter/akuarium. Setiap akuarium diisi ikan koi sebanyak 13 ekor. Ikan diaklimatisasi selama 14 hari dengan pergantian air dilakukan sebanyak 50% setiap dua hari sekali. Konfirmasi status kesehatan ikan uji dilakukan sebelum perlakuan untuk mengetahui ada tidaknya infeksi KHV pada ikan yang akan digunakan. Deteksi keberadaan KHV pada ikan dilakukan dengan teknik polymerase chain reaction(PCR) menurut metode yang dikembangkan oleh Grayet al. (2002). Ikan dipilih yang tidak terinfeksi atau bebas dari KHV.
Vaksin DNA KHV
4
glikoprotein 81 yang berasal dari KHV isolat lokal dengan promoter keratin dari ikan flounder Jepang Paralichthys olivaceus (Yazawa et al. 2005), sedangkan plasmid GP-25 menggunakan glikoprotein 25 yang berasal dari KHV isolat lokal dengan promoterβ-aktin dari ikan medaka (Hamadaet al. 1998).
Prosedur Penelitian Perbanyakan Vaksin DNA KHV GP-11
Bakteri Escherichia coli DH5α yang telah mengandung konstruksi vaksin DNA GP-11 dikultur dengan media 2xYT padat pada suhu inkubasi 37C selama 24 jam.E. coliyang tumbuh dipindahkan ke media kultur 2xYT cair dan diinkubasi dalamincubation shakerpada suhu 37 ºC dengan kecepatan 200 rpm selama 17-20 jam. Pelet bakteri dipanen menggunakan sentrifugasi dengan kecepatan 13000 rpm selama 5 menit. Plasmid konstruksi vaksin DNA GP-11 diisolasi menggunakan prosedur Sambrooket al. (1989).
Pelet bakteri diresuspensi dalam 110 µl Solution 1 (dingin), kemudian dihomogenasi menggunakan vortex. SelanjutnyaSolution2 ditambahkan sebanyak 200 µl, tabung mikro dibolak-balik sebanyak 5 kali dan diinkubasi dalam es (on ice) selama 10 menit. Setelah 10 menit,Solution3 ditambahkan sebanyak 150 µl, dihomogenasi dengan vortex dan diinkubasi dalam es (on ice) selama 10 menit, kemudian di sentrifugasi selama 5 menit dengan kecepatan 12000 rpm pada suhu 4 °C. Supernatan yang terbentuk dipindahkan ke dalam tabung mikro baru. Larutan P/C ditambahkan, lalu dihomogenasi dengan vortex. Selanjutnya, dilakukan sentrifugasi selama 5 menit dengan kecepatan 12000 rpm pada suhu 4 °C. Supernatan yang terbentuk dipindahkan ke tabung mikro baru. Presipitasi DNA dilakukan dengan menambahkan 1 mL etanol 100%, dihomogenasi dengan vortex secara pelan, dan diinkubasi dalam suhu -20 °C selama 30 menit. Sentrifugasi dilakukan selama 5 menit dengan kecepatan 12000 rpm pada suhu 4 °C. Supernatan yang terbentuk dibuang seluruhnya, kemudian DNA dibilas dengan 700 µl etanol 70%. Sentrifugasi dilakukan selama 5 menit dengan kecepatan 12000 rpm pada suhu 4 °C. Supernatan yang terbentuk dibuang seluruhnya dan DNA dikering-udarakan dengan cara membalikkan tabung mikro hingga benar-benar kering. Selanjutnya, DNA diresuspensi dalamion exchange water(IEW) dan digabungkan menjadi satu.
Produksi Antibodi Poliklonal Anti-Ikan Koi
Ikan koi sehat dengan bobot 250 - 300 gram diambil serumnya sebanyak 1 mL/ekor. Serum murni yang telah diperoleh kemudian disuntikkan pada kelinci ras
New Zealand White Breddengan bobot sekitar 3 kg. Imunisasi pertama dilakukan dengan menginjeksikan 0,2 mL serum yang diemulsi dengan Freund’s adjuvant
complete(FAC) pada rutesubcutan(SC). Imunisasi kedua dilakukan empat minggu pascaimunisasi pertama dengan dosis 0,2 mL serum yang diemulsi dengan Freund’s adjuvant incomplete (FAI). Imunisasi ketiga dilakukan tiga minggu pascaimunisasi kedua dengan dosis 0,2 mL serum yang diemulsi dengan FAC. Dua minggu setelah imunisasi ketiga, darah kelinci tersebut diambil melalui vena
5 antibodinya dengan uji agar gel presipitasi (agar gel presipitation test/AGPT) (Lampiran 1). Kelinci yang telah membentuk antibodi terhadap ikan koi selanjutnya darah diambil untuk dipanen serum sebanyak-banyaknya. Serum yang telah membentuk antibodi anti-ikan koi disimpan dalam suhu -20 °C hingga akan digunakan untuk ujienzyme-linked immunosorbent assay(ELISA).
Vaksinasi Melalui Metode Injeksi
Proses vaksinasi dilakukan dengan menginjeksikan vaksin DNA KHV GP-11 dan GP-25 secara intramuskuler. Penggunaan vaksin DNA KHV GP-25 bertujuan sebagai pembanding. Dosis yang digunakan untuk proses vaksinasi mengacu pada Nuryati et al. (2010a) dan masing-masing perlakuan dirancang dengan 3 kali ulangan.
Tabel 1. Perlakuan dosis vaksin Perlakuan Dosis Vaksin
(μ g/100μ l) Vaksin DNA Penantangan
Kontrol (-) - - Tanpa Uji tantang
Kontrol positif (+) - - Uji tantang
A 2,5 GP-11 Uji tantang
B 7,5 GP-11 Uji tantang
C 12,5 GP-11 Uji tantang
D 12,5 GP-25 Uji tantang
Pemeliharaan Ikan Uji Pascavaksinasi
Ikan koi yang telah divaksinasi selanjutnya dipelihara di dalam akuarium (60 × 40 × 40 cm3) yang dilengkapi dengan aerasi. Kualitas air media pemeliharaan dipertahankan melalui pergantian air sebanyak 50% dengan frekuensi dua hari sekali. Ikan diberi pakan berupa pelet dengan kadar protein 28% secaraat satiation
pada pagi dan sore hari. Selama pemeliharaan dilakukan pengukuran kualitas air meliputi oksigen terlarut, pH, dan total amonium nitrogen (TAN) yang diukur pada awal, tengah dan akhir penelitian, dan parameter suhu air diukur setiap hari. Suhu air berkisar 23 - 25 °C.
Uji Ekspresi mRNA
Analisis ekspresi mRNA dilakukan pada 24 jam, 14 hari dan 28 hari pascavaksinasi. Total RNA diekstraksi dari ginjal menggunakanRNeasy Mini Kit
(Qiagen, USA). Analisis ekspresi mRNA GP-11 dilakukan dengan metode RT-PCR. Sampel dipotong dan dikeluarkan secara aseptis dan langsung dimasukkan ke dalam tabung mikro yang telah berisi 350μ lbufer RLT, kemudian sampel digerus sampai hancur dan disentrifugasi dengan kecepatan tinggi (full speed) selama 3 menit. Supernatan diambil dengan menggunakan mikropipet secara perlahan dan dipindahkan ke dalam tabung mikro baru. Selanjutnya 350 μ l etanol (70%)
ditambahkan dan dilakukanpipetting. Sebanyak700 μ l sampel tersebut ditransfer
ke RNeasy Spin Column yang diletakkan pada 2 mL collecting tube, kemudian ditutup dan disentrifugasi selama 15 detik dengan kecepatan 10000 rpm. Supernatan yang terbentuk dibuangdan ditambahkan dengan 700 μ l bufer RW1 ke dalamRNeasy Spin Column, kemudian ditutup dan disentrifugasi selama 15 detik dengan kecepatan 10000 rpm. Supernatan yang terbentuk dibuang dan ditambahkan
6
terbentuk dibuang dan ditambahkan dengan 500 μ l bufer RPE ke dalam RNeasy Spin Column, kemudian ditutup dan disentrifugasi selama 2 menit dengan kecepatan 10000 rpm. Selanjutnya,RNeasy Spin Columndiletakkan ke dalam 1,5 mLcollecting tubebaru dan ditambakan dengan 30 μ lRNase free water, kemudian ditutup dan disentrifugasi selama 1 menit dengan kecepatan 10000 rpm. Setelah RNA didapat, dilanjutkan dengan sintesis cDNA dan amplifikasi PCR.
Sintesis cDNA dilakukan dengan membuatmaster mix(High CapacitycDNA
Reverse Transcription Kit, Applied Biosystems, USA) sesuai dengan jumLah sampel yang ada. Master mix kemudian dimasukkan sebanyak 10 μ l ke dalam masing-masing tabung mikro (volume200 μ l). Selanjutnya RNA total dimasukkan ke dalam tabung mikro yang telah berisi master mix sebanyak 10 μ l. Homogenasi dilakukan dengan cara pipetting atau menggunakan vortex dengan kecepatan rendah. Sampel kemudian diinkubasi melalui 4 tahapan (step 1: 25 °C selama 10 menit; step 2: 37 °C selama 120 menit; step 3: 85 °C selama 5 menit; dan step 4: 4 °C selama 30 detik).
Hasil sintesis cDNA selanjutnya di amplifikasi dengan PCR. Dalam proses amplifikasi PCR, untuk cDNA gen GP-11 menggunakan primer F-81 (F : 5’-TTA CCG GTA TGG CCT CCA CTT CAA CCG CT-3’) dan R-81 (R :5’-TAG AGA TCG TCC CAG TCC TT GTT TAG-3’). Sebanyak1 μ lcDNA digunakan sebagai
sampel untuk PCR, kemudian dicampur dengan 1 μ l primerforwarddanreverse, 1
μ l dNTP, 1 μ l ExTaqbuffer, 0,25μ lEx Taqpolymerase (TAKARA, Shiga, Jepang) kemudian ditambahkan SDW sebanyak 4,75 μ l. Proses polimerisasi dilakukan dengan menggunakan mesin PCR pada suhu 94oC selama 3 menit; (94 °C selama
30 detik; 59 °C selama 20 detik; 72 °C selama 30 detik) sebanyak 45 siklus; 72 °C selama 3 menit; dan 4 °C (1 menit). Pengecekan hasil amplifikasi PCR dilakukan menggunakan elektroforesis dengan konsentrasi gel agarosa 1,5% (TopVision®
Agarose, USA), dan marka DNA Ladder 100bp (Vivantis, USA). Hasil elektroforesis selanjutnya didokumentasikan untuk melihat ada tidaknya gen GP-11 yang teramplifikasi.
Pengadaan Isolat KHV
Virus yang digunakan dalam uji tantang berasal dari ikan mas positif KHV setelah dilakukan pengganasan (melalui pasase) dengan menggunakan virus yang berasal dari kultur sel yang didapat dari Instalasi Pengembangan Penelitian Pengendalian Penyakit Ikan (IP4I) Depok, Jawa Barat. Insang ikan yang terinfeksi virus KHV sebanyak 1 gram disuspensikan dengan 9 mL PBS. Suspensi disentrifugasi dengan kecepatan 6500 rpm selama 10 menit pada suhu 4 °C. Supernatan diambil dan disaring dengan filter (kertas millipore) 0,45 μ m. Supernatan yang didapat merupakan stok filtrat dengan konsentrasi 10-1kemudian
diecerkan 100 kali dengan PBS (1 mL filtrat : 99 mL PBS) sehingga konsentrasi filtrat menjadi 10-3.
Uji Tantang
Ikan koi yang telah divaksinasi diuji tantang dengan menginjeksikan filtrat KHV sebanyak 0,1 mL dengan konsentrasi FID50 103 secara intramuskuler (IM)
7 tantang pada hari ke- 42 pascavaksinasi, selama 30 hari pada suhupermissiveKHV (22 C). Ikan yang mati diambil dan dianalisis dengan PCR untuk memastikan kematian akibat infeksi KHV.
Deteksi KHV dengan MetodePolymerase Chain Reaction(PCR)
Insang ikan uji dari masing-masing perlakuan diambil sebanyak 10 - 25 mg untuk selanjutnya dilakukan ekstraksi DNA menggunakan DNeasy Blood and Tissue Kit (Qiagen, USA) dengan pengerjaan manual sesuai dengan prosedur (Lampiran 2). Amplifikasi DNA KHV dilakukan dengan menggunakan primer F (5’-GAC ACC ACA TCT GCA AGG AG-3’)dan primer R (5’-GAC ACA TGT TAC AAT GGT CGC-3’), dengan program PCR yang digunakan mengacu pada Yuasa et al. (2005). Produk PCR selanjutnya dibaca menggunakan elektroforesis dengan kosentrasi gel agarosa 2% (TopVision®Agarose, USA), dan marka PCR sizer 100bp DNA Ladder Norgen Biotek. Hasil elektroforesis selanjutnya didokumentasikan.
Parameter Uji Kelangsungan Hidup (KH)
Kelangsungan hidup (KH) ikan uji diamati hingga akhir masa penelitian. Penghitungan nilai kelangsungan hidup berdasarkan persamaan sebagai berikut:
KH (%)=Nt
No × 100
Keterangan:
KH = Kelangsungan hidup (%)
Nt = JumLah populasi ikan pada akhir pemeliharaan (ekor) No = JumLah populasi ikan pada awal pemeliharaan (ekor) Relative Percent Survival(RPS)
Pengamatan RPS dilakukan setiap hari setelah diuji tantang selama 30 hari. Persentase mortalitas tiap perlakuan dibandingkan dengan kontrol dan RPS dihitung untuk masing-masing perlakuan. Penghitungan dilakukan dengan rumus (Ellis 1988):
RPS(%)= 1-Mn
Mo × 100
Keterangan:
RPS =Relative Percent Survival(%) Mn = % mortalitas ikan perlakuan ke-n Mo = % mortalitas ikan kontrol
Gejala Klinis
8
JumLah Sel Darah Putih (SDP) Total
JumLah sel darah putih dihitung berdasarkan metode Anderson dan Siwicki (1993). Darah dihisap menggunakan pipet hemositometer berbulir putih sampai skala 0,5 lalu diencerkan dengan larutan Turk’s sampai skala maksimum 11. Larutan Turk’s bersifat asam yang akan mengakibatkan lisisnya sel darah merah
sehingga yang tertinggal hanya sel darah putih. Kedua ujung ditutup sejajar kemudian digoyangkan membentuk angka delapan selama 3 - 5 menit sehingga darah tercampur rata. Selanjutnya, larutan pada bagian ujung pipet yang tidak teraduk dibuang sebanyak 2 tetes. Tetesan berikutnya diteteskan ke dalam hemositometer yang telah dilengkapi dengan kaca penutup. Larutan darah akan memenuhi ruang hitung secara kapiler. Penghitungan dilakukan di bawah mikroskop dengan perbesaran 400× dan jumLah leukosit dihitung pada 5 kotak besar hemositometer dengan faktor pengenceran 20 kali. Penghitungan jumLah total sel darah putih berdasarkan persamaan sebagai berikut:
∑ Leukosit = rataan ∑ sel terhitung×
. × faktor pengenceran
Diferensial Leukosit (DL)
Diferensial leukosit dihitung berdasarkan metode Anderson dan Siwicki (1993). Preparat ulas dibuat dengan cara meneteskan 10 µl sampel darah pada gelas obyek dan diratakan dengan bantuan gelas obyek lain (dengan sudut 45 °C) lalu dikeringudarakan. Setelah kering, preparat difiksasi dalam larutan metanol selama 5 - 10 menit dan dikeringudarakan kembali. Selanjutnya preparat direndam ke dalam larutan Giemsa yang diencerkan (1:15) selama 10 - 15 menit dan dibilas dengan air mengalir. Preparat yang sudah selesai kemudian diamati dibawah mikroskop untuk dihitung persentase sel-sel leukosit (limfosit, monosit, neutrophil dan trombosit). Sel-sel leukosit dihitung sampai 100 sel, lalu dikelompokkan dan dipersentasekan sesuai dengan jenisnya dengan rumus sebagai berikut.
Limfosit (%) = × 100 Monosit (%) = × 100
Aktivitas fagositik dihitung berdasarkan metode Anderson dan Siwicki (1993).
Darah diambil sebanyak 50 μ l diletakkan ke dalam microplate. Suspensi
Staphylococcus aerus dalam PBS (107 sel/mL) ditambahkan sebanyak 50 μ l,
9 dikeringudarakan kembali. Selanjutnya preparat direndam ke dalam larutan Giemsa yang diencerkan (1:15) selama 10 - 15 menit dan dibilas dengan air mengalir. Preparat yang sudah selesai kemudian diamati dibawah mikroskop untuk dihitung jumLah sel yang menunjukkan proses fagositik dari 100 sel fagosit yang teramati. Perhitungan aktivitas fagositik berdasarkan persamaan sebagai berikut.
Aktivitas Fagositik (%) = (JumLah sel fagosit yang melakukan fagositosis) × 100 JumLah sel fagosit
Titer Antibodi
Pengukuran titer antibodi dilakukan dengan menggunakan metode ELISA. Preparasi antigen untuk uji ELISA dilakukan dengan sonikasi filtrat KHV dengan frekuensi 40 Hz selama 5 menit (on ice). Antigen yang telah disonikasi diukur konsentrasi proteinnya dengan metode Braddford. Antigen diencerkan 1:160 menggunakan coating buffer (0,05 M carbonate-bicarbonate pH 9,5) sehingga konsentrasi antigen akhir yang digunakan adalah 5 µg/mL. Antigen yang telah diencerkan kemudian dimasukkan ke dalam masing-masing sumur darimicroplate sebanyak 100 μ l/sumur dan diinkubasi padasuhu 4 ºC selama semalam (overnight).
Plate selanjutnya dicuci lima kali menggunakan PBS-T (PBS pH 7,4 + 0,05% Tween-20) sebanyak 300 µl tiap sumur. Masing-masing sumur pada plateuji
di-blockingmenggunakan larutan PBS skim milk5% sebanyak 100 µl dan diinkubasi pada suhu 37 ºC selama 1 jam. Plate kemudian dicuci seperti pada langkah sebelumnya. Sampel serum diencerkan menjadi 1:100 kemudian ditambahkan pada masing-masing sumur sebanyak 100 µl dan diinkubasi pada suhu 37 ºC selama 1 jam. Pengujian sampel dilakukan sebanyak dua kali (duplo). Platekemudian dicuci seperti pada langkah sebelumnya. IgG--ikan koi yang berasal dari kelinci diencerkan menjadi 1:200 kemudian ditambahkan sebanyak 100 µl pada tiap sumur dan diinkubasi pada suhu 37 ºC selama 1 jam.Plate kemudian dicuci seperti pada langkah sebelumnya. IgG anti-rabbit yag telah dikonjugasi dengan horse reddish peroxydase (HRP) diencerkan menjadi 1:10000 kemudian ditambahkan pada tiap sumur sebanyak 100 µl dan diinkubasi pada suhu 37 ºC selama 1 jam. Plate
kemudian dicuci seperti pada langkah sebelumnya. One-Step Ultra TMB-ELISA selanjutnya ditambahkan pada tiap sumur sebanyak 100 µl dan diamkan selama 15 - 20 menit. Reaksi ELISA dihentikan dengan menambahkan 50 µl H2SO42M dan
dilakukan pembacaan optical density (OD) pada 450 nm. Nilaicut of value (CV) pada uji ini diperoleh dengan persamaan:
CV = Rerata kontrol negatif + standar deviasi
Analisis Data
10
3 HASIL DAN PEMBAHASAN
Hasil Kelangsungan Hidup Masa Uji Tantang
Kelangsungan hidup (KH) ikan perlakuan vaksinasi setelah diuji tantang dengan KHV menunjukkan bahwa perlakuan B (93,33%), D (86,67%), dan C (83,33%) menghasilkan nilai yang lebih tinggi (P<0.05) dibandingkan dengan perlakuan K+ (33,33 %) dan perlakuan A (50,00%). Nilai RPS berbanding lurus dengan nilai SR (Tabel 2).
Tabel 2 Kelangsungan hidup (KH) dan relative percent survival (RPS) ikan koi pascauji tantang
Parameter Perlakuan
K- K+ A B C D
KH
(%) 100±0d 33,33±5,77a 50,00±10,00b 93,33±11,55cd 83,33±5,77c 86,67±5,77cd
RPS
(%) - - 24,60±15,85a 90,48±16,50b 75,40±6,87b 80,16±7,65b
Keterangan: kontrol negatif (K-), kontrol positif (K+), GP-11 2,5 μ g/100 μ l (A),
GP-11 7,5 μ g/100 μ l (B), GP-11 12,5 μ g/100 μ l (C), GP-25 12,5 μ g/100 μ l (D).
Data pada baris yang sama dengan huruf yang berbeda menunjukkan perlakuan berbeda nyata (P<0,05).
Hasil tersebut (Tabel 2) menunjukkan bahwa vaksinasi mampu meningkatkan kelangsungan hidup ikan koi terhadap infeksi KHV. Nilai RPS yang diperoleh berbanding lurus dengan nilai KH, dimana nilai RPS pada perlakuan B, C dan D lebih tinggi (P<0,05) dibandingkan dengan perlakuan A.
Pola Kematian Ikan Uji
Ikan uji mulai mengalami kematian delapan hari pascainfeksi (hpi) pada perlakuan K+, sedangkan pada perlakuan B, C, D dan A ikan uji teramati mengalami kematian pada 11 hpi (Gambar 1).
11 Berdasarkan Gambar 1, kematian ikan pada perlakuan B hanya terjadi pada 11 12 hpi. Puncak kematian yang disebabkan oleh infeksi KHV ini terjadi pada 15 -22 hpi. Ikan perlakuan K+ dan A terus mengalami kematian hingga 24 hpi. Nilai mortalitas tertinggi terdapat pada perlakuan K+ (66,67%) yang diikuti oleh perlakuan A (50,00%), C (16,67%), D (13,33%), dan paling rendah adalah perlakuan B (5,77%).
Gejala Klinis
Pengamatan gelaja klinis dilakukan untuk mengamati perubahan yang terjadi pada ikan uji akibat adanya infeksi KHV. Pengamatan gejala klinis ikan uji dilakukan setiap hari selama masa uji tantang. Konfirmasi awal status kesehatan ikan uji dilakukan dengan menggunakan metode PCR. Hasil konfirmasi awal menunjukkan bahwa ikan uji yang digunakan adalah sehat dan bebas KHV (Gambar 2).
Gambar 2 Elektroforegram hasil konfirmasi awal status kesehatan ikan uji bebas KHV menggunakan metode PCR. Marker DNA (M), 1-4 (sampel ikan 1-4), kontrol negatif tanpa DNA templat (N), kontrol positif KHV (P). Tanda kepala panah di sebelah kanan gambar menunjukkan posisi DNA KHV produk amplifikasi PCR (296 bp).
Pengamatan gejala klinis menunjukkan bahwa ikan uji yang diinfeksi KHV mengalami beberapa perubahan morfologis dan tingkah laku dibandingkan dengan ikan kontrol negatif (Gambar 3A). Secara umum gejala klinis yang teramati diantaranya penurunan nafsu makan, ikan berenang di permukaan dan tampak megap-megap, bergerak tidak normal dan kehilangan keseimbangan, tubuh mulai terasa kesat, pecahnya pembuluh darah yang menyebabkan terjadinya pendarahan (hemorrhage) (Gambar 3B), kerusakan pada sirip (Gambar 3C) dan kematian sel (necrosis) pada insang (Gambar 3D).
Gambar 3 Gejala klinis ikan uji yang terinfeksi KHV. Ikan sehat (A),hemorrhage
12
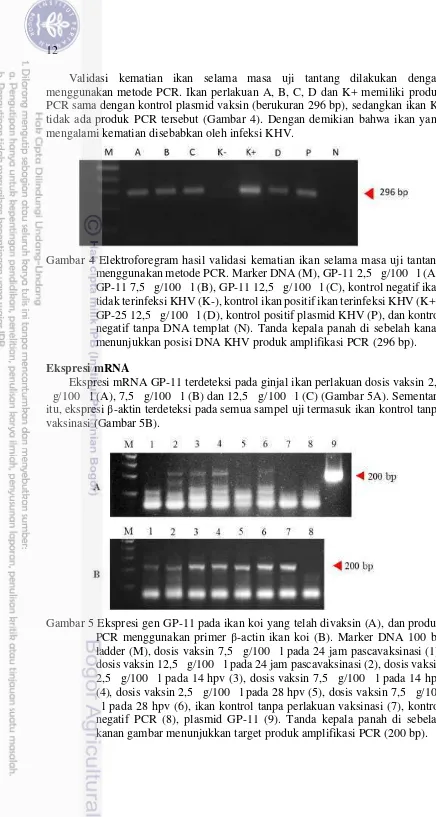
Validasi kematian ikan selama masa uji tantang dilakukan dengan menggunakan metode PCR. Ikan perlakuan A, B, C, D dan K+ memiliki produk PCR sama dengan kontrol plasmid vaksin (berukuran 296 bp), sedangkan ikan K-tidak ada produk PCR tersebut (Gambar 4). Dengan demikian bahwa ikan yang mengalami kematian disebabkan oleh infeksi KHV.
Gambar 4 Elektroforegram hasil validasi kematian ikan selama masa uji tantang menggunakan metode PCR. Marker DNA (M), GP-11 2,5 μ g/100 μ l(A), GP-11 7,5 μ g/100 μ l (B), GP-11 12,5 μ g/100 μ l (C),kontrol negatif ikan tidak terinfeksi KHV (K-), kontrol ikan positif ikan terinfeksi KHV (K+), GP-25 12,5 μ g/100 μ l (D), kontrol positifplasmid KHV (P), dan kontrol negatif tanpa DNA templat (N). Tanda kepala panah di sebelah kanan menunjukkan posisi DNA KHV produk amplifikasi PCR (296 bp). Ekspresi mRNA
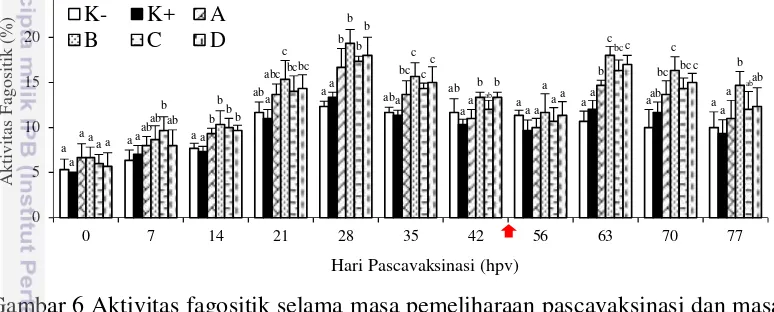
Ekspresi mRNA GP-11 terdeteksi pada ginjal ikan perlakuan dosis vaksin 2,5
μ g/100 μ l (A), 7,5 μ g/100 μ l (B) dan 12,5 μ g/100 μ l (C) (Gambar5A). Sementara
itu, ekspresi β-aktin terdeteksi pada semua sampel uji termasuk ikan kontrol tanpa vaksinasi (Gambar 5B).
Gambar 5 Ekspresi gen GP-11 pada ikan koi yang telah divaksin (A), dan produk
PCR menggunakan primer β-actin ikan koi (B). Marker DNA 100 bp ladder (M), dosis vaksin 7,5 μ g/100 μ l pada 24 jam pascavaksinasi (1),
dosis vaksin 12,5 μ g/100 μ l pada 24 jam pascavaksinasi (2), dosis vaksin
2,5 μ g/100 μ l pada 14 hpv (3), dosis vaksin 7,5 μ g/100 μ l pada 14 hpv
(4), dosis vaksin 2,5 μ g/100 μ l pada 28 hpv (5), dosis vaksin 7,5 μ g/100 μ l pada 28 hpv (6), ikan kontrol tanpa perlakuan vaksinasi (7), kontrol
13
Berdasarkan Gambar 5, promoter keratin ikan flounder Jepang Paralichthys olivaceus dapat aktif pada ikan koi. Namun demikian, ekspresi gen GP-11 pada ikan koi terekspresi pada waktu yang berbeda-beda, yaitu pada 24 jam pascavaksinasi ekspresi terdeteksi pada sampel 2, 14 hari pascavaksinasi (hpv) ekspresi gen tersebut terdeteksi pada sampel 3 dan 4, akan tetapi pada hari ke-28 ekspresi tidak terdeteksi. Penelitian lebih lanjut perlu dilakukan untuk memperoleh jawaban mengapa hasil tersebut berbeda-beda.
Aktivitas Fagositik (AF)
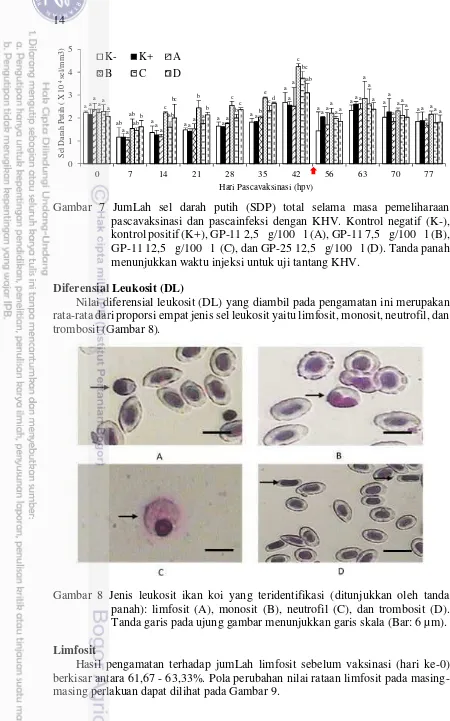
Pengamatan aktivitas fagositik (AF) dilakukan pada ikan uji sebelum dan setelah uji tantang. Pengamatan terhadap nilai AF dalam darah ikan pada semua perlakuan menunjukkan hasil yang berfluktuatif (Gambar 6).
Gambar 6 Aktivitas fagositik selama masa pemeliharaan pascavaksinasi dan masa pemeliharaan pascainfeksi dengan KHV. Kontrol negatif (K-), kontrol positif (K+), GP-11 2,5 μ g/100 μ l (A), GP-11 7,5 μ g/100 μ l (B), GP-11 12,5 μ g/100 μ l (C), dan GP-25 12,5 μ g/100 μ l (D). Tanda panah
menunjukkan waktu injeksi untuk uji tantang KHV.
Berdasarkan Gambar 6, nilai AF teramati mengalami peningkatan pada semua perlakuan sejak awal pengamatan hingga 28 hpv. Ikan perlakuan vaksinasi (A, B, C dan D) memiliki nilai yg lebih tinggi (P<0,05) dibandingkan dengan ikan kontrol (K) pada 28 hpv. Namun demikian, nilai AF mengalami penurunan pada semua perlakuan sejak 35 hpv sampai satu minggu pascainfeksi (56 hpv). Pada minggu kedua pasacauji tantang (63 hpv), terjadi peningkatan kembali pada semua perlakuan di mana perlakuan ikan yang diberi vaksin memiliki nilai yang lebih tinggi (P<0,05) dibandingkan dengan ikan kontrol. Secara umum nilai AF perlakuan vaksinasi lebih tinggi dibandingkan dengan ikan kontrol pada masa pemeliharan.
Jumlah Sel Darah Putih (SDP) Total
14
Gambar 7 JumLah sel darah putih (SDP) total selama masa pemeliharaan pascavaksinasi dan pascainfeksi dengan KHV. Kontrol negatif (K-), kontrol positif (K+), GP-11 2,5 μ g/100 μ l (A), GP-11 7,5 μ g/100 μ l (B),
GP-11 12,5 μ g/100 μ l (C), dan GP-25 12,5 μ g/100 μ l (D). Tanda panah
menunjukkan waktu injeksi untuk uji tantang KHV. Diferensial Leukosit (DL)
Nilai diferensial leukosit (DL) yang diambil pada pengamatan ini merupakan rata-rata dari proporsi empat jenis sel leukosit yaitu limfosit, monosit, neutrofil, dan trombosit (Gambar 8).
Gambar 8 Jenis leukosit ikan koi yang teridentifikasi (ditunjukkan oleh tanda panah): limfosit (A), monosit (B), neutrofil (C), dan trombosit (D). Tanda garis pada ujung gambar menunjukkan garis skala (Bar: 6 µm). Limfosit
Hasil pengamatan terhadap jumLah limfosit sebelum vaksinasi (hari ke-0) berkisar antara 61,67 - 63,33%. Pola perubahan nilai rataan limfosit pada masing-masing perlakuan dapat dilihat pada Gambar 9.
15
Gambar 9 Persentase jumLah limfosit selama masa pemeliharaan pascavaksinasi dan uji tantang. Kontrol negatif (K-), kontrol positif (K+), GP-11 2,5
μ g/100μ l (A), GP-11 7,5 μ g/100 μ l (B), GP-11 12,5 μ g/100 μ l (C), dan
GP-25 12,5 μ g/100 μ l (D). Tanda panah menunjukkan waktu injeksi
untuk uji tantang KHV.
Berdasarkan Gambar 9, persentase jumLah limfosit menunjukkan bahwa semua perlakuan vaksinasi mengalami peningkatan pada hari ke-7 pascavaksinasi. JumLah limfosit pada ikan perlakuan vaksinasi terus mengalami peningkatan hingga hari ke-42 pascavaksinasi. Namun demikian, jumLah limfosit mengalami penurunan yang signifikan (P<0,05) pada perlakuan K+, A, B, C dan D, yaitu satu minggu pascainfeksi (56 hpv). JumLah limfosit mengalami kenaikan kembali pada minggu ke-2 hingga minggu ke-3 pascainfeksi (63 - 70 hpv). Secara umum jumLah limfosit perlakuan vaksinasi lebih tinggi dibandingkan dengan kontrol pada masa pemeliharaan.
Monosit
Hasil pengamatan terhadap jumLah monosit sebelum vaksinasi (hari ke-0) berkisar antara 6,33 - 8,00%. Pola perubahan nilai rataan monosit pada masing-masing perlakuan dapat dilihat pada Gambar 10.
Gambar 10 Persentase jumLah monosit selama masa pemeliharaan pascavaksinasi dan uji tantang. Kontrol negatif (K-), kontrol positif (K+), GP-11 2,5
16
Berdasarkan Gambar 10, persentase jumLah monosit menunjukkan bahwa semua perlakuan vaksinasi mengalami peningkatan pada 7 hpv. Rataan jumLah monosit menunjukkan perubahan yang fluktuatif di setiap minggu pascavaksinasi. Perubahan ini terjadi sebagai respons keseimbangan hematologi terhadap peningkatan jenis sel leukosit lainnya. Persentase jumLah monosit mengalami peningkatan yang signifikan (P<0,05) pada perlakuan K+, A, B, C dan D, yaitu satu minggu pascainfeksi (56 hpv). Namun demikian, pada minggu ke-2 pascainfeksi (63 hpv) jumLah monosit kembali menurun pada semua perlakuan. JumLah monosit mengalami peningkatan kembali pada minggu ke-3 pascainfeksi (70 hpv). Secara umum jumLah monosit perlakuan vaksinasi lebih tinggi dibandingkan dengan kontrol pada masa pemeliharaan.
Neutrofil
Hasil pengamatan terhadap jumLah neutrofil sebelum vaksinasi (hari ke-0) berkisar antara 6,33 - 8,33%. Pola perubahan nilai rataan neutrofil pada masing-masing perlakuan dapat dilihat pada Gambar 11.
Gambar 11 Persentase jumLah neutrofil selama masa pemeliharaan pascavaksinasi dan masa pemeliharaan pascauji tantang dengan KHV. Kontrol negatif (K-), kontrol positif (K+), GP-11 2,5 μ g/100 μ l(A), GP-11 7,5 μ g/100 μ l (B), GP-11 12,5 μ g/100 μ l (C), danGP-25 12,5 μ g/100 μ l (D). Tanda panah menunjukkan waktu injeksi untuk uji tantang KHV.
Berdasarkan Gambar 11, persentase jumLah neutrofil menunjukkan bahwa terjadi perubahan yang fluktuatif di setiap minggu pascavaksinasi. Rataan jumLah neutrofil pada semua perlakuan vaksinasi mengalami peningkatan pada 7 hpv. Namun, jumLah neutrofil terus mengalami penurunan hingga uji tantang. Persentase jumLah neutrofil mengalami peningkatan yang signifikan (P<0,05) pada perlakuan K+, A, B, C dan D, yaitu satu minggu pascainfeksi (56 hpv).
Trombosit
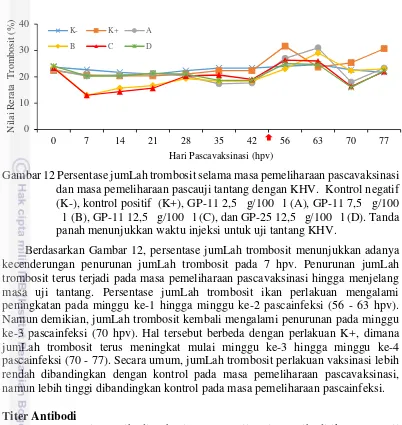
Hasil pengamatan terhadap jumLah trombosit sebelum vaksinasi (hari ke-0) berkisar antara 22,33 - 24,00 %. Pola perubahan nilai rataan trombosit pada masing-masing perlakuan dapat dilihat pada Gambar 12.
17
Gambar 12 Persentase jumLah trombosit selama masa pemeliharaan pascavaksinasi dan masa pemeliharaan pascauji tantang dengan KHV. Kontrol negatif (K-), kontrol positif (K+), GP-11 2,5 μ g/100 μ l(A), GP-11 7,5 μ g/100 μ l (B), GP-11 12,5 μ g/100 μ l (C), dan GP-25 12,5μ g/100 μ l (D). Tanda panah menunjukkan waktu injeksi untuk uji tantang KHV.
Berdasarkan Gambar 12, persentase jumLah trombosit menunjukkan adanya kecenderungan penurunan jumLah trombosit pada 7 hpv. Penurunan jumLah trombosit terus terjadi pada masa pemeliharaan pascavaksinasi hingga menjelang masa uji tantang. Persentase jumLah trombosit ikan perlakuan mengalami peningkatan pada minggu ke-1 hingga minggu ke-2 pascainfeksi (56 - 63 hpv). Namun demikian, jumLah trombosit kembali mengalami penurunan pada minggu ke-3 pascainfeksi (70 hpv). Hal tersebut berbeda dengan perlakuan K+, dimana jumLah trombosit terus meningkat mulai minggu ke-3 hingga minggu ke-4 pascainfeksi (70 - 77). Secara umum, jumLah trombosit perlakuan vaksinasi lebih rendah dibandingkan dengan kontrol pada masa pemeliharaan pascavaksinasi, namun lebih tinggi dibandingkan kontrol pada masa pemeliharaan pascainfeksi. Titer Antibodi
18
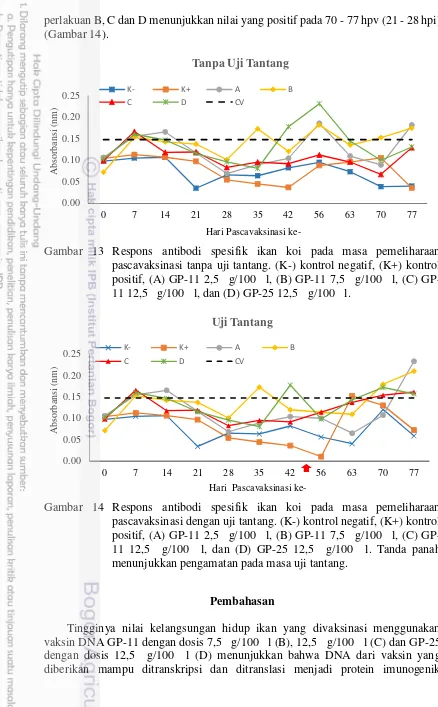
perlakuan B, C dan D menunjukkan nilai yang positif pada 70 - 77 hpv (21 - 28 hpi) (Gambar 14).
Gambar 13 Respons antibodi spesifik ikan koi pada masa pemeliharaan pascavaksinasi tanpa uji tantang. (K-) kontrol negatif, (K+) kontrol positif, (A) GP-11 2,5 μ g/100 μ l, (B) GP-11 7,5 μ g/100 μ l, (C) GP -11 12,5 μ g/100 μ l, dan (D) GP-25 12,5 μ g/100μ l.
Gambar 14 Respons antibodi spesifik ikan koi pada masa pemeliharaan pascavaksinasi dengan uji tantang. (K-) kontrol negatif, (K+) kontrol positif, (A) GP-11 2,5 μ g/100 μ l, (B) GP-11 7,5 μ g/100 μ l, (C) GP -11 12,5 μ g/100 μ l, dan (D) GP-25 12,5 μ g/100 μ l. Tanda panah menunjukkan pengamatan pada masa uji tantang.
Pembahasan
Tingginya nilai kelangsungan hidup ikan yang divaksinasi menggunakan vaksin DNA GP-11 dengan dosis 7,5 μ g/100 μ l (B), 12,5 μ g/100 μ l (C) dan GP-25 dengan dosis 12,5 μ g/100 μ l (D) menunjukkan bahwa DNA dari vaksin yang diberikan mampu ditranskripsi dan ditranslasi menjadi protein imunogenik
19 (glikoprotein KHV) yang diekspresikan pada ikan koi. Protein ini dikenali tubuh sebagai antigen KHV sehingga ikan dapat menginduksi respons imun dan memberikan proteksi terhadap infeksi virus KHV. Plasmid DNA yang diinjeksikan dalam sel inang akan ditranskripsi dan ditranslasi menjadi protein yang identik dengan protein tipe liar yang diekspresikan oleh virus sehingga mampu menginduksi respons kekebalan (Donnelly et al. 1997; Donnelly et al. 2000). Menurut Tangheet al. (2000), vaksin DNA dapat menginduksi imun dengan kuat dan tahan lama terhadap patogen infeksius tanpa perlu adanya organisme hidup, replikasi vektor ataupun adjuvan. Aktivasi respons imun direpresentasikan oleh tingginya kelangsungan hidup ikan pada perlakuan B (93,33%), C (83,33%) dan D (86,67%) selama 30 hari masa uji tantang dibandingkan dengan ikan kontrol (33,33%) (Tabel 2). Nilai RPS pada perlakuan B (90,48%), C (75.40%) dan D (80,16%) telah memenuhi kisaran nilai yang efektif untuk proteksi, yaitu lebih dari 50% (Triyantoet al. 1997). Vaksinasi menggunakan dosis yang lebih rendah, yaitu 2,5 μ g/100 μ l (A) tidak efektif karena masih menyebabkan kematian ikan hampir
75% setelah uji tantang.
Penggunaan vaksin DNA GP-11 dan GP-25 dalam penelitian ini memiliki efektivitas yang sama dalam kaitannya dengan proteksi terhadap infeksi KHV. Namun, dosis vaksin DNA GP-11 (7,5μ g/100 μ l) yang lebih rendah dibandingkan
GP-25 (12,5μ g/100 μ l) telah mampu memberikan proteksi terhadap infeksi KHV.
Rendahnya dosis yang digunakan, menjadikan vaksin DNA GP-11 lebih ekonomis dibandingkan GP-25. Penentuan dosis vaksin yang tepat akan berimplikasi terhadap efisiensi nilai ekonomis vaksin yang digunakan. Nuryati (2010) menyatakan bahwa pemilihan dosis vaksin yang akan digunakan harus mempertimbangkan nilai efisiensi yang melibatkan perhitungan dari sisi ekonomi.
Ikan yang diuji tantang menunjukkan adanya infeksi KHV dengan gejala klinis berupa terjadinya penurunan nafsu makan, ikan berenang di permukaan dan tampak megap-megap, bergerak tidak normal dan kehilangan keseimbangan, serta tubuh mulai terasa kesat, terutama pada perlakuan ikan kontrol positif. Menurut Taukhid
20
gejala klinis yang terjadi pada permukaan tubuh seperti adanya borok (ulcer) atau pendarahan (hemorraghe) (Hedricket al. 2000).
DNA vaksin yang ditranskripsi dan ditranslasi oleh sel inang dibuktikan berdasarkan analisis mRNA dari vaksin DNA GP-11 yang teramati pada 24 jam pascavaksinasi, dan 14 hari pascavaksinasi. Hasil ekspresi gen tersebut menunjukkan bahwa promoter keratin ikanflounderJepangParalichthys olivaceus
dapat aktif pada ikan koi. Ekspresi gen pada tiap perlakuan teramati aktif pada waktu yang berbeda-beda (Gambar 5). Namun demikian, ekspresi gen dari vaksin DNA dalam waktu singkat (short-term expression) sudah cukup untuk membangkitkan respons imunitas baik seluler maupun humoral, sehingga mampu memberikan proteksi terhadap infeksi KHV. Respons imun dimulai oleh sel-sel APC (antigen precenting cells) yaitu sel-sel dendrit maupun makrofag setelah glikoprotein virus KHV di ekspresikan oleh sel tubuh denganup-takeDNA vaksin. Plasmid DNA yang masuk ke dalam sel akan ditranskripsi dan ditranslasi sehingga menghasilkan protein imunogenik yang berikutnya akan dipresentasikan sebagai protein asing (antigen) di permukaan sel oleh MHC kelas I dan MHC kelas II. Sel TCR (Tcell receptor) mengenali antigen yang dipresentasikan oleh molekul MHC kelas I dan II masing-masing melalui molekul CD8+ yang ada di sel T (cytotoxicT
cell), dan CD4+ dari sel T (T helper) (Tonheim et al. 2008). Antigen endogenus diproses melalui jalur sitosolik (cytosolic pathway) dan dipresentasikan oleh molekul MHC kelas I. Antigen eksogenus diproses melalui jalur endositik (endocytic pathway) dan dipresentasikan oleh molekul MHC kelas II (Rawat et al.
2007).
Ekspresi gen yang dihasilkan oleh vaksin DNA GP-11 pada sel inang, selain menginduksi sistem kekebalan humoral, juga menginduksi sistem kekebalan seluler yang ditunjukkan melalui hasil pengamatan aktivitas fagositik (AF). Secara umum nilai AF perlakuan vaksinasi lebih tinggi dibandingkan dengan kontrol baik pada masa pemeliharaan pascavaksinasi maupun pada masa uji tantang (Gambar 6). Peningkatan nilai AF teramati mulai 7 - 28 hpv. Penurunan secara signifikan terjadi pada 56 hpv (7 hpi), hal ini berkaitan dengan proses uji tantang KHV. Penurunan nilai AF terjadi karena adanya pengaruh dari aktivitas kekebalan seluler pada sistem sirkulasi, diduga kemungkinan besar aktivitas fagositik berlangsung di tempat terjadinya infeksi sehingga sel-sel leukosit yang melakukan aktivitas fagositik di pembuluh darah lebih rendah (Nuryati 2010). Pola peningkatan dan penurunan nilai AF tersebut berkaitan dengan respons imun seluler yang terjadi pada ikan yang terinfeksi KHV. Tizzard (1998) menyatakan bahwa pola peningkatan nilai AF mencerminkan fungsi dari peningkatan total leukosit maupun persentase pada masing-masing sel leukosit (limfosit, monosit, neutrofil, dan trombosit) terhadap antigen yang masuk ke dalam tubuh.
21 darah putih. Peningkatan jumLah leukosit merupakan respons sistem imunitas ikan dalam mengembangkan respons imunitas seluler sebagai pemicu respons kekebalan tubuh (Kresno 2001). JumLah limfosit selama masa pemeliharaan pascavaksinasi teramati meningkat. Limfosit memiliki peran terutama dalam penyediaan zat kebal untuk pertahanan tubuh dengan cara mengenali antigen melalui reseptor spesifik pada membran sel (Mundriyantoet al.2002). Peningkatan jumLah sel limfosit pada pengamatan ini berbanding terbalik dengan jumLah sel monosit dan neutrofil yang teramati menurun selama masa pemeliharaan pascavaksinasi. Hal ini lebih disebabkan karena tidak adanya infeksi yang masuk ke dalam tubuh ikan sehingga sel monosit maupun neutrofil belum sepenuhnya teraktivasi. Kondisi ini teramati pula pada pengamatan trombosit selama masa pemeliharaan pascavaksinasi.
JumLah leukosit secara umum teramati mengalami penurunan pada seluruh perlakuan yaitu pada 7 hpi (56 hpv). Penurunan jumLah leukosit disebabkan karena respons dari sistem kekebalan tubuh yang mulai bekerja untuk mengatasi serangan yang ditimbulkan oleh KHV. Nuryati et al. (2010b) menyatakan bahwa secara umum tren penurunan jumLah leukosit pada ikan perlakuan dan ikan kontrol positif setelah uji tantang menunjukkan bahwa leukosit tersebut diduga aktif dan keluar dari pembuluh darah menuju ke jaringan yang terinfeksi. Kondisi ini juga teramati pada penurunan jumLah limfosit dalam darah yang disebabkan karena sebagian besar limfosit ditarik dari sistem sirkulasi dan berkompetisi ke dalam jaringan yang terinfeksi. JumLah sel limfosit yang memadai diperlukan untuk menghentikan infeksi virus yang bersifat intraseluler. Penghancuran mikroorganisme intraseluler seperti virus diperlukan respons imun seluler yang merupakan fungsi dari sel limfosit T dengan cara membunuh sel terifeksi untuk mampu membunuh mikroorganisme yang mengifeksi. Peningkatan limfosit T yang berupa sub populasi dari sel T yang disebut sebagai T-sitotoksik akan menghancurkan mikroorganisme intraseluler dengan cara mengenali mikroorganisme atau peptide-antigen virus yang langsung disajikan melalui MHC kelas I (cell to cell) pada permukaan sel makrofag. Selain itu, T-sitotoksik juga menghasilkan gamma-interferon yang mampu mencegah penyebaran mikroorganisme ke dalam sel lain. Dalam prosesnya, sistem imun seluler ini melibatkan sel limfosit T-sitotoksik dan sel limfosit yang tergolong dalam natural killer (sel NK), antibody dependent cell mediated cytotoxicity(ADCC), dan major histocompability complex(MHC) kelas I (Fenner
22
ikan mengalami kerusakan (luka) akibat infeksi dari KHV, sehingga trombosit memberikan repons dalam proses pembekuan darah untuk mencegah terjadinya pendarahan (hemorrhage) yang lebih lanjut (Clausset al.2008).
Salah satu kelebihan dari vaksin DNA adalah kemampuannya untuk mengaktifkan respons imun seluler maupun humoral (Tonheim et al. 2008). Respons titer antibodi yang terbentuk merupakan parameter penting dari efek vaksinasi. Pembentukan antibodi pada ikan pascavaksinasi dimulai saat sel
T-helper mengenali mikroorganisme melalui MHC kelas II yang terdapat pada permukaan sel makrofag. Sinyal ini kemudian menginduksi limfosit untuk memproduksi berbagai jenis limfokin. Pengikatan MHC kelas II dengan T-helper
akan memberi sinyal agar limfosit B berproliferasi dan berdiferensiasi untuk membentuk antibodi (Kresno 2001).
Titer antibodi pascavaksinasi pada penelitian ini secara umum teramati berfluktuasi baik pada perlakuan tanpa uji tantang maupun perlakuan dengan uji tantang. Titer antibodi pada kedua perlakuan menunjukkan nilai yang positif terbentuk pada 7 - 14 hpv. Namun demikian, nilai absorbansi pada 21 - 28 hpv teramati menurun. Kenaikan nilai absorbansi kembali teramati pada 35 dan 42 hpv, masing-masing hanya terjadi pada perlakuan B dan D. Nilai absorbansi pada perlakuan C tidak teramati meningkat, hal ini diduga berkaitan dengan fenomena hormesis. Hormesis merupakan suatu fenomena hubungan antara pemberian dosis dan response yang ditimbulkan, umumnya dicirikan dengan adanya stimulasi pada pemberian dosis rendah dan inhibisi pada pemberian dosis tinggi (Calabrese dan Baldwin 2003). Pola pembentukan titer antibodi yang teramati baik pada perlakuan tanpa uji tantang maupun dengan uji tantang diduga berkaitan dengan ekspresi gen GP-11 di dalam tubuh ikan. Hasil ekspresi gen pada tiap perlakuan teramati aktif pada waktu yang berbeda, dimana ekspresi gen GP-11 dalam kaitannya dengan respons antibodi yang dihasilkan berkaitan erat dengan aktivitas promoter di dalamnya (Alimuddin et al. 2009). Respons pembentukan antibodi pada pengamatan 56 - 77 hpv menunjukkan hasil yang berbeda pada kedua perlakuan, dimana perlakuan tanpa uji tantang pada 56 hpv teramati terus meningkat (Gambar 13). Hasil tersebut berbanding terbalik pada perlakuan dengan uji tantang yang teramati menurun pada 56 hpv (7 hpi). Peningkatan titer antibodi pada perlakuan tanpa uji tantang (56 hpv) menunjukkan bahwa tubuh masih terus memproduksi antibodi, sedangkan penurunan titer antibodi yang teramati pada perlakuan dengan uji tantang (56 hpv) berkaitan dengan proses infeksi KHV, yaitu antibodi dalam sirkulasi darah digunakan untuk menetralkan virus yang beredar sehingga jumLah immunoglobulin (Ig) yang beredar menurun.
23 melalui pengikatan molekul-molekul pada amplop virus. Proses pelekatan ini selanjutnya akan akan menginisiasi terjadinya lisis dan pembersihan (clearance) virus oleh antibodi melaluiantibody-dependent celluler cytotoxicity (ADCC) atau
complement-dependent cytotoxicity(CDC), yang akan menghambat replikasi virus di dalam sel, keluarnya (release) virus dari dalam sel yang terinfeksi maupun transmisi virus dari sel ke sel lainnya (Burton 2002).
4 SIMPULAN DAN SARAN
Simpulan
Aplikasi vaksin DNA GP-11 dengan dosis 7,5 μ g/100 μ l, 12,5 μ g/100 μ l dan
GP-25 dengan dosis 12,5 μ g/100 μ l memiliki efektivitas yang sama dalam meningkatkan sistem imun terhadap infeksi KHV. Hal ini didukung dengan data parameter imunitas baik seluler maupun humoral yang bekerja secara sinergi sehingga mampu meningkatkan kelangsungan hidup ikan yang diberi vaksin. Berdasarkan nilai RPS, vaksin DNA GP-11 layak untuk diaplikasikan.
Saran
Penelitian lanjut terhadap ekspresi gen GP-11 pada berbagai jaringan dengan jarak pengambilan sampel setiap minggu pada masa inkubasi agar diketahui sejauh mana gen tersebut dapat terekspresi dan perlu dilakukan penelitian lebih lanjut dengan masa pemeliharaan pascavaksinasi yang lebih lama untuk mengetahui sejauh mana antibodi yang dihasilkan dari vaksin DNA KHV GP-11 dapat bertahan.
DAFTAR PUSTAKA
Alimuddin, Lola IP, MH Fahrudin A, Chairul M, Carman O, Sumantadinata K.
2009. Aktivitas promoter β-aktin ikan medaka Jepang (Oryzias latipes) pada ikan mas (Cyprinus carpio).Jurnal Natur Indonesia.11:70-77.
Almendras JME, Catap ES. 2002. Immunity and Biological Methods of Disease Prevention and Control. Tighbauan Iloilo Philiphine: SEAFDEC/AQD. Anderson DP, Siwicki AK. 1993. Basic Haematology and Serology for Fish Health
Programs. Paper Presented in Second Symposium on Diseases in Asian
Aquaculture”Aquatic Animal Health and Environment”. Phuket, Thailand. 25- 29th October.
Baratawidjaja KG. 2002. Imunologi Dasar. Jakarta (ID): Universitas Indonesia. Bretzinger A, Fischer-Scherl T, Oumouna M, Hoffmann R, Truyen U. 1999. Mass
mortalities in koi carp (Cyprinus carpio) associated with gill and skin disease.
24
Calabrese EJ, Baldwin LA. 2003. Hormesis: The dose-response revolution.Annu. Rev. Pharmacol. Toxicol.43:175-197
Clauss TM, Dove ADM, Arnold JE. 2008. Hematologic disorders of fish.Vet Clin Exot Anim. 11:445-462.
Cho MY, Shon SK, Park SI. 2005. The status of viral disease of carp in Korea: Its control and research development. Bull. Fish. Res. Agent. Supplement. 2:23-25.
Davison AJ. 2010. Herpesvirus systematics.Vet. Microbiol. 143:52–69.
Dimmock NJ. 1995. Update on the neutralization of animal viruses. Rev Med Virology.5:165–179.
Donnelly JJ, Jeffrey BU, John WS, Margaret AL. 1997. DNA Vaccines.Annu. Rev. Immunology. 15:617-648.
Donnelly JJ, Margaret AL, Jeffrey BU. 2000. Antigen presentation and DNA vaccines.Am J Respir Crit Care Med. 162:190-193.
Fenner FJ, Gibbs EPJ, Murphy FA, Roil R, Studdert MJ, White DO. 1993. Virologi veteriner. California: Academic Press.
Gray WL, Mullis L, LaPatra SE, Groff JM, Goodwin A. 2002. Detection of koi herpesvirus DNA in tissue of infected fish. Journal of Fish Disease. 25:171-178.
H Rahmati-Halasoo, Zargar A, Ahmadivand S, Shokrpoor S, Ezhari S, Mousavi HAE. 2016. First detection of koi herpesvirus from koi (Cyprinus carpio L) experiencing mass mortalities in Iran: clinical, histopathological and molecular study.Journal of Fish Diseases. doi:10.1111/jfd.12448.
Haenen OLM, Way K, Bergman SM, Ariel E. 2004. The emergence of koi herpesvirus and its significance to European aquaculture. Bulletin of the European Association of Fish Pathology.24:293-307.
Hamada K, Tamaki K, Sasado T, Watai Y, Kani S, Wakamatsu Y, Ozato K, Kinoshita M, Kohno R, Takagi S, and Kimura M. 1998. Usefulness of the medaka â-actin promoter investigated using a mutant GFP reporter gene in transgenic medaka (Oryzias latipes). Molecular Marine Bology and Biotechnology. 7:173-180.
Hedrick RP, Gilad O, Yun S, Spangenberg JV. 2000. A herpesvirus associated with mass mortality of juvenile and adult koi, a strain of common carp. Journal Aquatic Animal Health.12:44-57.
Hutoran M, Ronen A, Perelberg A, Ilouze M, Dishon A, Bejerano I, Chen N, Kotler M. 2005. Description of an as yet unclassified DNA virus from diseased
Cyprinus carpiospecies.Journal Virology.79:1983-1991.
Kollner B, Wasserab B, Kotterba G, Fischer U. 2002. Evaluation of immune functions of rainbow trout (Onchorinchus mykiss)-how can environmental influences be detected?.Journal Toxicology Letters.131:83-95.
Kresno SB. 2011. Imunologi: Diagnosis dan prosedur laboratorium. Ed ke-3. Jakarta (ID): Universitas Indonesia.
Kurath G. 2008. Biotechnology and DNA vaccines for aquatic animals. Rev Sci Tech Off Int Epiz.27(1):175-196.