i
BERKEPADATAN TINGGI
BUDIYANTI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
ii
Dengan ini saya menyatakan bahwa tesis “Respon Fisiologi Benih Ikan Kerapu Macan Epinephelus fuscoguttatus Akibat Penggunaan Minyak Sereh dalam Transportasi Tertutup Berkepadatan Tinggi” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Oktober 2010
Budiyanti
NRP C151080181
iii
Budiyanti. Physiological Responses of Tiger grouper Juveniles Epinephelus fuscoguttatus as effectof utilisation of Lemon Grass Oil in Sealed Transportation
with high Density, Supervised by EDDY SUPRIYONO and TATAG BUDIARDI.
This research aimed to analyze the impact of lemon grass oil as anesthetic on physiological responses, growth and survival rate of tiger groupers juveniles (7 cm and 4.02 gram in average of length and weight respectively) during and post transportation. The research conducted in Laboratory of Environmental Aquaculture, Department of Aquaculture, Faculty of Fishery and Marine Science, Bogor Agricultural University for two months. A completely randomised design was applied to measure the impact of three different doses of lemon grass (10 mg/l, 20 mg/l and 30 mg/l), a solution with no lemon grass oil was used as control, with two replications. The result showed that 10 mg/l of lemon grass provided the lowest concentration of both total ammonia nitrogen (TAN) and carbon dioxide (CO2) in the transportation media (6.459 ± 1.290 mg/l and 32.561 ± 6.498 mg/l respectively). Moreover, it also provided similar physiological responses to normal fishes (i.e. blood glucose 25.19 ± 0.05 mg/dl, erythrocytes 1.28 x 106 cell/mm3, leukocytes 2.60 x 104 cell/mm3), N:L ratio 0,41%, minimum gill damaged, survival rate was 97.5% and of 1.43% growth rate.
iv
fuscoguttatus Akibat Pemanfaatan Minyak Sereh dalam Transportasi Tertutup
Berkepadatan Tinggi. Dibimbing oleh EDDY SUPRIYONO dan TATAG BUDIARDI.
Ikan kerapu merupakan komoditas perikanan laut dengan nilai ekonomis tinggi dan telah dapat dikembangkan di Indonesia melalui teknologi pengembangan budidaya. Ketersediaan benih pada setiap lokasi kegiatan budidaya ikan kerapu masih belum dapat dipenuhi secara lokal sehingga biasanya didatangkan dari daerah lain, oleh karena itu perlu suatu teknologi transportasi agar benih ikan kerapu tetap dalam kondisi baik dan tetap hidup meskipun telah mengalami berbagai keadaan selama perjalanan.
Minyak sereh merupakan salah satu alternatif pilihan yang dapat digunakan sebagai bahan anestesi dalam kegiatan transportasi sehingga dilakukan pengujian untuk mengetahui pengaruh penggunaan minyak sereh terhadap respon fisiologi.
Tujuan dari penelitian ini adalah untuk menganalisis pengaruh penggunaan minyak sereh terhadap respon fisiologi berupa gambaran darah (sel darah merah (SDM), sel darah putih (SDP), hemoglobin (Hb), N:L (Netrofil:Limposit) dan glukosa), histologi jaringan (insang), serta pertumbuhan dan kelangsungan hidup benih ikan kerapu macan pasca pengangkutan.
Penelitian ini dilaksanakan selama 3 bulan yaitu pada bulan Februari-April 2010 yang dilakukan di Laboratorium Lingkungan Akuakultur, Laboratorium Kesehatan Ikan Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan serta Laboratorium Fisiologi Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Prosedur penelitian yang dilakukan terdiri dari dua tahapan yaitu tahap pendahuluan dan tahap inti. Tahap pendahuluan terdiri dari puasa ikan, tingkat konsumsi oksigen, dan uji LC50 minyak sereh dengan konsentrasi 10 mg/L (perlakuan A) , 20 mg/L (perlakuan B), dan 30 mg/L (perlakuan C), sedangkan tahap inti terdiri dari lama pengangkutan dan pemeliharaan. Setelah proses pengangkutan dan pemeliharaan dilakukan analisis gambaran darah, histopatologi insang, pengukuran kualitas air, pengukuran glukosa darah, pertumbuhan dan kelangsungan hidup. Rancangan percobaan yang digunakan adalah rancangan acak lengkap dengan 4 perlakuan dan 2 ulangan. Data yang diperoleh dianalisis dengan menggunakan analisis ragam (anova) dengan uji F pada selang kepercayaan 95% untuk menentukan pengaruh perlakuan. Jika perlakuan berpengaruh nyata maka dilakukan uji lanjut dengan menggunakan uji Beda Nyata Jujur (BNJ).
Hasil penelitian menunjukkan bahwa ikan kerapu dapat bertahan hidup tanpa diberi pakan lebih dari 8 hari dengan kondisi ikan masih dalam keadaan aktif. Tingkat konsumsi oksigen dengan bobot rata-rata ikan 4,02±0,132 gram membutuhkan oksigen sebesar 0,352 mg O2.g-1.jam-1
Nilai SDM, SDP, Hb dan N:L rasio setelah pengangkutan selama 56 jam meliputi nilai SDM terendah dan tertinggi pada perlakuan A (1,28±0,12 sel/mm
.
v
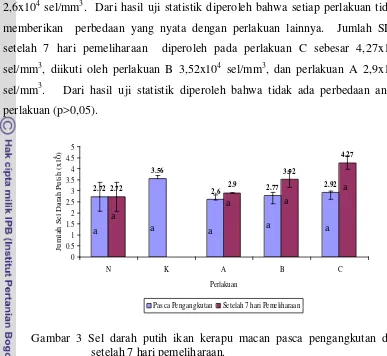
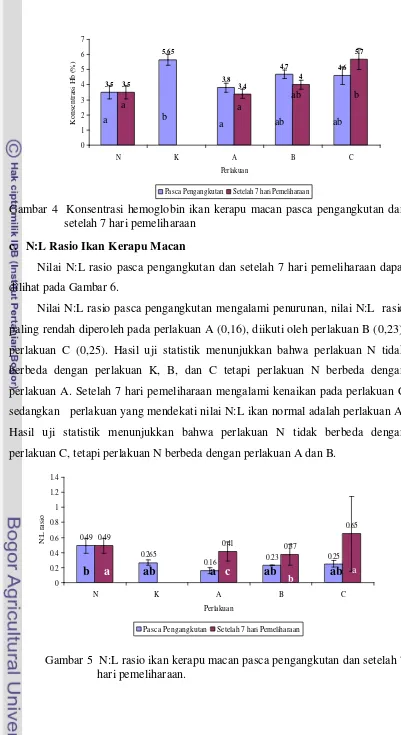
normal setelah pengangkutan. Setelah dilakukan 7 hari pemeliharaan jumlah sel darah putih tertinggi terdapat pada perlakuan C (4,27±0,30 sel/mm3) dan terendah terdapat pada perlakuan A (2,90±0,01 sel/mm3). Nilai Hb tertinggi setelah pengangkutan terdapat pada kontrol (5,65±0,35 sel/mm3) dan terendah terdapat pada perlakuan A (3,8±0,28 sel/mm3) dan setelah 7 pemeliharaan Hb tertinggi terdapat pada perlakuan C (5,7±0,71 sel/mm3) terendah terdapat pada perlakuan A (3,4±0,28 sel/mm3).
Pengukuran kadar glukosa darah pada akhir pengangkutan menunjukkan jumlah yang lebih tinggi pada perlakuan C (79,92±1,37 mg/dl) dan terendah pada perlakuan A (25,19±0,05 mg/dl) dibandingkan dengan kadar glukosa ikan normal, demikian juga kadar glukosa setelah pemeliharaan 7 hari pada perlakuan B dan C memiliki kadar glukosa yang lebih rendah dibandingkan dengan ikan normal.
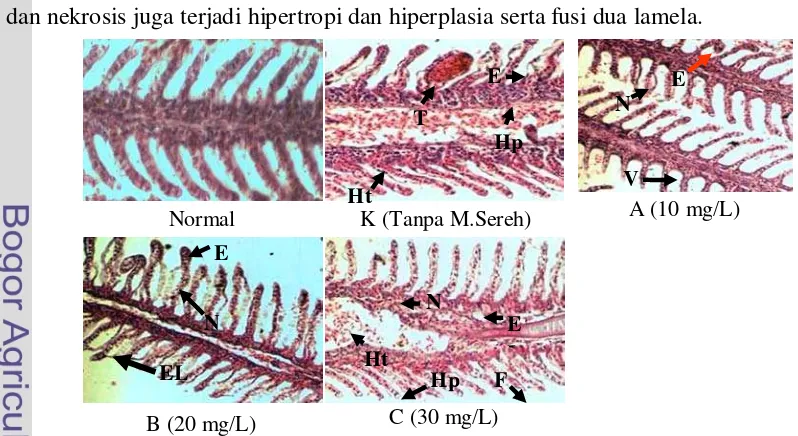
Hasil pengamatan histologi menunjukkan kerusakan jaringan insang ikan kerapu macan yang berbeda pada setiap perlakuan bila dibandingkan dengan ikan normal. Pada kontrol terjadi kerusakan lebih tinggi dan terendah pada perlakuan A dibanding perlakuan yang lain, setelah pengangkutan. Tingkat kerusakan pada perlakuan K yaitu (edema, hiperplasi, hemorage dan hipertropi,) perlakuan A (hemorage dan fusi) Perlakuan B (edema, hemorage, telengiektasis dan hipertropi), Perlakuan C (hipertropi dan fusi).
Semua parameter kualitas air media selama pengangkutan menunjukkan adanya peningkatan mulai dari jam ke-0 sampai dengan jam ke-56. Hal ini disebabkan karena adanya aktifitas biologis ikan seperti respirasi, metabolisme dan ekskresi.
Kelangsungan hidup ikan tertinggi setelah pengangkutan terjadi pada perlakuan A (10 mg/L) yaitu sebesar 97,5%. Laju pertumbuhan spesifik tertinggi setelah dilakukan pemeliharaan selama satu bulan terdapat pada perlakuan A yaitu sebesar 1,43% bobot tubuh/hari dengan tingkat kelangsungan hidup 73 %. Hal ini disebabkan karena pada perlakuan A kondisi ikan lebih baik dibandingkan dengan kondisi ikan pada perlakuan lainnya, yaitu tingkat stresnya rendah sehingga nafsu makan ikan tetap baik. Pemberian minyak sereh 10 mg/L dalam air media pengepakan dapat memberikan hasil yang paling baik. Hal ini dapat dilihat dari respon fisiologi berupa gambaran darah, kadar glukosa dan histopatologi insang yang mendekati normal, dan tingkat kelangsungan hidup tertinggi pada pasca transportasi sebesar 97,5 % pada jam ke-56, serta laju pertumbuhan harian yang tinggi sebesar 1,43% bobot tubuh/hari dibandingkan dengan perlakuan-perlakuan lain. Oleh karena itu untuk transportasi sistem tertutup ikan kerapu macan dengan kepadatan 20 ekor/L dapat menggunakan minyak sereh 10 mg/L.
vi
© Hak Cipta milik IPB, tahun 2010
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
vii
BERKEPADATAN TINGGI
BUDIYANTI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
viii Nama : Budiyanti
NRP : C151080181
Disetujui : Komisi Pembimbing
Dr. Ir. Eddy. Supriyono, M.Sc. Dr. Ir. Tatag Budiardi, M.Si. Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana IPB Ilmu Akuakultur,
Prof. Dr. Ir. Enang Harris, M.S. Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
ix
x
rahmat dan karunia-Nya sehingga proses perkuliahan dan penyusunan tesis dengan judul ”Respon fisiologi benih ikan kerapu macan epinephelus
fuscoguttatus akibat penggunaan minyak sereh dalam transportasi tertutup
berkepadatan tinggi” sebagai salah satu syarat untuk mendapatkan gelar Magister Sains pada Program Studi Budidaya Perairan Sekolah Pascasarjana Institut Pertanian Bogor.
Terima kasih kepada semua pihak yang telah memberikan bantuan baik moral maupun materil, utamanya kepada :
1. Dr.Ir. Eddy Supriyono, M.Sc dan Dr. Ir. Tatag Budiardi, M.Si, sebagai komisi pembimbing, atas curahan waktu, perhatian, motivasi dan pikiran mengantarkan penelitian penulis hingga selesai.
2. Dr.Ir. Kukuh Nirmala, M.Sc, selaku Penguji Luar Komisi yang telah memberikan saran yang sangat berarti untuk kesempurnaan tesis ini.
3. Terima kasih kepada anak-anakku tercinta (Ardi, Windu, Fitri, Kiki, Novi dan Iman) atas segala doa, dukungan dan motivasi serta pengorbanan yang tak terhingga nilainya.
4. Terima kasih yang tak terhingga kepada ayahanda La Budu dan ibunda Wa Dalima (alm) yang telah membesarkan penulis, kakakku serta keluarga besarku atas segala doa, dukungan dan kasih sayangnya..
5. Rektor Universitas Dayanu Ikhsanuddin (Unidayan) dan Dekan Fakultas Perikanan Unidayan yang telah memberikan kesempatan penulis untuk melanjutkan studi pada Institut Pertanian Bogor (IPB).
6. Beasiswa Program Pasca Sarjana (BPPS) yang telah membantu penulis dalam pembiayaan perkuliahan dan penelitian.
7. Lembaga penelitian dan pengabdian masyarakat (LPPM) Unidayan yang telah membantu sebahagian biaya penelitian penulis.
8. Bapak Ir. Tamar Mustari, M.S dan Muh. Chaidir Undu, S.Pi atas dukungannya baik moril maupun materil selama penulis menyelesaikan studi.
9. Teman-teman akuakultur 2008 terutama minor lingkungan (Riza, Ade, Pak Gian, Edo, Supasman, Pak Sumo, Pak Is, Pak Kadir, dan Isye), serta teman-teman yang tidak bisa disebut satu persatu atas segala bantuan, dorongan semangat yang diberikan kepada penulis sehingga penelitian ini selesai.
10. Teman-teman Pondok Edulweis”88” Rusman Prasetya, M.Si, Supasman, Siti Rahmaniar, Nurmin Amin, Jamal Harimuddin, M.Si,
Asmadin, S.Pi, La Ode Rusyamin, Al Azhar serta Hendrawan atas bantuan dan motivasinya sehingga penulis dapat menyelesaikan penelitian.
Sesungguhnya kesempurnaan hanyalah milik Allah, mohon maaf bila dalam tesis ini masih ada kekurangan, semoga hasil penelitian ini dapat berguna bagi kemajuan ilmu pengetahuan dan bermanfaat bagi semua pihak, khususnya kepada penulis kiranya dapat menjadi bekal setelah menyelesaikan studi nantinya.
xi
alm. La Budu dan ibu Wa Dalima. Penulis merupakan anak ke empat dari empat bersaudara.
Tahun 1984 penulis lulus dari MAN Bau Bau dan pada tahun yang sama lulus seleksi masuk program studi Budidaya Perairan, Jurusan Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan Universitas Dayanu Ikhsanuddin (Unidayan)
xii
1.1 Latar Belakang ... 1.2 Perumusan Masalah ... 1.3 Tujuan Penelitian ... 1.4 Manfaat Penelitian ... 1.5 Hipotesis ... TINJAUAN PUSTAKA
2.1 Taksonomi dan Morfologi ... 2.2 Sereh ………. 2.3 Transportasi ……….. 2.3.1 Kemasan ……….. 2.3.2 Kepadatan Ikan ……….... 2.4 Persyaratan Media Pengangkutan ……….
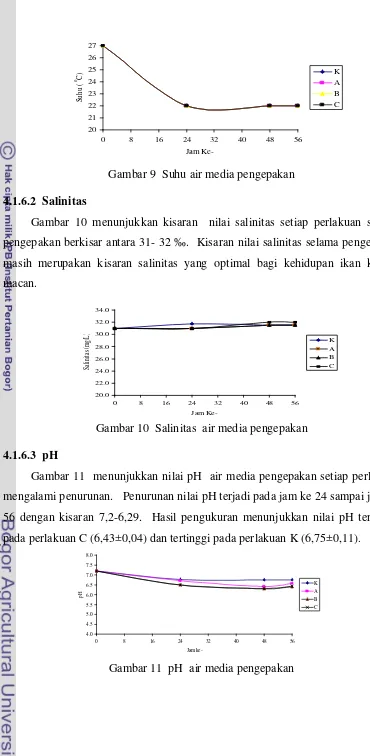
2.4.1 Oksigen Terlarut (DO)………. 2.4.2 Suhu ……….
` 2.4.3 Salinitas ………
2.4.4 Karbondioksida ……… 2.4.5 Derajat Keasaman (pH) ………... 2.4.6 Alkalinitas ……… 2.4.7 Kesadahan ……… 2.4.8 Amoniak ……….. 2.4.9 Nitrit ……… 2.5 Anastesi ……….
2.5.1 Tahapan Anastesi ………. 2.6 Stres ……….. 2.7 Histopatologi dan Gambaran Darah Ikan ……….. 2.7.1 Histopatologi Ikan ………... 2.7.2 Gambaran Darah Ikan ……….. METODE PENELITIAN
3.1 Waktu dan Tempat ... 3.2 Alat dan Bahan ... 3.3 Prosedur Penelitian ...
3.3.1 Puasa Ikan ... 3.3.2 Tingkat Konsumsi Oksigen ... 3.3.3 Uji Letal Konsentrasi (LC) ... 3.3.4 Analisis Darah ... 3.3.5 Analisis Histopatologi ... 3.3.6 Kualitas Air ... 3.3.7 Derajat Kelangsungan Hidup dan Laju
Pertumbuhan Spesifik ... 3.3.8 Prosedur Pengangkutan ...
xiv
Halaman
1 Susunan kimia minyak sereh wangi ... 8
2 Tahapan anastesi pada ikan ... 18
3 Tahapan anastesi dan pemulihan ... 18
4 Parameter air yang diukur dan alat yang digunakan... 26
5 Kemampuan puasa ikan kerapu macan ... 30
6 Hasil pengamatan tingkat mortalitas ikan kerapu selama uji LC50-96 jam 31 7 Konsentrasi TAN media pengepakan ... 40
xv
Halaman
1 Benih ikan kerapu macan (Epinephelus fuscoguttatus) ... 6
2 Jumlah sel darah merah pasca pengangkutan dan 7 hari pemeliharaan... 32
3 Jumlah sel darah putih pasca pengangkutan dan 7 hari pemeliharaan... 33
4 Konsentrasi Hb pasca pengangkutan dan 7 hari pemeliharaan ... 34
5 Perbandingan N:L rasio pasca pengangkutan dan 7 hari pemeliharaan... 34
6 Kadar glukosa pasca pengangkutan dan 7 hari pemeliharaan ... 35
7 Perubahan histopatologi insang pasca pengangkutan ... 36
8 Perubahan histopatologi insang setelah 7 hari pemeliraan ... 37
9 Suhu media pengangkutan benih ikan kerapu macan... 38
10 Salinitas media pengangkutan benih ikan kerapu macan... 38
11 pH media pengangkutan benih ikan kerapu macan... 38
12 DO media pengangkutan benih ikan kerapu macan ... 39
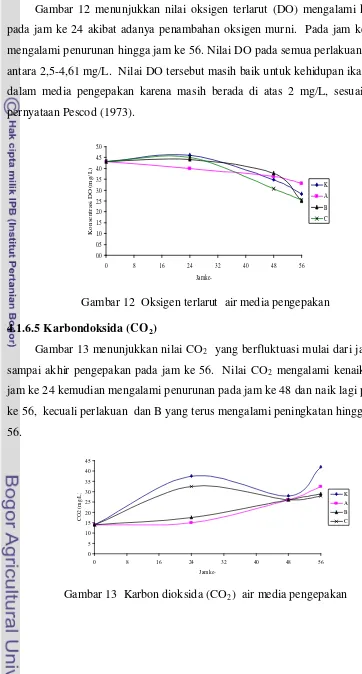
13 CO2 media pengangkutan benih ikan kerapu macan... 40
14 15 Kesadahan media pengangkutan benih ikan kerapu macan ... 41
16 Alkalinitas media pengangkutan benih ikan kerapu macan ... 41
17 Kelangsungan hidup benih ikan kerapu macan setelah pengangkutan... 42
18 Kelangsungan hidup benih ikan kerapu macan setelah pemeliharaan... 42
xvi
Halaman
1 Analisi probit uji LC50
2 Prosedur pengukuran kondisi histologi insang ikan kerapu macan ... 63
-96 jam ... 60
3 Gambaran darah ikan kerapu macan pasca pengangkutan dan hasil analisis statistik... . 66
4 Gambaran darah ikan kerapu macan setelah 7 hari pemeliharaan dan analisis statistik ... 69
5 Suhu rata-rata media air pengepakan ... 70
6 Konsentrasi salinitas rata-rata media pengepakan ... 70
7 pH rata-rata media air pengepakan ... 70
8 DO rata-rata media air pengepakan ... 70
9 Karbondioksida rata-rata media air pengepakan ... 71
10 TAN rata-rata media air pengepakan ... 71
11 NH3 12 Kesadahan rata-rata air media pengepakan ... 72
rata-rata media air pengepakan ... 71
13 Alkalinitas rata-rata air media pengepakan ... 72
14 Nitrit rata-rata air media pengepakan ... 72
15 Jumlah ikan hidup selama pengangkutan ... 72
16 T ingkat kelangsung hidup ikan selama pengangkutan ... 73
17 Jumlah ikan mati selama pengangkutan ... 73
18 Kelangsungan hidup selama pemeliharan ... 73
19 Preserntase ikan hidup selama pemeliharaan ... 74
20 Pengukuran bobot tubuh selama pemeliharaan ... 74
xvii
menyelesaikan sesuatu urusan, kerjakanlah dengan
sungguh-sungguh urusan selanjutnya (Q.S. 94: 6-7). Tiada
seorangpun yang dapat mengetahui dengan pasti apa yang
akan diperolehnya besok .. (Q.S. 31:34)
Saya persembahkan karya terindah ini dengan penuh rasa
haru dan bangga kepada :
Anak-anakku tercinta Ardi Purnama, Windu Sukendar,
Fitrianti, Rizki Kamelia, Nofita Sari dan
Muh. Satiman yang senantiasa
mengobarkan semangatku untuk bekerja keras
menyelesaikan karya ini.
Ikan kerapu merupakan komoditas perikanan laut dengan nilai ekonomis
tinggi dan telah dapat dikembangkan di Indonesia melalui teknologi
pengembangan budidaya. Penggunaan ikan rucah sebagai sumber utama pakan
telah dapat digantikan dengan pakan buatan yang teknologi pembuatannya telah
dikembangkan oleh Balai Riset Perikanan Budidaya Air Payau, Maros Sulawesi
Selatan (Nur 2007). Demikian pula perangkat lunak dalam penentuan lokasi
budidaya yang sesuai dengan pengembangan budidaya ikan kerapu yang
berkesinambungan (Halide 2007). Daerah produksi benih ikan kerapu macan
terletak di wilayah Bali, Situbondo, Lampung, sedangkan daerah budidaya atau
pembesaran terletak di wilayah Jakarta, Lombok dan Makassar. Karena jarak
antara daerah pembenihan dan daerah pembesaran relatif jauh, maka diperlukan
suatu teknologi transportasi yang dapat mempertahankan tingkat kelangsungan
hidup benih agar tetap tinggi dan waktu yang selama mungkin.
Pada umumnya transportasi ikan hidup dilakukan dengan dua sistem yaitu
sistem terbuka dan sistem tertutup. Pada pengangkutan dengan sistem terbuka
digunakan drum atau bak yang dilengkapi dengan aerasi, sedangkan pada
pengangkutan ikan dengan sistem tertutup digunakan kantong plastik dan
stirofom. Transportasi ikan hidup dapat diartikan sebagai suatu tindakan
memindahkan ikan dalam keadaan hidup dengan memberikan perlakuan tertentu
untuk menjaga kelangsungan hidup ikan tetap tinggi sampai ke lokasi tujuan
(Syamdidi et al. 2006). Selanjutnya Berka (1986) menyatakan, bahwa
transportasi ikan hidup dipengaruhi oleh kualitas air yaitu parameter fisika dan
kimia air seperti oksigen terlarut, suhu, pH, karbondioksida, dan amoniak (NH3).
Teknologi transportasi benih ikan kerapu yang umum digunakan saat ini dengan
sistem tertutup. Hasil penelitian menunjukkan bahwa transportasi sistem tertutup
benih ikan kerapu ukuran 7-8 cm dengan kepadatan 25 ekor dalam 2 liter air
selama 12 jam memberikan kelangsungan hidup sebesar 92,99%. Selanjutnya
dinyatakan, pengangkutan benih ukuran 6-7 dan 7-8 cm sering mengalami kendala
kantong plastik yang bocor dan kempes karena tertusuk duri sirip punggung
Penelitian ini merupakan aplikasi dari peningkatan teknologi pengangkutan
yang sering dilakukan oleh pembudidaya. Dengan meningkatnya kepadatan ikan
yang diangkut, maka tingkat metabolisme juga akan meningkat, dan
mengakibatkan tingginya tingkat stres yang dialami oleh ikan karena menurunnya
kualitas air. Oleh karena itu diperlukan metode yang dapat menurunkan aktivitas
metabolisme dan respirasi, sehingga ikan tidak banyak bergerak dan tidak banyak
memerlukan oksigen untuk respirasinya. Salah satu metode yang digunakan
untuk menurunkan aktivitas tersebut adalah dengan anastesi (Suryaningrum et al.
2005).
Penggunaan bahan anastesi seperti penggunaan ether, propoxate dan
quinaldine sulfat serta MS-222 telah menurunkan tingkat mortalitas selama
pengangkutan ikan hidup. Akan tetapi, bahan anestesi tersebut telah dilarang
penggunaannya karena dapat meninggalkan residu dalam tubuh ikan. Hal ini
sesuai dengan Keputusan Menteri Kelautan dan Perikanan, Nomor:
KEP.20/MEN/2003 tanggal 9 Juni 2003, tentang larangan penggunaan bahan
kimia sintetis sebagai obat bius.
Berdasarkan hal tersebut perlu ada bahan anastesi alternatif misalnya
bahan anastesi alami. Minyak sereh (Cymbopogon sp.) merupakan salah satu
tanaman dengan manfaat yang beragam. Minyak atsiri yang dikandung oleh
Cymbopogon olivieri dapat membunuh larva nyamuk Anopheles stepensi vector
malaria (Hadjiakhoondi et al. 2003). Minyak sereh (Cymbopogon citratus)
berperan sebagai anti jamur dan protozoa (Mahanta et al. 2007).
Minyak sereh merupakan minyak atsiri yang mampu menurunkan tingkat
metabolisme ikan dengan cara memingsankan atau menenangkan ikan. Menurut
de Sousa et al. (2005) tanaman sereh bersifat menenangkan (sedatif) dan
membantu proses pencernaan serta berbau harum dengan aroma yang khas.
Senyawa geraniol dan sitronelol yang terkandung dalam minyak sereh berperan
penting dalam mekanisme anastesi melalui jaringan pernafasan. Minyak sereh
dianggap cukup potensial untuk dikembangkan sebagai bahan pembius dalam
proses transportasi organisme akuakultur. Efektifitas minyak sereh sebagai obat
bius pada kepiting bakau (Scylla serata Forskal) telah dilaporkan oleh Semarlan
salah satu bahan anastesi dalam kegiatan transportasi ikan kerapu macan belum
tersedia sehingga dianggap perlu untuk dilakukan penelitian ini.
1.2 Perumusan masalah
Transportasi ikan hidup adalah salah satu upaya memindahkan ikan dalam
keadaan hidup dengan memberikan perlakuan tertentu untuk menjaga agar
kelangsungan hidup ikan tinggi serta efek negatif pasca transportasi tetap rendah
sampai ke tujuan. Semakin jauh jarak yang ditempuh, semakin dituntut suatu
teknologi yang mampu mempertahankan ikan agar tetap hidup dalam waktu yang
lama. Jadi semakin lama ikan dapat dipertahankan hidupnya, maka semakin jauh
jarak yang dapat dijangkau sehingga dapat meningkatkan jangkauan distribusi.
Penggunaan bahan anastesi kimia sintetis mampu menurunkan tingkat
mortalitas ikan hidup selama pengangkutan. Akan tetapi penggunaan bahan
anestesi tersebut telah dilarang penggunaannya karena dapat meninggalkan residu
dalam tubuh ikan. Berdasarkan hal tersebut perlu ada bahan anastesi alternatif
misalnya bahan anastesi alami. Minyak sereh (Cymbopogon sp.) merupakan salah
satu tanaman dengan manfaat yang beragam. Dinyatakan oleh de Sousa et al.
(2005) bahwa tanaman sereh (Cymbopogon schoenanthus) bersifat menenangkan
(sedatif) dan membantu proses pencernaan serta berbau harum dengan aroma
yang khas.
Namun demikian, informasi mengenai kegunaan minyak sereh sebagai
salah satu bahan anastesi dalam kegiatan akuakultur, khususnya dalam kegiatan
transportasi ikan kerapu macan belum tersedia. Dengan demikian dianggap perlu
untuk dilakukan penelitian ini terutama pengangkutan benih ikan kerapu macan
1.3 Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk menganalisis dampak penggunaan
minyak sereh terhadap respon fisiologi berupa gambaran darah (sel darah merah,
sel darah putih, hemoglobin, N:L rasio dan glukosa), histologi jaringan (insang),
serta pertumbuhan dan kelangsungan hidup benih ikan kerapu macan pasca
1.4 Manfaat Penelitian
Hasil dari penelitian ini dapat dijadikan sebagai informasi tentang
konsentrasi minyak sereh yang efektif dalam kegiatan transportasi ikan kerapu
macan dan pengembangannya.
1.5 Hipotesis
Hipotesis yang diajukan pada penelitian ini adalah pemberian minyak sereh
yang tepat dalam media transportasi tertutup dapat mengurangi tingkat stres dan
kondisi fisiologi ikan tetap terjaga sehingga tingkat kelangsungan hidup dan
Menurut Cornish (2004), klasifikasi ikan kerapu macan adalah :
Phylum : Chordata
Sub Phylum : Vertebrata
Super Species : Gnathostotamata
Class : Teleostei
Sub Class : Actinopterygii
Ordo : Perciformes
Sub Ordo : Percoide
Family : Serranidae
Sub Family : Epinephelinae
Genus : Epinephelus
Spesies : Epinephelus fuscoguttatus
Kerapu macan memiliki nama umum Brown-marbled Grouper, di Perancis
dengan nama Merou marron dan di Spanyol dengan nama Mero manchado.
Selanjutnya, kerapu macan memiliki nama sinonim Serranus horridus, Serranus
taeniocheirus dan Serranus lutra (Heemstra dan Randall 1993).
Menurut Heemstra dan Randall (1993), panjang standar ikan kerapu macan
2,6 sampai 2,9 kali lebar badannya, dan panjang kepala seperempat kali panjang
standar. Sirip ekor umumnya membulat, sirip punggung memanjang di mana
jarinya yang keras berjumlah kurang lebih sama dengan jari lunaknya,
jari-jari sirip keras berjumlah 6 – 8 buah, sedangkan sirip dubur berjumlah 3 buah,
jari-jari sirip ekor berjumlah 15 – 17 buah dan bercabang dengan jumlah 13 – 15
buah. Warna tubuhnya sawo matang, perut bawah agak keputihan dan badannya
terdapat titik berwarna merah kecoklatan serta tampak pula 4 – 6 baris warna
gelap yang melintang hingga ekornya.
Heemstra dan Randal (1993) menerangkan bahwa habitat ikan kerapu
macan adalah daerah terumbu karang yang dangkal dan perairan dengan dasar
berbatu, dengan kedalaman hingga 60 meter. Juvenil ikan kerapu macan
ditemukan pada areal padang lamun. Dilaporkan bahwa dalam lambung ikan
hidup pada kisaran salinitas 34,259 – 34,351 g/L, suhu 27 – 29 oC, oksigen
terlarut 3,95 – 4,28 ml/L, nitrat 1,00 – 6,00 µg.at/L, fosfat 0,80 – 1,40 µg.at/L
(Langkosono 2006). Menurut Sutarmat et al. (2003) ikan kerapu dapat hidup dan
tumbuh pada kisaran kadar garam 22-32 g/L dan suhu 26 – 31o
Gambar 1 Ikan kerapu macan (Epinephelus fuscoguttatus)
2.2 Sereh
Klasifikasi tanaman sereh adalah sebagai berikut :
Kingdom : Plantae
Subkingdom : Tracheobionta
Superdivision : Spermatophyta
Division : Magnoliophyta
Class : Liliopsida
Subclass : Commelinidae
Order : Cyperales
Family : Poaceae
Genus : Cymbopogon Spreng
Species : Cymbopogon citratus (DC. Ex Nees) Stapf.
(Dimodifikasi dari USDA 2009).
C.
Secara geografis, ikan kerapu macan terdistribusi pada wilayah Indo-Pasifik,
termasuk laut merah namun tidak ditemukan di Teluk Persia, Hawaii atau
Polinesia Perancis. Ikan kerapu macan dapat ditemukan di hampir semua
kepulauan tropis lautan Indonesia dan Pasifik Barat (dari timur hingga Samoa dan
Phoenix Island) sepanjang pantai timur Afrika hingga Mozambique, dan juga
dilaporkan terdapat di Madagaskar, India, Thailand, Indonesia, Pantai tropis
Australia, Jepang, Filipina, Papua Nugini dan Kaledonia Baru (Heemstra dan
Sereh merupakan tanaman tropis yang tumbuh dalam rumpun yang lebat
dan dapat mencapai ketinggian 1,8 meter dan lebar rumpun 1,2 meter (Anonim
2009). Daun sereh menyerupai pita dengan lebar 1,3 – 2,5 cm dan panjang 0,9
meter dengan ujung daun yang melengkung ke arah tanah. Daunnya berwarna
hijau kebiruan dan beraroma seperti jeruk ketika diremas. Daun tanaman sereh
digunakan sebagai penyedap rasa makanan dan obat-obatan. Minyak yang berasal
dari batang sereh disuling dan dimanfaatkan dalam industri parfum.
Sereh (Cymbopogon sp.) merupakan salah satu tanaman dengan manfaat
yang beragam. Minyak atsiri yang dikandung oleh C. olivieri dapat membunuh
larva nyamuk Anopheles stepensi vector malaria (Hadjiakhoondi et al. 2003).
Minyak sereh (C. citratus) berperan sebagai anti jamur dan protozoa (Mahanta et
al. 2007).
Komponen kimia dalam minyak sereh wangi cukup kompleks, namun
komponen yang terpenting adalah sitronelal dan geraniol. Kedua komponen
tersebut menentukan intensitas bau harum, serta nilai harga minyak sereh wangi.
Menurut Guenther (1950), komponen utama penyusun minyak sereh wangi adalah
sebagai berikut:
1. Geraniol ( C
10H18
Geraniol merupakan persenyawaan yang terdiri dari 2 molekul isoprene dan
1 molekul air, dengan rumus bangun adalah sebagai berikut : 0 )
Rumus bangunnya adalah sebagai berikut:
3 - C = CH - CH
2 --- CH2 - CH - CH2 - CH2 - OH
CH
3. Sitronellal (C 10 H 16
CH
O)
Rumus bangunnya adalah sebagai berikut:
3 - C = CH – CH2 --- CH2 - C = CH - C - H
CH
3 CH
Tabel 1 Susunan kimia minyak sereh wangi
3
Susunan kimia sereh wangi yang ditanam adalah seperti pada Tabel 1.
No Senyawa Penyusunan Kadar (%)
1
Elemol & Seskwiterpene lain Elemene & Cadinene
Sumber : Ketaren (1985)
2.3 Transportasi
Transportasi ikan hidup dapat diartikan sebagai suatu tindakan
memindahkan ikan dalam keadaan hidup dengan memberikan perlakuan tertentu.
Untuk menjaga agar kelangsungan hidup ikan tetap tinggi setelah sampai ditempat
tujuan, maka diperlukan perlakuan-perlakuan tertentu yang diharapkan mampu
mempertahankan ikan agar tetap hidup dalam jangka waktu yang lama.
Menurut Jangkaru (2001), secara garis besar pengangkutan ikan hidup
dibagi dalam dua sistem yaitu sistem terbuka dan sistem tertutup. Pada
pengangkutan sistem terbuka, ikan yang diangkut berhubungan langsung dengan
udara bebas, sebaliknya pengangkutan sistem tertutup, ikan yang diangkut akan
terlindungi dari udara bebas dan juga dari sinar matahari, sistem ini banyak
dipraktekkan untuk pengangkutan jarak jauh dan lama (lebih dari 24 jam). Waktu
pengangkutan sebaiknya dilakukan pada sore atau malam hari, pada suhu rendah.
demikian pada waktu pembongkaran sebaiknya pada sore atau malam hari.
Sebelum ditransportasikan, ikan sebaiknya dipuasakan terlebih dahulu
metabolisme menurun. Faktor yang sangat penting dalam transportasi adalah
ketersediaan oksigen terlarut yang memadai. Akan tetapi hanya dengan faktor ini
saja tidak menjamin ikan berada dalam kondisi yang baik. Kemampuan ikan
untuk mengkonsumsi oksigen juga dipengaruhi oleh toleransi ikan terhadap stres,
suhu air, pH, konsentrasi CO2, akumulasi amoniak, ikan terlalu aktif, infeksi
bakteri, dan luka fisik akibat penanganan yang kasar.
Hal penting yang perlu diperhatikan dalam transportasi ikan hidup adalah
(a) meningkatkan suplai oksigen dengan cara mengganti udara dengan oksigen
murni, meningkatkan tekanan pada wadah, dan mengurangi konsumsi oksigen
rata-rata (b) mengontrol metabolisme, dengan cara mengurangi laju buangan
metabolisme dan menetralisasi atau menghilangkan hasil metabolisme (Nemoto
1957).
Menurut Huet (1971), faktor utama yang mempengaruhi transportasi ikan
hidup dengan mempertimbangkan persediaan oksigen dalam alat transportasi
antara lain :
(a) Spesies ikan: kebutuhan ikan terhadap oksigen bervariasi sesuai dengan
spesiesnya.
(b) Umur dan ukuran ikan: ikan yang lebih kecil memiliki kebutuhan oksigen
lebih tinggi dibandingkan dengan ikan yang lebih besar.
(c) Ketahanan relatif ikan: ikan yang diberi pakan alami lebih tahan dibandingkan
dengan ikan yang diberi pakan buatan, serta ikan dalam kondisi yang siap
memijah memiliki daya tahan yang rendah
(d) Suhu air: pada suhu rendah mengakibatkan kadar oksigen di dalam air tinggi,
karena kebutuhan oksigen ikan akan menurun.
(e) Lama waktu angkut: makin pendek jarak angkut makin tinggi kepadatannya.
(f) Cara angkut dan lama istrahat: makin cepat pengangkutan dan makin baik
prasarana pengangkutan serta waktu istrahat yang pendek, kemungkinan
keberhasilan pengangkutan makin besar.
(g) Sifat alamiah alat pengangkut: pengangkutan dengan wadah kayu
menyebabkan peningkatan suhu air lebih lambat dibandingkan dengan wadah
(h) Kondisi klimatologi: hal ini dipengaruhi oleh suhu air di dalam wadah
maupun kandungan oksigen terlarutnya.
Liviawaty dan Afrianto (1990), menyatakan bahwa goncangan dapat
berdampak positif yaitu membantu difusi oksigen ke dalam air. Selain oksigen
yang cukup dalam kantong plastik, yang perlu diperhatikan ikan harus sehat, serta
kualitas air dan kondisi pengangkutan yang memadai.
2.3.1 Kemasan
Kemasan yang baik dalam pengangkutan sistem tertutup adalah
menggunakan plastik polyetilen dengan ketebalan plastik 0,03 mm, karena ringan,
mudah didapat dan murah, Liviawaty dan Afrianto (1990). Lebih lanjut dikatakan
bahwa, penggunaan kantong plastik pada pengangkutan jarak jauh sebaiknya
diletakkan di dalam kotak stirofom untuk mengurangi kontak yang terjadi antara
air di dalam kantong dengan temperatur lingkungan yang relatif lebih panas.
Garbrards (1965) menyatakan bahwa penggunaan wadah plastik yang diletakkan
dalam stirofom meningkatkan kelangsungan hidup 99,9%.
2.3.2 Kepadatan ikan
Kepadatan ikan adalah bobot ikan yang berada dalam suatu wadah dalam
waktu tertentu. Kepadatan ikan yang diangkut bergantung pada volume air, berat
ikan, spesies, ukuran ikan, lama pengangkutan, suplai oksigen dan suhu (Jhingran
dan Pullin 1985). Kepadatan yang biasa digunakan dalam pengangkutan ikan
kerapu macan adalah berkisar antara 10-12 ekor/kantong., 200kasi pribadi )
2.4 Persyatan Media Pengangkutan
Air sebagai media, baik untuk perawatan maupun pemberokan sebelum dan
sesudah pengangkutan harus memenuhi persyaratan bagi kesehatan ikan, yaitu
bebas dari partikel tanah, bahan organik, kontaminasi hama, parasit atau penyakit ,
bahan-bahan polusi yang dapat mengganggu kesehatan dan kehidupan ikan
(Jhingran dan pullin 1985). Kualitas air yang paling berpengaruh terhadap
kelangsungan hidup ikan antara lain: Oksigen terlarut, suhu, salinitas, CO2 , pH
2.4.1 Oksigen Terlarut
Oksigen terlarut (DO) adalah banyaknya kandungan oksigen yang terlarut
di dalam suatu perairan yang dinyatakan dalam mg/L. Kelarutaan oksigen dalam
air dipengaruhi oleh suhu, salinitas, agitasi dan tekanan. Menurut Boyd (1982),
kelarutan oksigen dalam air menurun dengan meningkatnya suhu dan kelarutan
gas dalam air menurun dengan meningkatnya salinitas. Tekanan udara terhadap
oksigen terlarut dapat mempercepat proses kelarutan dan pelepasan oksigen.
Konsentrasi DO adalah salah satu parameter kualitas air yang penting.
Kekurangan oksigen merupakan penyebab utama kematian ikan secara mendadak
dan dalam jumlah yang besar. Mempertahankan kondisi oksigen dalam kisaran
normal akan membantu mempertahankan kondisi ikan selama penanganan.
Konsentrasi DO yang terlalu rendah menimbulkan pengaruh yang buruk terhadap
kesehatan ikan seperti anoreksia, stres pernapasan, hipoksia jaringan, ketidak
sadaran, bahkan kematian (Wedemeyer 1996).
Langkosono (2006) menyatakan bahwa DO yang baik bagi ikan kerapu
adalah 3,95-4,28 ml/L, sedangkan Pescod dan Okun (1973) menyatakan bahwa
kandungan O2 terlarut yang baik untuk kehidupan ikan harus lebih dari 2 ppm.
Menurut Huet (1971) kadar terendah yang dapat ditoleransi oleh ikan dalam
pengangkutan adalah 2-3 mg/L. Kebutuhan ikan akan oksigen berbeda-beda,
bergantung pada spesies, ukuran, aktivitas ikan, toleransi terhadap stres, suhu, pH,
CO2 dan amoniak (Boyd 1992).
2.4.2 Suhu
Kelarutan gas-gas dalam air termasuk oksigen dipengaruhi oleh suhu.
Jhingran dan Pullin (1985) menyatakan bahwa kriteria temperatur yang ideal
untuk pengangkutan ikan tropis adalah 20-24ºC. Peningkatan suhu dapat
menyebabkan penurunan konsentrasi oksigen terlarut, karena akan meningkatkan
laju metabolisme dan konsumsi oksigen ikan. Penurunan suhu air akan
mengakibatkan respon imunitas menjadi lambat, nafsu makan dan pertumbuhan
berkurang (Wedemeyer 1996). Kisaran suhu air yang optimal untuk pemeliharaan
ikan kerapu macan adalah 26-31ºC (Sutarmat et al. 2003). Menurut Langkosono
Berka (1986) menyatakan bahwa kandungan oksigen terlarut bukan
merupakan faktor pembatas dalam transportasi ikan hidup apabila suhu air tidak
banyak berubah sehingga tidak mempengaruhi aktifitas metabolisme ikan. Suhu
sangat mempengaruhi tingkat konsumsi oksigen, peningkatan suhu akan
meningkatkan laju metabolisme dan menyebabkan konsumsi oksigen pada
jaringan lebih tinggi, sehingga kandungan oksigen terlarut berkurang (Berka
1986). Menurut Wibowo et al. (1997) pada suhu 21-27 0C cenderung terjadi
peningkatan metabolisme sehingga laju respirasi dan ekskresi amoniak meningkat.
2.4.3 Salinitas
Salinitas perairan menggambarkan kandungan garam dalam suatu perairan.
Pada umumnya salinitas disebabkan oleh 7 ion utama yaitu : natrium (Na), kalium
(K), kalsium (Ca), magnesium (Mg). Klorit (Cl), sulfat (SO4) dan bikarbonat
(HCO3). Salinitas dinyatakan dalam satuan g/kg atau promil (‰) (Effendi 2003).
Salinitas ikan kerapu berkisar antara 34,259 – 34,351‰ (Langkosono 2006).
Sedangkan menurut Kantor Menteri Negara dan Lingkungan Hidup (1988)
salinitas untuk ikan kerapu adalah berkisar antara 33 – 35 ‰.
2.4.4 Karbondioksida (CO2)
Karbondioksida dalam air pada umumnya merupakan hasil respirasi dari
ikan dan mikroba. Kadar CO2 lebih tinggi dari 10 mg/L diketahui bersifat racun
bagi ikan. Kadar karbondioksida tinggi juga menunjukkan lingkungan air yang
asam meskipun demikian karbondioksida diperlukan dalam proses pembufferan.
Kadar karbondioksida lebih dapat ditoleransi oleh ikan dibandingkan
dengan amoniak, bahkan banyak ikan yang hidup pada air dengan kadar CO2
lebih besar dari 60 mg/L (Boyd 1992). Kadar CO2 sebesar 50 - 100 mg/L dapat
membunuh ikan dalam waktu yang relatif lama. Kadar CO2 dalam air juga
mempengaruhi nilai pH air. Apabila kandungan CO2 dalam air tinggi maka nilai
pH air rendah dan sebaliknya bila kandungan CO2
2.4.5 pH
rendah maka nilai pH tinggi
(Boyd 1992).
Nilai pH merupakan suatu ekpresi dari konsentrasi ion hidrogen (H+) di
dalam air. Nilai pH sangat penting sebagai parameter kualitas air karena ia
ikan dan makhluk-makhluk akuatik lainnya hidup pada selang pH tertentu,
sehingga dengan diketahuinya nilai pH maka kita akan tahu apakah air tersebut
sesuai atau tidak untuk menunjang kehidupan mereka.
Besaran pH berkisar dari 0 (sangat asam) sampai dengan 14 (sangat
basa/alkalin). Nilai pH kurang dari 7 menunjukkan lingkungan yang masam
sedangkan nilai diatas 7 menunjukkan lingkungan yang basa (alkalin), sedangkan
pH = 7 disebut sebagai pH netral. Fluktuasi pH air sangat ditentukan oleh
alkalinitas air tersebut. Apabila alkalinitasnya tinggi maka air tersebut akan
mudah mengembalikan pH-nya ke nilai semula dari setiap "gangguan" terhadap
perubahan pH. Dengan demikian kunci dari penurunan pH terletak pada
penanganan alkalinitas dan tingkat kesadahan air.
2.4.6 Alkalinitas
Alkalinitas secara umum menunjukkan konsentrasi basa atau bahan yang
mampu menetralisir kemasamaan dalam air. Secara khusus, alkalinitas sering
disebut sebagai besaran yang menunjukkan kapasitas pembufferan dari ion
bikarbonat, dan sampai tahap tertentu ion karbonat dan hidroksida dalam air.
Ketiga ion tersebut di dalam air akan bereaksi dengan ion hidrogen sehingga
menurunkan kemasaman dan menaikan pH. Alkalinitas biasanya dinyatakan
dalam satuan ppm (mg/l) kalsium karbonat (CaCO3). Air dengan kandungan
kalsium karbonat lebih dari 100 ppm disebut sebagai alkalin, sedangkan air
dengan kandungan kurang dari 100 ppm disebut sebagai lunak atau tingkat
alkalinitas sedang (Boyd 1992).
Pada umumnya lingkungan yang baik bagi kehidupan ikan adalah dengan
nilai alkalinitas diatas 20 ppm. Air alami yang memiliki alkalinitas 40 mg/L atau
lebih CaCO3
2.4.7 Kesadahan
akan lebih produktif daripada yang alkalinitasnya dibawah nilai
tersebut (Moyle 1945; Mairs 1966 diacu dalam Boyd 1982).
Kesadahan sangat penting artinya bagi para pembudidaya karena kesadahan
merupakan salah satu petunjuk kualitas air yang diperlukan bagi ikan. Tidak
semua ikan dapat hidup pada nilai kesadahan yang sama. Dengan kata lain, setiap
hidupnya. Disamping itu, kesadahan juga merupakan petunjuk yang penting
dalam hubungannya dengan usaha untuk memanipulasi nilai pH.
Secara lebih rinci kesadahan dibagi dalam dua tipe, yaitu: (1) kesadahan
umum ("general hardness" atau GH) dan (2) kesadahan karbonat ("carbonate
hardness" atau KH). Kesadahan umum atau "general hardness" merupakan
ukuran yang menunjukkan jumlah ion kalsium (Ca++) dan ion magnesium (Mg++)
dalam air. Ion-ion lain sebenarnya ikut pula mempengaruhi nilai GH, akan tetapi
pengaruhnya diketahui sangat kecil dan relatif sulit diukur sehingga diabaikan.
Kesadahan karbonat atau KH merupakan besaran yang menunjukkan kandungan
ion bikarbonat (HCO3-) dan karbonat (CO3
--• 0 - 70 ppm : sangat rendah (sangat lunak)
) di dalam air. Dalam akuarium air
tawar, pada kisaran pH netral, ion bikarbonat lebih dominan, sedangkan pada
akuarium laut, ion karbonat lebih berperan. Disamping dua tipe kesadahan
tersebut, dikenal pula tipe kesadahan yang lain yaitu yang disebut sebagai
kesadahan total. Kesadahan total merupakan penjumlahan dari kesadahan umum
dan kesadahan karbonat (O-fish.com). Berikut adalah kriteria selang kesadahan
yang biasa digunakan:
• 70 - 140 mg/l : rendah (lunak)
• 140 - 210 mg/l : sedang
• 210 - 320 mg/l : agak tinggi (agak keras)
• 320 - 530 mg/l : tinggi (keras)
Sawyer dan McCarty 1967 diacu dalam Boyd 1992 mengklasifikasikan
derajat kesadahan air sebagai berikut:
• 0 - 75 mg/l : lunak
• 75 - 100 mg/l : sedang
• 150 - 300 mg/l : sadah
• >320 mg/l : sangat sadah
2.4.8 Amoniak
Amonia adalah produk sisa metabolisme yang utama dari ikan, dikeluarkan
melalui insang dan urine. Sumber utama amonia di perairan berasal dari ekskresi
Dalam perairan, amonia terdapat dalam dua bentuk, yakni; NH (amonia +4
terionisasi, karena memiliki ion positif) dan NH3 (tak terionisasi, karena tidak
memiliki ion), yang secara keseluruhan disebut total ammonia nitrogen (TAN),
proporsinya sangat bervariasi bergantung pada pH dan suhu. Jika pH dan suhu
meningkat maka jumlah NH3 meningkat, demikian pula sebaliknya. NH3 adalah
bentuk amonia yang lebih beracun dibanding NH4+ bagi organisme perairan
(Spotte 1970). Bentuk kandungan NH3 dan NH4+ dalam air bergantung pada
konsentrasi ion hidrogen dalam air. Air dengan pH yang rendah memiliki ion
hidrogen lebih banyak sehingga bentuk NH4+ lebih dominan, sehingga NH4+
lebih tidak beracun dibandingkan NH3.. Jika pH meningkat di atas 7,2 maka
jumlah ion hidrogen akan berkurang dan mengakibatkan NH3 lebih dominan.
Apabila konsentrasi amoniak pada lingkungan meningkat maka ekskresi
amoniak pada ikan akan menurun sehingga kadar amoniak dalam darah dan
jaringan akan meningkat (Boyd 1992). Di dalam wadah pengangkutan ikan
ekskresi amoniak penting diketahui karena jika ikan yang terus menerus
terekspos NH3 pada konsentrasi lebih dari 0,02 mg/l dapat menurunkan
pertumbuhan dan semakin rentan terhadap penyakit (Boyd 1992). Toksisitas akut
amonia untuk ikan laut berkisar 0.54 mg/L NH3-N untuk Centropristis striata
(Weirich dan Riche 2006 dalam Rodriguez et al. 2007) sampai 1.77 mg/L NH3-N
untuk Menidia beryllina (Miller et al. 1990 dalam Rodriguez et al. 2007).
2.4.9 Nitrit
Nitrit merupakan senyawa antara selama proses oksidasi amonia menjadi
nitrat (NO3), reaksinya berlangsung dengan cepat dan dipengaruhi oleh jumlah
konsentrasi amonia yang dioksidasi sehingga memiliki orde reaksi 2 (K2). Colt
(2006) menyatakan nitrit yang berbahaya adalah jika nitrit bergabung dengan ion
hidrogen membentuk asam nitrous (HNO2
Menurut Lewis et al. (1986) toksisitas nitrit (NO
-N) yang berupa asam kuat dan karena
tidak bermuatan listrik sehingga dengan bebas dapat berdifusi melintasi membran
insang atau melalui transpor aktif.
2-N) bagi ikan nila untuk
LC50-96 jam pada pH 7,9 adalah 16 mg/L, 5 mg/L (Losordo et al. 1977), dan
batas aman nitrit adalah < 1 mg/L (Timmons et al. 2002). Mekanisme efek toksik
bereaksi dengan besi II (Fe2+) menghasilkan besi III (Fe3+). Hal ini akan
mengurangi kemampuan sel darah merah untuk mengikat oksigen, yang
mengakibatkan penyakit darah coklat (methemoglobin) yang dapat mematikan
ikan karena kekurangan oksigen (hypoxia) (Wiesman et al. 2007). Almedras
(1987 diacu dalamRodriguez et al. 2007) menyatakan bahwa nitrit kurang toksik
terhadap ikan laut. Toksisitas akut nitrit terhadap ikan laut antara 30 mg/L NO2-N
untuk Paralichthys orbignyanus (Bianchini et al. 1996 diacu dalamRodriguez et
al. 2007) sampai 675 mg/L NO2
LC
-N untuk Chanos chanos (Almedras 1987 diacu
dalam Rodriguez et al. 2007).
Kurang toksiknya nitrit terhadap ikan laut disebabkan oleh adanya garam
(NaCl) pada media air laut. Masser et al. (1999) menyebutkan bahwa sodium dan
klorida dapat menghambat (block) nitrit berdifusi ke insang ikan selama proses
osmoregulasi. Oleh karena itu, untuk menekan toksisitas nitrit pada budidaya ikan
tawar biasanya diberikan garam (NaCl) 0.02-0.2 %.
2.5 Anastesi
Anastesi secara umum didefinisikan sebagai suatu keadaan yang disebabkan
oleh aplikasi agen eksternal yang menyebabkan hilangnya sensasi melalui depresi
pada sistem syaraf. Anastesi dapat berupa anastesi lokal atau umum bergantung
pada aplikasi anastesi tersebut (Ackerman et al. 2009).
Anastesi berperan dalam kegiatan transportasi ikan bandeng air tawar
(Hendrajat et al. 2006) dan sockeye salmon (Woody 2002), serta membantu dalam
kegiatan penanganan penyakit ikan (Wildgoose 2000). Demikian pula dalam
kegiatan penelitian untuk mengetahui aktivitas otak ikan Atlantik salmon yang
diberi kejutan listrik (Robb et al. 2003), pertumbuhan ikan gilthead bream (Sparus
auratus) yang diberi pakan beberapa jenis asam amino (Gomez-Requeni et al.
2003), gangguan perkembangan gonad ikan grass carp yang dibudidayakan di
daerah tropis (Glasser et al. 2003), sampling panjang dan berat ikan Atlantic
salmon (Salmo salar) (Berril et al. 2003) serta peningkatan kadar LH dan
mempercepat proses ovulasi ikan karper (Cyprinus carpio L.) baik dalam skala
laboratorium dan kondisi alamiah (Mikolajczyk et al. 2003).
50 adalah konsentrasi material (obat bius) dalam air yang diasumsikan
kepercayaan 95% umumnya berasal dari analisis statistik terhadap kematian
organisme uji setelah dilakukan pengujian terhadap beberapa konsentrasi larutan
bius dalam jangka waktu tertentu. Kisaran waktu organisme diekspos dalam
larutan bius harus dituliskan secara spesifik (misalnya 96 h LC50) (NIWA
Ecotoxicology Laboratory 1998).
Obat bius dapat disuntikkan langsung ke tubuh ikan, namun kebanyakan
prosedur anastesi dilakukan dengan cara dip atau bath treatment dalam sebuah
static bath atau dengan aliran air. Pada suatu kasus, obat bius dilarutkan secara
langsung ke dalam air, dikasus lain, obat bius harus dilarutkan terlebih dahulu
dalam pelarut organik kemudian dilarutkan ke dalam air. Ikan kemudian
dipaparkan dalam larutan bius dengan konsentrasi obat bius yang telah ditentukan
berdasarkan waktu pemaparannya. Konsentrasi obat bius umumnya dinyatakan
dalam satuan ppm yang setara dengan mg/L atau gram per kubik meter air (g/m3
a. Berpindahnya bahan penenang atau pembius dari lingkungan ke dalam muara
pernafasan organisme.
)
(Bowser 2001). Pada prinsipnya proses penenangan atau pembiusan pada ikan
meliputi tiga tahap yaitu :
b. Difusi membran dalam tubuh yang menyebabkan terjadinya penyerapan bahan
penenang ke dalam darah.
c. Sirkulasi darah dan difusi jaringan menyebarkan substansi tersebut ke seluruh
tubuh. Kecepatan distribusi dan penyerapan oleh sel ini sangat beragam,
bergantung pada persediaan darah dan kandungan lemak pada setiap jaringan.
Dengan sifat bahan pembius yang mudah larut dalam air dan lemak, proses
difusi zat penenang dalam aliran darah melalui insang terjadi sangat cepat.
Masuknya cairan penenang ke dalam sistem darah akan disebarkan ke seluruh
tubuh termasuk otak dan jaringan lain. Pengaruh bobot zat penenang terhadap
ikan ditentukan oleh kadar zat penenang yang terkandung dalam jaringan otak
atau sarafnya (Hunn 1970 diacu dalam Pratiwi 2000).
2.5.1 Tahapan anastesi
Dalam kegiatan anastesia pada ikan, ikan secara berturut-turut mengalami
lambatnya laju respirasi, kehilangan kontrol keseimbangan dan pada akhirnya
ikan tidak dapat merespon stimuli dari luar (Davis 2000).
Tabel 2 Tahapan anastesi pada ikan (Summerfelt dan Smith, 1990 diacu dalam
Cooke et al. 2004)
Tahapan
anastesi Deskripsi Karakteristik
0 Normal Reaktif terhadap stimuli eksternal, laju bukaan
operkulum dan detak jantung normal
1 Light sedation Secara perlahan-lahan kehilangan reaktifitas terhadap stimuli, secara perlahan-lahan laju bukaan operkulum menurun namun keseimbangan masih terjaga
2 Deep sedation Reaktivitas terhadap semua stimuli hilang secara total, namun demikian masih reaktif terhadap stimuli yang keras
3 Kehilangan
keseimbangan secara parsial
Elastisitas otot hilang secara sebagian, pergerakan ikan tidak teratur, peningkatan laju bukaan operkulum hanya reaktif ketika ikan disentuh dengan keras.
4 Kehilangan
keseimbangan secara total
Elastisitas otot dan keseimbangan hilang secara total, laju bukaan operkulum menjadi rendah, kehilangan refleksi spinal
5 Kehilangan
reaktifitas reflex
Reaktifitas hilang secara total, pergerakan operkulum menjadi lambat dan tidak teratur, denyut jantung menjadi lamban, kehilangan semua bentuk reflex
6 Medullary collapse
Tidak ada pergerakan operkulum yang diikuti oleh berhentinya detak jantung.
Tabel 3 Tahapan anastesi dan pemulihan (dimodifikasi dari Summerfelt dan
Smith 1990; Keene et al. 1998 diacu dalam Mylonas et al. 2005).
Tahapan Deskripsi Tingkah laku
Anastesia
A Kehilangan
keseimbangan
3 Kehilangan keseimbangan secara total, pergerakan
ikan hanya disebabkan dari sirip dada, pergerakan operkulum normal
A5 Deep anastesia Tidak ada pergerakan, kehilangan responsitas
terhadap stimuli berupa sentuhan, pergerakan operkulum lamban dan tidak teratur
Pemulihan
R3 Mulai pulih Keseimbangan pulih secara menyeluruh dan
permanen, pergerakan operkulum normal
R Pulih
secara total
5 Reponsif terhadap stimuli visual, dapat berenang
2.6. Stres
Proses pembiusan yang dilakukan untuk menenangkan atau memingsankan
ikan merupakan suatu tindakan yang menyebabkan ikan menjadi stres. Akibat
yang ditimbulkan karena pengaruh stres adalah ikan memberikan respon yang
dimulai dengan respon neuroendokrin. Respon ini meliputi proses-proses
fisiologi yang melibatkan sistem saraf dan sistem hormon/endokrin yang disebut
sebagai pengaruh primer. Akibat yang ditimbulkan dari pengaruh primer yaitu
adanya gangguan metabolik dan osmotik secara cepat yang disebut sebagai
pengaruh sekunder. Dengan kata lain ketika ikan dihadapkan pada kondisi stres
maka sistem neuroendokrin akan melepaskan hormon ke dalam darah. Hal ini
menyebabkan naiknya konsentrasi dari substansi ini yang kemudian mengganggu
proses-proses fisiologis yang disebut dengan respon stress primer. Pengaruh
primer dan sekunder merupakan faktor-faktor fisiologi yang dapat diukur.
Hormon utama yang dihasilkan dari respon primer adalah dilepaskannya senyawa
cathecholamin (adrenalin dan noradrenalin) dan corticosteroid (cortisol dan
cortison). Pengaruh sekunder meliputi gangguan osmoregulasi, penurunan asam
ascorbic darah, perubahan dalam ikatan oksigen dan hemoglobin, naiknya
metabolisme laktat dan lipid, perubahan kimia darah dan hematologi serta
turunnya daya kekebalan tubuh terhadap penyakit. Disamping itu pengaruh
sekunder juga dapat menaikkan kadar gula darah (hiperglisemia) (Spotte 1992).
2.7 Histopatologi dan Gambaran Darah Ikan 2.7.1 Histopatologi ikan
Histologi adalah cabang ilmu biologi yang mempelajari tentang jaringan.
Patologi adalah kajian tentang penyakit atau kajian tentang adaptasi yang tidak
cukup terhadap perubahan lingkungan eksternal dan internal (Spector 1993).
Histopatologi adalah metode yang sensitif dan secara biologis dapat mengukur
efek stres hewan terhadap lingkungan. Perubahan histopatologi merupakan
indikator faktor stres terhadap lingkungan.
2.7.2 Gambaran Darah Ikan
Sel darah tersusun atas sel darah merah (eritrosit) dan sel darah putih
(leukosit), dan kedua tipe sel ini terbentuk pada jaringan hematopoetik ginjal.
yaitu sekitar 3% dari berat tubuhnya. Darah mempunyai fungsi vital diantaranya
adalah mengedarkan nutrien seperti ke seluruh sel-sel tubuh, membawa oksigen
ke seluruh jaringan tubuh serta membawa hormon dan enzim ke organ yang
memerlukannya, menjaga keseimbangan tubuh dan untuk mengangkut hasil
buangan metabolisme seperti karbon dioksida dan asam laktat. Darah juga
membawa materi ion anorganik Na+, Mg2+, Cl-, dan senyawa organik seperti
hormon, vitamin, dan beberapa protein plasma. Pemeriksaan darah penting
artinya untuk mendiagnosa suatu penyakit dan kondisi ikan. Penyimpangan
fisiologi ikan menyebabkan komponen-komponen darah juga mengalami
perubahan. Perubahan gambaran darah dapat menentukan kondisi atau status
kesehatan ikan (Wedemeyer 1996).
2.7.2.1 Sel Darah Merah
Sel darah merah terbentuk di jaringan hematopoetik ginjal dan pada ikan
merupakan sel yang terbanyak. Lagler et al. (1977) membagi darah ikan
berdasarkan warna dan fungsinya yaitu sel darah merah (eritrosit) dan sel darah
putih (leukosit). Sel darah merah ikan pada umumnya mempunyai inti dengan
bentuk oval hingga bundar, intinya kecil dengan sitoplasma, berwarna merah
kekuningan dan berukuran 10 x 11 μm sampai 12 x 13 μm dengan diameter inti
4-5 μm dan jumlah sel darah merah 1,43 x 106 sel/mm3 sampai 3,18 x 106
sel/mm3. Pada ikan bertulang keras jumlah sel darah merah dalam keadaan
normal berkisar antara 1,05-3,00 x 106 sel/mm3
Jumlah sel darah putih lebih sedikit dibandingkan dengan sel darah merah.
Penyimpangan sel darah putih dari keadaan normal mempunyai arti klinis penting
untuk evaluasi proses penyakit (Dallman dan Brown 1989). Sel darah putih
dibedakan menjadi dua golongan berdasarkan ada tidaknya butir-butir (granula) . Sel darah merah berfungsi
sebagai transport oksigen. Rendahnya jumlah eritrosit menandakan ikan menderita
anemia dan kerusakan organ ginjal, sedangkan tingginya jumlah eritrosit
menandakan ikan dalam keadaan stres (Wedemeyer dan Yasutake 1977; Nabib
dan Pasaribu 1989). Faktor-faktor yang mempengaruhi jumlah sel darah merah
adalah spesies, perbedaan induk (genetik), kondisi nutrisi, aktifitas fisik, dan umur
(Dallman dan Brown 1989).
dalam sel, yaitu agranulosit dan granulosit. Agranulosit dibagi menjadi limposit,
trombosit, dan monosit, sedangkan granulosit berupa netrofil. Sel darah putih
berdiferensiasi pada ginjal menjadi beberapa tipe khusus seperti limposit, netrofil,
dan trombosit. Netrofil berfungsi melawan penyakit bersama-sama dengan
eosinofil yang disebabkan oleh organisme mikroseluler seperti bakteri dan virus.
Sifat melawan penyakit ini disebut sifat fagositik yaitu memakan dan
menghancurkan sel penyebab penyakit (Lagler et al. 1977). Secara normal pada
individu yang sehat jumlah sel darah putih di dalam darah adalah 1% dari total
jumlah darah. Sel darah putih tidak berwarna, jumlahnya setiap mm3 berkisar
20.000-150.000 butir (Affandi dan Tang 2002). Peningkatan sel darah putih
dapat disebabkan oleh penyakit, infeksi, parasit, stres akibat penanganan dan
pengaruh lingkungan (Guyton dan Hall, 1997). Kadar limfosit pada ikan kerapu
normal adalah 72% dari total leukositnya, sedangkan yang diberi perlakuan
hormon steroid LHRHa dosis 50 mg/kg bobot tubuh yaitu 54,5% (Fris et al.
2003). Limfosit merupakan jenis leukosit yang paling dominan dalam leukosit
dengan kisaran 71,1-82,88% dari total leukosit (Rostagi 1997).
Jumlah limfosit yang tinggi dalam sirkulasi darah akan diimbangi dengan
jumlah netrofil yang rendah dan sebaliknya. Penurunan jumlah limfosit dalam
darah terjadi karena sebagian besar limfosit dari sirkulasi darah berkonsentrasi
dalam jaringan dimana terjadi peradangan (Jawad et al. 2004)
2.7.2.3 Hemoglobin
Hemoglobin adalah protein dalam eritrosit yang tersusun atas protein globin
tidak berwarna dan pigmen heme yang dihasilkan dalam eritrosit. Blaxhall (1972)
menyatakan bahwa kadar hemoglobin merupakan indikator anemia, selanjutnya
Anderson dan Swicki (1993) menyatakan bahwa peningkatan kadar hemoglobin
menunjukkan ikan berada dalam keadaan stres. Siakpere (2005) menyatakan
bahwa secara fisiologis, hemoglobin menentukan tingkat ketahanan tubuh ikan
dikarenakan hubungannya yang sangat erat dengan daya ikat oksigen oleh darah.
Kemampuan darah untuk mengangkut oksigen bergantung pada kadar Hb dalam
darah (Lagler et al. 1977). Wells et al. (2005) menyatakan bahwa 1 gram
2.7.2.5 Glukosa
Tingkat glukosa darah merupakan indikator terjadinya stres awal pada ikan
karena tingkat glukosa darah sangat sensitif terhadap hormon yang mengatur stres
(Mazeaud dan Mazeaud 1991). Stres dapat disebabkan oleh berbagai faktor seperti
perubahan kualitas air atau penanganan yang salah pada waktu pengangkutan,
sehingga dapat menyebabkan ikan mengalami hiperglisemia dan mempengaruhi
kesehatan ikan, pertumbuhan dan kelangsungan hidup (Carmichael 1984;
Robertson et al. 1988; Barton dan Iwama 1991). Mekanisme terjadinya
hiperglisemia (tingkat glukosa darah tinggi) akibat stres yaitu dengan pemecahan
glikogen otot dan hati melalui jalur glikogenolisis yang akan menghasilkan
glukosa (Mazeaud dan Mazeaud 1981).
Keberadaan glukosa darah ditentukan oleh pakan, waktu akhir makan, status
simpanan glikogen hati, stadia perkembangan dan musim (Mazeud dan Mazeud
1981). Apabila kadar glukosa darah mengalami penurunan dari tingkat normal,
maka hormon insulin, tiroid, glukagon, epinefrin dan steroid dengan segera akan
berfungsi untuk meningkatkan glukosa darah ke tingkat normal melalui
pemecahan glikogen, deaminasi asam amino dan konversi dari gliserol yang
merupakan bagian dari molekul lemak. Jika jumlah glukosa darah mengalami
peningkatan diatas nilai normal, maka hanya hormon insulin yang dapat berperan
dalam menurunkan glukosa ke level normal melalui transport aktif glukosa dalam
Penelitian ini dilaksanakan selama 2 bulan dari bulan Februari sampai
dengan bulan April 2010. Kegiatan pemeliharaan benih ikan dilakukan di
Laboratorium Lingkungan Akuakultur, analisis darah dan histologi insang
dilakukan di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan,
Fakultas Perikanan dan Ilmu Kelautan. Pengujian kadar glukosa darah dilakukan
di Laboratorium Fisiologi Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
3.2 Bahan dan Alat
Bahan yang digunakan dalam penelitan ini adalah sebagai berikut: kantong
plastik, es batu, minyak sereh , dan benih ikan kerapu macan ukuran 7±0,5 cm.
Alat yang digunakan adalah sebagai berikut: kotak stirofom (ukuran 100 x 50 x
34 cm3
3.3 Prosedur Penelitian
), akuarium untuk wadah pemeliharaan, termometer, pH-meter, DO-meter
dan spektrofotometer.
3.3.1 Puasa Ikan
Puasa ikan dilakukan dengan tujuan untuk mengetahui kemampuan ikan
bisa bertahan hidup tanpa diberi makan. Penentuan puasa ikan dilakukan dengan
cara menyiapkan akuarium berukuran 40 × 32 × 30 cm3
3.3.2 Tingkat Konsumsi Oksigen
yang telah dibersihkan
dan dikeringkan selama 2 hari kemudian diisi air laut sebanyak 25 liter yang
diaerasi selama 2 hari lalu dimasukkan ikan kerapu macan berukuran 7±0,5 cm
sebanyak 10 ekor. Pengamatan tingkah laku ikan serta kualitas air dilakukan
setiap hari. Kualitas air yang ukur yaitu oksigen terlarut dengan menggunakan
DO-meter, suhu dengan termometer dan pH dengan pH-meter
Tingkat konsumsi oksigen (TKO) ditentukan bertujuan untuk menghitung
kebutuhan oksigen benih ikan kerapu macan per jam, dengan cara menyiapkan 3
stoples bervolume 3 liter yang telah dibersihkan dan dikeringkan, kemudian diisi
air bersalinitas 31 g/l yang sebelumnya diaerasi selama 3 hari hingga jenuh. Ikan
uji yang digunakan berukuran 7±0,5 cm dengan bobot 4,02 gram. Ikan uji
dengan kepadatan 3 ekor setiap wadah, kemudian ditutup dengan penutup
plastik. Kandungan DO diukur setiap jam selama 4 jam dengan memasukkan
DO-meter ke dalam stoples.
3.3.3 Uji Letal Konsentrasi (LC50-96 jam)
Uji letal konsentrasi yang mematikan selama 96 jam (LC50-96 jam) dengan
4 tingkat konsentrasi termasuk kontrol. Untuk mendapatkan konsentrasi yang
dikehendaki dilakukan pengenceran dari larutan stok berkonsentrasi 1000 ppm,
dengan menggunakan rumus: N1V1 = N2V2
3.3.4 Analisis Darah
. Selanjutnya konsentrasi tersebut
ditetapkan sebagai konsentrasi perlakuan yaitu perlakuan A (60 ppm), B (80
ppm), C (100 ppm), D (120 ppm) dan E (140 ppm), kemudian ikan yang sudah
dipuasakan selama 48 jam dimasukkan kedalam media yang sudah mengandung
konsentrasi minyak sereh tertentu, lalu diamati tingkah laku ikan sampai ada
perlakuan yang mengalami kematian 50%.
Analisis darah yang dilakukan selama penelitian meliputi parameter :
1) Sel darah merah (eritrosit)
Penghitungan jumlah sel darah merah dilakukan pada ikan normal, pasca
pengangkutan dan 7 hari setelah pemeliharaan. Pengamatan dan penghitungan
jumlah sel darah merah dilakukan berdasarkan prosedur dari Blaxhall dan Daisley
(1973). Darah diambil dari ikan dengan menggunakan injeksi yang terlebih dahulu
telah diisi dengan cairan antikoagulan untuk mencegah terjadinya penggumpalan
darah. Darah yang tersedot dimasukkan kedalam ependorf, dan kemudian darah
dihisap dengan menggunakan pipet pencampur sampai dengan skala 0,5 dan
ditambahkan dengan larutan hayems yang dihisap dengan menggunakan pipet
yang sama hingga mencapai skala 101. Setelah itu, pipet digoyang membentuk
angka delapan selama 3-5 menit. Tetesan pertama dibuang dan tetesan berikutnya
diteteskan kedalam hemositometer dan ditutup dengan kaca penutup.
Penghitungan dilakukan pada 5 kotak kecil yaitu pada sudut kiri atas, sudut kanan
atas, sudut kiri bawah, sudut kanan bawah dan pada bagian tengah.
Jumlah sel darah merah yang terhitung dikonversikan dengan rumus :
2) Sel darah putih (leukosit)
Penghitungan jumlah sel darah putih dilakukan pada ikan normal, pasca
pengangkutan dan 7 hari setelah pemeliharaan. Pengamatan dan penghitungan
jumlah sel darah putih dilakukan berdasarkan prosedur dari Blaxhall dan Daisley
(1973). Metode pengambilan darahnya sama dengan metode pengambilan darah
merah. Darah dihisap dengan pipet pencampur sampai dengan skala 11.
Kemudian pipet digoyangkan hingga membentuk angka delapan selama 3-5
menit. Tetesan pertama dibuang, dan tetesan selanjutnya diteteskan diatas
hemositometer lalu ditutup dengan kaca penutup. Penghitungan dilakukan pada 5
kotak besar.
Jumlah sel darah putih yang terhitung dikonversikan dengan rumus :
Jumlah sel darah putih = ∑ sel darah putih terhitung x 50 sel/mm
4) Kadar Hemoglobin (Hb)
3
3) Diferensiasi Leukosit
Dengan cara menghitung jumlah neutrofil, limfosit, monosit, trombosit
dalam darah tersebut dengan pengamatan dilakukan sebanyak 10 lapang pandang
kemudian perhitungan dalam bentuk persentase
Pengukuran kadar hemoglobin pada prinsipnya adalah mengkonversikan
hemoglobin dalam darah ke dalam bentuk asam hematin oleh asam klorida dan
dinyatakan dalam persen (% Hb). Kadar HB dilakukan pada ikan normal, pasca
pengangkutan dan 7 hari setelah pemeliharaan (Anderson dan Swicki 1993).
Prosedur pengukuran kadar hemoglobin. Mula-mula darah diisap menggunakan
pipet sahli hingga skala 20 mm3, kemudian dipindahkan ke dalam tabung Hb yang
berisi HCl 0,1 N sampai skala 10 (kuning). Didiamkan selama 3–5 menit agar Hb
bereaksi dengan HCl membentuk asam hematin, kemudian diaduk dan
ditambahkan aquadestila (sedikit demi sedikit) hingga warnanya sama dengan
standar. Pembacaan skala dilakukan dengan melihat tinggi permukaan larutan
yang dikocok dengan skala lajur g% yang menunjukkan banyaknya Hb dalam
4. Glukosa Darah
Pengukuran dilakukan untuk mengevaluasi tingkat stres pada ikan.
Prosedur pengukuran glukosa darah ikan yaitu: darah diambil dari ikan dengan
menggunakan injeksi yang telah diisi dengan cairan antikoagulan untuk mencegah
terjadinya penggumpalan darah. Darah yang tersedot dimasukkan ke dalam
tabung ependorf, kemudian disentrifuge dengan kecepatan 12.000 rpm selama 5
menit. Setelah terbentuk lapisan-lapisan yang terdiri dari lapisan plasma yang
jernih di bagian atas, selanjutnya ambil 10 µ l lapisan plasma tambahkan kedalam
tabung reaksi berisi 1 ml regen (glucose liquicolor) selanjutnya dihomogenkan
dengan menggunakan vortex, diinkubasi selama 10 menit pada suhu kamar, baca
nilai absorban pada spektrofotometer dengan λ 500 nm. Kadar glukosa darah
diukur mengikuti Wedemeyer dan Yatsuke (1977) yaitu :
Absorban sampel
Glukosa darah = x Konsentrasi standar Absorban standar
Analisis Histopatologi
Histopatologi dilakukan pada ikan normal, pasca pengangkutan, dan setelah
pemeliharaan 7 hari diukur di Laboratorium Kesehatan ikan Departemen
Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan IPB. Jaringan yang
diamati adalah insang. Pengamatan dilakukan dengan membuat preparat histologi.
Prosedur pembuatan preparat histologi insang disajikan pada Lampiran 2.
3.3.6 Kualitas Air
Parameter kualitas air yang diukur dalam penelitian ini seperti terlihat pada
Tabel 4 dan dilakukan pengukuran setiap 24 jam sekali.
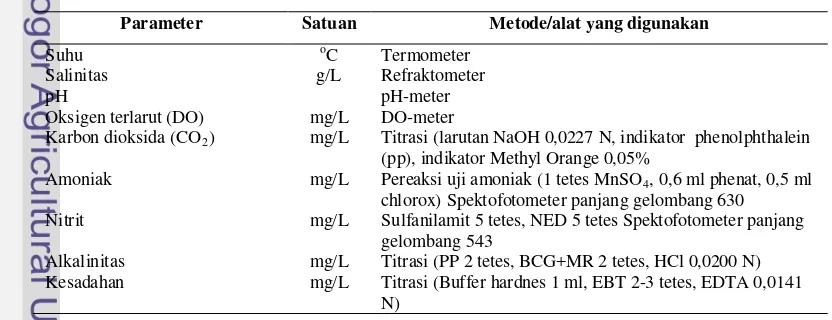
Tabel 4 Parameter air yang diukur dan alat yang digunakan
Parameter Satuan Metode/alat yang digunakan
Suhu oC Termometer
Salinitas g/L Refraktometer
pH pH-meter
Oksigen terlarut (DO) mg/L DO-meter
Karbon dioksida (CO2) mg/L Titrasi (larutan NaOH 0,0227 N, indikator phenolphthalein
(pp), indikator Methyl Orange 0,05%
Amoniak mg/L Pereaksi uji amoniak (1 tetes MnSO4
Nitrit
, 0,6 ml phenat, 0,5 ml chlorox) Spektofotometer panjang gelombang 630
mg/L Sulfanilamit 5 tetes, NED 5 tetes Spektofotometer panjang
gelombang 543
Alkalinitas mg/L Titrasi (PP 2 tetes, BCG+MR 2 tetes, HCl 0,0200 N)
Kesadahan mg/L Titrasi (Buffer hardnes 1 ml, EBT 2-3 tetes, EDTA 0,0141
3.3.7 Derajat Kelangsungan Hidup dan Laju Pertumbuhan Spesifik
Pengamatan kelangsungan hidup (survival rate, SR) ikan kerapu macan
dilakukan setiap 6 jam sekali selama pengangkutan. Derajat kelangsungan hidup
ikan kerapu ditentukan dengan menggunakan rumus (Effendi 1978) :
Nt = jumlah hewan uji pada akhir penelitian (ekor)
No = jumlah hewan uji pada awal penelitian (ekor)
Laju pertumbuhan spesifik (spesific growth rate, SGR) ikan kerapu macan
ditentukan dengan menggunakan rumus (Zonneveld 1991) :
%
Penelitian ini terdiri dari 4 perlakuan masing-masing 2 ulangan. Setiap
kantong dilengkapi dengan kran pengeluaran air, kemudian diisi air laut dan
oksigen dengan perbandingan 1 : 3 kemudian diikat dengan karet gelang, setelah
itu dimasukkan ke dalam kotak stirofom dan diberi es batu kemudian ditutup.
Pengangkutan dilakukan secara simulasi yaitu dengan memasukkan stirofom ke
dalam bak kemudian air dialirkan dari kran dan juga digerakkan dengan pompa.
Pengamatan keadaan ikan dilakukan setiap 6 jam dengan cara mengeluarkan
kantong dari stirofom, sedangkan pengambilan sampel air dilakukan setiap 24
jam sekali dengan mengalirkan air dari kran sehingga kantong tetap dalam