VAKSINASI INDUK IKAN NILA (Oreochromis niloticus)
DAN KETAHANAN BENIH YANG DIHASILKANNYA
TERHADAP INFEKSI BAKTERI Streptococcus agalactiae
KHAIRUN NISAA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa disertasi berjudul Vaksinasi Induk Ikan Nila (Oreochromis niloticus) dan Ketahanan Benih yang Dihasilkannya terhadap Infeksi Bakteri Streptococcus agalactiae adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Mei 2016
RINGKASAN
KHAIRUN NISAA. Vaksinasi Induk Ikan Nila (Oreochromis niloticus) dan Ketahanan Benih yang Dihasilkannya terhadap Infeksi Bakteri Streptococcus agalactiae. Dibimbing oleh SUKENDA, MUHAMMAD ZAIRIN JUNIOR, ANGELA MARIANA LUSIASTUTI, dan SRI NURYATI.
Penyakit Streptococcosis utamanya disebabkan oleh bakteri S. agalactiae. Bakteri ini termasuk Gram positif dan bagian yang bersifat virulen adalah eksotoksin dari produk ekstraseluler (ECP). Bakteri S. agalactiae merupakan salah satu bakteri yang berbahaya dan menyebabkan kematian massal pada budidaya ikan nila. Tujuan penelitian ini adalah mengkaji pengaruh pemberian vaksin gabungan sel utuh dan ECP bakteri S. agalactiae isolat N14G pada induk
terhadap kualitas benih yang dihasilkan serta mengkaji potensi vaksinasi benih yang dihasilkan guna peningkatan kualitas benih kedepannya. Tiga tahapan penelitian dirancang untuk mencapai tujuan dari penelitian ini.
Pertama, untuk menentukan waktu vaksinasi induk terbaik berdasarkan tingkat kematangan gonad. Tahap perkembangan gonad per satuan waktu ditentukan melalui pengambilan contoh gonad ikan dewasa. Pengambilan contoh gonad dan plasma darah dimulai sesaat setelah memijah (0 hari), dan dilanjutkan setiap 7 hari hingga ikan memijah kembali. Pengamatan perkembangan gonad secara makroskopik dilakukan langsung di lapangan dengan menggunakan spesimen segar, dan dilanjutkan dengan analisis menggunakan metode histologi. Analisis level vitelogenin (VTG) plasma secara kualitatif selama siklus reproduksi menggunakan metode SDS-PAGE. Tahap selanjutnya adalah mengevaluasi level IgM dalam telur dan benih dari induk yang divaksin pada 7 hari dan 14 hari pascapemijahan. Vaksin yang digunakan adalah vaksin gabungan sel utuh dan produk ekstraseluler dari bakteri S. agalactiae. Vaksin disuntikkan sebanyak 0,4 ml per kg ikan dengan konsentrasi vaksin 109 CFU/ml. Level IgM induk, telur,
dan benih dianalisis menggunakan metode indirect ELISA. Hasil pengamatan perkembangan gonad menunjukkan bahwa awal vitelogenesis (Tingkat Kematangan Gonad/TKG 2) ditemukan pada pengambilan contoh hari ke 7 pascapemijahan sebelumnya, dan puncak vitelogenesis (TKG 3) ditemukan pada pengambilan contoh hari ke 14 pascapemijahan. Level IgM (optical density, ELISA) dari induk yang divaksin pada 7 hari pascamijah dalam telur (0.165±0.003) dan benih umur 7, 14, 21 dan 28 hari pascapenetasan (berturut-turut 0.163±0.002; 0.162±0.006, 0.155±0.006, dan 0.140±0.008) signifikan lebih tinggi (P<0.05) dibandingkan dengan telur dan benih yang berasal dari induk yang divaksin pada 14 hari pascamijah dan induk tanpa vaksinasi hingga akhir pengamatan. Hal ini menunjukkan bahwa, waktu vaksinasi induk betina ikan nila secara langsung mempengaruhi akumulasi IgM dalam telur dan benih ikan yang dihasilkan sebagai imunitas turunan. Waktu vaksinasi induk betina ikan nila terbaik adalah pada TKG 2.
konsentrasi 109 cfu/ml sebanyak 0.4 ml/kg ikan. Kontrol adalah induk ikan yang
tidak diberi vaksin. Tahap kedua adalah uji tantang benih dari induk yang divaksin dan kontrol melalui perendaman dengan konsentrasi 107 cfu/ml selama 30 menit
menggunakan bakteri S. agalactiae pada umur benih 7, 14, 21, dan 28 hari setelah menetas. Parameter yang dievaluasi yaitu relative percentage survival (RPS) induk, telur, dan benih. Dari uji tantang benih dengan bakteri S. agalactiae umur 7, 14, 21, dan 28 hari didapatkan RPS tertinggi pada perlakuan penyuntikan vaksin TKG 2 berturut-turut sebesar 95.24%, 83.33%, 72.22%, dan 56.02%. Pemberian vaksin pada induk ikan nila TKG 2 memberikan ketahanan benih yang lebih baik melalui imunitas maternal terhadap infeksi S. agalactiae.
Ketiga, mengkaji efektivitas vaksinasi benih dari induk betina ikan nila yang telah diberi vaksin gabungan sel utuh dan ECP bakteri S. agalactiae pada tingkat kematangan gonad (TKG) yang berbeda. Perlakuan terbagi atas empat kelompok yaitu benih tanpa vaksinasi dari induk betina tanpa vaksinasi, benih divaksin dari induk tanpa vaksinasi, benih divaksin dari induk yang divaksin pada TKG 2, dan benih divaksin dari induk yang divaksin pada TKG 3. Vaksinasi benih dilakukan melalui perendaman menggunakan vaksin gabungan sel utuh dan produk ekstraseluler dengan konsentrasi 1 x 107 CFU mL-1. Pengukuran aktivitas lisosim
dan immunoglobulin diukur pada 11 hari pasca vaksinasi. Selanjutnya uji tantang dilakukan menggunakan bakteri S. agalactiae Isolat N14G dengan konsentrasi 1 x
107 CFU ml-1. Parameter mortalitas dan relative percent survival (RPS) diamati
pada tujuh hari pasca uji tantang. Hasil menunjukkan bahwa mortalitas tertinggi dijumpai pada benih tanpa vaksin dari induk tanpa vaksin (70.00%) dibandingkan dengan mortalitas pada perlakuan lain. Mortalitas terendah berasal dari perlakuan vaksinasi benih dari induk yang divaksin pada TKG 2 (32.67%). Nilai RPS benih yang divaksin dari induk tanpa vaksin, induk yang divaksin pada TKG 2 dan induk yang divaksin pada TKG 3 berturut-turut adalah 23.33%, 54.77%, dan 35.84%. Berdasarkan hasil yang diperoleh, disimulkan bahwa vaksinasi benih mampu meningkatkan daya tahan tubuh terhadap infeksi bakteri S. agalactiae dan vaksinasi benih dari induk yang telah divaksin pada TKG 2 memberikan hasil yang terbaik.
SUMMARY
KHAIRUN NISAA. Broodstock Vaccination of Tilapia (Oreochromis niloticus) and Resistance of Their Seeds Against Streptococcus agalactiae Infection. Supervised by SUKENDA, MUHAMMAD ZAIRIN JUNIOR, ANGELA MARIANA LUSIASTUTI, and SRI NURYATI.
Streptococcosis disease mostly caused by the bacteria S. agalactiae. S. agalactiae was a Gram-positive bacteria. Part of the virulent was an exotoxin of extracellular products (ECP). S. agalactiae was one of the most devastating bacterial infection and causes high mortality in tilapia farming. The purpose of this study was to examine the combined effect of whole-cell vaccine and ECP bacteria S. agalactiae isolates N14G in maintaining the quality of seeds produced, and assess the potential for vaccination of seeds produced in order to improve the quality of seeds in the future. The study designed with three stages of experiment to aid the objectives achievement.
The First was to determine the best time to vaccinate broodstock of tilapia based on gonad developmental stage. The stage of gonad development per unit time were determining through the sampling gonads of adult fish. Sampling gonads and blood plasma were began shortly after spawning (0-day), and continued every 7 days until re-spawning. Macroscopic viewed of gonadal development conducted directly in the field using a fresh's specimen, and then analyzed using histological methods. Qualitative analyze of vitellogenin level (VTG) plasma during the reproductive cycle was using SDS-PAGE. The antibody level in eggs and seeds from broodstock vaccinated on days 7 and 14 postspawning and control broodstock were measured using indirect ELISA. Vaccine of mixed whole cell and ECP of S. agalactiae injected as much as 0.4 ml per kg of fish (109CFU/ml). The results showed the onset of vitelogenesis found on day 7 post spawning earlier, and peak of vitelogenesis found on day 14 postspawning. Spesific antibody levels in eggs of vaccinated broodstock (0.165 ± 0.003) and seed aged of 7, 14, 21 and 28 days posthatching (0.163 ± 0.002, 0.162 ± 0.006, 0.155 ± 0.006, and 0.140 ± 0.008 respectively) in stage 2 was significantly higher compared with other treatment until the end of the observation (P<0.05). The results showed that vaccination time directly affected the accumulation of antibody in eggs and a seed as maternal immunity, and the best time of vaccination was at gonad developmental stage 2.
seed was conducted by immersing S. agalactiae for 30 minutes at 7, 14, 21, and 28 days posthatching (DPH) in 107 CFU ml-1. Antibody levels on broodstocks, eggs, and body fluids, and relative percentage survival (RPS) were evaluated. Challenged test by immersing with S. agalactiae suspension on seed aged 7, 14, 21, and 28 days had highest RPS (95.24%, 83.33%, 72.22%, and 56.02% respectively) formed on seed from broodstock vaccination in gonad development stage 2. Vaccination in tilapia broodstocks at stage 2 of gonad developmental stage gave highest protection by maternal immunity to the seed against S. agalactiae.
The third was to evaluate the effectiveness of seeds vaccination from vaccinated broodstock of tilapia with mixed whole cell and ECP of S. agalactiae at different level of gonad developmental stages. Study were divided into four groups (non-vaccinated seeds from non-vaccinated broodstock, vaccinated seeds from non-vaccinated broodstock, vaccinated seeds from vaccinated broodstock at gonad developmental stage 2, and vaccinated seeds from vaccinated broodstock at gonad developmental stage 3. Seeds were vaccinated by immersion using mixed whole cell and ECP of S. agalactiae with concentration of 1x107CFUmL-1 for 30 minutes. Challenge test were carried out using the S. agalactiae with a concentration of 1x107CFU ml-1. Percentage of mortality and relative percent survival (RPS) were observed at seven days post-challenge test. Results showed that the highest mortality found in the non-vaccinated seeds from non-vaccinated broodstock (70.00%) compared with other treatments. Lowest mortality derived at vaccinated seeds from vaccinated broodstock at gonad developmental stage 2 (32.67%). The RPS value from vaccinated seeds from non-vaccinated broodstock, vaccinated seeds from vaccinated broodstock at gonad developmental stage 2, and vaccinated seeds from vaccinated broodstock at gonad developmental stage 3 were 23.33%, 54.77% and 35.84% respectively. Based on the results, it was known that vaccination could improve seeds resistance to bacterial infection of S. agalactiae, and a vaccinated seed from vaccinated broodstock at gonad developmental stage 2 was giving the best result.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Ilmu Akuakultur
VAKSINASI INDUK IKAN NILA (Oreochromis niloticus)
DAN KETAHANAN BENIH YANG DIHASILKANNYA
TERHADAP INFEKSI BAKTERI Streptococcus agalactiae
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Penguji Luar Komisi pada Ujian Tertutup : 1. Dr. Ir. Slamet Soebjakto, M.Si.
2. Dr. Dinamella Wahjuningrum, S.Si, M.Si. Penguji Luar Komisi pada Ujian Terbuka :
1. Dr. Ir. Slamet Soebjakto, M.Si.
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan September 2013– Desember 2014 ini ialah Vaksinasi Induk Ikan Nila (Oreochromis niloticus) dan Ketahanan Benih yang Dihasilkannya terhadap Infeksi Bakteri Streptococcus agalactiae.
Terima kasih penulis ucapkan kepada Bapak Dr. Ir. Sukenda, M.Sc, Bapak Prof. Dr. Ir. Muhammad Zairin Junior, M.Sc, Ibu Dr. drh. Angela Mariana Lusiastuti, M.Si, dan Ibu Dr. Sri Nuryati, S.Pi, M.Si selaku komisi pembimbing atas bimbingan, bantuan, saran dan masukan. Disamping itu, terima kasih penulis sampaikan kepada Pimpinan Balai Penelitian dan Pengembangan Budidaya Air Tawar (BPPBAT), Bogor dan kepada Prof. Dr. drh. Retno D. Soejoedono, MS (Laboratorium Imunologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor) yang telah memberi izin penggunaan laboratorium selama penelitian. Terima kasih juga penulis sampaikan untuk Universitas Hasanuddin yang telah memberikan rekomendasi untuk menempuh pendidikan S3 melalui Program Beasiswa Unggulan DIKTI. Terima kasih juga disampaikan kepada Dr. Ir. Hilal Anshary, M.Sc. (Dosen pada Program Studi Budidaya Perairan, Fakultas Ilmu Kelautan dan Perikanan, Universitas Hasanuddin) yang telah memberi masukan dalam penyelesaian studi, juga kepada Kementrian RISTEKDIKTI RI melalui Dirjen DIKTI yang telah memberikan beasiswa pendidikan S3 melalui program Beasiswa Unggulan periode tahun 2012-2015. Terima kasih juga penulis sampaikan kepada teman AKU 2012, semoga persahabatan tetap terjalin. Ungkapan terima kasih yang sebesar-besanya juga disampaikan kepada kedua orang tua tercinta Bapak Andi Jamaluddin Syam dan Ibu (Alm.) Andi Herawatiy, Bapak Mertua (Alm.) H. Umar Rumagia dan Ibu Mertua Hj. Syarifah Rumagia, Suami Faizal Rumagia, S.Pi, M.Si, saudara penulis Nurul Auliyah, S.Pi., M.Si., Andi Sompa, S.P., Anshar Priwarsani, S.T., Andi Khairun Mutia, S.TP, M.Si, Andi Nurul Mutmainnah, S.Sos, M.Si., dan Andi Ainun Hasanah, serta seluruh keluarga atas doa, bantuan dan dukungannya selama studi dan penelitian, dan terima kasih juga untuk kedua buah hati, Faraz Syabil Rumagia dan Nadzhifah Syarifah Rumagia yang selalu menemani dan memberikan semangat dalam kehidupan penulis.
Semoga karya ilmiah ini bermanfaat.
Bogor, Mei 2016
DAFTAR ISI
DAFTAR TABEL xv
DAFTAR GAMBAR xv
DAFTAR LAMPIRAN xvi
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 3
Manfaat Penelitian 3
Hipotesis Penelitian 3
Kebaruan (Novelties)Penelitian 4
Kerangka Berpikir Penelitian 4
2 TINJAUAN PUSTAKA 6
Karakteristik Bakteri Streptococcus agalactiae 6
Vitelogenesis Pada Ikan 7
Respons Imun Tubuh Ikan Terhadap Infeksi Patogen 11
Imunitas Maternal Ikan 11
3 METODOLOGI UMUM 16
Alur pelaksanaan penelitian 16
4 PENINGKATAN IMUNITAS BENIH IKAN NILA Oreochromis niloticus TERHADAP BAKTERI Streptococcus agalactiae MELALUI VAKSINASI
INDUK PADA TINGKAT KEMATANGAN GONAD YANG BERBEDA 19
Pendahuluan 20
Tujuan Penelitian 21
Bahan dan Metode 21
Hasil dan Pembahasan 25
Simpulan 34
5 UJI KETAHANAN BENIH DARI INDUK IKAN NILA, Oreochromis
niloticus, YANG DIVAKSIN BERDASARKAN TINGKAT KEMATANGAN GONAD (TKG) TERHADAP INFEKSI BAKTERI Streptococcus agalactiae 35
Pendahuluan 36
Tujuan Penelitian 37
Bahan dan Metode 37
Hasil Dan Pembahasan 38
Simpulan 40
6 EFIKASI VAKSIN Streptococcus agalactiae MELALUI PERENDAMAN PADA BENIH IKAN NILA (Oreochromis niloticus) DARI INDUK YANG
DIVAKSIN PADA TINGKAT KEMATANGAN GONAD BERBEDA 41
Pendahuluan 42
Tujuan 42
Bahan dan Metode 43
Hasil dan Pembahasan 45
7 PEMBAHASAN UMUM 49
8 SIMPULAN DAN SARAN 53
DAFTAR PUSTAKA 54
DAFTAR TABEL
1. Perkembangan organ limfoid utama pada beberapa ikan setelah
fertilisasi ... 12 2. Tingkat mortalitas dan RPS benih ikan pasca uji tantang dengan
bakteri Streptococcus agalactiae isolat N14G ... 38
3. Tingkat mortalitas dan relative percent survival (RPS) benih ikan nila
pasca uji tantang dengan bakteri Streptococcus agalactiae isolat N14G 47
DAFTAR GAMBAR
1. Kerangka berpikir penelitian vaksinasi induk ikan nila (Oreochromis niloticus) dan ketahanan benih yang dihasilkannya terhadap infeksi bakteri S. agalactiae ... 5 2. Peta penyebaran patogen streptococcal pada ikan Tilapia ... 6 3. Exophthalmia dan opacity pada ikan nila yang terinfeksi S.
agalactiae ... 7 4. Tingkat kematangan telur ikan. Secara fisiologis untuk betina dibagi
kedalam empat tahap. Tahap I previtelogenik, tahap II vitelogenik awal, tahap III vitelogenik akhir, tahap IV maturasi oocyte. ... 9 5. Siklus ovarium betina dari pemijahan tunggal dan multi. ... 10 6. Transfer imun induk kepada keturunannya. ... 12 7. Tahapan rencana penelitian vaksinasi gabungan sel utuh dan ECP
dari bakteri S. agalactiae isolate N14G untuk pencegahan penyakit
Streptococcosis pada benih ikan nila. ... 16 8. Alur rencana penelitian vaksinasi gabungan sel utuh dan dari bakteri
S. agalactiae ECP isolate N14G untuk pencegahan penyakit
Streptococcosis pada benih ikan nila. ... 17 9. Diagram alir percobaan. Head arrow menunjukkan waktu vaksinasi
induk betina ikan nila dan pengumpulan sampel telur dan benih yang dihasilkan. ... 22 10. Perkembangan gonad dan indeks gonad somatik (IGS, bobot
gonad/bobot tubuh x 100 %) selama satu siklus reproduksi dari induk ikan nila. ... 25 11. Penampang histologi tingkat pematangan gonad dari induk betina
ikan nila dalam satu siklus reproduksi. ... 27 12. Fraksinasi protein vitelogenin (VTG 1 dan VTG 2) dari ikan nila
17β-estradiol; 4 : jantan dengan perlakuan 17β-estradiol. Head arrowmenunjukkan berat molekul protein VTG (120 dan 195 kDa) .... 28 13. Fraksinasi protein vitelogenin (VTG 1 and VTG 2) dari induk ikan
nila selama sklus reproduksi menggunakan metode SDS-PAGE. ... 29 14. Optical density (OD)-ELISA titer antibodi setelah vaksinasi induk
ikan nila ... 31 15. Aktivitas lisozim serum ikan nila (a) serum induk pasca vaksinasi,
(b) homogenat telur, (c) homogenat benih. ... 33 16. Grafik perubahan pertumbuhan benih ikan nila. ... 34 17. Perubahan mata benih ikan nila (Oreochromis niloticus) setelah diuji
tantang dengan bakteri Streptococcus agalactiae isolatN14G; (a) mata
normal; (b) mata keruh . ... 39 18. Aktivitas lisozim benih ikan nila pasca vaksinasi ... 45 19. Titer antibodi spesifik (IgM) benih ikan nila pasca vaksinasi melalui
metode indirect ELISA pada 405 nm. ... 46
DAFTAR LAMPIRAN
1. Karakterisasi bakteri S. agalactiae menggunakan KIT API 20 Strep ... 59 2. Hasil pengukuran bobot molekul protein produk ekstraselular
(Extracellular Product/ECP) Streptococcus agalactiae dengan metode Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis (SDS-PAGE) ... 60 3. Metode dan hasil pengukuran kandungan protein dalam sampel
Glossarium
Embriogenesis : proses pembentukan dan perkembangan embrio. Proses ini merupakan tahapan perkembangan sel setelah mengalami pembuahan atau fertilisasi. Embriogenesis meliputi pembelahan sel dan pengaturan di tingkat sel.
Enhancer : reagen yang digunakan dalam pewarnaan gel SDS-PAGE menggunakan pewarna perak yang berfungsi mengubah perak terikat menjadi perak metalik sehingga warna pita pada gel menjadi lebih jelas Imunokompeten : kemampuan tubuh memproduksi respons kekebalan
secara normal setelah terpapar sebuah antigen Lymphomyeloid : organ yang berperan dalam sistem kekebalan
Memijah : proses pengeluaran sel telur yang telah matang dari gonad oleh induk betina ikan dan siap untuk dibuahi oleh jantan
Opacity : kekeruhan kornea
Penyuntikan Sub-kutan : penyuntikan ke area bawah kulit yaitu pada jaringan konektif atau lemak di bawah dermis.
TKG : tingkat kematangan gonad induk ikan nila
PENDAHULUAN
Latar Belakang
Ikan nila merupakan salah satu komoditas perikanan tawar yang tergolong populer sebagai ikan budidaya. Hal ini menggiring kepada peningkatan intensifikasi budidaya yang menyebabkan ikan ini tidak terlepas dari masalah penyakit akibat infeksi virus dan bakteri dan dapat menyebabkan kerugian bagi pembudidaya. Kebanyakan diantara penyakit tersebut yang paling sering dijumpai adalah streptococcosis, penyakit ini yang secara signifikan menyebabkan kematian pada budidaya nila. Menurut Sheehan et al. (2009), terdapat dua spesies yang merupakan agen utama dalam penyebaran penyakit ini yaitu bakteri Streptococcus agalactiae dan Streptococcus iniae, namun yang paling sering dijumpai menginfeksi ikan nila adalah S. agalactiae.
Bakteri S. agalactiae termasuk Gram positif dan bagian yang bersifat virulen adalah eksotoksin dari produk ekstraseluler (ECP) (Pasnik et al. 2005; Williams et al. 2003). Secara klinis ikan yang terinfeksi akan mengalami perubahan tingkah laku menjadi tidak normal, seperti berenang yang tidak menentu (whirling) dengan gerakan memutar bila berenang dipermukaan (Buller, 2004). Hasil penelitian yang dilakukan Hardi (2011), ECP dari bakteri S. agalactiae tipe β-hemolitik dan non-hemolitik yang diinjeksikan pada ikan nila menunjukkan gejala yang hampir sama dan seragam yaitu berenang abnormal (miring) dan dilanjutkan dengan berenang whirling.
Bakteri S. agalactiae adalah satu-satunya spesies streptococcal yang membawa antigen group B. Hasil analisis yang rinci dari Sheehan et al. (2009), S. agalactiae terdiri dari dua cluster atau biotipe berbeda berdasarkan variasi biokimia dan karakteristik fenotipnya. Strain biotipe 1 merupakan jenis beta-hemolitik, memfermentasi berbagai jenis gula termasuk trehalose dan galaktose, dan tumbuh baik pada suhu 37°C. Sebaliknya, strain dari biotipe 2 merupakan non-hemolitik, lebih terbatas dalam pemanfaatan gula dan pertumbuhan rendah pada suhu 37°C. Menurut Sheehan et al. (2009), biotipe 1 cenderung menginfeksi ikan pada masa pertumbuhan dari juvenil, sedangkan biotipe 2 menyebabkan penyakit secara umum pada ikan yang lebih besar.
Beberapa peneliti telah melaporkan penyebaran bakteri S. agalactiae pada ikan di Indonesia (Lusiastuti et al. 2009; Lusiastuti et al. 2014; Anshary et al. 2014). Aspek yang mempengaruhi keberhasilan dari budidaya ikan nila salah satunya adalah kualitas benih ikan nila yang ditebar. Hal ini erat hubungannya dengan kualitas induk ikan. Menurut Swain dan Nayak (2009), kesehatan dan status sistem imun induk ikan sangat penting bukan hanya pada saat pemijahan tetapi juga untuk kesehatan benih yang dihasilkan. Hal ini penting karena pada fase awal pertumbuhan, kemampuan embrio dan benih ikan masih terbatas atau sedikit dalam mensintesis antibodi spesifik. Setelah beberapa minggu menetas, tergantung dari spesiesnya, adanya imun yang diturunkan oleh induk menjadi esensial pada fase awal pertumbuhan benih. Sistem imun spesifik pada induk ikan mampu dirangsang pembentukannya melalui pemberian vaksin.
2
terhadap kerentanan serangan patogen sebelum sistem imun tubuh pada ikan berkembang dengan sempurna dan matang (Zhang et al. 2013). Pada mamalia, transfer IgG dari induk ke fetus dan anak yang baru lahir terjadi melalui plasenta dengan mekanisme transport aktif, mencakup reseptor yang memediasi transcytosis IgG menyeberangi syncytiotrophoblast, dan jalur transeluler melalui endothelium.
Pada ikan, imunoglobulin (IgM) maternal ditransferkan melalui kuning telur selama awal fase vitelogenesis. Mekanisme pengambilan dan penyimpanan IgM dalam kuning telur sampai saat ini masih dalam tahap penelitian. Proses yang diyakini terjadi adalah pengangkutan IgM ke dalam telur terjadi melalui transcytosis dengan menyeberangi sel folikel. Pada proses pengambilan IgM, folikel sel tampak berperan aktif karena keberadaannya dalam sitoplasma sel thecal dan granulose pre-vitelogenetik dan folikel vitelogenetik. Proses pengangkutan IgM kemungkinan berasal dari darah ke folikel tergantung pada variasi dari konsentrasi Ig sirkulasi darah. Keberadaan IgM dalam plasma pembuluh darah stromal selama tahap pematangan ovari, dan konsentrasi Ig serum meningkat signifikan selama periode reproduksi memperkuat dugaan lebih lanjut (Swain dan Nayak 2009).
Berdasarkan hasil penelitian Kanlis et al. (1995), diketahui bahwa imunoglobulin yang terdapat dalam oosit, telur, dan kuning telur benih dari red sea bream berhasil dideteksi menggunakan SDS-PAGE dan Western blotting, menggunakan antibodi kelinci anti IgM darah red sea bream. Imunoglobulin tersebut secara struktural tampak identik berdasarkan berat molekul dengan IgM darah induk ikan tersebut yaitu 78 kDa dan 26 kDa. Hubungannya dengan imunoglobulin oosit, IgM ada pada pada fase awal vitelogenesis sebelum pemijahan dan juga dalam ovari yang aktif bereproduksi selama pemijahan. Observasi tersebut menunjukkan bahwa imunoglobulin yang terdapat dalam darah induk dapat ditransfer ke oosit dan selanjutnya pada telur dan kuning telur benih dari ikan red sea bream. Hasil percobaan Swain danNayak (2009) pada induk sea bream (Sparus auratus) yang divaksin, total level IgM serum dan ekstrak telur sertabenih lebih tinggi daripada yang tidak diimunisasi.
Vaksin dari protein dalam ECP bakteri S. agalactiae yang diaplikasikan pada ikan nila telah diteliti sebelumnya oleh Hardi et al.(2013). Hasil penelitian menunjukkan bahwa protein dalam ECP bakteri S. agalactiae tipe β-hemolitik terbukti mampu memproteksi terhadap infeksi S. agalactiae. Lebih lanjut Hardi (2011) meneliti bahwa vaksinasi gabungan (sel utuh dan ECP β-hemolitik) S. agalactiae melindungi 92% ikan setelah diuji tantang dengan tipe β-hemolitik (103 CFU/ekor) dan 75% saat diuji tantang dengan tipe non-hemolitik (105
CFU/ekor). Nilai RPS (Relative Percent Survival) yang diperoleh pada percobaan tersebut lebih tinggi bila dibandingkan dengan percobaan vaksinasi menggunakan kombinasi vaksinasi dengan gabungan (sel utuh dan ECP non-hemolitik) melindungi 56% ikan setelah diuji tantang dengan tipe β-hemolitik dan hanya 50% saat diuji tantang dengan tipe non-hemolitik terhadap ikan nila.
3 minggu dengan cara perendaman (imersi) (Lusiastuti dan Hadie, 2010). Berdasarkan hasil penelitian Hardi (2011), vaksinasi dengan gabungan (sel utuh dan ECP) S. agalactiae isolat N14G mampu memberi proteksi sebesar 92% pada
ikan nila setelah diuji tantang dengan bakteri S. agalactiae yang homolog dan 75% saat diuji tantang dengan bakteri S. agalactiae isolat NK1.
Informasi mengenai imunitas maternal khususnya pada ikan nila dalam usaha pencegahan terhadap penyakit streptococcosis belum tersedia. Sebelumnya, Nur et al. (2004) telah berhasil meningkatkan daya tahan benih ikan nila melalui vaksinasi induk terhadap infeksi S. iniae (salah satu bakteri penyebab penyakit Streptococcosis). Namun, informasi waktu terbaik dalam melakukan vaksinasi induk betina sebelum pemijahan belum diketahui. Hal tersebut menjadi dasar dalam penelitian ini, dimana dianggap penting untuk dikaji perbedaan pengaruh pemberian vaksin pada induk berdasarkan tingkat kematangan gonad induk betina ikan nila, dengan harapan kedepannya hasil dari penelitian ini mampu mendukung keberhasilan produksi benih ikan nila yang berkualitas.
Tujuan Penelitian
Tujuan umum dari penelitian ini adalah mengkaji pengaruh pemberian vaksin gabungan sel utuh dan ECP bakteri S. agalactiae isolat N14G pada induk
terhadap kualitas benih yang dihasilkan. Berdasarkan tujuan umum tersebut, maka dikembangkan tujuan khusus untuk mencapai tujuan umum yaitu sebagai berikut : 1. Mengkaji pengaruh penyuntikan vaksin gabungan sel utuh dan ECP bakteri S. agalactiae isolat N14G pada induk betina ikan nila TKG II dan TKG III
terhadap kualitas imunitas maternal benih pada fase awal pertumbuhan.
2. Mengkaji laju pertumbuhan dan tingkat kebugaran benih ikan nila setelah diuji tantang dengan bakteri S. agalactiae isolat N14G.
3. Mengkaji efektivitas vaksinasi benih dari induk ikan nila yang telah diberi vaksin gabungan sel utuh dan ECP bakteri S. agalactiae isolat N14G.
Manfaat Penelitian
Manfaat penelitian ini adalah mengetahui efektivitas kandidat vaksin gabungan sel utuh dan ECP dari bakteri S. agalactiae isolat N14G pada induk dan
benih ikan nila. Dimasa depan diharapkan kandidat vaksin ini mampu memberi proteksi terhadap infeksi patogen tersebut pada ikan nila dalam proses budidaya.
Hipotesis Penelitian
Hipotesis yang diajukan dalam penelitian ini adalah sebagai berikut: 1. Perbedaan waktu vaksinasi induk ikan berpengaruh terhadap imunitas
turunannya.
2. Vaksin gabungan sel utuh dan ECP bakteri S. agalactiae isolat N14G
pada induk ikan nila, mampu memberikan proteksi pada benih akibat infeksi S. agalactiae (penyakit Streptococcosis) daripada benih yang berasal dari induk yang tidak divaksin.
4
4. Vaksinasi benih dari induk yang divaksin mampu memberi proteksi lebih baik terhadap infeksi bakteri S. agalactiae.
Kebaruan (Novelties)Penelitian
Kebaruan (novelty) dari penelitian ini adalah aplikasi vaksinasi menggunakan vaksin gabungan sel utuh dan ECP bakteri S. agalactiae isolat N14G
pada induk betina berdasarkan waktu vaksinasi (tingkat kematangan gonad/TKG), kajian analisis imunitas maternal serta potensi pengembangan aplikasi vaksinasi pada benih yang dihasilkannya sebagai bagian krusial proses produksi untuk menghasilkan benih yang berkualitas.
Kerangka Berpikir Penelitian
Latar belakang dan kerangka berpikir penelitian berjudul Vaksinasi Induk Ikan Nila (Oreochromis niloticus) dan Ketahanan Benih yang Dihasilkannya Terhadap Infeksi Bakteri Streptococcus agalactiae dijabarkan pada Gambar 1.
Ikan nila merupakan salah satu komoditas budidaya yang sedang pesat dikembangkan. Namun, dalam perkembangannya, kegiatan budidaya ikan ini juga mengalami keterhambatan oleh masalah penyakit Streptococcosis yang salah satunya disebabkan oleh bakteri S. agalactiae. Kejadian ini terus berlanjut akibat daya tahan tubuh ikan yang rendah selain faktor lingkungan yaitu tingginya padat penebaran, pencemaran perairan, perubahan iklim global yang juga mampu menyebabkan penurunan daya tahan tubuh ikan.
Infeksi patogen S. agalactiae mampu menyebabkan mortalitas 80 hingga 100% pada suatu wilayah budidaya ikan nila sistem intensif. Hal ini disebabkan selain karena faktor virulensi patogen yang tinggi, juga akibat gesekan antara ikan yang dapat menyebabkan luka dan terinfeksi oleh patogen ini.
Mudahnya ikan terinfeksi akibat rendahnya daya tahan tubuh ikan itu sendiri. Hal ini erat hubungannya dengan kualitas induk yang akan menurunkan imun (imunitas maternal) kepada benih yang dihasilkan. Induk yang telah terpapar antigen spesifik dari patogen, akan memproduksi antibodi spesifiknya (IgM). Melalui konsep ini, dianggap penting melakukan serangkaian penelitian yang berhubungan dengan vaksinasi induk. Hal ini diharapkan agar induk menghasilkan antibodi spesifik yang dapat diturunkan sebagai pertahanan awal benih yang dihasilkan sebelum fungsi sistem imunnya bekerja sempurna pada benih. Penelitian ini didesain dengan mengisolasi sel utuh dan ECP dari isolat N14G bakteri S. agalactiae yang selanjutnya digunakan sebagai kandidat vaksin
pada induk ikan nila. Pengujian tingkat proteksi imunitas maternal pada benih akan dilakukan dengan cara uji tantang dengan isolat N14G bakteri S. agalactiae.
5
Bakteri patogen
S. agalactiae
isolat N14G
Pencemaran air, kepadatan tinggi,
dll Kualitas Pakan
rendah
Kualitas induk ikan nila menurun
Benih yang dihasilkan rentan terhadap infeksi
patogen
Produksi budidaya ikan nila tilapia
menurun
Dibutuhkan solusi peningkatan kualitas
benih
Vaksinasi induk (Imunitas maternal)
Benih yang berkualitas (ketahanan tubuh lebih
baik)
Sel utuh ECP
Ruang lingkup penelitian
6
TINJAUAN PUSTAKA
Karakteristik Bakteri Streptococcus agalactiae
Berdasarkan hasil penelitian Sheehan et al. (2009), secara geografis S. agalactiae biotipe 2 yang memiliki nilai prevalensi paling tinggi dan menyebarkan patogen streptococcal. S. agalactiae biotipe 2 ditemukan di Asia (Cina, Indonesia, Vietnam, dan Filipina) dan Amerika Latin (Ecuador, Honduros, Mexico dan Brazil). S. agalactiae biotipe 1 patogen dominan pada ikan tilapia ditemukan di daerah Thailand, Malaysia dan Singapura. S. iniae seringkali diidentifikasi bersamaan keberadaannya dengan S. agalactiae biotipe 1 atau 2 di Cina, Ecuador, Honduras, Indonesia, Filipina, dan Thailand. Hanya di Negara Filipina dan Vietnam ditemukan ketiga jenis tersebut secara bersamaan (Gambar 2).
Gambar 2. Peta penyebaran patogen streptococcal pada ikan Tilapia (Sumber : Sheehan et al. 2009)
Bakteri S. agalactiae tipe non-hemolitik lebih virulen dibandingkan dengan tipe β-hemolitik dilihat dari kematian, munculnya gejala klinis, perubahan tingkah laku, perubahan patologi anatomi baik secara makroskopis maupun mikroskopis. Permukaan sel bakteri tipe β-hemolitik (non kapsul) lebih banyak tersusun atas protein yang lebih mudah dan cepat dikenali oleh sel fagosit. Sel bakteri tipe non-hemolitik (berkapsul) selain tersusun atas protein, juga tersusun atas karbohidrat yang lebih banyak, sehingga lebih sulit untuk difagosit. Sel bakteri tipe non-hemolitik lebih cepat tumbuh dan berkembangbiak serta menyebarkan virulensi di sel atau jaringan dibandingkan bakteri tipe β-hemolitik yang mudah dikenali dan mampu dilawan oleh sistem imun (Hardi 2011).
7 nafsu makan menurun. Gejala lain yang sering muncul adalah mata menonjol (exophthalmia) dan berenang memutar (whirling). Apabila serangan akut terjadi, maka akan terjadi kematian yang diduga karena adanya toksin, kehilangan cairan pada saluran pencernaan dan tidak berfungsinya sebagian organ.
Gambar 3. Exophthalmia dan opacity pada ikan nila yang terinfeksi S. agalactiae (Sumber : Sheehan et al. 2009)
Injeksi secara intraperitonial S. agalactiae dengan kepadatan 105 CFU/ml
pada ikan nila menyebabkan eksoptalamia, opacity, berenang tidak menentu, lethargy, dan kulit berwarna gelap setelah inokulasi pada hari 2, 7, dan ke-14. Peradangan terjadi pada hari ke-3 dan ke-7 setelah infeksi (Filho et al. 2008). Mian et al. (2009) menerangkan bahwa gejala klinis dari Streptococcus adalah kurang nafsu makan, kelesuan, perut bengkak dan usus diisi dengan cairan gelatinous atau kekuning-kuningan dan pada beberapa ikan terjadi hemoragik kecil di mata, eksoptalamia dan kornea keburaman (opacity), selain itu hati membesar, kongesti ginjal dan limpa, dan adanya cairan di rongga peritoneal. Ikan tilapia yang sakit akan menjadi lesu, berenang tak menentu, dan menunjukkan tanda-tanda kekakuan dorsal.
Perbedaan gejala yang muncul dapat dikaitkan dengan organ target S. agalactiae (mata, otak dan ginjal). Keberadaan bakteri pada organ mata dapat menyebabkan perubahan pada mata (opacity, purulens, eksoptalmia dan sebagainya). Keberadaan bakteri pada organ otak dapat menyebabkan ikan berenang abnormal (berenang miring bahkan whirling sedangkan keberadaan bakteri pada ginjal ikan dapat menyebabkan perubahan warna tubuh menjadi lebih hitam (Hardi 2011).
Ikan yang terinfeksi akan mengalami penurunan nafsu makan. Menurut Hardi (2011), bakteri yang menginfeksi otak ikan mengganggu kerja hipotalamus bagian lateral yang mengatur rasa lapar. Terganggunya sel-sel dalam hipotalamus yang berada dalam telencephalon (otak depan) akibat adanya S. agalactiae inilah yang menyebabkan ikan mulai mengalami penurunan nafsu makannya bahkan tidak mau makan pasca injeksi.
Vitelogenesis Pada Ikan
8
di dasar perairan. Telur yang telah dibuahi dierami dalam mulut (mouth breeder) induk betina kemudian menetas setelah 4 – 5 hari (Gomez-Marquez et al. 2003).
Secara mikroskopik, tingkat kematangan ovarium ikan nila diklasifikasikan menjadi 5 tingkatan. Pada kematangan gonad tingkat I: ovarium masih kecil, transparan, dan oosit muda hanya terlihat dengan menggunakan mikroskop. Pada kematangan gonad tingkat II, ovarium berwarna kuning terang, dan oosit dapat terlihat dengan mata. Pengamatan secara histologis memperlihatkan bahwa ovarium terdiri atas oosit muda dan oosit yang berisi protoplasma yang belum berkuning telur. Pada kematangan gonad tingkat III, ovarium besar, berwarna kuning gelap, dan ada oosit yang mulai mengandung kuning telur. Pada kematangan gonad tingkat IV, ovarium besar, berwarna cokelat, banyak oosit berukuran maksimal dan mudah dipisahkan. Pada kematangan gonad tingkat V, ovarium berwarna kuning terang, ukurannya berkurang karena telur yang sudah matang telah dilepaskan. Ovarium berisi oogonia, oosit berprotoplasma, dan sedikit oosit mengandung kuning telur, dan banyak dijumpai folikel pecah (Dadzie dan Wangila 1980).
Siklus reproduksi ikan betina didasarkan pada proses vitelogenesis, yaitu sintesis vitelogenin (VTG) yang merupakan prekursor penyediaan vitelin telur. VTG merupakan lipofosfoglikoprotein yang disintesis dalam hati di bawah rangsangan Estradiol-17ß. Estradiol-17ß diproduksi oleh lapisan granulosa pada folikel yang disekresikan ke aliran darah. Sebagian akan menuju hati dan sebagian akan memberikan rangsang balik ke hipotalamus dan hipofisa. Estradiol-17ß yang menuju hati akan berperan dalam proses pembentukan VTG yang merupakan komponen utama kuning telur. Rangsangan yang diberikan estradiol-17ß kepada hipotalamus adalah memacu pelepasan gonadotropin releasing hormon (GnRH) yang selanjutnya hormon ini merangsang hipofisa untuk melepaskan gonadotropin yang berperan dalam merangsang ovulasi pada oosit.
VTG setelah diproduksi kemudian dilepaskan ke peredaran darah dan bergabung secara bertahap ke dalam oosit, melalui reseptor yg dimediasi endositosis, VTG dipecah kedalam komponen yang lebih kecil (phosvitin, lipovitin, dan α-component), berkembang menjadi vitellin telur, kuning telur, atau vitelus. Akumulasi optimal dan proses dari VTG sangat penting untuk kualitas telur yang selanjutnya untuk ketahanan hidup benih yang baru menetas, di mana ini sebagai makanan cadangan untuk benih hingga permulaaan mencari makan dilingkungannya, beberapa hari setelah menetas (Mañanós et al. 2009).
9
Tidak ma
ta
ng
atau ika
n istirah
at
Pemijahan tunggal tahunan
Pemijahan multi tahunan
Pema
ta
ngan
i
kan
Ikan Matan
g
Telur tak terbuahi
Telur tak terbuahi Kejadian suksesi
memijah Tahap IV
Tahap IV
Tahap IV Tahap III
Tahap II Tahap I
Kejadian suksesi vitellogenesis
Awal Pematangan
Sex pertama vitellogenesis
10
Pemijahan multi tahunan
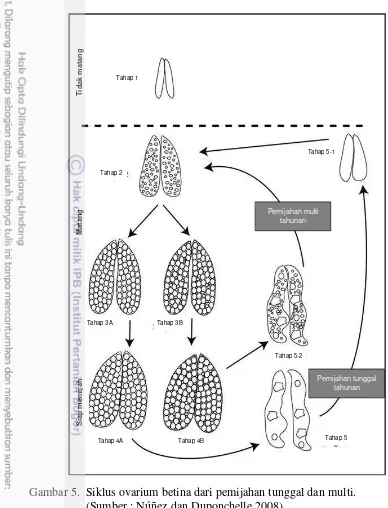
Pemijahan tunggal tahunan Tahap 2
Tahap 1
Tahap 3A Tahap 3B
Tahap 5-1
Tahap 5-2
Tahap 4B
Tahap 4A Tahap 5
Tid
ak
m
atang
Matang
Siap
m
emij
a
h
Gambar 5. Siklus ovarium betina dari pemijahan tunggal dan multi. (Sumber : Núñez dan Duponchelle 2008)
11
Respons Imun Tubuh Ikan Terhadap Infeksi Patogen
Berdasarkan hasil penelitian Hardi (2011) terhadap komposisi leukosit ikan normal dan ikan yang terinfeksi patogen, diketahui bahwa rataan proporsi leukosit ikan nila normal yaitu: limfosit (68-86%), monosit (3.9-5.9%) dan neutrofil (10-18.1%); sedangkan rataan proporsi jenis leukosit ikan yang diinjeksi bakteri S. agalactiae lebih bervariatif yaitu limfosit (72–81%), monosit (4.4–5.3%) dan neutrofil (13.5–21.2%). Hal ini menunjukkan bahwa ikan nila secara spontan melakukan invasi terhadap infeksi patogen dengan meningkatkan faktor imun tubuhnya melalui sel darah leukosit.
Peningkatan dan aktivitas leukosit dapat disebabkan oleh infeksi yang memicu aktivitas pembelahan sel dan perubahan populasi leukosit dapat diamati setelah 7 hari pascapemaparan. Adanya infeksi S. agalactiae menyebabkan ikan mengirimkan sel leukosit lebih banyak ke areal infeksi sebagai upaya pertahanan. Sel-sel leukosit tersebut bekerja sebagai sel yang memfagosit bakteri yang ada agar tidak dapat berkembang dan menyebarkan virulensi dalam tubuh inang sehingga sering ditemukan jumlah total leukosit mengalami peningkatan pasca infeksi oleh bakteri (Anderson 1974).
Mekanisme terbentuknya antibodi dalam tubuh diawali dengan pengikatan antigen oleh makrofag atau antigen presenting cell (APC). Antigen terfraksinasi pada sel makrofag dan diekspresikan ke permukaan sel APC melalui molekul major histocompatibility complex (MHC) kelas II yang berinteraksi dengan limfosit T helper melalui molekul cluster of differentiation (CD4) dan T-cell Receptor (TCR) (Mariuzza et al. 2010). Terjadi proliferasi limfosit T-helper menghasilkan sitokinin interleukin-2 (IL-2) yang merupakan mediator komunikasi limfosit T helper dan limfosit B. Limfosit B menangkap sinyal interleukin 2 dan berproliferasi menjadi sel plasma yang siap menghasilkan antibodi spesifik terhadap epitop antigen yang memaparnya, sedangkan sel memori akan tetap berada dalam sistem humoral dalam jangka waktu tertentu (Hirano et al. 2011).
Imunitas Maternal Ikan
12
induk yang tidak diimunisasi, menerangkan adanya perpindahan maternal faktor imun spesifik dan non-spesifik.
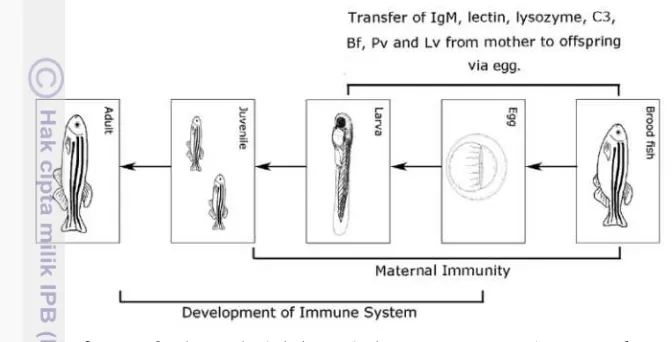
[image:30.595.109.445.200.371.2]Menurut Zhang et al. (2013), faktor yang berhubungan dengan kekebalan alami dan buatan turunan disalurkan dari induk ke benih sebagai imunitas maternal, ini memegang peranan penting terhadap perlindungan benih selama awal pertumbuhan sebelum sistem kekebalannya berkembang dan aktif bekerja untuk memproduksi IgM (Gambar 6).
Gambar 6.Transfer imun induk kepada keturunannya (Zhang et al. 2013). Studi mengenai imunitas maternal penting karena perkembangan organ yang berperan dalam sistem imun (lymphomyeloid) pada ikan terjadi beberapa hari setelah menetas tergantung spesies dan kondisi lingkungannya (Tabel 1), sehingga membutuhkan imun bawaan yang memungkinkan organime tersebut bertahan dari serangan patogen pada masa awal pertumbuhannya. Secara morfologi, sistem imun dari ikan didasarkan pada struktur organ lymphomyeloid dan pembentukan leukosit untuk ikan dewasa.
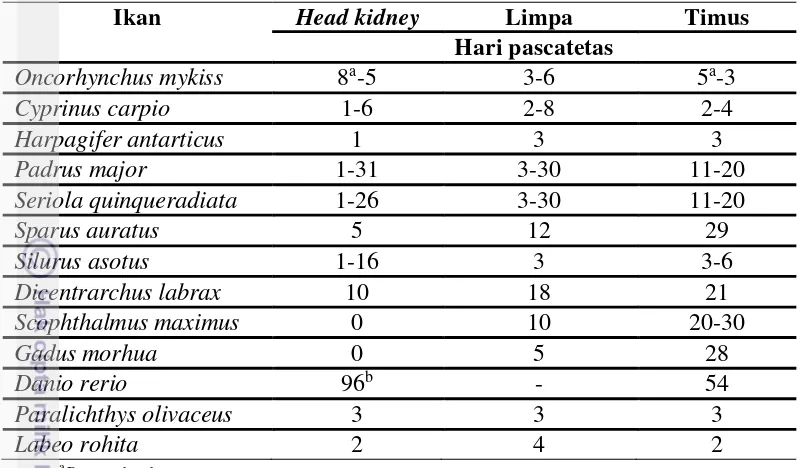
Organ lymphomyeloid utama pada ikan adalah, timus, head kidney, dan limpa. Ontogeny dari organ ini mulai berkembang dalam beberapa jam setelah fertilisasi (Tabel 1) tetapi urutan perkembangan berbeda antara perairan tawar, estuari, dan laut. Timus adalah organ yang pertama menjadi lymphoid, selanjutnya diikuti oleh ginjal dan limpa. Diperkirakan, organ lymphoid dan lymphocyte-B dan T muncul pada awal embriogenesis, untuk mencapai imunokompeten membutuhkan beberapa minggu tergantung spesies ikan (Swain dan Nayak 2009).
13 Tabel 1. Perkembangan organ limfoid utama pada beberapa ikan setelah fertilisasi
Ikan Head kidney Limpa Timus
Hari pascatetas
Oncorhynchus mykiss 8a-5 3-6 5a-3
Cyprinus carpio 1-6 2-8 2-4
Harpagifer antarticus 1 3 3
Padrus major 1-31 3-30 11-20
Seriola quinqueradiata 1-26 3-30 11-20
Sparus auratus 5 12 29
Silurus asotus 1-16 3 3-6
Dicentrarchus labrax 10 18 21
Scophthalmus maximus 0 10 20-30
Gadus morhua 0 5 28
Danio rerio 96b - 54
Paralichthys olivaceus 3 3 3
Labeo rohita 2 4 2
aDay pre hatch. bHours post fertilization
(Sumber : Mulero et al. 2007; Swain dan Nayak 2009)
Imunitas maternal melindungi organisme muda pada masa awal kehidupannya, di mana induk betina menyalurkannya melalui plasenta, kolostrum susu atau kuning telur. Pada ikan, kedua jenis imunitas alami dan adaptif disalurkan melalui induk betina ke keturunannya. Faktor imunitas yang telah dilaporkan mampu ditransfer dari induk ikan ke keturunannya adalah sebagai berikut :
a. Imunoglobulin atau antibodi
Transfer imunitas maternal seringkali didasarkan pada perpindahan Ig dari induk ke benih. Transfer imunoglobulin atau antibodi ke keturunannya telah dilaporkan di berbagai studi pada mamalia, reptile, dan ikan. Keberhasilan perpindahan IgM maternal ke telur dan embrio telah dilaporkan terjadi pada beberapa ikan teleostei seperti plaice (Pleuronectes platessa), tilapia (Oreochromis aureus), ikan mas (Cyprinus carpio), sea bream (Sparus aurata), sea bass (Dicentrarchus labrax), dan rainbow trout (O. mykiss). Beberapa peneliti telah melaporkan bahwa transfer antibodi menyebabkan perlindungan benih melalui imunisasi induk ikan dengan antigen spesifik.
14
b. Komponen komplemen
Sistem komplemen merupakan komponen penting dalam sistemimun dan bekerja melalui jalur lektin, ini merupakan lapisan pertama dari mekanisme pertahanan dari serangan patogen. Pada ikan teleostei, komponen berperan pada respon imun adaptif dan meliputi kemotaksis, opsonisasi, fagositik dan degradasi patogen. Komponen juga berperan sangat penting pada beberapa proses non-imunologis seperti fertilisasi, regenerasi hingga signal transduksi dan metabolisme energi dalam syaraf periferal sebaik organogenesis. Komponen komplemen yang berbeda seperti C3 (C3-1, C3-3, C3-4), C4, C5, C7, faktor B, dan D telah diketahui dipindahkan ke benih pada O. mykiss, C. carpio, D. rerio dan spotted wolffish (Anarhichas minor olafsen) (Swain dan Nayak 2009). c. Lektin
Lektin adalah karbohidrat yang berikatan dengan efektor protein yang larut dari respon imun alami yang berinteraksi dengan struktur permukaan patogenik yang mengarah ke opsonisasi, fagositosis atau aktifitas komplemen.Pada beberapa spesies teleostei, dilaporkan keberadaan dari beberapa jenis lektin yang berbeda telah dilaporkan.Lektin mencakup tipe pentraxin (protein C-reaktif, serum amyloid protein) termasuk dalam multipel fungsi biologis seperti imun alami melalui peran ikatan lektin, pencegahan polyspermy, aktivitas bakterisidal, dan opsonisasi patogen, respon fase akut, dan sitotoksisitas seluler yang dimediasi oleh lektin (Swain dan Nayak 2009).
Transfer lektin dari ind\uk ke benih telah dilaporkan pada banyak spesies ikan. Lektin seperti agglutinin, rhamnosa dan galactosa binding lectin ditemukan dalam oosit/ova/telur pada ikan yang berbeda seperti brown trout (Salmo trutta), ikan mola (Hypophthalmichthys molitrix), tench (Tinca tinca), Atlantic herring (Clupea harengus), coho salmon (Oncorhynchus kisutch), roach (Rutilus rutilus), O. mykiss dan P. platessa (Swain dan Nayak 2009).
d. Lisosim
16
METODOLOGI UMUM
Alur pelaksanaan penelitian
[image:34.595.44.474.61.764.2]Pelaksanaan pelaksanaan penelitian secara skematis disajikan pada Gambar 7 dan Gambar 8 berikut :
Calon induk ikan betina
matang gonad
Induk memijah
Telur menetas
Larva
Juvenil
TAHAP I :
Penentuan waktu vaksinasi induk terbaik berdasarkan Tingkat Kematangan Gonad
(TKG)
Parameter yang diukur : IgM dan aktivitas lisosim induk, telur, dan larva
TAHAP II :
Uji ketahanan benih dari induk yang divaksin terhadap bakteri
S. agalatiae
Parameter yang diukur : Mortalitas, RPS, dan gejala klinis pasca uji tantang
TAHAP III :
Uji potensi vaksinasi benih dari induk yang telah divaksin dan dibandingkan dengan
kontrol (tanpa vaksinasi) Parameter yang diukur : Total IgM,
aktivitas lisosim, RPS
Gambar 7. Tahapan penelitian vaksinasi gabungan sel utuh dan ECP dari bakteri S. agalactiae isolat N14G untuk pencegahan penyakit Streptococcosis
17
Persiapan vaksin
Vaksinasi induk pada TKG 2 dan 3
Uji tantang benih
Vaksinasi benih
Uji tantang benih
Persiapan induk
Penentuan TKG 2 dan 3
Sampling plasma darah per minggu Sampling gonad (histologi)
Analisis Vtg via SDS-PAGE Kultur Bakteri (media BHIB)
Pemisahan sel utuh dan ECP
50% Sel utuh + 50% ECP murni
Pengukuran IgM dan aktivitas lisosim telur dan benih
Pengukuran IgM dan aktivitas lisosim Induk
Pengamatan mortalitas dan RPS
Dalam media bak
Dalam media akuarium
Persiapan calon induk
Produksi serum rabbit anti-tilapia Pengamatan durasi proteksi Tahap I Tahap II Tahap III
Pengukuran IgM dan aktivitas lisosim benih
Pengamatan pertumbuhan benih Induk memijah
Gambar 8. Alur penelitian vaksinasi gabungan sel utuh dan dari bakteri S. agalactiae ECP isolat N14G untuk pencegahan penyakit
Streptococcosis pada benih ikan nila.
Penelitian mengenai vaksinasi S. agalactiae ini dilakukan dalam tiga tahap. Setiap tahap merupakan rangkaian penelitian yang saling berkaitan dan tidak dapat terpisahkan dari tahapan yang lainnya.
Tahap I merupakan penentuan waktu vaksinasi terbaik untuk induk ikan nila menggunakan vaksin gabungan sel utuh dan ECP bakteri S. agalactiae isolat N14G. Pada tahap ini, yang dilakukan pertama adalah pengamatan waktu rata-rata
[image:35.595.87.509.78.646.2]18
pada tahap ini adalah total IgM dan aktivitas lisosim induk, telur dan benih ikan nila.
Tahap II merupakan uji ketahanan benih ikan nila dari induk yang divaksin terhadap infeksi bakteri S. agalactiae. Pada tahap ini, benih yang dihasilkan dari induk yang diberi vaksin diuji tantang menggunakan bakteri S. agalactiae. Parameter utama yang diamati adalah Relative Per cent Survival (RPS) pascauji tantang.
Tahap III merupakan tahap akhir dimana pada tahap ini dilakukan pengujian potensi vaksinasi benih dari induk yang diberi vaksin gabungan sel utuh dan ECP bakteri S. agalactiae - N14G. Pada tahap ini, benih dari induk yang telah diberi
vaksin akan divaksin kembali menggunakan vaksin gabungan sel utuh dan ECP bakteri S. agalactiae isolate N14G di mana vaksinasi dilakukan saat total IgM
19
PENINGKATAN IMUNITAS BENIH IKAN NILA Oreochromis
niloticus TERHADAP BAKTERI Streptococcus agalactiae
MELALUI VAKSINASI INDUK PADA TINGKAT
KEMATANGAN GONAD YANG BERBEDA
Abstrak
Tujuan dari penelitian ini adalah untuk menentukan waktu vaksinasi induk terbaik berdasarkan tingkat kematangan gonad. Tahap perkembangan gonad per satuan waktu ditentukan melalui pengambilan contoh gonad ikan dewasa. Pengambilan contoh gonad dan plasma darah dimulai sesaat setelah memijah (0 hari), dan dilanjutkan setiap 7 hari hingga ikan memijah kembali. Pengamatan perkembangan gonad secara makroskopik dilakukan langsung di lapangan dengan menggunakan spesimen segar, dan dilanjutkan dengan analisis menggunakan metode histologi. Analisis level vitelogenin (VTG) plasma secara kualitatif selama siklus reproduksi menggunakan metode SDS-PAGE. Tahap selanjutnya adalah mengevaluasi level IgM dalam telur dan benih dari induk yang divaksin pada 7 hari dan 14 hari pascapemijahan. Vaksin yang digunakan adalah vaksin gabungan sel utuh dan produk ekstraseluler dari bakteri S. agalactiae. Vaksin disuntikkan sebanyak 0.4 ml per kg ikan dengan konsentrasi vaksin 109 CFU/ml.
Level IgM induk, telur, dan benih dianalisis menggunakan metode indirect ELISA. Hasil pengamatan perkembangan gonad menunjukkan bahwa awal vitelogenesis (Tingkat Kematangan Gonad / TKG 2) ditemukan pada pengambilan contoh hari ke 7 pascapemijahan sebelumnya, dan puncak vitelogenesis (TKG 3) ditemukan pada pengambilan contoh hari ke 14 pascapemijahan. Level IgM (optical density, ELISA) dari induk yang divaksin pada 7 hari pascamijah dalam telur (0.165±0.003) dan benih umur 7, 14, 21 dan 28 hari pascapenetasan (berturut-turut 0.163±0.002; 0.162±0.006, 0.155±0.006, dan 0.140±0.008) signifikan lebih tinggi (P<0.05) dibandingkan dengan telur dan benih yang berasal dari induk yang divaksin pada 14 hari pascamijah dan induk tanpa vaksinasi hingga akhir pengamatan. Hal ini menunjukkan bahwa waktu vaksinasi induk betina ikan nila secara langsung mempengaruhi akumulasi IgM dalam telur dan benih ikan yang dihasilkan sebagai imunitas turunan dan waktu vaksinasi induk betina ikan nila terbaik adalah pada TKG 2.
Kata kunci : vitelogenin, Streptococcus agalactiae, vaksin, imunoglobulin, benih
Abstract
20
level (VTG) plasma during the reproductive cycle was using SDS-PAGE. The antibody level in eggs and seeds from broodstock vaccinated on days 7 and 14 postspawning and control broodstock using indirect ELISA. Vaccine of mixed whole cell and ECP of S. agalactiae was injectedas much as 0.4 ml per kg of fish (109CFU/ml). The results showed that the stage 2 (onset of vitelogenesis) was found on day 7 postspawning earlier, and stage 3 (peak of vitelogenesis) found on day 14 postspawning. Spesific antibody levels in eggs of vaccinated broodstock (0.165 ± 0.003) and seed aged of 7, 14, 21 and 28 days posthatching (0.163 ± 0.002, 0.162 ± 0.006, 0.155 ± 0.006, and 0.140 ± 0.008 respectively) in stage 2 was significantly higher compared with other treatment until the end of the observation (P<0.05). The results indicated that vaccination time directly affected the accumulation of antibody in eggs and seeds as maternal immunity, and the best time of vaccination were at gonad developmental stage 2.
Keyewords: vitellogenin, Streptococcus agalactiae, vaccine, immunoglobulin, seed
Pendahuluan
Ikan nila Oreochromis niloticus merupakan salah satu jenis ikan yang banyak dibudidayakan di Indonesia. Permintaan yang tinggi berdampak pada intensifikasi budidaya ikan yang semakin meningkat. Ini memberi konsekuensi terhadap munculnya wabah penyakit infeksi, baik penyakit bakterial, viral maupun parasiter. Salah satu penyakit yang paling umum dijumpai menginfeksi ikan nila adalah adalah penyakit streptococcus yang salah satunya disebabkan oleh bakteri S. agalactiae. Yuasa et al. (2008), Sheehan et al. (2009), dan Jantrakajorn et al. (2014) berhasil mengidentifikasi bakteri S. agalactiae menjadi salah satu penyebab penyakit yang paling berbahaya yang menyebabkan kematian yang tinggi pada budidaya ikan nila di Cina, Thailand, Malaysia, dan Indonesia. Ditambahkan lagi bahwa bakteri tersebut umumnya menyerang organ mata dan otak ikan. Jantrakajorn et al. (2014) menemukan bakteri S. agalactiae yang paling dominan dijumpai menginfeksi ikan nila di seluruh area budidaya di Thailand, sedangkan S. iniae hanya ditemukan di daerah timur laut dan pusat Thailand.
Vaksinasi dengan tujuan pencegahan terhadap infeksi bakteri S. agalactiae telah berhasil dikembangkan oleh beberapa peneliti sebelumnya. Evans et al. (2004a) dan Evans et al. (2004b) mengungkapkan bahwa vaksin yang terdiri atas kombinasi formaline-killed S. agalactiae sel utuh dan produk ekstraseluler (ECP) secara signifikan mampu meningkatkan kekebalan ikan nila Tilapia terhadap infeksi bakteri tersebut. Selanjutnya, Pasnik et al. (2006) mengungkapkan bahwa antibodi spesifik anti S. agalactiae memegang peranan utama dalam sistem kekebalan tubuh ikan terhadap bakteri S. agalactiae.Amrullah et al. (2014) lebih spesifik mengungkapkan bahwa vaksin protein toxin ECP 89 kDa dari bakteri S. agalactiae isolat N14G dapat menjadi salah satu kandidat vaksin dalam
21 ikan. Faktor yang berhubungan dengan kekebalan alami dan buatan turunan disalurkan dari induk ke benih sebagai imunitas maternal, di mana ini memegang peranan penting terhadap perlindungan benih selama awal pertumbuhan sebelum sistem kekebalannya berkembang dan aktif bekerja untuk memproduksi IgM (Zhang et al. 2013).
Hanif et al. (2004) berhasilkan mengembangkan vaksin Photobacterium damsel subsp. piscicida SK7 (Phdp) pada induk sea bream (Sparus aurata L.) dan menghasilkan parameter humoral immune yang lebih tinggi pada telur dan benih dari induk yang divaksin dibanding dengan benih dari induk yang tidak divaksin. IgM dalam sirkulasi darah induk dipercaya ikut masuk bersama dengan vitelogenin ke dalam oosit selama proses vitelogenesis (Swain dan Nayak 2009). Namun, informasi mengenai waktu terbaik untuk melakukan vaksinasi pada induk belum tersedia khususnya pada ikan nila. Hal tersebut yang mendasari sehingga dianggap penting melakukan penelitian ini.
Tujuan Penelitian
Tujuan penelitian ini adalah untuk menemukan waktu yang terbaik untuk melakukan vaksinasi menggunakan vaksin kombinasi sel utuh dan ECP formaline-killed bakteri S. agalactiae berdasarkan perkembangan gonad dari induk ikan nila dengan harapan kedepannya mampu menghasilkan benih yang berkualitas.
Bahan dan Metode Ikan
Ikan yang digunakan adalah ikan betina yang telah dewasa dengan bobot rata-rata 250 g selama percobaan, ikan diletakkan dalam hapa secara individual pada kolam yang terkondisikan secara alami dengan 12 jam terang dan 12 jam gelap. Aerasi diberikan selama 24 jam. Pakan diberikan dua kali sehari sepuasnya menggunakan pakan komersil dengan kandungan protein 32%.
Induksi Sintesis dan Fraksinasi Protein Vitellogenin Ikan Nila Tilapia
22
Pengamatan Perkembangan Gonad Ikan Nila Tilapia
Tahapan perkembangan gonad berdasarkan makroskopik ditentukan di lapangan menggunakan sampel segar, dan sampel gonad ditempatkan dalam larutan Neutral Buffer Formalin (NBF) 10% untuk analisis menggunakan metode histologi. Pendugaan perkembangan gonad mengikuti hasil penelitian Suwa dan Yamashita (2007), McMillan (2007), dan Núñez dan Duponchelle (2008).
Sampel gonad dikumpulkan dimulai sesaat setelah pemijahan sebagai 0 hari, dan dilanjutkan setiap 7 hari hingga pemijahan berikut dengan masing-masing tiga ulangan. Induk ikan dipelihara dalam sistem tertutup. Plasma darah dikumpulkan setiap waktu pengambilan contoh. Analisis level vitelogenin (VTG) plasma secara kualitatif selama satu siklus reproduksi dilakukan dengan menggunakan metode SDS-PAGE (gel 7.5%) berdasarkan metode Laemmli (1970).
Bakteri
Bakteri yang digunakan adalah S. agalactiae isolat N14G (isolat dari Balai
Penelitian dan Pengembangan Budidaya Air Tawar Bogor). Vaksin
Vaksin yang digunakan adalah campuran sel utuh dan ECP dari bakteri S. agalactiae. Bakteri ditumbuhkan dalam media BHIB dan diinkubasi dengan shaker pada suhu 27 °C selama 72 jam berdasarkan metode Klesius et al. (1999) dan Evans et al. (2004a). Konsentrasi yang dicapai dalam proses ini sekitar 1 x 1011 colony-forming units (CFU) ml-1. Biakan bakteri selanjutnya ditambahkan neutral buffer formaline (NBF) dengan konsentrasi 3%. Suspensi disentrifugasi untuk memisahkan sel utuh dan cairan kultur. ECP diperoleh melalui penyaringan cairan kultur menggunakan 0.22 µm miliphore filter steril (membrane solution MS® CA syringe filter). Konsentrat ECP dan sel utuh disimpan secara terpisah dalam wadah steril pada suhu 4 °C.
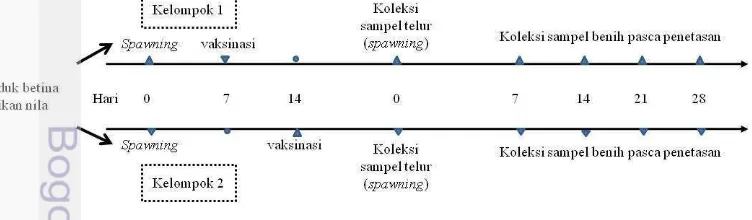
Induk ikan divaksin dengan dosis vaksin 0.4 ml/kg ikan dan konsentrasi 1x109 CFU/ml yang terdiri atas campuran 50% sel utuh dan 50% ECP (v/v).
Induk ikan diinjeksi pada hari ke 7 setelah pemijahan sebelumnya sebagai Kelompok 1, dan 14 hari setelah pemijahan sebelumnya sebagai Kelompok 2 (Gambar 9) dan induk tanpa vaksin digunakan sebagai kelompok kontrol.
[image:40.595.101.477.591.701.2]23
Persiapan Antigen Bakteri
Antigen ELISA dipersiapkan dengan cara sel utuh dan ECP disonikasi 40 Hz selama 5 menit (diatas es) dan selanjutnya disentrifugasi pada 3000 g selama 60 menit. Supernatant dikumpulkan sebagai antigen dan disimpan pada -20 °C. Persiapan Serum IgM Induk Ikan, Telur dan Benih
Darah induk dikumpulkan melalui pangkal ekor sebelum divaksin dan hari ke 15 setelah vaksinasi. Darah dibiarkan menggumpal pada suhu ruang selama 1 – 2 jam dan pada suhu 4 °C semalaman. Serum dikumpulkan setelah disentrifugasi pada 3000 rpm selama 10 menit, penyimpanan dilakukan dengan membagi dua serum dan disimpan pada -20 °C.
Telur dikumpulkan saat induk memijah. Benih (tiga kelompok) dikumpulkan pada hari ke tujuh setelah penetasan dan dilanjutkan setiap tujuh hari hingga hari ke 28. Telur dan benih dibilas tiga kali menggunakan PBS steril pH 7.2, dihomogenkan 4 x volume dalam larutan phosphate-buffer saline plus 0.05% tween-20 (PBS-T) dan disentrifugasi pada 3000 rpm selama 5 menit dan disimpan pada -20°C.
Pembuatan Antiserum Ikan Nila
Pembuatan antibodi kelinci anti-nila berdasarkan metode Swain et al. (2007) dengan mengambil 10-15 mL serum dari ikan Nila sehat 250-300 g. Kemudian ditambahkan larutan amonium sulfat jenuh setetes demi setetes dalam suhu 4 °C (on ice) menggunakan konsentrasi hasil hitung dari kalkulator amonium sulfat (Encor Biotechnology Inc. 2012), pengadukan semalaman dilakukan menggunakan magnetic stirrer pada suhu 4°C. Selanjutnya, disentrifugasi dengan 10000 g pada suhu 4 °C selama 10 menit. Presipitat (endapan) dilarutkan dalam 5 mL karbonat-bikarbonat bufer (pH 9.6). Sentrifugasi dilakukan kembali dengan 10000 g pada suhu 4 °C selama 10 menit. Pelet lalu dikumpulkan dan dibuat volume 2 mL dengan karbonat-bikarbonat bufer (pH 9.6). Larutan globulin tersebut didialisis menggunakan membran dialisis dalam PBS (pH 7.2) selama 72 jam pada suhu 4 °C. Untuk menguji amonium sulfat yang tersisa dalam proses dialisis, dapat menggunakan larutan 10% BaCl2, jika masih terdapat endapan
berarti masih terdapat amonium sulfat sehinga proses dialisis perlu dilanjutkan kembali sampai bebas dari amonium sulfat. Globulin murni yang telah diperoleh kemudian dikumpulkan dalam tube steril dan disimpan pada suhu -20 °C.
Produksi globulin anti-nila dilakukan pada kelinci (New Zealand White Bred) berdasarkan metode Lund et al. (1991). Serum yang dipanen selanjutnya dimurnikan seperti tahapan sebelumnya. Untuk penyimpanan lama, globulin kelinci anti-nila disimpan pada suhu -40 °C.
Enzime-linked immunosorbent assay (ELISA)
24
setiap sumur dari 8-sumur microtiter plate, inkubasi pada suhu 4 °C selama 24 jam. Microtiter plate dicuci dengan menggunakan PBS-T (PBS pH 7.4 + 0,05% Tween-20). Bovine Serum Albumin (BSA, Sigma) 3% dalam H2O w/v
ditambahkan sebanyak 100 μL dan disimpan pada suhu 25 °C selama 1 jam, kemudian plate dicuci dengan PBS-T. Sampel nila diencerkan 1:50 pada PBS-T untuk serum induk, dan 1:4 untuk telur dan benih. Sampel nila yang telah diencerkan ditambahkan ke dalam microtiter plate 100 μL dengan 3 kali ulangan. Plate di inkubasi pada 25 °C selama 1 jam kemudian dicuci dengan PBS-T. Ig anti-nila rantai panjang untuk antibodi spesifik monoklonal diencerkan 1:200 pada PBS-T dan 100 μL ditambahkan ke setiap sumur Mikrotiter plate. Plate diinkubasi pada suhu 25 °C selama 1 jam kemudian dicuci menggunakan PBS-T. Peroxidase-conjugated rabbit anti rabbit (Sigma) diencerkan menjadi 1:5000 pada PBS-T dan 100 μL ditambahkan pada setiap sumur microtiter plate. Plate diinkubasi pada suhu 25 °C selama 1 jam kemudian dicuci. One-Step Ultra TMB-ELISA (Sigma) (TMB 5 mg + 10 µL H2O2 38% dalam 5 mL asetat buffer pH 5)
sebanyak 100 μL ditambahkan pada setiap sumur microtiter plate. Setelah 20 menit, reaksi ELISA dihentikan dengan menambahkan 50 μL 3 M H2SO4.
Pengamatan optical density (OD) pada absorbance 405 nm menggunakan Microplate Reader. Untuk blanko, H2SO4 ditambahkan sebanyak 100 μL kedalam
sumur pertama dari microtiter plate dan didiamkan selama 20 menit, kemudian ditambahkan 100 μL substrat TBM-ELISA. Jumlah total antibodi dinyatakan dalam nilai OD.
Pengukuran Aktivitas lisosim
Aktivitas lisosim pada induk, telur dan benih diukur menggunakan metode Ellis (1990) dalam Hanif et al. (2004). Sampel (plasma induk betina, homogenat telur dan benih) sebanyak 100 µL dimasukkan ke dalam microtiter plate dan ditambahkan 100 µL suspensi bakteri Micrococcus lysodeikticus dalam phosphate buffer dengan konsentrasi 0.4 mg mL-1. Selanjutnya, microtiter plate diinkubasi
pada 22°C dan OD dibaca pada 450 nm. Pembacaan OD dilakukan pada 30 detik
dan 30 menit. Hasil pengukuran OD lisosim selanjutnya secara matematis diolah menggunakan rumus sebagai berikut :
�� = ��� − �� / � / � �
Keterangan :
ODin : optical density awal (30 detik)
ODf : optical density akhir (30 menit)
Waktu : waktu pengukuran yaitu 30 menit
Volume plasma : volume plasma induk, telur, dan benih (homogenattelur dan benih yaitu 0.1 ml x 4 [jumlah volume pengenceran menggunakan PBS-T])
Analisis Data
25
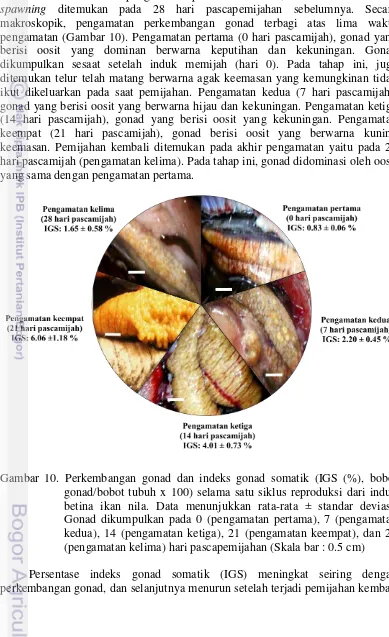
Hasil dan Pembahasan Perkembangan gonad
Berdasarkan hasil pengamatan pada Gambar 10, diketahui bahwa re-spawning ditemukan pada 28 hari pascapemijahan sebelumnya. Secara makroskopik, pengamatan perkembangan gonad terbagi atas lima waktu pengamatan (Gambar 10). Pengamatan pertama (0 hari pascamijah), gonad yang berisi oosit yang dominan berwarna keputihan dan kekuningan. Gonad dikumpulkan sesaat setelah induk memijah (hari 0). Pada tahap ini, juga ditemukan telur telah matang berwarna agak keemasan yang kemungkinan tidak ikut dikeluarkan pada saat pemijahan. Pengamatan kedua (7 hari pascamijah), gonad yang berisi oosit yang berwarna hijau dan kekuningan. Pengamatan ketiga (14 hari pascamijah), gonad yang berisi oosit yang kekuningan. Pengamatan keempat (21 hari pascamijah), gonad berisi oosit yang berwarna kuning keemasan. Pemijahan kembali ditemukan pada akhir pengamatan yaitu pada 28 hari pascamijah (pengamatan kelima). Pada tahap ini, gonad didominasi oleh oosit yang sama dengan pengamatan pertama.
[image:43.595.113.502.150.787.2]26
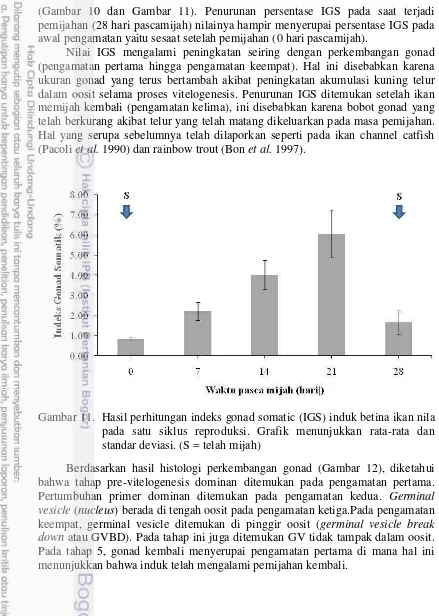
(Gambar 10 dan Gambar 11). Penurunan persentase IGS pada saat terjadi pemijahan (28 hari pascamijah) nilainya hampir menyerupai persentase IGS pada awal pengamatan yaitu sesaat setelah pemijahan (0 hari pascamijah).
[image:44.595.47.486.81.697.2]Nilai IGS mengalami peningkatan seiring dengan perkembangan gonad (pengamatan pertama hingga pengamatan keempat). Hal ini disebabkan karena ukuran gonad yang terus bertambah akibat peningkatan akumulasi kuning telur dalam oosit selama proses vitelogenesis. Penurunan IG