SKRINING FITOKIMIA DAN UJI AKTIVITAS ANTIBAKTERI EKSTRAK KULIT BUAH TANAMAN JENGKOL (Pithecellobium jiringa (Jack) Prain.) TERHADAP BAKTERI Streptococcus mutans, Staphylococcus aureus DAN Escherichia coli
SKRIPSI
OLEH: NURUSSAKINAH
NIM : 050804040
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
BAHAN SKRIPSI
SKRINING FITOKIMIA DAN UJI AKTIVITAS ANTIBAKTERI EKSTRAK KULIT BUAH TANAMAN JENGKOL (Pithecellobium jiringa (Jack) Prain.) TERHADAP BAKTERI Streptococcus mutans, Staphylococcus aureus DAN Escherichia coli
Diajukan untuk melengkapi salah satu syarat untuk mencapai Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH: NURUSSAKINAH
NIM : 050804040
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
Pengesahan Skripsi
SKRINING FITOKIMIA DAN UJI AKTIVITAS ANTIBAKTERI EKSTRAK KULIT BUAH TANAMAN JENGKOL (Pithecellobium jiringa (Jack) Prain.) TERHADAP BAKTERI Streptococcus mutans, Staphylococcus aureus DAN Escherichia coli
Oleh:
NURUSSAKINAH NIM 050804040
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi
Universitas Sumatera Utara Pada tanggal : Februari 2010
Pembimbing I, Panitia Pengu ji,
(Drs. Awaluddin Saragih, M.Si., Apt) (Dr. M. Pandapotan Nasution, MPS., Apt NIP. 195008221974121002 NIP. 194908111976031001
)
Pembimbing II, (Drs. Awaluddin Saragih, M.Si., Apt
NIP. 195008221974121002
)
(Drs. Suryadi Achmad, M.Sc.,Apt.) (Dra. Masfria, MS., Apt NIP. 195109081985031002 NIP. 195707231986012001
)
(Dra. Suwarti Aris, M.Si., Apt NIP. 195107231982032001
)
Dekan Fakultas Farmasi
(Prof. Dr. Sumadio Hadisahputra, Apt. NIP. 195311281983031002
KATA PENGANTAR
Alhamdulillah, penulis ucapkan ke hadirat Allah SWT Yang Maha Agung
yang telah melimpahkan rahmat, hidayah dan kemudahan kepada penulis
sehingga dapat menyelesaikan penelitian dan penyusunan skripsi yang berjudul
“Skrining Fitokimia dan Uji Aktivitas Antibakteri Ekstrak Kulit Buah Tanaman Jengkol (Pithecellobium jiringa (Jack) Prain) terhadap Bakteri Streptococcus mutans, Staphylococcus aureus, dan Esherichia coli” sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi di Fakultas Farmasi
Universitas Sumatera Utara.
Penulis mempersembahkan rasa terima kasih yang tak terhingga kepada
Ayahanda Azwir Salam dan Ibunda Mardani yang telah memberikan semangat
dan cinta yang sangat tulus, untuk kakak dan adik-adikku tersayang Fadhliah
Azwir, Muhammad Arqam, Memen Permata Azmi dan Idul Muttaqin, atas semua
doa, kasih sayang, semangat dan pengorbanan baik moril maupun materil.
Semoga Allah SWT selalu melindungi.
Pada kesempatan ini, penulis juga mengucapkan terima kasih yang
sebesar-besarnya kepada:
1. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas
Farmasi Universitas Sumatera Utara
2. Bapak Drs. Awaluddin Saragih, M.Si., Apt., dan Bapak Drs. Suryadi
Achmad, M.Sc., Apt., selaku pembimbing yang telah memberikan waktu,
bimbingan dan nasehat selama penelitian hingga selesainya penyusunan
3. Bapak/Ibu Pembantu Dekan, Bapak dan Ibu staf pengajar Fakultas Farmasi
USU yang telah mendidik penulis selama masa perkuliahan dan Ibu Dra.
Siti Aman, MS., Apt., selaku penasehat akademik yang telah memberikan
arahan dan bimbingan kepada penulis selama ini.
4. Bapak Dr. M. Pandapotan Nasution, MPS., Apt., Ibu Dra. Masfria, M.Si.,
Apt., Ibu Dra. Suwarti Aris, M.Si., Apt., selaku dosen penguji yang telah
memberikan saran, arahan, kritik dan masukan kepada penulis dalam
penyelesaian skripsi ini.
5. Bapak Drs. Awaluddin Saragih, M.Si., Apt., selaku Kepala Laboratorium
Obat tradisional dan Bapak Prof. Dr. Erman Munir, M.Sc., selaku Kepala
Laboratorium Mikrobiologi, FMIPA serta semua staf yang telah
memberikan arahan dan fasilitas selama penulis melakukan penelitian.
6. Sahabat tersayang penulis Raja Abdul Kadir Jailani yang telah
memberikan semua doa, kasih sayang, dan semangat yang luar biasa dalam
menyelesaikan skripsi ini.
7. Sahabat-sahabat penulis: Uswah, Dwi, Rina, Anna, Esther, Reni, Tata,
Intan, Icut, Devi, Andien dan rekan-rekan mahasiswa Farmasi stambuk
2005 serta sahabat kecil penulis Juwita Arini atas dukungan, semangat,
bantuan dan persahabatan selama ini selama masa perkuliahan sampai
sampai penyusunan skripsi ini.
8. Abang dan Kakak-kakak Farmasi: Bang Diding, Bang Tomi, kak Sulastri,
kak Nanda, kak Puji, kak Merry, kak Nita, kak Febi, kak Reki, kak Yayuk,
kak Bunga, kak Leli, kak Ira, kak Silmi, kak Indah, kak Winda dan
bantuan, motivasi dan inspirasi bagi penulis selama penelitian sampai
penyusunan skripsi ini.
Semoga Allah SWT memberikan balasan yang berlipat ganda dan pahala
yang sebesar-besarnya kepada semua pihak yang telah membantu penyelesaian
skripsi ini.
Penulis mengharapkan kritik dan saran yang membangun dari semua pihak
guna perbaikan skripsi ini. Akhir kata penulis berharap semoga skripsi ini dapat
bermanfaat bagi ilmu pengetahuan khususnya di bidang Farmasi.
Medan, Februari 2010
Penulis,
SKRINING FITOKIMIA DAN UJI AKTIVITAS ANTIBAKTERI EKSTRAK KULIT BUAH TANAMAN JENGKOL
(Pithecellobium jiringa (Jack) Prain.) TERHADAP BAKTERI Streptococcus mutans, Staphylococcus aureus, DAN Escherichia coli
Abstrak
Kulit buah tanaman jengkol (Pithecellobium jiringa (Jack) Prain.)
merupakan salah satu bagian tanaman yang perlu dikembangkan manfaatnya,
misalnya sebagai obat kumur, pencegah karies, infeksi pada kulit dan saluran
pencernaan. Selama ini kulit buah jengkol termasuk limbah organik di pasar
tradisional yang tidak memberikan nilai ekonomis, oleh karena itu perlu dilakukan
penelitian pemanfaatan kulit buah jengkol.
Pada penelitian ini dilakukan skrining fitokimia dan uji aktivitas
antibakteri ekstrak etanol kulit buah jengkol terhadap Streptococcus mutans,
Staphylococcus aureus dan Escherichia coli yang dilakukan secara in vitro
dengan metode difusi agar meggunakan lubang. Sampel kulit buah jengkol
diambil secara purposif dari pasar tradisional di Jalan Sei Kera, Kecamatan
Medan Timur, Medan, Provinsi Sumatera Utara.
Hasil skrining fitokimia dari simplisia dan ekstrak etanol kulit buah
jengkol menunjukan adanya senyawa golongan alkaloid, flavonoid, tanin,
glikosida, saponin, steroid/triterpenoid. Uji aktivitas antibakteri dari ekstrak etanol
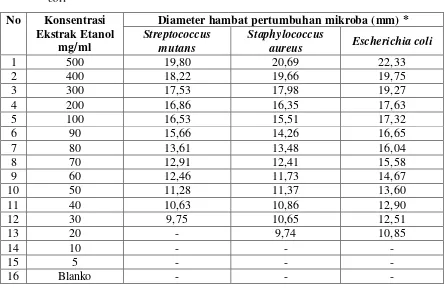
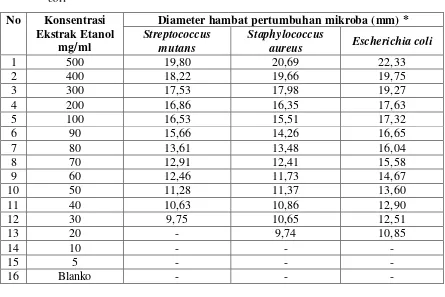
kulit buah jengkol menunjukan bahwa konsentrasi terkecil pada bakteri
Streptococcus mutans sebesar 30 mg/ml konsentrasi terkecil pada bakteri
Staphylococcus aureus sebesar 20 mg/ml, dan konsentrasi terkecil pada bakteri
Escherichia coli sebesar 20 mg/ml. Sedangkan batas daerah hambat yang efektif
dengan diameter 15,66 mm pada konsentrasi 90 mg/ml untuk bakteri
Streptococcus mutans, diameter 14,26 mm pada konsentrasi 90 mg/ml untuk
bakteri Staphylococcus aureus dan diameter 14,67 mm pada konsentrasi 60 mg/ml
untuk bakteri Escherichia coli.
PHYTOCHEMICAL SCREENING AND ANTIBACTERIAL ACTIVITY TEST OF JENGKOL PERICARP EXTRACT
(Pithecellobium jiringa (Jack) Prain.) WITH RESPECT TO Streptococcus mutans, Staphylococcus aureus AND Escherichia coli
Abstract
Jengkol pericarp (Pithecellobium jiringa (Jack) Prain.) is one of the plants
part that need to be developed the benefits, such as mouthwash, dental caries
prevention, infection of the skin and gastrointestinal tract. During this, jengkol
pericarp includes organic waste in the traditional markets which do not provide
economic value, therefore the utilization of jengkol pericarp research needs to be
done.
In this research was conducted at the phytochemical screening and testing
antibacterial activity of ethanol extract of the jengkol pericarp against
Streptococcus mutans, Staphylococcus aureus dan Escherichia coli that was
conducted as invitro agar diffusion method by using the hole. Jengkol pericarp
sample purposively drawn from traditional market at Sei Kera Street, district of
East Medan, Province North Sumatra.
The results of phytochemical screening of jengkol pericarp simplisia and
ethanol extract indicate class of alkaloid compounds, flavonoids, tannins,
glycosides, saponins, steroids/ triterpenoids. The antibacterial activity test of
ethanolic extract of jengkol pericarp shows that the smallest concentration of
Streptococcus mutans bacteria at 30 mg/ml, the smallest concentration of
Staphylococcus aureus bacteria at 20 mg/ml, and the smallest concentration of
Escherichia coli bacteria at 20 mg/ml. Whereas the limit of effective drag area
with a diameter of 15,66 mm in the concentration 90 mg/ml for Streptococcus
mutans bacteria, a diameter of 14,26 mm in the concentration 90 mg/ml for
Staphylococcus aureus bacteria and a diameter of 14,67 mm in the concentration
60 mg/ml for Escherichia coli bacteria.
DAFTAR ISI
Halaman
JUDUL……… i
HALAMAN PENGESAHAN... iii
KATA PENGANTAR... iv
ABSTRAK... vii
ABSTACT... viii
DAFTAR ISI... ix
DAFTAR TABEL... xiv
DAFTAR GAMBAR... xv
DAFTAR LAMPIRAN... xvi
BAB I PENDAHULUAN... 1
1.1 Latar Belakang... 1
1.2 Perumusan Masalah... 3
1.3 Hipotesis... 3
1.4 Tujuan Penelitian... 3
1.5 Manfaat Penelitian... 4
1.6 Kerangka Pikir Penelitian... 4
BAB II TINJAUAN PUSTAKA... 5
2.1 Uraian Tumbuhan... 5
2.1.1 Sistematika Tumbuhan... 5
2.1.2 Sinonim... 5
2.1.3 Nama Daerah... 5
2.1.5 Kandungan Kimia dan Khasiat Tumbuhan... 6
2.2. Ekstraksi... 7
2.3. Uraian Kandungan Kimia Tumbuhan... 9
2.3.1 Steroid/Triterpenoid... ... 9
2.3.2 Alkaloid... 10
2.3.3 Glikosida... 10
2.3.4 Flavonoid... 11
2.2.5 Tanin... 12
2.2.6 Saponin ... 13
2.4 Uraian Bakteri... 13
2.4.1 Perkembangbiakan Bakteri... 14
2.4.2 Media Pertumbuhan Bakteri... 16
2.4.3 Fase Pertumbuhan Bakteri... 18
2.4.4 Bakteri Streptococcus mutans... 20
2.4.4.1 Sistematika Streptococcus mutans... 20
2.4.4.2 Uraian Bakteri Streptococcus mutans... 20
2.4.4.3 Karies Gigi... 20
2.4.4.4 Sifat Adherensi Streptococcus mutans... 21
2.4.5 Bakteri Staphylococcus aureus... 23
2.4.5.1 Sistematika Staphylococcus aureus... 23
2.4.5.2 Uraian Bakteri Staphylococcus aureus.... 23
2.4.6 Bakteri Escherichia coli... 24
2.4.6.1 Sistematika Escherichia coli... 24
2.4.7 Uji Aktivitas Antibakteri... 24
BAB III METODOLOGI PENELITIAN... 26
3.1 Alat dan Bahan... 26
3.1.1 Alat... 26
3.1.2 Bahan... 26
3.1.3 Pembuatan larutan Pereaksi... 27
3.1.3.1 Larutan Pereaksi Mayer... 27
3.1.3.2 Larutan Pereaksi Dragendorff... 27
3.1.3.3 Larutan Pereaksi Bouchardat... 27
3.1.3.4 Larutan Pereaksi Molish... 27
3.1.3.5 Larutan Liebermann-Burchard... 27
3.1.3.6 Larutan Pereaksi Besi (III) Klorida 1% 28 3.1.3.7 Larutan Pereaksi Timbal (II) Asetat 0,4 M 28 3.1.3.8 Larutan Pereaksi Asam Klorida 2 N... 28
3.1.3.9 Larutan Pereaksi Asam Sulfat 2 N... 28
3.1.3.10 Larutan Pereaksi Asam Nitrat 0,5 N... 28
3.2 Pengolahan Sampel... 28
3.2.1 Identifikasi Sampel... 28
3.2.2 Pengambilan Sampel... 28
3.2.3 Pembuatan Simplisia... 29
3.2.4 Karakterisasi Simplisia... 29
3.2.4.1 Pemeriksaan Makroskopik Simplisia... 29
3.2.4.2 Pemeriksaan Mikroskopik Serbuk Simplisia dan Bahan Segar... 29
3.2.4.4 Penetapan Kadar Sari yang Larut Air... 31
3.2.4.5 Penetapan Kadar Sari yang Larut Etanol… 31 3.2.4.6 Penetapan Kadar Abu Total... 31
3.2.4.7 Penetapan Kadar Abu yang Tidak Larut dalam Asam... 32
3.2.5 Pembuatan Ekstrak Kulit Buah Jengkol...…... 32
3.3 Skrining Fitokimia... 33
3.3.1 Pemeriksaan Steroid/Triterpenoid... 33
3.3.2 Pemeriksaan Alkaloida... 33
3.3.3 Pemeriksaan Glikosida... 33
3.3.4 Pemeriksaan Flavonoid... 34
3.3.5 Pemeriksaan Tanin ... 34
3.3.6 Pemeriksaan Saponin ... 34
3.4 Uji Aktivitas Antibakteri... 35
3.4.1 Sterilisasi Alat... 35
3.4.2 Pembuatan Media Muller Hinton Agar (MHA)…... 35
3.4.3 Pembuatan Larutan Natrium Klorida 0,9 %... 35
3.4.4 Pembuatan Suspensi Standar Mc. Farland……... 36
3.4.5 Pembuatan Media Agar Miring... 36
3.4.6 Pembiakan Bakteri...………..……. 37
3.4.6.1 Pembuatan Stok Kultur... 37
3.4.61.1 Bakteri Streptococcus mutans... 37
3.4.61.2 Bakteri Staphylococcus aureus... 37
3.4.6.2 Penyiapan Inokulum...………… 37
3.4.6.2.1 Bakteri Streptococcus mutans... 37
3.4.6.2.2 Bakteri Staphylococcus aureus... 38
3.4.6.2.3 Bakteri Escherichia coli... 38
3.4.6 Pembuatan Larutan Uji dengan Berbagai Konsentrasi... 38
3.4.7 Metode Pengujian Efek Antibakteri secara Invitro... 38
BAB IV HASIL DAN PEMBAHASAN……… 40
BAB V KESIMPULAN DAN SARAN………... 45
4.1 Kesimpulan... 45
4.2 Saran... 45
DAFTAR PUSTAKA………... 46
DAFTAR TABEL
Tabel Halaman
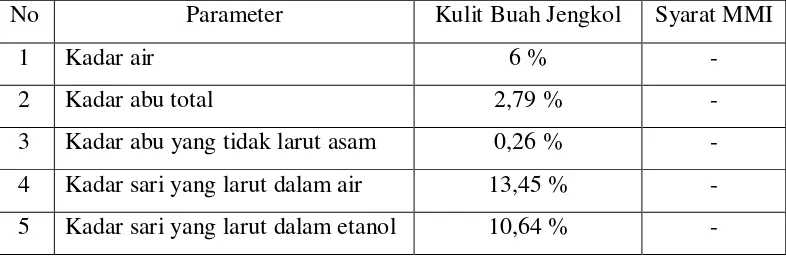
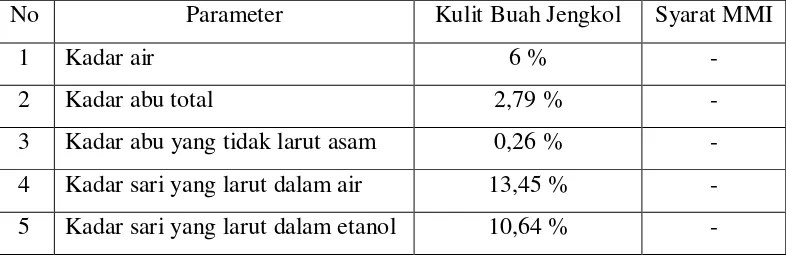
1. Hasil Pemeriksaan Karakterisasi Serbuk Simplisia... 40
2. Hasil Skrining Fitokimia ... 41
3. Hasil Uji Aktivitas Antibakteri Ekstrak Etanol Kulit Buah
Jengkol... 42
4. Hasil Uji Aktivitas Antibakteri Ekstrak Etanol Kulit Buah
Jengkol tiga kali perulangan... 63
DAFTAR GAMBAR
Gambar Halaman
1. Struktur Steroid... 9
2. Struktur Flavonoid... 11
3. Grafik Pertumbuhan Bakteri... 19
4. Metabolisme Sukrosa ekstraselular oleh Streptococcus mutans Membentuk Glukan Ikatan Glikosidik (1-3) dan asam laktat Yang Dapat Menyebabkan Karies Gigi... 22
5. Gambar Buah Jengkol...……... 42
6. Kulit Buah Jengkol………... 43
7. Simplisia Kulit Buah Jengkol..………... 44
8. Serbuk Simplisia Kulit Buah Jengkol…... 44
9. Mikroskopik Penampang Melintang Kulit Buah Jengkol... 45
10. Mikroskopik Simplisia Serbuk Kulit Buah Jengkol... 45
11. Bagan Penelitian... 46
12. Bagan Pengolahan Sampel...………... 47
13 Bagan Pembuatan Ekstrak Serbuk Simplisia Kulit Buah Jengkol 48 14. Bagan Uji Aktivitas Antibakteri ... 49
15. Zona Hambat Dari Ekstrak Kulit Buah Jengkol Terhadap Bakteri Streptococcus mutans …... 56
16. Zona Hambat Dari Ekstrak Kulit Buah Jengkol Terhadap Bakteri Staphylococcus aureus..………... 56
DAFTAR LAMPIRAN
Lampiran Halaman
1. Identifikasi Tumbuhan Jengkol (Pithecellobium jiringa (Jack)
Prain.)………... 49
2. Gambar Buah Jengkol...…..………... 50
3. Gambar Kulit Jengkol...……….…………... 51
4. Gambar Simplisia dan Simplisia Serbuk Kulit Buah Jengkol.. 52
5. Mikroskopik...……... 53
6. Perhitungan Hasil Pemeriksaan Karaterisrik Simplisia... 54
7. Bagan Penelitian…………... 59
8. Bagan Pengolahan Sampel……… 60
9. Bagan Pembuatan Ekstrak Serbuk Simplisia Kulit Buah Jengkol... 61
10. Bagan Uji Aktivitas Antibakteri Ekstrak Etanol Kulit Buah Jengkol... 62
11. Hasil Uji Aktivitas Antibakteri Dengan Tiga Kali Perulangan... 63
12. - Zona Hambat Dari Ekstrak Etanol Kulit Buah Jengkol Terhadap Bakteri Streptococcus mutans………... 64
- Zona Hambat Dari Ekstrak Etanol Kulit Buah Jengkol Terhadap Bakteri Staphylococcus aureus...……….. 64
SKRINING FITOKIMIA DAN UJI AKTIVITAS ANTIBAKTERI EKSTRAK KULIT BUAH TANAMAN JENGKOL
(Pithecellobium jiringa (Jack) Prain.) TERHADAP BAKTERI Streptococcus mutans, Staphylococcus aureus, DAN Escherichia coli
Abstrak
Kulit buah tanaman jengkol (Pithecellobium jiringa (Jack) Prain.)
merupakan salah satu bagian tanaman yang perlu dikembangkan manfaatnya,
misalnya sebagai obat kumur, pencegah karies, infeksi pada kulit dan saluran
pencernaan. Selama ini kulit buah jengkol termasuk limbah organik di pasar
tradisional yang tidak memberikan nilai ekonomis, oleh karena itu perlu dilakukan
penelitian pemanfaatan kulit buah jengkol.
Pada penelitian ini dilakukan skrining fitokimia dan uji aktivitas
antibakteri ekstrak etanol kulit buah jengkol terhadap Streptococcus mutans,
Staphylococcus aureus dan Escherichia coli yang dilakukan secara in vitro
dengan metode difusi agar meggunakan lubang. Sampel kulit buah jengkol
diambil secara purposif dari pasar tradisional di Jalan Sei Kera, Kecamatan
Medan Timur, Medan, Provinsi Sumatera Utara.
Hasil skrining fitokimia dari simplisia dan ekstrak etanol kulit buah
jengkol menunjukan adanya senyawa golongan alkaloid, flavonoid, tanin,
glikosida, saponin, steroid/triterpenoid. Uji aktivitas antibakteri dari ekstrak etanol
kulit buah jengkol menunjukan bahwa konsentrasi terkecil pada bakteri
Streptococcus mutans sebesar 30 mg/ml konsentrasi terkecil pada bakteri
Staphylococcus aureus sebesar 20 mg/ml, dan konsentrasi terkecil pada bakteri
Escherichia coli sebesar 20 mg/ml. Sedangkan batas daerah hambat yang efektif
dengan diameter 15,66 mm pada konsentrasi 90 mg/ml untuk bakteri
Streptococcus mutans, diameter 14,26 mm pada konsentrasi 90 mg/ml untuk
bakteri Staphylococcus aureus dan diameter 14,67 mm pada konsentrasi 60 mg/ml
untuk bakteri Escherichia coli.
PHYTOCHEMICAL SCREENING AND ANTIBACTERIAL ACTIVITY TEST OF JENGKOL PERICARP EXTRACT
(Pithecellobium jiringa (Jack) Prain.) WITH RESPECT TO Streptococcus mutans, Staphylococcus aureus AND Escherichia coli
Abstract
Jengkol pericarp (Pithecellobium jiringa (Jack) Prain.) is one of the plants
part that need to be developed the benefits, such as mouthwash, dental caries
prevention, infection of the skin and gastrointestinal tract. During this, jengkol
pericarp includes organic waste in the traditional markets which do not provide
economic value, therefore the utilization of jengkol pericarp research needs to be
done.
In this research was conducted at the phytochemical screening and testing
antibacterial activity of ethanol extract of the jengkol pericarp against
Streptococcus mutans, Staphylococcus aureus dan Escherichia coli that was
conducted as invitro agar diffusion method by using the hole. Jengkol pericarp
sample purposively drawn from traditional market at Sei Kera Street, district of
East Medan, Province North Sumatra.
The results of phytochemical screening of jengkol pericarp simplisia and
ethanol extract indicate class of alkaloid compounds, flavonoids, tannins,
glycosides, saponins, steroids/ triterpenoids. The antibacterial activity test of
ethanolic extract of jengkol pericarp shows that the smallest concentration of
Streptococcus mutans bacteria at 30 mg/ml, the smallest concentration of
Staphylococcus aureus bacteria at 20 mg/ml, and the smallest concentration of
Escherichia coli bacteria at 20 mg/ml. Whereas the limit of effective drag area
with a diameter of 15,66 mm in the concentration 90 mg/ml for Streptococcus
mutans bacteria, a diameter of 14,26 mm in the concentration 90 mg/ml for
Staphylococcus aureus bacteria and a diameter of 14,67 mm in the concentration
60 mg/ml for Escherichia coli bacteria.
BAB I PENDAHULUAN
1.1.Latar Belakang
Indonesia merupakan pusat keragaman hayati dunia dan menduduki urutan
terkaya dunia setelah Brazil. Di Indonesia diperkirakan hidup sekitar 40.000
spesies tumbuhan Spermatophyta, dimana dari seluruh spesies tumbuhan tersebut,
diperkirakan sekurang-kurangnya 9.600 spesies tumbuhan berkhasiat obat dan
baru kurang lebih 300 spesies yang digunakan sebagai bahan obat tradisional
(Depkes RI, 2006).
Sesuai Keputusan Menteri Kesehatan No.131/Menkes/SK/II/2004 tentang
Sistem Kesehatan Nasional (SKN) yang menyatakan bahwa pengembangan dan
peningkatan obat tradisional harus terus dilakukan agar diperoleh obat yang
bermutu tinggi, aman, memiliki khasiat yang nyata yang teruji secara ilmiah dan
dimanfaatkan secara luas baik untuk pengobatan sendiri oleh masyarakat maupun
digunakan dalam pelayanan kesehatan formal (Depkes RI, 2006).
Salah satu tumbuhan yang berkhasiat obat adalah jengkol (Pithecellobium
jiringa (Jack) Prain.) suku Fabaceae, yang sudah sejak lama ditanam di Indonesia,
di kebun atau pekarangan. Buah jengkol mengandung karbohidrat, protein,
vitamin A, vitamin B, fosfor, kalsium, alkaloid, minyak atsiri, steroid, glikosida,
tanin, dan saponin. Biji jengkol merupakan bagian tanaman yang paling banyak
dimanfaatkan sebagai bahan makanan dan obat. Sebagai obat, biji jengkol dapat
membantu memperlancar proses buang air besar karena jengkol mengandung serat
yang tinggi, dapat juga mencegah penyakit diabetes karena kandungan asam dan
tradisional dan tidak memberikan nilai ekonomis. Kulit buah jengkol diduga
mengandung senyawa tanin, dugaan tersebut berdasarkan kenyataan, bila kulit
buah jengkol dikupas menggunakan pisau besi maka akan terbentuk warna biru
kehitaman pada kulit buah jengkol yang dikupas. Hal ini menunjukkan adanya
senyawa tanin. Senyawa tanin merupakan senyawa metabolit sekunder pada
tumbuhan yang bersifat sebagai antibakteri, memiliki kemampuan menyamak
kulit dan juga dikenal sebagai astringensia (Robinson, 1995).
Dari sifat antibakteri senyawa tanin, maka tanin dapat digunakan sebagai
obat antiradang, antidiare, pengobatan infeksi pada kulit dan mulut, dan
pengobatan luka bakar. Oleh karena itu, tanin sebagai antibakteri dapat digunakan
dalam bidang pengobatan (Hariana, 2007).
Berdasarkan uraian diatas, dilakukan penelitian uji aktivitas antibakteri
dari ekstrak kulit buah jengkol. Bakteri uji yang digunakan dalam penelitian ini
adalah Streptococcus mutans, Staphylococcus aureus dan Escherichia coli.
Streptococcus mutans adalah bakteri penyebab karies gigi, dimana penyakit ini
merupakan penyakit tertinggi keenam yang dikeluhkan masyarakat. Berdasarkan
Survey Kesehatan Rumah Tangga (SKRT, 2004), prevalensi karies mencapai
90,05 % (Pitauli, 2008). Staphylococcus aureus merupakan bakteri gram positif,
yang terdapat pada kulit, hidung, mulut, selaput lendir, bisul dan luka, sedangkan
Escherichia coli merupakan bakteri gram negatif, terdapat dalam saluran cerna
1.2 Perumusan Masalah
Adapun perumusan masalah penelitian ini adalah:
a. Apa sajakah golongan senyawa kimia yang terdapat pada simplisia dan
ekstrak etanol kulit buah jengkol?
b. Apakah ekstrak etanol kulit buah jengkol mempunyai aktivitas antibakteri
terhadap bakteri Streptococcus mutans, Staphylococcus aureus, dan
Escherichia coli?
1.3 Hipotesis
Berdasarkan perumusan masalah, maka hipotesis penelitian adalah:
a. Golongan senyawa kimia yang terdapat pada simplisia dan ekstrak etanol
kulit buah jengkol adalah sama yaitu alkaloid, flavonoid, tanin, saponin,
glikosida dan steroid/triterpenoid.
b. Ekstrak etanol kulit buah jengkol mempunyai aktivitas antibakteri
terhadap bakteri Streptococcus mutans, Staphylococcus aureus dan
Escherichia coli.
1.4 Tujuan Penelitian
Adapun tujuan penelitian ini adalah sebagai berikut:
a. Untuk mengetahui golongan senyawa kimia pada simplisia dan ekstrak
etanol kulit buah jengkol.
b. Untuk mengetahui aktivitas antibakteri dari ekstrak etanol kulit buah
jengkol terhadap bakteri Streptococcus mutans, Staphylococcus aureus
1.5 Manfaat Penelitian
Adapun manfaat dari penelitian ini adalah sebagai berikut:
a. Memperoleh informasi tentang aktivitas antibakteri dari ekstrak etanol
kulit buah jengkol terhadap bakteri Streptococcus mutans,Staphylococcus
aureus dan Escherichia coli, dengan meneliti terlebih dahulu golongan
senyawa kimia yang terdapat pada simplisia dan ekstrak etanol kulit buah
jengkol.
b. Dengan pengembangan penelitian selanjutnya, akan mendukung program
pemerintah dalam rangka pemanfaatan bahan alam sehingga dapat
dimanfaatkan dalam pelayanan kesehatan formal.
1.6 Kerangka Pikir Penelitian
Penelitian ini dilaksanakan dengan kerangka konsep seperti ditunjukkan
berikut ini :
Variabel bebas Variabel terikat Parameter
Daya Hambat Staphylococcus aureus,
Streptococcus mutans dan Escherichia coli
yana diukur dengan metode zona hambat Ekstrak kulit buah jengkol Simplisia kulit buah jengkol Makroskopik Mikroskopik Kadar air
Kadar sari larut dalam etanol
Kadar sari larut dalam air
Kadar abu total
Kadar abu tidak larut dalam asam Golongan senyawa kimia
BAB II
TINJAUAN PUSTAKA 2.1 Uraian Tumbuhan
2.1.1 Sistematika Tumbuhan
Sistematika tumbuhan jengko l (Tjitrosoepomo, 2000):
Divisi : Spermatophyta
Sub divisi : Angiospermae
Kelas : Dicotyledonae
Bangsa : Rosales
Suku : Fabaceae
Genus : Pithecellobium
Spesies : Pithecellobium jiringa (Jack) Prain
2.1.2 Sinonim
Sinonim dari Pithecellobium jiringa (Jack) Prain (ITOI, 1994) :
1. Pithecollobium lobatum Benth
2. Zygia jiringa (Jack) Kosterm
2.1.3 Nama Daerah
Gayo: jering, Batak: jering, Karo dan Toba: joring, Minangkabau: jarieng,
Lampung: jaring, Dayak: Jaring, Sunda: jengkol, Jawa: jingkol, Bali: blandingan,
Sulawesi Utara: Lubi (Heyne, 1987).
2.1.4 Habitat dan Morfologi
Tumbuhan jengkol merupakan pohon di bagian barat Nusantara, tingginya
sampai 26 m, dibudidayakan secara umum oleh penduduk di Jawa dan Sumatera
musim kemarau yang sedang dan tidak tahan terhadap musim kemarau yang
terlalu panjang (Heyne, 1987).
Buah jengkol berupa polong berbentuk gepeng dan berbelit. Warna
buahnya lembayung tua. Setelah tua, bentuk polong buahnya menjadi cembung
dan di tempat yang mengandung biji ukurannya membesar. Bijinya berkulit ari
tipis dan berwarna coklat mengilap (Anonim, 2009).
2.1.4. Kandungan Kimia dan Khasiat Tumbuhan
Buah jengkol mengandung karbohidrat dan minyak atsiri (Heyne, 1987).
Selain itu dari hasil penelitian buah jengkol juga mengandung protein, vitamin A,
vitamin B, fosfor, kalsium, alkaloid, steroid, glikosida, tanin, dan saponin
(Anonim, 2007).
Khasiat buah jengkol menurut para ahli kesehatan adalah dapat
memperlancar proses buang air besar, jengkol juga dapat mencegah penyakit
diabetes. Kandungan vitamin C pada 100 gram buah jengkol adalah 80 mg
Vitamin C sangat dibutuhkan tubuh untuk meningkatkan imunitas tubuh. Buah
jengkol merupakan sumber protein yang baik, yaitu 23.3 gram per 100 gram
bahan. Kadar proteinnya jauh melebihi tempe yang selama ini dikenal sebagai
sumber protein nabati, yaitu hanya 18.3 gram per 100 gram. Bagi anak-anak,
protein sangat berperan untuk perkembangan tubuh dan sel otaknya. Pada orang
dewasa, apabila terjadi luka memar dan sebagainya, protein dapat membangun
kembali sel-sel yang rusak. Buah jengkol mengandung zat besi, yaitu 4.7 gram per
100 gram. Kandungan fosfor pada buah jengkol (166.7mg/100 gram) juga sangat
penting untuk pembentukan tulang dan gigi, serta untuk penyimpanan dan
Dari hasil penelitian Rahayu dan Pukan (1998) diungkapkan kalau
kandungan senyawa kimia dalam kulit jengkol yaitu alkaloid, steroid/triterpenoid,
saponin, flavonoid dan tanin (Anonim, 2009).
Menurut penelitian, ekstrak air kulit buah jengkol dapat digunakan
sebagai larvasida untuk mencegah penyakit demam berdarah (Anonim, 2009).
Selain itu juga dimanfaat sebagai herbisida alami untuk pengendalian gulma di
sawah tanpa menghambat pertumbuhan padi, senyawa aktif tersebut merupakan
hasil dekomposisi kulit buah jengkol selama 5-20 hari (Anonim 2001).
Penyebab bau jengkol adalah asam amino yang terkandung didalam biji
jengkol. Asam amino itu didominasi oleh asam amino yang mengandung unsur
Sulfur (S). Ketika terdegradasi akan terpecah-pecah menjadi komponen yang
lebih kecil, asam amino itu akan menghasilkan berbagai komponen flavor yang
sangat bau, karena pengaruh sulfur tersebut. Salah satu gas yang terbentuk dengan
unsur itu adalah gas H2S yang terkenal sangat bau (Anonim, 2009).
Memakan biji jengkol terlalu banyak dapat menyebabkan keracunan,
yaitu hyperaemia ginjal dan pendarahan ginjal. Selain itu dapat juga mengurangi
atau menghentikan keluarnya urine serta kejang kandung kemih (Heyne, 1987).
2.2 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair. Ekstrak
adalah sediaan kental yang diperoleh dengan mengekstrak senyawa aktif dari
simplisia nabati atau simplisia hewani mengggunakan pelarut yang sesuai,
tersisa diperlakukan sedemikian hingga memenuhi baku yang telah ditetapkan
(Ditjen POM, 2000).
Ada beberapa cara metode ekstraksi dengan menggunakan pelarut (Ditjen
POM, 2000), yaitu:
1. Cara Dingin
a. Maserasi adalah proses pengekstrakan simplisia dengan menggunakan
pelarut dengan beberapa kali pengocokan atau pengadukan pada
temperatur kamar. Remaserasi berarti dilakukan pengulangan penambahan
pelarut setelah dilakukan penyaringan maserat pertama dan seterusnya.
b. Perkolasi adalah ekstraksi dengan pelarut yang selalu baru, yang umumnya
dilakukan pada temperatur ruangan. Prosesnya terdiri dari tahapan
pengembangan bahan, tahapan maserasi antara, tahap perkolasi sebenarnya
(penetesan/penemapungan ekstrak), terus menerus sampai diperoleh
ekstrak (perkolat) yang tidak meninggalkan sisa bila 500 mg perkolat
terakhir diuapkan pada suhu ± 50oC.
2. Cara Panas
a. Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya,
selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan
dengan adanya pendingin balik. Umumnya dilakukan pengulangan proses
pada residu pertama sampai 3-5 kali sehingga proses ekstraksi sempurna.
b. Soxhlet adalah ekstraksi menggunakan pelarut yang selalu baru yang
umumnya dikakukan dengan alat khusus sehingga terjadi ekstrak kontinu
c. Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada
temperatur yang lebih tinggi dari temperatur kamar, yaitu secara umum
dilakukan pada temperatur 40-50oC.
d. Infus adalah ekstraksi dengan pelarut air pada temperatur 96-98oC selama
15-20 menit di penangas air dapat berupa bejana infus tercelup dengan
penangas air mendidih.
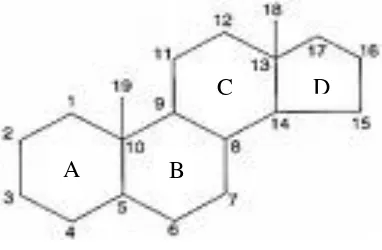
2.3 Uraian Kandungan Kimia Tumbuhan 2.3.1Steroid / Triterpenoid
Steroid adalah triterpenoida yang kerangka dasarnya sistem cincin siklo
pentana perhidrofenantren. Uji yang biasa digunakan adalah reaksi
Liebermann-Burchard yang dengan kebanyakan triterpen dan steroid memberikan warna
hijau-biru (Harbone, 1987).
Gambar 1. Struktur steroid
Triterpenoid adalah senyawa yang kerangka karbonnya berasal dari enam
satuan isoprena dan secara biosintesis diturunkan dari hidrokarbon C30 asiklik,
yaitu skualena. Senyawa ini berstruktur siklik yang rumit, kebanyakan berupa
alkohol, aldehid atau asam karboksilat. berupa senyawa tanwarna, berbentuk
kristal, sering kali bertitik leleh tinggi dan aktif optik (Harbone, 1987).
A B
Triterpenoid dapat dipilah menjadi sekurang-kurangnya menjadi empat
golongan senyawa: triterpenoid sebenarnya, steroid, saponin, dan glikosida
jantung. Saponin dan glikosida jantung merupakan triterpenoida dan steroid yang
terutama terdapat sebagai glikosida (Harbone, 1987).
2.3.2 Alkaloid
Alkaloida merupakan senyawa bersifat basa yang mengandung satu atau
lebih atom nitrogen, bersifat optis aktif. Kebanyakan alkaloid berbentuk kristal
dan hanya sedikit yang berupa cairan pada suhu kamar. Sebagian besar alkaloid
berasa pahit. Alkaloid sering kali beracun bagi manusia dan banyak yang
mempunyai kegiatan fisiologi yang menonjol, jadi banyak digunakan secara luas
dalam bidang pengobatan (Harborne, 1987).
Prazat alkaloid yang paling umum adalah asam amino, tetapi kebanyakan
biosintesis alkaloid lebih rumit (Harborne, 1987). Beberapa pereaksi uji yang
sering digunakan adalah Mayer, Bouchardat dan Dragendorf (Farnsworth, 1966).
2.3.3 Glikosida
Glikosida adalah suatu senyawa yang bila dihidrolisis akan menghasilkan
satu atau lebih gula yang disebut glikon dan bagian bukan gula disebut aglikon.
Jika bagian gulanya adalah glukosa maka disebut glukosida, sedangkan jika
bagian gulanya selain glukosa disebut glikosida (Tyler,1977)
Menurut Fransworth (1966), pembagian glikosida berdasarkan ikatan yang
menghubungkan bagian gula dan bukan gula adalah :
1. C-glikosida, jika atom C menghubungkan bagian gula dan bukan gula.
2. O-glikosida, jika atom O menghubungkan bagian gula dan bukan gula.
Contoh: salisin.
3. N-glikosida, Jika atom N menghubungkan bagian gula dan bukan gula.
Golongan ini sebagian gulanya bukan gula sebenarnya tetapi derivatnya.
Contoh: vidarabin.
4. S-glikosida, jika thiol (SH) yang menghubungkan bagian gula dan bagian
bukan gula. Contoh: sinigrin.
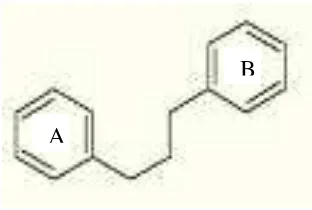
2.3.4Flavonoid
Menurut perkiraan, kira-kira 2% dari seluruh karbon yang difosintesis oleh
tumbuhan diubah menjadi flavonoid atau senyawa yang berkaitan erat dengannya.
Sebagian besar tanin berasal dari flavonoid. Jadi flavonoid merupakan salah satu
golongan fenol alam yang terbesar (Markham, 1988).
Flavonoid mengandung 15 atom karbon dalam inti dasarnya mempunyai
struktur C6-C3-C6 yaitu dua cincin aromatik yang dihubungkan oleh tiga atom
karbon yang merupakan rantai alifatik (Markham, 1988).
Gambar 2. Struktur flavonoid
Dalam tumbuhan flavonoid terikat dengan gula sebagai glikosida dan
aglikon flavonoid yang mungkin terdapat dalam satu tumbuhan dalam bentuk
kombinasi glikosida (Harborne, 1987). Aglikon flavonoid (flavonoid tanpa gula
terikat) terdapat dalam berbagai bentuk struktur (Markham, 1988). A
Tanin
Tanin terdapat luas pada tumbuhan berpembuluh, dalam Angiospermae
terdapat khusus di jaringan kayu. Tanin dapat bereaksi dengan protein membentuk
kopolimer mantap yang tidak larut dalam air. Dalam industri, tanin adalah
senyawa yang berasal dari tumbuhan, yang mampu mengubah kulit hewan yang
mentah menjadi kulit siap pakai karena kemampuannya menyambung silang
protein (Harbone, 1987).
Secara kimia terdapat dua jenis utama tanin (Harborne, 1987) yaitu :
1. Tanin terkondensasi
Tanin terkondensasi terbentuk dengan cara kondensasi katekin tunggal
(galokatekin) yang membentuk senyawa dimer dan oligomer yang lebih
tinggi. Ikatan karbon-karbon menghubungkan satu satuan flavon dengan
satuan berikutnya melalui ikatan 4-8 atau 6-8. Kebanyakan flavolan
mempunyai 2-20 satuan flavon. Tanin terkondensasi disebut juga dengan
proantosianidin karena bila direaksikan dengan asam panas, beberapa ikatan
karbon-karbon penghubung satuan terputus dan dibebaskanlah monomer
antosianidin.
2. Tanin terhidrolisis
Terdiri dari dua kelas yaitu:
a. Depsida galoilglukosa
Pada senyawa ini, inti yang berupa glukosa dikelilingi oleh lima
b. Dimer asam galat
Inti molekul berupa senyawa dimer asam galat, yaitu asam
heksahidroksidifenat yang berikatan dengan glukosa. Tanin terhidrolisis
disebut juga elagitanin yang pada hidrolisis menghasilkan asam galat.
Saponin
Saponin tersebar luas diantara tanaman tinggi. Keberadaan saponin sangat
mudah ditandai dengan pembentukan larutan koloidal dengan air yang apabila
dikocok menimbulkan buih yang stabil. Saponin merupakan senyawa berasa pahit
menusuk, menyebabkan bersin dan sering mengakibatkan iritasi terhadap selaput
lendir (Gunawan & Mulyani, 2004)
Saponin merupakan senyawa aktif permukaan, bersifat seperti sabun dan
dapat dideteksi berdasarkan kemampuanya membentuk busa dan menghemolisis
sel darah. Pembentukan busa yang mantap sewaktu mengekstraksi tumbuhan atau
pada waktu memekatkan ekstrak tumbuhan merupakan bukti terpercaya akan
adanya saponin (Harbone, 1987).
2.4 Uraian Bakteri
Nama bakteri berasal dari kata “bakterion” (bahasa Yunani) yang berarti
tongkat atau batang. Sekarang nama itu dipakai untuk menyebut sekelompok
mikroorganisme yang bersel satu, tidak berklorofil (meskipun ada kecualinya),
berbiak dengan pembelahan diri, serta demikian kecilnya sehingga hanya dapat
dilihat dengan menggunakan mikroskop (Dwijoseputro1982).
Ukuran bakteri bervariasi baik penampang maupun panjangnya, tetapi
pada umumnya penampang bakteri adalah sekitar 0,7-1,5 µm dam panjangnya
Tubuh bakteri yang terdiri dari satu sel mempunyai bentuk yang
beranekaragam. Ada yang berbentuk peluru atau bola (kokus), berbentuk batang
(basil), berbentuk koma dan spiral (Tjitrosoepomo, 1994).
Berdasarkan perbedaannya didalam menyerap zat warna gram bakteri
dibagi atas dua golongan yaitu bakteri gram positif dan bakteri gram negatif.
Bakteri gram positif menyerap zat warna pertama yaitu kristal violet yang
menyebabkan berwarna ungu, sedangkan bakteri gram negatif menyerap zat
warna kedua yaitu safranin dan menyebabkannya berwarna merah
(Dwijoseputro,1982).
Bakteri gram positif memiliki kandungan peptidoglikan yang tinggi
(dapat mencapai 50%) dibandingkan bakteri gram negatif (sekitar 10%).
Sebaliknya kandungan lipida dinding sel bakteri gram positif rendah sedangkan
pada dinding sel bakteri gram negatif tinggi yaitu sekitar 11-22% (Lay,1992).
2.4.1 Perkembangbiakan Bakteri
Pertumbuhan dan perkembangbiakan bakteri dipengaruhi oleh:
1. Suhu
Setiap spesies bakteri tumbuh pada suatu kisaran suhu tertentu. Atas
dasar ini maka bakteri diklasifikasikan menjadi (Dwijoseputro,1982):
a. Bakteri psikrofil (oligotermik) yaitu bakteri yang dapat hidup
antara suhu 0-30 oC, sedangkan suhu ptimumnya antara 10-20 oC.
b. Bakteri mesofil (mesotermik), yaitu bakteri yang tumbuh pada suhu
antara 5-60 oC, sedangkan suhu optimumnya antara 25-40 oC.
c. Bakteri termofil (politermik), yaitu bakteri yang tumbuh dengan
berbiak pada temperatur lebih rendah atau lebih tinggi dari pada
itu, yaitu dengan batas-batas 40-80 oC.
Suhu terendah dimana bakteri dapat tumbuh disebut minimum growth
temperature. Sedangkan suhu tertinggi dimana bakteri dapat tumbuh dengan
baik disebut maximum growth temperature. Suhu dimana bakteri dapat
tumbuh dengan sempurna diantara kedua suhu tersebut disebut suhu optimum
(Tim Mikrobiologi FK Unibraw, 2003).
2. pH
Pertumbuhan bakteri pada pH optimal antara 6,5 dan 7,5. Namun,
beberapa spesies dapat tumbuh dalam keadaan sangat asam atau sangat alkali.
Bagi kebanyakan spesies, nilai pH minimum dan maksimum ialah antara 4
dan 9. Bila bakteri dibiakan dalam suatu medium, yang mula-mula
disesuaikan adalah pHnya maka mungkin sekali pH ini berubah karena adanya
senyawa asam atau basa yang dihasilkan selama pertumbuhan (Pelczar and
Chan,1988).
3. Oksigen
Berdasarkan akan kebutuhan terhadap oksigen , bakteri dapat
digolongkan menjadi (Tim Mikrobiologi FK Unibraw, 2003):
a. Bakteri aerob mutlak, yaitu bakteri yang untuk pertumbuhannya
memerlukan adanya oksigen.
b. Bakteri anaerob fakultatif, yaitu bakteri yang dapat tumbuh, baik
ada oksigen maupun tanpa adanya oksigen.
c. Bakteri anaerob aerotoleran, yaitu bakteri yang tidak mati dengan
d. Bakteri anaerob mutlak, yaitu bakteri yang hidup bila tidak ada
oksigen.
e. Bakteri mikroaerofilik, yaitu bakteri yang kebutuhan oksigennya
rendah.
4. Nutrisi
Sumber zat makanan (nutrisi) bagi bakteri diperoleh dari senyawa
karbon, nitrogen, sulfur, fosfor, unsur logam (natrium, kalsium,
magnesium, mangan, besi, tembaga dan kobalt), vitamin dan air untuk
fungsi-fungsi metabolik dan pertumbuhannya (Dwijoseputro,1982).
5. Pengaruh Kebasahan dan Kekeringan
Bakteri sebenarnya adalah makhluk yang suka akan keadaan basah,
bahkan dapat hidup didalam air, hanya didalam air yang tertutup mereka
tidak dapat hidup subur, hal ini disebabkan karena kurangnya udara. Tanah
yang basah baik untuk kehidupan bakteri. Banyak bakteri yang mati, jika
terkena udara kering (Dwijoseputro,1982).
6. Tekanan Osmosa.
Medium yang paling cocok untuk kehidupan bakteri ialah medium
yang isotonik terhadap isi sel bakteri (Dwijoseputro,1982).
2.4.2Media pertumbuhan Bakteri
Pembiakan mikroorganisme membutuhkan media yang berisi zat hara
serta lingkungan pertumbuhan yang sesuai bagi mikroorganisme. Media dapat
dibagi berdasarkan (Lay, 1994):
1. Konsistensinya, media dapat dibagi menjadi tiga macam, yaitu:
b. Media cair
c. Media semi padat
Media padat diperoleh dengan menambahkan agar. Agar berasal dari
ganggang merah. Agar digunakan sebagai bahan pemadat karena tidak
diuraikan oleh mikroorganisme dan membeku pada suhu diatas 45 oC.
Kandungan agar sebagai bahan pemadat dalam media adalah 1,5-2 %.
2. Sumber bahan baku yang digunakan, media dapat dibagi menjadi dua
macam:
a. Media sintetik, bahan baku yang digunakan merupakan bahan kimia
atau bahan yang bukan berasal dari alam. Pada media sintetik,
kandungan dan isi bahan yang ditambahkan diketahui secara
terperinci.
b. Media nonsintetik, menggunakan bahan yang terdapat dialam,
biasanya tidak diketahui kandungan kimianya secara terperinci.
Contoh: ekstrak daging, pepton, ekstrak ragi dan kaldu daging.
3. Berdasarkan fungsinya, media dapat dibagi menjadi:
a. Media selektif, yaitu media biakan yang mengandung paling sedikit
satu bahan yang dapat menghambat perkembangbiakan
mikroorganisme yang tidak diinginkan dan membolehkan
perkembangbiakan mikroorganisme tertentu yang ingin diisolasi.
b. Media differensial, yaitu media untuk membedakan kelompok
mikroorganisme tertentu yang tumbuh pada media biakan. Bila
maka dapat dibedakan kelompok mikroorganisme berdasarkan
perubahan pada media biakan atau penampilan koloninya.
c. Media diperkaya, yaitu dengan menambahkan bahan-bahan khusus
pada media untuk menumbuhkan mikroba yang khusus.
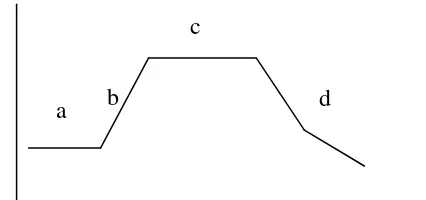
2.4.3 Fase Pertumbuhan Bakteri
Bila bakteri ditanam dalam perbenihan yang sesuai dan pada waktu-waktu
tertentu diobservasi (dihitung jumlah bakteri yang hidup), pertumbuhan dan
perkembangbiakan bakteri tersebut dapat digambarkan dengan sebuah grafik.
Pertumbuhan bakteri tersebut dapat dibagi menjadi 4 fase yaitu :
1. Fase Penyesuaian Diri (Lag phase)
Fase penyesuaian merupakan periode waktu dari bakteri yang ditanam
pada media perbenihan yang sesuai atau waktu yang diperlukan untuk
beradaptasi terhadap lingkungan yang baru. Rentang waktu fase penyesuiaan
tersebut tergantung dari fase pertumbuhan bakteri saat dipindahkan untuk
diinokulasikan pada media perbenihan yang baru dan tergantung pula pada
adanya bahan toksis atau bahan yang dapat menghambat pertumbuhan dan
perkembangbiakan bakteri (Tim Mikrobiologi FK Unibraw, 2003). Waktu
penyesuaiaan ini umumnya berlangsung selama 2 jam. Pada fase ini belum
terjadi pertumbuhan dan perkembangbiakan, tetapi aktivitas metabolismenya
sangat tinggi (Staf Pengajar Kedokteran UI, 1994).
2. Fase Pembelahan (Logarhytmik Phase / Exponensial Phase)
Pada fase ini bakteri berkembang biak dengan cepat, jumlah bakteri
meningkat secara eksponensial. Untuk kebanyakan bakteri, fase ini berlangsung
teratur, semua bahan dalam sel berada dalam seimbang (balanced growth)
(Pratiwi, 2008).
3. Fase Stasioner (Stationary phase)
Dengan meningkatnya jumlah bakteri, meningkat juga hasil metabolisme
yang toksik. Bakteri mulai ada yang mati, pembelahan terhambat, pada suatu
saat terjadi jumlah bakteri yang hidup sama dengan bakteri yang mati (Staf
Pengajar Kedokteran UI, 1994).
4. Fase Kematian (Death phase)
Pada fase ini terjadi akumulasi bahan toksik, zat hara yang diperlukan oleh
bakteri berkurang sehingga bakteri akan memasuki fase kematian. Fase ini
merupakan kebalikan dari fase logaritmik. Jumlah sel menurun terus sampai
didapatkan jumlah sel yang konstan untuk beberapa waktu (Lay, 1992).
[image:37.595.135.348.448.548.2]
Gambar 3. Grafik Pertumbuhan bakteri Keterangan :
a : Lag phase b : Log phase c : Stationary phase d : Death phase
a b
c
2.4.4 Bakteri Streptococcus mutans 2.4.4.1 Sistematika Streptococcus mutans
Sistematika bakteri (Tjitrosoepomo, 1994):
Divisi : Schizophyta
Kelas : Schizomycetes
Bangsa : Eubacteriales
Suku : Lactobacillaceae
Marga : Streptococcus
Spesies : Streptococcus mutans
2.4.4.2 Uraian Bakteri Streptococcus mutans
Streptococcus mutans merupakan bakteri gram positif, bersifat nonmotil
(tidak bergerak), bakteri anaerob fakultatif. Memiliki bentuk kokus dan tersusun
dalam bentuk rantai. Bakteri ini tumbuh secara optimal pada suhu sekitar 18-40oC.
Streptococcus mutans biasanya ditemukan pada rongga gigi manusia dan menjadi
bakteri yang paling kondusif menyebabkan karies untuk email gigi (Nugraha,
2008).
2.4.4.3Karies Gigi
Karies merupakan suatu penyakit pada jaringan keras gigi, yaitu email,
dentin dan sementum yang disebabkan aktivitas jasad renik yang ada dalam suatu
karbohidrat yang diragikan. Proses karies ditandai dengan terjadinya
demineralisasi pada jaringan keras gigi, diikuti dengan kerusakan bahan
organiknya. Hal ini akan menyebabkan terjadinya invasi bakteri dan kerusakan
pada jaringan pulpa serta penyebaran infeksi ke jaringan periapikal dan
karies dinyatakan sebagai penyakit multifaktorial yaitu adanya beberapa
faktor yang menjadi penyebab terbentuknya karies. Ada tiga faktor utama yang
memegang peranan yaitu faktor host atau tuan rumah, agen atau mikroorganisme,
substrat atau diet yang ditambah dengan faktor waktu sebagai tiga lingkaran yang
bertumpang tindih. Untuk terjadinya karies, maka kondisi setiap faktor tersebut
harus saling mendukung yaitu tuan rumah yang rentan, mikroorganisme yang
kariogenik, substrat yang sesuai dan waktu yang lama. Untuk terjadinya karies,
maka kondisi setiap faktor tersebut harus saling mendukung yaitu tuan rumah
yang rentan, mikroorganisme yang kariogenik, substrat yang sesuai dan waktu
yang lama (Pintauli, 2008).
2.4.4.4 Sifat Adherensi Streptococcus mutans
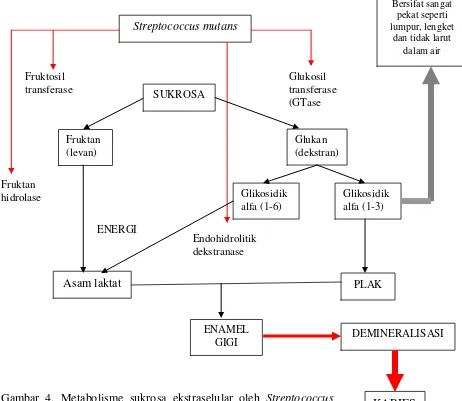
Sukrosa dari makanan dapat digunakan oleh Streptococcus mutans untuk
meningkatkan koloninya didalam rongga mulut. Jumlah koloni kuman ini dapat
ditingkatkan atau diturunkan dengan mengatur jumlah sukrosa dari makanan.
Sukrosa merupakan disakarida, terdiri dari satu molekul glukosa dan satu molekul
fruktosa. Hidrolisis sukrosa, dikatalisis oleh invertase membentuk glukosa dan
fruktosa (Melanie, 1988).
Streptococcus mutans menghasilkan dua enzim yaitu fruktosiltransferase
dan glikosiltransferase. Enzim-enzim tersebut terdapat pada permukaan dinding
sel bakteri. Fruktosiltransferase mensintesis pembentukan fruktan (levan).
Mikroorganisme ini menyimpan levan dan memecahkan kembali jika karbohidrat
eksogen berkurang, dengan demikian bakteri tersebut dapat menghasilkan asam
terus menerus. Hasil penelitian Gibbons dan Banghart, Streptococcus mutans
glukan dari sukrosa. Menurut Michalek dan Mc Ghee, (1982), glukan atau
dekstran merupakan ikatan glikosidik alfa (1-6) dan alfa (1-3). Streptococcus
mutans juga mempunyai enzim endohidrolitik dekstranase yang dapat memecah
dekstran ikatan alfa (1-6). Hasil pemecahannya merupakan sumber energi. Ikatan
glukosa alfa (1-3) bersifat sangat pekat seperti lumpur, lengket dan tidak larut
dalam air. Roeslan dan Melanie (1988) mengatakan bahwa ikatan glukosa alfa
(1-3) berfungsi pada perlekatan dan peningkatan koloni bakteri ini dalam kaitannya
dengan pembentukan plak dan terjadinya karies gigi (Melanie, 1988).
Streptococcus mutans Fruktosil transferase Bersifat sangat pekat seperti lumpur, lengket
[image:40.595.114.576.318.719.2]dan tidak larut dalam air KARIES Asam laktat DEMINERALISASI ENAMEL GIGI PLAK Glikosidik alfa (1-3) Glikosidik alfa (1-6) Fruktan (levan) Glukan (dekstran) SUKROSA Glukosil transferase (GTase Fruktan hidrolase Endohidrolitik dekstranase ENERGI
2.4.5 Bakteri Staphylococcus aureus
2.4.5.1 Sistematika Bakteri Staphylococcus aureus
. Sistematika bakteri (Tjitrosoepomo, 1994):
Divisio : Schizophyta
Kelas : Schizomycetes
Bangsa : Eubacteriales
Suku : Micrococcaceae
Marga : Staphylococcus
Jenis : Staphylococcus aureus
2.4.5.2 Uraian Bakteri Staphylococcus aureus
Staphylococcus aureus merupakan bakteri gram positif yang bersifat
aerob atau anaerob fakultatif, tes katalase positif dan tahan hidup dalam
lingkungan yang mengandung garam dengan konsentrasi tinggi (halofilik),
misalnya NaCl 10%. Hasil pewarnaan yang berasal dari perbenihan padat akan
memperlihatkan susunan bakteri yang bergerombol seperti buah anggur. Untuk
membiakkan bakteri Staphylococcus aureus diperlukan suhu optimal sekitar 35oC
dan pH optimal untuk pertumbuhan Staphylococcus aureus adalah 7,4 (Tim
Mikrobiologi FK Unibraw, 2003).
Infeksi yang disebabkan oleh bakteri Staphylococcus aureus pada
permukaan kulit tampak sebagai jerawat dan abses. Akne/jerawat terjadi sebagian
2.4.6 Bakteri Escherichia coli
2.4.6.1 Sistematika Bakteri Escherichia coli
Sistematika bakteri (Tjitrosoepomo, 1994):
Divisi : Schizophyta
Kelas : Schizomycetes
Bangsa : Eubacteriales
Suku : Enterobacteriaceae
Marga : Escherichia
Jenis : Escherichia coli
2.4.6.2 Uraian Bakteri Escherichia coli
Escherichia coli disebut juga Bacterium coli,merupakan bakteri gram
negatif, aerob atau anaerob fakultatif, panjang 1-4 mikrometer, lebar 0,4-1,7
mikrometer, berbentuk batang, tidak bergerak. Bakteri ini tumbuh baik pada suhu
37oC tapi dapat tumbuh pada suhu 8-40oC, membentuk koloni yang bundar,
cembung, halus dan dengan tepi rata (Jawetz, 2001).
Escherichia coli merupakan bakteri yang secara normal terdapat didalam
usus dan berperan dalam proses pengeluaran zat sisa pada saluran pencernaan
manusia. Bakteri Escherichia coli bersifat enterotoksigenik, dapat menghasilkan 2
macam enterotoksin yaitu toksin yang tahan panas dan toksin yang tidak tahan
panas. Enterotoksin dari bakteri Escherichia coli menyebabkan infeksi didalam
usus dan menyebabkan diare (M.Dzen, 2003)
2.4.7 Uji Aktivitas Antibakteri
Pengukuran aktivitas antibakteri dapat dilakukan dengan metode dilusi
a. Metode dilusi
Zat antibakteri dengan konsentrasi yang berbeda-beda dimasukkan pada media
cair. Media tersebut langsung diinokulasi dengan bakteri dan diinkubasi.
Tujuan dari percobaan ini adalah menentukan konsentrasi terkecil suatu zat
antibakteri dapat menghambat pertumbuhan atau membunuh bakteri uji.
Metode dilusi agar membutuhkan waktu yang lama dalam pengerjaannya
sehingga jarang digunakan.
b. Metode difusi
Metode yang paling sering digunakan adalah metode difusi agar dengan
menggunakan cakram kertas, cakram kaca, pencetak lubang. Prinsip metode
ini adalah mengukur zona hambatan pertumbuhan bakteri yang terjadi akibat
difusi zat yang bersifat sebagai antibakteri didalam media padat melalui
pencadang. Daerah hambatan pertumbuhan bakteri adalah daerah jernih
disekitar cakram. Luas daerah berbanding lurus dengan aktivitas antibateri,
BAB III
METODE PENELITIAN
Penelitian ini menggunakan metode ekperimental meliputi penyiapan alat,
bahan dan pereaksi, pengolahan simplisia, skrining fitokimia dan uji aktivitas
antibakteri secara in vitro dengan metode difusi agar.
3.1 Alat dan Bahan 3.1.1 Alat-alat
Alat-alat yang digunakan dalam penelitian ini meliputi alat- alat gelas,
blender (Philips), oven listrik (Fisher scientitic), neraca kasar (O’Haus), neraca
listrik (Vibra AJ), seperangkat alat destilasi penetapan kadar air, perkolator,
cawan porselen berdasar rata, desikator, mortir, stamper, cawan porselen, Rotary
evaporator (Buchi 461), inkubator (Fisher Scientific), oven (Gallenkam), autoklaf
(Fison), kapiler, jarum ose, lampu spritus, lemari pendingin (Karl Kolb), pinset,
rubber pump, hot plate, spatula, penangas air, mikro pipet, jangka sorong, kertas
saring, aluminium foil, pencetak logam, spatula, mikroskop (Olympus), object
glass, cover glass, lemari pengering, rak tabung reaksi, Freeze dryer (Edward).
3.1.2 Bahan-bahan
Bahan tumbuhan yang dipergunakan adalah kulit buah (pericarp) jengkol,
semua bahan yang digunakan berkualitas pro analisa kecuali disebutkan lain
adalah; air suling, etanol 96% (hasil destilasi), asam klorida encer P, asam klorida
pekat, kloroform, besi (III) klorida, timbal (II) asetat, asam asetat anhidrat,
natrium klorida, barium klorida, kalium iodida, Merkuri (II) klorida, iodium,
α-naftol, asam nitrat, bismuth nitrat, isopropanol, serbuk magnesium, metanol,
Streptococcus mutans, Staphylococcus aureus ATCC 25923 dan Escherichia coli
ATCC 25922, (Lab.Mikrobiologi FMIPA), Muller Hinton Agar (Difco), suspensi
standar Mc.Farland, NaCl 0,9 %.
3.1.3 Pembuatan Larutan Pereaksi 3.1.3.1 Larutan Pereaksi Mayer
Sebanyak 5 g Kalium Iodida dalam 10 ml air suling kemudian
ditambahkan larutan 1,36 g merkuri (II) klorida dalm 60 ml air suling. Larutan
dikocok dan ditambahkan air suling hingga 100 ml.
3.1.3.2 Larutan Pereaksi Dragendorff
Sebanyak 8 g bismuth nitrat dilarutkan dalam asam nitrat 20 ml kemudian
dicampur dengan larutan kalium iodida sebanyak 27,2 g dalam 50 ml air suling.
Campuran didiamkan sampai memisah sempurna. Larutan jernih diambil dan
diencerkan dengan air secukupnya hingga 100 ml.
3.1.3.3 Larutan Pereaksi Bouchardat
Sebanyak 4 g kalium iodida dilarutkan dalam 20 ml air suling kemudian
ditambah 2 g iodium sambil diaduk sampai larut, lalu ditambah air suling hingga
100 ml.
3.1.3.4 Larutan Pereaksi Molish
Sebanyak 3 g α- naftol dilarutkan dalam asam nitrat 0,5 N secukupnya
hingga diperoleh larutan 100 ml.
3.1.3.5 Larutan Pereaksi Liebermann-Burchard
Sebanyak 20 g bagian asam asetat anhidrat dicampurkan dengan 1 bagian
asam sulfat pekat dan 50 bagian kloroform. Larutan penyemprot harus dibuat
3.1.3.6 Larutan Pereaksi Besi (III) klorida 1%
Sebanyak 1 g besi (III) klorida dilarutkan dalam air suling hingga 100 ml
kemudian disaring.
3.1.3.7 Larutan Pereaksi Timbal (II) asetat 0,4 M
Sebanyak 15,17 g Timbal (II) asetat ditimbang, kemudian dilarutkan
dalam air hingga 100 ml.
3.1.3.8 Larutan Pereaksi Asam Klorida 2 N
Sebanyak 17 ml asam klorida pekat diencerkan dengan air suling sampai
100 ml.
3.1.3.9 Larutan Pereaksi Asam Sulfat 2 N
Sebanyak 5,5 ml asam sulfat pekat diencerkan dengan air suling hingga
volume 100 ml.
3.1.3.10 Larutan Pereaksi Asam Nitrat 0,5 N
Sebanyak 3,4 ml asam nitrat pekat diencerkan dengan air suling hingga
volume 100 ml.
3.2 Pengolahan Sampel 3.2.1 Identifikasi Sampel
Identifikasi tumbuhan dilakukan di Pusat Penelitian Biologi, Lembaga
Ilmu Pengetahuan Indonesia (LIPI) Bogor, Indonesia. Hasil Identifikasi tumbuhan
dapat dilihat pada lampiran 1 halaman 49.
3.2.2 Pengambilan Sampel
Pengambilan sampel dilakukan secara purposif, yaitu tanpa
membandingkan dengan daerah lain. Bahan penelitian ini adalah kulit buah
jalan Sei Kera, Pusat pasar, Kecamatan Medan Timur, Medan, Sumatera Utara.
Gambar buah jengkol dapat dilihat pada lampiran 2 halaman 50 dan gambar kulit
buah jengkol dapat dilihat pada lampiran 3 halaman 51.
3.2.3 Pembuatan Simplisia
Kulit buah jengkol dicuci, ditiriskan kemudian ditimbang berat basahnya,
yaitu 3,2 kg. Kulit buah jengkol selanjutnya dirajang dengan ukuran 1-3 cm, lalu
dikeringkan di lemari pengering pada suhu 40-50 oC sampai simplisia kering dan
mudah dipatahkan kemudian berat kering simplisia ditimbang, yaitu 850 g
kemudian simplisia diblender sampai menjadi serbuk, lalu ditimbang beratnya,
yaitu 820 g. Gambar simplisia dan serbuk simplisia dapat dilihat pada lampiran 4
halaman 52.
3.2.4 Karakterisasi Simplisia
Karakterisasi simplisia meliputi pemeriksaan makroskopik simplisia,
pemeriksaan mikroskopik serbuk simplisia dan bahan segar, penetapan kadar air,
penetapan kadar abu total, penetapan kadar abu yang tidak larut dalam asam,
penetapan kadar sari yang larut dalam air, penetapan kadar sari yang larut dalam
etanol.
3.2.4.1 Pemeriksaan Makroskopik Simplisia
Pemeriksaan makroskopik dilakukan dengan cara mengamati warna, bau,
rasa, bentuk, ukuran dan tekstur dari simplisia. Gambar simplisia dapat dilihat
pada lampiran 4 halaman 52.
3.2.4.2 Pemeriksaan Mikroskopik Serbuk Simplisia dan Bahan Segar
Untuk mengetahui jenis fragmen dari simplisia dilakukan pemeriksaan
diatas kaca objek yang telah diteteskan dengan larutan kloralhidrat dan ditutup
dengan kaca penutup kemudian diamati dibawah mikroskop. Untuk mengetahui
struktur anatomi kulit buah jengkol dilakukan pemeriksaan mikroskopik pada
kulit buah jengkol segar dengan cara membuat irisan tipis melintang diatas kaca
objek yang telah diteteskan dengan kloralhidrat panaskan sebentar diatas api
spritus dan ditutup dengan kaca penutup kemudian diamati dibawah mikroskop.
Hasil pengamatan mikroskopik terhadap serbuk simplisia dan penampang
melintang kulit buah jengkol dapat dilihat pada lampiran 5 halaman 53.
3.2.4.3 Penetapan Kadar Air
Penetapan kadar air dilakukan dengan metode Azeotropi (Destilasi
Toluen). Alat meliputi labu alas 500 ml, alat penampung, tabung penerima 5 ml
berskala 0,05 ml pendingin, tabung penyambung, pemanas.
Cara kerja: Ke dalam labu bulat dimasukkan 200 ml toluen dan 2 ml air suling,
didestilasi selama 2 jam. Toluen didinginkan selama 30 menit dan volume air
pada tabung penerima dibaca (WHO, 1992). Kemudian ke dalam labu
dimasukkan 5 g serbuk simplisia yang telah ditimbang seksama, lalu dipanaskan
hati- hati selama 15 menit. Setelah toluen mulai mendidih, kecepatan tetesan
diatur, kurang lebih 2 tetes tiap detik, hingga sebagian besar air tersuling.
Kemudian kecepatan penyulingan dinaikkan hingga 4 tetes tiap detik. Setelah
semua air tersuling, bagian dalam pendingin dibilas dengan toluen yang telah
dijenuhkan. Destilasi dilanjutkan selama 5 menit kemudian tabung penerima
dibiarkan mendingin sampai suhu kamar. Setelah air dan toluen memisah
sempurna, volume air dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air
diperiksa. Kadar air dihitung dalam persen (Ditjen POM, 1989). Perhitungan
penetapan kadar air dapat dilihat pada lampiran 6, halaman 54.
3.2.4.4 Penetapan Kadar Sari Yang Larut Dalam Air
Sebanyak 5 g serbuk di maserasi selama 24 jam dalam 100 ml air
kloroform (2,5 ml kloroform dalam air suling 1000 ml), dalam labu bersumbat
sambil sesekali dikocok selam 6 jam pertama kemudian dibiarkan selama18 jam
dan disaring. Sejumlah 20 ml filtrat pertama diuapkan sampai kering dalam cawan
dangkal berdasar rata yang telah ditara. Sisa dipanaskan dalam oven pada 1050C
sampai diperoleh bobot konstan kadar sari yang larut di dalam air dihitung
terhadap bahan yang telah dikeringkan di udara (Ditjen POM, 1989). Perhitungan
penetapan kadar sari yang larut dalam air dapat dilihat pada lampiran 6, halaman
55.
3.2.4.5 Penetapan Kadar Sari Yang Larut Dalam Etanol
Sebanyak 5 g serbuk yang telah dikeringkan di udara dimaserasi selama 24
jam dalam 100 ml etanol 96 % dalam labu bersumbat sambil dikocok sesekali 6
jam pertama dan dibiarkan selama 18 jam dan disaring. Sejumlah 20 ml filtrat
pertama diuapkan sampai kering dalam cawan dangkal berdasar rata yang telah
ditara. Sisanya dipanaskan dalam oven pada 105oC sampai diperoleh bobot
konstan kadar sari yang larut di dalam etanol dihitung terhadap bahan yang
dikeringkan di udara (Ditjen POM, 1989). Perhitungan penetapan kadar sari yang
larut dalam etanol dapat dilihat pada lampiran 6, halaman 56.
3.2.4.6 Penetapan Kadar Abu Total
Sebanyak lebih kurang 2 g sampai 3 g zat yang telah digerus dan
kemudian diratakan. Krus dipijarkan perlahan-lahan hingga arang habis,
kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu
total dihitung terhadap bahan yang telah dikeringkan di udara (Ditjen POM,
1989). Perhitungan penetapan kadar abu total dapat dilihat pada lampiran 6,
halaman 57.
3.2.4.7 Penetapan Kadar Abu Yang Tidak Larut dalam Asam
Abu yang telah diperoleh dari penetapan kadar abu total dididihkan
dengan 25 ml asam klorida encer P selama 5 menit. Bagian yang tidak larut dalam
asam dikumpulkan, disaring melalui kertas saring dipijarkan pada suhu 600oC
sampai diperoleh bobot konstan, didinginkan kemudian ditimbang beratnya.
Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang dikeringkan
di udara (Ditjen POM, 1989). Perhitungan penetapan kadar abu yang tidak larut
dalam asam dapat dilihat pada lampiran 6, halaman 58.
3.2.5 Pembuatan Ekstrak Kulit Buah Jengkol
Sebanyak 300 g serbuk simplisia dimasukkan kedalam wadah kaca cairan
penyari dituangi sampai semua simplisia terendam, biarkan sekurang-kurangnya
selama 3 jam. Pindahkan massa sedikit demi sedikit ke dalam perkolator sambil
tiap kali di tekan hati- hati, tuangi cairan penyari secukupnya sampai cairan mulai
menetes dan di atas simplisia masih terdapat selapis cairan penyari, perkolator
ditutup dan dibiarkan selama 24 jam. Cairan dibiarkan menetes dengan kecepatan
1 ml tiap menit, cairan penyari ditambahkan berulang-ulang secukupnya hingga
selalu terdapat selapis cairan penyari diatas simplisia. Perkolasi dihentikan jika
500 mg perkolat yang keluar terakhir diuapkan, tidak meninggalkan sisa (Ditjen
evaporator. Kemudian dikeringkan dengan freeze dryer pada suhu 40oC pada
tekanan 2 atm selama lebih kurang 24 jam dan diperoleh ekstrak kental sebanyak
30,75 g (Voigt, 1994).
3.3 Skrining Fitokimia
3.3.1 Pemeriksaan Steroida/ Triterpenoida
Sebanyak 1 g sampel dimaserasi dengan 20 ml n-heksan selama 2 jam,
lalu disaring. Filtrat diuapkan dalam cawan penguap. Pada sisa ditambahkan 2
tetes asam asetat glasial dan 1 tetes asam sulfat pekat. Timbul warna ungu atau
merah kemudian berubah menjadi hijau biru menunjukkan adanya steroida
triterpenoida (Harborne, 1978).
3.3.2 Pemeriksaan Alkaloida
Serbuk simplisia ditimbang sebanyak 0,5 g kemudian ditambahkan 1 ml
asam klorida 2 N dan 9 ml air suling, dipanaskan air selama 2 menit, didinginkan
lalu disaring. Filtrat dipakai untuk percobaan berikut :
a. Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Mayer
b. Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Bouchardat
c. Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Dragendrof
Alkaloida dianggap positif jika terjadi endapan atau paling sedikit dua atau
tiga dari percobaan diatas ( Ditjen POM,1995).
3.3.3 Pemeriksaan Glikosida
Serbuk simplisia ditimbang sebanyak 3 g kemudian disari dengan 30 ml
campuran 7 bagian volume etanol 96 % dan 3 bagian volum air suling ditambah
dengan 10 ml HCl 2N. Direfluks selama 30 menit, didinginkan dan disaring.
M, dikocok, lalu didiamkan selama 5 menit dan disaring. Filtrat disari dengan 20
ml campuran 3 bagian kloroform dan 2 isopropanol dilakukan berulang sebanyak
tiga kali. Kumpulan sari air diuapkan pada temperatur tidak lebih dari 50oC.
Sisanya dilarutkan dalam 2 ml metanol. Larutan sisa digunakan untuk percobaan
berikut, yaitu 0,1 ml larutan percobaan dimasukkan kedalam tabung reaksi,
diuapkan di penangas air. Sisa dilarutkan dalam 2 ml air suling dan 5 tetes
pereaksi Molish. Kemudian secara perlahan ditambahkan 2 ml asam sulfat pekat.
Glikosida positif jika terbentuk cincin ungu (Ditjen POM, 1995).
2.3.4 Pemeriksaan Flavonoida
Sebanyak 10 g serbuk simplisia kemudian ditambahkan 100 ml air panas,
dididihkan selama 5 menit dan disaring dalam keadaan panas. Filtrat yang
diperoleh kemudian diambil 5 ml lalu ditambahkan 0,1 g serbuk Mg dan 1 ml HCl
pekat da 2 ml amil alkohol, dikocok, dan dibiarkan memisah. Flavonoida positif
jika terjadi warna merah, kuning, jingga pada lapisan amil alkohol. (Farnsworth,
1966).
3.3.5 Pemeriksaan Tanin
Sebanyak 0,5 g sampel disari dengan 10 ml air suling, disaring lalu
filtratnya diencerkan dengan air suling sampai tidak berwarna. Diambil 2 ml
larutan lalu ditambahkan 1 sampai 2 tetes pereaksi besi (III) klorida. Terjadi
warna biru atau hijau kehitaman menunjukkan adanya tannin (Farnsworth, 1966).
3.3.6 Pemeriksaan Saponin
Sebanyak 0,5 g sampel dimasukkan ke dalam tabung reaksi dan
ditambahkan 10 ml air suling panas, didinginkan kemudian dikocok kuat-kuat
1- 10 cm. Ditambahkan 1 tetes larutan asam klorida 2 N, bila buih tidak hilang
menunjukkan adanya saponin ( Ditjen POM, 1995).
3.4 Uji Aktivitas Antibakteri 3.4.1 Sterilisasi Alat
Alat - alat yang digunakan dalam penelitian uji aktivitas anti bakteri ini
disterilkan terlebih dahulu sebelum digunakan. Alat - alat gelas disterilkan di
dalam oven pada suhu 170oC selama 2 jam. Media disterilkan di autokaf pada
suhu 121oC selama 15 menit. Jarum ose dan pinset dengan lampu bunsen (Lay,
1994)
3.4.2 Pembuatan Media Muller Hinton Agar (MHA)
Komposisi : Beef, infusion form 300 mg
Bacto - casamino Acids, Technical 17,5 g
Starch 1,5 g
Bacto - agar 17 g
Cara Pembuatan :
Sebanyak 38 g media disuspensikan dalam 1000 ml air suling steril,
kemudian dipanaskan hingga mendidih dan semuanya larut. Disterilkan dalam
autoklaf (Difco, 1977)