Hendrix Yulis Setyawan (F351050091)
Program Studi Teknologi Industri Pertanian
Sekolah Pasca Sarjana
Nama : Hendrix Yulis Setyawan, S.TP
Nomor Pokok : F. 351050091
Program Studi : Teknologi Industri Pertanian
Disetujui, Komisi Pembimbing
Dr. Ir. Erliza Hambali Ketua
Dr. Ir. Ani Suryani DEA Dr. Ir. Dwi Setyaningsih, MSi
Anggota Anggota
Diketahui,
Ketua Program Studi Dekan Sekolah Pascasarjana Teknologi Industri Pertanian Institut Pertanian Bogor
DAFTAR ISI ... i
5. Optimasi Dengan Metode Permukaan Respon ... 15
a. Metode Respon Permukaan ... 15
b. Desain Komposit Terpusat ... 16
6. Teknologi Pemisahan Tokoferol Terdahulu ... 16
METODE PENELITIAN
2. Kondisi Proses dan Operasi Destilasi Molekuler ... 25
3. Data Hasil Penelitian ... 27
a. Kandungan Tokoferol Biodiesel ... 27
b. DestilatYang Berhasil Diseparasi ... 27
c. Tokoferol yang Berhasil Diseparasi ... 29
5. Karakteristik Metil Ester dan Vitamin E yang dihasilkan ... 43
KESIMPULAN DAN SARAN ... 45
DAFTAR PUSTAKA ... 46
Tabel Keterangan Hal
Tabel 1. Komponen Minor Dalam Minyak Sawit Mentah (CPO) ... 4
Tabel 2. Perbandingan Beberapa Metoda Ekstraksi Vitamin E ... 9
Tabel 3. Rancangan penelitian Terkodekan dan Actual ... 23
Tabel 4. Keterangan Kondisi Suhu Proses pada Run 1 ... 26
Tabel 5. Rancangan dan Hasil Pengaruh Laju Alir Bahan, Suhu Destilasi, dan Kecepatan Putaran Wiper Terhadap Konsentrasi Tokoferol dalam Destilat ... 28
Tabel 6. Konsentrasi Tokoferol Pada Destilat Dan Jumlah Tokoferol Yang Berhasil Dipisahkan ... 29
Tabel 7. Rekoveri Tokoferol ... 31
Tabel 8. Transformasi Data Dengan Invers Akar Kuadrat (Lambda= -0,5) ... 33
Tabel 9. Batasan Optimalisasi Rekoveri Tokoferol Menggunakan Program Design-Expert DX 7.1.1 ... 40
Gambar Keterangan Hal
Gambar 1. Struktur Molekul Gliserida ... 5
Gambar 2 Struktur Molekul Alfa-Tokoferol ... 7
Gambar 3. Penguapan Molekul dari Larutan ... 10
Gambar 4. Dasar-Dasar Evaporasi dan Kondensasi pada Destilasi Molekuler .... 10
Gambar 5. Wiper Blade ... 11
Gambar 6. Skema Proses Pemisahan dengan Destilasi Molekuler ... 12
Gambar 7. Bagian Alat Destilasi Molekuler ... 14
Gambar 8. Panel-panel Suhu untuk Mengontrol Proses ... 25
Gambar 9. Kesetimbangan Massa Separasi Tokoferol. ... 30
Gambar 10. Profil Sebaran Data Rekoveri Tokoferol Pada Peningkatan Laju Alir Bahan ... 34
Gambar 11. Profil Sebaran Data Rekoveri Tokoferol Pada Peningkatan Suhu Destilasi ... 36
Gambar 12. Profil Sebaran Data Rekoveri Tokoferol Pada Peningkatan Kecepatan Putaran Wiper ... 37
Gambar 13. Interaksi Antara Suhu Destilasi dan Laju Alir Bahan Pada Rekoveri Tokoferol ... 38
Gambar 14. Interaksi Antara Kecepatan Putar Wiper dan Laju Alir Bahan Pada Rekoveri Tokoferol ... 38
Gambar 15. Interaksi Antara Suhu Destilasi dan Kecepatan Putar Wiper Pada Rekoveri Tokoferol ... 38
Gambar 16. Permukaan Respon dan Plot Kontour Tingkat Rekoveri Tokoferol Optimal Yang Dihasilkan Pada Kecepatan Putaran Wiper 400rpm ... 41
Lampiran Keterangan Hal
Lampiran 1. Prosedur Analisa Biodiesel ... 49
Lampiran 2. Kondisi Suhu Proses Tiap Pelakuan ... 53
Lampiran 3. Peak Pengujian Alfa Tokoferol ... 57
Lampiran 4. Perhitungan Konsentrasi Alfa Tokoferol ... 78
Lampiran 5. Evaluasi Model Prediksi ... 79
Lampiran 6. Anova ... 80
Lampiran 7. Analisis Model Transformasi ... 81
Lampiran 8. Hasil Analisis Anova Data Transformasi ... 82
1. Latar Belakang
Minyak sawit kasar (Crude Palm Oil) mempunyai komposisi utama
trigliserida. Komponan penyusun CPO lainnya adalah asam lemak bebas,
digliserida, dan komponen minor seperti monoalkilgliserol, sterol, glikolipid,
fosfolipid, squalen, karoten, hidrokarbon dan triterpen alkohol (Ketaren, 2005).
Menurut May (2007), Crude Palm Oil (CPO) mengandung 1% komponen minor
yang terdiri atas karoten, vitamin E (tokoferol dan tokotrienol), sterol, fosfolipid,
glikolipid, terpen dan hidrokarbon. Khusus tokoferol dan tokotrienol memiliki
konsentrasi sekitar 600 – 1000 ppm.
Separasi vitamin E dari CPO dilakukan dengan merubah CPO menjadi
biodiesel terlebih dahulu. Perubahan CPO menjadi biodiesel dapat dilakukan
dengan reaksi esterifikasi dan transesterifikasi. Penggunaan reaksi esterifikasi dan
transesterfikasi dapat memudahkan destilasi molekuler karena molekul-molekul
yang berat seperti gliserol telah terpisahkan terlebih dahulu. Batistella (1998),
menggunakan reaksi esterifikasi dan transesterifikasi sebagai perlakuan awal
untuk memisahkan karoten dari minyak sawit dengan destilasi molekuler.
Isolat tokoferol dan tokotrienol dapat digunakan sebagai bahan aditif untuk
meningkatkan kandungan vitamin E pada makanan. Kegunaan vitamin E adalah
sebagai antioksidan. Antioksidan merupakan senyawa yang dapat menghambat
oksidasi di dalam tubuh. Tokoferol dan tokotrienol akan menyerap radikal bebas
dan bereaksi membentuk senyawa yang tidak berbahaya yang dapat diserap oleh
antioksidan yang lain. Kegunaan lain dari vitamin E adalah sebagai pembentuk
sel-sel tubuh (baru) seperti nukleus (inti sel), dinding sel, RNA dan DNA.
Vitamin E bersama vitamin C bertindak untuk menjaga kesehatan sel-sel tubuh,
berfungsi juga untuk memperlancar peredaran darah, mencegah pengerasan arteri,
dan mencegah pembentukan darah beku. Vitamin E juga merupakan antioksidan
yang berguna untuk mencegah proses penuaan sel dan memperbaiki pembekalan
oksigen. Vitamin E berfungsi memperbaiki suplai oksigen dan membantu
Kegunaan vitamin E yang potensial tersebut mendorong banyak
dilakukannya isolasi vitamin E. Teknologi isolasi Vitamin E ada beberapa macam
seperti pemisahan menggunakan teknologi membran, adsorbsi, desorbsi, dan
ekstraksi dengan menggunakan pelarut dan destilasi molekuler. Beberapa
penelitian isolasi tokoferol menggunakan destilasi molekuler telah dilakukan
dengan bahan baku palm fatty acid distillates (PFAD) (Posada et al. 2007) dan rapeseed oil deodorizer distillate (RODD) (Shao et al. 2007).
Destilasi molekuler adalah proses separasi fraksi-fraksi molekul yang
berbeda bobotnya pada suhu serendah mungkin untuk menghindari kerusakan.
Keuntungan menggunakan teknik destilasi molekuler adalah proses pemisahannya
dengan vakum bertekanan tinggi sehingga suhu pemisahan dapat diupayakan
serendah mungkin untuk menghindari kerusakan bahan (Shao et al. 2007).
Penggunaan destilasi molekuler untuk memisahkan vitamin E dari biodiesel CPO
diharapkan tidak merusak metil ester dan isolat vitamin E yang dihasilkan,
diperoleh rendemen yang tinggi, dan tahapan proses relatif cepat.
Proses separasi dalam penelitian ini akan digunakan sebagai proses samping
dalam produksi biodiesel CPO. Biodiesel CPO dilewatkan dalam alat destilasi
molekuler untuk diambil kandungan vitamin E agar nilai tambah konversi CPO
menjadi biodiesel meningkat.
Separasi dengan menggunakan alat destilasi molekuler dapat dilakukan
secara kontinyu sehingga tidak mengganggu proses produksi biodiesel secara
keseluruhan. Mengingat kapasitas produksi biodiesel yang umumnya berskala
besar, skala destilasi molekuler dapat disesuaikan karena pabrikan alat destilasi
molekuler seperti Myers, TMC Industries, Atrisan dan Pope Science telah banyak
memproduksi alat destilasi molekuler untuk memisahkan molekul spesifik,
sehingga secara teknologi pemisahan dengan destilasi molekuler telah
berkembang pesat dan dapat diaplikasikan dalam skala industri.
2. Perumusan Masalah
Komponen minor CPO banyak yang bermanfaat dan bernilai ekonomis
tinggi contohnya vitamin E. Konversi langsung CPO menjadi biodiesel sebagai
minyak bakar mengabaikan potensi yang bisa diperoleh dari komponen minor
nilai tambah konversi CPO menjadi biodiesel sebelum digunakan sebagai minyak
bakar. Salah satu teknik separasi yang dapat memisahkan vitamin E adalah
menggunakan destilasi molekuler. Permasalahannya yang perlu diteliti adalah
kondisi operasi destilasi molekuler yang sesuai agar dapat memisahkan vitamin E
dari biodiesel CPO tanpa menimbulkan kerusakan pada vitamin E dan biodiesel.
3. Tujuan dan Manfaat Penelitian a. Tujuan
Tujuan dari penelitian ini adalah untuk:
a. Memisahkan fraksi kaya vitamin E dari biodiesel CPO dengan destilasi
molekuler.
b. Memperoleh kondisi operasi destilasi molekuler yang optimal untuk
memisahkan fraksi kaya vitamin E dari biodiesel CPO.
c. Menghasilkan fraksi kaya vitamin E dari biodiesel CPO.
d. Mendapatkan hasil uji bilangan iod, angka asam dan asam lemak bebas
untuk mengetahui perubahan kualitas biodiesel CPO sebelum dan sesudah
destilasi molekuler.
4. Ruang Lingkup
Lingkup penelitian ini dibatasi pada:
a. Pembuatan biodiesel berasal dari CPO.
b. Separasi fraksi kaya vitamin E dari biodiesel CPO dengan destilasi
molekuler.
c. Penentuan kondisi proses dan teknik operasi separasi fraksi kaya vitamin E
dari biodisel CPO dengan destilasi molekuler.
d. Analisis hasil separasi dan rekoveri vitamin E.
e. Pengujian bilangan iod, angka asam dan asam lemak bebas untuk
mengetahui perubahan biodiesel CPO sebelum dan sesudah destilasi
TINJAUAN PUSTAKA 1. Minyak Sawit Kasar
Kandungan utama minyak kelapa sawit adalah trialkilgliserol (trigliserida).
Komponan lainnya adalah 1 - 5% asam lemak bebas, 4 - 7,5% digliserida, dan
komponen minor seperti monoalkilgliserol, sterol, glikolipid, fosfolipid, squalen,
karoten, hidrokarbon dan triterpen alkohol (Ketaren 2005). Menurut O’Brien
(2000), sebagaian besar minyak yang telah dimurnikan mengandung 98%
trigliserida; kurang dari 0,5% digliserida; 0,1 % FFA; 0,3 % sterol; 0,1 %
tokoferol, beberapa ppm fosfolipid dan berbagai pigmen. Menurut May (2007)
CPO mengandung 1% komponen minor yang terdiri atas karoten, vitamin E
(tokoferol dan tokotrienol), sterol, fosfolipid, glikolipid, terpen dan hidrokarbon.
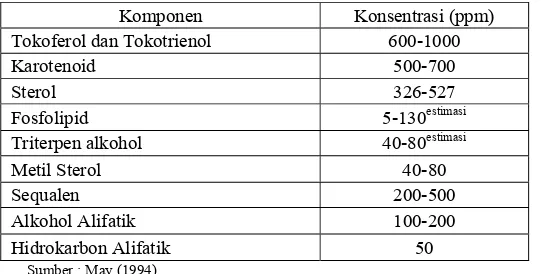
Tabel 1. Komponen minor dalam minyak sawit mentah (CPO)
Komponen Konsentrasi (ppm) Tokoferol dan Tokotrienol 600-1000
Karotenoid 500-700 Sterol 326-527 Fosfolipid 5-130estimasi
Triterpen alkohol 40-80estimasi Metil Sterol 40-80
Sequalen 200-500 Alkohol Alifatik 100-200
Hidrokarbon Alifatik 50 Sumber : May (1994)
Minyak kelapa sawit berpotensi sebagai sumber vitamin E terbaik.
Kandungan Vitamin E di CPO cenderung unik dengan komposisi tokotrienol lebih
banyak dari tokoferol, dari kandungan normal 600 - 1000 mg/L, yang terdiri dari
43% tokotrienol, 24% α tokotrienol, 11% tokotrienol, and 21% α tokoferol
(Posada et al. 2007).
2. Biodiesel
Biodiesel adalah bahan bakar mesin/motor diesel yang terdiri atas alkil ester
dari asam-asam lemak (Hambali 2006). Biodiesel dapat dibuat dari minyak nabati.
Komposisi yang terdapat dalam minyak nabati terdiri dari trigliserida-trigliserida
sekitar 95%), asam lemak bebas (free fatty acid atau biasa disingkat dengan FFA), mono dan digliserida, serta beberapa komponen-komponen lain seperti
fosfogliserida, vitamin, mineral, dan sulfur.
Bahan-bahan mentah untuk pembuatan biodiesel adalah trigliserida, dan
asam-asam lemak (Mittelbach 2004). Trigliserida adalah triester dari gliserol
dengan asam-asam lemak, yaitu asam-asam karboksilat beratom karbon 6 s/d 30.
Trigliserida banyak dikandung dalam minyak dan lemak, merupakan komponen
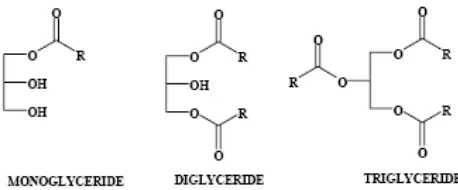
terbesar penyusun minyak nabati. Selain trigliserida, terdapat juga monogliserida
dan digliserida. Struktur molekul dari ketiga macam gliserida tersebut dapat
dilihat pada Gambar 1.
Gambar 1. Struktur molekul gliserida.
Pembuatan biodiesel dilakukan dengan dua tahap, esterifikasi dan
transesterifikasi. Esterifikasi adalah tahap konversi dari asam lemak bebas
menjadi ester. Esterifikasi mereaksikan minyak dan lemak dengan alkohol.
Katalis-katalis yang cocok adalah zat berkarakter asam kuat, seperti asam sulfat,
asam sulfonat organik atau resin penukar kation asam kuat merupakan
katalis-katalis yang biasa terpilih dalam praktek industrial (Soerawidjaja 2006). Reaksi
esterifikasi adalah sebagai berikut:
... (1)
Pada proses pembuatan biodiesel, esterifikasi dilakukan untuk membuat
biodiesel dari minyak berkadar asam lemak bebas tinggi (berangka-asam ≥ 5
mg-KOH/g). Pada tahap ini, asam lemak bebas akan dirubah menjadi metil ester.
Tahap esterifikasi dilanjutkan dengan tahap transesterfikasi. Akan tetapi sebelum RCOOCH3 + H2O....
produk esterifikasi diumpankan ke tahap transesterifikasi, air dan bagian terbesar
katalis asam yang dikandungnya harus dihilangkan terlebih dahulu. Kandungan
air harus dihilangkan karena berdasarkan Persamaan 1, reaksi esterifikasi bersifat
reversible, sehingga pembentukan FFA dapat terjadi dengan adanya air (Knothe, 2005).
Transesterifikasi adalah tahap konversi dari trigliserida menjadi alkil ester
melalui reaksi dengan alkohol, dan menghasilkan produk samping gliserol.
Diantara alkohol-alkohol monohidrik yang menjadi kandidat sumber/pemasok
gugus alkil, metanol adalah yang paling umum digunakan, karena harganya murah
dan reaktifitasnya paling tinggi (sehingga reaksi disebut metanolisis). Reaksi
transesterifikasi trigliserida menjadi metil ester disajikan pada Persamaan 2
berikut:
…….(2)
Triglieserida Metanol Metyl ester (biodiesel) Gliserol
Sumber: http://en.wikipedia.org/wiki/Fatty_acid_methyl_ester
Pada suhu 32˚C, 90% reaksi transesterifikasi selesai dalam 4 jam dengan
menggunakan katalis basa. Pada suhu >60˚C, reaksi selesai dalam waktu 1 jam.
Meskipun minyak dapat ditransesterifikasi, rendemen akan berkurang karena
adanya gum dan bahan pengotor lainnya dalam minyak (Knothe et al. 2005).
3. Vitamin E
Minyak sawit kasar (Crude Palm Oil/CPO) mengandung 600 – 1000 ppm
tokoferol dan tokotrienol. Tokoferol dan tokotrienol merupakan senyawa yang
bernilai tinggi untuk minyak pangan. Terdapat 12 anggota keluarga Vitamin E
yang diketahui, secara bersama-sama mereka disebut tocols. Senyawa-senyawa
tersebut adalah : alpha, beta, gamma dan delta tokoferol; alpha, beta, gamma dan
delta tokotrienol; desmetiltokotrienol; didesmetiltokotrienol dan dua isomer dari
dengan cincin kroman, sedangkan tokotrienol memiliki tiga ikatan rangkap di sisi
rantai farnesyl. Tokomonoenol punya satu ikatan rangkap pada hidrokarbon di sisi rantai. Selain sisi rantai, tokoferol, tokomonoenol dan tokotrienol mempunyai
struktur kimia yang hampir sama yaitu cincin croman (Tou 2006).
Alfa-tokol menunjukkan tokol dengan posisi 5,7,8 dari cincin kroman
digantikan golongan metil, sedangkan beta-tokol menunjukkan tokol dengan
posisi 5 dan 8 dari cincin kroman diganti dengan golongan metil, gamma tokol
menunjukkan tokol dengan posisi 7 dan 8 dari cinicn kroman digantikan oleh
golongan metil, sedangkan delta-tokol menunjukkan tokol dengan posisi 8 dari
cincin kroman digantikan oleh golongan metil (Tou 2006).
Alfa tokoferol adalah suatu zat menyerupai minyak yang berwarna kuning
dan tidak dapat dikristalkan dengan berat molekul 430,7061 [g/mol]. Sediaoetama
(1976) menyatakan bahwa vitamin E sangat stabil dan tidak rusak oleh suhu tinggi
sampai 220oC, tidak rusak oleh udara atau cahaya, dapat tahan terhadap
penyabunan dan hidrogenisasi minyak di mana zat ini larut di dalamnya. Rumus
struktur tokoferol menurut Gast (2000) adalah sebagai beikut:
Gambar 2 Struktur molekul tokoferol.
Menurut Merck Index dalam Wikipedia (2008) nama tokoferol menurut
IUPAC adalah (2R)-2,5,7,8-Tetramethyl-2-[(4R,8R)-4,8,12 atau trimethyltridecyl]
-3,4-dihydro-2H-chromen-6-ol. Rumus molekul tokoferol adalah C29H50O2,
sedangkan molaritas tokoferol adalah 430,69 g/mol, berat jenis tokoferol adalah
0,950 g/cm³, titik leleh tokoferol adalah 2,5 - 3,5 °C, sedangkan titik uap
Andarwulan dan Koswara (1992) menambahkan bahwa tokoferol dan
tokotrienol stabil terhadap asam, panas, dan alkali tetapi dapat rusak oleh oksigen
dan proses oksidasi dapat dipercepat jika terkena cahaya, panas, alkali, dan
adanya logam seperti Cu2+ dan Fe2+. Tanpa adanya oksigen, vitamin E stabil
terhadap panas pada suhu di atas 200oC, serta tidak terpengaruh oleh asam sulfat
dan asam klorida pada suhu di atas 100oC. Alkali (tanpa panas dan oksigen) tidak
banyak merusak vitamin E, sehingga proses saponifikasi dapat dilakukan untuk
mengisolasi vitamin tersebut.
Vitamin E murni tidak berbau dan tidak berwarna, sedangkan vitamin E
sintetik yang dijual secara komersial biasanya berwarna kuning muda hingga
kecokelatan. Vitamin E larut dalam lemak dan dalam sebagian besar pelarut
organik, tetapi tidak larut dalam air. Bentuk sintetik vitamin E mempunyai
aktivitas biologik 50% dibandingkan alfa-tokoferol alam (Almatsier 2002).
Vitamin E tahan panas dan asam tetapi tidak tahan alkali, sinar ultraviolet,
dan oksigen. Vitamin E bisa rusak bila bersentuhan dengan minyak tengik, timah,
dan besi. Karena tidak larut air, vitamin E tidak hilang karena pemasakan dengan
air. Ester tokoferol seperti tokoferol asetat yang paling banyak ditemukan di alam,
tidak banyak rusak karena pengolahan. Absorpsi vitamin E berkisar antara
20-80%. Vitamin E disimpan sebagian besar di jaringan lemak dan selebihnya di hati
(Almatsier 2002).
Tokoferol mempunyai sifat absorbsi sinar ultraviolet dengan panjang
gelombang maksimum pada 295 nm. Dilain pihak, ester-esternya misalnya asetat
mempunyai panjang gelombang maksimum pada 285 nm (Andarwulan dan
Koswara 1992). Separasi tokoferol sebagai vitamin E dari bahan nabati telah
banyak dilakukan. Metoda separasi tokoferol yang telah dilakukan antara lain
esterifikasi, saponifikasi, destilasi molekuler, kromatografi, ekstraksi
Tabel 2. Perbandingan beberapa metoda ekstraksi vitamin E
Metoda Keuntungan Kerugian Referensi Esterifikasi Efektif untuk
menghilangkan komponen lemak
• Kehilangan tokoferol karena esterifikasi tokoferol
• Katalis alkalin (untuk transesterifikasi) menurunkan tokoferol dan meningkatkan titik didih selama destilasi
Quek et al.
(2007)
Saponifikasi Efektif untuk menghilangkan Kromatografi Kemurnian produk
tinggi
• Sterol dapat membuat blok pada kolom
• Umur absorben pendek
Quek et al.
(2007)
Kristalisasi Sesuai untuk
memisahkan sterol dari tokoferol
Recovery rendah Quek et al.
(2007)
Enzimatis Lipase dapat digunakan berulang kali
Lipase cukup mahal Quek et al.
(2007) Superkritikal
larutan
Tingkat kemurnian tinggi
Biaya operasional tinggi Mendez et al.
(2005) Sumber : Quek et al. (2007)
Fungsi utama vitamin E adalah sebagai antioksidan yang larut dalam lemak
dan mudah memberikan hidrogen dari gugus hidroksil (OH) pada struktur cincin
ke radikal bebas. Vitamin E mungkin mempunyai fungsi penting lain yang tidak
berkaitan dengan fungsi sebagai antioksidan, yaitu fungsi struktural dalam
memelihara integritas membran sel, sintesis DNA, merangsang reaksi kekebalan,
mencegah penyakit jantung koroner, mencegah keguguran dan sterilisasi, serta
mencegah gangguan menstruasi. Namun, fungsi-fungsi ini masih memerlukan
pembuktian lebih lanjut (Almatsier 2002).
4. Destilasi Molekuler
Destilasi molekuler adalah proses separasi fraksi-fraksi molekul yang
berbeda bobotnya pada suhu serendah mungkin untuk menghindari kerusakan
(Lutisan et al. 2002). Destilasi molekuler dicirikan dengan alokasi waktu destilasi yang singkat, koefisien transfer panas tinggi, penghilangan hotspot, aliran operasi kontinyu, tekanan rendah sampai 0,001 mbar dan jarak yang sempit antara
kondensor dan evaporator (Shimada 2000; Ibanez 2002).
Teknologi wiped-film menggunakan hukum bahwa setiap molekul kimia
memiliki karakteristik penguapan yang berbeda-beda. Perbedaan titik uap dapat
materi yang selalu bergerak konstan dengan derajat tertentu tergantung komposisi
dan perlakuan pada suhu dan tekanan yang diberikan padanya. Molekul yang
berada di permukaan mempunyai kecenderungan untuk meloncat ke udara yang
mengelilingnya. Ketika suhu dinaikkan dan tekanan diturunkan, loncatan molekul
bertambah sehingga disebut menguap (Pope 2008).
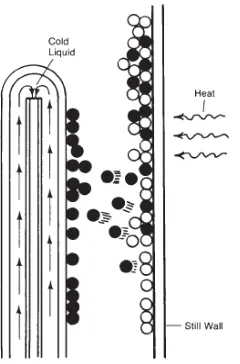
Gambar 3. Penguapan molekul dari larutan.
Proses destilasi molekuler bekerja berdasarkan sifat penguapan molekul
diatas. Destilasi molekuler terdiri dari pemanas yang dialiri bahan baku
(tergantung dari suhunya pemanasannya). Cairan bahan baku kemudian disebar
dalam lapisan film tipis dengan memutar wiper pada kecepatan yang telah
ditentukan. Lapisan tipis yang terbentuk, dibentuk menjadi aliran turbulen oleh
wiper kemudian turun sepanjang pemanas dengan adanya gaya gravitasi dan
lubang di dalam wiper (Pope 2008).
Gambar 4. Dasar-dasar evaporasi dan kondensasi pada destilasi molekuler.
Selama bahan mengalir pada pemanas, terjadi evaporasi yang tergantung
mengalir ke bagian bawah, sedangkan bahan yang terevaporasi dikondensasikan
dan dipisahkan (Pope 2008).
Menurut Pope (2008), destilasi molekuler menggunakan lapisan tipis
dilakukan karena beberapa alasan, diantaranya adalah:
1. Turbulensi dihasilkan dari pergerakan wiper yang berperan besar pada
transmisi panas keseluruh permukaan evaporator, oleh karena itu dapat
menghasilkan suhu yang lebih rendah di dalam evaporator.
2. Dihasilkan luas area permukaan pemanasan per unit volume yang
maksimum dengan adanya aliran evaporasi.
3. Waktu kontak cairan dengan pemanas dapat dikontrol dalam hitungan
detik atau kurang. Hal ini meminimasi kerusakan produk karena panas
dengan mengontrol kecepatan wiper.
4. Bahan baku dengan viskositas tinggi dapat diproses atau dengan
penambahan pelarut.
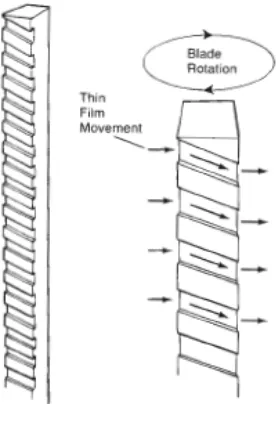
5. Untuk menunjang lapisan tipis, pope science mendesain blade yang dapat
meminimasi waktu tinggal dan memastikan bahan yang masuk kedalam
proses seragam. Bentuk blade seperti pada gambar dibawah ini:
Gambar 5. Wiper blade.
Bermacam-macam kecepatan wiper dengan kemampuan untuk berputar
mengalirkan fluida ke evaporator. Blade dapat terbuat dari karbon maupun teflon,
stainless steel, hastelloy, titanium, C-20, alumunium alloys dan kaca (Pope 2008).
Proses separasi dengan menggunakan destilasi molekuler pada dasarnya
adalah bahan cair yang masuk dalam kondisi vakum disemprotkan ke lapisan tipis
dan ditekan ke dalam permukaan evaporator. Dinding fraksinasi yang dipanaskan
(orange) dan vakum tekanan tinggi (kuning) membawa komponen yang volatil
mendekati kondensor internal, sedangkan komponen yang kurang volatil (residu)
masuk ke dalam silinder. Hasil fraksinasi keluar melalui outlet. Sesuai dengan
penggunaannya, produk yang diinginkan bisa dihasilkan dari fase destilasi
ataupun residunya (Pope 2008).
Gambar 6. Skema proses pemisahan dengan destilasi molekuler.
Waktu kontak yang sangat singkat antara cairan dan tabung evaporasi,
beberapa detik sampai satu menit, menjamin pendistribusian cairan yang seragam
dalam pemanas. Penurunan tekanan non-condensable gas pada evaporator
digunakan dalam purifikasi, separasi dan pemekatan larutan untuk molekul yang
kompleks dan sensitif terhadap panas (Lutisan et al. 2002).
Evaporasi fasa cair pada silinder evaporasi merupakan tahapan utama
proses destilasi molekuler. Cairan yang didestilasi dialirkan melewati silinder
sebagai lapisan film tipis dengan ketebalan 0,05-2mm, tergantung kondisi cairan
dan viskositasnya, ketika sedang didistribusikan di sekeliling perimeternya dan
diputar oleh wiper. Sebagai hasil evaporasi intensif dari lapisan permukaan tanpa
adanya pemanasan, gradien konsentrasi dan suhu terbentuk dalam lapisan tipis.
Selanjutnya, komponen yang lebih volatil akan bisa dikurangi dan permukaan
lapisan lebih dingin dibandingkan rata-rata suhu lapisan permukaan.
Fungsi wiper adalah untuk menyeimbangkan kondisi tersebut. Wiper
dengan intensif akan mencampur film dan mengalirkan panas di layer yang lebih
rendah yang lebih banyak mengandung komponen volatil dari permukaan silender
evaporasi ke permukaan lapisan tipis. Kondisi riilnya adalah lapisan film
terbentuk diantara dua kondisi kritis, a) turbulen film dengan pencampuran ideal
dengan arah tegak lurus ke aliran tanpa perbedaan suhu dan konsentrasi, dan b)
lapisan film laminar dengan kecepatan distribusi semi parabolik dan dengan
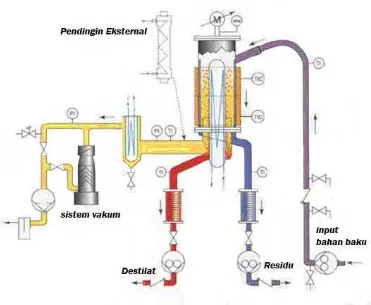
Keterangan: 1. Pompa bahan baku, 2. pipa pemanas, 3 & 13. pipa bahan baku, 4 & 14. wiper, 5 & 15. tabung destilasi, 6. pendingin stage 1, 7 & 20. Cool Trap, 8 & 16. tabung residu, 9. pompa transfer, 10 & 18. tabung destilat, 11&19. pompa destilat, 12. pipa transfer, 17. pompa residu, 21&22 pompa vakum, 23. panel kontrol.
Gambar 7. Bagian alat destilasi molekuler.
Gambar alat destilasi molekuler disajikan pada Gambar 7. Proses destilasi
molekuler diawali dengan memompa (1) bahan masuk kedalam tabung destilasi.
Sebelum bahan masuk ke tabung destilasi, bahan baku dipanaskan terlebih dahulu
(2) dalam pipa pemanas. Alat destilasi tipe ini memiliki dua stage destilasi. Fungsi pada masing-masing stage sama, tetapi kondisi operasinya bisa dibedakan. Residu pada stage 1 dipompa dengan pompa transfer ke stage 2 (9). Bahan yang masuk ke stage 2 kemudian didestilasi. Hasilnya, bahan akan terpisah menjadi dua larutan, residu (bahan tidak menguap pada proses destilasi) dan destilat (bahan
yang teruapkan). Residu dialirkan ke sisi kanan (16), sedangkan destilat dialirkan
ke sisi kiri (18), masing-masing ditampung dalam tabung penampung berskala
dan dapat dikeluarkan dengan pompa destilat (19) dan pompa residu (17).
Proses destilasi seluruhnya dikendalikan melalui panel kontrol. Panel
kontrol mengatur suhu destilasi, kecepatan laju alir bahan, putaran wiper dan
molekuler sangat dipengaruh oleh faktor-faktor seperti suhu, tekanan vakum,
kecepatan putar wiper, dan kecepatan aliran umpan (feed flow rate). Dikarenakan suhu dan tekanan vakum saling mempengaruhi pada destilasi molekuler, maka
pada pemurnian tokoferol dari RODD digunakan tekanan vakum konstan
(Jiang et al. 2006).
5. Optimasi dengan Metode Permukaan Respon a. Metode Permukaan Respon
Metode Permukaan Respon (Response Surface Methode) adalah suatu
kumpulan dari teknik-teknik statistika dan matematika yang berguna untuk
menganalisis permasalahan tentang beberapa variabel bebas yang mempengaruhi
variabel tak bebas atau respon, serta bertujuan untuk mengoptimumkan respon itu.
Metode permukaan respon dapat dipergunakan oleh peneliti untuk: (1) mencari
suatu fungsi pendekatan yang cocok untuk meramalkan respon yang akan datang,
serta (2) menentukan nilai-nilai dari variabel bebas yang mengoptimumkan respon
yang dipelajari (Gaspersz 1992).
Menurut Gaspersz (1992), langkah pertama dari metode permukaan respon
adalah mencari atau menentukan suatu pendekatan yang cocok untuk
menggambarkan hubungan fungsional yang tepat diantara respon Y dan
sekumpulan variabel bebas yang dispesifikasikan. Pada tahap awal, dirumuskan
model regresi polinomial dengan ordo pertama seperti Persamaan 3.
Y = o + 1X1 + 2X2 + ……. + kXk + ……….(3)
Jika terdapat lengkungan (curvature) dalam sistem, maka digunakan model
polinomial dengan derajat yang lebih tinggi. Model yang lebih tinggi dari orde
pertama dapat dirumuskan oleh model polinomial ordo kedua, seperti berikut :
Y = o +
∑
Model diatas dapat ditingkatkan ordenya menjadi model orde tiga (kubik).
tergantung dari sebaran data pada respon, sehingga didapat model prediksi yang
paling mendekati kenyataan.
b. Rancangan Komposit Terpusat (Central Composite Design)
Suatu rancangan percobaan untuk membangun model polinomial ordo kedua
harus memiliki paling sedikit tiga taraf dari setiap faktor yang dicobakan agar
parameter model dapat diduga. Rancangan percobaan itu dipilih berdasarkan
pertimbangan: (1) ketelitian relatif dalam menduga koefisien parameter model dan
(2) banyaknya pengamatan yang dibutuhkan. Rancangan percobaan yang dapat
dipergunakan untuk membangun model ordo kedua adalah rancangan faktorial 3k.
Salah satu bentuk rancangan permukaan respon ordo kedua yang diterapkan
secara luas adalah rancangan komposit terpusat (central composite design ). Pada dasarnya rancangan komposit terpusat adalah rancangan faktorial ordo pertama
(2k) yang diperluas melalui penambahan titik-titik pengamatan pada pusat agar
memungkinkan pendugaan koefisien parameter permukaan respon ordo kedua.
Rancangan komposit terpusat didefinisikan sebagai suatu rancangan percobaan
faktorial 2k atau faktorial sebagian (biasanya diberi kode +1 dan –1) ditambah
dengan titik-titk sumbu (+ 1, 0, 0,....0), (0, + 1, 0,....0), (0, 0, + 1,....0), (0,0,....+ 1)
(Gaspersz 1992).
Pembahasan dalam Metode Permukaan Respon, variabel bebas akan
didefinisikan sebagai X, dimana variabel bebas itu diasumsikan merupakan
variabel kontinyu dan dapat dikendalikan oleh peneliti tanpa kesalahan,
diasumsikan merupakan variabel acak (random variable). Variabel bebas bisa
terdiri dari X1, X2, ... Xk dengan Y sebagai variabel tak bebas atau variabel respon
yang diduga sebagian atau seluruhnya merupakan respon dari X1, X2, ... Xk. Secara
umum persamaan Metode Permukaan Respon dapat dituliskan sebagai Y = f (X1,
X2, ... Xk). (Pada dasarnya metode dakian tercuram merupakan suatu prosedur
untuk mencari daerah respon maksimum) (Gaspersz 1992).
6. Teknologi Pemisahan Tokoferol Terdahulu
Menurut United States Patent nomor 5646311, ada bermacam-macam proses
yang diketahui dapat menghasilkan konsentrat tokoferol, seperti esterifikasi,
A1, konsentrat tokoferol dihasilkan dari produk samping proses deodorisasi pada
pengolahan minyak dan lemak. Separasi tokoferol yang terdapat dalam United
States Patent nomor EP 171 009 A2, bahan yang mengandung tokoferol
dikontakkan dengan pelarut organik yang polar yang mampu melarutkan
tokoferol, kemudian tokoferol dipisahkan. Proses lainnya adalah pemisahan
tokferol dengan penyerapan adsorben dengan anion exchangers (Ulmanns
Enzyklopadie der Technischen Chemie, 1984). United State patent dengan nomor
336434 memfokuskan pada pemisahan dan penghilangan trialkilgliserol dan
dialkilgliserol, separasi parsial dan penghilangan asam lemak bebas, sterol
monogliserol dan komponen lainnya dari tokotrienol dengan ekstraksi cair-cair,
penambahan urea dan fraksinasi, dilanjutkan dengan vakum destilasi untuk
memisahkan asam lemak dan monoalkilgliserol untuk menghasilkan konsentrat
tokotrienol.
Tokoferol juga bisa dihasilkan dengan memisahkan tokoferol dari strerol
melalui kristalisasi sebagian sterol setelah dilakukan pemekatan. Pada United
States Patent nomor DE 31 26 110 A1, tokoferol dihasilkan dari minyak dan
lemak setelah proses esterifikasi untuk memisahkan asam lemak, kemudian
dilanjutkan dengan destilasi molekuler.
Penelitian ini dimaksudkan untuk mencari metode pemisahan tokoferol
dan tokotrienol dari CPO yang efektif dan efisien. Berbagai patent diatas telah
mengkaji pemisahan tokoferol dan tokotrienol dengan bebagai cara. Perbedaan
teknik separasi tokoferol dan tokotrienol dibandingkan dengan berbagai patent
diatas adalah tokoferol dan tokotrienol akan dipisahkan dari biodiesel dengan
destilasi molekuler. Pada patent 336434, tokoferol dan tokotrienol dipisahkan dari
CPO tanpa pengubahan CPO ke bentuk lain, sehingga memerlukan proses lebih
panjang untuk menghilangkan mono, di, dan trigliseridanya. Pada penelitian ini,
tokoferol dan tokotrienol akan dipisahkan dari biodiesel yang relatif lebih bersih
METODE PENELITIAN 1. Bahan dan Alat
Bahan-bahan yang digunakan pada penelitian ini adalah CPO yang berasal
dari PT Perkebunan Nusantara VIII Malimping Serang Banten, standard
alfa-tokoferol (Sigma-Aldrich T3251-56, Synthetic, 95% HPLC), hexan HPLC grade,
isopropanol HPLC grade, metanol, NaOH, asam sulfat, KOH, PP dan bahan kimia
lainnya.
Peralatan yang dibutuhkan adalah destilasi molekuler produksi Pope Science
berjenis Turnkey, 6”, Two-Stage Molecular Still Pilot Plant, dengan spesifikasi luas body 0,22m2 stainless steel, feed rate antara 2 sampai 50 liter/jam, tekanan
vakum mulai 300 torr sampai 5x10-3 torr, dengan suhu destilasi dapat
dioperasikan mulai dari 0-400oC, reaktor esterifikasi dan transesterifikasi, High Performance Liquid Chromatrography (HPLC) kolom Zorbax SIL (0,46 x 25 cm) dengan fase bergerak isopropanol : hexane (0,5 : 99,5 v/v) untuk absorbansi
α tokoferol (Tay et al. 2002), timer, timbangan, hot plate, termometer, stiring bor,
sudip, magnetic stirer-hot plate, labu pemisah, erlenmeyer, serta peralatan analisis seperti buret, peralatan gelas dan pendukung lainnya.
2. Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Surfactant and Bioenergy
Research Centre (SBRC) Institut Pertanian Bogor, Laboratorium Pengawasan Mutu Departemen Teknologi Industri Pertanian – Institut Pertanian Bogor, dan
Laboratorium Atsiri - Lembaga Ilmu Pengetahuan Indonesia (LIPI) di
PUSPIPTEK Serpong, mulai bulan Pebruari sampai dengan bulan Oktober 2008.
3. Metode
Penelitian ini dibagi menjadi dua tahap, tahap pertama adalah pembuatan
biodiesel dari CPO, tahap kedua adalah separasi Vitamin E dari biodiesel CPO
a. Pembuatan Biodiesel CPO
CPO yang digunakan berasal dari PTPN VIII Bandung. CPO selanjutnya
dianalisis kadar asam lemak bebasnya (% FFA). Kadar asam lemak bebas akan
menentukan besarnya metanol dan asam sulfat untuk reaksi esterifikasi.
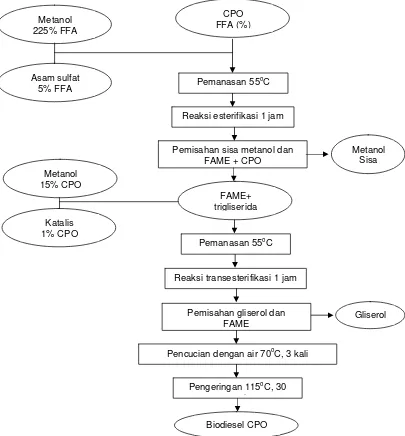
Gambar 8. Diagram alir pembuatan biodiesel CPO.
Pada proses pembuatan biodiesel, CPO sebanyak 1000 ml dipanaskan
sampai suhu 55oC, ditambah metanol 225% dari jumlah FFA dan katalis asam
sulfat 5% FFA. Selanjutnya dilakukan pengadukan 350 rpm untuk
menyeragamkan suhu dan suspensi sampai terbentuk ester. Suhu campuran
CPO FFA (%)
Pemanasan 55oC Metanol
225% FFA
Asam sulfat 5% FFA
Reaksi esterifikasi 1 jam
Pemisahan sisa metanol dan FAME + CPO
Metanol Sisa
FAME+ trigliserida
Pemanasan 55oC
Reaksi transesterifikasi 1 jam
Pemisahan gliserol dan FAME
Metanol 15% CPO
Katalis 1% CPO
Gliserol
Pencucian dengan air 70oC, 3 kali
Pengeringan 115oC, 30 i
dipertahankan pada 55oC. selama 1 jam. Setelah reaksi berlangsung sempurna
dilakukan tahap transesterifikasi, dengan menambahkan metanol 15% dan NaOH
sebanyak 1% dari jumlah minyak. Pengadukan dilanjutkan kembali selama 1 jam
sampai terbentuk warna kecoklatan yang menandai telah terbentuknya gliserol
sebagai produk samping.
Metil ester dan gliserol dipisahkan menggunakan labu pemisah. Lapisan
bawah adalah gliserol dan metil ester berada di bagian atas. Metil ester dipisahkan
dan dicuci dengan akuades suhu 50oC untuk menghilangkan sisa katalis, metanol
dan sabun, sampai tiga kali pencucian. Pengeringan metil ester atau biodiesel
dilakukan menggunakan pemanasan suhu 115oC sampai seluruh air menguap.
Pengujian tahap awal adalah uji kadar lemak bebas pada biodiesel yang
telah dihasilkan. Pengujian asam lemak bebas ini penting untuk memastikan
bahan baku tidak memiliki asam lemak bebas yang cukup tinggi (>1%) yang
dapat menghambat kinerja pompa vakum pada destilasi molekuler. Asam lemak
bebas tinggi dapat menguap secara cepat dan terserap dalam pompa vakum tanpa
terjerat trap yang mengakibatkan macetnya pompa vakum.
b. Separasi Vitamin E
Pada tahap ini, biodiesel yang dihasilkan dihitung kandungan tokoferol
kemudian dianalisis sifat fisik dan kimianya. Informasi karakteristik tokoferol dan
metil ester secara spesifik akan sangat dibutuhkan pada tahapan penelitian
separasi dengan destilasi molekuler.
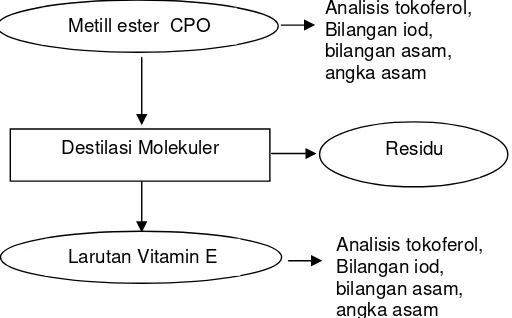
Gambar 9. Diagram alir tahapan separasi Vitamin E.
Metill ester CPO
Destilasi Molekuler
Larutan Vitamin E
Analisis tokoferol, Bilangan iod, bilangan asam, angka asam
Residu
Parameter penting untuk menunjang proses separasi dengan destilasi
molekuler adalah berat molekul dan titik didih. Hasil proses pemisahan dengan
destilasi molekuler kemudian di analisis menggunakan HPLC untuk mengetahui
konsentrasi larutan vitamin E yang dihasilkan.
4. Rancangan Percobaan
Tahap pengumpulan data dan analisis hasil penelitian digunakan Metode
Permukaan Respon (RSM). Faktor yang berpengaruh pada destilasi molekuler
adalah Kecepatan wiper, kecepatan laju alir bahan, dan suhu evaporasi. Percobaan
ini menggunakan rancangan komposit terpusat (Central Composite Design)
dengan menggunakan 3 faktor, masing-masing perlakuan dibagi menjadi dua
level. Sesuai dengan rancangan komposit terpusat 3 faktor maka pengulangan
dilakukan pada titik tengah sebanyak 6 (enam) kali. Faktor berserta level
dibawahnya adalah sebagai berikut:
a. Faktor Kecepatan Laju Alir Bahan (A)
1. Kecepatan Laju Alir Bahan = 1,3 liter/jam (a1 = - 1)
2. Kecepatan Laju Alir Bahan = 2,7 liter/jam (a2 = +1)
b. Faktor Suhu Destilasi (B)
1. Suhu Destilasi = 175˚C (b1 = - 1)
2. Suhu Destilasi = 220˚C (b2 = +1)
c. Faktor Kecepatan Putaran Wiper (C)
1. Kecepatan Putaran Wiper = 200 rpm (c1 = - 1)
2. Kecepatan Putaran Wiper = 400 rpm (c2 = +1)
Nilai α dipilih k = 3 adalah 2 k/4 = 2 ¾ = 20,75 = 1,68. Setelah menetapkan
level-level faktor yang bersesuaian dengan rancangan faktorial 2k, maka
ditetapkan level-level faktor yang bersesuaian dengan titik pusat a = 0, b= 0 dan c
= 0, dengan jalan mengambil titik tengah diantara kedua level faktor yang telah
dispesifikasikan dalam langkah pertama. Dari faktor dan level diatas, maka
diketahui titik –titik pusat adalah:
a. Faktor laju alir bahan dengan titik pusat :
b. Faktor suhu destilasi dengan titik pusat:
(kode b = 0)
c. Faktor kecepatan putar wiper dengan titik pusat:
(kode c = 0)
Diketahui bahwa level-level laju alir bahan (A) berturut-turut: 1,3 liter/jam
(kode a = -1), 2,7 liter/jam (kode a = 1) dan 2 liter/jam (kode a = 0), maka titik
tengah dari faktor A adalah 2 liter/jam serta jarak diantara level faktor adalah 0,7
liter/jam, dengan demikian hubungan antara variabel kode a dan variabel asli A
dapat dinyatakan sebagai berikut:
7
dengan cara yang sama, maka dapat ditentukan bentuk hubungan antara b dan
B serta c dan C, sebagai berikut:
Penentuan level-level faktor yang bersesuaian dengan nilai -α = -1,68 dan α =
1,68 dengan jalan memanfaatkan hubungan yang ada antara variabel kode dan
variabel asli dalam persamaan (5), (6), dan (7).
Menggunakan persamaan 5, maka diketahui bahwa:
untuk a = -1,68, maka A = 0,7 (-1,68) + 2 = 0,82
untuk a = 1,68, maka A = 0,7 (1,68) + 2 = 3,18
Menggunakan persamaan 6, maka diketahui bahwa :
untuk b = -1,68, maka B = 25 (-1,68) + 200 = 159,9
untuk b = 1,68, maka B = 25 (1,68) + 200 = 235,3
Menggunakan persamaan 7, maka diketahui bahwa :
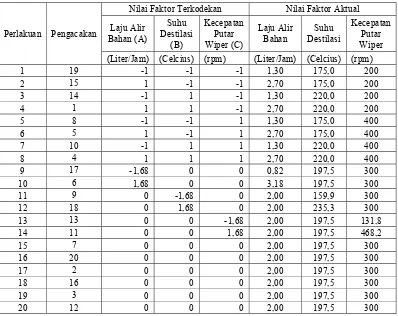
Pengkodean dan level asli proses atau variabel bebas ditunjukkan oleh Tabel 3.
Tabel 3. Rancangan penelitian terkodekan dan aktual
Perlakuan Pengacakan
Nilai Faktor Terkodekan Nilai Faktor Aktual
Laju Alir (Liter/Jam) (Celcius) (rpm) (Liter/Jam) (Celcius) (rpm) 1 19 -1 -1 -1 1,30 175,0 200
Data pendukung yang diuji selain konsentrasi tokoferol adalah bilangan
iod, angka asam, asam lemak bebas. Pengujian bilangan iod menggunakan standar
pengujian A04-03), pengujian angka asam dan FFA menggunakan
(FBI-A01-03). Kandungan alfa-tokoferol diukur dengan menggunakan HPLC (AOAC
1997). Detektor yang digunakan pada sistem HPLC ini adalah Ultraviolet (UV)
dengan panjang gelombang 292 nm. Kolom yang digunakan untuk analisa alfa
tokoferol adalah Zorbax Sil dengan ukuran 250 x 4,6 mm dengan saringan
membran 0,5 µm. Fasa bergerak yang digunakan adalah isoproanol dalam hexan
dengan perbandingan 0,5 : 99,5 v/v. Larutan vitamin E minyak sawit sebanyak 0,4
gr ditimbang dalam labu ukur 5 ml, kemudian ditera menggunakan hexan. Contoh
diinjeksikan sebanyak 20 µm kedalam injektor. Laju alir yang digunakan pada
kolom HPLC adalah 1 ml/menit selama 15 menit. Prosedur pengujian terdapat
HASIL DAN PEMBAHASAN
1. Pembuatan Biodiesel CPO
Menurut May (2007), metode ekstraksi dan isolasi komponen minor (tokoferol
termasuk didalamnya) dari minyak nabati dilakukan dengan a) esterifikasi dan
transesterifikasi, b) mengambil fase ester yang mengandung komponen minor
dengan memisahkan dari gliserol, c) ekstraksi untuk memisahkan komponen
minor. Hal ini menunjukkan bahwa proses perubahan CPO menjadi metil ester
merupakan salah satu bagian dari proses pemisahan yang tidak merusak
komponen minor yang terdapat dalam CPO. Batistella (1998), juga menggunakan
metode esterifikasi dan transesterifikasi untuk memisahkan karoten dari biodiesel
dengan metode destilasi molekuler. Penggunaan esterifikasi dan transesterifikasi
dapat memudahkan destilasi molekuler karena molekul-molekul yang berat seperti
gliserol telah terpisahkan terlebih dahulu.
Berdasarkan hasil uji, CPO yang digunakan dalam penelitian ini memiliki
kadar asam lemak bebas 5,25%, kadar air 0,19% dan kadar kotoran 0.020%
(PTPN VIII, 2007). Kadar asam lemak bebas lebih dari 2 % mensyaratkan proses
dua tahap, esterifikasi dan transesterikfikasi pada konversi CPO menjadi metil
ester. Proses konversi metil ester dilakukan bertahap sesuai dengan kapasitas
peralatan yang tersedia di Laboratorium Surfactant and Bioenergy Research
Centre (SBRC).
Hasil pengujian metil ester yang terbentuk menunjukkan kadar asam lemak
bebas sebanyak 0,4%, dan kadar bilangan asam sebesar 1,83%. Hasil analisis
HPLC pada metil ester menunjukkan konsentrasi tokoferol pada metil ester
sebesar 651 ppm. Nilai ini tidak jauh berbeda dengan kandungan tokoferol dari
CPO sebesar 600-1000 ppm (Tan dan Oh 1981; Gapor et al. 1981). Hasil uji
bilangan iod menunjukkan nilai 59,7 jauh lebih rendah dari yang disyaratkan
dalam standar mutu biodiesel Indonesia sebesar 115 (Haryadi dkk. 2005). Artinya,
bilangan iod kecil menunjukkan metil ester yang terbentuk cenderung jenuh dan
tidak memiliki banyak ikatan rangkap. Bilangan iod kecil juga menunjukkan
bahwa metil ester yang dihasilkan stabil pada suhu tinggi karena ketiadaan ikatan
2. Kondisi Proses dan Operasi Destilasi Molekuler
Alat destilasi molekuler yang digunakan dalam penelitian ini merupakan
produksi Pope Science berjenis Turnkey, 6”, Two-Stage Molecular Still Pilot
Plant, dengan spesifikasi luas body 0,22m2 stainless steel, feed rate antara 2
sampai 50 liter/jam, tekanan vakum mulai 300 torr sampai 5x10-3 torr, dengan
suhu destilasi dapat dioperasikan mulai dari 0-400oC.
Proses destilasi tiap perlakuan dilakukan minimal selama 2 jam agar seluruh
feed terdistilasi. Kecepatan laju alir bahan paling kecil adalah 1,3 liter per jam. Dengan proses operasi 2 jam diasumsikan seluruh bahan baku telah terdestilasi.
Kondisi suhu proses destilasi tiap perlakuan diamati setiap 15 menit. Bahan baku
biodiesel CPO yang digunakan konstan sebanyak 2 liter/run. Tekanan pada proses destilasi konstan pada 0,06 milibar atau sama dengan 0,04 torr.
Gambar alat serta panel-panel yang digunakan untuk mengontrol proses
destilasi disajikan pada Gambar 8.
Keterangan: Panel 1 = Suhu Feed (bahan baku) Stage 1, Panel 2 = Suhu Distilat Stage 1, Panel 3 = Exchanger Stage 1 Ke Stage 2, Panel 7 = Suhu Feed Stage 2, Panel 8 = Suhu Input Cold Trap Stage 2, Panel 9 = Suhu Residu Stage 2, Panel 10= Suhu Distilat Stage 2
Alat destilasi molekuler tipe ini memiliki 2 destilator (stage 1 dan stage 2) dengan fungsi sama namun kondisi operasinya bisa dirancang berbeda. Pada
penelitian ini, stage 1 dikondisikan sama tiap perlakuannya, yaitu pada suhu
110˚C untuk menjaga input yang masuk ke stage 2 tetap. Suhu 110˚C
dimaksudkan untuk menghilangkan kandungan air dan terdestilasinya sebagian
FAME. Menurut Jiang (2006), destilasi molekuler pada suhu 100-110˚C
menghasilkan FAME dengan konsentrasi mencapai 90%. Stage 1 digunakan
sebagai bahan baku destilasi molekuler di Stage 2.
Kondisi operasi alat destilasi molekuler pada percobaan pertama (run1) pada stage 2 adalah dengan menggunakan laju alir bahan 2,7 liter, suhu destilasi 220˚C
dan kecepatan wiper 200 rpm. run 1 merupakan perlakuan 4. Urutan proses
destilasi disesuaikan dengan pengacakan pada desain perlakuan. Kondisi suhu
yang terbaca pada panel suhu alat disajikan dalam Tabel 4:
Tabel 4. Keterangan Kondisi Suhu Proses pada Run 1
Suhu Panel (˚C)
Waktu 1 2 3 7 8 9 10
7:20 45 27 26 43 23 66 22
7:35 46 29 26 43 25 95 22 7:50 46 31 27 44 27 125 22 8:05 45 32 27 45 28 124 22 8:20 46 33 28 45 29 131 23 8:35 46 34 28 46 29 135 23 8:50 47 35 29 46 30 138 23 9:05 47 36 29 47 29 137 24 9:20 46 37 29 46 30 138 24
Besaran suhu pada bagian destilasi molekuler menunjukkan kondisi
operasinya. Berdasarkan Tabel 4, diatas, suhu input bahan baku selama proses
berkisar antara 45-47˚C. Pada saat proses stage 1, bahan baku dipanaskan 45˚C sebagai perlakuan pemanasan awal sebelum masuk ke proses selanjutnya.
Pemanasan awal ini berfungsi untuk memudahkan pemompaan bahan ke destilator
dan mengurangi perbedaan suhu yang terlalu jauh yang dapat menurunkan suhu
Data suhu yang terukur pada stage 2 ada di panel No 7,8,9,10. Panel No 7
merupakan suhu input untuk stage 2. Bahan masuk dengan kecepatan yang diatur
oleh pompa transfer (transfer pump). Selanjutnya bahan didestilasi dengan
kecepatan wiper dan suhu yang telah ditentukan. Output dari destilasi molekuler,
bahan terpisah menjadi destilat (hasil destilasi) dan residunya. Suhu destilat
ditunjukkan dengan panel 10, sedangkan suhu residu panel 9. Panel no 8
merupakan panel suhu dari penjerat bahan (vacuum trap) sebelum masuk ke
pompa vakum. Data penelitian dihasilkan oleh destilat dan residu dari stage 2. Hal ini disebabkan pemisahan terjadi pada stage 2, sedangkan stage 1 tidak ada yang terpisah. Kondisi suhu proses pada perlakuan-perlakuan selengkapnya terdapat
pada Lampiran 2.
3. Data Hasil Penelitian
a. Kandungan tokoferol biodiesel CPO
Kandungan tokoferol dalam biodiesel CPO dianalisis. Setiap perlakuan
menggunakan bahan baku biodiesel CPO sebanyak 2 liter (2000 ml). Hasil
analisis konsentrasi tokoferol pada biodiesel CPO adalah 651 (μg/ml). Oleh
karena itu jumlah tokoferol pada biodiesel CPO adalah 1302000 μg, atau 1302 mg
atau 1,3 gr per 2 liter biodiesel CPO yang digunakan pada setiap perlakuan.
b. Destilat yang Berhasil di Separasi
Berdasarkan perhitungan berat molekul, berat molekul palmitic metyl ester
menurut Jiang et.al (2006) adalah 270,2559 [g/mol]sedangkan berat molekul
tokoferol adalah 430,7061 [g/mol] (Pumchem 2008). Proses destilasi dimulai
dengan menguapkan molekul dengan berat molekul lebih ringan sampai yang
berat. Data penelitian diperoleh dengan menganalisis konsentrasi tokoferol yang
terdapat pada destilat. Menurut Posada (2007), tokotrienol bersama tokoferol akan
terpisahkan dan masuk ke destilat pada suhu tinggi. Tokoferol tetap berada pada
residu jika bahan didestilasi dibawah 115°C, sedangkan hasil terbaik untuk
destilasi komponen minor CPO dicapai pada suhu diatas 160°C. Pada suhu diatas
160°C tokoferol akan menguap dan masuk kedalam destilat (Posada 2007). Pada
penelitian ini, suhu destilasi dimulai pada suhu 175°C, sehingga tokoferol
penelitian ini dimulai pada 175°C karena berdasarkan penelitian pendahuluan,
destilasi mulai menghasilkan fase destilat pada suhu 170°C.
Data hasil penelitian menunjukkan jumlah destilat tiap perlakuan bervariasi
dengan rentang 11 ml - 350 ml. Jumlah destilat terkecil dihasilkan pada perlakuan
1 (laju alir bahan 1,3 L/h, suhu destilasi 175°C, dan kecepatan putaran wiper
200rpm), perlakuan 2 (laju alir bahan 2,7 Liter/jam, suhu destilasi 175°C, dan
kecepatan putaran wiper 200), dan perlakuan 11 (laju alir bahan 2 Liter/jam, suhu
destilasi 159,9°C, dan kecepatan putaran wiper 300 rpm).
Tabel 5. Rancangan dan hasil pengaruh laju alir bahan, suhu destilasi, dan kecepatan putaran wiper terhadap hasil destilasi
Perlakuan
Jumlah destilat terbesar pada Perlakuan 12 (laju alir bahan 2 Liter/jam, suhu
c. Tokoferol yang Berhasil di Separasi
Hasil analisis konsentrasi tokoferol pada destilat dan jumlah tokoferol yang
berhasil dipisahkan dari biodiesel CPO disajikan pada Tabel 6. Berdasarkan hasil
perhitungan jumlah tokoferol yang dipisahkan, dapat dilihat bahwa jumlah
tokoferol terendah yang dapat dipisahkan dengan menggunakan destilasi
molekuler sebanyak 22,9 mg yang terdapat pada perlakuan 11 (laju alir bahan 2
liter/jam, suhu destilasi 159,9°C dan kecepatan putaran wiper 300 rpm). Jumlah
tokoferol tertinggi yang berhasil dipisahkan sebanyak 605 mg yang terdapat pada
Perlakuan 3 (laju alir bahan 1,3 L/hr, suhu destilasi 220°C dan kecepatan putaran
wiper 200 rpm).
Berdasarkan data hasil analisis tokoferol, konsentrasi tokoferol pada seluruh
perlakuan mempunyai rentang 809 ppm – 4017 ppm. Konsentrasi tokoferol
terendah dihasilkan oleh perlakuan 7 (laju alir bahan 1,3 Liter/jam, suhu destilasi
220°C dan kecepatan putaran wiper 400 rpm). Konsentrasi tokoferol tertinggi
dalam destilat diperoleh pada perlakuan 4 (laju alir bahan 2,7 Liter/jam, suhu
destilasi 220°C dan kecepatan putaran wiper 200 rpm). Gambar peak pengujian
alfa-tokoferol selengkapnya terdapat pada Lampiran 3a. Lampiran 3b
menunjukkan peak standar alfa tokoferol. Lampiran 3c merupakan gambar peak
metil ester. Perhitungan konsentrasi alfa tokoferol dalam destilat selengkapnya
terdapat pada Lampiran 4.
d. Rekovery Tokoferol
Berdasarkan data pada Tabel 6, pada perlakuan 1 didapatkan hasil destilasi 11
ml dengan konsentrasi 2938 (μg/ml). Jika dihitung maka jumlah tokoferol pada
perlakuan 1 adalah 32,3 mg. Hasilnya, rekoveri untuk perlakuan 1, merupakan
perbandingan jumlah tokoferol yang berhasil didestilasi dan jumlah tokoferol
awal, adalah sebesar 2,48%. Kesetimbangan massa untuk menerangkan hasil
separasi pada Perlakuan 1 disajikan pada Gambar 9.
Gambar 9. Kesetimbangan massa separasi tokoferol.
Dengan cara yang sama, Perlakuan 2-20 dapat dihitung besaran rekoverinya.
Besaran rekoveri inilah yang kemudian digunakan dalam analisis data. Destilasi
molekuler
Biodiesel CPO
Volume = 2000 ml
Konst Tokoferol = 651 ppm Jumlah tokoferol = 1302 mg
Fraksi kaya tokoferol
Volume = 11 ml
Konst Tokoferol = 2938 ppm Jumlah tokoferol = 32,3 mg Rekoveri = 2,48%
Volume = 1989 ml
Perbandingan antara jumlah tokoferol dalam biodiesel CPO, jumlah tokoferol
hasil separasi dan rekoverinya disajikan dalam Tabel 7.
Tabel 7. Rekoveri tokoferol
Perla
4. Hasil Analisis RSM
Metode analisis penelitian menggunakan metode permukaan respon dengan
desain komposit terpusat. Data hasil penelitian diolah dengan program Design
Expert 7.1.1. Respon yang diolah adalah rekoveri tokoferol. Perhitungan respon menggunakan presentase rekoveri untuk menyeragamkan perolehan tokoferol agar
a. Analisis Model Prediksi
Hasil analisis terhadap model (linier, kuadratik dan kubik), menunjukkan ordo
model tertinggi yang dapat dipilih merupakan model kuadratik. Model kubik
terbaca ”aliased” atau bisa diartikan salah jika model kubik digunakan sebagai
pendekatan. Hal ini dikarenakan tidak cukupnya perlakuan yang telah dilakukan
untuk memprediksi model kubik. Hasil analisis model selengkapnya terdapat pada
Lampiran 5.
b. Analisis Anova
Analisis Anova disajikan pada Lampiran 6, menunjukkan model kuadratik
yang dipilih mempunyai nilai F hitung 3,26 dan nilai p = 0,0399; laju alir bahan
memiliki F hitung 3,88 dengan nilai p = 0,0772; suhu destilasi memiliki F hitung
16,72 dengan nilai p = 0,0022; dan kecepatan putar wiper memiliki nilai F hitung
0,70 dan nilai p = 0,4228. Nilai p < 0,0500 menunjukkan pengaruh signifikan
pada respon. Hal ini menunjukkan bahwa model dan suhu destilasi berpengaruh
signifikan pada respon. Laju alir bahan dan kecepatan putar wiper tidak
memberikan pengaruh signifikan. Interaksi antar faktor juga tidak memiliki
pengaruh signifikan pada respon.
Kesalahan pemodelan berpengaruh nyata pada model yang memiliki nilai
0,0175 sedangkan nilai yang diharapkan harus lebih besar dari 0,1. Nilai
kesalahan pemodelan dibawah 0,05 mencerminkan bahwa model tidak cocok
dengan data. Karena nilai sisa (residual) berpengaruh signifikan pada respon,
maka diperlukan transformasi data untuk memeroleh model prediksi yang lebih
baik.
Data didiagnosa menggunakan metode Box Cox untuk mengetahui
transformasi data yang cocok. Hasil pengujian Box Cox menunjukkan lambda
terbaik adalah -0,67, oleh karena itu transformasi data yang direkomendasikan
adalah invers akar kuadrat (inverse sqrt) untuk menggeser lambda pada -0,5 yang mendekati lambda terbaiknya. Transformasi akar kuadrat cocok untuk data
persentase apabila wilayahnya antara 0 - 30% atau 70 - 100% (Gomez & Gomez
1995). Pada kasus yang sama Steel & Torrie (1989) memberikan batasan 0 - 20%
atau 80 - 100%. Pada penelitian ini, presentase data mempunyai selang 26,37%
c. Transformasi Data
Untuk menghasilkan normalitas yang lebih baik, maka data di transformasi
menjadi invers akar kuadrat. Hasil transformasi data disajikan pada Tabel 8
berikut:
Tabel 8. Transformasi data dengan invers akar kuadrat (Lambda= -0,5)
Perlakuan
Faktor 1 Faktor 2 Faktor 3 Respon Transformasi data respon
Data hasil transformasi ini kemudian dijadikan input data. Ringkasan
pemilihan model pada Lampiran 7 menunjukkan model yang disarankan adalah
kuadratik. Hasil analisis anova data yang telah ditransformasi pada Lampiran 8,
menunjukkan model kuadratik yang dipilih mempunyai nilai F hitung 13,79 dan
nilai p = 0,0002; laju alir bahan memiliki F hitung 13,49 dengan nilai p = 0,0043;
suhu destilasi memiliki F hitung 88,50 dengan nilai p < 0,0001; dan kecepatan
putar wiper memiliki nilai F hitung 0,65 dan nilai p = 0,4402. Nilai p < 0,0500
menunjukkan pengaruh signifikan pada respon. Hal ini menunjukkan bahwa
putar wiper dan interaksi antar faktor tidak memiliki pengaruh signifikan pada
respon. Standar deviasi 0,068, dan R2 = 0,9254. Model persamaan kuadratik yang
dihasilkan adalah sebagai berikut:
1/Sqrt(Rekoveri Tokoferol ) = 0,38 + 0,068 A - 0,17 B - 0,015 C - 0,031 AB + 0,044 AC + 0,050 BC - 0,010 A2 + 0,051 B2 - 0,033 C2...(8)
Permukaan respon dan plot kontur tingkat rekoveri yang dihasilkan oleh
pengaruh laju alir bahan, suhu destilasi dan kecepatan putar wiper sebelum
optimalisasi ditunjukkan pada Gambar 10 sampai Gambar 15. Model persamaan
kuadratik diatas (persamaan 8), berdasarkan hasil analisis anova, menjelaskan
bahwa 92,54% total ragam masuk dalam nilai rekoveri tokoferol sehingga model
dapat menerangkan kondisi sebenarnya dari laju alir bahan, suhu destilasi dan
kecepatan putar wiper terhadap rekoveri tokoferol.
d. Analisis Faktor
Profil Faktor Laju Alir Bahan
Hasil analisis anova menunjukkan bahwa laju alir bahan berpengaruh
signifikan pada model. Profil laju alir terhadap besaran rekoveri tokoferol
disajikan pada Gambar 10.
0
1.30 1.65 2.00 2.35 2.70 0.140
Warning! Factor involved in an interaction.
Gambar 10 menunjukkan bahwa peningkatan laju alir (pada suhu destilasi
197,5°C dan kecepatan putar wiper 300 rpm) mulai 1,3 liter/h sampai 2,7 liter/h
menunjukkan penurunan rekoveri tokoferol pada laju alir yang paling besar. Nilai
1/Sqrt(rekoveri tokoferol) berbanding terbalik dengan nilai rekoveri tokoferol. Hal
ini dikarenakan semakin kecil nilai pembagi Sqrt(rekoveri tokoferol) maka
semakin besar rekoveri tokoferol pada kondisi aktual.
Penurunan rekoveri tokoferol seiring dengan peningkatan laju alir. Tokoferol
dan tokotrienol semakin banyak dijumpai di destilat pada laju alir paling rendah.
Hal ini berkaitan dengan waktu tunggu (retention time) tokoferol dan tokotrienol di dalam evaporator. Pada laju aliran yang rendah, energi molekul (tokoferol dan
tokotrienol) cukup punya waktu untuk mencapai permukaan larutan, oleh karena
itu molekul ini bisa keluar menuju fase terdestilasi, Posada (2007).
Signifikansi pengaruh laju alir yang rendah pada penelitian ini menunjukkan
besaran laju alir berpengaruh pada waktu tunggu (retention time) metil ester
didalam evaporator. Artinya, laju alir 2,7 liter per jam sebagai laju aliran bahan
tertinggi memiliki retention time berbeda dengan laju alir 1,3. Perbedaan alat yang digunakan, terutama pada luasan penampang evaporasi dan laju alir, memberikan
profil hasil rekoveri yang sama. Luas penampang evaporator pada Posada (2007)
adalah 0,043 m2, sedangkan pada penelitian ini luas areal evaporasi lebih kecil
0,022 m2. Laju alir bahan pada Posada (2007) antara 0,1 Kg/jam – 0,4 Kg/jam
jauh lebih kecil dari laju alir bahan pada penelitian ini yang mencapai 2,7
Liter/jam.
Profil Faktor Suhu Destilasi
Hasil analisis anova menunjukkan bahwa faktor suhu destilasi berpengaruh
signifikan pada model. Hal ini jelas terlihat pada Gambar 11, bahwa seiring
dengan peningkatan suhu destilasi, maka rekoveri tokoferol juga meningkat.
Gambar 11 menunjukkan profil rekoveri tokoferol pada berbagai suhu destilasi
dengan laju alir 2 liter/jam dan kecepatan putar wiper 300.
Peningkatan rekoveri tokoferol pada suhu yang lebih tinggi menunjukkan
sigifikansi pengaruh suhu destilasi pada model. Menurut Posada (2007), semakin
tinggi suhu destilasi maka semakin banyak komponen yang masuk ke fase
120°C akan mampu memisahkan FFA dan squalen, sedangkan tokoferol dan
tokotrienol mulai terpisah pada suhu diatas 160 °C.
175.00 186.25 197.50 208.75 220.00 0.140
Warning! Factor involved in an interaction.
Gambar 11. Profil rekoveri tokoferol pada berbagai suhu destilasi.
Nilai 1/Sqrt(rekoveri tokoferol) pada Gambar 11 berbanding terbalik dengan
nilai rekoveri tokoferol. Hal ini dikarenakan semakin kecil nilai pembagi
Sqrt(rekoveri tokoferol) maka semakin besar rekoveri tokoferol pada kondisi
aktual.
Pada penelitian ini, rentang suhu destilasi mulai 175°C – 220 °C. Harapannya,
tokoferol dan tokotrienol akan terpisah dan masuk kedalam destilat sesuai dengan
hasil penelitian Posada (2007) diatas. Pemilihan rentang tertinggi (220°C) didasari
pada penelitian Jiang (2006) yang memisahkan tokoferol dari RODD pada suhu
170 – 230 °C. Hasil penelitian Jiang (2006) menyebutkan bahwa rekoveri
tokoferol pada suhu 200°C mencapai 35%, sedangkan pada suhu 230°C
konsentrasinya menurun mencapai 31% karena phytosterol mulai terpisah. Hal ini
menunjukkan bahwa pada suhu 230°C tokoferol masih bisa terpisahkan tetapi
kemurniannya menurun.
Menurut Wikipedia (2008), titik didih tokoferol berada pada rentang 200°C -
220°C. Hal ini menunjukkan tokoferol mulai terdestilasi pada rentang suhu
tersebut. Menurut Jiang (2006) dan Shao (2007), suhu destilasi molekuler optimal
Profil Faktor Kecepatan Putaran Wiper
Kecepatan putaran wiper tidak menunjukkan signifikasi pada anova. Hal ini
terlihat pada Gambar 12, bahwa peningkatan putaran wiper (pada laju alir bahan 2
liter/jam dan suhu destilasi 197,5 °C) tidak menunjukkan pola perubahan
signifikan pada prosentase rekoveri tokoferol.
200.00 250.00 300.00 350.00 400.00 0.140
Warning! Factor involved in an interaction.
Gambar 12. Profil rekoveri tokoferol pada berbagai kecepatan putar wiper.
Fungsi wiper pada dasarnya adalah memudahkan proses destilasi agar merata
baik di bagian permukaan dari dinding pemanas internal dan mengontrol
ketebalan lapisan tipis/layer bahan baku pada dinding. Berbagai macam kecepatan
wiper digunakan untuk memperoleh pasokan bahan baku yang paling efisien pada
permukaan destilasi dan menjaga kestabilan permukaan. Lapisan tipis bahan
menjadi tidak stabil (noise) ketika wiper berputar terlalu cepat (Jiang, 2006). e. Interaksi Antar faktor
Intaraksi antar faktor penelitian terdapat pada Gambar 13 – Gambar 15.
Berdasarkan hasil uji Anova, tidak ditemukannya interaksi antar faktor secara
signifikan.
Interaksi antara Laju Alir Bahan dan Suhu Destilasi
Gambar 13 menunjukkan plot kontur interaksi antara laju alir bahan dan suhu
destilasi. Arah lintasan dakian tercuram dimulai pada titik (A, B, C=0) dengan
persamaan yang baru sebagai berikut:
Persamaan 9 diatas dapat diterangkan bahwa A merupakan representasi dari
laju alir bahan dan B merupakan representasi dari suhu destilasi. Berdasarkan
persamaan 9 diatas dapat diketahui koefisien A dan A2, bernilai negatif yang
artinya mempunyai tren data negatif (menurun). Sedangkan koefisien B, AB, dan
B2 memiliki koefisien persamaan positif artinya memiliki tren data positif (naik).
Naik dan turunnya faktor pada dakian ini bergerak melewati titik C ( kecepatan
putar wiper) terkodekan = 0 atau faktor aktual pada 300 rpm.
ed value
Gambar 13. Interaksi antara Suhu Destilasi dan Laju Alir Bahan Pada Rekoveri Tokoferol.
Intaraksi antara Laju Alir Bahan dan Kecepatan Putar Wiper
Gambar 14 menunjukkan plot kontur interaksi antara laju alir bahan dan
Kecepatan putar wiper.
d value
Arah lintasan dakian tercuram dimulai pada titik (A, B=0, C) dengan
persamaan yang baru sebagai berikut:
1/Sqrt(Rekoveri Tokoferol ) = 0,38 + 0,068 A - 0,015 C + 0,044 AC - 0,010 A2 - 0,033 C2...(10)
Berdasarkan persamaan 10 diatas, koefisien A, C, A2 dan C2 semuanya bersifat
negatif, artinya tren data rekoveri tokoferol semakin menurun dengan
bertambahnya kecepatan laju alir dan kecepatan putar wiper.
Interaksi antara Suhu Destilasi dan Kecepatan Putar Wiper
Gambar 15 menunjukkan plot kontur interaksi antara suhu destilasi dan
kecepatan putar wiper. Arah lintasan dakian tercuram dimulai pada titik (A=0, B,
C) dengan persamaan yang baru sebagai berikut:
1/Sqrt(Rekoveri Tokoferol ) = 0,38 - 0,17 B - 0,015 C + 0,050 BC + 0,051 B2 - 0,033 C2...(11)
Berdasarkan Persamaan 11 diatas dapat diketahui koefisien B dan B2, bernilai
positif yang artinya mempunyai tren data positif (naik). Sedangkan koefisien C,
BC, dan C2 memiliki koefisien persamaan negatif artinya memiliki tren data
negatif (menurun). Naik dan turunnya faktor pada dakian ini bergerak melewati
titik A ( Laju alir bahan) terkodekan = 0 atau faktor aktual pada 2 liter/jam.
d value
f. Prediksi Nilai Faktor Untuk Mendapatkan Hasil Rekoveri Optimal
Optimasi dari faktor laju alir bahan, suhu destilasi, dan kecepatan putaran wiper
menggunakan kreteria seperti pada Tabel 9.
Tabel 9. Batasan Optimalisasi Rekoveri Tokoferol Menggunakan Program Design-Expert DX 7.1.1
Nama Tujuan Batas Bawah Batas Atas
Laju Alir Bahan Dalam batas 1,3 2,7
Suhu Destilasi Dalam batas 175 220
Kecepatan Putar Wiper Dalam batas 200 400
1/Sqrt(Rekoveri Tokoferol ) Minimal 0,14 0,75
Tabel 9 menunjukkan kreteria dan batas dalam mengoptimalisasi respon
rekoveri tokoferol dalam batasan laju alir, suhu destilasi dan kecepatan wiper alat
destilasi molekuler.
Hasil komputasi menunjukkan terdapat 26 solusi untuk mengoptimalkan
faktor yang diurutkan berdasarkan tingkat Desirability. Lima nilai dengan
desirability teratas adalah:
Tabel 10. Solusi Hasil Komputasi Nilai Optimal Rekoveri Tokoferol Dengan
Menggunakan Program Design Expert 7.1.1.
No Laju Alir
Gazper (1992), mendeskripsikan bahwa suatu metode multirespon dinamakan
desirability (atau disarankan pada Tabel 10). D(X), dinamakan fungsi desirability. Fungsi tersebut mencerminkan bentangan yang diinginkan untuk masing-masing
simultan adalah suatu rata-rata geometrik semua respon yang telah ditranformasi
dalam bentuk persamaan berikut:
dimana n adalah banyaknya respon yang diukur. Kalau beberapa respon atau
faktor jatuh diluar jangkauan nilai desirability maka fungsi menjadi nol. Tabel 10 menunjukkan bahwa ada 5 solusi yang mempunyai nilai desirability tinggi, untuk itu maka dipilih nilai rekoveri yang paling tinggi yaitu solusi pertama. Hasil
selengkapnya dapat dilihat pada Lampiran 9.
Respon permukaan dan plot kontour untuk tingkat rekoveri yang diperoleh
oleh kecepatan laju alir, suhu destilasi dan kecepatan putaran wiper setelah proses
optimalisasi dengan nilai desirability tertinggi (solusi 1) dapat dilihat pada
Gambar 16.
Gambar 16. Permukaan Respon dan Plot Kontour Tingkat Rekoveri Tokoferol Optimal yang Dihasilkan pada Kecepatan Putaran Wiper 400 rpm.
Model optimum yang dihasilkan pada faktor aktual adalah sebagai berikut;
1/Sqrt(Rekoveri Tokoferol ) = 6,20518 + 0,38003 Laju Alir Bahan 0,050045 Suhu Destilasi -3,78973E-003 Kecepatan Putar Wiper - 1,96284E-003 Laju Alir Bahan x Suhu Destilasi + 6,21716E-004 Laju Alir Bahan x Kecepatan Putar Wiper + 2,21318E-005 Suhu Destilasi x Kecepatan Putar Wiper - 0,020446 Laju Alir Bahan2 + 1,00189E-004 Suhu Destilasi2 - 3,28939E-006 Kecepatan Putar Wiper2....(13)
Prediksi optimum dengan menggunakan model ini sesuai dengan solusi 1