iii
UIN Syarif Hidayatullah Jakarta
HALAMAN PERNYATAAN ORISINALITAS
Skripsi ini adalah hasil karya saya sendiri,
dan semua sumber baik yang dikutip maupun dirujuk
telah saya nyatakan dengan benar.
Nama : Ummi Habibah
NIM : 1112102000055
Tanda Tangan :
ABSTRAK
Nama : Ummi Habibah
Program Studi : Farmasi
Judul : Analisis Cemaran Bakteri Coliform dan Identifikasi Escherichia coli pada Air Minum Isi Ulang (AMIU) Depot di Kelurahan Pondok Cabe Ilir Kota Tangerang Selatan Tahun 2016
Air minum merupakan kebutuhan pokok bagi manusia, akan tetapi ketersediaan air bersih kini sulit didapatkan, oleh karena itu masyarakat beralih mengonsumsi Air Minum Isi Ulang (AMIU). Tujuan dari penelitian ini yaitu untuk mengetahui kualitas mikrobiologi Air Minum Isi Ulang (AMIU) yang diperoleh dari depot di Kelurahan Pondok Cabe Ilir. Sampel tersebut dianalisis kualitas mikrobiologinya berdasarkan Permenkes RI No. 492/Menkes/Per/IV/2010. Kualitas mikrobiologi ini terdiri dari total Coliform dan Escherichia coli, Air Minum Isi Ulang tidak diperbolehkan mengandung aspek tersebut lebih dari 0/100 mL. Metode yang digunakan untuk mengetahui total Coliform pada sampel yaitu metode Angka Paling Mungkin (APM) yang dilakukan berdasarkan SNI 01-2897-1992 dan identifikasi Escherichia coli menggunakan uji IMViC, uji Triple Sugar Iron, uji produksi H2S, dan uji
motilitas. Satu dari 5 sampel mengandung bakteri Coliform dengan nilai 4 Coliform/mL sampel dan 1 dari 5 sampel mengandung bakteri Escherichia coli. Kesimpulan dari penelitian ini yaitu 1 dari 5 sampel mengandung Colifrom dan Escherichia coli melebihi batas yang dipersyaratkan Permenkes RI No. 492/Menkes/Per/IV/2010.
vii
UIN Syarif Hidayatullah Jakarta
ABSTRACT
Name : Ummi Habibah
Program Study : Pharmacy
Title : Analysis of Coliform Bacteria Contamination and Identification of Escherichia coli in Refilled Drinking Water (AMIU) Stations in Pondok Cabe Ilir South Tangerang City 2016
Water is basic necessity for human life, but nowadays clean water is getting hard to get, so people prefer to consume refilled drinking water. The aim of this study is to investigate the microbial quality of refilled drinking water from stations in Pondok Cabe Ilir based on Permenkes RI No. 492/Menkes/Per/IV/2010. The microbial quality consist of total Coliform and Escherichia coli. Refilled drinking water is not allowed to contain both of these aspects more than 0/100 mL. Method that use to determined total Coliform based on SNI 01-2897-1992 is Most Probable Number (MPN) method and IMViC test, Triple Sugar Iron test, H2S production test, and motility test for Escherichia coli
identification. One of 5 samples was contains Coliform bacteria (4 Coliform/mL) and 1 of 5 samples contains Escherichia coli. The conclusion is one of five samples of refilled drinking water contains Coliform bacteria above the limit number according to Permenkes RI No. 492/Menkes/Per/IV/2010.
KATA PENGANTAR
Alhamdulillah puji syukur penulis panjatkan kepada Allah SWT karena atas
berkat dan rahmat-Nya penulis dapat menyelesaikan skripsi ini. Penulisan skripsi ini
dilakukan dalam rangka memenuhi salah satu syarat untuk memperoleh gelar Sarjana
Farmasi pada Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam negeri
(UIN) Syarif Hidayatullah Jakarta.
Saya menyadari bahwa tanpa bantuan dan bimbingan dari berbagai pihak, dari
masa perkuliahan hingga pada penyusunan skripsi ini, sangatlah sulit bagi penulis
untuk menyelesaikan skripsi ini. Oleh karena itu, saya mengucapkan terima kasih
kepada:
1. Puteri Amelia M.Farm., Apt selaku pembimbing pertama dan Ofa Suzanti Betha M.Si., Apt selaku pembimbing kedua yang telah memberikan ilmu, waktu, tenaga, nasihat, serta arahan sejak proposal skripsi, penelitian hingga penulisan skripsi. Semoga segala bantuan dan bimbingan ibu mendapat imbalan dari Nya, Aamiin
2. Dr. H. Arif Sumantri, SKM., M.Kes selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah
Jakarta
3. Dr. Nurmeilis M.Si., Apt selaku Ketua Program Studi Farmasi dan Ibu Nelly Suryani, PhD., Apt selaku Sekretaris Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta
4. Supandi, M.Si., Apt selaku Dosen Penasihat Akademik
5. Bapak dan Ibu staf pengajar dan karyawan yang telah memberikan bimbingan dan bantuan selama penulis menempuh pendidikan di Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta
ix
UIN Syarif Hidayatullah Jakarta
7. Nur Aeni Hidayah, MMSI selaku kepala PLT UIN Jakarta yang telah memberikan izin penelitian dan Chris Adhiyanto, M.Biomed., Ph.D selaku kepala STP labotarorium Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta
8. Laboran Laboratorium Mikrobiologi PLT UIN, mbak Puji, kak Amal, mbak Festy yang bersedia dengan senang hati membantu penulis pada masa penelitian
9. Kepada pemilik usaha dan karyawan Depot Air Minum Isi Ulang yang telah memberikan izin penelitian dan membantu penulis dalam menyelesaikan tugasnya
10.Kedua orang tua tercinta, Ayahanda Suroso, S.Pd, ibunda Tri Murdani yang telah memberikan dukungan baik moril maupun materil
11.Adik tercinta, Ahmad Nurodin yang telah memberikan semangat
12.Thomas Alfa yang selalu menemani penulis sejak penulisan proposal hingga skripsi
13.Sahabat tersayang Addina, Fika, dan Santi serta Laila partner Coliform yang telah memberikan semangat dan selalu membantu penulis sejak proposal hingga skripsi
14.Sahabat SMA yang berkuliah di berbagai Universitas namun tetap memberikan semangatnya, Fitri, Nur, Mia, Dede, Rinta, Ratna, Sita, Ninis, Anna.
15.Semua pihak yang telah membantu penulis selama proposal, penelitian, hingga penulisan skripsi yang tidak dapat disebutkan satu per satu.
Semoga semua bantuan yang telah diberikan mendapatkan balasan dari Allah
SWT. Penulis menyadari bahwa masih banyak kekurangan dalam penulisan skripsi
ini, oleh karenanya kritik dan saran sangat diharapkan demi perbaikan skripsi ini.
Semoga skripsi ini membawa manfaat bagi pengembangan ilmu pengetahuan.
Ciputat, Juli 2016
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI TUGAS AKHIR UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademik Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta, saya yang bertanda tangan di bawah ini:
Nama : Ummi Habibah
NIM : 1112102000055
Program Studi : Farmasi
Fakultas : Kedokteran dan Ilmu Kesehatan Jenis karya : Skripsi
demi perkembangan ilmu pengetahuan, saya menyetujui skripsi/karya ilmiah saya, dengan judul :
Analisis Cemaran Bakteri Coliform dan Identifikasi Escherichia coli pada Air Minum Isi Ulang (AMIU) Depot di Kelurahan Pondok Cabe Ilir Kota
Tangerang Selatan Tahun 2016
untuk dipublikasikan atau ditampilkan di internet atau media lain yaitu Digital Library Perpustakaan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta untuk kepentingan akademik sebatas sesuai dengan Undang-Undang Hak Cipta.
Demikian pernyataan persetujuan publikasi karya ilmiah ini saya buat dengan sebenarnya.
Dibuat di : Jakarta Pada Tanggal : Juli 2016
Yang menyatakan,
xi
UIN Syarif Hidayatullah Jakarta
DAFTAR ISI
Halaman
HALAMAN PERNYATAAN ORISINALITAS ... III HALAMAN PERSETUJUAN PEMBIMBING ... ERROR! BOOKMARK NOT DEFINED.
HALAMAN PENGESAHAN...V ABSTRAK ... V
ABSTRACT ... VII KATA PENGANTAR ... VIII HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI... X DAFTAR ISI...XI
BAB I PENDAHULUAN
1.1. Latar Belakang ... 1
1.2. Rumusan Masalah ... 2
1.3. Tujuan Penelitian ... 3
1.4. Manfaat Penelitian ... 3
BAB II TINJAUAN PUSTAKA 1.1.Depot Air Minum Isi Ulang (DAMIU) ... 4
1.1.1. Syarat Depot Air Minum Isi Ulang (DAMIU) ... 4
1.1.2. Definisi Air Minum Isi Ulang (AMIU) ... 4
1.1.3. Syarat Air Minum Isi Ulang (AMIU) ... 5
1.2. Bakteri Coliform ... 5
1.3. Escherichia coli ... 7
1.4. Media Pertumbuhan ... 8
1.4.1. Media Lactose Broth (LB) ... 9
1.4.2. Media Brilliant Green Lactose Bile Broth 2% (BGLB 2%) ... 9
1.4.3. Media Escherichia coli Broth (E.C Broth) ... 9
1.4.4. Media Eosin Methylene Blue Agar (EMBA) ... 10
1.4.5. Media Nutrient Agar (NA) ... 10
1.4.6. Media Sulfide-Indole-Motility (SIM) ... 10
1.4.7. Media Methyl Red-Voges Proskauer (MR-VP) ... 11
1.4.8. Media Simon Sitrat ... 11
1.4.9. Media Triple Sugar Iron Agar (TSIA) ... 11
1.5. Analisis Mikrobiologi Air ... 12
1.5.1. Metode Angka Paling Mungkin (APM) ... 12
1.5.1.1.Uji Sangkaan ... 13
1.5.1.2.Uji Penegasan (Confirmed Test) ... 13
1.5.2. Identifikasi Bakteri Escherichia coli ... 14
2.2. Alat dan Bahan ... 20
2.2.1. Alat ... 20
2.2.2. Bahan ... 20
2.3. Prosedur Kerja ... 20
2.3.1. Pengambilan Sampel ... 20
2.3.2. Metode Sangkaan (SNI 01-2897-1992) ... 21
2.3.3. Uji Penegesan (Confirmed Test) (SNI 01-2897-1992) ... 21
2.3.4. Identifikasi Bakteri Escherichia coli (SNI 01-2897-1992) ... 21
BAB IV HASIL DAN PEMBAHASAN 4.1 Pengumpulan Sampel Dan Pengamatan Depot Air Minum Isi Ulang ... 24
4.2. Hasil Uji Sangkaan ... 30
4.3. Hasil Uji Penegasan ... 32
4.4. Hasil Uji Identifikasi Escherichia coli ... 36
BAB V PENUTUP 5.1 Kesimpulan...51
5.2 Saran...51
DAFTAR PUSTAKA ... 52
xiii
UIN Syarif Hidayatullah Jakarta
DAFTAR GAMBAR
Halaman Gambar 2.1 Escherichia coli... Gambar 2.2 Metode MPN/ APM... Gambar 2.3 Metode Streak plate... Gambar 2.4 Koloni Escherichia coli pada media EMBA... Gambar 4.1 Peta lokasi sampling air minum isi ulang... Gambar 4.2 Hasil uji penegasan... Gambar 4.3 Hasil uji identifikasi pada media E.C broth... Gambar 4.4 Hasil uji identifikasi pada media Eosin Methylene Blue Agar... Gambar 4.5 Hasil pewarnaan Gram ... Gambar 4.6 Hasil uji indol... Gambar 4.7 Reaksi oksidasi triptofan... Gambar 4.8 Hasil uji merah metil... Gambar 4.9 Hasil uji voges proskauer... Gambar 4.10 Hasil uji sitrat... Gambar 4.11 Hasil uji TSI... Gambar 4.12Hasil uji produksi H2S...
DAFTAR TABEL
Halaman Tabel 2.1 Distribusi genus coliform...
Tabel 2.2 Hasil Uji Triple Sugar Iron dan Interpretasinya ... Tabel 3.1 Hasil Uji Positif Escherichia coli ... Tabel 4.1 Pengamatan DAMIU... Tabel 4.2 Hasil uji sangkaan masa inkubasi 24 jam... Tabel 4.3 Hasil uji sangkaan masa inkubasi 48 jam... Tabel 4.4 Nilai APM/mL setiap sampel air minum isi ulang ... Tabel 4.5 Hasil Uji IMViC Sampel D2... Tabel 4.6 Uji keseluruhan sampel...
xv
UIN Syarif Hidayatullah Jakarta
DAFTAR LAMPIRAN
Halaman Lampiran 1 Sertifikat analisis...
Lampiran 2 Bagan alur penelitian... Lampiran 3 Pembuatan media pertumbuhan... Lampiran 4 Bagan prosedur kerja uji sangkaan... Lampiran 5 Bagan prosedur kerja uji penegasan... Lampiran 6 Bagan prosedur kerja uji identifikasi... Lampiran 7 Bagan pewarnaan Gram... Lampiran 8 Bagan uji IMViC... Lampiran 9 Bagan prosedur kerja uji TSI... Lampiran 10 Tabel APM menggunakan 3 tabung... Lampiran 11 Hasil uji sangkaan... Lampiran 12 Persyaratan kualitas air minum...
BAB I PENDAHULUAN
1.1. Latar Belakang
Air merupakan kebutuhan pokok bagi manusia. Permintaan air dipengaruhi oleh pertumbuhan populasi, urbanisasi, peraturan jaminan makanan, dan proses ekonomi seperti perdagangan global dan perubahan pola konsumsi (UNESCO, 2015). Menurut Permendagri standar kebutuhan pokok air minum Nomor 23 Tahun 2006 yaitu sebanyak 10 m3 per kepala keluarga per bulan atau 60 L per orang per hari. Hal ini menunjukkan bahwa semakin banyak jumlah penduduk maka semakin besar permintaan terhadap air.
Air harus mampu tersedia dalam jumlah yang cukup dan aman untuk semua penduduk. Akan tetapi pada kenyataannya, menurut WHO tahun 2000, sebanyak 2,5 milyar penduduk dunia tidak memiliki akses untuk memperoleh sanitasi. Sanitasi, perilaku kebersihan yang buruk dan air minum yang tidak aman mengakibatkan 88% kematian pada anak-anak karena diare di seluruh dunia. Lebih dari 1,5 juta anak-anak meninggal setiap tahunnya dikarenakan diare Kematian yang disebabkan karena penyakit yang ditimbulkan karena air yaitu lebih dari 5 juta orang per tahun dan 5%-nya merupakan infeksi mikroba saluran pencernaan (WHO, 2000). Sedangkan di Indonesia, diare menjadi penyebab 31% kematian anak usia 1 bulan hingga 1 tahun dan 25% kematian pada anak usia 1 hingga 4 tahun (Kemenkes RI, 2008) dan lima provinsi dengan angka insiden diare tertinggi salah satunya yaitu Banten sebesar 8,0% (Kemenkes RI, 2013). Menurut data 10 kasus penyakit terbanyak pasien rawat inap di RSU Kota Tangerang Selatan, diare menempati peringkat 9 dengan jumlah kasus 92 (BPS Kota Tangerang Selatan, 2015).
UIN Syarif Hidayatullah Jakarta
memiliki jarak 10 m dari septik tank. Apabila septik tank jarang disedot maka kotoran akan merembes ke tanah dan air tanah di sekitarnya.
Depot air minum isi ulang telah banyak beredar di Kota Tangerang Selatan yaitu sebanyak 283 unit di tahun 2012 akan tetapi hadirnya depot kurang diimbangi dengan perizinan, pembinaan, pengawasan, dan peredarannya yang kemudian menyebabkan rendahnya jaminan kualitas air minum karena dapat terjadi kontaminasi mikroba patogen akibat penanganan dan pengolahan yang kurang baik (Dinkes Kota Tangerang Selatan, 2013; Mirza, 2014; Radji et al., 2008). Hal ini terbukti pada bulan Juli 2013 telah dilaporkan bahwa sekitar 40% dari depot air minum isi ulang yang berada di wilayah Jabodetabek tercemar bakteri (Tempo.com, 2013). Kasus lain di tahun 2014 terjadi di Desa Durian, Kabupaten Serdang dimana 4 orang tewas dan 100 warga lainnya mengalami muntah dan diare akibat mengonsumsi air minum isi ulang yang diduga tercemar Escherichia coli (Tempo.co.id, 2015).
Penelitian sebelumnya telah dilakukan dengan menganalisis cemaran Coliform dan Escherichia coli pada air isi ulang depot di Manado dan hasilnya menunjukkan bahwa air minum isi ulang tersebut tidak memenuhi syarat karena positif mengandung Coliform dan beberapa sampel mengandung E.coli (Bambang, Adrian G et al. 2014). Selain itu, penelitian serupa juga dilakukan dengan menganalisis bakteri Coliform (fekal dan non fekal) sebagai indikator sungai Gajah Wong di Daerah Istimewa Yogyakarta dan hasilnya ditemukan bakteri Coliform salah satunya yaitu Escherichia coli yang terdapat di daerah hulu, tengah, dan hilir sungai (Aqielatunnisa’, 2015).
Dari uraian diatas maka peneliti tertarik untuk melakukan analisis cemaran Coliform dan Escherichia coli pada Air Isi Ulang (AMIU) depot di Kelurahan Pondok Cabe Ilir, Kecamatan Pamulang, Kota Tangerang Selatan.
1.2. Rumusan Masalah
1.3. Tujuan Penelitian
Untuk mengetahui cemaran bakteri Coliform dan Escherichia coli pada Air Minum Isi Ulang Depot di Kelurahan Pondok Cabe Ilir Kota Tangerang Selatan Tahun 2016.
1.4. Manfaat Penelitian
1. Sebagai bahan evaluasi bagi pengusaha depot Air Minum Isi Ulang (AMIU) dan bagi Dinas Kesehatan setempat
4
UIN Syarif Hidayatullah Jakarta
BAB II
TINJAUAN PUSTAKA
1.1. Depot Air Minum Isi Ulang (DAMIU)
Menurut Keputusan Menteri Perindustrian dan Perdagangan Republik Indonesia Nomor 651/MPP/Kep/10/2004, depot air minum merupakan suatu usaha industri yang melakukan proses pengolahan air baku menjadi air minum dan menjualnya secara langsung kepada masyarakat (Merindag, 2004).
1.1.1. Syarat Depot Air Minum Isi Ulang (DAMIU)
Menurut Keputusan Menteri Perindustrian dan Perdagangan Republik Indonesia Nomor 651/MPP/Kep/10/2004 tentang persyaratan teknis depot air minum dan perdagangannya depot air minum isi ulang memiliki syarat sebagai berikut (Indirawati, 2009):
1. Memiliki ruang proses pengolahan, ruang tempat penyimpanan, ruang tempat pembagian/tempat penyediaan, dan ruang tunggu pengunjung;
2. Lantai dan dinding bangunan depot harus terbuat dari bahan kedap air, permukaan rata, halus tapi tidak licin, tidak menyerap debu, mudah dibersihkan, bersih dan tidak berdebu, dan untuk dinding bangunan harus terang dan cerah serta tidak ada pakaian tergantung;
3. Atap bangunan menutup seluruh bangunan depot, bahan atap tahan terhadap air dan tidak bocor, konstruksi atap dan langit-langit dibuat anti tikus, bahan atap harus kuat, tahan lama dan mudah dibersihkan serta tidak menyerap debu; 4. Tinggi ruangan minimal 3 meter dari lantai, mempunyai ventilasi udara, dan
mengatur posisi ventilasi udara;
5. Proses pencucian dan desinfeksi botol disediakan oleh pengusaha DAMIU. Setiap wadah yang telah diisi ditutup dengan penutup wadah yang steril.
1.1.2. Definisi Air Minum Isi Ulang (AMIU)
air minum isi ulang yaitu air permukaan, air sumur dalam, mata air, dan air dari Perusahaan Daerah Air Minum/ PDAM (BPOM, 2003).
1.1.3. Syarat Air Minum Isi Ulang (AMIU)
Pengawasan kualitas air minum menurut Permenkes RI No. 736/Menkes/Per/IV/2010 yaitu:
a. Inspeksi sanitasi dilakukan dengan cara pengamatan dan penilaian kualitas fisik air minum dan faktor risikonya;
b. Pengambilan sampel air minum dilakukan berdasarkan hasil inspeksi sanitasi; c. Pengujian kualitas air minum dilakukan di laboratorium terakreditasi;
d. Analisis hasil pengujian laboratorium;
e. Rekomendasi untuk pelaksanaan tindak lanjut; f. Pemantauan pelaksanaan tindak lanjut.
Syarat yang harus dipenuhi oleh air minum isi ulang harus sesuai dengan Permenkes RI No.492/Menkes/Per/IV/2010 tentang Persyaratan Kualitas Air Minum. Parameter yang dipersyaratkan terdiri dari 2 parameter, parameter wajib dan tambahan. Pada parameter wajib tercantum parameter yang berhubungan langsung dengan kesehatan yang didalamnya terdapat syarat parameter mikrobiologi yaitu Escherichia coli dan total bakteri Coliform dengan kadar maksimum yang diperbolehkan yaitu 0/100 mL sampel (Menkes, 2010). Menurut Farmakope Indonesia IV, bakteri yang perlu dilakukan uji batas mikroba yaitu Staphylococcus aureus, Pseudomonas aeruginosa, Salmonella sp, dan Escherichia coli (Depkes RI, 2010).
1.2. Bakteri Coliform
UIN Syarif Hidayatullah Jakarta
Bakteri indikator polusi fekal harus memenuhi kriteria sebagai berikut (Cabral, 2010):
1. Terdapat pada saluran pencernaan manusia dan feses dalam jumlah yang banyak;
2. Tidak patogenik terhadap manusia;
3. Dapat dideteksi dengan mudah, murah, dan dapat dipercaya;
4. Bakteri indikator harus ada dalam jumlah yang besar daripada bakteri patogen; 5. Bakteri indikator sebaiknya memiliki perilaku die-off seperti bakteri patogen
Bakteri Coliform dibedakan menjadi 2 jenis, yaitu Coliform fekal seperti Escherichia coli dan Coliform non fekal seperti Enterobacter aerogenes (Widyanti dan Ristiati, 2004). Coliform fekal terdapat pada feses manusia dan hewan berdarah panas dalam jumlah yang besar (Stevens, 2003) sedangkan Coliform non fekal ditemukan pada hewan atau tumbuhan yang telah mati (Ferdiaz, 1993 dalam Widyanti dan Ristiati, 2004). Ketiadaan Coliform secara umum dapat dikatakan bahwa air minum tersebut aman dari bakteri patogen, seperti Vibrio cholerae, S.typhi, dan Salmonella. Oleh karena itu, Coliform dijadikan sebagai bakteri indikator kualitas air (Lund, et al., 2000).
Kontaminasi Coliform dapat disebabkan karena pencemaran pada air baku, jenis peralatan yang digunakan, sanitasi prosedur produksi (GMP) yang buruk, kurangnya pengetahuan tentang higienitas dan sanitasi, hilangnya pelindung wadah bersegel sehingga terjadi kontaminasi setelah air minum diproduksi, lamanya waktu penyimpanan air dalam tempat penampungan, adanya kontaminasi selama memasukkan air ke dalam tangki pengangkutan, tempat penampungan kurang bersih, kontaminasi dari galon yang tidak disterilisasi, dan tidak dilakukannya uji secara berkala untuk memeriksakan kelayakan produksi air minum isi ulang (Indirawati, 2009; Lund, et al., 2000; Natalia et al., 2014).
Anggota kelompok Coliform memiliki ciri sebagai berikut:
2. Aerob dan anaerob fakultatif, Gram negatif, tidak membentuk spora, berbentuk batang yang berkembang membentuk koloni berwarna merah dengan kilap seperti logam setelah 24 jam pada suhu 35ºC dalam medium yang mengandung laktosa (Rompre, et al., 2002).
Tabel 2.1 Distribusi genus Coliform pada feses hewan dan manusia
Sampel
% Total Coliform
Referensi Escherichia
coli Klebsiella spp.
Enterobacter/
Citrobacter spp
Feses
manusia
96,8 1,5 1,7 Dofour (1977)
94,1 5,9 Allen and Edberg
(1995)
Feses
hewan
94 2 4 Dofour (1977)
92,6 7,4 Allen and Edberg
(1995)
Sumber: Review of Coliforms as Microbial Indicators of Drinking Water Quality
Genus yang paling umum menjadi perhatian di dalam kelompok Coliform yaitu Enterobacter, Klebsiella, Citrobacter, dan Escherichia terutama Escherichia coli, Hafnia alvei, Buttiauxella, Leclercia, Pantoea, Serratia, Yersinia (Stevens. 2003).
1.3. Escherichia coli
Taksonomi (Migula, 1985 dalam itis) Kingdom : Bacteria
Subkingdom : Negibacteria Divisi : Proteobacteria
Kelas : Gammaproteobacteria Ordo : Enterobacteriales Famili : Enterobacteriaceae Genus : Escherichia
UIN Syarif Hidayatullah Jakarta
Escherichia coli merupakan bakteri Gram negatif, berbentuk batang, berukuran 1 hingga 3 mikron namun umumnya berukuran 0,5 mikron, tidak membentuk spora, kebanyakan bersifat motil dengan menggunakan flagela akan tetapi ada pula yang tidak motil, ada yang mempunyai kapsul tetapi biasanya tidak berkapsul, memfermentasi glukosa dan laktosa dengan memproduksi asam dan gas dalam waktu 48 jam, tidak mampu memanfaatkan asam urat sebagai sumber nitrogen, tidak memanfaatkan asam sitrat dan garam asam sitrat sebagai sumber karbon, ada beberapa strain yang menghasilkan H2S, dan tidak memproduksi
asetilmetilkarbinol (Breed et al., 1957; Pelczar dan Chan, 2005)
Transmisi melalui rute fekal oral dimana makanan atau air terkontaminasi. Escherichia coli adalah bakteri kolon manusia yang merupakan flora normal. Akan tetapi, serotype patogen dapat menginduksi diare dengan berbagai cara, seperti Enterotoxigenic Escherichia coli (ETEC) yang dapat menyebabkan penyakit traveler’s diarrhea dan Enteropathogenic Escherichia coli (EPEC) yang berperan dalam penyakit diare pada bayi. Escherichia coli merupakan bakteri penyebab infeksi saluran kemih paling umum dan sekitar 90% infeksi saluran kemih pertama pada wanita muda (Pommerville, 2010; Jawetz, 2013).
Gambar 2.1 Escherichia coli perbesaran 1000x
Sumber: Dokumen pribadi
1.4. Media Pertumbuhan
berkembangbiak (Hidayat dan Sutarma, 1999). Zat-zat makanan atau nutrisi yang dibutuhkan untuk tumbuh dibedakan menjadi 2 macam, yaitu makroelemen dan mikroelemen.
Makroelemen merupakan nutrisi yang dibutuhkan oleh mikroorganisme dalam jumlah yang besar, seperti karbon (C), hidrogen (H), oksigen (O), nitrogen (N), sulfur (S), fosfor (P) yang diperlukan untuk membentuk karbohidrat, lemak, protein, dan asam nukleat, kalium (K), magnesium (Mg), kalsium (Ca) berperan sebagai kation dalam sel dan besi (Fe). Mikroelemen merupakan nutrisi yang dibutuhkan dalam jumlah kecil, seperti mangan (Mn), zinc (Zn), kobalt (Co), molibdenum (Mo), nikel (Ni), dan tembaga (Cu) (Pratiwi, 2008).
1.4.1. Media Lactose Broth (LB)
Media Lactose Broth (LB) merupakan medium yang direkomendasikan untuk digunakan dalam prosedur kualitatif dalam mendeteksi Coliform pada air, makanan, dan produk susu. Komposisi media Lactose Broth yaitu bubuk Lab-Lemco, pepton, dan laktosa dengan pH akhir 6,9 ± 0,2 pada suhu 25ºC (Oxoid, 2015).
1.4.2. Media Brilliant Green Lactose Bile Broth 2% (BGLB 2%)
Media Brilliant Green Lactose Bile Broth 2% (BGLB 2%) merupakan media selektif untuk mendapatkan bakteri dari kelompok coli-aerogenes. Komposisi media Brilliant Green Lactose Bile Broth 2% (BGLB 2%) yaitu pepton, laktosa, empedu, dan brilliant green. Media ini mampu menghambat pertumbuhan bakteri Gram positif karena adanya empedu dan brilliant green. Laktosa pada media ini akan difermentasi oleh bakeri kelompok coli-aerogenes yang kemudian membentuk gas. Untuk mendeteksi adanya Escherichia coli, media diinkubasi pada suhu 44±1ºC selama 48 jam (Oxoid, 2015).
1.4.3. Media Escherichia coli Broth (E.C Broth)
UIN Syarif Hidayatullah Jakarta
media ini berfungsi sebagai sumber karbon, garam empedu berfungsi sebagai agen selektif menghambat bakteri gram positif, terutama streptococcus fekal dan basilus (Acumedia, 2015).
1.4.4. Media Eosin Methylene Blue Agar (EMBA)
Media Eosin Methylene Blue Agar (EMBA) merupakan media selektif yang digunakan untuk mengisolasi bakteri Gram negatif yang berbentuk batang pada beragam jenis spesimen. Komposisi media Eosin Methylene Blue Agar yaitu pepton, laktosa, kalium hidrogen fosfat, eosin Y, methylene blue, dan agar dengan pH akhir 6,8 ± 0,2 pada suhu 25ºC (Oxoid, 2015). Eosin Y dan methylene blue menghambat pertumbuhan bakteri Gram positif dan dalam suasana asam juga memproduksi kompleks ungu tua yang biasanya disertai dengan kilap logam berawarna hijau. Kilap logam bewarna hijau merupakan indikator telah terjadinya fermentasi laktosa dan/ atau sukrosa oleh Coliform fekal (Leboffe dan Pierce, 2010).
1.4.5. Media Nutrient Agar (NA)
Media Nutrient Agar merupakan media dasar yang digunakan untuk memanen berbagai jenis bakteri dan untuk enumerasi organisme yang terdapat pada sampel air, limbah, feses, dan bahan lain. Komposisi media Nutrient Agar yaitu pepton, natrium klorida, ekstrak ragi, ekstrak daging sapi, dan agar dengan pH akhir 7,4 ± 0,2 pada suhu 25ºC (Atlas, 2010).
1.4.6. Media Sulfide-Indole-Motility (SIM)
Media Sulfide-Indole-Motility (SIM) merupakan media yang digunakan untuk membedakan anggota Enterobacteriaceae berdasarkan kemampuannya dalam memproduksi H2S, indol, dan berdasarkan pergerakan atau motilitas. Media
1.4.7. Media Methyl Red-Voges Proskauer (MR-VP)
Media Methyl Red-Voges Proskauer (MR-VP) merupakan media yang dikenal juga dengan nama Glucose Phophate Broth. Media ini digunakan untuk membedakan bakteri yang didasarkan pada produksi asam pada uji metil merah dan produksi asetoin pada uji Voges Proskauer (Atlas, 2010). Komposisi media Metil Red-Voges Proskauer (MR-VP) yaitu glukosa, pepton, dan dapar fosfat dengan pH akhir 6,9 ± 0,2 pada suhu 25ºC (Atlas, 2010; Leboffe dan Pierce, 2010).
1.4.8. Media Simon Sitrat
Media Simon Sitrat merupakan media yang digunakan untuk membedakan bakteri Enterobacteriaceae. Komposisi media Simon Sitrat yaitu natrium sitrat sebagai sumber karbon dan amonium fosfat sebagai sumber nitrogen, dengan pH akhir 6,8 ± 0,2 pada suhu 25ºC (Atlas, 2010; Himedia, 2011).
1.4.9. Media Triple Sugar Iron Agar (TSIA)
Komposisi Media Triple Sugar Iron Agar (TSIA) yaitu bubuk Lab-Lemco, ekstrak ragi, pepton, natrium klorida, laktosa, sukrosa, glukosa, besi sitrat, natrium tiosulfat, fenol merah, dan agar (Oxoid, 2015). Ekstrak ragi dan pepton merupakan sumber karbon dan nitrogen, natrium tiosulfat sebagai sumber untuk reduksi sulfur, fenol red sebagai pH indikator, dan besi sitrat sebagai indikator H2S (Leboffe dan Pierce, 2010). Media ini terdiri dari 3 karbohidrat yaitu laktosa,
sukrosa, dan glukosa yang bertujuan untuk meningkatkan sensitivitas medium dengan memfasilitasi deteksi bakteri yang memfermentasi sukrosa sebaik mendeteksi laktosa dan atau dekstrosa/ glukosa (Difco).
Media ini digunakan untuk membedakan bakteri Gram negatif berbentuk batang berdasarkan kemampuannya memfermentasi karbohidrat seperti laktosa, sukrosa, glukosa dan produksi H2S hasil dari reduksi sulfur. Bakteri yang
memfermentasi karbohidrat ditunjukkan dengan terjadinya perubahan warna medium karena pH indikator yaitu fenol merah dari merah menjadi kuning dan produksi H2S terlihat dengan terbentuknya endapan berwarna hitam pada dasar
UIN Syarif Hidayatullah Jakarta
dalam keadaan asam dan sebaliknya apabila media berwarna merah menandakan bahwa suasana basa. Produksi gas mengindikasikan bahwa telah terjadi pemecahan medium oleh bakteri.
1.5. Analisis Mikrobiologi Air
1.5.1. Metode Angka Paling Mungkin (APM)
Metode Angka Paling Mungkin (APM) atau Most Probable Number (MPN) atau dalam Farmakope IV disebut sebagai metode tabung ganda merupakan metode yang digunakan untuk memperkirakan mikroorganisme dalam jumlah yang sedikit, konsentrasi kecil, atau untuk bakteri yang tidak mampu tumbuh dengan baik pada media padat. Sampelnya dapat berupa susu, makanan, air, dan tanah. Perhitungan APM ini tidak memperhatikan jenis bakteri di dalam kelompok tersebut apakah termasuk ke dalam Coliform fekal atau pun Coliform non fekal (Suriwawiria. 2003).
Kelebihan metode Angka Paling Mungkin (Jay, 2000): 1. Sederhana;
2. Kelompok organisme yang spesifik dapat ditentukan dengan menggunakan media selektif dan diferensial yang cocok;
3. Metode ini merupakan pilihan untuk menentukan populasi Coliform fekal.
Kekurangan metode Angka Paling Mungkin (Suriawiria, 2003): 1. Hanya dapat menggunakan sedikit sampel air dalam satu kali analisis; 2. Untuk mendapatkan biakan yang baik dibutuhkan waktu beberapa hari; 3. Hanya didapatkan perkiraan jumlah Coliform secara kasar;
4. Membutuhkan banyak alat dan bahan;
Gambar 2.2 Metode APM
1.5.1.1. Uji Sangkaan
Uji sangkaan merupakan tes pandahuluan untuk melihat ada tidaknya kehadiran bakteri Coliform pada suatu sampel berdasarkan terbentuknya asam dan gas yang disebabkan karena fermentasi laktosa oleh bakteri kelompok Coliform. Uji ini dilakukan dengan cara menumbuhkan bakteri dalam media Lactose Broth (LB) dan diinkubasi selama hingga 48 jam. Hasil positif dan negatif didasarkan pada kekeruhan media dan terbentuk atau tidaknya gelembung pada tabung durham. Apabila media menjadi keruh dan terbentuk gelembung sebanyak paling tidak 10% dari volume tabung durham maka hasil positif dan sebaliknya apabila media tetap jernih dan tidak terbentuk gelembung maka hasilnya negatif (SNI, 1992; Widyanti dan Ristiati, 2014).
1.5.1.2. Uji Penegasan (Confirmed Test)
Konfirmasi hasil uji sangkaan perlu dilakukan karena pada uji sangkaan mungkin terdeteksi bakteri non Coliform yang bukan merupakan bakteri indikator polusi fekal (Kiiyukia, 2003). Tabung yang positif terbentuk asam dan gas pada uji sangkaan diinokulasi pada media Brilliant Green Lactose Bile Broth 2%
Pengenceran 100 Pengenceran 10-1 Pengenceran 10-2 Pengenceran 10-3 Dilakukan secara 3 replikasi atau 5 replikasi atau 10 replikasi Dilakukan secara 3 replikasi atau 5 replikasi atau 10 replikasi Dilakukan secara 3 replikasi atau 5 replikasi atau 10 replikasi
35ºC selama 18-24 jam kemudian lakukan pewarnaan Gram (Leboffe dan Pierce, 2011; SNI, 1992).
Gambar 2.4 Koloni Escherichia coli pada media EMBA berwarna kilap logam kehijauan
Sumber: Dokumen pribadi
Pada suasana asam, Eosin Methylene Blue Agar (EMBA) akan membentuk kompleks yang akan mengendapkan bakteri Coliform dan membentuk koloni berwarna kehijauan dengan bintik hitam di tengah koloni dan kilap logam. Reaksi ini merupakan karakteristik Escherichia coli (Kiiyukia, 2003). Kilap logam kehijauan ini sebagai indikator bakteri Coliform fekal yang memfermentasi laktosa dan/ atau sukrosa. Akan tetapi, pada beberapa strain Escherichia coli menunjukkan koloni berwarna hitam (Leboffe dan Pierce, 2011).
1.5.2.1. Pewarnaan Gram
Pewarnaan Gram merupakan metode yang dilakukan untuk membedakan spesies bakteri menjadi 2 kelompok besar yaitu bakteri Gram negatif dan Gram positif. Pewarnaan Gram dilakukan berdasarkan pada sifat fisika kimia dinding selnya.
UIN Syarif Hidayatullah Jakarta
menit. Dicuci kembali menggunakan air mengalir dan dikering anginkan. Sediaan dicuci dengan alkohol 96% selama 30 detik. Dicuci dengan air mengalir dan dikering anginkan. Sediaan diberi beberapa tetes safranin lalu biarkan selama 10-30 detik. Dicuci menggunakan air mengalir setelah itu dikering anginkan dan diserap dengan kertas saring kemudian diamati di bawah mikroskop (SNI, 1992).
Kemampuan untuk mencegah penghilangan warna bukan berdasarkan pada konstruksi dinding sel antara bakteri Gram positif dan bakteri Gram negatif. Dinding sel bakteri Gram negatif memiliki kandungan lipid yang lebih banyak dan memiliki lapisan peptidoglikan yang lebih tipis daripada dinding sel bakteri Gram positif (Leboffe dan Pierce, 2010).
Muatan positif kristal violet melewati dinding sel dan membran sel kemudian berikatan dengan komponen di dalam sel yang bermuatan negatif. Lugol ditambahkan untuk meningkatkan pewarnaan kristal violet dengan membentuk kompleks kristal violet-lugol. Kemudian dilakukan penghilangan warna dengan menggunakan alkohol. Pada bakteri Gram negatif, alkohol melarutkan lipid yang terdapat pada membran terluar bakteri Gram negatif dan meluruhkan kompleks kristal violet-lugol dari sel. Sedangkan pada bakteri Gram positif terjadi dehidrasi karena penetesan alkohol dan menyebabkan tertutupnya porus selama dehidrasi. Kompleks kristal violet-lugol akan terperangkap dalam lapisan peptidoglikan dan tidak terjadi penghapusan warna. Bakteri Gram negatif akan mengalami penghilangan warna sedangkan bakteri Gram positif tidak. Lalu dilakukan penetesan safranin yang menyebabkan bakteri Gram negatif akan menunjukkan warna merah sedangkan Gram positif akan berwarna ungu (Leboffe dan Pierce, 2010).
1.5.2.2. Uji Lanjutan
a. Uji Indol
Uji indol dilakukan untuk membedakan bakteri dari famili Enterobacteriaceae berdasarkan kemampuannya mendegradasi asam amino triptofan dan produksi indol. Mikroorganisme uji diinokulasi pada Triptofan Broth yang mengandung triptofan yang merupakan asam amino esensial. Oleh beberapa bakteri, triptofan akan dioksidasi yang kemudian akan membentuk indol, asam piruvat, dan ammonia. Indol ini akan dideteksi dengan penambahan reagen KOVAC yang akan membentuk cincin merah (Hemraj et al., 2013).
Media yang digunakan selain Triptofan Broth yaitu Sulfide-Indole-Motility (SIM) dan Motility-Indole-Ornithine (MIO). Reagen Ehrlich dapat digunakan
sebagai alternatif reagen KOVAC. Reagen ini juga mengandung P-dimetilaminobenzaldehid (DMAB) yang akan bereaksi dengan indol dan
mengahasilkan cincin berwarna merah. Reagen Ehrlich ini lebih sensitif daripada reagen KOVAC akan tetapi mengandung zat toksik atau pelarut yang mudah terbakar. Reagen Ehrlich direkomendasikan untuk mendeteksi kelompok bakteri yang memproduksi sedikit indol seperti basilus nonfermentative atau anaerob. Sedangkan reagen KOVAC lebih stabil dan tidak mengandung ekstraksi organik sehingga formulasi KOVAC lebih cocok digunakan oleh mahasiswa peneliti di laboratorium (Hemraj et al., 2013).
b. Uji Merah Metil
UIN Syarif Hidayatullah Jakarta
c. Uji Voges Proskauer
Uji Voges Proskauer dilakukan berdasarkan pada pencernaan glukosa menjadi asetilmetilkarbinol. Jika glukosa dipecah akan bereaksi dengan α-Naftol dan KOH yang kemudian membentuk warna merah. Untuk Escherichia coli hasilnya akan negatif, yaitu terbentuk warna kuning coklat (Hemraj et al., 2013).
d. Uji Sitrat
Uji sitrat dilakukan untuk membedakan bakteri enterik berdasarkan kemampuannya untuk memanfaatkan sumber karbon. Pemanfaatan sitrat bergantung pada enzim sitrat permease. Media yang digunakan dalam uji ini yaitu Simon Sitrat. Media ini mengandung natrium sitrat yang merupakan satu-satunya sumber karbon dan energi bagi bakteri. Indikator juga diperlukan dalam uji ini, yaitu bromotimol blue. Ketika asam sitrat dimetabolisme dan menghasilkan karbon dioksida, kombinasi natrium dan air membentuk natrium karbonat yang merupakan produk yang bersifat alkali/ basa yang kemudian akan mengubah warna dari hijau menjadi biru. Jika perubahan terjadi maka hasilnya positif. Sedangkan untuk Escherichia coli akan menunjukkan hasil negatif.
e. Uji Triple Sugar Iron
Uji triple sugar iron dilakukan untuk membedakan bakteri dari famili Enterobacteriaceae berdasarkan kemampuannya memfermentasi laktosa, sukrosa, glukosa, dan produksi H2S (Raghavan, 2015). Fermentasi laktosa, sukosa, dan
glukosa dideteksi dengan perubahan warna pH indikator yaitu merah fenol dari merah menjadi kuning sedangkan produksi H2S dideteksi dari perubahan warna
media menjadi hitam.
Prosedurnya yaitu diambil sebanyak 1 ose bakteri dari media Nutrient Agar (NA) kemudian diinokulasi dalam media Triple Sugar Iron Agar (TSIA) lalu diinkubasi pada suhu 37ºC selama 18-24 jam untuk melihat fermentasi karbohidrat dan hingga 48 jam untuk melihat produksi H2S (Leboffe dan Pierce,
menyebabkan perubahan warna medium menjadi kuning dalam 24 jam sedangkan bakteri yang memfermentasi glukosa dan laktosa akan menunjukkan perubahan warna medium menjadi kuning dalam waktu lebih dari 24 jam dan jika laktosa atau sukrosa difermentasi maka akan terbentuk asam dalam jumlah besar yang mengakibatkan permukaan media dan bagian dasar media berubah menjadi kuning (Atlas, 2010; Jawetz et al., 2013). Bakteri Escherichia coli akan menunjukkan hasil A/A,G dimana permukaan kuning dan bagian dasar kuning karena terjadi fermentasi glukosa dan laktosa dan/atau sukrosa dengan akumulasi asam pada bagian permukaan dan dasar media dengan agar pecah atau terangkat karena produksi gas (Leboffe dan Pierce, 2010).
Tabel 2.2 Hasil Uji Triple Sugar Iron dan Interpretasinya
Hasil Interpretasi Kode
Permukaan kuning/ bagian
dasar kuning
Fermentasi glukosa dan laktosa dan/atau sukrosa
dengan akumulasi asam pada bagian permukaan
dan dasar
A/A
Permukaan merah/ bagian
dasar kuning
Fermentasi glukosa dengan memproduksi asam.
Protein dikatabolisme secara aerob (pada bagian
permukaan) dengan memproduksi basa
K/A
Permukaan merah/ bagian
dasar merah
Tidak terjadi fermentasi. Pepton dikatabolisme
secara aerob dan anaerob dengan menghasilkan
basa. Bukan dari Enterobacteriaceae
K/K
Permukaan merah/ bagian
dasar tidak ada perubahan
Tidak terjadi fermentasi. Pepton dikatabolisme
secara aerob dan menghasilkan basa. Bukan dari
Enterobacteriaceae
K/NC
Permukaan tidak ada
perubahan/bagian dasar
tidak ada perubahan
Organisme tumbuh secara lambat atau tidak
tumbuh. Bukan dari Enterobacteriaceae
NC/NC
Endapan hitam Reduksi sulfur (pada kondisi asam yang dihasilkan
dari fermentasi glukosa atau laktosa dan/atau
sukrosa akan membentuk warna kuning pada
bagian dasar akan tetapi akan disamarkan dengan
oleh endapan hitam)
H2S
Agar pecah atau terangkat Produksi gas G
20
UIN Syarif Hidayatullah Jakarta
BAB III
METODE PENELITIAN
2.1. Waktu dan Tempat Penelitian
Pengambilan sampel dan pengamatan dilakukan di depot isi ulang Kelurahan Pondok Cabe Ilir Kota Tangerang Selatan pada bulan April-Mei 2016 dan penelitian dilakukan di Pusat Laboratorium Terpadu (PLT) UIN Syarif Hidayatullah Jakarta pada bulan April-Mei 2016.
2.2. Alat dan Bahan 2.2.1. Alat
Alat gelas (Iwaki), mikropipet, inkubator (Memmert), autoklaf (ALP, TOMY), vorteks, hotplate (Heidolph), timbangan analitik (Explorer Pro)
2.2.2. Bahan
Sampel air minum isi ulang depot, Lactose Broth (Oxoid), Brilliant Green Lactose Bile Broth 2% (Oxoid), Eosin Methylene Blue Agar (Oxoid), E.C Broth (Oxoid), Nutrient Agar (Oxoid), MR-VP broth (Merck), Simon sitrat (Merck), Triple Sugar Iron Agar (Oxoid), reagen KOVAC, Barritt A, Barritt B, merah metil
2.3. Prosedur Kerja
2.3.1. Pengambilan Sampel
2.3.2. Metode Sangkaan (SNI 01-2897-1992)
Uji sangkaan dilakukan dengan metode Angka Paling Mungkin (APM) seri tabung 3-3-3. Prosedurnya yaitu sampel dikocok sebanyak 25 kali kemudian diencerkan dengan menggunakan larutan pengencer yaitu Peptone Water sesuai dengan tingkat pengencerannya. Dipipet sebanyak 1 mL sampel dengan pengenceran 10-1 pada 3 seri tabung pertama yang berisi Lactose Broth (LB) sebanyak 5 mL yang telah terdapat tabung durham didalamnya. Untuk 3 seri tabung berikutnya dipipet sebanyak 1 mL sampel dengan pengenceran 10-2 dan untuk 3 seri tabung selanjutnya dipipet sebanyak 1 mL sampel dengan pengenceran 10-3. Setelah itu, tabung diinkubasi pada suhu 36±1ºC selama 24 dan 48 jam lalu dicatat jumlah tabung yang membentuk gas.
2.3.3. Uji Penegesan (Confirmed Test) (SNI 01-2897-1992)
Tabung yang positif pada uji sangkaan kemudian dilakukan uji penegasan. Prosedurnya yaitu diambil sebanyak 1 ose biakan dan diinokulasi pada media Brilliant Green Lactose Bile Broth 2% (BGLB 2%) sebanyak 10 mL yang terdapat pada tabung reaksi yang telah berisi tabung durham. Setelah itu, tabung diinkubasi pada suhu 36±1ºC selama 24-48 jam kemudian dihitung jumlah tabung yang menghasilkan gas dan dihitung jumlah bakteri/mL.
2.3.4. Identifikasi Bakteri Escherichia coli (SNI 01-2897-1992)
Diambil sebanyak 1 ose dari tabung reaksi yang positif pada uji sangkaan ke dalam tabung rekasi yang berisi Escherichia coli broth dan tabung durham. Setelah itu, tabung diinkubasi pada suhu 44-45ºC selama 24-48 jam dan dicatat tabung yang positif.
Tabung yang membentuk gas kemudian diinokulasi pada media Eosin Methylene Blue Agar (EMBA) dan diinkubasi pada suhu 35ºC selama 18-24 jam. Dipilih koloni berwarna kilap logam yang kemudian diinokulasi pada media agar miring Nutrient Agar (NA) dan diinkubasi suhu 35°C selama 24 jam.
2.3.4.1. Pewarnaan Gram (SNI 01-2897-1992)
UIN Syarif Hidayatullah Jakarta
cara melewatkan sediaan di atas api bunsen. Sediaan ditetesi beberapa tetes larutan kristal violet dibiarkan selama 1 menit. Setelah itu, dicuci dengan air mengalir dan dikering anginkan. Sediaan ditetesi beberapa tetes lugol lalu dibiarkan selama 1 menit. Dicuci kembali menggunakan air mengalir dan dikering anginkan. Sediaan dicuci dengan alkohol 96% selama 30 detik. Dicuci dengan air mengalir dan dikering anginkan. Sediaan diberi beberapa tetes safranin lalu biarkan selama 10-30 detik. Dicuci menggunakan air mengalir setelah itu dikering anginkan dan diserap dengan kertas saring kemudian diamati di bawah mikroskop.
2.3.4.2. Uji IMViC (SNI 01-2897-1992 dengan modifikasi)
a. Uji Indol
Biakan dari media Nutrient Agar (NA) diinokulasi pada media Sulfide-Indole-Motility (SIM) dan diinkubasi pada suhu 37ºC selama 24 jam. Setelah diinkubasi, ditambahkan reagen KOVAC sebanyak 0,5 mL lalu didiamkan selama 10 menit. Apabila positif Escherichia coli akan menunjukkan lapisan warna merah pada permukaan biakan.
b. Uji Merah Metil
Biakan dari media Nutrient Agar (NA) diinokulasi pada Methyl Red-Voges Proskauer (MR-VP) dan diinkubasi pada suhu 35ºC selama 48 jam. Setelah diinkubasi, biakan diambil sebanyak 5 mL ke dalam tabung reaksi kemudian ditambahkan merah metil sebagai indikator sebanyak 5 tetes dan dikocok. Apabila positif Escherichia coli akan berwarna merah.
c. Uji Voges Proskauer
d. Uji Sitrat
Biakan dari media Nutrient Agar (NA) diinokulasi pada media agar miring Simmon Sitrat dan diinkubasi pada suhu 35ºC selama 48-96 jam. Apabila positif Escherichia coli tidak terjadi perubahan warna pada media.
2.3.4.3. Uji Triple Sugar Iron
[image:37.595.113.512.196.554.2]Diambil sebanyak 1 ose bakteri dari media Nutrient Agar (NA) kemudian diinokulasi dalam media Triple Sugar Iron Agar (TSIA) dengan cara menggores bagian miringnya dan menusuk bagian tegaknya kemudian diinkubasi pada suhu 37ºC selama 20-48 jam. Apabila positif Escherichia coli terjadi perubahan warna pada media uji yaitu permukaan agar berwarna kuning dan bagian dasar kuning, agar pecah atau terangkat karena produksi gas.
Tabel 3.1 Hasil Uji Positif Escherichia coli
Uji Hasil positif Escherichia coli
Uji Indol Terbentuk lapisan warna merah pada permukaan biakan.
Uji Merah Metil Berwarna merah
Uji Voges Proskauer Kuning coklat
Uji Sitrat Media tidak berubah menjadi biru
Uji Triple Sugar Iron Permukaan agar berwarna kuning dan bagian dasar kuning, agar
pecah atau terangkat karena produksi gas
24
UIN Syarif Hidayatullah Jakarta
BAB IV
HASIL DAN PEMBAHASAN
4.1. Pengumpulan Sampel dan Pengamatan Depot Air Minum Isi Ulang
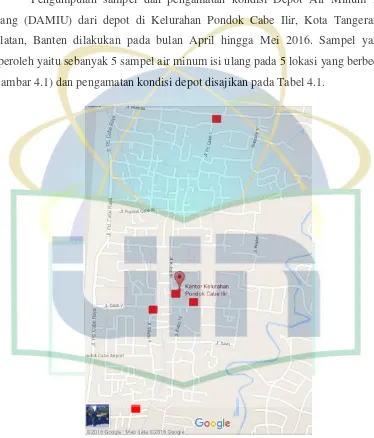
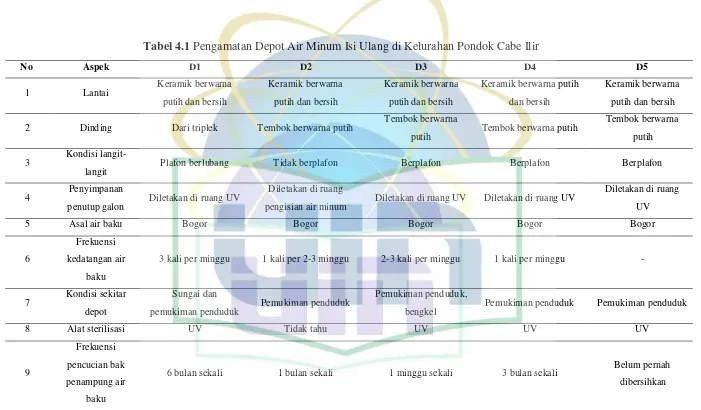
[image:38.595.125.499.165.603.2]Pengumpulan sampel dan pengamatan kondisi Depot Air Minum Isi Ulang (DAMIU) dari depot di Kelurahan Pondok Cabe Ilir, Kota Tangerang Selatan, Banten dilakukan pada bulan April hingga Mei 2016. Sampel yang diperoleh yaitu sebanyak 5 sampel air minum isi ulang pada 5 lokasi yang berbeda (Gambar 4.1) dan pengamatan kondisi depot disajikan pada Tabel 4.1.
Tabel 4.1 Pengamatan Depot Air Minum Isi Ulang di Kelurahan Pondok Cabe Ilir
No Aspek D1 D2 D3 D4 D5
1 Lantai Keramik berwarna
putih dan bersih
Keramik berwarna
putih dan bersih
Keramik berwarna
putih dan bersih
Keramik berwarna putih
dan bersih
Keramik berwarna
putih dan bersih
2 Dinding Dari triplek Tembok berwarna putih Tembok berwarna
putih Tembok berwarna putih
Tembok berwarna
putih
3 Kondisi
langit-langit Plafon berlubang Tidak berplafon Berplafon Berplafon Berplafon
4 Penyimpanan
penutup galon Diletakan di ruang UV
Diletakan di ruang
pengisian air minum Diletakan di ruang UV Diletakan di ruang UV
Diletakan di ruang
UV
5 Asal air baku Bogor Bogor Bogor Bogor Bogor
6
Frekuensi
kedatangan air
baku
3 kali per minggu 1 kali per 2-3 minggu 2-3 kali per minggu 1 kali per minggu -
7 Kondisi sekitar
depot
Sungai dan
pemukiman penduduk Pemukiman penduduk
Pemukiman penduduk,
bengkel Pemukiman penduduk Pemukiman penduduk
8 Alat sterilisasi UV Tidak tahu UV UV UV
9
Frekuensi
pencucian bak
penampung air
baku
6 bulan sekali 1 bulan sekali 1 minggu sekali 3 bulan sekali Belum pernah
UIN Syarif Hidayatullah Jakarta
(Lanjutan)
No Aspek D1 D2 D3 D4 D5
10 Cara pencucian
galon Air Air Air Air Air
11 Lokasi alat
pencucian galon Berada di luar depot Berada di luar depot Berada di luar depot Berada di dalam depot Berada di luar depot
Persyaratan teknis Depot Air Minum Isi Ulang (DAMIU) telah ditetapkan oleh mentri perindustrian dan perdagangan melalui Keputusan Mentri Perindustrian dan Perdagangan Republik Indonesia Nomor: 651/MPP/Kep/10/2004. Sehingga kondisi depot di Kelurahan Pondok Cabe Ilir dibandingkan kesesuaiannya dengan peraturan tersebut.
Berdasarkan tabel 4.1, kondisi bangunan depot D1 yaitu lantai terbuat dari keramik berwarna putih dan bersih, dinding terbuat dari triplek, kondisi plafon atau langit-langit berlubang, penyimpanan penutup galon di ruang pengisian air yang ber-UV, asal air baku yaitu dari Bogor dengan frekuensi kedatangan 3 kali dalam seminggu, di sekitar depot terdapat sungai dan pemukiman penduduk, alat sterilisasinya yaitu UV, pencucian bak penampung air baku dilakukan 6 bulan sekali, pencucian galon menggunakan air tanpa deterjen, dan alat pencucian galon berada di luar bangunan depot.
diketahui, pencucian bak penampung air baku dilakukan 1 bulan sekali, pencucian galon menggunakan air tanpa deterjen, dan alat pencucian galon berada di luar bangunan depot.
Berdasarkan tabel 4.1, kondisi bangunan depot D3 yaitu lantai terbuat dari keramik berwarna putih dan bersih, dinding terbuat dari tembok dengan cat berwarna putih, kondisi plafon atau langit-langit baik, penyimpanan penutup galon di ruang pengisian air yang ber-UV, asal air baku yaitu dari Bogor dengan frekuensi kedatangan 2 hingga 3 kali dalam seminggu, di sekitar depot terdapat pemukiman penduduk dan bengkel, alat sterilisasinya yaitu UV, pencucian bak penampung air baku dilakukan 1 minggu sekali, pencucian galon menggunakan air tanpa deterjen, dan alat pencucian galon berada di luar bangunan depot.
Berdasarkan tabel 4.1, kondisi bangunan depot D4 yaitu lantai terbuat dari keramik berwarna putih dan bersih, dinding terbuat dari tembok dengan cat berwarna putih, kondisi plafon atau langit-langit baik, penyimpanan penutup galon di ruang pengisian air yang ber-UV, asal air baku yaitu dari Bogor dengan frekuensi kedatangan 1 kali dalam seminggu, di sekitar depot terdapat pemukiman penduduk, alat sterilisasinya yaitu UV, pencucian bak penampung air baku dilakukan 3 bulan sekali, pencucian galon menggunakan air tanpa deterjen, dan alat pencucian galon berada di dalam bangunan depot.
Berdasarkan tabel 4.1, kondisi bangunan depot D5 yaitu lantai terbuat dari keramik berwarna putih dan bersih, dinding terbuat dari tembok dengan cat berwarna putih, kondisi plafon atau langit-langit baik, penyimpanan penutup galon di ruang pengisian air yang ber-UV, asal air baku yaitu dari Bogor dengan frekuensi kedatangan belum ditentukan karena depot D5 merupakan depot baru, di sekitar depot terdapat pemukiman penduduk, alat sterilisasinya yaitu UV, pencucian bak penampung air baku belum pernah dilakukan, pencucian galon menggunakan air tanpa deterjen, dan alat pencucian galon berada di luar bangunan depot.
UIN Syarif Hidayatullah Jakarta
kondisi lantai, semua depot memenuhi persyaratan sedangkan syarat dinding tidak demikian. Dinding semua depot di Kelurahan Pondok Cabe Ilir tidak terbuat dari bahan yang licin akan tetapi dinding berwarna terang dan bersih. Syarat kondisi atap dan langit-langit bangunan depot yaitu harus sempurna tertutup, tidak ada yang bocor, permukaan rata, berwarna terang, dan mudah dibersihkan (Suprihatin dan Adriyani, 2008). Sebagian besar kondisi langit-langit depot sudah memenuhi syarat kecuali pada depot D1 yang berlubang dan depot D2 yang tidak berplafon sehingga sangat rawan binatang masuk ke area depot.
Mesin dan peralatan yang berhubungan langsung dengan air baku atau produk akhir harus dibersihkan dan dilakukan sanitasi secara teratur. Pada depot D2 pencucian bak penampung air baku dilakukan sebulan sekali, kegiatan ini sudah baik karena seharusnya 6 bulan sekali akan tetapi air baku tersimpan cukup lama dalam bak penampung karena air baku datang setiap 2-3 minggu sekali sehingga meningkatkan risiko tercemarnya mikroba (Rahayu et al., 2013). Sedangkan untuk depot D1, D3, D4, dan D5 perputaran air baku pada bak penampung lebih cepat dibandingkan dengan depot D2 dan frekuensi pembersihan bak penampung air juga memenuhi syarat.
Sanitasi lingkungan berpengaruh terhadap adanya cemaran bakteri Coliform pada air minum isi ulang terlihat pada kondisi depot yang tidak berplafon dan kotor, alat sterilisasi yang tidak diketahui oleh petugas dan hal ini menunjukkan bahwa alat sterilisasi tidak pernah dirawat sehingga petugas tidak tahu jenisnya, dan juga lamanya air baku tersimpan dalam bak penampung air (Suprihatin et al., 2008). Pada depot air minum isi ulang biasanya terdapat lampu indikator bahwa UV masih bekerja dengan baik sedangkan pada depot D2 tidak adanya indikator tersebut sehingga kemungkinan lampu UV perlu diganti (Rahayu et al., 2013).
lagi pada depot D1, D2, D3, dan D5 alat pembersih galon yang letaknya di luar bangunan depot sehingga semakin tinggi risiko tercemar mikroba.
Empat dari 5 kondisi lokasi semua depot sudah memenuhi syarat yaitu bangunan depot berada di lokasi yang bebas dari pencemaran, seperti tempat pembuangan kotoran dan sampah, penumpukan barang bekas atau bahan berbahaya yang beracun, bengkel, perusahaan cat, las, kapur (Deperindag, 2004). Hanya depot D3 berada di lokasi yang berdekatan dengan bengkel.
Berdasarkan pengamatan pada kondisi depot air minum isi ulang yang telah disajikan dalam tabel 4.1 terlihat bahwa depot D2 yang kurang menjaga kondisi depotnya yang seharusnya bangunan dan bagian-bagiannya harus dipelihara dan dilakukan sanitasi secara teratur dan berkala, hal ini dilakukan untuk mencegah masuknya tikus, serangga, dan binatang kecil lainnya ke dalam bangunan bangunan proses produksi atau pun tempat pengisian (Indirawati, 2009).
Kontaminasi pada air minum isi ulang dapat disebabkan karena tingginya kandungan cemaran mikroba pada air baku, adanya kontaminasi selama memasukkan air ke dalam tangki pengangkutan, bak penampungan kurang bersih, lamanya waktu penyimpanan air dalam bak penampungan, pengusaha depot belum mengetahui peralatan depot yang baik dan cara memeliharanya sehingga kurang memperhatikan dan tidak rutin membersihkan peralatan depot, proses filtrasi kurang memadai, peralatan depot air minum yang tidak dilengkapi alat sterilisasi atau daya bunuhnya rendah terhadap bakteri, kurang memperhatikan pentingnya sanitasi lingkungan, adanya kontaminasi dari galon yang tidak disterilisasi, tidak dilakukannya uji rutin untuk memeriksakan kelayakan produksi air minum isi ulang (Natalia et al, 2004; Radji, 2008; Walangitan et al, 2016).
UIN Syarif Hidayatullah Jakarta
sebelum diisi dan proses pengisian air hingga penutupan wadah dilakukan di ruang yang higienis (Purnawijayanti 2001; Purwaningsih, 2009).
4.2. Hasil Uji Sangkaan
[image:44.595.121.510.162.642.2]Hasil uji sangkaan dari 5 sampel air minum isi ulang dari depot di Kelurahan Pondok Cabe Ilir dibandingkan dengan kontrol negatif dapat dilihat pada tabel 4.2. dan 4.3. Hanya sampel D2 pengenceran 10-1 replikasi tabung ke-2 yang menunjukkan hasil positif dimana terbentuk gelembung dan terjadi kekeruhan media Lactose broth, sedangkan sampel D1, D3, D4, dan D5 hanya menunjukkan produksi asam yang ditandai dengan kekeruhan pada media Lactose broth dan pada blangko akuades steril pengenceran 10-1, 10-2, 10-3, dan media tidak menujukkan kekeruhan media atau pun gelembung pada tabung durham.
Tabel 4.2 Hasil uji sangkaan air minum isi ulang (AMIU) depot di Kelurahan Pondok Cabe Ilir
pada masa inkubasi 24 jam dengan metode Angka Paling Mungkin (APM) seri 3 tabung
Sampel
Tabung positif pada masa inkubasi 24 jam
Replikasi
Pengenceran 10-1
Replikasi
Pengenceran 10-2
Replikasi
Pengenceran 10-3
1 2 3 1 2 3 1 2 3
D1 - - - -
D2 - + - - - -
D3 - - - -
D4 - - - -
D5 - - - -
BM - - - -
B10-1 - - - -
B10-2 - - - -
B10-3 - - - -
Keterangan:
1= Replikasi tabung 1; 2= Replikasi tabung 2; 3= Replikasi tabung 3; BM = Blangko media;
B10-1= Blangko pengenceran 10-1 ; B10-2= Blangko pengenceran 10-2 ; B10-3= Blangko
pengenceran 10-3; - Tidak terbentuk gelembung pada tabung durham; + Terbentuk gelembung
Tabel 4.3 Hasil uji sangkaan air minum isi ulang (AMIU) depot di Kelurahan Pondok Cabe Ilir
pada masa inkubasi 48 jam dengan metode Angka Paling Mungkin (APM) seri 3 tabung
Sampel
Tabung positif pada masa inkubasi 48 jam
Replikasi
Pengenceran 10-1
Replikasi
Pengenceran 10-2
Replikasi
Pengenceran 10-3
1 2 3 1 2 3 1 2 3
D1 - - - -
D2 - + - - - -
D3 - - - -
D4 - - - -
D5 - - - -
BM - - - -
B10-1 - - - -
B10-2 - - - -
B10-3 - - - -
Keterangan:
1=Tabung 1; 2= Tabung 2; 3= Tabung 3; BM = Blangko media; B10-1= Blangko pengenceran 10-1
; B10-2= Blangko pengenceran 10-2 ; B10-3= Blangko pengenceran 10-3; - Tidak terbentuk
gelembung pada tabung durham; + Terbentuk gelembung pada tabung durham.
UIN Syarif Hidayatullah Jakarta
Ketika tabung menunjukkan terbentuknya gelembung gas pada tabung durham dan asam yang ditandai dengan kekeruhan media Lactose broth, kemungkinan besar bahwa bakteri yang terkandung di dalamnya merupakan bakteri Enterobacteriaceae karena dapat memfermentasi gula melalui fermentasi campuran asam dan butandiol (Müller, 2001). Perubahan gula menjadi piruvat melalui proses glikolisis dan oleh beberapa bakteri akan diubah menjadi asam, CO2, dan H2. Media yang digunakan pada uji sangkaan mengandung gula yaitu
laktosa dan akan menjadi sumber energi bagi bakteri. Secara sederhana, reaksi yang terjadi dapat digambarkan sebagai berikut:
4.3. Hasil Uji Penegasan
Tahap selanjutnya yaitu uji penegasan yang dilakukan untuk menghitung jumlah total Coliform serta untuk meyakinkan bakteri yang terkandung dalam sampel merupakan bakteri kelompok Coliform karena pada uji sangkaan hasil positif tidak selalu disebabkan oleh bakteri Coliform, seperti bakteri lain yang mampu memfermentasi laktosa yang kemudian memproduksi gas dan asam seperti bakteri asam laktat atau oleh bakteri yang bersifat sinergis sehingga dapat
menguraikan karbohidrat dan membentuk gas (APHA, 1992; Radji, 2008). Hanya sampel D2 replikasi tabung ke-2 pengenceran 10-1 yang dilanjutkan ke uji penegasan karena pada sampel D1, D3, D4, D5 menunjukkan hasil negatif pada uji sangkaan. Sampel D2 yang menunjukkan hasil positif pada uji sangkaan diinokulasi dalam media Brilliant Green Lactose Bile broth 2% (BGLB 2%) kemudian diinkubasi pada suhu 36±1ºC selama 24-48 jam.
Pada uji penegasan sampel D2 replikasi tabung ke-2 pengenceran 10-1 masa inkubasi 24 jam terbentuk gelembung gas pada tabung durham namun sangat kecil yaitu <10% sehingga diputuskan untuk dilanjutkan inkubasinya hingga 48 jam (Gambar 4.2). Pada masa inkubasi 48 jam terlihat terbentuk gelembung yang semakin besar dan >10%. Hasil yang diperoleh dari uji penegasan ini kemudian dapat digunakan untuk menghitung nilai APM/mL
dengan menggunakan tabel Hopkins yang tercantum dalam SNI 01-2897-1992 (Tabel 4.4).
Gambar 4.2 Hasil uji penegasan pada masa inkubasi 24 jam terbentuk gelembung gas <10%
(A) dan pada masa inkubasi 48 jam gelembung yang terbentuk gelembung gas semakin
besar yaitu >10% (B)
Tabel 4.4 Nilai APM/mL setiap sampel air minum isi ulang
Sampel Kombinasi tabung yang positif Nilai APM/mL
D1 0-0-0 <3
D2 1-0-0 4
D3 0-0-0 <3
D4 0-0-0 <3
D5 0-0-0 <3
Berdasarkan tabel 4.4, nilai APM/mL pada sampel D1, D3, D4, dan D5 yaitu <3/mL yang berarti bahwa jumlah bakteri Coliform pada sampel tidak terdeteksi dan dianggap negatif (El-Hadedy dan El-Nour, 2012) sedangkan sampel D2 bernilai 4/mL. Semakin tinggi tingkat kontaminasi bakteri Coliform, semakin tinggi risiko adanya bakteri patogen lain (Suprihatin, 2003) serta semakin sedikit kandungan bakteri Coliform pada air minum, maka semakin baik kualitas air minum tersebut, dan sebaliknya semakin banyak jumlah bakteri Coliform dalam air minum, maka semakin buruk kualitas air minum tersebut (Pracoyo, 2006). Air minum akan menyebabkan penyakit gastroenteritis jika pada 100 mL air minum terdapat 500 bakteri Coliform sedangkan jumlah bakteri Coliform pada sampel D2
UIN Syarif Hidayatullah Jakarta
tidak mencapai 500/100 mL jadi kemungkinan jika masyarakat mengonsumsi air minum tersebut tidak menyebabkan penyakit gastroenteritis meskipun air minum sampel D2 tidak layak konsumsi (Suriawiria, 2003).
Hasil penelitian menunjukkan 1 dari 5 sampel air minum isi ulang di Kelurahan Pondok Cabe Ilir tercemar bakteri Coliform. Hasil tersebut hampir sama dengan hasil penelitian yang telah dilakukan sebelumnya, yaitu ada beberapa sampel air minum isi ulang yang tercemar bakteri Coliform.
Bakteri Coliform tidak menyebabkan penyakit akan tetapi dapat digunakan sebagai salah satu indikator hadirnya bakteri patogen yang dapat mengakibatkan berbagai macam penyakit (Khoeriyah dan Anies, 2015). Hadirnya bakteri Coliform yang terdapat pada sampel D2 menunjukan kemungkinan adanya mikroba yang bersifat enteropatogenik dan toksigenik yang berbahaya bagi kesehatan seperti Salmonella, Shigella dan Staphylococcus (Bambang et al., 2014), seperti yang terjadi di Charsadda, Pakistan penduduk menderita penyakit gastoentritis, kolera, disentri, diare, dan hepatitis karena mengonsumsi air yang tercemar bakteri Coliform (Shahnaz et al., 2012 dalam Khoeriyah dan Anies, 2015). Higienitas dan sanitasi berpengaruh terhadap ada tidaknya cemaran bakteri Coliform dalam air minum isi ulang (Natalia, et al., 2014). Tercemarnya sampel D2 oleh bakteri Coliform dapat disebabkan karena air baku tercemar, sistem transportasi pengangkutan air baku ke depot, penanganan wadah air, pemeliharaan bangunan dan peralatan, kondisi depot yang tidak memenuhi syarat (Walingitan et al., 2016). Jumlah bakteri Coliform akan meningkat dengan meningkatnya waktu penyimpanan, pada depot D2 air baku tersimpan cukup lama dalam bak penampung karena air baku hanya datang setiap 2-3 minggu sekali sehingga meningkatkan risiko tercemarnya mikroba (Rahayu et al., 2013; Violita et al., 2010).
UIN Syarif Hidayatullah Jakarta
4.4. Hasil Uji Identifikasi Escherichia coli
Uji identifikasi Escherichia coli merupakan uji lanjutan dari uji sangkaan dan uji penegasan. Pada uji sangkaan dan uji penegasan didapatkan kesimpulan bahwa bakteri yang terkandung dalam sampel merupakan bakteri kelompok Coliform. Mengacu pada Peraturan Menteri Kesehatan No.492/MENKES/Per/IV/2010, langkah selanjutnya yang perlu dilakukan yaitu mengidentifikasi bakteri Coliform yang terkandung pada sampel D2 apakah merupakan bakteri Escherichia coli atau bukan. Escherichia coli dianggap sebagai indikator kontaminasi fekal terbaik pada air minum (Edberg, 2000). Pada uji identifikasi terdapat beberapa langkah yang perlu dilakukan, yaitu inkubasi sampel D2 pada media E.C Broth, media Eosin Methylene Blue Agar, pewarnaan Gram, uji IMViC, uji Triple Sugar Iron, uji motilitas, dan uji produksi H2S.
4.4.1. Hasil Uji pada Media Escherichia coliBroth (E.C Broth)
Sampel D2 replikasi tabung ke-2 pengenceran 10-1 yang menunjukkan hasil positif pada uji sangkaan dilanjutkan ke uji identifikasi. Hasil uji sangkaan dibiakkan pada media Escherichia coli Broth (E.C broth). Pada masa inkubasi 24 jam, tabung hanya menunjukkan kekeruhan pada media sehingga diputuskan untuk diinkubasi kembali hingga 48 jam. Pada masa inkubasi 48 jam, tabung menunjukkan hasil positif karena terbentuk gelembung pada tabung durham dan kekeruhan pada media. Hasil seperti yang ditunjukkan pada gambar 4.3. Hasil positif pada uji ini dianggap positif Escherichia coli (APHA, 1992).
Gambar 4.3 Media E.C broth yang telah diinokulasi bakteri sebelum diinkubasi (A),
hasil uji identifikasi pada media E.C broth pada masa inkubasi 48 jam terlihat terbentuk
gelembung gas pada tabung durham dan terjadi kekeruhan media (B)
4.4.2. Hasil Uji pada Media Eosin Methylene Blue Agar (EMBA)
Sampel D2 replikasi tabung ke-2 pengenceran 10-1 yang telah menunjukkan hasil positif pada media E.C broth kemudian diinokulasi pada media Eosin Methylene Blue Agar. Hasilnya yaitu terdapat koloni kilap logam berwarna hijau dan membentuk koloni tunggal yang merupakan spesifik Escherichia coli (Gambar 4.4).
Gambar 4.4 Hasil uji identifikasi pada media Eosin Methylene Blue Agar masa inkubasi 24
jam terbentuk koloni berwarna hijau kilap logam
Uji identifikasi pada media Eosin Methylene Blue Agar dilakukan bertujuan untuk memastikan bahwa benar bakteri tersebut adalah Escherichia coli. Media ini secara selektif mengisolasi bakteri Gram negatif yang berbentuk batang. Eosin Y dan methylene blue yang terkandung di dalamnya mampu menghambat
[image:51.595.116.507.125.592.2]UIN Syarif Hidayatullah Jakarta
pertumbuhan bakteri Gram positif dan dalam suasana asam akan memproduksi kompleks ungu tua yang biasanya disertai dengan kilap logam berwarna hijau. Kilap logam berwarna hijau merupakan indikator telah terjadinya fermentasi laktosa dan/ atau sukrosa oleh fekal Coliform yakni Escherichia coli (Leboffe dan Pierce, 2010).
4.4.3. Hasil Pewarnaan Gram
Bakteri yang telah diremajakan pada media Nutrient Agar (NA) kemudian dilakukan pewarnaan Gram. Pewarnaan Gram pada penelitian ini dilakukan untuk mengamati morfologi sel bakteri yang terkandung pada sampel D2. Pada gambar 4.5 terlihat hasil pewarnaan Gram yang diamati di bawah mikroskop dengan perbesaran 100x terlihat bakteri berwarna merah dan berbentuk batang pendek.
[image:52.595.114.513.191.540.2]Prinsip dari pewarnaan Gram yaitu berdasarkan struktur lapisan dinding bakteri. Dinding sel bakteri Gram negatif memiliki kandungan lipid yang lebih banyak dan memiliki lapisan peptidoglikan yang lebih tipis daripada dinding sel bakteri Gram positif (Leboffe dan Pierce, 2010).
Gambar 4.5 Hasil pewarnaan Gramsampel D2 yang dilihat di bawah mikroskop perbesaran
100x (A dan B), dan hasil pewarnaan Gram Escherichia coli kontrol perbesaran 1000x (C).
Muatan positif kristal violet melewati dinding sel dan membran sel kemudian berikatan dengan komponen di dalam sel yang bermuatan negatif. Iodin ditambahkan untuk meningkatkan pewarnaan kristal violet dengan membentuk kompleks kristal violet-lugol. Langkah berikutnya yaitu dilakukan penghilangan warna dengan menggunakan alkohol. Pada bakteri Gram negatif, alkohol dapat meningkatkan porositas dinding sel dengan melarutkan lipid pada lapisan membran terluar dan meluluhkan kompleks kristal violet-lugol dari sel sehingga
akan terjadi penghilangan warna. Ketika ditet