NUR ZAMILAH
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Dibimbing oleh CHARLENAdan HADIATI AGUSTINE.
Biodegradasi metode bioremediasi dilakukan dengan memanfaatkan bakteri yang dapat bertahan hidup pada tanah tercemar dan menunjukkan kemampuan metabolisme terhadap pencemar sebagai sumber karbon. Identifikasi dan pencirian diperlukan untuk menentukan nama genus dari isolat bakteri tersebut. Metode konvensional lazim digunakan, yaitu dengan mengamati sifat morfologi, sifat fisiologi, dan aktivitas biokimianya. Tujuan penelitian ini adalah mengidentifikasi dan mencirikan suatu isolat bakteri pendegradasi hidrokarbon yang diisolasi dari tanah yang tercemari minyak bumi. Identifikasi dilakukan pada suhu 27, 37, dan 40 °C dalam media yang diperkaya mineral. Identifikasi terdiri atas 4 tahap, yaitu regenerasi (peremajaan kembali) isolat bakteri; uji morfologi isolat yang ditumbuhkan dalam cawan petri selama 24 jam, meliputi bentuk koloni, elevasi, warna, dan permukaan koloni; uji fisiologi isolat bakteri meliputi pewarnaan sederhana, pewarnaan Gram, pewarnaan spora dan kapsul; serta uji aktivitas biokimia yang meliputi uji fermentasi karbohidrat, uji hidrolisis (pati, lemak, kasein, dan gelatin), analisis IMViC, oksidase-katalase, motilitas, analisis H2S dan reduksi nitrat.
Hasil identifikasi dan pencirian dibandingkan dengan panduan Bergey’s Manual of Determinative Bacteriology dan menunjukkan bahwa isolat dengan kode MY 1, MY 3, MY 6, MY 8, MY 9, dan MY FLR adalah genus Bacillus, MY 10 dan MY 11 adalah golongan Enterobacter, sedangkan MY 12 adalah Pseudomonassp.
ABSTRACT
NUR ZAMILAH. Identification and Characterization of Hydrocarbon-Degrading Bacteria Isolates. Supervised by CHARLENA and HADIATI AGUSTINE.
Biodegradation with bioremediation method is performed by utilizing bacteria that can survive in contaminated soil and shows metabolic capabilities towards pollutants as carbon sources. Identification and characterization are needed to determine the genera name of the bacterial isolates. Conventional methods is commonly used, that is by observing the morphological and physiological properties as well as the biochemical activities. This research was aimed to identify and characterize several hydrocarbon- degrading bacteria already isolated from the soil contaminated with petroleum waste. Identification were performed at 20, 30, and 37 °C in a mineral-enriched medium. Identification consisted of 4 steps, namely regeneration of bacterial isolates; morphology test of isolates grown in petri dish for 24 hours, including the form, edge, color, and surface of the colony; physiology test of isolates, including simple coloring, Gram coloring , spore and capsule staining; and biochemical activity test including carbohydrate fermentation test, hydrolysis test (starch, fat, casein, and gelatin), IMViC analysis, oxidase-catalase test, motility, hydrogen sulfide and nitrate reduction analysis. The identification and characterization results were compared with guidance in Bergey's Manual Determinative of Bacteriology and showed thatisolate codedMY 1, MY 3, MY 6, MY 8, MY 9, and MY FLR were Bacillus genera, MY 10 and MY 11 were
NUR ZAMILAH
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
NIM :
G44076009
Disetujui
Pembimbing I
Dr Charlena, MS
NIP 19671222 199403 2 002
Pembimbing II
Dra Hadiati Agustine
NIP 19570817 198103 2 002
Diketahui
Ketua Departemen Kimia
Prof Dr Ir Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
sehingga karya ilmiah ini berhasil diselesaikan. Penelitian dilaksanakan sejak
bulan April 2010, dengan judul Identifikasi dan Pencirian Isolat Bakteri
Pendegradasi Hidrokarbon.
Penulis mengucapkan terima kasih kepada Ibu Dr Charlena, MS dan Ibu Dra
Hadiati Agustine selaku pembimbing, yang telah banyak memberi arahan,
dorongan, saran, dan waktunya. Penulis juga mengucapkan terima kasih kepada
Ibu Etty, Ibu Esih beserta staf dari Laboratorium Mikrobiologi Smakbo; Ibu Ella,
staf dari Laboratorium PKT 2; Ibu Sulistiowati yang telah memberikan izin
penggunaan tempat kepada penulis dalam melaksanakan penelitian; serta Ibu drh
Tati dari Laboratorium Mikrobiologi balitvet, yang telah membantu selama
pengumpulan data. Ungkapan terima kasih juga penulis sampaikan kepada ayah,
ibu, serta seluruh keluarga atas segala do’a, kasih sayangnya serta dukungan
material maupun spiritual selama penulis melaksanakan penelitian.
Akhir kata semoga karya ilmiah ini bermanfaat bagi perkembangan ilmu
pengetahuan.
Bogor, Januari 2012
Nur Zamilah
Godjali dan Ibu Siti Aisyah. Penulis adalah putri keempat dari enam bersaudara.
Tahun 2002 penulis lulus dari Diploma 3 Analisis Kimia, Institut Pertanian
Bogor. Pada Desember 2003, penulis diterima di Sekolah Menengah Analis Kimia
Bogor (SMAKBo) sebagai teknisi laboratorium.
vi
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
BAHAN DAN METODE
Alat dan Bahan ... 1
Metode Penelitian ... 2
Regenerasi Isolat Bakteri ... 2
Uji Morfologi ... 2
Uji Fisiologi ... 2
Uji Biokimia ... 2
HASIL DAN PEMBAHASAN
Hasil Regenerasi Kultur Murni ... 3
Morfologi Isolat Bakteri ... 4
Fisiologi Isolat Bakteri ... 4
Aktivitas Biokimia Isolat Bakteri ... 5
SIMPULAN DAN SARAN
Simpulan ... 11
Saran ... 11
DAFTAR PUSTAKA ... 11
vii
1 Morfologi koloni ... 4
2 Sifat-sifat fisiologi sel ... 5
3 Fermentasi karbohidrat... 6
4 Hasil uji hidrolisis pati ... 6
5 Hasil uji hidrolisis lemak ... 7
6 Hasil uji hidrolisis gelatin ... 7
7 Hasil uji hidrolisis kasein ... 7
8 Hasil uji produksi indol ... 8
9 Hasil uji MR-VP (
methyl red
– Voges Proskauer)... 8
10 Hasil uji Kosser sitrat ... 9
11 Hasil uji oksidase dan katalase ... 9
12 Hasil uji motilitas ... 10
13 Hasil uji H
2S ... 10
14 Hasil uji reduksi nitrat ... 10
viii
1 Hasil regenerasi isolat bakteri ... 4
2 Isolat koloni bakteri MY FLR ... 4
3 Isolat bakteri Gram positif dan Gram negatif ... 4
4 Isolat koloni bakteri Gram negatif ... 5
5 Isolat bakteri penghasil spora ... 5
6 Isolat bakteri tanpa pelindung kapsul ... 5
7 Fermentasi karbohidrat (glukosa, laktosa, dan sukrosa) isolat bakteri ... 6
8 Hidrolisis pati pada isolat bakteri ... 6
9 Hidrolisis lemak pada isolat bakteri ... 7
10 Hidrolisis gelatin pada isolat bakteri (setelah direndam dalam air es) ... 7
11 Hasil pengamatan IMViC isolat bakteri ... 8
12 Hasil pengamatan VP isolat bakteri ... 8
13 Hasil pengamatan oksidase dan katalase isolat bakteri ... 9
14 Hasil pengamatan motilitas isolat bakteri ... 9
15 Hasil pengamatan uji reduksi nitrat ... 10
DAFTAR LAMPIRAN
Halaman1 Komposisi media pertumbuhan bakteri ... 14
2 Komposisi pereaksi kimia yang digunakan ... 15
3 Diagram alir penelitian ... 16
4 Bagan alir identifikasi bakteri batang Gram positif dan Gram negatif ... 17-18
5 Bagan alir identifikasi bakteri
Bacillus spp
... 19
6 Bagan alir identifikasi famili
Enterobactericeae
... 20
PENDAHULUAN
Hidrokarbon adalah senyawa yang mengandung unsur hidrogen dan karbon (H dan C), terdiri atas alkana, alkena, dan alkuna. Senyawa hidrokarbon dalam minyak bumi atau lumpur minyak bumi merupakan salah satu cemaran yang relatif sulit didegradasi. Selain senyawa hidrokarbon, minyak bumi juga mengandung unsur nitrogen, sulfur, dan oksigen. Degradasi minyak bumi menghasilkan bentuk senyawa lain, misalnya alkohol, aldehida, fenol, asam karboksilat, H2O, dan CO2 (Atlas 1981). Masalah
pencemaran lingkungan dapat terjadi karena sifat produk minyak bumi yang sulit didegradasi (Udiharto 1996).
Pencemaran oleh minyak bumi tidak hanya diakibatkan oleh kecelakaan seperti kapal tanker terbentur batu karang, tetapi dapat juga berasal dari aktivitas pengeboran minyak, produksi, pengilangan, transportasi, maupun akibat adanya perembesan dari tangki reservoir. Lingkungan darat maupun air dapat tercemari oleh senyawa organik maupun oleh bahan kimia yang bersifat toksik dan sulit didegradasi dan dapat menggangu kehidupan tanaman maupun organisme lain (Alexander 1999).
Penanganan kondisi lingkungan yang telah tercemari minyak bumi dapat dilakukan dengan metode biologi. Metode ini relatif lebih ramah lingkungan. Penanganan dilakukan menggunakan teknik bioremediasi dengan memanfaatkan mikroorganisme (bakteri atau kapang) atau tanaman untuk menghilangkan cemaran. Mikroorganisme dapat berfungsi sebagai bahan pengurai alami sesudah diadaptasikan dengan senyawa limbah. Hanya mikrob yang dapat beradaptasi dengan minyak bumi dapat melakukan biodegradasi. Di alam, mikroorganisme jarang dijumpai sebagai kultur atau biakan murni, dan biasanya berinteraksi dengan mikroorganisme lain atau dengan organisme inang (Widyastuti 2003).
Bakteri yang umum dan telah diketahui mampu mendegradasi hidrokarbon berasal dari genus Achromobacter, Actinobacter, Alcaligenes, Arthrobacter, Bacillus, Flavobacterium, Nocardia, dan Pseudomonas spp (Leahy & Colwell 1990). Pseudomonas dapat mengurai senyawaan polutan seperti benzena, toluena, xilena, etilbenzena, stirena, dan asam klorobenzoat, sedangkan Enterobacter agglomerans dapat mengurai campuran benzena, etilbenzena, dan xilena. Pada penelitian ini digunakan isolat bakteri
yang diisolasi dari tanah tercemari minyak bumi. Identifikasi dan pencirian dilakukan untuk mengetahui lebih lanjut kemampuan atau potensi bakteri tersebut dalam mengurai cemaran hidrokarbon.
Identifikasi bertujuan menentukan nama spesies mikroorganisme dalam isolat baru. Berbagai metode dapat dipakai, bergantung pada fasilitas laboratorium yang tersedia, mulai dari metode konvensional hingga modern (tingkat molekular). Identifikasi dalam penelitian meliputi uji morfologi, fisiologi, dan aktivitas biokimia. Berdasarkan data identifikasi, dilakukan pencirian isolat bakteri tersebut (Widyastuti 2003). Pada penelitian ini, pencirian dilakukan hanya sampai tingkat genus.
BAHAN DAN METODE
Alat dan BahanAlat-alat yang digunakan antara lain tabung Durham, mikropipet, inkubator, oven, autoklaf, pipet serologi 1 mL, neraca analitik, colony counter, mikroskop, desikator, ruang laminar dan alat-alat yang lazim di laboratorium.
Isolat bakteri yang digunakan berasal dari limbah tercemari minyak bumi dengan kode MY1, MY3, MY6, MY8, MY9, MY10, MY11, MY12 dan MY FLR. Bahan-bahan yang digunakan antara lain media mineral air laut (marine agar), larutan garam fisiologis (NaCl 0.85%), agar nutrien (NA) atau plate count agar (PCA), kaldu nutrien (NB), triple sugar iron agar (TSIA), media Kosser sitrat, media pepton cair 1%, media gelatin, media tripton 1%, Na-tiosulfat, media selektif (McConkey, centrimade agar, brilliant green lactose broth (BGLB), dan mannitol salt agar (MSA), media motilitas, media merah metil -Voges Proskauer (MR-VP), kaldu glukosa, kaldu laktosa (LB), dan sukrosa (Lampiran 1), reagen Kovacs, reagen Erlich, H2O2 3%
Metode Penelitian
Digunakan metode konvensional diawali dengan regenerasi isolat (peremajaan) dilanjutkan dengan identifikasi dan pencirian isolat bakteri berdasarkan Bergey’s Manual of Determinative Bacteriology yang meliputi sifat morfologi, fisiologi, dan aktivitas biokimianya. Analisis meliputi pengamatan bentuk, elevasi, warna, dan permukaan koloni. Pengamatan juga dilakukan terhadap bentuk sel, pewarnaan Gram, kapsul dan spora, uji fermentasi karbohidrat (uji glukosa, laktosa, dan sukrosa), hidrolisis pati, hidrolisis gelatin, hidrolisis lemak, uji Indol, uji merah metil-Voges Proskauer, uji motilitas, uji oksidase-katalase, uji H2S dan reduksi nitrat. Diagram
alir penelitian dapat dilihat pada Lampiran 3 (Aryantha et al. 2000).
Regenerasi Isolat Bakteri
Media agar miring steril disiapkan, isolat biakan murni diinokulasikan secara aseptik kemudian diinkubasi dalam inkubator pada suhu 37 oC selama 24 jam (LabOps 2004).
Uji Morfologi
Hasil regenerasi isolat bakteri masa inkubasi 24 jam diamati secara visual mulai dari bentuk, elevasi, warna, dan permukaan koloni.
Uji Fisiologi (Hadioetomo 1993)
Uji fisiologi meliputi pewarnaan sederhana, pewarnaan Gram, pewarnaan spora, dan pewarnaan kapsul.
Pewarnaan sederhana bertujuan mengamati morfologi sel. Kaca objek dibersihkan dengan kapas beralkohol. Larutan fisiologis diteteskan sebanyak 2–3 tetes, lalu secara aseptik diambil 1 ose isolat bakteri, diratakan, dan dikeringkan dengan difiksasi dekat nyala api Bunsen. Pewarna safranin diteteskan lalu dibiarkan ±1 menit. Kelebihan pewarna dicuci dengan air suling, kemudian preparat dikeringkan dengan kertas saring dan bentuk sel diamati dengan mikroskop pada perbesaran 1000×, dengan ditetesi minyak imersi secara perlahan-lahan. Preparat dibersihkan dan direndam dalam larutan asam kromat.
Pewarnaan Gram bertujuan melihat pengelompokan bakteri berdasarkan perbedaan komponen dinding sel. Kaca objek disterilkan dengan kapas beralkohol. Sebanyak 2–3 tetes larutan fisiologis diteteskan, lalu 1 ose isolat bakteri diambil secara aseptik, diratakan, dan ditambahkan pewarna dasar kristal violet, dibiarkan
kembali 1–2 menit. Kelebihan zat warna dicuci dengan air mengalir kemudian preparat ditambahkan lugol atau campuran aseton-iodin, dibiarkan kembali selama 1-2 menit. Setelah itu, preparat direndam dalam alkohol 96% selama 30 detik, dicuci dengan air mengalir, dan diwarnai dengan safranin sebagai warna standar. Preparat dicuci kembali dan dikeringkan, kemudian diamati di bawah mikroskop dengan perbesaran 1000×.
Pewarnaan spora bertujuan mengamati struktur khusus endospora. Kaca objek dibersihkan dengan kapas beralkohol lalu ditetesi 2–3 tetes larutan fisiologis. Secara aseptik diambil 1 ose isolat bakteri berumur 36 jam. Preparat ditutup dengan kertas saring sambil diteteskan hijau malasit di atas penangas air, terus menerus hingga ±5 menit. Kelebihan zat warna dicuci dengan air mengalir lalu preparat ditetesi safranin selama 30 detik, dan diamati di bawah mikroskop.
Pewarnaan kapsul bertujuan mengamati struktur khusus lapisan pelindung kapsul. Pada kaca objek yang telah disterilkan dengan kapas beralkohol, diteteskan 2–3 tetes larutan fisiologis, lalu ditambahkan 1 ose isolat bakteri berumur 36 jam, diratakan dan diberi kristal violet, dibiarkan terendam selama 5–7 menit. Kelebihan warna dicuci dengan terusi 20% dikeringkan, lalu diamati di bawah mikroskop dengan perbesaran 1000×.
Uji Biokimia (Prescott 2002) Uji biokimia mikrob meliputi fermentasi karbohidrat (glukosa, laktosa, dan sukrosa), hidrolisis (pati, lemak, gelatin, dan kasein), analisis IMViC (indol, MR-VP, sitrat), oksidase-katalase, motilitas, H2S, dan reduksi
nitrat.
Fermentasi Karbohidrat
Isolat bakteri diinokulasi ke dalam tabung berisi media steril (glukosa dan sukrosa), dengan indikator merah fenol. Satu tabung lain digunakan sebagai kontrol tanpa penambahan isolat bakteri, keduanya diinkubasi pada suhu 37 °C selama 48 jam. Untuk media agar laktosa, diinkubasi pada suhu 37 oC selama 24 jam.
Hidrolisis Pati
aseptik lalu diinkubasi selama 36 jam pada suhu 27 °C. Setelah terlihat pertumbuhan bakteri, ditetesi lugol di sekitar biakan dan dibiarkan ±5 menit. Pengamatan dilakukan pada bagian berwarna biru dan tidak berwarna, dicatat hasilnya.
Hidrolisis Lemak
Cawan petri steril dibagi menjadi 4 daerah, diberi nama bakteri yang akan diinokulasikan beserta tanggal inokulasi. Media agar lemak steril dituang hingga menutupi permukaan cawan, diputar perlahan hingga beku. Bakteri diinokulasikan ke 4 daerah, dan dinkubasi pada suhu 30 °C selama 48 jam. Setelah terlihat pertumbuhan bakteri, terusi 5% diteteskan di sekitar biakan, dibiarkan 10–15 menit dan diamati hasil yang terbentuk. Hidrolisis Gelatin
Sebanyak 4 tabung media agar gelatin steril disiapkan. Tiga tabung diinokulasi bakteri, 1 tabung sebagai kontrol. Keempatnya dinkubasi pada suhu 37 °C selama 2–7 hari. Pengamatan dilakukan dalam wadah berisi es. Hidrolisis Kasein
Cawan petri steril dibagi menjadi 4 daerah, diberi nama bakteri yang akan diinokulasikan beserta tanggal inokulasi. Media agar susu steril dituang hingga menutupi permukaan cawan, diputar perlahan hingga beku, lalu 1 ose bakteri diinokulasikan pada keempat daerah. Inkubasi dilakukan pada suhu 37 °C selama 3–7 hari, hasil yang terbentuk diamati perubahannya.
Uji Indol
Sebanyak 2 tabung berisi kaldu tripton 1% dan 1 tabung berisi kaldu tripton 1% + glukosa 1% diinokulasi dengan biakan bakteri. Satu tabung lainnya berisi kaldu tripton tanpa penambahan biakan (kontrol). Keempat tabung diinkubasi pada suhu 37 °C selama 2–7 hari. Setelah masa inkubasi selesai, tabung berisi biakan dan tabung kontrol ditambahkan pereaksi Kovacs, dikocok perlahan hingga terlihat adanya lingkaran merah (positif).
Uji Merah Metil dan Voges Proskauer Sebanyak 1 ose bakteri diinokulasi ke dalam media MR–VP cair, diinkubasi pada suhu 35 °C selama 48 jam. Kira-kira 2 mL suspensi kultur dipindahkan ke tabung steril untuk uji merah metil(MR) dan diberi 5 tetes indikator MR. Untuk uji Voges Proskauer (VP), sebanyak 5 mL sisa kultur dituang ke
dalam tabung steril, ditambahkan berturut-turut 10 tetes larutan KOH 40% dan 15 tetes reagen α-naftol 1%. Campuran dikocok hingga larut sempurna dan dibiarkan selama 30 menit. Perubahan yang terjadi diamati. Uji Kosser Sitrat
Agar Kosser sitrat diinokulasi dengan isolat bakteri, lalu diinkubasi dalam suhu 35 °C selama 48 jam. Hasil positif ditandai dengan terbentuknya warna biru pada medium.
Uji Oksidase dan Katalase
Untuk uji oksidase, isolat bakteri yang tumbuh di permukaan agar ditambahkan 1–2 tetes reagen oksidase, lalu terbentuknya warna biru pada media diamati selama 30 detik. Untuk uji katalase, pada koloni bakteri diteteskan 1–2 tetes H2O2 3%, diamati
terbentuk atau tidaknya gelembung udara. Motilitas
Isolat bakteri ditanam dalam agar tegak dengan metode stab (tusuk) kurang lebih ¾ tinggi tabung, tetapi tidak sampai menyentuh dasar tabung. Kultur diinkubasi pada suhu 37 °C selama 24 jam, kemudian hasilnya diamati. Uji H2S
Pada 2 tabung yang berisi media TSIA steril, diinokulasikan 1 ose isolat bakteri dengan metode tusuk, lalu diinkubasi pada suhu 37 °C selama 48 jam. Diamati terbentuk atau tidaknya blackening/area hitam pada media di daerah inokulasi bakteri.
Reduksi Nitrat
Isolat bakteri diinokulasi ke dalam tabung berisi media NB steril, dan satu tabung media disiapkan sebagai kontrol. Kedua tabung diinkubasi pada suhu 37 °C selama 48 jam. Untuk uji nitrit, pada masing-masing tabung ditambahkan 1 mL asam sulfanilat dan α -naftilamina lalu dikocok dan diamati hasilnya.
ini dimaksudkan agar bakteri yang tumbuh merupakan bakteri yang berperan dalam proses degradasi limbah hidrokarbon (Dwipayana & Herto 2010).
Regenerasi isolat ini dilakukan pada suhu 30 °C selama 24 jam. Regenerasi diawali dengan pengenceran sampel isolat dilanjutkan dengan penanaman sampel ke dalam media NA. Pengenceran bertujuan agar koloni yang tumbuh tidak terlalu padat sehingga memudahkan dalam identifikasi selanjutnya (Dwipayana & Herto 2010). Hasil regenerasi dapat dilihat pada Gambar 1.
Gambar 1 Hasil regenerasi isolat bakteri. Morfologi Isolat Bakteri
Pengamatan morfologi bakteri dilakukan terhadap isolat bakteri berumur 24 jam. Morfologi yang diamati meliputi bentuk, elevasi, warna, dan permukaan koloni. Pengamatan dilakukan secara visual. Pengamatan ini penting dilakukan sebagai dasar pengujian selanjutnya. Hasil pengamatan morfologi koloni isolat bakteri dapat dilihat pada Tabel 1.
Tabel 1 Morfologi koloni Isolat Bentuk Elevasi Warna Permukaan
MY 1 Bulat Naik Krem Halus mengilat
MY 3 Bulat Naik Krem Halus mengilat
MY 6 Bulat Naik Krem Halus mengilat
MY 8 Bulat Naik Krem Halus mengilat
MY 9 Bulat Naik Krem Halus mengilat
MY 10 Bulat Naik Krem Halus mengilat
MY 11 Bulat Naik Krem Halus Mengilat
MY 12 Bulat Naik Agak kuning
Halus mengilat
MYFLR Bulat Datar Krem Berserabut halus
Tabel 1 memperlihatkan bahwa isolat dengan kode MY 1, MY 3, MY 6, MY 8, MY 9, MY 10, dan MY 11 memiliki ciri morfologi yang serupa, yaitu bentuk bulat, elevasi naik, warna krem, dan permukaan halus mengilat (Gambar 1) sehingga diduga masuk ke dalam genus Bacillus sp (Lampiran
4). Isolat MY 12 bentuk, elevasi, dan permukaannya sama, tetapi warna koloninya agak kuning. Warna koloni ini dimiliki oleh golongan Pseudomonas sp. Sementara isolat MY FLR memiliki tepian dan permukaan koloni yang berbeda, yaitu elevasi datar, permukaan berserabut halus yang lazim dijumpai pada golongan kapang (Gambar 2).
Gambar 2 Isolat koloni bakteri MY FLR. Fisiologi Isolat Bakteri
Mikroorganisme mempunyai morfologi, struktur, dan sifat-sifat yang khas, begitu pula dengan bakteri. Bakteri hidup hampir tidak berwarna dan kontras dengan air tempat sel-sel bakteri tersebut disuspensikan. Salah satu cara mengamati bentuk sel bakteri sehingga mudah diidentifikasi ialah dengan metode pewarnaan. Pengamatan meliputi pewarnaan sederhana, pewarnaan Gram, pewarnaan spora dan kapsul. Pewarnaan Gram merupakan suatu metode empiris untuk membedakan spesies bakteri menjadi 2 kelompok besar, yaitu Gram positif dan Gram negatif berdasarkan sifat kimia dan fisik dinding sel bakteri.
Berdasarkan pewarnaan Gram, isolat dengan kode MY 1, MY 3, MY 6, MY 8, dan MY 9 tergolong Gram positif yang ditandai dengan sel berwarna ungu (Gambar 3). Bakteri Gram positif dapat menahan senyawaan kompleks kristal violet, sedangkan bakteri Gram negatif tidak mampu menahannya dan karena itu, terwarnai oleh pewarna kedua (Hadioetomo 1993), (Lampiran 5).
Gambar 3 Isolat bakteri Gram positif (kiri) dan Gram negatif (kanan).
krem agak kuning (MY12), dan bersifat Gram negatif (sel berwarna merah), diduga adalah Pseudomonas (Gambar 4). Keseluruhan hasil pengamatan fisiologi isolat bakteri dapat dilihat pada Tabel 2.
Gambar 4 Isolat koloni bakteri Gram negatif. Tabel 2 Sifat-sifat fisiologi sel Isolat Bentuk Gram Spora Kapsul MY 1 Batang Positif Ada Tidak ada MY 3 Batang Positif Ada Tidak ada
MY 6 Batang Positif Tidak
ada Tidak ada
MY 8 Batang Positif Tidak
ada Tidak ada
MY 9 Batang Positif Tidak
ada Tidak ada MY 10 Batang Negatif Ada Tidak ada MY 11 Batang Negatif Ada Tidak ada MY 12 Batang Negatif Ada Tidak ada MY
FLR
Batang Negatif Tidak terlihat
Tidak ada
Berdasarkan sifat fisiologi dan morfologi, isolat MY 1, MY 3, MY 6, MY 8, dan MY 9 diduga masuk ke dalam genus Bacillus sp (Fardiaz 1998), sedangkan isolat MY 10, MY 11, dan MY FLR diduga genus Bacillus sp, tetapi dengan sifat Gram negatif. Isolat dengan kode MY 12 berdasarkan cirinya, yaitu bentuk sel batang panjang, warna koloni krem agak kuning, dan Gram negatif diduga termasuk genus Pseudomonas sp. Secara umum, Dharmawibawa (2004) (dalam Darmayasa 2008) mengungkapkan bahwa genus Bacillus sp dan Pseudomonas sp mampu merombak hidrokarbon minyak bumi.
Pewarnaan spora dilakukan untuk mengamati kemampuan suatu bakteri menghasilkan spora yang berfungsi melindungi sel vegetatif dari kondisi ekstrem di luar sel yang dapat membahayakannya (Hadioetomo 1993). Endospora sel memiliki lapisan khusus yang sulit ditembus zat pewarna, maka dilakukan pemanasan dalam preparasi preparat selama proses pengikatan warna dasar (malasit hijau). Pemanasan bukan hanya membuat spora yang terwarnai hijau, melainkan juga sel vegetatif. Oleh karena itu, pencucian dengan air mengalir diperlukan untuk menghilangkan kelebihan zat warna yang menempel pada dinding sel. Dinding sel yang tidak berwarna ini kemudian
diwarnai dengan warna pembanding, yaitu safranin (merah muda), sehingga spora tetap berwarna hijau dan sel vegetatif berwarna merah (Gambar 5).
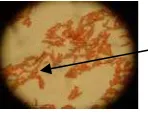
Gambar 5 Isolat bakteri penghasil spora. Hasil penelitian (Tabel 2) menunjukkan bahwa isolat dengan kode MY 1, MY 3, MY 10, MY 11, dan MY 12 memiliki endospora yang terletak di ujung dan subujung (Gambar 5). Sementara pada isolat MY 6, MY 8, MY 9, dan MY FLR tidak ditemukan endospora.
Endospora dapat bersifat dorman untuk waktu yang cukup lama. Selain itu, endospora sangat tahan terhadap panas tinggi, radiasi gelombang pendek, dan bahan kimia beracun (Anonim 2000). Dengan sifat tersebut, endospora diharapkan dapat membantu mendegradasi cemaran limbah hidrokarbon.
Pewarnaan kapsul dilakukan untuk mengamati keberadaan struktur khusus lapisan pelindung kapsul pada bakteri. Dari hasil identifikasi, tidak terdapat isolat yang memiliki lapisan pelindung kapsul (Gambar 6).
Gambar 6 Isolat tanpa pelindung kapsul. Berdasarkan pengamatan pewarnaan kapsul diduga isolat bakteri mudah diberi perlakuan karena tidak ada pelindung kapsul yang membungkus sel. Karena itu, bakteri ini diharapkan memiliki potensi dalam merombak hidrokarbon.
Aktivitas Biokimia
aktivitas biokimia atau metabolisme mikroorganisme digunakan untuk identifikasi dan pencirian mikroorganisme dalam penelitian ini (Djide & Sartini 2006).
Fermentasi Karbohidrat
Fermentasi karbohidrat merupakan proses oksidasi karbohidrat secara biologis dalam keadaan anaerob. Hasil fermentasi berbeda-beda, bergantung pada jenis bakterinya. Pada penelitian ini digunakan 3 media karbohidrat, yaitu glukosa, sukrosa, dan laktosa (Djide & Sartini 2006). Tabel 3 menunjukkan perbandingan hasil fermentasi karbohidrat ke-9 isolat bakteri dengan kontrol.
Tabel 3 Fermentasi karbohidrat
Isolat Fermentasi
Glukosa Laktosa Sukrosa
MY1 + + +
MY3 + + +
MY6 - - -
MY8 - - +
MY9 + + +
MY10 + + - MY11 + + + MY12 + - +
MYFLR - - -
Kontrol - - -
Keterangan: (+) perubahan warna larutan merah menjadi kuning; (-) tidak terjadi perubahan warna
Pada uji fermentasi karbohidrat, hasil positif dilihat dari perubahan warna larutan media dari merah menjadi kuning serta pembentukan gas yang terlihat dalam tabung Durham terbalik. Perubahan warna media disebabkan oleh adanya indikator merah fenol dalam media mengalami penurunan pH dalam keadaan aerob. Hasil positif tersebut ditunjukkan oleh isolat MY 1, MY 3, MY 9, dan MY 11 untuk semua jenis karbohidrat (Gambar 7).
Gambar 7 Fermentasi karbohidrat (glukosa, sukrosa, dan laktosa).
Isolat dengan kode MY 6 dan MY FLR tidak mampu memfermentasikan semua jenis karbohidrat yang diujikan. MY 8 tidak mampu memfermentasi glukosa dan laktosa, MY 10 tidak mampu memfermentasi sukrosa, dan MY 12 tidak mampu memfermentasi laktosa.
Hasil ini dipengaruhi oleh sifat mikrob di dalamnya, media biakan yang digunakan, serta faktor lingkungan seperti suhu dan pH (Reynolds 2009). Berdasarkan kemampuan memfermentasi ketiga jenis karbohidrat, diduga isolat MY 1, MY 3, MY 9, dan MY 11 termasuk ke dalam golongan Bacillus sp (Lampiran 6). Menurut Djide dan Sartini (2006), umumnya spesies Bacillus mampu memfermentasikan glukosa dan laktosa. MY 12 yang inaktif terhadap laktosa diduga termasuk golongan Pseudomonas sp, sedangkan isolat MY FLR memberikan hasil negatif untuk ketiga jenis gula.
Sifat Hidrolisis
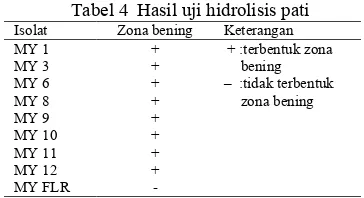
Hidrolisis Pati. Salah satu polisakarida yang dapat dihidrolisis oleh mikroorganisme adalah pati (amilum) dengan hasil akhir dekstrin. Hidrolisis ini terjadi karena adanya enzim amilase yang dapat dihasilkan oleh mikroorganisme tertentu. Hasil penelitian menunjukkan bahwa seluruh isolat mampu menghidrolisis pati terlihat dari perubahan warna di sekitar isolat (Gambar 8).
Gambar 8 Hasil uji hidrolisis pati isolat bakteri.
Zona bening (area sekitar biakan tidak menjadi biru) menandakan pati telah terhidrolisis, sedangkan daerah berwarna biru menandakan masih terdapat butir-butir pati. Tabel 4 menunjukkan adanya zona bening di sekitar biakan bakteri pada uji hidrolisis pati, kecuali isolat MY FLR.
Tabel 4 Hasil uji hidrolisis pati Isolat Zona bening Keterangan MY 1 + + :terbentuk zona
bening – :tidak terbentuk
zona bening
MY 3 +
MY 6 +
MY 8 +
MY 9 +
MY 10 +
MY 11 +
MY 12 +
MY FLR -
ikatan-ikatan hidrokarbon dalam cemaran limbah.
Hidrolisis Lemak. Hidrolisis mengurai
molekul lemak menjadi gliserol dan asam lemak. Asam lemak ini kemudian dibentuk menjadi lemak bakteri atau komponen sel atau sebagai energi. Dari hasil percobaan, hanya isolat MY6 yang mampu menghidrolisis lemak (Tabel 5), dan karena itu diduga termasuk genus Bacillus (Reynolds 2009). Hasil positif ditandai dengan terbentuknya butiran berwarna hijau di sekitar biakan koloni (Gambar 9).
Tabel 5 Hasil uji hidrolisis lemak
Gambar 9 Hidrolisis lemak isolat bakteri. Hidrolisis Gelatin. Gelatin adalah protein yang diperoleh dari hidrolisis kolagen. Kolagen adalah salah satu komponen dalam jaringan penghubung dan otot pada hewan. Gelatin merupakan substrat yang baik untuk menguji adanya enzim proteolitik yang dihasilkan mikrob. Larutan gelatin yang digunakan sebagai medium bersifat cair dalam suhu kamar dan padat dalam suhu es (0–4 °C). Hasil pengamatan hidrolisis gelatin oleh isolat bakteri ditunjukkan pada Tabel 6.
Tabel 6 Hasil uji hidrolisis gelatin
Berdasarkan hasil penelitian, seluruh isolat tidak mampu menghidrolisis gelatin. Media tetap membeku ketika diletakkan dalam wadah berisi es batu (Gambar 10).
Gambar 10 Hidrolisis gelatin pada isolat bakteri (setelah direndam dalam air es)
Umumnya golongan Bacillus mampu menghidrolisis gelatin, tetapi identifikasi di atas menunjukkan hasil berbeda. Kemungkinan hal tersebut terjadi karena isolat bakteri tidak mampu membuat enzim gelatinase yang terbentuk karena pemadatan dan pencairan.
Hidrolisis Kasein. Kasein adalah protein pokok susu, suspensi koloid yang menyebabkan susu berwarna putih mengilat. Apabila mikrob mampu menghidrolisis protein ini, maka akan tampak zona bening di sekitar koloni mikrob. Pengamatan hidrolisis kasein terhadap isolat bakteri dapat dilihat pada Tabel 7.
Tabel 7 Hasil uji hidrolisis kasein
Analisis IMViC
Uji produksi indol dilakukan untuk mengetahui mikroorganisme yang dapat menggunakan asam amino baik sebagai komponen protein, komponen sel, atau kadangkala sebagai sumber energi. Asam amino ini dimodifikasi dengan berbagai cara sewaktu metabolisme. Asam amino triptofan lazim terdapat dalam protein dan dapat dengan mudah digunakan oleh mikroorganisme. Hidrolisis oleh enzim triptofanase akan menghasilkan indol dan asam piruvat (Djide & Sartini 2006). Pada Isolat Hasil Keterangan
MY 1 - + : terbentuk butiran berwarna hijau di sekitar biakan - : tidak terbentuk butiran
hijau di sekitar biakan koloni
MY 3 - MY 6 + MY 8 - MY 9 -
MY 10 - MY 11 - MY 12 - MY FLR - Kontrol -
Isolat Hasil Keterangan MY 1 - +: media menjadi tidak
berwarna/bening –: media membeku kontrol: media putih susu MY 3 -
MY 6 - MY 8 - MY 9 - MY 10 - MY 11 - MY 12 - MY FLR - Kontrol -
Isolat Hasil Keterangan MY 1 - +: media tetap cair meski
direndam dalam bongkahan es
- : media membeku kontrol: media tetap beku MY 3 -
penelitian ini digunakan media cair kaya triptofan dalam bentuk tripton 1%. Indol yang terbentuk, dengan penambahan reagen Kovacs akan menghasilkan senyawa p -aminobenzaldehida yang tidak larut dalam air dan membentuk warna merah pada permukaan media (Gambar 11a).
Gambar 11 Hasil pengamatan IMViC isolat bakteri.
Hanya pada sampel MY 11 terbentuk cincin merah di sekitar permukaan media, sampel lainnya tidak (Tabel 8). Hal ini menunjukkan bahwa sampel MY 11 adalah bakteri penghasil indol yang umumnya dari genus Enterobacter atau Pseudomonas. Uji dengan reagen Kovacs harus segera dilakukan setelah inkubasi. Waktu inkubasi yang terlalu lama dapat menyamarkan hasil (hasil yang didapat tidak sesuai dengan yang sebenarnya).
Tabel 8 Hasil uji produksi indol
Uji merah metil digunakan untuk menentukan terjadinya fermentasi yang menghasilkan campuran asam. Beberapa bakteri dapat memfermentasi glukosa dan menghasilkan berbagai produk asam organik sederhana yang menurunkan pH media pertumbuhan. Indikator merah metil digunakan sebagai penunjuk terjadinya perubahan pH dan akan menjadi merah pada suasana asam (pH sekitar 4.4) dan kuning pada suasana basa (pH sekitar 6.2) (Gambar 11b). Hasil positif ditunjukkan oleh isolat dengan kode MY 1, MY 3, MY 8, MY 11 dan MY 12 yang merupakan ciri golongan Bacillus sp dan Pseudomonas sp (Tabel 9).
Tabel 9 Hasil uji MR-VP Isolat Hasil
MR VP
MY 1 + -
MY 3 + -
MY 6 - -
MY 8 + -
MY 9 - -
MY 10 - -
MY 11 + -
MY 12 + -
MY FLR - -
Kontrol - - Keterangan:
+: larutan berwarna merah –: larutan berwarna sindur atau jernih
Uji Voges–Proskueur juga digunakan untuk mengidentifikasi mikroorganisme yang dapat melakukan fermentasi tetapi dengan hasil akhir 2,3-butanadiol. Pada uji ini ditambahkan larutan KOH 40% dan α-naftol 1% yang dapat menentukan adanya asetoin, senyawa pemula dalam sintesis 2,3 butanadiol. Dengan larutan KOH 40%, asetoin memunculkan warna merah yang dipertegas oleh beberapa tetes larutan α-naftol 1%. Pada uji VP ini, isolat yang diuji menunjukkan hasil negatif, artinya tidak dapat menghasilkan asetoin, asetil, metil karbinol dan etanol (Gambar 12). Ciri ini umum dimiliki oleh bakteri golongan Bacillus sp.
Gambar 12 Hasil pengamatan VP isolat bakteri.
Uji sitrat digunakan untuk melihat kemampuan mikroorganisme menggunakan sitrat sebagai satu-satunya sumber karbon dan energi. Penelitian ini menggunakan medium sintetik Kosser sitrat dengan natrium sitrat sebagai sumber karbon, amonia sebagai sumber nitrogen, dan indikator pH. Bila mikrob mampu menggunakan sitrat, maka asam akan dihilangkan dari medium biakan, pH meningkat, dan warna medium berubah dari tak berwarna menjadi biru (Gambar 11c). Hasil identifikasi ditunjukkan pada Tabel 10. Isolat Hasil Keterangan
MY 1 - +: terbentuk cincin merah atau lingkaran merah diatas permukaaan media setelah penambahan pereaksi Kovacs
-: tidak terbentuk cincin merah kontrol: tidak berwarna MY 3 -
MY 6 - MY 8 - MY 9 - MY 10 - MY 11 + MY 12 - MY FLR - Kontrol -
Tabel 10 Hasil uji Kosser sitrat
Tidak adanya perubahan warna media, berarti isolat bakteri tidak mampu menggunakan sitrat sebagai sumber karbon. Ciri ini lazim dimiliki oleh bakteri golongan Enterobacter (Lampiran 6).
Oksidase-Katalase
Oksidase umumnya bekerja pada respirasi aerob menghasilkan CO2 dan H2O dengan
tujuan akhir akumulasi energi, untuk aktivitas mikroorganisme maupun proses-proses biologis lainnya (Djide & Sartini 2006). Uji oksidase positif ditunjukkan dengan warna koloni keunguan sekitar 2 menit setelah penambahan reagen oksidase (Gambar 13a).
a. uji oksidase b. uji katalase
Gambar 13 Hasil pengamatan oksidase dan katalase isolat bakteri.
Uji katalase dilakukan untuk mengetahui aktivitas katalase pada bakteri. Enzim ini memecah H2O2 (peroksida) menjadi H2O dan
O2 karena itu, uji katalase positif ditunjukkan
oleh gelembung-gelembung O2 hasil
pemecahan H2O2 (Gambar 13b). Hidrogen
peroksida merupakan salah satu produk respirasi aerob bakteri yang toksik sehingga dapat menghambat pertumbuhan bakteri itu sendiri dan harus diurai (Todar 2008). Hasil keseluruhan uji oksidase dan katalase ditunjukkan pada Tabel 11.
Tabel 11 Hasil uji oksidase-katalase
Keterangan: (+) oksidase: warna koloni keunguan setelah ditambah reagen (10–15 detik). (+) katalase: timbulnya gelembung udara.
Uji oksidase umumnya digunakan untuk membedakan golongan Pseudomonas dan Enterobacter (Reynolds 2009). Tidak ada isolat yang menunjukkan hasil positif. Hal ini dapat terjadi karena produksi sitokrom oksidase oleh isolat bakteri tersebut dihambat oleh produksi asam atau bakteri dalam isolat tidak mampu memproduksi sitokrom oksidase atau telah terkontaminasi nitrat sehingga memberikan hasil yang berbeda. Dapat pula terjadi, reagen oksidase telah kehilangan aktivitasnya atau kedaluwarsa.
Katalase dilakukan untuk mengidentifikasi kelompok bakteri bentuk kokus. Hasil positif, yaitu gelembung udara di sekitar koloni setelah ditambahkan H2O2 3%, hanya
ditunjukkan oleh isolat MY 6 (Gambar 13b). Motilitas
Motilitas adalah salah satu ciri makhluk hidup, begitu juga mikroorganisme, namun dengan alat gerak yang sederhana berupa silia atau flagela. Pada percobaan ini, motilitas ditandai dari gerak pertumbuhan dalam agar tegak (bekas tusukan pada media, yang telah diinokulasi oleh biakan dan diinkubasi), ditunjukkan pada Gambar 14.
Gambar 14 Hasil pengamatan motilitas isolat bakteri.
Isolat Hasil Keterangan MY 1 - +: larutan berwarna biru
- : larutan tidak berwarna kontrol: larutan tidak
berwarna MY 3 -
MY 6 - MY 8 - MY 9 - MY 10 -
MY 11 - MY 12 - MY FLR - Kontrol -
Isolat Oksidase Katalase
MY 1 - -
- + - - - - - - - MY 3 -
Tabel 12 menunjukkan hasil pengamatan motilitas isolat bakteri. Sifat motil ini umumnya dimiliki oleh bakteri golongan Bacillus (Hadioetomo 1993).
Tabel 12 Hasil motilitas isolat bakteri
Analisis H2S
H2S diproduksi oleh beberapa jenis
mikroorganisme melalui pemecahan asam amino yang mengandung unsur belerang seperti sistein dan metionin. Keberadaan H2S
ditandai dengan terbentuknya sulfida yang berwarna hitam. Uji ini lazim digunakan untuk membedakan bakteri golongan Enterobacter (Djide & Sartini 2006). Tabel 13 menunjukkan tak satu pun isolat mampu menghidrolisis sulfur yang terdapat dalam medium.
Tabel 13 Hasil uji H2S
Reduksi Nitrat
Reduksi nitrat dilakukan untuk menguji kemampuan bakteri mengubah nitrat menjadi nitrit, umumnya dimiliki oleh golongan Pseudomonas (Reynolds 2009). Tabel 14 menunjukkan, isolat dengan kode MY 1, MY 6, MY 8, MY 9, MY 10, MY 12 dan MY FLR menunjukan kemampuan bakteri mengubah nitrat (merah) menjadi nitrit (kuning) yang ditandai dengan perubahan kondisi lingkungan dalam media (Gambar 15). Isolat MY 11 memperlihatkan perubahan kondisi lingkungan, tetapi tanpa disertai timbulnya gas, dan isolat MY 3 tidak menunjukkan perubahan.
Gambar 15 Pengamatan uji reduksi nitrat. Tabel 14 Hasil uji reduksi nitrat Isolat Hasil Keterangan MY 1 A (A): Larutan berubah asam
(AG): Larutan berubah asam disertai timbulnya gas (O): Tidak menunjukkan Perubahan MY 3 O
MY 6 AG MY 8 AG MY 9 AG MY 10 AG MY 11 A MY 12 AG MY FLR AG Kontrol -
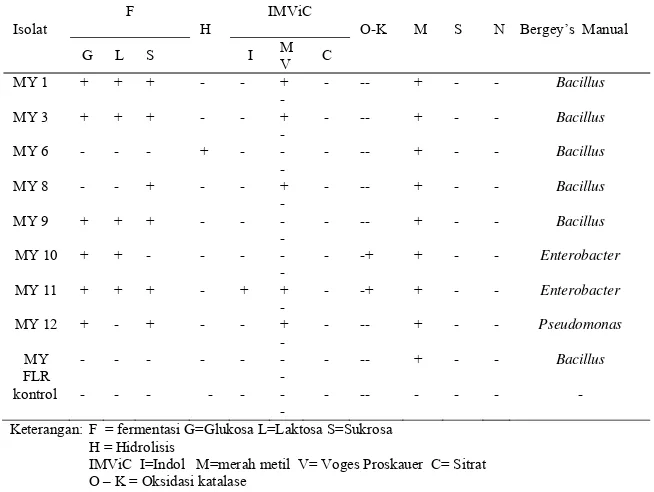
Berdasarkan hasil uji biokimia (Tabel 15), isolat bakteri MY 1, MY 3, MY 6, MY 8, MY 9, dan MY FLR diduga termasuk golongan Bacillus, kode MY 10 dan MY 11 termasuk Enterobacter, dan MY 12 Pseudomonas. Dugaan ini berdasarkan identifikasi bakteri teknik konvensional, yaitu membandingkan dengan bakteri yang telah diidentifikasi sebelumnya dalam Bergey’s Manual of Determinative Bacteriology. Bagan alir identifikasi selengkapnya ditunjukkan pada Lampiran 7.
Bila tidak terdapat bakteri yang ciri-cirinya 100% serupa, maka dilakukan pendekatan terhadap bakteri yang memiliki ciri-ciri paling menyerupai. Teknik identifikasi dengan metode konvensional ini akan selalu menghasilkan bakteri tertentu yang sudah teridentifikasi sebelumnya dan tidak dapat menemukan spesies baru (Cowan 1974 dalam Dwipayana & Herto 2004).
Bakteri yang didentifikasi dari cemaran limbah minyak bumi kemungkinan besar turut berperan dalam proses degradasi limbah minyak bumi secara biologi. Penelitian Nugroho 2006, Saidi et al. (1999) dan Nababan (2008) mengidentifikasi bahwa isolat bakteri dari cemaran limbah minyak bumi merupakan genus Bacillus, Enterobacter dan Pseudomonas. Bakteri tersebut bertahan hidup dalam cemaran hidrokarbon dengan mendegradasi hidokarbon dalam limbah sebagai sumber karbon.
Nama Hasil Keterangan
MY 1 + +: Ada pertumbuhan bakteri melebar ke samping daerah sekitar tusukan atau melebar di atas permukaan agar MY 3 +
MY 6 + MY 8 + MY 9 + MY 10 + MY 11 + MY 12 + MY FLR + Kontrol -
Isolat Hasil Keterangan MY 1 - +: terbentuk warna
hitam di sekitar tusukan -: tidak terbentuk MY 3 -
MY 6 - MY 8 -
Tabel 15 Karakteristik isolat bakteri berdasarkan aktivitas biokimia
Isolat
F
H
IMViC
O-K M S N
Bergey’s Manual
G L S I M
V C MY 1 + + + - - +
-
- -- + - - Bacillus
MY 3 + + + - - + -
- -- + - - Bacillus
MY 6 - - - + - - -
- -- + - - Bacillus
MY 8 - - + - - + -
- -- + - - Bacillus
MY 9 + + + - - - -
- -- + - - Bacillus
MY 10 + + - - - - -
- -+ + - - Enterobacter
MY 11 + + + - + + -
- -+ + - - Enterobacter
MY 12 + - + - - + -
- -- + - - Pseudomonas
MY FLR
- - - - - - -
- -- + - - Bacillus
kontrol - - - - -
- -- - - - -
Keterangan: F = fermentasi G=Glukosa L=Laktosa S=Sukrosa H = Hidrolisis
IMViC I=Indol M=merah metil V= Voges Proskauer C= Sitrat O – K = Oksidasi katalase
M = Motilitas S = uji H2S
N= uji nitrit
SIMPULAN DAN SARAN
SimpulanBerdasarkan hasil identifikasi dan karakterisasi sifat morfologi, fisiologi dan aktivitas biokimia setelah dibandingkan dengan panduan menurut Bergey’s Manual Determinative of Bacteriology, isolat bakteri MY 1, MY 3, MY 6, MY 8, MY 9, MY FLR diduga termasuk golongan Bacillus, MY 10 dan MY 11 diduga golongan Enterobacter, dan isolat MY 12 diduga golongan Pseudomonas.
Saran
Perlu dilakukan pencirian lebih lanjut isolat bakteri sampai tingkat molekular untuk memastikan genus dan spesies bakteri tersebut. Bakteri juga perlu diuji kemampuannya dalam mendegradasi senyawa hidrokarbon alifatik atau aromatik.
DAFTAR PUSTAKA
Alexander M. 1999. Biodegradation and Bioremediation. London: Academic Pr.
Anonim. 2000. Lesson 19; Endospore Forming Bacteria. New Delhi: Rai University Pr.
Aryantha N, et al. 2000. Penuntun Mikrobiologi Praktik. Bandung: Fakultas Matematika dan Ilmu Pengetahuan AIam, Institut Teknologi Bandung.
Atlas RM. 1981. Microbial degradation of petroleum hydrocarbon: An environmental perspective.Microbiol Rev 45:180-209. Darmayasa IBG. 2008.Isolasi dan identifikasi
bakteri pendegradasi lipid (lemak), pada beberapa tempat pembuangan limbah dan estuari dam denpasar. Bumi Lestari 8:122-127.
Djide N, Sartini. 2006. Dasar-Dasar Mikrobiologi. Makassar: Laboratorium Mikrobiologi Farmasi, Universitas Hasanuddin.
Fardiaz S. 1998. Fisiologi Fermentasi. Bogor: PAU dan Lembaga Sumber Data Informasi, Institut Pertanian Bogor.
Hadioetomo RS. 1993. Mikrobiologi Dasar dalam Praktek. Jakarta: Gramedia Pustaka Utama.
LabOps(Laboratory Operation). 2004. Tes 304: Elemen 2, Cara Pembuatan Media Perbenihan :AusAID.
Leahy JG, Colwell RR. 1990. Microbial degradation of hydrocarbons in the environment. Microbiol Rev 54:305-315. Nababan B. 2008. Isolasi dan uji potensi
bakteri pendegradasi minyak solar dari laut Belawan [tesis]. Medan: Fakultas Matematika dan Ilmu Pengetahuan Alam, Biologi. Universitas Sumatera Utara. Nugroho A. 2006. Biodegradasi sludge
minyak bumi dalam skala mikrokosmos. J Ilmu Tanah dan Lingkungan 10:82-89. Prescott H. 2002. Laboratory Exercise in
Microbiology. New York: Mc-Graw Hill. Reynolds J. 2009. Lab. Manual: Identification
of Microbiology. Texas: Richland Coll. Saidi D, Anas I, Hadi N, Santoso DA. 1999.
Kemampuan bakteri dari ekosistem air hitam Kalimantan tengah dalam merombak minyak bumi dan solar. J Ilmu Tanah dan Lingkungan 2:1-7.
Todar K. 2008. Todar Online Textbook of Bacteriology. http://www.textbook of bacteriology.net [20 Jun 2011].
Udiharto. 1996. Bioremediasi minyak bumi. Di dalam: Peranan Bioremediasi dalam Pengelolaan Lingkungan. Prosiding Pelatihan dan Lokakarya; Cibinong, 24-28 Jun 1996. Cibinong: LIPI-BPPT HSF, hlm 24-28
Widyastuti Y. 2003. Dasar-Dasar Mikrobiologi. Di dalam: Pengajaran Mata Diklat Mikrobiologi untuk Guru. Pelatihan dan Lokakarya Tenaga Pengajar Biologi. Bogor. 24-28 Mar 2002. Bogor: Puslit-Biologi, LIPI
LAMPIRAN
Lampiran 1 Komposisi media pertumbuhan bakteri
No Media Komposisi
1 Media gelatin Sebanyak 150 g gelatin dilarutkan dengan akuades
hingga 1000 mL, cek pH 6.7±7.0, lalu disterilisasi dengan autoklaf.
2 Media Kosser sitrat Sebanyak 5 g NaCl; 0,28 g MgSO4.7 H2O; 1 g
(NH4)2HPO4; 1 g KH2PO4; 2 g asam sitrat cek pH
6.7±7.0, dilarutkan dengan akuades hingga 1000 mL, dan disterilisasi dengan autoklaf.
3 Kaldu laktosa (LB) Sebanyak 3 g pepton daging; 3 g ektrak daging; 5 g laktosa cek pH 6.7±7.0, dilarutkan dengan akuades hingga 1000 mL dan disterilisasi dengan autoklaf.
5 Kaldu nutrien (NB) Sebanyak 2 g pepton daging; 3 g ekstrak daging, cek pH 6.7±7.0 dilarutkan dengan akuades hingga 1000 mL dan disterilisasi dengan autoklaf.
6 Media MR-VP Sebanyak 0,5 g D-glukosa; 0,5 g K2HPO4; 0,5 g
pepton, cek pH 6.7±7.0 dilarutkan dalam akuades hingga 1000 mL dan disterilisasi dengan autoklaf.
7 Media motilitas Sebanyak 80 g gelatin; 10 g pepton daging; 3 g
ekstrak daging; 3 g NaCl; 30 g agar, cek pH 6.7±7.0 dilarutkan dengan akuades hingga 1000 mL dan disterilisasi dengan autoklaf
8 Media tripton 1 % Sebanyak 10 gram tripton dilarutkan akuades
hingga 1000 mL dan disterilisasi dengan autoklaf 9 Media pepton cair 1% Sebanyak 10 g pepton dilarutkan dalam akuades
hingga 1000 mL dan disterilisasi dengan autoklaf 10 Larutan fisiologis 0.83% Sebanyak 0,83 g NaCl, dilarutkan dengan akuades
100 mL dan di sterilisasi dalam autoklaf 11 Media marine agar
(media agar laut)
Sebanyak 0.5 g pepton, 1 g ekstrak khamir, 0.1 g besi sitrat, 19.45 g NaCl, 8.8 g MgCl, 3.24 g Na-sulfat, 1.88 g CaCl2, 0.55 g KCl, 0.16 g Na-
bikarbonat, 34 mg SrCl2, 22 mg H3BO3, 4 mg
Na-silikat, 2.4 mg Na-F, 1.6 mg NH4-nitrat, 8 mg
Lampiran 2 Komposisi pereaksi kimia
No Pereaksi Cara pembuatan
1 Alkohol 70% 74 mL etanol 96% dilarutkan dalam akuades
hingga 100 mL
2 Asam alkohol 1% 3 mL asam klorida pekat dilarutkan dalam
alkohol 96% hingga 100 mL
3 Aseton iodine 1:1 10 g iodin, 4 g KI dilarutkan dengan 10 mL
akuades lalu ditambah etanol 96% hingga 100 mL (larutan A). Sebanyak 4 mL diambil dan dilarutkan dengan aseton hingga 100 mL
4 Asam sulfanilat 1% 1 g asam sulfanilat dilarutkan ke dalam
alkohol 70% dan diencerkan hingga 100 mL 5 Indikator merah fenol 1% 1 g merah fenol dilarutkan dalam etanol
hingga 100 mL
6 Indikator biru brom timol 1% 1 g BTB dilarutkan dalam etanol hingga 100 mL
7 Indikator feriamonium sulfat 1% 1 g feriamonium sulfat dilarutkan dalam akuades hingga 100 mL
8 Indikator merah metil 1% 1g merah metil dilarutkan dalam etanol 70% hingga 100 mL
9 Karbol fuchsin 1 % 1 g fuksin basa dilarutkan dalam 10 mL
etanol (larutan A), 5 g fenol dilarutkan dalam 95 mL akuades (larutan B), lalu keduanya dicampur dan disaring.
10 KOH 40% 40 g KOH dilarutkan dalam 100 mL akuades,
diaduk hingga homogen
11 Kovacs 1 p-dimetilamino benzaldehida dilarutkan
dalam 100 mL etanol 96%.
12 Kristal violet 1% 1 g kristal violet dilarutkan dalam air hingga 100 mL
13 Lugol pekat 5 g iodin ditambah 10 g KI dilarutkan dengan
akuades hingga 100 mL
14 Lugol encer Lugol pekat diencerkan hingga 5x
15 Malachite hijau 5% 5 g malasit hijau dilarutkan dalam 100 mL
akuades
16 Peroksida 3 % 30 mL H2O2 30% dilarutkan dalam 100 mL
akuades
17 Safranin 1% 1 g safranin dilarutkan dalam 100 mL
akuades, diaduk hingga homogeny
18 Tembaga sulfat 20% 20 g terusi dilarutkan dalam 100 mL akuades
Lampiran 3 Diagram alir penelitian
Persiapan Sampel
Isolat bakteri
Regenerasi kultur murni (37 oC, 24 jam)
Pengamatan dan identifikasi bakteri
Analisis morfologi: Bentuk, elevasi, warna, permukaan
koloni
Analisis fisiologi: Bentuk sel Pewarnaan Gram Spora
Kapsul
Aktivitas biokimia: Fermentasi karbohidrat Hidrolisis
Analisis IMViC Oksidase-katalase Motilitas
Analisis H2S
Reduksi nitrat
Bergey’s Manual of Determinative Bacteriology
Pencirian
Dibimbing oleh CHARLENAdan HADIATI AGUSTINE.
Biodegradasi metode bioremediasi dilakukan dengan memanfaatkan bakteri yang dapat bertahan hidup pada tanah tercemar dan menunjukkan kemampuan metabolisme terhadap pencemar sebagai sumber karbon. Identifikasi dan pencirian diperlukan untuk menentukan nama genus dari isolat bakteri tersebut. Metode konvensional lazim digunakan, yaitu dengan mengamati sifat morfologi, sifat fisiologi, dan aktivitas biokimianya. Tujuan penelitian ini adalah mengidentifikasi dan mencirikan suatu isolat bakteri pendegradasi hidrokarbon yang diisolasi dari tanah yang tercemari minyak bumi. Identifikasi dilakukan pada suhu 27, 37, dan 40 °C dalam media yang diperkaya mineral. Identifikasi terdiri atas 4 tahap, yaitu regenerasi (peremajaan kembali) isolat bakteri; uji morfologi isolat yang ditumbuhkan dalam cawan petri selama 24 jam, meliputi bentuk koloni, elevasi, warna, dan permukaan koloni; uji fisiologi isolat bakteri meliputi pewarnaan sederhana, pewarnaan Gram, pewarnaan spora dan kapsul; serta uji aktivitas biokimia yang meliputi uji fermentasi karbohidrat, uji hidrolisis (pati, lemak, kasein, dan gelatin), analisis IMViC, oksidase-katalase, motilitas, analisis H2S dan reduksi nitrat.
Hasil identifikasi dan pencirian dibandingkan dengan panduan Bergey’s Manual of Determinative Bacteriology dan menunjukkan bahwa isolat dengan kode MY 1, MY 3, MY 6, MY 8, MY 9, dan MY FLR adalah genus Bacillus, MY 10 dan MY 11 adalah golongan Enterobacter, sedangkan MY 12 adalah Pseudomonassp.
ABSTRACT
NUR ZAMILAH. Identification and Characterization of Hydrocarbon-Degrading Bacteria Isolates. Supervised by CHARLENA and HADIATI AGUSTINE.
Biodegradation with bioremediation method is performed by utilizing bacteria that can survive in contaminated soil and shows metabolic capabilities towards pollutants as carbon sources. Identification and characterization are needed to determine the genera name of the bacterial isolates. Conventional methods is commonly used, that is by observing the morphological and physiological properties as well as the biochemical activities. This research was aimed to identify and characterize several hydrocarbon- degrading bacteria already isolated from the soil contaminated with petroleum waste. Identification were performed at 20, 30, and 37 °C in a mineral-enriched medium. Identification consisted of 4 steps, namely regeneration of bacterial isolates; morphology test of isolates grown in petri dish for 24 hours, including the form, edge, color, and surface of the colony; physiology test of isolates, including simple coloring, Gram coloring , spore and capsule staining; and biochemical activity test including carbohydrate fermentation test, hydrolysis test (starch, fat, casein, and gelatin), IMViC analysis, oxidase-catalase test, motility, hydrogen sulfide and nitrate reduction analysis. The identification and characterization results were compared with guidance in Bergey's Manual Determinative of Bacteriology and showed thatisolate codedMY 1, MY 3, MY 6, MY 8, MY 9, and MY FLR were Bacillus genera, MY 10 and MY 11 were
PENDAHULUAN
Hidrokarbon adalah senyawa yang mengandung unsur hidrogen dan karbon (H dan C), terdiri atas alkana, alkena, dan alkuna. Senyawa hidrokarbon dalam minyak bumi atau lumpur minyak bumi merupakan salah satu cemaran yang relatif sulit didegradasi. Selain senyawa hidrokarbon, minyak bumi juga mengandung unsur nitrogen, sulfur, dan oksigen. Degradasi minyak bumi menghasilkan bentuk senyawa lain, misalnya alkohol, aldehida, fenol, asam karboksilat, H2O, dan CO2 (Atlas 1981). Masalah
pencemaran lingkungan dapat terjadi karena sifat produk minyak bumi yang sulit didegradasi (Udiharto 1996).
Pencemaran oleh minyak bumi tidak hanya diakibatkan oleh kecelakaan seperti kapal tanker terbentur batu karang, tetapi dapat juga berasal dari aktivitas pengeboran minyak, produksi, pengilangan, transportasi, maupun akibat adanya perembesan dari tangki reservoir. Lingkungan darat maupun air dapat tercemari oleh senyawa organik maupun oleh bahan kimia yang bersifat toksik dan sulit didegradasi dan dapat menggangu kehidupan tanaman maupun organisme lain (Alexander 1999).
Penanganan kondisi lingkungan yang telah tercemari minyak bumi dapat dilakukan dengan metode biologi. Metode ini relatif lebih ramah lingkungan. Penanganan dilakukan menggunakan teknik bioremediasi dengan memanfaatkan mikroorganisme (bakteri atau kapang) atau tanaman untuk menghilangkan cemaran. Mikroorganisme dapat berfungsi sebagai bahan pengurai alami sesudah diadaptasikan dengan senyawa limbah. Hanya mikrob yang dapat beradaptasi dengan minyak bumi dapat melakukan biodegradasi. Di alam, mikroorganisme jarang dijumpai sebagai kultur atau biakan murni, dan biasanya berinteraksi dengan mikroorganisme lain atau dengan organisme inang (Widyastuti 2003).
Bakteri yang umum dan telah diketahui mampu mendegradasi hidrokarbon berasal dari genus Achromobacter, Actinobacter, Alcaligenes, Arthrobacter, Bacillus, Flavobacterium, Nocardia, dan Pseudomonas spp (Leahy & Colwell 1990). Pseudomonas dapat mengurai senyawaan polutan seperti benzena, toluena, xilena, etilbenzena, stirena, dan asam klorobenzoat, sedangkan Enterobacter agglomerans dapat mengurai campuran benzena, etilbenzena, dan xilena. Pada penelitian ini digunakan isolat bakteri
yang diisolasi dari tanah tercemari minyak bumi. Identifikasi dan pencirian dilakukan untuk mengetahui lebih lanjut kemampuan atau potensi bakteri tersebut dalam mengurai cemaran hidrokarbon.
Identifikasi bertujuan menentukan nama spesies mikroorganisme dalam isolat baru. Berbagai metode dapat dipakai, bergantung pada fasilitas laboratorium yang tersedia, mulai dari metode konvensional hingga modern (tingkat molekular). Identifikasi dalam penelitian meliputi uji morfologi, fisiologi, dan aktivitas biokimia. Berdasarkan data identifikasi, dilakukan pencirian isolat bakteri tersebut (Widyastuti 2003). Pada penelitian ini, pencirian dilakukan hanya sampai tingkat genus.
BAHAN DAN METODE
Alat dan BahanAlat-alat yang digunakan antara lain tabung Durham, mikropipet, inkubator, oven, autoklaf, pipet serologi 1 mL, neraca analitik, colony counter, mikroskop, desikator, ruang laminar dan alat-alat yang lazim di laboratorium.
Isolat bakteri yang digunakan berasal dari limbah tercemari minyak bumi dengan kode MY1, MY3, MY6, MY8, MY9, MY10, MY11, MY12 dan MY FLR. Bahan-bahan yang digunakan antara lain media mineral air laut (marine agar), larutan garam fisiologis (NaCl 0.85%), agar nutrien (NA) atau plate count agar (PCA), kaldu nutrien (NB), triple sugar iron agar (TSIA), media Kosser sitrat, media pepton cair 1%, media gelatin, media tripton 1%, Na-tiosulfat, media selektif (McConkey, centrimade agar, brilliant green lactose broth (BGLB), dan mannitol salt agar (MSA), media motilitas, media merah metil -Voges Proskauer (MR-VP), kaldu glukosa, kaldu laktosa (LB), dan sukrosa (Lampiran 1), reagen Kovacs, reagen Erlich, H2O2 3%
Metode Penelitian
Digunakan metode konvensional diawali dengan regenerasi isolat (peremajaan) dilanjutkan dengan identifikasi dan pencirian isolat bakteri berdasarkan Bergey’s Manual of Determinative Bacteriology yang meliputi sifat morfologi, fisiologi, dan aktivitas biokimianya. Analisis meliputi pengamatan bentuk, elevasi, warna, dan permukaan koloni. Pengamatan juga dilakukan terhadap bentuk sel, pewarnaan Gram, kapsul dan spora, uji fermentasi karbohidrat (uji glukosa, laktosa, dan sukrosa), hidrolisis pati, hidrolisis gelatin, hidrolisis lemak, uji Indol, uji merah metil-Voges Proskauer, uji motilitas, uji oksidase-katalase, uji H2S dan reduksi nitrat. Diagram
alir penelitian dapat dilihat pada Lampiran 3 (Aryantha et al. 2000).
Regenerasi Isolat Bakteri
Media agar miring steril disiapkan, isolat biakan murni diinokulasikan secara aseptik kemudian diinkubasi dalam inkubator pada suhu 37 oC selama 24 jam (LabOps 2004).
Uji Morfologi
Hasil regenerasi isolat bakteri masa inkubasi 24 jam diamati secara visual mulai dari bentuk, elevasi, warna, dan permukaan koloni.
Uji Fisiologi (Hadioetomo 1993)
Uji fisiologi meliputi pewarnaan sederhana, pewarnaan Gram, pewarnaan spora, dan pewarnaan kapsul.
Pewarnaan sederhana bertujuan mengamati morfologi sel. Kaca objek dibersihkan dengan kapas beralkohol. Larutan fisiologis diteteskan sebanyak 2–3 tetes, lalu secara aseptik diambil 1 ose isolat bakteri, diratakan, dan dikeringkan dengan difiksasi dekat nyala api Bunsen. Pewarna safranin diteteskan lalu dibiarkan ±1 menit. Kelebihan pewarna dicuci dengan air suling, kemudian preparat dikeringkan dengan kertas saring dan bentuk sel diamati dengan mikroskop pada perbesaran 1000×, dengan ditetesi minyak imersi secara perlahan-lahan. Preparat dibersihkan dan direndam dalam larutan asam kromat.
Pewarnaan Gram bertujuan melihat pengelompokan bakteri berdasarkan perbedaan komponen dinding sel. Kaca objek disterilkan dengan kapas beralkohol. Sebanyak 2–3 tetes larutan fisiologis diteteskan, lalu 1 ose isolat bakteri diambil secara aseptik, diratakan, dan ditambahkan pewarna dasar kristal violet, dibiarkan
kembali 1–2 menit. Kelebihan zat warna dicuci dengan air mengalir kemudian preparat ditambahkan lugol atau campuran aseton-iodin, dibiarkan kembali selama 1-2 menit. Setelah itu, preparat direndam dalam alkohol 96% selama 30 detik, dicuci dengan air mengalir, dan diwarnai dengan safranin sebagai warna standar. Preparat dicuci kembali dan dikeringkan, kemudian diamati di bawah mikroskop dengan perbesaran 1000×.
Pewarnaan spora bertujuan mengamati struktur khusus endospora. Kaca objek dibersihkan dengan kapas beralkohol lalu ditetesi 2–3 tetes larutan fisiologis. Secara aseptik diambil 1 ose isolat bakteri berumur 36 jam. Preparat ditutup dengan kertas saring sambil diteteskan hijau malasit di atas penangas air, terus menerus hingga ±5 menit. Kelebihan zat warna dicuci dengan air mengalir lalu preparat ditetesi safranin selama 30 detik, dan diamati di bawah mikroskop.
Pewarnaan kapsul bertujuan mengamati struktur khusus lapisan pelindung kapsul. Pada kaca objek yang telah disterilkan dengan kapas beralkohol, diteteskan 2–3 tetes larutan fisiologis, lalu ditambahkan 1 ose isolat bakteri berumur 36 jam, diratakan dan diberi kristal violet, dibiarkan terendam selama 5–7 menit. Kelebihan warna dicuci dengan terusi 20% dikeringkan, lalu diamati di bawah mikroskop dengan perbesaran 1000×.
Uji Biokimia (Prescott 2002) Uji biokimia mikrob meliputi fermentasi karbohidrat (glukosa, laktosa, dan sukrosa), hidrolisis (pati, lemak, gelatin, dan kasein), analisis IMViC (indol, MR-VP, sitrat), oksidase-katalase, motilitas, H2S, dan reduksi
nitrat.
Fermentasi Karbohidrat
Isolat bakteri diinokulasi ke dalam tabung berisi media steril (glukosa dan sukrosa), dengan indikator merah fenol. Satu tabung lain digunakan sebagai kontrol tanpa penambahan isolat bakteri, keduanya diinkubasi pada suhu 37 °C selama 48 jam. Untuk media agar laktosa, diinkubasi pada suhu 37 oC selama 24 jam.
Hidrolisis Pati
aseptik lalu diinkubasi selama 36 jam pada suhu 27 °C. Setelah terlihat pertumbuhan bakteri, ditetesi lugol di sekitar biakan dan dibiarkan ±5 menit. Pengamatan dilakukan pada bagian berwarna biru dan tidak berwarna, dicatat hasilnya.
Hidrolisis Lemak
Cawan petri steril dibagi menjadi 4 daerah, diberi nama bakteri yang akan diinokulasikan beserta tanggal inokulasi. Media agar lemak steril dituang hingga menutupi permukaan cawan, diputar perlahan hingga beku. Bakteri diinokulasikan ke 4 daerah, dan dinkubasi pada suhu 30 °C selama 48 jam. Setelah terlihat pertumbuhan bakteri, terusi 5% diteteskan di sekitar biakan, dibiarkan 10–15 menit dan diamati hasil yang terbentuk. Hidrolisis Gelatin
Sebanyak 4 tabung media agar gelatin steril disiapkan. Tiga tabung diinokulasi bakteri, 1 tabung sebagai kontrol. Keempatnya dinkubasi pada suhu 37 °C selama 2–7 hari. Pengamatan dilakukan dalam wadah berisi es. Hidrolisis Kasein
Cawan petri steril dibagi menjadi 4 daerah, diberi nama bakteri yang akan diinokulasikan beserta tanggal inokulasi. Media agar susu steril dituang hingga menutupi permukaan cawan, diputar perlahan hingga beku, lalu 1 ose bakteri diinokulasikan pada keempat daerah. Inkubasi dilakukan pada suhu 37 °C selama 3–7 hari, hasil yang terbentuk diamati perubahannya.
Uji Indol
Sebanyak 2 tabung berisi kaldu tripton 1% dan 1 tabung berisi kaldu tripton 1% + glukosa 1% diinokulasi dengan biakan bakteri. Satu tabung lainnya berisi kaldu tripton tanpa penambahan biakan (kontrol). Keempat tabung diinkubasi pada suhu 37 °C selama 2–7 hari. Setelah masa inkubasi selesai, tabung berisi biakan dan tabung kontrol ditambahkan pereaksi Kovacs, dikocok perlahan hingga terlihat adanya lingkaran merah (positif).
Uji Merah Metil dan Voges Proskauer Sebanyak 1 ose bakteri diinokulasi ke dalam media MR–VP cair, diinkubasi pada suhu 35 °C selama 48 jam. Kira-kira 2 mL suspensi kultur dipindahkan ke tabung steril untuk uji merah metil(MR) dan diberi 5 tetes indikator MR. Untuk uji Voges Proskauer (VP), sebanyak 5 mL sisa kultur dituang ke
dalam tabung steril, ditambahkan berturut-turut 10 tetes larutan KOH 40% dan 15 tetes reagen α-naftol 1%. Campuran dikocok hingga larut sempurna dan dibiarkan selama 30 menit. Perubahan yang terjadi diamati. Uji Kosser Sitrat
Agar Kosser sitrat diinokulasi dengan isolat bakteri, lalu diinkubasi dalam suhu 35 °C selama 48 jam. Hasil positif ditandai dengan terbentuknya warna biru pada medium.
Uji Oksidase dan Katalase
Untuk uji oksidase, isolat bakteri yang tumbuh di permukaan agar ditambahkan 1–2 tetes reagen oksidase, lalu terbentuknya warna biru pada media diamati selama 30 detik. Untuk uji katalase, pada koloni bakteri diteteskan 1–2 tetes H2O2 3%, diamati
terbentuk atau tidaknya gelembung udara. Motilitas
Isolat bakteri ditanam dalam agar tegak dengan metode stab (tusuk) kurang lebih ¾ tinggi tabung, tetapi tidak sampai menyentuh dasar tabung. Kultur diinkubasi pada suhu 37 °C selama 24 jam, kemudian hasilnya diamati. Uji H2S
Pada 2 tabung yang berisi media TSIA steril, diinokulasikan 1 ose isolat bakteri dengan metode tusuk, lalu diinkubasi pada suhu 37 °C selama 48 jam. Diamati terbentuk atau tidaknya blackening/area hitam pada media di daerah inokulasi bakteri.
Reduksi Nitrat
Isolat bakteri diinokulasi ke dalam tabung berisi media NB steril, dan satu tabung media disiapkan sebagai kontrol. Kedua tabung diinkubasi pada suhu 37 °C selama 48 jam. Untuk uji nitrit, pada masing-masing tabung ditambahkan 1 mL asam sulfanilat dan α -naftilamina lalu dikocok dan diamati hasilnya.
ini dimaksudkan agar bakteri yang tumbuh merupakan bakteri yang berperan dalam proses degradasi limbah hidrokarbon (Dwipayana & Herto 2010).
[image:36.612.384.451.177.237.2]Regenerasi isolat ini dilakukan pada suhu 30 °C selama 24 jam. Regenerasi diawali dengan pengenceran sampel isolat dilanjutkan dengan penanaman sampel ke dalam media NA. Pengenceran bertujuan agar koloni yang tumbuh tidak terlalu padat sehingga memudahkan dalam identifikasi selanjutnya (Dwipayana & Herto 2010). Hasil regenerasi dapat dilihat pada Gambar 1.
Gambar 1 Hasil regenerasi isolat bakteri. Morfologi Isolat Bakteri
[image:36.612.163.273.239.299.2]Pengamatan morfologi bakteri dilakukan terhadap isolat bakteri berumur 24 jam. Morfologi yang diamati meliputi bentuk, elevasi, warna, dan permukaan koloni. Pengamatan dilakukan secara visual. Pengamatan ini penting dilakukan sebagai dasar pengujian selanjutnya. Hasil pengamatan morfologi koloni isolat bakteri dapat dilihat pada Tabel 1.
Tabel 1 Morfologi koloni Isolat Bentuk Elevasi Warna Permukaan
MY 1 Bulat Naik Krem Halus mengilat
MY 3 Bulat Naik Krem Halus mengilat
MY 6 Bulat Naik Krem Halus mengilat
MY 8 Bulat Naik Krem Halus mengilat
MY 9 Bulat Naik Krem Halus mengilat
MY 10 Bulat Naik Krem Halus mengilat
MY 11 Bulat Naik Krem Halus Mengilat
MY 12 Bulat Naik Agak kuning
Halus mengilat
[image:36.612.133.308.449.626.2]MYFLR Bulat Datar Krem Berserabut halus
Tabel 1 memperlihatkan bahwa isolat dengan kode MY 1, MY 3, MY 6, MY 8, MY 9, MY 10, dan MY 11 memiliki ciri morfologi yang serupa, yaitu bentuk bulat, elevasi naik, warna krem, dan permukaan halus mengilat (Gambar 1) sehingga diduga masuk ke dalam genus Bacillus sp (Lampiran
4). Isolat MY 12 bentuk, elevasi, dan permukaannya sama, tetapi warna koloninya agak kuning. Warna koloni ini dimiliki oleh golongan Pseudomonas sp. Sementara isolat MY FLR memiliki tepian dan permukaan koloni yang berbeda, yaitu elevasi datar, permukaan berserabut halus yang lazim dijumpai pada golongan kapang (Gambar 2).
Gambar 2 Isolat koloni bakteri MY FLR. Fisiologi Isolat Bakteri
Mikroorganisme mempunyai morfologi, struktur, dan sifat-sifat yang khas, begitu pula dengan bakteri. Bakteri hidup hampir tidak berwarna dan kontras dengan air tempat sel-sel bakteri tersebut disuspensikan. Salah satu cara mengamati bentuk sel bakteri sehingga mudah diidentifikasi ialah dengan metode pewarnaan. Pengamatan meliputi pewarnaan sederhana, pewarnaan Gram, pewarnaan spora dan kapsul. Pewarnaan Gram merupakan suatu metode empiris untuk membedakan spesies bakteri menjadi 2 kelompok besar, yaitu Gram positif dan Gram negatif berdasarkan sifat kimia dan fisik dinding sel bakteri.
Berdasarkan pewarnaan Gram, isolat dengan kode MY 1, MY 3, MY 6, MY 8, dan MY 9 tergolong Gram positif yang ditandai dengan sel berwarna ungu (Gambar 3). Bakteri Gram positif dapat menahan senyawaan kompleks kristal violet, sedangkan bakteri Gram negatif tidak mampu menahannya dan karena itu, terwarnai oleh pewarna kedua (Hadioetomo 1993), (Lampiran 5).
Gambar 3 Isolat bakteri Gram positif (kiri) dan Gram negatif (kanan).
[image:36.612.349.483.559.615.2]krem agak kuning (MY12), dan bersifat Gram negatif (sel berwarna merah), diduga adalah Pseudomonas (Gambar 4). Keseluruhan hasil pengamatan fisiologi isolat bakteri dapat dilihat pada Tabel 2.
[image:37.612.389.463.130.187.2]Gambar 4 Isolat koloni bakteri Gram negatif. Tabel 2 Sifat-sifat fisiologi sel Isolat Bentuk Gram Spora Kapsul MY 1 Batang Positif Ada Tidak ada MY 3 Batang Positif Ada Tidak ada
MY 6 Batang Positif Tidak
ada Tidak ada
MY 8 Batang Positif Tidak
ada Tidak ada
MY 9 Batang Positif Tidak
ada Tidak ada MY 10 Batang Negatif Ada Tidak ada MY 11 Batang Negatif Ada Tidak ada MY 12 Batang Negatif Ada Tidak ada MY
FLR
Batang Negatif Tidak terlihat
Tidak ada
Berdasarkan sifat fisiologi dan morfologi, isolat MY 1, MY 3, MY 6, MY 8, dan MY 9 diduga masuk ke dalam genus Bacillus sp (Fardiaz 1998), sedangkan isolat MY 10, MY 11, dan MY FLR diduga genus Bacillus sp, tetapi dengan sifat Gram negatif. Isolat dengan kode MY 12 berdasarkan cirinya, yaitu bentuk sel batang panjang, warna koloni krem agak kuning, dan Gram negatif diduga termasuk genus Pseudomonas sp. Secara umum, Dharmawibawa (2004) (dalam Darmayasa 2008) mengungkapkan bahwa genus Bacillus sp dan Pseudomonas sp mampu merombak hidrokarbon minyak bumi.
Pewarnaan spora dilakukan untuk mengamati kemampuan suatu bakteri menghasilkan spora yang berfungsi melindungi sel vegetatif dari kondisi ekstrem di luar sel yang dapat membahayakannya (Hadioetomo 1993). Endospora sel memiliki lapisan khusus yang sulit ditembus zat pewarna, maka dilakukan pemanasan dalam preparasi preparat selama proses pengikatan warna dasar (malasit hijau). Pemanasan bukan hanya membuat spora yang terwarnai hijau, melainkan juga sel vegetatif. Oleh karena itu, pencucian dengan air mengalir diperlukan untuk menghilangkan kelebihan zat warna yang menempel pada dinding sel. Dinding sel yang tidak berwarna ini kemudian
diwarnai dengan warna pembanding, yaitu safranin (merah muda), sehingga spora tetap berwarna hijau dan sel vegetatif berwarna merah (Gambar 5).
Gambar 5 Isolat bakteri penghasil spora. Hasil penelitian (Tabel 2) menunjukkan bahwa isolat dengan kode MY 1, MY 3, MY 10, MY 11, dan MY 12 memiliki endospora yang terletak di ujung dan subujung (Gambar 5). Sementara pada isolat MY 6, MY 8, MY 9, dan MY FLR tidak ditemukan endospora.
Endospora dapat bersifat dorman untuk waktu yang cukup lama. Selain itu, endospora sangat tahan terhadap panas tinggi, radiasi gelombang pendek, dan bahan kimia beracun (Anonim 2000). Dengan sifat tersebut, endospora diharapkan dapat membantu mendegradasi cemaran limbah hidrokarbon.
[image:37.612.132.308.230.369.2]Pewarnaan kapsul dilakukan untuk mengamati keberadaan struktur khusus lapisan pelindung kapsul pada bakteri. Dari hasil identifikasi, tidak terdapat isolat yang memiliki l